PENGEMBANGAN BIOSENSOR DENGAN MENGGUNAKAN
TEKNIK
SCREEN PRINTING
UNTUK DETEKSI KADAR
KOLESTEROL
Oleh :
Saor Roy Julianus
G74104001
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Saor Roy Julianus. PENGEMBANGAN BIOSENSOR DENGAN MENGGUNAKAN TEKNIK SCREEN PRINTING UNTUK DETEKSI KADAR KOLESTEROL. Dibimbing oleh Setyanto Tri Wahyudi dan Pratondo Busono
Abstrak
Telah dilakukan pengembangan biosensor kolesterol dengan metode screen printing. Desain elektroda dengan konfigurasi tiga elektroda kemudian dikarakterisasi konduktifitas AC dan impedansi AC elektroda kerja dengan variasi frekuensi 42 Hz sampai dengan 100 kHz. Proses imobilisasi enzim kolesterol oksidase dengan mediator 1,1’-Dimethylferrocene dilakukan pada suhu ruangan dengan cara drop coating pada permukaan elektroda kerja. Setelah itu pengujian strip biosensor kolesterol dilakukan dengan teknik cyclic voltammetry. Sampel kolesterol yang digunakan 100 mg/dl, 125 mg/dl, 150 mg/dl, 175 mg/dl, 200 mg/dl, 250 mg/dl, 300 mg/dl. Pengujian stabilitas strip biosensor dilakukan dengan menyimpan strip biosensor yang telah diimobilisasi enzim ke dalam refrigerator selama delapan hari dengan suhu -150C. Hasil penelitian didapat konduktifitas AC dan impedansi AC elektroda kerja sebesar 4,8 x 10-4 Siemens.m-1 dan 9,039 KΩ. Sensitifitas biosensor kolesterol diperoleh sebesar 3x10-7 μA.mg-1dl dan sensitifitas
biosensor kolesterol hari ke-8 menurun 97% dari nilai sensitifitas hari ke-0 menjadi 9x10-9μA.mg-1dl sehingga stabilitas penyimpanan strip biosensor sangat tidak stabil dan
memuaskan. Akurabilitas strip biosensor kolesterol diperoleh sangat rendah.
PENGEMBANGAN BIOSENSOR DENGAN
MENGGUNAKAN TEKNIK
SCREEN PRINTING
UNTUK DETEKSI KADAR KOLESTEROL
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh :
Saor Roy Julianus
G74104001
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengembangan Biosensor dengan Menggunakan Teknik
Screen
Printing
untuk Deteksi Kadar Kolesterol
Nama : Saor Roy Julianus
NIM : G74104001
Menyetujui
Pembimbing I,
(Setyanto Tri Wahyudi,M.Si)
NIP: 19760731 200501 1 003
Pembimbing II,
(Pratondo Busono, Ph.D)
NIP: 19620808 198803 1 001
Mengetahui :
Ketua Departemen,
(Dr. Ir. Irzaman, M.Si)
NIP: 19630708 199512 1 001
RIWAYAT HIDUP
Penulis dilahirkan di Padang Sidimpuan, Kabupaten Tapanuli Selatan pada
tanggal 31 Juli 1986 dari pasangan Drs.Barmen Dongoran dan Frida Antalena
br.Tampubolon. Penulis merupakan putra pertama dari dua bersaudara. Penulis
menyelesaikan masa studi di sekolah dasar di SD Xaverius Padang Sidimpuan
selama enam tahun, kemudian melanjutkan ke SLTP Kesuma Indah Padang
Sidimpuan selama tiga tahun. Penulis lulus dari SMU Negeri 2 Padang Sidimpuan
pada tahun 2004 dan pada tahun yang sama penulis melanjutkan pendidikan
sarjana strata satu di Departemen Fisika, Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA) Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI).
PRAKATA
Puji syukur penulis panjatkan atas ke hadirat Tuhan Yang Maha Esa
karena atas segala kasih dan karunia-Nya, penulis dapat menyelesaikan penelitian
yang berjudul Pengembangan Biosensor dengan Menggunakan Teknik Screen
Printing untuk Deteksi Kadar Kolesterol. Penelitian ini dilakukan sebagai salah
satu syarat kelulusan program sarjana di Departemen Fisika Fakultas Matematika
dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
Penulis ucapkan trimakasih yang tak terhingga kepada kedua orang tua,
adik yang selalu memberikan cinta, semangat, dorongan, doa yang tulus,
kesabaran dan kasih sayang tiada henti. Ucapan terima kasih juga penulis
sampaikan kepada seluruh staf Teknologi Farmasi dan Medik TIAB BPPT
PUSPIPTEK Serpong atas fasilitas dan kemudahan yang diberikan; Pak Arief
Barkah, Pak Adi, Mba Nur, Pak Subintoro dan Pak Amrizal. Kepada Bapak
Setyanto Tri Wahyudi dan Bapak Pratondo Busono sebagai pembimbing skripsi
yang selalu memberikan motivasi untuk segera menyelesaikan penelitian ini.
Kepada teman-teman jurusan fisika IPB. khususnya untuk teman-teman angkatan
41 dan teman-teman di Vilmer : Bang Rato, Bang Sanggam, Diar Erstantyo,
Buyung, Riduan, Okto, Stefanus, Hari, Joner Simanjuntak dan Wagner, yang telah
banyak membantu penulis selama ini.
Akhir kata, semoga tulisan ini dapat memberikan manfaat untuk kita
semua. Kritik dan saran yang membangun sangat penulis harapkan untuk
kemajuan dari aplikasi biosensor yang dikembangkan ini. Semoga Tuhan Yang
Maha Esa senantiasa melimpahkan kasih dan karunianya untuk kita semua.
Amiin.
Bogor, Desember 2009
Saor Roy Julianus
DAFTAR ISI
Halaman
LEMBAR PENGESAHAN ... i
RIWAYAT HIDUP ... ii
PRAKATA ... iii
DAFTAR ISI ... iv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian... 1
TINJAUAN PUSTAKA ... 1
Biosensor ... 1
Metode Elektrokimia ... 2
Metode Voltametri ... 3
Voltametri Siklik ... 4
Ferosen ... 5
Kolesterol ... 6
Enzim ... 7
Imobilisasi Enzim ... 8
Resistansi dan Konduktifitas Listrik ... 9
EIS (Electrochemical Impedance Spectroscopy ) ... 10
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Alat dan Bahan ... 10
Pembuatan Elektroda ... 10
Desain Layout Elektroda ... 10
Pencetakan Desain Elektroda pada Alat Sablon atau Screen Printing ... 11
Pembuatan Elektroda dengan Metode Screen Printing ... 11
Karakterisasi EIS (Electrochemical Impedance Spectroscopy) ... 11
Imobilisasi Enzim ... 12
Preparasi Enzim Kolesterol Oksidase ... 12
Proses Imobilisasi Enzim ... 12
Karakterisasi SEM (Scanning Electron Microscope) ... 13
Pengujian Strip Biosensor Kolesterol ... 13
Preparasi Sampel Kolesterol ... 13
Tes CV ( Cyclic Voltammetry ) ... 13
HASIL DAN PEMBAHASAN ... 13
Karaktrisasi EIS ... 13
Karakterisasi SEM ... 14
Hasil Tes CV ... 15
KESIMPULAN DAN SARAN ... 17
Kesimpulan ... 17
Saran ... 17
DAFTAR PUSTAKA ... 17
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
Gambar 1. Komponen utama biosensor ... 2
Gambar 2. Konfigurasi elektroda dalam sel elektrokimia ... 3
Gambar 3. Kurva voltametri penyapuan-linier ... 3
Gambar 4. Kurna arus sebagai fungsi potensial pada voltametri siklik ... 4
Gambar 5. Struktur molekul ferosen ... 6
Gambar 6.Struktur Kolesterol... 6
Gambar 7. Molekul lipoprotein ... 6
Gambar 8. Kurva energi aktifasi tanpa katalis dan terkatalis enzim ... 7
Gambar 9. Mekanisme reaksi enzim. ... 7
Gambar 10.Kurva hubungan antar laju reaksi, konsentrasi enzim dan substrat.. ... 8
Gambar 11. Enzim dalam keadaan jenuh. ... 8
Gambar 12. Strip Biosensor Kolesterol ... 11
Gambar 13. Grafik Hubungan Zre Vs Zim... 12
Gambar 14. Mekanisme reaksi katalisis enzimtik pada kolesterol ... 12
Gambar 15. Grafik Konduktifitas Elektroda kerja,Ө + KӨl 1 M, log f Vs log ... 14
Gambar 16. Grafik Impedansi elektroda kerja C+KCl 1 M, Zre Vs Zim ... 14
Gambar 17. Hasil SEM dengan perbesaran 200 kali ... 14
Gambar 18. Hasil SEM dengan perbesaran 200 kali ... 15
Gambar 19. Voltamogram Siklik dengan variasi sample kolesterol ... 15
Gambar 20. Kalibrasi kurva sensitifitas biosensor kolesterol. ... 15
Gambar 21. Voltamogram siklik sample kolesterol hari ke-0 ... 16
Gambar 22. Voltamogram siklik sample kolesterol hari ke-8 ... 17
DAFTAR LAMPIRAN
Lampiran 1. Diagram alir penelitian ... 21
Lampiran 2. Gambar peralatan penelitian ... 22
Lampiran 3. Data tabel hasil pengukuran LCR-meter ... 23
Lampiran 4. Data tabel hasil perhitungan konduktifitas AC elektroda kerja ... 24
Lampiran 5. Data tabel hasil perhitungan impedansi AC elektroda kerja ... 25
Lampiran 6. Voltamogram untuk semua konsentrasi kolesterol yang diuji ... 26
PENDAHULUAN
Latar Belakang
Perkembangan biosensor kolesterol sangat penting di tengah-tengah berkembangnya penyakit kardiovaskular yang mengancam kesehatan utama manusia di seluruh dunia. Amperometrik kolesterol biosensor menggunakan kolesterol oksidase telah menjadi fokus dari riset biosensor [1].
Kolesterol LDL merupakan bahan yang tidak seharusnya beredar dalam sirkulasi darah melebihi kadar 160 mg/dl. Kolesterol masuk ke dalam tubuh sebagian besar masuk ke dalam tubuh melalui makanan. Kolesterol banyak ditemukan dalam daging, telur dan makanan berlemak. Jika mengkonsumsi makanan tersebut secara berlebihan maka kadar kolesterol dalam darah akan meningkat drastis. Akhir-akhir ini mulai banyak yang sadar akan pentingnya menjaga kadar kolesterol dalam darah. Hal ini sangat penting untuk menurunkan angka kematian akibat penyakit jantung dan pembuluh darah. Penyakit jantung sudah menjadi penyakit yang umum saat ini. Penyakit ini bisa menyerang siapa saja terutama bagi mereka yang telah berusia di atas 50 tahun. Pada usia ini jantung bekerja lebih berat akibat peningkatan tekanan pembuluh darah tepi. Peningkatan tekanan darah tepi paling sering disebabkan oleh penumpuikan plak kolesterol pada dinidng pembuluh darah [2].
Kadar kolesterol dalam tubuh dapat diketahui melalui tes pemeriksaan kadar kolesterol darah. Pemeriksaan ini biasanya dilakukan dalam laboratorium. Pemeriksaan akan menghasilkan data perkiraan kadar kolesterol yang beredar dalam sirkulasi darah. Hasil tes rutin yang dilakukan di laboratorium akan membutuhkan waktu yang lama untuk mengetahui hasilnya dan tentu biaya juga tidak sedikit. Selain itu pemeriksaaan tidak hanya memeriksa kadar kolesterol dalam darah tapi juga kadar protein dan kreatin.
Metode analisis telah dikembangkan oleh manusia agar menjadi lebih fleksibel dan target analisis akurat untuk berbagai senyawa kimia dan biokimia. Karakteristik seperti spesivitas, sensitifitas dan biaya merupakan hal perlu dipertimbangkan dalam mengembangkan metode analisis yang turut mempengaruhi keberhasilan atau kegagalan dari teknologi pengukuran baru [1].
Berdasarkan latar belakang di atas maka dikembangkanlah biosensor kolesterol yang dapat khusus mengukur kadar kolesterol dalam darah secara langsung. Biosensor kolesterol ini diharapkan memiliki kemampuan deteksi kadar kolestrol dengan selektifitas yang tinggi, akurat, stabil dan murah. Oleh karena itu dikembangkanlah transduser biosensor kolesterol dengan imobilisasi enzim sehingga lebih selektif lagi dalam pendeteksian kadar kolesterol dalam darah.
Pada penelitian ini akan dilakukan perancangan desain elektroda, pembuatan elektroda dengan metode screen printing, imobilisasi enzim kolesterol oksidase dengan mediator 1,1’-Dimethylferrocene, karakterisasi elektroda dengan metode EIS (Electrochemical Impedance Spectroscopy) dan SEM (Scanning Electron Microscope) serta melakukan pengujian kinerja biosensor kolesterol yang dikembangkan dengan tes CV (CyclicVoltametry ).
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengembangkan biosensor berbasis enzim untuk deteksi kadar kolesterol dengan biaya yang murah. Tujuan khusus dari penelitian ini adalah menentukan konduktifitas, impedansi, sensitifitas, stabilitas dan akurabilitas dari biosensor kolesterol.
TINJAUAN PUSTAKA
Biosensor
Biosensor menurut definisi
klasiknya merupakan suatu
perangkat/instrumen analitik yang menggunakan biomolekul (enzim, antibodi, jaringan, sel dan mikroba) untuk melakukan pengenalan/deteksi/rekognisi (recognition) akan suatu zat (bio) kimia tertentu. Perubahan sifat fisika-kimia pada biomolekul yang mempresentasikan informasi ditransduksikan dengan transduser fisis menjadi besaran listrik [3].
perubahan kimia-fisika yang kemudian akan dideteksi dan diukur oleh transduser [4].
Transduser yang banyak digunakan dalam suatu biosensor adalah transduser elektrokimia, optoelektronik, kristal piezoelektronik, field effect transistor, dan termistor. Proses yang terjadi dalam transduser dapat berupa kalorimetrik biosensor, potensiometrik biosensor, amperometrik biosensor, optikal biosensor, maupun piezo-elektrik biosensor. Sinyal yang keluar dari transduser kemudian diproses dalam suatu sistem elektronik misalnya recorder atau komputer [5].
Skema operasi dari biosensor kimia diilustrasikan dalam Gambar 1. Dalam bentuk skema umumnya biosensor terdiri dari selector, transducer, dan detector yang terhubung dalam jalur yang tepat. Selector memberi selektifitas pada sensor dan umumnya diikuti oleh filter pada sisi rekognisi. Jika sisi rekognisi ini dari biomolekul (seperti enzim, reseptor, antibodi atau DNA) maka alat ini disebut biosensor. Sisi rekognisi penting untuk menghasilkan sinyal kimia (perubahan dalam ikatan kimia) pada ikatannya dengan analit dan fungsi dari transduser adalah mengkonversi proses tersebut ke dalam pengukuran sinyal fisik (elektrik,termal, mekanik, optik dan magnetik) dan melewatkan sinyal ke detektor yang akan menghasilkan output elektrik [6].
Generasi pertama biosensor dikemukakan oleh Clark dan Lyons (1962) yang diimplementasikan oleh Updike dan Hicks. Generasi ini menggunakan elektroda oksigen dan mengukur penurunan arus yang disebabkan konsumsi oksigen akibat reaksi enzimatik. Generasi kedua mengukur arus yang dihasilkan dari reaksi elektro enzimatik pada sebuah molekul redoks yang berperan sebagai mediator transfer elektron antara enzim dan elektroda. Enzim sebagai reseptor terikat secara kovalen dengan permukaan transduser. Prinsip ini telah dikomersilkan dalam pengukuran kadar gula darah menggunakan glukosa meter. Generasi ketiga biosensor berdasarkan transfer elektron secara langsung dari sebuah enzim pada permukaan elektroda. Enzim terikat pada sebuah peralatan elektronik yang akan mentransduksikan dan memperkuat sinyal yang dihasilkan [7,8].
Gambar 1 Komponen utama biosensor [6]
Metode Elektrokimia
Metode elektrokimia dapat mendeteksi pertukaran elektron yang terjadi pada reaksi redoks enzim. Sehingga didapatkan hubungan dengan konsentrasi zat yang terkait dalam reaksi redoks tersebut [3].
Reaksi (bio) elektrokimia dapat dianalisis dari pengukuran arus (amperometric), pengukuran potensial (potentiometric), dan pengukuran konduktifitas bahan (conductomeric) di antara elektroda. Selain itu teknik impedimetric juga dapat digunakan dalam analisis reaksi elektrokimia. Impedimetric pengukurannya berdasakan impedansi (resistansi dan reaktansi) dan efek luas permukaan, yang menggunakan teknologi transistor untuk mengukur arus sebagai hasil pengaruh potensiometrik pada elektroda [9].
Metode elektrokimia yang biasa dipakai yaitu : Voltammetry (dengan mengukur tegangan terhadap arus yang tetap), Amperometry (tegangan tetap, arus terukur), Cyclic Voltamemetry (arus yang diukur terhadap suatu tegangan yang berubah dengan fungsi segitiga terhadap waktu [3].
terjadinya reaksi kimia. Dalam reaksi redoks terjadi suatu perubahan bilangan oksidasi dari atom atau ion akibat terjadinya transfer elektron [10].
Teknik Voltametri siklik telah digunakan secara efektif untuk menentukan kadar kolesterol dalam sistem. Biosensor amperometrik mengukur perubahan arus pada elektroda indikator melalui oksidasi elektrokimia atau reduksi dari produk dalam reaksi biokima. Dalam amperometrik biosensor potensial elektroda dijaga konstan ketika arus diukur [11].
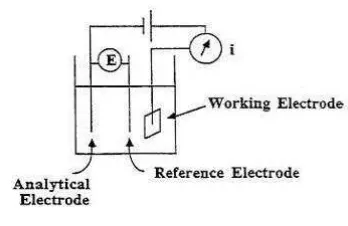
Sensor elektrokimia terdiri dari elektroda pembanding (reference electrode), elektroda pendukung (counter electrode or auxillary electrode) dan elektroda kerja (working electrode), yang juga dikenal sebagai elektroda redoks. Elektroda pembanding, umumnya dibentuk dari Ag/AgCl, jaraknya dijaga dari tempat reaksi bertujuan untuk menjaga potensial awal dan potensial stabil. Elektroda pembanding memiliki nilai potensial yang telah diketahui konstan serta tidak sensitif terhadap komposisi larutan yang dianalisis. Elektroda kerja berperan sebagai elemen transduksi dalam reaksi biokimia [9]. Elektroda kerja merupakan tempat terjadinya reaksi yang akan merespon analit target. Elektroda pendukung membentuk hubungan dengan larutan elektrolit sehingga arus mengalir ke elektroda kerja. Elektroda pendukung diperlukan untuk memperkecil kesalahan dari tahanan sel dalam mengontrol potensial elektroda kerja [1].
Konfigurasi tiga elektroda digunakan untuk meminimalkan kesalahan yang diakibatkan oleh adanya lapisan produk reaksi yang ada pada elektroda. Lapisan ini akan mengakibatkan adanya hambatan tambahan pada sel elektrokimia. Elektroda pembanding dan elektroda kerja dibuat sedekat mungkin agar diperoleh hasil pengukuran dengan hambatan sel yang minimal. Jarak elektroda pemdanding dan kerja yang terlalu dekat dapat mengakibatkan adanya ganguan karena spesi produk yang menempel pada elektroda. Elektroda pendukung dapat mengatasi permasalahan jarak elektroda pembanding dan kerja. Elektroda pendukung akan memberikan jalur alternatif aliran elektron dalam sel elektrokimia, dengan demikian pada elektroda pembanding tidak akan terbentukl lapisan produk reaksi. Hal ini akan membuat pengukuran dapat dilakukan dengan hambatan sel yang minimal [10].
Gambar 2 Konfigurasi elektroda dalam sel elektrokimia [12]
Metode Voltametri
Metode analisis voltametri didasarkan pada pengukuran arus listrik sebagai fungsi perubahan potensial listrik yang diterapkan pada sel elektrolisis. Sel elektrolisis terdiri dari elektroda kerja (working electrode), elektroda pembanding (reference electrode), dan elektroda pendukung (auxillary electrode) [13] .
Mekanisme transfer elektron melalui ion-ion dalam elektrolit menuju permukaan elektroda dapat melalui tiga cara yaitu cara konveksi, migrasi, dan difusi. Pergerakan akibat konveksi dapat disebabkan oleh pengadukan larutan secara mekanik atau akibat perbedaan panas pada setipa bagian larutan. Pergerakan akibat migrasi disebabkan oleh tarik menarik elektrostatik anali-analit dalam larutan atau analit-elektroda. Perpindahan ion akibat difusi disebabkan oleh adanya perbedaan konsentrasi (gradien konsentrasi) pada setiap bagian larutan. Pada voltametri diusahakan hanya pengaruh difusi yang terlibat, sehingga dalam larutan ditambah elektrolit pendukung (supporting electrolyte) untuk menghilangkan pengaruh migrasi ion dan larutan uji tidak diaduk untuk menghilangkan pengaruk konveksi [13]. I
V
Jenis keluaran dari metode voltametri ini ada dua yaitu voltametri penyapuan linear dan voltametri siklus. Gambar 3 menunjukkan keluaran dari voltametri penyapuan linear, pada awalnya potensial rendah dan arus katoda disebabkan oleh migrsi ion dalam larutan. Akan tetapi saat potensial mendekati potensial reduksi dari zat terlarut tereduksikan, arus katodanya bertambah besar. Segera setelah potensial melebihi potensi reduksi, arus berkurang disebabkan polarisasi konsentrasi elektroda karena sekarang terdapatkekuranagn zat terlarut tereduksikan di dekat elektroda ini [15].
Aplikasi metode voltametri tidak sebatas pada penggunaan untuk kepentingan analitik tetapi juga nonanalitik, seperti penelitian mengenai proses dan mekanisme oksidasi-reduksi pada berbagai media, proses adsorpsi, dan mekanisme transfer elektron pada permukaan elektroda yang dimodifikasi. Metode voltametri hanya melibatkan analit-analit pada daerah permukaan elektroda kerja. Fenomena pada permukaan elektroda yang berpengaruh terhadap pengukuran secara voltametri meliputi reaksi oksidasi/reduksi analit, arus yang timbul, dan lapisan difusi yang terbentuk [1].
Voltametri Siklik
Voltametri siklik termasuk dalam metode pengukuran potensiodinamik elektrokimia. Eksperimen voltametri siklik memiliki proses yang lebih panjang dari Voltametri penyapuan-linear. Voltametri siklik dikarakterisasi dari peningkatan potensial elektroda kerja dari potensial awal ke potensial berikutnya dan kembali lagi. Hal ini menunjukkan bahwa potensial awal dan potensial penyapuan adalah parameter yang dapat disesuaikan begitu juga bahan-bahan elektrolit terutama konsentrasi dan temperaturnya dapat juga mempengaruhi [16].
Voltametri siklik mengukur nilai listrik sebagai fungsi aluran potensial dengan rentang potensial awal sama dengan potensial akhir. Perpindahan elektron pada bagian antar muka elektroda-elektrolit terjadi pada saat potensial diubah secara linear dengan laju tertentu sampai suatu potensial tertentu yang memungkinkan senyawa elektroaktif dalam sel mengalami reaksi redoks. Perpindahan elektron ini menyebabkan kenaikan arus mencapai suatu nilai tertentu yang kemudian akan turun
kembali. Pada turun kembali, potensial dialurkan ke arah sebaliknya sehingga senyawa yang terbentuk mengalami reaksi reduksi bila sebelumnya mengalami oksidasi atau sebaliknya [17].
Gambar 4 Kurva arus sebagai fungsi potensial pada metode voltametri
siklik [18]
Voltamogram siklus yang khas terlihat dalam Gambar 4. Bentuk kurvanya pada awalnya menyerupai kurva eksperimen penyapuan linear, tetapi setelah potensial mulai turun, terdapat perubahan arus yang cepat disebabkan konsentrasi spesies teroksidasikan tinggi di dekat elektroda. Ketika potensialnya mendekati potensial yang diperlukan untuk mengoksidasikan spesies tereduksi, terdapat arus anoda yang besar sampai oksidasinya sempurna dan arus kembali nol. Bentuk keseluruhan kurva itu memberikan perincian kinetika proses elektroda [15].
dan arus (Ip) puncak, potensial setengah gelombang (E1/2 ketika I=Id/2) dan potensial
saat setengah puncak (Ep/2 ketika I=Ip/2).
Cara membaca densitas arus dari puncak ditunjukkan dalam Gambar 4. Asumsikan reaksi reversibel elektroda dari konsentrasi spesi elektroaktif di setiap titik kurva polarisasi kurva harus berhubungan dengan Persamaan Nernst [16] :
t r o C C nF RT E E , , , ln (1)
Potensial elektroda yang bergantung waktu dalam kasus metoda potensiodinamik dinyatakan dalam persamaan :
E v
E i (2) Dengan mensubsitusikan E dalam Persamaan 1 dengan hubungan Persamaan 2 dan menyusun hubungan perbandingan konsentrasi permukaan dari oksidasi dan reduksi spesi bergantung waktu dan potensial penyapuan dinyatakan dalam Persamaan 3 :
exp .( ,)
, ,
E v E RT nF C C i r o (3)Persamaan – persamaan di atas merupakan dasar untuk menurunkan deskripsi matematis dari bentuk umum kurva polarisasi potensiodinamik.
Nilai arus puncak maksimum dapat dihitung dari Persamaan 4 yang diturunkan dari deskripsi persamaan di atas :
2 1 2 1 2 1 4463 .
0 o o
p D
RT nF nFc
i
(4)
Nilai dari potensial setengah puncak dan perbedaan antara potensial puncak dan setengah puncak dinyakan dalam Persamaan 5 dan Persamaan 6 :
nF RT E
Ep/2,c 1/2 1,09 (5)
mV n nF RT E
E p c
c p 6 , 56 . 2 , 2 , 2 /
, (6)
Dapat disimpulkan bahwa potensial puncak dan karakteristik potensial lainnya adalah potensial rata-rata penyapuan yang berdiri sendiri dan densitas arus puncak sebanding dengan v1/2, ketika reaksi reversibel.
Persamaan di atas dapat digunakan untuk menentukan jumlah perubahan elektron dalam reaksi di elektroda atau untuk menentukan koefisien difusi dari spesi elektroaktif [16].
Keterangan :
Do = koefisien difusi oksidasi (cm2..s-1) υ = sweep rate (V/s)
Ep,c = potensial puncak katodik (V)
T = 298 K
Ep/2 = potensial puncak setengah (V)
Ip,c = arus puncak katodik (A)
Ei = potensial inisial (V)
F = konstanta faraday 9,6485×104 C.mol-1
R = konstanta gas (8,31451 JK-1mol-1) Co, = konsentrasi oksidasi (mol.cm-3)
Cr, = konsentrasi reduksi (mol.cm-3)
E , = potensial formal
Ferosen
Mediator adalah suatu molekul yang dapat menggerakkan bolak-balik elektron antara pusat redoks enzim dengan elektrode. Mediator digunakan sebagai perantara elektron antara elemen pengenal dengan elektroda. Cara ini dapat efektif menghilangkan senyawa penggangu tergantung sampel yang digunakan, yaitu sampel tersebut dapat dihasilkan pada potensial dimana reaksi oksidasi/reduksi senyawa pengganggu tidak terjadi. Mediator yang dapat digunakan pada biosensor yaitu ferosen, ferosianida, kuinon, kompleks rutheum [20]. Mediator yang digunakan harus dapat mentransfer elektron lebih cepat. Syarat-syarat yang harus dipenuhi oleh mediator yakni memilki kelarutan yang sesuai dalam larutan encer atau pelarut organik, bersifat reversibel, stabil dalam bentuk tereduksi dan teroksidasinya, memilki potensial redoks yang lebih rendah dari potensial oksidasi zat-zat pengganggu atau analit, tidak adanya reaksi langsung dengan substrat enzim, serta kurang sensitif terhadap pH dan efek kekuatan ion pada media [1].
Ferosen adalah kompleks logam organik dengan rumus molekul Fe(C5H5)2
dengan lima atom karbon gugus siklopentadienil terikat secara simultan pada atom besi [22]. Titik leleh ferosen berkisar 172-1740C, titik didih 2490C, memiliki kelarutan dalam pelarut organik seperti benzena, dietileter, metanol, etil alkohol, dan kerosin. Ferosin juga bersifat stabil, tidak beracun, tidak bereaksi dengan asam, basa dan ultra violet [1].
Ferosen mengoksidasi sebuah elektron pada potensial rendah, sekitar 0.5 V Vs saturated calomel electrode (SCE). Oksidasi ferosen menghasilkan sebuah kation stabil yang disebut ferrocenium. Ferrocenium kadang-kadang digunakan sebagai bahan pengoksidasi karena produk reaksi ferosen segera terpisah dari produk ion [23].
Gambar 5 Struktur molekul ferosen [21]
Kolesterol
Kolesterol merupakan sterol utama dalam tubuh manusia. Kolesterol merupakan komponen struktural membran sel dan lipoprotein plasma, dan juga merupakan bahan awal pembentukan asam empedu serta hormon steroid. Sterol dan derivatnya sukar larut dalam larutan berair tetapi larut dalam pelarut organik terutama alkohol. Sehingga senyawa ini dimasukkan dalam golongan lipid [24].
Gambar 6 Struktur kolesterol [25]
Kolesterol mempunyai 2 gugus metil yang terikat pada C-13 dan C-10 dengan 5 ikatan rangkap. Rantai cabang hidrokarbon terikat pada atom C-17, sedangkan gugus hidroksil pada C-3. Kolesterol disimpan di dalam sel sebagai
ester asam lemak yang dihasilkan dari reaksi esterifikasi oleh enzim asil KoA : kolesterol asiltransferase (ACAT) di sitoplasma [ 26]. Kolesterol dibuat di dalam tubuh dan juga diperoleh melalui makanan. Hati membentuk sebagian besar kolesterol di dalam tubuh yang membantu mengangkut lemak ke berbagai bagian tubuh yang membutuhkan lemak untuk energi dan perbaikan jaringan tubuh yang rusak [27].
Lipoprotein merupakan senyawa pembawa yang berfungsi sebagai penggerak dalam pembuluh darah [24]. Senyawa ini dibentuk dari ikatan lipid dengan protein. Lipoprotein di dalam plasma darah mengangkut molekul-molekul lipid seperti triasil gliserol, fosfolipid, dan kolesterol melalui aliran darah dari satu organ ke organ lainnya. Lipoprotein juga mengandung anti oksidan yang larut dalam lemak. Pembagian lipoprotein dilakukan berdasarkan densitasnya yaitu : kilomikron, lipoprotein densitas sangat renda (Very Low Density Lipoprotein, VLDL, 0.95-1.006 g/cm3), lipoprotein densitas rendah (Low Density Lipoprotein, LDL, 1.006-1.063 g/cm3 ), dan lipoperotein densitas tinggi (High Density Lipoprotein, HDL, 1.063-1.210 g/ cm3 ) [26].
Gambar 7 Molekul lipoprotein [25]
Partikel LDL mengangkut kolesterol dari hati ke seluruh bagian tubuh. Jika kolesterol yang tersedia lebih dari yang dibutuhkan, LDL akan beredar dalam aliran darah dan akhirnya tertimbun pada bagian dalam diniding pembuluh darah. LDL
disebut ”kolesterol jahat” karena dapat
kelebuhan kolesterol atau sebagian besar diubah menjadi asam empedu. [26]. HDL
juga dikenal sebagi ”kolesterol baik” karena
berjalan mengikuti aliran darah dari area-area tepi (perifer) tubuh sambil membawa kolesterol ke hati untuk dihancurkan [ 27].
Kadar LDL yang tinggi (>160 mg/dl) akan meningkatkan resiko penyakit hati, arteri koroner dan stroke. Sebaliknya, kadar HDL yang dibutuhkan untuk mengurangi resikio penyakit hati, arteri koroner dan stroke lebih dari 40 mg/dl (pria) dan 50 mg/dl (wanita). Kadar kolesterol dalam darah adalah kurang dari 200 mg/dl (resiko rendah), 200-239mg/dl (normal, dan lebih dari 240 mg/dl(resiko tinggi) [27,28].
Enzim
Enzim merupakan suatu protein yang dapat mengkatalisis suatu reaksi kimia dalam makhluk hidup. Protein ini memiliki ukuran yang berada pada kisaran 62 residu asam amino hingga lebih dari 2500 residu asam amino. Sama seperti protein, enzim tersusun dari rantai lurus asam amino yang kemudian mengalami proses pelipatan membentuk suatu struktur tiga dimensi. Setiap urutan asam amino yang berbeda akan menghasilkan struktur unik dan akan memiliki sifat yang berbeda pula [29].
Beberapa enzim membutuhkan kofaktor dan koenzim untuk sebagaimana mestinya. Kofaktor dapat berupa logam anorganik sedangkan koenzim berupa senyawa organik seperti vitamin. Semua enzim adalah protein kecuali sebagian kecil dari molekul RNA katalitik. Enzim akan kehilangan aktivitasnya akibat panas, asam atau basa (perubahan pH), pelarut organik, atau apa saja yang bisa menyebabkan denaturasi protein. Enzim mempunyai sifat khas yaitu bekerja pada substrat dan reaksi tertentu.. Enzim sebagai katalis dapat menurunkan energi aktivasi suatu reaksi. Akibatnya hanya dibutuhkan energi yang kecil untuk mengubah reaktan menjadi produk. Reaksi yang dikatalis oleh enzim lebih cepat dibanding dengan reaksi tanpa katalis [26].
Pengaruh suhu terhadap enzim telah diamati karena struktur protein menentukan aktifitas enzim maka jika struktur ini terganggu aktifitas akan berubah. Proses denaturasi protein berlaku juga untuk protein-protein enzim. Enzim sering memperlihatkan kerapuhan akibat suhu, jika dipanaskan sehingga kurang lebih di atas 500C kebanyakan tetapi tidak semua enzim
akan terdenaturasi. Denaturasi akibat suhu tinggi biasanya ireversibel karena gaya-gaya ikatan lemah yang penting rusak akibat meningkatnya getaran termal komponen atom-atomnya. Pada kondisi yang tidak menyebabkan denaturasi kebanyakan enzim menunjukkan adanya suhu optimum [30].
Suatu reaksi kimia dapat berlangsung karena molekul-molekul reaktan A pada suatu waktu tertentu mengalami keadaan aktif, yaitu apabila energi molekul tersebut dalam keadaan energi pengaktifan. Dalam keadaan demikian ikatan kimia dalam molekul dapat pecah sehingga memungkinkan terbentuknya produk P. Keadaan transisi terjadi ketika molekul A ada dalam keadaan aktif dan energi pengaktifan diartikan sebagai jumlah energi yang dibutuhkan oleh satu mol zat pada temperatur tertentu untuk membawa semua molekul ke-keadaan aktifnya [31].
Gambar 8 Kurva energi aktifasi tanpa katalis Enzim dan terkatalisis
Enzim [ 32]
Tahap katalisis
E+S ES
ES*→EP→E+P
Ikatan substrat
Gambar 9 Mekanisme reaksi enzim
E mewakili enzim bebas, S substrat, ES kompleks antara enzim dan substrat, ES* keadaan aktif atau transisi dari kompleks tersebut, EP kompleks antara enzim dan produk, dan P produk bebas. Dalam formulasi yang tidak begitu rinci ES* dihilangkan guna penyederhanaan. Umumnya substrat lebih banyak terdapat dari pada enzim sehingga hanya sebagian dari S yang terikutkan dalam ES pada suatu waktu tertentu. Bagian S yang membentuk ES mempunyai kandungan energi yang lebih tinggi dari pada S bebas, karena pengaruh penstabilan ES maka kondisi yang secara statistik tidak mungkin ini tetap berlangsung sepanjang waktu yang diperlukan untuk katalisis. Ketika ES diubah menjadi EP terdapat penurunan stabilitas sehingga EP berdisosiasi menghasilkan produk bebas plus enzim. Siklus ini dapat berulang ratusan atau ribuan kali tiap menit [30].
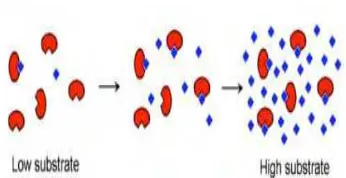
Gambar 10 Kurva hubungan antara laju reaksi, konsentrasi enzim dan konsentrasi substrat [33]
Gambar11 Enzim dalam keadaan jenuh [34]
Dengan meningkatnya konsentrasi substrat, aktifitas enzim akan bertambah karena kemungkinan terbentuknya kompleks enzim-substrat menjadi semakin besar. Kenaikan ini akan terus terjadi seiring dengan bertambahnya konsentrasi substrat sampai pada suatu keadaan jenuh dimana jumlah enzim menjadi faktor pembatas. Pada keadaan ini penambahan konsentrasi substrat tidak memiliki pengaruh lagi terhadap laju reaksi. Proses ini diilustrasikan dalam Gambar 10 dan Gambar 11 [10 ].
Jika laju reaksi awal didefenisikan sebagai laju teramati untuk sejumlah enzim bila konsentrasi produk yang terbentuk mendekati nol, digambarkan sebagai fungsi konsenstrasi substrat maka hasilnya akan nampak seperti pada Gambar 10. Kurva yang menghubungkan titik–titik yang diamati akan berupa hiperbola dan akan mendekati nilai maksimum secara asimtotis seperti diperlihatkan oleh Vmaks. Ini merupakan
kecepatan awal maksimum yang dapat dicapai tanpa penambahan jumlah enzim [ 30].
Salah satu enzim yang diaplikasikan dalam berbagai bidang seperti kedokteran dan industri adalah enzim kolesterol oksidase ( 3β-hidroksisteroid oksidase). Kolesterol oksidase termasuk enzim oksido reduktase, yakni enzim yang berperan dalam reaksi redoks. Beberapa mikroba yang mampu menghasilkan enzim ini adalah Nokardia sp., Streptomyces hygroscopicus., dan Brevibacterium sterolicum [1].
Imobilisasi Enzim
Proses imobilisasi enzim biasanya mengalami reduksi dalam aktifitas reaksinya. Imobilisasi enzim memilki beberapa keuntungan pada enzim terlarut yaitu jumlah total enzim yang dibutuhkan lebih sedikit dan imobilisasi enzim dapat digunakan lagi, proses dapat dioperasikan secara terus menerus dan dapat dikontrol, produk mudah dipisahkan, kegagalan dalam reaksi materi diperkecil, dan dalam beberapa bahan, aktifitas, dan stabilitas enzim dapat secara mudah diubah dengan imobilisasi. Setiap metode imobilisasi memiliki keterbatasan dan penting untuk
menemukan prosedur yang tepat bagi partikel enzim dan aplikasi yang mudah, tidak terlalu mahal dan mempermudah imobilisasi enzim dengan aktifitas dan stabilitas yang baik [19].
Dalam imobilisasi enzim pada permukaan penting untuk memilih metode perlakuan imobilisasi yang akan mencegah kehilangan aktifitas enzim dengan tidak mengubah sifat kimia atau kelompok reaktif dalam ikatan enzim [35].
Ada beberapa metode untuk imobilisasi enzim yaitu carrier binding, metode ini terdiri dari adsorpsi fisik, ikatan ionik, dan ikatan kovalen. Metode adsorpsi fisik memanfaatkan gaya van der waals, ikatan ionik, dan gaya hidropobik antar materi [3,35]. Metode ini berdasarkan adsorpsi fisik protein pada permukaan matriks dan prosesnya sederhana. Keuntungan utama yang berhubungan dengan adsorpsi langsung pada permukaan benda adalah prosesnya sederhana dan dapat digunakan pada kondisi tertentu [11]. Metode adsorpsi membutuhkan preparasi yang minimal dan tergantung substrat. Kelemahan metode ini adalah ketergantungan terhadap suhu, pH pelarut, kekuatan ionik, serta memilki stabilitas yang cepat [3].
Metode ikatan ionik berdasarkan ikatan ionik dari enzim protein dengan pembawa zat terlarut sehingga terjadi pertukaran ion. Keuntungan dari metode ini adalah ikatan antara enzim dengan carrier mudah terlepas. Oleh karena itu metode ikatan ionik menyebabkan sedikit perubahan dalam bentuk dan sisi aktif dari enzim. Kebocoran enzim dari carrier dapat terjadi di larutan substarat yang kekuatan ioniknya tinggi atau berdasar variasi pH. Hal ini menyebabkan gaya ikatan antara enzim dan carrier lebih lemah dari ikatan kovalen [35].
Metode ikatan kovalen digunakan untuk mendapatkan imobilisasi yang bertahan lama. Misalnya adalah pada reversibilitas. Reversibilitas dapat diperoleh dengan memanfaatkan teknik tertentu seperti Metal-cheating [3]. Metode ini berdasarkan ikatan enzim dan zat terlarut yaitu ikatan kovalen. Kondisi untuk imobilisasi dengan ikatan kovalen lebih rumit dari pada kasus adsorpsi fisik dan ikatan ionik. Oleh karena itu ikatan kovalen dapat merubah struktur dan pusat aktif enzim, kehilangan aktifitas dan perubahan dari substrat. Metode kovalen relatif lebih mahal. Gaya ikatan antara enzim dan carrier sangat kuat sehingga kebocoran enzim tidak terjadi [35].
Metode berikutnya adalah cross linking. Metode ini berdasarkan ikatan kovalen antara molekul enzim, dengan menggunakan reagen multifungsional sehingga mempermudah terbentuknya tiga dimensi kumpulan cross link. Metode cross link digunakan untuk menjaga stabilitas adsorbsi enzim dan juga mencegah kebocoran. Metode ini dapat menyebabkan perubahan signifikan sisi aktif enzim yang membuat kehilangan aktifitas enzim selama proses preparasi. Metode entrapping berdasarkan lokalisasi enzim dalam kisi-kisi matriks polimer atau membran. Metode ini berbeda dari ikatan kovalen dan cross lingking yaitu enzim tidak terikat ke gel matriks atau membran [35]. Matrix-Entrapment yaitu proses imobilisasi suatu biomolekul dibarengi dengan elektropolimerisasi sehingga biomolekul akan dikungkung oleh elektropolimer yang terbentuk. Membran-entrapment yaitu dengan menyelubungi biomolekul dengan membran yang misalnya hanya bisa melewatkan analit tapi tidak melewatkan biomolekul [3].
Resistansi dan Konduktivitas Listrik
Resistansi suatu material bergantung pada panjang, luas penampang lintang, tipe material dan temperatur. Pada material ohmik resistansinya tidak bergantung pada arus dan. Hubungan empiris ini disebut dengan hukum Ohm dinyatakan oleh Persamaan 7 [36] :
tan
;
R
kons
IR
V
I V R
(8) Kurva hubungan arus dan tegangan pada material Ohmik adalah linear sedangkan material nonohmik kurva hubungannya tidak linear.
Resistansi suatu kawat penghantar sebanding dengan panjang kawat dan berbanding terbalik dengan luas penampang lintang [36]:
A L R
(9) Di mana disebut resistivitas material penghantar. Satuan resistivitas adalah ohm meter (Ωm). Kebalikan dari resistivitas
disebut konduktivitas :
1
(10)
Konduktivitas listrik adalah kemampuan suatu bahan untuk menghantarkan arus listrik . Persamaan 12 merupakan hubungan konduktivitas listrik dan resistansi :
A L R (11) RA L (12)
EIS (Electrochemical Impedance Spectroscopy )
Publikasi pertama mengenai Electrochemical Impedance Spectroscopy terjadi di tahun 1975 melalui aplikasi secara sinusoidal dengan variasi potensial U, salah satunya mengukur hasil respon arus I. Melalui variasi eksitasi frekuensi f dari aplikasi potensial di atas range frekuensi dapat menghitung kompleks impedansi, jumlah dari riil dan imaginer komponen impedansi dari sistem fungsi frekuensi
(contohnya frekuensi angular ω). τleh
karena itu, EIS mengkombinasikan analisis dari riil dan imaginer komponen impedansi yaitu resiatansi dan reaktansi elektrik seperti dalam Persamaan 13 [9]
: ) ( ) ( ) ( ) ( ) (
Z jZij I
j U j
Z r (3)
f
2
(14)EIS memilki kemampuan untuk mempelajari bahan intrinsik material atau proses spesifik yang dapat mempengaruhi konduktifitas/resistifitas atau kapasitas dari sistem elektrokimia. EIS merupakan alat yang sangat berguna dalam pengembangan dan analisis material untuk transduksi biosensor. Teknik impedansi untuk sensor elektrokimia sangat dibutuhkan dalam mengamati perubahan bahan elektrikyang muncul dari peristiwa biorekognisi pada permukaan elektroda termodifikasi. Contohnya perubahan konduktansi dari elektroda dapat diukur hasil reaksi imobilisasi protein dan antibodi-antigen di atas permukaan elektroda [9].
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Teknologi Farmasi dan Medik TIAB BPPT PUSPIPTEK Serpong dan Laboratorium Departemen Fisika IPB dari bulan Agustus 2008 sampai bulan Februari 2009.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah neraca analitik, alat sablon atau screen-printing dengan ketebalan screen 180 mesh, PVC sheet, alat gelas, tisu, Ulano 23, mikropipet, HIOKI 3532-50 LCR Hi Tester dan Potentiostat- Galvanostat Model PG 580 yang dihubungkan ke komputer.
Bahan yang digunakan dalam penelitian ini adalah carbon conductive ink Elektrodag PF-407 ( Acheson Colloids, USA), silver chloride (AgCl) Elektrodag 6037SS (Acheson Colloids, USA), silver (Ag) conductive ink Elektrodag 427SS (Acheson Colloids, USA), insulator ink Elektrodag 452SS (Acheson Colloids, USA),
1,1’-Dimethylferrocene 97% (Sigma), kolesterol standar, kolesterol oksidase dari Streptomyces sp 39 unit/mg, triton X-100, KCl, bufer fosfat 0,2 M pH 7.5 ( KH2PO4 +
Na2HPO4) dan aquades.
Pembuatan Elektroda
Desain Layout Elektroda
elektroda pembanding, elektroda pendukung, sirkuit yang menghubungkan antara ketiga elektroda dengan kaki elektroda dan insulator sebagai penutup sirkuit. Ukuran kaki elektroda harus disesuaikan dengan Potentiostat- Galvanostat Model PG 580 yang digunakan. Ukuran elektroda kerja 1,4 cm x 0,6 cm berbentuk persegi panjang. Elektroda pembanding dengan panjang 1,4 cm dan lebar 0,09 cm. Elektroda pendukung berbentuk persegi panjang dengan ukuran 1,4 cm x 0,2 cm. Bagian insulator dibentuk persegi panjang dengan ukuran 3 cm x 1,9 cm. Bagian-bagian elektroda ini dipisahkan pembentukannya karena bahan tinta untuk penyablonan pada tahap berikutnya berbeda-beda yaitu C, Ag/AgCl, Ag dan insulator ink. Hasil desain kemudian diprint pada kertas A4.
Pencetakan Desain Elektroda pada Alat Sablon atau Screen Printing Alat sablon yang digunakan berbentuk persegi panjang terdiri dari bingkai yang terbuat dari kayu disetiap sisi-sisinya dan layar atau screen. Ukuran bingkai 30 cmx 40 cm dan ketebalan screen 180 mesh. Hasil print out desain elektroda dibentuk pada layar dengan cara melekatkan hasil desain di bawah screen kemudian memotong atau membuang bahan screen yang tak berpori. Proses ini membutuhkan pencahayaan yang cukup agar bentuk elektroda pada screen sesuai dengan hasil desain elektroda yang telah dibuat. Proses berikutnya adalah membersihkan screen yang telah tercetak dengan Ulano 23 tujuannya untuk menghilangkan lemak dan pengotor lainnya sehingga proses penempelan emulsi lebih mudah.
Pembuatan Elektroda dengan Metode
Screen Printing
Proses penyablonan dengan screen printing pada PVC sheet ada empat tahap. Tahap pertama yaitu menyablon konstruksi dasar elektroda biosensor dengan menggunakan tinta silver Elektrodag 427SS. Konstruksi dasar elektroda ini terdiri dari sirkuit, kaki elektroda dan reference electrode, Tahap kedua menyablon elektroda pembanding dengan tinta silver chloride (AgCl) Elektrodag 6037SS.Tahap ketiga menyablon elektroda kerja dan elektroda pendukung dengan tinta carbon conductive Elektrodag PF-407. Tahap terakhir menyablon insulator atau penutup sirkuit dengan tinta insulator Elektrodag 452SS. Setiap tahap setelah proses penyablonan
elektroda harus dikeringkan dalam suhu ruangan kemudian dimasukkan ke oven dengan suhu 400C.
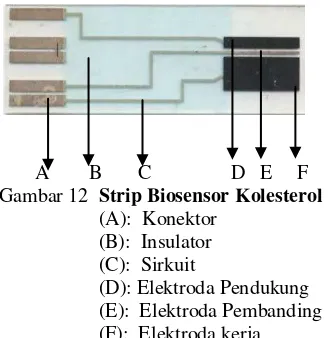
A B C D E F Gambar 12 Strip Biosensor Kolesterol
(A): Konektor (B): Insulator (C): Sirkuit
(D): Elektroda Pendukung (E): Elektroda Pembanding (F): Elektroda kerja
Karakterisasi EIS (Electrochemical Impedance Spectroscopy )
Elektroda yang telah dicetak pada PVC sheet kemudian dikarakterisasi
resistansi (Rs), reaktansi (X), sudut fasa ( )
dan konduktansi (G) dengan menggunakan HIOKI 3532-50 LCR Hi Tester. Sebelum dihubungkan ke kaki elektroda, elektroda kerja ditetesi dengan larutan elektrolit KCl 1 M. Parameter yang akan diukur pada proses
ini adalah G (Siemens), Rs (Ω), X(Ω) dan θ.
Karakterisasi EIS ini dilakukan pada frequensi 42 Hz sampai 100 KHz. dan konduktifitas AC.
Konduktansi G bahan merupakan kebalikan dari tahanan bahan R, makin rendah tahanan maka makin besar konduktansinya [15] :
R
G 1 (15)
Dari Persamaan 12 dapat ditentukan hubungan antara konduktansi dan konduktifitas elektroda kerja dengan mensubsitusikan Persamaan 15 ke Persamaan 12. Sehingga didapat hubungan persamaan : G A L
(16) Dimana,G= Konduktansi (Siemens) L= Panjang Elektroda kerja (m) A= Luas area elektroda kerja (m2)
= Konduktifitas (Siemens.m-1
Dalam mempermudah pengolahan data EIS
dapat dirumuskan konduktifitas ( ) :
s
f
0
(17)f slog log
log
0 (18)Persamaan 21 dianalogikan ke dalam persamaan linear :
B Ax
Y (19)
Sehingga didapat analogi persamaan :
log
Y
(20)S
A (21)
0
log
B (22)
f
X
log
(23)Hubungan anatar Zre dan Zim dapat dianalisis dari grafik di bawah :
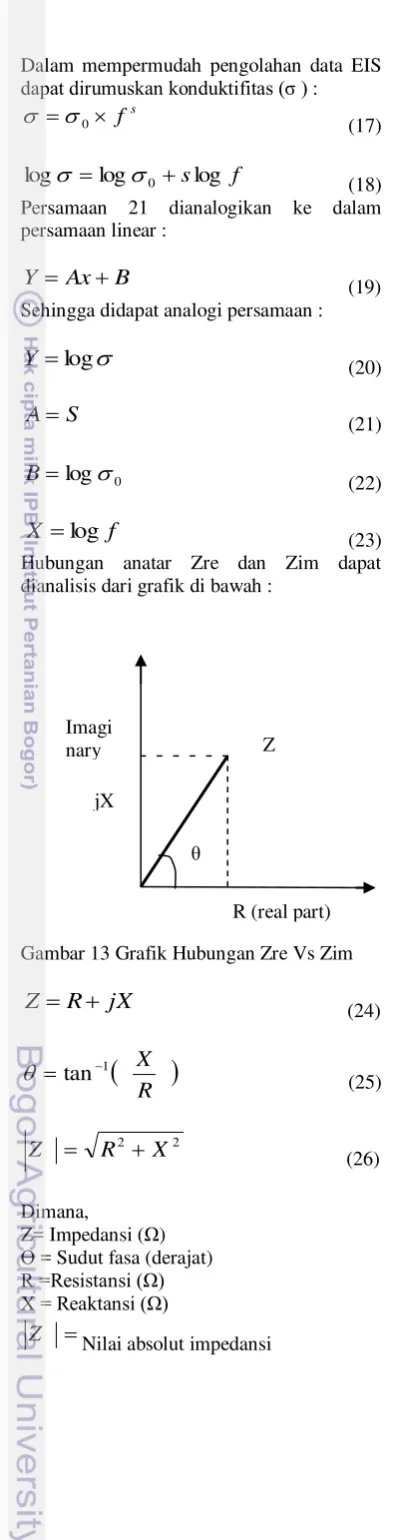
Gambar 13 Grafik Hubungan Zre Vs Zim
jX
R
Z
(24)
R X 1 tan
(25)2
2 X
R
Z (26)
Dimana,
Z= Impedansi (Ω) = Sudut fasa (derajat)
R =Resistansi (Ω) X = Reaktansi (Ω)
Z Nilai absolut impedansi
Dari Gambar 14 diperoleh Persamaan :
cos
R
Zre (27)
sin X Zim (28) Imobilisasi Enzim Preparasi Enzim Kolesterol Oksidase Pertama dipersiapkan sebanyak 4,01 mg (39 unit/mg) kolesterol oksidase dari Streptomyces sp kemudian dilarutkan dalam 1 ml aquades. Perhitungan stokiometri dapat menentukan seberapa banyak enzim kolesterol oksidase yang dibutuhkan untuk satu strip biosensor. Pehitungannya sebagai berikut :
ChOx/ 1ml = 39unit/mg x 4.01mg / 1ml = 156 unit/ml
= 156 unit/1000µl = 1,092 unit/7 µl
Sehingga setiap strip biosensor membutuhkan 1,092 unit/7 µl. Hasil pengenceran antara enzim kolesterol oksidase 4,01 mg (39 unit/mg) dan 1 ml aquades disimpan dalam lemari pendingin dengan suhu -150 C dengan tujuan untuk menjaga struktur enzim.
Proses Imobilisasi Enzim
Metode adsorbsi fisik menampilkan proses yang sederhana dalam imobilisasi enzim, tapi kehilangan enzim secara bertahap selama penggunaan biosensor sering terjadi [28]. Metode yang digunakan dalam penelitian ini untuk proses imobilisasi enzim kolesterol oksidase adalah adsorbsi fisik.
Sebelum imobilisasi enzim dilakukan terlebih dahulu elektroda kerja diteteskan
mediator 1,1’-Dimethylferrocene sebanyak
7,5.10-8 mol/ 5µl. Proses penetesan dilakukan sebanyak dua kali sehingga mediator pada elektroda kerja ada 1,5.10
-7
mol/ 10µl. Setelah itu proses pengeringan dilakukan selama 10 menit pada suhu 300C. Imobilisasi dilakukan dengan drop coating. Strip biosensor yang telah dikeringkan kemudian ditetesin kolesterol oksidase sebanyak 1,092 unit/7µl. Proses penetesan dilakukan sebanyak dua kali dengan tujuan untuk mengurangi kehilangan enzim selama proses reaksi redoks saat pengujian strip dilakukan sehingga setiap strip biosensor terdapat 2,184 unit/ 7µl. Setelah itu strip dikeringkan pada suhu 300C selama 10 menit.
Analisis kolesterol dengan menggunakan biosensor berbasis enzim kolesterol oksidse untuk menentukan hydrogen peroxide
Imagi nary
θ
R (real part) jX
ChOx
Cholesterol + O2
4-cholesten-3one
+ H2O2
H2O2 O2 + 2H++ 2e-
Gambar 14 Mekanisme reaksi katalisis enzimtik pada kolesterol [37]
Karakterisasi SEM
Morfologi permukaan elektroda kerja diobservasi dengan menggunakan SEM. Morfologi yang akan diamati ketika elektroda kerja sebelum dan setelah dimobilisasi enzim kolesterol oksidase+
1,1’-Dimethylferrocene..
Pengujian Strip Biosensor Kolesterol
Preparasi Sampel Kolesterol
Sebelumnya bufer fosfat 0,2 M pH 7.5 dibuat terlebih dahulu dengan mencampurkan 48 ml 0,2 M KH2PO4 + 252
ml 0,2 M Na2HPO4 + aquades hingga
mencapai volume 600 ml (13,9 gr 0,2 M KH2PO4 diencerkan dalam 500 ml aquades
dan 28,4 gr 0,2 M Na2HPO4 diencerkan
dalam 1000 ml aquades). Larutan hot (700C) bufer fosfat 0,2 M pH 7.5 sebanyak 100 ml dicampur dengan 15% triton x-100 kemudian dicampur lagi dengan 100 mg kolesterol. sehingga didapat konsentrasi kolesterol 400 mg/dl. Proses pengenceran konsentrasi 400 mg/dl dengan larutan hot (700C) bufer fosfat akan menghasilkan konsentrasi kolesterol yang akan diuji yaitu 100 mg/dl, 125 mg/dl, 150 mg/dl, 175 mg/dl, 200 mg/dl, 250 mg/dl, 300 mg/dl.
Tes CV (Cyclic Voltammetry)
Pengujian CV dilakukan menggunakan alat Potentiostat- Galvanostat Model PG 580 beserta satu set komputer dengan pengolah data UiEChem Version 1.20 dari Uniscan Instrument. Tujuannya untuk mengamati sensitifitas dan stabilitas enzim biosensor dalam mendeteksi sampel kolesterol. Sensitifitasnya dapat dilihat dari grafik yang keluar pada pengolah data. Strip biosensor yang telah diimobilisasi enzim kolesterol oksidase kemudian diteteskan sampel kolesterol dengan konsentrasi 100 mg/dl sebanyak 20 µl pada elektroda kerjanya. Setelah itu strip biosensor dihubungkan ke potentiostat yang terhubung ke komputer dengan pengaturan Voltage sebesar +0,5 V, sweep rate 0,1 V/s kemudian parameter yang akan diubah yaitu sweep potential (V), current range (A). Prosedur ini seterusnya dilakukan pada konsentrasi 125 mg/dl, 150 mg/dl, 175 mg/dl, 200 mg/dl, 250 mg/dl dan 300 mg/dl.
Untuk pengujian stabilitas strip biosensor. Strip yang telah terimobilisasi disimpan dalam refrigerator dengan suhu -150C selama 8 hari. Dalam pengujian stabilitas diambil tiga variasi kolesterol (125mg/dl, 150mg/dl, 175mg/dl). Pengujian stabilitas hari ke-0 dilakukan saat pengujian sensitifitas. Setelah hari-8 strip biosensor diteteskan sampel kolestrol 125 mg/dl kemudian dihubungkan ke potensiostat
.
Pengaturan parameter sama seperti sebelumnya. Prosedur yang sama juga dilakukan pada konsentrasi 150 mg/dl, 175 mg/dl. Kondisi optimal dihasilkan dari voltamogram yang memilki puncak arus yang paling tinggi.HASIL DAN PEMBAHASAN
Karakteristik EIS
Pengukuran konduktifitas dan impedansi elektroda dilakukan dengan menggunakan alat LCR-meter. Parameter yang diukur pada alat tersebut adalah resistansi (Rs), reaktansi (X), sudut fasa ( ) dan konduktansi (G), dengan variasi frekuensi 42 Hz sampai 100 KHz. Konduktifitas AC dapat dipengaruhi oleh frekuensi [35]. Arus listrik bisa berupa arus searah (DC) atau bisa berupa arus bolak balik (AC), di mana arus berganti arah dengan frekuensi tertentu. Arus bolak balik sinusoidal terhadap waktu, I = I0 sin
[38]. Data pengukuran LCR-meter dapat dilihat pada Lampiran 3.
Grafik konduktifitas elektroda kerja pada Gambar 15 menunjukkan hubungan antara frekuensi dan konduktifitas (log f Vs log ), Persamaan garis lurus Y = Ax + B merepresentasikan Persamaan 18. Persamaan garis lurus yang didapat Y =0,3441x – 2,6487. Konduktifitas awal ( 0)
elektroda kerja diperoleh dengan memasukkan nilai B sebesar -2,6487 ke dalam Persamaan 22, sehingga diperoleh konduktifitas awal ( 0) sebesar 2,24 × 10-3
Siemens.m-1 dengan luas elektroda kerja 84 mm2. Konduktifitas awal elektroda kerja khusus menggunakan karbon pada penelitian sebelumnya didapat 5,83×10-1 Siemens.m-1 dengan luas permukaan elektroda kerja 78 mm2 [35] dan 8,57×10-3 Siemens.m-1 dengan luas permukaan elektroda kerja 80 mm2 [39]. Persamaan 16 menunjukkan adanya hubungan antara konduktifitas, konduktansi dan luas permukaan elektroda kerja. Permukaan elektroda kerja yang semakin luas akan menyebabkan konduktifitas elektroda kerja semakin lebih kecil atau berkurang konduktifitasnya. Hal ini dapat dibuktikan dengan membandingkan nilai konduktifitas yang didapat pada penelitian ini, dengan nilai konduktifitas pada penelitian sebelumnya. Konduktifitas dengan luas permukaan elektroda kerja paling kecil yaitu 78 mm2 diperoleh nilai 0 paling besar.
KONDUKTIFITAS AC ELEKTRODA KERJA
y = 0.3441x - 2.6487
-2 -1.8 -1.6 -1.4 -1.2 -1 -0.8 -0.6 -0.4 -0.2 0
0 1 2 3 4 5
log f
lo
g
σ
Gambar 15 Grafik Konduktifitas Elektroda kerja,C + KCl 1 M, log f Vs log
IMPEDANSI AC ELEKTRODA KERJA
y = 0.007x - 4030.4
-4500 -4000 -3500 -3000 -2500 -2000 -1500 -1000 -500 0
0 100000 200000 300000 400000 500000 600000
Zre,Ω
Z
im
,Ω
Gambar 16 Grafik Impedansi lektroda kerja C+KCl 1 M, Zre Vs Zim
Grafik impedansi elektroda kerja pada Gambar 16 menunjukkan hubungan antara Zre (resistensi) dan Zim (reaktansi) dan dari analis grafik pada Gambar 13 diperoleh Persamaan 27 dan Persamaan 28. Besarnya impedansi elektroda kerja diperoleh dengan memasukkan komponen Zre dan Zim ke dalam Persamaan 26 atau ekspresi lain Persamaan tersebut [19] :
2 2' ' ' Z Z
Z (29)
өi mana Z’=Zre dan Z’’=Zim,
sebelumnya Persamaan 24 dianalogikan ke dalam persamaan garis lurus Y =Ax + B. Persamaan yang diperoleh yaitu [19] :
' ' ' Z iZ
Z (30)
Sehingga didapat analogi persamaan :
Z Y (31) ' ' Z
A (32)
'
Z
B (33)
Persamaan garis lurus yang terdapat pada Gambar 16 Y = 0,007x – 4030,4 sehingga diperoleh nilai B =Zre =-4030,4 Ω dan A = Zim=0,007 Ω. Nilai Zre dan Zim kemudian dimasukkan ke dalam Persamaan 29 sehingga impedansi elektroda kerja C+KCl 1 M diperoleh sebesar 4,03 KΩ
Karakteristik SEM
diteteskan dengan enzim kolesterol oksidase dan mediator 1,1’-Dimethylferrocene dapat dilihat dalam Gambar 17. Permukaan elektroda terlihat tidak homogen dan terdapat perbedaan bentuk dan warna pada permukaan elekroda kerja. Bagian A menunjukkan struktur PVC yang tidak tercetak oleh tinta karbon konduktif, berwarna agak keputihan membentuk jejaring di antara cetakan karbon dan bagian B menunjukkan tinta karbon konduktif yang berhasil melewati pori-pori layar screen printing, terlihat berwarna hitam. Bentuk dari cetakan karbon agak lonjong dan susunanya berpola antara satu cetakan dengan yang lainya. Ukuran diameter
panjang cetakan karbon 15 μm dan diameter
pendek 5 μm. Pola dari cetakan karbon ini menunjukkan gambaran pori-pori dari layar alat screen printing dengan ukuran mesh 180.
Gambar 17. Hasil SEM karbon (C) elektroda kerja dengan perbesaran 200 X (A) Bagian PVC (B) karbon konduktif yang tercetak.
Gambar 18. Hasil SEM Ө+1,1’ -Dimethylferrocene dengan perbesaran 200 X
Morfologi permukaan karbon elektroda kerja setelah diteteskan enzim
kolesterol oksidase + 1,1’
-Dimethylferrocene dapat dilihat pada Gambar 18. Permukaan elektroda kerja terlihat lebih homogen dari pada sebelum diimobiisasi enzim. Enzim kolesterol oksidase strukturnya tersusun rapat dan membentuk gumpalan berwarna putih di seluruh permukaan elektroda kerja.
Hasil Tes CV ( Cyclic Voltammetry ) Pengujian strip biosensor dilakukan dengan menggunakan metode voltametri siklik. yang dihubungkan ke potentiostat dan terhubung ke komputer dengan pengaturan Voltage sebesar +0,5 V, sweep rate 0,1 V/s, current range 100 μA. Variasi konsentrasi sampel kolesterol dilakukan untuk melihat perbedaan arus puncak saat reaksi oksidasi-reduksi terjadi untuk setiap konsentrasi kolesterol. Lampiran 6 menampilkan voltamogram untuk seluruh konsentrasi yang telah diuji.
Kolesterol sebagai substrat dioksidasi oleh kolesterol oksidase yang memiliki pusat aktif ligan flavin adenin dinukleotida (FAD) yang akan direduksi menjadi FADH2. Semakin banyak jumlah
kolesterol dalam larutan kemungkinan semakin banyak pula yang bereaksi dengan enzim sehingga meningkatkan puncak arus [1].
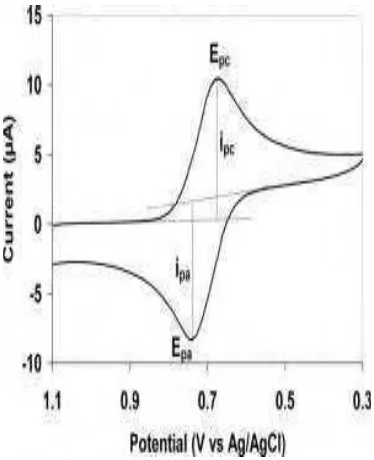
Gambar 19 menampilkan voltamogram untuk tujuh konsentrasi kolesterol yang diukur (100 mg/dl, 125mg/dl, 150mg/dl, 175 mg/dl, 200 mg/dl, 250 mg/dl dan 300 mg/dl). Konsentrasi kolesterol 175 mg/dl menghasilkan puncak arus oksidasi tertinggi yakni 1,94 × 10-5μA namun pada konsentrasi 200 mg/dl dihasilkan arus puncak oksidasi paling rendah yakni 1,79 × 10-6μA. Penurunan arus puncak oksidasi pada konsentrasi lebih tinggi disebabkan adanya kolesterol yang tidak larut sempurna dalam konsentrasi tinggi sehingga molekul-molekul kolesterol tidak dapat melewati membran dialis dan tidak dapat bereaksi dengan enzim.
15 μm
5 μm
-0.00005 0 0.00005 0.0001 0.00015 0.0002 0.00025
-0.6 -0.4 -0.2 0 0.2 0.4 0.6
Potensial,V Ar u s ,I ( µ A) 100 mg/dl 125 mg dl 150 mg/dl 175 mg/dl 200 mg/dl 250 mg/dl 300 mg/dl
Gambar 19 Voltamogram Siklik dengan variasi sample kolesterol. Voltage : +0,5 V, sweep rate 0,1 V/s
Tabel 1. Nilai arus puncak katodik (oksidasi) dengan variasi konsentrasi kolesterol
Konsentrasi
(mg/dl) Arus puncak (µA)
100 1.43E-05
125 2.95E-06
150 7.98E-06
175 1.94E-05
200 1.79E-06
250 2.37E-06
300 5.48E-06
Kalibrasi Kurva Sensitifitas C Vs I
y = 3E-07x - 4E-05
0.00E+00 5.00E-06 1.00E-05 1.50E-05 2.00E-05 2.50E-05
0 50 100 150 200
Konsentrasi Sampel Kolesterol [mg/dl]
A rus ( μA ) Series1 Linear (Series1)
Gambar 20 Kalibrasi Kurva Sensitifitas Biosensor Kolesterol Sensitifitas biosensor kolesterol dapat dianalisis dari regresi linier grafik pada Gambar 20 yaitu hubungan antara variasi sampel kolesterol dengan arus puncak oksidasi. Pada tiga konsentrasi yang
dianggap linier, yaitu 125 mg/dl, 150 mg/dl dan 175 mg/dl dihasilkan Persamaan garis Y= 3×10-7x– 4× 10-5, sehingga sensitifitas dari biosensor kolesterol sama dengan 3 × 10-7
μA.mg-1.dl. Persamaan garis di atas dapat juga digunakan untuk menentukan batas arus puncak oksidasi untuk konsentrasi kolesterol yang lain. -4.00E-05 -2.00E-05 0.00E+00 2.00E-05 4.00E-05 6.00E-05 8.00E-05 1.00E-04 1.20E-04
-0.6 -0.4 -0.2 0 0.2 0.4 0.6
125 mg/dl 150 mg/dl
175 mg/dl
Gambar 21 Voltamogram siklik sampel kolesterol 125 mg/dl, 150 mg/dl dan 175 mg/dl. Voltage : +0,5 V, sweep rate 0,1 V/s
Tabel 2. Nilai arus puncak katodik (oksidasi) setelah hari ke-0
konsentrasi (mg/dl)
Arus puncak (µA)
125 2.95E-06
150 7.98E-06
175 1.94E-05
diperoleh dari persamaan garis Y= 9 × 10-9x – 3×10-7(Gambar 23), sehingga
sensitifitasnya sebesar 9 × 10-9 μA.mg-1dl. Stabilitas penyimpanan adalah hal penting untuk biosensor [28]. Sensitifitas biosensor kolesterol hari ke-8 menurun 97% dari nilai sensititifitas hari ke-nol sehingga stabilitas penyimpanan strip biosensor sangat tidak stabil dan memuaskan. Penurunan sensitifitas biosensor hari ke-0 dari 3×10
-7μ
A.mg-1.dl menjadi 9×10-9μA.mg1dl dihari ke-8 disebabkan adanya kerusakan dan teroksidasinya enzim pada elektroda kerja ketika disimpan di dalam refrigerator selama delapan hari dengan suhu -150C sehingga sedikit enzim yang berinteraksi dengan substrat pada permukaan elektroda kerja dan mengakibatkan elektron yang dihasilkan sedikit yang ditransfer ke elektroda.
Tingkat keakuratan strip biosensor kolesterol dapat dianalisis dari persamaan linier Y= 3×10-7x– 4× 10-5. Untuk konsentrasi kolesterol 300 mg/dl diperoleh hasil pengukuran arus puncak katodik sebesar 5,48 × 10-6 μA. Jika dibandingkan dengan hasil perhitungan persamaan di atas diperoleh arus puncak katodik sebesar 5 ×10
-5 μ
A. Perbedaan nilai arus puncak hasil pengukuran dan hasil perhitungan menunjukkan akurabilitas strip biosensor kolesterol sangat rendah. Hal ini disebabkan jumlah kolesterol yang diteteskan pada permukaan elektroda kerja berkurang akibat teroksidasi saat pengukuran sehingga tidak banyak molekul-molekul kolesterol yang berinteraksi dengan enzim kolesterol oksidase dan mengakibatkan pergerakan elektron semakin sedikit melewati elektroda. Faktor penyebab yang lain adalah tinta karbon yang membentuk elektroda kerja tidak melewati membran berpori pada alat sablon sehingga homogenitasnya berkurang. Hal ini membuat enzim kolesterol oksidase serta mediator tidak teradsorbsi dengan baik sehingga mudah teroksidasi. Interaksi antara enzim dan kolesterol yang berkurang mengakibatkan pergerakan jumlah elektron antar elektroda semakin rendah sehingga pengukuran arus puncak katodik diperoleh semakin rendah juga.
-2.50E-06 -2.00E-06 -1.50E-06 -1.00E-06 -5.00E-07 0.00E+00 5.00E-07 1.00E-06 1.50E-06 2.00E-06 2.50E-06
-0.6 -0.4 -0.2 0 0.2 0.4 0.6
Potensial, V A r u s , I ( µ A ) 125mg/dl 150mg/dl 175mg/dl
Gambar 22 Voltamogram Siklik sampel kolesterol(125,150.175 )mg/dl hari ke-8. Voltage =+0,5 V. sweep rate 0,1 V/s
Tabel 3. Nilai arus puncak katodik (oksidasi) setelah hari ke-8
konsentrasi
(mg/dl) Arus puncak (µA)
125 1.34E-06
150 1.76E-06
175 1.80E-06
Kurva Sensitifitas C vs I Hari ke-0 dan Hari ke-8
y = 3E-07x - 4E-05
y = 9E-09x + 3E-07 0.00E+00 2.00E-06 4.00E-06 6.00E-06 8.00E-06 1.00E-05 1.20E-05 1.40E-05 1.60E-05 1.80E-05 2.00E-05
0 50 100 150 200
Konsentrasi Sampel Kolesterol [mg/dl]
A r u s ( µ A
) Hari Ke-8
Hari Ke-0
KESIMPULAN
Dari hasil yang diperolah dapat disimpulkan bahwa strip biosensor kolesterol yang dikembangkan dengan metode screen printing dapat mendeteksi beberapa konsentrasi kolesterol dan memerlukan biaya material yang cukup murah. Konduktifitas elektroda kerjanya semakin menurun jika luas permukaan elektroda kerja semakin besar. Nilai impedansi strip biosensor kolesterol bertambah besar dengan menurunnya konduktifitas elektroda kerja. Sensitifitas biosensor kolesterol hari ke-8 menurun 97% dari nilai sensititifitas hari ke-0 sehingga stabilitas penyimpanan strip biosensor sangat tidak stabil dan memuaskan. Akurabilitas strip biosensor kolesterol diperoleh sangat rendah.
SARAN
Desain strip elektroda untuk ke depan sebaiknya dimodifikasi bentuk elektrodanya dengan meminimalkan luas permukaan elektroda kerja agar pergerakan elektron lebih teroptimalisasi. Dalam menjaga stabilitas dan sensitifitas biosensor diperlukan membran dialis untuk menjaga struktur enzim pada permukaaan elektroda kerja.
DAFTAR PUSTAKA
[1]. Mariatul K. Penggunaan Metode Voltametri dalam Biosensor Kolesterol dengan Ferosen sebagai Mediator. Skripsi, Departemen Kimia, Institut Pertanian Bogor, (2005)
[2].
http://www.blogdokter.net /2008/11/11/mengapa-pemeriksaan-kolesterol-itu-penting/
(21 Agustus 2008)
[3]. Wicaksono DHB. Mengenal Biosensor dan Generasi Terbaru Biosensor. Zemi on Air no 31, Tokyo 6-11 Mei 2000
[4]. Trasch HF. Recent Development of Biosensor. Jerman : Universitas Manheim Jerman (2001)
[5]. Ahira Suryana. Prinsip Kerja Biosensor. Universitas Indonesia, Jakarta (2007)
[6]. Willem M. Albers. Immobilisation of Biomolecules onto Organised Molecular Assemblies. Academic Dissertation, Crandfield University, England (1999)
[7]. Clark LC, Lyons C. Electrode Systems for Continuous Monitoring in Cardiovascular Surgery. Ann NY Acad Sci 102 :29.(1962)
[8]. Kubota LT, Freire RS, Pessoa CA, Mello LD. Direct Electron Transfer an Approach for Electrochemical Biosensor with highest Selectivity and Sensitivity. J braz Chem Soc 14(2) : 230-243. (2003)
[9]. Grieshaber D, Robert Mackenzie, Janos V and Erik R. Electrochemical Biosensor-Sensor Principles and Architectures. Sensors, 8, 1400-1458. (2008)
[10]. Ekananda R. Pembuatan dan Karakterisasi Biosensor Kolesterol dan Biosensor Glukosa. Laporan Penelitian, LIPI. (2007)
[11]. Arya Sunil K Datta, Monika and Malhotra, Bansi D. Recent Avances in Cholesterol Biosensor. pp.1083-1100. (2007)
[12].
http://en.wikipedia.org/w/i ndex.php?title=Electrochemical&re
direct=no ( 3 September 2008)
[13]. Wang J. Analitical
Electrochemistry. Las Cruces : VCH Publishers, inc. (1994)
[14].
http://en.wikipedia.org/wi
ki/Linear_sweep_voltammetry
( 4 November 2008 )
[16]. Annonim. Manual Book. Laboratory Experiment N0.7. Department of Inorganic Technology .
[17] Wang Q et al. An Introduction to Electrochemistry for Ungraduates Detection of Vitamin C (ascorbic acid ) by inexpensive electrode sensors. Chem Educ 5 : 2. (2000)
[18].
http://en.wikipedia.org/wi
ki/Cyclic_voltammetry
( 4 November 2008)
[19]. Brett Christoper and Ana M. Electrochemistry : Principles, Methods, and Aplication. Oxford University Press. (1993)
[20]. Cardosi FM, Davis J, Vaughan DW. Elements of Biosensor Construction. Enzyme Microbial Technol 17: 1030-1035. (1995)
[21].
http://en.wikipedia.org/wiki/Organo
metallic_compound
( 8 Januari 2009)
[22]. Saito Taro. Kimia Anorganik. Hal 144 -146. Jakarta : P
![Gambar 1 Komponen utama biosensor [6]](https://thumb-ap.123doks.com/thumbv2/123dok/657470.353553/42.595.330.514.86.276/gambar-komponen-utama-biosensor.webp)
![Gambar 7 Molekul lipoprotein [25]](https://thumb-ap.123doks.com/thumbv2/123dok/657470.353553/46.595.328.519.437.592/gambar-molekul-lipoprotein.webp)
![Gambar 8 Kurva energi aktifasi tanpa katalis Enzim dan terkatalisis Enzim [ 32]](https://thumb-ap.123doks.com/thumbv2/123dok/657470.353553/47.595.329.533.354.580/gambar-kurva-energi-aktifasi-katalis-enzim-terkatalisis-enzim.webp)