3
7n/sa/z
ca
b
AKTIVITAS PROTEIN PENGHAMBAT p-LAKTAMASE
DARl
Streptomyces
sp. IVNFI
-1
TERHADAP
Escherichia coli
ENTEROPATOGEN K1 .I
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESlS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Aktivitas Protein Penghambat
$-laktamase dari
Strepdomycessp.
IVNFI-1 terhadapE s c b ~ ~
coli
Enteropatogen Kl.1 adalah karya saya sendiri dan belum diijukan dalambentuk apa pun kepada perguman tinggi mana pun. Sumber informasi yang
berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka
di bagian akhir disertasi ini.
Elsie
ABSTRAK
ELSIE. Aktivitas Protein Penghambat P-laktamase dari Streptomyces sp. IVNFI- 1 terhadap Escherichia coli Enteropatogen K l .l
.
Dibimbing oleh YULlN LESTARl dan SRI BUDlARTl POERWANTO.EPEC K1.l yang diisolas dari penderita d i r e resisten terhadap ampisilin 100 pglml dengan menghasilkan enzim plaktamase. Enzim ini dapat menghiirolisis uncin P-laktam dan rnenimbulkan resistensi pada bakteri tersebut. Untuk mengatasi masalah tersebut, maka dilakukan kajian pencarian senyawa yang marnpu menghambat plaktamase. Strepiomyces spp. dipilih
karena
kemampuannya dalam menghasilkan senyawa bioaktii. Penapisan dilakukan terhadap 6 Streprmycss spp. isolat lokal (IVNF1-1, PSI-4, PD2-9. LCl7-2, SLW8-I, dan 856-2) dan diperoleh IVNF1-I yang mampu menghambat EPEC K1.l deman diameter
zona
hambatan 4 mm. Tuiuan penelitin iniadalah
untuk mengetahui aktivitas protein penghambat i-lakkmase yang dihasilkan St~ptumvces sp. IVNFI-1 temadar, EPEC K1.l resisten am&ilin. lsolat IVNFI- 1 diketahui rnenghasilkan protein' penghambat 6-laktamase. Protein tersebut dimumikan dengan cara diindapkan d a m amonium sulfat 80%. d i d i i i s , dan tiltrasi gel. Esei aktivitas $-laktamase dan penghambatannya dilakukan dengan metode Sawai et a/. (1978). Aktivitas $-laktamase EPEC K1.1 sebesar 1.950 xABSTRACT
ELSIE. Activity of 0-lactamase Inhibitory Protein from Sftwtomyces sp. IVNFI-1 to ~ntero~atho~enic Escherichia coli -KI
.I.
Under the direction 'of YULlN LESTARI dan SRI BUDlARTl POERWANTO.OHak cipta milik lnstitut Pertanian
Bogor,
tahun 2006
Hak cipta dilindungi
AKTlVlTAS PROTEIN PENGHAMBAT $-LAKTAMASE
DARl
Streptomyces
sp. IVNFI-1 TERHADAP
Escherichia coli
ENTEROPATOGEN K1
.I
ELSIE
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITLIT PERTANIAN BOGOR
BOGOR
Judul Tesis: Aktivitas Protein Penghambat p-laktamase dari Shptomyces
sp.
IVNFI-I terhadapEschenchia
coli Enteropatogen K1 .INama : Elsie
NRP : G351020161
Disetujui
Komisi Pembimbing
Drl lr!~ulin Lestari Ketua
Dr. dr. Sri Budirti P m a n t o Anggota
Diketahui
Ketua Program Studi Biologi
Dr. Ir. Dedy Duryadi S.. DEA
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah S W atas
segala
rahmat dan nikmat-Nya sehingga tesis ini dapat diselesaikan. Penelitian dengan judulAktivitas
Protein Penghambat
8-laktamasedari
Strepfomycessp.
RINF 1-1terhadap Escherichm coli Enteropatogen
Kl.l dilaksanakan dari bulan April 2005 hingga April 2006 dan dibiyai oleh dana Penelin Hibah Bersaing IPerguruan Tinggi Tahun Anggaran 2005-2006.
Ucapan terima kasih dan penghargaan penulis sampaikan kepada Dr. Ir.
Yulin Lestari, seJaku ketua komisi pembimbing, atas segala arahan, rnasukan,
dan bimbingan selama penulis melakukan penelitiin. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Yulin Lestari yang telah mengijinkan penggunaan isolat-isolat Streptomyces untuk diieliti. Ucapan terima kasih juga penulis
sampaikan kepada Dr. dr. Sri Budiaiti Poetwanto, selaku anggoia komisi
pembimbing, atas saran, rnasukan, diskusi, dan motivasi yang diberikan serta ijin
penggunaan isolat Eschefichia coli enteropatogen K1 .I yang digunakan
sebagai
bakteri target dalam penelitiin ini. Penulis juga mengucapkan terima
kasih
kepada Dr. Aris Tri Wahyudi dan Dr. Utut Widyastuti, MS yang telah memberikan
ijin menggunakan E. cdi DH5a dan E.
coli
pspott dalam penelian ini. KepadaDr. Min Rahminiwati, selaku penguji luar komisi, penulis sampaikan rasa terima kasih atas masukan serta saran untuk perbaikan tesis ini.
Penuli juga mengucapkan terima kasih kepada Dr. Ir. Dedy Duryadi Solihin, DEA (selaku
Ketua
Program Studi Bmlogi) dan s e l u ~ h staf pengajarDepartemen biologi yang telah memberikan bekal ilmu selarna penuli
mehksanakan studi. Terima kasih penulis sampaikan juga kepada rekan-rekan di laboratorium Mikrobiologi, Wulan, Bu It, Dii, Rika, Henry, adii-adik Bio 38 dan 39 atas bantuan dan kerja samanya. Rekan-rekan Mikro 2002. Mba Antin, Awil,
Muhammad. Agus, dan Esti, terima kasih atas kebersamaan dalam suka dan
duka
selama
p e r k u l i n di IPB. Nana, Ides, Desy, Emma, dan Untung terima kasih atas diskusi dan dukungan morilnya selama ini. Tak lupa rasa terima kasihpenuli sampaikan kepada Mba Heny, Pak Endang. Pak Eman. Pak Jaka, Pak
Kus, dan Bu Kokoy atas bantuan dan kemudahan yang diberikan selama penulis
melaksanakan penelitian. Terima kasih juga penulis sampaikan kepada Pak Joni
dan Bu Etty atas bantuan dan persahabatan selama penulis menempuh studi di
Kepada kedua orangtua tercinta, Uni. dan adik-adik, penulis menghaturkan
rasa terirna kasih atas kasih sayang, dorongan semangat, dan doa yang tidak pemah putus kepada penulis- Aa, terima kasih atas dukungan morilnya hingga
penulis dapat menyelesaikan tesis ini. Sernoga karya ilmiah ini bermanfaat.
Penuli dilahirkan di Pekanbaru, R i u , pa& tanggal 28 Desember 1972 dari ayah Makmur Agus dan ibu Rosma. Penulis merupakan putri ke-2
dari
limabersaudara.
Pendidikan sarpna ditempuh pada Jurusan Biologi, Fakultas Matematika dan llrnu Pengetahuan Alam, Universitas Indonesia, Depok, dan memperoleh
gelar kesarjanaan tahun 1998. Pada tahun 2002, penulis mendapat kesempatan
melanjutkan studi di Sekolah Pascaswjana lnstiiut Pertanian Bogor pada
Program Studi Biologi, Sub Program Mikrobidogi.
Pa& tahun 1998-2001, penulis pernah bekerja sebagai tenaga pengajar
DAFTAR IS1
Halaman
DAFTAR TABEL ... xii ...
DAFTAR GAMBAR xii
...
DAFTAR LAMPIRAN xii
PENDAHULIJAN ., ... 1
Latar belakang ... 1
Hipotesis 2
Tujuan ... 2
...
TINJAUAN PUSTAKA 3
Escherichia coli Enterepatogen ... 3
...
Antibiotik p-laktam dan p-laktamase 4
... Senyawa Penghambat p-laktamase dari Streptomyces 6
BAHAN DAN METODE
.
.Waktu dan Tempat Penelitian ... ... Bahan
... Metode
Peremajaan lsolat Streptomyces spp . dan Bakteri Target ...
.
Kurva Pertumbuhan EPEC K1 1 ...
. ... Uji Keberadaan p-IaMamase pada EPEC K1 1
Pengumpulan Filtrat Kultur EPEC K1 . 1 sebagai Sumber P-laktamase ...
Pengumpulan Filtrat Kultur Streptomyces spp
.
sebagai SumberProtein Penghambat p-laktamase ...
Esei Antagonis Filtrat Kultur Streptomyces spp ...
Pengukuran Aktivitas p-laktamase
Pengukuran Aktivitas Penghambatan p-laktamase ...
Pengukuran Konsentrasi Protein ... Pengendapan dengan Amonium Sulfat ...
Dialisis ...
Uji Kadar Hambat Minimal ... 13 . .
Bagan Alir Penel~tlan ... 14
...
HASIL DAN PEMBAHASAN 15
Pertumbuhan EPEC K1.l 15
Keberadaan plaktamase pada EPEC K1 . 1 ... 15
Esei Antagonis Filtrat Kultur Streptomyces spp ... 16
.
...Aktivitas P-laktamase EPEC K1 1 18
Aktivitas Protein Penghambat plaktamase dari Streptomyces sp . 18
IVNFI-1 ...
.
.
Kadar Hambat M~n~mal ... 23
SIMPULAN DAN SARAN ... 25
...
DAFTAR TABEL
Halaman
1 Hasil uji antagonis filtrat kultur enam isolat Streptomyces spp. 17
terhadap EPEC K1.l, E. coli p-sport, dan
E.
coli DH5a ...2 Aktivitas protein penghambat p-laktamase Streptomyces sp. 21
IVNFI-1 dengan p-laktarnase EPEC K1.l ...
DAFTAR GAMBAR
Halaman
...
Rumus bangun antibiotik p-laktam 4
Kerja enzim p-laktamase terhadap antibiotik p-laktam ... 5
K u ~ a pertumbuhan EPEC K1.l pada media NB yang inkubasi 15
pada suhu 37 "C selama 7 jam ...
Hasil uji keberadaan
P
laktamase terhadap E. coli DH5a (a), EPEC...
K1.l (b), dan penisilinase (c) 16
Motfologi koloni isolat Streptomyces spp. yang ditumbuhkan pada 16 media Yeast Malt Agar (IVNFI-1, PSI-4, PD2-9, SLW8-1, dan
056-2) dan Oatmeal Agar (LC1 7-2) ...
Konsentrasi protein fraksi-fraksi filtrasi gel ...
22
Hasil uji kadar hambat minimal filtrat kultur IVNFI-1 terhadap 23 pertumbuhan EPEC K1.l dalam media NB+am~isilin selama 7 iam K U N ~ jumlah sel EPEC K1.l yang turnbuh pada media NA tanpa 24 ampisilin setelah diinkubasi selama 24 jam pada suhu 37 OC ...DAFTAR LAMPIRAN
Halaman
1 Komposisi media peremajaan, uji daya hambat, produksi 30 Streptomyces spp. dan bakteri target ... 2 Reagen iodin yang digunakan dalam esei aktivitas p-laktamase dan 31
aktivitas penghambatannya ...
PENDAHULUAN
Diare merupakan salah satu penyaki infeksi yang masih menjadi masalah kesehatan di Indonesia dan beberapa negara berkembang. Penyakit ini masih
sering menimbulkan Kejadian Luar B i s a (KLB) yang diindikasikan dengan
tejadinya peningkatan kejadiin kesakitanlkematian kasus d i r e menjadi dua kali
lipat atau lebih dibandingkan jumlah kesakiinlkematian karena diare yang biasa terjadi pa& kurun waktu sebelumnya (RSPI-SS 2005). Pada tahun 2006
diemukan beberapa
kasus
KLB diare di tndonesia seperti di Papua yangrnenyebabkan 157 orang meninggal (PPK Depkes RI 2006) dan di Tangerang
jumlah penderita mencapai 1256 orang (Harian KOMPAS 30 Juni 2005).
Moyenuddin et a/. (1989) malaporkan bahwa 56% dari 50 penderita KLB
diare pada anak-anak di Amerika Serikat pada tahun f934-1987 disebabkan oleh
E-richia odi enteropatogen (EPEC). Pada tahun 2003 Yatsuyanagi et a/. juga melaporkan bahwa 25% dari 36 penderita diare pada siswa (usia 12-14
tahun) di .Ispang pada tahun 2000 juga dkbakkan
oleh
WEC. Di indonesia, bakteri EPEC didapatkan pada 55% anak-anak penderita diire (Budiarti 1997).EPEC K1.l diketahui rnemiliki aktivitas proteotitik ekstraseluler tertinggi yang
diduga sebagai salah satu faktor virulensi EPEC (8udiarti
ef
a/. 1999).Penanganan terhadap penderita d i r e dilakukan rnelalui rehidrasi dan
pemberian antibiotik. $-laktam merupakan salah satu antibiati yang digunakan
untuk pengobatan diire. Antibiotik ini bekerja dengan cara
menghambat
terbentuknya ikatan silang antar peptida pada tahapakhir
sintesis peptidoglikandari dinding sel bakteri Gram negatif (Nataro 8 Kaper 1998; Todar 20021.
Penggunaan antibiotik 8-laktam secara terus-menerus dapat menimbulkan
masalah resistensi pada bakteri. Resistensi terhedap antibiotik plaktam yang terjadi pada bakteri Gram negatif seringkali disebabkan karena dihasilkannya
enzim P-IaMamase. Enzim ini akan menghidrolisis cincin P-laktam sehingga dihasilkan produk inaktif dari antibiotik tersebut (Ogawara et at. 1981).
Permasalahan resistensi pada bakteri yang disebabkan oleh aktivitas enzim
$-laktamase dapat diatasi dengan melakukan modifikasi struktur terhadap
senyawa kimia antibbtik &laMam, sehingga dapai meningkatkan efek terapi
dilakukan adalah mencari senyawa baru yang mampu menghambat kerja enzim
p-laktamase. Streptomyces spp. merupakan bakteri Gram positif berfilamen
yang menghasilkan berbagai macam senyawa metaboli sekunder, enzim
pendegradasi, dan inhibitor enzim. Reading & Cole (1977) berhasil mengisolasi asam klavulanat dari S. clavuligenrs yang mampu menghambat aktivitas enzim
p-laktamase. Selain asam klavulanat, S. clavuligenrs juga menghasilkan BLIP
(beta-lactamase-inhibitory
protein), protein ekstraseluler yang mampumenghambat p-laktamase tipe TEM (Temoniera) (Doran et a/. 1990). Dua
protein penghambat plaktamase ekstraseluler (BLIP-I dan BLIP-11) juga berhasil
dikarakterisasi oleh Kim & Lee (1 994) dari S. exfoliatus SMFI 9.
Streptomyces spp. yang diisolasi dari berbagai daerah di Indonesia
diketahui berpotensi menghasilkan berbagai macam senyawa bioaktif. Selain mampu menghasilkan senyawa bioaktif pengendali bakteri patogen tanaman
(Ifdal 2003; Andri 2004; Winarni 2004), Streptomyces spp. isolat indigenus
dilaporkan juga mampu menghasilkan senyawa antibakteri (Frewari 1999; Widuretno 2000). Lebih jauh, hasil penapisan terhadap 39 Streptomyces spp. isolat indigenus menunjukkan bahwa 3 isolat Streptwnyces spp. (IVNFI-1, PS4-
16, dan SLW 8-1) mampu menghasilkan protein penghambat p-lakiamase
(Desriani 2004). Wahyuni (2006) juga berhasil mengisolasi asam klavulanat dari filtrat kultur Streptomyces sp. IVNFI-1 yang mampu menghambat pertumbuhan
EPEC K1.l resisten ampisilin.
Hipotesis
Hipotesis penelitiin ini adabh:
1. EPEC K1 .I resisten ampisilin menghasilkan p-laktamase.
2. Stmptmyces sp. IVNF1-1 menghasilkan protein penghambat plaktamase.
Tujuan
Peneliian ini bertujuan untuk mengetahui aktivitas protein penghambat $-
laktamase yang dihasilkan Streptomyces sp. IVNFI-1 terhadap EPEC K1.l
TlNJAUAN PUSTAKA
Escherichia coli Enteropatogen
E. coli merupakan bakteri Gram negatii berbentuk batang yang bersifat anaerobik fakultatif. Menurut Holt et
a/.
(1994), E. coli memiliki kemampuanuntuk memfermentasi laktosa, memberikan reaksi indol positif. metil positif, uji Voges-Proskauer negatif, dan tidak dapat menggunakan sitrat sebagai satu-
satunya sumber karbon.
E.
coli merupakan flora normal pada saluran pencernaan hewan berdarah panas dan manusia, namun beberapa di antaranyabersifat patogen.
lnfeksi yang disebabkan oleh E. cdi yang bersifat patogen dapat terjadi
pada permukaan mukosa atau menyebar luas ke seluruh tubuh. Keberadaan galur-galur E. coli tersebut dapat menyebabkan tiga macam infeksi, yaitu infeksi
saluran kemih, meningitis, dan infeksi saluran pencernaan (diare). Berdasarkan
patogenisitasnya, E. coli penyebab diare terdiri atas lima kelompok, yalu enterupthogenic E.
coli
(EPEC), enterohemonhagic E. coli (EHEC), enteruaggegative E. coli (EAEC), enterntoxigenicE.
coli (ETEC), danenteroinvasive E. coli (EIEC). EPEC merupakan penyebab utama diare pada
anak-anak di negara yang sedang berkembang (Nataro 8, Kaper 1998).
Diare merupakan salah satu penyakit infeksi dengan tanda-tanda adanya perubahan bentuk dan konsistensi tinja (melembek sampai mencair)
serta
bertambahnya frekuensi buang air besar dari biasanya (3 kali atau lebih dalamsehari). Penyakii diare masih sering menimbulkan KLB dengan jumlah penderita yang banyak dabm waktu yang singkat (RSPI-SS 2005). Berdasarkan hasil pemeriksaan laboratorium, diketahui bahwa penyebab KLB diire yang terjadi di Tangerang (jumlah penderita mencapai 1256 orang) adalah bakteri patogen yang mencernari sumber air dan mengontaminasi makanan penduduk (Harian KOMPAS 2005). Budiarti (1997. diacu dalam Budiarti et a/. 1999) melaporkan bahwa galur-galur EPEC yang diisolasi dari anak-anak penderita diare (55%) di Indonesia bersifat resisten terhadap antibiotik berspektrum luas seperii
Antibiotik
p-laktam dan $-hktamaseAntibiotik merupakan produk metabolit sekunder yang dihasilkan oleh kelompok mikroorganisrne tertentu, memilii berat molekul rendah, clan pada
konsentrasi yang sangat rendah dapat membunuh atau menghambat pertumbuhan mikroorganisme lain. Mikroorganisme penghasil antibiotik di
antaranya adalah Streptomyw, Baci/lus, dan cendawan belfbmen. Antibiotik bekeja secara tepat pada bagian tertentu dari sel, misalnya pada dinding sel,
membran sitoplasma atau piranti sintesis protein, atau bahkan enzim-erujm yang terlibat dalam sintesis asam nukleat. Efek toksik yang dimbulkan oleh antibiotik
terhadap bakteri berbeda dengan efek yang timbul pada manusia maupun
hewan, hal inilah yang menjadi alasan digunakannya antibiotik untuk pengobatan
penyakit (Singleton 1999; Todar 2002).
Berdasarkan struktur kimianya, $-laktarn merupakan antibiotik kelompok
asam amino-peptida (Madigan et a/. 2000), memiliki struktur cincin yang
mengandung nitrogen, disebut cincin 8-laktam (Gambar 1). Penisilin dan
sefalosporin adalah contoh antibiotik $-laldam yang dihasilkan oleh Penici/Iium
dan Cephalosporium, sedangkan karbapenem, klavam, dan monobaktarn adalah
[image:18.556.31.469.40.766.2]antibiotik $-laktam yang dihasilkan oleh bakteri (Singleton 1999).
Gambar 1 Rumus bangun antibiotik $-laktam (Rollins & Joseph 2000)
Antibiotik 8-hktam merupakan salah satu antibiotik yang paling sering digunakan sebagai agen antimikrob. Hal ini disebabkan karena antibiotik ini memiliki selektivitas yang tinggi dan toksisitas yang rendah terhadap sel inang
(Cole & Nicolas 1986). Enzim ini akan berikatan dan menghambat enzim karboksipeptidase dan transpeptidase yang diperlukan dalam tahap akhir sintesis
p-laktam merupakan antibiotik yang palrng banyak d~unakan dalam dunia
medis. Penggunaan antibiotik $-laktam menimbulkan masakh resistensi yang
cukup tinggi pada antibotik p-laktam sehingga pencarian anggota baru antibiotik
p-laktam terus dikembangkan. Resistensi terhadap antibiotik p-laktarn sering
terjadi disebabkan oleh keberadaan enzim p-laktamase, namun mutasi pada penicillin-binding proteins (PBPs, suatu enzim yang terlibat dalam sintesis
peptidoglikan) menyebabkan berkurangnya afinitas PBPs terhadap antibiik
P-
laktam juga dapat terjadi (Fluit et
al.
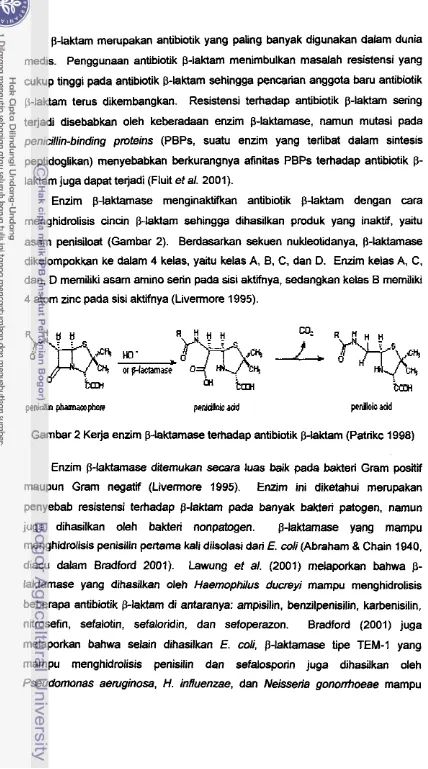
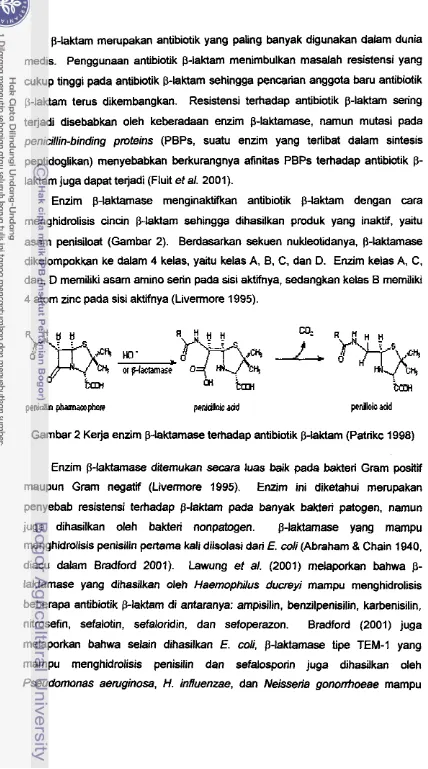
2001).Enzim p-laktamase menginaktifkan antibiotik p-laktam dengan cara
menghidrolisis
cincin
p-laktam sehingga dihasilkan produk yang inaktii, yaituasam penisiloat (Gambar 2). Berdasarkan sekuen nukleotidanya, p-laktamase
dikelompokkan ke dalam 4 kelas, yaitu kelas A,
B.
C, dan D. Enzim kelas A, C, dan, D memiliki asam amino serin pada sisi aktifnya, sedangkan kelas B memiliki4 atom zinc pada sisi aktifnya (Livermore 1995).
[image:19.556.48.476.29.798.2]peridh phaaMmphofe pe-arld pdloic add
Gambar 2 Kerja enzim p-laktamase terhadap antibiotik p-iaktam (Patrikc 1998)
Enzim p-laktamase ditemukan
secara luas
baik pada W e n Gram positifmaupun
Gram
negatii (Livermore 1995). Enzim ini diketahui merupakanpenyebab resistensi terhadap p-laktarn pada banyak M e n patogen, namun
juga dihasilkan oleh bakteti nonpatogen. p-laktamase yang mampu menghidrolisis penisilin pertarna kali diisolasi dari E. cdi (Abraham & Chain 1940,
diacu dalam Bradford 2001). Lawung et a/. (2001) melaporkan bahwa
p-
laktamase yang dihasilkan oleh HaemophJus dumM mampu menghidrolisis
beberapa antibiotik plaktam di antaranya: ampisilin, benzilpenisilin, karbenisilin.
nitrosefin, sefalotin, sefaloridin, dan sefoperazon. Bradford (2001) juga
melaporkan bahwa selain dihasilkan E. cdi, p-laktamase
hpe
TEM-1 yangmampu menghidrofisis penisilin dan sefalosporin juga dihasilkan oleh
menghirolisis penisilin dan sefalosporin. 6-laktamase juga dihasilkan oleh Streptomyces secara konstitutif. Ogawara ef
d.
(1978) melaporkan bahwa darihasil kajian yang dilakukannya diperoleh beberapa galur Shptomyces spp. yang
memiliki aktivitas p-laktarnase di antaranya: S.
albus,
S. ~statochmogenes, S.fradiae, dan S. lavsnclulae. Deak et a/. (1998) juga melaporkan bahwa S. griseos
menghasilkan 6-lakiamase ektraseluler yang terikat membran. Gen yang
menyandi resistensi terhadap plaktam dapat dimukan pada plasmid,
kromosom bakteri, dan transposon (Heritage etal. 1999; Flul etal. 2001). Pada
baMeri
Gram positi, sebagian besar 0-laktamase disekresikan ke lingkungannya (ekstraseluler) dan beberapa melekat pada membran sitoplasrna. Sebaliknya,pada bakteri Gram negahf sebagian besar enzim disekresikan ke ruang
periplasma, namun beberapa juga bersifat ekstraseluler (Livenore 1995).
Senyawa Penghambat
$-hktamase
dari SlrepiomycesStreptomyces merupakan bakteri tanah Gram positif termasuk ke
dalam
kelompok aktinomisetes. Hia vegetatif bakteri ini berdiimeter 0.5-2.0 pm,
spora
nonmotii, dan menghasilkan
berbagai
macam pigmen yang terlihatpada
miselium vegetatii dan aerialnya. Dinding selnya tenusun oleh sejumhhbesar
asam L-diaminopimelat. Streptomyces adalah bakteri aerob, kemoorganotrof.memberikan reaksi katalase positii, dan umumnya mampu mereduksi nitrat
menjadi nitrit (Hol ef
a/.
1994).Streptomyces dan
beberapa
genus kelompok aktinomket lainnya dikenalsebagai bakteri penghasil antibiotik, karena dari 10000 antibiotik yang telah ditemukan,
2/3
nya dihdkan oleh bakteri ini (Miyadoh BOtoguro
2004). Streptomyces memiliki siklus hidup yang kompleks dan mampu menghasilkanberbagai senyawa metaboli sekunder, enzim, dan i n h i o r enzim. Sebagai
contoh, S. clavukgems mampu menghasilkan senyawa plaktam
seperti
antibiotik, antiiungal, dan senyawa penghambat p-laktam (Thai et
a/.
2001).Disamping menghasilkan antibiotik penisilin N dan sepamisin C, S. clavuligenis juga menghasilkan asam klavulanat (Reading 8 Cole 1977) dan BLIP (Doran at
al. 1990; Kim & Lee 1994) yang terbukti memiliki aktivitas penghambatan
Masalah resistensi terhadap a n t i b i k $-laktam sernakin cepat berkembang
seiring dengan dihasilkannya enzim $-laktamase yang semakin I U ~ S spektrum aktivitasnya. Untuk mengatasi masalah resistensi tersebut, dilakukan upaya
pencarian metaboli-metaboli dari mikroba yang mampu menghambat aktivitas
$-laktamase, seperti asam klavulanat (Reading 8 Cole 1977), asam olivanat
(Park & Lee 1998 ), dan tinamisin (Kahan et al. 1979, diacu dalam Park 8
Lee
1998) yang telah digunakan secara klinis. Wahyuni (2006) melaporkan bahwa
asam klavulanat yang diisolasi dari filtrat kultur Streptomyces sp. IVNFI-1
menunjukkan aktivitas penghambatan terhadap p-laktamase dari EPEC K1.l
yang resisten ampisilin.
Selain metaboli-metabolit tersebut di atas, beberapa peneliii juga berhasil
menemukan protein yang mampu menghambat aktivitas $-laktamase. Protein
yang memiliki aktivitas pengharnbatan terhadap B-laktamase Staphylococcus
aueus berhasil diisolasi dari filtrat kultur Strepfomyces gedaensis (Park & Lee
1998). Protein lain (BLIP) yang juga mampu menghambat berbagai plaktamase
berhasil dikarakterisasi dari filtral kultur S. clavuligems dengan berat molekul
berkisar 17.5 kDa (Doran et a/. 1990). Dua protein penghambat $-bktarnase
lainnya (BLIP-I dan BLIP-11) yang dihasilkan oleh S. exfoiatus SMF19 juga
berhasil dikarakterisasi oleh Kim 8 Lee (1994). BLIP-II dari S. exrolatus berukuran lebih besar daripada BLlP S. clavuligems, yaitu 33
kDa.
Gen yangmenyandi BLIP-II (blB) telah diklon dan disekuen, namun dari perkiraan sekuen
asam aminonya BLIP-I1 tidak memperlihatkan kemiripan dengan BLIP dari S.
davuligems (Park & Lee 1998). Sebaliknya, gen yang menyandi BLIP-I (M)
juga berhasil diklon dan disekuen, hasilnya menunjukkan bahwa BLIP-I memiliki kemiripan ukuran (17.5 kDa) dan sekuen dengan BLlP dari S. davulige~s (Kang eta/. 2000).
Frewari (1999) melaporkan bahwa peptida antimikrob yang diiiolasi dari
Streptomyces sp. isolat indigenus (IR-1 dan IR-5) mampu menghambat pertumbuhan bakteri target E. coli ATCC 25922 dan S. aureus ATCC 25923
Desriani (2004) juga melaporkan bahwa dari hasil penapisan terhadap 39 Strepomyces spp.
isolal
indienus diperoleh 3 isdat Streptomyces spp. (IVNF1-1, PS4-16, dan SLW 8-1) yang menghasilkan protein ekstraseluler dan memiliki
BAHANDANMETODE
Waktu dan Ternpat P e n e l i n
Peneltiin ini dilaksanakan di Laboratorium Mikrobiiogi (Departemen
Biologi) dan Laboratorium Kimia Analiiik (Departemen Kimia), FMIPA, lnstitut Pertanian Bogor pada bulan April 2005-ApriI2006.
Bahan
Bahan yang digunakan dalam peneltiin ini adabh 6 isoiat Sfmpfomyces spp. yaitu IVNFI-1, PSI-4, PD2-9, LC17-2, SLW&l, dan 656-2 (Garnbar 6) yang merupakan koleksi Laboratorium Mikrobiologi, Departemen Biologi, FMlPA IPB.
Bakteri target yang digunakan sebagai penghasil p-laktamase adalah EPEC K1.l
koleksi Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Peneliian
Sumberdaya Hayati dan Bioteknobgi (PPSHB), lnstitut Pertanian Bogor.
Sedangkan E. coli DH5a (koleksi Laboratorium Mikrobiologi, Departemen
Bilogi, FMlPA IPB) dan
E.
coli p-sport (koleksi Laboratorium BiotechnologyResearch
Indonesia-Nethedand. PPSHB IPB) masing-masing digunakan sebagaikontrol negatif (sensitif ampisilin) dan kontrol positif (resisten ampisilin).
Peremajaan lsolat
Strepfomyces
spp. dan Bakteri TargetEnam isolat Streptomyces spp. diremajakan pada media Yeast Malt Agar dan Yeast Malt B d h (Lampiran I), diinkubasi selama 7-10 hari pada suhu ruang.
Bakteri target EPEC K1.l dan E, wli p-sport ditumbuhkan pada media Nutrient
Agar (Oxoid) dan Nutrient Broth (Oxoid) yang mengandung 100~g/ml ampisilin
(Boehringer) sedangkan
E
cob
DH5a ditumbuhkan pada medii N A dan NBtanpa ampisilin, kemudiin diinkubasi selama 24 jam pada suhu 37 OC.
Kurva Perturnbuhan EPEC K1 .I
Satu koloni EPEC K1.l yang diiumbuhkan
pada
medii NA+ampisilin 100W/ml diinokulasikan ke dalam media NB+ampisilin 100 wglml. Kemudian
diinkubasi pada suhu 37 OC selama 3 jam dengan pengocokan berkecepatan 120
100 pg/ml, diinkubasi dengan kondisi yang sama seperti kultur awal. K U N ~
tumbuh EPEC K1.l ditentukan dengan menghubungkan antara absorbansi kultur EPEC K1 . I dengan waktu.
Uji Keberadaan $-laktamase pada EPEC K1.l
Uji keberadaan $-laktamase dilakukan untuk mengetahui mekanisme
resistensi EPEC K1.l terhadap antibiotik p-laktam. Uji ini dilakukan dengan
metode iodometric spot test (Lee 8 Komarmy 1981). Pada uji ini, tiga potongan kerlas saring disiapkan, E.
coli
DH5a digunakan sebagai kontrol negatif,sedangkan penisilinase (Sigma) digunakan sebagai kontrol positif. Sebanyak
0.02 mg benzilpenisilin (Sigma) diletakkan di tengah potongan kertas saring dan ditambahkan 1 tetes akuades. Pada masing-masing kertas saring dimbahkan
1 tetes penisilinase, 1 koloni E.
coli
DH5a. dan 1 koloni EPEC K1.1, kemudiandiinkubasi pada suhu ruang selama 10 menit. Setelah itu dimbahkan 5 tetes reagen iodin (Lampiran 2) dan diinkubasi pada suhu ruang selama 5 menit. Pengarnatan dilakukan setelah dilakukan penambahan 1 tetes soluble starch
(Merck) pada masing-masing kertas saring.
Pengumpulan Filtrat K u b r EPEC K1.1 sebagai Sumber $-laktamase
EPEC K1.l dlumbuhkan dalam medii NB+arnpisilin 100 pg/ml pada suhu
37 "C selama 5 jam dengan pengocokan berkecepatan 120 rpm. Kitrat kultur disentrifugasi (Jouan CR3i) dengan kecepatan 20000 x g pada suhu 4
"C
selama 10 menit. Filtrat kultur yang diieroleh dikeringbekukan untuk kemudian
digunakan dalam esei aktivitas p-laktamase.
Pengumpulan Filtrat K u h r 3mpfomyces
spp.
sebagai Sumber ProteinPenghambat 0-laktamase
Enam lsolat Stn,ptomyces spp. ditumbuhkan
pada
media fermentasi Kim 8 Lee (1994) selama 14 hari pada suhu ruang dengan pengocokan berkecepatan 100 rpm. Pada hari ke-14 dilakukan pernanenan tiftrat kunur, disentrifugasidengan kecepatan 20000 x g pada suhu 4 OC selama 10 menit. Selanjutnya
filtrat kultur digunakan untuk esei antagonis (metode agar diiusi) terhadap bakteri
Esei Antagonis Fiitrat
K u h r
Stmptomyces sppFiltrat kultur 6 isolat Streptomyces spp. diukur daya hambatnya terhadap
pertumbuhan bakteri target dengan menggunakan metode Kirby-Bauer (Madigan
et
al.
2000). Media NA semisolid (0.75%) yang berisi 100 biakan bakteri targetdengan konsentrasi minimal
lo6
sellml diiuang diatas medii
NA yang tebhmemadat. Selanjutnya 15 pl filtrat kultur Streptomyces spp. diteteskan di atas
kertas cakram. Pengamatan dibkukan setelah inkubasi selama 24 jam pada
suhu 37
"C
dengan mengukur zona bening yang terbentuk. Dari hasil ujiantagonis 6 is& Strepomyces spp. ini dipih satu isolat Strepfornyces
sp.
yangmemiliki penghambatan paling besar dan digunakan untuk uji selanjutnya.
Pengukuran Aktivitas $-laktamase
Esei terhadap 5-bktamase dari
EPEC
K l . 1 diikukan dengan metode Sawai et a/. (1 978) dan menggunakan kmilpenisilin 0.1 mg/mJ sebagai substrat.Sebanyak 2.5 ml g-laktamase dalam buffer fosfat 0.1 M pH 7 diinkubasi pada
pada suhu 30 O C selama 5 menit. Kemudiin d i i b a h k a n 0.5 ml benzilpenisiii
dan diinkubasi pada 30 O C selama 20 menit. Reaksi enzimatis dihentikan
dengan menambahkan 5 ml reagen iodin, kemudiin diinkubasi pada suhu ruang &ma 20 menit. Selanjutnya dibkukan pengukuran absorbansi pada
panjang
gelombang 540 nm. Pengukuran juga dilakukan terhadap 2 blanko, yaitu blanko A yang berisi 3 ml buffer fosfat dan 5 ml reagen iodii sedangkan blanko B terdiri
atas 0.5 ml substrat,
dan
5 ml reagen iodin. Kemudian 2.5 ml p-laktamaseditambahkan pada blanko B setelah penambahan reagen iodin.
Aktivitas 6-bktamase dihitung dengan menggunakan rumus berikut:
Aktivitas p-laktamase (Ulml) = Blanko B
-
Sampel x x1
x1
Blanko A F T V
Dari persamaan tersebut:
F
=
iodin yang dikonsumsi per mol substrat yang dihidrolisis T = waktu (menit) untuk reaksi enzirnatiiV
=
volume (ml) enzim yang diiambahkanSatu unl aktivitas p-laktamase didefinisikan sebagai sejumlah enzim yang
mengatalisis hidrolisis 1 pmol benzilpenisilin per menit pada 30
"C
pada pH 7Pengukuran Aktivitas Penghambatan
B-laktamase
Essi aktivitas penghambatan fikrat kukur Stfeptomyces sp. terhadap
6-
laktamase EPEC K1.l dilakukan menggunakan metode Sawai eta/. (1978).
p-
laktamase diinkubasi benama-sama dengan fikrat kultur Streptomycessp.
Aktivitas penghambatan terhadap plaktamase diukur dengan menggunakan
rumus berikut:
Persentase penghambatan
=
x 100% ADari persamaan tersebut:
A
=
Aktivitas p-laktamase tanpa penghambatanB
=
Aktivitas p-lakiamase dengan penghambatanSatu unit aktivitas penghambatan didefinisikan sebagai sejurnlah inhibitor
P-
laktamase yang dibutuhkan untuk menghambat 50% 0.96 unit aktivitas
P-
laktamase (Kim &
Lee
1994).Pengukuran Konsenhsi Protein
Esei konsentrasi protein finrat kunur diukur Streptomyces sp. diikukan
menggunakan metode Bradford (1976). Sebanyak 1 ml filtrat kunur direaksikan dengan 5 ml pereaksi Coomassie Brilant Blue 6250, dikocok dan d i d i i k a n
selama 20 menit. Sebagai blanko digunakan 1 ml akwdes yang direaksikan
dengan pereaksi yang sama, sedangkan sebagai standar protein digunakan Bovine Serum Albumin (BSA) dengan seri konsentrasi 0.01-0.1 mg/ml dari stok
BSA 0.1 mg/ml. Pengukuran konsentrasi protein juga diikukan untuk protein hasil pengendapan amonium &at, dialisis, dan fraksi-fraksi kromatografi filtrasi
gel.
Pengendapan dengan Amonium Sulfat
Sebanyak 100 ml filtrat kultur hasil produksi diendapkan dengan menambahkan amonium sulfat hingga tingkat kejenuhan 80% pada suhu 4 OC.
Amonium sulfat (4.25 M) ditambahkan sedikii demi sedikit sambil d i i u k dengan
pengaduk magnet. Setelah semua amonium sulfat ditambahkan, kemudian
diinkubasi sehma 20 jam pada suhu 4
"C.
Fikrat kultur yang telah diendapkandisentrifugasi dengan kecepatan 20000 x g selarna 10 menit pada suhu 4 "C.
mengendapkan 100 ml filtrat kukur dibutuhkan 56.1 g amoniurn sulfat (Bollag &
Edelstein 1 991 ).
Sebelum digunakan membran (SIGMA, kantung dapat menahan protein
dengan berat molekul 12
kD
atau lebih) dicuci dengan air mengalir selama 3-4 jam, kemudiin direndam dalam 0.3% (w/v) larutan sodium sulfida (0.0385 M).Setelah itu membran diilas dengan air bersuhu 60
OC
selama
2 menit untuk sebnjutnya diasidikasi dengan 0.2% (vlv) asarn solfur. Untuk menghingkansisa asam, membran dibilas dengan air panas selama 5 menit.
Membran berisi 3 ml protein hasil pengendapan amonium sulfat dimasukkan ke dalam wadah yang berisi buffer fosfat 5 mM pH 7 (wlume total
100x volume sampel di dalarn membran) sambil diaduk pelan dengan pengaduk
magnet. Buffer fosfat (0.1 M pH 7) di luar membran diganti setelah 2 jam waktu inkubasi dengan buffer yang baru dengan volume yang sama dan diinkubasi
pada suhu 4
"C
&ma
20 jam.Kmmatografi
FiltrasiGel
Sebanyak 1.3 g Sephadex G 75 dikernbangkan (swelling) dalam 20 ml
buffer fosfat 0.1 M pH 7. diinkubasi selama 30 menit. Kemudiin divakum selama
30 menit untuk menghilangkan gelembung udara sehingga tidak mengganggu
saat pengemasan kolom. Kolom dengan tinggi 30 cm dan diameter I cm diisi
dengan gel secara perkhan hingga diperoleh tinggi kernasan gel yang diinginkan. Kolom yang telah dikernas, diilusi dengan buffer fosfat 0.1 M pH 7
hingga diieroleh laju alir yang konstan.
Sebanyak 800 @I (4% dari volume
kolom)
proteinhasil
dialisis drapliiasikanke dalam kolom dan dielusi dengan buffer fosfat 0.1 M pH 7, pada suhu 4 OC.
Laju alir larutan pengelusi 0.167 mUmenit. Fraksi hasil elusi d i i p u n g setimp 5 ml dan diukur serapannya dengan spektrofotometer ultraviolet pada panjang
gelombang 280 nm. Fraksi-fraksi yang diperoleh dikelompokkan berdasarkan
Uji
Kadar
Hambat MinimalSebanyak 7 tabung reaksi berisi 5 ml media NB+ampisilin 100 pglml disiapkan. Tabung
pertama
clan ketujuhberisi
media NB tanpa filtrat kunurIVNFI-1. Tabung ke-2 ditambahkan filtrat kultur IVNFI-1 sebanyak 78.125
(kadar protein = 2.316 x
lo4
mg), tabung ke-3 diiambahkan filtrat kultur IVNFI-1sebanyak 156.25 pi (kadar protein = 4.631 x
lo4
mg). tabung ke-4 ditambahkanfiltrat kultur IVNFI-1 sebanyak 312.5 pl (kadar protein
=
9.263 xlo4
mg), tabungke-5 ditambahkan filtrat kultur IVNFI-1 sebanyak 625
4
(kadar protein=
1.853 xmgf, dan tabung ke-6 dtambahkan filtrat kultur IVNFI-lsebanyak 1250 pl
(kadar protein = 3.705 x 10" mg).
Sebanyak 0.1% inokulum EPEC Kl.1 daJam media NB, konsentrasi
lo6
seVml, diinokulasikan ke dalam tabung ke-I, ke-2, ke-3, ke-4, ke-5, dan ke-6,
sedangkan tabung ke-7 t i i k diiiokulasikan EPEC K1 .I. Perlakuan ini ct&kukan dengan 2 ulangan. lnkubasi dilakukan pa& suhu 37
"C
dengan pengomkanberkecepatan
120 rpmselama
7jam.
Setiap
1 jam waktu inkubasi, sebanyak100
111
dari isi tabung-tabung tenebut disebar ke media NA yang tidakmengandung ampisilin (pencawanan dilakukan dengan 2 ulangan). Setelah diinkubasi pada suhu 37 O C selama 24 jam, sel yang tumbuh diamati dan
BAGAN ALIR PENELITIAN
Streptomyces spp.
(
Streptomyces spp.I
Pernbuatan kurva tumbuh EPEC K1 . I
I
Uji keberadaan
p-
laktamase EPEC K1 .I
Fikrat kultur isolat
/--'--,
Pengumpulan filtrat kultur EPEC K1 .I
(3-laktamase
Esei antagonis dengan EPEC K1 .I, E. colip-sport,
dan E. cdi DH5a
Pengukuran aktlvitas (3-laktarnase dan penghambatan terhadap plaktamase
4 7 1
amonium sulfat-1
Dialisis
w
IHASlL
DAN
PEMBAHASAN
Pertumbuhan EPEC K1.l
EPEC K1.1 yang digunakan pada penelifian ini diisolasi dari penderita
diare. Pertumbuhan EPEC K1.l yang resisten ampisilin berlangsung sangat
cepat. Fase eksponensial dimulai pada jam ke-3 dan akhir fase eksponensial tercapai pada jam Ice-5 (Gambar 3) sedangkan pada galur E. coli lainnya tercapai
pada
jam ke-16 (Ferguson et a/. 1998). Kemampuan tumbuh EPEC K1.l yanglebih cepat dibandingkan galur
E. cok'
Jainnya menyebabkan EPEC K1.lsangat
berbahaya bagi kesehatan.Waktu (jam)
Garnbar 3 Kurva pertumbuhan EPEC K1.1 pada media NB yang diinkubasi pada suhu 37 'C selama 7 jam
Keberadaan $-laktamase
pada EPEC K1.1Hasil uji menunjukkan bahwa EPEC K l .I menghasilkan P-laktamase yang mengindikasikan mekanisme resistensinya terhadap antibiotik 0-laktam. Hal ini terlihat dari zona putih yang terbentuk di tengah kertas uji EPEC K1.l dan kontrol
positif (penisilinase), sedangkan pada kertas uji untuk kontrol negatif ( E coli
DH5a) tidak terbentuk zona putih di tengah kertas (Gambar 4). Menurut
Lee
&Komarrny (1981), molekul antibiotik yang akfif (penisilin) tidak akan berikatan
dengan iodin sedangkan produk inaktif antibiotik tersebut (asarn penisiloat) akan
mengikat Win. Pada reaksi positif tidak akan terbentuk warna coklat-keungwn,
hal ini disebabkan karena
asam
penisiloat yang berikatan dengan iodin tiiakterhadap antibiotik 0-laktam pada Gram negatif, sebagian besar disebabkan
karena keberadaan enzim p-laktamase. Enzim ini menginaktifkan antibiotik
laktam dengan cara menghidrolisis cincin p-laktam sehingga dihasilkan produk
[image:30.556.64.458.1.783.2]yang inaktif, yaltu asam penisiloat.
Gambar 4 Hasil uji keberadaan
p
laktamase terhadap E. coli DH5a (a). EPEC K1.l (b), dan penisilinase (c)Esei Antagonis Filtrat Kultur Streptomyces spp.
Filtrat kultur Streptomyces spp. yang telah dikumpulkan digunakan untuk uji
antagonis terhadap EPEC K1 .I,
E.
coli p-sport, dan E. coli DH5a. Untuk EPEC K1.l dan E. coli p-sport, uji antagonis dilakukan pada media NA yangmengandung 100 kglml ampisilin. Hal ini dilakukan untuk mempertahankan sifat
resistensi terhadap ampisilin yang dimiliki oleh EPEC K1.l dan E. coli psport,
sedangkan untuk E. coli DH5a uji antagonis dilakukan pada media NA tanpa
ampisilin.
Gambar 5 Morfologi koloni isolat Streptomyces spp. yang ditumbuhkan pada media Yeast Malt Agar (lVNF1-I, PSI-4, PD2-9, SLW8-1, dan B56-2) dan
Tabel 1 Hasil Uji antagonis filtrat kultur enam isolat Sfreptomyces spp. terhadap EPEC K1.l, E. coli psport, dan E. coli DH5a
No Kodelsdat D i m zona bening (mm)
EPEC K1 .I E.
mli
p-~pod E. coli DH5a1. IV NF1-1 4 6.75 13.75
2. PS1-4
-
4.5 83. PD2-9
-
2 6.254. LCl7-2
-
-
-
5. SLW8-1
-
-
-
6. 856-2
-
-
-
Dan hasil uji antagonis ke-6 filtrat kultur Strephvnyces
sp.
terhadap EPECK1 .l, tedihat bahwa hanya IVNF1-1 yang mampu menghambat pertumbuhan EPEC K1.1 dengan zona hambatan sebesar 4
mm
(Tabel 1). Hal inimengindikasikan bahwa IVNFI-1 menghdkan swfu senyawa yang mampu
menghambat pertumbuhan EPEC K1-1 yang menghasilkan plaktamase sebagai mekanisme resistensinya terhadap ampisilin. Desliani (2004) melaporkan bahwa protein ekstraseluler yang terkandung dalam filtrat kultur IVNF1-1 mampu
rnenghambat pertumbuhan E, coli resisten ampisilin. Wahyuni (2006) juga
mehporkan bahwa asam klavulanat yang terkandung di dalam filtrat kultur IVNFI-1 mampu memberikan zona penghambatan terhadap EPEC K1.1 sebesar
6 mm setelah dipanaskan pada suhu 98 'C.
Hasil uji antagonis filtrat kultur Streptomyces spp. terhadap E. coli gsport
(Tabel 1) menunjukkan bahwa IVNFI-1, PS1-4, dan PD 2-9 mampu rnenghambat pertumbuhan
E.
coh
p-sport
yang juga resisten terhadap ampisilin. Namun demikian mekanisrne resistensi pa& E. coli psport terhadap ampisilinbelum diketahui, Zona hambatan yang diberikan masing-masing sebesar 6.75,
4.5, dan 2 mm. Menurut Fluit et a/. (2001). resistensi terhadap antibiotik $-laktam
disarnping disebabkan oleh aMivitaa enzirn plaktamase, juga dapat disebabkan
deh
mutasi pada PBPs yang menyebabkan berkurangnya atinitas PBPs terhadap antibiotik P-laktam.Streptomyces sp. IVNFI-1, PS1-4, dan PD2-9 juga mampu mengharnbat
pertumbuhan E. coli DH5a yang sensitif ampisilin dengan zona hambatan lebih
besar daripada zona hambatan yang terbentuk pada 2 bakteri target hinnya,
masing-rnasing sebesar 13.75. 8, dan 6.25 mm. Luasnya zona hambatan yang
terbentuk diiuga disebabkan karena aktivitas ampisilin yang mampu
Disamping itu, keberadaan filtrat kultur Streptmyces spp. (IVNFI-1, PS1-4, dan PD2-9) diduga juga memberikan kontribusi terhadap luasnya
zona
hambatan
yang terbentuk, yaitu dengan kandungan senyawa antibakteti. Disampingmenghasilkan asam klavulanat (Reading & Cole 1977) dan beberapa protein
yang mampu menghambat aktivitas p-laktamase (Doran et a/. 1990; Kim & Lee
1994).
Streptomyces
spp. juga menghasilkan berbagai senyawa 6-laktam yangmemiliki aktivitas antibakteri dan anfifungal (Pruess & Kellett 1983, d i m &lam
Thai et a/. 2001). Hasl in; mengindjkasikan bahwa senyawa ekstraseluler
IVNFI-1. PS1-4, clan PD2-9 sebagai agens antimikrob memiliki spektrum yang
luas.
Aktivitas p-laktamase
EPEC
K1.1
Berdasarkan hasii uji iodornetrik Sawai et a/. (1978). maka diperoleh
aktivitas waktamase EPEC K1 . I
sebesar
1.950 xlo4
Ulml (Lampiran 2). Hasilini membuktikan bahwa EPEC K l .I yang diisdasi dari penderita d i r e memiliki
mekanisme resistensi melalui pembentukan p-laktamase. Narnun demikian.
aktivitas p-laktamase EPEC K1.l masih relatif kecil bila dibandingkan dengan
aktivitas p-laktamase
E.
coli yang membawa plasmid pCb (menyandip-
laktamase dari Haemophdus dumy,), yajtu
sebesar
4.623 Ulml (Lawung et a/.2001). Menurut Bennet & Chopra (1993), sebagian besar p-laktamase pada bakteri Gram negatif dihasilkan secara konstitutif, sedangkan pada bakteri Gram
positif keberadaan antibiotik p-laktam di lingkungan berperan sebagai pengatw
ekspresi enzim $-laktamase.
Aktivitas Protein
Penghambat
p-laktamase dari Stmptomyess sp. IVNFl-1Hasil pengukuran aktivitas protein pengharnbat p-laktamase dari filtrat kultur Streptomyces
sp.
IVNFI-1 dan fdtrat kultur ha& pengendapan amoniumsuifat, dialisis, dan fraksi aktif (Fl) filtrasi gel menunjukkan adanya aktivitas
penghambatan terhadap p-laktamase EPEC K1.l (Tabel 2). Filtrat kuitur
Sbrtptomyces sp. IVNFI-1 memiliki aktivitas protein penghambat plaktamase
sebesar 0.3079 x
lo4
Ulml. Bila dibandiigkan dengan filtrai kultur hasil pengendapan amoniumsulfat
(61.5700 xlo4
Wml), d i i l i (3.0790 xlo4
Ulml),laktamase yang diberikan oleh filtrat kultur IVNFI-1 relatif lebih rendah. Hal ini diduga diibabkan protein yang terdapat di dalam filtrat kultur rnasih terencerkan oleh media (pebrut). Menurut Suhartono (1989) tahapan penggumpalan protein
dengan garamnya (amonium sulfat) merupakan suatu proses pemisahan yang dapat mernisahkan protein dari komponen terlarut lainnya sebelum dimumikan ke
tahap selanjutnya. Kemudian
garam
yang tersisa dari proses penggumpalandapat dipisahkan dengan dilisis dan filtrasi gel sehingga dihasilkan protein yang
lebih mumi.
Hasil pengukuran konsentrasi protein filtrat kultur IVNF1-1 serta filtrat kultur hasil pengendapan amonium sulfat, diiisis, dan filtrasi gel menunjukkan nilai konsentrasi yang be~ariasi. Konsentrasi protein terendah dihasilkan oleh filtrat
kultur IVNFI-1, yaitu sebesar 2.964 x
lo3
mg/ml. Sedangkan konsentrasiprotein fmat kultur hasil pengendapan amonium suifat, dialisis, dan fraksi aktif
fiitrasi gel rnasing-masing sebesar 144.000 x 1 03, 24.100 x 1 03, dan 5.749 x 1 O9
mglml. Berdasarkan hasil pengukuran aktivitas protein penghambat
p-
laktamase, maka fdtrat kultur IVNFI-1 memiliki aktivitas spesifiksebesar
0.0104Wmg dengan aktivitas penghambatan sebesar 84.21%. Nilai aktivitas spesif~k terbesar dihasilkan oleh fraksi aktif filtrasi gel, yaitu 0.0322 Wmg, kemudiin diikuti oleh filtrat kuitur hasil dialisis dan pengendapan amonium sulfat masing-
masing sebesar 0.0128 dan 0.0043 Ufmg. Besarnya % penghambatan yang dihasilkan deh fraksi aktif filtrasi gel adalah 5.28%. Persentase penghambatan
protein h a d pengendapan amonium sulfat clan d i i l i tidak
ciapat
ditentukan (merujuk ke formula yang digunakan untuk penentuan besamya %penghambatan) karena nilai aktivitas p-laktamase EPEC K1 .I jauh lebih rendah
dibandingkan dengan aktivitas protein penghambat B-laktamase hasil
pengendapan amonium sulfat dan d i a l i . Hal ini diduga terjadi karena saat proses pengendapan dengan amnium suifat yang dilanjutkan dengan dialisis, semua protein yang terkandung dalam filtrat kultur IVNFI-1
akan
terkumpulrnenjadi satu. Pada saat dilakukan esei aktivitas penghambatan terhadap
P
laktamase, kemungkinan ada beberapa protein yang memberikan kontribusi
penghambatan terhadap p-laktamase.
Bila dibandingkan dengan penelitin yang dilakukan oleh Kim & Lee (1994) dan Doran et al. (1990), kadar protein (Tabel 2) dan aktivitas spesifik protein
penghambat p-laktamase yang dihasilkan
oleh
IVNF1-1 reiatih lebih rendah. KimSMF19 rnemiliki aktivitas
spesifik
sebesar 60.5 U/rng dengan kadar protein yang cukup besar yaitu 1465mg.
Demikian juga dengan hasil penelitian Doran eta/.Tabel 2 Aktivitas protein penghambat p-laktamase Streptomyces sp. IVNFI-1 dengan p-laktamase EPEC K1.1*
-
Sampel Aktivitas B-laktamase Total Aktivitas
a-
Konsentrasi Total Aktivitas spesifik % penghambatan . - dengan protein IaMarnase dangan protein protein protein penghambat terhadap p-laktamase penghambat (Ulml) protein penghambat (U) (mgfml) (mg) 0-laktamase (Ulmg) oleh IVNFI-1 Filtrat kultur 0.3079x
3.0790 x 10" 2.964 x 10'" 0,2964 0.0104 84.21Pengendapan 61.5700
x
l o 4
6.1570 x 10‘~ 144.000 x 10' 1.4400 0.0043arnonium sulfat
Dialisis 3.0790 x I 0" 1 ,5395 x 1
o - ~
2 4 . 1 0 0 ~ 1 0 ' ~ 0.1205 0.0128Filtrasi gel 1.8470
x
1o4
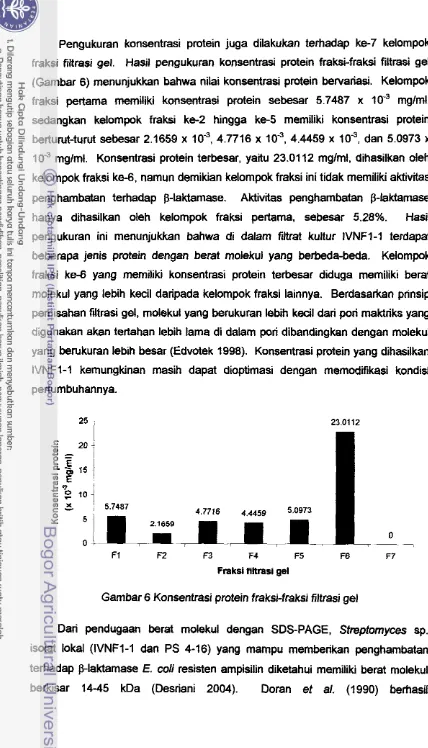
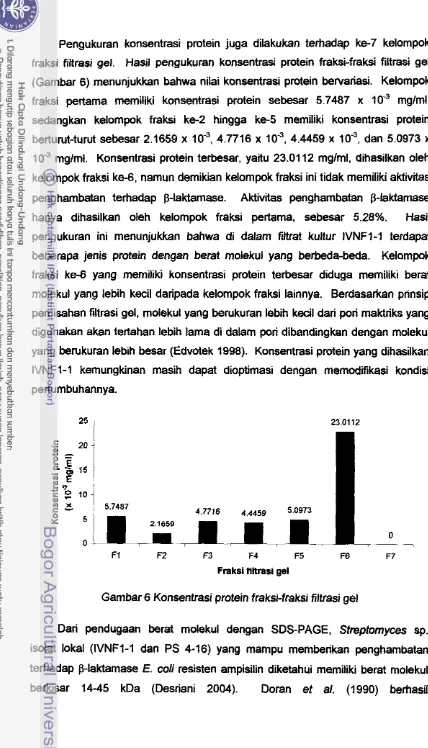
0.9235 x 5.749 x 1 0 ' ~ 0.0287 0.0322 5.28Pengukuran konsentrasi protein juga dilakukan terhadap ke-7 kelompok fraksi filtrasi gel. HasiJ pengukuran konsentrasi protein fraksi-fraksi filtrasi gel
(Gambar
6) menunjukkan bahwa nilai konsentrasi protein bewariasi. Kelompokfraksi pertama merniliki konsentrasi protein sebesar 5.7487 x mglml,
sedangkan kelompok fraksi ke-2 hingga ke-5 memiliki konsentrasi protein berturut-turut sebesar 2.1659 x
lo4,
4.7716 x lo3, 4.4459 xlo4,
dan 5.0973 xlo4
mglml. Konsentrasi protein terbesar, yalu 23.0112 mglml, dihasilkandeh
kelompok fraksi ke-6, namun demikian kelompok fraksi ini tidak memiliki aktivitas
penghambatan terhadap $-laktamase. Aktivitas penghambatan 6-laktamase
hanya dihasilkan oleh kelompok fraksi pertama. sebesar 5.28%. Hasil
pengukuran ini menunjukkan bahwa di dalam flltrat kultur 1VNF1-1 terdapat
beberapa jenis protein dengan berat molekul yang berbeda-beda. Kelompok fraksi ke-6 yang memiliki konsentrasi protein terbesar diduga memiliki berat
molekul yang lebih kecil daripada kelompok fraksi lainnya. Berdasarkan prinsip
pemisahan f&rasi gel, molekul yang berukuran lebih kecil dari pori maktriks yang digunakan akan tertahan lebih lama di dalam pori dibandingkan dengan molekul
yang berukuran lebih besar (Edvotek 1998). Konsentrasi protein yang dihasilkan
IVNF1-1 kemungkinan masih dapat dioptimasi dengan memodiikasi kondisi pertumbuhannya.
F1 F2 F3 F4 FS F6 F7
[image:36.556.39.467.24.772.2]Fraksi fiitrasi gel
Gambar 6 Konsentrasi protein fraksi-fraksi filtrasi gel
Dari pendugaan berat molekul dengan
SDS-PAGE,
Streptomyces sp.
isolat lokal (IVNFI-1 dan
PS
4-16) yang mampu memberikan penghambatanterhadap $-laktamase E. coli resisten ampisilin diketahui memiliki berat molekul
mengarakterisasi protein penghambat p-laktamase (BLIP) dari filtrat kultur S.
clavuligerus yang mampu menghambat penisilinase Bacillus cereus dan
p-
laktamase yang disandi oleh plasmid pUC dan kromosom E. coli Dari hasilpendugaan berat molekul dengan SDS-PAGE, BLIP tersebut diduga rnemiliki
berat molekul berkisar 17.5 kDa. Kim & Lee (1994) juga berhasil
mengarakterisasi dua protein penghambat p-laktamase dari filtrat kultur yang
dihasilkan oleh S. exfoliatus SMF19, yaitu BLIP-I dan BLIP-II dengan berat
molekul masing-masing 48 kDa dan 33 kDa. Menurut Doran et al. (1990) selain
BLIP, di dalam filtrat kultur Streptomyces sp. juga terdapat asam klavulanat yang
secara sinergis menghambat aktivitas p-laktamase. Wahyuni (2006) berhasil
mengisolasi asam klavulanat dari filtrat kultur IVNF1-1 yang ternyata dapai menghambat pertumbuhan EPEC K1.l resisten ampisilin.
Kadar Hambat Minimal
Pengaruh pernberian filtrat kultur IVNF1-1 dengan kadar protein be~ariasi
[image:37.553.78.426.442.607.2]terhadap pertumbuhan EPEC K1.l dapat dilihat pada Gambar 7. Penambahan filtrat kultur IVNF1-1 ke dalam media tumbuh terbukti mampu menghambat pertumbuhan EPEC K1.l bila dibandingkan dengan kontrol (tanpa penambahan filtrat kultur EPEC K1.l).
Gambar 7 Hasil uji kadar hambat minimal filtrat kultur IVNF1-1 terhadap pertumbuhan EPEC K1.l dalam media NB+ampisilin selama 7 iam. EPEC K1.l tanpa filtrat kultur IVNF1-1 (I), penambahan 2.316 x
lod
mg filtrat kultur IVNF1-1(2), penambahan 4.631 x
lod
mg filtrat kultur IVNF1-1 (3). penarnbahan 9.263 xlo4
mg filtrat kultur IVNFI-1(4), penambahan 1.853;
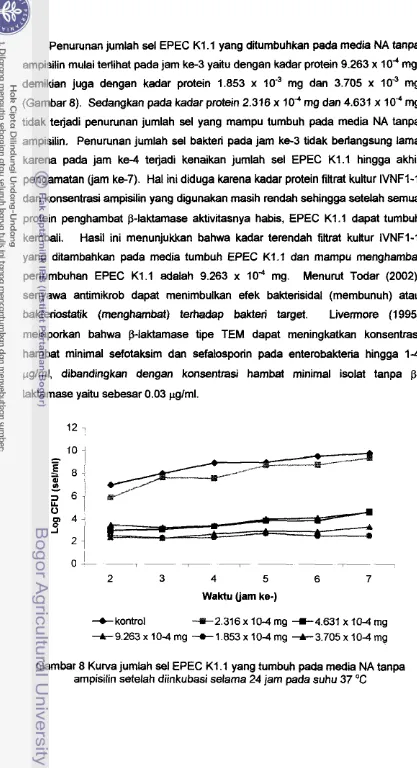
103 mg filtrat kultur IVNF1-1 (5) penambahan 3.705 x mg filtrat kultur IVNF1-1 (6), media NBPenurunan jumlah sel EPEC K1.l yang ditumbuhkan
pada
medii NA tanpa ampisilin mulai terlihat padajam
ke-3 y&udengan
kadar
protein 9.263 xlo4
mg.
[image:38.553.47.464.21.789.2]demikiin juga dengan kadar protein 1.853 x
lo3
mg dan 3.705 xlo3
mg(Gambar 8). Sedangkan
pada
kadaf protein 2.316 xlo4
mgdan
4.631 xlo4
mg
tidak terjadi penurunan jumlah sel yang mampu turnbuh pada media NA tanpaampisili. Penurunan jumlah sel bakteri pada jam ke-3 tidak berlangsung lama
karena pada jam ke-4 terjadi kenaikan jumlah sel EPEC K1.l hingga akhir
pengamatan (jam ke-7). Hal ini diduga karena kadar protein fikrat kultur IVNFI-1 dan konsentrasi ampisilin yang digunakan masih rendah sehingga setelah
m u a
protein penghambat $-laktamase aktivitasnya habis, EPEC K1.l dapat tumbuh
kembali. Hasil ini menunjukkan bahwa kadar terendah
filtrat
kukur IVNFI-1 yang ditambahkan pada media tumbuh EPEC K1.f dan mampu menghambatpertumbuhan EPEC K1.l adalah 9.263 x
loa
mg.
Menurut Todar(2002),
senyawa antimikrob dapat menimbulkan efek bakterisidal (membunuh) atau
bakteriostatik (menghambat) terhadap bakteri target. Livermore (1995)
melaporkan bahwa P-laktarnase tipe TEM dapat meningkatkan konsentrasi
hambat minimal sefotaksim dan sefalosporin pada enterobakteria hingga 1-4
gg/ml, dibandingkan dengan konsentsasi hambat minimal
isolat
tanpaP-
laktamase yaitu sebesar 0.03 &ml.
0 - - 7 - 77--
--
2 3 4 5 6 7
Waktu (jam ke-)
+
kontrol t 2 . 3 1 6 x 104 mg t 4 . 6 3 1 x 104 mg t-9.263x104mg 41.853x104mg t 3 . 7 0 5 x 1 0 4 m gSIMPULAN DAN SARAN
EPEC
K1.l resisten ampisilin memiliki mekanisme resistensi dengan menghasilkan enzim 6-laktamase, dengan aktivitas 0-laktamase sebesar 1.950 xlo4
Ulml. St&omyces sp. IVNFI-1 menghasilkan protein penghambatP
laktamase. Aktivitas protein penghambat $-laktamase dalam filtrat kultur, hasilpengendapan dengan amonium sulfat, dialisis, dan fraksi aktif (Fl) masing-
masing sebesar 0.3079 x lo4, 61.5700 x
lo4,
3.0790 x lo4, dan 1.8470 xloa
Ufml. Penghambatan yang dihasjlkan oleh filtrat kultur JVNF1-1 dan fraksi
aktif
filtrasi gel sebesar 84.21% dan 5.28%. Kadar hambat minimal protein yang terkandung dalam filtrat kultur IVNF1-1 adalah 9.263 x
lo4
mg.saran
Diperlukan penelitian lebih lanjut untuk mengoptimasi kondii pertumbuhan,
karakterisasi, dan purifikasi protein penghambat Plaktamase yang dihasilkan
DAFTAR PUSTAKA
Abraham EP. Chain E. 1940. An enzyme from bacteria
able
to destroy penicillin. Nature 146:837.Andri C. 2004. Kajiin potensi Streptomyces sp. PSI-4 sebagai penghasil senyawa bioaktii pengendali bakteri patogen tanaman kedelai [skripsi]. Bogoc Fakultas Matematika dan llrnu Pengetahuan Alam, lnstitut Pertanian Bogor.
Benet MP, Chopra 1. 1993. Molecular basis of p-lactamase induction in bacteria. Antimicmb Agents Chemofher 37:153-158.
Bollag DM, Edelstein SJ. 1991. Pmtein methock. New York: John W h y & Sons.
Bradford M. 1976. A rapid, sensitive method for quantitation
of
microgram quantities of protein utilizing principle of protein-dye binding. Anal Biochem 72:24&254.Bradford PA. 2001. Extended-spectrum p-lactamases
in
the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Micmbiol Rev 14:933-951.Budiarti
S. 1997. Telaah faktor adhesivitasEshtwichia
CW
enteropatogenikdalam penanggulangan penyaki diare di Indonesia. Laporan Akhir Peneltiin H i h Bersaing Ill Perguruan Tinggi Tahun Anggaran 1994- 1997. Fakultas Matematika dan llmu Pengetahuan Alam, lntiiut Pertanian Bogor.
Budiarti S, Suhartono MT, Meryandini A. 1999. Studi faktor virulensi pada Escherichia coli enteropatogenik dalam upaya mengkaji model patogenisitas penyakit dire. Laporan Akhir Penelitian Hibah Bersaing VU2 Perguruan Tinggi Tahun Anggaran 1997-1999. Fakultas Matematika dan llmu Pengetahuan Alarn, lnstitut Pertanian Bogor.
Cole ST, Nicolas MH. 1986.
&ladam
resistance mechanism in Gram negative bacteria. J Micmbiol Sci 11 :334-339.Deak et al. 1998. Membrane-bound and extracellular
p-lactamase
production with developmental regulation in Streptomyces griseus NRRL 8-2682. Micmbidogy 144:2169-2177.Desriani. 2004. Penapisan isolat Streptomyces spp. penghasil protein penghambat 0-laktamase. Hayati 11 :88-92.
Edvotek. 1998. Principles of gel filtration chromatography. http://www.edvotek.com.
17
Agustus 20061.Ferguson GP, Crecghton RI, Nikdaev Y, Booth IR. 1998. Important of Rpos and Dpsin survival of exposure of both exponential-stationary-phase Escherichia cob
cells
to electrophile Nethylealeimide. J Bacterial 180:1030-1036.
Fluit ADC, Viser MR, Schmitz F-J. 2001. Molecular detection of antimicrobial resistance. Clin Microbid Rev 14:836-871.
Frewari 1. 1999. Penapisan biiogis dan isolasi senyawa peptida antimikrob dari Streptomyces sp. [skripsi]. Bogor: Fakultas Matematika dan llmu Pengetahuan Alam, lnstitut Pertanian Bogor.
Harian KOMPAS. 2005. Bakteri patogen sumber KLB. htt~:llkom~as.com. 112 Juli 20061.
Heritage J, M'Zali FH. Gascoyne-Binzi D. Hawkey PM. 1999. Evolution and spread of SHV extended-spectrum 0-lactamase in Gram negative bacteria. J Antimicrob Chernofher 44309-318.
Holt JG, Krieg NR, Sneath PHA. Staley JT, Williams ST. 1994. Bergey's Manual of Determinatfve Bacteriology. Ed ke-9. Philadelphia: Williams & Wilkins.
Ifdal. 2003. lnteraksi antara Streptomyces sp. dengan B a d u s subtdis, Xanthomonas campestiis pv glycine, Rhizobia, dan Pseudomonas sp. MK I [skripsi]. Bogor: Fakultas Matematika dan llmu Pengetahuan Alam, lnstitut Pertanian Bogor.
Kahan KS et al. 1979. Thienarnycin, a new $-lactam antibiotic. 1. Discovery, taxonomy, isolation and physical properties. J Antibiot 323-12.
Kang SG, Park HU. Lee HS, Kim HT, Lee KJ. 2000. New 0-lactamase inhibitory protein from Streptomyces exfoliatus SMF19 and its roles on the morphological differentiation. The Joumal of BioIogcaI Chemistry 275:16851-16856.
Kim MK,
Lee
KJ. 1994. CharactetWcs of 0-lactamase-inhibiting proteins from Streptomyces exfoliatus SMF19. Appl Environ Micmbiol60:1029-1032.Lawung R, Prachayasittikul V, Bulow L. 2001. Purification and charactehation of a p-lactamase from Haernophilus ducreyi in Escherichia coli. Protein Expression and Purification 23:151-158.
Lee WS, Komarmy L. 1981. lodomelric spot test for detection of beta-lactamas.? in Haemophilus influenza. J Clin Microbiol13: 224-225.
Madigan MT, Martinko JM, Parker J. 2000. Biology of microorganisms. New Jersey: Prentice-Hall.
Miyadoh S. Otoguro M. 2004. Workshop on isolation
methods
and d a s i t l d i o n of actinomycetes. Jakarta: Lembaga llmu Pengetahuan Indonesia.Moyenuddin M, Wachsmuth IK, Moseley SL, Bopp CA, Blake PA. 1989. Serotype. antimicrobial resistance, and adherence properties of Exhen'chia coli strain associated with outbreaks of diarrheal illnes in children in the United States. J Clin Microbe/ 27:2234-2239.
Nataro JP, Kaper JB. 1998. Diarrheagenic
Escherichia
col%
Ck'nica/ MCfobidogyReviews 11 :142-201.
Ogawara H. Horikawa S, Shiida-Miyoshi S, Yasuzawa K. 1978. Production and property of beta-lactamases in Streptomyces: comparison of the strains isolated newly and thirty years ago. Aniimiwob Agents and Chemother 13:865-870.
Ogawara H, Mantoku A, Shimada S. 1981.
p-lactamase
frim Streptomyces cacoai. The Journal of Biological Chemistry 256: 2649-2655.Park HU,
Lee
KJ. 1998. Cloning and heterologous expression of the gene for BLIP-II, a $-lactamase-inhibitory proteion from Streptomyces exfoliatus SMF19. MhUbbl~gy 144:2161-2167.Patrikc MW. 1998. Chemistry of
betctlacbm
antibiotics. htt~:/lwww.acsmedchem.omlmodulelbetalactam.html. [ I 5 Juni 20061Pusat Penanggulangan Krisis Depkes R1. 2006. Korban akibat diare di Papua bertambah menjadi 157 orang. htto://www.ookdeokes.or.id. [9 Juli 20061.
Reading C, Cole M. 1977. Clavulanic acid: a beta-lactamse-inhibiting beta-lactam from Streptomyoes davuligems. Antimicmb Agents and Chemother 1 1352- 857.
Rollins DM, Joseph SW. 2000. Mechanism of action of beta-lactarn antibiotics. htt~:/lwww.liie.umd.edu. [I8 Juli 20061.
Rumah Sakit Penyakit lnfeksi Prof. Dr. Sulianti Saroso. 2005. Diare. htt~i:llwww.infeksi.com. 18 Juli 20061.
Sawai T, Takahashi 1, Yamagishi. 1978. lodometric assay method for beta- lactamase with various beta-lactam antibiotics as substrates. Antimicrab Agents and Chemother 13:910-913.
Singleton P. 1999, Bacteria in biology, bidechnology, and medicine. Ed k e 5 . Chichester: John Wiley & Sons.
Thai W, Paradkar AS, Jensen SE. 2001. Construction and analysis of
0-
lactamase-inhibitory protein (BLIP) non-producer mutants of Streptomyces clavuligerus. Mcrvbiology 147:325335.Todar K. 2002. Antimicrobial agents used in treatment of infectious disease. htt~://textbook~erioloav.net/aaentsantimicmbial.html. [ I 9 April 20061.
Wahvuni VVT. 2006. Isolasi. emum mi an. dan identifikasi senvawa anti-0- .laktamase dari .Stmptomyces sp. IVNFI-I (Penghambat bertumbuhan bakteri wnvebab diare.
.
-
EPEC Kl.1) Iskri~sil. Bogor: Fakuttas Matematika dan llmu Pengetahuanlam,
lntiiut'pkrtanian ~ G o r .Widuretno
0.
2000. Penapisanlsolat
Stmpfwnyces sp.penghasil
senyawa penghambat Escherichia coli resisten ampisilin [skripsi]. Bogor: Fakultas Matematika dan lknu Pengetahuan Alam, lnstitut Pertaniian Bogor.Winarni 1. 2004. Kqian potensi Stmptomyces sp. sebagai agens pengendali hayati bakteri patogen pada benih padi dan kedelai [tesis]. Bogor: Program Pascasarjana, lnstitul Pertanian Bogor.
Lampiran 1 Komposisi media peremajaan, produksi serta uji daya hambat Sfreptomyces spp. dan bakteri target
No. Nama media Komposisi Jumlah (gll)
1. Yeast Malt Agar Yeast extract (Oxoid) 4 Malt extact (Oxoid) 10
Glukosa 4
Bacto agar 15
2. Yeast Malt Smth Yeast extract (Oxoid) 4 Malt extract (Oxoid) 10
Glukosa 4
3. Nutrient agar (NA) Beef extract 3
B a d peptone 5
Bado agar 15
4. Nutrient bmth (NB) Beef axtract 3
Bacto peptone 5
5. Produksi Kim 8 Lee Glukosa NH4CI NaHzPO4 KzHP04 MgS04.7H20 CoCI*
Lampiran 2 Reagen iodii yang digunakan dalam esei aldivitas $-laktamase dan aktivitas penghambatannya
Buffert asetat
Sebanyak 80 gram sodium asetat anhidnus pH 4 dicukupkan volurnenya dengan akuades hiigga 2 liter.
Reagen iodin
3
7n/sa/z
ca
b
AKTIVITAS PROTEIN PENGHAMBAT p-LAKTAMASE
DARl
Streptomyces
sp. IVNFI
-1
TERHADAP
Escherichia coli
ENTEROPATOGEN K1 .I
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PENDAHULUAN
Diare merupakan salah satu penyaki infeksi yang masih menjadi masalah kesehatan di Indonesia dan beberapa negara berkembang. Penyakit ini masih
sering menimbulkan Kejadian Luar B i s a (KLB) yang diindikasikan dengan
tejadinya peningkatan kejadiin kesakitanlkematian kasus d i r e menjadi dua kali
lipat atau lebih dibandingkan jumlah kesakiinlkematian karena diare yang biasa terjadi pa& kurun waktu sebelumnya (RSPI-SS 2005). Pada tahun 2006
diemukan beberapa
kasus
KLB diare di tndonesia seperti di Papua yangrnenyebabkan 157 orang meninggal (PPK Depkes RI 2006) dan di Tangerang
jumlah penderita mencapai 1256 orang (Harian KOMPAS 30 Juni 2005).
Moyenuddin et a/. (1989) malaporkan bahwa 56% dari 50 penderita KLB
diare pada anak-anak di Amerika Serikat pada tahun f934-1987 disebabkan oleh
E-richia odi enteropatogen (EPEC). Pada tahun 2003 Yatsuyanagi et a/. juga melaporkan bahwa 25% dari 36 penderita diare pada siswa (usia 12-14
tahun) di .Ispang pada tahun 2000 juga dkbakkan
oleh
WEC. Di indonesia, bakteri EPEC didapatkan pada 55% anak-anak penderita diire (Budiarti 1997).EPEC K1.l diketahui rnemiliki aktivitas proteotitik ekstraseluler tertinggi yang
diduga sebagai salah satu faktor virulensi EPEC (8udiarti
ef
a/. 1999).Penanganan terhadap penderita d i r e dilakukan rnelalui rehidrasi dan
pemberian antibiotik. $-laktam merupakan salah satu antibiati yang digunakan
untuk pengobatan diire. Antibiotik ini bekerja dengan cara
menghambat
terbentuknya ikatan silang antar peptida pada tahapakhir
sintesis peptidoglikandari dinding sel bakteri Gram negatif (Nataro 8 Kaper 1998; Todar 20021.
Penggunaan antibiotik 8-laktam secara terus-menerus dapat menimbulkan
masalah resistensi pada bakteri. Resistensi terhedap antibiotik plaktam yang terjadi pada bakteri Gram negatif seringkali disebabkan karena dihasilkannya
enzim P-IaMamase. Enzim ini akan menghidrolisis cincin P-laktam sehingga dihasilkan produk inaktif dari antibiotik tersebut (Ogawara et at. 1981).
Permasalahan resistensi pada bakteri yang disebabkan oleh aktivitas enzim
$-laktamase dapat diatasi dengan melakukan modifikasi struktur terhadap
senyawa kimia antibbtik &laMam, sehingga dapai meningkatkan efek terapi
dilakukan adalah mencari senyawa baru yang mampu menghambat kerja enzim
p-laktamase. Streptomyces spp. merupakan bakteri Gram positif berfilamen
yang menghasilkan berbagai macam senyawa metaboli sekunder, enzim
pendegradasi, dan inhibitor enzim. Reading & Cole (1977) berhasil mengisolasi asam klavulanat dari S. clavuligenrs yang mampu menghambat aktivitas enzim
p-laktamase. Selain asam klavulanat, S. clavuligenrs juga menghasilkan BLIP
(beta-lactamase-inhibitory
protein), protein ekstraseluler yang mampumenghambat p-laktamase tipe TEM (Temoniera) (Doran et a/. 1990). Dua
protein penghambat plaktamase ekstraseluler (BLIP-I dan BLIP-11) juga berhasil
dikarakterisasi oleh Kim & Lee (1 994) dari S. exfoliatus SMFI 9.
Streptomyces spp. yang diisolasi dari berbagai daerah di Indonesia
diketahui berpotensi menghasilkan berbagai macam senyawa bioaktif. Selain mampu menghasilkan senyawa bioaktif pengendali bakteri patog