PENURUNAN KADAR LOGAM KROMIUM, TEMBAGA,
DAN NIKEL PADA LIMBAH CAIR LABORATORIUM
ELEKTROPLATING POLITEKNIK NEGERI MEDAN
DENGAN METODE ELEKTROKOAGULASI
SKRIPSI
CHRISTIANA FIRSTA ARITONANG
080802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENURUNAN KADAR LOGAM KROMIUM, TEMBAGA,
DAN NIKEL PADA LIMBAH CAIR LABORATORIUM
ELEKTROPLATING POLITEKNIK NEGERI MEDAN
DENGAN METODE ELEKTROKOAGULASI
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
CHRISTIANA FIRSTA ARITONANG
080802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Penurunan Kadar Logam Kromium, Tembaga, dan Nikel Pada Limbah Cair Laboratorium Elektroplating Politeknik Negeri Medan Dengan Metode Elektrokoagulasi
Kategori : Skripsi
Nama : Christiana Firsta Aritonang Nomor Induk Mahasiswa : 080802016
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di Medan, Juli 2013
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Dra. Saur Lumban Raja, M.Si Dr. Hamonangan Nainggolan, M.Sc NIP 1955062319686011002 NIP 195606241983031002
Disetujui oleh:
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENURUNAN KADAR LOGAM KROMIUM, TEMBAGA, DAN NIKEL PADA LIMBAH CAIR LABORATORIUM ELEKTROPLATTING POLITEKNIK
NEGERI MEDAN DENGAN METODE ELEKTROKOAGULASI
SKRIPSI
S
aya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.Medan, Juli 2013
CHRISTIANA FIRSTA ARITONANG
PENGHARGAAN
Terutama untuk Bapa di sorga yang selalu memberikanku harapan seakan-akan selama ini semua beban yang ada seolah-olah menjadi ringan, merupakan suatu mukjizat dalam kehidupanku.
Tiada terima kasih yang bisa diterjemahkan lebih indah daripada rasa kegembiraan dan rasa terima kasih penulis kepada kedua dosen pembimbing Dr. Hamonangan Nainggolan M.Sc dan Dra. Saur Lumban Raja M.Si yang selalu mengerti tentang kesulitan penulis dan dengan sabar selalu membimbing dan memberi solusi kepada penulis dalam penyusunan skripsi ini. Saya menganggap bapak dan ibu begitu istimewa. Terimakasih kepada Ibu Dr. Rumondang Bulan, M.Sc dan Bapak Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA-USU Medan. Ucapan terimakasih juga kepada Dekan dan Pembantu Dekan FMIPA-USU.
Terimakasih kepada Bapak Jamahir Gultom Ph.D yang menjadi sumber inspirasi saya selama menjalani studi di masa perkuliahan, saya rasa beliau selalu menjadi inspirator bagi mahasiswa.Terimakasih pak. Kekaguman saya terhadap Prof. Seri Bima Sembiring dan Prof. Nimpan Bangun atas pengalaman dan pengetahuan yang secara tidak langsung diberikan kepada saya selama menjadi asisten laboratorium Kimia Anorganik. Di tengah perkataan pedas ada sebuah makna yang bersifat membangun dan akan selalu menjadi modal untuk saya melangkah lebih jauh lagi. Ucapan terimakasih saya kepada Bapak/Ibu dosen Kimia FMIPA-USU atas ilmu pengetahuan yang saya dapatkan dari Bapak dan Ibu. Kiranya nama yang harum selalu melekat pada Bapak dan Ibu sekalian.
Untuk keluarga, terkhusus oppung Jannus, kedua orangtua Daniel Aritonang/ Masliana Pangaribuan dan kelima orang adik tersayang yang selalu memberikan cinta yang murni untuk saya.
Dan yang terakhir dukungan dari teman Kimia 08 semasa studi beserta adik-adik stambuk dan tidak terkecuali untuk sahabat asisten Lab. Anorganik FMIPA-USU Suwanto, Elisa, Lina, Edelina, Hamdan, Karlina, Sahat, Rizal, Paulus, Fantoso, Lois, Mars, Rachel, Nabila, Tionerlis, dan Suwandy.
PENURUNAN KADAR LOGAM KROMIUM, TEMBAGA,
DAN NIKEL PADA LIMBAH CAIR LABORATORIUM
ELEKTROPLATING POLITEKNIK NEGERI MEDAN
DENGAN METODE ELEKTROKOAGULASI
ABSTRAK
THE DECREASE OF CHROM(Cr), CUPRUM(Cu), AND NIKEL (Ni) CONTENT IN WASTEWATER ELECTROPLATTING BY ELECTROCOAGULATION
METHOD
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan ` i
Pernyataan ii
Penghargaan iii
Abstrak iv
Abstract v
Daftar isi vi
Daftar table x
Daftar gambar xi
Daftar lampiran xii
Bab 1. Pendahuluan 1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 3
1.5. Manfaat Penelitian 4
1.6. Lokasi Penelitian 4
1.7. Metodologi Penelitian 4
Bab 2. Tinjauan Pustaka 2.1. Pengertian Lingkungan dan Pencemaran 5
2.2. Industri Sebagai Sumber Pencemaran Lingkungan 6
2.3. Limbah Berdasarkan Karakteristik Kimia 7
2.4. Logam Berat 7
a) Logam Kromium (Cr) 9
b) Logam Tembaga (Cu) 10
c) Logam Nikel (Ni) 11
2.5. Elektroplating 12
2.6. Pengolahan Limbah 13
2.7. Koagulasi dan Flokulasi 14
2.8. Elektrokoagulasi 15
2.9. Faktor-Faktor Yang Mempengaruhi Elektrokoagulasi 18
Bab 3. Metode Penelitian 3.1 Bahan 20
3.2 Alat 20
3.3 Prosedur Penelitian 3.3.1. Pembuatan Larutan Standar Logam Kromium 100 mg/L 21 3.3.2. Pembuatan Larutan Standar Logam Kromium 10 mg/L 21 3.3.3. Pembuatan Larutan Seri Standar Logam Kromium 21
3.3.6. Pembuatan Larutan Standar Logam Tembaga 10 mg/L 22
3.3.7. Pembuatan Larutan Seri Standar Logam Tembaga 22
3.3.8. Pembuatan Kurva Kalibrasi Logam Tembaga 22
3.3.9. Pembuatan Larutan Standar Logam Nikel 100mg/L 23
3.3.10. Pembuatan Larutan Standar Logam Nikel 10 mg/L 23
3.3.11. Pembuatan Larutan Seri Standar Logam Nikel 23
3.3.12. Pembuatan Kurva Kalibrasi Logam Nikel 23
3.3.13. Elektrokoagulasi larutan limbah 24
3.3.14. Rangkaian Alat 25
3.4. Bagan Penelitian 26
Bab 4. Hasil dan Pembahasan 4.1. Hasil Penelitian 27
4.1.1. Kadar Logam Kromium Setelah Elektrokoagulasi 28
4.1.2. Kadar Logam Tembaga Setelah Elektrokoagulasi 28
4.1.3. Kadar Logam Kromium Setelah Elektrokoagulasi 29
4.2. Persentase Penurunan Kadar Logam 30
4.3. Pembahasan 31
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 33
5.2. Saran 34
DAFTAR TABEL
Nomor Judul Halaman Tabel
Tabel 1. Konsentrasi logam kromium, tembaga, dan nikel dalam 27 limbah cair elektroplating Politeknik Negeri Medan
Tabel 2. Penentuan konsentrasi logam kromium hasil elektrokoagulasi 28 pH 7 dengan variasi waktu kontak
Tabel 3. Penentuan konsentrasi logam tembaga hasil elektrokoagulasi 29 pH 7 dengan variasi waktu kontak
Tabel 4. Penentuan konsentrasi logam kromium hasil elektrokoagulasi 29 pH 7 dengan variasi waktu kontak
Tabel 5. Persentase penurunan kadar logam 30
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
Gambar 1. Bagan Alat Spektrofotometer Serapan Atom 23
Gambar 2. Rangkaian Alat 25
Gambar 3. Proses Elektrokoagulasi 34
DAFTAR LAMPIRAN
Nomor Judul Halaman Lamp
Lampiran A. Perhitungan Hasil 39
Lampiran B. Data Hasil Pengukuran Absorbansi Larutan 46
Lampiran C. Gambar Larutan Sebelum dan Sesudah Elektrokoagulasi 49
PENURUNAN KADAR LOGAM KROMIUM, TEMBAGA,
DAN NIKEL PADA LIMBAH CAIR LABORATORIUM
ELEKTROPLATING POLITEKNIK NEGERI MEDAN
DENGAN METODE ELEKTROKOAGULASI
ABSTRAK
THE DECREASE OF CHROM(Cr), CUPRUM(Cu), AND NIKEL (Ni) CONTENT IN WASTEWATER ELECTROPLATTING BY ELECTROCOAGULATION
METHOD
ABSTRACT
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Salah satu sektor industri yang memberikan kontribusi di dalam peningkatan pertumbuhan ekonomi adalah industri pelapisan logam (elektroplating). Elektroplating adalah proses pelapisan logam melibatkan reaksi elektrokimia. Industri ini berkembang pesat seiring dengan meningkatnya kebutuhan masyarakat. Akan tetapi selain memberikan dampak positif, juga menimbulkan dampak negatif berupa limbah yang ditimbulkan dari proses produksi, dalam hal ini limbah cairnya. Limbah yang dihasilkan dari proses elektroplating merupakan limbah logam berat yang diperoleh akibat penggunaan logam-logam berat itu sendiri pada proses elektroplating. Beberapa unsur logam yang terdapat dalam limbah elektroplating diantaranya adalah Cr, Cu, dan Ni (Ginting, 1992).
Dalam industri elektroplating pada dasarnya kromium digunakan karena sifatnya yang sangat tahan terhadap korosi, karena reaksi dengan udara menghasilkan Cr2O3 yang bersifat non-pori sehingga mampu melindungi logam yang terlapisi dari reaksi lebih lanjut. Dengan sifat logam yang tahan korosi, manfaat utama kromium yaitu sebagai pelapis logam atau baja. Selain itu, lapisan kromium juga menghasilkan warna yang mengkilap sehingga memberikan
manfaat tambahan yaitu sebagai fungsi dekoratif. Pada pelapisan kromium melalui proses elektro kromium plating dapat dipakai Cr2O3 yang dilarutkan dalam H2SO4 sebagai elektrolit. Ion Cr3+ akan tereduksi menjadi logam kromium yang melapisi logam lain yang dipasang sebagai katoda. Jika logam langsung dilapisi dengan kromium, biasanya lapisan hasil ini mudah retak-retak. Untuk memperoleh lapisan yang baik, kuat, dan tidak retak-retak, logam yang akan dilapisi dengan kromium, sebelumnya dilapisi terlebih dahulu dengan logam tembaga dan nikel (Sugiyarto, 2003).
ekskresi (hati dan ginjal). Beberapa logam memiliki sifat karsinogenik (pembentuk kanker) misalnya kromium (Ginting, 1992), maupun teratogenik (salah bentuk organ). Daya toksisitas logam ini dipengaruhi oleh beberapa faktor yaitu kadar logam yang termakan, lamanya mengkomsumsi, umur, spesies, jenis kelamin, kondisi fisik, dan jaringan tubuh untuk mengakumulasi logam (Darmono, 1995).
Teknologi pengolahan air limbah adalah kunci dalam memelihara kelestarian
lingkungan. Berbagai teknik pengolahan air buangan untuk menyisihkan bahan polutannya telah dicoba dan dikembangkan selama ini. Koagulasi dan flokulasi merupakan metode tradisional untuk mengolah air limbah. Pada proses ini, koagulan (misalnya alum atau ferri klorida) dan bahan aditif (misalnya polielektrolit) dipakai untuk memproduksi agregat yang lebih besar sehingga endapan dapat dipisahkan secara fisika. Proses ini memerlukan area yang luas dan supply pengkoagulasi secara lanjutan. Justru sebaliknya metode dengan biaya murah, efektif, untuk membersihkan polutan dalam air dan dengan sedikit bahan tambahan perlu dilakukan untuk pengolahan air. Pengolahan dengan elektrokoagulasi cocok untuk gambaran ini (Peter Holt, 2006). Proses elektrokoagulasi terbentuk melalui pelarutan logam dari anoda yang kemudian berinteraksi secara simultan dengan ion hidroksi dan gas hidrogen yang dihasilkan dari katoda membentuk koagulan. Koagulan ini akan mengadsorbsi polutan-polutan menjadi senyawa berpartikel besar yang tidak larut yang akan terflotasi ke permukaan larutan yang diproses.
I.2. Permasalahan
Sesuai dengan latar belakang di atas timbul permasalahan bagaimana kemampuan proses elektrokoagulasi dalam menurunkan kadar Cr, Cu, Ni serta waktu optimum untuk menurunkan kadar logam Cr, Cu, Ni dalam limbah elektroplating.
I.3. Pembatasan Masalah
Limbah industri elektroplating mengandung banyak bahan pencemar namun untuk penelitian ini peneliti membatasi hanya pada logam kromium, tembaga, dan nikel saja, dan waktu elektrokoagulasi dibatasi hingga 60 menit.
I.4. Tujuan Penelitian
a. Memperkenalkan teknologi elektrokoagulasi sebagai teknologi alternatif dengan operasi yang mudah dilakukan dan harga terjangkau bagi pengelolaan limbah cair.
b. Mengetahui waktu optimum yang digunakan untuk menurunkan kadar logam kromium (Cr), tembaga (Cu), dan nikel (Ni).
c. Memperoleh air bersih yang kadar logamnya sesuai dengan persyaratan air bersih buangan industri ( KEP-51/MENLH/10/1995).
I.5. Manfaat Penelitian
yang mahal. Penelitian ini dilakukan untuk memberikan solusi yang mudah dan murah dalam pengolahan air terutama air limbah sehingga dapat menghasilkan air buangan yang layak dibuang ke lingkungan.
I.6. Lokasi Penelitian
Air limbah elektroplating berasal dari Laboratorium Elektroplating Politeknik Negeri Medan. Penelitian ini dilakukan di Laboratorium Anorganik FMIPA Universitas Sumatera Utara,
Medan, Analisis kadar logam dilakukan di Badan Riset dan Penelitian (BARISTAN), Medan.
I.7. Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1. Pengertian Lingkungan dan Pencemaran
Pembangunan ekonomi di Indonesia menitikberatkan pada pembangunan sektor industri. Di satu sisi, pembangunan akan meningkatkan kualitas hidup manusia dengan meningkatnya pendapatan masyarakat. Di sisi lain, pembangunan juga bisa menurunkan kesehatan masyarakat dikarenakan pencemaran yang berasal dari limbah industri dan rumah tangga.
Pada akhir-akhir ini, kita begitu sering mendengar, membaca dan bahkan membicarakan masalah pencemaran lingkungan. Media-media massa memaparkan tentang bermacam-macam pengrusakan lingkungan. Lingkungan dapat diartikan sebagai media atau suatu areal, tempat atau wilayah yang di dalamnya terdapat bermacam-macam bentuk aktivitas yang berasal dari ornamen-ornamen penyusunnya. Suatu lingkungan dikatakan tercemar apabila telah terjadi perubahan-perubahan dalam tatanan lingkungan itu sehingga tidak sama lagi dengan bentuk asalnya, sebagai akibat dari masuk dan atau dimasukkannya suatu zat atau benda asing (bahan polutan) ke dalam tatanan lingkungan itu. Bahan polutan tersebut pada umumnya mempunyai sifat racun (toksik) yang berbahaya bagi organisme hidup (Palar, 1994).
Polutan berupa logam mencemari lingkungan, baik di lingkungan udara, air, dan tanah yang berasal dari proses alami dan kegiatan industri. Proses alami antara lain siklus alamiah sehingga bebatuan gunung berapi bisa memberikan kontribusi ke lingkungan udara, air, dan tanah. Kegiatan manusia yang bisa menambah polutan bagi lingkungan berupa kegiatan industri, pertambangan, pembakaran bahan bakar, serta kegiatan domestik lain yang mampu
teratogen ( salah bentuk organ), atau karsinogen bagi manusia maupun hewan (Widowati, 2008).
2.2. Industri Sebagai Sumber Pencemaran Lingkungan
Pencemaran daratan dan air (air sungai/ laut) biasanya terjadi karena pembuangan limbah dari
industri penggunaan logam yang bersangkutan secara tidak terkontrol (pabrik aki/ baterai) atau penggunaan bahan yang mengandung logam itu sendiri (Darmono, 1994).
Limbah mengandung bahan pencemar yang bersifat racun dan berbahaya. Secara fakta, industri merupakan sumber pencemar yang paling dominan, walaupun kenyataannya sektor lainnya juga memberikan kontribusi dalam pencemaran lingkungan.
Bahan beracun dan berbahaya banyak digunakan sebagai bahan baku industri maupun sebagai bahan tambahan. Beracun dan berbahaya ditunjukkan oleh sifat fisik maupun kimianya. Dalam kadar tertentu, kehadirannya dapat merusak kesehatan bahkan mematikan manusia atau kehidupan lainnya sehingga perlu ditetapkan batas-batas yang diperkenankan dalam lingkungan pada waktu tertentu.
Adanya batasan kadar bahan beracun dan berbahaya yang terdapat dalam suatu elemen tertentu dikenal dengan nilai ambang batas, yang artinya dalam jumlah demikian masih dapat ditoleransi oleh lingkungan sehingga tidak membahayakan lingkungan atau pemakai.
Tingkat bahaya dan keracunan yang disebabkan limbah tergantung pada karakteristiknya, dalam jangka waktu yang relative singkat tidak memberikan pengaruh yang berarti, tetapi dalam jangka panjang cukup fatal bagi lingkungan(Ginting, 1992). Biasanya senyawa kimia yang sangat beracun bagi organisme hidup dan manusia adalah
2.3. Limbah Berdasarkan Karakteristik Kimia
Bahan kimia yang terdapat dalam air akan menetukan sifat air baik dalam tingkat keracunan maupun bahaya yang ditimbulkan. Karakteristik kimia limbah terdiri dari bahan organik dan anorganik. Dengan mengetahui karakteristik limbah maka proses pengolahannya akan lebih mudah.
Bahan buangan organik pada umumnya merupakan bahan yang dapat membusuk dan sebaiknya tidak dibuang ke badan air karena dapat menaikkan jumlah mikroorganisme dalam air. Bahan buangan anorganik merupakan limbah yang tidak dapat didegradasi oleh mikroorganisme. Bahan buangan ini berasal dari industri. Logam berat pada umumnya seperti tembaga, perak, seng, kadmium, air raksa, timah, kromium, besi, nikel, arsen, selenium, kobalt, mangan, dan aluminium.
2.4. Logam Berat
Secara gamblang, dalam konotasi keseharian kita beranggapan bahwa logam diidentikkan dengan besi, padat, berat, keras dan sulit dibentuk. Istilah logam biasanya diberikan kepada semua unsur-unsur kimia dengan ketentuan atau kaidah-kaidah tertentu. Unsur-unsur ini dalam kondisi suhu kamar, tidak selalu berbentuk padat melainkan ada yang berbentuk cair. Logam berat masih termasuk golongan logam dengan kriteria-kriteria yang sama dengan logam-logam lain. Perbedaannya terletak dari pengaruh yang dihasilkan bila logam berat ini berikatan atau masuk ke dalam tubuh organisme hidup. Sebagai contoh, bila unsur logam besi (Fe) masuk ke dalam tubuh, meski dalam jumlah agak berlebihan, biasanya tidak memberikan pengaruh yang begitu buruk terhadap tubuh. Karena unsur Fe dibutuhkan dalam darah untuk mengikat oksigen. Sedangkan unsur logam berat baik itu logam berat beracun yang dipentingkan seperti tembaga (Cu), bila masuk ke dalam tubuh dalam jumlah
tingkat kebutuhannya sangat dipentingkan maka logam-logam tersebut dinamakan sebagai logam-logam atau mineral essensial tubuh. Adapun logam di lingkungan perairan (hidrosfer) umumnya berada dalam bentuk ion, ada yang merupakan ion bebas, organologam , ion-ion kompleks dan bentuk lainnya (Palar, 1994).
Metabolisme logam dalam tubuh menyangkut katalisis dari protein aktif yang ion logamnya terikat erat dalam protein dan sulit untuk dilepaskan, hal ini melibatkan reaksi
katalitik dari enzim. Reaksi tersebut meliputi absorpsi logam tertentu yang diperlukan dan ekskresi logam lain yang tidak diperlukan, juga mengenai transportasi dan penyimpannya dalam tubuh. Transportasi ion logam diangkut melalui aliran darah ke hati yang kemudian bergabung dengan metaloenzim. Kemudian ion logam tersebut didistribusikan ke dalam jaringan yang memerlukannya. Protein sangat berperan dalam transportasi ini, terutama albumin yang biasanya dijumpai dalam jumlah besar dalam aliran darah dan dapat mengikat bermacam ion logam. Yang terpenting dalam ikatan logam dengan albumin ini ialah mudahnya melepaskan ion logam tersebut ke dalam jaringan yang membutuhkan, tetapi sebaliknya, ikatan ion logam dengan enzim (metaloenzim) tidak dapat melepaskan ion logam (irreversible) (Darmono, 1994).
a) Logam Kromium (Cr)
Logam kromium merupakan logam berat dengan berat atom 51,996 g/mol; berwarna abu-abu, tahan terhadap oksidasi meskipun pada suhu tinggi, mengkilat, keras, memiliki titik cair 1.857oC dan titik didih 2.672oC, bersifat paramagnetik (sedikit tertarik oleh medan magnet), membentuk senyawa-senyawa berwarna, memiliki beberapa bilangan oksidasi, yaitu +2, +3, dan +6, dan stabil pada bilangan oksidasi +3 (Weast, 1982). Senyawa kromium pada bilangan oksidasi +6 merupakan oksidator kuat (Sugiyarto, 2003).
Dalam larutan-larutan air, kromium membentuk tiga jenis ion; kation-kation kromium(II) dan kromium (III) dan anion kromat (dan dikromat) dalam mana keadaan oksidasi kromium
Penggunaan kromium dalam industri di bidang metalurgi untuk mencegah korosi, mengkilapkan logam, antara lain sebagai bahan komponen alloy, pelapisan krom, dan
wood treatment. Kromium dalam jumlah kecil digunakan sebagai water treatment, katalisator, safety matches, copy machine toner, photographic chemical, magnetic tapes, pelapis pada spare part kendaraan bermotor, dan stainless steel, yaitu campuran 18% Cr, 8% Ni, sedikit Mn, C, P, Si, dan Fe (Widowati, 2008). Logam kromium sangat tahan terhadap korosi, karena reaksi dengan udara menghasilkan Cr2O3 yang bersifat non-pori sehingga mampu melindungi logam yang terlapisi dari reaksi lebih lanjut. Dengan sifat logam yang tahan korosi, manfaat utama kromium yaitu sebagai pelapis logam atau baja. Selain itu, lapisan kromium juga menghasilkan warna yang mengkilap sehingga memberikan manfaat tambahan yaitu sebagai fungsi dekoratif. Pada pelapisan kromium melalui proses elektro kromium plating dapat dipakai Cr2O3 yang dilarutkan dalam H2SO4 sebagai elektrolit. Ion Cr3+ akan tereduksi menjadi logam kromium yang melapisi logam lain yang dipasang sebagai katoda. Jika logam langsung dilapisi dengan kromium, biasanya lapisan hasil ini mudah retak-retak. Untuk memperoleh lapisan yang baik, kuat, dan tidak retak-retak, logam yang akan dilapisi dengan kromium, sebelumnya dilapisi terlebih dahulu dengan logam tembaga dan nikel (Sugiyarto, 2003).
Industri elektroplating membuang sejumlah besar limbah Cr ke sungai. Leaching
lapisan tanah atas dan batuan merupakan sumber utama Cr alami menuju badan perairan. Limbah padat dari proses industri kromat dapat mencemari tanah dan akhrinya mencemari perairan (U.S. Environmental Protection Agency, 2006).
Kromium (III) merupakan mikronutrien bagi mahluk hidup, dibutuhkan dalam metabolisme hormon insulin dan pengaturan kadar glukosa darah. Sedangkan dalam jumlah berlebih Cr merupakan senyawa toksik (Widowati, 2008).
Kadar maksimum logam kromium yang diizinkan adalah 0,05 mg/L total kromium yang direkomendasikan sebagai air buangan (Dean. 1981). The Departement of Health and Human Sevices telah menetapkan bahwa Cr VI bersifat karsinogenik pada manusia. Sedangkan kromium (III) memiliki potensi yang sama dengan Cr (VI) dalam menimbulkan kanker
Sebagian besar kasus kanker dikarenakan oleh Cr (VI) yang larut dalam asam tetapi tidak larut dalam air (Klassen et al. 1986). Selain itu Cr (VI) bersifat toksik terhadap kulit, mata, alat pernafasan, alat pencernaan, serta bisa ditransfer ke embrio melalui plasenta (Widowati, 2008).
b) Logam Tembaga (Cu)
Tembaga dengan nama kimia cuprum dilambangkan dengan Cu. Unsur logam ini berbentuk kristal dengan warna kemerahan, yang lunak, dapat ditempa, dan liat, dengan berat atom 63,546 g/mol; nomor atom 29; titik lebur 1083,4 oC; titik didih 2567 oC (Weast, 1982). Tembaga terdapat dalam keadaan oksidasi +1 dan +2, namun hanya tembaga (II) yang stabil dan mendominasi dalam larutan air (Sugiyarto, 2003).
Unsur tembaga di alam bisa ditemukan dalam bentuk logam bebas, tetapi lebih banyak ditemukan dalam bentuk senyawa padat bentuk mineral. Tembaga bisa masuk ke lingkungan melalui jalur alamiah dan buatan. Tembaga tidak bisa diuraikan di alam sehingga Cu akan diakumulasi di dalam tanaman dan hewan melalui tanah. Tanah kaya Cu berpengaruh terhadap aktivitas mikroorganisme tanah dan cacing tanah, dan menyebabkan dekomposisi senyawa organik sehingga mengurangi kesuburan tanah dan mengurangi produksi (Widowati, 2008). Pengawasan terhadap pencemaran limbah B3 di Propinsi Sumatera Utara berdasarkan pengambilan sampel air di sekitar nuara Sungai Deli dan daerah sekitar Pelabuhan Perikanan Samudera (PPS) Belawan menunjukkan bahwa logam berat Cu dan Zn di semua stasiun telah melampaui ambang batas yang ditetapkan. Berdasarkan data dari Bapedalda Sumut tahun 2004, tingginya kandungan logam Cu di semua stasiun disebabkan oleh pembuangan limbah dari 24 industri yang terletak di sekitar daerah aliran sungai Belawan dan Deli. Jenis-jenis industri yang diduga sebagai penyumbang tingginya kadar logam Cu, salah satunya adalah industri pelapisan logam disamping industri baterai kering, alat-alat berat, dan kawat kasar (Ditjen P2SDKP, 2005).
Unsur Cu dibutuhkan manusia dalam jumlah kecil. Pada manusia , Cu dikelompokkan ke dalam metalloenzim dalam sistem metabolismenya (Palar.1994) . Batas aman untuk Cu terakumulasi dalam tubuh adalah 3 mg/L (Kep-51/MENLH/ 10/ 1995).
metalotionin. Apabila jumlah Cu telah melampaui batas aman, akan muncul toksisitas. Toksisitas Cu secara signifikan berasal dari kemampuan Cu menerima dan mendonasikan 1 elektron sehingga bisa mengubah oksidasi. Cu memiliki aktivitas katalitik yang dapat menghasilkan ion radikal bebas yang sangat reaktif, yaitu radikal bebas hidroksil sehingga menyebabkan stres oksidatif yang bisa menimbulkan berbagai macam penyakit. Daya racun yang dimiliki oleh logam Cu menduduki peringkat kedua setelah logam Hg.
c) Logam Nikel (Ni)
Nikel adalah logam berwarna putih perak dengan berat jenis 8,5 dan berat atom 58,71 g/mol; nomor atom 28; titik lebur 1453 oC; titik didih 2732 oC; kelarutan 8,902 g/L pada 25 o
C, terdapat dalam keadaan oksidasi 0, 1, 2, 3. Nikel merupakan logam yang resisten terhadap korosi dan oksidasi pada temperatur tinggi sehingga bisa digunakan untuk memproduksi stainless steel (Weast, 1982). Nikel sebagai paduan logam banyak digunakan di industri logam , berbagai macam baja, serta pelapisan logam. Nikel merupakan zat gizi esensial untuk beberapa jenis hewan dan manusia. Nikel terdapat dalam DNA dan RNA, berfungsi menstabilisasi struktur asam nukleat serta protein, mengatur kadar lipid dalam jaringan dan sebagai kofaktor berbagai enzim. Defisiensi Ni bisa mengakibatkan kerusakan hati dan alat tubuh lain (Widowati, W. 2008). Sunderman (1977) melaporkan bahwa defisiensi Ni dapat menyebabkan hambatan absorpsi Fe dalam usus sehingga menyebabkan anemia.
Pembuangan limbah yang mengandung Ni mengakibatkan pencemaran Ni pada air tanah, air, dan tanaman. Total Ni di dalam tanah bisa mencapai 5-500 ppm, sedangkan kadar Ni pada air tanah mencapai 0,005-0,05 ppm dan kadar Ni dalam tumbuhan tidak lebih dari 1 ppm (Surhendrayatna, 2002). Kanker hidung tampaknya merupakan jenis neoplasma utama. Tetapi Ni juga menginduksi kanker pada paru-paru, laring, lambung, dan barangkali juga di ginjal. Sedangkan pada hewan uji, diketahui bahwa paparan per oral dari garam Ni bisa mengakibatkan penurunan jumlah anak yang hidup per kelahiran serta penurunan berat badan
muncul setelah kontak dengan barang logam yang mengandung Ni, misalnya uang logam dan barang-barang perhiasan (Widowati, 2008).
2.5. Elektroplating
Elektroplating didefenisinikan sebagai perpindahan ion logam dengan bantuan arus
listrik melalui elektrolit sehingga ion logam mengendap pada benda padat konduktif membentuk lapisan logam. Prinsip dasar pada proses pelapisan logam adalah terjadinya reduksi dan oksidasi pada dua buah elektroda dengan syarat: adanya aliran listrik, adanya logam pelapis sebagai anoda, dan adanya logam yang dilapisi sebagai katoda dan eletrolit sebagai larutan penghantar arus listrik (Laurance, 1986). Lapisan logam yang mengendap disebut juga deposit. Sumber arus listrik searah dihubungkan dengan dua buah elektroda, yaitu elektroda yang dihubungkan dengan kutub negatif disebut katoda dan elektroda yang dihubungkan dengan kutub positif disebut anoda. Benda yang akan dilapisi harus bersifat konduktif atau menghantarkan arus listrik dan berfungsi sebagai katoda, disebut sebagai benda kerja. Pada anoda aktif digunakan anoda logam yang mempunyai kemurnian yang tinggi. Arus mengalir dari anoda menuju katoda melalalui elektrolit (Purwanto & Huda, 2005).
2.6. Pengolahan Limbah
Ada tiga cara pengolahan air limbah berdasarkan karakterisriknya yaitu: 1. Pengolahan limbah cair secara fisik
Bertujuan untuk menyisihkan atau bahan pencemar tersusupensi atau melayang yang berupa padatan dari dalam air limbah. Pengolahan secara fisik misalnya dengan penyaringan dan pengendapan. Aerasi adalah proses awal yang selalu dilakukan secara terbuka maupun injeksi udara. Proses penyaringan dimaksudkan untuk memisahkan padatan tersuspensi atau padatan
2. Pengolahan limbah cair secara kimia
Bertujuan untuk menghilangkan partikel-partikel yang tidak mudah mengendap (koloid), menetralkan limbah cair dengan cara menambahkan bahan kimia tertentu agar terjadi reaksi kimia untuk menyisihkan bahan polutan. Penambahan zat pengendap disertai dengan pengadukan cepat menyebabkan terjadinya penggumpalan, hasil akhir pengolahan biasanya merupakan endapan yang kemudian dipisahkan secara fisika.. Proses ini memiliki kelemahan, yaitu bagaimana mengambil unsur baru sebagai hasil reaksi yang terjadi. Contoh pengolahan
secara kimia lainnya seperti: oksidasi dan reduksi, netralisasi dan klorinasi, disinfektan (Sugiharto. 1987).
3. Pengolahan limbah cair secara biologi
Pengolahan secara biologi ini memanfaatkan mikroorganisme yang berada di dalam air untuk menguraikan bahan-bahan polutan. Pengolahan limbah cair secara biologi ini dipandang sebagai pengolahan yang paling murah dan efisien. Pengolahan ini digunakan untuk mengolah air limbah yang biodegradable.
2.7. Koagulasi dan Flokulasi
Istilah koagulasi kimia dipakai untuk semua reaksi dan mekanisme kimia dalam destabilisasi partikel koloid membentuk partikel yang berukuran lebih besar. Koagulasi adalah peristiwa destabilisasi partikel-partikel koloid dalam larutan, partikel-partikel tersebut membentuk lapisan secara kimia yang kemudian diikuti dengan flokulasi. Bahan yang dipakai untuk proses koagulasi dinamakan koagulan (Tchobanoglous, 2003).
Macam-macam koagulan yaitu: Al2(SO4)3 (Aluminium sulfat), NaAlO2 (Sodium aluminat), AlCl3 (Aluminium klorida), FeCl3 (Ferri clorida), FeSO4 (Ferro sulfat), Fe2(SO4)3 (Ferri sulfat), CuSO4 (Tembaga sulfat) dan ozon. Penggabungan beberapa koagulan dalam proses koagulasi juga dapat dilakukan seperti NaAlO2 + Al2(SO4)3 . 18 H2O (Laing, 1940).
Pada dasarnya partikel koloid selalu mempunyai muatan negatif, baik pada air alam maupun air buangan. Dalam hal ini, penambahan koagulan yang bermuatan positif akan menetralkan muatan muatan negatif dari koloid yang bermuatan negatif sehingga membentuk endapan (Robert, 1986). Pada proses koagulasi, ketika konsentrasi dari ion pusat di dalam medium dispersi adalah kecil, ketebalan lapisan rangkap listrik adalah besar. Dua partikel koloid yang berdekatan tidak dapat bersatu dengan yang lain disebabkan adanya lapisan rangkap listrik yang tebal, oleh karena itu koloidnya stabil. Namun ketika konsentrasi
ditingkatkan, kuatnya tarikan diantara muatan pertama dan ion pusatnya ditingkatkan sehingga menyebabkan lapisan rangkapnya berkurang. Lapisan ini kemudian ditekan secukupnya dengan dilanjutkan penambahan ion pusat.
Bentuk flok merupakan hasil dari penambahan koagulan, yang diikuti dengan flokulasi. Flokulasi adalah penggabungan dari partikel-partikel hasil koagulasi menjadi partikel yang lebih besar dan memiliki kecepatan mengendap yang lebih besar.
2.8. Elektrokoagulasi
Elektrokoagulasi merupakan metode pengolahan air dengan proses koagulasi dengan menggunakan arus listrik searah melalui peristiwa elektrokimia, yaitu gejala dekomposisi elektrolit, dimana salah satu elektrodanya adalah aluminium atau besi.
Dalam proses ini akan terjadi pembentukan koagulan yang terbentuk dari ion hidroksi dengan logam dari anoda dan terbentuknya gas hidrogen pada katoda (Vik et al, 1984) mendeskripsikan pengolahan limbah di London pada tahun 1889 dengan mencampurkan air laut dengan limbah yang kemudian dielektrolisis. Elektrokoagulasi menurut Ni’am (2007), merupakan proses penggumpalan dan pengendapan partikel-partikel halus dalam air menggunakan energy listrik. Proses elektrokoagulasi dilakukan pada bejana elektrolisis yang didalamnya terdapat dua buah elektroda sebagai penghantar listrik, yang tercelup dalam larutan elektrolit.
Sebuah reaktor elektrokoagulasi adalah sel elektrokimia dimana anoda (biasanya menggunakan aluminium atau besi) digunakan sebagai koagulan dan dihasilkannya gas hidrogen (pada katoda). Beberapa material elektroda dapat dibuat dari aluminium, besi,
stainless steel, dan platina.
Menurut Johannes (1978) reaksi yang terjadi pada elektroda tersebut adalah :
a) Reaksi pada Katoda
Pada katoda akan terjadi reaksi-reaksi reduksi terhadap kation, yang termasuk dalam kation ini adalah ion H+ dan ion logam.
1. Ion H+ dari suatu asam akan direduksi menjadi gas hidrogen yang akan bebas sebagai gelembung-gelembung gas.
Reaksi : 2H+ + 2e → H2
2. Jika larutan mengandung ion-ion logam alkali, alkali tanah, maka ion-ion ini tidak dapat direduksi dari larutan yang mengalami reduksi adalah pelarut (air) dan terbentuk gas-gas hidrogen (H2) pada katoda.
Reaksi : 2H2O + 2e → 2 OH- + H2
Dari daftar Eo (deret potensial logam/deret volta), maka akan diketahui bahwa reduksi terhadap air limbah lebih mudah berlangsung daripada reduksi terhadap pelarutnya (air). K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, Sb, Bi, Cu, Hg, Ag, Pt, Au.
3. Jika larutan mengandung ion-ion logam lain, maka ion-ion logam akan direduksi menjadi logamnya dan terdapat pada katoda.
b) Reaksi pada Anoda
1. Anoda yang digunakan logam aluminium akan teroksidasi : Reaksi : Al3+ + 3 H2O → Al(OH)3 + 3H+ + 3e
2. Ion OH- dari basa akan mengalami oksidasi membentuk gas oksigen (O2) : Reaksi : 4OH- → 2H2O + O2 + 4e
3. Anion-anion lain seperti (SO42-, SO3-) tidak dapat dioksidasi dari larutan, yang akan mengalami oksidasi adalah pelarutnya (H2O) membentuk gas O2 pada anoda.
Dari reaksi-reaksi yang terjadi dalam proses elektrokoagulasi, maka pada katoda akan dihasilkan gas hidrogen dan reaksi ion logamnya. Sedangkan pada anoda akan dihasilkan gas halogen dan pengendapan flok-flok yang terbentuk. Proses elektrokoagulasi melibatkan sifat dari bahan polutan yang ada dalam larutan, kecepatan untuk terkoagulasi didasarkan pada jari-jari atom dari polutan yang akan dihilangkan. Logam yang jari-jari atomnya lebih besar akan terlebih dahulu terkoagulasi.
Untuk pertimbangan penentuan penggunaan elektrokoagulasi maka Mollah (2001) telah memberikan gambaran tentang keuntungan dan kerugiannya.
Keuntungan dari penggunaan elektrokoagulasi adalah sebagai berikut:
1. Elektrokoagulasi membutuhkan peralatan yang sederhana dan mudah dioperasikan.
2. Air yang diolah dengan elektrokoagulasi menghasilkan effluen yang jernih, tidak berwarna,dan tidak berbau.
3. Flok yang terbentuk pada elektrokoagulasi memiliki kesamaan dengan flok yang terbentuk dari koagulasi kimia. Perbedaannya adalah flok dari elektrokoagulasi berukuran lebih besar, lebih stabil, dan mudah dipisahkan secara cepat dengan filtrasi.
4. Effluen yang dihasilkan elektrokoagulasi mengandung TDS (Total Dissolved Solid) dalam jumlah yang lebih sedikit dibandingkan dengan pengolahan kimiawi..
5. Proses elektrokoagulasi mempunyai keuntungan dalam mengolah partikel-partikel koloid yang berukuran sangat kecil, sebab diaplikasikan medan elektrik dengan gerak yang lebih cepat, sehingga proses koagulasi lebih mudah terjadi.
6. Proses elektrokoagulasi jauh dari penggunaan bahan kimia sehingga tidak bermasalah dengan netralisasi kelebihan bahan kimia, dan tidak ada polusi yang kedua yang disebabkan senyawa-senyawa kimia yang ditambahkan pada konsentrasi tinggi.
7. Produksi gelembung-gelembung gas selama elektrolisis dapat membawa polutan-polutan yang diolah untuk naik ke permukaan (flotasi) dimana flok tersebut dapat dengan mudah terkonsentrasi, dikumpulkan, dan dipisahkan.
8. Perawatan reaktor elektrokoagulasi lebih mudah karena proses elektrolisis yang terjadi cukup dikontrol dari pemakaian listrik tanpa perlu memindahkan bagian-bagian di
dalamnya.
Sedangkan kerugian dari penggunaan elektrokoagulasi adalah :
1. Elektroda yang digunakan dalam proses pengolahan ini harus diganti secara teratur. 2. Terbentuknya lapisan di elektroda dapat mengurangi efisiensi pengolahan.
3. Penggunaan listrik kadangkala lebih mahal pada beberapa daerah.
4. Teknologi ini membutuhkan konduktivitas yang tinggi pada air limbah yang diolah
2.9. Faktor-Faktor yang Mempengaruhi Koagulasi dan Flokulasi.
Proses koagulasi-flokulasi optimum , dapat dicapai dengan pengaturan kondisi-kondisi tertentu seperti :
a. Pengaruh Temperatur Air
Apabila temperatur menurun maka viskositas air akan meningkat sehingga kecepatan mengendap flok akan menurun. Proses koagulasi-flokulasi lebih mudah dilakukan pada temperatur tinggi daripada temperatur rendah.
b. Pengaruh pH
Koagulasi akan berjalan dengan baik bila berada pada rentang pH optimum. Alkalinitas air dapat membantu proses pembentukan flok dengan peranannya memproduksi ion hidroksida pada reaksi hidroksida koagulan, seperti penambahan Na(OH), Ca(OH)2, CaO yang sekaligus sebagai pengatur pH sebelum koagulasi dilakukan.
c. Jenis Koagulan
Koagulan yang dipilih didasarkan pada penelitian perbandingan performa koagulan dan dilihat dari segi ekonomisnya juga.
d. Pengaruh Tingkat Kekeruhan Air Baku
Pada tingkat kekeruhan yang rendah, proses destabilisasi akan sukar terjadi, dan juga dilihat dari dosis koagulan yang dipakai.
sangat tinggi akan diperlukan koagulan yang lebih sedikit karena besarnya tumbukan antar partikel-partikel koloid yang telah dikoagulasi. Selain itu bervariasinya distribusi ukuran partikel akan memudahkan terjadinya koagulasi.
e. Pengaruh Jumlah Garam-Garam Terlarut Dalam Air
Pengaruh anion lebih besar daripada kation, sehingga ion seperti Natrium, Kalsium, dan Magnesium tidak memberikan pengaruh yang berarti terhadap proses koagulasi.
Sedangkan ion-ion negatif memperbesar daerah pH optimum koagulasi yang tergantung juga pada valensi ion-ion tersebut. Ion-ion monovalen seperti klorida, nitrat tidak memberikan pengaruh yang berarti dibanding ion-ion sulfat, pospat, dsb.
f. Pengaruh Kondisi Pengadukan
Pengaturan kondisi pengadukan dapat dilakukan dengan mengatur gradien kecepatan dan lamanya waktu pengadukan, proses koagulasi yang baik dilakukan dengan mengatur kecepatan dan waktu pengadukan secara tepat, karena dengan kecepatan pengadukan yang terlalu besar akan mengakibatkan pecahnya flok sehingga proses koagulasi tidak berhasil (Nainggolan, 2011).
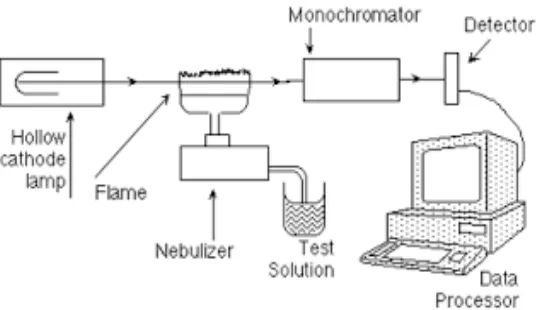
2.10. Spektrofotometri Serapan Atom
Spektrofotometer Serapan Atom (SSA) adalah suatu metode pengukuran kuantitatif suatu unsur yang terdapat dalam suatu cuplikan berdasarkan penerapan cahaya pada panjang gelombang tertentu oleh atom-atom bentuk gas dalam keadaan dasar. Jika cahaya dengan panjang gelombang resonansi dilewatkan, nyala yang mengandung atom-atom yang bersangkutan, maka sebagian cahaya itu akan diserap dan jauhnya penyerapan akan berbanding lurus dengan atom keadaan dasar yang berada dalam nyala. Metode ini digunakan untuk penetapan sejumlah unsur, kebanyakan logam, dan berbagai sampel. (Mulja,M.1995). Spektrofotometri terdiri dari sumber sinar (biasanya lampu katoda berongga yang diisi
Gambar 1. Bagan Alat Spektrofotometer Serapan Atom
Berbagai faktor dapat mempengaruhi pancaran nyala suatu unsur tertentu dan menyebabkan gangguan pada penetapan konsentrasi unsur. Gangguan ini dapat berupa gangguan spektral dan gangguan kimia. Gangguan spektral dalam AAS timbul terutama dari tumpang tindih antara frekuensi-frekuensi garis resonansi yang terpilih dengan garis-garis yang dipancarkan oleh sesuatu unsur lain. Gangguan spektral lebih mungkin terjadi apabila emisi gas unsur yang akan ditetapkan tersebut dan emisi garis yang disebabkan zat-zat pengganggu
berdekatan panjang gelombangnya. Gangguan ini dapat diatasi dengan daya pisah instrumen yang lebih baik, menggunakan prisma sebagai pengganti filter misalnya.
BAB 3
METODE PENELITIAN
3.1. Bahan
- Limbah cair laboratorium elektroplating Politeknik Negeri Medan
- NaOH(s) E’Merck
- Na2S2O5(s) E’Merck - Akuades
3.2. Alat
- Gelas Beker pyrex
- Gelas ukur pyrex
- Neraca analitis (Presisi 0,001 g) Mettler PM 2000 - Kabel tembaga
- Stopwatch
- Indikator Universal
- Adaptor 3-12 V/1,5 A BSTech
- Elektroda aluminium teknis
- Spektrofotometer Serapan Atom Varian AA 240 FS - Hotplate Strirer
- Kertas Saring Biasa
3.3. Prosedur Penelitian
3.3.1. Pembuatan Larutan Standar Logam Kromium 100 mg/L
Sebanyak 10 mL larutan induk logam kromium 1000 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan garis batas dan diaduk sampai homogen.
3.3.2. Pembuatan Larutan Standar Logam Kromium 10 mg/L
3.3.3. Pembuatan Larutan Seri Standar Logam Kromium
Sebanyak 1, 2, 3, 4, 5 mL larutan induk logam kromium 10 mg/L dimasukkan ke dalam 5 buah labu takar 50 mL lalu kemudian diencerkan dengan akuades sampai garis tanda dan diaduk hingga homogen sehingga diperoleh larutan seri standar logam kromium 0,2 ; 0,4 ; 0,6 ; 0,8 ; 1 mg/L.
3.3.4. Pembuatan Kurva Kalibrasi Logam Kromium
Larutan seri standar logam kromium 0,2 mg/L dibuat pada pH 2-4 kemudian diukur absorbansinya pada panjang gelombang 357,9 nm. Perlakuan dilakukan sebanyak 3 kali dan dilakukan hal yang sama terhadap larutan seri standar 0,4 ; 0,6 ; 0,8 ; dan 1 mg/L.
3.3.5. Pembuatan Larutan Standar Logam Tembaga 100 mg/L
Sebanyak 10 mL larutan induk logam tembaga 1000 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan garis batas dan diaduk sampai homogen.
3.3.6. Pembuatan Larutan Standar Logam Tembaga 10 mg/L
Sebanyak 10 mL larutan induk logam tembaga 100 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades sampai garis batas dan diaduk sampai homogen.
3.3.7. Pembuatan Larutan Seri Standar Logam Tembaga
diaduk hingga homogen sehingga diperoleh larutan seri standar logam tembaga 0,2 ; 0,4 ; 0,6 ; 0,8 ; 1 mg/L.
3.3.8. Pembuatan Kurva Kalibrasi Logam Tembaga
Larutan seri standar logam tembaga 0,2 mg/L dibuat pada pH 2-4 kemudian diukur
absorbansinya pada panjang gelombang 324,8 nm. Perlakuan dilakukan sebanyak 3 kali dan dilakukan hal yang sama terhadap larutan seri standar 0,4 ; 0,6 ; 0,8 ; dan 1 mg/L.
3.3.9. Pembuatan Larutan Standar Logam Nikel 100 mg/L
Sebanyak 10 mL larutan induk logam nikel 1000 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan garis batas dan diaduk sampai homogen.
3.3.10. Pembuatan Larutan Standar Logam Nikel 10 mg/L
Sebanyak 10 mL larutan induk logam nikel 100 mg/L dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades sampai garis batas dan diaduk sampai homogen.
3.3.11. Pembuatan Larutan Seri Standar Logam Nikel
3.3.12. Pembuatan Kurva Kalibrasi Logam Nikel
Larutan seri standar logam kromium 0,2 mg/L dibuat pada pH 2-4 kemudian diukur absorbansinya pada panjang gelombang 232,0 nm. Perlakuan dilakukan sebanyak 3 kali dan dilakukan hal yang sama terhadap larutan seri standar 0,4 ; 0,6 ; 0,8 ; dan 1 mg/L.
3.3.13. Elektrokoagulasi Larutan Limbah
Sebanyak 1 L sampel dimasukkan ke dalam gelas beker, ditambahkan sebanyak 2 g Na2S2O5 dan diatur pH hingga 7 kemudian elektroda yang telah dirangkai dicelupkan ke dalam larutan sampel sambil dilakukan pengadukan dengan menggunakan hotplate stirer sampai 60 menit. Setiap 15 menit sekali diambil filtrat dengan memisahkan endapan yang terbentuk. Sehingga
3.3.14. Rangkaian Alat
Adaptor 12 V
dihubungkan dengan elektroda aluminium
Rangkaian alat
dihubungkan dengan kabel tembaga
3.4. Bagan Penelitian
1 L limbah cair
dimasukkan ke dalam wadah sampel
ditambahkan NaOH hingga pH 7
ditambahkan sebanyak 2 gram Na2S2O5
dielektrokoagulasi selama 15, 30, 45, dan 60 menit
dibiarkan hingga seluruh endapan turun ke dasar wadah
diuji kadar logam Cr, Cu, dan Ni dalam filtrat
dengan menggunakan Spektrofotometri Serapan Atom
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
[image:40.595.72.473.334.410.2]Kadar kromium dalam limbah cair elektroplating dapat ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusikan harga Y (absorbansi) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi sehingga diperoleh konsentrasi logam dalam air limbah sebagai berikut :
Tabel 1. Konsentrasi Logam Kromium, Tembaga, dan Nikel dalam Limbah CairElektroplating Politeknik Negeri Medan
Jenis Logam Bacaan Absorbansi (A) Absorbansi Rata-Rata
Kadar (mg/L)
A1 A2 A3
Kromium (Cr) 0,0352 0,0346 0,0343 0,0347 64,5941 Tembaga (Cu) 0,2430 0,2439 0,2438 0,2436 251,8272
Nikel (Ni) 0,0685 0,0679 0,0675 0,0680 125,3418
Catatan : dilakukan pengenceran terhadap limbah sebesar 200 kali sehingga diperoleh konsentrasi sebenarnya seperti tertera pada tabel di atas.
4.1.1. Penentuan Kadar Logam Kromium Setelah Elektrokoagulasi
Kadar kromium ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusikan nilai Y (absorbansi) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi Y = 0,08685 (X) + 0,00665 sehingga diperoleh konsentrasi Kromium.
Tabel 2. Penentuan konsentrasi logam Kromium hasil elektrokoagulasi pH 7 dengan variasi waktu kontak
Waktu Kontak ( menit )
Ulangan Bacaan Absorbansi ( A )
Rata-Rata Konsentrasi
( mg/L)
1 2 3
15 0,0051 0,0049 0,0052 0,0178
30 0,0024 0,0022 0,0024 0,0501
45 0,0014 0,0014 0,0015 0,0604
[image:40.595.72.477.637.739.2]4.1.2. Penentuan Kadar Logam Tembaga setelah Elektrokoagulasi
Kadar tembaga ditentukan dengan menggunakan metode kurva kalibrasi dengan mensubstitusikan nilai Y (absorbansi) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi Y = 0,1921 (X) + 0,0016 sehingga diperoleh konsentrasi Tembaga.
Tabel 3. Penentuan konsentrasi logam Tembaga hasil elektrokoagulasi pH 7dengan variasi waktu kontak
Waktu Kontak ( menit )
Ulangan Bacaan Absorbansi ( A )
Rata-Rata Konsentrasi ( mg/L)
1 2 3
15 0,2908 0,2901 0,2902 15,0276
30 0,1490 0,1490 0,1486 7,6616
45 0,0861 0,0863 0,0864 4.4029
60 0,0801 0,0805 0,0808 0,4101
4.1.3. Penentuan Kadar Logam Nikel setelah Elektrokoagulasi
Kadar Nikel ditentukan dengan menggunakan metode kurva kalibrasi dengan
mensubstitusikan nilai Y (absorbansi) yang diperoleh dari hasil pengukuran terhadap garis regresi dan kurva kalibrasi Y = 0,1078 (X) + 0,0002 sehingga diperoleh konsentrasi Nikel. Tabel 4. Penentuan konsentrasi logam Nikel hasil elektrokoagulasi pH 7 dengan variasi
waktu kontak
Waktu Kontak ( menit )
Ulangan Bacaan Absorbansi ( A )
Rata-Rata Konsentrasi
( mg/L)
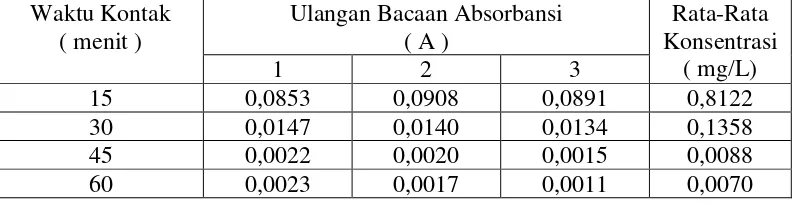
1 2 3
15 0,0853 0,0908 0,0891 0,8122
30 0,0147 0,0140 0,0134 0,1358
45 0,0022 0,0020 0,0015 0,0088
60 0,0023 0,0017 0,0011 0,0070
4.2. Persentase Penurunan Kadar Logam Kromium, Tembaga, dan Nikel
Persentase penurunan kadar logam dapat ditentukan dengan formula berikut ini :
��������������������ℎ − �������������ℎ�������ℎ
��������������������ℎ × 100 %
[image:41.595.103.495.225.325.2] [image:41.595.73.472.497.600.2]=
5941 , 64
0178 , 0 5941 ,
64 −
x 100 %
= 99,902 %
[image:42.595.92.501.222.309.2]Dengan cara yang sama dihitung persentase penurunan kadar logam Cr, Cu, Ni pada perlakuan lainnya sehingga diperoleh hasil seperti pada tabel berikut ini:
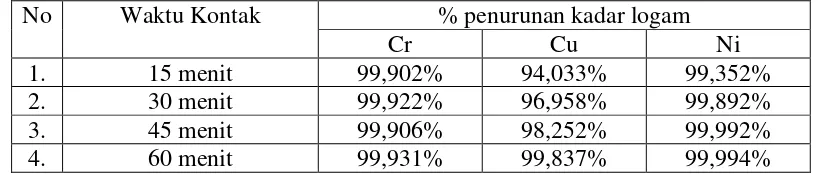
Tabel 5. Persentase Penurunan Kadar Logam
No Waktu Kontak % penurunan kadar logam
Cr Cu Ni
1. 15 menit 99,902% 94,033% 99,352%
2. 30 menit 99,922% 96,958% 99,892%
3. 45 menit 99,906% 98,252% 99,992%
4. 60 menit 99,931% 99,837% 99,994%
4.3. Pembahasan
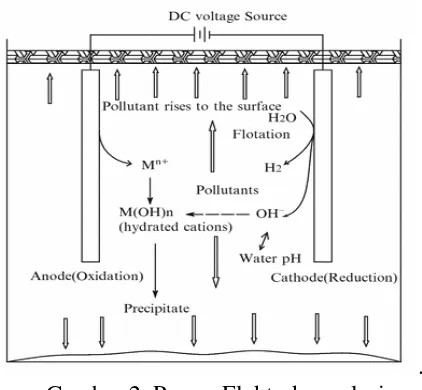
Elektrokoagulasi adalah metode koagulasi dengan memakai arus listrik searah (arus DC) melalui proses elektrokimia. Penelitian dengan menggunakan limbah cair Laboratorium Elektroplating Poleteknik Negeri Medan dengan parameter yang diamati adalah penurunan konsentrasi logam berat yang terdapat dalam air limbah. Kadar logam Cr, Cu, dan Ni diperiksa kadarnya terlebih dahulu sebelum pengolahan. Peneliti sebelumnya Ridwan Harahap telah berhasil mengolah limbah PT. industri karet dengan menurunkan konsentrasi logam Zn sebesar 99,56% dengan pH yang paling optimum yaitu waktu kontak 60 menit pada pH 7. Sehingga proses elektrokoagulasi pada penelitian ini cukup dilakukan pada pH 7, pH larutan akan menyediakan hidroksida yang akan menggumpalkan polutan bersama koagulan yang diproduksi pada logam (anoda), semakin berkurang keasaman maka hidroksida dalam larutan semakin banyak.
. Gambar 2. Proses Elektrokoagulasi
Anoda logam aluminium akan teroksidasi :
Reaksi : Al3+ + 3 H2O → Al(OH)3 + 3H+ + 3e
Pada katoda ion H+ dari suatu asam akan direduksi menjadi gas hidrogen yang akan bebas sebagai gelembung-gelembung gas.
Reaksi : 2H+ + 2e → H2
Flok yang terbentuk dari Al(OH)3 akan mengikat logam Cu, dan Ni sedangkan Cr (VI) terlebih dahulu direduksi menjadi Cr III dengan menggunakan Na2S2O5 sehingga diadsorpsi oleh Al(OH)3 membentuk flok. Kemudian flok yang terbentuk akan memisah dari cairannya melalui pengendapan. Untuk memperoleh cairannya dapat dilakukan penyaringan.
Hasil analisis setelah melalui proses elektrokoagulasi dengan menggunakan plat Al-Al yaitu menunjukkan bahwa penurunan kadar logam Cr, Cu, dan Ni pada air limbah
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Pada proses elektrokoagulasi 1 liter air limbah dengan menggunakan plat aluminium dan
memakai tegangan listrik sebesar 12 volt memberikan hasil yang baik, dengan kadar logam yang tinggi berhasil diturunkan sehingga sesuai dengan syarat air buangan industri. Dari hasil penelitian diperoleh bahwa penurunan kadar logam kromium pada menit ke 15, 30, 45, 60 berturut-turut sebesar 99,902%; 99,922%; 99,906%; 99,931%. Penurunan kadar logam tembaga pada menit ke 15, 30, 45, 60 berturut-turut sebesar 94,033%; 96,958%; 98,252%; 99,837%. Dan penurunan kadar logam nikel pada menit ke 15, 30, 45, 60 berturut-turut sebesar 99,352%; 99,892%; 99,992%; 99,994%.
Berdasarkan hasil penelitian dapat diambil kesimpulan bahwa penurunan kadar logam yang paling baik dicapai pada menit ke 60 dengan persentase penurunan: kromium (Cr) mengalami penurunan hingga 99,931 % dengan kadar 0,0443 mg/L, tembaga (Cu) mengalami penurunan hingga 99,837% dengan kadar 0,4101 mg/L, sedangkan nikel (Ni) mengalami penurunan hingga 99,994% dengan kadar 0,007 mg/L.
5.2. Saran
DAFTAR PUSTAKA
Darmono. 1995. Logam Dalam Sistem Biologi Mahluk Hidup. Jakarta: UI-Press.
Dean, R. 1981. Water Reuse: Problem And Solutions. New York: Academic Press.
Ginting, P. 1992. Mencegah dan Mengendalikan PencemaranIndustri. Cetakan Pertama. Jakarta: Sinar Harapan.
Hartomo, A. 1995. Mengenal Pelapisan Logam (Elektroplating). Bandung: Andi Offset.
Holt, P. 2006. Electrocoagulation As A Wastewater Treatment. New South Wales: Chemical Engineering.
Laing, D. 1940. Water Treatment Hand Book. New York: Jhon Wiley & Sons, Inc.
Laurance, L. T. 1986. Process Modification For Industrial Polution Source Reduction. 2nd Edition. Michigan: Lewis Publisher.
Lu, F. C. 1994. Toksikologi Dasar. Edisi Kedua. Jakarta: UI-Press.
Mollah, M. Y. 2001. Electrocoagulation – Science and Aplications. USA: Lamar University, Beaumont.
Mulja, M. 1995. Analisi Instrumental. Surabaya: Aiirlangga University Press.
Nainggolan, H. 2011. Pengolahan Limbah Cair Industri Perkebunan dan Air Gambut Menjadi Air Bersih. Medan: Usu Press.
Palar, H. 1994. Pencemaran dan Toksikologi Logam Berat. Jakarta: Penerbit Rineka Cipta.
Proste, R. L. 1997. Theory and Practice of Water and Wastewater Treatment. New York: John Willey & Sons, Inc.
Purwanto dan Huda. 2005. Teknologi Industri Elektroplating. Semarang: Badan Penerbit Universitas Diponegoro.
Robert, W. 1986. Handbook of Public Water System. New York: Van Nostrand Reinhold.
Rohman, A. 2007. Kimia Farmasi. Cetakan Pertama. Yogyakarta: Pustaka Pelajar.
Saleem, M. 2011. Electrocoagulation For The Treatment Of Wastewater For Reuse In Irrigation And Plantation. Saudi Arabia: King Fahd University of Petroleum & Mineral.
Sugiyarto, K. S. 2003. Kimia Anotganik II. Common Textbook. Yokyakarta: Universitas Negeri Yogyakarta.
Surhendrayatna. 2002. Heavy Metal Bioremoval by Microorganisms: A Literature Study. Institute for Science and Technology Studies (ISTECS)- Chapter Japan.
Tchobanoglous, G., 2003. Wastewater Engineering: Treatment and Reuse. New York: Mc Graw Hill.
US Environmental Protection Agency. 2000. Nickel Compound Vik, 1984. Electrocoagulation of Potable Water, Water Research.
Vogel, A. I. 1979. Texbook of Macro and Semimicro Qualitative Inorganic Analysis. London: Butler and Tanner Ltd.
Weast, R. C. 1982. Handbook of Chemistry and Physics. 63rd Edition. Florida: CRC Press, Inc.
WHO. 1981. Guidelines for drinkingWater Quality,Health Criteria and Other Supporting Information.
Widowati, W. 2008. Efek Toksik Logam. Pencegahan dan Penanggulangan Pencemaran. Bandung: Penerbit Andi Yogyakarta.
Wikipedia.Chromium. The Free Encyclopedi
Wikipedia. Copper. The Free Encyclopedia
LAMPIRAN A. Perhitungan Hasil Elektrokoagulasi
A1. Tabel. Penurunan Persamaan Garis Regresi dengan Metode Least Square untuk logam kromium
No x y x2 y2 xy
1. 0,2000 0,0223 0,0400 0,0005 0,00446
2. 0,4000 0,0412 0,1600 0,0017 0,01648
3. 0,6000 0,0624 0,3600 0,0039 0,03744
4. 0,8000 0,0763 0,6400 0,0058 0,06104
5. 1,0000 0,0916 1,0000 0,0084 0,09160
∑ 3,0000 0,2938 2,2000 0,0203 0,21102
Keterangan : x = konsentrasi y = absorbansi
n x
x=
∑
=5 3
= 0,6000
y =
n y
∑
= 5 2938 , 0 = 0,05876Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis : y = ax + b
dengan (a) = slope (b) = intersep
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square sebagai berikut :
a =
∑
∑
∑
∑ ∑
− − 2 2 ) ( ) ( ) )( ( ) ( x x n y x xy na = 2
) 3 ( ) 2 , 2 ( 5 ) 2938 , 0 )( 3 ( ) 21102 , 0 ( 5 − −
a =
9 11 8814 , 0 0551 , 0 − −
a = 0,08685 2
1737 ,
0 =
Harga intersep (b) diperoleh melalui substitusi harga (a) ke persamaan :
y = ax + b b = y - ax
= 0,05876 – (0,08685)(0,6) = 0,05876 – 0,05211 = 0,00665
harga intersep = 0,00665
r = 2 1 2 2 2
2 ( )
)( ) ( ( ) )( ( − − −
∑
∑
∑
∑
∑
∑ ∑
n y y n x x n y x xy = 2 1 2 2 ) 5 ) 2938 , 0 ( 0203 , 0 )( 5 ) 3 ( 2 , 2 ( 5 ) 2938 , 0 )( 3 ( 21102 , 0 − − − =[
]
21 01726 , 0 0203 , 0 )( 8 , 1 2 , 2 ( 17628 , 0 21102 , 0 − − − =
[
]
21 001216 , 0 03474 , 0 = 03487 , 0 03474 , 0
= 0,9962
A2. Tabel. Penurunan Persamaan Garis Regresi dengan Metode Least Square untuk logam tembaga
No x y x2 y2 xy
1. 0,2000 0,0393 0,0400 0,0015 0,0079
2. 0,4000 0,0791 0,1600 0,0062 0,0316
3. 0,6000 0,1182 0,3600 0,0139 0,0709
4. 0,8000 0.1547 0,6400 0,0239 0,1238
5. 1,0000 0,1936 1,0000 0,0375 0,1936
∑ 3,0000 0,5849 2,2000 0,0830 0,4278
Keterangan : x = konsentrasi y = absorbansi
n x
x=
∑
=5 3
= 0,6000
y =
n y
∑
= 5 5849 , 0 = 0,1169Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis : y = ax + b
dengan (a) = slope (b) = intersep
a =
∑
∑
∑
∑ ∑
− − 2 2 ) ( ) ( ) )( ( ) ( x x n y x xy na = 2
) 3 ( ) 2 , 2 ( 5 ) 5849 , 0 )( 3 ( ) 4278 , 0 ( 5 − −
a =
9 11 7547 , 1 139 , 2 − −
a = 0,1921 2
3843 , 0
=
Maka harga slope yang diperoleh = 0,1921
Harga intersep (b) diperoleh melalui substitusi harga (a) ke persamaan :
y = ax + b b = y - ax
= 0,1169 - 0,1921 (0,6000) = 0,1169 - 0,1153
= 0,0017
Maka persamaan garis regresi yang diperoleh adalah : y = 0,1921 (x) + 0,0017
Perhitungan Koefisien Korelasi
r =
2 1 2 2 2 2 ) ) ( )( ) ( ( ) )( ( − − −
∑
∑
∑
∑
∑
∑ ∑
n y y n x x n y x xy = 2 1 2 2 ) 5 ) 5849 , 0 ( 0830 , 0 )( 5 ) 3 ( 2 , 2 ( 5 ) 5849 , 0 )( 3 ( 4278 , 0 − − − = 2 1 2 5 ) 5849 , 0 ( 0830 , 0 )( 5 9 2 , 2 ( 5 7547 , 1 4278 , 0 − − − =[
]
21 ) 01476 , 0 )( 4 , 0 ( 07686 , 0 =
[
]
21 005904 , 0 07686 , 0 = 07688 , 0 07686 , 0
A3. Tabel . Penurunan Persamaan Garis Regresi dengan Metode Least Square untuk logam nikel
No x y x2 y2 xy
1. 0,2000 0,0199 0,0400 0,0004 0,0039
2. 0,4000 0,0443 0,1600 0,0019 0,0177
3. 0,6000 0,0653 0,3600 0,0043 0,0392
4. 0,8000 0,0874 0,6400 0,0076 0,0699
5. 1,0000 0,1064 1,0000 0,0113 0,1064
∑ 3,0000 0,3233 2,2000 0,0225 0,2371
Keterangan : x = konsentrasi y = absorbansi
n x
x=
∑
=5 3
= 0,6000
y =
n y
∑
= 5 3233 , 0 = 0,0647Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis : y = ax + b
dengan (a) = slope (b) = intersep
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square sebagai berikut :
a =
∑
∑
∑
∑ ∑
− − 2 2 ) ( ) ( ) )( ( ) ( x x n y x xy na = 2
) 3 ( ) 2 , 2 ( 5 ) 3233 , 0 )( 3 ( ) 2371 , 0 ( 5 − −
a =
9 11 9699 , 0 1855 , 1 − −
a = 0,1078 2
2156 ,
0 =
Maka harga slope yang diperoleh = 0,1078
Harga intersep (b) diperoleh melalui substitusi harga (a) ke persamaan :
y = ax + b b = y - ax
= 0,0647 - 0,1078 (0,6000) = 0,0647 – 0,06468
= 0,00002
Maka persamaan garis regresi yang diperoleh adalah : y = 0,1078 (x) + 0,00002
r = 2 1 2 2 2 2 ) ) ( )( ) ( ( ) )( ( − − −
∑
∑
∑
∑
∑
∑ ∑
n y y n x x n y x xy = 2 1 2 2 ) 5 ) 3233 , 0 ( ) 0255 , 0 )( 5 ) 3 ( 2 , 2 ( 5 ) 3233 , 0 )( 3 ( 2371 , 0 − − − =[
]
21 ) 0209 , 0 0255 , 0 )( 4 , 0 ( 19398 , 0 2371 , 0 − − = 04313 , 0 04312 , 0
LAMPIRAN B. Data Hasil Pengukuran Absorbansi Larutan Standar
B1. Kurva kalibrasi logam kromium
No Kadar (ppm) Absorbansi (A)
1. 0,2000 0,0223
2. 0,4000 0,0412
3. 0,6000 0,0624
4. 0,8000 0,0763
5. 1,0000 0,0916
∑ 3,0000 0,2938
y = 0,091x + 0,004 R² = 0,993
0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09
0 0,2 0,4 0,6 0,8 1
A
bs
o
r
ba
ns
i
Konsentrasi (ppm)
Kurva kalibrasi logam Cr
B2. Kurva kalibrasi logam kromium
No Kadar (ppm) Absorbansi (A)
1. 0,2000 0,0393
2. 0,4000 0,0791
3. 0,6000 0,1182
4. 0,8000 0.1547
5. 1,0000 0,1936
∑ 3,0000 0,5849
y = 0,192x + 0,001 R² = 0,999
0 0,05 0,1 0,15 0,2 0,25
0 0,2 0,4 0,6 0,8 1 1,2
A
bs
o
r
ba
ns
i
Konsentrasi (ppm)
Kurva Kalibrasi Logam Cu
B3. Kurva kalibrasi logam nikel
No Kadar (ppm) Absorbansi (A)
1. 0,2000 0,0199
2. 0,4000 0,0443
3. 0,6000 0,0653
4. 0,8000 0,0874
5. 1,0000 0,1064
∑ 3,0000 0,3233
y = 0,110x - 0,000 R² = 0,999
-0,01 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,1
0 0,2 0,4 0,6 0,8 1
A
bs
o
r
ba
ns
i
Konsentrasi (ppm)
Kurva Kalibrasi Logam Nikel
LAMPIRAN D. Parameter Baku Mutu Limbah Cair
KEPUTUSAN MENTERI NEGARA LINGKUNGAN HIDUP NOMOR : KEP-51 / MENLH / 10 / 1995
TENTANG : BAKU MUTU LIMBAH CAIR BAGI KEGIATAN INDUSTRI TANGGAL : 23 OKTOBER 1995
BAKU MUTU LIMBAH CAIR
NO PARAMETER SATUAN GOLONGAN BAKU
MUTU LIMBAH CAIR FISIKA
1 Temperatur derajat C 38 40
2 Zat padat larut mg/L 2000 4000
3 Zat padat tersuspensi mg/L 200 400
KIMIA
1 Ph 6,0 sampai 9,0
2 Besi terlarut (Fe) mg/L 5 10
3 Mangan terlarut (Mn) mg/L 2 5
4 Barium (Ba) mg/L 2 3
5 Tembaga (Cu) mg/L 2 3
6 Seng (Zn) mg/L 5 10
7 Krom Heksavalen (Cr6+) mg/L 0,1 0,5
8 Krom Total (Cr) mg/L 0,5 1
9 Cadmium (Cd) mg/L 0,05 0,1
10 Raksa (Hg) mg/L 0,002 0,005
11 Timbal (Pb) mg/L 0,1 1
12 Stanum mg/L 2 3
13 Arsen mg/L 0,1 0,5
14 Selenium mg/L 0,05 0,5
15 Nikel (Ni) mg/L 0,2 0,5
16 Kobalt (Co) mg/L 0,4 0,6
17 Sianida (CN) mg/L 0,05 0,5
18 Sulfida (H2S) mg/L 0,05 0,1
19 Flourida (F) mg/L 2 3
20 Klorin Bebas (Cl2) mg/L 1 2
21 Amonia bebas (NH3-N) mg/L 1 5
22 Nitrat (NO3-N) mg/L 20 30
23 Nitrit (NO2-N) mg/L 1 3
24 BOD mg/L 50 150
25 COD mg/L 100 300
26 Senyawa aktif biru metilen mg/L 5 10
27 Fenol mg/L 0,5 1
28 Minyak Nabati mg/L 5 10
29 Minyak Mineral mg/L 10 50
30 Radioaktivitas**) - - -
Catatan :
* Untuk memenuhi baku mutu limbah cair tersebut kadar parameter limbah tidak diperbolehkan dicapai dengan cara pengenceran dengan air secara langsung diambil dari sumber air. Kadar parameter limbah tersebut adalah limbah maksimum yang diperbolehkan.