KARAKTERISTIK FENOTIPE DAN GENOTIPE HIBRIDA
ANTARA HUNA BIRU (Cherax albertisii) DENGAN HUNA
CAPITMERAH (Cheraxquadricarinatus
)
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Karakteristik Fenotipe dan Genotipe Hibrida antara Huna biru (Cherax albertisii) dengan Huna Capitmerah
(Cherax quadricarinatus) adalah karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2009
Irin Iriana Kusmini
ABSTRACT
Irin Iriana Kusmini. Phenotype and Genotype Characteristics of Blue Crayfish
(Cherax albertisii) and Red Claw (Cherax quadricarinatus) Hybrid. Under
direction of Komar Sumantadinata, Estu Nugroho and Alimuddin
Freshwater crayfish is an endemic species of Papua and Australia and one of specific fisheries commodity in these regions.This species includes in family of Parastacidae and genus of Cherax. Morphologically blue crayfish and red claw have a similarity in body shape and colors. Because of inbreeding pressure the production of red claw started to be decreased. Hybridization between blue crayfish and red claw was aimed to increase genetic variation of crayfish in order to achieve better quality in growth and survival rate. RAPD analysis was conducted to determine the genetic variation of the crayfish offspring. The result showed that at four month-old, the growth of blue crayfish and red claw hybrid was similar to the non hybrid crayfish. After reached five month-old, the hybrid grew faster than the non hybrid. Hybridization of male blue crayfish with female red claw (AR) produced hybrid that had 25% heterosis effect on the increase of body weight. The hybrid had higher heterozigosity value (0,187-0,290) than that of the non hybrid (0,2211-0,0997).
RINGKASAN
Irin Iriana Kusmini. Karakteristik Fenotipe dan Genotipe Hibrida antara Huna Biru (Cherax albertisii) dengan Huna Capitmerah (Cherax quadricarinatus). Dibimbing oleh Komar Sumantadinata, Estu Nugroho dan Alimuddin
Lobster air tawar adalah jenis endemik dan merupakan komoditas perikanan spesifik lokal Papua dan Australia, termasuk famili Parastacidae dan genus Cherax. Secara morfologi, ada persamaan bentuk dan warna antara huna biru dengan huna capitmerah. Di duga akibat tekanan inbreeding produksi huna capitmerah mulai menurun. Pada penelitian ini dilakukan hibridisasi antar huna dengan tujuan untuk meningkatkan keragaman genetiknya sehingga diperoleh kualitas benih huna yang lebih baik dalam hal pertumbuhan dan kelangsungan hidup (sintasan).
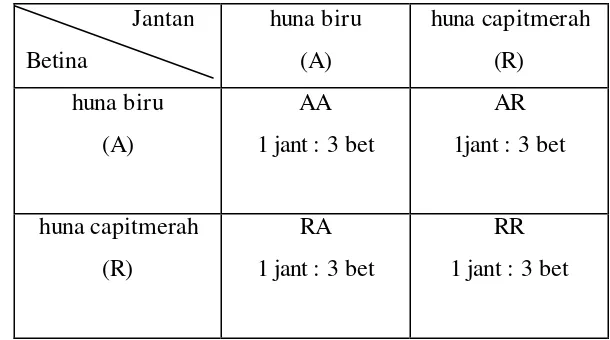
Percobaan hibrida huna biru dengan huna capitmerah ini dilaksanakan selama 9 bulan di Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi, Cibalagung – Bogor. Analisis PCR-RAPD dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan di Balai Riset Perikanan Budidaya Air Tawar, Sempur- Bogor. Induk huna biru dengan huna capitmerah dipijahkan secara alami dalam akuarium ukuran 50 x 50 x 40 cm. Rancangan percobaaan yang dilakukan dalam penelitian ini adalah rancangan acak lengkap dengan 4 perlakuan dan 3 ulangan, yaitu :
1. jantan huna biru x betina huna biru (AA); 2. jantan huna birux betina huna capitmerah (AR);
3. jantan huna capitmerahx betina huna capitmerah (RR); 4. jantan huna capitmerah x betina huna biru (RA);
Benih-benih yang dihasilkan dari masing- masing induk betina dari perlakuan pemijahan di atas dipelihara secara terpisah sesuai dengan perlakuan dan ulangan. Kepadatan benih untuk masing- masing perlakuan dan ulangan adalah 80 ekor/ bak tembok, ukuran bak tembok 2x 2,5x 0,8 m, dengan sistem air mengalir. Pakan yang diberikan berupa pellet udang sebanyak 3% dari bobot massa per hari. Pengamatan pertumbuhan dilakukan setiap 1 bulan sekali, dengan cara sampling 25 % atau 20 ekor. Benih ditimbang bobotnya per ekor dan diamati perbedaan morfologis dengan cara mengukur panjang total, panjang standar, panjang kepala (cm). Panjang capit dan lebar capit (cm) diukur setelah berumur 5 bulan. Pemeliharaan untuk mengamati berat rataan dan perbedaan morfologis serta kelangsungan hidup dilakukan selama 9 bulan. Rasio jenis kelamin diamati setelah benih berumur 5 bulan. Setiap tolok ukur kemudian dibandingkan terhadap persilangan lainnya dan terhadap turunan masing- masing induknya.
DNA diekstraksi menggunakan metode Phenol-chloroform (Nugroho, 1997). Primer yang digunakan dalam analisis PCR-RAPD ini adalah OPA 08 dengan urutan basa 5’- GTGACGTAGG-3’. Hasil amplifikasi PCR kemudian dipisahkan secara elektroforesis dan diamati dengan illuminator (uv) serta dicetak gambarnya dengan polaroid.
dengan yang nonhibrida. Hibridisasi antara jantan huna biru dengan betina huna capit merah (AR) memberikan efek heterosis 25 % pada pertumbuhan bobot badannya, sedangkan RA lebih rendah. Heterozigositas RA lebih tinggi daripada AR, jarak genetik terjauh antara huna AA dengan huna RR, sedangkan jarak genetik terdekat adalah antara huna AR dengan huna RA. Nilai heterozigositas hibrida lebih tinggi (0,187-0,290) dibandingkan dengan nonhibrida (0,0997-0,2211). Nilai heterosis AR maupun RA untuk bobot tubuh dan lebar capit menunjukkan yang jantan lebih tinggi dari pada betina, untuk panjang capit perlakuan AR betina mempunyai nilai heterosis yang tinggi dibandingkan dengan jantan. Rasio jenis kelamin dan sintasan tidak mempunyai nilai heterosis signifikan.
Kata kunci : Huna Biru (Cherax albertisii), Huna Capitmerah (Cherax
© Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan
pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan,
penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak
merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluiruh karya
KARAKTERISTIK FENOTIPE DAN GENOTIPE HIBRIDA
ANTARA HUNA BIRU (Cherax albertisii) DENGAN HUNA
CAPITMERAH (Cherax quadricarinatus)
IRIN IRIANA KUSMINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Judul Tesis : Karakteristik fenotipe dan genotipe hibrida antara huna biru (Cherax albertisii) dengan huna capitmerah (Cherax quadricarinatus)
Nama : Irin Iriana Kusmini
NIM : C151060221
Disetujui
Komisi Pembimbing,
Prof. Dr. Ir. Komar Sumantadinata, M.Sc. Ketua
Dr. Ir. Estu Nugroho, M.Sc. Dr. Alimuddin, S.Pi., M.Sc.
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Perairan
PRAKATA
Puji syukur Alhamdulillahirobil’alamin penulis panjatkan kehadirat Allah
SWT yang telah melimpahkan rahmat, hikmat, dan karunia-Nya sehingga penulis
dapat menyelesaikan studi dan penulisan tesis yang berjudul “ Karakteristik
fenotipe dan genotipe hibrida antara huna biru (Cherax albertisii) dengan huna
capitmerah (Cherax quadricarinatus)”.
Atas selesainya penelitian dan penulisan tesis ini, penulis mengucapkan
terima kasih kepada Prof. Dr. Komar Sumantadinata, Dr. Estu Nugroho, dan Dr.
Alimuddin selaku komisi pembimbing, serta Dr. Ir. Dinar Tri Soelistyowati,
DEA. yang telah banyak memberi saran. Di samping itu, penghargaan penulis
sampaikan kepada Bapak Kepala Balai Riset Perikanan Budidaya Air Tawar yang
telah memberikan fasilitas penuh selama penelitian. Ungkapan terima kasih juga
disampaikan kepada seluruh keluarga atas segala doa dan dukungannya selama
ini. Ucapan terima kasih juga penulis sampaikan kepada Mulyasari STP, Glenni
H.H. SPi dan Catur A.P. MSi, serta rekan-rekan mahasiswa Program Studi Ilmu
Perairan, Sekolah Pascasarjana IPB angkatan 2006, yang telah banyak membantu
dalam proses penelitian dan penyusunan tesis.
Dalam penyusunan tesis ini penulis menyadari masih banyak terdapat
kekurangan. Namun demikian, semoga karya ilmiah ini bermanfaat bagi mereka
yang membutuhkan. Amin.
Bogor, Oktober 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 17 Agustus 1962 dari ayah
Kusen (Alm) dan ibu Titi Suparti (Almh). Penulis merupakan anak ke delapan
dari sepuluh bersaudara. Tahun 1980 penulis lulus dari SMA Negeri 4 Bandung
dan pada tahun 1980 lulus seleksi masuk pada Jurusan Biologi, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadjaran Bandung dan
lulus pada tahun 1985. Pada tahun 1991 diterima sebagai staf peneliti di Pusat
Riset Perikanan Budidaya, dari tahun 2003 sampai sekarang ditempatkan sebagai
peneliti di Balai Riset Perikanan Budidaya Air Tawar Bogor. Penulis melanjutkan
studi ke Program Studi Ilmu Perairan, Sekolah Pascasarjana Institut Pertanian
Bogor dengan izin dari Kepala Balai Riset Perikanan Budidaya Air Tawar Bogor
DAFTAR ISI
Perumusan dan Pendekatan Masalah ... 2
Tujuan dan Manfaat Penelitian ... 4
Hipotesis ... 4
TINJAUAN PUSTAKA Sistematika dan Morfologi ... 5
Habitat Huna Biru dan Huna Capitmerah ... 6
Hibridisasi ... 8
Manfaat Hibridisasi ... 10
Heterosis ... 12
Keragaman Genetik pada Hibrida ... 12
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 16
Rancangan Perlakuan ... 16
Heterozigositas dan Polimorfisme ... 26
KESIMPULAN DAN SARAN Kesimpulan ……… 32
Saran ………... 32
DAFTAR PUSTAKA ... 33
DAFTAR TABEL
No Uraian
H
alaman1 Deskripsi genetik huna biru berdasarkan marker MtDNA ... 15
2 Deskripsi genetik huna capitmerah berdasarkan marker MtDNA ... 15
3 Skema perlakuan pemijahan huna biru dengan huna capitmerah ... 16
4 Hasil pengukuran kualitas air ... 17
5 Primer RAPD yang digunakan untuk analisis DNA ...20
6 Nilai efek heterosis (%) AR dan RA dalam hal pertumbuhan bobot tubuh (g), panjang tubuh, panjang kepala, panjang capit dan lebar capit (cm) turunan (F1) antara huna biru dan huna capitmerah pada umur 5 bulan dan 9 bulan ... 22
7 Nilai efek heterosis (%) AR dan RA dalam hal perbedaan pertumbuhan jantan dan betina F1 huna ... 25
8 Sintasan dan rasio kelamin jantan dan betina turunan (F1) hasil hibridisasi antara huna biru dengan huna capitmerah ... 25
9 Heterozigositas dan presentase polimorfisme hibrida hasil hibridisasi antara huna capitmerah & huna biru hasil RAPD menggunakan primer OPA-08 ... 26
DAFTAR GAMBAR
No Uraian Halaman
1 Diagram alir tentang hibridisasi ... 4
2 Huna biru ... 5
3 Huna capitmerah ... .. 6
4 Perkembangan bobot tubuh, panjang (total, standar, kepala) F1 hasil hibridisasi antara huna biru dengan huna capitmerah
sampai umur 9 bulan ………... . 23
5 Dendrogram F1 hibrida hasil hibridisasi antara huna biru (AA)
DAFTAR LAMPIRAN
No Uraian Halaman
1 Perbedaan bentuk tubuh induk jantan & betina huna biru
dengan huna capitmerah ………... 38
2 RAPD hibrida huna capit merah dengan huna biru
menggunakan primer OPA-8 ……… 41
3 Hasil analisa karakter fenotipe F1 umur 5 bulan dan 9 bulan
menggunakan ANOVA dengan software SPSS 11,5 ... 42
PENDAHULUAN
Latar Belakang
Lobster air tawar adalah jenis endemik dan merupakan komoditas
perikanan spesifik lokal Papua dan Australia, termasuk famili Parastacidae dan
genus Cherax. Jumlah jenis Cherax asli Indonesia sekitar 12-15 spesies. Jenis
Cherax yang potensial untuk dibudidayakan untuk tujuan konsumsi diantaranya
C. monticula, C. lorentzi, C. lakembutu dan C. albertisii (Sukmajaya & Suharjo
2003). Namun demikian, hanya jenis huna biru (Cherax albertisii) asal Papua dan
huna capitmerah (Cherax quadricarinatus) asal Australia bagian tenggara
(Queensland) yang telah didomestikasikan dan telah terkuasai pembenihan dan
budidayanya. Hal ini disebabkan karena huna biru dan huna capitmerah lebih
mudah dalam beradaptasi pada lingkungan budidaya di luar habitatnya dan tidak
ada masalah dalam reproduksinya (Kusmini & Nugroho, 2007).
Huna capitmerah telah berkembang lebih awal dibandingkan dengan
huna biru, sejak tahun 2003 di Indonesia budidaya huna capitmerah mulai
berkembang dengan pesatnya, sedangkan huna biru baru dikenal di pembudidaya
pada tahun 2006 dan kurang berkembang diduga tingkat keragaman genetiknya
masih tinggi. Yogyakarta pada tahun 2004-2006 memiliki 800 orang lebih
pembudidaya huna capitmerah, bulan April 2008 hanya ada 4 pembudidaya yang
panen. Budidaya huna capitmerah di Tulungagung berkembang pesat pada tahun
2005-2006, namun pertengahan tahun 2007 usaha pembenihan dan pembesaran
mulai berkurang (Kusmini, 2009). Produksi huna capitmerah mulai menurun hal
ini dapat disebabkan oleh pengelolaan induk dalam budidaya dan terjadi silang
dalam (inbreeding) yang dapat menyebabkan terjadinya penurunan keragama
genetik, salah satu program untuk meningkatkan keragaman genetik adalah
dengan hibridisasi. Huna capitmerah satu genus tetapi berbeda spesies dengan
huna biru dan mempunyai kesamaan morfologi, sehingga untuk meningkatkan
keragaman benih sebar huna capitmerah perlu penelitian hibrid antara huna
Hibridisasi adalah memanfaatkan sifat heterosis karena sifat dominan dan
heterozigot pada banyak lokus (Kapusckinski & Jacobson, 1987) atau interaksi
dari alela pada lokus (Tave, 1993). Hibridisasi berpengaruh dalam meningkatkan
proporsi gen-gen yang heterozigot dan menurunkan proporsi gen yang homozigot
(Falconer, 1996). Interspesifik hibridisasi adalah persilangan antar ikan yang
berbeda species, yang dimaksudkan untuk memperoleh turunan yang tumbuh
cepat, steril (triploid), tahan terhadap penyakit dan tahan terhadap perubahan
lingkungan yang ekstrim (Hickling, 1968). Hibrid channel catfish betina ><
catfish biru jantan menghasilkan turunan yang tumbuh lebih cepat dan lebih
seragam (Brooks et al, 1982). Demikian juga dengan persilangan ikan- ikan jenis
rainbow trout, dan brook trout tumbuh lebih cepat dari pada garis parental
(induk) (Tave, 1993). Behrends & Smitherman (1984) menyilangkan tilapia
aurea yang tahan dingin dengan Red tilapia untuk menghasilkan populasi red
tilapia yang tahan dingin. Menurut Lawrence (2005), di Australia persilangan
antara betina Cherax roduntus x jantan Cherax albitus menghasilkan turunan
jantan semua, karena itu pertumbuhannya 4,8 kali lebih cepat setelah dipelihara
selama 424 hari.
RAPD (Random Amplified Polymorphism DNA) adalah suatu aplikasi
standar dari Polymerase Chain Reaction (PCR) yang digunakan untuk mendeteksi
perbedaan polimorfik DNA yang ada antara spesies atau antar individu. Analisis
RAPD terdiri dari tiga bagian, yaitu ekstraksi DNA, PCR dan elektroforesis
(Soewardi, 2007). Semakin banyak jumlah primer yang digunakan semakin besar
peluang untuk mendeteksi polimorfik DNA, sehingga lebih mudah menganalisis
keragaman genetiknya. Primer RAPD yang digunakan dalam penelitian ini
adalah OPA08, OPA11, OPB02, OPB06, OPC03 dan OPC09, sebagaimana yang
telah dilakukan Nguye n et al. (2004) di Australia, dengan menggunakan 60
primer, 10 primer diantaranya yang disebut di atas menunjukkan adanya 31 locus
yang berbeda antara Cherax destructor dengan turunan pertama (F1) dan turunan
Perumusan dan Pendekatan Masalah
Ketersediaan benih yang bermutu unggul, baik dari segi kualitas, kuantitas
dan kontinuitas, seringkali merupakan masalah yang dihadapi dalam budidaya
ikan, termasuk budidaya lobster air tawar. Umumnya pada tahapan awal budidaya
yang sedang berkemb ang seperti lobster air tawar, produksi akan cukup bagus
namun lambat laun produksinya akan menurun pada generasi berikutnya sebagai
akibat penurunan mutu benih dan induk yang ada hubungannya dengan penurunan
keragaman genetik.
Untuk meningkatkan keragaman genetik, dapat dilakukan persilangan atau
hibridisasi, yaitu karakter-karakter dari tetuanya akan saling bergabung
menghasilkan turunan yang tumbuh cepat, terkadang steril (triploid), tahan
terhadap penyakit dan tahan terhadap perubahan lingkungan yang ekstrim
(Hickling, 1968).
Pengukuran keragaman genetik dari hibridisasi dapat dilakukan melalui
karakter fenotipe dan karakter genotip e. Karakter fenotipe dapat dilihat dari
morfologi dan pertumbuhan keturunannya yaitu pengukuran kuantitatif hybrid
vigour yang disebut heterosis, didefinisikan sebagai presentase peningkatan
performa dari hasil hibridisasi di atas rataan tetuanya. Karakter genotipe diamati
dengan RAPD, untuk mengetahui tingkat derajat heterosigositas antara
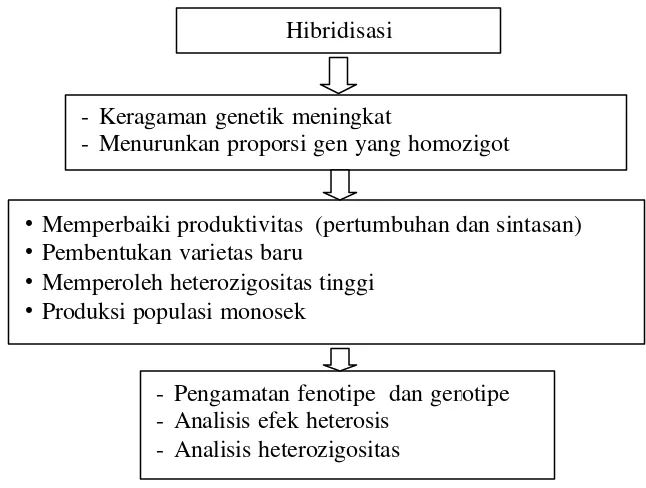
Gambar 1. Diagram alir tentang hibridisasi
Tujuan dan Manfaat Penelitian
Hibridisasi antar huna bertujuan untuk meningkatkan keragaman
genetiknya sehingga diperoleh kualitas benih huna yang lebih baik dalam hal
pertumbuhan dan kelangsungan hidup (sintasan). Selain itu juga untuk
mengetahui perbedaan morfologi dan rasio jenis kelamin benih huna hibrida.
Analisis RAPD dilakukan untuk mengetahui keragaman genetik (heterosigositas)
dari turunannya.
Manfaatnya adalah diperoleh benih huna yang mempunyai keragaman
yang tinggi, berkualitas baik dalam hal pertumbuhan dan kelangsungan hidup
(sintasan) untuk pembudidaya huna (lobster air tawar).
Hipotesis
Persilangan antara huna biru dengan huna capitmerah dapat menghasilkan
benih yang berkualitas baik, dan mempunyai nilai heterosigositas yang tinggi. Hibridisasi
- Keragaman genetik meningkat
- Menurunkan proporsi gen yang homozigot
•Memperbaiki produktivitas (pertumbuhan dan sintasan) •Pembentukan varietas baru
•Memperoleh heterozigositas tinggi •Produksi populasi monosek
- Pengamatan fenotipe dan genotipe - Analisis efek heterosis
TINJAUAN PUSTAKA
Sistematika dan Morfologi
Menurut Ho lthuis (1950), huna biru dan huna capitmerah diklasifikasikan
sebagai berikut :
Filum : Arthropoda
Kelas : Crustacea
Ordo : Decapoda
Famili :` Parastacidae
Genus : Cherax
Spesies : Huna biru (Cherax albertisii) (Nobili, 1899)
Spesies : Huna capitmerah (Cherax quadricarinatus)
(Von Martens)
Gambar 2. Huna biru
Morfologi Huna biru
Huna biru (Gambar 2) memiliki ciri-ciri morfologi seperti dijelaskan oleh
Tim Cherax BBPBAT Sukabumi (2006a) sebagai berikut : Eksoskeleton berwarna
hijau kecokla tan, ujung ekor (telson) berwarna coklat tua, chela (capit) berukuran
kecil dan cendrung memanjang, rostrum cekung dilengkapi 2-3 buah duri halus.
ramping dan panjang. Capit pada Cherax jantan ramping dan terdapat garis non
kalsium tidak penuh berwarna merah, sedang pada betina polos berwarna biru.
Morfologi huna capitmerah
Disebut capitmerah (Gambar 3), karena dikedua ujung capitnya terdapat
warna merah. Jenis huna capitmerah memiliki keunikan, yaitu warna tubuhnya
biru laut yang berkilau sehingga dapat pula dimanfaatkan sebagai udang hias.
Ukuran tubuh dan capit huna capitmerah lebih besar dibandingkan dengan huna
biru. Ukuran capit 2-3 kali lebar tangkai capit. Huna capitmerah memiliki ukuran
dan bentuk tubuh hampir sama dengan lobster air laut. Tumbuh dengan ukuran
yang jauh lebih besar dibandingkan jenis lobster air tawar yang lain, yaitu dapat
mencapai ukuran panjang 30 cm dengan berat 500 – 600 gram.
Gambar 3. Huna capitmerah
Habitat huna biru & huna capitmerah
Menurut Holthuis (1950), huna biru banyak ditemukan pada habitat yang
potongan kayu (pohon), bebatuan, juga dengan substrat dasar perairan yang
berupa pasir berlumpur (Dinas Perikanan dan Kelautan Papua, 2003) .
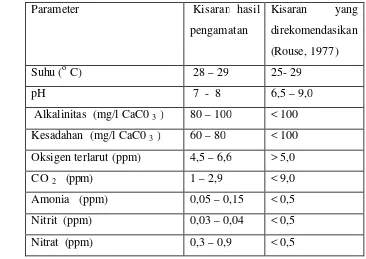
Menurut Rouse (1977), habitat alami huna capitmerah adalah wilayah
tropis Australia bagian utara yaitu daerah Queensland bagian tenggara Australia
dan Australia bagian Utara (Walkamin). Huna capitmerah mengalami
pertumbuhan terbaik pada suhu 24oC– 29oC. Kondisi kualitas air untuk huna
capitmerah meliputi : oksigen terlarut > 1 ppm, kesadahan dan alkalinitas 20 –
300 ppm, dan pH 6,5 – 9. Huna capitmerah dewasa menunjukkan toleransi
terhadap kadar oksigen terlarut sampai 1 ppm, tetapi huna capitmerah muda lebih
rentan terhadap kadar oksigen terlarut yang rendah. Huna capitmerah juga toleran
terhadap konsentrasi ammonia terionisasi sampai 1,0 ppm dan nitrit sampai 0,5
ppm dalam jangka waktu yang pendek.
Pembenihan huna biru & huna capitmerah
Untuk melakukan pembenihan, indukan jantan dan betina disatukan
dalam suatu media kolam atau akuarium (Sukmajaya & Suharjo, 2003).
Induk-induk huna berukuran 5 inci dapat dipijahkan di dalam akuarium ukuran 90 x 45
x 40 cm dengan perbandingan 3 betina : 1 jantan. Akuarium tersebut dilengkapi
dengan aerasi dan pipa pvc sebagai pelindung (selter). Pakan yang diberikan
berupa pelet udang serta cacing tanah 3 – 10% berat tubuh lobster per hari
(Kusmini & Nugroho, 2007). Induk betina yang telah bertelur dipindahkan ke
akuarium khusus dan diberi makan secukupnya. Setelah 1 – 1,5 bulan, telur-telur
akan menetas menjadi benih yang masih menempel pada induknya (diasuh oleh
induknya). Ssetelah 7 – 10 hari kemudian, induk- induk lobster tersebut akan
melepaskan benih-benihya. Jumlah benih 100 – 300 ekor per induk (Sukmajaya &
Suharjo, 2003). Benih-benih huna ini dipelihara dalam akuarium yang dilengkapi
dengan aerasi dan selter. Benih diberi makan pelet udang halus dan cacing
cheronomus atau cacing tubifek 3 – 10 % bobot massa/ hari.
Pembesaran benih huna di kolam
Wadah untuk pembesaran, bisa berupa kolam semen, bak fiber, bisa juga
banyak dilakukan dalam kolam tanah di Australia ( Jones & Lawrence, 2001) dan
dalam bak beton serta akuarium di Indonesia. Setelah benih di hatchery berumur 2 – 3 bulan, benih huna dapat dipelihara di kolam pembesaran dengan kepadatan
yang sama sesuai dengan benih yang diperoleh, sebagai berikut :
Kolam yang digunakan berukuran 2x2 m2 atau sesuai dengan yang
diinginkan. Agar huna tidak stress dan tetap melakukan aktivitas pada siang hari
sebagian kolam tersebut ditutup dengan tanaman air. Kolam dilengkapi dengan
selter berupa rooster atau potongan bambu yang disusun bertingkat. Puncak
pematang kolam dilapisi plastik untuk mencegah hewan uji merayap keluar
kolam. Pipa pemasukan air dipasang menggantung dan tidak berhubungan
langsung dengan badan air, pipa pembuangan dilengkapi dengan L-pipe yang
dipasang di dalam kolam dan dilengkapi dengan saringan terbuat dari kawat.
Dasar kolam ditebari kerikil batu kapur (CaCO3) sebagai sumber kalsium.
Pakan diberikan setiap hari sebanyak 3-10% dari bobot biomas berupa pelet
udang. Air dalam tiap kolam dipertahankan terus mengalir dengan debit 50-100
L/menit menggunakan gaya gravitasi untuk menjamin arus air yang mencukupi
dalam rangka mendukung kehidupan hewan uji secara optimal.
Hibridisasi
Hibridisasi merupakan perkawinan antar individu yang berasal dari populasi
yang berbeda secara genetik. Kegiatan ini bermaksud menggabungkan
karakter-karakter dari tetuanya yang akan dimunculkan pada turunan sebagai efek heterosis
atau sifat unggul dari hasil hibridisasi (Falconer, 1996). Menurut Tave (1993),
hibridisasi dapat memperbaiki produktivitas oleh karena eksploitasi variasi
dominan. Variasi dominan adalah keragaman genetik yang dihasilkan oleh
interaksi masing- masing alel pada lokus. Sedangkan berdasarkan Beaumont &
Hoare (2003), variasi dominan adalah variabilitas suatu trait/karakter karena
kombinasi alel yang berbeda pada suatu lokus, efek dominansi mewakili interaksi
induk kepada turunannya. Meiosis berlangsung pada saat pembentukkan gamet;
dari satu sel induk akan diperoleh empat sel turunan (tetrad) yang mengandung
kromosom dengan jumlah separuh dari jumlah yang dikandung oleh sel induknya.
Dalam satu bivalen dua kromatid tidak bersaudara dapat saling bertukar ruas satu
dengan lain, yang disebut pindah silang dalam membentuk kombinasi baru
(rekombinasi) pada saat pembentukan turunan-turunan persilangan sehingga
diperoleh keragaman genotipe ( Jusuf, 2001). Selain itu juga potensi krossing
terbesar bila terdapat banyak variansi genetik non aditif atau overdominan
gen-gen terkait dan hanya sedikit gen-gen aditif (Falconer, 1996).
Dalam program pengembangbiakan silang kombinasi induknya
menghasilkan kombinasi dari alelnya yang akan berinteraksi pada keturunannya
dan dengan demikian akan memperbaiki produktivitasnya, sehingga diperlukan
kombinasi dalam persilangan. Agar tidak kehilangan hibrid yang baik, harus
membuat perkawinan resiprokal (berbalasan). Persilangan resiprokal mempunyai
2 kemungkinan perkawinan antara 2 kelompok : betina A >< jantan B dan betina
B >< jantan A (Tave, 1993). Hibrid Channel catfish betina >< Catfish biru
jantan adalah super untuk reciprocalnya, tumbuh lebih cepat dan seragam (
Brooks et al., 1982). Menurut Falconer (1996), hibrid merupakan cara yang lebih
baik untuk meningkatkan nilai rata-rata karakter yang diinginkan, terutama dalam
hal keseragaman. Sebagian fenotipe yang terekspresi adalah hasil interaksi antara
faktor genetik dan lingkungan. Interaksi itu timbul karena beberapa alel
bertanggung jawab terhadap suatu fenotipe yang diekspresikan secara berbeda
dalam lingkungan yang berbeda. Hibrid dua galur dengan alel yang berbeda akan
menghasilkan turunan (F1), dimana semua individu adalah heterozigot, dan ini
adalah satu-satunya jalan untuk menghasilkan suatu kelompok individu yang
semuanya heterozigot, bila ada overdominan dalam hal karakter yang diinginkan
(Falconer, 1996).
Menurut Hickling (1968), hibridisasi pada ikan dapat dibedakan menjadi
hibridisasi intraspesifik, interspesifik dan intergenerik. Hibridisasi intraspesifik
adalah hibridisasi antar ikan satu ras atau ras yang berbeda dari lokasi atau sistem
budidaya yang berbeda. Hibridisasi interspesifik adalah persilangan antar ikan
yang tumbuh cepat, steril (triploid), tahan terhadap penyakit dan tahan terhadap
perubahan lingkungan yang ekstrim. Intergenerik hibridisasi adalah persilangan
antar ikan yang berbeda genus. Sedangkan menurut Reddy et al. (1997),
hibridisasi adalah suatu metode tak langsung untuk memodifikasi atau
memanipulasi genom turunan (F1) dengan mengkombinasi genom haploid dari
kedua induknya yang berbeda dalam genus yang sama (Interspesifik atau antar
spesies), antar dua genus yang berbeda (Intergenerik), bahkan antar dua strain
dari spesies yang sama (intraspesifik).
Hibridisasi yang sukses antara spesies yang mempunyai jumlah kromosom
yang berbeda adalah amat kecil peluangnya. Oleh sebab itu pengetahuan detail
tentang karyotipe spesies yang berpotensi untuk hibridisasi adalah penting untuk
pengembangan dalam akuakultur (Beaumont & Hoare, 2003). Menurut Lutz
(2001), hibrid ikan “sturgeon” adalah mengkombinasi karyotipe-karyotipe yang
amat berbeda yang menghasilkan jumlah kromosom yang amat bervariasi antar
keturunannya. Hibrid antar spesies dengan jumlah kromosom diploid yang lebih
besar atau tidak sama, seperti antara ikan carp India (2n=50) dan ikan mas
(Cyprinus carpio) (2n = 104) menghasilkan hibrid steril dengan status genom
“uneuploid” (Reddy et al. 1997).
Manfaat Hibridisasi
Hibridisasi merupakan salah satu jalan untuk memperbaiki produktivitas,
yang bermanfaat untuk menghasilkan produk yang seragam, dan juga dapat
menghasilkan populasi yang monoseks (Tave, 1993). Menurut Ryman & Utter
(1987), anak-anak hibrid mengekspresikan suatu kombinasi karakteristik yang
terletak diantara kedua spesies induknya, yang cenderung tumbuh lebih cepat dari
kedua induknya dan sebagian besar merupakan jantan yang steril. Hibridisasi
mempunyai tujuan memperbaiki kualitas benih, seperti perbaikan terhadap laju
pertumbuhan, penundaan kematangan gonad, meningkatkan ketahanan terhadap
ikan lele (Chanel catfish), sembilan dari sebelas hasil hibrid tumbuh rata-rata 8–
18% lebih baik dibandingkan dengan indukannya. Hibrid dapat juga digunakan
untuk memperbaiki masalah perikanan yang masih liar. Moav et al. (1978)
memprogram penyediaan keturunan hatchery yang akan dihibridisasi dengan
populasi lokal untuk menghasilkan pertumbuhan hibrid yang lebih cepat.
Untuk meningkatkan hasil hibridisasi dapat dilakukan “ recurrent selection “
yaitu dengan menseleksi induk-induk yang mempunyai hibrid terbaik (membuat
“pure breed”), setelah itu induk terseleksi tersebut dihibridkan lagi, setelah
diketahui hasilnya maka induk- induk hasil seleksi 1 yang menghasilkan hibrid
terbaik diseleksi dengan memproduksi “pure breed” lagi demikian berulang- ulang
dari generasi ke generasi (Falconer, 1996). Chappel (1979) menemukan bahwa
beberapa hibrid dapat memeperbaiki hasil produksi antara 10 – 18 %, dan dapat
memperbaiki konversi pakan.
Beberapa penyilangan hibridisasi menghasilkan populasi monosex. Populasi
monosex telah dihasilkan oleh hibridisasi interspesifik (hibridisasi dari 2 jenis)
dalam “ sun fishes” dan tilapia (Tave, 1993). Beberapa spesies dari tilapia
mempunyai sistim tertentu dari kromosom kelamin XY sementara yang lain
memepunyai sistim tertentu dari kromosom kelamin WZ. Kombinasi sebenarnya
dari kromosom X pada induk akan menghasilkan keturunan jantan semua.
Kombinasi ini dihasilkan oleh hibridisasi betina XX dan jantan ZZ. Contoh,
Hibridisasi dari T. nilotica betina >< T. hornorum jantan akan menghasilkan
Menurut Lawrence (2005), di Australia persilangan antara betina Cherax
roduntus x jantan Cherax albitus menghasilkan turunan jantan semua dengan
pertumbuhan 4,8 kali lebih cepat setelah dipelihara selama 424 hari, dengan laju
pertumbuhan benih rata-rata lebih tinggi (0,004 g/hari) dibandingkan C. albitus
(murni) yaitu 0,002 g/hari. Jantan hasil persilangan tersebut dipijahkan kembali
dengan betina C. albitus atau C. destructor tidak menghasilkan anakan.
Heterosis
Untuk mengukur hasil hibridisasi digunakan nilai heterosis. Nilai ini
menunjukkan prosentase kenaikan atau penurunan hasil bibridisasi dibandingkan
dengan perkawinan yang tidak hibrid. Perhitungannya menggunakan rumus
sebagai berikut (Tave, 1993) :
Rata-rata hibrid - Rata-rata induknya
H = --- X 100 %
Rata-rata induknya
Keragaman genetik pada hibrida
Silang luar berpengaruh dalam meningkatkan proporsi gen-gen yang
heterozigot dan menurunkan proporsi gen yang homozigot. Namun, silang luar
tidak mempengaruhi frekuensi genotipe. Perubahan derajat heterozigositas
tergantung dari hubungan kekerabatan yang disilangkan, atau tergantung pada
perbedaan genetik dari tetuanya. Hubungan kekerabatan yang jauh akan sedikit
kesamaan gen- gennya dan akan besar tingkat heterozigositasnya.
Variasi genetik dapat dievaluasi dengan dua cara yaitu dengan “ allelic
diversity” dan “heterozygosity”. Beberapa metoda dapat digunakan untuk
mengestimasi tingkat variasi genetik yaitu penggunaan marker molekuler
(Carvalho & Picher, 1995), termasuk diantaranya adalah DNA mitokondria (Park
1995). Keragaman genetik dapat diamati dalam tingkat DNA. Ryman & Utter
(1987) mengemukakan bahwa salah satu metode terbaru untuk mengukur
keragaman genetik dengan lebih akurat adalah pada tingkat DNA.
Beberapa pendekatan yang digunakan untuk mendeteksi tingkat
polimorfisme dapat diimplementasikan. Salah satu diantaranya adalah dengan
menggunakan teknik molekuler genetik (Carvalho & Pitcher, 1995). Beberapa
teknik molekuler DNA yang umum digunakan dalam bidang perikanan antara lain
adalah Allozyme, Mitokondria DNA, Minisatelit DNA dan Mikrosatelit DNA.
Minisatelit dan Mikrosatelit DNA lebih akurat digunakan dalam studi populasi
genetik, sedangkan mitokondria DNA lebih sesuai untuk menguk ur silsilah
keturunan (pendigri trace) (Park & Moran, 1995).
Metode Isozym telah secara luas digunakan sebagai marker genetik untuk
menganalisa keragaman populasi ikan. Namun analisis berdasarkan polimorfisme
DNA lebih memberikan hasil yang lebih rinci tentang informasi keragaman
genetik suatu spesies. Disamping analisis molekuler berdasarkan mtDNA, teknik
identifikasi molekuler marker yang juga telah berkembang adalah Randomly
Amplified Polymorphism DNA (RAPD). RAPD adalah suatu aplikasi standar dari
Polymerase Chain Reaction (PCR) yang digunakan untuk mendeteksi perbedaan
polimorfik DNA yang ada antara spesies atau antar individu. Analisis RAPD
terdiri dari tiga bagian, yaitu ekstrasi DNA, PCR dan elektroforesis. Apabila PCR
digunakan dalam analisis RAPD, maka ukuran primer tidak lebih panjang dari 10
basa. Pada analisis ini tidak dibutuhkan penempelan primer ke DNA secara
specifik tetapi secara acak. Pemberian primer dengan konsentrasi tinggi dapat
menyebabkan penempelan pada sekuens DNA yang salah, tetapi primer
berkonsentrasi rendah dapat mengakibatkan kegagalan dalam proses PCR karena
hasil amplifikasi yang akan diperoleh sangat sedikit. Langkah awal dari analisis
dilakukan dengan mengekstrasi DNA, yaitu memisahkan DNA dari
molekul-molekul lain yang ada dalam jaringan dengan bantuan senyawa kimia, sehingga
diperoleh DNA template yang murni. Kualitas DNA template yang tinggi akan
menjamin keberhasilan dari teknik RAPD secara keseluruhan (Soewardi, 2007).
Marker RAPD adalah sekuens DNA polimorfik yang dipisahkan oleh gel
oligonukleotida pendek secara acak. RAPD sangat baik digunakan untuk
mendeteksi polimorfik dalam jumlah besar karena primer oligonukleotida bisa
mendata semua genom yang memiliki situs ikatan dalam reaksi PCR. Saat dua
situs ikatan berjarak cukup dekat (3.000 bp atau kurang), pita RAPD akan terlihat
pada gel. Biasanya setiap primer RAPD mampu mengamplifikasi beberapa pita.
Marka RAPD yang muncul dihitung sebagai alel dominan. Produk DNA yang
diamplifikasi dihitung berdasarkan ukuran dan penampakannya. Polimorfik
dikatakan ada jika suatu pita muncul pada satu jenis parental tapi tidak muncul
pada parental yang lain. Meskipun suatu fragmen homolog ada pada parental lain
tersebut dan tampak sebagai suatu pita dengan ukuran yang berbeda akan dihitung
sebagai marka yang berbeda, meskipun sebenarnya mewakili lokus yang sama
atau lokasi umum yang sama dari sekuens DNA.
Marker RAPD berguna untuk DNA fingerprinting yang efisien, ekonomis
dan tidak mengandung radioaktif dalam menentukan hubungan genetik dan
pembuatan petanya. RAPD tidak membutuhkan probe atau informasi sekuens
seperti untuk analisis RFLP dan DNA satelit. RAPD memiliki kriteria sebagai
sistem marka yang ideal karena polimorfiknya yang tinggi, mudah dan cepat,
ekonomis serta bisa direproduksi kembali. Namun kelemahan analisis secara
RAPD pertama dari pola pita dominan yang muncul tidak bisa dibedakan antara
individu yang heterozigot dan homozigot walaupun turunan dari marka bisa
diverifikasi dengan tes progeni, tapi hal ini tidak mudah dilakukan karena
banyaknya jumlah pita yang ada. Kedua, perlu dilakukan uji coba primer dalam
jumlah besar untuk mendapatkan marka dalam jumlah banyak pula (Dunham,
2004).
Hasil pengamatan Nugroho (2003), secara karakterisasi genetis antara Cherax
allbertisii dan Cherax quadricarinatus berdasarkan Mt DNA marker, deskriptif
genetiknya berbeda (Tabel 1 & 2). Hasil penelitian Nugroho et al. (2006)
menunjukkan bahwa, dua dari 20 primer RAPD menunjukkan perbedaan genetik
metode RAPD-PCR dapat mendeteksi perbedaan pola-pola pita DNA antara
strain ikan mas yang diamati. Penggunaan primer OPA-1 memperlihatkan adanya
perbedaan pola-pola pita antara strain Majalaya dan Sinyonya. Penggunaan primer
OPA-15 menghasilkan perbedaan pola pita antara strain Domas dengan Strain
Majalaya dan Mirror.
Tabel 1. Dekripsi genetik huna biru berdasarkan marker MtDNA
No Uraian Nilai
1 Panjang MtDNA daerah 16s r-RNA (bp) 1
2 Jumlah situs pemotongan MtDNA daerah 16s r-RNA dengan ensim Mbo I (buah)
2
3 Jumlah situs pemotongan MtDNA daerah 16s r-RNA dengan ensim Rsa I (buah)
4
4 Jumalah situs pemotongan MTDNA daerah 16s r-RNA dengan ensim Alu I (buah)
3
Tabel 2. Deskripsi genetik huna capitmerah berdasarkan marker MtDNA
No Deskriptif Nilai
1 Panjang MtDNA daerah 16s r-RNA (bp) 1
2 Jumlah situs pemotongan MtDNA daerah 16s r-RNA dengan ensim Nde II (buah)
2
3 Jumlah situs pemotongan MtDNA daera h 16s r-RNA dengan ensim Hae III (buah)
1
4 Jumlah situs pemotongan MtDNA daerah 16s r-RNA dengan ensim Rsa I (buah)
4
Berdasarkan hasil Isozyme tidak terdapat perbedaan genetik yang nyata
diantara populasi lobster mutiara dari 4 lokasi (P>0,05). Perbedaan genetik yang
teramati antara populasi lobster mutiara dari Pangandaran dan Bulukumba dengan
keragaman genetik yang tergolong rendah, jarak genetik Nei rata-rata adalah
0,026. (Nugroho et al. 2003). Hasil penelitian Nguyen et al. (2004), 10 dari 60
primer RAPD diantaranya OPA08, OPA11, OPB02, OPB06, OPC03 dan OPC09,
menunjukkan 31 lokus yang berbeda antara induk Cherax destruktor dengan
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Pengamatan dan pengukuran fenotipe hibrida huna biru dengan huna
capitmerah ini dilaksanakan selama 9 bulan di Instalasi Riset Lingkungan
Perikanan Budidaya dan Toksikologi, Cibalagung – Bogor. Analisis PCR- RAPD
dilakukan di Laboratorium Reproduksi dan Genetika Organisme Ak uatik,
Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan di Balai Riset
Perikanan Budidaya Air Tawar, Sempur- Bogor.
Rancangan Perlakuan
Induk huna biru dengan huna capitmerah ( Lampiran 1), dipijahkan
secara alami di akuarium ukuran 50 x 50 x 40 cm, dengan sistem resirkulasi.
Dengan 4 perlakuan pemijahan yaitu :
1. jantan huna biru x betina huna biru (AA);
2. jantan huna birux betina huna capitmerah (AR);
3. jantan huna capitmerahx betina huna capitmerah (RR);
4. jantan huna capitmerah x betina huna biru (RA);
Ulangan dalam pemijahan ini sebanyak 3 ulangan yaitu jumlah indukan
betina yang dipijahkan dalam masing- masing pemijahan 1 jantan : 3 betina.
Perlakuan pemijahan sebagai berikut :
Tabel 3. Skema perlakuan pemijahan huna biru dengan huna capitmerah
Benih-benih yang dihasilkan dari masing- masing induk betina dari
perlakuan pemijahan di atas dipelihara secara terpisah sesuai dengan perlakuan
dan ulangan induk. Kepadatan benih untuk masing- masing perlakuan dan ulangan
adalah 80 ekor/ bak tembok, ukuran bak tembok 2x 2,5x 0,8 m, dengan sistem
air mengalir.
Rancangan percobaaan yang dilakukan dalam penelitian ini adalah
rancangan acak lengkap dengan 4 perlakuan dan 3 ulangan untuk masing- masing
perlakuan.
Pemijahan dan pembenihan
Sumber air yang digunakan dalam penelitian ini adalah air tanah. Sebelum
melakukan penelitian ini, diukur dulu kualitas air diantaranya suhu, DO,
alkalinitas, kesadahan, CO2, pH, NH3 dan NO2.
Tabel 4. Hasil pengukuran kualitas air
Parameter Kisaran hasil
pengamatan
Percobaan pemijahan dilakukan sistem resirkulasi, yang dilengkapi
dengan kerikil batu kapur (CaCO3) sebagai sumber kalsium. Tiga induk betina
yang dapat menghasilkan benih (sebagai ulangan). Masing- masing perlakuan
Pakan yang diberikan pagi hari berupa pellet udang dengan kadar
protein 42 % dan pada sore hari cacing tanah sebanyak 3% dari bobot massa per
hari.
Untuk masing- masing perlakuan :
- Induk- induk yang bertelur diamati setiap sepuluh hari sekali
- Induk- induk yang bertelur dipisahkan dalam akuarium penetasan secara
terpisah untuk masing- masing perlakuan dan ulangan.
- Masa inkubasi biasanya 1,5 – 2 bulan, induk-induk yang telah
menghasilkan benih diukur beratnya, dikembalikan ke bak akuarium
pemijahan.
- Benih yang diperoleh dihitung, ditimbang bobot per ekor dan diberi pakan
pelet udang sebanyak 3% dari bobot biomas per hari.
Pembesaran benih huna di bak tembok
Setelah telur menetas benih yang diperoleh dipelihara di bak tembok ukuran
2 X 2,5 X 0,8 m dengan sistem air mengalir, pembesaran secara terpisah sesuai
dengan masing- masing perlakuan dan ulangan. Kepadatan benih 80 ekor/bak
tembok.
Pakan diberikan setiap hari sebanyak 3-10% dari bobot biomas berupa pelet
udang. Pengamatan pertumbuhan dilakukan setiap 1 bulan sekali, dengan cara
sampling 25 % atau 20 ekor benih masing- masing perlakuan dan ulangan, benih
ditimbang bobotnya per ekor dan diamati perbedaan morfologis dengan cara
mengukur panjang total, panjang standar, panjang kepala (cm). Sedangkan
panjang capit dan lebar capit (cm) diukur setelah berumur 5 bulan. Setiap tolok
ukur kemudian dibandingkan terhadap persilangan lainnya dan terhadap turunan
masing- masing induknya. Pemeliharaan untuk mengamati berat rataan dan
perbedaan morfologis serta kelangsungan hidup dilakukan selama 9 bulan.
Rasio jenis kelamin yang dihasilkan dari persilangan diamati setelah benih
berumur 5 bulan (Lampiran 1), dihitung jumlah jantan dan betina yang dihasilkan
Prosedur Analisis RAPD Ektraksi DNA
DNA diekstraksi menggunakan metode Phenol-chloroform (Nugroho, 1997). Potongan antena atau kaki jalan dengan berat 5 – 10 mg masing- masing
induk huna yang disilangkan dan turunannya diambil, dan selanjutnya akan
dimasukkan ke dalam tabung yang telah berisi 500 µl larutan TNES urea.
Kemudian sampel ditambahkan 15 µl/ml proteinase lalu divortex dan diikubasi
pada suhu 55oC selama 1 jam.
Selanjutnya campuran tersebut divortex dan ditambahkan dengan larutan
Phenol chloroform sebanyak 1.000 µl. Lalu dilakukan sentrifugasi dengan
kecepatan 10.000 rpm selama 10 menit. Supernatan yang terbentuk dipindahkan
ke dalam tabung baru lalu ditambahkan 1.000 µl larutan etanol 90% dan natrium
asetat (NH3 COONO2) 10 µl. Setelah itu campuran disentrifugasi dengan
kecepatan 10.000 rpm selama 10 menit hingga terbentuk endapan berwarna putih.
Hasil dari campuran tersebut lalu dipisahkan antara DNA dengan larutan, DNA
yang telah terpisah dikeringkan dalam suhu kamar. Selanjutnya DNA
ditambahkan dengan 50-100 µl Rehydration Solution DNA.
RAPD-PCR
Primer yang digunakan dalam RAPD ini adalah OPA08, OPA11, OPB02, OPB06, OPC03 dan OPC09 dengan urutan basa tertera pada Tabel 5.
Pengamplifikasian dilakukan menggunakan metode Polymerize Chain Reaction
(PCR) dengan komposisi reaksi yang terdiri : 10µg DNA, 10 pmol primer dan
pure Taq DNA (Promega) dengan total volume keseluruhannya 25 µ l. Program
PCR yang digunakan dalam amplifikasi adalah predenaturasi pada suhu 95oC
selama 4 menit, 35 siklus penggandaan yang terdiri dari 95oC selama 1 menit,
36oC selama 1 menit, 72oC selama 2,5 menit. Selanjutnya ekstensi akhir pada
suhu 72oC selama 10 menit. Hasil PCR kemudian dipisahkan secara
elektroforesis dengan menggunakan gel agarose 2% dalam Tris-Boric-EDTA
(TBE) buffer dan diamati dengan illuminator (UV) serta dicetak gambarnya
Tabel 5. Primer RAPD yang digunakan untuk analisis DNA
1. Pertambahan bobot harian benih hasil persilangan
2. Perbedaan morfologis :
1. Pertumbuhan berat individu cherax selama percobaan, dinyatakan dalam
pertambahan berat rata-rata (g). Rata-rata bobot individu yang diperoleh
dihitung dengan rumus sebagai berikut :
X = ΣX1 + ΣX2 + ΣX3 + ΣX4 +... + ΣXn
n
2. Kelangsungan hidup (sintasan )
S = Nt/No x 100 % (Effendie, 1979)
Keterangan :
S = Sintasan
Nt = Jumlah Cherax yang hidup pada akhir penelitian (ekor)
No = Jumlah Cherax yang hidup pada awal penelitian (ekor)
Pertambahan bobot dan kelangsungan hidup serta perbedaan morfologis dari
masing- masing perlakuan pemijahan, dianalisis menggunakan ANOVA
dengan software SPSS 11,5.
3. Nilai heterosis dihitung dari data pertumbuhan yang diperoleh menggunakan
rumus (Tave, 1993). Misalkan Heterosis antara huna biru (A) X huna lokus yang sama dihitung berdasarkan persamaan Hardy-Weinberg, (Nei, 1978
dalam Miller, 1997), Program Tools for Population Genetic Analysis (TFPGA)
digunakan untuk mencari kekerabatan antar perlakuan yang dihitung menurut
HASIL DAN PEMBAHASAN
HASIL
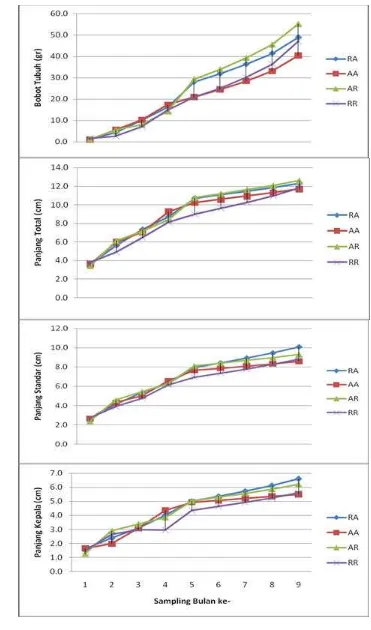
Pertumbuhan Turunan Hibrid Huna
Pertumbuhan bobot tubuh turunan hibrid antara huna capitmerah dengan huna biru sampai umur 4 bulan relatif sama, pada umur 5 bulan mulai tumbuh
lebih cepat daripada yang non hibrid (Gambar 4).
Efek Heterosis
Nilai efek heterosis huna AR dan RA pada umur 5 bulan dan 9 bulan
umumnya positif, kecuali lebar capit pada RA memiliki nilai heterosis negatif
pada umur 5 bulan dan AR pada umur 9 bulan (Tabel 6).
Tabel 6. Nilai efek heterosis (%) AR dan RA dalam hal pertumbuhan bobot tubuh (g), panjang tubuh, panjang kepala, panjang capit dan lebar capit (cm) turunan (F1) antara huna biru dan huna capitmerah pada umur 5 bulan dan 9 bulan.
Huruf superscrift yang berbeda pada baris yang sama menunjukkan perbedaan nyata (p<0,05)
Rata-rata bobot tubuh pada umur 5 bulan perlakuan AR & RA lebih tinggi
daripada RR & AA, antara perlakuan AR &RA berbeda nyata dengan RR &AA.
Sedangkan pada umur 9 bulan rata-rata bobot tubuh AR paling tinggi diantara
Umur 5 Bulan AA
rata-rata
AR RA RR
rata-rata rata-rata heterosis rata-rata heterosis
Bobot tubuh 21,3 + 6,24a 26,6 + 8,32 b 25,01 24,4 + 9,99ab 14,82 21,2 + 8,16a rata-rata heterosis rata-rata heterosis
Rata-rata panjang tubuh pada umur 5 bulan relatif sama antara perlakuan,
hanya RR yang mempunyai nilai lebih kecil, sedangkan pada umur 9 bulan
panjang tubuh yang hibrid (AR & RA) lebih tinggi daripada non hibrid (AA
&RR) namun relatif tidak berbeda nyata. Panjang tubuh pada umur 5 bulan
perlakuan AR mempunyai nilai heterosis yang lebih tinggi dari pada RA, tetapi
pada umur 9 bulan nilai heterosis panjang standar RA lebih tinggi daripada AR.
Rata-rata panjang kepala pada umur 5 bulan relatif sama antar perlakuan
kecuali RR, sedangkan pada umur 9 bulan yang hibrid lebih tinggi daripada yang
non hibrid. Nilai heterosis untuk panjang kepala pada umur 5 bulan AR lebih
tinggi daripada RA, sebaliknya pada umur 9 bulan nilai heterosis pajang kepala
RA lebih tinggi daripada AR.
Rata-rata panjang capit baik pada umur 5 bulan maupun 9 bulan yang hibrid lebih tinggi dari pada yang non hibrid namun relatif tidak berbeda nyata,
sedangkan rata-rata lebar capit pada umur 5 bulan perlakuan AR dan RR berbeda
nyata dengan AA dan RA, pada umur 9 bulan rata-rata lebar capit RR lebih
tinggi dibandingkan dengan perlakuan lainnya. Nilai heterosis panjang capit
pada umur 5 bulan AR jauh lebih tinggi daripada RA, sebaliknya pada umur 9
bulan RA jauh lebih tinggi daripada AR. Demikian juga untuk lebar capit RA
memiliki nilai heterosis negatif pada umur 5 bulan dan AR pada umur 9 bulan.
Nilai efek heterosis huna yang jantan untuk bobot tubuh dan lebar capit
Tabel 7. Nilai efek heterosis (%) AR dan RA dalam hal perbedaan pertumbuhan jantan dan betina F1 huna
Huruf superscrift yang berbeda pada baris dan perlakuan yang sama untuk jantan dan betina menunjukkan perbedaan nyata (p<0,05)
Berdasarkan Tabel 7, dapat terlihat untuk semua parameter dalam
perlakuan yang jantan relatif tidak berbeda nyata dengan yang betina kecuali
panjang capit betina RR lebih kecil dan lebar capit untuk semua perlakuan yang
jantan berbeda nyata dengan yang betina.Nilaiheterosis terutama untuk parameter
bobot tubuh dan lebar capit yang jantan lebih tinggi dari pada yang betina.
Tabel 8. Sintasan dan rasio kelamin jantan dan betina turunan (F1) hasil hibridisasi antara huna biru dengan huna capitmerah.
Sintasan
Keterangan: n = Jumlah populasi awal
AR RR
Parameter jantan heterosis betina heterosis jantan betina Bobot tubuh (g) 26,6+9,41a 25,6 25+7,51a 23,1 21,0+9,17a 19,1+7,43a
Berdasarkan Tabel 8, terlihat bahwa sintasan untuk perlakuan hibrid
dengan nonhibrid sekitar 20- 23 %. Rasio jenis kelamin jantan dengan betina AR
hampir sama dengan RR mendekati perbandingan 1 : 1, sedangkan AA dan RA
rasio betina lebih tinggi daripada yang jantan diduga dengan persilangan induk
betina dari huna biru akan menghasilkan lebih banyak yang betina dibandingkan
dengan yang jantan.
Heterozigositas dan Polimorfisme
Dari 4 primer yang dicoba hanyai 1 primer menunjukkan hasil PCR yang
baik. Primer OPA-8 urutan basa 5’GTG ACG TAG G 3’mempunyai fragmen
yang dapat digunakan sebagai pembeda diantara populasi huna yang diuji. Hasil
perhitungan RAPD (Lampiran 2) dapat terlihat bahwa untuk penciri dari Huna
panjang molekulnya ada diantara 275 bp sampai 1400 bp. Panjang molekul
hibrida huna RA dan hibrida huna AR mendapat kontribusi panjang molekul baik
dari huna AA maupun huna RR.
Tabel 9. Heterozigositas dan presentase polimorfisme hibrida hasil hibridisasi antara huna capitmerah & huna biru dengan RAPD menggunakan primer OPA-08
Keragaman genetik ditentukan oleh nilai rata-rata heterozigositas dan
presentase lokus polimorfik. Hasil hibrid menunjukkan nilai heterozigositas dan
presentase lokus polimorfik lebih tinggi dibandingkan dengan huna nonhibrid,
nilai hetorozigositas dan polimorfik dari hibrid yang terpaut dengan asal induk
betinanya memiliki nilai yang tinggi. Secara berurutan yang mempunyai nilai
heterozigositas dan lokus polimorfik yang paling tinggi adalah perlakuan RA,
kemudian AA, AR dan RR (Tabel 10).
AA RR AR RA
Heterozigositas 0,2211 0,0997 0,1871 0,2907
Tabel 10. Jarak genetik F1 hibrida hasil hibridisasi antara huna biru (AA) dengan huna capitmerah (RR)
AA RR AR RA
AA xxxxxxxx
RR 0,4816 xxxxxxxx
AR 0,2966 0,0983 xxxxxxxx
RA 0,1012 0,1705 0,0691 xxxxxxxx
Berdasarkan perhitungan jarak genetik dari empat perlakuan diperoleh
nilai jarak genetik terjauh antara AA dengan RR, diikuti dengan AA dengan AR
dan RR dengan RA, AA dengan RA, sedangkan jarak yang terdekat adalah antara
AR dengan RA dan antara RR dengan AR.
Dendrogram yang dibentuk berdasarkan jarak genetik digambarkan dalam
tiga kluster utama. Hibrida AR dengan RA mempunyai jarak genetik yang relatif
rendah (0,0691) sehingga memiliki kluster yang sama dengan RA menunjukkan
adanya jarak kekerabatan yang lebih dekat antara keduanya dibandingkan RA
dengan RR atau RR dengan AA yang memiliki hubungan kekerabatan yang lebih
jauh (Gambar 5).
Gambar 5. Dendrogram F1 hibrida hasil hibridisasi antara huna biru (AA) dengan huna capitmerah (RR)
AR
RA
RR
PEMBAHASAN
Pertumbuhan turunan hibrida antara huna capitmerah dengan huna biru sampai umur 4 bulan relatif sama, pada umur 5 bulan mulai tumbuh lebih cepat
daripada yang non hibrid a. Hal ini diduga variasi dominan untuk pertumbuhan
huna baru terlihat mulai umur 5 bulan. Nilai efek heterosis hibrida jantan huna
biru dengan betina huna capitmerah (AR) baik pada umur 5 bula n maupun 9
bulan menghasilkan efek heterosis sekitar 25 % pada pertumbuhan bobot
badannya, betina capitmerah menyebabkan positif untuk bobot tubuh. Menurut
Tave (1993), hibridisasi dapat memperbaiki produktivitas karena eksploitasi vd
(variasi dominan). Variasi dominan adalah keragaman genetik yang dihasilkan
oleh interaksi masing- masing alel pada lokus atau kombinasi alel berbeda pada
suatu lokus (Beaumont & Hoare 2003). Nilai efek heterosis tinggi ditunjang juga
dengan hasil heterozigositas hibrida (AR & RA) yang lebih tinggi dari pada
nonhibrida (AA & RR). Hibridisasi bermaksud menggabungkan karakter-karakter
dari tetuanya yang akan dimunculkan pada turunan sebagai efek heterosis atau
sifat unggul dari hasil hibridisasi (Falconer, 1996). Tujuan hibridisasi adalah
untuk menemukan satu atau lebih dari galur rekombinasi lebih baik dari galur
kedua induknya (Falconer, 1996). Persilangan antara betina Cherax roduntus x
jantan Cherax albitus menghasilkan turunan jantan semua, dengan pertumbuhan
4,8 kali lebih cepat setelah dipelihara selama 424 hari (Lawrence,2005). Hasil
penelitian Gustiano & Kristanto (2007), bahwa hibrida antara betina P.
hypophthalmus dengan jantan P. jambal menujukkan rata-rata pertumbuhannya
lebih baik daripada kedua spesies induknya. Menurut Frankham (1999)
berkurangnya keragaman genetik akan mengurangi kemampuan spesies tersebut
untuk beradaptasi terhadap perubahan lingkungan. Individu dengan keragaman
genetik yang tinggi akan mempunyai komponen fitness yang besar yang meliputi
laju pertumbuhan, fekunditas, viabilitas, dan daya tahan terhadap perubahan
lingkungan dan stress. Menurut Ryman & Utter (1987), anak-anak hibrid
tipe dna lebih polimorpik. Menurut Ricardo dan Taniguchi (1999), rata-rata
polimorfisme berasal dari lingkungan budidaya lebih rendah dibanding dengan
populasi yang terdapat di alam.
Heterozigositas RA lebih tinggi daripada AR, disebabkan adanya
kontribusi gen dari induk betina AA yang mempunyai nilai heterozigositas lebih
tinggi jika dibandingkan dengan RR. Hal ini menunjukkan bahwa keragaman
genetik didapat dari huna AA menunjukkan tingginya nilai rata-rata
heterozigositas, presentase polimorfisme dan jarak genetik. Keragaman genetik
juga dipengaruhi oleh perpindahan materi genetik antar dua populasi yang
berbeda tempat (Soelistyawati, 1996). Jarak genetik terjauh antara huna AA
dengan huna RR hal ini dapat disebabkan antara kedua huna tersebut berbeda
spesies. Hibrida ada kontribusi dari induk betinanya lebih dekat jarak genetiknya.
Sedangkan AR dengan RA masih dekat jarak genetiknya karena masing- masing
mempunyai kontribusi dari kedua induknya. Hal ini menunjukkan bahwa selain
adanya kontribusi diantara kedua induknya, juga menunjukkan bahwa adanya
kontribusi dari induk betina (maternal effect) relatif kuat dibandingkan dengan
dari induk jantannya. Menurut Saavedra, et al. 2005 bahwa penyebab maternal
effect dapat disebabkan oleh lingkungan dan genetik, selain itu bahwa ekspresi
dari beberapa gen dapat dipengaruhi oleh lingkungan.
Panjang tubuh dan kepala pada umur 9 bulan hibrid lebih tinggi
daripada non hibrid, sedangkan nilai heterosisnya baik pada umur 5 bulan
maupun 9 bulan panjang tubuh perlakuan AR lebih tinggi dari pada RA, hal ini
menunjukkan adanya kontibusi gen dari induk betina huna capitmerah sehingga
AR mempunyai nilai heterosis yang lebih tinggi dari pada RA. Menurut Tim
Cherax (2006b), Ukuran tubuh huna capitmerah lebih besar dibandingkan dengan
huna biru. Sedangkan nilai heterosis panjang kepala pada umur 5 bulan AR lebih
tinggi dari RA dan sebaliknya pada umur 9 bulan. Menurut Falconer (1996),
hibridisasi bermaksud menggabungkan karakter-karakter dari tetuanya yang akan
dimunculkan pada turunan sebagai efek heterosis atau sifat unggul.
Nilai heterosis untuk panjang capit baik pada umur 5 bulan maupun 9
bulan menunjukkan nilai positif, sedangkan untuk lebar capit ada yang
gen indukan betina lebih mendominasi dibandingkan dengan indukan jantan RR
yang mempunyai lebar capit lebih besar daripada AA. Betina huna biru
menyebabkan pleotropik yaitu yang menyebabkan lebar capit menjadi kecil
(negatif). Menurut Tim Cherax (2006b) ukuran capit huna capitmerah lebih besar
dibandingkan dengan huna biru, ukuran capit huna capitmerah ( 2-3 kali lebar
tangkai capit). Bila ada dua gen saling berpengaruh secara berlawanan, maka
kedua pengaruh tersebut dapat akan saling mengurangi. Sebaliknya apabila kedua
gen saling mempengaruhi yang sama, maka semua pengaruhnya akan bersifat
menambah. Heterosis adalah keunggulan beberapa sifat yang semula terdapat
dalam bangsa yang berbeda disatukan melalui persilangan, heterosis akan timbul
pada sifat yang banyak dikendalikan oleh gen non-aditive (Hardjosubroto 2001).
Nilai heterosis untuk bobot tubuh dan lebar capit menunjukkan huna
jantan lebih tinggi dari pada betina, untuk panjang capit perlakuan AR betina
mempunyai nilai heterosis tinggi dibandingkan dengan jantan. Beberapa jenis
Cherax pertumbuhan jantan lebih cepat pada tahap dewasa daripada pada tahap
awal. Pertumbuhan Cherax betina lebih lambat pada tahap dewasa karena
banyaknya energi dibutuhkan untuk reproduksi. Namun secara keseluruhan
parameter untuk semua perlakuan tidak berbeda nyata (p>0,05) antara
pertumbuhan jantan dan betina, kecuali lebar capit dan panjang capit, sesuai
dengan pernyataan Merrick (1993) bahwa Cherax destructor pada kondisi yang
terkontrol tidak menunjukkan perbedaan nyata antara laju pertumbuhan jantan
dan betina. Rata-rata pertumbuhan Cherax quadricarinatus jantan (0,31±0,41
g/hari) menunjukkan signifikansi yang lebih tinggi dari pada yang betina (0,18±
0,09 g/hari), (Manor et al. 2002).
Rasio jenis kelamin dan sintasan tidak mempunyai nilai heterosis
signifikan, karena mempunyai nilai hampir sama dengan nonhibrida. Menurut
Lawrence et al. (2006) persilangan antara jantan Cherax destructor albitus dengan
betina Cherax destructor destructor menghasilkan F1 dengan sex ratio jantan :
menghasilkan F1 dengan perbandingan 1 betina : 1 jantan. Berdasarkan penelitian
Akhmad, et al. (2007) pemeliharaan huna capitmerah dengan bobot awal 4-7g
dan huna biru 2-4g setelah dipelihara selama 3 bulan, sintasan untuk huna
capitmerah sekitar 51%, sedangkan huna biru 30%. Rodgers et al., (2006)
menyatakan hasil pengamatan terhadap huna capitmerah dengan padat penebaran
4-6 ekor/m2, pemeliharaan selama 145 hari sintasannya antara 41%-52%.
Timbulnya sifat kanibalisme disamping faktor internal seperti faktor genetik, juga
KESIMPULAN DAN SARAN
KESIMPULAN
1. Pertumbuhan turunan hibrida antara huna capitmerah dengan huna biru
sampai 4 bulan relatif sama dengan nonhibrid a, pada umur 5 bulan
pertumbuhan hibrida mulai terlihat lebih cepat dibandingkan dengan yang
nonhibrida.
2. Hibridisasi antara jantan huna biru dengan betina huna capit merah (AR)
menghasilkan hibrida dengan efek heterosis 25 % pada pertumbuhan bobot
badannya.
3. Nilai heterozigositas hibrida lebih tinggi (0,187-0,290) dibanding nonhibrida
0,0997-0,2211).
4. Hibridisasi antara jantan huna capitmerah dengan betina huna biru (RA)
menghasilkan nilai sintasan, heterozigositas dan jarak genetik yang lebih baik
dibandingkan dengan AR.
Saran
Pembudidaya huna dapat meningkatkan produksi benih sebarnya dengan
memijahkan antara jantan huna biru dengan betina huna capitmerah.
Program seleksi untuk huna biru dan huna capitmerah perlu dilakukan di Balai
DAFTAR PUSTAKA
Ahmad T, Sofiarsih L, dan Sutrisno. 2007. Budidaya terpadu Cherax
quadricarinatus dan C. albertisii dengan padi dalam kolam tanah. Jurnal
Riset Akuakultur 2 (2):157-165.
Beaumont AR, and Hoare K. 2003. Biotechnology and genetics in fisheries and aquaculture. Blackwell Publishing Inc USA. p.110-112.
Behrends LL, and Smitherman RO. 1984. Development of a cold-tolerant population of red tilapia through introgressive hybridization. J. World
Maricul. Soc. 15:172-178.
Brooks MJ, Smitherman RO, Chappell JA. and Dunham RA. 1982. Sex-weight relation in blue channel, and white catfishes : Implication for brood stock selection. Prog. Fish-Cult. 44:105-107.
Cavarlho GR, and TJ Pitcher. 1995. Molecular genetics in fisheries. Chapman & Hall, Inc. London.
Chappell JA. 1979. An evaluation of twelve genetic groups of catfish for suitability in commercial production. Doctoral Dissertation, Auburn Univ. AL.
Dunham RA. 2004. Aquaculture and fisheries biotechnology : Genetic approaches. CABI publishing UK. p 85-99.
Dunham RA. and Smitherman RO. 1984. Ancestry and breeding of catfish in the United States. Circular 273, Alabama Agricultural Experiment Station. Auburn University.
Dinas Perikanan dan Kelautan Papua. 2003. Inventarisasi potensi pengembangan udang Cherax spp di Kabupaten Jayawijaya. Departemen Perikanan dan Kelautan.
Effendie MI. 1979. Metode biologi perikanan. Yayasan Dewi Sri Bogor.
Gustiano R, and Kristanto AH. 2007. Evaluation of hybridization between
Pangasius djambal Bleeker 1846 and Pangasianodon hypophthalmus
(Sauvage 1878) : Biometric characterization and growth analysis.
Faizal I, Irawan D, Aliah RT, Makagiansar IT dan Amarullah MH. 1999. Studi pendahuluan pengamatan polimorfisme DNA ikan mas menggunakan teknik RAPD-PCR. Prosiding Seminar Hasil Penelitian Genetika Ikan.
Infigrad, bekerja sama dengan Puslitbangkan dan Ditjenkan Departemen
pertanian. hlm. 40-44.
Falconer DS. 1996. Introduction to quantitative genetics. Longman Malaysia. p.281-288.
Frankham R. 1999. Quantitative genetic in conservation Biology. Genetics.
Pres.Cam. 74:237-244.
Ferguson AI, Taggart AJ, Prodohl PA, Mcmeel O, Thompson C, Stone C, Meginnity P, and Hynes RA. 1995. The application of molecular markers to study and conservation of fish population, with special reference to salmo n. Journal of Fish Biology, 47:103-126.
Hardjosubroto W. 2001. Genetika hewan. Fakultas Peternakan Universitas Gadjah Mada Yogyakarta.
Hickling C. 1968. Fish hybridization. Proc. of world symp. on warm water pond fish culture. FAO Fish Rep. 44:1-10.
Holthuis LB. 1950. The crustacea decapoda macruba collected by the archbold New Guinea expeditions. The America Museum of Natural History City of
New York. p.1-17.
Imron. 1998. Keragaman morfologis dan biokimia beberapa stock keturunan induk udang windu (Penaeus monodon) asal laut yang dibudidayakan di tambak. Tesis Program Pasca Sarjana Institut Pertanian Bogor.
Jones JBN and CS Lawrence. 2001. Diseases of yabbies (Cherax albidus) in Western Australia. Aquaculture 194:221-232.
Jusuf M. 2001. Genetika I struktur dan ekspresi gen. Institut Pertanian Bogor. CV Sagung Seto. Jakarta. hlm. 51-60.
Kapusckinski AR and Jacobson LD. 1987. Genetic guidelines for fisheries management. Univ. of Minnesota, USA.
Kusmini II, dan E Nugroho. 2007. Koleksi, domestikasi dan evaluasi bioreproduksi lobster air tawar (Cherax spp) asli Papua. Buku
Pengembangan Teknologi Budidaya Perikanan. ISBN :
Kusmini II. 2009. Inventarisasi budidaya cherax di berbagai lokasi. Prosiding Seminar Nasional Kelautan V. ”Dampak Krisis Global Terhadap Pembangunan Kelautan & Perikanan dalam Rangka Peningkatan Kesejahteraan Masyarakat Maritim”. Universitas Hang Tuah. Surabaya. hlm. 293-296.
Lawrence CS, Morrissy NM, Vercoe PE and Williams IH. 2006. Differences in growth rate, size at sexual maturity and sex ratio. Journal Freshwater
Crayfish. 15:24-35.
Lawrence CS. 2005. Yabby hibrid grouwth experiment. Fisheries Research Contract Report No. 11, FRDC. Project no. 97/3/9.02. Aquaculture Development Fund of Western Australia. Project.
Leary RF, Allendorf FW and Knudsen KL, 1985. Development instability and high meris tic counts in interspesific hybrid of salmonid fishes. Evolution, 39:1318-1326.
Lutz CG. 2001. Practical genetics for aquaculture. Fishing News Books.
Blackwell Publishing, Inc, USA. p.101-112.
Manor R, Seger R, Leibovitz MP, Aflalo ED and Sagi A. 2002. Intensifikation of redclaw crayfish Cherax quadricarinatus culture II. Growthout in a separate cell system. Aquaculture Engineering 26:263-276.
Merrick JR. 1993. Freshwater crayfish of New South Wales. Linnean Society of New South Wales Australia.
Miller MP. 1997. Tools For Population Genetic Analysis (TFPGA) version 1.3. Department of Biological Science. Northern Arizona University, Arizona, USA.
Moav R, Brody T and Hulata G. 1978. Genetic improvement of wild fish populations. Science 201:1090-1094.
Nugroho E. 1997. Practical manual on detection of DNA polymorphism in fish population study. Bulletin of Marine Science and Fisheries, 17:109-129.
Nugroho E, Girsang ES dan Mardlilah S. 2003. Keragaman genetik lobster mutiara dari Pangandaran, Pamengpeuk, Liwa dan Bulukumba. Warta
Penelitian Perikanan Indonesia, 9 (2):14-17.
Nugroho E, Subagja J, Asih. S dan Kurniasih T. 2006. Evaluasi keragaman genetik ikan kancra dengan menggunakan Marker Mt DNA D- loop dan
Random Amplified Polymorphism DNA (RAPD). Jurnal Riset