STABILITAS DAN PENGARUH GEL RIMPANG KUNYIT
DALAM PROSES PENYEMBUHAN LUKA MENCIT
HIPERGLIKEMIK
LINA NOVIYANTI SUTARDI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Stabilitas dan Pengaruh Gel Rimpang Kunyit dalam Proses Penyembuhan Luka Mencit Hiperglikemik adalah karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
LINA NOVIYANTI SUTARDI. Stability and Wound Healing Activity of
Curcuma longa Gel in Hyperglycemic Mice. Under direction of IETJE WIENTARSIH and WIWIN WINARSIH
Indonesia has a rich tradition of plant based on knowledge in healthcare. A large number of plants are used by people in Indonesia for treatment of diabetic, wounds, and antiinflammatory. Curcuma longa Linn is popular for its medicinal. The specific aim of this study is to evaluate formulation, physical stability, safety test, and investigate the possible effect on wound healing of Curcuma longa gel in skin hyperglycemic mice. The physical stability of aethyl acetate gel and n-hexane gel was determined by observation of changes in physical appearance, colour, odor, pH, and viscosity during eight months storage periods (temperature 25°C and 40°C). There are no physical changes on each gel, but the pH determination in six months storage periods at temperature 40°C is showed decreasing in pH value but the value in range safety gel. The Curcuma longa gel was evaluated for its healing efficiency on excision wound in fourty mice. The animal were divided into four groups, KN as a negative control (without treatment), KP as a positive control (Neomycin sulfate), treated groups (GE=aethyl acetat gel and GH=n- hexane gel). Compare to KN group there were significant effect of GE and GH (p< 0.05) in histopathological characteristics in treated mice. The study showed that gel is safe enough to be used and it provides a scientific rationale for the use of this plant in the management of the wounds.
LINA NOVIYANTI SUTARDI. Stabilitas dan Pengaruh Gel Rimpang Kunyit dalam Proses Penyembuhan Luka Mencit Hiperglikemik. Dibimbing oleh IETJE WIENTARSIH dan WIWIN WINARSIH.
Tanaman merupakan salah satu sumber bahan baku dalam sistem pengobatan tradisional maupu n modern. Kunyit telah digunakan dalam pengobatan tradisional sebagai antiinflamasi, antiseptik, antiiritansia, anoreksia, luka diabetik, dan gangguan hati. Kunyit mempunyai potensi untuk dikembangkan menjadi sediaan farmasi, salah satunya adalah sediaan topikal kunyit yang berkhasiat dalam mempercepat proses penyembuhan luka pada pasien diabetes. Berawal dari hal tersebut maka penelitian ini dilakukan dengan merancang suatu formulasi bentuk sediaan farmasi yang tepat dari tanaman kunyit. Penelitian ini bertujuan untuk menguji stabilitas sediaan gel dari fraksi etil asetat dan fraksi n-heksan rimpang kunyit serta aktivitasnya terhadap proses penyembuhan luka pada mencit hiperglikemik yang diinduksi streptozotocin
(STZ).
Metode penelitian terdiri dari ekstraksi dan fraksinasi rimpang kunyit, penapisan fitokimia, formulasi sediaan gel, uji stabilitas fisik sediaan gel yang meliputi uji organoleptik (warna, bau, konsistensi), perubahan nilai pH dan nilai viskositas selama penyimpanan. Uji keamanan dilakukan pada 10 orang sukarelawan dengan mengoleskan sediaan gel fraksi n-heksan dan gel fraksi etil asetat pada punggung tangan. Semua uji dilakukan pada hari penyimpanan ke 1, 3, 5, 7, 14, 21, 28, 35, 42, 49, dan 56. Induksi hiperglikemik menggunakan STZ diberikan secara intraperitonial dengan dosis 40mg/kg BB. Pemeriksaan kadar gula darah dilakukan pada hari ke 1, 7, 14, 21 setelah penyuntikan STZ atau sampai kadar gula darah ≥200mg/dl. Hewan coba yang digunakan adalah yang mempunyai kadar gula darah ≥200mg/dl. Pemeriksaan kadar gula darah dilakukan pada hari ke 1, 7, 14, 21 menggunakan glukometer. Uji efektifitas sediaan gel dalam proses penyembuhan luka menggunakan 40 ekor mencit (Mus musculus albinus) hiperglikemik, strain DDY umur 4-6 minggu yang dibagi menjadi 4 kelompok. Kelompok KN yaitu kontrol negatif tidak diobati, kelompok KP yaitu kontrol positif diobati dengan obat luka komersial neomisin sulfat, Kelompok GH dan GE berturut-turut yaitu kelompok yang diobati dengan gel fraksi n-heksan dan gel fraksi etil asetat rimpang kunyit. Perlukaan dilakukan pada punggung mencit dengan membuat sayatan sepanjang 1,5cm. Gel fraksi n-heksan dan gel fraksi etil asetat diberikan secara topikal dengan cara mengoleskannya pada bagian luka mencit setiap pagi dan sore selama 21 hari pasca perlukaan. Pada hari ke 2, 4, 7, 14, 21 pasca perlukaan dilakukan nekropsi untuk mengambil sampel organ kulit. Sampel dibuat preparat histopatologi dengan pewarnaan Hematoxylin Eosin untuk mengamati jumlah sel radang dan pewarnaan Masson Trichrome untuk mengamati pembentukan neovaskularisasi, merapatnya lapisan epidermis kulit, dan pembentukan jaringan kolagen. Analisis data menggunakan uji anova dilanjutkan dengan uji Duncan untuk melihat ada tidaknya perbedaan yang nyata (P≤0,05).
selama penyimpanan. Sediaan gel selama pemakaian dapat disimpan pada suhu ruangan. Hasil pengamatan histopatologi menunjukan kelompok KN mempunyai jumlah sel radang (neutrofil dan makrofag) yang lebih tinggi dibandingkan dengan kelompok KP, GH, dan GE. Kelompok KN mempunyai jumlah neovaskularisasi, persentase re-epitelisasi, dan persentase luas jaringan kolagen yang lebih rendah dibandingkan dengan kelompok lain, hal ini disebabkan kelompok KN tidak diobati. Berdasarkan data tersebut dapat diketahui pemberian gel fraksi etil asetat dan gel fraksi n-heksan dapat mempercepat proses penyembuhan luka pada mencit hiperglikemik. Hal ini terjadi karena pemberian gel fraksi etil asetat dan gel fraksi n-heksan dapat mengurangi proses peradangan, dapat mempercepat pembentukan pembuluh darah baru, re-epitelisasi, dan jaringan ikat. Gel fraksi n-heksan dan gel fraksi etil asetat memiliki pengaruh yang sama.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan karya hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
STABILITAS DAN PENGARUH GEL RIMPANG KUNYIT
DALAM PROSES PENYEMBUHAN LUKA MENCIT
HIPERGLIKEMIK
LINA NOVIYANTI SUTARDI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Biomedis Hewan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
STABILITAS DAN PENGARUH GEL RIMPANG KUNYIT
DALAM PROSES PENYEMBUHAN LUKA MENCIT
HIPERGLIKEMIK
LINA NOVIYANTI SUTARDI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Biomedis Hewan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Latar Belakang
Tanaman merupakan salah satu sumber bahan baku dalam sistem pengobatan tradisional maupun modern. Lebih dari 60% produk farmasetik berasal dari tanaman (Jain et al. 2007). Curcuma longa Linn. (sinonim Curcuma domestica Val) yang biasa disebut dengan kunyit, famili zingiberaceae adalah tanaman obat yang dianggap penting di Indonesia. Kunyit digunakan dalam berbagai bidang seperti kesehatan, kuliner, dan kosmetik. Pada pengobatan tradisional, kunyit digunakan sebagai antiinflamasi, antiseptik, antiiritansia, anoreksia, luka diabetik, dan gangguan hati (Jain et al. 2007; Chattopadhyay et al.
2004). Beberapa tahun terakhir penelitian secara ekstensif dilakukan untuk mengetahui aktivitas biologi dan aksi farmakologi dari kunyit dan ekstraknya. Kurkumin merupakan komponen bioaktif dalam kunyit yang berwarna kuning. Kurkumin menunjukan aktivitas biologi dan potensi terapetik yang hebat, termasuk aktivitasnya sebagai antiinflamasi, antioksidan, antikarsinogenik, antimutagenik, antikoagulan, antifertilitas, antidiabetik, antibakteri, antifungi, antiprotozoa, antiviral, antifibrosis, antivenom, antiulcer, hipotensif, dan hipokolesterolemia (Jain et al. 2007; Chattopadhyay et al. 2004).
Berdasarkan studi yang telah dilakukan mengenai evaluasi keamanan dari kunyit dan kurkumin menyatakan bahwa pada dosis di bawah 100mg/kg BB tidak menimbulkan efek toksik, oleh karena itu kunyit dan kurkumin sangat potensial dikembangkan dalam pengobatan modern untuk terapi berbagai penyakit (Chattopadhyay et al. 2004). Salah satunya adalah penggunaan kunyit secara topikal pada penyakit kaki diabetik karena hiperglikemia kronik.
Hiperglikemia kronik seperti pada kasus diabetes melitus sering menyebabkan terjadinya komplikasi sekunder seperti pada pembuluh darah, ginjal, saraf, gangguan penglihatan dan infeksi. Kerusakan pembuluh darah dapat menyebabkan aliran darah menurun sehingga terjadi kerusakan saraf pada kaki. Hal ini dapat meningkatkan kemungkinan terjadinya ulkus pada kaki (kaki diabetik) (Scobie 2007).
Penyakit kaki diabetik merupakan komplikasi kronik yang terjadi pada hampir 15% dari semua pasien diabetes. Faktor yang berhubungan dengan kesembuhan pasien membutuhkan biaya yang besar. Beberapa penelitian menyatakan bahwa 6–43% pasien dengan kaki diabetik pada akhirnya akan diamputasi. Faktor utama yang menyebabkan ulkus pada kaki adalah terjadinya neuropati. Faktor ini akan lebih parah lagi kalau terkena infeksi bakteri seperti
Staphylococcus aureus dan Streptococcus pyogenes, diiringi spesies Bacteroides
(Scobie 2007).
Sediaan farmasi yang sering digunakan untuk penyembuhan luka adalah gel. Sediaan gel mempunyai keuntungan yaitu efeknya mendinginkan karena mengandung banyak air sehingga diharapkan dapat membantu mempercepat proses penyembuhan luka. Gel merupakan sediaan semipadat digunakan pada kulit, umumnya sediaan tersebut berfungsi sebagai pembawa pada obat-obat topikal, sebagai pelunak kulit, atau sebagai pelindung (Lachmann et al. 1994).
Tujuan
Penelitian ini bertujuan untuk menguji stabilitas sediaan gel dari fraksi etil asetat dan fraksi n-heksan rimpang kunyit serta aktivitasnya terhadap proses penyembuhan luka pada mencit hiperglikemik yang diinduksi streptozotocin.
Manfaat
Rimpang Kunyit
Kunyit merupakan tanaman obat asli dari Asia Tenggara dan telah dikembangkan secara luas di Asia Selatan, Cina Selatan, Taiwan, Filipina dan tumbuh dengan baik di Indonesia. Tanaman kunyit (Gambar 1) tumbuh tegak mencapai tinggi 1,0-1,5m. Kunyit memiliki batang semu yang dililit oleh pelepah-pelepah daun. Daun tanaman runcing dan licin dengan panjang sekitar 30cm dan lebar 8cm. Bunga muncul dari batang semu dengan panjang sekitar 10-15cm. Warna bunganya putih atau putih bergaris hijau dan terkadang ujung bunga berwarna merah jambu. Bagian utama dari tanaman adalah rimpang yang berada di dalam tanah (Gambar 2). Rimpang ini biasanya tumbuh menjalar dan rimpang induk berbentuk lonjong. Rimpang kunyit (Curcuma domestica rhizoma) terdiri atas rimpang Curcuma domestica Val dalam keadaan utuh atau dipotong-potong. Rimpang kunyit mempunyai bau khas aromatik, rasa agak pahit, agak pedas, lama kelamaan menimbulkan rasa tebal. Kepingan rimpangnya ringan, rapuh, berwarna kuning jingga, kuning jingga kemerahan sampai kuning jingga kecoklatan (Dirjen POM 2000).
Kunyit digunakan sebagai zat tambahan makanan (rempah), pengawet, dan pewarna di sebagian besar negara Asia. Pada pengobatan tradisional bubuk kunyit digunakan untuk terapi gangguan kelenjar empedu, anoreksia, batuk, luka diabetes, rematik, sinusitis dan gangguan hati. Di Cina, kunyit biasa digunakan untuk penyakit yang berkaitan dengan gangguan abdominal (Chattopadhyay et al.
2004).
Menurut Linnaeus dalam Chattopadhyay et al. (2004) kunyit dideskripsikan sebagai Curcuma longa dengan taksonomi sebagai berikut:
Kelas : Liliopsida Subkelas : Kommelinida Ordo : Zingiberales Keluarga : Zingiberaceae Genus : Curcuma Spesies : Curcuma longa
Kunyit yang tumbuh liar sering disebut dengan Curcuma Aromatica
sedangkan kunyit yang dibudidayakan disebut dengan Curcuma Longa (sinonim
Curcuma Domestica Val) (Chattopadhyay et al. 2004; Dirjen POM 2000).
Gambar 2 Rimpang kunyit.
bromelain dapat meningkatkan absorpsi dan efek antiinflamasi dari kurkumin (Ravindran et al. 2007).
Kunyit mempunyai banyak aktivitas farmakologi. Salah satu aktivitas farmakologi kunyit adalah sebagai antiinflamasi pada hewan percobaan yang diinduksi karagenan. Efektivitasnya pada tikus dilaporkan sama dengan efektivitas hidrokortison asetat dan indometasin. Menurut Jain et al. (2007) ekstrak kunyit mempunyai aktivitas sebagai antialergi melalui penghambatan pelepasan antihistamin oleh sel mast dan fraksi etil asetat mempunyai potensi yang paling tinggi dibandingkan dengan fraksi lain. Rimpang kunyit menunjukan aktivitas hepatoprotektor secara in vitro maupun in vivo pada hewan percobaan yang diinduksi karbon tetraklorida, aflatoksin B1, parasetamol, besi, dan siklospamid pada mencit, tikus, dan itik. Ekstrak kunyit pada profil lipid menunjukan, efikasi kunyit pada penurunan resiko aterosklerosis. Pemberian ekstrak kunyit dapat menghambat oksidasi LDL dan mempunyai efek hipokolesterolemia pada kelinci aterosklerosis. Ekstrak kunyit juga mempunyai aktivitas antifertilitas dan antispermatik yang signifikan pada tikus albino dengan pemberian jangka panjang (500mg/kg BB/ tikus/hari sampai 60 hari) (Jain et al. 2007).
Serbuk kunyit menurut Pandya (1995), mempunyai aktivitas penyembuhan luka pada pasien diabetes dan terbukti mempunyai aktivitas antimikroba dan antifungi yang signifikan. Komponen minyak atsiri, turmeron dan kurlon mempunyai daya spektrum yang luas dalam membunuh bakteri, seperti Bacillus cereus, Bacillus coagulans, Bacillus. subtilis, Staphylococcus aureus, Escherichia
coli, dan Pseudomonas aeruginosa dan fungi seperti Candida albicans MTCC-183 Cryptococcus neoformans MTCC-1347 (Jain et al. 2007). Minyak atsiri kunyit menunjukan, aktivitas antiinflamasi pada tikus arthritis yang diinduksi ajuvan, karagenan dan hialuronidase melalui penghambatan enzim tripsin dan hialuronidase (Dirjen POM 2000).
Kurkumin (Gambar 3) dan turunannya juga mempunyai aktivitas antiinflamasi, karena kemampuannya mengikat radikal bebas oksigen (Jain et al.
penghambat yang kuat dari sitokrom P450 pada hati, yang merupakan suatu isoenzim yang terlibat dengan beberapa toksin (Dirjen POM 2000).
Studi farmakokinetik pada kurkumin menunjukan bahwa kurkumin yang diberikan peroral atau intraperitonial sebagian besar dibuang melalui feses dan hanya sebagian kecil melalui urin. Hanya sejumlah kecil kurkumin yang ditemukan pada darah dari jantung, hati, dan ginjal. Kurkumin setelah dimetabolisme di hati, akan disekresikan melalui empedu (Chattopadhyay et al.
2004).
Gambar 3 Struktur kimia kurkumin (Chattopadhyay et al. 2004).
Kunyit seperti halnya tanaman obat lain mengandung senyawa aktif yang mungkin menyebabkan timbulnya efek samping dan interaksi dengan herbal lain, suplemen, atau obat. Kunyit dan kurkuminoid diketahui aman apabila diberikan sesuai dengan dosis yang direkomendasikan. Berdasarkan studi evaluasi keamanan yang dilakukan Chattopadhyay et al. (2004) kunyit tidak memberikan efek toksik pada dosis tinggi, tetapi pada penggunaan berlebihan kurkumin murni dapat menyebabkan gangguan lambung dan pada kasus ekstrem dapat menyebabkan ulkus pada lambung. Pemberian kunyit dapat menimbulkan kontraindikasi pada pasien dengan batu atau kerusakan saluran empedu, pasien yang diberikan warfarin, aspirin, antiinflamasi non steroid, obat hipotensif, dan reserpin. Studi pada tikus, mencit, dan kera bunting menyatakan bahwa pemberian kunyit atau kurkumin aman pada hewan bunting. Studi tersebut tidak menyertakan wanita hamil sebagai subyek sehingga belum diketahui keamanan penggunaan kunyit pada wanita hamil (Dirjen POM 2000).
Pada studi klinis yang telah dilakukan oleh Aggarwal et al. (2003) menyatakan bahwa pemberian kurkumin pada dosis 10g/hari tidak menimbulkan efek toksik. Pada studi klinis fase pertama terhadap 25 orang relawan dengan
O O
OH
OMe
pemberian 8g kurkumin perhari selama tiga bulan tidak ditemukan toksisitas (Cheng et al. 2001). Lima relawan lain diberikan 1,125 sampai 2,5g kurkumin per hari dan hasilnya tidak ditemukan efek toksik. Ekstrak kunyit aman diberikan pada pasien kanker sampai dosis 2,2g/hari yang setara dengan 0,18g kurkumin (Sharma et al. 2001).
Simplisia
Simplisia adalah bahan alamiah yang telah dikeringkan dan digunakan sebagai obat, yang belum mengalami pengolahan atau sudah mengalami pengolahan secara sederhana tetapi belum merupakan zat murni kecuali dinyatakan lain, dan merupakan bahan yang telah dikeringkan (Dirjen POM 2000).
Simplisia nabati adalah simplisia berupa tanaman utuh, bagian tanaman (contohnya akar tinggal, herbal, daun) atau eksudat tanaman. Eksudat tanaman adalah isi sel yang secara spontan keluar dari tanaman atau isi sel dengan cara tertentu dikeluarkan dari selnya atau zat-zat nabati lainnya yang dengan cara tertentu dipisahkan dari tanamannya dan belum berupa zat kimia murni, contohnya: opium, papainum (Dirjen POM 2000).
Simplisia hewani adalah simplisia yang berupa hewan utuh, bagian hewan atau zat-zat yang berguna yang dihasilkan oleh hewan dan belum berupa zat kimia murni, contohnya: adepslanae (Dirjen POM 2000).
Simplisia mineral adalah simplisia yang berupa mineral yang belum diolah atau sudah diolah dengan cara sederhana dan belum berupa zat kimia murni, contohnya: vaselinum album, parafinum solidum (Dirjen POM 2000).
Ekstrak
adalah 1:5 atau 1:10 untuk menjamin kualitas ekstrak yang digunakan (Gaedcke dan Barbara2003).
Fraksinasi dengan menggunakan pelarut merupakan salah satu metode pemisahan yang baik dan populer karena dapat dilakukan untuk tingkat mikro maupun makro. Fraksinasi terdiri dari dua macam yaitu ekstraksi padat-cair dan cair-cair. Fraksinasi padat-cair dapat dikerjakan dengan alat sokhlet, pada fraksinasi ini terjadi keseimbangan di antara fasa padat dan fasa cair (pelarut). Fraksinasi cair-cair merupakan suatu pemisahan yang didasarkan pada perbedaan kelarutan komponen dua pelarut yang tidak saling bercampur. Alat yang digunakan adalah alat yang sederhana yaitu corong pisah. Prinsip fraksinasi menggunakan pelarut didasarkan pada distribusi zat terlarut dan perbandingan tertentu antara dua pelarut yang tidak saling bercampur (Harborne 2006).
Sediaan Gel
Gel atau jeli merupakan bentuk semi padat terdiri dari suspensi yang dibuat dari partikel anorganik yang kecil atau molekul organik yang besar, terpenetrasi oleh suatu cairan. Jika bentuk gel terdiri dari jaringan partikel yang terpisah, gel digolongkan sebagai sistem dua fase yaitu fase terdispersi dan pendispersi (misalnya gel alumunium hidroksida). Dalam sistem dua fase jika ukuran partikel dari fase terdispersi relatif besar, bentuk gel dinyatakan sebagai magma (misalnya magma bentonit). Baik gel maupun magma dapat berupa tiksotropik dan bila dibiarkan dapat membentuk semipadat dan pada pengocokan menjadi cair. Gel fase tunggal terdiri dari makromolekul organik yang tersebar serba sama dalam suatu cairan, sehingga tidak terlihat adanya ikatan antara molekul makro yang terdispersi dan cairan. Gel fase tunggal dapat dibuat dari makromolekul sintetik (misalnya karbomer) atau dari gom alam (misalnya tragakan). Gel dapat digunakan untuk obat yang diberikan secara topikal atau dimasukan melalui anus atau vagina (Depkes 1995). Gel memiliki banyak keuntungan seperti praktis, mudah digunakan, tahan lama mudah diaplikasikan (Ansel 1989), dan memberikan efek dingin (USP NF 2007).
jernih, lunak, lembut, mempunyai daya pelumas yang baik, viskositas setara atau terikat dengan kenaikan pH. Gel dari bahan alam mempunyai viskositas bervariasi, sedangkan gel dari sintetis mempunyai viskositas sama (Voight 1995). Proses stabilisasi gel dapat dilakukan dengan penambahan bahan-bahan kimia (misalnya zat pengawet, zat pengental, antioksidan), penggunaan panas (proses termal), atau dengan kombinasi dari kedua cara tersebut (Morsy 1991).
Pemilihan basis gel dalam sediaan farmasi dan kosmetik harus inert, aman dan tidak bereaksi dengan komponen lain. Penambahan basis gel dalam formula perlu dipertimbangkan yaitu tahan selama penyimpanan dalam tube dan selama pemakaian topikal. Beberapa basis gel terutama polisakarida alami peka terhadap mikroba. Penambahan bahan pengawet perlu untuk mencegah kontaminasi dan hilangnya karakter gel dalam kaitannya dengan mikrobial (Lieberman 1996).
Berdasarkan komposisinya basis gel dapat dibedakan menjadi basis gel hidrofobik dan basis gel hidrofilik (Ansel 1989). Basis gel hidrofobik antara lain petrolatum, alumunium stearat, karbowax sedangkan basis gel hidrofilik antara lain bentonit, veegum, silika, pektin, tragakan, metil selulosa, karbomer (Ansel 1989). Basis gel hidrofobik umumnya terdiri dari partikel-partikel anorganik yang tidak dapat dilarutkan atau disatukan dengan molekul dari fase pendispersi. Berbeda dengan bahan hidrofilik, bahan hidrofobik tidak secara spontan menyebar (Ansel 1989). Basis gel hidrofilik umumnya adalah molekul-molekul organik yang besar dan dapat dilarutkan atau disatukan dengan molekul-molekul dari fase pendispersi. Sistem koloid hidrofilik biasanya lebih mudah untuk dibuat dan memiliki stabilitas yang lebih besar (Ansel 1989). Gel hidrofilik umumnya mengandung komponen bahan pengembang, air, penahan lembab, dan bahan pengawet. Keuntungan gel hidrofilik antara lain: daya sebarnya pada kulit baik, efek dingin yang ditimbulkan akibat lambatnya penguapan air pada kulit, tidak menghambat fungsi fisiologis kulit khususnya respirasi pada kulit karena tidak melapisi permukaan kulit secara kedap dan tidak menyumbat pori-pori kulit, mudah dicuci dengan air dan memungkinkan pemakaian pada bagian tubuh yang berambut serta pelepasan obatnya baik (Voight 1995).
tinggi juga mempunyai ketoksikan yang rendah. Pemerian karbopol adalah berbentuk serbuk halus putih, sedikit berbau khas, higroskopis, memiliki berat jenis 1,76-2,08 g/cm³ dan titik lebur pada 260ºC selama 30 menit. Karbopol larut dalam air, etanol dan gliserin. Konsentrasi lazim karbopol sebagai basis gel yaitu dengan 0,5-2% (Rowe et al. 2009). Menurut Lu dan Jun (1998), karbopol konsentrasi 2% memiliki nilai difusi paling besar.
Propilen glikol
Propilen glikol sering digunakan sebagai kosolven dalam formulasi sediaan parenteral dan non parenteral sebagai pengganti gliserin (Jones 2008). Propilen glikol dapat meningkatkan kelarutan bahan obat sehingga meningkatkan penetrasinya melalui membran kulit untuk mencapai tempat aksinya. Propilen glikol sebagai humektan dan kosolven pada kadar 10-24%. Propilen glikol dapat digunakan sebagai peningkat penetrasi pada konsentrasi 1% sampai 10% (Boylan 1994). Penggunaan propilen glikol untuk sediaan topikal, memiliki efek iritasi yang kecil, tetapi penggunaan pada membran mukosa dilaporkan dapat menyebabkan iritasi lokal. Propilen glikol mengalami inkompatibilitas dengan agen pengoksidasi seperti kalium permanganat (Rowe et al. 2009). Sifat fisik propilen glikol adalah cairan jernih, tidak berwarna, kental, tidak berbau dan memiliki rasa manis. Propilen glikol bersifat higroskopis sehingga harus disimpan dalam wadah tertutup rapat, ditempat dingin dan kering serta terlindung dari cahaya (USP NF 2007).
Zat Pengawet
Gel merupakan bentuk sediaan non steril, meskipun diproduksi di dalam ruangan bersih untuk meminimalkan jumlah bakteri dalam sediaan gel. Berbeda dengan salep dan pasta, gel mengandung lebih banyak air sehingga dibutuhkan pengawet. Beberapa contoh pengawet yang digunakan dalam sediaan topikal antara lain:
• Golongan fenolik: fenol (0,2–0,5%), klorokresol (0,075–0,12%)
• Asam benzoat dan garamnya (0,1–0,3%)
• Propilparaben (0,02–0,3%)
• Benzil alkohol (3,0%)
• Fenoksietanol (0,5–1,0%)
• Bronopol (0,01–0,1%, biasanya 0.02%)
Kombinasi metilparaben dan propilparaben efektif digunakan pada kisaran pH yang luas, memiliki aktivitas mikroba dengan spektrum luas dan paling efektif digunakan pada kapang dan jamur. Kombinasi antara metilparaben dan propilparaben dengan perbandingan 9:1 atau 10:1, sering digunakan untuk meningkatkan efektivitas sebagai pengawet (Jones 2008).
Hewan Percobaan
Mencit (Mus musculus), dikarakterisasi mempunyai kemampuan untuk hidup berdampingan dengan manusia. Faktanya sebagian besar mencit tergantung pada perlindungan dan aktivitas manusia dan bermigrasi bersama-sama dengan populasi manusia selama lebih dari 10.000 tahun. Mencit merupakan hewan yang relatif berbagi dalam suplai makanan. Mencit seperti manusia merupakan omnivora. Mencit dianggap sebagai hewan model yang baik untuk meneliti pengaturan asupan makanan dan metabolisme nutrisi pada manusia. Selain itu sumber informasi dan penelitan yang mengacu pada genetik mencit telah banyak dilakukan. Informasi tersebut dapat digunakan untuk mempelajari proses biologi termasuk penyakit pada manusia. Sebagai contoh diabetes melitus tipe 2 yang secara klinik didefinisikan melalui nilai kadar glukosa, yaitu kadar glukosa puasa lebih dari 126 mg/dL, kadar glukosa 2 jam setelah makan, lebih dari 200 mg/dL. Hasil tersebut juga digunakan sebagai dasar kriteria hewan model (mencit) diabetes melitus tipe 2, meskipun pada mencit nilai baseline glukosa lebih tinggi. Dalam hal ini mencit sebagai hewan model dibagi menjadi 2 tipe: pertama model genetik berkembang mengalami gejala diabetes, tidak dipengaruhi perubahan lingkungan dan kedua mencit yang diberi diet untuk menginduksi obesitas, sehingga terjadi peningkatan resistensi insulin (Baribault 2010).
mencit liar yaitu mencapai 18-20 g pada umur empat minggu dan saat dewasa dapat mencapai 30-40 g (Smith 1988).
Klasifikasi mencit menurut Linnaeus dalam Ungerer (1985) adalah: Kingdom : Animalia
Phylum : Chordata Sub phylum : Vertebrata Kelas : Mamalia Ordo : Rodentia Sub ordo : Myomorphoa Familia : Muridae Sub familia : Murinae Genus : Mus
Spesies : Mus musculus
Sub Spesies : Mus musculus albinus
Gambar 4 Mus musculus albinus.
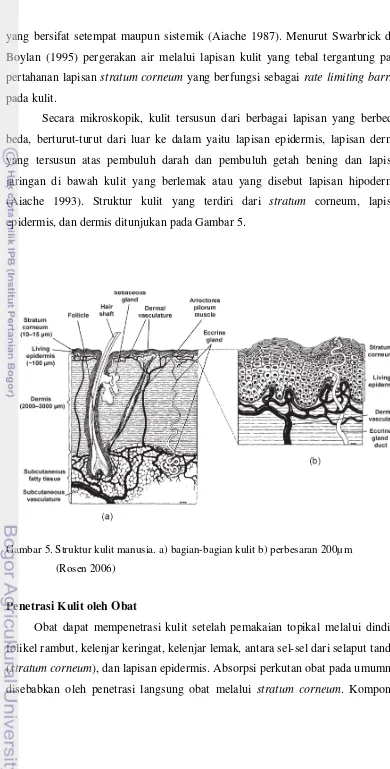
Kulit
yang bersifat setempat maupun sistemik (Aiache 1987). Menurut Swarbrick dan Boylan (1995) pergerakan air melalui lapisan kulit yang tebal tergantung pada pertahanan lapisan stratum corneum yang berfungsi sebagai rate limiting barrier
pada kulit.
Secara mikroskopik, kulit tersusun dari berbagai lapisan yang berbeda-beda, berturut-turut dari luar ke dalam yaitu lapisan epidermis, lapisan dermis yang tersusun atas pembuluh darah dan pembuluh getah bening dan lapisan jaringan di bawah kulit yang berlemak atau yang disebut lapisan hipodermis (Aiache 1993). Struktur kulit yang terdiri dari stratum corneum, lapisan epidermis, dan dermis ditunjukan pada Gambar 5.
Gambar 5. Struktur kulit manusia. a) bagian-bagian kulit b) perbesaran 200µm
(Rosen 2006)
Penetrasi Kulit oleh Obat
lemak pada stratum corneum merupakan faktor utama yang mempengaruhi rendahnya penetrasi obat. Ketika obat dapat melalui stratum corneum, obat akan diteruskan melalui epidermis dan masuk ke lapisan dermis. Apabila obat mencapai pembuluh kulit maka obat tersebut siap diabsorpsi ke dalam sirkulasi umum (Ansel 1989).
Stratum corneum sebagai jaringan keratin bersifat semi permiabel. Molekul obat mempenetrasi lapisan ini dengan cara difusi pasif. Konsentrasi obat yang masuk ke lapisan kulit tergantung pada dosis obat, kelarutannya dalam air, dan koefisien partisi minyak atau airnya. Bahan-bahan yang dapat larut dalam minyak dan air merupakan bahan yang baik untuk berdifusi melalui lapisan kulit (Ansel 1989).
Streptozotocin
Streptozotocin (STZ) adalah antibiotik yang diproduksi oleh Streptomyces achromogenes. Streptozotocin (Gambar 6) merupakan analog glukosa dan telah digunakan untuk menginduksi diabetes pada hewan percobaan. Induksi STZ pada hewan model rodensia telah diakui sebagai salah satu teknik penggunaan hewan model untuk mendeteksi efikasi uji pada percobaaan diabetes. Efikasi dari uji tersebut berdasarkan pada perubahan kadar gula dalam darah dan urin, berat badan, dan histopatologi dari pankreas. Kerusakan sel β timbul setelah tiga hari pemberian STZ dan meningkat setelah tiga sampai empat minggu. Pada kasus studi terapeutik pemberian bahan uji harus dilakukan sedikitnya 21 hari setelah pemberian STZ (Kim 2006).
Pemberian dosis rendah STZ pada mencit dapat menggambarkan fase lanjut diabetes melitus, sedangkan pemberian dosis tinggi menyebabkan terjadinya diabetes melitus tipe 1. Pada tikus dengan dosis 25 mg/kgBB dapat menginduksi diabetes, sedangkan dosis 100 mg/kgBB menyebabkan diabetes fase lanjut. Pada tikus, nilai LD50
Proses Penyembuhan Luka
sekitar 130 mg/kg. Secara klinik streptozotocin biasa digunakan untuk terapi kanker dan tumor sel pulau langerhans pankreas (Brenna2003).
Penyembuhan luka merupakan suatu proses dinamik beragam yang kompleks dan belum sepenuhnya diketahui. Proses biologik dari penyembuhan luka meliputi berbagai macam aspek dari mekanisme molekuler dan seluler. Penyembuhan luka diatur dan dikoordinasikan oleh sekelompok sitokin yang disebut faktor pertumbuhan, disekresi dari trombosit, makrofag, neutrofil, limfosit, sel endotelium, dan fibroblas. Banyak sitokin telah diidentifikasi mempunyai peranan dalam proses penyembuhan luka, seperti platelet-derived growth factor (PDGF), fibroblast derived growth factor (FGF), epidermal growth factor (EGF), tumor necrosis factor (TNF), granulocyte-macrophage colony-stimulating factor (GM-CSF), insulin-like growth factor (IGF), dan transforming growth factors (TGF) α dan β. Faktor pertumbuhan menginduksi proliferasi lapisan dalam sel, termasuk fibroblas, sel endotelium, dan sel epitelium. Faktor pertumbuhan juga menginduksi proses seperti kontraksi luka dan deposisi matriks ekstraseluler (Shai 2005).
Secara umum proses penyembuhan luka terdiri dari tiga tahap yaitu fase peradangan, fase pembentukan jaringan, dan fase perbaikan jaringan (Gambar 7). Fase peradangan
Secara normal fase peradangan berlangsung selama 4-6 hari. Peristiwa yang mengawali fase inflamasi setelah terjadinya perlukaan adalah vasokonstriksi pembuluh darah dan limfatik. Vasokonstriksi ini berlangsung hanya beberapa menit. Agregat trombosit menutupi endotelium pembuluh yang mengalami kerusakan. Proses luka juga mengaktivasi terjadinya koagulasi. Fibrinogen diubah menjadi monomer fibrin dengan pembentukan clot. Agregasi trombosit dan pembentukan clot mencegah keluarnya darah pada pembuluh yang rusak. Clot
fibronektin, vitronektin, dan trombospondin. Proses tersebut diakhiri dengan proses fibrinolisis.
Gambar 7 Fase penyembuhan luka yaitu fase peradangan, fase pembentukan jaringan, dan fase perbaikan jaringan (Shai 2005).
Vasodilatasi pembuluh darah dan kenaikan permeabilitas kapiler akibat pelepasan prostaglandin dari jaringan yang rusak dan pelepasan histamin dari sel
mast menyebabkan timbulnya gejala peradangan seperti panas, kemerahan, dan bengkak.
hari berikutnya. Jika tidak terjadi infeksi jumlah neutrofil akan menurun pada hari kedua. Bersamaan dengan munculnya neutrofil terdapat makrofag dan monosit. Sel-sel yang rusak atau mati segera difagositosis dengan cepat dari tempat luka (Thomson 1997). Akumulasi makrofag dan sel-sel debris yang merupakan tanda awal perbaikan jaringan terjadi selama beberapa hari pertama proses penyembuhan luka (Spector 1980). Jumlah maksimum makrofag dan neutrofil terjadi setelah 4-5 hari dan merupakan sel yang paling signifikan untuk melakukan proses fagositosis. Limfosit mencapai jumlah maksimal kira-kira 6 hari setelah terjadinya luka. Sel darah putih dan makrofag beraksi melawan organisme patogen, menghasilkan faktor pertumbuhan yang selanjutnya akan mengaktivasi proses penyembuhan luka (Shai 2005).
Fase pembentukan jaringan
Fase ini merupakan fase terpenting dalam proses penyembuhan luka dan mulai terjadi 4-5 hari setelah terjadi luka dan berakhir beberapa minggu sesudahnya pada kasus normal penyembuhan luka. Fase pembentukan jaringan meliputi angiogenesis dan pembentukan jaringan granulasi, pembentukan matriks ekstraseluler, re-epitelisasi, dan kontraksi luka. Pada pengamatan patologi anatomi dalam fase ini, pada luka akan terlihat adanya jaringan granulasi yang ditandai dengan munculnya keropeng.
a. Angiogenesis dan pembentukan jaringan granulasi
b. Pembentukan matriks ekstraseluler
Dua atau tiga hari setelah terjadi luka, fibroblas bermigrasi dan muncul pada luka, kemudian berproliferasi. Setelah beberapa hari diproduksi kolagen tipe III. Terbentuknya kolagen merupakan proses awal pemulihan keutuhan kulit (Shai 2005).
c. Re-epitelisasi
Re-epitelisasi merupakan tahapan perbaikan luka yang meliputi mobilisasi, migrasi, mitosis dan diferensiasi sel epitel. Tahapan-tahapan ini akan mengembalikan integritas kulit yang hilang. Mitosis dan migrasi sel epitel akan berfungsi untuk mengembalikan integritas dari kulit. Pada permukaan kulit, re-epitelisasi akan terjadi melalui pergerakan sel-sel epitel dari tepi jaringan bebas menuju jaringan rusak (Kalangi 2004).
d. Kontraksi luka
Kontraksi luka berasal dari miofibroblas yang merupakan sel kontraktil. Miofibroblas merupakan jumlah terbesar dalam jaringan granulasi pada luka yang memperantarai kontraksi pada jaringan granulasi yang terlihat seperti otot (Kalangi 2004).
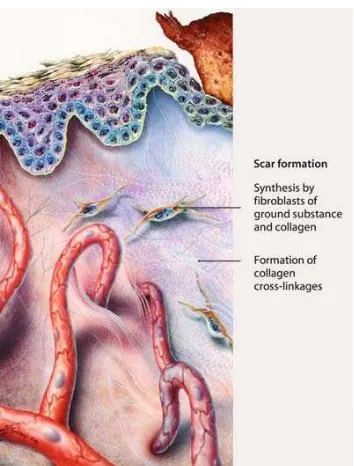
Fase perbaikan jaringan
Gambar 8 Pembentukan jaringan parut (Shai 2005).
Diabetes melitus
Penyakit Diabetes Melitus (DM) ditandai dengan adanya glukosa dalam urin (glukosuria). Dalam keadaan tak terkendali penyakit ini ditandai adanya poliuri, polidipsi, poliphagia. Diabetes melitus secara tradisional dibagi menjadi: DM tipe 1 (Insulin Dependent Diabetes Mellitus) dan DM tipe 2 (Non Insulin Dependent Diabetes Mellitus) (Suryohudoyo 2000).
Diabetes melitus tipe 1 merupakan hasil interaksi antara faktor genetik, lingkungan, dan imunologi. Interaksi faktor ini menyebabkan kerusakan sel beta pankreas dan defisiensi insulin. Diabetes melitus tipe 1 merupakan hasil dari proses autoimun kerusakan sel beta pankreas (Suryohudoyo 2000). Proses autoimun disebabkan adanya interaksi antara infeksi dan faktor lingkungan (seperti virus coxsackie dan virus gondongan) (Scobie 2007).
menyebabkan penyakit diabetes. Hampir 80% dari pengidap penyakit DM tipe 2 mengalami kelebihan berat badan. Diabetes melitus tipe 2 terjadi ketika pasien mengalami penyusutan sel beta yang progresif serta penumpukan amiloid di sekitar sel beta. Sel beta yang tersisa pada umumnya masih aktif tetapi sekresi insulinnya semakin berkurang. Selain itu kepekaan reseptornya menurun. Hipofungsi sel beta bersama resistensi insulin ini yang mengakibatkan terjadinya hiperglikemia (Scobie 2007).
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Farmasi dan Bagian Patologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan. Laboratorium Kimia Fisik, Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Pada bulan Mei 2009 sampai dengan bulan Juni 2010.
Alat dan Bahan
Alat
Kotak plastik (beralaskan sekam) dan kawat untuk kandang mencit, anaerobik jar untuk anastesi, peralatan bedah (gunting anatomis untuk bedah,
scalpel), plastik, timbangan, kaca arloji, sendok kecil, kertas perkamen, cawan porselin dan penangas air, mikrotom, gelas objek dan gelas penutup, mikroskop. Bahan
Sediaan gel rimpang kunyit (fraksi n-heksan dan fraksi etil asetat), sediaan gel komersial, sediaan gel plasebo, eter untuk euthanasia, larutan neutral buffer formalin 10% untuk fiksasi, kapas dan bahan-bahan untuk sediaan histopatologi yaitu larutan Mayer’s Hematoxylin, larutan Eosin, Xylol, alkohol dengan konsentrasi yang bertingkat (70%, 80%, 90%, 95%, 100%), larutan Lithium Carbonat, akuades, asam asetat 1%, Schiff Reagent, air sulfit, larutan Mordant, larutan Carrazi’s Hematoxylin, larutan Orange G 0,75%, larutan Ponceau Xylidine Fuchsin, larutan Phosphotungstic Acid 2,5%, Anilin Blue dan parafin.
Hewan Percobaan
diberikan yaitu pakan komersial berbentuk pelet dan minum secara ad libitum.
Sekam pada kandang mencit diganti 3 hari sekali.
Metode Penelitian
Pengumpulan Bahan dan Determinasi Tanaman.
Pada penelitian ini digunakan rimpang kunyit yang didapatkan dari Balitro Bogor. Determinasi rimpang kunyit dilakukan di Herbarium Bogoriensis untuk mengetahui spesies dari tanaman kunyit yang digunakan.
Ekstraksi dan Fraksinasi Rimpang Kunyit
Ekstraksi simplisia rimpang kunyit dilakukan dengan metode maserasi selama 3X24 jam dengan pelarut etanol 96%. Ekstrak yang diperoleh dipekatkan dengan rotary evaporator pada suhu 40°C dan 50 rpm sampai diperoleh ekstrak kental.
Ekstrak etanol dipartisi dengan n-heksan, lapisan n-heksan dipekatkan. Lapisan air kemudian dipartisi dengan etil asetat. Lapisan etil asetat dan lapisan air yang diperoleh dipekatkan, sehingga diperoleh fraksi n-heksan dan fraksi etil asetat.
Penapisan Fitokimia Ekstrak dan Fraksi Rimpang Kunyit
Penapisan fitokimia dilakukan untuk mengetahui adanya senyawa yang termasuk dalam metabolit sekunderantara lain: alkaloid, flavonoid, tanin, steroid, kuinon, dan saponin. Prosedur penapisan fitokimia yang digunakan adalah metode Fransworth (1966) yang dimodifikasi dijelaskan sebagai berikut:
Senyawa Alkaloid
pereaksi Dragendorff, terjadinya endapan atau kekeruhan diamati. Bila terjadi kekeruhan atau endapan berwarna jingga kuning berarti dalam simplisia kemungkinan terkandung alkaloid. Bagian 3 digunakan sebagai blangko.
Senyawa Tanin
Sejumlah kecil serbuk simplisia dalam tabung reaksi dipanaskan dalam tangas air, kemudian disaring. Kepada filtrat ditambahkan larutan pereaksi besi (III) klorida sehingga terjadi warna hijau-biru hitam hingga hitam, kemudian ditambahkan larutan gelatin 1%. Adanya senyawa tanin ditandai dengan terjadinya endapan berwarna putih.
Senyawa Flavonoid
Simplisia dipanaskan dengan campuran logam Magnesium dan asam klorida 5N, kemudian disaring. Adanya flavonoid akan menyebabkan filtrat berwarna merah yang dapat ditarik oleh amil alkohol. Untuk lebih memudahkan pengamatan, sebaiknya dilakukan percobaan blangko.
Senyawa Kuinon
Sejumlah kecil serbuk simplisia dalam tabung reaksi dipanaskan dalam tangas air, kemudian disaring. Filtrat ditambahkan larutan KOH 5%. Adanya senyawa kuinon ditandai dengan terjadinya warna kuning hingga merah.
Senyawa Saponin
Sejumlah kecil serbuk simplisia dalam tabung reaksi dipanaskan dalam tangas air, kemudian disaring. Setelah dingin filtrat dalam tabung reaksi dikocok kuat-kuat selama lebih kurang 30 detik. Pembentukan busa sekurang-kurangnya setinggi 1 cm dan persisten selama beberapa menit, serta tidak hilang pada penambahan satu tetes asam klorida encer, menunjukan bahwa dalam simplisia terdapat saponin.
Senyawa Polifenolat
Formulasi Gel Fraksi n-Heksan dan Gel Fraksi Etil Asetat Rimpang Kunyit.
Formula sediaan gel dibuat dengan komposisi sebagai berikut (Herdiana 2007): karbopol sebagai basis gel, trietanolamin sebagai surfaktan dan pembuat basa, metil paraben dan propil paraben sebagai pengawet, propilen glikol sebagai humektan dan kosolven, air suling, ekstrak atau fraksi rimpang kunyit sebagai zat aktif.
Pengujian Stabilitas Sediaan Gel Selama Penyimpanan.
Evaluasi sediaan dilakukan dengan mengamati karakteristik fisika yang meliputi: organoleptik (warna, bau, kejernihan, konsistensi), pH, viskositas.
Organoleptik
Pada uji organoleptik diamati perubahan warna, bau, kejernihan, dan konsistensi dari sediaan gel. Pengamatan sediaan dilakukan pada hari ke 1, 3, 5, 7, 14, 21, 28, 35, 42, 49, dan 56 (Herdiana 2007).
Pengukuran pH
Pengukuran pH dari formula yang dibuat dengan cara mencelupkan kertas pH universal ke dalam gel setelah tercelup dengan sempurna, pH universal tersebut dilihat perubahan warnanya dengan menggunakan standar pH universal. Pengukuran dilakukan untuk masing-masing sediaan pada hari ke 1, 3, 5, 7, 14, 21, 28, 35, 42, 49, dan 56 (Herdiana 2007).
Pengukuran Viskositas
Pengukuran viskositas sediaan gel dilakukan dengan menggunakan
Viscometer TV-10 Toki Sangyo Co. Ltd. (kecepatan 20 rpm, spindle nomor 21 M2). Prosedur pengukuran viskositas sebagai berikut: sediaan yang akan diperiksa ditempatkan dalam wadah bermulut besar, kemudian alat dinyalakan dan didiamkan beberapa lama hingga diperoleh angka yang stabil. Pengukuran dilakukan pada hari ke 1, 3, 5, 7, 14, 21, 28, 35, 42, 49, dan 56 (Herdiana 2007). Uji keamanan
Pengamatan dilakukan terhadap sediaan selama penyimpanan hari ke 1, 3, 5, 7, 14, 21, 28, 35, 42, 49, dan 56.
Induksi Hiperglikemia dengan Streptozotocin
Induksi hiperglikemia pada hewan coba menggunakan STZ (Eshrat dan Hussain 2002), sebelum diinduksi hewan coba dipuasakan semalam, kemudian disuntik dengan STZ secara intraperitonial (ip). Hewan coba diinjeksi STZ dengan dosis 40 mg/kg BB, kemudian secara interval dilakukan pemeriksaan kadar glukosa darah setiap mencit, untuk mengetahui keberhasilan induksi hiperglikemia. Hewan coba yang digunakan adalah yang mempunyai kadar gula darah ≥200mg/dl.
Pemeriksaan kadar glukosa darah pada hewan coba dilakukan secara berkala diukur dengan glukometer (Eshrat dan Hussain 2002; Mazunder et al. 2005). Sampel darah diambil dari vena pada ekor, pada hari ke 1, 7, 14 dan hari ke 21 setelah penyuntikan STZ atau sampai kadar gula darah mencapai ≥200 mg/dl. Desain Penelitian
Pada penelitian ini digunakan 40 ekor mencit strain DDY umur 4-6 minggu yang dibagi menjadi 4 kelompok, masing-masing kelompok terdiri dari 10 ekor mencit.
a. Kelompok KN yaitu kontrol negatif (tidak diobati)
b. Kelompok KP yaitu kontrol positif (obat luka komersial Neomycin sulfat 5%) c. Kelompok GE (sediaan gel fraksi etil asetat)
d. Kelompok GH (sediaan gel fraksi n-heksan)
Perlukaan dilakukan pada punggung mencit dengan membuat sayatan sepanjang 1,5 cm (Halper et al. 2003; Chen et al. 2005). Sebelum dilakukan perlukaan bulu di sekitar punggung dicukur dan dibersihkan dengan alkohol.
Gel fraksi etil asetat dan gel fraksi n-heksan rimpang kunyit diberikan secara topikal yaitu dengan cara mengoleskannya pada bagian luka mencit 2 kali setiap hari pada pagi dan sore. Pemberian gel fraksi etil asetat dan gel fraksi n-heksan secara topikal pada luka dilakukan dari hari ke 1 sampai hari ke 21 (Halper
Pengamatan Histopatologi pada Hewan Coba Hiperglikemik
Pada hari ke 2, 4, 7, 14, 21 pasca perlukaan dilakukan nekropsi untuk mengambil sampel organ kulit. Sampel organ kulit difiksasi dalam larutan Buffer Normal Formalin (BNF) 10%, didehidrasi dengan alkohol berbagai konsentrasi (70%, 80%, 90%, dan alkohol absolut I dan II), clearing dengan xylol dan diembedded dalam parafin. Jaringan dimasukan ke dalam alat pencetak parafin cair dan dibiarkan sampai parafin mengeras. Jaringan dipotong dengan mikrotom dengan ketebalan 5 mikron. Kemudian dilakukan proses rehidrasi dan sediaan diwarnai dengan hematoksilin eosin (HE) dan pewarnaan khusus (Masson Trichrome).
Pengamatan histopatologi menggunakan metode lesio skoring menurut metode Chen et al. 2005 dan Winarsih et al. 2007. Peubah yang diamati adalah merapatnya lapisan epidermis kulit (reepitelisasi), jumlah sel radang, pembentukan neovaskularisasi (pembentukan pembuluh darah baru), pembentukan jaringan ikat (kolagen) .
Analisis Data
Hasil Ekstraksi Rimpang Kunyit
Berdasarkan hasil determinasi diketahui rimpang kunyit yang digunakan dalam penelitian ini berasal dari tanaman Curcuma longa Linn. Hasil ekstraksi serbuk rimpang kunyit dengan pelarut etanol 96% berupa ekstrak kental berwarna coklat dan berbau khas. Sebanyak 1000g serbuk rimpang kunyit didapat 187,7g ekstrak kental sehingga diperoleh randemen sebesar 18,77% memenuhi persyaratan Depkes RI. Menurut Depkes RI 1995 randemen ekstrak dari rimpang kunyit sebesar 11%. Hasil ekstraksi dapat dilihat pada Tabel 1.
Metode ekstraksi yang digunakan adalah metode maserasi. Maserasi merupakan metode ekstraksi dingin yaitu proses pengekstrakan simplisia dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan, sehingga zat-zat yang terkandung di dalam simplisia relatif lebih aman jika dibandingkan dengan penggunaan ekstraksi panas (Gaedcke dan Barbara 2003). Keuntungan dari cara ini adalah pekerjaan dan peralatan yang digunakan sederhana.
Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan kadar antara larutan zat aktif yang ada di dalam dan di luar sel maka larutan yang terpekat didesak keluar. Peristiwa tersebut terjadi berulang-ulang sehingga terjadi kesetimbangan kadar antara larutan di dalam dan di luar sel.
Pemilihan pelarut dalam ekstraksi berdasarkan pada tingkat keamanan dan kemudahan saat menguapkan. Pada penelitian ini maserasi menggunakan etanol sebagai cairan pengekstraksinya, karena etanol tidak menyebabkan pembengkakan membran sel dan memperbaiki stabilitas bahan aktif terlarut. Etanol relatif lebih aman dibandingkan dengan metanol dan mempunyai sifat dapat menarik metabolit sekunder secara optimal dalam simplisia (Voight 1995).
Hasil Fraksinasi Rimpang Kunyit
44,28g ekstrak etanol rimpang kunyit diperoleh 10,3g fraksi n-heksan dan 15,2 g fraksi etil asetat. Besarnya randemen dari fraksi n-heksan 4,4 sedangkan fraksi etil asetat 6,4 (Tabel 1).
Tabel 1 Hasil Ekstraksi dan Fraksinasi Rimpang Kunyit
Ekstrak/fraksi Berat (g) Rendemen (%)
Ekstrak etanol 187,7 18,8 Fraksi n- heksan 10,3 4,4 Fraksi etil asetat 15,2 6,4
Metode fraksinasi yang digunakan adalah metode ekstraksi cair-cair. Ekstrak etanol diekstraksi dalam corong pisah dengan n-heksan untuk membebaskan ekstrak dari zat-zat yang kepolarannya rendah seperti lemak, terpen, klorofil, xantofil. Ekstraksi dilakukan berulang kali untuk mengoptimalkan pemisahan (Markham 1988). Larutan etanol kemudian diekstraksi dengan etil asetat sehingga dihasilkan fraksi n-heksan dan fraksi etil asetat.
Salah satu faktor yang mempengaruhi keberhasilan ekstraksi adalah pemilihan pelarut. Pada proses pelarutan suatu zat, pemilihan pelarut didasarkan pada prinsip like dissolves like (Suatu senyawa akan larut dalam pelarut yang mempunyai kepolaran hampir sama). Pemilihan bahan pelarut yang paling sesuai untuk ekstraksi metabolit sekunder dalam simplisia nabati adalah berdasarkan tingkat kepolaran. Dalam hal ini n-heksan bersifat non polar sedangkan etil asetat bersifat semi polar.
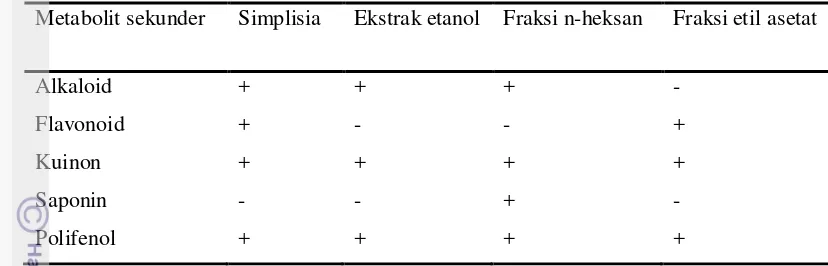
Hasil Penapisan Fitokimia Ekstrak dan Fraksi Rimpang Kunyit
Tabel 2 Hasil Penapisan Fitokimia Senyawa Metabolit Sekunder
Metabolit sekunder Simplisia Ekstrak etanol Fraksi n-heksan Fraksi etil asetat
Alkaloid + + + -
Flavonoid + - - +
Kuinon + + + +
Saponin - - + -
Polifenol + + + +
*Keterangan : + : terdeteksi; - : tidak terdeteksi
Hasil Pembuatan Sediaan Gel Rimpang Kunyit
Gel merupakan bentuk sediaan semisolid yang banyak digunakan untuk sediaan topikal. Basis gel dalam formulasi harus bersifat inert dan non reaktif dengan komponen lain. Bahan-bahan pembentuk gel yang dapat digunakan antara lain alginat, tragakan, pektin, karagenan, derivat selulosa, dan karbomer. Karbopol termasuk golongan karbomer bersifat hidrofilik sehingga mudah didispersikan oleh air dan dengan konsentrasi yang kecil (0.050-2,00%) mempunyai kekentalan yang cukup sebagai basis gel. Dalam penelitian ini digunakan karbopol sebagai basis gel. Pemilihan basis gel ini berdasarkan pada keuntungan yang dimiliki oleh karbopol dibandingkan dengan bahan lain. Berdasarkan penelitian Lu dan Jun (1998) difusi dan pelepasan obat dari karbopol 20 kali lebih tinggi dibandingkan dengan salep, dimana difusi dan pelepasan obat mempengaruhi absorbsi perkutan dan durasi efikasi obat pada formulasi topikal.
Karbopol sebagai basis gel bekerja tergantung pada pH. Penambahan alkohol dapat menurunkan viskositas dan kejernihan dari gel karbopol. Permasalahan ini dapat diatasi dengan menambahkan sedikit konsentrasi karbopol dan dapat mengubah pH gel tersebut. Karbopol sebagai basis gel memiliki pH asam, untuk mencapai pH normal pada sediaan ditambahkan trietanolamin (Jones 2008).
meningkat akan lebih mudah lepas dari basis kemudian berpengaruh pada efektifitasnya. Basis gel yang baik tidak mengikat bahan obat terlalu kuat, karena bahan obat harus terlepas sebelum menembus kulit.
Humektan juga berfungsi sebagai pembuat lunak harus memenuhi beberapa persyaratan. Pertama harus mampu meningkatkan kelembutan dan daya sebar sediaan dan kedua melindungi dari kemungkinan menjadi kering. Tingginya kandungan air dalam sediaan gel dengan basis karbopol dapat menyebabkan terjadinya kontaminasi mikroba. Kontaminasi ini dapat dicegah dengan penambahan bahan pengawet. Bahan pengawet yang digunakan merupakan campuran larutan pengawet metil paraben dan propil paraben. Pada formulasi sediaan gel dosis kedua pengawet tersebut ditingkatkan, karena beberapa pengawet seperti paraben dan fenolik berinteraksi dengan basis gel hidrofilik. Interaksi ini mengakibatkan menurunnya konsentrasi pengawet di dalam formulasi (Jones 2008).
Sediaan gel disimpan dalam tube untuk menghindari penguapan dan mengeringnya sediaan. Penyimpanan sediaan dalam botol meskipun tertutup baik tidak menjamin perlindungan yang memuaskan (Voight 1995).
Sediaan gel yang dibuat diamati secara organoleptis. Hasil pengamatan organoleptis sediaan gel dapat dilihat pada Tabel 3.
Tabel 3 Hasil Sediaan Gel secara Organoleptis
Formula Warna Bau Konsistensi
KN Bening Khas karbopol Kental
GH Kuning Khas ekstrak kunyit Kental
GE Coklat Khas ekstrak kunyit Kental
dengan basis gel karena tingginya konsentrasi ekstrak yang ditambahkan. Ketiga formula yang dibuat menghasilkan sediaan gel kental.
Gambar 9 Sediaan gel.
Keterangan:
KN : Formula tanpa ekstrak rimpang kunyit GH : Formula dengan fraksi n-heksan rimpang kunyit GE : Formula dengan fraksi etil asetat rimpang kunyit
Hasil Pengujian Stabilitas Sediaan Gel
Hasil Pengamatan Organoleptis
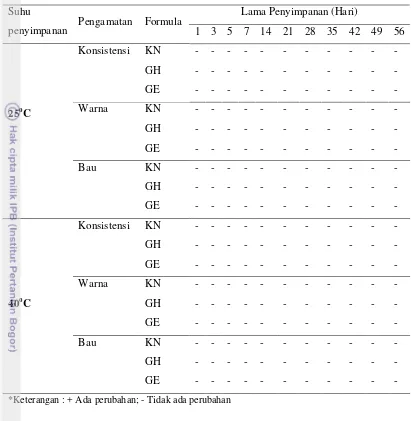
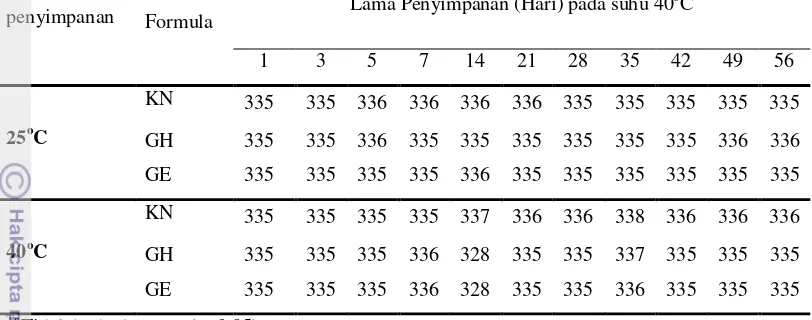
Hasil pengamatan perubahan stabilitas gel secara organoleptis yang meliputi konsistensi, warna, dan bau dari masing-masing formula gel pada penyimpanan selama 56 hari pada suhu 25oC dan 40o
Berdasarkan hasil pengamatan, diketahui bahwa gel tanpa ataupun dengan penambahan rimpang kunyit tidak mengalami perubahan konsistensi, warna maupun bau selama penyimpanan. Hasil pengamatan tersebut menunjukan bahwa semua sediaan gel yang dibuat stabil secara fisik.
C dapat dilihat pada Tabel 4.
KN
GH
Tabel 4 Hasil Pengamatan Perubahan Konsistensi, Warna, dan Bau Sediaan Gel
Suhu
penyimpanan Pengamatan Formula
Lama Penyimpanan (Hari)
*Keterangan : + Ada perubahan; - Tidak ada perubahan
Hasil Pengukuran pH
Stabilitas gel dapat juga dilihat dari pH sediaan selama penyimpanan. Perubahan pH sediaan selama penyimpanan dapat digunakan untuk mengamati stabilitas gel. Hasil pengukuran pH sediaan gel yang dibuat ditunjukan pada Tabel 5.
perlakuan. Berdasarkan analisis uji Duncan diketahui bahwa terdapat perbedaan nilai pH gel pada suhu penyimpanan 25ºC dan 40ºC. Pada suhu penyimpanan 25ºC pH gel tidak mengalami perubahan sedangkan pada suhu 40ºC pH gel mengalami perubahan. Perubahan pH gel pada suhu 40ºC juga dipengaruhi oleh lama penyimpanan. Berdasarkan analisis uji Duncan diketahui bahwa pada ketiga formula tidak terdapat perbedaan pH pada penyimpanan selama 41 hari, terjadi perubahan nilai pH pada suhu 40ºC dari 7 menjadi 6 saat penyimpanan memasuki hari ke 42 . Kestabilan nilai pH kembali terjadi pada penyimpanan hari ke 42 sampai ke 56 (Tabel 5). Penurunan nilai pH pada suhu penyimpanan 40ºC kemungkinan disebabkan terjadinya hidrolisis senyawa pada ekstrak rimpang kunyit. Gel plasebo (KN) juga mengalami penurunan nilai pH dari 8 menjadi 7 sehingga dapat disimpulkan basis gel juga mengalami penguraian. Secara umum nilai pH gel selama penyimpanan adalah antara 6-8. Nilai tersebut masih sesuai dengan persyaratan pH gel untuk kulit yaitu antara 5-10 sehingga gel aman bila digunakan dan tidak berkurang efektifitasnya (Jones 2008).
Tabel 5 Hasil Pengamatan Perubahan pH Sediaan Gel
Suhu
penyimpanan Formula Lama Penyimpanan (Hari)
1 3 5 7 14 21 28 35 42 49 56
Huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata P>0,05 (huruf kecil)
*
Huruf yang sama pada baris yang sama menyatakan tidak berbeda nyata P>0,05 (huruf besar)
Hasil Pengukuran Viskositas
Tabel 6 Hasil Pengamatan Perubahan Viskositas (cPa) Sediaan Gel
Suhu
penyimpanan Formula Lama Penyimpanan (Hari) pada suhu 40 o
Secara umum viskositas dari semua formula gel mengalami perubahan. Nilai viskositas semua sediaan gel pada suhu penyimpanan 40oC mengalami penurunan dan mulai stabil pada penyimpanan hari ke 42 (Tabel 6). Setelah dilakukan analisis statistik dengan desain acak sempurna model tetap diperoleh hasil dengan taraf signifikan P≤ 0,05. H ipotesis nol (Ho) diterima untuk semua formula gel yang dibuat (P> 0,05). Ini berarti bahwa tidak terdapat perbedaan yang nyata nilai viskositas selama penyimpanan pada suhu 25oC dan 40oC.
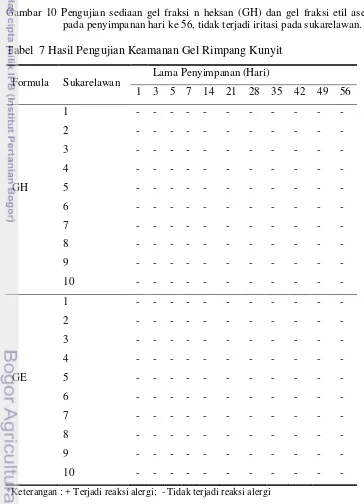
Pengujian Keamanan Gel Rimpang Kunyit
Gambar 10 Pengujian sediaan gel fraksi n heksan (GH) dan gel fraksi etil asetat (GE) pada penyimpanan hari ke 56, tidak terjadi iritasi pada sukarelawan.
Tabel 7 Hasil Pengujian Keamanan Gel Rimpang Kunyit
Formula Sukarelawan Lama Penyimpanan (Hari)
1 3 5 7 14 21 28 35 42 49 56
1 - - - -
2 - - - -
3 - - - -
4 - - - -
GH 5 - - - -
6 - - - -
7 - - - -
8 - - - -
9 - - - -
10 - - - -
1 - - - -
2 - - - -
3 - - - -
4 - - - -
GE 5 - - - -
6 - - - -
7 - - - -
8 - - - -
9 - - - -
10 - - - -
*Keterangan : + Terjadi reaksi alergi; - Tidak terjadi reaksi alergi
Hasil Pengamatan Mikroskopis (Histopatologi)
Proses penyembuhan luka merupakan suatu proses kompleks yang meliputi tiga tahap yaitu inflamasi, pembentukan jaringan granulasi, dan remodeling jaringan.
Parameter yang diamati pada pemeriksaan histopatologi adalah jumlah sel-sel radang (neutrofil dan makrofag), jumlah neovaskularisasi dengan preparat yang digunakan adalah preparat yang telah diwarnai dengan pewarnaan
Hematoxylin-Eosin, sedangkan persentase re-epitelisasi dan kepadatan jaringan ikat (fibroblas) preparat yang digunakan adalah preparat yang telah diwarnai dengan pewarnaan Masson Trichrome.
Neutrofil
Neutrofil merupakan sel radang pertama yang dilepaskan segera setelah terjadi luka. Neutrofil memberikan respon imun dengan menghasilkan enzim proteolitik untuk mencerna partikel asing dan membunuh bakteri melalui proses fagositosis dan produksi hidrogen peroksida. Neutrofil akan mengalami apoptosis setelah 24 sampai 48 jam dan digantikan dengan makrofag (Stroncek dan Reichert 2008).
Tabel 8 Rataan Jumlah Sel Radang Neutrofil
Hari ke-
Huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata P>0,05 (huruf kecil) *
Huruf yang sama pada baris yang sama menyatakan tidak berbeda nyata P>0,05 (huruf besar)
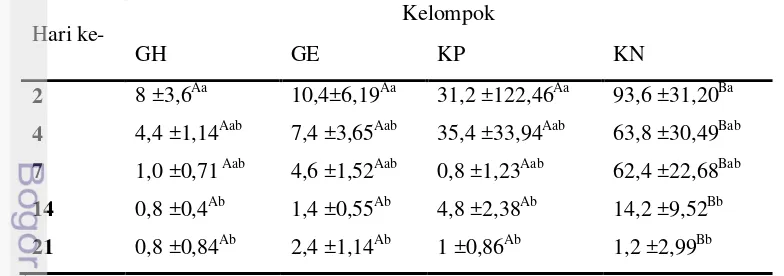
berarti bahwa terdapat perbedaan pengaruh perlakuan pada setiap kelompok terhadap jumlah neutrofil. Selanjutnya dilakukan uji Duncan untuk mengetahui perbedaan jumlah neutrofil pada setiap kelompok perlakuan. Berdasarkan analisis uji Duncan diketahui bahwa terdapat perbedaan, jumlah sel neutrofil pada kleompok KN lebih tinggi dibandingkan dengan kelompok lain, sedangkan jumlah neutrofil pada kelompok GH, GE, dan KP tidak memiliki perbedaan yang signifikan (Tabel 8).
Gambar 11 Gambar histopatologi kulit, kontrol positif 2 hari pasca perlukaan sel radang
neutrofil (N). (HE, obyektif 100X)
secara nyata (P< 0,05), dibandingkan dengan KP, GE, dan GH. Hal ini disebabkan kelompok KN diberikan sediaan gel plasebo.
Makrofag
Makrofag akan menggantikan peran neutrofil, ketika neutrofil mengalami apoptosis. Makrofag menghasilkan sitokin seperti IL-1, TGF-β, and tumor necrosis factor-α (TNF-α) yang mengaktivasi fibroblas. Makrofag akan memfagositosis sel-sel nekrotik dan partikel asing dalam waktu tertentu tergantung pada tingkat keparahan luka, jumlah sel nekrotik serta jumlah partikel asing (Stroncek dan Reichert 2008).
Berdasarkan Tabel 9 setelah dilakukan analisis statistik dengan desain acak sempurna model tetap diperoleh hasil dengan taraf signifikan P≤ 0, 05. Hipotesis nol (H0) diterima untuk semua kelompok percobaan. Ini berarti bahwa tidak terdapat perbedaan jumlah makrofag pada setiap kelompok perlakuan.
Gambar 12 Gambar histopatologi kulit, kontrol negatif 21 hari pasca perlukaan, sel
Tabel 9 Rataan Jumlah Sel Radang Makrofag
Huruf yang sama pada baris yang sama menyatakan tidak berbeda nyata P>0,05
Jumlah makrofag pada kelompok KN lebih tinggi dari kelompok lain. Hal ini dikarenakan pada kelompok KN diduga terdapat infeksi dan sel nekrotik yang lebih banyak. Pada kelompok GH dan GE jumlah makrofag sedikit disebabkan adanya zat aktif yang membantu mengeliminir partikel-partikel asing dan sel nekrotik sehingga tingkat inflamasi rendah.
Neovaskularisasi
Keberadaan pembuluh darah memiliki peranan yang penting untuk memberikan asupan nutrisi bagi jaringan yang sedang beregenerasi. Selain itu, pembuluh darah juga mempunyai peranan untuk menghantarkan sel-sel radang yang dibentuk di sumsum tulang sehingga mendekati jaringan yang terluka, sel radang tersebut melakukan emigrasi.
Tabel 10 Rataan Jumlah Neovaskularisasi
Hari ke- Kelompok
Huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata P>0,05 (huruf kecil) *
Pembuluh darah akan membentuk tunas-tunas pembuluh baru yang nantinya akan berkembang menjadi percabangan baru di daerah jaringan yang terluka untuk menunjang fungsi-fungsinya (Spector 1993).
Pada Tabel 10 terlihat bahwa pemberian gel fraksi etil asetat dan gel fraksi n-heksan dapat mempercepat pembentukan pembuluh darah baru (neovaskularisasi), reepitelisasi, dan jaringan ikat. Pada kelompok GH dan GE neovaskularisasi terjadi dua hari pasca perlukaan. Pada kelompok KN neovaskularisasi baru mulai terjadi pada hari ke 7 pasca perlukaan. Hal ini berarti tidak terdapat vaskularisasi yang cukup pada kelompok KN, sehingga kemungkinan terjadi hambatan pasokan darah kedaerah luka yang menyebabkan luka mengalami hambatan penyembuhan.
Gambar 13 Gambar histopatologi kulit, kontrol positif 14 hari pasca perlukaan, neovakularisasi (V). (MT, obyektif 100X)
Re-epitelisasi dan Luas Jaringan Kolagen
Tabel 11 Rataan Persentase Re-epitelisasi
Hari ke- Kelompok
GH GE KP KN
2 5 ±0,07ABa 5 ±0,0ABa 13 ±0,05Aa 0Ba
4 15 ±0,21ABb 8 ±0,04ABb 53 ±0,57Ab 24 ±0,17
7
Bb
100 ±0ABc 100 ±0ABc 100 ±0Ac 42 ±0,12
14
Bc
100 ±0ABc 100 ±0ABc 100 ±0Ac 38 ±0,53
21
Bc
100 ±0ABc 100 ±0ABc 100 ±0 Ac 92 ±0,12Bc
*
Huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata P>0,05 (huruf kecil) *
Huruf yang sama pada baris yang sama menyatakan tidak berbeda nyata P>0,05 (huruf besar)
Gambar 14 Perbandingan re-epitelisasi dan ketebalan jaringan ikat pada hari ke 2 pasca perlukaan. Pada kelompok KP (Kontrol Positif), GE (Gel fraksi etil asetat), dan GH (Gel n-heksan) re-epitelisasi dan jaringan ikat mulai terbentuk, sedangkan pada kelompok KN (Kontrol Negatif) re-epitelisasi dan jaringan ikat belum terbentuk. (MT, 20X)
GH
GE
Tabel 12 Rataan Persentase Luas Jaringan Kolagen
Hari ke- Kelompok
GH GE KP KN
2 2,5 ±0,035Aa 5 ±0,00 ABa 13 ±0,11ABa 0Ba
4 2,5 ±0,035Aa 5 ±0,00ABa 10 ±0,00ABa 8 ±0,04
7
Ba
20 ±0Ab 5 ±0ABb 28 ±0,04ABb 23 ±0,04
14
Bb
100 ±0Abc 88 ±0,18ABbc 65 ±0,21ABbc 40 ±0,14
21
Bbc
100 ±0Ac 100 ±0 ABc 100 ±0ABc 45 ±0,07ABc
*
Huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata P>0,05 (huruf kecil) *
Huruf yang sama pada baris yang sama menyatakan tidak berbeda nyata P>0,05 (huruf besar)
Gambar 14 Perbandingan re-epitelisasi dan ketebalan jaringan ikat pada hari ke 21 pasca
perlukaan. Pada kelompok KP (Kontrol Positif), GE (Gel fraksi etil asetat),
dan GH (Gel n-heksan) re-epitelisasi 100%, jaringan ikat padat dan kompak
(100%), sedangkan pada kelompok KN (Kontrol Negatif) re-epitelisasi 92%
dan jaringan ikat belum terbentuk sempurna (45%). (MT, 40X)
KN
KP
Berdasarkan Tabel 11 dan 12 setelah dilakukan analisis statistik dengan desain acak sempurna model tetap diperoleh hasil dengan taraf signifikan P≤ 0,05. Hipotesis nol (Ho) ditolak untuk semua kelompok percobaan. Ini berarti bahwa terdapat perbedaan pengaruh perlakuan pada setiap kelompok terhadap rataan persentase re-epitelisasi dan luas jaringan kolagen. Selanjutnya dilakukan uji Duncan untuk mengetahui perbedaan jumlah re-epitelisasi dan luas jaringan kolagen pada setiap kelompok perlakuan. Berdasarkan analisis uji Duncan diketahui bahwa terdapat perbedaan, pada kelompok KN menunjukan hasil yang berbeda yaitu lebih rendah dibandingkan dengan kelompok lain. Hasil pengamatan rataan pesentase re-epitelisasi dan luas jaringan kolagen pada kelompok GH, GE, dan KP tidak memiliki perbedaan. Pada kelompok KN re-epitelisasi dan pembentukan jaringan kolagen baru terjadi pada hari ke 4 pasca perlukaan (Tabel 11 dan 12).
Simpulan
1. Gel fraksi etil asetat dan gel fraksi n-heksan rimpang kunyit stabil secara organoleptis meliputi konsistensi, warna dan bau. Nilai pH gel tidak mengalami perubahan selama penyimpanan pada suhu 25oC sedangkan pada suhu 40oC mengalami perubahan, tetapi masih dalam rentang persyaratan pH gel untuk kulit. Nilai viskositas gel pada semua formula tidak mengalami perubahan yang signifikan. Sediaan gel stabil dalam penyimpanan pada suhu 25o
2. Gel fraksi etil asetat dan gel fraksi n-heksan rimpang kunyit merupakan sediaan yang stabil dan aman bila digunakan berdasarkan uji keamanan pada punggung tangan 10 orang sukarelawan.
C.
3. Gel fraksi etil asetat dan gel fraksi n-heksan rimpang kunyit memiliki aktivitas dalam proses penyembuhan luka karena dapat mengurangi proses peradangan (antiinflamasi), dapat mempercepat pembentukan pembuluh darah baru (neovaskularisasi), re-epitelisasi. Gel fraksi etil asetat dan gel fraksi n-heksan menunjukan pengaruh yang sama.
Saran
Andersen OM. Markham KR. 2006. Flavonoids Chemistry, Biochemistry and Applications. New York: CRC Press
Aiache JM. 1993. Farmasetika 2 Biofarmasi. Ed ke-2. Widji Soeratri, penerjemah. Surabaya: Airlangga University Press.
Ansel HC. 1989. Pengantar Sediaan Farmasi. Jakarta: UI Press.
Baribault H. 2010. Mouse Models of Type II Diabetes Mellitus. Di dalam: Gabriele P. Michael V. W. Drug Discovery in Mouse Models for Drug Discovery Methods and Protocols. New Yok: Springer. hlm 135-156. Barry, BW. 1983. Dermatological formulations: percutaneous absorption. New
York: Marcel Dekker.
Brenna O, Qvistad G, Brenna E, Waldum HL. 2003. Cytotoxicity of Streptozotocin on Neuroendocrine Cells of the Pancreas and the Gut.
Digestive Diseases and Sciences, Vol. 48, No. 5. 906–910
Chattopadhyay I, Biswas K, Bandyopadhyay U, Banerjee RK. 2004. Turmeric and curcumin; biological actions and medicinal applications. Current Sci. 87 (1): 44-53
Chen J. et. al. 2005. Tissue factor as a link between wounding and tissue repair. Diabetes 52: 2143-2154
Corwin EJ. 2000. Buku saku patofisiologi. Endah P, editor. Jakarta: EGC.
(Dirjen POM) Dirjen Pengawasan Obat dan Makanan. 2000. Acuan sediaan herbal. Jakarta: Departemen Kesehatan Republik Indonesia.
(Dirjen POM) Dirjen Pengawasan Obat dan Makanan. 1995. Farmakope
Indonesia. Ed ke-4. Jakarta: Departemen Kesehatan Republik
Indonesia.
(Depkes RI) Departemen Kesehatan RI. 1995. Materia Medika Indonesia. Jakarta Elsner M, Guldbake B, Tiedge M, Munday R, Lenzen S. 2000. Relative
importance of transport and alkylation for pancreatic beta-cell toxicity of streptozotocin. Diabetologia 43:1528-1533
Fransworth NR. 1966. Biological and Phytochemical Screening of Plants. J. Pharm.Sci. 55(3):243-269.
Gaedcke F. Barbara S. 2003. Herbal Medicinal Products. London: CRC press. Halper J, Leshin LS, Lewis SJ, Li WI. 2003. Wound healing and angiogenic
properties of supernatant from Lactobacillus cultures. Exp. Biology and Med. 228:1329-1337
Harborne JB. 2006. Metode fitokimia: penuntun cara modern menganalisis tumbuhan. Ed ke-2. Bandung: Penerbit ITB.
Herdiana Y. 2007. Formulasi gel undesilenil fenilalanin dalam aktivitas sebagai pencerah kulit. Karya ilmiah yang tidak dipublikasikan.
Jain S. et. al. 2007. PHCOG MAG.: Plant Review Recent trends in Curcuma Longa Linn. Pharmacognosy Reviews. Vol 1. Issue 1.
Juliantina FR. Dewa ACM. Bunga N. Titis N. Indrawati TB. 2008. Manfaat sirih merah (Piper crocatum) sebagai antibakterial terhadap bakteri gram positif dan negatif. Jurnal Kedokteran dan Kesehatan Indonesia.
Jones D. 2008. Pharmaceutics Dosage Form and Design. London: Pharmaceutical Press
Kalangi SJR. 2004. Peran Kolagen pada Persembuhan Luka. [15 April 2009]
Kim J. et. al. 2006. Anti-diabetic Activity of SMK001, a Poly Herbal Formula in Streptozotocin Induced Diabetic Rats: Therapeutic Study. Biol. Pharm. Bull. 29(3) 477—482
Lachman L. Herbert AL. Joseph LK. 1994. Teori dan Praktek Farmasi Industri. Ed ke-3. Jakarta: UI Press.
Lieberman. Rieger. Banker. 1989. Pharmaceutical Dosage Form : Disperse System. Ed ke-2. New York: Marcel Dekker Inc.
Boylan JC. 1994. Cairan. Di dalam: Lachman L. Lieberman HA. Kanig JL, editor.
Teori dan Praktek Farmasi Industri II. Diterjemahkan oleh Suyatmi S. Kawira J. Aisyah I. Jakarta: UI Press.
Lu G. Jun HW. 1998. Diffusion studies of methotrexate in Carbopol and Poloxamer gels. International Journal of Pharmaceutics. 160 (1): 1-9 Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Kosasih Padmawinata,
Mazunder UK. Gupta M. Rajeshwar Y. 2005. Antihyperglicemic effect and antioxidant potential of Phyllantus niruri (Euphorbiaceae) in streptozotocin induced diabetics rats. European Bulletin of Drug Research.13, (1): 15-23.
Morsy EM. 1991. The Final Technical Report on: Aloe Vera Stabilization and Processing for The Cosmetic, Bevearage and Food Industries (5rd ed).
United States of America: CITA International.
Murundar P. Pari L. 2007. Protective role of tetrahydrocurcumin on changes in fatty acid composition in streptozotocin-nicotinamide induced type 2 diabetic rats. J. Appl. Biomed. 5:31-38.
Mutschler R. 1991. Dinamika Obat. Bandung: Penerbit ITB.
Nwozo S. Adaramoye O. Ajaiyeoba E. 2009. Oral administration of extract from
Curcuma longa lowers blood glucose and attenuates alloxan-induced hyperlipidemia in diabetic rabbits. Pakistan Journal of Nutrition 8 (5): 625-628.
Pandya M.M. 1995. A study of septic wounds in diabetics and role of herbal treatment. Sach. Ayur. 48(3):392-4.
Penn D. 1999. A House Mouse Primer.
April 2009].
Ravindran PN. Babu KN. Sivaraman K. 2007. Turmeric The Genus Curcuma. New York: CRC Press.
Rosen MR. 2005.Delivery system handbook for personal care and cosmetic products: technology, applications, and formulations. United States of America: William Andrew, Inc.
Rowe RC. Paul JS. Marian EQ. 2009. Handbook of Pharmaceutical Excipients.
Sixth edition. London: Pharmaceutical Press.
Scobie IN. 2007. Atlas of Diabetes. Ed. 3. United Kingdom: Informa UK Ltd. 74 Senthilvel G. et al. 2006. Effect of a Polyherbal Formulation (Diarun plus) on
Streptozotocin induced experimental diabetes. International Journal of Tropical Medicine. 1(2): 88-92.