APLIKASI NANO KITOSAN SEBAGAI PENGAWET ALAMI
FILLET
NILA MERAH (
Oreochromis
sp.) SELAMA
PENYIMPANAN SUHU
CHILLING
DIANITA INDAH PRAHMILA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aplikasi Nano Kitosan sebagai Pengawet Alami Fillet Nila Merah (Oreochromis sp.) Selama Penyimpanan Suhu Chilling adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
ABSTRAK
DIANITA INDAH PRAHMILA. Aplikasi Nano Kitosan sebagai Pengawet Alami Fillet Nila Merah (Oreochromis sp.) selama Penyimpanan Suhu Chilling. Dibimbing oleh DESNIAR dan PIPIH SUPTIJAH.
Nano kitosan diketahui berpotensi dalam memperpanjang masa simpan produk perikanan karena sifatnya yang tidak beracun, biodegradable, dan memiliki aktivitas antibakteri. Penelitian ini bertujuan menentukan karakteristik nano kitosan dan membandingkan penggunaan nano kitosan dengan formalin dalam mengawetkan fillet
ikan nila merah pada penyimpanan suhu chilling. Nano kitosan dibuat dengan metode gelasi ionik dan dikarakterisasi melalui analisis Particle Size Analyzer, mikroskop elektronik payaran, dan Fourier Transform Infrared. Fillet direndam dalam larutan formalin (F), akuades (T), dan nano kitosan (L) selama 5 menit dan nano kitosan 10 menit (S). Fillet disimpan pada suhu 4±1 oC dan dianalisis total mikroba aerob, Total Volatile Base, dan pH pada hari ke-0, 2, 4, 6, 8, 10, dan 12. Karakteristik nano kitosan yang dihasilkan berukuran 512,58 nm dengan morfologi berbentuk bulat dan derajat deasetilasi sebesar 79,49%. Perendaman dengan nano kitosan selama 5 menit merupakan perlakuan terbaik untuk pengawetan fillet. Nilai total mikroba aerob, TVB, dan pH fillet S, L, dan F belum melewati batas aman konsumsi (<5 log cfu/g, <20 mg N/100 g, dan <7) hingga penyimpanan hari ke-12 dan tidak berbeda nyata satu sama lain (p>0,05), sehingga nano kitosan dapat dijadikan pengawet alami fillet nila merah dan dapat menggantikan formalin bila dilihat dari parameter total mikroba aerob, TVB, dan pH.
Kata kunci: chilling, fillet, formalin, nano kitosan, pengawet alami
ABSTRACT
DIANITA INDAH PRAHMILA. Application of Chitosan Nanoparticles as Biopreservative on Filleted Red Tilapia (Oreochromis sp.) During Refrigerated Storage. Supervised by DESNIAR and PIPIH SUPTIJAH.
Chitosan nanoparticle has gained high interest in recent times to extend the shelf-life of fish product due to its nontoxicity, biodegradability, and antibacterial activity. The purpose of this study were to characterize chitosan nanoparticles and to compare the use of chitosan nanoparticles and formaldehyde in extending the shelf-life of filleted red tilapia. The chitosan nanoparticles were analyzed by particle size analyzer, scanning electron microscopy, and fourier transform infrared. The red tilapia fillets were dipped in formaldehyde (F), aquades (T), and nanochitosan (L) for 5 minutes, and nanochitosan for 10 minutes (S). Filleted tilapia were stored at 4±1 oC for 12 days and determined based on microbiological and biochemical analysis on day of 0, 2, 4, 6, 8, 10, and 12. The charac-teristics of chitosan nanoparticles were 512.58 nm and 79.49% on degree of deacety-lation. Results showed that the best treatment were filleted red tilapia that were dipped in nanochitosan for 5 minutes. The value of total aerobic microbial, total volatile base and acidity on S, L, and F filleted red tilapia has not passed the safety limit for consumption (<5 log cfu/g, <20 mg N/100 g, and <7) until day 12 and showed no significant difference (p>0.05). These indicated that chitosan nanoparticle has a function as a natural preservative to replace formaldehyde in the shelf-life extension of red tilapia fillets.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
APLIKASI NANO KITOSAN SEBAGAI PENGAWET ALAMI
FILLET
NILA MERAH (
Oreochromis
sp.) SELAMA
PENYIMPANAN SUHU
CHILLING
DIANITA INDAH PRAHMILA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi berjudul “Aplikasi Nano Kitosan sebagai Pengawet Alami Fillet Nila Merah (Oreochromis sp.) selama Penyimpanan Suhu Chilling” dengan baik. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan skripsi ini, yaitu:
1 Dr. Desniar, S.Pi., M.Si dan Dr. Dra. Pipih Suptijah, MBA. selaku dosen pembimbing yang telah memberikan pengarahan, bimbingan, dan motivasi dalam penyusunan skripsi ini,
2 Prof. Dr. Ir. Nurjanah, MS sebagai penguji dan Dr. Eng. Uju S.Pi., M.Si. sebagai perwakilan program studi Teknologi Hasil Perairan yang telah banyak memberikan saran dan perbaikan dalam penyusunan skripsi,
3 Prof. Dr. Ir. Joko Santoso, M.Si selaku ketua Departemen Teknologi Hasil Perairan,
4 Seluruh dosen Departemen Teknologi Hasil Perairan pada khususnya dan Institut Pertanian Bogor pada umumnya atas ilmu yang diberikan,
5 Ibu Ema Masruroh S.Si., Dini Indriani AMd, dan Ardila Prameswari, S.Pi yang telah membantu penulis selama penelitian di Laboratorium,
6 Pak Ade Suratman, mas Adi, dan para staff Tata Usaha yang telah banyak membantu dalam hal administratif,
7 Papa, ibu, dan keluarga tercinta atas segala doa, dukungan, bantuan moril dan materiil, serta motivasi tiada henti kepada penulis,
8 Teman seperjuangan (Sari, Imam, Fahri, Rasta, Alam, Budi, Batara) serta rekan THP 46 atas bantuan dan kebersamaan dalam suka duka selama penelitian serta penyusunan skripsi ini,
9 Keluarga besar THP 47, THP 48, serta Pascasarjana untuk dukungan dan kerjasamanya,
10 Serta semua pihak yang telah membantu baik secara langsung maupun tidak langsung hingga terselesaikannya skripsi ini.
Penulis menyadari bahwa masih ada kekurangan pada penulisan skripsi ini. Oleh sebab itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, Februari 2016
DAFTAR ISI
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE PENELITIAN ... 3
Waktu dan Tempat ... 3
Bahan Penelitian ... 3
Peralatan Penelitian ... 3
Prosedur Penelitian ... 3
Pembuatan dan Karakterisasi Nano Kitosan (Suptijah et al. 2011) ... 4
Aplikasi Nano Kitosan pada Fillet Nila Merah (Nadia 2014) ... 4
Prosedur Analisis ... 5
Pengukuran Partikel Nano Kitosan dengan Particle Size Analyzer (PSA) ... 5
Morfologi Nano Kitosan dengan Mikroskop Elektronik Payaran (SEM)... 6
Spektroskopi Gugus Fungsi Nano Kitosan (FTIR) ... 6
Analisis Total Mikroba Aerob (BSN 2006) ... 6
Total Volatile Base (TVB) (Apriyantono et al. 1989) ... 7
Pengukuran pH (Apriyantono et al. 1989) ... 8
Rancangan Penelitian ... 8
HASIL DAN PEMBAHASAN ... 9
Karakteristik Nano Kitosan... 9
Ukuran dan Morfologi Nano Kitosan ... 9
Spektroskopi Gugus Fungsi Nano Kitosan ... 10
Aplikasi Nanopartikel Kitosan pada Fillet Nila Merah ... 12
Total Mikroba Aerob ... 12
Total Volatile Base (TVB) ... 13
Nilai pH ... 15
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 17
DAFTAR PUSTAKA ... 17
LAMPIRAN ... 21
DAFTAR GAMBAR
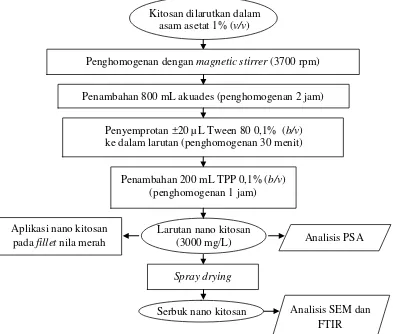
1 Diagram alir pembuatan nano kitosan dengan metode gelasi ionik ... 4
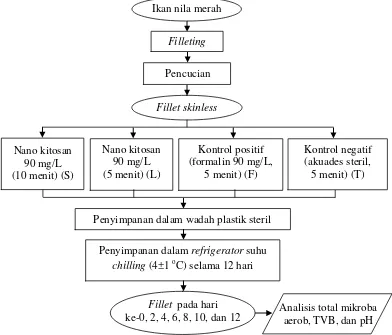
2 Aplikasi nano kitosan pada fillet nila merah ... 5
3 Dispersi ukuran berdasarkan intensitas ... 9
4 Morfologi nanopartikel kitosan ... 10
5 Grafik spektrum inframerah nanopartikel kitosan ... 11
6 Total mikroba aerob fillet nila merah selama penyimpanan suhu 4±1oC. ... 12
7 Nilai TVB fillet nila merah selama penyimpanan suhu 4±1 oC. ... 14
8 Nilai pH fillet nila merah selama penyimpanan suhu 4±1 oC. ... 15
DAFTAR LAMPIRAN
1 Data Hasil Analisis Particle Size Analyzer (PSA) Nano Kitosan ... 232 Sertifikat Analisis Kitosan ... 24
3 Analisis Statistik Pengaruh Perlakuan dan Waktu Pengamatan terhadap Total Mikroba Aerob ... 25
4 Analisis Statistik Pengaruh Perlakuan dan Waktu Pengamatan terhadap Nilai Total Volatile Base (TVB) ... 27
PENDAHULUAN
Latar Belakang
Ikan telah diketahui memiliki kandungan gizi dan protein yang cukup tinggi. Protein diperlukan tubuh untuk pertumbuhan sel, pengganti sel yang rusak, dan sebagai sumber kalori. Industri perikanan Indonesia semakin berkembang dan diprediksi akan terus meningkat dalam beberapa tahun mendatang (MRI 2015). Meski demikian, kemajuan tersebut lebih condong pada pemasaran internasional karena rendahnya konsumsi ikan di dalam negeri. Beberapa penyebab keengganan makan ikan antara lain rumitnya preparasi ikan sebelum dimasak (Nurjanah et al. 2011), banyaknya tulang pada ikan, baunya yang amis, dan penampakannya yang dianggap menakutkan bagi sebagian orang (Gifford 2010). Salah satu cara untuk mengurangi keengganan tersebut ialah melalui pengolahan dan penyajian ikan dalam bentuk fillet.
Fillet merupakan bentuk preparasi ikan yang mulai banyak dilakukan di Indonesia. Industri fillet ikan terus berkembang dengan adanya dukungan pemerintah karena dianggap meningkatkan daya jual produk ikan sekaligus meningkatkan pendapatan petani ikan budidaya (Kemenperin 2015). Fillet ikan biasa dipasarkan dalam bentuk chilled dan frozen. Data Forbes (2015) menunjukkan bahwa nilai chilled fillet terus mengalami peningkatan dalam satu dekade terakhir, sementara nilai frozen fillet terus menurun meskipun peningkatan harganya lebih rendah dibandingkan chilled fillet. Hal ini didukung hasil survei Gifford (2010) yang menunjukkan bahwa chilled fillet lebih digemari masyarakat dibandingkan frozen. Menurut Nevin (2003), konsumen menganggap chilled fillet lebih mudah diolah, praktis, efisien, dan penilaian kesegaran fillet dalam bentuk chilled dirasa lebih mudah dibandingkan frozen.
Ikan merupakan bahan pangan yang tergolong mudah mengalami kerusakan atau high perishable food. Penyimpanan fillet pada suhu chilling mampu memperlambat proses pembusukan, tetapi tidak menghentikannya. Ligthart (2007) menyatakan bahwa suhu refrigerated cabinet dalam supermarket umumnya adalah 4-7oC. Husni et al. (2014) dan Khalafalla et al. (2015) melaporkan bahwa fillet nila merah yang disimpan pada suhu 6oC dan 2oC hanya mampu bertahan 6-8 hari hingga mencapai batas aman layak konsumsi. Hal ini menunjukkan perlu adanya tindakan untuk memperpanjang masa simpan fillet ikan dalam rantai penjualan, salah satunya yaitu dengan penambahan bahan pengawet.
Bahan pengawet yang umum ditambahkan pada pengolahan ikan saat ini ialah asam sorbat, asam benzoat, sulfit, nitrit dan nitrat yang merupakan bahan pengawet sintetis. Pembatasan kadar pengawet jenis sintetis penting diperhatikan karena adanya kemungkinan terjadinya efek yang membahayakan bagi tubuh (BPOM 2014). Penggunaan bahan pengawet sintetis yang tidak terkontrol menyebabkan ditemukannya beberapa kasus dalam penyalahgunaan bahan pengawet yang sudah dilarang untuk mengawetkan makanan, salah satunya ialah formalin.
2
supermarket. Dinas Kesehatan Kota Mojokerto dan BPOM Kota Tegal juga menemukan kandungan formalin pada ikan asin (Tribunnews 2013) dan ikan teri (Liputan6 2015) yang dijual di sebuah supermarket. Paparan formalin melalui saluran pencernaan dapat mengakibatkan luka korosif dan perforasi lambung. Formalin dalam kadar tinggi dapat mematikan sisi aktif dari protein-protein vital dalam tubuh yang menyebabkan fungsi sel terhenti, kekacauan informasi genetik, mutasi gen dan sel kanker. Efek sistemik dapat berupa depresi susunan syaraf pusat, koma, kejang, hingga kematian (BPOM 2006). Kasus-kasus tersebut memunculkan kesadaran masyarakat untuk lebih selektif dan waspada dalam memilih bahan pangan dan mengutamakan pengawet alami untuk menjamin keamanan pangan.
Salah satu sumber pengawet alami yang telah diteliti ialah kitosan. Kitosan merupakan polimer kationik alami hasil dari deasetilasi kitin, suatu senyawa organik yang melimpah di alam setelah selulosa. Kitosan telah terbukti tidak beracun, biodegradable, biokompatibel, dan telah digunakan dalam industri makanan sebagai pencerna dan pemerangkap komponen lemak yang aman dan alami (Kean dan Thanou 2010). Penelitian Cruz et al. (2006) menunjukkan bahwa kitosan mampu menghambat pertumbuhan bakteri gram positif dan gram negatif yang diisolasi dari produk perikanan. Penelitian tersebut menyimpulkan bahwa kitosan dapat digunakan untuk meningkatkan daya simpan produk perikanan.
Hasil penelitian Alishahi (2014) menunjukkan bahwa nano kitosan menghasilkan nilai total mikroba aerob yang lebih rendah dibandingkan dengan kitosan biasa. Kitosan dalam bentuk nanopartikel memiliki efektivitas antibakteri yang lebih tinggi daripada kitosan biasa karena nano kitosan memiliki luas permukaan dan volume yang lebih besar. Qi et al. (2004) menyatakan bahwa nano kitosan berpotensi sebagai agen antibakteri pada industri obat dan makanan.
Nadia (2014) melaporkan bahwa nano kitosan dapat menggantikan klorin pada industri fillet nila merah. Penelitian tersebut hanya mengkaji kemampuan nano kitosan sebagai pengganti klorin. Karena itu, nano kitosan perlu dikaji pula potensinya sebagai pengawet alami pada fillet nila merah dan membandingkannya dengan daya awet formalin. Penelitian ini diharapkan dapat menghasilkan masa simpan fillet nila merah yang lebih lama selama penyimpanan suhu chilling dan dapat menggantikan formalin.
Tujuan Penelitian
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan pada bulan Juli hingga September 2015. Pembuatan nano kitosan dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan IPB. Analisis ukuran partikel dilakukan di Laboratorium Analisis Bahan Departemen Fisika IPB, pengeringan nano kitosan dilakukan di Laboratorium Pilot Plant Pusat Antar Universitas IPB, karakterisasi gugus fungsi nano kitosan dilakukan di Laboratorium Pusat Studi Biofarmaka IPB, dan karakterisasi morfologi nano kitosan dilakukan di Laboratorium Nanoteknologi Cimanggu. Preparasi ikan dilakukan di Laboratorium Penanganan Bahan Baku. Analisis total mikroba aerob, TVB, dan pH dilakukan di Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Bahan Penelitian
Bahan utama yang digunakan pada penelitian ini adalah kitosan (medical grade, Biotech Surindo) dan ikan nila merah (Oreochromis sp.) yang diperoleh dari kolam pembesaran ikan di Desa Petir, Darmaga, Bogor. Bahan-bahan yang digunakan untuk pembuatan nano kitosan antara lain CH3COOH 1%, tripolifosfat (TPP) 0,1%, akuades, emulsifier (Tween 80). Bahan-bahan lain meliputi bahan untuk analisis karakteristik nano kitosan dan uji total mikroba aerob, TVB, dan pH yang terdiri dari media plate count agar, buffered peptone water, alkohol 70%, TCA 7%, H3BO3, larutan K2CO3, HCl 0,001 N, buffer pH 4 dan buffer pH 7.
Peralatan Penelitian
Alat yang digunakan untuk pembuatan nano kitosan meliputi magnetic stirrer (Yamato MD-41), timbangan digital, batang pengaduk, gelas ukur, beaker glass, dan pipet tetes. Alat yang digunakan untuk karakterisasi nano kitosan antara lain Mini Spray Dryer (Buchi 190), particle size analyzer (VASCO Instrument), spektrofotometer (Quorum Q150R ES), dan mikroskop elektronik payaran (Zeiss). Alat yang digunakan dalam pengujian lainnya ialah autoklaf (Yamato SM 52 Autoclave), inkubator (Thermolyne type 42000 Incubator), laminar air flow (Thermo Scientific 1300 Series A2), vortex, pH meter (Eutech Instruments), cawan petri, pipet volumetrik, dan cawan conway.
Prosedur Penelitian
4
Pembuatan dan Karakterisasi Nano Kitosan (Suptijah et al. 2011)
Nano kitosan dibuat menggunakan metode gelasi ionik yang didasarkan pada interaksi elektrostatik antara grup amina kitosan dan grup muatan negatif polianion tripolifosfat (TPP). Sebanyak 3 g kitosan dilarutkan dalam 60 mL asam asetat dengan bantuan magnetic stirrer, lalu ditambahkan akuades 800 mL dan dihomogenkan selama 2 jam dengan kecepatan magnetic stirrer 3700 rpm. Sebanyak 20 µL emulsifier (Tween 80 0,1%) disemprotkan ke dalam larutan dan dihomogenkan selama 30 menit, selanjutnya dilakukan stabilisasi dengan penambahan 200 mL TPP 0,1% tetes demi tetes ke dalam larutan kitosan hingga terbentuk suspensi nanopartikel. Pengadukan terus dilanjutkan selama 1 jam agar proses ikatan silang berlangsung sempurna dan partikel yang dihasilkan tetap stabil. Larutan nano kitosan yang dihasilkan kemudian dikarakterisasi dengan uji particle size analizer (PSA), scanning electron microscopy (SEM), dan Fourier transform infrared spectroscopy (FTIR).
Gambar 1 Diagram alir pembuatan nano kitosan dengan metode gelasi ionik (Suptijah et al. 2011)
Aplikasi Nano Kitosan pada Fillet Nila Merah (Nadia 2014)
Ikan nila merah ditransportasikan ke laboratorium dalam keadaan hidup. Ikan nila merah dimatikan, dibersihkan, dibuat fillet, dan dibuang kulitnya. Proses pembuatan fillet dilakukan dengan cepat, hati-hati, dan dikondisikan dalam keadaan bersih. Fillet yang telah dipreparasi dikumpulkan dalam satu wadah bersih dengan penambahan es. Fillet ditimbang lalu direndam dalam
masing-Aplikasi nano kitosan
Penghomogenan dengan magnetic stirrer (3700 rpm)
Penambahan 800 mL akuades (penghomogenan 2 jam)
Penyemprotan ±20 µL Tween 80 0,1% (b/v) ke dalam larutan (penghomogenan 30 menit)
Penambahan 200 mL TPP 0,1% (b/v) (penghomogenan 1 jam)
Serbuk nano kitosan
5
masing perlakuan dan dimasukkan dalam plastik steril untuk analisis selanjutnya. Seluruh peralatan yang digunakan dikondisikan dalam keadaan bersih.
Perlakuan yang diberikan pada fillet ada empat, yaitu perendaman fillet dengan nano kitosan 90 mg/L pH 6,2 selama 5 menit dan 10 menit; perendaman fillet dengan formalin 90 mg/L pH 6,3; dan perendaman fillet dalam akuades pH 6,6 sebagai kontrol negatif. Prosedur perendaman dilakukan dengan merendam 40 g fillet nila merah dalam 200 mL larutan dari masing-masing perlakuan. Setiap sampel dimasukkan ke dalam wadah plastik steril yang ditutup rapat lalu disimpan dalam refrigerator dengan suhu 4±1 oC. Penyimpanan dilakukan selama 12 hari dengan pengamatan setiap 2 hari sekali untuk analisis total mikroba aerob, TVB, dan pH. Diagram alir tahap aplikasi nano kitosan pada fillet nila merah dapat dilihat pada Gambar 2.
Gambar 2 Aplikasi nano kitosan pada fillet nila merah
Prosedur Analisis
Pengukuran Partikel Nano Kitosan dengan Particle Size Analyzer (PSA) Sampel nano kitosan dimasukkan ke dalam dispersan berupa akuades pH 7 kemudian ditempatkan di dalam kuvet sebanyak 3 mL. Kuvet kemudian ditembakkan sinar tampak sehingga terjadi difraksi. Pengukuran ukuran partikel memanfaatkan prinsip penghamburan cahaya tampak.
Penyimpanan dalam wadah plastik steril
Fillet pada hari ke-0, 2, 4, 6, 8, 10, dan 12 Penyimpanan dalam refrigerator suhu
6
Morfologi Nano Kitosan dengan Mikroskop Elektronik Payaran
Serbuk nano kitosan diletakkan pada potongan alumunium (stub) berdiameter 1 cm menggunakan karbon tip. Serbuk tersebut dibuat menjadi konduktif dengan cara elektrik menggunakan sinar dari platina tipis (coating) emas selama 60 detik pada tekanan di bawah 2 Pa dan tegangan elektron 20 kV dengan perbesaran 1500 kali dan 5000 kali.
Spektroskopi Gugus Fungsi Nano Kitosan (FTIR) (Khan et al. 2002)
Sebanyak 200 mg KBr ditambahkan pada 2 mg nano kitosan lalu ditumbuk hingga homogen. Sampel dimasukkan ke dalam pressure gauge dan dipadatkan dalam kondisi hampa udara hingga berbentuk kepingan. Sampel kemudian dipasang pada IR card. Spektrum gelombang inframerah ditembakkan melalui sampel yang diletakkan di antara elektroda spektrofotometer, yang kemudian diteruskan menuju komputer. Data yang didapatkan berupa persentase nilai transmitansi, dengan pengukuran spektrum pada rentang bilangan gelombang 4000-400 cm-1. Selanjutnya nilai transmitan pada spektrum hasil pengukuran dicocokkan dengan data pada tabel acuan dari OChemOnline (2015).
Pengukuran derajat deasetilasi didasarkan pada kurva yang tergambar oleh spektrofotometer. Puncak tertinggi (Po) dan puncak terendah (P) dicatat dan diukur dengan garis dasar yang dipilih. Nisbah absorbansi dihitung dengan rumus:
A = LogPoP
Keterangan:
Po = Jarak antara garis dasar dengan garis singgung antara dua puncak tertinggi dengan panjang gelombang 1655 cm-1 atau 3450 cm-1
P = Jarak antara garis dasar dengan lembah terendah dengan panjang gelombang 1655 cm-1 atau 3450 cm-1
Perbandingan absorbansi pada 1655 cm-1 dengan absorbansi 3450 cm-1 digandakan satu per satu per standar N-deasetilasi kitosan (1,33). Pengukuran absorbansi pada puncak yang berhubungan, nilai persen N-deasetilasi dapat dihitung dengan rumus:
Derajat Deasetilasi % = − [AA x , ]
Keterangan:
A1655 = Absorbansi pada panjang gelombang 1655 cm-1 A3450 = Absorbansi pada panjang gelombang 3450 cm-1 1,33 = Konstanta untuk derajat deasetilasi yang sempurna Analisis Total Mikroba Aerob (BSN 2006)
7
Proses perhitungan total bakteri dilakukan dengan ketentuan sebagai berikut:
1. Cawan yang normal berisi 25-250 koloni. Semua koloni dihitung termasuk titik yang berukuran kecil. Seluruh pengenceran dan jumlah koloni dicatat untuk setiap cawan.
2. Cawan yang berisi lebih dari 250 koloni dicatat sebagai terlalu banyak untuk dihitung (TBUD). Jika tidak ada koloni yang tumbuh maka ditulis kurang dari 1 kali pengenceran terendah.
3. Rumus perhitungan yang digunakan adalah:
N =[ � � + , � � ]∑
Keterangan:
N = Jumlah koloni produk, dinyatakan dalam koloni per mL atau koloni per g
∑ = Jumlah koloni pada semua cawan yang dihitung
� = Jumlah cawan pada pengenceran pertama yang dihitung
� = Jumlah cawan pada pengenceran kedua yang dihitung = Pengenceran pertama yang dihitung
Total Volatile Base (TVB) (Apriyantono et al. 1989)
Sampel sebanyak 15 g ditambahkan ke dalam 45 mL larutan TCA 7% lalu dihaluskan dengan homogenizer. Larutan yang diperoleh kemudian disaring dengan kertas saring sehingga didapatkan filtrat yang jernih. Sebanyak 1 mL asam borat (H3BO3) dimasukkan ke dalam inner chamber cawan Conway. Filtrat sampel sebanyak 1 mL dimasukkan ke dalam outer chamber cawan Conway sebelah kiri, kemudian 1 mL larutan K2CO3 ditambahkan ke dalam outer chamber sebelah kanan dengan posisi cawan Conway hampir menutup. Cawan Conway ditutup rapat, kemudian digerakkan memutar agar kedua cairan di outer chamber tercampur.
8
Pengukuran pH (Apriyantono et al. 1989)
Analisis penentuan pH dilakukan menggunakan alat pH meter. Sampel sebanyak 5 g ditambahkan ke dalam 45 mL akuades, lalu dihomogenkan selama 2 menit. Elektroda dari pH meter dicelupkan ke dalam sampel hingga nilai pH terbaca stabil.
Rancangan Penelitian
Analisis data total mikroba aerob, total volatile base (TVB), dan nilai pH menggunakan rancangan acak lengkap (RAL) (Mattjik dan Sumertajaya 2006) dengan satu faktor, yaitu faktor perlakuan fillet. Perlakuan terdiri dari 4 taraf yaitu kontrol (perendaman fillet dengan akuades), perendaman fillet dengan nano kitosan 90 mg/L selama 5 menit, perendaman fillet dengan nano kitosan 90 mg/L selama 10 menit, dan perendaman dengan formalin 90 mg/L. Setiap perlakuan dilakukan sebanyak dua ulangan. Variabel yang diamati yaitu total mikroba aerob, TVB, dan pH. Model rancangan yang digunakan yaitu:
Yij= µ + τi + εij Keterangan:
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j µ = Rataan umum
τi = Pengaruh perlakuan ke-i
εij = Pengaruh acak pada perlakuan ke-i ulangan ke-j Hipotesis yang diuji yaitu:
H0 = Perlakuan yang diberikan tidak memberikan pengaruh terhadap nilai total mikroba aerob, TVB, dan pH.
H1 = Perlakuan yang diberikan memberikan pengaruh terhadap nilai total mikroba aerob, TVB, dan pH.
Sebelum dilakukan analisis ragam, terlebih dahulu dilakukan uji kenormalan data dengan uji Kolmogorov Smirnov menggunakan software SPSS 15.0 dengan output berupa P value (p>0,05 berarti data menyebar normal). Data yang diperoleh dianalisis menggunakan analisis sidik ragam (ANOVA), jika hasil analisis menunjukkan “Tolak H0” (p<0,05) pada selang kepercayaan 95% maka dilakukan uji lanjut menggunakan uji Duncan. Rumus uji Duncan yaitu:
� = ∑�; ; √�
Keterangan:
Rp = Nilai kritikal untuk perlakuan yang dibandingkan p = Perlakuan
dbs = Derajat bebas
9
HASIL DAN PEMBAHASAN
Karakteristik Nano Kitosan
Karakterisasi nano kitosan dilakukan melalui uji Particle Size Analyzer (PSA), scanning electron microscopy (SEM), dan Fourier Transform Infrared (FTIR). Analisis PSA digunakan untuk mendapatkan informasi ukuran nano kitosan, sedangkan SEM digunakan untuk mengamati morfologi nano kitosan. Analisis FTIR digunakan untuk mendeteksi gugus fungsi serta derajat deasetilasi nano kitosan yang dihasilkan.
Ukuran dan Morfologi Nano Kitosan
Ukuran partikel nano kitosan diuji segera setelah prosedur pembuatan nano kitosan selesai dilakukan. Analisis PSA berdasarkan intensitas dispersi partikel nano kitosan yang dihasilkan disajikan pada Gambar 3. Hasil analisis PSA secara keseluruhan dapat dilihat pada Lampiran 1.
Gambar 3 Dispersi ukuran berdasarkan intensitas
Partikel nano kitosan yang dihasilkan mempunyai dispersi ukuran rata-rata sebesar 512,58 nm yang terdistribusi dari 195,04-1349,32 nm (Gambar 3). Distribusi ukuran nano kitosan berdasarkan intensitas, volume, dan jumlah partikel masing-masing ialah sebesar 540,09 nm, 547,66 nm, dan 416,86 nm dengan indeks polidispersitas (PDI) sebesar 0,0950. Hasil ini menunjukkan bahwa sampel memiliki distribusi ukuran yang sempit, artinya larutan nano kitosan yang dihasilkan terbilang homogen. Nilai PDI yang mendekati 1 menunjukkan distribusi ukuran yang luas, sedangkan semakin kecil nilai PDI menunjukkan distribusi ukuran yang semakin seragam (Horiba 2014).
10
kitosan, bobot molekul, dan kondisi pencampuran saat stirring atau sonikasi. Suptijah et al. (2011) menjelaskan bahwa semakin besar intensitas kecepatan putaran dari magnetic stirrer maka partikel yang dihasilkan akan semakin kecil.
Analisis SEM dilakukan setelah larutan nano kitosan dikeringkan dengan teknik spray drying. Hasil visualisasi SEM lebih baik dibandingkan dengan mikroskop cahaya konvensional karena sumber cahayanya berupa elektron yang memiliki energi 1000 kali lebih kuat dibandingkan dengan energi dari cahaya tampak (Balaz 2008). Hasil uji SEM disajikan dalam Gambar 4.
(a) (b)
Gambar 4 Morfologi nano kitosan perbesaran (a) 1500 kali dan (b) 5000 kali Morfologi nano kitosan yang dihasilkan berbentuk bulat menyerupai bola, namun sebagian dari partikel-partikel tersebut telah mengalami aglomerasi (Gambar 4). Hasil ini tampak dengan adanya partikel berbentuk bulat cekung, dengan distribusi ukuran yang tidak merata. Aglomerasi yang terjadi pada nano kitosan yang diuji diduga akibat jangka waktu penyimpanan yang cukup lama dan penyimpanan yang kurang baik sebelum analisis SEM dilakukan.
Aglomerasi merupakan fenomena alam yang terjadi pada kondisi tertentu, baik diinginkan maupun tidak. Aglomerasi yang tak diinginkan, secara khusus disebut caking, merupakan keadaan bahan padat dalam jumlah banyak yang bergabung atau menggumpal karena ikatan kuat yang terbentuk antar partikel bahan tersebut. Menurut Paternina (2014), mekanisme utama yang dapat menyebabkan partikel bahan membentuk ikatan ialah ikatan mekanis, plastic-flow bonding, pengisian elektrostatis, ikatan fisika-kimia (termasuk moisture caking), dan kombinasi keempatnya. Ukuran partikel, distribusi ukuran partikel, dan bentuk partikel memainkan peranan penting dalam mekanisme tersebut. Potensi terjadinya caking semakin besar dengan meningkatnya kontak antar partikel. Karena itu, umumnya semakin kecil ukuran partikel dan semakin rendah keseragaman bentuk partikel maka semakin mudah terjadi caking pada bahan. Spektroskopi Gugus Fungsi Nano Kitosan
11
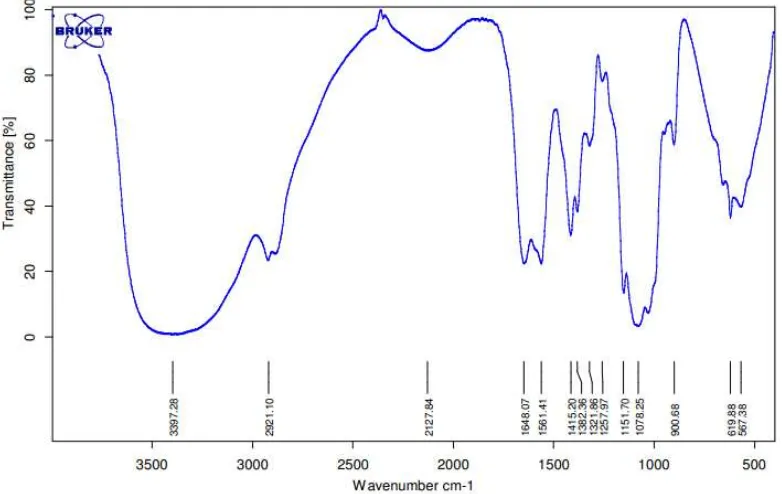
tertentu. Hasil analisis FTIR pada nano kitosan ialah berupa kurva bilangan gelombang terhadap persen transmitansi yang disajikan dalam Gambar 5.
Gambar 5 Grafik spektrum inframerah nano kitosan Spektrum FTIR nano kitosan memiliki puncak-puncak spesifik, yaitu gugus
hidroksil (-OH) yang berada pada bilangan gelombang 3397 cm-1 dan gugus amina (-NH2) yang berada pada bilangan gelombang 1648 cm-1 (Gambar 5). Secara spesifik, pita lebar pada daerah serapan 3550 dan 3200 cm-1 berkaitan dengan rentangan -OH dari ikatan hidrogen baik antarmolekul maupun intramolekul (Parida et al. 2011). Serapan bilangan gelombang gugus hidroksil (-OH) dan gugus amina (-NH2) pada nano kitosan yang dihasilkan ini tidak jauh berbeda dengan serapan bilangan pada kitosan komersil, yaitu pada bilangan gelombang 3441 cm-1 dan 1655cm-1 (Pebriani et al. 2012). Spektrum FTIR nano kitosan mengalami pergeseran intensitas transmitans pada daerah spektrum. Perubahan transmitans ini menunjukkan adanya interaksi antara kitosan, STPP, dan Tween 80 yang digunakan dalam pembuatan nano kitosan (Saputro 2013).
12
Pengaruh Nano Kitosan pada Fillet Nila Merah
Fillet yang telah diberi perlakuan disimpan dalam refrigerator pada suhu 4±1 oC. Pengamatan dilakukan pada hari ke-0, 2, 4, 6, 8, 10, dan 12, meliputi analisis total mikroba aerob, TVB, dan pH.
Total Mikroba Aerob
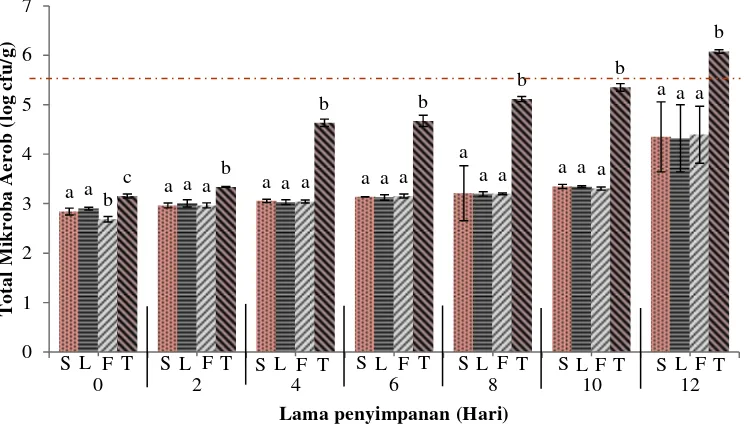
Total mikroba aerob fillet nila merah pada awal penyimpanan (hari ke-0) mencapai 3,15 log cfu/g. Batas maksimum cemaran mikroba dalam ikan segar menurut BSN (2009) adalah maksimal 5 x 105 cfu/g atau 5,69 log cfu/g. Perbandingan data tersebut menunjukkan bahwa fillet nila merah pada awal penyimpanan masih dalam keadaan segar. Data hasil analisis TPC pada fillet nila merah dengan beberapa perlakuan disajikan pada Gambar 6. Tabel hasil analisis statistik data TPC pada fillet nila merah selama masa penyimpanan disajikan dalam Lampiran 3.
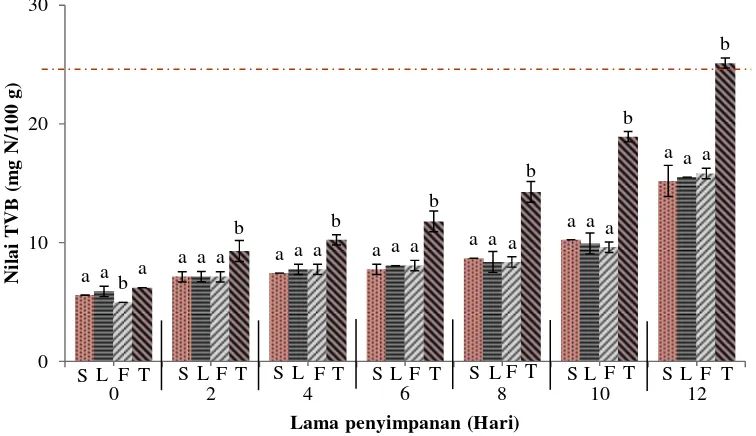
Gambar 6 Total mikroba aerob fillet nila merah selama penyimpanan suhu 4±1oC (keterangan: S= fillet dengan perendaman nano kitosan 10 menit, L= fillet dengan perendaman nano kitosan 5 menit, F= fillet dengan perendaman formalin, T= fillet kontrol negatif).
Penyimpanan hari ke-0, 2, 4, 6, 8, 10, dan 12 menunjukkan bahwa perlakuan yang diberikan pada fillet memberi pengaruh terhadap nilai total mikroba aerob (p<0,05). Hasil uji lanjut Duncan hari ke-0 menunjukkan bahwa total mikroba aerob fillet F berbeda nyata dengan fillet S, L, dan T dengan nilai terendah. Fillet S dan L tidak berbeda nyata satu sama lain, tetapi berbeda nyata terhadap fillet T dimana fillet T memiliki total mikroba aerob tertinggi. Hasil ini menunjukkan adanya aktivitas bakterisidal oleh formalin dan nano kitosan dengan menurunnya total mikroba aerob pada masa awal penyimpanan.
Hasil uji lanjut Duncan hari ke-2, 4, 6, 8, 10, dan 12 menunjukkan bahwa total mikroba aerob fillet S, L, dan F berbeda nyata dengan fillet T, tetapi tidak beda nyata antara satu dengan lainnya. Hasil ini menunjukkan bahwa nano kitosan sama efektifnya dengan formalin dalam menghambat pertumbuhan mikroba pada
13
fillet. Lama perendaman fillet S dan L tidak memberi perbedaan nyata dalam menghambat peningkatan total mikroba aerob sehingga perendaman fillet selama lima menit dapat dikatakan lebih baik karena dianggap lebih efisien.
Hingga akhir pengamatan pada hari ke-12, nilai total mikroba aerob fillet S, L, dan F masih berada dalam batas aman konsumsi, dengan nilai masing-masing sebesar 4,35 log cfu/g, 4,32 log cfu/g, dan 4,39 log cfu/g. Fillet T telah melewati batas aman konsumsi pada hari ke-12 dengan nilai total mikroba aerob mencapai 6,08 log cfu/g. Rong et al. (2012) melaporkan bahwa fillet nila yang direndam larutan kitosan hanya bertahan kurang dari 12 hari dengan total mikroba aerob di akhir penyimpanan mencapai 6 log cfu/g. Hasil ini menunjukkan bahwa larutan nano kitosan mampu mempertahankan masa simpan fillet nila lebih lama. Costa et al. (2011) menyatakan bahwa besarnya volume permukaan dan kecilnya ukuran nano memudahkan partikel untuk masuk ke dalam membran sel bakteri, yang pada akhirnya menyebabkan membran mengalami kerusakan.
Larutan formalin dikenal sebagai desinfektan yang efektif karena sifatnya yang bakterisidal, sporisidal, dan efektif melawan virus (Parija 2009). Kardono (2006) dalam Atika (2014) menyatakan bahwa formalin memiliki unsur aldehida yang bersifat mudah bereaksi dengan protein dan mudah berikatan dengan unsur protein, sehingga protein tersebut tidak dapat dijadikan sumber nutrisi bagi bakteri. Selain itu, formalin dapat merusak bakteri karena bakteri adalah protein. Formaldehida berkombinasi dengan asam amino bebas dari protein pada protoplasma sel, merusak nukleus, dan mengkoagulasi protein (Frazier dan Westhoff 1988).
Rong et al. (2012) menyatakan bahwa kitosan memiliki aktivitas bakterisidal terhadap bakteri patogen dan bakteri pada makanan serta dianggap berpotensi sebagai bahan pengawet makanan. Menurut Solval et al. (2014), kitosan dalam bentuk nano memiliki efektivitas antibakteri yang lebih tinggi daripada kitosan biasa karena nano kitosan memiliki luas permukaan yang lebih besar, sehingga interaksi antara gugus amina (NH2) lebih besar dengan membran sel bakteri. Qi et al. (2004) menyatakan bahwa mekanisme antibakteri nano kitosan terjadi melalui interaksi gugus amina (NH2) bermuatan positif dengan dinding sel yang bermuatan negatif. Hal ini menyebabkan gangguan membran dan kebocoran protein seluler sehingga pada akhirnya membunuh sel bakteri akibat perubahan permeabilitas membran.
Proses pembuatan nano kitosan tidak lepas dari penggunaan larutan asam asetat yang diketahui memiliki aktivitas antibakteri. Namun, asam asetat tersebut bukan merupakan faktor penentu daya antibakteri nano kitosan yang dihasilkan pada penelitian ini. Penelitian Andriani et al. (2007) melaporkan bahwa asam asetat dan asam laktat hanya menunjukkan kemampuan sebagai antibakteri pada konsentrasi 6% ke atas dan menunjukkan beda nyata pada konsentrasi 24%. Karena itu, asam asetat 1% yang digunakan pada penelitian ini tidak memberi pengaruh terhadap kemampuan antibakteri nano kitosan yang dihasilkan.
Total Volatile Base (TVB)
14
masih dalam keadaan sangat segar pada hari ke-0. Hasil analisis TVB fillet nila merah disajikan pada Gambar 7. Tabel hasil analisis statistik data TVB pada fillet nila merah selama masa penyimpanan disajikan dalam Lampiran 4.
Penyimpanan fillet nila merah pada hari ke-0, 2, 4, 6, 8, 10, dan 12 menunjukkan bahwa perlakuan yang diberikan pada fillet memberi pengaruh terhadap nilai TVB (p<0,05). Hasil uji lanjut Duncan hari ke-0 menunjukkan bahwa nilai TVB fillet F berbeda nyata dengan fillet S, L, dan T dengan nilai TVB
terendah. Rendahnya nilai TVB fillet F pada masa awal penyimpanan perendaman formalin, T= fillet kontrol negatif).
Uji lanjut Duncan terhadap nilai TVB tia perlakuan pada hari ke-2, 4, 6, 8, 10, dan 12 menunjukkan bahwa perlakuan S, L, dan F memberikan pengaruh yang berbeda nyata terhadap fillet T, tetapi tidak berbeda nyata satu sama lain. Artinya, perendaman fillet dalam larutan nano kitosan sama efektifnya dengan penggunaan larutan formalin dalam menekan nilai TVB pada fillet, dan perlakuan perendaman fillet dalam larutan nano kitosan selama 5 menit sama efektifnya dengan perendaman selama 10 menit. Fillet yang direndam dalam larutan nano kitosan dan formalin mempunyai tingkat perubahan yang berbeda namun memiliki pola yang sama.
Peningkatan nilai TVB fillet nila merah selama penyimpanan menunjukkan pola yang seiring dengan peningkatan nilai TPC. Susanto et al. (2011) menyatakan bahwa peningkatan kadar TVB disebabkan bertambahnya jumlah bakteri sehubungan dengan semakin berlanjutnya proses kemunduran mutu oleh mikroorganisme yang menghasilkan basa yang mudah menguap seperti amonia.
15
Hal ini menjelaskan peningkatan nilai TVB pada fillet S, L, dan F yang meningkat seiring dengan meningkatnya aktivitas bakteri.
Nilai TVB fillet S, L, dan F masih mengindikasikan fillet dalam kondisi
yang segar pada hari ke-12, yakni masing-masing 15,19 mg N/100 g, 15,50 mg N/100 g, dan 15,81 mg N/100 g. Saat nilai total mikroba aerob pada
fillet kontrol mencapai 6,08 log cfu/g, nilai TVB fillet ialah 25,11 mg N/100 g. Menurut Rong et al. (2012), nilai TVB sekitar 25 mg N/100 g yang ditentukan dengan metode difusi mikro dapat dijadikan indikasi masa akhir penyimpanan karena nilai TVB dapat bervariasi bergantung pada metode deteksi yang digunakan. Penentuan TVB dengan teknik destilasi biasanya menghasilkan nilai TVB yang lebih tinggi dibandingkan teknik difusi mikro. Lakhsmanan (2000) menyatakan bahwa nilai TVB 35-40 mg N/100 g pada daging ikan biasanya dianggap sebagai indikasi pembusukan, bukan tingkat kesegaran. Hal ini karena nilai TVB mengindikasikan aktivitas bakteri pembusuk, sementara TPC menghitung koloni bakteri yang ada pada produk tanpa membedakan jenis bakterinya. Hasil penelitian Atika (2014) melaporkan bahwa fillet ikan kakap yang diawetkan dengan penambahan Lactobacillus plantarum (SK5) memiliki nilai TVB di awal penyimpanan sebesar 6,61 mg N/100 g dan nilai TPC di atas 8 log cfu/g karena L. plantarum yang ikut terhitung dalam analisis TPC.
Nilai pH
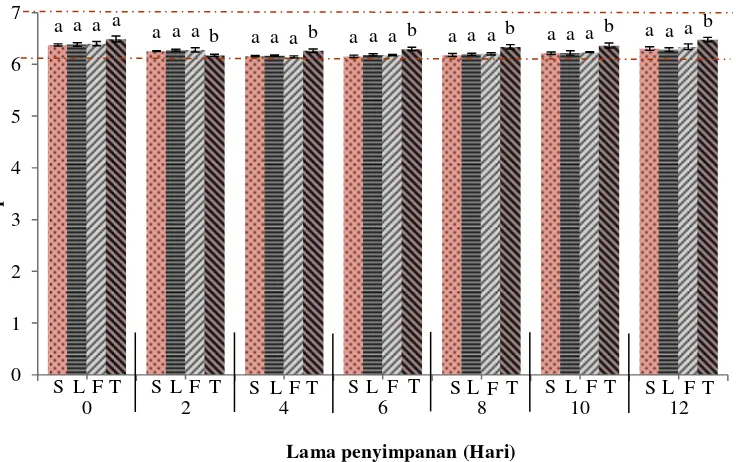
Nilai pH fillet nila merah kontrol pada hari ke-0 ialah 6,49 yang menunjukkan bahwa fillet ikan pada awal penyimpanan masih dalam kondisi segar. Nilai pH ikan segar menurut Eskin (1990) berkisar antara 6,2-7. Nilai pH ikan segar dipengaruhi oleh jumlah glikogen dalam ikan tersebut. Nilai pH pada fillet nila merah dengan berbagai perlakuan disajikan pada Gambar 8. Tabel hasil analisis statistik nilai pH fillet disajikan dalam Lampiran 5.
Gambar 8 Nilai pH fillet nila merah selama penyimpanan suhu 4±1 oC (keterangan: S= fillet dengan perendaman nano kitosan 10 menit, L= fillet dengan perendaman nano kitosan 5 menit, F= fillet dengan perendaman formalin, T= fillet kontrol negatif).
16
Nilai pH fillet S, L, F, dan T pada awal penyimpanan berturut-turut ialah 6,38; 6,39; 6,41; dan 6,49. Nilai pH fillet S, L, dan F cenderung asam disebabkan perlakuan yang diberikan memiliki sifat yang asam. Nano kitosan dibuat dengan melarutkan kitosan dalam larutan asam asetat, sedangkan formalin mudah teroksidasi oleh oksigen atmosfer menjadi asam format. Meski demikian, hasil analisis ragam terhadap nilai pH pada fillet hari ke-0 menunjukkan bahwa perlakuan yang diberikan tidak mempengaruhi nilai pH dengan nilai signifikansi sebesar 0,139 (p>0,05). Artinya, tidak ada perbedaan berarti pada derajat keasaman fillet antar perlakuan pada awal penyimpanan.
Penyimpanan hari ke-2, 4, 6, 8, 10, dan 12 menunjukkan bahwa perlakuan yang diberikan pada fillet memberi pengaruh terhadap nilai pH (p<0,05). Hasil uji lanjut Duncan hari ke-2, 4, 6, 8, 10, dan 12 menunjukkan bahwa nilai pH fillet T berbeda nyata dengan fillet S, L, dan F, tetapi fillet S, L, dan F tidak berbeda nyata satu sama lain. Perubahan nilai pH pada fillet masing-masing perlakuan menunjukkan pola serupa dimana pH cenderung menurun lalu meningkat kembali hingga akhir penyimpanan. Hasil serupa diperoleh dalam penelitian Rong et al. (2011) yang melaporkan bahwa nilai pH fillet kontrol dan fillet yang diberi penambahan kitosan menurun pada penyimpanan hari ke-2 dan kembali meningkat hingga akhir masa penyimpanan, diduga terkait dengan meningkatnya produksi senyawa basa volatil seperti amonia dan trimetilamin oleh bakteri pembusuk.
Nilai pH fillet S, L, F, dan T pada akhir penyimpanan ialah sebesar 6,31; 6,29; 6,34; dan 6,48. Nilai tersebut belum melampaui nilai pH masing-masing fillet saat awal penyimpanan. Hasil ini menunjukkan perubahan nilai pH yang berjalan lambat. Peningkatan nilai pH disebabkan terbentuknya suasana basa dari penguraian protein yang dihasilkan oleh aktivitas bakteri pembusuk. Kristoffersen et al. (2006) menyatakan bahwa aktivitas bakteri dapat mengakibatkan terjadinya kerusakan asam-asam amino, seperti asam glutamat, asam aspartat, lisin, histidin, dan arginin. Asam-asam amino tersebut dapat bertindak sebagai pemicu timbulnya senyawa biogenik amin, hingga pada akhirnya akumulasi basa-basa menguap ini meningkatkan nilai pH pada fillet. Penyimpanan pada suhu rendah (4±1 oC) serta perlakuan yang diberikan menyebabkan aktivitas mikroorganisme dan enzim penyebab pembusukan terganggu sehingga pembentukan basa volatil nitrogen dan aktivitas bakteri juga akan terganggu.
KESIMPULAN DAN SARAN
Kesimpulan
17
perendaman nano kitosan 90 mg/L dapat bertahan hingga 12 hari penyimpanan. Fillet dengan perendaman nano kitosan 90 mg/L selama 5 menit merupakan perlakuan yang terbaik.
Saran
Nano kitosan yang dihasilkan dengan metode gelasi ionik menggunakan magnetic stirrer cukup homogen dan relatif stabil, namun belum diketahui kestabilan nano kitosan selama penyimpanan, sehingga disarankan untuk meneliti lebih lanjut tentang umur simpan nano kitosan sebelum diaplikasikan sebagai antibakteri. Lama pengamatan juga perlu diperpanjang untuk mengetahui masa simpan fillet ikan dengan penambahan nano kitosan. Selain itu, perlu dilakukan analisis sensori untuk melengkapi data kemunduran mutu fillet ikan serta mengetahui penerimaan konsumen terhadap fillet yang diberi penambahan nano kitosan.
DAFTAR PUSTAKA
Alishahi A. 2014. Antibacterial effect of chitosan nanoparticle loaded with nisin for the prolonged effect. Journal of Food Safety. 34(2014): 111-118.
Andriani, Darmono, Kurniawati W. 2007. Pengaruh asam asetat dan asam laktat sebagai antibakteri terhadap bakteri Salmonella sp. yang diisolasi dari karkas ayam. Seminar Nasional Teknologi Peternakan dan Veteriner. Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanto S. 1989.
Analisis Pangan. Bogor (ID): IPB Press.
Atika LN. 2014. Lactobacillus plantarum (SK5) sebagai biopreservatif pada fillet ikan kakap (skinless) selama penyimpanan suhu chilling [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Balaz I. 2008. Mechanochemistry in Nanoscience and Mineral Engineering. Berlin (DE): Springer.
[BPOM] Badan Pengawas Obat dan Makanan. 2014. Mewaspadai bahaya keracunan akibat penggunaan pengawet nitrat dan nitrit pada daging olahan. ik.pom.go.id. (1 November 2015).
[BPOM] Badan Pengawas Obat dan Makanan. 2006. Bahan berbahaya yang dilarang untuk pangan. pom.go.id. (2 November 2015).
[BSN] Badan Standardisasi Nasional. SNI-01-2332.3-2006. Cara Uji Mikrobiologi Bagian 3: Penentuan Angka Lempeng Total (ALT) pada Produk Perikanan. Jakarta (ID): Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. SNI 7388:2009. Batas Maksimum Cemaran Mikroba dalam Pangan. Jakarta (ID): Badan Standardisasi Nasional.
18
Cruz Z, Lauzon H, Arboleya JC, Nuin M, de Maranon IM, Amarita F. 2006. Antimicrobial effect of chitosan on micro-organisms isolated from fishery products, dalam: Luten JB et al. (Editor). 2006. Seafood Research from Fish to Dish: Quality, Safety and Processing of Wild and Farmed Fish. 387-393. [DKP Jakarta] Dinas Kelautan dan Pertanian DKI Jakarta. 2012. DKP DKI
Gan Q, Wang T, Cochrane C, McCarron P. 2005. Modulation of surface charge, particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery. Colloids and Surfaces B: Biointerfaces. chitosan. Advanced Drug Delivery Reviews. 62(2010): 3-11
[Kemenperin] Kementerian Perindustrian. 2015. Rencana Induk Pembangunan Industri Nasional 2015-2035. kemenperin.go.id. (28 Oktober 2015).
Khalafalla FA, Ali FHM, Hassan ARHA. 2015. Quality improvement and shelf-life extension of refrigerated nile tilapia (Oreochromis niloticus) fillets using natural herbs. Beni-Suef University Journal of Basic and Applied Science. 4: 33-40.
Khan TA, Peh KK, Ch’ng HS. 2002. Reporting degree of deacetylation values of chitosan: the influence of analytical methods. Journal of Pharmacy and Pharmaceutical Science. 5(3): 205-212.
Kristoffersen S, Tobiassen T, Esaiassen M, Olson GB, Godvik LA, Seppola MA, Olsen R. 2006. Effects of pre-rigor filleting on quality aspects of Atlantic cod (Gadus morhua L.). Aquaculture Research. 37: 1556-1564.
Lakshmanan PT. 2000. Fish spoilage and quality assessment, dalam: Iyer TSG, Kandoran MK, Thomas M, Matthew PT (Editor). 2006. Quality Assurance In Seafood Processing. Cochin (IN): Society of Fisheries Technologists. Ligthart FATM. 2007. Closed supermarket refrigerator and freezer cabinets: a
feasibility study. Amsterdam (NL): Energy research Centre of the Netherlands. ECN-E-07-098.
19
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Bogor (ID): IPB Press.
[MRI] Marketing Research Indonesia. 2015. Prospek Industri Perikanan di Indonesia. mri-research-ind.com. (30 Oktober 2015).
Nadia LMH. 2014. Aplikasi nano kitosan sebagai pengganti klorin pada fillet nila merah (Oreochromis sp.) [thesis]. Bogor (ID): Institut Pertanian Bogor. Nevin C. 2003. Consumer’s perceptions of frozen and chilled seafood.
seafish.org. (28 November 2015).
Nollet LML, Toldra F. 2010. Handbook of Seafood and Seafood Product Analysis. Boca Raton (US): Taylor & Francis Group.
Nurjanah, Abdullah A, Kustiariyah. 2011. Pengetahuan dan Karakteristik Bahan Baku Hasil Perairan. Bogor (ID): Penerbit IPB Press.
OChemOnline. 2013. Infrared spectroscopy absorption table. http://www.ochemonline.com/. (20 Oktober 2015).
Parida UK, Nayak AK, Binhani BK, Nayak PL. 2011. Synthesis and characterization of chitosan-polyvinyl alcohol blended with cloisite 30b for controlled release of the anticancer drug curcumin. Journal of Biomaterials and Nanobiotechnology. 2:414-425.
Parija SC. 2009. Textbook of Microbiology & Immunology. Haryana (IN): Elsevier.
Paternina J. 2014. Preventing moisture caking, the unwanted agglomeration. Powder and Bulk Engineering Magazine. Minnesota (US): CSC Publishing. Pebriani RH, Rilda Y, Zulhajri. 2012. Modifikasi komposisi kitosan pada proses
sintesis komposit TiO2–kitosan. Jurnal Kimia Universitas Padjajaran. 1: 12-34.
Qi L, Xu Z, Jiang X, Hu C, Zou X. 2004. Preparation and antibacterial activity of chitosan nanoparticles. Carbohydrate Research. 339(16): 2693:2700.
Rong C, Qi L, Bangzhong Y, Biao W. 2012. Chitosan extends the shelf-life of filleted tilapia (Oreochromis niloticus) during refrigerated storage. J. Ocean Univ. China (Oceanic and Coastal Sea Research). 11(3): 408-412.
Saputro CKH. 2013. Karakteristik dan efektivitas penetrasi kafein terjebak dan tersalut nanopartikel kitosan sebagai antiselulit [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Solval KA, Rodezno LAE, Moncada M, Bankston D, Sathivel S. 2014. Evaluation of chitosan nanoparticles as a glazing material for cryogenically frozen shrimp. Journal Food Science and Technology. 57:172-180.
Suptijah P, Jacoeb MA, Rachmania D. 2011. Karakterisasi nano kitosan cangkang udang vannamei (Litopenaeus vannamei) dengan metode gelasi ionik. Jurnal Pengolahan Hasil Perikanan Indonesia. 17(2): 78-84.
Susanto E, Agustini TW, Swastawati F, Surti T, Fahmi AS, Albar MF, Nafis MK. 2011. Pemanfaatan bahan alami untuk memperpanjang umur simpan ikan kembung (Rastrelliger neglectus). Jurnal Perikanan. XIII(2): 60-69.
Thavarajah R, Mudimbaimannar VK, Elizabeth J, Rao UK, Ranganathan K. 2012. Chemical and physical basic of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16(3): 400-405.
20
23
Lampiran 1Data Hasil Analisis Particle Size Analyzer (PSA) Nano Kitosan
a. Hasil Analisis Particle Size Analyzer
b. Sebaran Ukuran berdasarkan Volume Partikel
24
25
Lampiran 3 Analisis Statistik Pengaruh Perlakuan dan Waktu Pengamatan terhadap Total Mikroba Aerob
27
Lampiran 4 Analisis Statistik Pengaruh Perlakuan dan Waktu Pengamatan terhadap Nilai Total Volatile Base (TVB)
a. Analisis Ragam
29
Lampiran 5 Analisis Statistik Pengaruh Perlakuan dan Waktu Pengamatan terhadap Nilai pH
30
pH Hari ke-6
Perlakuan N Subset α = 0,05
1 2
S 2 6,1550
F 2 6,1800
L 2 6,1850
T 2 6,2950
Sig. 0,290 1,000
pH Hari ke-8
Perlakuan N Subset α = 0,05
1 2
S 2 6,1800
L 2 6,1950
F 2 6,2050
T 2 6,3400
Sig. 0,451 1,000
pH Hari ke-10
Perlakuan N Subset α = 0,05
1 2
S 2 6,2150
L 2 6,2200
F 2 6,2350
T 2 6,3650
Sig. 0,597 1,000
pH Hari ke-12
Perlakuan N Subset α = 0,05
1 2
L 2 6,2850
S 2 6,3050
F 2 6,3400
T 2 6,4800
RIWAYAT HIDUP
Penulis dilahirkan di Palembang, Sumatera Selatan pada 21 April 1992. Penulis merupakan putri keempat dari pasangan M. Djamhuri Mochtar dan Hastina Patriani. Tahun 2009 penulis lulus dari SMA Negeri 8 Bandung dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Mandiri IPB dan diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Penanganan Hasil Perairan dan asisten praktikum Teknologi Produk Tradisional Hasil Perairan tahun ajaran 2012/2013. Penulis juga aktif sebagai anggota IPB Debating Community (2009-2011), sebagai sekretaris komisi Dewan Perwakilan Mahasiswa Fakultas (2010-2011), serta dalam berbagai kepanitiaan. Penulis mendapat kesempatan mewakili IPB dalam ajang Asian Law Student’s Association (ALSA) English Competition di Universitas Indonesia (2010) dan melakukan presentasi dalam konferensi Sustainable Future for Human Security (SUSTAIN) di Universitas Kyoto, Jepang (2011).
Penulis melaksanakan praktik lapangan di PT Satu Tiga Enam Delapan, Banyuwangi, Jawa Timur pada Juli-Agustus 2012 dengan judul Evaluasi Penerapan Sanitation Standard Operating Procedures pada Proses Produksi Udang Kupas Beku di PT Satu Tiga Enam Delapan, Banyuwangi – Jawa Timur yang dibimbing oleh Ir Heru Sumaryanto, M.Si. Penulis juga pernah lolos seleksi Program Kreativitas Mahasiswa (PKM) yang didanai oleh DIKTI bidang Gagasan Tertulis (2012) dengan judul Biobattery Paper dengan Polimer Nanokomposit Selulosa Alga di bawah bimbingan oleh Bambang Riyanti, S.Pi, M.Si.