PENGARUH ZAT PENGATUR TUMBUH BAP DAN NAA
TERHADAP PERTUMBUHAN TUNAS ULIN
(
Eusideroxylon zwageri
T. et B.) SECARA
IN VITRO
MOHAMMAD WAHYU DEWANTO
DEPARTEMEN SILVIKULTUR FAKULTAS KEHUTANAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Zat Pengatur Tumbuh BAP dan NAA terhadap Pertumbuhan Tunas Ulin (Eusideroxylon zwageri T. et B.) secara in Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
MOHAMMAD WAHYU DEWANTO. Pengaruh Zat Pengatur Tumbuh BAP dan NAA terhadap Pertumbuhan Tunas Ulin (Eusideroxylon zwageri T. et B.) secara in Vitro. Dibimbing oleh ARUM SEKAR WULANDARI dan ERINA SULISTIANI.
Ulin (Eusideroxylon zwageri) merupakan salah satu jenis tanaman yang berada pada status vulnerable berdasarkan kriteria IUCN; telah dievaluasi agar dimasukkan ke dalam Appendix II CITES. Perbanyakan ulin dari biji membutuhkan waktu yang lama. Penelitian ini bertujuan untuk mendapatkan kombinasi zat pengatur tumbuh (ZPT) terbaik antara sitokinin (BAP) dan auksin (NAA) terhadap tunas lateral dan apikal dalam perbanyakan ulin secara in vitro pada media woody plant medium (WPM). Penelitian dilakukan dengan rancangan acak lengkap (RAL) dua faktor. Faktor pertama ialah pemberian BAP yang terdiri atas 3 taraf yaitu 0.0 mg/L, 0.5 mg/L, dan 1.0 mg/L. Faktor kedua yakni pemberian NAA yang terdiri atas 3 taraf yaitu 0.00 mg/L, 0.01 mg/L, dan 0.05 mg/L. Peubah yang diamati ialah pertumbuhan tunas, tinggi tunas, dan pertumbuhan kalus. Pemberian BAP 1.0 mg/L menghasilkan pertumbuhan tunas sebesar 1 tunas per eksplan pada tunas lateral. Pertumbuhan tunas ulin terbaik diperoleh pada tunas apikal yang ditumbuhkan dalam media WPM dengan kombinasi BAP 1.0 mg/L dan NAA 0.05 mg/L, menghasilkan 1 tunas per eksplan. Pemberian NAA 0.05 mg/L menghasilkan tinggi tunas sebesar 0.67 cm per tunas pada tunas lateral. Pada peubah pertumbuhan kalus, pemberian BAP berkorelasi positif terhadap diameter kalus, baik pada tunas lateral maupun tunas apikal.
Kata kunci: Eusideroxylon zwageri, tunas apikal, tunas lateral, woody plant medium
ABSTRACT
MOHAMMAD WAHYU DEWANTO. Effect of Plant Growth Regulator BAP and NAA on the Growth of Ironwood Shoots (Eusideroxylon zwageri T. et B.) in Vitro. Guided by ARUM SEKAR WULANDARI and ERINA SULISTIANI.
Ironwood (Eusideroxylon zwageri) is one of the types of plants that are vulnerable status based on IUCN criteria; have been evaluated for inclusion in Appendix II of CITES. Ironwood Propagation from seed takes a long time. This research aims to get the combination of plant growth regulator (PGR) best between cytokinin (BAP) and auxin (NAA) to the apical and lateral buds in ironwood propagation in vitro on woody plant medium (WPM). The research is conducted with a completely randomized design (CRD) two factors. The first factor is the provision of BAP which consists of 3 levels that is 0.0 mg/L, 0.5 mg/L, and 1.0 mg/L. The second factor is the provision of NAA which consists of 3 levels that is 0.00 mg/L, 0.01 mg/L, and 0.05 mg/L. Parameters observed is the growth of shoot, shoot height, and callus growth. Giving BAP 1.0 mg/L resulted in growth of shoot is 1 shoot per explant on lateral bud. Ironwood best shoot growth was obtained in the apical buds were grown in WPM medium with BAP combination of 1.0 mg/L and NAA 0.05 mg/L, resulting in a 1 shoot per explant. Giving NAA 0.05 mg/L resulted in shoot height of 0.67 cm per shoot on lateral bud. On callus growth variables, giving BAP positively correlated to the diameter of the callus, both in apical buds and lateral buds.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
pada
Departemen Silvikultur
PENGARUH ZAT PENGATUR TUMBUH BAP DAN NAA
TERHADAP PERTUMBUHAN TUNAS ULIN
(
Eusideroxylon zwageri
T. et B.) SECARA
IN VITRO
DEPARTEMEN SILVIKULTUR INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi: Pengaruh Zat Pengatur Tumbuh BAP dan NAA terhadap Pertumbuhan Tunas Ulin (Eusideroxylon wageri T. et B.) secara
in Vitro
Nama NIM
: Mohammad Wahyu Dewanto : E44100001
Dr Ir Arum Sekar MS Pembimbing I
Disetujui oleh
Tanggal Lulus:
2 5 AUG 2014
Ir Erina MSi
Pembimbing II
PRAKATA
Alhamdulillahirabbil’alamin, puji syukur penulis panjatkan ke hadirat
Allah subhanahu wa ta’ala, Rabb yang Maha Kuasa yang telah menganugerahkan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan karya ilmiah ini dengan baik. Shalawat dan salam penulis sampaikan kepada teladan umat Nabi Muhammad SAW.
Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 sampai Januari 2014 ini ialah kultur jaringan, dengan judul Pengaruh Zat Pengatur Tumbuh BAP dan NAA terhadap Pertumbuhan Tunas Ulin (Eusideroxylon zwageri T. et B.) secara in Vitro.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Arum Sekar Wulandari, MS dan Ibu Ir Erina Sulistiani, MSi selaku dosen pembimbing, serta Bapak Samsul Ahmad Yani, SSi yang telah banyak memberikan saran dan pengalamannya. Di samping itu, penghargaan penulis sampaikan kepada pimpinan SEAMEO BIOTROP yang telah memberikan izin untuk melakukan penelitian. Ungkapan terima kasih juga disampaikan kepada M. Hakim dan Dalsiyah selaku orang tua, serta Suci Megawati selaku adik atas segala doa dan kasih sayangnya. Kemudian ungkapan terima kasih tidak lupa diucapkan kepada Asep, Devina, Aji, beserta teman-teman FAHUTAN angkatan 47 lainnya yang selalu memberikan doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat bagi pihak-pihak yang membutuhkan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE 3
Tempat dan Waktu Penelitian 3
Bahan 3
Alat 3
Metode Kerja 4
HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 13
SIMPULAN DAN SARAN 17
Simpulan 17
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 20
DAFTAR TABEL
1 Perlakuan kombinasi konsentrasi zat pengatur tumbuh pada eksplan
ulin dalam media WPM 5
2 Interpretasi koefisien korelasi terhadap uji korelasi Spearman sebagai acuan uji korelasi pemberian ZPT terhadap diameter kalus ulin 7 3 Jumlah eksplan ulin terkontaminasi berdasarkan jenis kontaminan pada
fase inisiasi selama 14 hari pengamatan 8
4 Pengaruh BAP dan NAA terhadap pertumbuhan tunas pada tunas lateral ulin dalam media WPM selama 6 minggu pengamatan 9 5 Pengaruh konsentrasi BAP terhadap pertumbuhan tunas pada tunas
lateral ulin dalam media WPM selama 6 minggu pengamatan 9 6 Pengaruh BAP dan NAA terhadap pertumbuhan tunas pada tunas apikal
ulin dalam media WPM selama 6 minggu pengamatan 10 7 Pengaruh konsentrasi NAA terhadap pertumbuhan tunas pada tunas
apikal ulin dalam media WPM selama 6 minggu pengamatan 11 8 Pengaruh interaksi BAP dan NAA terhadap pertumbuhan tunas pada
tunas apikal ulin dalam media WPM selama 6 minggu pengamatan 11 9 Pengaruh BAP dan NAA terhadap tinggi tunas pada tunas lateral ulin
dalam media WPM selama 6 minggu pengamatan 11
10 Pengaruh konsentrasi NAA terhadap tinggi tunas pada tunas apikal ulin
dalam media WPM selama 6 minggu pengamatan 12
11 Pengaruh BAP dan NAA terhadap tinggi tunas pada tunas apikal ulin
dalam media WPM selama 6 minggu pengamatan 12
12 Korelasi pengaruh penambahan konsentrasi BAP dan NAA terhadap pertumbuhan kalus pada tunas lateral dan apikal ulin dalam media
WPM selama 6 hari pengamatan 12
DAFTAR GAMBAR
1 Jenis kontaminan dan tingkat kontaminasi eksplan ulin pada fase inisiasi selama 14 hari pengamatan: (A) kontaminasi oleh fungi dengan tingkat kontaminasi 1, (B) kontaminasi oleh bakteri dengan tingkat kontaminasi 1, (C) kontaminasi oleh fungi dan bakteri dengan tingkat
kontaminasi 1 8
2 Tingkat kontaminasi eksplan ulin pada fase inisiasi selama 14 hari
pengamatan 8
3 Pertumbuhan tunas pada tunas lateral ulin dalam media WPM setelah 6 minggu pengamatan: (A) konsentrasi BAP 1.0 mg/L dan NAA 0.00 mg/L, (B) konsentrasi BAP 1.0 mg/L dan NAA 0.01 mg/L, (C)
konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L 10
4 Pertumbuhan tunas pada tunas apikal ulin dalam media WPM setelah 6 minggu pengamatan: (A) konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L, (B) konsentrasi BAP 0.5 mg/L dan NAA 0.05 mg/L, (C)
konsentrasi BAP 0.0 mg/L dan NAA 0.05 mg/L 10
minggu pengamatan: (A) kriteria kalus 0, (B) kriteria kalus 1, (C)
kriteria kalus 3 13
PENDAHULUAN
Latar Belakang
Ulin (Eusideroxylon zwageri) merupakan salah satu jenis tanaman penyusun hutan tropika yang tumbuh secara alami di wilayah Sumatera bagian Selatan dan Kalimantan. Jenis ini dikenal dengan nama daerah belian (umum); onglen (Sumatera); tulian, tebelian (Kalimantan); bulin (Palembang). Daya tahannya terhadap rayap kayu kering termasuk kelas awet II, tetapi terhadap jamur pelapuk kayu termasuk kelas awet I.
Kayu ulin tahan terhadap perubahan suhu, kelembaban, bahkan tahan pula terhadap pengaruh air laut. Kegunaan kayu ulin antara lain: (1) bahan kontruksi berat, (2) bahan konstuksi di laut, (3) jembatan, (4) kapal, (5) tiang rumah, (6) bantalan rel, (7) lantai rumah. Menurut Sudimaryono et al. (2004), kayu ulin tidak sesuai untuk penggunaan kayu lapis ataupun papan partikel. Pada umumnya pembangunan rumah pemukiman di Kalimantan menggunakan ulin sebagai penopang/pondasi.
Berdasarkan Asia Regional Workshop tahun 1998 yang diselenggarakan di Hanoi (Vietnam) International Union for Conservation of Nature and Natural Resource (IUCN), ditetapkan bahwa ulin berada pada status vulnerable A1cd+2cd artinya peka/sedang menghadapi resiko yang tinggi untuk mengalami kepunahan dan telah dievaluasi untuk dimasukkan ke dalam Appendix II CITES, yaitu spesies yang tidak terancam punah tetapi mungkin terancam punah bila perdagangan terus berlanjut tanpa adanya pengaturan (IUCN 2014).
Kayu ulin telah mencapai kondisi kritis dalam semua habitat alam. Keberadaan ulin yang sedikit disebabkan oleh adanya ekploitasi yang berlebihan. Selain itu, penyediaan bibit masih tergantung dari anakan alam.
Pembiakan ulin dengan biji membutuhkan waktu yang cukup lama. Perkecambahan biji ulin membutuhkan waktu sekitar 6−12 bulan. Hal tersebut memungkinkan terjadinya kerusakan biji yang akhirnya menurunkan daya kecambah biji ulin. Benih ulin merupakan benih rekalsitran, artinya viabilitasnya cepat menurun sehingga tidak dapat disimpan dalam jangka waktu yang lama. Oleh karena itu, untuk mengatasi ancaman kepunahan ulin diperlukan penyediaan bibit yang dilakukan dengan pembiakan vegetatif.
Teknik pembiakan vegetatif merupakan salah satu rangkaian kegiatan produksi bibit yang mampu menghasilkan bibit dalam jumlah relatif banyak, serta berkualitas baik dan sesuai waktu yang diinginkan serta merupakan bagian dari program pemuliaan pohon yang berfungsi sebagai upaya penyelamatan genetik dalam rangka mendapatkan bibit berkualitas dan unggul. Selain itu, pembiakan secara vegetatif juga dikembangkan untuk mengatasi perbanyakan tanaman yang sukar dilakukan secara genetatif (biji).
2
Kultur jaringan merupakan salah satu teknik perbanyakan vegetatif jenis ulin yang perlu diterapkan untuk mengatasi permasalahan dalam pengadaan bibit ulin. Selain dihasilkan jumlah bibit yang banyak dalam satu waktu, sifat genetik anakan akan sama seperti induknya. Hal tersebut dapat mempertahan keberadaan jenis ulin sekaligus mendapatkan kualitas bibit yang baik apabila menggunakan indukan yang berkualitas baik pula.
Penelitian kultur jaringan ulin yang pernah dilakukan ialah dengan menggunakan bahan tanam berupa endosperma. Induksi eksplan dari endosperma ulin secara in vitro telah dilakukan oleh Hidayat (2007) menunjukkan bahwa pemberian 5.0 ppm IAA (indole-3-acetic acid) + 6.0 ppm kinetin merupakan kombinasi ZPT terbaik terhadap perkembangan kalus ulin. Hasil penelitian tersebut didapatkan setelah pengamatan selama 24 minggu. Oleh karena itu diperlukan jenis bahan tanam atau eksplan yang tepat dalam penelitian perbanyakan vegetatif ulin secara in vitro guna mendapatkan individu baru secara cepat.
Teknik mikropropagasi yang sering digunakan untuk produksi bibit secara komersial ialah kultur tunas. Teknik tersebut dipilih karena lebih mudah dilakukan pada berbagai jenis tanaman (Sulistiani dan Yani 2012).
Kombinasi ZPT yang digunakan perlu diperhatikan dalam penelitian kultur jaringan sehingga hasil yang didapat sesuai dengan apa yang diinginkan. Penelitian yang dilakukan oleh Andari (2013) menunjukkan bahwa jumah tunas terbanyak dalam multiplikasi tunas suweg (Amorphophallus paeonifolius (Dennst.) Nicolson) terdapat pada perlakuan 1 mg/L BAP (6-benzylaminopurine) + 0.25 mg/L NAA (1-naphthalena acetic acid) yaitu 0.47 tunas/minggu. Pertumbuhan akar terbanyak terdapat pada perlakuan 1 mg/L BAP + 0.75 mg/L NAA yaitu 2.87 akar/minggu. Hal ini mengindikasikan bahwa kombinasi ZPT BAP dan NAA berpotensi dalam menstimulasi pertumbuhan eksplan. Oleh karena itu, jenis BAP dan NAA ditetapkan sebagai ZPT dalam penelitian induksi tunas ulin ini.
Berdasarkan penelitian yang telah dilakukan sebelumnya, diperlukan penelitian mengenai teknik perbanyakan ulin secara kultur jaringan dengan kombinasi ZPT dan jenis bahan tanaman yang tepat. Penggunaan eksplan yang berasal dari tunas lateral dan apikal dengan kombinasi BAP dan NAA diharapkan dapat memberikan pengaruh yang nyata terhadap pertumbuhan eksplan.
Perumusan Masalah
3 kombinasi media terbaik agar pertumbuhan eksplan dapat sesuai dengan yang diinginkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan kombinasi ZPT terbaik antara sitokinin (BAP) dan auksin (NAA) terhadap tunas lateral dan apikal dalam perbanyakan ulin (E.zwageri) secara in vitro.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang kombinasi ZPT terbaik antara BAP dan NAA dengan jenis tunas lateral dan apikal dalam perbanyakan ulin (E. zwageri) secara in vitro.
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Kultur Jaringan SEAMEO BIOTROP, Bogor, Jawa Barat. Waktu pelaksanaannya dari bulan Oktober 2013 sampai dengan Januari 2014.
Bahan
Bahan tanaman yang digunakan dalam penelitian berupa tunas lateral dan apikal ulin berumur ±6 bulan yang didapatkan dari rumah kaca bagian Kultur Jaringan SEAMEO BIOTROP. Bahan kimia yang digunakan ialah fungisida (bahan aktif: benomil 50.4%), bakterisida (bahan aktif: streptomisin sulfat 20%), desinfektan (bahan aktif: natrium hipoklorit 5.25%), NaOH 0.1 M, HCl 0.1 M, tween 20. Media prekondisi yang digunakan ialah media woody plant medium (WPM). Media perlakuan yang diterapkan ialah media WPM dengan penambahan BAP dan NAA.
Alat
4
Metode Kerja
A. Penyiapan bahan tanaman
Bahan tanaman yang berupa tunas diambil dengan cara digunting. Sebelum pengambilan bahan tanaman, tanaman ulin disemprot terlebih dahulu dengan fungisida dan bakterisida dengan konsentrasi masing-masing 2 g/L untuk meminimalkan kontaminasi fungi dan bakteri. Jumlah eksplan yang dibutuhkan untuk tahap inisiasi sebanyak 140 tunas yang terdiri dari 70 tunas lateral dan 70 tunas apikal.
B. Sterilisasi alat
Alat-alat yang digunakan dalam penelitian harus dalam keadaan steril. Botol kultur, pinset, cawan petri, pipet dan scalpel dibungkus kertas kemudian disterilkan di dalam autokaf pada suhu 121 0C selama 15 menit. Setelah tahapan sterilisasi, alat-alat disimpan di dalam oven dengan suhu 80 0C sampai alat tersebut digunakan. Alat logam seperti pinset dan scalpel dicelupkan ke dalam alkohol 70% sebelum digunakan untuk memotong eksplan, lalu dipanaskan di atas bunsen yang menyala untuk memperkecil kemungkinan adanya sumber kontaminan.
C. Sterilisasi lingkungan kerja
Kondisi lingkungan kerja perlu diperhatikan guna memperkecil kemungkinan adanya sumber kontaminan. Kegiatan penanaman dilakukan di laminar air flow cabinet yang sebelumnya telah diberikan alkohol 70% pada permukaan dan dindingnya. Lampu ultraviolet (UV) diaktifkan 30 menit sebelum laminar air flow cabinet digunakan yang bertujuan untuk untuk membunuh kontaminan yang terdapat di dalam laminar air flow cabinet.
D. Penyediaan air steril
Air yang digunakan dalam penelitian ialah air aquades yang disterilkan di dalam autoklaf pada suhu 121 0C selama 30 menit. Air ini digunakan untuk pembilasan eksplan dan pembuatan media tanam. Aquades didapatkan dari penyulingan air langsung (destilasi) yang dilakukan oleh SEAMEO BIOTROP. E. Pembuatan media prekondisi
5 dengan karet. Botol kultur disterilisasi di dalam autokaf pada suhu 121 0C selama
15 menit.
F. Pembuatan media perlakuan
Media WPM yang digunakan pada media prekondisi adalah media tanpa auksin maupun sitokinin, sedangkan media perlakuan ialah media WPM yang sudah diberikan auksin (BAP) dan sitokinin (NAA). Media WPM yang digunakan dalam perlakuan dibagi ke dalam 9 kelompok karena penelitian ini menggunakan 9 kombinasi media masing-masing untuk tunas lateral dan tunas apikal. Uraian perlakuan kombinasi media dapat dilihat pada Tabel 1.
Tabel 1 Perlakuan kombinasi konsentrasi zat pengatur tumbuh pada eksplan ulin dalam media WPM
Kombinasi ZPT
Konsentrasi (mg/L)
Benzyl amino purine (BAP) Naphthalene acetic acid (NAA)
1 0.0 0.00
Bahan tanaman yang digunakan dalam penelitian berupa tunas apikal dan lateral ulin. Tunas tersebut digunting dari induknya untuk diletakkan di dalam larutan fungisida 2 g/L + 3 tetes tween 20. Eksplan dikocok dalam larutan tersebut selama 1 jam, kemudian dibilas dengan air aquades sebanyak 3 kali bilasan. Eksplan dipindahkan ke larutan bakterisida 2 g/L + 3 tetes tween 20 dan dikocok selama 1 jam, kemudian dibilas sebanyak 3 kali bilasan. Eksplan diletakkan dan dikocok kembali dalam larutan fungisida 2 g/L + 3 tetes tween 20 selama 1 jam, lalu dibilas sebanyak 3 bilasan.
H. Penanaman eksplan
Tahapan sebelum kegiatan penanaman ialah sterilisasi lanjutan. Sterilisasi dilakukan di dalam laminar air flow cabinet guna memperkecil kemungkinan adanya kontaminasi. Eksplan yang siap ditanam diletakkan ke dalam botol kultur dengan pinset yang telah disterilkan. Sterilisasi yang dilakukan yakni perendaman eksplan dalam larutan desinfektan 15% (bahan aktif: natrium hipoklorit 5.25%) selama 10 menit, kemudian dibilas sebanyak 3 kali bilasan dengan air aquades. Eksplan yang sudah dibilas tersebut dimasukan ke dalam larutan alkohol 70% dan didiamkan selama 1 menit, lalu dibilas kembali. Eksplan tersebut sudah dapat ditanam di media WPM tanpa pemberian ZPT untuk dilihat adaptasi dan kontaminasinya.
6
dipotong dengan pisau guna memperkecil kemungkinan adanya desinfektan yang terbawa dalam eksplan.
I. Pemeliharaan
Botol-botol kultur yang telah berisi ekplan disimpan di ruang kultur. Selanjutnya dilakukan pengamatan awal dan pemisahan ekplan yang kontaminasi. Pengamatan awal dilakukan untuk mencari eksplan yang siap disubkultur ke media perlakuan, yaitu eksplan tunas yang masih hijau dan tidak kontaminasi. J. Pemindahan eksplan ke media perlakuan
Eksplan yang bebas dari kontaminasi fungi atau bakteri dipilih untuk dipindahkan ke media perlakuan. Jumlah eksplan steril yang berasal dari tunas lateral harus sama dengan eksplan yang berasal dari tunas apikal, karena perlakuan untuk jenis tunas membutuhkan jumlah kedua tunas yang sama. Setiap perlakuan media yang diuraikan pada Tabel 1 diberikan pada kedua jenis tunas, yakni tunas lateral dan tunas apikal.
K. Pengamatan fase inisiasi
Eksplan ditanam di dalam media dasar WPM tanpa penambahan ZPT. Selanjutnya eksplan dibiarkan selama 14 hari di dalam media tersebut untuk diamati kemampuan adaptasinya dalam kondisi in vitro, keberadaan kontaminan, persentase kontaminasi, dan penggolongan jenis kontaminan. Peubah yang diamati meliputi:
1. Persentase kontaminasi
Persentase kontaminasi diukur dengan menghitung jumlah tanaman yang terkontaminasi oleh fungi dan bakteri mulai dari satu minggu setelah eksplan ditanam (MST). Persentase kontaminasi dihitung dengan cara:
% Kontaminasi=∑eksplan terkontaminasi∑eksplan tanam
2. Tingkat kontaminasi
Tingkat kontaminasi diperoleh dari penglihatan kasat mata terhadap persentase penutupan permukaan media tanam oleh sumber kontaminan. Kriteria tingkat kontaminasi yang dibuat sebagai acuan ialah:
a. Nilai 1 untuk penutupan permukaan media oleh sumber kontaminan seluas 25%
b. Nilai 2 untuk penutupan permukaan media oleh sumber kontaminan seluas 50%
c. Nilai 3 untuk penutupan permukaan media oleh sumber kontaminan seluas 75%
d. Nilai 4 untuk penutupan permukaan media oleh sumber kontaminan seluas 100%
L. Pengamatan perlakuan
7 1. Pertumbuhan tunas
Pertumbuhan tunas didapatkan dengan menghitung jumlah tunas yang tumbuh secara kasat mata dan diakumulasikan hingga 6 minggu setelah dilakukan subkultur ke media perlakuan.
2. Tinggi tunas
Tinggi tunas dapat diukur dengan menghitung jarak titik eksplan tertinggi terhadap media secara tegak lurus. Pengukuran tinggi diukur dengan menggunakan mistar satuan cm yang diletakan di luar botol kultur.
3. Pertumbuhan kalus
Kalus diukur dengan mengamati perkembangannya mulai dari minggu pertama setelah subkultur. Pertumbuhan kalus diukur dengan mengamati diameter kalus. Kriteria ukuran kalus yang dibuat sebagai acuan ialah : a. Kriteria 0 untuk eksplan tak berkalus
b. Kriteria 1 untuk eksplan berkalus kecil (diameter kalus >0.0−0.2 cm) c. Kriteria 2 untuk eksplan berkalus sedang (diameter kalus 0.2−0.4 cm) d. Kriteria 3 untuk eksplan berkalus besar (diameter kalus >0.4 cm) M. Analisis data
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dua faktor yaitu pemberian BAP yang dikombinasikan dengan NAA terhadap jenis tunas lateral dan apikal. Jumlah ulangan dalam setiap perlakuan adalah 3 kali ulangan dan setiap ulangan terdiri dari 2 botol kultur, 1 botol kultur berisi 1 eksplan.
Data peubah pertumbuhan tunas dan tinggi tunas yang diperoleh dari hasil pengamatan dianalisis dengan menggunakan analisis ragam (ANOVA), apabila berpengaruh nyata akan dilanjutkan dengan uji Duncan pada taraf kesalahan 5%. Peubah diameter kalus dianalisis menggunakan uji korelasi (Spearman correlation). Koefisien korelasi diinterpretasikan kekuatan korelasinya sesuai yang disebutkan oleh Sarwono (2008) (Tabel 2).
Analisis data dilakukan dengan menggunakan software SPSS (Statistical Package for the Social Sciences) versi 16.0. Hipotesis yang dirumuskan dalam nilai signifikan < 0.05, (2) terima H0 jika nilai signifikan > 0.05.
Tabel 2 Interpretasi koefisien korelasi terhadap uji korelasi Spearman sebagai acuan uji korelasi pemberian ZPT terhadap diameter kalus ulin
Koefisien korelasi Interpretasi
0 Tidak ada korelasi
0.00−0.25 Korelasi sangat lemah
0.25−0.50 Korelasi lemah
0.50−0.75 Korelasi kuat
0.75−0.99 Korelasi sangat kuat
8
HASIL DAN PEMBAHASAN
Hasil
1. Fase inisiasi
Tabel 3 Jumlah eksplan ulin terkontaminasi berdasarkan jenis kontaminan pada fase inisiasi selama 14 hari pengamatan
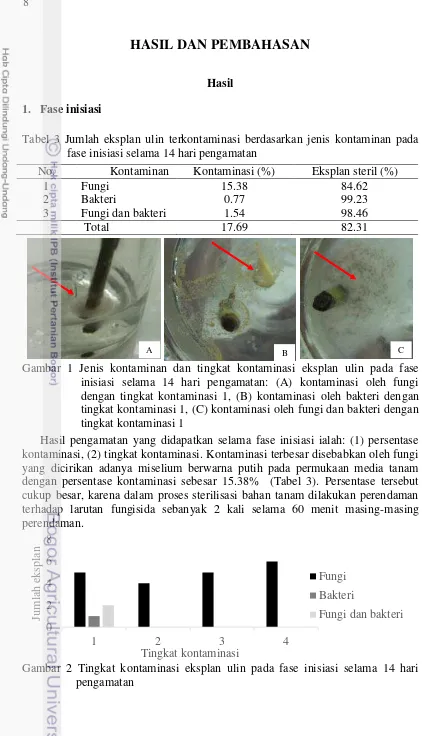
Gambar 1 Jenis kontaminan dan tingkat kontaminasi eksplan ulin pada fase inisiasi selama 14 hari pengamatan: (A) kontaminasi oleh fungi dengan tingkat kontaminasi 1, (B) kontaminasi oleh bakteri dengan tingkat kontaminasi 1, (C) kontaminasi oleh fungi dan bakteri dengan tingkat kontaminasi 1
Hasil pengamatan yang didapatkan selama fase inisiasi ialah: (1) persentase kontaminasi, (2) tingkat kontaminasi. Kontaminasi terbesar disebabkan oleh fungi yang dicirikan adanya miselium berwarna putih pada permukaan media tanam dengan persentase kontaminasi sebesar 15.38% (Tabel 3). Persentase tersebut cukup besar, karena dalam proses sterilisasi bahan tanam dilakukan perendaman terhadap larutan fungisida sebanyak 2 kali selama 60 menit masing-masing perendaman. No. Kontaminan Kontaminasi (%) Eksplan steril (%)
1 Fungi 15.38 84.62
2 Bakteri 0.77 99.23
3 Fungi dan bakteri 1.54 98.46
Total 17.69 82.31
9
Kontaminasi yang disebabkan bakteri dicirikan dengan bercak-bercak berlendir pada permukaan media tanam (Gambar 1). Dari 140 bahan tanaman yang digunakan, didapatkan 1 eksplan yang terkontaminasi oleh bakteri saja. Kontaminasi oleh kombinasi keduanya (fungi dan bakteri) juga ditemukan selama 14 hari pengamatan setelah inisiasi. Hasil pengamatan setelah inisiasi menunjukkan bahwa jumlah eksplan yang terkontaminasi oleh fungi, bakteri, dan keduanya yakni sebesar 23 eksplan. Artinya 117 eksplan (82.31%) telah steril dan dapat ditanam di media perlakuan, namun hanya 108 eksplan yang digunakan didasarkan pada jumlah perlakuan dan ulangan yang dibutuhkan.
Peubah lainnya yang diukur ialah tingkat kontaminasi eksplan setelah inisiasi. Tingkat kontaminasi ini diamati mulai hari pertama sampai dengan hari ke-14. Kontaminasi oleh fungi ditemukan pada berbagai tingkat kontaminasi (Gambar 2). Hasil pengamatan menunjukkan bahwa 6 eksplan yang ditanam terkontaminasi oleh fungi dengan tingkat kontaminasi 4. Hal tersebut menunjukkan seluruh luas permukaan media tanam telah tertutupi oleh sumber kontaminan fungi. Kontaminasi oleh bakteri hanya ditemukan pada tingkat kontaminasi 1, begitu pula dengan kontaminasi kombinasi kedua kontaminan (fungi dan bakteri). Kontaminasi yang disebabkan oleh fungi ditemukan mulai hari ke-4 sampai dengan hari ke-11, sedangkan kontaminasi oleh bakteri ditemukan pada hari ke-8 setelah inisiasi.
2. Pertumbuhan tunas
A. Tunas lateral
Tabel 4 Pengaruh BAP dan NAA terhadap pertumbuhan tunas pada tunas lateral ulin dalam media WPM selama 6 minggu pengamatan
Faktor ZPT Nilai signifikan Uji F taraf kesalahan 5%
BAP 0.036 *
NAA 0.281 tn
BAP*NAA 0.128 tn
* : berpengaruh nyata pada selang kepercayaan 95%, tn : tidak berpengaruh nyata. Tabel 5 Pengaruh konsentrasi BAP terhadap pertumbuhan tunas pada tunas lateral
ulin dalam media WPM selama 6 minggu pengamatan
huruf yang sama di belakang nilai rata-rata menunjukkan pengaruh yang tidak berbeda nyata pada selang kepercayaan 95%.
Perlakuan pemberian BAP pada peubah pertumbuhan tunas memberikan pengaruh yang nyata pada selang kepercayaan 95%, namun pemberian NAA dan interaksi keduanya tidak memberikan pengaruh yang nyata pada selang kepercayaan 95% terhadap pertumbuhan tunas (Tabel 4).
Hasil uji Duncan perlakuan BAP menunjukkan bahwa konsentrasi BAP 1.0 mg/L menghasilkan rata-rata pertumbuhan tunas tertinggi. Hasil tersebut berbeda
Konsentrasi BAP (mg/L) Pertumbuhan tunas
0.00 0.11 b
0.50 0.50ab
10
nyata pada selang kepercayaan 95% terhadap BAP 0.00 mg/L atau pun BAP 0.50 mg/L (Tabel 5). Pertumbuhan tunas pada tunas lateral dicirikan dengan munculnya tunas-tunas baru pada pucuk eksplan (Gambar 3).
Gambar 3 Pertumbuhan tunas pada tunas lateral ulin dalam media WPM setelah 6 minggu pengamatan: (A) konsentrasi BAP 1.0 mg/L dan NAA 0.00 mg/L, (B) konsentrasi BAP 1.0 mg/L dan NAA 0.01 mg/L, (C) konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L
B. Tunas apikal
Munculnya tunas baru mengindikasikan terjadinya pertumbuhan tunas pada eksplan (Gambar 4). Berdasarkan Analisis ragam yang didapatkan terhadap peubah pertumbuhan tunas, perlakuan pemberian NAA dan interaksi keduanya berpengaruh nyata terhadap pertumbuhan tunas pada selang kepercayaan 95% (Tabel 6). Pemberian BAP pada tunas apikal menunjukkan nilai signifikan sebesar 0.789. Hal ini berarti permberian BAP tidak memberikan pengaruh nyata pada selang kepercayaan 95%.
Gambar 4 Pertumbuhan tunas pada tunas apikal ulin dalam media WPM setelah 6 minggu pengamatan: (A) konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L, (B) konsentrasi BAP 0.5 mg/L dan NAA 0.05 mg/L, (C) konsentrasi BAP 0.0 mg/L dan NAA 0.05 mg/L
Tabel 6 Pengaruh BAP dan NAA terhadap pertumbuhan tunas pada tunas apikal ulin dalam media WPM selama 6 minggu pengamatan
* : berpengaruh nyata pada selang kepercayaan 95%, tn : tidak berpengaruh nyata. Faktor ZPT Nilai signifikan Uji F taraf kesalahan 5%
BAP 0.789 tn
NAA 0.022 *
BAP*NAA 0.038 *
A B C
11 Pemberian NAA dengan konsentrasi 0.05 mg/L menghasilkan rata-rata pertumbuhan tunas tertinggi (Tabel 7). Pemberian NAA sebesar 0.00 mg/L dan 0.01 mg/L tidak berbeda nyata terhadap nilai rata-rata tunas yang dihasilkan. Tabel 7 Pengaruh konsentrasi NAA terhadap pertumbuhan tunas pada tunas
apikal ulin dalam media WPM selama 6 minggu pengamatan Konsentrasi NAA (mg/L) Pertumbuhan tunas
0.00 0.28 b
0.01 0.22 b
0.05 0.67 a
huruf yang sama di belakang nilai menunjukkan pengaruh yang tidak berbeda nyata pada selang kepercayaan 95%.
Interaksi perlakuan BAP dan NAA berpengaruh nyata terhadap pertumbuhan tunas. Perlakuan BAP 1.0 mg/L dan NAA 0.05 mg/L menunjukkan nilai rata-rata pertumbuhan tunas tertinggi. Pertumbuhan tunas terendah ditemukan pada perlakuan kontrol atau BAP 0.0 mg/L dan NAA 0.00 mg/L (Tabel 8).
Tabel 8 Pengaruh interaksi BAP dan NAA terhadap pertumbuhan tunas pada tunas apikal ulin dalam media WPM selama 6 minggu pengamatan
Perlakuan Pertumbuhan tunas
* : berpengaruh nyata pada selang kepercayaan 95%, tn : tidak berpengaruh nyata. Pengamatan peubah tinggi tunas menunjukkan hanya perlakuan pemberian NAA yang memberikan perngaruh nyata pada selang kepercayaan 95%. Interaksi kedua ZPT tidak berpengaruh nyata pada selang kepercayaan 95% dengan nilai signifikan sebesar 0.396 (Tabel 9). Pemberian NAA 0.05 mg/L lebih baik karena menghasilkan nilai tinggi tunas terbesar yakni 0.31 cm. Nilai tinggi tunas yang
Faktor ZPT Nilai signifikan Uji F taraf kesalahan 5%
BAP 0.598 tn
NAA 0.032 *
12
dihasilkan oleh NAA 0.00 mg/L dan NAA 0.01 mg/L berbeda nyata dengan NAA 0.05 mg/L dengan selang kepercayaan 95% (Tabel 10).
Tabel 10 Pengaruh konsentrasi NAA terhadap tinggi tunas pada tunas apikal ulin dalam media WPM selama 6 minggu pengamatan
huruf yang sama di belakang nilai rata-rata menunjukkan pengaruh yang tidak berbeda nyata pada selang kepercayaan 95%.
B. Tunas apikal
Semua perlakuan yang diberikan terhadap tinggi tunas tidak memberikan pengaruh yang nyata pada selang kepercayaan 95% (Tabel 11). Seluruh perlakuan tidak dilanjutkan dengan uji Duncan karena tidak ada satu pun faktor ZPT yang berpengaruh nyata.
Tabel 11 Pengaruh BAP dan NAA terhadap tinggi tunas pada tunas apikal ulin dalam media WPM selama 6 minggu pengamatan
tn : tidak berpengaruh nyata. 4. Pertumbuhan kalus
Tabel 12 Korelasi pengaruh penambahan konsentrasi BAP dan NAA terhadap pertumbuhan kalus pada tunas lateral dan apikal ulin dalam media
* : berpengaruh nyata pada selang kepercayaan 95%, tn : tidak berpengaruh nyata. Perlakuan yang diberikan terhadap tunas apikal tidak memberikan pengaruh nyata terhadap perkembangan kalus pada selang kepercayaan 95%, namun pemberian BAP pada tunas lateral memberikan pengaruh yang nyata terhadap perkembagan kalus (Tabel 12). Berdasarkan uji korelasi pemberian BAP pada tunas lateral dan apikal menunjukkan korelasi yang positif. Hal ini berarti semakin tinggi pemberian konsentrasi BAP maka semakin tinggi pula kalus yang
Konsentrasi NAA (mg/L) Tinggi tunas
0.00 0.13 b
0.01 0.17 b
0.05 0.31 a
Faktor ZPT Nilai signifikan Uji F taraf kesalahan 5%
BAP 0.218 tn
NAA 0.243 tn
13 dihasilkan. Koefisien korelasi untuk perlakuan NAA tidak menunjukkan korelasi yang positif, artinya peningkatan atau penurunan konsentrasi NAA tidak memberikan pengaruh terhadap perkembangan kalus. Kriteria kalus 3 didapatkan pada konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L (Gambar 5).
Gambar 5 Pertumbuhan kalus pada tunas lateral ulin dalam media WPM dengan perlakuan konsentrasi BAP 1.0 mg/L dan NAA 0.05 mg/L setelah 6 minggu pengamatan: (A) kriteria kalus 0, (B) kriteria kalus 1, (C) kriteria kalus 3
Pembahasan
Kultur jaringan diartikan sebagai metode untuk mengisolasi bagian dari tanaman seperti protoplasmasma, sel, jaringan dan organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi individu yang utuh seperti induknya. Pelaksanaan teknik in vitro didasarkan pada teori Schleiden dan Schwann (1838) bahwa setiap sel dari suatu organisme memiliki sifat totipotensi. Totipotensi merupakan kemampuan setiap sel untuk tumbuh menjadi tanaman yang lengkap sesuai dengan induknya jika diletakkan dalam lingkungan yang sesuai.
Permasalahan yang kerap ditemukan dalam perbanyakan tanaman melalui kultur jaringan ialah kontaminasi oleh mikroba. Odutayo et al. (2007) mengatakan bahwa kontaminasi mikroba merupakan permasalahan yang selalu ada dalam kultur jaringan. Hal tersebut menyebabkan perlunya pengembangan teknik kultur jaringan yang tepat dalam hal mengeliminasi mikroba penyebab kontaminasi.
Proses sterilisasi merupakan tahapan mengeliminasi dan mematikan mikroba, sampai tidak memungkinkan lagi mikroba tersebut berkembang dan menjadi sumber kontaminan. Proses sterilisasi yang tidak sempurna menyebabkan sumber kontaminan ikut terbawa dan berkembang biak dalam botol kultur.
Pengontrolan kontaminasi mikroba sangat sulit dilakukan terutama untuk tanaman berkayu yang berasal dari lapangan (Bausher dan Niedz 1998). Tanaman berkayu pada umumnya tumbuh dalam kelembaban yang tinggi. Kondisi lingkungan tersebut tidak hanya mendukung keberlangsungan hidup tanaman berkayu melainkan mikroba juga banyak ditemukan. Oleh karena itu, sterilisasi dalam penelitian kultur jaringan ulin ini menggunakan teknik sterilisasi yang berbeda dengan sterilisasi eksplan dari jenis lainnya.
14
Metode sterilisasi dalam penelitian ini menggunakan bahan kimia berupa fungisida, bakterisida, desinfektan, dan alkohol. Penggunaan fungisida dan bakterisida sebagai bahan sterilisasi juga digunakan pada kultur embrio tanaman berkayu Pometia pinnata yang menghasilkan persentase eksplan steril 100% (Tanur 2008). Eksplan steril yang didapatkan dalam metode sterilisasi kultur ulin ini sebanyak 82.31%. Adanya kontaminasi diduga karena adanya mikroba di dalam jaringan yang tidak dapat hilang dengan sterilisasi permukaan saja. Putri (2009) mengatakan bahwa kontaminasi ulin dalam propagasi in vitro dapat tetap terjadi walaupun eksplan sudah melalui sterilisasi permukaan, karena beberapa bakteri hidup di dalam jaringan tanaman. Fungi merupakan sumber kotaminan terbanyak dalam penelitian ini. Penelitian kultur jaringan tanaman berkayu yang dilakukan Purnawati (2012) dalam sterilisasi tunas jabon (Anthocephalus cadamba [Roxb.] Miq.) secara in vitro menunjukkan bahwa persentase kontaminasi terbesar disebabkan oleh fungi. Begitu juga dengan penelitian yang dilakukan oleh Manurung (2007), kontaminasi terbesar yang didapatkan dalam kultur in vitro buah makassar (Brucea javanica [L.] Merr.) berasal dari golongan fungi.
Perendaman eksplan dalam larutan fungisida 2 g/L sebanyak 2 kali perendaman dinilai kurang efektif dalam mengeliminasi sumber kontaminan fungi. Metode sterilisasi yang diterapkan dalam penelitian ini tidak berbeda dengan kultur Pometia pinnata yang dilakukan oleh Tanur (2008), hanya saja ada pengaktifan sinar UV pada laminar air flow cabinet 30 menit sebelum digunakan sehingga menghasilkan persentase eksplan steril sebesar 24 eksplan (100%).
Fase inisiasi yang dilakukan dalam penelitian ini bertujuan untuk menyeleksi eksplan steril dari sumber kontaminan. Jika eksplan yang tidak steril dimasukan ke dalam media perlakuan maka akan merusak data pengamatan, karena sumber kontaminan akan menurunkan aktivitas metabolisme eksplan. Devi dan Srinivasan (2006) mengatakan bahwa mikroba mampu menyebabkan nekrosis jaringan, penurunan poliferasi tunas dan perakaran. Beberapa jenis mikroba melepaskan senyawa beracun ke dalam media kultur yang menyebabkan kematian eksplan (Zulkarnain 2009).
Penggunaan media WPM sebagai media dasar dalam penelitian ini didasarkan pada jenis tanaman yang dikulturkan. Tanaman berkayu sering mengeluarkan ekskresi yang mungkin menyebabkan racun terhadap medium tanam, sehingga mengganggu pertumbuhan dan perkembangan kultur. Penelitian multiplikasi jeruk kacang (Citrus nobilis L.) yang dilakukan Miryam et al. (2008) menunjukkan bahwa penggunaan media WPM dengan kombinasi BAP dan NAA menghasilkan persentase hidup eksplan sebesar 82.42%. Penelitian yang dilakukan oleh Qosim (2006) melaporkan bahwa penggunaan WPM dengan penambahan BAP menghasilkan regenerasi tunas pada kultur kalus nodular manggis (Garcinia mangostana L).
15 Jenis eksplan yang digunakan ialah tunas lateral dan tunas apikal. Tunas lateral merupakan tunas yang berada di antara tangkai daun dan batang. Tunas ini sering dihambat pertumbuhannya oleh tunas apikal yang berada di atasnya. Fenomena tersebut dinamakan dengan dominansi apikal. Prusinkiewiz et al. (2006) menjelaskan bahwa hipotesis tentang dominansi apikal yang didasarkan pada kompetisi nutrisi antara pusat-pusat pertumbuhan. Berdasarkan hipotesis tersebut, nutrisi akan cenderung ditransfer menuju tunas apikal yang mengakibatkan defisiensi nutrisi pada tunas lateral. Tunas apikal memiliki kadar hormon auksin yang lebih banyak dibandingkan dengan tunas lateral, hal ini akan mempengaruhi proses perpanjangan sel.
Penelitian kultur jaringan ulin ini menggunakan media WPM dengan kombinasi BAP dan NAA yang diaplikasikan pada tunas lateral dan tunas apikal. Berdasarkan hasil pengamatan selama 6 minggu setelah tanam, pemberian BAP berpengaruh nyata terhadap pertumbuhan tunas pada tunas lateral. Konsentrasi BAP tertinggi dalam perlakuan (1.0 mg/L) menghasilkan jumlah tunas terbanyak yakni 1.33 tunas selama 6 minggu pengamatan. Pengaruh yang nyata diduga karena adanya pematahan dominasi apikal, sehingga transportasi nutrisi ke tunas lateral tidak terhambat. Sitokinin berperan aktif dalam pertumbuhan tunas. Dalam penelitian Fauzi (2010) dilaporkan bahwa pemberian BAP 3 mg/L dalam media MS mampu menginduksi 5 tunas per eksplan. Penggunaan BAP yang tinggi memungkinkan terinduksinya tunas majemuk yang lebih banyak.
Pemberiaan auksin (NAA) pada tunas lateral tidak berpengaruh nyata terhadap pertumbuhan tunas ulin. Auksin berperan dalam proses induksi kalus, morfogenesis kalus, embriogenesis, pembentukan akar dan menghambat sitokinin apabila konsentrasi terlalu tinggi. Namun terlihat semakin tinggi konsentrasi NAA yang diberikan maka semakin tinggi pula jumlah tunas yang didapatkan (Gambar 6).
Gambar 6 Pengaruh pemberian NAA terhadap pertumbuhan tunas pada tunas lateral ulin dalam media WPM selama 6 minggu pengamatan
Hasil yang berbeda ditunjukkan pada tunas apikal dalam hal pertumbuhan tunas. Pengamatan selama 6 minggu menunjukkan bahwa pemberian NAA memberikan pengaruh yang nyata terhadap pertumbuhan tunas pada tunas apikal. Begitu juga dengan interaksi antara BAP dan NAA. Hasil tersebut merupakan kebalikan terhadap hasil yang diberikan pada tunas lateral. Hal ini diduga kuat karena pengaruh kadar auksin yang tinggi pada tunas apikal. Auksin berperan dalam proses pembelahan dan pemanjangan sel. Zulkarnain (2009) mengatakan
16
bahwa auksin (NAA) berfungsi untuk dalam pemanjangan sel, pembelahan sel, dan pembentukan akar adventif. Konsentrasi NAA tertinggi (0.05 mg/L) menghasilkan jumlah tunas terbanyak yakni 0.67 tunas selama 6 minggu pengamatan.
Berdasarkan nilai pertumbuhan tunas yang didapatkan, pemberian BAP 0.0 mg/L dan NAA 0.05 mg/L pada tunas lateral menghasilkan jumlah tunas terbanyak yakni 1.3 tunas per eksplan. Kombinasi ZPT terhadap tunas apikal terbanyak didapatkan pada pemberian BAP 1.0 mg/L dan NAA 0.05 mg/L yakni 1 tunas per eksplan Hal tersebut berarti media WPM dengan penambahan BAP 0.0 mg/L dan NAA 0.05 mg/L efektif diterapkan pada tunas lateral dalam pertumbuhan tunas, sedangkan tunas apikal akan efektif apabila dikulturkan pada media WPM dengan penambahan BAP 1.0 mg/L dan NAA 0.05 mg/L.
Tinggi tunas lateral dan tunas apikal merupakan salah satu peubah kuantitaif yang diukur dalam penelitian kutur ulin ini. Hasil analisis ragam menunjukkan bahwa pemberian NAA berpengaruh nyata terhadap tinggi tunas pada tunas lateral. Hal ini sesuai dengan peranan auksin (NAA) terhadap pemanjangan sel. Sandra (2013) mengatakan bahwa auksin mendorong pemanjangan sel dengan cara mempengaruhi dinding sel.
Pada tunas apikal didapatkan bahwa pemberian BAP, maupun NAA tidak memberikan pengaruh yang nyata (selang kepercayaan 95) terhadap tinggi tunas. Hal ini diduga karena pertumbuhan tinggi tunas pada tunas apikal bukan didasarkan pada pemberian ZPT melainkan karena tingginya kadar auksin alami yang ada dalam tunas apikal. Pendugaan tersebut diperkuat oleh rata-rata tinggi tunas pada tunas apikal sama dengan tunas lateral yakni 0.2 cm.
Peubah lainnya yang diukur ialah pertumbuhan kalus pada tunas lateral dan tunas apikal. Kalus merupakan suatu kumpulan sel tidak beraturan dan tidak terspesialisasi yang muncul dari sel-sel yang membelah diri secara terus-menerus. Pada umumnya kalus mulai terbentuk pada area pelukaan eksplan. Penelitian kultur jaringan ulin yang pernah dilakukan yakni menggunakan bahan tanaman berupa endosperma, daun dan tunas. Dalam penelitian Hidayat (2007) dilaporkan bahwa kombinasi terbaik IAA dan kinetin mampu menghasilkan kalus yang berasal dari endosperma dengan waktu tercepat 147.75 hari. Penelitian tersebut menunjukkan hasil yang positif, namun membutuhkan waktu yang sangat lama untuk menghasilkan kalus.
Kalus yang dihasilkan dalam penelitian ini berwarna hitam, hal ini menunjukkan adanya senyawa fenolik yang dikeluarkan dari eksplan ulin. Munculnya senyawa fenolik dalam kultur jaringan disebabkan oleh perilaku adaptasi suatu tanaman akibat adanya pelukaan. Senyawa fenolik tersebut berfungsi menutup bagian dari eksplan yang luka agar tidak adanya mikroba yang masuk ke dalam jaringan eksplan tersebut. Semakin tua umur tanaman maka semakin banyak senyawa fenolik yang dihasilkan. Senyawa fenolik ini dapat diatasi dengan cara subkultur eksplan tersebut, namun bagian ruas bawah eksplan dihilangkan.
17 korelasi yang lemah berdasarkan interpretasi yang disebutkan oleh Sarwono (2008). Artinya semakin tinggi konsentrasi BAP yang diberikan maka semakin besar pula diameter kalus yang didapatkan baik pada tunas apikal maupun tunas lateral namun dengan tingkat korelasi lemah. Pemberian auksin (NAA) tidak memberikan korelasi yang positif, bahkan pada penerapan tunas apikal terjadi korelasi yang negatif. Sandra (2013) mengatakan bahwa auksin sangat dikenal sebagai hormon yang mampu berperan menginduksi kalus. Hal ini diduga karena kurangnya konsentrasi NAA dalam kombinasi ZPT. Penggunaan auksin konsentrasi rendah dalam penelitian ini dimaksudkan agar faktor ZPT tidak menghambat pertumbuhan tunas.
Keberadaan hormon auksin yang tinggi dapat menghambat kinerja sitokinin sehingga mengakibatkan proses pertumbuhan eksplan terhambat. Penggunaan NAA pada konsentrasi yang rendah (0.5 mg/L) menunjukkan hasil terbaik pada perbanyakan vegetatif Dorystoechas hastata secara in vitro dalam media ½MS dengan menggunakan bahan tanaman berupa tunas lateral (Erdag et al. 2009). Penggunaan NAA 0.02 mg/L yang dikombinasikan dengan TDZ dan BAP merupakan kombinasi media terbaik untuk menghasilkan kalus pada penggandaan tunas Anthurium andraeanum (Linden ex Andre) (Winarto et al. 2009). Penggunaan 0.01 NAA mg/L dengan TDZ (thidiazuron) dan BAP merupakan kombinasi hormon yang sesuai untuk pengadaan tunas hasil kultur anther Anthurium (Winarto 2013). Namun pada hasil penelitian ini, peningkatan atau pun penurunan konsentrasi NAA tidak memberikan pengaruh pada diameter kalus. Penelitian kultur jaringan ulin yang dilakukan Pujawati (2008) menunjukkan kombinasi sukrosa 30 g/L dan 2,4-D (2,4-Dichlorophenoxyacetic) 2.0 mg/L merupakan perlakuan terbaik dalam menginduksi kalus. Dalam kombinasi tersebut didapatkan kalus pada hari ke-20 pengamatan setelah eksplan ditanam. Hal ini menunjukkan bahwa penggunaan konsentrasi auksin tanpa keterlibatan sitokinin dapat menginduksi kalus. Penggunaan konsentrasi NAA 0.00−0.05 mg/L dinilai kurang efektif dalam menginduksi kalus pada tunas lateral dan tunas apikal tanaman ulin.
SIMPULAN DAN SARAN
Simpulan
18
Saran
Konsentrasi NAA perlu ditingkatkan lebih dari 0.05 mg/L untuk mendapatkan respon yang positif terhadap pertumbuhan kalus pada tunas lateral. Rentang konsentrasi NAA 0.00−0.05 mg/L dinilai belum efektif dalam pertumbuhan kalus pada tunas lateral maupun tunas apikal.
DAFTAR PUSTAKA
Andari T. 2013. Multiplikasi tunas suweg (Amorphophallus paeonifolius (Dennst.) Nicolson) dengan zat pengatur tumbuh BAP dan NAA secara kultur jaringan [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Bausher MG, Niedz RP. 1998. A discussion of in vitro containation control of explant from greenhouse and field grown trees. Proc Fla State Hort Soc. 111:260-263.
Devi CS. Srinivasan VM. 2006. Stidues on various atmospheric microorganism affecting the plants tissue culture explants. American Journal of Plant Physiology 1:205-209.
Diantina M. 2008. Penggunaan zat pengatur tumbuh (ZPT) dan perbedaan tinggi cangkokan untuk mempercepat induksi akar ulin (Eusideroxylon zwageri T. et B.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Erdag BB, Emek YC, Aydogan SK. 2010. Clonal propagation of Dorystoechas hastata via axillary shoot poloferation. Turk J Bot. 34:233-240. doi:10.3906/bot-0906-36.
Fauzi AR. 2010. Induksi multiplikasi tunas ubi kayu (Manihot esculenta Crantz) varietas Adira 2 secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor. Hidayat. 2007. Induksi pertumbuhan eksplan endosperma ulin dengan IAA dan
kinetin. Agritrop. 26:147-152.
[IUCN] International Union for Conservation of Nature and Natural Resource. The IUCN red list of threatened species [Internet]. [diunduh 2014 Agu 1] Tersedia pada: http://www.iucnredlist.org
Manurung LYS. 2007. Pengaruh auksin (2,4-D) dan sitokinin (BAP) dalam kultur in vitro buah makasar (Bruea javanica) [L.] Merr.) [skripsi]. Bogor (ID): Institut Pertanian Bogor
Miryam A, Suliansyah I, Djamaran A. 2008. Multiplikasi jeruk kacang (Citrus nobilis L.) pada beberapa konsentrasi NAA dan BAP pada media WPM secara in vitro. Jurnal Agronomi Indonesia 1:97-104
Odutayo OI, Amusa NA, Okutade OO, Ogunsanwo YR. 2007. Determination of the sources of microbial contaminants of cultured plant tissue. Plant Pathology Journal 6:77-81.
19 Pujawati ED. 2008. Induksi kalus pada budi daya jaringan daun ulin (Eusideroxylon zwageri T. et B.) secara in vitro. Jurnal Hutan Tropis Borneo 23:87-92.
Purnawati L. 2012. Sterilisasi tunas jabon untuk mendapatkan eksplan steril secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Putri AI. 2009. Kajian glycocalyx bakteri pada kontaminasi Ulin (Eusideroxylon zwageri) in vitro. Jurnal Pemuliaan Tanaman Hutan 3:33-42.
Qosim. 2006. Studi iradiasi sinar gamma pada kultur kalus nodular manggis untuk meningkatkan keragaman genetik dan morfologi regeneran. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Sandra E. 2013. Kultur Jaringan Skala Rumah Tangga. Bogor (ID): IPB Press. Sarwono. 2008. Prosedur-prosedur populer statistik untuk mempermudah riset
skripsi. Korelasi [Internet]. [diunduh 2014 Agu 1]. Tersedia pada: http://www.jonathansarwono.info/korelasi/korelasi.htm.
Sudimaryono, Daris EN, Budi A, Arianto D. 2004. Informasi Singkat Benih Eusideroxylon zwageri Teijsm Dan Binn. Bandung (ID): IFSP.
Sulistiani E, Yani SA. 2012. Produksi Bibit Tanaman dengan Menggunakan Teknik Kultur Jaringan. Bogor (ID): SEAMEO BIOTROP.
Tanur EA. 2008. Kultur embrio matoa (Pometia pinnata Forster) pada media MS yang diperkaya dengan NAA dan kinetin [skripsi]. Manokwari (ID): Universitas Negeri Papua.
Winarto B, Mattjik NA, Purwito A, Marwoto B. 2009. Improvement of selected induction culture media on callus induction in anther culture of anthuriom and a histological study on its callus formation. Jurnal Agrotropika 14:1-8. Winarto B. 2013. Pengaruh medium dasar dan amonium nitrat terhadap
pembentukan, regenerasi kalus, dan penggandaan tunas hasil kultur anther Antherium. J Hort. 23:9-20.
20
Lampiran 1 Komponen penyusun media woody plant medium (WPM) sebagai media dasar dalam kultur jaringan ulin (E. zwageri T. et B.)
Komponen Konsentrasi (mg/L)
Makro
NH4NO3 400.00
CaCl2.2H2O 96.00
MgSO4.7H2O 370.00
KH2PO4 170.00
K2SO4 990.00
Ca(NO3).4H2O 556.00
Mikro
H3BO3 6.20
MnSO4.4H2O 22.30
ZnSO4.7H2O 8.60
Na2MoO4.2H2O 0.25
CuSO4.5H2O 0.25
Fe EDTA
Na2.EDTA 37.30
FeSO4.7H2O 27.80
Vitamin
Myo-inositol 100.00
Nicotinic acid 0.50
Thiamine HCl 1.60
Glycine 20.00
Gula (Sukrosa) 20,000.00
21
RIWAYAT HIDUP
Penulis diliahirkan di Bekasi pada tanggal 31 Januari 1992 dari ayah M. Hakim dan ibu Dalsiyah. Penulis merupakan putra pertama dari dua bersaudara. Tahun 2010 penulis lulus dari MA Negeri 8 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Silvikultur, Fakultas Kehutanan.
Selama mengikuti perkuliahan penulis menjadi ketua Paguyuban Bidikmisi Departemen Silvikultur. Penulis juga pernah aktif sebagai anggota divisi Business Development, Project Development Himpunan Profesi Tree grower community periode 2011/2013. Penulis telah melaksanakan Praktik Pengenalan Ekosistem Hutan (PPEH) di Taman Nasional Gunung Ciremai dan KPH Indramayu, Praktik Pengelolaan Hutan (PPH) di Hutan Pendidikan Gunung Walat. Pada bulan Maret sampai dengan Mei 2014 penulis melaksanakan Praktik Kerja Profesi di PT ANTAM (Persero) Tbk, Unit Bisnis Pertambangan Nikel, Sulawesi Tenggara.
Guna memperoleh sarjana kehutanan IPB, penulis menyelesaikan skripsi