PEMISAHAN BIOMASSA DAN EKSOPOLISAKARIDA
Porphyridium cruentum MENGGUNAKAN ULTRAFILTRASI
SERTA PENGARUHNYA TERHADAP AKTIVITAS INHIBISI
α-GLUKOSIDASE
HASANAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Pemisahan Biomassa dan Eksopolisakarida Porphyridium cruentum Menggunakan Ultrafiltrasi serta Pengaruhnya terhadap Aktivitas Inhibisi α-Glukosidase” adalah benar karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Hasanah
RINGKASAN
HASANAH. Pemisahan Biomassa dan Eksopolisakarida Porphyridiumcruentum
Menggunakan Ultrafiltrasi serta Pengaruhnya terhadap Aktivitas Inhibisi α-Glukosidase. Dibimbing oleh IRIANI SETYANINGSIH dan UJU.
Porphyridium cruentum merupakan mikroalga merah uniseluler yang menyekresikan eksopolisakarida (EPS) ke dalam medium kultivasi. Biomassa dan EPS P. cruentum memiliki potensi untuk dikembangkan dalam bidang farmasi, nutraseutika, serta kosmeseutika. Konsentrasi garam tinggi dan volume air yang besar pada media kultivasi menyebabkan biaya produksi tinggi pada pemanenan dan pemisahan EPS. Penelitian ini bertujuan untuk menentukan pengaruh membran
ultrafiltrasi (UF) terhadap karakteristik permeat (viskositas, pH, salinitas), kadar abu dan kadar garam EPS, serta aktivitas inhibisi α-glukosidase pada pemanenan dan pemisahan EPS. Penelitian yang dilakukan yaitu pengujian kandungan logam berat pada air laut, kultivasi mikroalga P. cruentum menggunakan media Guillard selama 40 hari, karakterisasi membran UF 0.05 dan 0.01 µm, pemanenan menggunakan UF 0.05 µm, pemisahan EPS menggunakan UF 0.01 µm, pengeringan biomassa dan EPS menggunakan freeze dryer.
Kandungan logam berat (Hg, As, Cd, Cu, Pb, Zn, Ni) air laut yang digunakan masih berada dalam standar baku mutu untuk biota laut. Sel P. cruentum umur 40 hari berbentuk bulat, berwarna merah, dan diameternya 4.86-9.93 µm. Nilai OD, pH, salinitas, dan viskositas P. cruentum berturut-turut 0.83 ± 0.004, 7.64 ± 0.005, 47.23 ± 0.05‰, 7.97 ± 0.25 cp.
Permeabilitas membran UF 0.05 µm (137.32 L/m2jam) lebih besar dibandingkan membran UF 0.01 µm (62.38 L/m2jam). Nilai fluks kultur yang dipanen menggunakan UF 0.05 µm mengalami penurunan dari 131.37 L/m2jam ke 94.75 L/m2jam dan rejeksi biomassa 96%. Membran UF 0.05 µm mampu menahan biomassa P. cruentum. Fraksi retentat 1 (R1) dan permeat 1 (P1) dihasilkan pada proses pemanenan. Fraksi retentat merupakan bagian yang tertahan di membran sedangkan permeat merupakan bagian yang lolos dari membran. Nilai fluks pada
pemisahan EPS menggunakan UF 0.01 µm mengalami penurunan dari 58.11 L/m2jam ke 51.53 L/m2jam. Penurunan fluks menunjukkan fouling pada
membran UF. Fraksi retentat 2 (R2) dan permeat 2 (P2) dihasilkan pada proses pemisahan EPS. Proses pemisahan EPS menyebabkan terjadinya penurunan viskositas, salinitas, berat kering, kadar abu, dan kadar garam dari P1 ke P2.
Senyawa yang teridentifikasi menggunakan Fourier Transformed Infrared
(FTIR) pada P1 dan P2 adalah simetrik COO dan C-O dengan COOH serta COO-asam uronik. Eksopolisakarida P. cruentum mengandung maltoheptosa yang dapat berperan sebagai immunomodulator. Jumlah maltoheptosa yaitu P1 (12.42 g/L), R2 (14.19 g/L), dan P2 (16.11 g/L).
Nilai Inhibition Concentration (IC50) inhibisi α-glukosidase P. cruentum yaitu P1 (419.06 µg/mL), R1 (425.48 µg/mL), P2 (178.67 µg/mL), dan R2 (502.25 µg/mL). Aktivitas inhibisi α-glukosidase terbaik pada P2 178.67 µg/mL. Penggunaan membran UF pada proses pemisahan EPS memengaruhi komposisi EPS sehingga juga berpengaruh terhadap aktivitas inhibisi α-glukosidase.
SUMMARY
HASANAH. Separation of Biomass and Exopolysaccharide of Porphyridium cruentum Using Ultrafiltration and its effect on the Activity of α-glucosidase Inhibition. Supervised by IRIANI SETYANINGSIH and UJU.
Porphyridium cruentum is unicellular red microalga secreted exopolysaccharide (EPS) into culture medium. Biomass and EPS of P. cruentum
potential for pharmaceutical, nutraceutical, and cosmeceutical products. Unfortunately, high concentration of salt and large volume of water in cultivation media cause high costs of biomass harvesting and EPS separation. This study aims to determine the effect of UF membrane to permeat (viscosity, pH, salinity), ash and salt content of EPS, and the best α-glucosidase inhibition activity in harvesting and EPS separation. This research include analysis content of heavy metals in sea water, cultivation of P. cruentum using Guillard media for 40 days, characterization of UF membrane 0.05 and 0.01 µm, harvesting using UF 0.05 µm, separation of EPS using UF 0.01 µm, drying of biomass and EPS using freeze dryer.
Heavy metals content (Hg, As, Cd, Cu, Pb, Zn, Ni) in sea water met standard for marine biota. Characteristics of P. cruentum cell for 40 days were round, red, and size 4.86-9.93 μm. Optical density, pH, salinity, and viscosity in culture were 0.83 ± 0.004, 7.64 ± 0.005, 47.23 ± 0.05‰ and 7.97 ± 0.25 cp respectively.
Membrane permeability of UF 0.05 μm (137.32 L/m2 h bar) was higher than UF 0.01 μm (62.38 L/m2 h bar). Culture flux was harvested using UF 0.05 μm have decreasing from 131.37 to 94.75 L/m2h and biomass rejection 96%. Membrane of UF 0.05 µm was able to retain biomass of P. cruentum. Retentate 1 (R1) and permeate 1 (P1) were produced in harvesting process. Retentate is part of membrane that can be restrained while permeate is part of membran that can be passed. Flux was separated using UF 0.01 μm have decreasing from 58.11 to 51.53 L/m2h. The decreasing of flux showed fouling in UF membrane. Retentate 2 (R2) and permeate 2 (P2) was produced in EPS separation. Separation process using UF led to decrease of viscosity, salinity, dry weight, ash content, and salt content from P1 to P2.
Compounds identified by Fourier Transformed Infrared (FTIR) were symetric COO- and C-O with –COOH and COO-uronic acid in P1 and P2. Exopolysaccharide of P. cruentum mainly was composed by maltoheptosa so that it is potential to be used immunomodulatory. The amount of maltoheptosa was P1 (12.42 g/L), R2 (14.19 g/L), and P3 (16.11 g/L).
Inhibition Concentration (IC50) values of P. cruentum α-glucosidase inhibition were P1 (419.06 µg/mL), R1 (425.48 µg/mL), P2 (178.67 µg/mL), and R2 (502.25 µg/mL). The best IC50 of α-glucosidase inhibiton was P2 178.67 µg/mL. Using of UF membrane in EPS separation process affected on composition of EPS. Change of EPS composition also affected on α-glucosidase inhibition activity.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PEMISAHAN BIOMASSA DAN EKSOPOLISAKARIDA
Porphyridium cruentum MENGGUNAKAN ULTRAFILTRASI
SERTA PENGARUHNYA TERHADAP AKTIVITAS INHIBISI
α-GLUKOSIDASE
HASANAH
Tesis
sebagai salah satu syarat untuk mendapatkan gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karuniaNya, sehingga penyusunan tesis ini dapat terselesaikan. Tema yang dipilih dalam tesis ini adalah “Pemisahan Biomassa dan Eksopolisakarida Porphyridium cruentum Menggunakan Ultrafiltrasi serta Pengaruhnya terhadap Aktivitas Inhibisi
α-Glukosidase”.
Penulisan tesis ini mendapat banyak dukungan dari berbagai pihak. Pada kesempatan kali ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada pihak yang telah bersedia membantu, di antaranya adalah :
1 Dr Ir Iriani Setyaningsih, MS dan Bapak Dr Eng Uju, SPi MSi sebagai dosen pembimbing yang memberikan bimbingan, saran, motivasi, dan semangat kepada penulis sehingga tesis ini dapat diselesaikan dengan baik.
2 Prof Dr Joko Santoso sebagai Ketua Departemen Teknologi Hasil Perairan. 3 Dr Ir Wini Trilaksani, MSc sebagai Ketua Program Studi S2 Departemen
Teknologi Hasil Perairan.
4 Dr Tati Nurhayati, SPi MSi sebagai dosen penguji dalam sidang akhir tesis yang memberikan banyak saran untuk perbaikan tesis ini.
5 Dr Kustiariyah Tarman, SPi MSi sebagai perwakilan dari Program Studi yang bersedia memberikan masukan untuk perbaikan tesis ini.
6 Direktorat Perguruan Tinggi (DIKTI) yang telah memberikan beasiswa studi di Pascasarjana IPB.
7 Kementerian Riset dan Teknologi (Kemenristek) dan Direktorat Perguruan Tinggi (DIKTI) atas dana penelitian institusi tahun 2015 dengan judul
“Pengembangan Produk Biomedis Antidiabetes” kontrak nomor :
083/SP2H/PL/Dit.Litbamas/11/2015 tanggal 5 Februari 2015 dengan Dr Desniar, SPi MSi sebagai ketua peneliti.
8 Kedua orang tua Gunarto dan Paijah, suami Yudhi Prasetyo, dan saudara Yuli Minarsih, Sulastri dan Hariyanto yang memberikan banyak dukungan dan semangat.
9 Teman-teman Pasca THP 2013, THP angkatan 48, staf dan laboran atas bantuan dan dukungannya.
Semoga penelitian ini dapat bermanfaat bagi kemajuan ilmu pengetahuan khususnya dalam bidang perikanan dan kelautan.
Bogor, November 2016
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
Manfaat Penelitian 3 Ruang Lingkup Penelitian 3 2 METODE Waktu dan Tempat 4 Bahan dan Alat 4 Prosedur Kerja 4 Kultivasi P. cruentum 4 Karakterisasi Membran UF 0.05 dan 0.01 µm 5 Pemanenan P. cruentum Menggunakan UF 0.05 µm 6
Pemisahan Eksopolisakarida Menggunakan UF 0.01 µm 6
Pengeringan Biomassa dan Ekspolisakarida P. cruentum 7
Prosedur Analisis 7
3 HASIL DAN PEMBAHASAN Kandungan Logam Berat pada Air Laut 12 Karakteristik P. cruentum 13 Karakteristik Membran UF 0.05 dan 0.01 µm 13 Karakteristik Permeat pada Pemanenan P. cruentum 14 Karakteristik Permeat pada Pemisahan Eksopolisakarida 17 Karakteristik Biomassa P. cruentum 18 Karakteristik Eksopolisakarida P. cruentum 19 Inhibisi α-glukosidase 22 4 SIMPULAN DAN SARAN Simpulan 27 Saran 27 DAFTAR PUSTAKA 28
LAMPIRAN 33
DAFTAR TABEL
1 Reaksi inhibisi α-glukosidase 11
2 Kandungan logam berat pada air laut 12
3 Karakteristik P1 16
4 Karakteristik P2 18
5 Karakteristik biomassa P. cruentum 18 6 Karakteristik komposisi kimia EPS P. cruentum 20 7 Inhibisi α-glukosidase polisakarida 25
DAFTAR GAMBAR
1 Diagram alir kultivasi dan pemanenan P. cruentum 52 Skema proses pemanenan P. cruentum 6
3 Skema proses pemisahan EPS P. cruentum 7 4 Sel P. cruentum perbesaran 40 kali 13 5 Karakteristik membran UF 0.05 dan 0.01 µm pada berbagai tekanan 14 6 Fluks terhadap waktu pada proses pemanenan 15 7 Rejeksi biomassa pada proses pemanenan 16 8 VCF terhadap fluks pada proses pemanenan 16 9 Parameter fluks dengan (a) waktu (b) VCF pada berbagai tekanan 17 10 Gugus fungsi EPS P. cruentum 21 11 Jumlah EPS P. cruentum 22 12 Inhibisi α-glukosidase biomassa dan EPS P. cruentum 23 13 Struktur EPS P. cruentum 24 14 Mekanisme akarbosa 24
DAFTAR LAMPIRAN
1 Komposisi media Guillard F/2 352 Perhitungan IC50 inhibisi α-glukosidase biomassa (R1) 35
3 Perhitungan IC50 inhibisi α-glukosidase P1 37
4 Perhitungan IC50 inhibisi α-glukosidase R2 38
5 Perhitungan IC50 inhibisi α-glukosidase P2 40
6 Perhitungan IC50 inhibisi α-glukosidase akarbosa 41
1 PENDAHULUAN
Latar belakang
Porphyridium cruentum merupakan mikroalga merah uniseluler dengan habitat di air laut, berbentuk bulat, dan selnya dikelilingi oleh eksopolisakarida (EPS) (Richmond dan Hu 2013). Biomassa P. cruentum mengandung karbohidrat 32.1%, protein 34.1%, lipid, pigmen (klorofil, karotenoid, fikobilliprotein) (Fuentes et al. 2000). Patel et al. (2013) melaporkan bahwa berat molekul EPS 2.39 x105 g/mol, mengandung tiga monosakarida netral utama yaitu galaktosa 40%, xilosa 30%, glukosa 20%, dan satu asam glukuronik 10%.
Biomassa dan EPS P. cruentum dapat menurunkan glukosa darah. Liu et al. (2005) melaporkan bahwa pemberian biomassa P. cruentum dengan
konsentrasi 600 dan 1200 mg/kg berat badan tikus diabetes selama 18 hari dapat menurunkan glukosa darah dan meningkatkan aktivitas Superoxide Dismutase
(SOD). Jian et al. (2006) menyatakan bahwa pemberian EPS P. cruentum dengan konsentrasi 150 dan 300 mg/kg berat badan tikus diabetes selama 21 hari dapat menurunkan glukosa darah, meningkatkan aktivitas SOD, dan melindungi sel pankreas.
Biomassa dan EPS P. cruentum memiliki potensi untuk dikembangkan namun pemisahannya dalam skala besar dan kelimpahan garam yang tinggi pada medium kultivasi menimbulkan masalah baru. Teknik pemanenan P. cruentum
yang sering digunakan saat ini adalah sentrifugasi. Sentrifugasi memerlukan energi besar sehingga menyebabkan biaya produksi mahal untuk skala besar. Dassey dan Theegala (2013) menyatakan untuk mendapatkan pemanenan mikroalga dengan efisiensi 94% diperlukan energi 20 kW jam/m3. Ahmad et al. (2014) melaporkan pemanenan mikroalga sebanyak 600 mL berturut-turut menggunakan sentrifugasi dapat memisahkan biomassa 99% selama 30 menit, mikrofiltrasi (MF) 90-98%, selama 40 menit dan koagulasi 70-80% selama 40 menit. Biomassa yang didapatkan pada proses pemanenan menggunakan MF mendekati sentrifugasi. Mikrofiltrasi dapat digunakan untuk pemanenan mikroalga dalam skala besar karena biaya operasinya lebih murah. Bilad et al. (2014) menyatakan pemanenan
Phaedactylum tricornutum menggunakan MF Polyvinylidene Fluoride (PVDF-9) memerlukan energi 0.27 kW jam/m3 dengan efisiensi 98%.
Mikrofiltrasi dan ultrafiltrasi (UF) dapat digunakan untuk pemanenan mikroalga Chlorella pyrenoidosa (Sun et al. 2013). Ultrafiltrasi memiliki ketahanan terhadap fouling internal dan kemampuan menahan sel lebih baik dibandingkan MF (Baker 2012). Ultrafiltrasi dapat dijadikan salah satu altenatif untuk pemanenan
P. cruentum. Wang et al. (2011) menyatakan proses pemisahan menggunakan UF efektif jika memiliki nilai fluks dan selektifitas (rejeksi) tinggi. Nilai fluks dipengaruhi oleh tekanan operasi dan fouling yang terjadi pada membran. Fluks berkaitan dengan volume pada umpan. Penurunan volume umpan selama proses operasi didefinisikan dengan Volume Concentration Factor (VCF).
Penggunaan ukuran membran UF dapat memengaruhi kemurnian komponen aktif. Polisakarida yang dipisahkan dengan UF 3, 8, dan 12 kDa
memiliki kemurnian 51%, 51.5%, 53.4% (Sun et al. 2011). Aktivitas inhibisi
2
konsentrasi 5000 ppm mempunyai aktivitas inhibisi α-glukosidase sebesar 52.2%. Inhibisi α-glukosidase fraksi etil asetat Polyopes lancifolia sebesar 52.4% (100 ppm) (Kim et al. 2010).
Teknik pemisahan dapat memengaruhi kualitas biomassa dan EPS, komponen aktif, serta inhibisi α-glukosidase. Proses UF diduga akan memengaruhi komposisi biomassa dan EPS P. cruentum sehingga juga berpengaruh terhadap aktivitas inhibisi α-glukosidase. Pemanenan biomassa P. cruentum menggunakan UF dilanjutkan pemisahan EPS dari permeat hasil pemanenan belum pernah diteliti. Informasi aktivitas inhibisi α-glukosidase dari biomassa dan EPS P. cruentum
menggunakan proses UF belum pernah dilaporkan sehingga perlu dilakukan penelitian tersebut.
Rumusan Masalah
Porphyridium cruentum dikultivasi menggunakan air laut sehingga memiliki kelimpahan garam yang tinggi pada medium kultivasi dan menyebabkan kadar garam dan abunya tinggi. Teknik pemanenan P. cruentum yang sering digunakan saat ini adalah sentrifugasi. Sentrifugasi memerlukan energi besar sehingga menyebabkan biaya produksi mahal untuk skala besar maka diperlukan metode pemanenan yang tepat. Ultrafiltrasi merupakan salah satu alternatif metode pemanenan yang dapat digunakan karena biayanya lebih murah, mudah dioperasikan, dan dapat digunakan pada skala besar. Metode pemanenan dapat memengaruhi rendemen, komponen aktif, dan aktivitas inhibisi α-glukosidase. Biomassa dan EPS P. cruentum menggunakan sentrifugasi diketahui memiliki aktivitas inhibisi α-glukosidase. Pemanenan biomassa dan pemisahan EPS menggunakan ultrafiltrasi diduga akan memengaruhi komposisi biomassa dan EPS
P. cruentum sehingga juga berpengaruh terhadap aktivitas inhibisi α-glukosidase.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1 Menentukan pengaruh membran UF terhadap karakteristik permeat pada
pemanenan dan pemisahan EPS
2 Menentukan pengaruh membran UF terhadap kadar garam dan abu EPS 3 Menentukan pengaruh membran UF terhadap komposisi biomassa dan EPS
P. cruentum serta aktivitas inhibisi α-glukosidase.
Hipotesis
Ukuran membran UF memengaruhi karakteristik permeat, kadar abu, kadar
garam, komposisi biomassa dan EPS, serta aktivitas inhibisi α-glukosidase
3
Manfaat Penelitian
Manfaat penelitian antara lain memberikan informasi karakteristik permeat pada pemanenan dan pemisahan EPS menggunakan membran UF, mengetahui pengaruh ukuran membran UF terhadap komposisi biomassa dan EPS serta
aktivitas inhibisi α-glukosidase. Manfaat penelitian ini juga sebagai informasi bahwa P. cruentum dapat dijadikan sebagai bahan baku farmasi yang potensial.
Ruang Lingkup Penelitian
4
2 METODE PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari 2015 sampai dengan Januari 2016 di Laboratorium Bioteknologi Hasil Perairan 2, Laboratorium Mikrobiologi Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Institut Pertanian Bogor, Laboratorium Studi Biofarmaka, Laboratorium Botani dan Mikrobiologi, LIPI Cibinong, Laboratorium Badan Pengkajian dan Penerapan Teknologi, PUSPIPTEK Serpong, Tangerang.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah mikroalga
P. cruentum diperoleh dari Laboratorium Marikultur Pusat Penelitian
Oseanografi-LIPI Ancol, Jakarta Utara, air laut, media Guillard, etanol teknis 96%, enzim α-glukosidase (Sigma), p-nitrophenyl α-D-glucopyranoside (Sigma), Bovine
Serum Albumin (BSA) (Sigma).
Alat yang digunakan dalam penelitian adalah membran UF jenis propilen 0.05 µm dengan area permukaan efektif 0.45 m2 dan polisulfon 0.01 µm dengan area permukaan efektif 0.25 m2 dari GDP Filter, Bandung, Indonesia, UV, Kromatografi Cair Kinerja Tinggi (KCKT), lampu neon Hannoch 40 watt, refrigerator, spektrofotometer UV VIS RS (UV-2500) (Culver, USA), viscometer brookfield FF-LV (Massachusett, USA), freeze dryer EYELA FDU 1200 (Tokyo, Japan), Elisa reader EpochTm (Winooski, USA), Tensor 37 (USA), sentrifus dingin Himac CR 21G (Ibaraki, Japan), salinometer (Multi 340i WTW 82362 Weilhem), pH meter (Eutech 664416), stopwatch, alat gelas dan kultivasi.
Prosedur Kerja
Penelitian dibagi menjadi lima tahapan, yaitu : 1) pengujian kandungan logam berat pada air laut dan kultivasi mikroalga P. cruentum 2) karakterisasi membran UF 3) pemanenan menggunakan UF 0.05 µm 4) pemisahan EPS menggunakan UF 0.01 µm 5) pengeringan biomassa dan EPS menggunakan freeze dryer. Diagram alir penelitian dapat dilihat pada Gambar 1.
Kultivasi P. cruentum
5
Ket : P : Permeat
R : Retentat
EPS : Eksopolisakarida
Gambar 1 Diagram alir kultivasi dan pemanenan P. cruentum
Karakterisasi Membran UF 0.05 dan 0.01 µm
Akuades sebagai umpan dilewatkan pada membran UF. Proses UF dilakukan pada tekanan transmembran 0.25-1.25 bar. Nilai permeabilitas membran ditentukan dengan cara menghitung gradien plot grafik antara nilai fluks (J) sebagai
sumbu Y dan tekanan transmembran (∆P) sebagai sumbu X.
Karakterisasi :
Kultivasi selama 40 hari
6
Pemanenan P. cruentum Menggunakan UF 0.05 µm
Pemanenan biomassa pada medium kultivasi dilakukan dengan mengambil mikroalga umur 40 hari sebanyak 5 L sebagai umpan dan menggunakannya untuk proses UF. Proses UF menghasilkan retentat 1 (R1), selanjutnya dikembalikan ke dalam umpan sedangkan permeat 1 (P1) dipisahkan pada tempat yang berbeda. Proses pemanenan dilakukan pada tekanan transmembran 1 bar. Skema proses pemanenan biomassa P. cruentum dapat dilihat pada Gambar 2.
Keterangan :
1 Umpan 5 Retentat
2 Pompa 6 Pressure gauge
3 Pressure gauge 7 Valve
4 Membran UF 0.05 µm 8 Permeat
Gambar 2 Skema proses pemanenan P. cruentum menggunakan UF 0.05 µm
Pengukuran fluks, rejeksi, dan VCF dihitung pada selang satu menit sekali. Total fraksi P1 di akhir pemanenan diukur nilai OD, viskositas, salinitas, dan pH. Pencucian membran UF 0.05 µm dilakukan menggunakan air selama 1 jam kemudian NaOH 1% selama 15 menit. Karakterisasi membran dilakukan kembali menggunakan akuades. Membran UF dapat dilakukan untuk proses pemanenan kembali apabila fluks sudah kembali seperti semula.
Pemisahan Eksopolisakarida Menggunakan UF 0.01 µm (Modifikasi Patel
et al. 2013)
Pemisahan EPS dilakukan dengan menyaring kembali P1 pada pemanenan sebagai umpan. Umpan dilewatkan pada membran UF 0.01 µm menggunakan tekanan transmembran 0.5, 1, dan 1.5 bar. Proses UF menghasilkan retentat 2 (R2), selanjutnya dikembalikan ke dalam umpan sedangkan permeat 2 (P2) dipisahkan pada tempat yang berbeda. Skema proses pemisahan EPS dengan membran UF 0.01 µm dapat dilihat pada Gambar 3. Pengukuran fluks dan VCF dihitung pada selang 5 menit sekali. Total fraksi P2 diukur nilai viskositas, salinitas, dan pH. Pencucian membran UF 0.01 µm dilakukan menggunakan air selama 1 jam kemudian NaOH 1% selama 15 menit. Karakterisasi membran dilakukan kembali menggunakan akuades. Membran UF dapat dilakukan untuk proses pemisahan EPS kembali apabila fluks membran UF sudah kembali seperti semula.
7
Keterangan :
1 Umpan 5 Retentat
2 Pompa 6 Pressure gauge
3 Pressure gauge 7 Valve
4 Membran UF 0.01 µm 8 Permeat
Gambar 3 Skema proses pemisahan EPS P. cruentum menggunakan UF 0.01 µm
Pengeringan Biomassa dan Eksopolisakarida P. cruentum
Biomassa basah P. cruentum (R1) didapatkan dengan mengalirkan air laut sebanyak 300 mL pada proses backwash membran UF. Biomassa basah dikeringkan menggunakan freeze dryer sehingga diperoleh biomassa kering. Fraksi P1, P2, dan R2 yang diperoleh ditambahkan etanol teknis 96% dengan rasio 1: 0.75. Hasil presipitasi kemudian dikeringkan menggunakan freeze dryer selama 3 jam untuk mendapatkan berat kering EPS. Biomassa dan EPS kering dianalisis berat kering, kadar air, kadar abu, kadar garam, dan inhibisi α-glukosidase. Eksopolisakarida dianalisis gugus fungsi dan diidentifikasi jenis serta jumlah gula sederhananya.
Prosedur Analisis
Analisis Logam Berat Cd, Cu, Pb, Zn, Ni (APHA 2012, 3111-C)
Sampel air laut dimasukkan ke dalam botol polietilen yang telah diberi label, selanjutnya sampel disaring dengan menggunakan kertas saring nekleopor 0.45 μm. Sampel air laut yang telah disaring kemudian di awetkan dengan menggunakan HNO3 pekat hingga nilai pH air laut berada di bawah dua dan disimpan.
Sampel air laut yang telah disaring sebanyak 200 mL, ditambahkan 1 mL
Ammonium Pyrrolidine Dithiocorbamate (APDC) 4% kemudian dikocok. Larutan ditambahkan 10 mL Methyl Isobutyl Keton (MIBK), dikocok selama ± 30 s. Larutan didiamkan sampai terdapat dua fase yaitu fase organik (bagian atas) dan fase anorganik (bagian bawah). Fase organik diambil dan dimasukkan ke labu kemudian dilakukan pengukuran dengan AAS untuk Cd, Cu, Pb, Zn, dan Ni.
5 7
6
4 3
1 8
8
Analisis Logam Berat Hg (APHA 2012, 3112-B)
Sampel air laut sebanyak 100 mL dimasukkan ke dalam labu Erlenmeyer 250 mL. Air laut ditambahkan 5 mL H2SO4, 2.5 mL HNO3, dan 15 mL KMNO4. Larutan didiamkan selama 15 menit kemudian ditambahkan 8 mL K2S2O8 dan dipanaskan selama 8 jam pada water bath dengan suhu 90 °C. Larutan didinginkan pada suhu ruang. Larutan ditambahkan NaCl hidroksiamin untuk menurunkan kelebihan KMnO4 kemudian ditambahkan 5 mL SnCl2. Larutan diukur dengan menggunakan AAS.
Analisis Logam Berat As (APHA 2012, 3114-B)
Larutan As (III) sebanyak 10 mL dilarutkan ke dalam 1000 mL air yang mengandung 5 mL HNO3 dan sebagai larutan standar (1mL = 0.100 µg As (III)). Sampel air laut dan larutan standar masing-masing diambil 50 mL kemudian ditambahkan 1 mL 2.5 N H2SO4 dan 5 mL dari 5% K2S2O8. Sampel dan standar direbus selama 30-40 menit atau volume sampai 10 mL kemudian diencerkan sampai 50 mL dan dilakukan pengukuran menggunakan AAS.
Analisis Kadar Air (SNI 01-2891-1992)
Prinsip analisis kadar air adalah mengetahui jumlah air yang terdapat pada suatu bahan. Cawan porselen dikeringkan dalam oven dengan suhu 105 oC selama satu jam. Cawan porselen yang sudah dikeringkan dalam oven dimasukkan dalam desikator (30 menit) kemudian ditimbang. Sampel ditimbang sebanyak 1-2 g dan dimasukkan ke dalam cawan porselen yang sudah kering serta diketahui beratnya. Cawan berisi sampel dimasukkan dalam oven dengan suhu 105 oC selama 3 jam atau sampai beratnya konstan. Cawan dimasukkan ke dalam desikator (30 menit) kemudian ditimbang. Kadar air dihitung dengan rumus:
W1
Kadar air (%) = x 100% W
Ket : W = Bobot sampel sebelum dikeringkan (g) W1 = Bobot sampel setelah dikeringkan (g)
Analisis Kadar Abu (SNI 01-2891-1992, butir 6.1)
9
Analisis Kadar Garam (SNI 01-2359-1991)
Sampel 3 g dimasukkan ke dalam labu Erlenmeyer kemudian ditambahkan 100 mL akuades secara bertahap dan larutan disaring. Filtrat yang dihasilkan dimasukkan ke dalam labu ukur 100 mL dan ditambahkan akuades sampai tanda tera. Larutan sampel 5 mL diambil dan dimasukkan ke labu Erlenmeyer dan ditambahkan 3 mL larutan K2CrO4 2 % kemudian dilakukan titrasi dengan AgNO3 0.1 N sampai terbentuk endapan merah bata. Kadar garam dihitung dengan rumus :
Kadar Garam (%) = (V AgNO3 × N AgNO3 × Mr.NaCl × fp × 100 %) / mg sampel
Analisis Ukuran Sel (Scheggia et al. 2008)
Kultur sel pada umur 40 hari diambil sebanyak 5 mL. Cairan diambil menggunakan pipet tetes dan diletakkan pada kaca objek. Ukuran sel diamati menggunakan mikroskop cahaya dengan perbesaran 40 kali.
Analisis Kepadatan Biomassa P. cruentum (Sobczuk et al. 2006)
Kultur P. cruentum umur 40 hari diambil sebanyak 5 mL dari akuarium. Kultur kemudian dimasukkan ke dalam kuvet dengan air laut sebagai blanko. Pengukuran OD P. cruentum dilakukan menggunakan spektofotometer pada panjang gelombang 760 nm. Nilai yang tertera pada layar dicatat sebagai OD
P. cruentum.
Analisis Viskositas (Bhatnagar et al. 2014)
Viskositas medium kultivasi diukur menggunakan Viskometer FF LV. Viskometer diletakkan pada posisi yang tepat kemudian spindel LV 1 dipasang ke alat tersebut. Viskometer diturunkan sampai spindel tercelup pada batas yang ditentukan. Viskometer dihidupkan dan spindel berputar dengan kecepatan 60 rpm selama 1 menit. Angka yang tertera pada viskometer kemudian dibaca.
Analisis pH dan Salinitas
Permeat 1 dan P2 diambil sebanyak 30 mL. Permeat diukur menggunakan pH meter dan salinometer. Kalibrasi pH meter dilakukan sebelum pengukuran sampel. Pengukuran sampel menggunakan pH meter dilakukan dengan mencelupkan elektroda ke dalam sampel, diputar-putar sampai homogen kemudian tekan hold dan tunggu sampai angka pada layar stabil selanjutnya angka yang tertera dicatat. Pengukuran salinometer dilakukan dengan mencelupkan elektroda ke dalam sampel kemudian tekan run/enter sampai angka pada layar stabil selanjutnya angka yang tertera dicatat.
Analisis Fluks (Wang et al. 2011)
10
Analisis Koefisien Rejeksi Biomassa (Wang et al. 2011)
Koefisien rejeksi adalah fraksi konsentrasi zat terlarut yang tidak menembus membran, dan dirumuskan sebagai :
Cp Cf Keterangan :
R = Koefisien rejeksi (%)
Cp = Konsentrasi zat terlarut dalam permeat (OD permeat) Cf = Konsentrasi zat terlarut dalam umpan (OD umpan)
Analisis Volume Concentration Factor (Sun et al. 2013)
Volume Concentration Factor adalah penurunan volume umpan selama proses operasi dan dihitung menggunakan rumus sebagai berikut :
V0 V0-Vt Keterangan :
VCF = Volume Concentration Factor
V0 = Volume umpan pada waktu ke-0
Vt = Volume umpan yang berkurang pada waktu ke-t
Analisis Inhibisi α-glukosidase (Gouda et al. 2015)
Pengujian inhibisi α-glukosidase menggunakan larutan blanko (B0), larutan kontrol blanko (B1), larutan sampel (S0), dan larutan kontrol sampel (S1). Larutan
blanko dibuat dengan mencampurkan larutan 4 mM p-nitrophenyl α-D-glucopyranoside (0.05 mL), 2 U/mL α-glukosidase (0.025 mL) dalam buffer
fosfat 0.05 M (pH 7) dan ditambahkan DMSO (1 mL). Perbedaan antara blanko dan kontrol blanko adalah kontrol blanko tidak menggunakan enzim α-glukosidase. Blanko dan kontrol blanko diinkubasi pada suhu 37 °C selama 15 menit dan reaksi perubahan warna terjadi. Reaksi dihentikan dengan penambahan Na2CO3 0.2 M (750 µL). Aktivitas enzim diukur pada absorbansi 405 nm.
Larutan sampel dibuat dengan mencampurkan larutan 4 mM p-nitrophenyl α-D-glucopyranoside (0.05 mL), 2 U/mL α-glukosidase (0.025 mL) dalam buffer
fosfat 0.05 M (pH 7) dan ditambahkan sampel (1 mL). Perbedaan antara sampel
11
penambahan Na2CO3 0.2 M (750 µL). Aktivitas enzim diukur pada absorbansi 405 nm.
Konsentrasi larutan akarbosa 1% dibuat dari tablet Glucobay sebagai standar. Tablet Glucobay dilarutkan dalam akuades dan HCl 2N (1:1) dengan konsentrasi 1% (b/v), kemudian disentrifugasi dan supernatan diambil sebanyak
10 μL, lalu dimasukkan ke dalam campuran reaksi seperti dalam sampel. Reaksi enzim selengkapnya untuk satu sampel dapat dilihat pada Tabel 1.
Tabel 1 Reaksi inhibisi α-glukosidase
Jenis B0 B1 S0 S1
Sampel - - 1 mL 1 mL
DMSO 1mL 1mL - -
Substrat 50 µL 50 µ L 50 µL 50 µ L
Enzim 25 µL - 25 µL -
Inkubasi 37 °C selama 15 menit
Na2CO3 750 µL 750 µL 750 µL 750 µL
Inhibisi α-glukosidase dihitung menggunakan rumus sebagai berikut :
C-S C
Keterangan :
C = Absorbansi blanko dikurangin kontrol blanko S = Absorbansi sampel dikurangin kontrol sampel
Analisis Gugus Fungsi (Mishra dan Jha 2009)
Gugus fungsi dari EPS dideteksi dengan Fourier Transformed Infrared
(FTIR). Pelet untuk analisis FTIR diperoleh dengan memasukkan 200 mg Kbr dan 2 mg sampel ke dalam mortar serta dicampurkan sampai homogen. Sampel dipadatkan dan dimasukkan ke dalam Tensor 37. Pengukuran sampel uji dilakukan pada bilangan gelombang antara 4000-500 cm-1. Spektra FTIR yang dihasilkan menunjukkan puncak-puncak serapan bilangan gelombang dari sampel uji. Gugus-gugus fungsi sampel uji ditentukan berdasarkan puncak serapan bilangan gelombang yang terdeteksi.
Analisis Jenis dan Jumlah Gula Sederhana (modifikasi Emega et al. 2012)
Eksopolisakarida 0.6 g dihidrolisis dengan 2M H2SO4 30 mL selama 15 menit pada suhu 121 °C pada tabung gelas yang ditutup. Eksopolisakarida
terhidrolisis kemudian dinetralkan dengan NH4OH 14 M dan difilter dengan kertas saring. Komposisi monosakarida ditentukan dengan KCKT menggunakan kolom Aminex HPX-87H (300 mm x 7.8 mm) dan detektor RI dengan rata-rata aliran 1 mL/menit pada suhu 35 °C dan fase gerak 0.008 N H2SO4. Volume diinjeksikan 20 µL. Area puncak diperkirakan sebagai komposisi monomer.
12
Analisis Data
Data yang didapatkan diolah secara deskriptif dan menggunakan standar deviasi. Data inhibisi α-glukosidase dihitung persen inhibisi dan dilakukan regresi linear serta ditentukan nilai IC50.
3 HASIL DAN PEMBAHASAN
Kandungan Logam Berat pada Air Laut
Logam berat adalah unsur-unsur kimia dengan densitas lebih besar dari 5 g/cm3, terletak di sudut kanan bawah pada sistem periodik unsur, mempunyai afinitas yang tinggi terhadap S dan biasanya bernomor atom 22 sampai 92, dari periode empat sampai tujuh (Setiawan 2013). Logam berat dapat mencemari air laut. Air laut adalah suatu komponen yang berinteraksi dengan lingkungan daratan, dimana buangan limbah dari daratan akan bermuara ke laut (Ika et al. 2012).
Biomassa dan EPS P. cruentum pada penelitian ini akan digunakan ke arah
farmasi sehingga harus aman dari logam berat. Media kultivasi mikroalga
P. cruentum menggunakan air laut sehingga perlu diketahui kadar kandungan logam beratnya. Kandungan logam berat pada media air laut P. cruentum dapat dilihat pada Tabel 2.
Tabel 2 Kandungan logam berat pada air laut
No. Parameter Satuan DL Sampel BM Metode
BM = Baku Mutu berdasarkan Kepmen-LH 51 Tahun 2004 Lampiran III
(untuk biota laut)
13
Karakteristik P. cruentum
Mikroalga P. cruentum pada media Guillard yang dipanen umur 40 hari memiliki sel berwarna merah dengan ukuran diameter sel 4.86-9.93 µm (Gambar 4) dan nilai OD P. cruentum sebesar 0.83 ± 0.00. Diameter sel pada penelitian ini sesuai standar diameter sel P. cruentum. Prasetyo et al. (2015) menyatakan diameter sel P. cruentum umur 12 hari sebesar 5.11 µm dan OD umur 40 hari sebesar 0.88.
Gambar 4 Sel P. cruentum perbesaran 40 kali
Medium kultivasi pada umur 40 hari memiliki viskositas 7.97 ± 0.25 cp, pH 7.64 ± 0.00, dan salinitas 47.23 ± 0.05‰. Viskositas pada penelitian ini rendah karena berkaitan dengan jumlah EPS yang dilepaskan ke medium. Jumlah EPS dipengaruhi media yang digunakan dan waktu pemanenan. Nilai pH pada penelitian ini sesuai dengan pH standar media untuk pertumbuhan P. cruentum. Salinitas medium kultivasi pada penelitian ini tinggi karena menggunakan air laut dengan penambahan mineral-mineral tertentu.
Sobzcuk et al. (2006) menyatakan nilai pH media pertumbuhan P. cruentum
7.7. Bhatnagar et al. (2014) menjelaskan mikroalga Nostoc calcicola yang dikultivasi pada media BG11 dengan penambahan NaCl (0-1 M) dan kondisi fosfor terbatas (0.023 mM), penyinaran 12:12 dipanen umur 45 hari pada fase stasioner memiliki viskositas 55-65 cp. Mishra dan Jha (2009) meneliti pengaruh perbedaan konsentrasi NaCl (0.5-5 M) terhadap EPS Dunaliella. Eksopolisakarida tertinggi didapatkan pada Media Walne dengan penambahan NaCl 5 M.
Karakteristik Membran UF 0.05 dan 0.01 µm
14
fluoropolymer 100 kDa, polysulfone 100 kDa, dan regenerated cellulose acetate
10 kDa sebesar 270.9 L/m2jam bar, 177.4 L/m2jam bar, dan 52.1 L/m2jam bar.
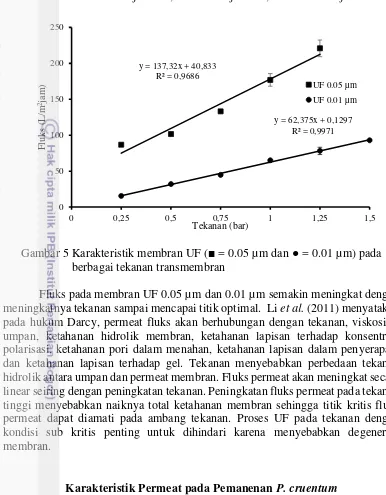
Gambar 5 Karakteristik membran UF (■ = 0.05 µm dan ● = 0.01 µm) pada berbagai tekanan transmembran
Fluks pada membran UF 0.05 µm dan 0.01 µm semakin meningkat dengan meningkatnya tekanan sampai mencapai titik optimal. Li et al. (2011) menyatakan pada hukum Darcy, permeat fluks akan berhubungan dengan tekanan, viskositas umpan, ketahanan hidrolik membran, ketahanan lapisan terhadap konsentrasi polarisasi, ketahanan pori dalam menahan, ketahanan lapisan dalam penyerapan, dan ketahanan lapisan terhadap gel. Tekanan menyebabkan perbedaan tekanan hidrolik antara umpan dan permeat membran. Fluks permeat akan meningkat secara linear seiring dengan peningkatan tekanan. Peningkatan fluks permeat pada tekanan tinggi menyebabkan naiknya total ketahanan membran sehingga titik kritis fluks permeat dapat diamati pada ambang tekanan. Proses UF pada tekanan dengan kondisi sub kritis penting untuk dihindari karena menyebabkan degenerasi membran.
Karakteristik Permeat pada Pemanenan P. cruentum
15
Gambar 6 Fluks terhadap waktu pada proses pemanenan
Penurunan fluks pada awal proses disebabkan terjadinya lapisan gel pada permukaan sehingga menyebabkan terjadinya fouling. Penurunan fluks selanjutnya disebabkan terjadinya densifikasi lambat pada lapisan gel. Penyebab utama terjadi
fouling pada membran karena konsentrasi polarisasi. Konsentrasi polarisasi menyebabkan terjadinya pengendapan pada permukaan membran. Pelarut dan zat terlarut pada proses UF melewati membran. Molekul zat pelarut dapat menembus membran sedangkan zat terlarut dengan molekul lebih besar sebagian menumpuk di permukaan membran dan sebagian lagi ditolak dan berdifusi kembali ke umpan. Zat terlarut yang terkonsentrasi pada permukaan membran umumnya 20-50 kali lebih tinggi dari konsentrasi larutan umpan dan membentuk lapisan gel pada permukaan membran sehingga menjadi penghalang sekunder aliran yang melewati membran (Baker 2012).
Nilai OD fraksi R1 sebesar 0.88 dan mengalami peningkatan 6% dibandingkan sebelum pemanenan. Peningkatan OD kecil pada R1 disebabkan sel P. cruentum lebih banyak terperangkap di dalam pori membran dan menyebabkan fouling sehingga biomassa dikeluarkan melalui proses backwash. Zhang et al. (2013) melakukan pemanenan Chlorella sp. menggunakan membran UF. Biomassa yang didapatkan melalui proses backwash. Konsentrasi awal
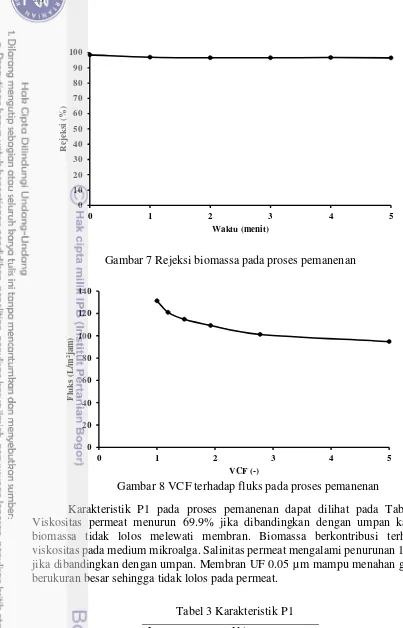
biomassa Chlorella sp 29 g/L menjadi 248.6 g/L. Nilai rejeksi biomassa
P. cruentum tinggi (Gambar 7). Membran UF 0.05 µm efektif menahan biomassa
P. cruentum. Perubahan OD dapat dilihat dari penurunan fluks lebih cepat pada saat VCF 0-1.67 dan mulai stabil pada VCF 2.7-5 (Gambar 8). Volume concentration factor semakin besar menunjukkan konsentrasi umpan semakin lama semakin kental sehingga memengaruhi laju aliran pada proses pemanenan
Mikroalga yang dipanen menggunakan UF memiliki rejeksi tinggi. Huang
et al. (2012) menyatakan Chlorella sp. dipanen menggunakan UF 0.02 µm. Rejeksi biomassa sebesar 87.2-95.5%. Chaiklahan et al. (2014) menyatakan Spirulina
16
Gambar 7 Rejeksi biomassa pada proses pemanenan
Gambar 8 VCF terhadap fluks pada proses pemanenan
Karakteristik P1 pada proses pemanenan dapat dilihat pada Tabel 3. Viskositas permeat menurun 69.9% jika dibandingkan dengan umpan karena biomassa tidak lolos melewati membran. Biomassa berkontribusi terhadap viskositas pada medium mikroalga. Salinitas permeat mengalami penurunan 10.3% jika dibandingkan dengan umpan. Membran UF 0.05 µm mampu menahan garam berukuran besar sehingga tidak lolos pada permeat.
17
Karakteristik Permeat pada Pemisahan Eksopolisakarida
Parameter fluks dan VCF dilakukan pada proses pemisahan EPS dengan tekanan 0.5, 1, dan 1.5 bar (Gambar 9). Nilai fluks pada tekanan 1 bar meningkat tiga kali lipat dibandingkan 0.5 bar. Fluks tidak mengalami peningkatan yang nyata ketika tekanan dinaikkan menjadi 1.5 bar karena telah mencapai tekanan optimal. Tekanan terpilih pada pemisahan EPS menggunakan UF 0.01 µm adalah 1 bar.
Gambar 9 Parameter fluks dengan (a) Waktu (b) VCF pada berbagai tekanan transmembran (● = 0.5 bar, ▲ = 1 bar, dan ■ = 1.5 bar)
18
Pola yang sama juga terjadi pada VCF. Semakin tinggi nilai fluks yang dihasilkan maka VCF semakin besar pada waktu yang sama. Hal ini menunjukkan konsentrasi umpan pada tekanan 0.5 bar lebih encer dibandingkan pada tekanan 1 dan 1.5 bar pada waktu yang sama.
Tabel 4 Karakteristik P2 Viskositas semakin menurun karena EPS ukuran >0.01 µm tertahan pada membran dan hanya EPS berukuran <0.01 µm yang ada di P2. Salinitas P2 pada tahap pemisahan EPS mengalami penurunan 18%. Penurunan salinitas kecil karena ion garam memiliki ukuran yang lebih kecil dari UF 0.01 µm. Izadpanah dan Javidan (2012) menyatakan rejeksi salinitas 77-83% menggunakan membran nanofiltrasi yang memiliki ukuran lebih kecil.
Karakteristik Biomassa P. cruentum
Teknik pemanenan memengaruhi karakteristik biomassa yang dihasilkan. Karakteristik biomassa P. cruentum yang dipisahkan menggunakan UF 0.05 µm dapat dilihat pada Tabel 5. Berat kering dan kadar air biomassa pada penelitian ini mendekati hasil beberapa penelitian P. cruentum lainnya. Berat kering mikroalga dipengaruhi kondisi dan lama kultivasi serta waktu pemanenan. Kadar air dipengaruhi metode dan lama pengeringan. Kadar abu P. cruentum pada penelitian ini lebih tinggi dibandingkan penelitian lainnya. Hal ini diduga biomassa tanpa pencucian menyebabkan mineral pada air laut ikut tercampur. Fuentes et al. (2000) menjelaskan biomassa kering P. cruentum dengan pencucian mengandung mineral Ca, K, Na, Mg, Zn, Fe, Cu, Cr, dan S.
Tabel 5 Karakteristik biomassa P. cruentum
19
melaporkan bahwa kadar abu alga air tawar 8-11% sedangkan alga air laut 9-33%. Marrez et al. (2014) melaporkan media kultivasi yang berbeda memengaruhi kadar abu dan komposisi serta jumlah mineral pada biomassa S. platensis. Michelon et al.
(2015) menyatakan komposisi nitrogen (N) dan fosfor (P) memengaruhi kadar abu biomassa mikroalga. Mikroalga yang dikultivasi pada N dan P terbatas memiliki kadar abu yang lebih tinggi dibandingkan P terbatas, N terbatas, dan kondisi normal. Elfeel dan Bakhashwain (2012) melaporkan salinitas air yang berbeda pada tanaman Acacia saligna dapat memengaruhi kadar abu dan kandungan mineral.
Teknik pemanenan diduga memengaruhi nilai kadar abu pada biomassa. Proses pemanenan menggunakan membran UF 0.05 µm dapat menurunkan salinitas pada P1. Hal ini menunjukkan bahwa garam pada media kultivasi tertahan pada retentat dan bercampur dengan biomassa. Biomassa basah yang didapatkan juga masih berupa cairan kental yang bercampur dengan air laut sehingga meningkatkan kadar abu pada biomassa kering. Michelon et al. (2015) menjelaskan bahwa teknik pemanenan berpengaruh terhadap komposisi biomassa sel mikroalga (protein, karbohidrat, lemak, dan kadar abu). Kadar abu yang dihasilkan dari pemanenan menggunakan koagulasi (7.7%) lebih rendah dibandingkan sentrifugasi (12.8%).
Karakteristik Eksopolisakarida P. cruentum
Komposisi Kimia
Karakteristik berat kering, kadar air, kadar abu, dan kadar garam dari EPS
P. cruentum dapat dilihat pada Tabel 6. Proses UF menyebabkan terjadinya penurunan berat kering, kadar abu, dan kadar garam dari P1 ke P2. Komposisi kimia
terbaik pada P2 yang didapatkan menggunakan UF 0.01 µm. Berat kering
P. cruentum pada penelitian ini berada pada kisaran berat kering Richmond dan Hu (2013) dan lebih besar dibandingkan penelitian Raposo et al. (2014). Berat kering EPS dipengaruhi oleh teknik pemisahan dan kondisi kultur. Penggunaan membran UF 0.01 µm menyebabkan berat kering EPS P2 lebih kecil dibandingkan P1. Richmond dan Hu (2013) menyatakan P. cruentum yang dikultivasi dengan diameter wadah berbeda memiliki berat kering EPS 0.5-2 g/L. Raposo et al. (2014) menyatakan EPS dipisahkan menggunakan sentrifugasi dilanjutkan dengan dialisis. Berat kering EPS pada media NTIP 0.2-0.4 g/L dan media Brody 0.9-1 g/L.
Kadar abu EPS P. cruentum lebih tinggi dibandingkan beberapa penelitian lain dari laut. Hal ini disebabkan perbedaan habitat lingkungan. Porphyridium cruentum dikultivasi menggunakan air laut dengan penambahan mineral tertentu sehingga menyebabkan salinitas menjadi tinggi. Settamongkol et al. (2015) menjelaskan bahwa Caulerpa lentifiliera yang ditumbuhkan pada media F/2 dan dipanen dengan pencucian air tawar memiliki kadar abu sebesar 47.80%. Benjama dan Masniyom (2011) menyatakan bahwa kadar abu rumput laut dari Teluk Pattani, Thailand Selatanyaitu Ulva pertusa (27.2%) dan Ulva intestinalis (27.6%). Rojano
et al. (2014) menyatakan amphipod dari Selat Gibraltar mempunyai kadar abu 29.3-39.7%.
20
Penambahan etanol menyebabkan ion mineral dipresipitasi bersama dengan ion polisakarida. Polisakarida C. abyssinica yang dipresipitasi dengan etanol terdeteksi mineral sodium, kalsium, magnesium, dan potassium sedangkan dengan asam tidak terdeteksi. Kadar garam EPS kecil diduga karena penggunaan membran UF dan adanya penambahan akuades setelah proses presipitasi.
Tabel 6 Karakteristik komposisi kimia EPS P. cruentum
EPS Berat kering FAO/WHO Expert Comittee on Food Additives (JECFA 2007) menyatakan standar kadar abu polisakarida karagenan komersil 15-40% dw. Kepmen (2009) menyatakan persyaratan ekstrak untuk herbal memiliki kadar air ≤ 10% dan kadar
abu ≤ 1%. Hal ini menunjukkan bahwa kadar abu dan kadar air EPS P.cruentum
belum memenuhi standar sehingga perlu dilakukan pemisahan mineral dan pengeringan lebih lama.
Garam dan mineral pada kadar abu EPS dapat memberikan efek negatif terhadap kesehatan. Kadar garam melebihi batas normal menyebabkan penyakit hipertensi. Kelebihan mineral menyebabkan terganggunya keseimbangan homeostatis dan toksik pada tubuh. Qin et al. (2014) menyatakan pasien yang mengkonsumsi garam lebih dari 6 g/d memiliki tekanan darah lebih tinggi dari normal sehingga dapat menyebabkan hipertensi. Soetan et al. (2010) menjelaskan kelebihan natrium menyebabkan tekanan darah tinggi. Kelebihan besi menyebabkan kerusakan hati.
Gugus Fungsi Eksopolisakarida
Fourier Transformed Infrared adalah alat yang digunakan untuk mencari getaran molekul dan ikatan polar antara atom yang berbeda berdasarkan bilangan gelombang pada ikatan. Penyerapan intensitas digunakan untuk menghitung konsentrasi relatif. Spektra FTIR menggambarkan karakteristiknya pada tiga bagian. Bagian pertama antara 4000-1800 cm-1 menunjukkan adanya ikatan hidroksil. Kedua, antara 1800-1500 cm-1 menunjukkan adanya ikatan karbonil dan ikatan ganda C=C. Ketiga, antara 1500-750 cm-1 menunjukkan adanya ikatan protein, lipid, dan karbohidrat. Penyerapan 1200-800 cm-1 menunjukkan adanya ikatan polisakarida dengan komposisi dan struktur yang berbeda (Sood et al. 2013). Gugus fungsi EPS P. cruentum dapat dilihat pada Gambar 10.
21
nonkovalen 66 kDa terdiri dari polipeptida 58 kDa dan gugus glikan 8 kDa. Ginzberg et al. (2008) melaporkan gugus fungsi EPS P. cruentum adalah –OH, -COOH, C=O, NH, CC, CN,-CH, -CH2, -COO, dan SO4. Yang et al. (2012) menyatakan standar asam ursolik terdapat pada spektrum 2350-2250 cm-1, 1700-1550 cm-1, 1550-1450 cm-1, dan 1450-1350 cm-1. Wozniak et al. (2015) menyatakan asam ursolik adalah triterpenoid pentasiklik yang merupakan metabolit sekunder pada tanaman dan banyak diaplikasikan pada bidang farmasi.
Gambar 10 Gugus fungsi EPS P. cruentum
Jenis dan Jumlah Gula Sederhana Eksopolisakarida
Jenis gula pada EPS P. cruentum adalah maltoheptosa, jumlahnya semakin meningkat ketika ukuran membran UF yang digunakan semakin kecil (Gambar 11). Maltoheptosa merupakan tujuh disakarida maltosa yang tersusun dari komponen glukosa. Jenis gula pada EPS diduga hanya terdapat glukosa. Min et al. (2010) menyatakan bahwa maltoheptosa adalah oligomer glukosa yang dihubungkan dengan ikatan α-(1,4) dan tersusun atas 7 glukosa. Maltoheptosa banyak digunakan sebagai bahan untuk analisis dan substrat pada aktivitas α-amilase. Tsai et al.
(2013) menyatakan bahwa maltoheptosa (derajat polimerisasi 7) mempunyai kecenderungan membentuk struktur heliks bersama sama dengan dua ujung terdekat dari rantai glukan. Konformasi ini dapat menyebabkan dua residu glukosa untuk berinteraksi dengan reseptor efektif pada waktu yang sama. Maltoheptosa mempunyai kemampuan mengikat toll like receptor (TLR-2) di monosit dan signifikan merespon imun dengan merangsang ekspresi sitokin. Maltoheptosa bisa berinteraksi dengan TLR 2 dengan afinitas tinggi melalui ikatan hidrogen antara residu glukosa dari dua ujung siklik maltoheptosa dan sisi aktif protein TLR 2.
400
Bilangan gelombang (cm-1)
P1 R2 P2 874
22
Gambar 11 Jumlah EPS P. cruentum
Jenis EPS pada penelitian ini berbeda dengan beberapa penelitian lain. Patel et al. (2013) menyatakan EPS P. cruentum terdiri dari galaktosa, glukosa, xylosa, dan asam glukuronik. Raposo et al. (2014) menyatakan monosakarida dari EPS P. cruentum terdiri dari galaktosa 36.5%, glukosa 24%, arabinosa 16%, mannosa 11%, fukosa 9%, xilosa 7%,dan rhamnosa 4%. Ontman et al. (2011) menyatakan monosakarida dari EPS P. cruentum terdiri dari asam glukuronik, mannosa, 6-O-metil mannosa, dan xylosa. Semua struktur intinya mempunyai karakteristik struktur [Man]4[O-MeMan]3[Xyl]1[GlcNAc]2 yang mengandung residu metil mannosa.
Perbedaan jenis EPS yang dihasilkan diduga karena kondisi hidrolisis belum optimum. Waktu yang digunakan untuk proses hidrolisis belum dapat memecah ikatan EPS P. cruentum. Beberapa faktor yang memengaruhi proses hidrolisis adalah jenis dan konsentrasi sampel, waktu hidrolisis, suhu hidrolisis, jenis dan konsentrasi asam kuat yang digunakan. Jang et al. (2012) menjelaskan bahwa jumlah glukosa, rhamnosa, dan galaktosa mengalami peningkatan dengan semakin lamanya waktu hidrolisis. Emega et al. (2012) menyatakan semakin tinggi konsentrasi asam kuat yang digunakan maka proses hidrolisis semakin cepat dan asam galakturonik yang dihasilkan semakin besar. Asam galakturonik yang dihidrolisis menggunakan H2SO4 pada konsentrasi 0.2, 1, dan 2 M selama 24 jam menunjukkan hasil hidrolisis yang diperoleh 6% (16 jam), 10% (8 jam), dan 10% (2 jam) w/w.
Semakin tinggi suhu maka waktu hidrolisis yang diperlukan semakin cepat. Emega et al. (2012) melaporkan bahwa jumlah asam galakturonik yang dihidrolisis menggunakan H2SO4 0.2 M suhu 80 °C dan 100 °C adalah 2.5% (28 jam) dan 6% (16 jam) (w/w). Gula netral yang dihidrolisis menggunakan H2SO4, HCl, dan TFA 2 M 100 °C menunjukkan bahwa hasil terbaik H2SO4.
Inhibisi α-glukosidase
Beberapa EPS dan biomassa mikroalga diketahui mampu menghambat enzim α-glukosidase. α-glukosidase merupakan enzim yang dapat menghidrolisis pati menjadi glukosa sehingga dapat diserap di dalam tubuh kita menjadi energi.
23
Inhibisi α-glukosidase biomassa dan EPS P. cruentum dapat dilihat pada Gambar 12. Perhitungan nilai IC50inhibisi α-glukosidase dapat dilihat pada Lampiran 2-6.
Gambar 12 Inhibisi α-glukosidase biomassa dan EPS P. cruentum
Nilai IC50 inhibisi α-glukosidase P2 lebih kecil dibandingkan P1. Ukuran EPS yang lebih kecil diduga memiliki berat molekul lebih rendah dan aktivitas biologisnya lebih tinggi. Ukuran partikel berpengaruh terhadap penetrasinya sehingga lebih efektif. Nilai IC50 inhibisi α-glukosidase P2 lebih kecil diduga karena memiliki jumlah maltoheptosa lebih banyak dibandingkan P1 dan R2 (Gambar 11), kadar abu dan kadar garam paling rendah (Tabel 4), dan gugus fungsi COO- dan C-O- dengan COOH serta COO-asam uronik (Gambar 10). Pal et al.
(2011) menjelaskan ukuran partikel lebih kecil menyebabkan area permukaan lebih luas sehingga komponen aktif lebih cepat larut. Komponen aktif yang lebih cepat larut menyebabkan penyerapan dan bioavailabilitas lebih besar. Ukuran EPS yang lebih kecil diduga memiliki antioksidan lebih besar. Sun et al. (2009) menyatakan berat molekul EPS P. cruentum yang lebih kecil menyebabkan nilai IC50 antioksidan lebih kecil.
Efektifitas penghambatan α-glukosidase dipengaruhi oleh beberapa faktor antara lain ukuran partikel (Zhu et al. 2012), berat molekul (Hu et al. 2013), dan komponen aktif (Kang et al. 2012; Deng et al. 2015). Zhu et al. (2012) melaporkan
bitter melon lyophilized superfine grinding powder (BLSP) ukuran 3-10 µm mempunyai kemampuan menurunkan glukosa darah lebih baik dibandingkan bitter melon hot air drying superfine grinding powder (BSP) ukuran 50-150 µm.
Adanya aktivitas inhibisi α-glukosidase pada EPS diduga karena gugus fungsi COO- dan C-O- dengan COOH serta COO-asam uronik. Gugus fungsi COO- dan C-O- dengan COOH diduga merupakan asam ursolik berdasarkan hasil FTIR. Ikena et al. (2009) menyatakan asam ursolik merupakan asam karboksilat triterpenoid pentasiklik natural yang umumnya terdapat pada tumbuhan dan memiliki aktivitas biologis sebagai antioksidan, antikanker, dan anti-inflamasi. Terpenoid merupakan metabolit sekunder yang berfungsi melindungi tanaman dari herbivora dan patogen. Hal ini didukung juga oleh Kang et al. (2012) yang
menyatakan asam ursolik dari Osmanthus fragrans memiliki IC50 inhibisi α-glukosidase 3.38 µg/mL. Deng et al. (2015) melaporkan bahwa polisakarida dari
24
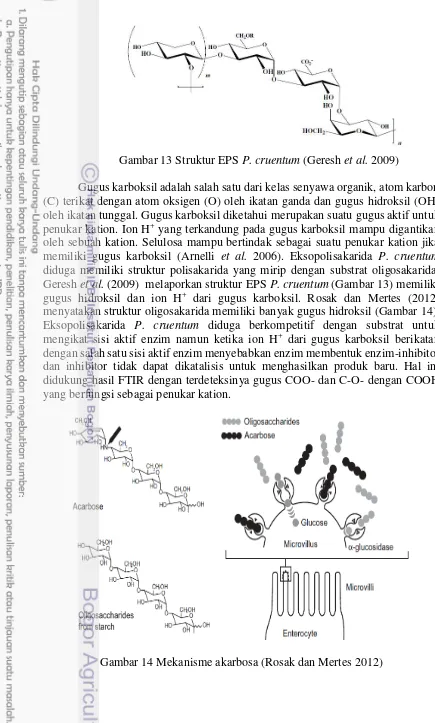
Gambar 13 Struktur EPS P. cruentum (Geresh et al. 2009)
Gugus karboksil adalah salah satu dari kelas senyawa organik, atom karbon (C) terikat dengan atom oksigen (O) oleh ikatan ganda dan gugus hidroksil (OH) oleh ikatan tunggal. Gugus karboksil diketahui merupakan suatu gugus aktif untuk penukar kation. Ion H+ yang terkandung pada gugus karboksil mampu digantikan oleh sebuah kation. Selulosa mampu bertindak sebagai suatu penukar kation jika memiliki gugus karboksil (Arnelli et al. 2006). Eksopolisakarida P. cruentum
diduga memiliki struktur polisakarida yang mirip dengan substrat oligosakarida. Geresh et al. (2009) melaporkan struktur EPS P. cruentum (Gambar 13) memiliki gugus hidroksil dan ion H+ dari gugus karboksil. Rosak dan Mertes (2012) menyatakan struktur oligosakarida memiliki banyak gugus hidroksil (Gambar 14). Eksopolisakarida P. cruentum diduga berkompetitif dengan substrat untuk mengikat sisi aktif enzim namun ketika ion H+ dari gugus karboksil berikatan dengan salah satu sisi aktif enzim menyebabkan enzim membentuk enzim-inhibitor dan inhibitor tidak dapat dikatalisis untuk menghasilkan produk baru. Hal ini didukung hasil FTIR dengan terdeteksinya gugus COO- dan C-O- dengan COOH yang berfungsi sebagai penukar kation.
25
Mekanisme inhibisi α-glukosidase pada EPS P. cruentum diduga hampir sama dengan mekanisme akarbosa. Rosak dan Mertes (2012) menyatakan akarbosa memiliki struktur yang sama dengan oligosakarida alami tetapi memiliki afinitas 104-105 lebih tinggi untuk α-glukosidase. Akarbosa merupakan inhibitor enzim yang bersifat kompetitif terhadap substrat. Mekanisme akarbosa dapat dilihat pada Gambar 14. Saqib dan Siddiqi (2008) menjelaskan mekanisme akarbosa sebagai inhibitor α-glukosidase. Unit akarvosin pada akarbosa masuk ke dalam katalitik domain dan menempati subsite gula -1 dan +1. Secara struktur, residu sisi aktif pada sisi ikatan gula -1 akan melengkapi ikatan antara tiga protein. Ikatan akarbosa dengan enzim α-glukosidase membentuk ikatan hidrogen terutama dengan cincin akarvosin. Cincin akarbosa menempati ikatan +1 melalui ikatan hidrogen dengan Asp587 dan Arg571.
Ion H+ pada gugus karboksil bertanggung jawab membentuk interaksi dengan sisi aktif enzim. Saqib dan Siddiqi (2008) menjelaskan dari 5784 komponen diketahui bahwa komponen gugus karboksil dan hidroksil bertanggung jawab pada
interaksi ikatan hidrogen dengan aseptor ikatan hidrogen pada enzim α-glukosidase. Ion H+ pada salah satu gugus karboksil berikatan dengan sisi aktif
Asp398, sedangkan ion H+ pada gugus karboksil lainnya berikatan dengan sisi aktif Arg571. Ion H+ pada gugus NH berikatan dengan sisi aktif Asp587 dan His 645. Ion H+ pada salah satu gugus hidroksil berikatan dengan sisi aktif Asp398 dan His 645.
Nilai IC50 inhibisi α-glukosidase EPS P. cruentum lebih rendah dibandingkan penelitian polisakarida lain (Tabel 7). Perbedaan ini disebabkan
teknik pemisahan dan komponen aktif yang berperan pada penghambatan
α-glukosidase. Cui et al. (2015) menyatakan Armeniaca sibirica L, Lam yang
dipisahkan menggunakan UF memiliki inhibisi α-glukosidase lebih kecil dibandingkan UF dan kromatografi.
Tabel 7 Inhibisi α-glukosidase polisakarida
Polisakarida Inhibisi α-glukosidase
Coriolus versicolor LHI EPS-F3-1 (3.4 kDa) IC50 = 2100 µg/mL
Aktivitas inhibisi α-glukosidase pada biomassa P. cruentum diduga mengandung komponen fenol. Inhibisi α-glukosidase pada biomassa besar diduga karena kadar garam dan abu yang tinggi (Tabel 5) sehingga memengaruhi kemurnian dari komponen aktif. Hal ini didukung penelitian Setyaningsih et al.
26
Gouda et al. (2015) melaporkan ekstrak biomassa Spirulina memiliki IC50 inhibisi
α-glukosidase sebesar 23 µg/mL. Kandungan fenol 121 mg GAE.g-1 dan flavonoid 27.4 mg GAE.g-1pada ekstrak biomassa Spirulina berkontribusi terhadap inhibisi
α-glukosidase.
Kadar abu merupakan campuran mineral yang terdapat pada bahan pangan. Kadar abu biomassa dan EPS diduga mengandung mineral air laut (Na, Mg, Ca, K, Zn, Fe, Cu, Cr, Mn, dan V). Mineral pada biomassa dan EPS diduga berperan pada
aktivitas inhibisi α-glukosidase. Arika et al. (2016) menyatakan bahwa ekstrak tanaman Croton macrostachyus, Azadiratchta indica, Lippia javanica, Ocimum lamifolium, Persea americana digunakan secara tradisional sebagai obat antidiabetes dan mengandung mineral Mg, Fe, K, Ca, Mn, Zn, Cr, Cu, dan V. Ha et al. (2013) menyatakan bahwa balance deep sea water (BDSW) mengandung Mg : Ca (3 : 1) konsentrasi 500-2000 ppm dapat menurunkan glukosa darah pada hari ke-20.
Mineral Mg, Fe, K, Ca, Mn, Zn, Cr, Cu, dan V memiliki manfaat dalam kesehatan dan berkaitan dengan metabolisme karbohidrat di dalam tubuh. Arika et al. (2016) menyatakan magnesium berperan penting dalam reaksi fosforilasi glukosa dan metabolismenya. Kekurangan magnesium menyebabkan resistensi insulin, intoleransi karbohidrat, dislipidemia, dan komplikasi diabetes. Mangan berfungsi sebagai kunci aktivator enzim metallo pada reaksi biokimia sel. Mangan aktif sebagai enzim antioksidan mangannase superoksida dismutase (MnSOD) untuk melindungi membran sel dan jaringan dari kerusakan dan degenerasi. Mangan terlibat dalam modulasi transport glukosa melewati membran sel Vanadium memengaruhi metabolisme karbohidrat antara lain transpor glukosa, glikolisis, oksidasi glukosa, dan sintesis glikogen. Vanadium dapat meningkatkan sensitifitas insulin. Zink berperan dalam seluruh aspek metabolisme insulin (sintesis, sekresi, dan pemanfaatannya). Zink berfungsi sebagai kofaktor enzim intraseluler yang terlibat pada metabolisme protein, lemak, dan glukosa. Zink merupakan kunci pengaturan produksi insulin oleh jaringan pankreas dan melindungi sel beta dari kerusakan. Kekurangan zink menyebabkan peningkatan kerusakan sel beta karena radikal bebas.
27
4 SIMPULAN DAN SARAN
Simpulan
Membran UF memengaruhi karakteristik permeat pada pemanenan dan pemisahan EPS. Viskositas dan salinitas permeat yang dipanen menggunakan UF 0.01 µm lebih rendah dibandingkan UF 0.05 µm. Membran UF memengaruhi kadar abu dan kadar garam EPS. Ukuran membran UF memengaruhi komposisi biomassa dan EPS serta aktivitas inhibisi α-glukosidase.
Saran
28
DAFTAR PUSTAKA
Abdirahman YA, Juma KK, Mukundi MJ, Gitahi SM, Agyirifo DS, Ngugi MP, Gathumbi PK, Ngeranwa JJN, Njagi ENM. 2015. In vivo antidiabetic activity and safety of the aqueous stem bark extract of Kleinia squarrosa. J Diabetes Metab. 6 (9) : 601-611.
Ahmad AL, Yasin NHM, Derek CJC, Lim JK. 2014. Comparison of harvesting methods for microalgae Chlorella sp. and its potential use as a biodiesel feedstock. Environ Technol. 35 (17) : 2244-2253.
[APHA] American Public Health Association. 2012. Standard methods for the examination of water and wastewater. Maryland (US) : APHA.
Arika WM, Ogola PE, Nyamai DW, Mawia AM, Wambua FK, Kiboi NG, Wambani JR, Njagi SM, Rachuonyo HO, Emmah KO, Lagat RC, Muruthi CW, Abdirahman YA, Agyirifo DS, Ouko RO, Ngugi MP, Njagi ENM. 2016. Mineral elements content of selected Kenyan antidiabetic medicinal plants. Adv Tech Biol Med. 4 (1) : 1-5.
Arnelli, Yoga MSH, Astuti Y. 2006. Pengaktifan kapas sebagai resin penukar kation asam lemah. JSM. 14 (4) : 165-167.
Baker RW. 2012. Membrane Technology and Applications. London (GB). J Wiley. 583 hlm.
Baky HA, Hanaa El Baz KF, El Latife SA. 2013. Induction of sulfated polysaccharides in Spirulina platensis as response to nitrogen concentration and its biological evaluation. J Aquac Res Development. 5 : 1-8.
Bardi U. 2010. Extracting mineral from seawater : an energy analysis.
Sustainability. 2 : 980-992.
Benhura MAN, Chidewe C. 2011. Characterization of the polysaccharide material that is isolated from the fruit of Cordia abyssinica. Afr J Biochem Res. 5(3) : 95-101.
Benjama O, Masniyom P. 2011. Nutritional composition and physicochemical properties of two green seaweeds (Ulva pertusa and Ulva intestinalis) from the Pattani Bay in Southern Thailand. Songklanakarin J Sci Technol. 33 (5) : 575-583.
Bhatnagar M, Pareek S, Bhatnagar A, Ganguly J. 2014. Rheology and characterization of a low viscosity emulsifying exopolymer from desert borne Nostoc calcicola. Indian J Biotechnol. 13 : 241-246.
Bilad MR, Vandamme D, Foubert I, Muylaert K, Vankelecom FJ. 2012. Harvesting microalgal biomass using submerged microfiltration membranes. Bioresour Technol. 111 : 343-352.
[BSN] Badan Standarisasi Nasional. 1991. SNI 01-2359-1991 Kadar Garam. Jakarta (ID) : BSN.
[BSN] Badan Standarisasi Nasional. 1992. SNI 01-2891-1992 Kadar Air. Jakarta (ID) : BSN.
Chaiklahan R, Chirasuwan N, Triratana P, Tia S, Bunnag B. 2014. Effect of extraction temperature on the diffusion coefficient of polysaccharide from
Spirulina and the optimal separation method. Biotechnol Bioprocess Eng.
29
Cui J, Gu X, Wang F, Ouyang J, Wang J. 2015. Purification and structural
characterization of an α-glucosidase inhibitory polysaccharide from apricot
(Armeniaca sibirica L. Lam.) pulp. Carbohyd Polym. 121 : 309-314.
Dassey AJ, Theegala CS. 2013. Harvesting economics and strategies using centrifugation for cost effective separation of microalgae cells for biodiesel applications. Bioresour Technol. 128 : 241-245.
Deng YT, Shiau SYL, Syur LF, Lin JK. 2015. Puerh-tea polysaccharides decrease blood sugar by inhibition α-glucosidase activity in vitro and in mice. Food Funct. 6 : 1539-1546.
Elfeel AA, Bakhashwain AA. 2012. Salinity effects on growth attributes mineral uptakes, forage quality and tannin contents of Acacia saligna (Labill) H Wendi. Res J Environ Earth Sci. 4 (11) : 990-995.
Emega TH, Rabetafika N, Blecker CS, Paquot M. 2012. Kinetics of the hydrolysis of polysaccharide galacturonic acid and neutral sugars chains from flaxseed mucilage. Biotechnol Agron Soc Environ. 16 (2) : 139-147.
Fuentes MMR, Fernandez GGA, Pearez JAZ, Guerrero JLG. 2000. Biomass nutrient profiles of the microalga Porphyridium cruentum. Food Chem. 70 : 345-353.
Geresh S, Arad S, Ontman OL, Zhang W. 2009. Isolation and characterization of poly and oligosaccharides from the red microalga Porphyridium sp.
Carbohyd Res. 344 : 343-349.
Ginzberg A, Korin E, Arad S. 2008. Effect of drying on the biological activities of a red microalgal polysaccharides. Biotechnol Bioeng. 99 (2) : 411-420. Goiris K, Muylaert K, Fraeye I, Foubert I, Brabanter JD, Cooman LD. 2012.
Antioxidant potential of microalgae in relation to their phenolic and carotenoid content. J Appl Phycology. 24 : 1477-1486.
Gouda KGM, Kavitha MD, Sarada R. 2015. Antihyperglycemic, antioxidant and antimicrobial activities of butanol extract from Spirulina platensis. J Food Biochem. 39 (5) : 594-602.
Ha BG, Shin EJ, Park JE, Shon YH. 2013. Anti diabetic effect of balanced deep sea water and its mode of action in high fat diet induced diabetic mice. Mar Drugs. 11 (11) : 4193-4212
Hu J, Pang W, Chen J, Bai S, Zheng Z, Wu X. 2013. Hypoglycemic effect of polysaccharides with different molecular weight of Pseudostellaria heterophylla. BMC Complemen Altern Med. 13 : 1-9.
Huang C, Chen X, Liu T, Yang Z, Xiao Y, Zeng G, Sun X. 2012. Harvesting of
Chlorella sp. using hollow fiber ultrafiltration. Environ Sci Pollutan Res.
19 (5) : 1416-1421.
Ika, Tahril, Said I. 2012. Analisis logam timbal (Pb) dan besi (Fe) dalam air laut di wilayah pesisir pelabuhan Ferry Taipa Kecamatan Palu Utara. J Akademika Kimia.1(4) : 181-186.
Ikena Y, Murakami A, Ohigashi H, 2008. Ursolic acid : An anti- and pro- inflammatory triterpenoid. Mol Nutr Food Res. 52 : 26-42.
Izadpanah AA, Javidan A. 2012. The ability of a nanofiltration membrane to remove hardness and ions from diluted seawater. Water. 4 : 283-294. Jang SS, Shirai Y, Uchida M, Wakisaka M. 2012. Production of mono sugar from