AKTIVITAS ANTIHIPERGLIKEMIK DARI BIOMASSA DAN
POLISAKARIDA EKSTRASELULER Porphyridium cruentum
SEBAGAI INHIBITOR α
-GLUKOSIDASE
DWI ABDIA RAHMAN
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
DWI ABDIA RAHMAN. C34060103. Aktivitas Antihiperglikemik dari Biomassa dan Polisakarida Ekstraseluler Porphyridium cruentum sebagai
Inhibitor α-Glukosidase. Dibimbing oleh IRIANI SETYANINGSIH dan ELLA SALAMAH.
Diabetes mellitus merupakan penyakit yang tidak dapat disembuhkan, tetapi dapat dikontrol dengan upaya perencanaan diet, mempertahankan bobot badan normal dan melakukan cukup olah raga. Obat hanya diberikan jika setelah melakukan berbagai upaya tersebut secara maksimal tidak berhasil mengendalikan kadar glukosa darah. Salah satu jenis obat antidiabetik oral adalah golongan
inhibitor α-glukosidase. Porphyridium cruentum merupakan mikroalga merah penghasil polisakarida ekstraseluler yang diduga mempunyai aktivitas inhibitor
α-glukosidase yang menghambat pemecahan karbohidrat menjadi glukosa.
Tujuan penelitian ini untuk mendapatkan kurva pertumbuhan
Porphyridium cruentum, mendapatkan dan mengukur polisakarida ekstraseluler dan biomassa kering dari Porphyridium cruentum, dan menganalisis aktivitas antihiperglikemik pada polisakarida ekstraseluler dan biomassa kering dari
Porphyridium cruentum
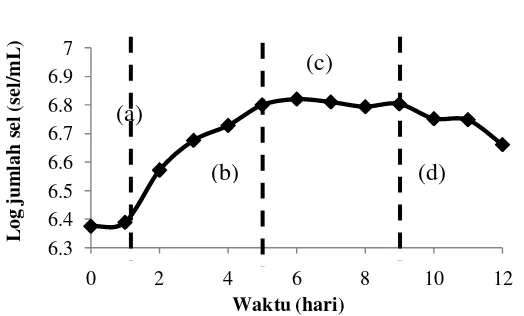
Fase pertumbuhan pada kultur Porphyridium cruentum meliputi fase lag, fase log, fase stasioner dan fase kematian. Fase lag terjadi sampai hari pertama, fase log terjadi pada umur 1 sampai 5 hari, fase stasioner pada umur 5 sampai 9 hari, dan setelah hari ke-9 telah memasuki masa kematian. Pemanenan dilakukan pada umur 12 hari dengan jumlah polisakarida ekstraseluler 0,215 gram/10 ml.
AKTIVITAS ANTIHIPERGLIKEMIK DARI BIOMASSA DAN
POLISAKARIDA EKSTRASELULER Porphyridium cruentum
SEBAGAI INHIBITOR α
-GLUKOSIDASE
DWI ABDIA RAHMAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
sebagaiInhibitor α-Glukosidase
Nama : Dwi Abdia Rahman
NIM : C34060103
Menyetujui
Pembimbing I, Pembimbing II,
(Dr. Ir. Iriani Setyaningsih, MS) (Dra. Ella Salamah, M.Si) NIP : 19600925 198601 2 001 NIP : 19530629 198803 2 001
Mengetahui :
Ketua Departemen Teknologi Hasil Perairan
(Dr. Ir. Ruddy Suwandi, MS, M.Phil) NIP : 19580511 198503 1 002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini menyatakan bahwa skripsi dengan judul “Aktivitas
Antihiperglikemik dari Biomassa dan Polisakarida Ekstraseluler Porphyridium cruentum sebagai Inhibitor α-Glukosidase” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun di Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2011
Dwi Abdia Rahman
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan
hidayah-Nya yang senantiasa diberikan kepada penulis sehingga penulis dapat
menyelesaikan skripsi dengan judul “AktivitasAntihiperglikemik dari Biomassa
dan Polisakarida Ekstraseluler Porphyridium cruentum sebagai Inhibitor
α-Glukosidase”.
Penulisan skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karena
itu, melalui kesempatan ini penulis ingin menyampaikan terima kasih kepada :
1. Dr. Ir. Iriani Setyaningsih, M.Si dan Dra. Ella Salamah, M.Si selaku dosen
pembimbing, atas segala bimbingan dan pengarahan yang diberikan
kepada penulis.
2. Dr. Tati Nurhayati, S. Pi, M.Si selaku dosen penguji, atas saran dan arahan
yang diberikan kepada penulis.
3. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen Teknologi
Hasil Perairan dan Dr. Ir. Agoes Mardiono Jacoeb Dipl.Biol selaku Ketua
Program Studi Teknologi Hasil Perairan
4. Keluarga terutama papa dan mama, yang telah memberikan semangat dan
kasih sayang kepada penulis.
5. Tim mikroalga Budi Atrika Candra, Ely Ermayanti, Hasanah, Nur Madina.
6. Ibu Emma, Mbak Lastri, Mbak Silvi, Mas Ipul, Bu Nunuk dan Pak Wahyu
yang telah banyak membantu penulis dalam melakukan penelitian.
7. Teman-teman THP 43 yang telah banyak membantu penulis baik moril
maupun material serta pihak lain yang telah banyak membantu dalam
penyelesaian skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi
ini. Oleh karena itu, kritik dan saran yang dapat membangun dalam
penyempurnaan skripsi ini sangat diharapkan. Semoga tulisan ini bermanfaat bagi
pihak-pihak yang memerlukan.
Bogor, Januari 2011
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Kota Jakarta, pada tanggal
18 Desember 1988. Penulis adalah anak kedua dari dua
bersaudara pasangan Bapak Maridjo dan Ibu Supatmi. Penulis
memulai pendidikan formal di SD Negeri 1 Gunungan dan
lulus pada tahun 2000. Penulis melanjutkan Sekolah
Menengah Pertama Negeri 1 Manyaran dan lulus pada tahun
2003. Kemudian, penulis melanjutkan Sekolah Menengah Atas Negeri 1
Wonogiri dan lulus pada tahun 2006.
Pada tahun 2006 penulis lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk Institut Pertanian Bogor (USMI). Penulis memilih Departemen
Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut
Pertanian Bogor. Selama menjalani pendidikan akademik di Institut Pertanian
Bogor penulis pernah mengikuti organisasi Lembaga Dakwah Kampus (LDK)
Al-Hurriyyah dan Dewan Perwakilan Mahasiswa Tingkat Persiapan Bersama
(DPM TPB) pada tahun 2006 serta HIMASILKAN pada tahun 2007 sampai 2009.
Penulis juga pernah mengikuti pelatihan Broadcasting Angkatan 17 yang
diselenggarakan oleh AGRI FM pada tahun 2009 dan lulus sebagai penyiar serta
Divisi Program. Penulis juga aktif sebagai asisten praktikum m.k. Oseanografi
Umum tahun ajaran 2009-2010 dan m.k. Mikrobiologi Hasil Perairan tahun ajaran
2010-2011. Selain itu penulis juga aktif dalam kepanitiaan berbagai kegiatan
mahasiswa di Institut Pertanian Bogor. Selama masa studinya, penulis juga
mendapatkan beasiswa POM, PPA dan Yayasan Goodwill Internasional
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dan
penyusunan skripsi dengan judul “Aktivitas Antihiperglikemik dari Biomassa dan
Polisakarida Ekstraseluler Porphyridium cruentum sebagai Inhibitor
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
1 PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Porphyridium cruentum ………... ... 3
2.2 Faktor Lingkungan yang Mempengaruhi Pertumbuhan Mikroalga... ... 4
2.3 Pertumbuhan Mikroalga………… ... 6
2.4 Polisakarida ... 7
2.5 Diabetes Mellitus (DM)... 9
2.6 Pengobatan Diabetes Mellitus (DM) ... 10
2.7 Komponen Bioaktif ... 12
2.8 Inhibisi α- Glukosidase ... 15
3 METODE... 17
3.1 Waktu dan Tempat ... 17
3.2 Alat dan Bahan ... 17
3.3 Metode Penelitian ... 17
3.3.1 Penelitian pendahuluan ... 18
3.3.2 Penelitian utama ... 21
4 HASIL DAN PEMBAHASAN ... 26
4.1 Kultivasi Porphyridiun cruentum ... 26
4.2 Kurva Pertumbuhan Porphyridiun cruentum ... 27
4.3 Produksi dan Pengendapan Polisakarida ... 29
4.5 Komponen Aktif ... 37
4.6 Aktivitas Inhibisi α-Glukosidase ... 39
5 KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
Halaman
1 Sistem reaksi enzim untuk satu sampel dengan volume total 2 ml ... 24
2 Kondisi umum kultivasi Porphyridium cruentum ... 26
3 Komposisi biokimia biomassa Porphyridium cruentum ... 32
4 Hasil uji fitokimia ... 37
DAFTAR GAMBAR
Halaman
1 Porphyridium cruentum ... 3
2 Pola pertumbuhan sel alga (Fogg 1975) ... 7
3 Polisakarida Porphyridium cruentum... 8
4 Struktur kimia acarbose ... 12
5 Persamaan reaksi enzimatik α-glukosidase dan p-nitrofenil-α -D-glukopiranosa (Sugiwati 2005) ... 16
6 Diagram alir metode penelitian ... 18
7 Penampang hemasitometer ... 20
8 Kultur mikroalga Porphyridium cruentum ... 26
9 Kurva pertumbuhan mikroalga Porphyridium cruentum ... 28
10 Kurva polisakarida harian ... 30
11 Pengendapan polisakarida ... 30
12 Produk dari Porphyridium cruentum ... 32
Halaman
1 Medium kultivasi untuk mikroalga Porphyridium cruentum ... 49
1 PENDAHULUAN
1.1Latar Belakang
Diabetes mellitus (DM) merupakan suatu kelainan metabolik kronis serius
yang memiliki dampak signifikan terhadap kesehatan seseorang atau suatu kondisi
konsentrasi glukosa dalam darah secara kronis lebih tinggi daripada nilai normal
(hiperglikemia) akibat tubuh kekurangan insulin atau fungsi insulin tidak efektif
(Subroto 2006). Sekitar 171 juta jiwa penduduk dunia menderita diabetes. Angka
kematian penduduk dunia akibat diabetes sekitas 3,2 juta jiwa per tahun berarti
6 orang meninggal tiap menit. Jumlah penderita diabetes di Indonesia menduduki
peringkat ke-4 dunia setelah China, India, dan Amerika Serikat (WHO 2010).
Diabetes mellitus merupakan penyakit yang tidak dapat disembuhkan,
tetapi dapat dikontrol dengan melakukan upaya-upaya, seperti perencanaan diet,
mempertahankan bobot badan normal, dan melakukan cukup olah raga. Obat
hanya perlu diberikan, bila setelah melakukan berbagai upaya tersebut secara
maksimal tidak berhasil mengendalikan kadar glukosa darah (Sugiwati 2005).
Obat antihiperglikemik terdiri dari dua macam, yaitu berupa suntikan insulin dan
obat antidiabetik oral meliputi golongan sulfonilurea, biguanid, thiazolidinedion,
miglitinida dan inhibitor α-glukosidase (Subroto 2006).
Senyawa inhibitor α-glukosidase bekerja menghambat enzim
α-glukosidase yang terletak pada dinding usus halus. Enzim-enzim α-glukosidase (maltase, isomaltase, glukomaltase dan sukrase) berfungsi untuk menghidrolisis
oligosakarida pada dinding usus halus. Inhibisi kerja enzim ini secara efektif dapat
mengurangi pencernaan karbohidrat kompleks dan absorbsinya, sehingga dapat
mengurangi peningkatan kadar glukosa postprandial pada pasien diabetes.
Senyawa inhibitor α-glukosidase juga menghambat enzim α-amilase pankreas
yang bekerja menghidrolisis polisakarida di dalam lumen usus halus (Info Obat
Indonesia 2009).
Beberapa penelitian telah menunjukkan adanya aktivitas hipoglikemik
pada polisakarida berupa alginat, xanthan, dan polisakarida yang berasal dari
mikroba (Giavasis dan Biliaderis 2006). Porphyridium cruentum merupakan
oleh sel melalui badan golgi ke dalam media kultur. Polisakarida ekstraseluler
yang dihasilkan terdiri dari D-xylose, D-glucose, D-galactose, L-galactose,
3-O-methylxylose, 3-O-metylgalactose, dan D-glucuronic acid
(Percival dan Foyle 1979).
Selain sebagai penghasil polisakarida ekstraseluler dalam jumlah besar,
Porphyridium cruentum juga menghasilkan asam lemak jenis arakidonat.
Arakidonat merupakan asam lemak tak jenuh yang memiliki atom karbon 20
dengan 4 ikatan rangkap, sehingga biomassa berpotensi sebagai pangan
fungsional. Penelitian tentang antihiperglikemik dari polisakarida ekstraseluler
dan komposisi biokimia biomassa Porphyridium cruenttum belum banyak
dilakukan. Hal inilah yang mendorong dilakukannya penelitian aktivitas
antihiperglikemik polisakarida dan biomassa dari Porphyridium cruentum.
1.2Tujuan
Tujuan penelitian ini untuk :
1 Mendapatkan kurva pertumbuhan Porphyridium cruentum.
2 Mendapatkan dan mengukur polisakarida ekstraseluler dan biomassa
kering dari Porphyridium cruentum.
3 Menganalisis aktivitas antihiperglikemik pada polisakarida ekstraseluler
2 TINJAUAN PUSTAKA
2.1Porphyridium cruentum
Porphyridium cruentum adalah mikroalga merah bersel satu yang
termasuk divisi Rhodophyta, hidup bebas atau berkoloni yang terikat dalam
mucilago. Senyawa mucilago dieksresikan secara konstan oleh sel membentuk
sebuah kapsul yang mengelilingi sel. Mucilago merupakan polisakarida sulfat
yang bersifat larut dalam air (Vonshak 1988).
Klasifikasi Porphyridium cruentum (Vonshak 1988) adalah sebagai
berikut :
Divisi : Rhodophyta
Sub Kelas : Bangiophycidae
Ordo : Porphyridiales
Famili : Porphyridiaceae
Genus : Porphyridium
Gambar 1 Porphyridium cruentum (Department of Enviromental Science 2008)
Sel Porphyridium cruentum berbentuk bulat dengan diameter 4-9 μm.
Struktur selnya terdiri dari sebuah nukleus (inti), kloroplas, badan golgi,
mitokondria, lendir, pati dan vesikel (Lee 2008). Porphyridium cruentum tidak
memiliki dinding sel. Setiap sel memiliki kloroplas dengan pirenoid di tengahnya.
Permukaan membran tilakoid pada kloroplas diselimuti oleh phycobilisome
Porphyridium dapat hidup di berbagai habitat alam seperti air laut, air
tawar, maupun pada permukaan tanah yang lembab dan membentuk lapisan
kemerah-merahan yang sangatmenarik. Habitat asli dari Porphyridium cruentum
diduga berasal dari laut karena dapat hidup dengan baik pada media cair maupun
media padat air laut (Vonshak 1988).
Porphyridium cruentum dibungkus oleh polisakarida yang merupakan
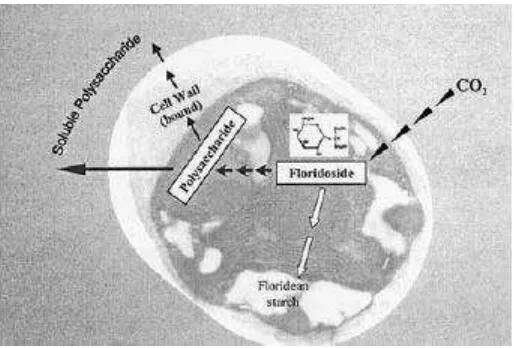
heteropolimer asam yang dibentuk oleh gula sulfat. Polisakaridanya membentuk
jembatan ion melalui dua ikatan kation dan memiliki bobot molekul yang tinggi.
Ketebalan polisakarida bervariasi tergantung pada fase pertumbuhan dan kondisi
pertumbuhan. Sebagian polisakarida diekskresikan ke dalam medium
pertumbuhan, sehingga viskositasnya semakin tinggi (Arad et al. 1985).
Biomasa sel Porphyridium cruentum mengandung kadar air 1,25-8,83%,
kadar abu 16,8-23,6%, karbohidrat 22,8-39,3%, protein 27,7-40,8%, dan total
lemak 5,78-7,55% (Fuentes et al. 2000). Produk komersial dari Porphyridium
diantaranya adalah asam arakidonat, polisakarida, dan fikoeritrin. Biomassa
kering sel Porphyridium cruentum mengandung 2% asam arakidonat, 35%
polisakarida, dan 8% fikoeritrin (Vonshak 1988).
2.2Faktor Lingkungan yang Mempengaruhi Pertumbuhan Porphyridium cruentum
Pertumbuhan mikroalga dipengaruhi oleh faktor instrinsik dan ekstrinsik.
Faktor instrinsik merupakan faktor yang berkaitan dengan metabolisme tubuh
mikroalga, dalam hal ini adalah Porphyridium cruentum, sedangkan faktor
ekstrinsik merupakan faktor yang berkaitan dengan lingkungan di mana
Porphyridium cruentum tersebut tumbuh. Faktor lingkungan yang mempengaruhi
pertumbuhan mikroalga Porphyridium cruentum diantaranya adalah suhu, cahaya,
salinitas dan pH, serta nutrisi.
(1) Suhu
Sel Porphyridium cruentum dapat tumbuh pada kisaran suhu 10-35 oC.
Aktivitas optimum fotosintesis pada kultur Porphyridium cruentum terjadi pada
suhu 25 oC (Vonshak 1988). Suhu optimum untuk pertumbuhan Porphyridium
cruentum adalah 21-26 oC dan pada suhu di bawah 13 oC dan di atas 31 oC
5
(2) Cahaya
Pertumbuhan Porphyridium cruentum tergantung pada intensitas cahaya
meskipun Porphyridium cruentum memiliki toleransi yang cukup tinggi terhadap
intensitas cahaya. Kultur yang ditumbuhkan di bawah cahaya secara kontinyu
akan tumbuh dengan cepat. Arad dan Richmond (2004) melaporkan bahwa faktor
lingkungan yang penting untuk kultur mikroalga adalah cahaya yang merupakan
faktor utama pada fotosintesis.
Pertumbuhan mikroalga akan meningkat lebih dari 400% bila intensitas
cahaya diubah dari 538 lux menjadi 4300 lux. Pertumbuhan ini juga diikuti
dengan peningkatan volume sel dan granula sitoplasma. Kandungan pigmen dan
ukuran kloroplast menurun sejalan dengan meningkatnya intensitas cahaya
(Vonshak 1988). Menurut penelitian Sung et al. (2009), total lemak (bb)
Porphyridium cruentum pada siklus terang-gelap (12:12) lebih tinggi
dibandingkan pada siklus terang–gelap (18:6) dan (6:18), dengan nilai total lemak
berturut-turut adalah 19,3%, 18,3% dan 14,4%.
(3) Salinitas dan pH
Porphyridium cruentum dapat bertahan hidup pada kisaran salinitas yang
cukup lebar, yaitu 0,5-2 kali konsentrasi air laut (Vonshak 1988). Porphyridium
cruentum tidak mampu bersaing hidup dengan mikroalga lainnya pada kondisi
salinitas kurang dari 3,5% jika ditumbuhkan pada kultur terbuka. Salinitas sebesar
4,6% tidak menghambat proses pertumbuhan. Meskipun demikian salinitas
dengan kisaran 3,5-4,5% dapat memacu pertumbuhan yang optimal
(Arad dan Richmond 2004).
Porphyridium cruentum juga toleran terhadap perubahan pH pada kisaran
antara 5,2-8,3. Aktivitas fotosintesis menurun hingga maksimum 33% ketika pH
turun mencapai 5 dan pH optimum fotosintesis Porphyridium cruentum adalah 7,5
(Colman dan Gehl 1983 diacu dalam Vonshak 1988)
(4) Nutrisi
Porphyridium cruentum dapat menggunakan KNO3 dan ammonium
sebagai sumber nitrogen. Pertumbuhan dapat juga dihasilkan dengan
menggunakan urea sebagai sumber nitrogen pada medium air laut
medium akan menghambat fotosintesis, namun terbatasnya jumlah nitrogen ini
akan berdampak pada meningkatnya ekskresi polisakarida ke dalam medium.
Porphyridium cruentum menggunakan CO2 sebagai sumber karbon.
Pertumbuhan menjadi lebih cepat pada kultur yang diberi cahaya dan aerasi
dengan udara yang mengandung CO2 (Vonshak 1988). Sumber sulfur diperoleh
dari MgSO4, Na2SO3, atau Na2S2O3 dengan konsentrasi antara 5,4-27,0 mM akan
menghasilkan pertumbuhan alga yang baik (Vonshak 1988).
2.3 Pertumbuhan Mikroalga
Pertumbuhan mikroalga pada kultur dapat ditandai dengan bertambah
besarnya ukuran sel atau bertambahnya jumlah sel. Perkembangan sel dalam
kultur mikroalga terdiri atas lima fase, yaitu fase lag (adaptasi), fase eksponensial
(logaritmik), fase penurunan laju pertumbuhan (deklinasi), fase stasioner dan fase
kematian (Fogg 1975).
Fase lag merupakan fase pertama dalam pertumbuhan mikroalga dan
mengalami penurunan tingkat metabolisme karena fase inokulum yang tidak
merata dan terjadi proses adaptasi terhadap media kultur. Fase kedua adalah fase
eksponensial di mana percepatan pertumbuhan dan perbandingan konsentrasi
komponen biokimia menjadi konstan (Fogg 1975).
Fase ketiga merupakan fase penurunan laju pertumbuhan yang disebabkan
populasi sel terus bertambah namun tidak ada penambahan nutrien sedangkan
pemanfaatan nutrien oleh mikroalga terus berlanjut, sehingga terjadi persaingan
antar sel untuk mendapatkan nutrien yang semakin berkurang. Intensitas cahaya
yang diterima sel semakin berkurang akibat jumlah sel yang semakin tinggi
sehingga terjadi pembentukan bayangan dari sel itu sendiri juga dapat
menyebabkan penurunan laju pertumbuhan (Fogg 1975).
Kurva pertumbuhan mulai berubah karakter dari eksponensial menjadi linier
pada saat faktor-faktor pertumbuhan mulai habis. Fase ini disebut fase stasioner.
Peningkatan ukuran populasi tidak terjadi, jumlah sel terlihat cenderung konstan,
karena laju pertumbuhan seimbang dengan laju kematian pada fase stasioner.
Pertumbuhan mikroalga yang dikultur mencapai tingkat maksimal pada fase
7
penurunan produksi biomassa karena kematian sel. Karakteristik pertumbuhan sel
alga dalam kultur disajikan pada Gambar 2.
eksponensial, (3) fase deklinasi, (4) fase stasioner,
(5) fase kematian) (Fogg 1975)
2.4Polisakarida
Polisakarida adalah polimer dari beberapa monosakarida yang berikatan
satu sama lain. Polisakarida dapat dibagi menjadi dua kelompok, yaitu kelompok
homopolisakarida dan heteropolisakarida. Homopolisakarida adalah polisakarida
yang tersusun dari satu jenis monosakarida. Homopolisakarida terbanyak di alam
adalah pati, glikogen, selulosa dan kitin, sedangkan heteropolisakarida adalah
polisakarida yang terdiri dari dua atau lebih monosakarida. Heteropolisakarida
terdiri dari dua jenis, yaitu glikosaminoglikan dan murein (Roswiem 2006).
Polisakarida telah digunakan sebagai pengental, flokulan, dan minyak
pelumas. Beberapa polisakarida dari alga menunjukkan potensi untuk dijadikan
antikanker. Porphyridium cruentum merupakan salah satu penghasil polisakarida
ekstraseluler dalam jumlah besar. Polisakarida ekstraseluler yang dihasilkan
terdiri dari D-xylose, D-glucose, D-galactose, L-galactose, 3-O-methylxylose,
3-O-metylgalactose, dan D-glucuronic acid (Percival dan Foyle 1979).
Sel-sel mikroalga merah dibungkus oleh polisakarida sulfat dalam bentuk
gel. Selama pertumbuhan dalam media cair, viskositas medium meningkat karena
pengeluaran polisakarida dari permukaan sel ke dalam media (polisakarida larut
air). Kapsul polisakarida paling tipis selama fase pertumbuhan dan tebal selama
Jumlah sel (sel/ml)
fase stasioner (Ramus, 1972, 1986 diacu dalam Arad dan Richmond 2004). Letak
polisakarida pada Porphyridium cruentum dapat dilihat pada Gambar 3.
Gambar 3 Polisakarida Porphyridium cruentum
(Arad dan Richmond 2004)
Fungsi biologi dari polisakarida pada Porphyridium cruentum, yaitu
melindungi sel, pertukaran atau penampungan ion, membentuk penghalang yang
sulit ditembus oleh gas dan air, serta sebagai tempat vitamin dan hormon.
Polisakarida dari Porphyridium cruentum juga berfungsi untuk membentuk
thallus pseudoparenkim yang dilakukan bersama-sama dengan sel
(Vonshak 1988).
Polisakarida terdiri atas 7-10% rantai sulfat ester dan dihubungkan oleh
5-7% protein. Bobot molekul rata-rata polisakarida Porphyridium cruentum
adalah 4x106. Viskositas polisakarida Porphyridium cruentum cukup tinggi
dibandingkan dengan xanthan gum komersial. Produksi rata-rata tiap hari
polisakarida Porphyridium cruentum sekitar 55 sampai 75 mg (berat kering)
per liter (Borowitzka 1988).
Kultur Porphyridium cruentum dapat mencapai densitas sel yang tinggi
pada waktu yang relatif singkat dan mengeluarkan polisakarida ke medium dalam
jumlah besar. Polisakarida berbentuk kapsul yang mengelilingi sel dengan
kekentalan yang bervariasi tergantung dengan fase pertumbuhan. Polisakarida
yang paling kental terjadi pada fase stasioner, yaitu jumlah sistesis polisakarida
lebih besar dibandingkan dengan jumlah yang dikeluarkan ke dalam medium.
9
polisakarida ke medium. Polisakarida disintesis dan disekresikan oleh badan
golgi. Kondisi lingkungan yang berbeda berpengaruh terhadap jumlah produksi
polisakarida. Produksi polisakarida tertinggi ketika jumlah sumber nitrogen
terbatas. Polisakarida dapat diisolasi melalui presipitasi menggunakan
cetylpiridinium chloride, diikuti dengan konversi menjadi kalsium dan
dipresipitasi kembali dengan etanol. Prosedur ini akan menghasilkan polisakarida
murni dan menjaga viskositas terhadap perubahan pH dan suhu (Vonshak 1988).
Prosedur isolasi polisakarida dari mikroorganisme tergantung pada letak
biopolimer terikat pada dinding sel atau diekskresikan oleh sel sebagai pelindung
atau pengotor. Isolasi dapat dilakukan dengan ekstraksi dari biomassa sel. Namun,
akhir-akhir ini isolasi polisakarida dilakukan dengan sentrifugasi maupun filtrasi
untuk memisahkan produk dari sel (Giavasis dan Biliaderis 2006).
Viskositas polisakarida Porphyridium sp.dalam larutan terkonsentrasi
(1-2 g/L), stabil pada berbagai nilai pH (2-9), suhu (30-120 oC) dan air garam.
Ketergantungan dari viskositas intrinsik pada kekuatan ionik, diperkirakan bahwa
kekakuan dari rantai polisakarida Porphyridium sp. berada dalam kisaran yang
sama seperti yang dari getah xanthan dan DNA (Eteshola et al. 1996 diacu dalam
Arad dan Richmond 2004).
2.5Diabetes Mellitus (DM)
Diabetes mellitus (DM) merupakan suatu kelainan metabolik kronis serius
yang memiliki dampak signifikan terhadap kesehatan seseorang atau suatu kondisi
konsentrasi glukosa dalam darah secara kronis lebih tinggi daripada nilai normal
(hiperglikemia) akibat tubuh kekurangan insulin atau fungsi insulin tidak efektif.
Diabetes mellitus merupakan penyakit degeneratif, yaitu penyakit akibat fungsi
atau struktur dari jaringan atau organ tubuh secara progresif menurun karena usia
ataupun gaya hidup (Subroto 2006).
Klasifikasi Diabetes mellitus (Subroto 2006) adalah sebagai berikut :
a. Diabetes mellitus Tipe I (Diabetes Mellitus tergantung Insulin)
Tipe ini disebabkan oleh kerusakan sel beta pankreas sehingga kekurangan
insulin absolut. Faktor keturunan juga merupakan salah satu penyebab. Penderita
mengonsumsi obat antidiabetika oral. Penderita Diabetes mellitus Tipe I tidak
dapat disembuhkan dan tergantung pada injeksi insulin selama hidupnya.
b. Diabetes mellitus Tipe II (Diabetes Mellitus tidak tergantung Insulin)
Tipe ini disebabkan oleh gangguan sekresi insulin yang progresif karena
resistensi insulin. Diabetes mellitus Tipe II dipicu oleh pola hidup yang kurang
sehat. Rata-rata penderita berumur lebih dari 40 tahun. Proses penuaan juga
menjadi penyebab akibat penyusutan sel-sel beta yang progresif sehingga sekresi
insulin semakin berkurang dan kepekaan reseptornya juga menurun. Diabetes
mellitus Tipe II dapat dikontrol dengan mengubah pola hidup, terutama dengan
mengatur pola makan yang baik dan seimbang, berolah raga dengan teratur, tidak
merokok, dan menghindari konsumsi minuman beralkohol.
c. Diabetes Mellitus Kehamilan
Diabetes tipe ini hanya diderita oleh wanita selama kehamilannya dan
umumnya akan kembali normal sesudah hamil. Walaupun demikian, beberapa
kasus yang tidak terkontrol dapat berkembang lebih lanjut pasca-kelahiran.
Penanganan yang kurang baik terhadap penderita akan berakibat buruk pada janin
seperti kelainan bawaan, gangguan pernapasan pada bayi bahkan kematian janin.
d. Diabetes mellitus tipe lain
Diabetes tipe ini disebabkan oleh keadaan atau sindrom tertentu seperti
pernyakit pankreas, penyakit hormonal, keadaan yang disebabkan oleh obat atau
zat kimia, gangguan reseptor insulin, dan sindrom genetik tertentu.
2.6Pengobatan Diabetes Mellitus (DM)
Diabetes mellitus merupakan penyakit yang tidak dapat disembuhkan,
tetapi dapat dikontrol. Untuk mengendalikan penyakit DM, perlu dilakukan
pengaturan pola konsumsi makanan, olahraga, pengontrolan berat badan, dan
penggunaan obat hipoglikemik. Ada dua macam obat hipoglikemik, yaitu berupa
suntikan dan berupa tablet yang disebut hipoglikemik oral. Antiglikemik oral
dapat dibagi dalam 5 golongan (Subroto 2006), yaitu :
a. Golongan sulfonilurea
Derivat sulfonilurea bekerja dengan cara merangsang sel beta pulau
11
golongan sulfonilurea yaitu Tolbutamide, Chlorpropamide, Tolazamide,
Acetohexamide, Glibenklamide, Glipizide, dan Glibonuride.
b. Golongan biguanid
Derivat biguanid mempunyai mekanisme kerja yang berlainan dengan
derivat sulfonylurea. Obat golongan ini bekerja dengan mengurangi resistensi
insulin, sehingga glukosa dapat memasuki sel-sel hati, otot dan organ tubuh
lainnya. Obat-obat yang termasuk golongan biguanid adalah metformin,
phenformin, dan buformin.
c. Golongan thiazolidinedion
Derivat thiazolidinedion bekerja dengan cara yang sama dengan derivat
biguanid, yaitu dengan mengurangi resistensi insulin, sehingga glukosa dapat
memasuki sel-sel hati, otot dan organ tubuh lainnya,. Obat yag tergolong
thiazolidinedion adalah Troglitazone.
d. Golongan miglitinida
Obat ini bekerja dengan cara mencetuskan pelepasan insulin dari pankreas
segera setelah makan. Obat golongan ini adalah replaginida. Efek samping dari
obat ini yaitu hipoglikemia dan peningkatan berat badan.
e. Golongan inhibitor α-glukosidase
Obat ini bekerja dengan cara menginhibisi secara reversible kompetitif
terhadap enzim hidrolase α-amilase pankreatik dan enzim-enzim pencernaan di
usus halus, seperti isomaltase, sukrase dan maltase. Enzim-enzim ini berperan
pada hidrolisis karbohidrat makanan menjadi glukosa dan monosakarida lainnya.
Pada penderita DM, inhibisi terhadap enzim ini menyebabkan
penghambatan absorbsi glukosa, sehingga menurunkan keadaan hiperglikemia
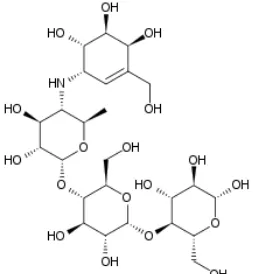
setelah makan. Obat yang termasuk golongan ini adalah acarbose dan di Indonesia
telah dipasarkan dengan nama Glucobay. Acarbose merupakan suatu
oligosakarida yang diperoleh dari proses fermentasi mikroorganisme Actiniplanes
utahensis. Acarbose merupakan serbuk berwarna putih dengan berat molekul
645.6 bersifat larut dalam air dan memiliki pKa 5.1 (Info Obat Indonesia 2009).
Rumus empirik acarbose adalah C25H43NO18 dan struktur kimianya dapat dilihat
Gambar 4 Struktur kimia acarbose (Info Obat Indonesia 2009)
2.7 Komponen Aktif
Komponen aktif merupakan kelompok senyawa fungsional yang
terkandung dalam bahan pangan dan dapat memberikan pengaruh biologis.
(Kannan et al. 2009). Penapisan komponen aktif ini dapat dilakukan dengan
metode uji fitokimia yang meliputi alkaloid, steroid, flavonoid, saponin, dan fenol
hidrokuinon (Harborne 1987).
(1) Alkaloid
Komponen alkaloid merupakan golongan senyawa organik yang paling
banyak ditemukan di alam. Alkaloid umumnya dapat didefinisikan sebagai
substansi dasar yang memiliki satu atau lebih atom nitrogen yang bersifat basa
dan tergabung dalam suatu sistem siklis, yaitu cincin heterosiklik. Alkaloid
biasanya tidak berwarna dan sebagian besar berbentuk kristal dengan titik lebur
tertentu, tetapi ada pula yang berbentuk amorf atau cairan pada suhu ruang.
Secara organoleptik, alkaloid akan terasa pahit di lidah (Harborne 1987).
Alkaloid dikategorikan sebagai hasil metabolisme sekunder, dimana
kelompok molekul ini merupakan substansi organik yang tidak bersifat vital bagi
organisme yang menghasilkannya (Kutchan 1995). Alkaloid kerap kali bersifat
racun pada manusia, tetapi ada pula yang memiliki aktivitas fisiologis pada
kesehatan manusia sehingga digunakan secara luas dalam pengobatan
(Harborne 1987).
Senyawa metabolit alkaloid diduga juga mempunyai aktivitas inhibitor α-
glukosidase. Hal ini sesuai dengan penelitian Samson (2010) yang menyatakan
13
merah-hijau memiliki aktivitas inhibitor enzim α- glukosidase sebesar 35.16% dan
36,80%.
(2) Steroid/triterpenoid
Triterpenoid merupakan komponen dengan kerangka karbon yang tersusun
oleh 6 unit isoprene dan dibuat secara biosintesis dari skualen (C30 hidrokarbon
asiklik). Triterpenoid tidak berwarna, jernih, memiliki titik lebur tinggi dan
merupakan komponen aktif yang sulit dikarakterisasi. Pengujian yang telah
digunakan secara luas untuk mendeteksi triterpenoid adalah dengan pereaksi
Liebermann-Burchard, yang memberikan warna biru-hijau pada triterpenoid dan
steroid (Harborne 1987). Hasil penelitian Setzer (2008) menunjukkan bahwa
sejumlah produk triterpenoid alami memiliki aktivitas antitumor karena memiliki
kemampuan menghambat kinerja enzim topoisomerase II, dengan cara berikatan
dengan sisi aktif enzim yang nantinya akan mengikat DNA dan membelahnya.
Hal ini menyebabkan enzim menjadi terkunci dan tidak dapat mengikat DNA.
Steroid merupakan golongan triterpena yang tersusun atas sistem cincin
cyclopetana perhydrophenanthrene. Steroid pada mulanya dipertimbangkan
hanya sebagai komponen pada substansi hewan saja (sebagai hormon seks, asam
empedu, dan lain sebagainya), akan tetapi akhir-akhir ini steroid juga ditemukan
pada substansi tumbuhan (Harborne 1987). Prekursor pembentukan steroid adalah
kolesterol atau fitosterol. Hasil penelitian Silva et al. (2002) menunjukkan bahwa
komponen steroid yang diekstrak dari daun Agave attenuata memiliki aktivitas
anti-inflamasi, walaupun aktivitas ini diikuti dengan efek hemolitik yang tidak
diinginkan. Komponen steroid dapat meningkatkan aktivitas hemolitik karena
steroid memiliki afinitas lebih tinggi dari kolesterol pada membran eritrosit.
(3) Flavonoid
Flavonoid umumnya merupakan komponen larut air (polar). Komponen
ini dapat diekstrak dengan etanol 70% dan tetap berada pada lapisan air setelah
pemisahan ekstrak menggunakan petroleum ether. Flavonoid pada tanaman
berikatan dengan gula sebagai glikosida dan adapula yang berada dalam aglikon.
Flavonoid dapat dikelompokkan menjadi 9 kelas, yaitu anthosianin,
proanthosianidin, flavonol, flavon, glikoflavon, biflavonil, chlacone dan aurone,
Flavonoid sangat efektif untuk digunakan sebagai antioksidan, antibakteri
dan inhibitor enzim α-glukosidase. Hal ini terbukti dari hasil penelitian Bernardi
et al (2007) yang menunjukkan bahwa seluruh komponen flavonoid yang diisolasi
dari Hypericum ternum memiliki aktivitas antioksidan. Hasil penelitian Sukadana
(2009) menunjukkan bahwa komponen flavonoid yang diisolasi dari buah
belimbing manis memiliki aktivitas antibakteri pada bakteri Staphylococcus
aureus pada konsentrasi 500 ppm dan bakteri Escherichia coli pada konsentrasi
100 ppm. Berdasarkan penelitian Hartika (2009) menyatakan bahwa ekstrak
flavonoid buah mahkota dewa dengan konsentrasi 1% (b/v) mampu menginhibisi
aktivitas enzim α-glukosidase sebesar 23,06-40,26%.
(4) Saponin
Saponin merupakan agen aktif permukaan dengan sifat yang menyerupai
sabun. Saponin larut dalam air, sedikit larut atau tidak sama sekali dalam etanol
dan metanol pekat yang dingin. Kehadirannya dapat dideteksi dengan mudah
karena komponen ini mampu membentuk busa dan dapat menyebabkan hemolisis
sel darah (Harborne 1987).
Saponin memiliki aktivitas antimikroba, merangsang sistem imun,
dan mengatur tekanan darah (Astawan dan Kasih 2008). Hasil penelitian Cui et
al. (2004) menunjukkan bahwa ekstrak air dari tumbuhan herbal Dioscorea
nipponica Mak mengandung komponen furostanol saponin yang tergolong dalam
steroidal saponin dan biasa digunakan sebagai obat penyakit cardiovascular.
Selain untuk kesehatan, saponin juga dapat digunakan sebagai agen bioaktif
pengendali nyamuk. Hasil penelitian Wiesman dan Chapagain (2003)
menunjukkan bahwa ekstrak saponin yang diisolasi dari Quillaja saponaria dan
Balanites aegyptiaca mampu digunakan sebagai agen pengendali nyamuk Aedes
aegypti dan Culex pipiens yang aman bagi mamalia.
(5) Fenol hidrokuinon
Komponen fenolat merupakan struktur aromatik yang berikatan dengan
satu atau lebih gugus hidroksil, beberapa mungkin digantikan dengan gugus metil
atau glikosil. Komponen fenolat bersifat larut air selama komponen tersebut
berikatan dengan gula membentuk glikosida, dan biasanya terdapat dalam vakuola
15
alami yang strukturnya telah diketahui, tetapi fenol monosiklik sederhana,
fenilpropanoid dan fenolat quinon terdapat dalam jumlah sedikit (Harborne 1987).
Pigmen quinon alami berada pada kisaran warna kuning muda hingga
hitam. Quinon mengandung kromatofor dasar yang sama dengan kromatofor
benzoquinon, yang terdiri dari dua grup karbonil yang berkonjugasi dengan dua
ikatan rangkap karbon-karbon. Hasil penelitian Escudero et al. (2008)
menunjukkan bahwa komponen polifenol yang diisolasi dari daun
Piper aduncum L. memiliki aktivitas antioksidan dan menurunkan kandungan
hidrogen peroksida secara in-vivo. Komponen polifenol tersebut meliputi asam
gallat, asam klorogenat, katekin, dan quercetin yang dilaporkan memiliki nilai
IC50 1-8 ppm.
2.8Inhibisi α-Glukosidase
Enzim α-glukosidase berfungsi memecah karbohidrat menjadi glukosa
pada usus halus manusia. Enzim ini merupakan enzim yang terlibat dalam
degradasi glikogen. Degradasi lanjutan dari glikogen oleh fosforilase dapat terjadi
hanya setelah kerja enzim glukanotransferase dan α-glukosidase, yang
mengkatalis dua reaksi. Pada reaksi pertama, enzim glukanotransferase
memindahkan tiga dari residu glukosa yang tersisa ke ujung cabang-cabang di
sebelah luar molekul lain. Kemudian enzim α-glukosidase menghidrolisis ikatan
α(1-6) pada titik percabangan rantai glikogen dan menghasilkan D-glukosa dan
membuat residu glukosa dengan ikatan α(1-4). Pada rantai lanjutan molekul tersebut kini terbuka terhadap kerja glikogen fosforilase yang menghasilkan
glukosa 1-fosfat (Lehninger 2004).
Substrat p-nitrofenil-α-D-glukopiranosa merupakan model yang digunakan
untuk merepresentasikan karbohidrat yang akan dipecah oleh enzim
α-glukosidase. Inhibisi enzim α-glukosidase terjadi karena enzim α-glukosidase akan menghidrolisis p-nitrofenil-α-D-glukopiranosa menjadi p-nitrofenol
p-nitrofenil-α-D-glukopiranosa
+ +
α-glukosidase
p-nitrofenol α-D-Glucose
Gambar 5 Persamaan reaksi enzimatik α-glukosidase dan p-nitrofenil-α -D-glukopiranosa (Sugiwati 2005)
Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol. Apabila
memiliki kemampuan menghambat aktivitas enzim α-glukosidase, maka
p-nitrofenol yang dihasilkan akan berkurang (Basuki et al. 2002 diacu dalam
Sugiwati 2005). Sehingga semakin tinggi selisih absorbansi sampel dengan
penambahan enzim dan absorbansi sampel tanpa penambahan enzim, maka
3 METODE
3.1Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli sampai Desember 2010,
bertempat di Laboratorium Bioteknologi Hasil Perairan II, Laboratorium
Mikrobiologi Hasil Perairan, Laboratorium Biokimia Hasil Perairan Departemen
Teknologi Hasil Perairan, Laboratorium Terpadu Fakultas Kedokteran Hewan,
dan Laboratorium Pusat Studi Biofarmaka.
3.2Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah tabung kultur, lampu TL
40 Watt, aerator 500-AP, alat-alat gelas, mikroskop Cole Parmer, haemositometer
Marienfeld, tanur, timbangan, sentrifuse Himac CR21G, lampu UV, drying oven
Yamato DV 41, spektrofotometer UV-Vis Hitachi U-2800, inkubator WTB
Binder, destilator, penangas air dan nylon mess (20 mess).
Bahan-bahan yang digunakan dalam penelitian adalah inokulum mikroalga
Porphyridium cruentum dan medium kultivasi Becker (Lampiran 1) sebagai bahan
kultivasi, etanol sebagai bahan pengendap polisakarida, bahan uji proksimat
(kjeltab jenis selenium, asam borat 2 % yang mengandung indikator bromcherosol
green methyl red (1:2), HCl, n-heksana), Bahan uji fitokimia (pereaksi Wagner,
pereaksi Meyer, pereaksi Dragendorff, kloroform, anhidrat asetat, serbuk
magnesium, amil alkohol, larutan FeCl3 5 %, aquadest), dan bahan uji inhibisi
α–glukosidase (bovine serum albumin, asam sulfat, enzim α-glukosidase, buffer phosfat (pH 7), p-nitrofenil-α-D-glukopiranosa, Glucobay, dan Dimethyl Sulfoxide
(DMSO). Porphyridium cruentum yang digunakan dalam penelitian ini berasal
dari koleksi Laboratorium Pusat Penelitian Oseanografi Lembaga Ilmu
Pengetahuan Indonesia (LIPI) Ancol Jakarta Utara.
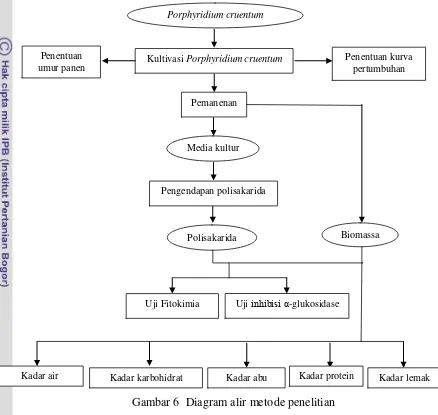
3.3 Metode Penelitian
Penelitian ini dilakukan dalam beberapa tahap, yaitu tahap pendahuluan
dan penelitian utama. Penelitian pendahuluan terdiri dari penyegaran inokulum
mikroalga Porphyridium cruentum, kultivasi dan pemanenan mikroalga,
utama terdiri dari pemisahan polisakarida, pengujian komposisi biokimia
biomassa Porphyridium cruentum, yang meliputi uji kadar air, kadar abu, kadar
protein, dan kadar karbohidrat, dan uji inhibisi α-glukosidase. Diagram alir
prosedur kerja penelitian dapat dilihat pada Gambar 6.
Gambar 6 Diagram alir metode penelitian
3.3.1 Penelitian pendahuluan
1) Penyegaran inokulum mikroalga Porphyridium cruentum
Kultivasi Porphyridium cruentum dilakukan dengan media Becker.
Namun sebelum dilakukan kultivasi, inokulum yang berasal dari Laboratorium
Pusat Penelitian Oseanografi – LIPI tersebut disegarkan dengan media Guillard.
Medium Guillard digunakan untuk membuat suatu kondisi yang sama dengan
media awal pertumbuhan mikroalga tersebut. Hal ini diharapkan dapat membantu Penentuan kurva
pertumbuhan Porphyridium cruentum
Kultivasi Porphyridium cruentum Penentuan
umur panen
Biomassa Media kultur
Pemanenan
Pengendapan polisakarida
Polisakarida
Kadar lemak Kadar abu
Kadar karbohidrat Kadar protein Kadar air
19
Porphyridium cruentum untuk melakukan proses adaptasi terhadap lingkungan
baru secara cepat. Selanjutnya pembuatan inokulum dan kultivasi mikroalga
Porphyridium cruentum digunakan media Becker yang dapat dilihat pada
Lampiran 1.
Penyegaran stok mikroalga perlu dilakukan sebelum kultivasi dalam
bioreaktor agar mikroalga yang ditumbuhkan dalam kondisi segar dan aktif.
Penyegaran stok mikroalga dilakukan dalam keadaan aseptik pada suhu ruang di
bawah penyinaran lampu pada selang 500-2000 lux dengan pemberian aerasi.
Porphyridium cruentum dikultur dalam media yang diatur pada pH 7,6 dan
disterilkan dengan lampu UV selama 30 menit.
2) Kultivasi dan pemanenan mikroalga Porphyridium cruentum
Kultivasi dilakukan dengan memindahkan 20% kultur segar Porphyridium
cruentum ke dalam bioreaktor. Kultivasi dilakukan pada media Becker pada suhu
ruang di bawah penyinaran lampu pada selang 500-2000 lux dengan pemberian
aerasi. Selama kultivasi dilakukan penghitungan konsentrasi sel. Penghitungan
konsentrasi sel mikroalga dilakukan untuk membuat kurva pertumbuhan.
Penghitungan ini dilakukan setiap hari dengan menggunakan metode mikroskopis
langsung menggunakan haemasitometer.
Pemanenan dilakukan pada fase stasioner dimana produksi polisakarida
optimum. Pemanenan Porphyridium cruentum dilakukan dengan pengendapan
menggunakan sentrifuge. Sentrifugasi dilakukan pada kecepatan 10.000 rpm
selama 15 menit pada suhu 4 oC. Biomassa dan media kultur terpisah. Media
kultur disimpan pada suhu refrigerasi untuk keperluan pemisahan polisakarida.
3) Penghitungan jumlah sel (Hadioetomo 1993)
Penghitungan jumlah sel dilakukan dengan metode hitungan langsung
sebagai berikut:
a) Permukaan hitung haemasitometer dan kaca penutup dibersihkan dengan
menggunakan alkohol 70%.
b) Tutup kaca haemasitometer diletakkan pada permukaan haemasitometer.
Suspensi biakan P. cruentum hasil pengambilan contoh dikocok, kemudian
tempat menaruh sampel yang terdapat pada haemasitometer hingga suspensi
P. cruentum menyebar pada ruang hitung.
c) Haemasitometer diletakkan di atas pentas mikroskop. Jumlah sel yang terdapat
dalam 80 kotak kecil yang terletak dalam kotak bagian tengah yang berukuran
0,2 mm2 (5 x 16 x 0,0025 mm2) dihitung dengan mikroskop pada pembesaran
40x10. Perhitungan jumlah sel dilakukan sebanyak 2 kali ulangan. Penampang
haemasitometer dapat dilihat pada Gambar 7.
Gambar 7 Penampang haemasitometer ( : Kotak yang dihitung jumlah sel)
d) Formulasi yang dipakai dalam menghitung kepadatan sel sebagai berikut:
N = x x
Keterangan:
N = kepadatan sel (sel/mL)
∑N1 = jumlah sel dalam 80 kotak kecil (ulangan ke-1)
∑N2 = jumlah sel dalam 80 kotak kecil (ulangan ke-2) 4) Penentuan umur panen
Penentuan umur panen diawali dengan pemisahan polisakarida. Sebanyak
10 mL sampel pada setiap umur kultur disentrifuse kemudian supernatannya
ditambahkan dengan etanol teknis 96% dengan perbandingan 1:1. Hasil campuran
ini didiamkan dan disimpan dalam freezer selama 24 jam. Kemudian dilakukan
penyaringan dengan kertas saring untuk memisahkan polisakarida dan larutannya.
Kertas saring kemudian dikeringkan dengan oven pada suhu 45 oC selama 6 jam.
21
antara kertas saring kering kosong dan kertas saring yang mengandung
polisakarida. Umur panen ditentukan pada bobot polisakarida tertinggi.
5) Penentuan perbandingan jumlah etanol
Penentuan perbandingan jumlah etanol dilakukan dengan menambahkan
etanol teknis 96% pada supernatan hasil panen. Penambahan etanol dilakukan
pada perbandingan supernatan : etanol yaitu 1:2; 1:1; 1:0,75; 1:0,5; dan 1:0,25.
Hasil campuran ini didiamkan dan disimpan dalam refrigerator selama 24 jam.
Kemudian dilakukan penyaringan dengan kertas saring untuk memisahkan
polisakarida dan larutannya. Kertas saring kemudian dikeringkan dengan oven
pada suhu 45 oC selama 6 jam. Hasil pengeringan ini kemudian ditimbang. Berat
polisakarida didapat dari selisih antara kertas saring kering kosong dan kertas
saring yang mengandung polisakarida. Bobot polisakarida tertinggi merupakan
konsentrasi etanol terpilih yang akan digunakan pada pemisahan polisakarida
dalam jumlah besar.
3.3.2 Penelitian utama
1) Pemisahan polisakarida
Pemisahan polisakarida dilakukan dengan menambahkan etanol teknis
96% pada supernatan hasil panen. Penambahan etanol dilakukan pada
perbandingan supernatan : etanol dengan konsentrasi terpilih. Hasil campuran ini
didiamkan dan disimpan dalam refrigerator selama 24 jam. Kemudian dilakukan
penyaringan dengan nylon mess 20 mess untuk memisahkan polisakarida dan
larutannya. Hasil penyaringan kemudian ditimbang dan dihitung rendemennya.
2) Analisis komposisi biokimia biomassa Porphyridium cruentum
(1) Analisis kadar air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah
mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam.
Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan
dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali
hingga beratnya konstan. Sebanyak 5 gram contoh dimasukkan ke dalam cawan
tersebut, kemudian dikeringkan dengan oven pada suhu 105 oC selama 5 jam atau
ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang
kembali.
Perhitungan kadar air :
(2) Analisis kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu
105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang
hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke
dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak
berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu
600 oC selama 6 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
Kadar abu ditentukan dengan rumus:
(3) Analisis kadar protein (AOAC 1980)
Tahap-tahap yang dilakukan dalam analisis protein ini terdiri dari tiga
tahap, yaitu dekstruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan
dengan metode mikro Kjeldal. Sampel ditimbang sebanyak 0,25 gram, kemudian
dimasukkan ke dalam labu Kjeldal 100 mL, lalu ditambahkan 0,25 gram selenium
dan 3 mL H2SO4 pekat. Contoh didekstruksi pada suhu 410 oC selama kurang
lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin ke dalam labu
Kjeldal ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian
dil;akukan destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung
dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3)
2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah
23
kebiruan, maka proses destilasi dihentikan. Lalu destilat dititrasi dengan HCL
0,10 N sampai terjadi perubahan merah muda. Volume titran dibaca dan dicatat.
Kadar protein dihitung dengan rumus sebagai berikut :
% N =
x
100 %% kadar protein =
*) Faktor konversi = 6,25
(4) Analisis kadar lemak (AOAC 2005)
Contoh seberat 3 gram (W1) dimasukkan ke dalam kertas saring pada
kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya
dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus
dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan
disambungkan dengan tabung Soxhlet. Selongsong lemak dimasukkan ke dalam
ruang ekstraktor tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana).
Kemudian dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu
lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut
akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali
ke dalam labu lemak. Labu lemak dikeringkan dalam oven pada suhu 105 oC,
kemudian labu didinginkan dalam desikator sampai beratnya konstan (W3).
Perhitungan kadar lemak :
% Kadar lemak =
x
100 %Keterangan :
W1 : Berat contoh (gram)
W2 : Berat labu lemak kosong (gram) W3 : Berat labu lemak dengan lemak (gram) 3) Uji fitokimia (Harborne 1987)
(1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N
kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi
Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi
Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2
dengan 0,50 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi
100 mL dengan labu takar. Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat
dengan cara 10 mL akuades dipipet kemudian ditambahkan 2,50 gram iodin dan 2
gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam
labu takar. Pereaksi ini berwarna coklat. Pereaksi Dragendorff dibuat dengan cara
0,80 gram bismut subnitrat ditambahkan dengan 10 mL asam asetat dan 40 mL
ditambahkan ke dalamnya. Larutan berwarna merah yang terbentuk untuk pertama
kali kemudian berubah menjadi biru dan hijau, menunjukkan reaksi positif.
(3) Flavonoid
Sejumlah sampel ditambahkan serbuk magnesium 0,10 mg dan 0,40 mL
amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang
sama) dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning atau
jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid.
(4) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil
selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan
adanya saponin.
(5) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 mL etanol 70%. Larutan
yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan
FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya
25
4) Uji Inhibisi α-glukosidase (Sutedja 2003 diacu dalam Sugiwati 2005)
Larutan enzim dibuat dengan melarutkan 1 mg α-glukosidase dalam 100
mL buffer fosfat (pH 7) yang mengandung 200 mg bovin serum albumin.
Sebelum digunakan, sebanyak 1 mL larutan enzim tersebut diencerkan 25 kali
dengan buffer fosfat (pH 7). Campuran reaksi terdiri dari 250 μl
p-nitrofenil- -D-glukopiranosa (20 mM) sebagai substrat, 490 μl buffer fosfat
(100 mM, pH 7) dan 10 μl larutan sampel dalam DMSO. Setelah campuran reaksi
diinkubasi pada 37 oC selama 5 menit, 250 μl larutan enzim ditambahkan dan
selanjutnya diinkubasi selama 15 menit. Reaksi enzim dihentikan dengan
penambahan 1000 μl natrium karbonat (200 mM) dan p-nitro fenol yang
dihasilkan dibaca absorbansinya pada 400 nm.
Larutan standar (acarbose) dibuat dengan konsentrasi yang sama dengan
larutan sampel, dengan melarutkan tablet Acarbose (Glucobay) dalam akuades
dan HCl 2N. Larutan disentrifugasi dan supernatannya digunakan sebagai standar.
Larutan standar diperlakukan sama dengan sampel. Sistem reaksi enzim
selengkapnya untuk satu sampel dengan volume total 2 mL dapat dilihat pada
Tabel 2.
Tabel 2 Sistem reaksi enzim untuk satu sampel dengan volume total 2 mL
Blanko (μl) K (μl) So (μl) S1(μl)
Larutan sampel - - 10 10
DMSO 10 10 - -
Buffer 490 490 490 490
Substrat 250 250 250 250
Inkubasi 37oC selama 5 menit
Buffer 250 - 250 -
Enzim - 250 - 250
Inkubasi 37oC selama 15 menit
Na2CO3 1000 1000 1000 1000
Masing-masing pengujian daya hambat sampel terhadap aktivitas
α-glukosidase dihitung dalam persen inhibisi dengan rumus sebagai berikut.
% inhibisi = x 100 %
Keterangan :
4.1 Kultivasi Porphyridium cruentum
Kultur Porphyridium cruentum berwarna merah terang. Warna ini terkait
dengan keberadaan fikoeritrin sebagai pigmen dominan pada mikroalga
Porphyridium cruentum sebesar 8 % bobot kering (Vonshak 1988). Warna kultur
akan semakin pekat seiring dengan lamanya waktu kultivasi. Kepekatan warna
kultur mengindikasikan terjadinya pertambahan sel pada kultur tersebut. Hasil
kultivasi pada penelitian ini menunjukkan bahwa kultur hari ke-10 lebih pekat
dibandingkan dengan hari ke-1 dan hari ke-5. Hal ini membuktikan terjadinya
pertumbuhan. Warna kultur Porphyridium cruentum dapat dilihat pada Gambar 8.
a b c d
Gambar 8 Kultur mikroalga Porphyridium cruentum pada umur yang berbeda (a) 1 hari, (b) 5 hari, (c) 10 hari, dan (d) 12 hari
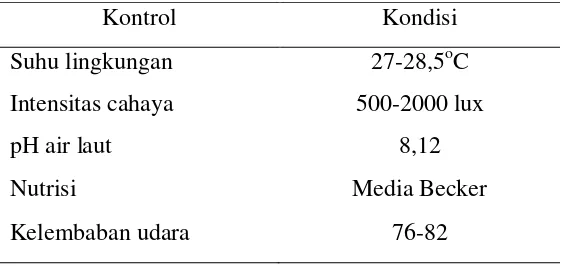
Kondisi lingkungan sangat berpengaruh dalam kultivasi mikroalga
Porphyridium cruentum. Perubahan kondisi lingkungan dan nutrisi akan
berpengaruh pada pertumbuhan mikroalga Porphyridium cruentum. Kondisi
lingkungan selama kultivasi dapat dilihat pada Tabel 2.
Tabel 2 Kondisi umum kultivasi Porphyridium cruentum
Kontrol Kondisi
Suhu lingkungan 27-28,5oC
Intensitas cahaya 500-2000 lux
pH air laut 8,12
Nutrisi Media Becker
27
Suhu optimum untuk pertumbuhan Porphyridium cruentum adalah
21-26 oC, sedangkan pada suhu di bawah 13oC dan di atas 31oC pertumbuhannya
lambat (Golueke dan Oswald 1962 diacu dalam Vonshak 1988). Kultivasi pada
penelitian ini dilakukan pada rentang suhu 27-28,5 oC dan mampu tumbuh dengan
baik. Kultur yang ditumbuhkan di bawah cahaya secara kontinyu akan tumbuh
dengan cepat. Faktor lingkungan yang penting untuk kultur mikroalga adalah
cahaya, yang merupakan faktor utama pada fotosintesis (Arad dan Richmond
2004).
Porphyridium cruentum juga toleran terhadap perubahan pH pada kisaran
antara 5,2-8,3. Menurut Colman dan Gehl (1983) diacu dalam Vonshak (1988)
bahwa pH optimum fotosintesis Porphyridium cruentum adalah 7,5. Ramus
(1972) diacu dalam Vonshak (1988) menyatakan bahwa jika Porphyridium
cruentum ditumbuhkan dalam media dengan sumber nitrogen terbatas maka
produksi polisakaridanya lebih tinggi.
4.2 Kurva Pertumbuhan Porphyridium cruentum
Pertumbuhan organisme didefinisikan sebagai suatu peningkatan massa
atau ukuran sel yang disertai oleh sintesis makromolekul dan menghasilkan
struktur organisme baru. Pertumbuhan jaringan terjadi melalui peningkatan
ukuran sel yang diikuti peningkatan jumlah sel (Becker 1994). Penentuan pola
pertumbuhan pada Porphyridium cruentum dilakukan dengan cara sampling untuk
menghitung jumlah sel mikroalga tersebut setiap hari menggunakan
haemasitometer yang kemudian diamati di bawah mikroskop. Nilai kepadatan sel
yang diperoleh berasal dari perhitungan matematis yang kemudian diturunkan
dengan pendekatan logaritmik (log) dan diplotkan ke dalam grafik sehingga
diperoleh kurva pertumbuhan.
Fase pertumbuhan setiap organisme tidak selalu tetap. Perbedaan panjang
atau kemiringan kurva pertumbuhan ditentukan oleh kondisi umum kultur.
Keberagaman fase pertumbuhan menggambarkan perubahan kondisi lingkungan
dan tergantung pada inokulum, metode kultivasi, konsentrasi nutrisi, intensitas
cahaya, dan suhu (Becker 1994). Kurva pertumbuhan mikroalga Porphyridium
Gambar 9 Kurva pertumbuhan mikroalga Porphyridium cruentum
(a) fase lag, (b) fase logaritmik, (c) fase stasioner, (d) fase kematian
Fase pertumbuhan pada kultur Porphyridium cruentum meliputi fase lag,
fase log, fase stasioner dan fase kematian. Fase lag terjadi sampai hari pertama.
Fase lag hanya berlangsung selama 1 hari diduga berkaitan dengan umur
inokulum yang digunakan. Inokulum yang digunakan berumur 7 hari dan
berdasarkan kurva pertumbuhan termasuk dalam fase tengah stasioner.
Umur fisiologis sel berpengaruh terhadap kemampuan sel dalam
melakukan multiplikasi. Sel yang diambil dari fase lag akhir, fase log dan fase
stasioner awal akan membutuhkan waktu lag yang lebih pendek bila dibandingkan
dengan sel yang diambil dari fase stasioner akhir. Pada fase lag aktivitas fisiologi
sel sangat tinggi, karena sel sangat sensitif terhadap temperatur atau perubahan
lingkungan lain daripada sel pada fase yang lebih dewasa (Becker 1994).
Fase pertumbuhan selanjutnya adalah fase logaritmik (log). Fase log
terjadi pada hari ke-1 sampai hari ke-5. Fase ini ditandai dengan meningkatnya
jumlah sel yang dapat dihitung di bawah mikroskop dengan menggunakan
haemasitometer. Peningkatan laju pertumbuhan didukung oleh ketersediaan
nutrisi dan lingkungan yang baik sehingga pertumbuhannya optimal (Fogg 1975).
Selain itu, sel telah terbiasa dengan lingkungan baru sehingga mulai tumbuh dan
melipatgandakan diri pada akhir fase lag (Lee dan Shen 2004).
Fase stasioner terjadi pada hari ke-5 sampai hari ke-9. Peningkatan ukuran
populasi tidak terjadi, jumlah sel terlihat cenderung konstan, karena laju
29
Fase stasioner terjadi akibat keterbatasan intensitas cahaya yang mampu diserap
oleh mikroalga. Jumlah energi cahaya yang mampu diserap melalui fotosintesis
berkaitan dengan konsentrasi sel yang semakin melimpah hingga akhir fase log.
Setelah konsentrasi sel mencapai maksimal, jumlah biomassa tetap sampai nutrisi
dalam medium dan inhibitor menjadi faktor pembatas (Lee dan Shen 2004).
Fase kematian dimulai pada hari ke-9. Kematian sel disebabkan oleh
nutrien dalam medium telah habis sedangkan sel yang masih hidup tidak mampu
untuk tumbuh dan hanya dapat bertahan hidup (Fogg 1975). Selain itu, fase ini
terjadi disebabkan oleh kondisi lingkungan yang kurang baik, umur kultur yang
sudah tua, keterbatasan nutrisi dan absorbs cahaya, atau infeksi oleh
mikroorganisme lain (Becker 1994).
Berdasarkan penelitian Kusmiyati dan Agustini (2006) diperoleh kurva
pertumbuhan mikroalga Porphyridium cruentum yang tidak diawali dengan fase
lag. Fase log terjadi mulai awal kultivasi hingga hari ke-8, fase stasioner terjadi
pada hari ke-8 hingga hari ke-10, dan fase kematian mulai terjadi pada hari ke-10.
Kultivasi Porphyridium cruentum dilakukan dalam botol berisi 500 ml media
Becker. Setelah stok kultur mencapai optical density (OD) 1,6, sebanyak 250 ml
kultur tersebut dipindahkan ke botol 2 L diencerkan dengan 750 ml media yang
sama sehingga OD sekitar 0,4. Perbedaan kualitas dan jumlah inokulum yang
ditambahkan diduga menjadi penyebab perbedaan bentuk kurva pertumbuhan
yang didapatkan.
4.3 Produksi dan Pengendapan Polisakarida
Menurut penelitian Kusumawarni (1998), secara umum produksi
polisakarida terus meningkat dari waktu ke waktu. Selain faktor lingkungan, fase
pertumbuhan juga berpengaruh terhadap produksi polisakarida. Produksi
polisakarida akan meningkat pada fase stasioner. Hal ini menunjukkan bahwa
kondisi lingkungan hingga akhir fase stasioner masih mendukung bagi
pertumbuhan dan pembentukan polisakarida. Kondisi pertumbuhan yang baik
akan menentukan kandungan polisakarida sebagai hasil fotosintesis. Sehingga
semakin tinggi tingkat fotosintesis, semakin banyak pula polisakarida yang akan
terbentuk. Kandungan polisakarida Porphyridium cruentum selama kultivasi dapat
Gambar 10 Kurva polisakarida harian
Hasil penelitian menunjukkan bahwa kandungan polisakarida ekstraseluler
dari Porphyridium cruentum yang dikultivasi dengan media Becker meningkat
setelah umur 6 hari. Polisakarida dari sel Porphyridium cruentum merupakan
suatu metabolit sekunder, yaitu senyawa yang tidak dibutuhkan sel untuk
pertumbuhannya (Said 1987 diacu dalam Kusumawarni 1998). Metabolit
sekunder biasanya disintesis pada akhir siklus pertumbuhannya, dan merupakan
cadangan makanan untuk bertahan hidup. Hal ini sesuai dengan pernyataan bahwa
polisakarida diproduksi pada fase stasioner dan bersifat untuk melindungi sel dari
kondisi yang tidak menguntungkan (Lee 2008). Pengendapan polisakarida dapat
dilihat pada Gambar 11.
Gambar 11 Pengendapan polisakarida 0.00
0.05 0.10 0.15 0.20 0.25
0 1 2 3 4 5 6 7 8 9 10 11 12
Waktu (hari)
gr
am
/10
m
31
Berdasarkan penelitian Agustini et al. (2009), produksi ekstraseluler
Porphyridium cruentum dipengaruhi oleh lamanya waktu penyinaran. Produksi
polisakarida ekstraseluler mencapai maksimum pada saat sel mengalami fase
logaritmik akhir menuju ke fase stasioner. Berbeda halnya dengan penelitian
Kusumawarni (1998), produksi polisakarida ekstraseluler akan meningkat saat sel
mulai memasuki fase stasioner hingga akhir fase stasioner.
Cahaya biru dan merah dapat digunakan untuk meningkatkan efisiensi
fotosintesis dan meningkatkan produksi polisakarida ekstraseluler. Pertumbuhan
dan produksi polisakarida ekstraseluler Porphyridium cruentum dipengaruhi oleh
intensitas dan panjang gelombang cahaya. Pertumbuhan Porphyridium cruentum
meningkat seiring dengan peningkatan intensitas cahaya, meskipun cahaya yang
melebihi titik jenuh menjadi penghambat pertumbuhan mikroalga
(You dan Barnett 2004).
Porphyridium cruentum menggunakan nitrat atau ammonium sebagai
sumber nitrogen. Arad et al. (1988) melakukan penelitian dengan menggunakan
tiga tipe kultur yaitu batch mode (pemberian nitrat pada awal kultivasi), continual
mode (pemberian nitrat tiap hari), dan deficient mode (tanpa pemberian nitrat)
menyatakan bahwa batch mode dan continual mode mengalami pertumbuhan
yang sama, sedangkan pertumbuhan pada deficient mode terhambat. Jumlah
polisakarida yang dihasilkan pada continual mode dan deficient mode tiap sel
memiliki persamaan. Meskipun produksi polisakarida maksimal terjadi pada batch
mode, tetapi jumlah polisakarida yang diekskresikan ke medium secara maksimal
terjadi pada deficient mode. Jumlah nitrogen yang ditambahkan pada medium
kultivasi berpengaruh terhadap distribusi antara jumlah polisakarida terlarut pada
medium dan polisakarida yang terikat pada sel.
Umur panen yang dipilih adalah umur 12 hari. Hal ini berkaitan dengan
kurva pertumbuhan mikroalga Porphyridium cruentum dan jumlah polisakarida
yang dihasilkan. Pada umur 12 hari terjadi penurunan populasi tetapi warna kultur
masih dalam keadaan baik (tidak pudar). Selama kultivasi, jumlah polisakarida
paling tinggi pada umur 12 hari dengan jumlah 0,215 gram/10 ml. Biomassa
kering dan polisakarida ekstraseluler Porphyridium cruentum dapat dilihat pada