ISOLASI DAN IDENTIFIKASI SENYAWA INHIBITOR
α-GLUKOSIDASE DARI EKSTRAK DAUN TAKOKAK
(Solanum torvum)
YUSRIDAH HASIBUAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Isolasi dan identifikasi senyawa inhibitor α-glukosidase dari ekstrak daun takokak (Solanum torvum) adalah karya
saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
Yusridah Hasibuan
NRP G451090091
ABSTRACT
YUSRIDAH HASIBUAN. Isolation and identification of α-glucosidase inhibitor compound from the leaves extracts of takokak (Solanum torvum). Supervized by
IRMA HERAWATI SUPARTO and IRMANIDA BATUBARA.
This study aimed to isolate the alpha-glucosidase inhibitor compounds on leaves and fruit of takokak (Solanum torvum). The leaves and fruit were extracted
with n-hexane, ethylacetate, methanol and water and determined the activity of α
-glucosidase inhibitors. Leaves extract has properties as an inhibitor, while no activity was found in the fruits extract. The IC50 values of methanol extract of Solanum torvum leaves was 100 ppm. Fractionation performed on leaf extracts using silica gel column chromatography. Fractionation results obtained six fractions (1-6) and the most active fraction was fraction 2 (IC50 18.28 ppm). Fraction 2 was separated further by preparative thin layer chromatography and obtained ten fractions. One fraction has the highest activity of α-glucosidase inhibitors with IC50 of 67.02 ppm. Phytochemical assay, ultraviolet visible spectroscopy and infrared spectroscopy on the fraction with the highest activity showed that the active compound as inhibitors was flavon.
RINGKASAN
YUSRIDAH HASIBUAN. Isolasi dan Identifikasi Senyawa Inhibitor α -Glukosidase dari Ekstrak Daun Takokak (Solanum torvum). Dibimbing oleh
IRMA HERAWATI SUPARTO dan IRMANIDA BATUBARA.
Pengobatan diabetes yang saat ini digunakan dalam dunia kedokteran adalah dengan injeksi insulin ke dalam tubuh secara berkala atau dengan mengkonsumsi obat sintetik. Selain memerlukan biaya yang cukup mahal, obat sintetik dapat menimbulkan efek samping, sehingga pengobatan tradisional mendapat tempat di masyarakat dan menjadi alternatif dalam pengobatan.
Takokak (Solanum torvum) merupakan salah satu genus Solanum, yang
buahnya telah lama dikonsumsi orang sebagai sayur atau lalapan khususnya di daerah Sumatera Utara. Daun dan buahnya secara empiris dipercaya memiliki beberapa khasiat sehingga dapat digunakan sebagai obat alternatif. Salah satunya digunakan sebagai obat diabetes. Dari segi kandungan kimia, tumbuhan ini belum banyak diketahui. Evaluasi fitokimia, telah dilakukan pada daun takokak diduga mengandung mengandung alkaloid, glukoalkaloid, solasonin, dan solamargin. Sementara itu, buah takokak diduga mengandung flavonoid, glukoalkaloid, solasonin, steroid, protein dan mineral.
Uji inhibisi terhadap enzim α-glukosidase dilakukan untuk mengetahui aktivitas antihiperglikemik dari setiap ekstrak. Pada uji ini alfa-glukosidase akan menghidrolisis substrat p-nitrofenil-α-D-glukopiranosa menjadi p-nitrofenol yang
berwarna kuning dan glukosa. Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol yang berwarna kuning. Dengan adanya ekstrak daun
takokak yang berperan sebagai inhibitor α-glukosidase maka p-nitrofenol yang
dihasilkan akan berkurang yang ditandai oleh berkurangnya intensitas warna kuning.
Penelitian ini dilakukan untuk memperoleh ekstrak, fraksi dan senyawa inhibitor α-glukosidase dengan uji aktivitas inhibitor α-glukosidase dan diidentifikasi dengan fitokimia, UV-Vis, dan FTIR. Hasil penelitian ini menunjukkan bahwa ekstrak metanol daun takokak kering (IC50 100 ppm) memiliki sifat sebagai inhibitor α-glukosidase, tetapi tidak sebaik kontrol positif (IC50 1.096 ppm) karena IC50 ekstrak lebih besar dari IC50 kontrol positif. Hasil fraksinasi diperoleh 6 fraksi dan fraksi 2 adalah fraksi teraktif (IC50 18.28 ppm). Fraksi 2 dipisahkan dengan KLTP diperoleh 10 fraksi (2A-2J) fraksi 2A memiliki aktivitas inhibitor α-glukosidase yang paling baik (IC50 67.02 ppm). Hasil KLT uji fitokimia, UV-Vis, dan FTIR pada fraksi 2A menunjukkan senyawa yang aktif sebagai inhibitor α-glukosidase adalah kelompok flavon.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB.
ISOLASI DAN IDENTIFIKASI SENYAWA INHIBITOR
α-GLUKOSIDASE DARI EKSTRAK DAUN TAKOKAK
(Solanum torvum)
YUSRIDAH HASIBUAN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul Tesis : Isolasi dan Identifikasi Senyawa Inhibitor α-Glukosidase dari Ekstrak Daun Takokak (Solanum torvum Swartz)
Nama : Yusridah Hasibuan NRP : G451090091
Disetujui Komisi Pembimbing
Dr. dr. Irma Herawati Suparto, MS.
Ketua Dr. Irmanida Batubara. S.Si., M.Si. Anggota
Diketahui Ketua Program Studi Kimia
Prof. Dr. Purwantiningsih Sugita, MS.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tak lupa penulis panjatkan shalawat serta salam bagi teladan penulis Nabi Muhammad SAW.
Karya ilmiah berjudul Isolasi dan identifikasi senyawa inhibitor α -glukosidase dari ekstrak daun takokak (Solanum torvum) disusun berdasarkan
penelitian yang dilaksanakan dari mulai bulan November sampai dengan bulan juni 2011 di Laboratorium Kimia Analitik Departemen Kimia FMIPA dan Laboratorium Pusat Studi Biofarmaka LPPM Institut Pertanian Bogor (IPB).
Ucapan terima kasih penulis sampaikan kepada Dr. dr. Irma Herawati Suparto, MS. dan Dr. Irmanida Batubara, S.Si., M.Si. yang telah memberikan bimbingan dan saran selama berlangsungnya penelitian dan dalam penyusunan karya ilmiah.Terima kasih juga penulis ucapkan kepada Departemen agama yang telah membiayai studi dan penelitian saya, juga kepada orang tua, suami, dan keluarga yang telah memberi dukungan materi, non materi, dan doa kepada penulis dalam penelitian dan penulisan karya ilmiah ini. Ucapan terima kasih penulis tujukan kepada teman-teman angkatan 2009, staf laboratorium kimia Analitik dan staf laboratorium Pusat Studi Biofarmaka IPB atas kerja samanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 1 Oktober 1976 dari ayah Maaruf Hasibuan dan ibu Nurhayati Lubis Penulis merupakan anak ke delapan dari sembilan bersaudara.
Tahun 1995 penulis terdaftar sebagai mahasiswa pada program sarjana mayor Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas negeri Medan (UNIMED) dan menamatkannya pada tahun 2000. Kesempatan untuk melanjutkan program pascasarjana S2 pada program studi Kimia IPB Melalui Program Beasiswa Departemen Agama Republik Indonesia pada tahun 2009. Penulis bekerja sebagai guru mata pelajaran kimia di Madrasah Aliyah Negeri 7 Jakarta dari tahun 2003 sampai sekarang.
DAFTAR ISI
Halaman DAFTAR TABEL ... x DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi PENDAHULUAN ... 1 Tujuan Penelitian ... 2 Manfaat Penelitian ... 2 TINJAUAN PUSTAKA ... 3 Takokak ... 3 Diabetes Melitus ... 4Inhibitor Enzim α-Glucosidase ... 4
Ekstraksi dan Fraksinasi Senyawa Metabolit Sekunder ... 6
BAHAN DAN METODE ... 9
Tempat dan Waktu ... 9
Alat dan Bahan ... 9
Prosedur Penelitian ... 9
Preparasi dan Ekstrak Sampel ... 10
Penentuan Kadar Air ... 10
Ekstraksi ... 11
Uji Fitokimia ... 12
Penentuan Eluen Terbaik ... 13
Fraksinasi dengan Kromatografi Kolom ... 13
Uji Aktivitas α-Glukosidase ... 13
Identifikasi Senyawa Inhibitor α-Glukosidase ... 14
HASIL DAN PEMBAHASAN ... 15
Penetapan Kadar Air ... 15
Hasil Ekstraksi Daun dan Buah Takokak ... 15
Penapisan Fitokimia ... 16
Uji Inhibisi α-Glukosidase Ekstrak Metanol ... 17
Pemilihan Eluen Terbaik ... 19
Fraksinasi dengan Kromatografi Kolom ... 20
Aktivitas Inhibitor α-Glukosidase pada Hasil Fraksinasi ... 21
Hasil Kromatografi Lapis Tipis Preparatif (KLTP) ... 22
Aktivitas Inhibitor α-Glukosidase pada Hasil KLTP ... 23
Uji Fitokimia Lanjutan ... 24
Analisis Spektrofotometer UV-Vis ... 24
Analisis Spektrofotometer FTIR ... 25
SIMPULAN DAN SARAN ... 27
DAFTAR PUSTAKA ... 29
DAFTAR TABEL
Halaman
1 Hasil uji fitokimia dan hasil rendemen ekstraksi dari
daun takokak kering dan buah takokak segar ... 16 2 Nilai IC50 dari ekstrak daun takokak kering dan buah
takokak segar ... 18 3 Rendemen hasil fraksinasi ekstrak daun takokak ... 21 4 Nilai IC50 inhibitor α-glukosidase pada fraksi hasil kromatografi
kolom ... 21 5 Rendemen hasil KLTP fraksi 2A ekstrak daun takokak ... 23 6 Nilai IC50 Inhibitor α-glukosidase pada fraksi hasil KLTP ... 24 7 Hasil absorpsi inframerah gugus fungsi fraksi 2A pada ekstrak
metanol daun takokak kering ... 26
DAFTAR GAMBAR
Halaman
1 Tumbuhan takokak (Solanum torvum) ... 3
2 Struktur molekul acarbose, miglitol, voglibose... 6 3 Penentuan eluen terbaik pada ekstrak daun takokak dengan
menggunakan eluen tunggal ... 19 4 Penentuan eluen terbaik dengan menggunakan eluen campuran ... 20 5 Hasil analisis KLT pada 10 fraksi hasil KLTP dengan eluen
DAFTAR LAMPIRAN
Halaman
1 Diagram alir metode penelitian daun dan buah takokak
(Solanum torvum) ... 32
2 Diagram alir proses ekstraksi daun dan buah takokak ... 33
3 Diagram alir uji aktivitas inhibitor α-glukosidase ... 34
4 Hasil kadar air daun takokak kering dan buah takokak segar ... 35
5 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari ekstrak metanol daun takokak ... 36
6 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari fraksinasi daun takokak ... 38
7 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari hasil KLTP daun takokak ... 39
8 Spektrum UV-Vis fraksi 2A hasil KLTP ekstrak daun takokak ... 40
PENDAHULUAN
Pengobatan diabetes yang saat ini digunakan dalam dunia kedokteran adalah dengan injeksi insulin ke dalam tubuh secara berkala atau dengan mengkonsumsi obat sintetik. Selain memerlukan biaya yang cukup mahal, obat sintetik dapat menimbulkan efek samping, sehingga pengobatan tradisional mendapat tempat di masyarakat dan menjadi alternatif dalam pengobatan.
Banyak penelitian yang membuktikan bahwa beberapa senyawa golongan flavonoid dan alkaloid yang diperoleh dari tumbuh-tumbuhan berpotensi sebagai antidiabetes. Di antaranya, ekstrak air buah mahkota dewa mampu menurunkan kadar glukosa darah (Sugiwati et al. 2006), ekstrak etanol daun sirih memiliki
aktivitas sebagai antidiabetes (Αrabi 2010), ekstrak senyawa golongan flavonoid pada buah mahkota dewa memiliki daya aktivitas α-glukosidase (Hartika 2009), sedangkanSutedja (2003) melaporkan biji alpukat,daun bungur, daun sukun, daun kesumba, kulit jamblang, dan cocor bebek memiliki kandungan senyawa fenol serta berpotensi sebagai inhibitor α-glukosidase.
Takokak (Solanum torvum Swartz) merupakan salah satu genus Solanum,
yang buahnya telah lama dikonsumsi orang sebagai sayur atau lalapan khususnya di daerah Sumatera Utara. Daun dan buahnya secara empiris dipercaya memiliki beberapa khasiat sehingga dapat digunakan sebagai obat alternatif. Salah satunya digunakan sebagai obat diabetes (Kusirisin et al. 2009). Dari segi kandungan
kimia, tumbuhan ini belum banyak diketahui. Evaluasi fitokimia, telah dilakukan pada daun takokak yang diduga mengandung alkaloid, glukoalkaloid, solasonin dan solamargin (Amador et al. 2007). Sementara itu, pada buah takokak diduga
mengandung flavonoid, glukoalkaloid, solasonin, steroid, protein dan mineral (Yuanyuan et al. 2009).
Enzim α-glukosidase adalah enzim yang berfungsi untuk menghidrolisis karbohidrat menjadi gula sederhana (glukosa) pada usus. Senyawa yang dapat menghambat aktivitas enzim tersebut berpotensi sebagai obat antidiabetes karena dapat menurunkan kadar gula darah dengan cara memperlambat penyerapan karbohidrat postprandial. Pada penelitian ini, daya hambat bahan aktif dari
- 2
nitrofenil-α-D-glukosa sebagai substrat. Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol, apabila ekstrak takokak memiliki kemampuan
menghambat aktivitas enzim α-glukosidase, maka p-nitrofenol yang dihasilkan
akan berkurang atau tidak terbentuk (Suarsana et al. 2008). Selanjutnya dalam
penelitian ini dilakukan isolasi dan identifikasi aktivitas antidiabet daun dan buah takokak.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan ekstrak, fraksi ekstrak, senyawa inhibitor dari daun dan buah takokak yang memiliki aktivitas inhibitor α -glukosidase.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat meningkatkan penggunaan takokak sebagai obat antidiabet alternatif bagi masyarakat terutama masyarakat pedesaan yang sulit memperoleh obat jadi atau karena tidak terjangkau oleh daya beli masyarakat.
3
TINJAUAN PUSTAKA
Takokak (Solanum torvum)
Takokak (Solanum torvum) merupakan tanaman yang berasal dari Amerika
Serikat dan Hindia Barat, namun sudah dikenal lama oleh masyarakat Indian mulai dari Meksiko sampai Brasil dan sekarang sudah menyebar di seluruh daerah tropis di dunia. Tanaman ini dikelompokkan dalam kerajaan Plantae, divisi Magnoliophyta, klas Magnoliopsidae, bangsa Solanales, suku Solanaceae, marga Solanum, nama jenis Solanum torvum. Takokak dikenal dengan nama yang
berbeda di beberapa tempat, seperti terong pipit (Sumatra), poka, terongan, cepoka, congbelut, cokowana, pokok (Jawa), dan takokak (Sunda) (Hutapea 2000).
Gambar 1 Tumbuhan Takokak (Solanum torvum)
Secara morfologi, tanaman takokak merupakan tanaman perdu dengan tinggi kurang lebih 2 meter. Batang berbentuk bulat, berkayu, bercabang, berduri, percabangannya simpodial, berwarna putih kotor. Daun tunggal tersebar, berbentuk bulat telur, bertepi rata, ujungnya meruncing, berpangkal runcing dengan panjang 27-30 cm, lebar 20-24 cm, pertulangan menyirip, ibu tulang berduri, hijau. Bunganya majemuk, berbentuk bintang, bertajuk, waktu kuncup berbintik ungu, kelopaknya berbulu, bertajuk lima, runcing dengan panjang kurang 5 mm, berwarna hijau muda, memiliki lima benang sari, panjang tangkai kurang lebih 1 m, panjang kepala sari kurang lebih 6 mm, berbentuk jarum,
4
berwarna kuning, panjang tangkai putik kurang lebih 1 cm, kepala putik berwarna hijau dan putih. Buah berbentuk buni, bulat, masih muda berwarna hijau dan menjadi jingga bila sudah tua. Bijinya pipih, kecil, licin, berwarna kuning pucat. Akar berbentuk tunggang, berwarna kuning pucat (Stevanie 2007).
Takokak banyak dimanfaatkan sebagai obat tradisional. Khasiat tumbuhan ini di antaranya untuk mengobati sakit lambung, sakit gigi, katarak, tidak datang haid, wasir atau ambeien, radang payudara, influenza, panas dalam, pembengkakan, bisul, koreng, sakit pinggang, asam urat tinggi, keropos tulang, jantung berdebar-debar, menetralkan racun dalam tubuh, dan melancarkan sirkulasi darah (Hembing 2006). Kusirisin et al. (2009) melaporkan bahwa
takokak secara tradisional digunakan sebagai pengobatan alternatif pada diabetes. Diabetes Melitus
Diabetes melitus (DM) merupakan penyakit dengan kadar glukosa darah melebihi nilai normal (80-120 mg/dl), yang biasa disebut hiperglikimia, akibat tubuh kekurangan insulin baik absolut atau relatif. Insulin merupakan hormon yang secara alami di dalam darah dan penting dalam penyediaan energi dalam sel agar dapat berfungsi.
Secara etiologi diabetes melitus dibagi menjadi empat kelompok, yaitu diabetes melitus tipe 1, tipe 2, tipe spesifik akibat kelainan genetik, dan akibat kehamilan. Namun yang banyak diderita adalah diabetes melitus tipe 1 dan tipe 2. Diabetes melitus tipe 1 merupakan penyakit diabetes melitus yang tergantung dengan insulin. Tipe ini sangat tergantung dengan insulin dari luar tubuh untuk menurunkan kadar glukosa darah karena sel-β pankreas penderita tidak memiliki kemampuan untuk memproduksi insulin. Peristiwa ini terjadi akibat rusaknya sel-β pankreas akibat proses autoimun tubuh atau serangan virus. Diabetes mellitus tipe 2 merupakan penyakit diabetes melitus yang tidak tergantung dengan insulin. Penyakit jenis ini diasumsikan bahwa penderita mampu memproduksi insulin tetapi kerja insulin tidak maksimal (The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus 2003).
5
Inhibitor α-Glukosidase
Senyawa yang dapat menghambat kerja katalisis enzim disebut dengan inhibitor. Senyawa ini merupakan bagian dari modulator enzim yang memberikan efek negatif terhadap kerja katalisis enzim. Terdapat dua jenis inhibitor, yaitu yang bersifat reversible dan irreversible. Inhibisi reversible merupakan jenis
inhibisi enzim yang tidak merusak gugus fungsi dari enzim tersebut, hanya menghambat proses katalisis. Jenis inihibisi reversibel dibagi menjadi tiga jenis,
yaitu competitive, noncompetitive, dan uncompetitive. Jenis inhibisi kedua adalah
inhibisi irreversible. Jenis inhibisi ini merupakan inhibisi yang dapat merusak
struktur atau gugus fungsi dari enzim sehingga enzim tersebut menjadi tidak aktif. Mekanisme inhibisi ini merupakan mekanisme yang dimiliki oleh obat-obat tertentu seperti obat kanker (Stryer 2000). Proses inhibisi ini dapat membantu penderita diabetes melitus untuk mengurangi kadar gula darah yang tinggi dengan cara menghambat kerja enzim yang berperan membantu penyerapan karbohidrat, yaitu enzim α-glukosidase.
Enzim α-glukosidase merupakan enzim dari golongan hidrolase. Enzim ini berfungsi mengkatalisis reaksi akhir dari proses penyerapan karbohidrat di usus. Enzim ini mengkatalisis hidrolisis ikatan α-1,4 sehingga menghasilkan α -D-glukosa (Stuart et al. 2004). Terhambatnya kerja enzim α-glukosidase
menyebabkan berkurangnya glukosa yang diserap oleh usus sehingga berkurangnya sumber glukosa yang masuk ke dalam aliran darah. Peristiwa ini mampu membantu menurunkan keadaan hiperglikemia sehingga penderita diabetes dapat mengatur kadar glukosa darahnya. Saat ini banyak obat-obat yang dibuat untuk menghambat (inhibitor) kerja α-glukosidase.
Beberapa obat inhibitorenzim α-glukosidase dapat ditemukan dengan mudah seperti, acarbose, miglitol, dan voglibose. Namun, saat sekarang banyak
penelitian yang telah melaporkan bahwa banyak ekstrak tumbuhan yang berkhasiat sebagai inhibitor α-glukosidase. Salah satu penelitian melaporkan bahwa asam triterpen yang diisolasi dari daun Lagerstroemia speciosa mampu
menjadi inhibitor α-glukosidase (Wenli et al.2009). Selain itu, beberapa ekstrak
tumbuhan asal Meksiko yang mengandung kaempferol seperti Cecropia obtusifolia, Equisetum myriochaetum, Acosmium panamense, dan Malmea
6
depressa dapat menghambat kerja α-glukosidase secara in vitro dan in vivo (Cetto et al. 2008).
(a) (b) (c)
Gambar 2 Struktur Molekul Acarbose (a), Miglitol (b), Voglibose (c) Ekstraksi dan Fraksinasi Senyawa Metabolit Sekunder
Ekstraksi merupakan suatu proses yang secara selektif mengambil zat terlarut dari campuran dengan bantuan pelarut. Secara umum ekstraksi dilakukan secara berturut-turut mulai dengan pelarut nonpolar (n-heksana) lalu dengan
pelarut yang semi polar (etil asetat atau dietil eter) kemudian dengan pelarut polar (metanol dan air). Dengan demikian akan diperoleh ekstrak kasar yang mengandung berturut-turut senyawa nonpolar, semi polar dan senyawa polar. Markham (1988) menyatakan bahwa komponen yang terbawa pada proses ekstraksi adalah komponen yang berpolaritas sesuai dengan pelarutnya.
Ekstraksi terdiri dari tahap penghancuran sampel, maserasi, penyaringan dan evaporasi. Penghancuran bertujuan untuk memperkecil ukuran partikel sehingga meningkatkan kontak antara bahan dan pelarutnya. Maserasi adalah proses perendaman sampel dalam pelarut dengan waktu tertentu sehingga senyawa dalam sampel larut dalam pelarut tersebut. Evaporasi dilakukan untuk menguapkan pelarut sehingga ekstrak dapat terpisah dengan pelarutnya dan dilakukan pada 30-40 oC untuk mengurangi kerusakan senyawa aktif pada suhu tinggi. Hasil ekstraksi dipengaruhi oleh beberapa faktor, yaitu kondisi alamiah bahan alam, metode ekstraksi yang digunakan, ukuran partikel serta kondisi dan lama penyimpanan sampel.
Fraksinasi adalah proses pemisahan komponen dalam suatu ekstrak menjadi kelompok senyawa yang memiliki kemiripan karakteristik secara kimia (Rouessac & Rouessac 2007). Proses fraksinasi biasanya menggunakan kromatografi kolom, dalam pemisahan dengan kromatografi kolom ini suatu pelarut pengelusi akan
7
dialirkan secara kontinu melalui kolom dan komponen demi komponen dari campuran yang pada akhirnya akan keluar dari kolom dapat dikumpulkan.
Kromatografi kolom dilakukan dalam sebuah kolom yang diisi dengan fase diam yang berpori. Cairan digunakan sebagai fase gerak untuk mengelusi sampel keluar melalui kolom, sampel yang ditempatkan di dalam kolom akan terpisah dan digambarkan sebagai pita. Sampel akan bergerak ke bawah dengan bantuan fase gerak dan terpisah jika kekuatan interaksi antara komponen dengan fase diam berbeda, komponen-komponen akan terpisah sebagai sebuah pita.
Kromatografi lapis tipis digunakan untuk memisahkan senyawa-senyawa yang sifatnya hidrofob. Sebagai fase diam digunakan senyawa yang tak bereaksi seperti silika gel atau alumina. Silika gel biasa diberi pengikat yang dimaksudkan untuk memberikan kekuatan pada lapisan dan menambah adhesi pada gelas penyokong. Pengikat yang biasa digunakan adalah kalsium sulfat. Fase diam KLT yang digunakan biasanya silika gel. Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan angka Rf berjangka antara 0.00 dan 1.00, dan hanya dapat ditentukan dua desimal. Rf ialah angka Rf dikalikan faktor 100 (h) yang menghasilkan nilai 0 sampai 100 (Harvey 2000).
8
9
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilakukan mulai bulan November 2010 sampai dengan bulan Juni 2011 di Laboratorium Kimia Analitik Departemen Kimia FMIPA dan Laboratorium Pusat Studi Biofarmaka LPPM Institut Pertanian Bogor.
Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini meliputi alat-alat ekstraksi, neraca analitik, penguap putar, pipa kapiler, alat-alat kaca, spektrofotometer UV-Vis (Shimadzu Pharmaspec 1700 double beam), spektrofotometer inframerah (FTIR vector 33 Bruker Company, Ettlingen Germany) dan mikroplat reader.
Bahan-bahan yang digunakan meliputi daun dan buah takokak yang berasal dari Balitro Bogor, n-heksana, etil asetat, metanol, pereaksi uji flavonoid,
alkaloid, triterpenoid, steroid, saponin, tanin,KLT preparatif, enzim α-glukosidase (Sigma G 3651-250UN), p-nitrofenil α-D-glukopiranosida (PNG) (Sigma N 1377-5G), Serum Bovine Albumin (SBA), tablet akarbosa (Bayer, Jakarta-Indonesia), dan HCl 2 N.
Prosedur Penelitian
Prosedur penelitian dimulai dari pengambilan sampel Solanum torvum
Swartz di Balitro Bogor, Bagian tanaman lalu dipisahkan antara daun dan buah. Setelah itu daun dikeringkan dan dibuat dalam bentuk serbuk, sedangkan buah tanpa dikeringkan terlebih dahulu dan dilakukan penentuan kadar air. Serbuk daun diekstraksi dan buah dalam kondisi basah dihaluskan dengan mesin penggiling, kemudian diekstraksi secara bertingkat dengan cara maserasi dimulai dengan pelarut non polar (n-heksana) kemudian diekstraksi kembali dengan pelarut semi
polar (etil asetat), dan terakhir diekstraksi dengan pelarut polar (metanol dan air). Semua ekstrak yang dihasilkan diuji fitokimia, kemudian dilakukan uji aktivitas α- glukosidase. Penentuan eluen terbaik dilakukan dengan menggunakan kromatografi lapis tipis, ekstrak teraktif dipisahkan dengan kromatografi kolom silika gel, fraksi yang diperoleh diuji aktivitas inhibitor α-glukosidase sehingga
10
diperoleh fraksi teraktif. Kemudian dilakukan pemisahan lebih lanjut dengan kromatografi lapis tipis preparatif untuk mendapatkan fraksi teraktif. Hal ini bertujuan untuk mendapatkan senyawa inhibitor α-glukosidase, karakterisasi dan identifikasi senyawa dilakukan dengan menggunakan spektrofotometer UV-Vis, dan FTIR, serta uji kualitatif untuk menentukan golongan senyawanya. Prosedur penelitian dapat dilihat pada Lampiran 1−3.
Preparasi dan Ekstrak Sampel
Daun takokak berwarna hijau dikeringkan terlebih dahulu hingga kadar air kurang dari 10%. Hasil pengeringan tersebut digiling sampai berbentuk serbuk. Sedangkan untuk buah takokak yang berwarna hijau langsung dibuat serbuk dengan mesin penggiling tanpa dikeringkan terlebih dahulu. Sampel daun dan buah takokak diekstraksi secara bertingkat dengan cara maserasi dimulai dengan pelarut nonpolar (n-heksana) dan ampas yang diperoleh kemudian dimaserasi
kembali dengan pelarut semi polar (etil asetat) dan terakhir ampas dimaserasi dengan pelarut polar (metanol dan air). Semua ekstrak yang diperoleh disaring dengan menggunakan kertas saring dan dipekatkan dengan penguap putar pada suhu 40 oC kemudian rendemen tiap ekstrak dihitung.
Penentuan Kadar Air
Cawan porselin dikeringkan pada suhu 105 oC selama 30 menit. Setelah itu, didinginkan dalam eksikator. Sebanyak masing-masing 3 g serbuk daun dan buah takokak dimasukkan ke dalam cawan porselen yang berbeda dan dipanaskan dalam oven pada suhu 105 oC selama 3 jam. Setelah itu, cawan diangkat dan didinginkan dalam eksikator selama 30 menit. Cawan dengan serbuk daun dan buah takokak ditimbang hingga bobot konstan.
Kadar air (%) = A-B x 100% A
Keterangan:
A adalah bobot sampel (g)
11
Ekstraksi
Proses ekstraksi bahan aktif dilakukan dengan empat jenis pelarut dengan tingkat kepolaran yang berbeda yaitu heksana (bersifat nonpolar), etil asetat (bersifat semi polar), metanol (bersifat polar) dan air (bersifat polar). Proses ekstraksi dilakukan secara bertingkat dimulai dari pelarut heksana, etil asetat, metanol, dan air. Sebelum ekstraksi dilakukan, sampel daun yang sudah kering dijadikan serbuk dan ditimbang (± 1 kg), sedangkan buah takokak langsung dimaserasi tanpa dikeringkan terlebih dahulu dan ditimbang (± 5 kg). Kedalam sampel yang telah ditimbang ditambahkan pelarut heksana sampai terendam dan dilakukan proses maserasi selama 24 jam.
Selama proses maserasi bagian atas wadah ditutup dengan aluminium foil untuk mencegah menguapnya kandungan senyawa volatil dalam bahan dan pelarut. Setelah 24 jam, ekstrak disaring dengan menggunakan kertas saring, filtrat yang dihasilkan diuapkan dengan evaporator putar vakum hingga pelarut heksana menguap dan diperoleh ekstrak 1. Residu yang dihasilkan selanjutnya dikeringkan dan ditambah pelarut etil asetat sampai terendam dan dilakukan proses maserasi selama 24 jam. Kemudian disaring kembali dan filtrat yang dihasilkan diuapkan hingga pelarut etil asetat menguap dan diperoleh ekstrak 2. Residu yang dihasilkan selanjutnya dikeringkan dan ditambah pelarut metanol sampai terendam dan dilakukan proses maserasi selama 24 jam. Kemudian disaring kembali dan filtrat yang dihasilkan diuapkan hingga pelarut metanol menguap dan diperoleh ekstrak 3. Residu yang dihasilkan selanjutnya dikeringkan dan ditambah pelarut air sampai terendam dan dilakukan proses maserasi selama 24 jam. Kemudian disaring kembali dan filtrat yang dihasilkan diuapkan hingga pelarut menguap dan diperoleh ekstrak 4. Dari proses ekstraksi ini diperoleh ekstraksi 1 (pelarut heksana), ekstrak 2 (pelarut etil asetat), ekstrak 3 (pelarut metanol), dan ekstrak 4 (pelarut air). Diagram alir proses ekstraksi daun dan buah takokak terdapat pada Lampiran 2.
Setelah mendapatkan ekstrak, dilakukan pengukuran rendemen. Rendemen diperlukan untuk mengetahui dan membandingkan jumlah senyawa atau ekstrak yang dapat terambil oleh pelarut. Banyak ekstrak dihitung berdasarkan rumus:
12
Rendemen (%) = bobot ekstrak x 100% bobot bahan
Uji Fitokimia
Untuk mengetahui kandungan bahan aktif dari ekstrak dan fraksi aktif inhibitor α-glukosidase perlu dilakukan uji identifikasi kualitatif golongan senyawa kimia tanaman (fitokimia) yang terdapat di dalam ekstrak dan fraksi aktif tersebut. Uji fitokimia menurut Harborne (1987) meliputi uji steroid, uji tanin, uji alkaloid, uji flavonoid, dan uji saponin.
Uji Alkaloid. Sebanyak 1 g ekstrak takokak dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH kemudian disaring ke dalam tabung reaksi tertutup. Ekstrak kloroform dalam tabungreaksi dikocok dengan penambahan 10 tetes H2SO4 2 M kemudian lapisan asamnya dipindahkan ke dalam tabung reaksi yang lain. Lapisan asam ini diteteskan pada plat tetes dan ditambahkan pereaksi Mayer, Wagner, dan Dragendorf yang akan menimbulkan endapan warna berturut-turut putih, cokelat, dan merah jingga.
Uji Flavonoid. Sebanyak 1 g ekstrak takokak dari masing-masing sumber ditambahkan 100 ml air panas kemudian dididihkan selama 5 menit dan disaring. Filtrat yang diperoleh kemudian diambil sebanyak 5 mL, ditambah dengan serbuk Mg 0.05 g, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat-kuat. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Terpenoid dan Steroid. Uji ini menggunakan pereaksi Lieberman-Buchard. Pada pengujian ini, sebanyak 1 g ekstrak takokak dari masing-masing sumber dimaserasi dengan 10 mL dietil eter selama 1 jam kemudian disaring. Ke dalam filtratnya ditambahkan 3 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid serta hijau atau biru untuk steroid.
Uji Saponin. Sebanyak 1 g ekstrak takokak ditambahkan ke dalam 100 mL air panas, didihkan selama 5 menit, lalu disaring. Sebanyak 5 mL filtrat dikocok dalam tabung reaksi tertutup selama 10 detik, kemudian dibiarkan 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih stabil.
13
Uji Tanin. Sebanyak 1 g ekstrak takokak ditambahkan ke dalam 100 mL air panas kemudian didihkan selama 5 menit lalu disaring. Sebanyak 5 mL filtrat ditambah FeCl3 1 % Uji positif ditandai munculnya warna hijau kehitaman.
Penentuan Eluen Terbaik
Ekstrak pekat dari sampel ditotolkan pada pelat KLT. Setelah kering langsung dielusi dalam bejana elusi yang telah dijenuhkan oleh uap eluen pengembang. Eluen yang digunakan adalah metanol, etil asetat, kloroform, dietil eter, diklorometana, dan n-heksana, lalu dilakukan perbandingan pada eluen yang
menghasilkan spot yang banyak dan terpisah. Eluen akan diperbaiki lebih lanjut apabila pemisahan belum baik. Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Fraksinasi dengan Kromatografi Kolom (Rouessac & Rouessac 2007)
Fraksinasi dilakukan dengan pengemasan kolom untuk pemisahan 2 g ekstrak Solanum torvum dengan diameter kolom 2 cm dan tinggi kolom 30 cm.
Ekstrak dilarutkan dalam eluen terbaik yang telah diperoleh, kemudian dipisahkan dengan kolom kromatografi dengan elusi step gradient. Eluen ditampung setiap 5 mL dalam tabung reaksi dan eluat yang memiliki warna yang sama kemudian dikumpulkan dalam satu fraksi. Setiap fraksi yang diperoleh kemudian dilakukan pengujian KLT. Selanjutnya fraksi teraktif diuji dengan KLT preparatif, noda yang diperoleh kemudian dideteksi di bawah lampu UV 254 nm dan 366 nm. Uji Aktivitas α-Glukosidase (Sugiwati et al. 2006)
Sebanyak 1 mg enzim α-glukosidase dilarutkan dalam 100 mL bufer fosfat 100 mM (pH 7.0). Kemudian ditambahkan 200 mg bovin serum albumin yang telah dilarutkan dalam bufer fosfat 100 mM (pH 7.0). Sebelum digunakan sebanyak 1 mL larutan enzim tersebut diencerkan 25 kali dengan bufer fosfat (pH 7.0). Campuran reaksi terdiri atas 250 µL 20 mM p-nitrofenil α-D-glukopiranosa
sebagai substrat, 490 µL 100 mM bufer fosfat (pH 7.0), dan 10 µL larutan sampel dengan variasi konsentrasi 50, 100, 200, 400, dan 800 ppm dalam 10 µL dimetil sulfo oksida/DMSO. Campuran reaksi diinkubasi dalam penangas air pada suhu
14
37 oC selama 5 menit dan ditambahkan 250 µL larutan enzim kemudian diinkubasi lagi dalam penangas air pada suhu 37 oC selama 15 menit. Reaksi enzim dihentikan dengan penambahan 1000 µL 200 mM natrium karbonat. Hasil reaksi kemudian dibaca absorbansinya pada panjang gelombang 400 nm. Tablet akarbosa (Glucobay) dilarutkan dalam bufer dan HCl 2 N (1:1) dengan konsentrasi 1% b/v sebagai kontrol positif. Endapan dikumpulkan dengan pemusingan dan supernatannya sebanyak 20 µL dimasukkan ke dalam campuran reaksi seperti pada sampel. Hasil reaksi tersebut diukur dengan spektrofotometer UV pada panjang gelombang 400 nm. Sampel dan kontrol positif dilakukan dua kali ulangan sebagai pembanding dengan sampel yang akan diuji. Bagan alir uji inhibisi α-glukosidase dapat dilihat pada Lampiran 3.
Persentase inhibisi = K-(S1-S0) x 100
K
K= absorban kontrol negatif
S1= absorban sampel dengan penambahan enzim S0= absorban sampel tanpa penambahan enzim Identifikasi Senyawa Inhibitor α-Glukosidase
Identifikasi senyawa dilakukan terhadap fraksi teraktif dengan menggunakan spektrofotometer UV-Vis dan FTIR. Identifikasi spektrofotometer UV-Vis dilakukan untuk mengukur spektrum serapan dengan pelarut metanol, senyawa dalam sampel diukur pada panjang gelombang 200-700 nm. Identifikasi dengan menggunakan IR dilakukan dengan menimbang sebanyak ± 0.8000 mg sampel dihaluskan bersamaan dengan 0.2004 g KBr dalam mortar agat. Setelah dihaluskan dan bercampur, serbuk ini dimasukkan ke dalam alat pencetak pelat KBr, sehingga diperoleh serbuk lempeng yang transparan. Lempeng yang diperoleh dimasukkan ke dalam spektrofotometer IR.
15
HASIL DAN PEMBAHASAN
Penetapan Kadar Air
Penentuan kadar air berguna untuk mengidentifikasi kandungan air pada sampel sebagai persen bahan keringnya. Selain itu penentuan kadar air berfungsi untuk mengetahui ketahanan sampel terhadap penyimpanan. Kadar air yang baik dari suatu sampel adalah kurang dari 10% karena pada tingkat kadar air tersebut waktu simpan sampel akan relatif lebih lama dan terhindar dari pencemaran yang disebabkan oleh mikroba.
Kadar air yang diperoleh dari serbuk daun takokak dan buah takokak dalam kondisi segar yang berasal dari Balitro diperoleh masing-masing sebesar 8.83% dan 16.16%. Nilai rerata yang diperoleh artinya bahwa dalam 100 g bahan terdapat 8.83 g dan 16.16 g air. Hasil ini menunjukkan bahwa daun takokak kering dapat disimpan dalam jangka waktu yang cukup lama, sedangkan buah takokak dalam kondisi segar cukup tinggi sehingga buah takokak segar pada penelitian ini tidak baik disimpan dalam jangka waktu lama.
Hasil Ekstraksi Daun dan Buah Takokak
Metode ekstraksi yang digunakan untuk mengekstraksi sampel adalah maserasi. Adapun mekanisme metode maserasi, yaitu adanya proses difusi pelarut ke dalam dinding sel tumbuhan untuk mengekstrak senyawa-senyawa yang ada dalam tumbuhan tersebut dan senyawa yang kurang tahan terhadap panas, biasanya digunakan untuk sampel yang belum diketahui sifat dan pencirian senyawanya.
Pelarut yang digunakan untuk maserasi adalah n-heksana, etil asetat,
metanol dan air. Maserasi dilakukan sebanyak 3 kali dengan asumsi maserasi sudah tidak efektif mengekstraksi komponen tumbuhan dalam jumlah yang berarti. Ekstrak yang diperoleh selanjutnya dipekatkan untuk mengetahui persen rendemen. Pemekatan dilakukan dengan menggunakan rotary evaporator pada
suhu 40 oC untuk mencegah kemungkinan terjadinya kerusakan komponen yang terkandung dalam ekstrak, sedangkan maserasi dengan pelarut air dipekatkan dengan freeze drier. Ekstrak yang diperoleh disebut ekstrak kasar n-heksana,
16
ekstrak kasar etil asetat, ekstrak kasar metanol, dan ekstrak kasar air. Persen rendemen hasil ekstraksi dari daun takokak kering dan buah takokak segar dapat dilihat pada Tabel 1.
Penapisan Fitokimia
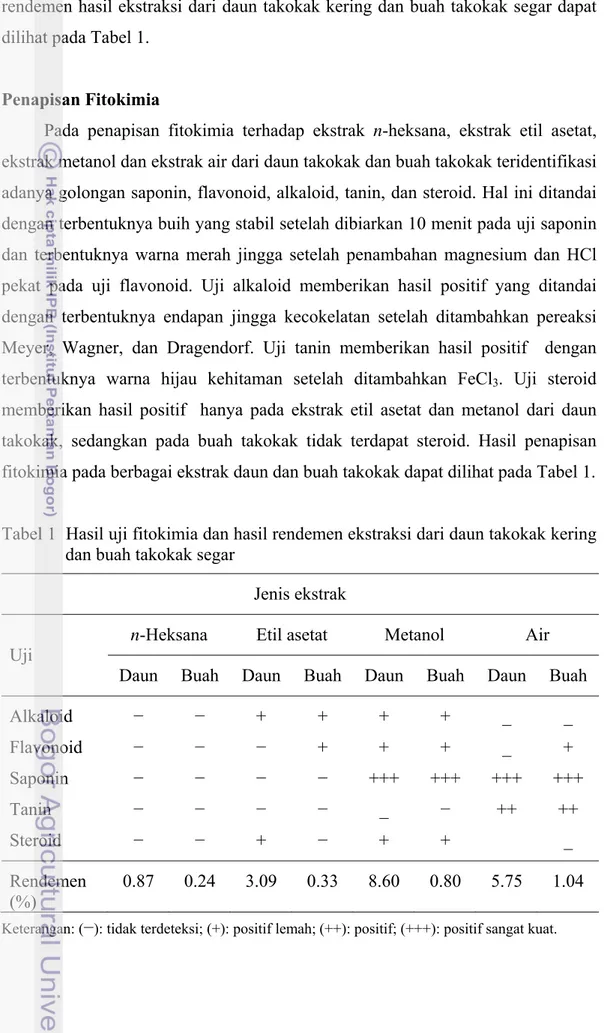
Pada penapisan fitokimia terhadap ekstrak n-heksana, ekstrak etil asetat,
ekstrak metanol dan ekstrak air dari daun takokak dan buah takokak teridentifikasi adanya golongan saponin, flavonoid, alkaloid, tanin, dan steroid. Hal ini ditandai dengan terbentuknya buih yang stabil setelah dibiarkan 10 menit pada uji saponin dan terbentuknya warna merah jingga setelah penambahan magnesium dan HCl pekat pada uji flavonoid. Uji alkaloid memberikan hasil positif yang ditandai dengan terbentuknya endapan jingga kecokelatan setelah ditambahkan pereaksi Meyer, Wagner, dan Dragendorf. Uji tanin memberikan hasil positif dengan terbentuknya warna hijau kehitaman setelah ditambahkan FeCl3. Uji steroid memberikan hasil positif hanya pada ekstrak etil asetat dan metanol dari daun takokak, sedangkan pada buah takokak tidak terdapat steroid. Hasil penapisan fitokimia pada berbagai ekstrak daun dan buah takokak dapat dilihat pada Tabel 1. Tabel 1 Hasil uji fitokimia dan hasil rendemen ekstraksi dari daun takokak kering
dan buah takokak segar
Jenis ekstrak
Uji n-Heksana Etil asetat Metanol Air Daun Buah Daun Buah Daun Buah Daun Buah
Alkaloid − − + + + + _ _ Flavonoid − − − + + + _ + Saponin − − − − +++ +++ +++ +++ Tanin − − − − _ − ++ ++ Steroid − − + − + + _ Rendemen (%) 0.87 0.24 3.09 0.33 8.60 0.80 5.75 1.04
17
Dari Tabel diatas dapat dilihat bahwa rendemen daun takokak paling tinggi diperoleh dari hasil ekstraksi dengan pelarut metanol (ekstrak metanol). Hal ini sesuai dengan pernyataan Health dan Reineccius (1987) yang menyebutkan bahwametanol mampu mengekstraksi senyawa organik, sebagian lemak serta tanin karena metanol memiliki gugus yang mampu mengikat ekstrak polar dan non polar yang menyebabkan hasil ekstraksi metanol cukup besar.
Berdasarkan hasil uji fitokimia simplisia daun takokak kering (Tabel 1) ini sama dengan yang dilaporkan Dharmayanti (2008) bahwa simplisia dari Solanum
sp. mengandung senyawa alkaloid, steroid, saponin, dan tanin. Dengan demikian, metabolit sekunder yang terkandung dalam ekstrak metanol daun Solanum torvum
diduga memiliki peran tertentu dalam menghambat aktivitas dari enzim α -glukosidase.
Uji Inhibisi α-Glukosidase Ekstrak Metanol
Uji inhibisi terhadap enzim α-glukosidase dilakukan untuk mengetahui aktivitas antihiperglikemik dari setiap ekstrak. Pada uji ini α-glukosidase akan menghidrolisis substrat p-nitrofenil-α-D-glukopiranosa menjadi p-nitrofenol yang
berwarna kuning dan glukosa dengan reaksi sebagai berikut: P-nitrofenol-α-D-glukopiranosa +
α-glukosidase P-nitrofenol α-D-glukosa Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol yang
berwarna kuning (Basuki et al. 2002). Dengan adanya ekstrak daun takokak yang
berperan sebagai inhibitor α-glukosidase maka p-nitrofenol yang dihasilkan akan
berkurang yang ditandai oleh berkurangnya intensitas warna kuning.
O O OH HO N+ -O O HO O OH HO OH N+ -O O
18
Nilai IC50 dari hasil uji inhibisi α-glukosidase ekstrak daun kering dan buah takokak segar dapat dilihat pada Tabel 2. Parameter yang digunakan untuk pengukuran aktivitas inhibitor α-glukosidase dari daun takokak adalah IC50, yaitu bilangan yang menunjukkan konsentrasi ekstrak yang mampu menghambat aktivitas inhibitor α-Glukosidase sebesar 50%.
Tabel 2 Nilai IC50 dari ekstrak daun takokak kering dan buah takokak segar
Pelarut IC50 Daun (ppm) Buah (ppm) n-Heksana − 315.44 Etil asetat − − Metanol 100 − Air Akarbose 301.28 1.096 154.98 1.096
Keterangan: IC50 adalah konsentrasi ekstrak yang mampu menghambat aktivitas inhibitor α
-glukosidase sebesar 50%; tanda − : tidak mencapai inhibisi 50% sampai konsentrasi maksimum 8000 ppm. Data absorbansi dan persen inhibisi dari ekstrak metanol daun takokak kering dapat dilihat pada Lampiran 6.
Nilai IC50 diperoleh dari persamaan kurva hubungan antara % inhibisi (sebagai sumbu y) dan konsentrasi ekstrak (sebagai sumbu x). Hasil yang diperoleh (Tabel 2) menunjukkan ekstrak daun takokak memiliki IC50 100 ppm. Nilai ini berarti ekstrak metanol daun takokak dapat menginhibisi 50% pada konsentrasi 100 ppm. Hasil uji aktivitas inhibisi α-glukosidase pada buah takokak memberikan nilai IC50 cukup besar jika dibandingkan dengan ekstrak daun takokak kering yang artinya buah takokak tidak bersifat sebagai inhibitor tetapi sebagai aktivator, sehingga buah takokak tidak digunakan untuk uji aktivitas selanjutnya.
Kontrol positif (acarbose) yang digunakan pada uji aktivitas inhibisi α- glukosidase dimulai dari konsentrasi 0.375, 0.75, 1.5, 3, dan 6 ppm memiliki IC50 sebesar 1.096 ppm. Nilai ini berarti acarbose dapat menginhibisi 50 % aktivitas α -glukosidase pada konsentrasi 1.096 ppm. Hal ini tidak berbeda jauh dengan ekstrak metanol daun takokak nilai persen inhibisinya, tetapi konsentrasi ekstrak
19
tidak sebaik kontrol positif karena IC50 ekstrak lebih besar dari pada IC50 akarbose. Data absorbansi dan nilai persen inhibisi acarbose dapat dilihat pada Lampiran 5.
Pemilihan Eluen Terbaik
Hasil pemilihan eluen terbaik yang bersifat semipolar diperoleh noda berekor sedangkan eluen polar diperoleh noda yang terpisah. Jadi eluen tunggal terbaik, yaitu butanol. Eluen campuran terdiri atas butanol-aseton (1:1, 2:1, 3:1, 4:1, 6:1, 9:1) (Gambar 2). Dari kelima perbandingan tersebut diperoleh noda yang terpisah pada butanol-aseton (1:1), sedangkan pada perbandingan lain pemisahannya kurang bagus ditandai dengan adanya noda yang berekor (Gambar 3).
Gambar 3 Penentuan eluen terbaik pada ekstrak daun takokak dengan menggunakan eluen tunggal. Keterangan: n-heksana, metanol,
kloroform, aseton, butanol, etil asetat. (Kondisi KLT: plat KLT SiO2 G60 F254, visualisasi noda: UV 254 dan 366 nm).
20
Gambar 4 Penentuan eluen terbaik dengan menggunakan eluen campuran. Keterangan: perbandingan aseton-butanol dari kiri ke kanan adalah 1:1, 4:1, 3:1, 2:1, 9:1, dan 6:1 (Kondisi KLT: plat KLT SiO2 G60 F254, visualisasi noda: UV 254 dan 366 nm).
Fraksinasi dengan Kromatografi Kolom
Fraksinasi daun takokak pada penelitian ini dilakukan dengan menggunakan kromatografi kolom. Fase diamnya adalah silika gel dan proses elusinya dilakukan secara gradien (peningkatan kepolaran). Elusi gradien dipilih agar semua senyawa yang terdapat pada daun takokak dapat difraksinasi dan terelusi ke luar kolom dengan cepat. Menurut Harvey (2000), metode step gradient (peningkatan
kepolaran) pada kromatografi kolom dapat dilakukan untuk fraksinasi komponen-komponen dalam suatu sampel agar dengan peningkatan polaritas sistem eluen, semua komponen dalam sampel tersebut akan terbawa lebih cepat ke luar kolom. Eluen n-heksana, butanol, aseton, dan air dengan berbagai komposisi pada
penelitian ini diharapkan dapat membawa semua pita-pita senyawa yang terkandung dalam daun takokak untuk ke luar kolom.
Semua fraksi dari hasil pemisahan dengan kromatografi kolom kemudian dianalisis jumlah spotnya menggunakan kromatografi lapis tipis (KLT) dengan fase diam berupa silika G60F254 dan fase geraknya menggunakan eluen terbaik yang diperoleh dari analisis menggunakan KLT sebelumnya, yaitu aseton-butanol(1:1). Hasil fraksinasi kolom diperoleh sebanyak 6 fraksi (Tabel 3).
21
Tabel 3 Rendemen hasil fraksinasi ekstrak daun takokak Fraksi Jumlah spot Nilai Rf Bobot fraksi
(g) Rendemen (%) 1 1 0.94 0.1634 4.66 2 1 0.91 1.2124 34.64 3 1 0.90 0.7151 20.43 4 2 0.93, 0.40 0.7747 22.13 5 2 0.75, 0.83 0.4069 11.62 6 1 0.60 0.1382 3.94
Aktivitas Inhibitor α-Glukosidase pada Hasil Fraksinasi
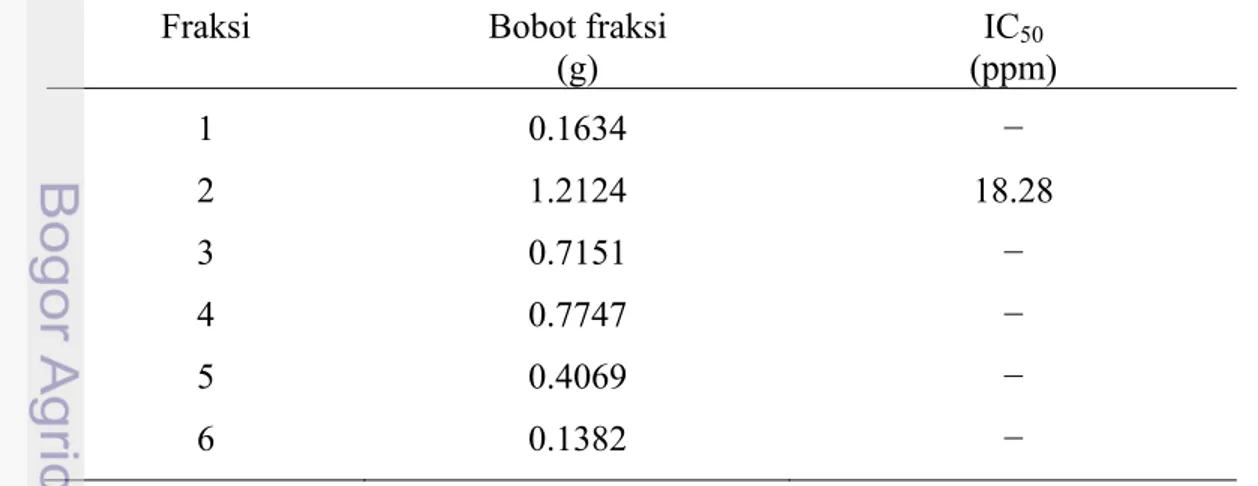
Pengujian selanjutnya dilakukan pada hasil fraksinasi dari ekstrak daun takokak. Berdasarkan pengujian terhadap ke 6 fraksi, fraksi teraktif adalah fraksi 2 dengan nilai IC50 sebesar 18.28 ppm. Nilai ini berarti bahwa ekstrak daun takokak fraksi 2 hasil fraksinasi mampu menginhibisi 50% pada konsentrasi 18.28 ppm. Nilai IC50 dari fraksi 2 yang diperoleh pada kromatografi kolom dapat dilihat pada Tabel 4. Data absorbansi dan persen inhibisi α-glukosidasi hasil fraksinasi kolom dari fraksi 2 dapat dilihat pada Lampiran 6.
Tabel 4 Nilai IC50 inhibitor α-glukosidase pada fraksi hasil kromatografi kolom Fraksi Bobot fraksi
(g) IC50 (ppm) 1 0.1634 − 2 1.2124 18.28 3 0.7151 − 4 0.7747 − 5 0.4069 − 6 0.1382 −
Hasil yang diperoleh dari pengujian ke fraksi tersebut terhadap aktivitas inhibisi enzim α-glukosidase, nilai IC50 yang diperoleh dari fraksi 1 sampai 6,
22
haya fraksi 2 yang berpotensi sebagai inhibitor α-glukosidase. Fraksi lain memiliki nilai IC50 diatas konsentrasi maksimum (-). Aktivitas ini lebih kecil dari ekstrak kasarnya yaitu IC50 = 100 ppm, hal ini di duga karena pemisahan yang terjadi pada kromatografi kolom kurang baik akibat interaksi fase diam dan fase gerak begitu kuat sehingga masih banyak senyawa yang tertinggal pada fase diam, bagian lain terpisahkan begitu cepat yang ditunjukkan oleh sedikitnya keterpisahan yang muncul pada fraksi. Selain itu tidak sempurnanya kelarutan contoh pada eluen juga di perkirakan menyebabkan pemisahan pada kolom kromatografi menjadi kurang sempurna.
Adanya aktivitas senyawa kemungkinan sifat senyawa yang jika di pisahkan dari kelompok senyawaannya maka aktivitas enzimatisnya menjadi tidak optimal atau berkurang turut menjadi kemungkinan kurang baiknya hasil pengujian. Hasil pengujian ini juga di dukung oleh Usman (2009) bahwa aktivitas antidiabetes hasil fraksinasi kolom pada buah mahkota dewa mengalami penurunan dibandingkan dengan ekstrak kasar.
Data absorbansi dan persen inhibisi α-glukosidasi hasil fraksinasi kolom dari fraksi 2 dapat dilihat pada Lampiran 6.
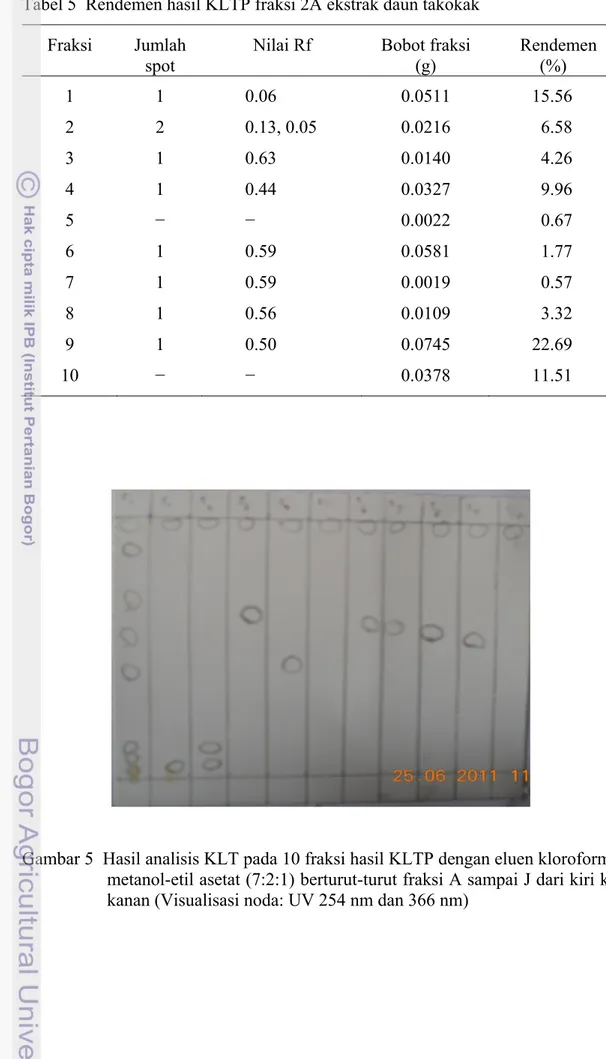
Hasil Kromatografi Lapis Tipis Preparatif (KLTP)
Fraksi 2 sebagai fraksi teraktif hasil fraksinasi daun takokak dimurnikan lebih lanjut dengan menggunakan KLTP. Pemisahan dengan KLTP menggunakan eluen kloroform-metanol-etil asetat (7:2:1) sebagai eluen terbaiknya. Pemisahan ini menggunakan adsorben silika gel. Berdasarkan pemisahan yang dilakukan diperoleh 10 fraksi. Selanjutnya, dilakukan analisis KLT dari 10 fraksi (2A-2J). Noda terlihat pada Gambar 5. Noda yang terbentuk dapat dideteksi dengan sinar UV pada panjang gelombang 254 nm dan 366 nm. Nilai Rf dan rendemen hasil KLTP dapat dilihat pada Tabel 5.
23
Tabel 5 Rendemen hasil KLTP fraksi 2A ekstrak daun takokak Fraksi Jumlah
spot
Nilai Rf Bobot fraksi (g) Rendemen (%) 1 1 0.06 0.0511 15.56 2 2 0.13, 0.05 0.0216 6.58 3 1 0.63 0.0140 4.26 4 1 0.44 0.0327 9.96 5 − − 0.0022 0.67 6 1 0.59 0.0581 1.77 7 1 0.59 0.0019 0.57 8 1 0.56 0.0109 3.32 9 1 0.50 0.0745 22.69 10 − − 0.0378 11.51
Gambar 5 Hasil analisis KLT pada 10 fraksi hasil KLTP dengan eluen kloroform-metanol-etil asetat (7:2:1) berturut-turut fraksi A sampai J dari kiri ke kanan (Visualisasi noda: UV 254 nm dan 366 nm)
24
Aktivitas Inhibitor α-Glukosidase pada Hasil KLTP
Selanjutnya hasil KLTP fraksi 2A-2J diuji aktivitas inhibitor α -glukosidasenya. Uji aktivitas inhibitor α-glukosidase menunjukkan bahwa fraksi 2A memiliki aktivitas inhibitor α-glukosidase. Nilai IC50 fraksi 2A sebesar 67.02 ppm. Hasil IC50 hasil KLTP lebih besar dari nilai IC50 hasil kolom sebesar 18.28 ppm, dapat disimpulkan bahwa fraksi hasil pemisahan dapat meningkatkan kemampuan fraksi dalam menghambat α-glukosidase. Nilai IC50 hasil KLTP (Tabel 6). Data absorbansi Persen inhibisi hasil KLTP dari fraksi 2A dapat dilihat pada Lampiran 7
Tabel 6 Nilai IC50 Inhibitor α-glukosidase pada fraksi hasil KLTP Fraksi Bobot fraksi
(g) Inhibitor α-glukosidase A 0.0511 67.02 B 0.0216 − C 0.0140 − D 0.0327 − E 0.0022 − F 0.0581 − G 0.0019 − H 0.0109 − I 0.0745 − J 0.0378 −
Berdasarkan pengujian aktivitas inhibitor α-glukosidase menunjukkan dari awal ekstrak, hasil fraksinasi kolom, dan hasil fraksinasi KLTP bahwa nilai IC50 memiliki data yang fluktuatif, hal ini dimungkinkan eluen terbaik yang digunakan berbeda, untuk ekstrak kasar dan fraksinasi kolom menggunakan eluen aseton:butanol (1:1), hasil fraksinasi KLTP menggunakan eluen kloroform:metanol:etil asetat (7:2:1) dan dipengaruhi oleh senyawa metabolit sekunder yang berpotensi sebagai inhibitor α-glukosidase.
25
Uji Fitokimia Lanjutan
Pengujian fitokimia lanjutan pada fraksi 2A bertujuan mengetahui senyawa metabolit sekundernya. Berdasarkan uji yang dilakukan diketahui bahwa fraksi 2A mengandung senyawa flavon. Hasil ini berdasarkan warna noda pada sinar tampak adalah kuning pucat dan berwarna coklat tua ketika dilihat dengan sinar UV. Ketika diuapi dengan amonia, warna yang terbentuk adalah kuning kunyit. Hal ini menandakan bahwa fraksi 2A merupakan senyawa golongan flavonoid (Harborne 1987).
Analisis Spektrofotometer UV-Vis
Fraksi 2A yang diperoleh dari hasil KLTP dianalis dengan menggunakan spektrofotometer UV-VIS. Hasil analisis ini menunjukkan fraksi 2A KLTP sebagai fraksi teraktif memiliki panjang gelombang maksimum pada 326.6 nm. Hasil tersebut menunjukkan terjadinya transisi π-π* yang dihasilkan dari kromofor C=O dan C=C (Sudjadi 1985). Menurut Harborne (1987), kisaran panjang gelombang maksimum 330-350 nm merupakan senyawa flavon. Hasil ini semakin menguatkan bukti bahwa fraksi 2A merupakan senyawa flavon. Spektrum UV-VIS fraksi 2A dapat dilihat pada Lampiran 8.
Analisis Spektrofotometer FTIR
Berdasarkan spektrum inframerah fraksi teraktif (Lampiran 12) terdapat uluran –OH pada serapan 3378.24 cm-1, regangan C-H pada 2932.13 cm-1, nada lipat aromatik pada bilangan gelombang 2097.03 cm-1, gugus C=O pada serapan 1701.26 cm-1, tekukan aromatik pada 1651.25-1603.95 cm-1, pada bilangan gelombang 1384.07 cm-1 terdapat tekukan O-H, dan terakhir regangan C-O eter siklik terdapat pada bilangan gelombang 1069.68 cm-1 (Tabel 8). Berdasarkan data spektrum FTIR maka diduga bahwa dalam fraksi 2A mengandung senyawa flavon. Spektrum FTIR fraksi 2A dapat dilihat pada Lampiran 9.
26
Tabel 7 Hasil absorpsi inframerah gugus fungsi fraksi 2A pada ekstrak metanol daun takokak kering
Bilangan gelombang (cm-1)
Dugaan gugus fungsi Kisaran bilangan gelombang (cm-1)
3378.24 Regangan –OH 3650-3300**
2932.13 Regangan C-H alifatik 3600-2500* 2097.03 Nada lipat aromatik 2273-2000*
1701.26 Regangan C=O 1870-1540*
1651.25-1603.95 Tekukan aromatik 1900-1550**
1384.07 Tekukan –O-H 1425-1350**
1069.68 Regangan C=O eter siklik 1200-1150**
27
SIMPULAN DAN SARAN
Simpulan
Ekstrak metanol daun takokak kering memiliki sifat sebagai inhibitor α -glukosidase dengan nilai IC50 sebesar 100 ppm. Hasil fraksinasi diperoleh 6 fraksi) dan fraksi 2 adalah fraksi teraktif dengan nilai IC50 18.28 ppm. Fraksinasi lanjut diperoleh fraksi 2A dari 10 fraksi yang memiliki aktivitas inhibitor α -glukosidase terbaik (IC50 67.02 ppm). Hasil KLT uji fitokimia, UV-Vis, dan FTIR pada fraksi 2A menunjukkan senyawa yang aktif sebagai inhibitor α-glukosidase adalah kelompok flavon.
Saran
Perlu dilakukan proses pemurnian lebih lanjut untuk memperoleh senyawa murni yang bersifat sebagai inhibitor α-glukosidase, uji karakteristik dengan LC-MS dan spektroskopi NMR untuk menentukan suatu senyawa secara kuantitatif, serta uji in vivo sebagai antidiabetes.
28
29
DAFTAR PUSTAKA
Αlfarabi M. 2010. Kajian antidiabetogenik ekstrak daun sirih merah (Piper crocatum) in vitro [tesis]. Bogor: FMIPA IPB.
Amador P, Ocotero V, Castaneda JM, Esquinca AR. 2007. Alkaloid in Solanum torvum Sw. Journal of Experimental Botani 76: 39-45.
Basuki T, Indah DD, Nina A, Kardono LBS. 2002. Evaluasi aktivitas daya hambat enzim α-glukosidase dari ekstrak kulit batang, daun, bunga, dan buah kemuning [Murraya Paniculata (L.) Jack.]. Prosiding Seminar Nasional Tumbuhan Obat Indonesia XXI; Surabaya, 27-28 Maret 2002. Surabaya:
Fakultas Farmasi Universitas Surabaya. hlm 314-318.
Cetto AA, Jimenez JB, Vazquez RC. 2008. α-Glucosidase inhibiting activity ofsome Mexican plants used in the treatment of type 2 diabetes. Journal ofEthnopharmacology 117:27-32.
Colthup NB, Daly LD, Wilberly SE. 1975. Introduction to infrared and Raman spectroscopy. 2nd edition. New York: Academic Press.
Dharmayanti N. 2008. Isolasi dan identifikasi inhibitor topoisomerase 1 daun tanaman pesisir terong pungo (Solanum sp.) [tesis]. Bogor: FMIPA IPB.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata, I Sudiro, penerjemah. Bandung: Institut
Teknologi Bandung. Terjemahan dari Phytochemical Method.
Hartika R. 2009. Aktivitas inhibisi α-glukosidase ekstrak senyawa golongan flavonoid buah mahkota dewa [skripsi]. Bogor: FMIPA IPB.
Harvey D. 2000. Modern Analytical Chemistry. Toronto: The McGraw-Hill.
Hembing. 2006. Sehat dengan takokak (Solanum torvum Swartz). http://www.suarakarya-online.com/news. [5 Nopember 2010].
Hutapea JR. 2000. Inventaris Tanaman Obat Indonesia, (1) Jilid 1, Departemen
Kesehatan RI, Jakarta. hlm 215-216.
Kusirisin W, Jaikang C, Chaiyavasut, Narongchai P. 2009. Effect of polyphenolic compounds from Solanum torvum on plasma lipid peroxidation, superoxide
anion and cytochrome P450 2EI in human liver microsomes. Journal Medicinal Chemistry 5:583-588.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K,
penerjemah. Bandung: Institut Teknologi Bandung. Terjemahan dari
30
Pavia DL, Lampman GM, Kriz GS. 1996. Introduction of spectroscopy-a guide for student of organic chemistry. Ed-2. Saunders College Publishing. Philadelpia.
Rouessac F, Rouessac A, 2007. Chemical analysis modern instrumentation methods and techniques 2nd. USA: John Wiley & Sons, Ltd.
Suarsana I, Priosoeryanto P, Bintang M, Wresdiyati T. 2008. Aktivitas daya hambat enzim α-glukosidase dan efek hipoglikemik ekstrak tempe pada tikus diabetes. Jurnal Veteriner 9:122-127.
Sugiwati S, Kardono L, Bintang M. 2006. Α-Glucosidase inhibitor activity and hypoglycemic effect of Phaleria macrocarpa fruit pericarp extract by oral
administration to rats. Journal of Applied Sciences 6:2312-2316.
Sutedja L. 2003. Bioprospecting tumbuhan obat Indonesia sebagai sediaan fitofarmaka antidiabetes. Laporan Kemajuan Tahap II Riset Unggulan
Terpadu, Pusat Penelitian Kimia LIPI.
Stevanie. 2007. Telaah kandungan kimia ekstrak n-heksana buah takokak
(Solanum torvum Swartz) [skripsi]. Bandung: Jurusan Farmasi FMIPA ITB.
Stryer L. 2000. Biokimia Edisi ke 4. Sadikin M et al., penerjemah; Soebianto
S,Setiadi E, editor. Jakarta: EGC. Terjemahan dari Biochemistry.
Stuart AR, Gulve EA, Wang M. 2004. Chemistry and biochemistry of type 2 diabetes. Chemical Reviews 104:1255-1282.
The Expert Committee on the diagnosis and classification of diabetes mellitus. 2003. Report of the expert committee on the diagnosis and classification of diabetes melitus. Diabetes Care 26 (Suppl 1): 5-20.
Usman F. 2009. Isolasi fraksi flavonoid sebagai inhibitor enzim α-glukosidase dari buah mahkota dewa. [Skripsi]. Bogor: FMIPA IPB
Wenliet al. 2009. Triterpene acid isolated from lagerstroemia Speciosa leaves as α-glukosidase inhibitors. Phytotherapy Research 23:614-618.
Yuanyuan LU, Jianguang L, Xuefeng H, Lingyi K. 2009. Four streoidal glycosides from Solanum torvum and their cytotoxic activities. Steroids
32
Lampiran 1 Diagram alir metode penelitian daun dan buah takokak (Solanum torvum) Ekstrak kasar Uji α-Glukosidase Ekstrak Aktif Fraksinasi ekstrak aktif dengan kromatografi kolom
Fraksi ekstrak aktif/spot tunggal
Uji α-Glukosidase
Fraksi aktif inhibitor
α-Glukosidase
Fraksinasi dengan KLTP
Seyawa inhibitor
α-Glukosidase
Identifikasi dengan UV-Vis dan FT-IR Serbuk kering daun dan buah takokak
Ekstraksi sampel dengan pelarut nonpolar, semi polar, dan polar
Uji Fitokimia
33
Lampiran 2 Diagram alir proses ekstraksi daun dan buah takokak
Sampel daun dan buah takokak Maserasi dengan n-heksana Filtrat Residu Maserasi dengan etil asetat Ekstrak n-heksana Filtrat Residu Ekstrak etil asetat Maserasi dengan metanol Filtrat Residu Ekstrak metanol Maserasi dengan air Ekstrak air Filtrat Residu Evaporasi Evaporasi Evaporasi Evaporasi
34
Lampiran 3 Diagram alir uji aktivitas inhibitor α-glukosidase
Substrat + ekstrak (50, 100, 200,400, dan 800 ppm) + 25 µL larutan enzim + 100 µL 200 mM Na2CO3 Diukur dengan λ = 400 nm
Diinkubasi pada suhu 37 oC selama 5 menit
35
Lampiran 4 Hasil kadar air daun takokak kering (a) dan buah takokak segar (b)
a) Daun takokak kering Ulangan Bobot cawan kosong (g) Bobot contoh awal (g) Bobot contoh kering (g) Bobot contoh kering + cawan (g) 1 2,0645 3,0014 2,5721 4,6366 2 2,0484 3,0045 2,4698 4,5182 3 2,0338 3,0046 2,5124 4,5462 b) Buah takokak segar
Ulangan Bobot cawan kosong (g) Bobot cawan awal (g) Bobot contoh kering (g) Bobot contoh kering + cawan (g) 1 2,0072 3,0025 2,7437 4,7509 2 1,9751 3,0014 2,7393 4,7144 3 1,9567 3,0041 2,7290 4,6857
36
Lampiran 5 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari ekstrak metanol daun takokak
Konsentrasi acarbosa (ppm) Konsentrasi sampel (%) Absorbansi
S1 Absorbansi S0 Absorbansi S1-S0 Inhibisi %
0.375 0.005 1.0155 0.204 0.946 37.1845 0.75 0.01 0.8965 0.268 0.8775 41.7330 1.5 0.02 0.958 0.372 0.5855 61.1122 3 0.04 1.1455 0.573 0.3255 78.3864 6 0.08 1.149 0.883 0.1305 91.3346 Kontrol 1.614 0.108 1.506
Contoh perhitungan % inhibisi dari ekstrak metanol daun takokak: % Inhibisi = [ ( C- S ) ] / C x 100
% Inhibisi pada konsentrasi 0.375% = [ (1.506–0.946)/ 1.506] x 100 = 37.1845% Keterangan:
C = kontrol (K) S = (S1-S0)
S1 = sampel dengan penambahan enzim S0 = sampel tanpa penambahan enzim
37
Lampiran 5 (lanjutan)
Kurva % inhibisi vs konsentrasi ekstrak metanol
Persamaan garis regresi sebagai berikut: Y= 21.54 ln (x) + 148.9 50 – 148.9 = 21.54 ln (x) -98.9 = 21.54 ln (x) Ln (x) = -98.9/ 21.54 Ln (x) = -4.59 = 0.010 % Jadi IC50 = 100 ppm y = 21.54 lnx + 148.9 R² = 0.995 0 20 40 60 80 100 120 0 0.02 0.04 0.06 0.08 0.1 % inhibisi Konsentrasi (%)
38
Lampiran 6 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari fraksinasi daun takokak
Konsentrasi Acarbosa (ppm) Konsentrasi sampel (%) Absorbansi
S1 Absorbansi S0 Absorbansi (S1-S0) inhibisi %
0.375 0.005 2.0735 0.937 1.1365 58.3318 0.75 0.01 1.2055 0.2 1.0055 63.1347 1.5 0.02 1.4885 0.529 0.9595 64.8212 3 0.04 1.1775 0.294 0.8835 67.6076 6 0.08 3.019 2.137 0.882 67.6627 Kontrol 3.074 2.381 2.7275
Kurva % Inhibisi vs Hasil Fraksinasi Kolom
Persamaan garis regresi sebagai berikut: Y = 5.166 ln ( x ) + 82.57 50 = 5.166 ln ( x ) + 82.57 50 – 82.57 = 5.166 ln ( x) -32.57 = 5.166 ln (x) ln (x) = -6.3046/5.166 = 0.00182 % Jadi IC50 = 18.2 ppm y = 5,166 lnx + 82,57 R² = 0.578 0 10 20 30 40 50 60 70 80 0 0.02 0.04 0.06 0.08 0.1 Persen inhibisi Konsentrasi (%)
39
Lampiran 7 Data absorbansi dan persen inhibisi hasil uji inhibisi α-glukosidase in vitro dari hasil KLTP daun takokak
Konsentrasi Acarbosa (ppm) Konsentrasi sampel (%) Absorbansi
S1 Absorbansi S0 Absorbansi (S1-S0) inhibisi %
0.375 0.005 0.891 0.149 0.742 49.3860 0.75 0.01 0.71 0.185 0.525 64.1882 1.5 0.02 0.803 0.367 0.436 70.2592 3 0.04 1.089 0.654 0.435 70.3274 6 0.08 0.626 0.24 0.386 73.6698 Kontrol 1.59 0.124 1.466 Kurva % inhibisi vs hasil KLTP
Persamaan garis regresi sebagai berikut: Y = 12.403 ln (x) + 112.08 50 = 12.403 ln (x) + 112.08 50-112.08 = 12.403 ln (x) -62.08 = 12.403 ln (x) Ln (x) = -62.08/12.403 = 0.0067 % Jadi IC50 = 67 ppm y = 12.403 lnx + 112.08 R² = 0.8464 0 10 20 30 40 50 60 70 80 90 0 0.02 0.04 0.06 0.08 0.1 % inhibisi Konsentrasi (%)
40
Lampiran 8 Spektrum UV-Vis fraksi 2A hasil KLTP ekstrak daun takokak
41
Lampiran 9 Spektrum FTIR hasil fraksi 2A daun takokak
Panjang Gelombang (cm-1)
Puncak Dasa
r
(%