SEL DARAH MERAH, ANTIBAKTERI DAN ANTIOKSIDAN
BENNY MANULLANG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Aktivitas Ekstrak Kelinci Laut (Dolabella auricularia) sebagai Inhibitor α-glukosidase, Stabilisator sel darah merah, Antibakteri dan Antioksidan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
sebagai Inhibitor α-glukosidase, Stabilisator Sel Darah Merah, Antibakteri dan Antioksidan. Dibimbing oleh SRI PURWANINGSIH dan AZRIFITRIA.
Dolabella auricularia dikenal dengan nama kelinci laut merupakan salah satu spesies laut yang tergolong ke dalam gastropoda, Dolabella disebut sebagai kelinci laut memiliki rhinoporus yang bentuknya menyerupai telinga pada kelinci. Penelitian ini bertujuan untuk menggali potensi aktivitas komponen bioaktif kelinci laut melalui karakterisasi kelinci laut; karakterisasi ekstrak kelinci laut dan pengujian aktivitas inhibitor α-glukosidase, stabilisator sel darah merah, antibakteri dan antioksidan secara in vitro. Karakteristik kelinci laut meliputi identifikasi; pengamatan morfometrik dan karakterisasi kimia kelinci laut, sedangkan karakteristik ekstrak kelinci laut meliputi rendemen ekstrak; deskripsi ekstrak dan skrining komponen aktif secara kualitatif. Aktivitas bioaktif diukur secara in vitro meliputi antidiabetes dengan metode inhibisi α-glukosidase, antiinflamasi dengan metode stabilisasi membran sel darah merah, antibakteri dengan metode difusi agar dan antioksidan dengan metode DPPH.
Hasil identifikasi menunjukkan bahwa kelinci laut memiliki sepasang tentakel yang terdapat pada bagian dorsal. Pada bagian ventral kelinci laut
terdapat cangkang yang menutupi kelenjar tinta. Rata-rata panjang total 11.12± 1.02 cm, diameter 3.7±0.51 cm dan berat total 81.41±19.29 g. Kadar air,
protein, lemak, abu dan karbohidrat dari daging kelinci laut berturut-turut 62.11±2.19%, 12.49±0.34%, 0.87±0.55%, 23.02±3.23% dan 1.52±0.83%. Asam amino esensial (arginina, leusina, valina, treonina, I-leusina, penilalanina, lisina, metionina, histidina) asam amino non esensial (glisina, asam aspartate, alanina, serina, tirosina). Total asam lemak jenuh 5.33% (b/b), MUFA 2.11% (b/b), PUFA 4.1% (b/b). Kalsium 68100 mg/kg, kalium 10000 mg/kg, magnesium 7600 mg/kg, natrium 8200 mg/kg, timbal <1.25 mg/kg, kadmium <0.24 mg/kg dan fosfor 1200 mg/kg.
Rendemen ekstrak dari seluruh bagian tubuh kelinci laut adalah ekstrak metanol (1.54±0.01%) dan ekstrak etil asetat (1.34±0.02%). Semua ekstrak memiliki karakteristik bentuk pasta dan berbau amis. Warna ekstrak metanol dan ekstrak etil asetat adalah hijau kecoklatan dan hijau gelap. Ekstrak etil asetat
memiliki kandungan fitokimia (steroid, tanin, saponin), aktivitas inhibitor
α-glukosidase (IC50 = 25.765 mg/mL), aktivitas stabilisasi sel darah merah
(IC50 = 10.741 mg/mL), aktivitas antioksidan (IC50 = 614.25 mg/mL) dan aktivitas
antibakteri ekstrak metanol memiliki zona hambat 0.60 mm pada konsentrasi 0.1 mg.
BENNY MANULLANG. Activities of Sea Hare Extract (Dolabella auricularia) as an Inhibitor α-glucosidase, Stabilizer of Red Blood Cells, Antibacterial and Antioxidant. Supervised by SRI PURWANINGSIH and AZRIFITRIA.
Dolabella auricularia, also known as sea hare, is a marine gastropods. It has rhinophores which resemble rabbit ears. This research aims to explore the potential of the bioactive compounds of the species through characterizations of sea hare and its extracted compound to identify invitro inhibitor α- glucosidase activity, stabilization of red blood cells activity, antibacterial activity and antioxidant activity. Characterization of sea hare includes identification, morphometric observation, and proximate analysis, meanwhile characterization of the sea hare extract includes extract yield, extract description and qualitative screening of bioactive compounds. Furthermore, alpha-glucosidase inhibition testing was conducted for antidiabetic activity, red blood cell membrane stability test for anti-inflammatory activity, agar diffusion testing for antibacterial activity and DPPH test for antioxidant activity.
The identification showed that the sea hare had a pair of tentacles on the dorsal. It had a shell that covers the ink glands on the ventral. It had an average total length of 11.12± 1.02 cm, the diameter of 3.7±0.51 cm and the average weight was 81.41±19.29 g. Moisture, protein, fat, ash, and carbohydrate content were 62.11±2.19%, 12.49±0.34%, 0.87±0.55%, 23.02±3.23% and 1.52±0.83% respectively. The Essential amino acids consisted of arginine, leucine, valine, threonine, I-leucine, phenylalanine, lysine, methionine, histidine. The non-essential amino acids consisted of glycine, aspartic acid, alanine, serine, tyrosine. Total saturated fatty acids at 5.33% (g / 100g), MUFA at 2.11% (g/ 100g), PUFA at 4.1% (g/100g). Calcium at 68100 mg/kg, potassium at 10000 mg/kg, magnesium at 7600 mg/kg, sodium at 8200 mg/kg, lead less than 1.25 mg/kg, cadmium less than 0.24 mg/kg and phosphorus at 1200 mg/kg.
The methanol extraction yield of all parts of the sea hare was 1.54±0.01% and ethyl acetate extract was 1.34±0.02%. All the extracts had pasta texture and fishy smell. The colour of methanol extract was brownish-green while the ethyl acetate extract was dark green. The ethyl acetate extracts contained phytochemicals (steroids, tannins, saponins), Inhibitor α-glukosidase activity (IC50 = 25.765 mg/mL), Stability of red blood cells activity (IC50 = 10.741
mg/mL), antioxidant activity (IC50 = 614.25 mg/mL), and antibacterial activity
methanol extracts had inhibition zone 0.60 mm on the concentration 0.1 mg.
©
Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
DARAH MERAH, ANTIBAKTERI DAN ANTIOKSIDAN
BENNY MANULLANG
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala rahmat dan karunia-Nya sehingga tesis dengan judul “Aktivitas Ekstrak Kelinci Laut (Dolabella auricularia) sebagai Inhibitor α-glukosidase, Stabilisator Sel Darah Merah, Antibakteri dan Antioksidan” ini dapat diselesaikan. Terima kasih penulis ucapkan kepada seluruh pihak yang telah berkenan membantu dalam penyelesaian tesis ini. Ucapan terima kasih ini terkhusus penulis sampaikan kepada
1 Prof Dr Ir Sri Purwaningsih, M.Si dan Dr Azrifitria M.Si, Apt sebagai ketua dan anggota komisi pembimbing atas kesediaan dan kesabarannya dalam membimbing dan memberikan arahan dan masukan dalam proses penyelesaian tesis ini sehingga dapat selesai dengan baik.
2 DR Kustiariyah, S.Pi M.Si selaku dosen penguji luar komisi dan Prof Dr Ir Linawati Hardjito, MS selaku wakil gugus kendali mutu THP atas masukan serta saran dalam proses penyempurnaan tesis ini.
3 Orang tua dan keluarga tercinta untuk kasih sayang serta dukungan moril dan materil selama penyelesaian tesis ini.
4 Ketua Departemen dan Ketua Program Studi yang tak henti dalam memberikan dukungan moril serta saran dan nasehat selama penulisan tesis ini.
5 UTD PMI Bogor dan PMI DKI Jakarta atas bantuan dan dukungannya selama proses penelitian.
6 Laboran dan teman-teman dari Program Studi Farmasi FKIK UIN Syarif Hidayatullah yang telah membantu selama penelitian di FKIK UIN Syarif Hidayatullah.
7 Teman-teman kuliah dan seluruh tim Basecamp THP atas motivasi, persahabatan, kekeluargaan dan canda tawa yang telah dilalui bersama kiranya silaturahmi ini dapat terus terjalin.
8 Seluruh pihak yang membantu doa dan dukungan sehingga tesis ini dapat selesai dengan baik.
Semoga tesis ini membawa manfaat bagi kemajuan ilmu pengetahuan khususnya dalam bidang perikanan dan kelautan.
Bogor, Desember 2016
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE PENELITIAN 3
Waktu dan Tempat 3
Bahan dan Alat 3
Prosedur Penelitian 4
Rancangan Percobaan 13
3 HASIL DAN PEMBAHASAN 14
Karakteristik Kelinci Laut 14 Identitas kelinci laut 14 Morfometrik kelinci laut 15 Karakterisasi kimia daging kelinci laut 15 Komposisi kimia daging kelinci laut 15 Kandungan asam amino daging kelinci laut 16 Kandungan asam lemak daging kelinci laut 17 Kandungan mineral daging kelinci laut 19 Karakteristik Ekstrak Kelinci laut 20 Rendemen ekstrak kelinci laut 20 Deskripsi ekstrak kelinci laut 21 Aktivitas Komponen Bioaktif Kelinci Laut 21 Uji fitokimia ekstrak kelinci laut 21 Aktivitas inhibitor α-glukosidase ekstrak kelinci laut 22 Aktivitas stabilisator sel darah merah ekstrak kelinci laut 25 Aktivitas antibakteri ekstrak kelinci laut 27 Aktivitas antioksidan ekstrak kelinci laut 29 Aktivitas komponen bioaktif ekstrak kelinci laut 31
4 SIMPULAN DAN SARAN 32
DAFTAR PUSTAKA 33
LAMPIRAN 37
α
2 Morfometrik kelinci laut 15
3 Komposisi kimia daging kelinci laut 15 4 Kandungan asam amino kelinci laut 16 5 Skor kimia asam amino esensial kelinci laut 17 6 Kandungan asam lemak kelinci laut 18 7 Kandungan mineral kelinci laut 19 8 Rendemen ekstrak kelinci laut 20 9 Deskripsi ekstrak kelinci laut 21 10 Hasil uji fitokimia pada kelinci laut 21 11 Aktivitas antibakteri ekstrak metanol kelinci laut 28 12 Aktivitas komponen bioaktif ekstrak kelinci laut 32
DAFTAR GAMBAR
1 Diagram alir penelitian 4
2 Kelinci laut 14
3 Ekstrak kelinci laut 20
4 Aktivitas inhibitor α-glukosidase ekstrak kelinci laut 23 5 Aktivitas inhibitor α-glukosidase ekstrak etil asetat kelinci laut 23 6 Hubungan antara konsentrasi ekstrak etil asetat kelinci laut
dengan persentase inhibisi α-glukosidase 24 7 Hubungan antara kosentrasi glucobay dengan presentase
Inhibisi α-glukosidase 24
8 Aktivitas stabilisator sel darah merah ekstrak kelinci laut 25 9 Aktivitas stabilisator sel darah merah ekstrak etil asetat kelinci laut 26 10 Hubungan antara konsentrasi ekstrak etil asetat dengan persentase
stabilitas sel darah merah 26
11 Hubungan antara konsentrasi ekstrak Na diklofenak
dengan persentase stabilitas sel darah merah 27 12 Aktivitas antibakteri ekstrak kelinci laut 28 13 Aktivitas antioksidan ektrak kelinci laut 29 14 Aktivitas antioksidan ekstrak etil asetat kelinci laut 30 15 Hubungan antara konsentrasi ekstrak etil asetat kelinci laut
dengan persentase inhibisi radikal bebas DDPH 30 16 Hubungan antara konsentrasi vitamin C dengan persentase inhibisi
Radikal bebas DDPH 31
DAFTAR LAMPIRAN
8 Aktivitas inhibitor α-glukosidase etil asetat kelinci laut 44 9 Normalitas inhibitor α-glukosidase ekstrak etil asetat kelinci laut 45 10 Homogenitas inhibitor α-glukosidase ekstrak etil asetat kelinci laut 45 11 Sidik ragam inhibitor α-glukosidase ekstrak etil asetat kelinci laut 45 12 Uji Duncan inhibitor α-glukosidase ekstrak etil asetat kelinci laut 45 13 Aktivitas inhibitor α-glukosidase Glucobay 46 14 Aktivitas stabilisator sel darah merah ekstrak kelinci laut 46 15 Aktivitas stabilisator sel darah merah ekstrak etil asetat kelinci laut 47 16 Normalitas aktivitas stabilisator sel darah merah ekstrak etil asetat 47 17 Homogenitas aktivitas stabilisator sel darah merah ekstrak etil asetat 47 18 Sidik ragam aktivitas stabilisator sel darah merah ekstrak etil asetat
kelinci laut 48
19 Uji Duncan aktivitas stabilisator sel darah merah ekstrak etil asetat
kelinci laut 48
1
PENDAHULUAN
Latar Belakang
Keanekaragaman sumberdaya laut Indonesia merupakan salah satu kekayaan alam yang sangat besar manfaatnya terutama bagi peningkatan ekonomi masyarakat, besarnya biodiversitas yang terdapat dalam perairan laut Indonesia berpotensi besar baik dalam peningkatan kebutuhan pangan maupun dalam penggalian sebagai bahan baku dalam bidang farmasinya. Sukara dan Tobing (2008) menyatakan bahwa posisi dan letak wilayah perairan Indonesia yang strategis menjadikan wilayah perairan Indonesia memiliki biota-biota khas dan beraneka ragam yang berpotensi dalam pengembangan berbagai bidang salah satunya bidang kesehatan.
Pencarian dan penelitian zat aktif dari berbagai biota semakin banyak dilakukan, hal ini tidak terlepas dari besarnya manfaat yang didapatkan dari komponen bioaktif tersebut dalam penurunan permasalahan yang diderita oleh masyarakat salah satunya adalah diabetes. Pola hidup yang tidak sehat sering kali menjadi faktor semakin bertambahnya penderita penyakit ini, selain itu dengan semakin banyaknya penemuan zat aktif yang terdapat dari biota dapat dimanfaatkan dalam berbagai hal lainnya seperti antibakteri, antiinflamasi serta dapat dimanfaatkan sebagai antioksidan.
Biota laut yang banyak terdapat di perairan Indonesia serta dapat dimanfaatkan zat aktifnya salah satunya adalah golongan gastropoda. Gastropoda merupakan organisme yang sangat banyak tersebar baik di perairan maupun di daratan, golongan ini banyak dikonsumsi oleh masyarakat, serta diyakini memiliki manfaat yang sangat besar dalam menambah stamina tubuh. Penelitian tentang gastropoda telah banyak dilakukan diantaranya adalah Pringgenies (2009) menyatakan bahwa gastropoda jenis Conus murriculatus memiliki metabolit sekunder yang dapat menghambat pertumbuhan bakteri MDR (Multi Drug Resisten), penelitian Anand et al. (2010) yang menyatakan bahwa ekstrak gastropoda laut Pleuropoca trapezium dengan menggunakan metanol memiliki aktivitas antioksidan dengan nilai IC50 sebesar 4021 µg/mL. Penelitian
Purwaningsih et al. (2008) menyatakan bahwa ekstrak metanol pada keong matah merah memiliki antioksidan yang kuat dengan IC50 sebesar 58.19 ppm. Penelitian
Ravi et al. (2012) menyatakan ekstrak aseton dari gastropoda laut Hemifusus pugilinus memiliki aktivitas antiinflamasi tertinggi pada konsentrasi 1 mL sebesar 72.58±1.66%.
Gosliner et al. (1996) menyatakan D. auricularia merupakan salah satu spesies yang banyak ditemukan di wilayah Indo-Pasifik. Burghardt et al. (2006) menyatakan bahwa salah satu wilayah penyebaran dari kelinci laut adalah terdapat pada wilayah perairan Sulawesi Utara. Aneiros & Garateix (2004) menyebutkan dalam penelitiannya bahwa kelinci laut memiliki salah satu komponen aktif yaitu
dolastin 10 bermanfaat dalam pembentukan sitotoksin sebagai antikanker. Iijima et al. (2003) dalam penelitiannya menyatakan bahwa isolasi dari tubuh dan
kulit kelinci laut didapatkan senyawa dolabelanin B2 yang memiliki aktivitas antibakteri dengan Minimum Inhibitory Concentration (MIC) 2.5 µg/ mL pada bakteri Bacillus subtilis. Abirami et al. (2011) menyatakan bahwa tinta kelinci laut dapat menghambat aktivitas bakteri Pseudomonas aeruginosa dan
Staphylococcus aureus. Penelitian tentang kandungan kimia dan potensi yang terdapat pada ekstrak daging dan jeroan D. auricularia belum banyak sehingga perlu dikaji lebih dalam tentang kandungan, fungsi dan manfaatnya sebagai bahan alami yang bermanfaat bagi kesehatan.
Tujuan Penelitian
Tujuan dari penelitian “Aktivitas Ekstrak Kelinci Laut (D. auricularia) sebagai Inhibitor α-glukosidase, Stabilisator Sel Darah Merah, Antibakteri dan Antioksidan” adalah mengetahui karakteristik kimia kelinci laut (D. auricularia), serta kandungan metabolit sekundernya dan mengetahui serta menganalisis besarnya aktivitas inhibitor α-glukosidase, stabilisator sel darah merah, antibakteri, antioksidan.
Manfaat Penelitian
Manfaat dari penelitian “Aktivitas Ekstrak Kelinci Laut (D. auricularia) sebagai inhibitor α-glukosidase, Stabilisator Sel Darah Merah, Antibakteri dan Antioksidan” adalah memberikan informasi karakteristik nilai proksimat, asam
amino, asam lemak, mineral dan metabolit sekunder ekstrak kelinci laut (D. auricularia). Memberikan informasi potensi kelinci laut dalam bidang farmasi
sebagai acuan untuk penelitian lebih lanjut sebagai inhibitor α-glukosidase, stabilisator sel darah merah, antibakteri dan antioksidan dan mengangkat potensi sumber daya laut Indonesia yang dapat meningkatkan ekonomi masyarakat.
Ruang lingkup penelitian
ekstrak teraktif dengan pengukuran persentase inhibitor α-glukosidase, kemudian aktivitasnya diuji kembali dengan beberapa seri konsentrasi ekstrak dan kelinci laut kering untuk menentukan nilai IC50 (Konsentrasi ekstrak yang dapat
mereduksi aktivitas α-glukosidase sebesar 50%). Uji aktivitas stabilisasi sel darah
merah diawali dengan penapisan awal 2 jenis ekstrak yang berbeda untuk menentukan ekstrak teraktif, kemudian dilakukan dengan beberapa seri konsentrasi ekstrak untuk menentukan nilai IC50 (Konsentrasi ekstrak yang dapat
menstabilkan membran sel darah merah sebesar 50%). Uji aktivitas antibakteri diawali dengan penapisan awal dari 2 jenis ekstrak yang berbeda untuk menentukan ekstrak teraktif, kemudian ekstrak diuji kembali dengan beberapa seri konsentrasi ekstrak untuk menentukan nilai zona hambat yang terbentuk serta
dibandingkan dengan antibiotik kloramfenikol. Uji aktivitas antioksidan dari 2 jenis ekstrak yang berbeda (metanol dan etil asetat) kemudian ekstrak diuji
kembali aktivitas nya dengan beberapa seri konsentrasi untuk menentukan nilai IC50 serta dibandingkan dengan vitamin C.
2
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2015 sampai Januari 2016 di Laboratorium Karakteristik Bahan Baku Departemen Teknologi Hasil Perairan Institut Pertanian Bogor, Laboratorium Biokimia Hasil Perairan Departemen Teknologi Hasil Perairan Institut Pertanian Bogor, Pusat Studi Biofarmaka Institut Pertanian Bogor, Laboratorium Pharmacy Sterile Technology dan Laboratorium Penelitian II FKIK UIN Syarif Hidayatullah Jakarta.
Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah kelinci laut (D. auricularia) berasal dari desa Toronipa, Kendari Provinsi Sulawesi Tenggara.
Bahan lain yang digunakan diantaranya selenium, H2SO4 pekat, aquadest, NaOH
40%, asam borat 2%, indikator bromcresol green-methyl red, HCl 0,1 N, benzena, metanol, kloroform dan heksan, HNO3 pekat, HClO4, Nutrient Broth, aquades,
biakan Escherichia coli, biakan Staphylococcus aureus, Muller Hinton Agar
(MHA), kloramfenikol, dekstrosa, sodium sitrat, asam sitrat, sodium klorida,
dapar pospat (pH 7.4), Na diklofenak dari PT Indofarma Global Medika Bandung,
1,1-diphenyl-2-picrylhydrazyl (DPPH), vitamin C, metanol pro analisis, p-Nitrophenyl α-D-glucopyranoside (PNPG), dapar fosfat pH (7.0), Na2CO3,
akarbosa, enzim α-glukosidase, Dimethyl Sulfoxide (DMSO), serbuk magnesium,
HCl pekat, amil alkohol, HCl (2N), FeCl3 (1%), etanol, NH4OH, H2SO4 (1M),
heksan, pereaksi Meyer, Wagner dan Dragendorff.
Peralatan yang digunakan dalam penelitian diantaranya cool box, pisau, penggaris, timbangan, peralatan gelas, krus porselen, desikator, oven, tanur, Kjeldahl system, soxlet, AAS, shaker, kertas saring, rotary evaporator, spatula,
mikropipet, pipet steril, spektrofotometer UV, sentrifus, mikroplate (96-well plate), plat tetes dan waterbath.
Prosedur Penelitian
Penelitian ini terdiri dari tiga tahap, tahap pertama terdiri dari preparasi sampel, karakterisasi sampel yang meliputi identifikasi sampel, analisis proksimat, analisis asam amino, asam lemak dan mineral. Tahap kedua terdiri dari terdiri dari ekstraksi kelinci laut, penghitungan rendemen ekstrak kelinci laut dan
deskripsi ekstrak. Tahap ketiga terdiri dari uji fitokimia, uji inhibitor
α-glukosidase, uji stabilisator sel darah merah, uji antibakteri, uji antioksidan. Diagram alir penelitian dapat dilihat pada Gambar 1.
Preparasi Sampel
Tahap pertama dari penelitian ini diawali dengan preparasi sampel serta persiapan bahan dan alat untuk analisis yang akan dilakukan. Bahan baku yang digunakan dalam penelitian ini adalah kelinci laut (D. auricularia) yang diperoleh dari perairan Kendari. Bahan baku dibawa menuju laboratorium dalam keadaan beku dengan menggunakan styrofoam. Pengamatan morfometrik dilakukan meliputi panjang, lebar, tebal dan berat. Bahan baku kemudian dicuci dengan air bersih.
Gambar 1 Diagram Alir Penelitian
Kelinci laut
Karakterisasi dan identifikasi Analisis Proksimat (AOAC 2005) Analisis Asam amino (AOAC 2005) Analisis asam lemak (AOAC 2005) Analisis Mineral (AOAC 2005)
Ekstrak
Ekstrak Terbaik Ekstraksi kelinci laut
(Metanol dan Etil asetat)
Uji Fitokimia (Harbone 2006)
Uji α- glukosidase (Sancheti et al. 2006)
Uji Stabilisator sel darah merah (Ravi et al. 2012) Uji Antibakteri (Rasyid 2012)
Analisis Proksimat
a. Kadar air (AOAC 2005)
Cawan porselen dikeringkan dalam oven pada suhu 105°C selama 1 jam. Cawan tersebut diletakkan ke dalam desikator 15 menit dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan, sebanyak 5 gram contoh dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105°C selama 5 jam atau hingga beratnya konstan. Cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali.
Perhitungan kadar air :
Kadar air (%) =
x 100%
Keterangan :
A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g)
b. Kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105°C, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Cawan kemudian dimasukkan ke dalam tanur pengabuan dengan suhu 600°C selama 1 jam, kemudian ditimbang hingga didapatkan berat yang
A = Berat cawan porselen kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah diabukan (g)
c. Kadar protein (AOAC 2005)
Sampel ditimbang sebanyak 0.25 gram, kemudian dimasukkan ke dalam labu Kjeldahl 100 mL, lalu ditambahkan 0.25 gram Selenium dan 3 mL H2SO4
pekat. Sampel didestruksi pada suhu 410°C selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, kedalam labu Kjeldahl ditambahkan 50 mL aquadest dan 20 mL NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100°C. Destilat ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes
Perhitungan kadar protein:
% Kadar Protein = 1- 2 N 0,01 fk fp 100
Keterangan:
W = berat sampel (g)
V1 = Volume HCl 0,01 N yang digunakan pada penitaran sampel (mL) V2 = Volume HCl 0,01 N yang digunakan pada penitaran blanko N = Normalitas HCl
Fk = faktor konversi untuk protein secara umum = 6,25 Fp = faktor pengenceran
d. Kadar lemak (AOAC 2005)
Sampel seberat 5 gram (A) dimasukkan ke dalam kertas saring pada kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (B) dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak (benzena). Refluks dilakukan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pelarut akan tertampung di ruang ekstraktor dan dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105°C, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (C).
Perhitungan kadar lemak:
Kadar lemak (%) = x 100%
Keterangan :
A= Berat sampel (g)
B= Berat labu lemak kosong (g) C= Berat labu lemak dengan lemak (g)
e. Kadar karbohidrat (AOAC 2005)
Analisis karbohidrat dilakukan secara by difference, yaitu hasil pengurangan dari 100% dengan kadar air, kadar abu, kadar protein dan kadar lemak.
Perhitungan kadar karbohidrat:
Karbohidrat (%) = 100 % - ( kadar air + kadar abu + kadar protein + kadar lemak)
Analisis Kandungan Asam Amino (AOAC 2005)
Komposisi asam amino ditentukan dengan menggunakan HPLC. Perangkat HPLC harus dibilas terlebih dahulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan dibilas dengan akuades sampai syiringe benar-benar bersih. Analisis asam amino dengan menggunakan HPLC terdiri dari empat tahap, yaitu: tahap pembuatan hidrolisat protein, tahap pengeringan, tahap derivatisasi dan tahap injeksi serta analisis asam amino.
1. Tahap pembuatan hidrolisat protein
pada suhu 100°C selama 24 jam. Pemanasan dilakukan untuk mempercepat reaksi hidrolisis.
2. Tahap pengeringan
Sampel disaring dengan dengan kertas saring milipore. Penyaringan ini bertujuan agar larutan yang dihasilkan benar-benar bersih, terpisah dari padatan. Hasil saringan diambil sebanyak 30 L dan ditambahkan dengan 30 µL larutan pengering (larutan pengering terdiri dari metanol, pikotiosianat dan trietilamin).
3. Tahap derivatisasi
Larutan derivatisasi sebanyak 30 µL ditambahkan pada hasil pengeringan, larutan derivatisasi dibuat dari campuran metanol, natrium asetat dan trietilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel, selanjutnya dilakukan pengenceran dengan cara menambahkan 20 mL asetonitril 60% atau buffer natrium asetat 1 M, lalu dibiarkan selama 20 menit.
4. Injeksi ke HPLC
Hasil saringan diambil sebanyak 40 L untuk diinjeksikan ke dalam HPLC. Perhitungan konsentrasi asam amino yang ada pada bahan dilakukan dengan pembuatan kromatogram standar dengan menggunakan asam amino yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel. Kandungan asam amino dalam bahan dapat dihitung dengan rumus:
% Asam amino = luas area sampel p M 100 luas area standar bobot sampel
Keterangan:
C = Konsentrasi standar asam amino (µg/mL)
FP = Faktor pengenceran
BM = Bobot molekul dari masing-masing asam amino (g/mol)
Kondisi HPLC pada saat berlangsungnya hidrolisis asam amino adalah sebagai berikut: Temperatur: 27ºC (suhu ruang), Jenis kolom HPLC: C-18 ultraspechtere, Kecepatan alir eluen: 1 mL/menit Tekanan: 1 atm Program: Gradien, Fase gerak: Na asetat dan larutan metanol, Detektor: Floruence Panjang gelombang : 350-450 nm.
Analisis Asam Lemak (AOAC 2005)
kromatografi gas yang digunakan adalah kromatografi gas Shimadzu GC 2010. Analisis asam lemak terdiri dari beberapa tahap yaitu.
1. Tahap ekstraksi
Terlebih dahulu diperoleh asam lemak dengan metode soxhlet. Pada tahap ini akan diperoleh lemak dalam bentuk minyak. Sampel tersebut ditimbang sebanyak 20-30 mg lemak untuk dilanjutkan pada tahap metilasi.
2. Pembentukan metil ester (metilasi)
Tahap metilasi dimaksudkan untuk membentuk senyawa turunan dari asam lemak menjadi metil esternya. Asam-asam lemak diubah menjadi ester-ester metil atau alkil yang lainnya sebelum disuntikkan ke dalam kromatografi gas. Metilasi dilakukan dengan merefluks lemak di atas penangas air dengan pereaksi
berturut-turut NaOH-metanol 0.5 N, BF3 20%, NaCl jenuh dan isooktan. Sebanyak 20-30 mg lemak dari sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 1 mL NaOH 0.5 N dalam metanol lalu dipanaskan dalam penangas
air selama 20 menit pada suhu 80°C. Larutan kemudian didinginkan. Sebanyak 2 mL BF3 20% dan 5 mg/mL standar internal ditambahkan ke dalam tabung lalu
tabung dipanaskan kembali pada waterbath dengan suhu 80°C selama 20 menit dan didinginkan. Kemudian ditambahkan 2 mL NaCl jenuh dan 1 mL isooktan, dikocok dengan baik. Lapisan isooktan bagian atas larutan dipindahkan dengan bantuan pipet tetes ke dalam tabung reaksi yang berisi 0.1 gram Na2SO4 anhidrat,
didiamkan selama 15 menit. Larutan disaring dengan mikrofilter untuk memisahkan fase cairnya sebelum diinjeksikan ke dalam kromatografi gas. Sebanyak 1 L sampel diinjeksikan ke dalam Gas Chromatography.
Asam lemak yang ada dalam metil ester akan diidentifikasi oleh
Flame Ionization Detector (FID) atau detektor ionisasi nyala dan respon yang ada akan tercatat melalui kromatogram (peak).
3. Identifikasi asam lemak
Identifikasi asam lemak dilakukan dengan menginjeksi metil ester pada alat kromatografi gas dengan kondisi sebagai berikut: standar asam lemak yang digunakan adalah SupelcoTM 37 component FAME Mix. Gas yang digunakan sebagai fase bergerak adalah nitrogen dengan aliran bertekanan 20 mL/menit dan sebagai gas pembakar adalah hidrogen dengan aliran 30 mL/menit. Kolom yang digunakan adalah kolom kapiler Quadrex fused silica capillary column 007
cyanoprophyl methyl sil yang panjangnya 60 m dengan diameter dalam 0.25 mm.
Temperatur yang digunakan adalah 125°C, kemudian suhu dinaikkan 5°C per menit hingga suhu akhir 225°C. Suhu injektor 220°C dan suhu detektor
240°C.
Ekstraksi
kertas saring, kemudian diulang kembali dengan proses yang sama. Filtrat dievaporasi dengan rotary evaporator pada suhu 40°C.
Ekstrak yang diperoleh kemudian dihitung rendemennya. Rendemen merupakan perbandingan antara berat ekstrak yang dihasilkan dengan berat awal bahan yang dinyatakan dalam persen (%).Penghitungan rendemen:
Uji Fitokimia (Harborne 2006)
a. Uji flavonoid
Sampel sebanyak 0.1 gram ditambah 10 mL air panas, dididihkan selama 5 menit, kemudian disaring. Filtrat sebanyak 10 mL ditambahkan 0.5 g serbuk magnesium, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat. Uji positif ditandai dengan timbulnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
b. Uji alkaloid
Sebanyak 0.1 gram sampel ditambah dengan 3 tetes amonia 10% dan 1.5 mL kloroform, lalu dikocok. Lapisan kloroform diambil kemudian dilarutkan
dalam 1 mL asam sulfat 2 N, kemudian dikocok. Ekstrak selanjutnya ditambahkan dengan pereaksi Meyer. Terbentuknya endapan putih menandakan adanya senyawa alkaloid.
c. Uji steroid dan triterpenoid
Sebanyak 0.1 gram sampel ditambah dengan 2 mL kloroform dalam tabung reaksi, kemudian diteteskan ke dalam plat tetes, dan dibiarkan sampai kering. Pereaksi Liebermann-Burchard ditambahkan sebanyak 1 tetes. Terbentuknya warna merah menandakan adanya senyawa triterpenoid dan terbentuknya warna biru atau ungu menandakan adanya senyawa steroid.
d. Uji saponin
Sebanyak 0.1 gram sampel ditambah dengan 20 mL aquades, kemudian dipanaskan selama 5 menit. Larutan dituang ke dalam tabung reaksi dalam keadaan panas. Larutan diambil sebanyak 10 mL, kemudian dikocok kuat secara vertikal selama 10 detik. Adanya saponin ditandai dengan terbentuknya busa yang stabil setinggi 1-10 cm selama 10 menit dan tidak hilang pada saat ditambahkan dengan satu tetes HCl 2 N.
e. Uji fenol hidrokuinon
Sebanyak 0.1 gram sampel diekstrak dengan 20 mL etanol 70 %. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5 %. Terbentuknya warna hijau atau hijau biru menunjukkan adanya
senyawa fenol dalam bahan.
Uji Aktivitas Inhibitor α-Glukosidase (Sancheti et al. 2009)
a. Pembuatan larutan
Larutan bufer fosfat pH 7 (100 mM) dibuat dengan cara melarutkan 1.3609 g KH2PO4 dan 1.4150 g K2HPO4 dengan akuabides hingga 100 mL.
Larutan enzim α-glukosidase dibuat dengan cara melarutkan 1 mg enzim
100 mL dan diencerkan sebanyak 25 kali sebelum digunakan. Larutan p-NPG 10 mM dibuat dengan cara melarutkan 0.1507 g p-NPG dengan bufer fosfat pH 7 hingga 50 mL. Larutan Na2CO3 200 mM dibuat dengan cara melarutkan 1.0599 g
Na2CO3 dengan bufer fosfat pH 7 hingga 50 mL. Larutan induk sampel (100
mg/mL) dibuat dengan cara melarutkan 100 mg sampel dalam 1 mL DMSO. Larutan induk Glucobay (10 mg/mL ) dibuat dengan cara melarutkan 1 g tablet Glucobay dengan 100 mL larutan HCl 2N : akuades (1:1), kemudian disentrifus. Supernatan yang dihasilkan dimasukkan ke dalam labu ukur 100 mL dan ditepatkan dengan akuabides.
b. Pengujian
Larutan induk ekstrak (metanol dan etil asetat) D. auricularia diencerkan pada konsentrasi 25 mg/mL. Larutan ekstrak sebanyak 10 µl ditambahkan ke dalam tabung reaksi yang berisi 25 µl p-NPG (10 mM) dan 50 µl bufer fosfat pH 7. Reaksi dimulai dengan penambahan 25 µl larutan enzim dan 25µl bufer fosfat dilanjutkan dengan inkubasi selama 30 menit pada 37ºC. Reaksi dihentikan dengan penambahan 100 µl Na2CO3 (200 mM). Serapan larutan diukur
menggunakan ELISA reader pada panjang gelombang 410 nm. Sistem reaksi
inhibisi α-glukosidase tersaji pada Tabel 1.
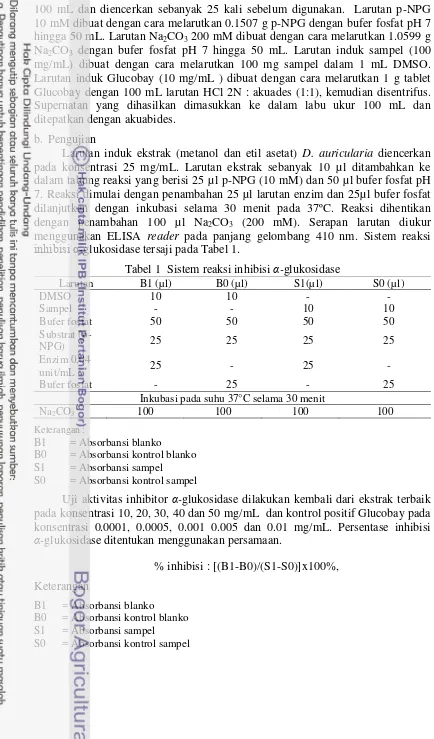
Tabel 1 Sistem reaksi inhibisi α-glukosidase
Larutan B1 (µl) B0 (µl) S1(µl) S0 (µl)
Inkubasi pada suhu 37°C selama 30 menit
Na2CO3 100 100 100 100
Keterangan :
B1 = Absorbansi blanko
B0 = Absorbansi kontrol blanko
S1 = Absorbansi sampel
S0 = Absorbansi kontrol sampel
Uji aktivitas inhibitor α-glukosidase dilakukan kembali dari ekstrak terbaik pada konsentrasi 10, 20, 30, 40 dan 50 mg/mL dan kontrol positif Glucobay pada
konsentrasi 0.0001, 0.0005, 0.001 0.005 dan 0.01 mg/mL. Persentase inhibisi
α-glukosidase ditentukan menggunakan persamaan.
% inhibisi : [(B1-B0)/(S1-S0)]x100%,
Keterangan
B1 = Absorbansi blanko
Persamaan garis yang diperoleh dalam bentuk y = b(x) + a digunakan untuk mencari nilai IC50. Nilai IC50 menunjukkan konsentrasi sampel yang diperlukan
untuk menghambat aktivitas α-glukosidase sebesar 50%.
Uji Aktivitas Stabilisator Sel Darah Merah (Ravi et al. 2012)
a. Pembuatan larutan
Larutan Na2HPO4.2H2O (0.15 M) dibuat dengan cara melarutkan 2.671 g
Na2HPO4.2H2O dengan akuades hingga 100 mL. Larutan NaH2PO4.H2O (0.15 M)
dibuat dengan cara melarutkan 2.070 g NaH2PO4.H2O dengan akuades hingga
100 mL. Larutan dapar fosfat pH 7.4 (0.15 M) dibuat dengan cara mencampurkan 81 mL larutan Na2HPO4.2H2O (0.15 M) dengan 19 mL larutan NaH2PO4.H2O
(0.15 M), kemudian disterilisasi dengan autoklaf pada suhu 115°C selama 30 menit. Larutan isosalin dibuat dengan cara melarutkan 0.85 g NaCl dengan dapar fosfat pH 7.4 (0.15 M) hingga 100 mL, kemudian disterilisasi dengan autoklaf pada suhu 115°C selama 30 menit. Larutan hiposalin dibuat dengan cara melarutkan 0.25 g NaCl dengan dapar fosfat pH 7.4 (0.15 M) hingga 100 mL, kemudian disterilisasi dengan autoklaf pada suhu 115°C selama 30 menit. Larutan induk sampel (10 mg/mL) dibuat dengan cara melarutkan 100 mg sampel dalam 10 mL larutan isosalin dengan bantuan DMSO.
b. Pembuatan suspensi sel darah merah
Darah dari Palang Merah Indonesia (PMI) sebanyak 10 mL disentrifugasi pada 3000 rpm selama 10 menit. Supernatan yang terbentuk dipisahkan menggunakan pipet steril. Endapan sel-sel darah yang tersisa kemudian dicuci dengan larutan isosalin (0.85%, pH 7.2) dan disentrifugasi kembali. Proses tersebut diulang 4 kali sampai isosalin jernih. Volume sel darah merah diukur dan diresuspensi dengan isosalin sehingga didapatkan suspensi sel darah merah dengan konsentrasi 10% v/v.
c. Pengujian
Larutan sampel terdiri dari 1 mL dapar fosfat pH 7.4; 2 mL hiposalin; 0.5 mL suspensi sel darah merah dan 1 mL sampel. Larutan kontrol sampel terdiri dari 1 mL dapar fosfat pH 7.4; 2 mL hiposalin; 0.5 mL isosalin dan 1 mL sampel. Larutan kontrol negatif terdiri dari 1 mL dapar fosfat pH 7.4; 2 mL hiposalin; 0.5 mL suspensi sel darah merah dan 1 mL isosalin. Semua larutan uji diinkubasi pada suhu 56°C selama 20 menit dan disentrifugasi. Cairan supernatan selanjutnya diambil dan kandungan hemoglobinnya diperhitungkan dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 560 nm. Uji aktivitas antiinflamasi dilakukan kembali pada konsentrasi 500, 1000, 2000, 4000 dan 6000 µg/mL dan kontrol positif Na diklofenak pada konsentrasi 200, 400, 600, 800 dan 1000 µg/mL. Persentase stabilitas membran sel darah merah dapat dihitung dengan
% Stabilitas sel darah merah: 100-[(S-KS/K)x100%]
Keterangan:
S = Absorbansi sampel
Nilai konsentrasi ekstrak kelinci laut dan stabilitas sel darah merah diplot masing-masing pada sumbu x dan y pada persamaan regresi linier. Persamaan garis yang diperoleh dalam bentuk y = b(x) + a digunakan untuk mencari nilai IC50. Nilai IC50 menunjukkan konsentrasi sampel yang diperlukan untuk
menstabilkan membrane sel darah merah sebesar 50%.
Uji Aktivitas Antibakteri (Rasyid 2012)
a. Pembuatan media
Media NA dibuat dengan cara melarutkan 1.4 g nutrient agar dalam 50 mL akuades dan dihomogenkan dengan memanaskan di atas hotplate. Masing-masing sebanyak 5 mL NA dimasukkan dalam tabung reaksi, ditutup dengan kapas dan disterilkan dengan autoklaf 121οC selama 15 menit. Tabung reaksi berisi NA kemudian dimiringkan sampai NA membeku.
Media NB dibuat dengan cara melarutkan 1.3 g nutrient broth dalam 100 mL akuades dan dihomogenkan dengan memanaskan di atas hotplate.
Masing-masing sebanyak 9 mL NB dimasukkan dalam tabung reaksi ditutup dengan kapas dan disterilkan dengan autoklaf 121°C selama 15 menit.
Media MHA dibuat dengan cara melarutkan 7.6 g Muller Hinton agar dalam 200 mL akuades dan dihomogenkan dengan memanaskan di atas hotplate. Masing-masing sebanyak 20 mL MHA dimasukkan dalam tabung reaksi ditutup dengan kapas dan disterilkan dengan autoklaf 121°C selama 15 menit.
b. Penyegaran dan pembuatan suspensi bakteri
Penyegaran bakteri dilakukan dengan memindahkan 1 ose bakteri uji dari stok ke tabung reaksi berisi media NA. Inkubasi dilakukan pada suhu 37°C selama 24 jam. Pembuatan suspensi bakteri dilakukan dengan memindahkan 1 ose bakteri dari media NA ke dalam media NB yang telah dingin secara aseptik, kemudian diinkubasi pada suhu 37°C selama 24 jam. Biakan bakteri yang telah
diinkubasi kemudian diukur optical density (OD) pada panjang gelombang 600 nm dengan nilai antara 0.5 – 0.8.
c. Pembuatan larutan induk ekstrak
Larutan induk ekstrak (100 mg/mL ) dibuat dengan cara melarutkan 100 mg sampel dalam 1 mL DMSO, kemudian diencerkan pada beberapa seri konsentrasi. Larutan induk kloramfenikol (10 mg/mL ) dibuat dengan cara melarutkan 10 mg kloramfenikol dalam 1 mL DMSO, kemudian diencerkan pada konsentrasi 1 mg/mL .
d. Pengujian
Uji Aktivitas Antioksidan (Molyneux 2004)
Pengujian aktivitas antioksidan dilakukan secara in vitro menggunakan metode DPPH. Sebanyak 1 mL DPPH ditambah metanol p.a hingga menjadi 4 mL (blanko). Sampel ekstrak dilarutkan dalam metanol p.a dan dibuat dalam beberapa seri konsentrasi. Masing-masing konsentrasi dimasukkan dalam botol coklat lalu ditambahkan larutan DPPH 1 mM sebesar 1 mL sehingga volume total dalam botol coklat menjadi 4 mL. Masing-masing botol tersebut diinkubasi pada suhu 37°C selama 30 menit. Vitamin C digunakan sebagai kontrol positif. Selanjutnya serapannya diukur dengan spektrofotometer pada panjang gelombang 517 nm. Persentase aktivitas inhibisi dihitung dengan persamaan : [(A – B)/A x 100], dimana A adalah absorbansi blanko dan B adalah absorbansi sampel. Nilai IC50
menunjukkan konsentrasi sampel yang diperlukan untuk menghambat radikal bebas sebesar 50% dan nilainya ditentukan dengan persamaan regresi.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan tiga kali ulangan. Data yang diperoleh dari hasil penelitian dilakukan uji normalitas dan homogenitas, kemudian dilanjutkan dengan analisis ragam dan jika berpengaruh nyata maka diuji lanjut menggunakan uji Duncan (Steel & Torrie 1993).
Hipotesis
H0 : Perbedaan konsentrasi kelinci laut kering dan ekstrak tidak berpengaruh
terhadap aktivitas uji kelinci kering (D. auricularia)
H1 : Perbedaan konsentrasi kelinci laut kering dan ekstrak berpengaruh terhadap
aktivitas uji kelinci laut (D. auricularia)
Model observasi Rancangan Acak Lengkap (RAL) adalah sebagai berikut :
Yij = μ + αi + ɛij
Keterangan :
Yij : Respon pengaruh perlakuan ke- i dan ulangan ke-j μ Pengaruh rata-rata umum
αi μ Pengaruh perlakuan ke-i
ɛij : Pengaruh acak (galat percobaan) pada perlakuan ke-i ulangan ke-j j : 1,2, dan 3.
Model observasi Uji Duncan adalah sebagai berikut :
√
Keterangan :
Rp : Nilai signifikansi
KTG : Kuadrat Tengah Galat
R : Ulangan
rαρ : Nilai wilayah nyata duncan
α : Taraf nyata
3 HASIL DAN PEMBAHASAN
Karakteristik Kelinci LautIdentitas kelinci laut
Kelinci laut merupakan salah satu hewan yang hidup diperairan laut, biasa
nya hewan ini berada didaerah dangkal yang banyak terdapat alga. Lozada et al. (2005) menyatakan dalam penelitiannya kelinci laut menyukai alga
hijau jenis Cladophora, lamun jenis Cymodocea rotundata serta jenis alga coklat
Sargassum cristaefolium. Ciri-ciri dari hewan ini adalah memiliki sepasang tentakel yang terdapat pada bagian dorsal. Pada bagian ventral kelinci laut terdapat cangkang yang menutupi kelenjar tinta. Kelenjar tinta pada kelinci laut digunakan pada saat dalam keadaan bahaya. Gambar kelinci laut dapat dilihat pada Gambar 2.
Gambar 2 Kelinci laut
Hasil identifikasi dari kelinci laut menunjukkan bahwa kelinci laut yang diamati termasuk kedalam golongan gastropoda yang tergabung kedalam genus dolabella. Klasifikasi dari kelinci laut (Lightfoot 1786) sebagai berikut:
Filum : Mollusca Kelas : Gastropoda Famili : Aplysiidae Genus : Dolabella
Spesies : Dolabella auricularia
Wagele dan Klussmann-Kolb (2005) menyatakan bahwa kelinci laut masih satu famili kedalam Aplysiidae. Kelinci laut juga termasuk ke dalam golongan nocturnal dan banyak terdapat pada daerah Indo-Pasifik. Masyarakat desa Toronipa provinsi Sulawesi Tenggara banyak yang belum mengetahui mafaat dan kandungan dari kelinci laut sehingga populasinya sangat melimpah. Pemanfaatan hewan yang termasuk ke dalam kelas moluska sebagai sumber makanan telah banyak dilakukan oleh masyarakat terutama pada daerah yang terletak dipesisir pantai, selain sebagai sumber makanan pemanfaatan moluska juga dipercaya sebagai penambah stamina dan meningkakan gairah seksual.
pengamatan ini meliputi panjang total kelinci laut (dari dorsal sampai ke ventral), diameter kelinci laut dan berat total dari kelinci laut.
Hasil pengamatan morfometrik (Tabel 2 dan Lampiran 1) rata-rata panjang total kelinci laut, diameter dan berat kelinci laut memiliki variasi yang berbeda-beda, variasi ini disebabkan oleh adanya perbedaan pertumbuhan antara kelinci laut dan juga dipengaruhi oleh keanekaragaman makanan yang ada didaerah sampel didapatkan.
Tabel 2 Morfometrik kelinci laut Parameter Satuan Nilai
Panjang total cm 11.12±1.02
Diameter cm 3.7±0.51
Berat basah total g 81.41±21.21
Karakterisasi kimia daging kelinci laut
Komposisi kimia daging kelinci laut
Pengukuran proksimat merupakan salah satu metode untuk mengetahui kandungan gizi yang terdapat pada sampel atau pada salah satu produk. beberapa komposisi utama yang biasanya diukur dalam analisis proksimat adalah protein. air. abu. lemak dan mineral. Hasil komposisi kimia kelinci laut dapat dilihat pada Tabel 3.
Tabel 3 Komposisi kimia daging kelinci laut Komposisi Proksimat Persentase (%) Protein 12.49±0.34
Air 62.11±2.19
Abu 23.02±3.23
Lemak 0.87±0.55 Karbohidrat 1.52±0.83
Hasil analisis kimia daging kelinci laut yang tertinggi adalah kadar air sebesar 62.11%. lebih kecil dibandingkan dengan gastropoda lainnya. penelitian Purwaningsih (2012) kadar air pada keong matah merah 77.5% dan penelitian Abdullah et al. (2013) kadar air kerang bulu yaitu 79.69%.
Kadar abu yang terdapat pada kelinci laut merupakan kandungan terbesar kedua setelah kandungan air 23.02%. bila dibandingkan dengan penelitian yang telah dilakukan pada golongan gastropoda lainnya. kandungan abu pada kelinci laut lebih besar dari Holothuria scabra J. Karnila et al. (2011) menyatakan kandungan abu pada Holothuria scabra J adalah 1.86% dan kadar abu keong matah merah yaitu 4.5% (Purwaningsih 2012).
(Anand et al. 2010). Perbedaan kandungan protein antar organisme menurut Georgiev et al. (2008) menyatakan bahwa kandungan protein antar organisme dipengaruhi oleh sifat protein yang tidak stabil serta dapat berubah dengan berubahnya kondisi lingkungan. Tingginya kandungan protein pada kelinci laut menunjukkan bahwa kelinci laut dapat dijadikan salah satu sumber protein hewani Persentase kandungan karbohidrat pada kelinci laut lebih kecil dari kandungan karbohidrat pada Pleuroploca trapezium 4.307% (Anand et al. 2010). sedangkan pada penelitian jenis gastropoda lainnya kandungan karbohidrat kelinci laut tidak berbeda jauh dengan Cerithidea obtuse 1.6% (Purwaningsih 2012).
Penelitian lain juga melaporkan bahwa kandungan karbohidrat pada
Anadara antiquate 3.56% (Abdullah et al. 2013).
Persentase kandungan lemak merupakan kandungan terkecil pada komposisi kimia kelinci laut dibandingkan dengan penelitian gastropoda lainnya. kandungan lemak pada kelinci laut lebih kecil dari Cerithidea obtuse yaitu 2.8% (Purwaningsih 2012). Anadara antiquate yaitu 2.29% (Abdullah et al. 2013). dan
Pleuroploca trapezium yaitu 1.74% (Anand et al. 2010).
Kandungan asam amino daging kelinci laut
Asam amino memiliki peranan yang penting didalam tubuh yaitu sebagai sekresi hormon pertumbuhan dapat juga memperbaiki jaringan yang rusak. Asam amino terbagi menjadi dua jenis yaitu asam amino yang tidak dapat dibuat oleh tubuh dan didapatkan dari sumber asam amino lainnya (asam amino esensial) dan asam amino yang dapat dibuat oleh tubuh manusia (asam amino non esensial). Hasil analisis asam amino pada kelinci laut dapat dilihat pada Tabel 4.
Tabel 4 Kandungan asam amino daging kelinci laut Parameter Hasil (% b/b basah)
Total asam amino esensial 5.06
Hasil analisis kandungan asam amino diperoleh 9 jenis asam amino esensial dan 6 jenis asam amino non esensial. Asam amino essensial yang tertinggi adalah arginina sebesar 1.61%. sedangkan asam amino esensial terendah adalah histidina yaitu 0.07%. Asam amino non essensial tertinggi adalah glisina sebesar 3.02%. sedangkan asam amino non esensial terendah adalah tirosina sebesar 0.41%. Kandungan asam amino glisina dan arginina pada kelinci laut lebih besar bila dibandingkan dengan gastropoda jenis kerang bulu yaitu glisina sebesar 0.6% dan kandungan arginina sebesar 0.83% (Abdullah et al 2013). Glisina pada keong mata merah yaitu 2.28% (Purwaningsih 2012). Derby et al. (2007) menyatakan salah satu asam amino yang paling banyak ditemui pada moluska laut adalah glisina. Glisina dan arginina memiliki fungsi yang penting di dalam tubuh. menurut Fatmah (2006) menyatakan bahwa arginina dapat mempengaruhi fungsi
dari sel T. mempercepat penyembuhan luka dan sekresi hormon prolaktin. Wang et al. (2013) menyatakan bahwa glisina memiliki peranan yang penting
dalam metabolisme tubuh.
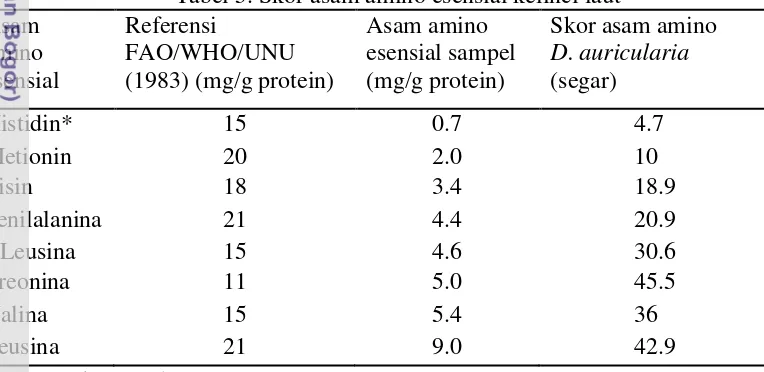
Skor kimia digunakan untuk mengetahui asam amino pembatas yang dilihat dari nilai skor kimia yang terendah. Block & Mitchell (1978) menyatakan bahwa skor kimia adalah metode yang digunakan untuk melihat kualitas protein oleh asam amino yang sangat kekurangan dibandingkan dengan profil asam amino yang terdapat pada protein standar. Skor asam amino terendah pada asam amino esensial kelinci laut adalah histidina. Nilai skor kimia diperoleh sebesar 4.7. nilai ini diperoleh menggunakan perbandingan dari standar FAO. Hasil perhitungan skor asam amino menunjukkan bahwa histidin merupakan nilai terkecil berdasarkan tingkat kecukupan asam amino yang dapat dikonsumsi dari asam amino pada kelinci laut. Perhitungan skor asam amino dapat dilihat pada Tabel 5 dan Lampiran 2.
Tabel 5. Skor asam amino esensial kelinci laut Asam
Kandungan asam lemak daging kelinci laut
jenuh dan asam lemak tak jenuh. salah satu yang membedakan asam lemak jenuh dan tak jenuh adalah ikatan rangkap.
Hasil analisis asam lemak diperoleh tiga jenis asam lemak. Total asam lemak SAFA sebesar 5.33%. total asam lemak MUFA sebesar 2.11% dan total asam lemak PUFA sebesar 4.10%. Kandungan asam lemak daging kelinci laut dapat dilihat pada Tabel 6.
Tabel 6 Kandungan asam lemak daging kelinci laut
Parameter Struktur Hasil (% b/b lemak)
Asam lemak jenuh (SAFA) Asam Cis-10 Heptadekanoat C17:1 0.08 Asam Cis-11 Eikosanoat C20:1 0.32
Asam Nervonat C24:1 0.16
Asam Elaidat C18:1n9t 0.05
Asam Oleat C18:1n9c 0.89
Asam Erukat C22:1n9 0.04
Total MUFA 2.01
Asam lemak tak jenuh majemuk (PUFA)
(Purwaningsih et al. 2012). asam palmitat memiliki peranan yang penting dalam inflamasi pada tubuh. Barve et al. (2007) menyatakan bahwa asam palmitat dapat menginduksi proinflamasi sitokin interleukin-8 dari hepatosit. Kandungan MUFA tertinggi pada kelinci laut adalah asam oleat sebesar 0.89% lebih rendah dari asam oleat kerang pisau yaitu 3.72% (Nurjanah et al. 2013). Asam oleat merupakan asam lemak yang berperan penting dalam tubuh yaitu sebagai sumber energi dan juga dapat sebagai anti kanker. Kandungan PUFA pada kelinci laut tertinggi adalah asam arakidonat yaitu 1.83% lebih rendah dari kerang pisau yaitu 2.35% (Nurjanah et al. 2013) dan arakidonat pada Anadara antiquata yaitu 2.36% (Abdullah et al 2013). Sartika (2008) menyatakan bahwa asam lemak PUFA (arakidonat. linoleat dan linolenat) memiliki peranan yang penting dalam transport dan metabolisme lemak serta dapat mempertahankan fungsi membran sel.
Total asam lemak omega 3 sebesar 1.23%. total kandungan omega 6 adalah 2.45%. Rasio atau perbandingan omega 6 dan omega 3 pada kelinci laut sebesar 1.99. Her Majesty’s Stationery Office (HMSO) (1994) merekomendasikan rasio omega 6 dan omega 3 maksimal adalah 4. rasio kelinci laut lebih rendah dari standar HMSO sehingga dapat dijadikan sebagai sumber omega-3. Asam lemak memiliki fungsi yang penting dalam tubuh. Marichamy et al. (2009) menyatakan bahwa fungsi dari asam lemak adalah dapat memelihara water barrier di dalam epidermis kulit sehingga dapat mencegah terjadinya kulit bersisik.
Kandungan mineral daging kelinci laut
Hasil analisis kandungan mineral kelinci laut yang tertinggi adalah kalsium yaitu sebesar 68100 mg/kg. sedangkan kandungan mineral yang terkecil adalah fosfor 1200 mg/kg. Hasil analisis kandungan mineral dapat dilihat pada Tabel 7.
Tabel 7 Kandungan mineral daging kelinci laut Parameter Hasil (mg/kg)
Kandungan kalsium pada kelinci laut lebih tinggi bila dibandingkan dengan keong matah merah. Penelitian Purwaningsih (2012) melaporkan bahwa kandungan kalsium pada keong matah merah sebesar 39.78 mg/100g. Penelitian Ademolu et al. (2015) menyatakan bahwa gastropoda jenis Achatina fulica
memiliki kandungan kalsium lebih rendah sebesar 10.45 mg/g.
Kadar kalsium pada kelinci laut lebih tinggi dibandingkan dengan gastropoda lainnya. Hal ini diduga dipengaruhi oleh tulang rawan yang meliputi daging pada kelinci laut. Tulang merupakan salah satu sumber kalsium yang
tinggi. Hal ini diperkuat menurut pendapat Kim dan Mendis (2006) dan Malde et al. (2010) menyatakan bahwa tulang merupakan sumber kalsium yang
515.83 mg/kg dan 97.80 mg/kg (Srimariana et al. 2015). Soetan et al. (2010) menyatakan bahwa kebutuhan mineral didalam tubuh sebesar 1-2500 mg perhari tergantung pada jenis mineral yang dibutuhkan oleh tubuh.
Karakteristik Ekstrak Kelinci Laut
Rendemen ekstrak kelinci laut
Ektraksi merupakan salah satu cara untuk mendapatkan metabolit sekunder yang terdapat pada suatu bahan sehingga dapat dimanfaatkan dalam berbagai bidang. Ekstraksi kelinci laut pertama kali dilakukan dengan cara membersihkan kelinci laut yang disimpan pada freezer dengan suhu (-14°C). Daging dan jeroan yang didapat dicacah dengan menggunakan pisau tajam. tinta yang terdapat didalam kelinci laut tidak termasuk kedalam bagian yang diekstraksi. Pencacahan bertujuan untuk memperluas permukaan sampel sehingga pelarut dapat lebih dalam menarik zat yang terdapat dalam sampel.
Proses ekstraksi kelinci laut dilakukan dengan menggunakan metode maserasi dengan menggunakan pelarut tunggal. Pemilihan metode maserasi didasarkan pada efektivitas zat yang terlarut dalam sampel dari pengaruh panas selama proses maserasi. Pelarut yang digunakan pada ekstraksi kelinci laut adalah metanol dan etil-asetat. Hasil ekstraksi dapat dilihat pada Gambar 3.
Gambar 3 Ekstrak kelinci laut
Prinsip dari maserasi adalah larutan yang konsentrasinya tinggi akan terdesak keluar kemudian diganti oleh cairan penyaring dengan konsentrasi yang lebih rendah. Proses ini biasa disebut dengan proses difusi. Proses ini terjadi secara berulang sampai adanya keseimbangan konsentrasi antara larutan diluar sel dan didalam sel. Selama proses maserasi dilakukan pengadukan dan penggantian cairan penyari setiap hari. Endapan yang diperoleh dipisahkan dari filtratnya. filtrat yang didapatkan dievaporasi dan diperoleh ekstrak kelinci laut. Hasil perhitungan randemen ekstrak dapat dilihat pada Tabel 8.
Tabel 8 Rendemen ekstrak kelinci laut Nama Berat Bahan
Awal (basah) (g)
Berat Ekstrak (g)
Rendemen (%)
Ekstrak metanol 100 1.54 1.54 Ekstrak etil asetat 100 1.34 1.34
paling banyak digunakan dalam ekstraksi senyawa aktif adalah metanol. Hart et al. (2003) menyatakan bahwa metanol memiliki berat molekul yang
rendah sehingga dapat dengan mudah melarutkan seluruh golongan metabolit sekunder yang terdapat pada sampel.
Deskripsi ekstrak kelinci laut
Deskripsi ekstrak merupakan salah satu parameter spesifik untuk melihat ciri-ciri dari penampakan ekstrak yang meliputi warna. bau dan bentuk (BPOM 2000).
Tabel 9 Deskripsi ekstrak kelinci laut
Nama Bentuk Warna Bau
Ekstrak metanol Pasta Hijau kecoklatan Amis Ekstrak etil asetat Pasta Hijau gelap Amis
Hasil uji deksripsi ekstrak kelinci laut (Tabel 9) ekstrak metanol memiliki bentuk pasta. berwarna hijau kecoklatan dan memiliki bau amis. sedangkan pada ekstrak etil asetat memiliki perbedaan warna yaitu hijau gelap. Perbedaan warna pada ekstrak dapat disebabkan oleh kemampuan pelarut dalam melarutkan zat warna yang terdapat pada senyawa. warna hijau pada ekstrak dapat disebabkan oleh terlarutnya zat klorofil pada sampel.
Aktivitas Komponen Bioaktif Kelinci Laut
Uji fitokimia ekstrak kelinci laut
Skrining fitokimia merupakan salah satu metode pengujian yang bertujuan untuk mengetahui kandungan metabolit sekunder yang terdapat pada suatu bahan. Hasil uji fitokimia pada ekstrak dari seluruh tubuh kelinci laut dapat dilihat pada Tabel 10.
Tabel 10. Hasil uji fitokimia ekstrak kelinci laut
Metabolit sekunder Jenis ektrak
Ekstrak metanol Ekstrak etil asetat
Alkaloid Wagner Mayer - - - -
Dragendorff - -
Flavonoid - -
Saponin - +
Steroid + +
Tanin + +
Triterpenoid - -
Quinon - -
Keterangan : + : menunjukkan adanya komponen metabolit sekunder pada ekstrak - : menunjukkan tidak terdeteksi komponen metabolit sekunder pada ekstrak
dibandingkan pada pelarut metanol. Jenis metabolit sekunder yang terdeteksi pada ekstrak etil asetat kelinci laut yang berupa steroid sama dengan metabolit sekunder yang terdeteksi pada ekstrak metanol. Hasil ini tidak berbeda jauh pada penelitian Mukti et al. (2012) yang menyatakan bahwa ekstrak etil asetat pada
Telescopium telescopium terdeteksi metabolit sekunder dengan jenis steroid. Steroid merupakan salah satu jenis metabolit sekunder yang terdapat pada ekstrak kelinci laut dengan menggunakan pelarut metanol dan etil asetat. Hal ini tidak berbeda dibandingkan penelitian Nurjanah et al. (2012) yang menyatakan bahwa steroid biasanya terdapat pada pelarut yang bersifat non polar dan semi polar. Hasil penelitian menunjukkan bahwa steroid pada kelinci laut memiliki kesamaan pada penelitian ekstrak Carijoa sp. Penelitian Zhao et al. (2013) menyatakan bahwa senyawa steroid terdapat pada ekstrak Carijoa sp dengan menggunakan pelarut etanol yang bersifat polar.
Steroid memiliki fungsi yang sangat penting bagi kesehatan. salah satu
fungsi dari steroid adalah dapat mencegah terjadinya inflamasi pada tubuh. Thao et al. (2013) menyatakan bahwa steroid dapat menghambat menghambat
sekresi sitokin pro - inflamasi serta termasuk IL - 12 p40. IL - 6. dan TNF - α. serta dapat mencegah dan mengobati penyakit inflamasi.
Tanin merupakan salah satu metabolit sekunder yang terdapat pada ekstrak kelinci laut. Tanin dapat dimanfaatkan sebagai zat alami yang berfungsi sebagai antibakteri. Fiori et al. (2013) menyatakn bahwa tanin memiliki korelasi positif sebagai antimikroba. Tanin dapat menghambat proses metabolisme pada mikroba. Lim et al. (2006) menyatakan bahwa tanin terhidrolisa dapat menghambat terjadinya biosintesis sel pada dinding dan membran sel mikroba sehingga dapat dijadikan sebagai antimikroba.
Kandungan lainnya yang terdapat pada ekstrak kelinci laut adalah saponin. Saponin sama dengan metabolit sekunder lainnya berpotensi dalam bidang
kesehatan. Fungsi saponin adalah antioksidan dan antibakteri. Pada penelitian Akinpelu et al. (2014) menyatakan bahwa saponin dapat mencegah kerusakan
yang disebabkan oleh radikal bebas dan infeksi yang disebabkan oleh bakteri patogen.
Aktivitas inhibitor α-glukosidase ekstrak kelinci laut
Inhibitor α-glukosidase merupakan salah satu pengujian untuk melihat aktivitas suatu senyawa dalam menghambat perkembangan diabetes pada tubuh. Antidiabetes dapat diuji secara in vivo dan in vitro. Pada penelitian ini
antidiabetes diuji secara in vitro dengan metode penghambatan kerja enzim
α-glukosidase. Enzim α-glukosidase dapat mengkatalisasi pemecahan ikatan
1.4 α-glikosida pada ujung non pereduksi dari maltooligosakarida dengan melepas β-D-glukosa.
Penghambatan α-glukosidase berdasarkan pada pemecahan substrat untuk menghasilkan produk berwarna. yang diukur absorbansinya selama periode waktu
tertentu. Warna kuning yang dihasilkan dari hidrolisis p-NPG menjadi
α-D-glukosa dan p-nitrofenol merupakan indikator kemampuan inhibitor menghambat kinerja dari enzim α-glukosidase (Sugiwati et al. 2009). Menurut Satoh et al (2013) enzim α-glukosidase dapat menurunkan ukuran dari
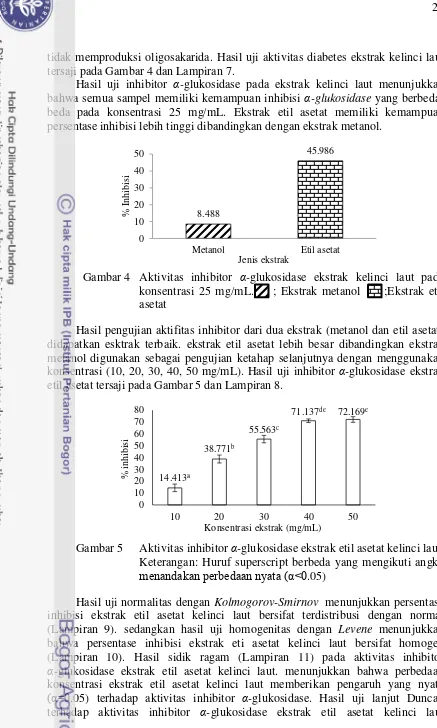
tidak memproduksi oligosakarida. Hasil uji aktivitas diabetes ekstrak kelinci laut tersaji pada Gambar 4 dan Lampiran 7.
Hasil uji inhibitor α-glukosidase pada ekstrak kelinci laut menunjukkan bahwa semua sampel memiliki kemampuan inhibisi α-glukosidase yang berbeda-beda pada konsentrasi 25 mg/mL. Ekstrak etil asetat memiliki kemampuan persentase inhibisi lebih tinggi dibandingkan dengan ekstrak metanol.
Gambar 4 Aktivitas inhibitor α-glukosidase ekstrak kelinci laut pada konsentrasi 25 mg/mL. ; Ekstrak metanol ;Ekstrak etil asetat
Hasil pengujian aktifitas inhibitor dari dua ekstrak (metanol dan etil asetat) didapatkan esktrak terbaik. ekstrak etil asetat lebih besar dibandingkan ekstrak metanol digunakan sebagai pengujian ketahap selanjutnya dengan menggunakan konsentrasi (10, 20, 30, 40, 50 mg/mL). Hasil uji inhibitor α-glukosidase ekstrak etil asetat tersaji pada Gambar 5 dan Lampiran 8.
Gambar 5 Aktivitas inhibitor α-glukosidase ekstrak etil asetat kelinci laut. Keterangan: Huruf superscript berbeda yang mengikuti angka
menandakan perbedaan nyata α<0.05)
Hasil uji normalitas dengan Kolmogorov-Smirnov menunjukkan persentase inhibisi ekstrak etil asetat kelinci laut bersifat terdistribusi dengan normal (Lampiran 9). sedangkan hasil uji homogenitas dengan Levene menunjukkan bahwa persentase inhibisi ekstrak eti asetat kelinci laut bersifat homogen
(Lampiran 10). Hasil sidik ragam (Lampiran 11) pada aktivitas inhibitor
α-glukosidase ekstrak etil asetat kelinci laut. menunjukkan bahwa perbedaan konsentrasi ekstrak etil asetat kelinci laut memberikan pengaruh yang nyata
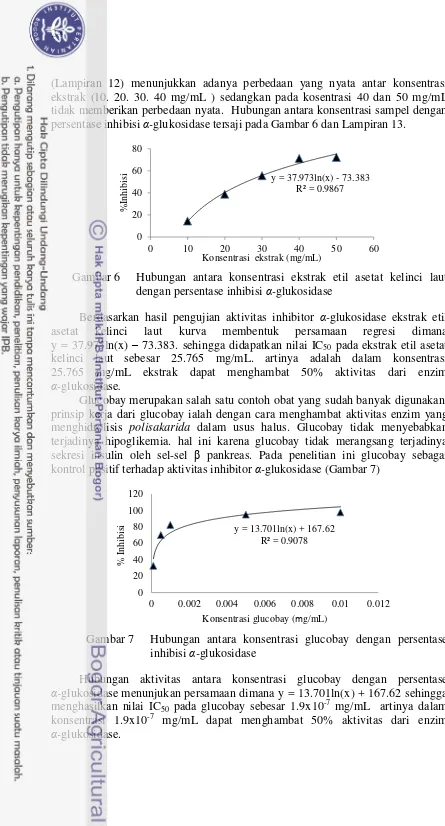
(Lampiran 12) menunjukkan adanya perbedaan yang nyata antar konsentrasi ekstrak (10. 20. 30. 40 mg/mL ) sedangkan pada kosentrasi 40 dan 50 mg/mL tidak memberikan perbedaan nyata. Hubungan antara konsentrasi sampel dengan persentase inhibisi α-glukosidase tersaji pada Gambar 6 dan Lampiran 13.
Gambar 6 Hubungan antara konsentrasi ekstrak etil asetat kelinci laut dengan persentase inhibisi α-glukosidase
Berdasarkan hasil pengujian aktivitas inhibitor α-glukosidase ekstrak etil
asetat kelinci laut kurva membentuk persamaan regresi dimana y = 37.973ln(x) – 73.383. sehingga didapatkan nilai IC50 pada ekstrak etil asetat
kelinci laut sebesar 25.765 mg/mL. artinya adalah dalam konsentrasi 25.765 mg/mL ekstrak dapat menghambat 50% aktivitas dari enzim
α-glukosidase.
Glucobay merupakan salah satu contoh obat yang sudah banyak digunakan. prinsip kerja dari glucobay ialah dengan cara menghambat aktivitas enzim yang menghidrolisis polisakarida dalam usus halus. Glucobay tidak menyebabkan terjadinya hipoglikemia. hal ini karena glucobay tidak merangsang terjadinya sekresi insulin oleh sel-sel β pankreas. Pada penelitian ini glucobay sebagai kontrol positif terhadap aktivitas inhibitor α-glukosidase (Gambar 7)
Gambar 7 Hubungan antara konsentrasi glucobay dengan persentase inhibisi α-glukosidase
Hubungan aktivitas antara konsentrasi glucobay dengan persentase
α-glukosidasemenunjukan persamaan dimana y = 13.701ln(x) + 167.62 sehingga menghasilkan nilai IC50 pada glucobay sebesar 1.9x10-7 mg/mL artinya dalam
0 0.002 0.004 0.006 0.008 0.01 0.012
Beberapa penelitian tentang antidiabetes dari gastropoda lainnya telah dilaporkan. Sadhasivam et al. (2013) menyatakan bahwa ekstrak metanol dari gastropoda jenis Aplysia sp. aktivitas inhibisi α-amilase sebesar 93.0%.
Bursatella leachii sebesar 70.6% dan Kalinga ornata sebesar 49.0%. Ravi et al. (2012) menyatakan akarbosa memiliki kemampuan yang lebih tinggi
dalam menghambat aktivitas alpha amylase dibandingkan dengan ekstrak metanol dan aseton dari Hemifusus pugilinus dan Natica didyma. Febrinda et al (2013) menyatakan bahwa akarbosa adalah senyawa oligosakarida komplek dapat dijadikan sebagai agen antidiabetik.
Aktivitas stabilisator sel darah merah ekstrak kelinci laut
aktivitas stabilisator sel darah merah pada ekstrak etil asetat kelinci laut tersaji pada Gambar 9 dan Lampiran 15.
Gambar 9 Aktivitas stabilisator sel darah merah ekstrak etil asetat kelinci laut. Keterangan: Huruf superscript berbeda yang mengikuti
angka menandakan perbedaan nyata α<0.05)
Hasil uji normalitas dengan Kolmogorov-Smirnovmenunjukkan persentase stabilitas membran sel darah merah ekstrak etil asetat kelinici laut bersifat terdistribusi dengan normal (Lampiran 16) sedangkan hasil uji homogenitas dengan Levene menunjukkan bahwa persentase stabilitas membran sel darah merah ekstrak etil asetat kelinici laut bersifat homogen (Lampiran 17). Hasil sidik ragam (Lampiran 18) pada peresentase stabilitas sel darah merah ekstrak etil asetat kelinci laut. menunjukkan bahwa perbedaan konsentrasi ekstrak etil asetat
kelinci laut memberikan pengaruh yang nyata α=0.05) terhadap stabilitas sel darah merah. Hasil uji lanjut Duncan terhadap stablitas sel darah merah ekstrak etil asetat kelinci laut (Lampiran 19) menunjukkan adanya perbedaan yang nyata antar konsentrasi ekstrak (1. 10. 100. 1000. 10000 µg/mL). Hubungan antara konsentrasi sampel dengan persentase stabilitas sel darah merah tersaji pada Gambar 10.
Gambar 10 Hubungan antara konsentrasi ekstrak etil asetat kelinci laut dengan persentase stabilitas sel darah merah
Hasil pengujian aktivitas stabilisator sel darah merah ekstrak etil asetat kelinci laut membentuk kurva persamaan regresi dimana y = 5.7783ln(x) - 3.6329.
sehingga didapatkan nilai IC50 pada ekstrak etil asetat kelinci laut sebesar
10.741 mg/mL. artinya adalah dalam konsentrasi 10.741 mg/mL ekstrak dapat menstabilkan 50% sel darah merah.
-0.485a
0 2000 4000 6000 8000 10000 12000
%s
tab
ilit
as