PROFIL BAKTERI ASAM LAKTAT DAN BAKTERI
PEMBENTUK ASAM PADA NIRA KELAPA (
Cocos nucifera
L.)
MILA KHARISMA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Profil Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa (Cocos nucifera L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Mila Kharisma
ABSTRAK
MILA KHARISMA. Profil Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa (Cocos nucifera L.). Dibimbing oleh LILIS NURAIDA.
Nira kelapa secara luas sudah banyak digunakan untuk memproduksi gula kelapa di berbagai negara. Nira merupakan cairan yang keluar melalui proses penyadapan bunga tanaman kelapa yang belum terbuka. Nira kaya akan kandungan gula (10~15%) dan kondisi pH nira mendekati netral. Karakteristik tersebut menyebabkan nira mudah mengalami fermentasi spontan oleh berbagai macam mikroba yang secara alami terdapat pada bunga tanaman kelapa atau manggar akibat kondisi penyadapan yang kurang bersih. Penelitian ini bertujuan untuk mengevaluasi profil bakteri asam laktat dan bakteri pembentuk asam serta mengevaluasi pengaruh penyimpanan pada nira kelapa. Nira kelapa diperoleh dari Sukabumi dan Purbalingga. Jumlah awal bakteri asam laktat dan bakteri pembentuk asam pada nira kelapa asal Sukabumi dan Purbalingga sudah tinggi. Rata-rata jumlah bakteri asam laktat pada nira kelapa segar asal Sukabumi dan Purbalingga masing-masing sebesar 7.38 log CFU/ml dan 7.94 log CFU/ml, sedangkan rata-rata jumlah bakteri pembentuk asam pada nira kelapa segar asal Sukabumi dan Purbalingga masing-masing sebesar 5.88 log CFU/ml dan 7.95 log CFU/ml. Nilai rata-rata pH nira kelapa segar asal Sukabumi dan Purbalingga adalah 5 dan 5.5 dengan total gula 15 dan 15.2o brix. Penyimpanan sampel nira Purbalingga pada suhu ruang selama 4, 8, dan 16 jam menyebabkan peningkatan jumlah bakteri asam laktat dan bakteri pembentuk asam, serta penurunan nilai pH. Hal tersebut juga terjadi pada sampel nira Sukabumi yang disimpan selama 18 jam pada suhu rendah. Hasil identifikasi isolat nira kelapa asal Sukabumi yang diisolasi dari media MRSA dan GYC didominasi oleh isolat heterofermentatif coccobasil, masing-masing 43% dan 62%. Isolat heterofermentatif coccobasil juga mendominasi 81% isolat nira kelapa Purbalingga yang diisolasi dari media MRSA, sedangkan isolat yang diperoleh dari media GYC didominasi oleh heterofermentatif basil (84%). Identifikasi dengan API 50 CHL menunjukkan bahwa nira kelapa dari kedua tempat didominasi oleh Weissella viridescens. Isolat bakteri asam laktat lain yang ditemukan, yaitu Lactococcus lactis ssp lactis 1 dan
ABSTRACT
MILA KHARISMA. Profile of Lactic Acid Bacteria and Acid-Forming Bacteria in Coconut Sap (Cocos nucifera L.). Supervised by LILIS NURAIDA.
Coconut sap has been widely used to produce coconut sugar in many countries. It is a liquid that coming out by tapping the unopened coconut flower. Coconut sap is rich in sugar (10~15%) and nearly at neutral pH condition. Those characteristics cause the coconut sap spontaneously fermented by certain microorganisms that present naturally in coconut flower due to unsanitary tapping process. This study aims to evaluate the profile of lactic acid bacteria and acid-forming bacteria and to evaluate the effect of storage on coconut sap. Coconut sap was obtained from Sukabumi and Purbalingga. The initial amount of lactic acid bacteria and acid-forming bacteria in fresh coconut sap from Sukabumi and Purbalingga was already high. The average number of lactic acid bacteria in Sukabumi and Purbalingga fresh coconut sap respectively amounted to 7.38 log CFU/ml and 7.94 log CFU/ml, meanwhile the average number of acid-forming bacteria in Sukabumi and Purbalingga fresh coconut sap respectively amounted to 5.88 log CFU/ml and 7.95 log CFU/ml. The average pH value of fresh coconut sap from Sukabumi and Purbalingga were 5 dan 5.5 with total sugar 15 and 15.2o brix. Purbalingga coconut sap stored at room temperature for 4, 8, and 16 hours increased the number of lactic acid bacteria and acid-forming bacteria, as well as decreased its pH value. Those also happened in Sukabumi coconut sap stored for 18 hours at low temperature. Isolates from Sukabumi coconut sap was dominated by heterofermentative coccobacilli, 43 % isolated from MRSA medium and 62 % from GYC medium. Heterofermentative coccobacilli also dominated 81 % isolates in Purbalingga coconut sap obtained from MRSA medium, whereas isolates from GYC medium were dominated by heterofermentative bacilli (84%). Identification using API 50 CHL showed that coconut saps from both places were dominated by Weissella viridescens. Other lactic acid bacteria isolates were identified as Lactococcus lactis ssp lactis 1 and Leuconostoc mesenteroides ssp mesenteroides/dextranicum 1.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PROFIL BAKTERI ASAM LAKTAT DAN BAKTERI
PEMBENTUK ASAM PADA NIRA KELAPA (
Cocos nucifera
L.)
MILA KHARISMA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Profil Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa (Cocos Nucifera L.)
Nama : Mila Kharisma NIM : F24090043
Disetujui oleh
Prof Dr Ir Lilis Nuraida MSc Pembimbing
Diketahui oleh
Dr Ir Feri Kusnandar MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2013 ini adalah mikrobiologi pangan, dengan judul Profil Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa (Cocos nucifera L.).
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Lilis Nuraida, MSc selaku dosen pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dian Herawati, STP, Msi, Ibu Ari, dan Ibu Antin serta staff Departemen Ilmu dan Teknologi Pangan dan staff SEAFAST Center IPB yang telah membantu penulis selama menjalankan proses penelitian hingga selesai.
Ungkapan terima kasih juga penulis sampaikan kepada Ayas, Hayyu, Seno, Eno, Aktris, Ghesi, Sarah, Aca, Dani, Sobich, Iqbal, Ajie, Anan, Sarida, Afi, Dini, Cynthia, Syarah, Allia, Tika, Rista, Nadya, Yoga, Tantina, Nandha, Memey, Yoshiara, Ratu, Atica, Hanna, Agi, Olla, serta seluruh teman-teman ITP angkatan 46 yang telah menemani penulis selama kuliah dan memberikan banyak motivasi selama 3 tahun. Terima kasih kepada Mama dan Papa atas segala doa dan semangatnya hingga karya tulis ini selesai dibuat dan penulis mendapatkan gelar sarjana.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL ... x DAFTAR GAMBAR ... xi DAFTAR LAMPIRAN ... xii PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE ... 2
Bahan dan Alat 2
Tahap Penelitian 2 Analisis Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa Segar Asal Sukabumi dan Purbalingga 3 Analisis Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Jerigen Penampungan dan Sisa Sayatan Manggar 3 Analisis Pengaruh Lama Penyadapan dan Penggunaan Wadah Penampungan terhadap Mutu Nira Kelapa Segar Asal Purbalingga 4 Analisis Pengaruh Lama Penyimpanan terhadap Mutu Nira Kelapa Asal
Sukabumi dan Purbalingga 5
Isolasi dan Identifikasi Isolat dari Nira Kelapa Segar Asal Sukabumi
dan Purbalingga 6
HASIL DAN PEMBAHASAN ... 7 Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira
Kelapa Segar Asal Sukabumi dan Purbalingga 7
Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada
Jerigen Penampungan dan Sisa Sayatan Manggar 8
Pengaruh Lama Penyadapan dan Penggunaan Wadah Penampungan
terhadap Mutu Nira Kelapa Segar Asal Purbalingga 9 Pengaruh Lama Penyimpanan terhadap Mutu Nira Kelapa Segar Asal
Sukabumi dan Purbalingga 11
Isolasi dan Identifikasi Isolat dari Nira Kelapa Segar Asal Sukabumi
dan Purbalingga 14
DAFTAR TABEL
1 Cara penyadapan sampel nira kelapa segar asal Sukabumi dan
Purbalingga 3
2 Cara penyadapan sampel nira kelapa Purbalingga berdasarkan variasi
lama penyadapan 4
3 Cara penyadapan sampel nira kelapa Purbalingga berdasarkan variasi
wadah penampungan 4
4 Lama penyimpanan sampel nira kelapa asal Sukabumi dan Purbalingga 5 5 Rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam pada
nira kelapa segar asal Sukabumi dan Purbalingga 8 6 Jumlah bakteri asam laktat dan bakteri pembentuk asam pada jerigen
penampungan Sukabumi dan Purbalingga 9
7 Jumlah bakteri asam laktat dan bakteri pembentuk asam pada sisa
sayatan manggar Sukabumi dan Purbalingga 9
8 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap
berdasarkan variasi lama penyadapan 10
9 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap
berdasarkan variasi wadah penampungan 10
10 Jumlah isolat Gram positif dan katalase negatif pada nira kelapa segar
Sukabumi dan Purbalingga 14
11 Hasil identifikasi isolat dari nira kelapa segar Sukabumi dan
Purbalingga menggunakan API 50 CHL 17
DAFTAR GAMBAR
1 Pengaruh penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Sukabumi sadapan 6
jam menggunakan jerigen petani 11
2 Pengaruh penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan
4 jam menggunakan plastik steril 12
3 Pengaruh penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan
6 jam menggunakan plastik steril 13
4 Pengaruh penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan
6 jam menggunakan jerigen petani 13
5 Hasil identifikasi isolat nira kelapa Sukabumi dari media MRSA 15 Hasil identifikasi isolat nira kelapa Sukabumi dari media GYC
6 Hasil identifikasi isolat nira kelapa Purbalingga dari media MRSA 15 Hasil identifikasi isolat nira kelapa Purbalingga dari media GYC
7 Bentuk sel isolat P6 1 G0 yang berasal dari nira 18 Bentuk sel isolat P6 7 G0 yang berasal dari nira
DAFTAR LAMPIRAN
1 Hasil analisis statistik nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap
berdasarkan variasi lama penyadapan 22
2 Hasil analisis statistik nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap
berdasarkan variasi wadah penampungan 24
3 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat dan bakteri pembentuk pada asam nira kelapa selama penyimpanan 26 4 Hasil identifikasi isolat nira kelapa asal Sukabumi (NS1 dan NS2) 27 5 Hasil identifikasi isolat nira kelapa asal Purbalingga (P5 dan P6) 28 6 Pemilihan isolat nira kelapa Sukabumi yang digunakan dalam
identifikasi menggunakan API 50 CHL 29
7 Pemilihan isolat nira kelapa Purbalingga yang digunakan dalam
PENDAHULUAN
Latar Belakang
Nira merupakan cairan yang dihasilkan dari bagian mayang atau malai tanaman palma, salah satunya tanaman kelapa yang pucuknya belum terbuka melalui proses penyadapan (Muralidharan dan Deepthi 2013). Hingga saat ini, nira digunakan sebagai bahan baku pembuatan gula kelapa maupun minuman fermentasi, seperti tuak, karena kandungan gulanya yang tinggi. Kandungan gula nira yang tinggi sekitar 15% dengan pH pada kisaran pH netral menjadikan nira kelapa sangat rentan terhadap pertumbuhan mikroba (Xia et al. 2011). Cairan nira yang keluar dari mayang merupakan cairan yang steril, namun kerusakan dapat terjadi sejak awal penyadapan nira (Yasni et al. 1997). Kerusakan nira terjadi akibat fermentasi spontan yang dilakukan oleh mikroba. Kontaminasi mikroba pada nira dapat bersumber dari alat penyadap yang kurang bersih, hygiene penderas yang kurang baik ketika melakukan penyadapan, dan kondisi penyadapan yang terbuka (Rusbana 2009).
Fase pertama fermentasi spontan yang tejadi pada nira kelapa didominasi oleh kelompok bakteri. Jenis bakteri diduga berupa Leuconostoc, Lactobacillus, Streptococcus, Bacillus, dan Enterobacter (Vidanapathirana et al. 1983). Penelitian yang dilakukan oleh Cahyaningsih (2006) menunjukkan bahwa bakteri asam laktat merupakan mikroba awal yang bertanggung jawab dalam fermentasi nira. Kehadiran bakteri asam laktat pada fermentasi nira berlangsung selama 24 jam. Bakteri asam laktat yang berhasil diisolasi oleh Cahyaningsih (2006) diidentifikasi sebagai Lactobacillus plantarum dan Leuconostoc mesenteroides.
Aktivitas bakteri asam laktat menyebabkan penurunan pH pada nira. Selain bakteri asam laktat, kerusakan pada nira kelapa juga disebabkan oleh khamir yang melakukan fermentasi alkohol (Vidanapathirana et al. 1983). Fermentasi kemudian dilanjutkan oleh aktivitas bakteri asam asetat (Acetobacter) yang muncul pada waktu 2-3 hari hingga akhirnya nira berubah menjadi cuka (Kadere dan Kutima 2012). Bakteri asam asetat akan mengoksidasi alkohol yang terbentuk menjadi asam asetat (Ray 2004).
Penurunan pH nira terjadi dengan cepat dan secara langsung mempengaruhi ketersediaan sukrosa di dalam nira. Sukrosa mengalami degradasi akibat lingkungan yang asam melalui reaksi hidrolisis. Reaksi hidrolisis tersebut dapat terjadi secara spontan pada kondisi asam (Wang 2004). Hal tersebut juga disebabkan oleh enzim invertase yang dihasilkan oleh Saccharomyces cerevisiae, sehingga dapat memecah sukrosa menjadi glukosa dan fruktosa (Pandey et al.
2
akibat reaksi antara gugus karbonil dari rantai gula pereduksi yang terbuka dengan gugus amino dari asam amino (Fisher dan Scott 1997).
Berdasarkan permasalahan tersebut, perlu dilakukan penelitian untuk mengetahui profil bakteri asam laktat dan bakteri pembentuk asam lainnya yang diduga sebagai mikroba dominan penyebab kerusakan awal pada nira kelapa, sehingga dapat menjadi informasi awal yang dapat digunakan dalam usaha pengendalian mutu nira kelapa.
Tujuan Penelitian
Tujuan penelitian ini adalah 1) mendapatkan data mengenai jumlah bakteri asam laktat dan bakteri pembentuk asam pada nira kelapa; 2) mengevaluasi pengaruh variasi cara penyadapan berupa lama penyadapan dan penggunaan wadah penampungan nira terhadap mutu nira kelapa segar yang dihasilkan; 3) mengevaluasi pengaruh lama penyimpanan terhadap mutu nira kelapa; dan 4) mengidentifikasi isolat bakteri hasil isolasi dari nira kelapa segar.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi awal mengenai mikroba yang dominan pada nira sebagai dasar untuk formulasi bahan tambahan yang dapat digunakan dalam usaha pengendalian mutu nira kelapa. Selain itu, informasi mengenai cara penyadapan diharapkan dapat digunakan untuk pengembangan cara penyadapan yang baik.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari sampel berupa nira kelapa segar yang berasal dari Kampung Cikondang, Desa Cidadap, Kecamatan Cidadap, Kabupaten Sukabumi, Jawa Barat dan Desa Bojong, Kecamatan Mrebet, Kabupaten Purbalingga, Jawa Tengah, nira kelapa hasil penyimpanan, sisa sayatan manggar, dan jerigen penampungan, serta bahan-bahan untuk keperluan analisis, seperti media MRSA Oxoid, GYC yang terdiri dari 5% D-glucose, 1% yeast extract, 0.5% CaCO3, 2% agar w/v (Soheir 2012), MRSB
Oxoid, media Gibson’s semi solid, media sukrosa agar, streptomycin, NaCl, pereaksi H2O2 3%, pewarna Gram, larutan pengencer KH2PO4, dan API 50 CHL.
Alat yang digunakan, yaitu hand refractometer, kertas pH, botol steril, plastik steril, cool box, dan alat-alat standar mikrobiologi.
Tahap Penelitian
3 kelapa segar yang dihasilkan; 3) analisis pengaruh lama penyimpanan terhadap mutu nira kelapa asal Sukabumi dan Purbalingga; 4) isolasi dan identifikasi isolat bakteri dari nira kelapa segar asal Sukabumi dan Purbalingga.
1. Analisis Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa Segar Asal Sukabumi dan Purbalingga
Sampel nira kelapa segar asal Sukabumi dan Purbalingga masing-masing diperoleh dari dua pohon kelapa yang berbeda dengan cara penyadapan seperti pada Tabel 1. Sampel nira kelapa segar tersebut juga tidak diberi bahan tambahan yang biasa digunakan petani untuk mencegah kerusakan nira.
Tabel 1 Cara penyadapan sampel nira kelapa segar asal Sukabumi dan
Nilai pH sampel nira kelapa yang baru disadap diukur menggunakan kertas pH dan total gula diukur dengan hand refractometer. Analisis jumlah bakteri asam laktat dan bakteri pembentuk asam pada nira kelapa dilakukan dengan menggunakan metode cawan tuang pada tingkat pengenceran yang ditentukan berdasarkan nilai pH nira. Sebanyak 10 ml nira dipipet ke dalam 90 ml larutan pengencer KH2PO4 yang kemudian dilanjutkan dengan pengenceran 1 ml
campuran tersebut ke dalam 9 ml larutan pengencer hingga tingkat pengenceran tertentu. Analisis terhadap jumlah bakteri asam laktat dilakukan pada media MRSA dan bakteri pembentuk asam pada media GYC (Soheir 2012). Pada media GYC ditambahkan streptomycin 25 mg/L untuk mencegah munculnya bakteri asam laktat (Soni 2007). Inkubasi hasil pemupukan sampel nira pada media MRSA dilakukan selama 48 jam pada suhu 37oC untuk sampel asal Sukabumi dan 30oC untuk sampel asal Purbalingga, sedangkan pemupukan pada media GYC streptomycin diinkubasi pada suhu tersebut selama 2-5 hari.
2. Analisis Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Jerigen Penampungan dan Sisa Sayatan Manggar
Jumlah bakteri asam laktat dan bakteri pembentuk asam pada sampel jerigen penampungan dan sisa sayatan manggar dianalisis untuk mengetahui adanya potensi jerigen penampungan dan sayatan manggar sebagai sumber kontaminasi terhadap nira kelapa segar yang diperoleh. Pengambilan sampel jerigen penampungan dilakukan dengan cara membilas bagian dalam jerigen penampungan menggunakan 100 mL larutan pengencer KH2PO4, sedangkan pada
4
kemudian dihancurkan dalam larutan pengencer menggunakan stomacher. Masing-masing 3.67 dan 3.49 gram sampel sisa sayatan manggar asal Sukabumi dan Purbalingga dihancurkan dalam 33.03 dan 31.41 ml larutan pengencer.
Analisis terhadap jumlah bakteri asam laktat dilakukan pada media MRSA dan bakteri pembentuk asam pada media GYC yang ditambahkan streptomycin. Inkubasi hasil pemupukan pada media MRSA dilakukan selama 48 jam pada suhu 37oC untuk sampel asal Sukabumi dan 30oC untuk sampel asal Purbalingga, sedangkan pemupukan pada media GYC streptomycin diinkubasi pada suhu tersebut selama 2-5 hari.
3. Analisis Pengaruh Lama Penyadapan dan Penggunaan Wadah Penampungan terhadap Mutu Nira Kelapa Segar Asal Purbalingga
Nira kelapa segar asal Purbalingga diperoleh melalui beberapa cara penyadapan. Hal tersebut bertujuan untuk mengetahui pengaruh masing-masing cara penyadapan, berupa lama penyadapan dan penggunaan wadah penampungan nira terhadap mutu nira kelapa segar yang dihasilkan. Pada Tabel 2 disajikan cara penyadapan berdasarkan variasi lama penyadapan, yaitu 4 dan 6 jam. Plastik steril digunakan sebagai wadah penampungan nira kelapa segar yang diperoleh.
Tabel 2 Cara penyadapan sampel nira asal Purbalingga berdasarkan variasi lama penyadapan
Pohon
(Kode Sampel) Ulangan Wadah Penampungan Lama Penyadapan
Pohon 1 (P1) 1 Plastik steril 4 jam
Pohon 2 (P2) 2 Plastik steril 4 jam
Pohon 3 (P3) 1 Plastik steril 6 jam
Pohon 4 (P4) 2 Plastik steril 6 jam
Cara penyadapan berdasarkan variasi wadah penampungan nira berupa plastik steril dan jerigen penampungan dapat dilihat pada Tabel 3. Lama penyadapan dilakukan selama 6 jam.
Tabel 3 Cara penyadapan sampel nira kelapa asal Purbalingga berdasarkan variasi wadah penampungan
Pohon
(Kode Sampel) Ulangan Wadah Penampungan Lama Penyadapan
Pohon 3 (P3) 1 Plastik steril 6 jam
Pohon 4 (P4) 2 Plastik steril 6jam
Pohon 5 (P5) 1 Jerigen milik petani 6 jam
5 Nilai pH sampel nira kelapa yang baru disadap diukur menggunakan kertas pH dan total gula diukur dengan hand refractometer. Analisis terhadap jumlah bakteri asam laktat dilakukan pada media MRSA dan bakteri pembentuk asam pada media GYC yang ditambahkan streptomycin. Inkubasi hasil pemupukan pada media MRSA dilakukan selama 48 jam pada suhu 37oC untuk sampel asal Sukabumi dan 30oC untuk sampel asal Purbalingga, sedangkan pemupukan pada media GYC streptomycin diinkubasi pada suhu tersebut selama 2-5 hari. Data hasil analisis pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa segar asal Purbalingga dari masing-masing cara penyadapan tersebut diolah dengan menggunakan aplikasi t-Test: two-sample assuming equal variances yang tersedia pada analysis toolpak Micorosoft Excel.
4. Analisis Pengaruh Lama Penyimpanan terhadap Mutu Nira Kelapa Asal Sukabumi dan Purbalingga
Selain analisis terhadap nira kelapa segar, analisis terhadap nira kelapa yang disimpan juga dilakukan untuk mengetahui pengaruh lama penyimpanan terhadap mutu nira kelapa berupa nilai pH, jumlah bakteri asam laktat, dan bakteri pembentuk asam. Nira kelapa segar asal Sukabumi langsung disimpan di dalam botol steril menggunakan cool box dan dijaga suhunya agar tetap dingin (Olawale
et al 2010). Pada Tabel 4 disajikan lama penyimpanan sampel nira kelapa asal Sukabumi dan Purbalingga.
6
pada media MRSA dan bakteri pembentuk asam pada media GYC yang ditambahkan streptomycin. Inkubasi hasil pemupukan pada media MRSA dilakukan selama 48 jam pada suhu 37oC untuk sampel asal Sukabumi dan 30oC untuk sampel asal Purbalingga, sedangkan pemupukan pada media GYC streptomycin diinkubasi pada suhu tersebut selama 2-5 hari.
5. Isolasi dan Identifikasi Isolat dari Nira Kelapa Segar Asal Sukabumi dan Purbalingga
a. Isolasi Bakteri dari Nira Kelapa Segar
Isolasi dilakukan dari cawan hasil pemupukan sampel nira kelapa segar asal Sukabumi (pohon 1 dan 2) dan Purbalingga (pohon 5 dan 6). Masing-masing 10 koloni dengan penampakan yang berbeda diambil dari cawan MRSA dan GYC streptomycin pada pengenceran tertinggi, serta memiliki jumlah koloni terhitung (25-250 koloni). Setiap koloni yang terpilih di goreskan secara aseptis ke dalam agar miring dengan media yang sama seperti media asalnya (MRSA dan GYC). Tahap isolasi dilanjutkan dengan metode goresan kuadran untuk mendapatkan isolat yang lebih seragam. Koloni terpisah dengan ukuran dan penampakan yang seragam dipilih dan diinokulasikan kembali pada media agar miring sejenis untuk selanjutnya digunakan dalam tahap identifikasi.
Tahap identifikasi diawali dengan pengamatan terhadap morfologi sel dan pewarnaan Gram. Identifikasi sifat biokimia dimulai dengan uji katalase menggunakan larutan H2O2 3%. Aktivitas katalase positif ditandai dengan
timbulnya gelembung udara saat satu loop isolat dicampurkan dengan larutan H2O2 di atas kaca objek dan hasil yang sebaliknya untuk hasil uji
katalase negatif. Isolat yang menunjukkan karakteristik bakteri asam laktat dengan ciri-ciri Gram positif dan katalase negatif dipilih untuk kemudian dilakukan identifikasi selanjutnya (Krishnamoorthy dan Arjun 2012).
b. Identifikasi Isolat dari Nira Kelapa Segar
Identifikasi yang dilakukan berupa pertumbuhan pada konsentrasi garam yang berbeda, produksi CO2 dari glukosa, pertumbuhan pada suhu yang
berbeda, dan produksi dekstran dari sukrosa.
Pertumbuhan pada Suhu yang Berbeda
Sebanyak satu loop isolat diinokulasikan ke dalam tabung yang berisi media MRSB. Sampel dalam media MRSB disimpan selama 7-14 hari dengan suhu untuk masing-masing seri tabung, yaitu 10oC, 15oC, 45oC, dan 30oC sebagai kontrol. Pertumbuhan diamati dengan adanya kekeruhan yang terjadi pada media MRSB yang menunjukkan adanya pertumbuhan (Nuraida, 1988; Hartanti 2007).
Pertumbuhan pada Konsentrasi Garam yang Berbeda
7
Produksi CO2 dari Glukosa
Pengujian ini bertujuan untuk membedakan bakteri asam laktat homofermentatif dan heterofermentatif. Media yang digunakan dalam pengujian ini adalah Gibson’s semi solid dengan penambahan nutrient agar sebagai penutupdi atas media tersebut. Isolat yang akan diinokulasi sebelumnya dihidupkan di dalam media MRSB selama 24 jam.
Sebanyak 0,5 ml isolat mikroba diinokulasi ke dalam media Gibson’s
semi solid dan kemudian ditambahkan nutrient agar setinggi 2-3 cm sebagai penutup. Inkubasi dilakukan pada suhu 30oC selama 2-5 hari. Bakteri asam laktat heterofermentatif akan membentuk gas yang ditandai dengan pecahnya atau terangkatnya penutup NA, sedangkan bakteri asam laktat homofermentatif tidak (Narang 2004).
Produksi Dekstran dari Sukrosa
Uji ini dilakukan untuk membedakan spesies dari genus
Leuconostoc. Satu loop kultur digoreskan pada media sukrosa agar yang telah dituang pada cawan dan kemudian diinkubasikan pada suhu 30oC selama 2 hari. Pembentukan dekstran dari sukrosa ditandai dengan koloni berlendir (Nuraida 1988; Hartanti 2007).
c. Identifikasi lanjutan menggunakan API 50 CHL (BioMérieux 2007)
Sebanyak 9 isolat nira kelapa asal Sukabumi dan 8 isolat asal Purbalingga dipilih berdasarkan keragaman isolat yang muncul sebagai hasil dari identifikasi sebelumnya. Pemilihan isolat tersebut tertera pada lampiran 6 dan 7. Isolat yang terpilih diidentifikasi menggunakan API 50 CHL untuk mengetahui jenis isolat hingga tahap spesies. Prosedur identifikasi API 50 CHL mengikuti instruksi penggunaan produk. Setiap cupule API 50 CHL diinokulasi dengan suspensi bakteri secara aseptis dan ditutup menggunakan parafin cair steril untuk menciptakan kondisi anaerob. Inkubasi dilakukan pada suhu 30°C selama 48 jam. Hasil reaksi diperiksa secara visual setelah 24 dan 48 jam. Hasil reaksi positif atau negatif dapat dilihat dengan adanya perubahan warna dalam cupule yang disebabkan oleh produksi asam. Reaksi asam dengan indikator pH yang terkandung dalam medium API akan menghasilkan perubahan warna, yaitu warna kuning dan warna hitam pada tabung nomor 25 yang berisi esculin. Hasil pembacaan berupa profil biokimia kemudian diidentifikasi menggunakan software APIwebTM API 50 CHLV5.1.
HASIL DAN PEMBAHASAN
1. Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Nira Kelapa Segar Asal Sukabumi dan Purbalingga
8
dapat dipengaruhi oleh prosedur penyadapan, musim, kondisi nutrisi yang tersedia pada nira kelapa, dan penanganan terhadap nira kelapa yang diperoleh (Sanchez 2008). Selain itu, nira yang dihasilkan dari setiap pohon, manggar, serta musim dapat memiliki kualitas yang berbeda-beda (Jnanadevan 2013).
Tabel 5 Rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam pada nira kelapa segar asal Sukabumi dan Purbalingga
Rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam pada nira kelapa segar dari kedua tempat sudah tinggi. Hal tersebut menunjukkan adanya aktivitas pemanfaatan gula oleh bakteri sebagai tahap awal kerusakan nira (Vidanapathirana et al. 1983). Aktivitas mikroba menyebabkan penurunan pH pada nira kelapa. Nilai pH nira kelapa segar yang diperoleh sudah menunjukkan adanya kerusakan pada nira karena nilai pH sampel mencapai pH 5 dan 5.5. Menurut Battcock dan Azam-Ali (1998), kerusakan nira ditandai dengan perubahan pH nira dari 7.4-6.8 menjadi 5.5.
Suhu inkubasi yang digunakan dalam analisis sampel nira kelapa Sukabumi (37oC) dan Purbalingga (30oC) merupakan suhu yang digunakan untuk menumbuhkan bakteri mesofilik karena mikroba dominan pada nira bersifat mesofilik (Roberts et al. 2005). Bakteri mesofilik memiliki rentang suhu pertumbuhan optimum 30-40oC (Todar 2012), sehingga perbedaan suhu tersebut tidak mempengaruhi hasil analisis jumlah bakteri asam laktat dan bakteri pembentuk asam pada sampel nira.
2. Jumlah Bakteri Asam Laktat dan Bakteri Pembentuk Asam pada Jerigen Penampungan dan Sisa Sayatan Manggar
Wadah penampungan nira dan proses pengirisan manggar yang kurang bersih dapat menjadi sumber kontaminasi bagi nira yang disadap, sehingga nira menjadi cepat rusak (Purnomo 1997). Tabel 6 menunjukkan hasil analisis jumlah bakteri asam laktat dan bakteri pembentuk asam pada jerigen penampungan Sukabumi dan Purbalingga.
9 Tabel 6 Jumlah bakteri asam laktat dan bakteri pembentuk asam pada jerigen
penampungan Sukabumi dan Purbalingga
Pada Tabel 7 disajikan data hasil analisis sisa sayatan manggar asal Sukabumi dan Purbalingga yang juga berpotensi sebagai sumber kontaminasi nira kelapa. Jumlah bakteri asam laktat dan bakteri pembentuk asam yang terhitung pada kedua sampel sisa sayatan manggar tersebut cukup tinggi, sehingga dapat mempengaruhi jumlah mikroba awal pada nira kelapa segar yang baru disadap. Pengirisan manggar dilakukan untuk membuka jalan bagi nira pada proses penyadapan. Ujung manggar yang disayat pada akhirnya akan layu dan busuk selama proses penyadapan berlangsung akibat terkontaminasi mikroba yang dapat berasal dari udara akibat kondisi penyadapan yang terbuka maupun pisau petani yang digunakan untuk menyadap kurang bersih (Purnomo 1997).
Tabel 7 Jumlah bakteri asam laktat dan bakteri pembentuk asam pada sisa sayatan manggar Sukabumi dan Purbalingga
Bakteri asam laktat merupakan salah satu bakteri yang umum ditemukan pada tanaman, sehingga memungkinkan kontaminasi pada nira juga berasal dari sisa sayatan manggar yang layu. Lactobacillus, Pediococcus, dan Leuconostoc
ditemukan pada bagian tanaman rusak. Jumlahnya akan mengingkat seiring dengan proses pemanenan berlangsung. Mikroorganisme dapat berasal dari peralatan mekanik maupun tangan manusia yang digunakan dalam pemanenan (Stirling dan Whittenbury 2008).
3. Pengaruh Lama Penyadapan dan Penggunaan Wadah Penampungan terhadap Mutu Nira Kelapa Purbalingga
Cara penyadapan nira kelapa dengan lama waktu penyadapan dan penggunaan wadah penampungan yang bervariasi dilakukan untuk mengetahui kualitas nira kelapa segar yang dihasilkan. Menurut Naknean et al. (2010) kontaminasi mikroba pada nira berasal dari lingkungan selama penyadapan berlangsung. Mikroba mengkontaminasi nira melalui prosedur penyadapan dan
Asal
Jumlah koloni
(Log CFU/ml air bilasan jerigen penampungan) Bakteri Asam Laktat Bakteri Pembentuk Asam
Sukabumi 5.53 6.45
Purbalingga 5.45 5.61
Asal
Jumlah koloni (Log CFU/g)
Bakteri Asam Laktat Bakteri Pembentuk Asam
Sukabumi 8.00 7.72
10
sanitasi alat yang buruk, sehingga mempengaruhi jumlah mikroba pada nira. Populasi mikroba tersebut akan meningkat dari waktu ke waktu. Tabel 8 menyajikan data hasil analisis pengaruh lama penyadapan terhadap kualitas nira kelapa segar yang dihasilkan.
Tabel 8 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap berdasarkan variasi lama penyadapan
Parameter Lama Penyadapan
4 jam 6 jam
pH 6.00 ± 0.00a 5.50 ± 0.71 a
Total gula (oBrix) 15.70 ± 0.42 a 14.90 ± 0.14 a Jumlah bakteri asam laktat
(log CFU/ml) 7.34 ± 0.16 tidak berbeda nyata (P < 0.05)
Berdasarkan hasil analisis statistik menggunakan t-Test, nira kelapa segar yang dihasilkan dari sadapan 4 jam dan 6 jam tidak berbeda nyata satu sama lain pada taraf kepercayaan 95% (Lampiran 1). Rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam dari kedua cara penyadapan tersebut tidak berbeda nyata. Hal tersebut juga terjadi pada nira segar yang diperoleh dari cara penyadapan berdasarkan wadah penampungan yang digunakan (Tabel 9).
Tabel 9 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap berdasarkan variasi wadah penampungan
Parameter Wadah Penampungan
Plastik Steril Jerigen Penampungan
pH 5.50 ± 0.71 a 5.50 ± 0.71 a
Total gula (oBrix) 14.90 ± 0.14 a 15.20 ± 0.28 a Jumlah bakteri asam laktat
(log CFU/ml) 7.12 ± 0.94 tidak berbeda nyata (P < 0.05)
11 dihasilkan. Variasi pada parameter mutu nira kelapa segar di setiap pohon yang diamati pada penelitian ini disebabkan karena nira yang dihasilkan dari setiap pohon, manggar, serta musim dapat memiliki kualitas yang berbeda-beda (Jnanadevan 2013).
Sayatan manggar diduga sebagai sumber kontaminan yang berpotensi menyebabkan kerusakan awal pada nira melihat hasil analisis terhadap jumlah bakteri asam laktat dan bakteri pembentuk asam pada sampel sisa sayatan manggar yang cukup tinggi (Tabel 7). Nira segar yang diperoleh dari masing-masing cara penyadapan memiliki jumlah bakteri yang tidak berbeda nyata dengan jumlah bakteri pada manggar, sehingga sayatan manggar berpotensi besar sebagai sumber kontaminasi bagi nira kelapa segar. Cairan nira yang baru keluar dari manggar merupakan cairan steril, namun kerusakan nira dapat terjadi sejak nira pertama kali keluar (Naknean et al. 2010).
4. Pengaruh Lama Penyimpanan terhadap Mutu Nira Kelapa
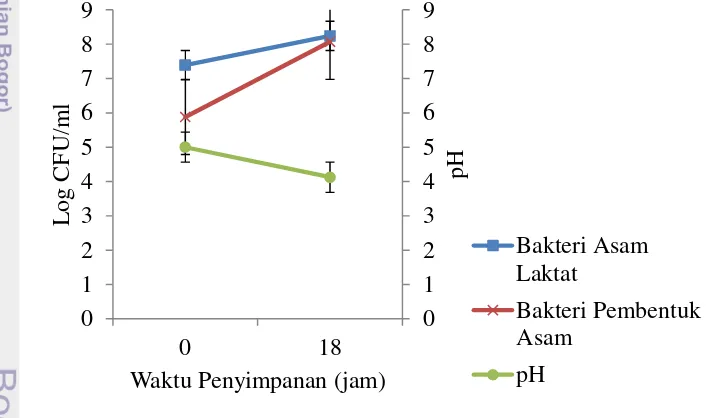
Sampel nira kelapa disimpan untuk mengetahui pengaruh lama penyimpanan terhadap perubahan mutu nira kelapa berupa pH, jumlah bakteri asam laktat, dan bakteri pembentuk asam selama penyimpanan. Gambar 1 menunjukkan pengaruh penyimpanan terhadap rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam serta nilai pH nira kelapa Sukabumi yang disadap selama 6 jam menggunakan jerigen milik petani (pohon 1 dan 2).
Gambar 1 Pengaruh lama penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Sukabumi sadapan 6 jam menggunakan jerigen petani
Penyimpanan sampel nira kelapa asal Sukabumi selama 18 jam dilakukan pada suhu rendah. Peningkatan jumlah bakteri asam laktat dan bakteri pembentuk asam terjadi selama penyimpanan pada suhu dingin tersebut. Bakteri asam laktat bersifat mesofilik. Beberapa di antaranya dapat hidup pada suhu 5oC hingga 45oC, serta dapat bertahan pada pH 3.2 hingga pH yang lebih tinggi yaitu 9.6 (Jay 2005).
12
Nilai pH nira yang disimpan pada suhu dingin tersebut juga mengalami penurunan hingga pH 4 akibat aktivitas mikroba yang masih berlangsung saat penyimpanan. Aktivitas mikroba tersebut memanfaatkan kandungan gula pada nira untuk melakukan fermentasi, sehingga menyebabkan penurunan nilai pH akibat asam organik yang dihasilkan dan peningkatan kadar alkohol pada nira (Battcock dan Azam-Ali 1998).
Gambar 2 menunjukkan pengaruh lama penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan nilai pH nira kelapa asal Purbalingga yang disadap selama 4 jam menggunakan plastik steril (pohon 1 dan 2). Sampel nira kelapa disimpan pada suhu ruang selama 4, 8, dan 16 jam. Rata-rata jumlah bakteri asam laktat pada sampel nira kelapa tersebut mengalami peningkatan selama penyimpanan yang juga diikuti dengan penurunan pH nira kelapa.
Gambar 2 Pengaruh lama penyimpanan terhadap rata-rata jumlah bakteri asam laktat, jumlah bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan 4 jam menggunakan plastik steril
Rata-rata jumlah bakteri pembentuk asam mengalami peningkatan selama penyimpanan 4 jam, namun jumlahnya menurun pada penyimpanan 8 jam dan meningkat kembali pada penyimpanan 16 jam. Peningkatan jumlah bakteri pembentuk asam tersebut dapat disebabkan karena adanya peningkatan jumlah bakteri pembentuk asam, seperti bakteri asam asetat. Bakteri asam asetat muncul seiring dengan peranannya memanfaatkan alkohol hasil fermentasi (Kadere dan Kutima 2012). Bakteri asam asetat akan mengoksidasi alkohol menjadi asam asetat dan asam laktat menjadi CO2 dan H2O, sehingga terjadi penurunan nilai pH
sampel nira (Ray 2004).
Penyimpanan selama 4 jam pada suhu ruang juga menyebabkan penurunan pH dan peningkatan rata-rata jumlah bakteri asam laktat serta bakteri pembentuk asam pada nira kelapa asal Purbalingga sadapan 6 jam menggunakan plastik steril (pohon 3 dan 4) seperti yang ditunjukkan pada Gambar 3.
13
Gambar 3 Pengaruh lama penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan 6 jam menggunakan plastik steril
Pada Gambar 4 disajikan grafik penurunan rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam, serta nilai pH nira kelapa asal Purbalingga yang disadap selama 6 jam menggunakan jerigen penampungan dan disimpan selama 4 jam pada suhu ruang (pohon 5 dan 6). Penurunan rata-rata jumlah bakteri tersebut disebabkan karena gula yang tersedia telah habis atau kadar alkohol yang dihasilkan dari fermentasi mencapai kadar limit toleransi bagi bakteri (Naknean et al. 2010).
Gambar 4 Pengaruh lama penyimpanan terhadap rata-rata jumlah bakteri asam laktat, bakteri pembentuk asam, dan pH nira kelapa asal Purbalingga sadapan 6 jam menggunakan jerigen petani
14
5. Isolasi dan Identifikasi Isolat dari Nira Kelapa Segar Asal Sukabumi dan Purbalingga
Identifikasi dilakukan terhadap isolat sampel dari nira kelapa segar pohon 1 dan 2 asal Sukabumi (NS1 dan NS2) dan sampel nira kelapa segar pohon 5 dan 6 asal Purbalingga (P5 dan P6). Sebanyak 10 isolat dipilih dari masing-masing cawan hasil pemupukan pada media MRSA dan GYC streptomycin. Hanya isolat dengan ciri-ciri sebagai bakteri asam laktat, yaitu Gram positif dan katalase negatif yang dipilih, sehingga terdapat 50 isolat untuk diidentifikasi.
Tabel 10 menunjukkan jumlah isolat nira kelapa segar Sukabumi dan Purbalingga yang diisolasi dari media MRSA dan GYC dengan ciri-ciri Gram positif dan katalase negatif.
Tabel 10 Jumlah isolat Gram positif dan katalase negatif pada nira kelapa segar asal Sukabumi dan Purbalingga
Asal Pohon
Isolat dengan karakteristik Gram positif dan katalase negatif banyak ditemukan pada isolat yang berasal dari media GYC. Pemberian streptomycin pada awalnya digunakan untuk menekan pertumbuhan bakteri asam laktat, sehingga bakteri pembentuk asam lainnya dapat tumbuh pada media GYC (Soni 2007), namun beberapa jenis bakteri asam laktat menunjukkan ketahanan terhadap penambahan streptomycin, seperti Leuconostoc (Zdolec et al. 2011),
Lactobacillus paracasei, Lactobacillus casei, dan Lactobacillus plantarum (Liasi
et al. 2009). Isolat dengan karakteristik Gram positif dan katalase negatif tersebut diidentifikasi menggunakan beberapa uji, seperti pertumbuhan pada berbagai kondisi suhu (10, 15, 30, dan 45oC), pertumbuhan pada kadar garam 4% dan 6.5%, produksi dekstran dari sukrosa, dan produksi CO2 dari glukosa. Seluruh isolat
15
Pada Gambar 5 disajikan hasil identifikasi berdasarkan uji produksi CO2
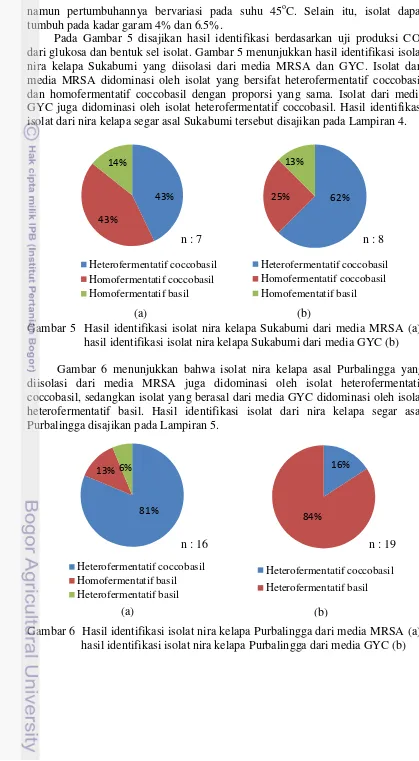
dari glukosa dan bentuk sel isolat. Gambar 5 menunjukkan hasil identifikasi isolat nira kelapa Sukabumi yang diisolasi dari media MRSA dan GYC. Isolat dari media MRSA didominasi oleh isolat yang bersifat heterofermentatif coccobasil dan homofermentatif coccobasil dengan proporsi yang sama. Isolat dari media GYC juga didominasi oleh isolat heterofermentatif coccobasil. Hasil identifikasi isolat dari nira kelapa segar asal Sukabumi tersebut disajikan pada Lampiran 4.
Gambar 5 Hasil identifikasi isolat nira kelapa Sukabumi dari media MRSA (a); hasil identifikasi isolat nira kelapa Sukabumi dari media GYC (b) Gambar 6 menunjukkan bahwa isolat nira kelapa asal Purbalingga yang diisolasi dari media MRSA juga didominasi oleh isolat heterofermentatif coccobasil, sedangkan isolat yang berasal dari media GYC didominasi oleh isolat heterofermentatif basil. Hasil identifikasi isolat dari nira kelapa segar asal Purbalingga disajikan pada Lampiran 5.
Gambar 6 Hasil identifikasi isolat nira kelapa Purbalingga dari media MRSA (a); hasil identifikasi isolat nira kelapa Purbalingga dari media GYC (b)
(a) (b)
n : 7 n : 8
16
Selain isolat dengan karakteristik Gram positif dan katalase negatif, ditemukan juga khamir dan isolat jenis lainnya pada hasil isolasi nira kelapa segar Sukabumi dan Purbalingga. Menurut Vidanapathirana et al. (1983), pada fase pertama fermentasi yang terjadi pada nira, ditemukan khamir dengan populasi di bawah 104 CFU/ml.Tahap identifikasi berupa uji produksi dekstran dari sukrosa dilakukan untuk mengetahui isolat dengan ciri-ciri seperti Leuconostoc mesenteroides yang membentuk koloni berlendir pada media sukrosa agar.
Leuconostoc memiliki karakteristik berupa Gram positif, katalase negatif, dan digolongkan sebagai bakteri heterofermentatif (Harrigan 1998). Berdasarkan tahap identifikasi tersebut, terdapat 26.67% isolat nira kelapa asal Sukabumi dan 57.14% asal Purbalingga yang memiliki karakteristik seperti Leuconostoc mesenteroides. Hasil identifikasi isolat dari nira kelapa segar berdasarkan produksi dekstran dari sukrosa disajikan pada Lampiran 4 dan 5.
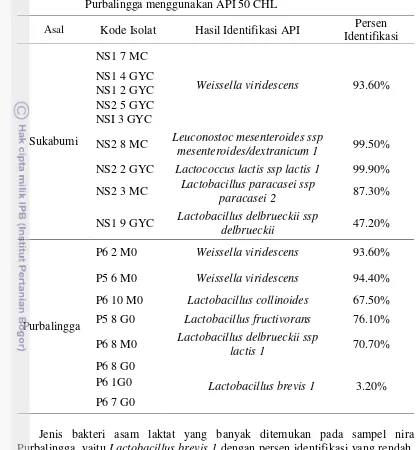
Identifikasi lanjut dengan menggunakan API 50 CHL dilakukan pada isolat terpilih yang mewakili masing-masing kelompok hasil identifikasi. Hasil identifikasi API disajikan dalam Tabel 11. Pemilihan isolat disajikan pada Lampiran 6 dan 7. Sebanyak 17 isolat dari sampel nira asal Sukabumi dan Purbalingga dipilih untuk diidentifikasi menggunakan API 50 CHL.
Isolat nira kelapa Sukabumi didominasi oleh bakteri asam laktat jenis
Weissella viridescens. Sebanyak 5 dari 9 isolat teridentifikasi sebagai Weissella viridescens (NS1 7 MC, NS1 4 GYC, NS1 2 GYC, NS2 5 GYC, dan NS1 3 GYC). Isolat NS2 8 MC dan NS2 2 GYC diidentifikasi sebagai Leuconostoc mesenteroides ssp mesenteroides/dextranicum 1 dan Lactococcus lactis ssp lactis. Leuconostoc mesenteroides ditemukan sebagai mikroba awal pada nira kelapa (Cahyaningsih 2006).
Isolat NS2 3 MC dengan bentuk batang diidentifikasi sebagai Lactobacillus paracasei ssp paracasei 2. Lactobacillus paracasei ssp paracasei 2 dan
Lactococcus lactis ssp lactis 1 juga ditemukan pada Mnazi produk fermentasi nira kelapa di Nigeria (Kadere dan Kutima 2012). Isolat NS1 9 GYC diidentifikasi sebagai Lactobacillus delbrueckii ssp delbrueckii dengan kedekatan sebesar 47.20% terhadap strain tersebut. Pada awalnya isolat NS1 9 GYC memiliki kedekatan sebesar 76.10% terhadap strain Lactobacillus fructivorans, namun hasil identifikasi awal isolat tersebut menunjukkan bahwa isolat NS1 9 GYC memiliki sifat homofermentatif, sedangkan Lactobacillus fructivorans digolongkan sebagai bakteri asam laktat heterofermentatif (Fugelsang dan Edwards 2007). Hal tersebut menyebabkan isolat NS1 9 GYC diidentifikasi sebagai Lactobacillus delbrueckii ssp delbrueckii.
Isolat P6 2 M0 dan P5 6 M0 asal Purbalingga diidentifikasi sebagai Weissella viridescens. Weissella viridescens merupakan bakteri Gram positif, katalase negatif dengan bentuk batang pendek dengan ujung membulat atau oval, dan bersifat anaerobik fakultatif, serta memfermentasi glukosa secara heterofermentatif (Lahtinen et al. 2012). Isolat lainnya diidentifikasi sebagai
17 Tabel 11 Hasil identifikasi isolat dari nira kelapa segar Sukabumi dan
Purbalingga menggunakan API 50 CHL
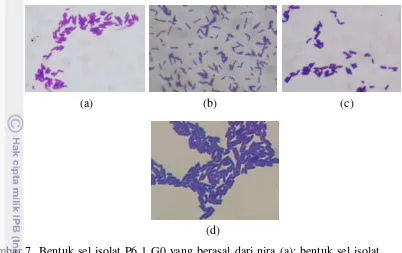
Jenis bakteri asam laktat yang banyak ditemukan pada sampel nira Purbalingga, yaitu Lactobacillus brevis 1 dengan persen identifikasi yang rendah. Hasil pembacaan profil biokimia oleh software APIwebTM terhadap ketiga isolat (P6 8 G0, P6 1 G0, dan P6 7 G0) menunjukkan ketiga isolat tesebut berasal dari jenis Lactococcus lactis ssp lactis 1 dengan persen identifikasi sebesar 57.60%, namun hasil identifikasi awal menunjukkan bahwa ketiga isolat tersebut memiliki bentuk sel berupa batang dan tergolong dalam jenis heterofermentatif sedangkan
Lactococcus lactis ssp lactis memiliki bentuk sel berupa kokus dan bersifat homofermentatif. Lactobacillus brevis 1 merupakan takson berikutnya yang muncul pada hasil identifikasi API ketiga isolat tersebut. Lactobacillus brevis
sering ditemukan pada tanaman yang busuk (Kandler dan Weiss 1986; Pande et al.
2011). Pengamatan terhadap bentuk sel ketiga isolat dilakukan untuk memastikan kesesuaian hasil identifikasi. Bentuk sel ketiga isolat tersebut menunjukkan bentuk yang serupa dengan Lactobacillus brevis hasil isolasi dari jagung yang mengalami fermentasi spontan (Rahmawati et al. 2013).
Asal Kode Isolat Hasil Identifikasi API Persen Identifikasi
NS2 8 MC Leuconostoc mesenteroides ssp
mesenteroides/dextranicum 1 99.50%
NS2 2 GYC Lactococcus lactis ssp lactis 1 99.90% NS2 3 MC Lactobacillus paracasei ssp
paracasei 2 87.30%
NS1 9 GYC Lactobacillus delbrueckii ssp
delbrueckii 47.20%
Purbalingga
P6 2 M0 Weissella viridescens 93.60%
P5 6 M0 Weissella viridescens 94.40%
P6 10 M0 Lactobacillus collinoides 67.50% P5 8 G0 Lactobacillus fructivorans 76.10% P6 8 M0 Lactobacillus delbrueckii ssp
lactis 1 70.70%
P6 8 G0
Lactobacillus brevis 1 3.20% P6 1G0
18
(b) (a)
Gambar 7 Bentuk sel isolat P6 1 G0 yang berasal dari nira (a); bentuk sel isolat P6 7 G0 yang berasal dari nira (b); bentuk sel isolat P6 8 G0 yang berasal dari nira (c); bentuk sel Lactobacillus brevis dari jagung (Rahmawati et al. 2013) (d) pada perbesaran 1000x
SIMPULAN DAN SARAN
Simpulan
Jumlah awal bakteri asam laktat dan bakteri pembentuk asam yang terhitung pada nira kelapa segar asal Sukabumi dan Purbalingga sudah tinggi, sehingga nilai pH nira kelapa segar yang diperoleh juga rendah. Jerigen penampungan dan sisa sayatan manggar dari kedua tempat memiliki jumlah bakteri asam laktat dan bakteri pembentuk asam yang tinggi, sehingga berpotensi sebagai sumber kontaminasi bagi nira kelapa.
Variasi cara penyadapan nira kelapa segar asal Purbalingga berdasarkan lama penyadapan dan penggunaan wadah penampungan tidak menyebabkan perbedaan kualitas nira segar yang dihasilkan terutama jumlah mikroba nira. Penyimpanan menyebabkan penurunan mutu nira kelapa asal Sukabumi dan Purbalingga yang tampak dengan adanya penurunan nilai pH nira selama penyimpanan. Peningkatan rata-rata jumlah bakteri asam laktat dan bakteri pembentuk asam terjadi pada nira kelapa asal Sukabumi yang disimpan selama 18 jam pada suhu dingin dan nira kelapa asal Purbalingga yang disimpan selama 4, 8, 16 jam pada suhu ruang.
Identifikasi isolat bakteri dari nira kelapa segar asal Sukabumi yang diisolasi dari media MRSA dan GYC didominasi oleh isolat heterofermentatif coccobasil. Begitu juga dengan isolat bakteri dari nira kelapa segar asal Purbalingga yang diisolasi dari media MRSA didominasi oleh isolat heterofermentatif cocobasil, sedangkan isolat yang berasal dari media GYC didominasi oleh isolat
(c)
19 heterofermentatif basil. Hasil identifikasi menggunakan API 50 CHL menunjukkan bahwa nira kelapa Sukabumi dan Purbalingga didominasi oleh bakteri asam laktat jenis Weissella viridescens.
Saran
Penelitian mengenai profil khamir dan mikroba lainnya yang terlibat pada kerusakan nira kelapa perlu dilakukan untuk melengkapi profil mikrobiologi nira kelapa untuk memaksimalkan upaya pengendalian mutu nira kelapa.
DAFTAR PUSTAKA
Battcock, Mike, Sue Azam-Ali. 1998. Fermented Fruits and Vegetables: A Global Perspective. Food and Agriculture Organization of the United Nations Rome.
FAO Agricultural Services Bulletin No. 134
BioMérieux. 2007. API 50 CHL Medium [internet]. [diunduh pada 2013 September 17]. lycee-valin.fr/bgb/ftapi/10.pdf
Cahyaningsih, HE. 2006. Identifikasi Bakteri Asam Laktat dari Nira Lontar serta Aplikasinya dalam Mereduksi S. Thypimurium dan A. flavus pada Biji Kakao. [Tesis]. Sekolah Pascasarjana, IPB Bogor.
Fisher, C. and T.R. Scott. 1997. Food Flavours Biology and Chemistry. UK: Royal Society of Chemistry.
Fugelsang, K.C., Edwards C.G. 2007. Wine Microbiology: Practical Application and Procedures. USA (US) : Springer.
Harrigan, W.F. 1998. Laboratory Methods in Food Microbiology. USA (US): WBC Book Manufactures.
Hartanti, Apriliana Wahyu. 2007. Seleksi bakteri asam laktat yang berpotensi sebagai probiotik dari isolat susu ibu. [Skripsi]. Bogor (ID) : IPB.
Jay, James M., Martin J. Loessner, David A. Golden. 2005. Modern Food Microbiology. Seventh Edition. USA (US): Springer Science + Business Media, Inc.
Jnanadevan, R. 2013. Coconut palms suitable for Neera tapping. . Indian Coconut J: 4-8
Kadere, T.T., Kutima P.M.. 2012. Isolation and identification of lactic acid bacteria in coconut toddy (Mnazi). J Asian Sci Res. 2(12): 807-819.
Kandler, O., and Weiss, N. (1986) Regular, non-sporing Gram-positive rods. Di dalam Santosh G. Pande, Fernando A. Pagliai, Christopher L. Gardner, Algevis Wrench, Raed Narvel, Claudio F. Gonzalez, dan Graciela L. Lorca. 2011. Lactobacillus brevis responds to flavonoids through KaeR, a LysR-type of transcriptional regulator. Molecul Microbiol. 81(6): 1623– 1639.
Krishnamoorthy, M., P. Arjun. 2012. Probiotic and antimicrobial activity of bacteria from fermented toddy of Cocus nucifera. J. Acad. Indust. Res.
20
Lahtinen, Sampo, Arthur J. Ouwehand, Seppo Salminen, Atte Von Wright. 2013. Lactic Acid Bacteria. Microbiological and Functional Aspects. Fourth Edition. USA (US) : CRC Press.
Liasi, S. A., T.I Azmi, M. D. Hassan, M. Shuhaimi, A.B. Ariff. 2009. Antimicrobial activity and antibiotic sensitivity of three isolates of lactic acid bacteria from fermented fish product, Budu. Malay J Microbiol. 5(1): 33-37.
Morgan, Stephen L., Stanley N. Deming. 2006. Guide to Microsoft Excel for calculations, statistics, and plotting data. [internet]. [diunduh pada 2014 Januari 13]. http://www.chem.sc.edu/faculty/morgan/resources/excel. Muralidharan, K. and Deepthi Nair S. 2013. Coconut Neera – The hidden
unexplored treasure. Indian Coconut J: 4-8.
Naknean, P, M. Meenune, G. Roudaut. 2010. Characterization of palm sap harvested in Songkhla province, Southern Thailand. J Inter Food Res 17: 977-986.
Narang, S.P. 2004. Food Microbiology. A.P.H New Delhi (IN) Publishing Corporation.
Nuraida, L. 1988. Studies on microorganism isolated from Pozol, a Mexican fermented maize dough. Faculty of Agriculture and Food Department of Food Science and Technology. University of Reading. Di Dalam Hartanti, Apriliana Wahyu. 2007. Seleksi bakteri asam laktat yang berpotensi sebagai probiotik dari isolat susu ibu. [Skripsi]. IPB (ID): Bogor.
Olawale, Adetunji Kola, Akintobi Akinbiyi Olubiyi, David Oluwole Moses. 2010. Evaluation of microbial quality and alkoholic improvement of natural and fermented raphia palmwine (“Ogoro”).JNew York Sci. 3(2): 35-39.
Pandey, Ashok, Colin Webb, Carlos Ricardo Soccol, Christian Larroche. 2006. Enzyme Technology. USA (US): Springer Science+Business Media, Inc and Asiatech Publishers.
Potter, Norman N. and Joseph H. Hotchkiss. 1998. Food Science. Fifth Edition. New York (US) : Aspen Publishers.
Purnomo E. 1997. Upaya Peningkatan Daya Saing Gula Merah Rakyat dari Pengolahan Hasil Tanaman Pemanis Alami. Di dalam : Budijanto S., Editor. Prosiding Seminar Nasional Teknologi Pangan. Denpasar, 16-17 Juli 1997. hlm : 438-450.
Rahmawati, Ratih Dewanti-Hariyadi, Purwiyatno Hariyadi, Dedi Fardiaz, Nur Richana. 2013. Isolasi dan identifikasi mikroorganisme pada fermentasi spontan jagung. J Teknol Indust Pangan. 24 (1): 33-39.
Ray, Bibek. 2004. Fundamental of Food Microbiology. Third Edition. New York (US): CRC Press.
Roberts, T.A., J.L. Cordier, L. Gram, R.B. Tompkin, J.I. Pitt, L.G.M. Gorris, K.M.J. Swanson. 2005. Microorganisms in Foods 6. Springer Link.
Rusbana, Tubagus Bahtiar. 2009. Kajian Pengawetan Nira Menggunakan Asap Cair Tempurung Kelapa [tesis]. Bogor (ID) : Institut Pertanian Bogor. Soheir S. Abd El-Salam. 2012. 16S rRNA Gene Sequence Detection of Acetic
Acid Bacteria Isolated from Tea Kombucha. J New York Sci. 5(3): 55-61. Soni, SK. 2007. Microbes A Source Energy for 21st Century. New Delhi (IN):
21 Stirling, Anna C., R. Whittenbury. 2008. Source of lactic acid bacteria occuring in
silage. J App Bacteriol. 26(1): 86-90.
Todar, Kenneth. 2012. Nutrition and growth of bacteria [internet]. [diunduh pada Januari 4]. http://textbookofbacteriology.net/nutgro_5.html
Vidanapathirana, S., J. D. Atputharajah, and U. Samarajeewa. 1983. Micriobiology of coconut sap fermentation. Vidyodaya J, Arts, Sci., Lett.11 : 35-39.
Wang, NS. 2004. Enzyme kinetic of invertase via initial rate determination. Departement of Chemical Engineering. University of Maryland.
Xia, Qiuyu, Rui Li, Songlin Zhao, Weijun Chan, Hua Chen, Minmin Tang. 2011. Composition changes of post-harvest coconut inflorescence sap during natural fermentation. J Biotechnol African. 10(66): 14999-15005.
Zdolec, Nevijo, Ivana Filipović, Željka Cvrtila Fleck, Aleks Marić, Dean
Jankuloski, Lidija Kozačinski, Bela Njari. 2011. Antimicrobial
22
LAMPIRAN
Lampiran 1 Hasil analisis statistik nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap berdasarkan variasi lama penyadapan
t-Test: Two-Sample Assuming Equal Variances
Jumlah Bakteri Asam Laktat
4 jam 6 jam
Mean 7.335 7.125
Variance 0.02645 0.88445
Observations 2 2
Pooled Variance 0.45545 Hypothesized Mean
Difference 0
df 2
t Stat 0.311171
P(T<=t) one-tail 0.392555 t Critical one-tail 2.919986 P(T<=t) two-tail 0.785109 t Critical two-tail 4.302653 Jumlah Bakteri Pembentuk Asam
4 jam 6 jam
Mean 7.31 6.545
Variance 0.0002 0.45125
Observations 2 2
Pooled Variance 0.225725 Hypothesized Mean
Difference 0
Df 2
t Stat 1.61017
23 pH
4 jam 6 jam
Mean 6 5.5
Variance 0 0.5
Observations 2 2
Pooled Variance 0.25
Hypothesized Mean
Difference 0
df 2
t Stat 1
P(T<=t) one-tail 0.211325 t Critical one-tail 2.919986 P(T<=t) two-tail 0.42265 t Critical two-tail 4.302653 Total Gula
4 jam 6 jam
Mean 15.7 14.9
Variance 0.18 0.02
Observations 2 2
Pooled Variance 0.1
Hypothesized Mean
Difference 0
df 2
t Stat 2.529822
P(T<=t) one-tail 0.063564 t Critical one-tail 2.919986 P(T<=t) two-tail 0.127128 t Critical two-tail 4.302653 Pengambilan kesimpulan
24
Lampiran 2 Hasil analisis statistik nilai pH, total gula, jumlah bakteri asam laktat, dan bakteri pembentuk asam pada nira kelapa Purbalingga yang disadap berdasarkan variasi wadah penampungan
t-Test: Two-Sample Assuming Equal Variances
Jumlah Bakteri Asam Laktat
plastik steril
jerigen penampungan
Mean 7.125 7.94
Variance 0.88445 0.125
Observations 2 2
Pooled Variance 0.504725 Hypothesized Mean
Difference 0
Df 2
t Stat -1.14718
P(T<=t) one-tail 0.185013 t Critical one-tail 2.919986 P(T<=t) two-tail 0.370027 t Critical two-tail 4.302653 Jumlah Bakteri Pembentuk Asam
plastik steril
jerigen penampungan
Mean 6.545 7.945
Variance 0.45125 1.78605
Observations 2 2
Pooled Variance 1.11865 Hypothesized Mean
Difference 0
df 2
t Stat -1.32367
25 pH
plastik steril
jerigen penampungan
Mean 5.5 5.5
Variance 0.5 0.5
Observations 2 2
Pooled Variance 0.5
Hypothesized Mean
Difference 0
Df 2
t Stat 0
P(T<=t) one-tail 0.5 t Critical one-tail 2.919986
P(T<=t) two-tail 1
t Critical two-tail 4.302653 Total Gula
plastik steril
jerigen penampungan
Mean 14.9 15.2
Variance 0.02 0.08
Observations 2 2
Pooled Variance 0.05
Hypothesized Mean
Difference 0
Df 2
t Stat -1.34164
P(T<=t) one-tail 0.155876 t Critical one-tail 2.919986 P(T<=t) two-tail 0.311753 t Critical two-tail 4.302653 Pengambilan kesimpulan
26
Lampiran 3 Rata-rata nilai pH, total gula, jumlah bakteri asam laktat dan bakteri pembentuk pada asam nira kelapa selama penyimpanan
a. Nira kelapa asal Sukabumi
b. Nira kelapa asal Purbalingga Pohon
Rata-rata Jumlah koloni (Log CFU/mL) pH
27 Lampiran 4 Hasil identifikasi isolat nira kelapa asal Sukabumi (NS1 dan NS2)
Bentuk Sel
Asal
Media Kode Isolat
Produksi CO2 dari Glukosa
Suhu Garam Produksi
Dekstran 10 15 45 30 4% 6.50%
Cocobasil
MRSA
NS1 7 MC Homofermentatif +++ +++ ++ ++++ ++ ++ - NS1 3 MC Heterofermentatif ++ +++ + +++ ++ + + NS2 8 MC Heterofermentatif +++ +++ ++ +++ +++ + + NS2 7 MC Heterofermentatif +++ ++ ++ +++ ++ + - NS2 6 MC Homofermentatif +++ +++ ++ ++++ +++ +++ -
NS1 5 MC Homofermentatif + - + ++ ++ + -
GYC
NS2 2 GYC Homofermentatif +++ +++ ++ +++ +++ ++ - NSI 3 GYC Heterofermentatif +++ +++ - ++++ +++ ++ + NS2 6 GYC Heterofermentatif +++ +++ + +++ +++ ++ - NS1 2 GYC Heterofermentatif ++ ++ + +++ ++ + + NS2 5 GYC Heterofermentatif +++ +++ ++ ++++ +++ + - NS1 1 GYC Homofermentatif +++ +++ + ++++ +++ ++ - NS1 4 GYC Heterofermentatif +++ +++ ++ ++++ +++ ++ -
Batang MRSA NS2 3 MC Homofermentatif +++ +++ ++ ++++ +++ +++ -
28
29 Lampiran 6 Pemilihan isolat nira kelapa Sukabumi yang digunakan dalam
identifikasi menggunakan API 50 CHL Bentuk
Sel Sampel
Produksi CO2 dari Glukosa
Pertumbuhan di Berbagai Suhu (oC)
Pertumbuhan pada Berbagai
Kadar Garam
Pertumbuhan pada Media Sukrosa Agar
10 15 45 30 4% 6.50%
Cocobasil
NS1 7 MC Homofermentatif +++ +++ ++ ++++ ++ ++ -
NS1 1 GYC Homofermentatif +++ +++ + ++++ +++ ++ -
NS1 4 GYC Heterofermentatif +++ +++ ++ ++++ +++ ++ -
NS1 3 MC Heterofermentatif ++ +++ + +++ ++ + +
NS1 2 GYC Heterofermentatif ++ ++ + +++ ++ + +
NSI 3 GYC Heterofermentatif +++ +++ - ++++ +++ ++ +
NS2 8 MC Heterofermentatif +++ +++ ++ +++ +++ + +
NS2 2 GYC Homofermentatif +++ +++ ++ +++ +++ ++ -
NS2 7 MC Heterofermentatif +++ ++ ++ +++ ++ + -
NS2 6 GYC Heterofermentatif +++ +++ + +++ +++ ++ -
NS2 5 GYC Heterofermentatif +++ +++ ++ ++++ +++ + -
Batang
NS2 3 MC Homofermentatif +++ +++ ++ ++++ +++ +++ -
NS2 6 MC Homofermentatif +++ +++ ++ ++++ +++ +++ -
NS1 5 MC Homofermentatif + - + ++ ++ + -
NS1 9 GYC Homofermentatif + + - + +++ +++ -
30
Lampiran 7 Pemilihan isolat nira kelapa Purbalingga yang digunakan pada identifikasi menggunakan API 50 CHL
Sel Sampel Produksi CO2 dari
31
RIWAYAT HIDUP
Penulis dilahirkan di Tangerang pada tanggal 11 Oktober 1991 dari ayah Ir. Daryanto, MS Arch dan ibu Umi Tusyanti. Penulis adalah putri kedua dari tiga bersaudara. Tahun 2009 penulis lulus dari SMA Negeri 70 Jakarta. Pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur USMI dan diterima di Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian.
Selama mengikuti perkuliahan, penulis pernah berpartisipasi pada beberapa acara kepanitiaan yang diselenggarakan di kampus IPB, seperti Plasma 2011, HACCP 2011, dan Indonesia Food Expo 2012. Organisasi yang pernah diikuti penulis antara lain Himpunan Mahasiswa Ilmu dan Teknologi Pangan (HIMITEPA) sebagai pengurus periode 2010-2011 dan 2011-2012. Selain itu penulis juga pernah mengikuti kegiatan lainnya, seperti penyuluh Home Industry
pembuatan sari jagung pada acara Social Act Fakultas Ekonomi UI tahun 2011 dan 2012, penyuluhan keamanan pangan yang diselenggarakan oleh Nestle “Koko