AKUMULASI METABOLIT DAN AKTIVITAS ENZIM
SEBAGAI RESPONS TERHADAP CEKAMAN AIR
PADA KELAPA SAWIT (Elaeis guineensis Jacq.)
ENDRI PURWANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Akumulasi Metabolit dan Aktivitas Enzim sebagai Respons terhadap Cekaman Air pada Kelapa Sawit (Elaeis guineensis Jacq.) adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
iv
Respons terhadap Cekaman Air pada Kelapa Sawit (Elaeis guineensis Jacq.). Di bawah bimbingan MARIA BINTANG dan NURITA TORUAN-MATHIUS.
Cekaman air (kekeringan) dapat menghambat pertumbuhan dan menurunkan produktivitas kelapa sawit. Toleransi kelapa sawit terhadap cekaman air dapat diamati berdasarkan respons morfologi, fisiologi, dan biokimia. Respons biokimia kelapa sawit terhadap cekaman air diantaranya adalah terjadinya akumulasi metabolit dan aktivitas enzim. Tujuan penelitian ini adalah untuk menganalisis respons tiga progeni kelapa sawit (fase bibit) yang diberi perlakuan cekaman air berdasarkan akumulasi metabolit dan aktivitas enzim.
Rancangan percobaan yang digunakan adalah rancangan kelompok lengkap teracak (RKLT) faktorial yang terdiri atas tiga faktor, yaitu jenis perlakuan (disiram dan tidak disiram), jenis progeni (P1, P2, dan P3), dan lama perlakuan (0, 9, 18, dan 27 hari). Sampel diambil dari bagian daun dan akar. Penelitian ini dilakukan pada bulan Januari – Februari 2014 di rumah plastik PT SMART Tbk, Sentul, Jawa Barat.
Hasil penelitian menunjukkan bahwa akumulasi metabolit dan aktivitas enzim lebih tinggi di bagian daun dibandingkan dengan di akar baik pada perlakuan disiram maupun tidak disiram. Tanaman yang mengalami cekaman air memiliki kadar asam absisat (ABA), prolin, dan aktivitas enzim pirolin-5-karboksilat sintetase (P5CS) lebih tinggi dibandingkan dengan tanaman kontrol, sebaliknya aktivitas enzim prolin dehidrogenase (PDH) lebih rendah. Akumulasi metabolit dan aktivitas enzim P5CS cenderung meningkat seiring dengan lamanya waktu cekaman, sedangkan aktivitas enzim PDH adalah sebaliknya (cenderung menurun). P5CS adalah enzim yang terlibat dalam proses biosintesis prolin, sedangkan PDH adalah enzim yang berperan dalam proses katabolisme prolin. Peningkatan akumulasi ABA ketika tanaman mengalami cekaman diduga dapat memicu aktivitas enzim P5CS untuk mensintesis prolin sehingga kadar prolin semakin meningkat. Pada saat yang bersamaan, proses katabolisme prolin juga terhambat karena aktivitas enzim PDH menurun. Pada kondisi normal (tidak mengalami cekaman) kadar prolin di setiap organ tanaman diatur oleh aktivitas enzim P5CS dan PDH sehingga kadar prolin relatif konstan. Akumulasi metabolit dan aktivitas enzim pada ketiga progeni yang mengalami cekaman air relatif lebih tinggi pada P3 dibandingkan dengan P1 dan P2, namun tidak signifikan.
a Response to Water Stress on Oil Palm (Elaeis guineensis Jacq.). Supervised by MARIA BINTANG and NURITA TORUAN-MATHIUS.
Water deficit stress could inhibit growth and decrease the productivity of oil palm. Oil palm tolerance to water stress could be observed from the response of the morphology, physiology, and biochemistry. One of biochemical response of oil palm to water stress is the accumulation of metabolites and enzymes activity. The objectives of this research were to analyse response of three progenies to water stress treatment based on accumulation of metabolites and enzymes activity.
The research was arranged in factorial randomized complete block design (RCBD) which consist of three factors, namely : water treatment (watering and no watering), progenies (P1, P2, and P3), and duration of treatment (0, 9, 18, and 27 days). The samples were taken from the leaves and roots. The research was undertaken at green house PT SMART Tbk, Sentul, West Java from January to February 2014.
The result showed that the accumulation of metabolites and activity of enzymes was higher at the leaves than roots either on water deficit stress treatment and normal condition. The plants with water deficit stress have higher content of abscisic acid (ABA), proline, and activity of pyrroline-5-carboxylate synthetase (P5CS) enzyme than normal condition. On the other hand, the activity of proline dehydrogenase (PDH) enzyme was lower. The accumulation of proline, ABA, and enzyme activity of P5CS had been increased along with the length of time stress, while PDH enzyme activity had been decerased. P5CS is an enzyme involved in the process of biosynthesis proline, while PDH is an enzyme that play a role in the process of proline catabolism. The accumulation of ABA could trigger activity of P5CS enzyme to synthesize prolin. At the same time, the process of proline catabolism was inhibited because the activity of enzyme PDH was decline. Under normal condition, levels of proline in any organ plants is regulated by activity of enzymes P5CS and PDH so the level of proline relatively constant. The accumulation of metabolites and enzymes activity was relatively higher on P3 than P1 and P2 but statistically not significant.
vi
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
AKUMULASI METABOLIT DAN AKTIVITAS ENZIM
SEBAGAI RESPONS TERHADAP CEKAMAN AIR
PADA KELAPA SAWIT (Elaeis guineensis Jacq.)
ENDRI PURWANTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
Penguji Luar Komisi pada Ujian Tesis: Dr Ir I Made Artika, M App Sc
Nama : Endri Purwanti
NRP : G851110061
Disetujui oleh,
Komisi Pembimbing
Prof Dr drh Maria Bintang, MS Dr Nurita Toruan-Mathius, MS Ketua Komisi Pembimbing Anggota Komisi Pembimbing
Diketahui oleh
Ketua Program Studi Biokimia Dekan Sekolah Pascasarjana IPB
Prof Dr drh Maria Bintang, MS Dr Ir Dahrul Syah, MscAgr
x
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Penelitian ini merupakan lanjutan dari penelitian-penelitian sebelumnya dari tahun 2009 yang terkait dengan cekaman kekeringan pada tanaman kelapa sawit. Rangkaian kegiatan penelitian ini dilakukan secara bersama (working group) antara bidang fisiologi, biokimia, molekuler, dan bioinformatik. Namun demikian, yang dilaporkan di dalam tesis ini lebih di fokuskan pada bidang fisiologi dan biokimia. Sumber dana penelitian ini berasal dari PT SMART Tbk, Divisi Plant Production and Biotechnology. Sebagian hasil penelitian ini sedang dalam proses publikasi di Jurnal Agronomi Indonesia (JAI).
Penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada Ibu Prof Dr drh Maria Bintang, MS dan Ibu Dr Nurita Toruan-Mathius, MS selaku pembimbing yang telah banyak memberikan arahan, motivasi, dan masukan mulai dari awal sampai akhir.
Selain itu, penulis juga menyampaikan terima kasih kepada :
1. Bapak Jo Daud Dharsono selaku Head of Upstream PT SMART Tbk yang telah memberikan kesempatan kepada penulis untuk melanjutkan studi S2. 2. Bapak Tony Liwang selaku Division Head PT SMART Tbk yang telah
memberikan dukungan selama studi.
3. Dr Ir I Made Artika, M App Sc selaku penguji luar komisi dan Dr Laksmi Ambarsari, MS selaku penguji wakil mayor yang telah memberikan saran dan masukan dalam perbaikan tesis.
4. Bapak Yong Yit Yuan selaku Plant Breeder SMARTRI beserta timnya yang telah membantu melakukan persilangan tetua-tetua bahan tanam.
5. Bapak Hairinsyah, Ibu Janita Tumanggor (PT Damimas Sejahtera) beserta timnya yang telah membantu mempersiapkan bahan tanam.
6. Randi, Yossi, Widyartini, Wulan, dan Zulfikar yang telah bekerja sama dengan baik dalam penelitian working group ini.
7. Seluruh staf dan karyawan Plant Production and Biotechnology Division PT SMART Tbk yang telah membantu dalam proses penelitian.
8. Ibunda Maryati, ayahanda Hadi Suwito (Alm), adik, beserta kakak-kakak, yang senantiasa mendoakan dan memberikan dukungan.
9. Godot Sesarian sebagai teman yang selalu memberikan motivasi.
10. Semua pihak yang telah membantu baik secara langsung maupun tidak langsung, sehingga penelitian ini dapat diselesaikan
Penulis menyadari bahwa dalam penelitian ini masih banyak memerlukan perbaikan di masa mendatang. Semoga karya ilmiah ini bermanfaat bagi yang memerlukannya.
Bogor, Oktober 2014
DAFTAR GAMBAR xii
Peranan Air bagi Pertumbuhan Tanaman 3
Cekaman Kekeringan 4
Respons Tanaman terhadap Cekaman Kekeringan 5
Hubungan ABA dengan Cekaman Kekeringan 6
Peranan Prolin, Enzim P5CS, dan PDH dalam Regulasi Osmotik 8 Cekaman Kekeringan pada Tanaman Kelapa Sawit 9
3 METODE 11
Bahan 11
Alat 12
Tempat dan Waktu Penelitian 12
Tahapan Penelitian 12
Percobaan I. Penetapan kapasitas lapang (KL) media tanah 12 Percobaan II. Penetapan titik layu/stres tanaman 12 Percobaan III. Analisis respons tanaman terhadap cekaman
air
4 HASIL DAN PEMBAHASAN 17
Kapasitas lapang (KL) media tanah 17
Titik layu/stres tanaman 18
Respons fisiologi dan biokimia tanaman 20
KA tanah, KA akar, dan KA relatif daun 20 Akumulasi metabolit dan aktivitas enzim pada daun dan akar 22 Nilai koefisien variasi (CV%) hasil analisis akar dan daun 23 Akumulasi metabolit dan aktivitas enzim pada selang waktu
pengamatan yang berbeda
24
Perbedaan akumulasi metabolit dan aktivitas enzim pada progeni uji
xii
LAMPIRAN 32
RIWAYAT HIDUP 41
DAFTAR GAMBAR
1 Jalur biosintesis prolin pada tanaman monokotil 9 2 Mekanisme respons tanaman kelapa sawit terhadap cekaman
kekeringan
11
3 Nilai rata-rata KA media tanah dari kondisi jenuh air sampai dengan kapasitas lapang (KL)
18
4 Pengaruh proses evapo-transpirasi tanaman terhadap penurunan KA media tanah hingga mencapai titik konstan (a) dan pengaruh penurunan KA media tanah terhadap proses perubahan morfologi daun tanaman (a)
19
5 Nilai rata-rata KA tanah (a), KA akar (b), dan KA relatif daun (c) dari 3 progeni uji pada pengamatan 0 hingga 27 hari
21 pada pengamatan 0 hingga 27 hari perlakuan
25
8 Nilai rata-rata kadar ABA (a), prolin (b), aktivitas enzim (c) dan PDH (d) dari 3 progeni uji selama mengalami cekaman 27 hari
27
DAFTAR LAMPIRAN
1 Bagan alir penelitian 33
2 Pengaturan posisi tanaman di dalam rumah plastik dengan rancangan kelompok faktorial teracak (RKLT) faktorial
34
3 Komposisi pereaksi untuk analisis biokimia 35 4 Nilai rata-rata data suhu (oC) dan kelembaban di dalam rumah
plastik pada percobaan II (a) dan percobaan III (b)
38
5 Kadar prolin, aktivitas P5CS, aktivitas PDH, dan kadar ABA pada daun dan akar yang dipengaruhi oleh perlakuan, lama perlakuan, progeni, dan interaksinya
39
1 PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman perkebunan penghasil minyak nabati yang memiliki nilai ekonomi tinggi di dunia, dan ditanam secara luas di Asia Tenggara seperti Indonesia, Malaysia, dan Thailand (Wilcove dan Koh 2010). Di Indonesia, sebagian besar perkebunan kelapa sawit terdapat di Sumatra, Kalimantan, dan Papua dengan total area mencapai 7.7 juta ha pada Tahun 2010 (Gunarso et al. 2013). Tanaman kelapa sawit tumbuh baik pada iklim tropis, dengan temperatur optimal berkisar antara 24-28 oC dan curah hujan tahunan 1500-4000 mm (Kiswanto et al. 2008). Oleh sebab itu, suplai air yang cukup dan temperatur yang tepat adalah faktor yang sangat penting yang menentukan produktivitas tanaman kelapa sawit.
Pemanasan global merupakan masalah yang serius di seluruh dunia yang mengakibatkan kondisi lingkungan ekstrim, seperti kekurangan air (cekaman kekeringan). Suhu di Indonesia diprediksikan naik sebanyak 0.2-0.3 oC setiap sepuluh tahun. Selain itu juga terjadi penurunan curah hujan sampai dengan 75% pada musim kemarau (Juli-September) (Naylor et al. 2007). Terjadinya “El Nino” yang semakin kuat dan sering, diduga akan memperparah kondisi kekeringan di Indonesia. Cekaman kekeringan akibat perubahan iklim global tersebut dapat memberikan potensi kerugian yang besar pada perusahaan kelapa sawit karena produktivitasnya menurun. Oleh karena itu, salah satu strategi perusahaan kelapa sawit adalah mempersiapkan tanaman yang dapat bertahan dalam kondisi tersebut.
Mekanisme adaptasi tanaman untuk mengatasi cekaman kekeringan di antaranya adalah dengan pengaturan potensial osmotik sel (Cha-um et al. 2010). Prolin merupakan asam amino yang digunakan sebagai senyawa osmotik yang diakumulasi oleh banyak spesies tanaman dalam kondisi cekaman kekeringan (Sharma dan Verslues 2010). Pada keadaan tercekam, prolin menstabilkan protein, membran, dan struktur subseluler serta melindungi fungsi-fungsi seluler (Djilianov et al. 2005). Level prolin intraseluler ditentukan oleh biosintesis, katabolisme dan transport antar sel dan kompartemen seluler yang berbeda. Prolin dibiosintesis di sitosol melalui jalur glutamat oleh enzim pirolin-5-karboksilat sintetase (P5CS). Katabolisme prolin terjadi di dalam mitokondria melalui aksi prolin dehidrogenase (PDH) atau prolin oksidase (POX).
Akumulasi prolin dipengaruhi oleh akumulasi asam absisat (ABA) yang berperan dalam transduksi sinyal. Penurunan level ABA dapat menyebabkan katabolisme prolin sehingga kadar prolin turun (Trotel-Aziz et al. 2003). ABA merupakan salah satu hormon tumbuh yang banyak kaitannya dengan kondisi cekaman lingkungan termasuk cekaman kekeringan. ABA meningkat dengan segera ketika tanaman mengalami cekaman kekeringan (Ye et al. 2012). Peningkatan level ABA di daun menginduksi dan mengatur penutupan stomata, sedangkan peningkatan level ABA di akar meningkatkan konduktivitas hidrolik yang meningkatkan pengambilan dan transportasi air (Parent et al. 2009).
akumulasi prolin, glisin-betain dan produktivitas kelapa sawit (Purwanti et al. 2009). Progeni-progeni tersebut kemudian diuji lebih lanjut dengan analisis microarray untuk mendapatkan informasi gen-gen yang terlibat pada saat terjadi cekaman kekeringan di lapangan. Hasil analisis microarray menunjukkan bahwa gen P5CS1 berhasil diidentifikasi pada progeni kelapa sawit yang diduga toleran. Gen tersebut terekspresi sebanyak 15.57 kali pada progeni kelapa sawit yang diduga toleran terhadap cekaman kekeringan (Budinarta et al. 2012).
P5CS1 merupakan gen penyandi enzim P5CS yang bertanggung jawab dalam biosintesis prolin. Oleh karena itu dalam penelitian ini akan dilakukan analisis aktivitas enzim P5CS, analisis kadar prolin, analisis aktivitas enzim PDH yang berperan dalam katabolisme prolin, dan analisis kadar ABA yang berperan dalam transduksi sinyal. Intensitas pengaruh cekaman kekeringan terhadap tanaman ditentukan oleh tingkat cekaman di antaranya jumlah air yang hilang, tingkat kerusakan, dan lama cekaman, jenis spesies dan genotipe, umur dan fase pertumbuhan/perkembangan tanaman saat mengalami cekaman. Dalam penelitian ini akan dilakukan perlakuan cekaman air pada fase bibit yang berumur 10-11 bulan dengan tujuan bisa mengetahui lebih dini karakter toleransinya terhadap cekaman kekeringan.
Tujuan penelitian
Tujuan penelitian ini adalah untuk 1). menganalisis respons biokimia tiga progeni kelapa sawit pada fase bibit terhadap cekaman air berdasarkan aktivitas enzim P5CS dan PDH, akumulasi prolin dan ABA, 2). menganalisis tingkat akumulasi metabolit dan aktivitas enzim pada bagian daun dan akar, 3) menguji karakter toleransi tiga progeni terhadap cekaman air berdasarkan aktivitas enzim dan akumulasi metabolit.
Manfaat Penelitian
Manfaat hasil penelitian ini adalah :
Seleksi tanaman kelapa sawit yang toleran terhadap cekaman kekeringan dapat dilakukan lebih dini, yaitu pada fase bibit di main nursery. Hal ini akan mempercepat waktu untuk mendapatkan genotipe tanaman kelapa sawit yang toleran cekaman kekeringan.
Tanaman kandidat toleran cekaman kekeringan tersebut selanjutnya diuji pada tahap lapang. Bahan tanam yang toleran cekaman kekeringan tersebut selanjutnya akan diperbanyak dengan teknologi kultur jaringan, sehingga diperoleh ramet-ramet toleran cekaman kekeringan untuk bahan tanam di daerah marginal dengan agroklimat kering.
2 TINJAUAN PUSTAKA
Tanaman Kelapa Sawit
Tanaman kelapa sawit termasuk kelas Monokotil, keluarga Palmae, genus Elaeis dan spesies E. guineensis. Tanaman ini berasal dari Afrika dan Amerika. E. guineensis dikenal sebagai kelapa sawit komersial yang memiliki keunggulan utama pada kandungan minyak mentah (Crude Palm Oil, CPO) yang tinggi. Kelapa sawit komersial dikenal dalam tiga kelompok, yaitu Dura, Pisifera, dan Tenera. Tenera merupakan hasil persilangan Dura x Pisifera.
Tanaman kelapa sawit berakar serabut yang terdiri atas akar primer, sekunder, tersier dan kuartener. Sebagian besar akarnya berada dekat permukaan tanah yaitu pada kedalaman 15-30 cm. Batangnya tegak tidak bercabang, berdiameter 40-75 cm, tinggi batang dalam pembudidayaan tidak lebih dari 15-18 m. Berdaun majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral. Panjang pelepah daun mencapai 9 m dengan panjang helai daun mencapai 1.2 m berjumlah 100-160 pasang. Jumlah pelepah yang dipertahankan dalam perkebunan kelapa sawit sekitar 30-50 pelepah (Hartley 1988).
Kelapa sawit tumbuh baik pada iklim tropis, lama penyinaran matahari yang baik untuk kelapa sawit yaitu antara 5-7 jam/hari. Tanaman ini memerlukan curah hujan tahunan 1500-4000 mm, temperatur optimal 24-28 oC. Ketinggian tempat yang ideal untuk sawit antara 1-500 m dpl (di atas permukaan laut). Kelembaban optimum yang ideal untuk tanaman sawit sekitar 80-90%. Tingkat keasaman (pH) yang optimum untuk sawit adalah 5.0-5.5. Kelapa sawit membutuhkan tanah yang gembur, subur, datar, berdrainase (beririgasi) baik dan memiliki lapisan solum cukup dalam (80 cm). Kemiringan lahan pertanaman kelapa sawit sebaiknya tidak lebih dari 15o (Kiswanto et al. 2008).
Peranan Air bagi Pertumbuhan Tanaman
Air merupakan komponen utama tanaman, yang membentuk 80-90% bobot segar jaringan yang sedang aktif. Air sebagai komponen esensial tanaman memiliki peranan antara lain: (a) sebagai pelarut, didalamnya terdapat gas, garam, dan zat terlarut lainnya, yang bergerak keluar masuk sel, (b) sebagai pereaksi dalam fotosintesis dan pada berbagai proses hidrolis, dan (c) air esensial untuk menjaga turgiditas diantaranya dalam pembesaran sel, pembukaan stomata (Griffin et al. 2004).
Pada keadaan normal tanaman membutuhkan keseimbangan potensial air antara tanah-akar-daun-atmosfer. Keseimbangan ini berarti gradien potensial air antara bagian-bagian tersebut yang memungkinkan tanaman untuk melakukan transpor air dan hara dari akar ke daun. Air akan mengalir dari potensial air tinggi ke potensial air rendah yang dipengaruhi oleh proses transpirasi (Taiz dan Zeiger 2006).
di xilem dari akar sampai ke daun. Peningkatan aliran air ini dibutuhkan untuk pertumbuhan sel tanaman. Aliran air ke sel akan mengakibatkan perbesaran dan pemanjangan sel, sehingga sel dapat tumbuh (Kramer dan Boyer 1995).
Pada kondisi lingkungan tertentu tanaman dapat mengalami defisit air. Defisit air berarti terjadi penurunan gradien potensial air antara tanah-akar-daun-atmosfer, sehingga laju transpor air dan hara menurun (Taiz dan Zeiger 2006). Penurunan ini akan mengakibatkan gangguan pada pertumbuhan tanaman, terutama pada jaringan yang sedang tumbuh (Kramer dan Boyer 1995). Hal ini biasanya terjadi pada tanah yang kekurangan air, sehingga gradien potensial air di tanah dan akar menurun.
Cekaman Kekeringan
Cekaman kekeringan merupakan istilah untuk menyatakan bahwa tanaman mengalami kekurangan air akibat 1) keterbatasan air dari lingkungannya, yaitu media tanam, 2) permintaan air yang berlebihan oleh daun akibat laju evapotranspirasi melebihi laju absorpsi air walaupun keadaan air tanah tersedia cukup, dan 3) kadar garam yang tinggi pada media tanam sehingga akar mengalami kesulitan dalam mengabsorbsi air (Borges 2003).
Air merupakan komponen penting dalam metabolisme, yaitu sebagai komponen protoplasma, bahan fotosintesis, pelarut sebagian besar senyawa, media transportasi, pengatur suhu dan faktor yang memungkinkan terjadinya reaksi kimia. Kehilangan air pada tingkat seluler dapat menyebabkan perubahan konsentrasi senyawa osmotik terlarut, perubahan volume sel dan bentuk membran, perubahan konsentrasi gradien potensial air, kehilangan turgor, kerusakan atau kehancuran integritas membran, dan denaturasi protein. Oleh karena itu pengaruh kekurangan air pada tanaman bersifat sangat kompleks (Mundree et al. 2002).
Tanaman yang mengalami kekurangan air akan mengalami penurunan kadar air relatif daun (relative water content, RWC). Hal tersebut menyebabkan nilai potensial air juga akan turun. RWC merupakan gambaran kandungan air relatif daun tanaman dan merupakan parameter ketahanan bagi tanaman dalam menghadapi kondisi cekaman kekeringan. Proses fotosintesis pada sebagian besar tanaman akan mulai tertekan bila nilai RWC-nya lebih rendah dari 70%, sehingga tanaman memerlukan suatu mekanisme pengaturan dalam tubuhnya di antaranya dengan melakukan penutupan stomata untuk mengurangi laju transpirasi (Quilambo 2004).
Intensitas pengaruh cekaman kekeringan terhadap tanaman ditentukan oleh tingkat cekaman di antaranya jumlah air yang hilang, tingkat kerusakan, dan lama cekaman, jenis spesies dan genotipe, umur dan fase pertumbuhan/perkembangan tanaman saat mengalami cekaman. Cekaman kekeringan dapat mempengaruhi berbagai mekanisme seluler, biokimia dan fisiologi (Mullet dan Whitshit 1996).
dan mengering, pelepah daun tua patah atau terkulai (sengkleh), bahkan dapat mengakibatkan seluruh kanopi mengalami kerusakan.
Dampak negatif cekaman kekeringan terjadi pula pada fase reproduktif terutama terjadinya perubahan perkembangan pembungaan (seks rasio), bunga dan buah muda mengalami keguguran. Tandan buah gagal menjadi masak yang berakibat pada gagal panen dan menurunkan produksi tandan buah segar (TBS) dan minyak sawit mentah (Crude Palm Oil, CPO). Produksi TBS dapat menurun 10-40%, sementara CPO diperkirakan dapat menurun hingga 21-65%.
Respons Tanaman terhadap Cekaman Kekeringan
Respons yang pertama kali dapat diamati pada tanaman yang kekurangan air adalah penurunan conductance yang disebabkan oleh berkurangnya tekanan turgor. Hal ini mengakibatkan laju transpirasi berkurang, dehidrasi jaringan dan pertumbuhan organ menjadi lambat, sehingga luas daun yang terbentuk saat kekeringan lebih kecil. Kekeringan pada tanaman dapat menyebabkan menutupnya stomata, sehingga mengurangi pengambilan CO2 dan menurunkan berat kering
(Ai et al. 2010).
Mekanisme respons tanaman terhadap cekaman kekeringan dapat dibedakan menjadi tiga, yaitu mekanisme escape (luput dari), avoidance (terhindar dari) dan tolerance (toleransi). Luput dari cekaman kekeringan artinya tanaman mampu menyelesaikan siklus hidupnya sebelum terjadi cekaman kekeringan sehingga tidak mengalami cekaman. Terhindar dari cekaman kekeringan adalah kemampuan tanaman untuk mempertahankan potensial air jaringan yang relatif tinggi pada saat mengalami kekeringan, sedangkan toleransi adalah kemampuan tanaman untuk bertahan hidup dengan potensial air jaringan yang rendah.
Pada umumnya tanaman melakukan lebih dari satu mekanisme respons dalam waktu yang sama. Mekanisme terhindar dari cekaman kekeringan pada berbagai tanaman merupakan faktor penting dalam menghadapi cekaman kekeringan. Produksi yang tinggi dalam kondisi cekaman kekeringan pada beberapa tanaman tertentu lebih disebabkan oleh mekanisme terhindar dibandingkan dengan mekanisme toleransi cekaman kekeringan (Ndunguru et al. 1995). Terhindar dari cekaman kekeringan dilakukan dengan cara mengurangi kehilangan air lewat daun dan meningkatkan kemampuan akar dalam menyerap air tanah. Faktor yang memiliki kontribusi pada terhindar dari cekaman kekeringan adalah 1) pertumbuhan akar yang ekstensif dan dalam (umumnya menjadi faktor
paling penting), 2) penutupan stomata untuk mengurangi kehilangan air, 3) penggulungan daun untuk mengurangi luas daun yang terpapar lingkungan, dan
4) deposit lilin pada epikutikular untuk menghambat kehilangan air (Sullivan 1983).
Mekanisme respons tanaman terhadap cekaman kekeringan terjadi melalui proses transduksi sinyal. Proses tersebut melibatkan reseptor sebagai penerima sinyal, phosphoprotein cascade sebagai penghantar sinyal, dan trans-acting factor sebagai pengaktif gen yang mengendalikan respons. Pada tanaman tertentu, ABA berperan sebagai reseptor sekunder yang menghubungkan reseptor utama di membran dengan phosphoprotein cascade (Mundree et al. 2002).
biosintesis osmolit, enzim antioksidan, protein proteksi, dan (b) protein regulator, antara lain berupa trans acting factor. Osmolit selain berperan dalam detoksifikasi, juga berperan dalam keseimbangan osmotik, yaitu mempertahankan tekanan turgor sel (Serraj dan Sinclair 2002).
Hubungan ABA dengan Cekaman Kekeringan
ABA merupakan salah satu hormon tumbuh yang banyak kaitannya dengan kondisi cekaman lingkungan pada tanaman termasuk cekaman kekeringan. Peningkatan konsentrasi ABA pada akar tanaman merupakan sinyal kimia yang akan ditranspor ke daun pada saat tanaman mengalami kekurangan air dari tanah. Ketika cekaman kekeringan terjadi peningkatan sintesis ABA pada akar tanaman sebagai respons terhadap keadaan defisit air tanah. Peningkatan ABA ini terkait dengan status air di akar tanaman. Proses selanjutnya ABA akan ditranspor dari akar menuju daun melalui xilem. Selain di akar, tanaman juga mensintesis ABA di daun, sehingga terjadi peningkatan ABA (Srivastava 2002).
Peningkatan ABA di daun menyebabkan protein channel Kout di sel penjaga
daun akan diaktifkan oleh keberadaan ABA dan protein Kin akan dihambat oleh
ABA, sehingga banyak ion K+ yang keluar dari sel penjaga. Kondisi ini akan menurunkan potensial osmotik sel penjaga sehingga stomata menutup (Roberts dan Snowman 2000). Proses isyarat oleh ABA dari akar ke daun ini dikenal dengan istilah long-distance chemical signaling (Comstock 2002).
Kehilangan ion K+ pada sel penjaga dapat disebabkan oleh penurunan kandungan air daun, dan ABA memegang peranan penting dalam proses ini. ABA disintesis secara lambat terus menerus di sel mesofil dan terakumulasi di kloroplas. Ketika mesofil terhidrasi maka ada dua hal yang akan terjadi yaitu :
1. Sebagian ABA yang disimpan di kloroplas akan dilepas ke apoplas sel mesofil. Redistribusi ABA ini bergantung kepada gradien pH daun, keasaman bahan molekul ABA dan permeabilitas membran sel. Redistribusi ABA memungkinkan aliran transpirasi untuk membawa sebagian ABA ke sel penjaga (Trejo et al. 1995).
2. ABA disintesis dengan kecepatan tinggi di akar sehingga mengakibatkan lebih banyak ABA yang diakumulasi pada apoplas daun (Taiz dan Zeiger 2006).
ABA meningkat dengan segera ketika tanaman mengalami cekaman kekeringan, sebagai respon terhadap kondisi cekaman kekeringan. Terdapat perbedaan tingkat kadar ABA yang terbentuk antara tanaman yang toleran terhadap cekaman kekeringan dibandingkan dengan tanaman yang peka. Kadar ABA pada tanaman yang toleran lebih tinggi dibandingkan dengan tanaman yang peka (Toruan-Mathius et al. 2001).
Konsentrasi ABA pada jaringan tertentu ditentukan oleh proses biosintesis, katabolisme, kompartemen dan transportasi. Beberapa tanaman menunjukkan adanya akumulasi ABA secara signifikan ketika tanaman mengalami cekaman air. Konsentrasi ABA endogenus meningkat lebih dari 10 kali lipat dalam waktu beberapa jam ketika mengalami cekaman kekeringan dan menurun kembali secara drastis hingga ke level normal ketika tanaman mengalami rehidrasi (pengairan kembali) (Ye et al. 2012).
tanaman jagung, laju katabolisme ABA terjadi 11 kali lebih tinggi pada tanaman yang diberi cekaman air dibandingkan dengan kondisi normal. Percobaan yang dilakukan oleh Ye et al. (2012) membuktikan bahwa biosintesis ABA pada akar memerlukan prekursor xantofil yang ditransfer dari daun, hal ini mengindikasikan bahwa percepatan laju katabolik ABA penting untuk menyediakan bahan mentah yang diperlukan akar dalam sintesis de novo ABA ketika akar memerlukan ABA dalam kondisi cekaman. Gen OsABA yang bertanggung jawab dalam katabolisme ABA juga diinduksi oleh cekaman air pada tanaman padi.
Dalam kondisi normal (tidak tercekam), kandungan ABA pada sel tanaman berada dalam level rendah. Kandungan ABA yang rendah diduga diperlukan untuk pertumbuhan tanaman secara normal. Level ABA dapat meningkat secara signifikan selama pemasakan biji dan pada kondisi yang kurang baik, seperti musim kering. ABA dapat menghambat pertumbuhan tanaman (inhibitor) dengan jalan mengurangi atau menghambat kecepatan pembelahan dan pembesaran sel. Pada saat tanaman mengalami kondisi yang kurang baik, misalnya ketika kekurangan air di musim kering, maka tanaman tersebut mengalami dormansi yaitu daun-daunnya akan digugurkan dan yang tertinggal adalah tunas-tunasnya. Dalam keadaan demikian ABA terkumpul/terakumulasi pada tunas yang terletak pada sel penutup stomata, hal ini menyebabkan stomata menutup, sehingga penguapan air berkurang dan keseimbangan air di dalam tubuh tanaman terpelihara. ABA dapat mengurangi kecepatan pertumbuhan dan pemanjangan sel pada daerah titik tumbuh, pengguguran daun dan mendorong dormansi biji agar tidak berkecambah (Parent et al. 2009).
Akumulasi ABA terjadi pada tanaman kelapa sawit yang mengalami cekaman kekeringan. Biosintesis ABA sebelumnya telah diduga hanya terjadi pada akar, tetapi hasil penelitian selanjutnya menunjukkan bahwa ABA juga disintesis di daun khususnya di dalam sel mesofil, jaringan vaskuler dan stomata. Peningkatan level ABA di daun menginduksi dan mengatur penutupan stomata, sedangkan peningkatan level ABA di akar meningkatkan konduktivitas hidrolik yang meningkatkan pengambilan dan transportasi air (Parent et al. 2009). Konsentrasi ABA di dalam jaringan diregulasi oleh beberapa tahap metabolik, baik tahap biosintesis dan inaktivasi.
Pada tanaman tinggi, ABA disintesis secara tidak langsung, yaitu melalui pemotongan oksidatif prekursor carotenoid C40, diikuti oleh dua tahap konversi
xanthoxin menjadi ABA melalui produk antara ABA aldehid. Langkah pertama dalam biosintesis ABA adalah epoksidasi zeaxanthin dan antheraxanthin menjadi
violaxanthin oleh zeaxanthin epoxidase (ZEP) di dalam plastid. Setelah melalui
serangkaian modifikasi struktural, violaxanthin dikonversi menjadi
9-cis-epoxycarotenoid (NCED). Pemotongan oksidatif epoxycarotenoid
9-cis-neoxanthin oleh NCED menghasilkan xanthoxin (C15). Tahap ini diduga sebagai
tahap pertama yang bertanggung jawab dalam jalur biosintesis ABA. Produk xanthoxin kemudian ditranslokasikan ke sitosol yang kemudian dikonversi menjadi ABA melalui dua tahap reaksi dengan produk antara yaitu ABA aldehid.
Sort–chain alcohol dehydrogenase/reductase (SDR) mengkatalisis tahap pertama
mono-oxo tersulfurilasi yang diperlukan oleh aldehyde oxidase dan xanthine dehydrogenase dalam melakukan aktivitasnya (Xiong dan Zhu 2003).
Peranan Prolin, Enzim P5CS, dan PDH dalam Regulasi Osmotik
Beberapa tanaman dapat mempertahankan tekanan turgor yang tinggi juga pada potensial air yang rendah dengan cara meningkatkan potensial osmotik melalui akumulasi zat terlarut yang meningkat di dalam sel. Proses ini disebut penyesuaian osmotik (osmotic adjustment) atau regulasi osmotik. Adanya penyesuaian osmotik, berarti menjaga turgor sel sehingga berarti pula menjaga integritas dan proses fisiologi sitoplasma. Penyesuaian osmotik pada toleransi tanaman terhadap cekaman kekeringan berperan dalam memelihara pemanjangan sel atau perluasan sel melalui pemeliharaan turgor, memelihara pembukaan stomata, memelihara fotosintesis, sehingga menjadikan tanaman tetap dapat bertahan hidup pada kondisi cekaman kekeringan (Naiola 1996).
Prolin merupakan asam amino yang digunakan sebagai senyawa osmotik yang diakumulasi oleh banyak spesies tanaman dalam kondisi cekaman kekeringan (Sharma dan Verslues 2010). Prolin dibiosintesis dan diakumulasi pada berbagai jaringan tanaman yang dicekam kekeringan, terutama pada bagian daun. Peningkatan konsentrasi ABA bertanggung jawab dalam akumulasi prolin, sementara penurunan level ABA dapat menyebabkan degradasi prolin sehingga konsentrasi prolin turun (Trotel-Aziz et al. 2003).
Prolin merupakan osmoprotektan yang disintesis pada saat terjadinya cekaman yang menyebabkan perubahan pada komponen-komponen seluler (Mathur-Bhatnagar et al. 2008). Pada keadaan tercekam, prolin menstabilkan protein, membran, dan struktur subseluler serta melindungi fungsi-fungsi seluler (Djilianov et al. 2005). Menurut Delauney dan Verma (1993) senyawa osmoprotektan prolin dapat digunakan sebagai pembeda tingkat toleransi tanaman terhadap cekaman kekeringan. Tanaman yang mempunyai level peningkatan osmotikum yang lebih tinggi diduga lebih toleran dibandingkan dengan tanaman yang level peningkatan osmotikumnya lebih rendah. Jika terjadi penurunan, maka penurunan yang lebih sedikit dianggap yang lebih toleran.
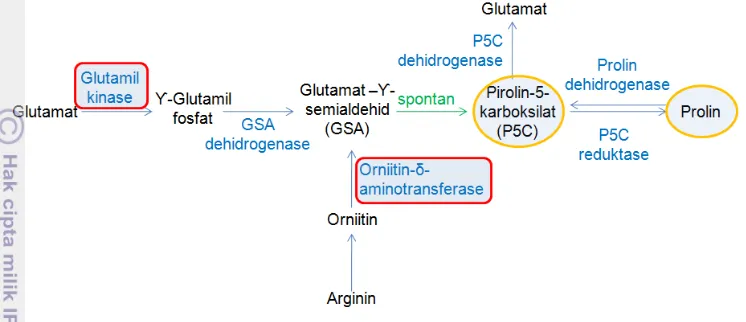
Prolin dibiosintesis melalui jalur glutamat dan jalur ornitin (Gambar 1). Biosintesis prolin melalui jalur glutamat melibatkan enzim P5CS. Enzim P5CS memiliki dua fungsi, yaitu sebagai glutamil kinase (GK) dan glutamat semialdehid (GSA) dehidrogenase. Sementara itu, biosintesis prolin melalui jalur ornitin melibatkan enzim ornitin-δ-aminotransferase (δ-OAT). Enzim δ-OAT mentransfer gugus δ-amino dari ornitin ke α-ketoglutarat, kemudian membentuk GSA dan glutamat. Reduksi glutamat menjadi GSA dilakukan oleh enzim P5CS yang terdiri atas GK dan GSA dehidrogenase. GK mengkatalisis fosforilasi glutamat dengan bantuan ATP. Reduksi glutamil fosfat menjadi GSA dilakukan oleh glutamil fosfat reduktase/GSA dehidrogenase dengan bantuan NADPH. P5C direduksi oleh P5C reduktase menjadi prolin (Szabados dan Savoure 2009). .
sedangkan mitokondria merupakan tempat untuk enzim-enzim yang terlibat dalam katabolisme prolin, seperti PDH, P5CDH dan δ-OAT (Szabados dan Savoure 2009).
Gambar 1 Jalur biosintesis prolin pada tanaman monokotil (Sumber : Lyon 2012)
Enzim P5CS merupakan enzim yang bertanggung jawab dalam biosintesis prolin, sedangkan enzim PDH berperan dalam katabolisme prolin. Potongan daun Canola (Brassica napus L.) yang diberi perlakuan hiper- dan hipo- osmotik menunjukkan bahwa, aktivitas enzim P5CS relatif rendah pada potongan daun yang masih segar. Namun kemudian, aktivitasnya meningkat dengan cepat (hingga dua kali lipat dari sebelumnya) ketika potongan daun tersebut diberi kondisi shock osmotik (tekanan osmotik lebih tinggi, cekaman air), dan aktivitasnya menurun kembali ketika dipindahkan ke medium yang memiliki tekanan osmotik lebih rendah (Trotel-Aziz et al. 2003).
Aktvitas PDH menunjukkan kebalikan dari aktivitas P5CS. Artinya ketika aktivitas P5CS tinggi, maka aktivitas PDH rendah dan sebaliknya. Aktivitas PDH relatif tinggi pada potongan daun Canola yang masih segar, dan kemudian menurun ketika dalam kondisi stres. Aktivitas PDH meningkat kembali setelah daun mengalami rehidrasi (dipindahkan ke medium yang memiliki tekanan osmotik lebih rendah) (Trotel-Aziz et al. 2003).
Prolin dehidrogenase disebut juga sebagai prolin oksidase, merupakan enzim pertama yang berperan dalam jalur katabolisme prolin (Gambar 1), mengkatalisis oksidasi prolin menjadi P5C di dalam mitokondria. Ekspresi gen ProDH diturunkan regulasinya oleh kondisi potensial air yang rendah, dehidrasi dan salinitas (Sharma dan Verslues 2010).
Cekaman Kekeringan pada Tanaman Kelapa Sawit
kekeringan di lapang. Kedua genotipe tanaman kelapa sawit yang telah berumur 14 bulan diberi perlakuan cekaman air di dalam kondisi rumah kaca. Hasil penelitian menunjukkan terjadinya perubahan potensial air daun (PAD), kadar air daun (KAD), kadar air relatif (KAR), luas daun spesifik (LDS), prolin, glisin-betain, ABA, gula silosa, serta protein dengan bobot molekul rendah yang merupakan peubah fisiologis dan biokimia sebagai respon bibit tanaman kelapa sawit terhadap cekaman air. Di antara beberapa peubah yang diamati menunjukkan bahwa, perubahan kadar prolin, gula silosa, dan PAD merupakan karakter pembeda tingkat toleransi tanaman kelapa sawit yang nyata terhadap cekaman kekeringan. PAD pada klon moderat menurun lebih cepat dibandingkan dengan genotipe toleran, demikian juga dengan KAD dan KAR. Kadar ABA baik genotipe yang toleran maupun moderat meningkat sejalan dengan semakin lama tanaman dicekam kekeringan, namun pada cekaman kekeringan 18 hari kadar ABA pada genotipe yang moderat mengalami penurunan. Secara umum kadar ABA pada genotipe toleran lebih tinggi dibandingkan dengan genotipe moderat (Toruan-Mathius et al. 2001).
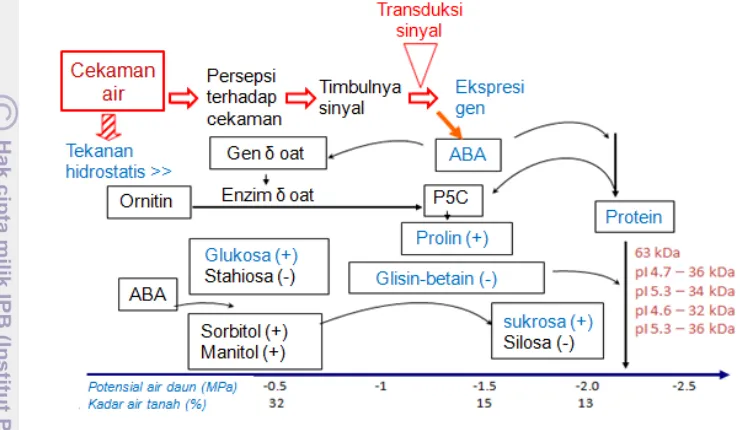
Peubah potensial yang telah digunakan untuk seleksi genotipe yang toleran terhadap cekaman kekeringan kemudian digunakan untuk menguji hibrida kelapa sawit (Toruan-Mathius et al. 2001). Hasil penelitian menunjukkan bahwa hibrida berpotensi toleran memberikan respon terhadap cekaman kekeringan dengan menginduksi protein baru berbobot molekul rendah, sedangkan pada hibrida yang berpotensi peka protein tersebut tidak ditemukan. Aktivitas enzim δ-OAT pada kelompok hibrida kelapa sawit berpotensi toleran lebih tinggi dibandingkan dengan hibrida berpotensi peka terhadap cekaman kekeringan. Ringkasan hasil penelitian tersebut disajikan dalam Gambar 2.
Percobaan di lapang dilakukan pada hibrida kelapa sawit berumur 10 tahun di dua lokasi perkebunan (Riau dan Kalimantan Selatan) yang memiliki perbedaan tipe tanah dan curah hujan (Toruan-Mathius et al. 2004). Pengamatan dilakukan pada empat waktu, pada bulan dengan curah hujan yang berbeda. Hasil penelitian menunjukkan bahwa ada perbedaan respon 11 progeni kelapa sawit terhadap cekaman kekeringan pada lokasi dan waktu pengamatan yang berbeda. Selanjutnya disimpulkan bahwa prolin, enzim δ-OAT, dan protein dapat digunakan sebagai penciri biokimia terhadap cekaman kekeringan pada tanaman kelapa sawit.
Palupi dan Dedywiryanto (2008) melakukan penelitian dengan menggunakan 4 genotipe yang berumur 4 bulan diberi perlakuan cekaman air. Hasil penelitian menunjukkan bahwa cekaman air secara signifikan dapat menghambat pertumbuhan bibit yang diindikasikan oleh penurunan KAD, berat kering batang dan akar, tinggi tanaman, serta panjang dan volume akar. Keempat hibrida tersebut memberikan respon yang berbeda terhadap beberapa peubah yang diukur.
kebocoran elektrolit, KAR dan kadar protein. Progeni yang memiliki nilai PAD dan KA yang lebih tinggi dibandingkan dengan progeni lainnya mengindikasikan bahwa progeni tersebut diduga lebih toleran terhadap cekaman air karena kemampuan relatifnya dalam menjaga kelembaban.
Gambar 2 Mekanisme respons tanaman kelapa sawit terhadap cekaman
kekeringan. (+) konsentrasi meningkat; (-)konsentrasi menurun pada cekaman berat; δ-OAT (ornithine-δ-aminotransferase); P5C (pyrolline- 5- carboxylate); ABA (abscisic acid) (Toruan-Mathius et al. 2001)
3 METODE
Bahan
Bahan tanam yang digunakan dalam penelitian ini berupa bibit kelapa sawit yang berumur 10-11 bulan. Bahan tanam terdiri dari tiga jenis progeni, yaitu progeni 1 (P1), progeni 2 (P2), dan progeni 3 (P3) yang merupakan hasil persilangan antara Dura (tetua jantan) x Pisifera (tetua betina).
Alat
Kadar prolin, aktivitas enzim P5CS dan PDH dianalisis dengan spektrofotometer U-2900 merek Hitachi. Kadar ABA dianalisis dengan kromatografi cair (Ultra High Performance Liquid Chromatography, UPLC) merek Waters, detektor PDA dan kolom Acquity UPLC BEH C18 1.7 µm (2.1 x 50 mm).
Tempat dan Waktu Penelitian
Perlakuan cekaman air dilakukan di dalam rumah plastik di PT SMART Tbk., Sentul, Jawa Barat pada bulan Januari - Februari 2014. Analisis fisiologi dan biokimia dilakuan di Laboratorium Proteomic & Metabolomic, Plant Biotechnology Department, Plant Production Division, PT. SMART Tbk., Sentul, Jawa Barat.
Tahapan Penelitian
Percobaan I. Penetapan kapasitas lapang (KL) media tanah
Kapasitas lapang adalah keadaan tanah yang cukup lembab yang menunjukkan jumlah air terbanyak yang dapat ditahan oleh tanah terhadap gaya tarik gravitasi. Kondisi tersebut selanjutnya disebut sebagai titik kapasitas lapang. Cara penetapan kapasitas lapang adalah sebagai berikut : (i) disiapkan tiga pot kosong yang diisi dengan media tanah dengan bobot yang sama, (ii) media tanah di dalam pot disiram dengan air hingga merata dan jenuh, (iii) untuk memastikan bahwa tanah sudah basah secara merata dan jenuh, pot disiram secara merata hingga air menetes dari lubang di bagian dasar pot selama 5-10 menit, (iv) permukaan atas pot ditutup dengan plastik untuk mencegah penguapan, (v) setiap 24 jam berikutnya pot ditimbang hingga tercapai bobot konstan. Kondisi kapasitas lapang telah tercapai apabila bobot pot telah konstan. Setelah tercapai kondisi kapasitas lapang dilakukan analisis kadar air (KA) media tanah. Nilai KA media tanah pada saat kondisi kapasitas lapang digunakan sebagai dasar untuk menentukan kapasitas lapang pada percobaan berikutnya.
Percobaan II. Penetapan titik layu/stres tanaman
Percobaan III. Analisis respons tanaman terhadap cekaman air
Percobaan dilakukan dengan rancangan kelompok lengkap teracak (RKLT) faktorial (Lampiran 2) yang terdiri atas tiga faktor, yaitu : perlakuan (disiram dan tidak disiram), progeni (P1, P2, dan P3), dan lama perlakuan (0, 9, 18, dan 27 hari). Percobaan diulang tiga kali dengan dua bibit untuk setiap satuan percobaan.
Jumlah air yang ditambahkan untuk perlakuan „disiram‟ dihitung dengan rumus : JA = (BP1-BP2) ρ-1 air (Palupi dan Dedywiryanto 2008), dimana JA : air
Bagian tanaman yang digunakan untuk penetapan kadar ABA, prolin, aktivitas enzim P5CS, dan PDH adalah daun ke-1 s.d. ke-3 dari ujung. Sampel daun, akar, dan tanah dimasukkan ke dalam kantong plastik dan disimpan sementara di cool box. Sampel daun dan akar kelapa sawit dibersihkan dari kotoran/debu yang menempel kemudian dipotong kecil-kecil. Potongan daun dihaluskan dengan nitrogen cair. Sampel yang telah halus disimpan di dalam freezer (-80 oC). Sampel digunakan untuk analisis metabolit dan aktivitas enzim.
Analisis kadar ABA
Kadar ABA dari daun/akar tanaman ditetapkan berdasarkan metode Kelen et al. (2004) yang dimodifikasi. Sebanyak 5 gram serbuk daun/akar diekstraksi menggunakan 30 mL metanol 80%. Sampel dimaserasi di dalam incubating shaker (4 °C) dengan kecepatan 80 rpm selama 24 jam. Ekstrak disaring menggunakan kertas saring Whatman 41. Filtrat yang diperoleh dipekatkan dalam rotary
evaporator pada temperatur 50 °C. Ekstrak pekat dilarutkan dengan 30 mL bufer
fosfat 0.1M pH 8.5. Larutan tersebut dicuci dengan menggunakan etil asetat (3x20 mL). Fase etil asetat dibuang dan fase air diatur pada pH 2.5 menggunakan HCl 1N. Setelah pH 2.5 tercapai, larutan diekstrak dengan dietil eter (3x20 mL). Fase air dibuang dan fase dietil eter ditambahkan CaCO3 untuk mengendapkan sisa air.
Fase dietil eter disaring dengan kertas saring Whatman 41 kemudian diuapkan dengan rotary evaporator pada temperatur 50 oC. Ektrak pekat dilarutkan dalam 2 mL metanol liquid chromatography (LC) grade, kemudian disaring ke dalam vial ultra high performance liquid chromatography (UPLC) dengan syringe filter 0.2 μm. Sampel diinjeksikan ke dalam kromatografi.
Analisis kromatografi cair menggunakan Waters Instrument, detektor PDA dan kolom Acquity UPLC BEH C18 1.7 µm (2.1 x 50 mm). Elusi isokratik menggunakan fase gerak asetonitril 26:74 akuades pH 4 (H3PO4) dengan
Sebagai standar digunakan ABA (Sigma) 100 ppm yang dilarutkan dengan metanol LC grade dalam mikrotube 2 mL. Komposisi pereaksi analisis kadar prolin disajikan pada Lampiran 3.
Kadar ABA dinyatakan dalam mg g-1 sampel basis kering dengan perhitungan sebagai berikut :
Kadar ABA (sampel segar) =
Luas area sampel
Luas area standar x konsentrasi standar ppm x 0,002
bobot sampel segar g x 1000
Kadar ABA basis kering = Kadar ABA (sampel segar) x (100 + kadar air) 100
Analisis kadar prolin
Kadar prolin dari daun/akar tanaman ditetapkan berdasarkan metode Bates et al. (1973). Sebanyak 0.5 g serbuk daun dihomogenisasi dalam larutan
pengekstrak 10 mL asam sulfosalisilat 3% dan disaring dengan kertas Whatman 41. Hasil saringan (supernatan) disimpan pada temperatur 4 oC selama analisis berlangsung. Supernatan direaksikan dengan asam ninhidrin dan asam asetat glasial dalam tabung reaksi selama 1 jam pada penangas air dengan temperatur 100 oC. Larutan campuran diekstrak dengan 4 mL toluen, dikocok kuat dengan vorteks selama 20 detik sehingga terbentuk kromofor dan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 520 nm.
Sebagai standar digunakan Prolin (Sigma) 0, 0.01, 0.03, 0.05, 0.1, dan 0.2 mM yang dilarutkan dengan asam sulfosalisilat 3% dalam labu ukur 10 mL. Masing-masing larutan standar dipipet 2 mL, direaksikan dengan 2 mL asam ninhidrin dan 2 mL asam asetat glasial dalam tabung reaksi selama 1 jam pada penangas air suhu 100 oC . Pengerjaan selanjutnya sama seperti prosedur sampel. Komposisi pereaksi analisis kadar prolin disajikan pada Lampiran 3.
Kadar prolin dinyatakan dalam µmol g-1 sampel basis kering dengan perhitungan sebagai berikut :
Kadar prolin (sampel segar) =
absorbansi
slope x volume asam sulfosalisilat (mL)
bobot sampel daun (g)
Analisis aktivitas enzim P5CS
Aktivitas enzim P5CS dari daun/akar tanaman ditetapkan berdasarkan metode Spoljarevic et al. (2011). Sampel serbuk daun/akar (0.1 g) dihomogenasi dalam 1 mL bufer ekstraksi. Bufer ekstraksi yang digunakan untuk uji P5CS adalah 50 mM tris-HCl (pH 7.5) yang mengandung 10 mM MgCl2, 10 mM β
-merkaptoetanol, 4 mM DTT, 2 mM PMSF (phenylmethanesulfonylfluoride), 1 mM EDTA dan 2% PVPP. Sampel divorteks selama 5 menit kemudian disentrifugasi pada kecepatan 16.000 g, 4 oC selama 10 menit dan supernatan yang dihasilkan digunakan sebagai sumber enzim. Total aktivitas enzim dinyatakan per gram sampel kering.
Disiapkan campuran reaksi yang mengandung 50 mM bufer Tris-HCl (pH 7.0), 20 mM MgCl2, 50 mM L-glutamat, 100 mM hidroksilamin HCl dan 10 mM
ATP. Reaksi dimulai dengan penambahan ekstrak enzim sebanyak 100 µL. Sampel divorteks kemudian diinkubasi selama 15 menit pada 37 oC. Reaksi dihentikan dengan penambahan 1 mL bufer (2.5 g FeCl3 dan 6 g asam
trikloroasetat dalam volume akhir 100 mL 2.5 M HCl). Endapan protein dibuang melalui sentrifugasi (4 oC selama 15 menit pada 10,000 g) dan absorbansi (spektrofotometer UV-VIS) pada 535 nm terhadap blanko dengan metode yang sama namun tanpa ATP.
Sebagai standar digunakan glutamic hydroxamate (GH) (Sigma) 0, 1, 5, 10, 25, dan 50 mg L-1 yang dilarutkan dengan bufer reaksi dalam mikrotube 2 mL. Komposisi pereaksi analisis aktivitas enzim P5CS disajikan pada Lampiran 3.
Satu unit aktivitas enzim P5CS didefinisikan sebagai jumlah enzim yang diperlukan untuk memproduksi 1 mg L-1 glutamic hydroxamate per menit. Aktivitas enzim P5CS dinyatakan dalam mg L-1 enzim menit-1 g-1 sampel basis kering, dengan perhitungan sebagai berikut :
Aktivitas P5CS (sampel segar) = Konsentrasi GH x vol. larutan (0,003 L) Vol. enzim 0,0001 L x 15 menit x sampel segar (g)
Aktivitas P5CS sampel kering = Aktivitas P5CS (sampel segar) x (100 + kadar air) 100
Analisis aktivitas enzim PDH
Disiapkan campuran reaksi yang mengandung 100 mM Na2CO3-NaHCO3
(pH 10.3), 20 mM L-prolin, 10 mM NAD+ . Reaksi dimulai dengan penambahan ekstrak enzim sebanyak 100 µL. Sampel divorteks menit kemudian diinkubasi selama 10 menit pada 28 oC. Reaksi dihentikan dengan penambahan 1 mL bufer (2.5 g FeCl3 dan 6 g asam trikloroasetat dalam volume akhir 100 mL 2.5 M HCl).
Endapan protein dibuang melalui sentrifugasi (4 oC selama 15 menit pada 10.000 g) dan absorbansi (spektrofotometer UV-VIS) pada 340 nm terhadap blanko dengan metode yang sama namun tanpa NAD+.
Sebagai standar digunakan NADH (Sigma) 0, 1, 5, 10, 25, dan 50 mg L-1 yang dilarutkan dengan bufer reaksi dalam mikrotube 2 mL. Komposisi pereaksi analisis aktivitas enzim PDH disajikan pada Lampiran 3.
Satu unit aktivitas enzim PDH didefinisikan sebagai jumlah enzim yang diperlukan untuk memproduksi 1 mg L-1 NADH per menit. Aktivitas enzim PDH dinyatakan dalam mg L-1 enzim menit-1 g-1 sampel basis kering, dengan perhitungan sebagai berikut :
Aktivitas PDH (sampel segar) = Konsentrasi NADH x vol. larutan (0,002 L) Vol. enzim 0,0001 L x 10 menit x sampel daun (g)
Aktivitas PDH basis kering = Aktivitas PDH (sampel segar) x (100 + kadar air) 100
Analisis KA media tanah
Tanah ditimbang ± 20 gram di dalam amplop kertas yang sudah diketahui bobotnya. Sebelum digunakan, amplop kertas dioven 105 oC selama 3 jam, lalu dimasukkan ke desikator dan ditimbang bobot amplop kosong. Sampel tanah dioven 105oC hingga diperoleh bobot konstan.
Penghitungan KA media tanah (%) dilakukan dengan rumus :
KA meda tanah BS−BKM
BS x 100%
Keterangan : BS adalah bobot segar sebelum dioven, BKM adalah bobot kering mutlak setelah dioven.
Analisis KA relatif daun
KA relatif tanaman dapat ditentukan melalui estimasi KA relatif daunnya. KA relatif ini dapat digunakan sebagai salah satu bahan untuk menginterpretasi tingkat stres air dan ketahanan suatu jenis tanaman terhadap kekeringan (Naiola 2006).
plastik. Dituangkan akuades secukupnya ke dalam botol plastik hingga semua potongan daun terendam. Botol plastik ditutup rapat kemudian disimpan di dalam kulkas (4oC) selama 24 jam. Langkah-langkah ini harus dilakukan dengan cepat untuk menghindari kehilangan air dari jaringan daun yang nantinya akan dapat mempengaruhi hasil akhir. Potongan daun dikeringkan dengan menggunakan paper towel dan ditimbang bobot turgidnya. Potongan daun dimasukkan ke dalam amplop kertas kemudian di oven 105 oC hingga diperoleh bobot konstan.
Penghitungan KA relatif (%) dilakukan dengan rumus :
KA relatif daun = BS−BKM
BT−BKM x 100%
Keterangan : BS adalah bobot segar sebelum direndam akuades, BKM adalah bobot kering setelah dioven, dan BT adalah bobot turgid setelah direndam air hingga jenuh.
Analisis KA akar
Akar dipotong kecil-kecil kemudain ditimbang ± 2 gram di dalam amplop kertas yang sudah diketahui bobotnya. Sampel akar dioven 105 oC hingga diperoleh bobot konstan.
Penghitungan KA akar (%) dilakukan dengan rumus :
KA akar =BS−BKM
BS x 100%
Keterangan : BS adalah bobot segar sebelum dioven, BKM adalah bobot kering mutlak setelah dioven.
Analisis Data
Data pengamatan dianalisis menggunakan analisis ragam model General
Linear Model dan faktor-faktor yang menyebabkan perbedaan nyata pada
keragaman data dilakukan pengujian lanjut menggunakan metode Duncan's Multiple Range Test (DMRT).
4 HASIL DAN PEMBAHASAN
Kapasitas lapang (KL) media tanah
media tanam tersebut merupakan kadar air optimum yang mampu diserap oleh akar tanaman.
Hasil percobaan ini dapat memberikan informasi mengenai KA optimum di dalam media tanah untuk pertumbuhan tanaman secara normal (kontrol) dalam percobaan selanjutnya. Palupi dan Dedywiryanto (2008) dalam percobaannya menggunakan media tanah yang memiliki KA 24% dalam kondisi KL. Dalam percobaan ini, KA media tanah pada kondisi KL adalah 31.37% (Gambar 3). Hal ini menunjukkan bahwa tanah yang digunakan sebagai media tanam dalam percobaan ini diduga memiliki tekstur yang cukup liat (memiliki kadar tanah liat yang tinggi) sehingga mampu mengikat air yang cukup banyak. Perbedaan jenis tanah yang digunakan sebagai media tanam pada setiap percobaan dapat memberikan hasil yang berbeda. Tanah yang memiliki tekstur berpasir cukup tinggi akan sulit menahan air untuk diserap oleh akar tanaman, sedangkan tanah yang bertekstur liat cukup tinggi akan mengikat air yang cukup banyak namun sulit untuk diserap oleh akar tanaman.
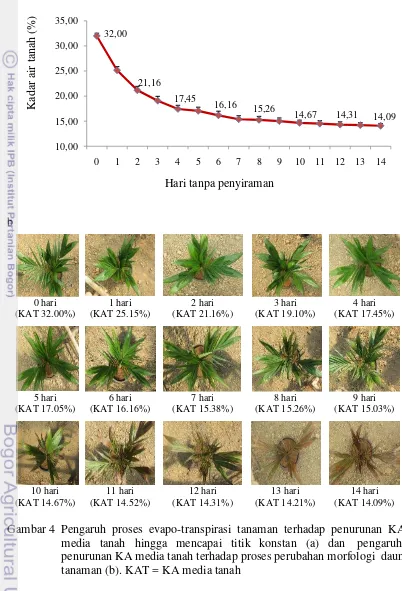
Gambar 3 Nilai rata-rata KA media tanah dari kondisi jenuh air sampai dengan kapasitas lapang (KL)
Titik layu/stres tanaman
Penurunan kadar air tanah sebagai media tanam bibit kelapa sawit berumur 10-11 bulan dan proses perubahan kondisi fisik tanaman tersebut dapat dilihat pada Gambar 4. Percobaan ini dilakukan dengan menggunakan masing-masing empat tanaman setiap progeni, sehingga jumlah total tanaman yang digunakan adalah 12 tanaman (3 progeni x 4 tanaman). Semua tanaman disiram hingga jenuh, kemudian dibiarkan (tidak disiram lagi) hingga tanaman menjadi layu. KA media tanam setelah media disiram sampai jenuh dan air tidak menetes lagi (oleh gaya gravitasi) adalah ± 32.00%. Pada percobaan sebelumnya disebutkan bahwa KA pada saat media tanah dalam kondisi KL adalah ± 31.37% (Gambar 3). Dengan demikian dalam percobaan ini, kondisi KL diperkirakan tercapai beberapa jam setelah hari ke-0. Pada percobaan sebelumnya, penetapan KL media tanah dilakukan terhadap media tanpa tanaman. Dalam percobaan ini penetapan KL dilakukan terhadap media yang berisi tanaman sehingga kehilangan air tidak hanya
disebabkan oleh gaya gravitasi namun juga oleh proses evaporasi dan transpirasi tanaman. Oleh karena itu, untuk mengetahui tanaman sudah dalam kondisi KL adalah dengan mengetahui KA dalam media tanah tersebut, yaitu ± 31.37%.
a
KA media tanah selanjutnya menurun karena adanya proses evaporasi dan transpirasi dari tanaman. KA media tanah menurun secara drastis selama beberapa hari pertama (0 s.d. 4 hari). Hal ini diduga karena, pada hari ke-0, tanaman dalam kondisi KL sehingga mampu menyerap air secara optimal disertai proses evaporasi dan transpirasi yang optimal juga. Ketika KA media tanah mencapai 17.45% (hari ke-4), persediaan air di dalam media mulai sulit untuk diserap oleh akar tanaman sehingga penurunan KA media tanah tidak terlalu drastis (relatif konstan). Pada minggu pertama tanaman belum tampak layu, kemudian seiring dengan berjalannya waktu tanaman mulai layu mulai hari ke-10 dan seterusnya hingga hari ke-14.
Informasi dari percobaan ini dapat digunakan sebagai dasar untuk percobaan selanjutnya, diantaranya untuk menentukan rancangan percobaan, jumlah tanaman yang digunakan, jumlah ulangan, jumlah titik pengambilan sampel, dan untuk memperkirakan lama waktu yang diperlukan bagi bibit berumur 10-11 bulan untuk bertahan dalam kondisi cekaman air. Pada percobaan selanjutnya dilakukan sampling akar dan daun untuk analisis beberapa peubah fisiologi dan biokimia. Untuk analisis enzim, sampel akar/daun yang diambil harus dalam keadaan masih hidup/aktif (daun berwarna hijau). Oleh karena itu pada percobaan selanjutnya, sampling dihentikan ketika tanaman sudah tidak memungkinkan untuk di ambil sampel daun dan akarnya. Jika dilihat dari percobaan ini maka perkiraan panen dihentikan pada hari ke-12 ketika KA media tanah mencapai 14.31%. Pada hari ke-12 sebagian besar daun sudah tampak layu, namun masih ada beberapa daun (daun ke-0, 1, dan 2) yang masih cukup hijau, sedangkan pada hari ke-13, seluruh daun sudah tampak layu.
Respons fisiologi dan biokimia tanaman
KA tanah, KA akar, dan KA relatif daun
Cekaman kekeringan pada tanaman berkaitan erat dengan ketersediaan air di dalam tubuh tanaman itu sendiri. Apabila kelembaban media tanaman berkurang atau berada pada keadaan kering, maka KA relatif daun juga akan menurun sehingga tanaman akan mengalami cekaman air. Analisis KA relatif daun dilakukan untuk memperkirakan KA relatif yang terdapat pada tanaman. KA relatif daun dapat digunakan sebagai salah satu peubah untuk mengetahui tingkat cekaman air dan ketahanan suatu jenis tanaman terhadap kekeringan (Naiola 2006).
Laju penurunan KA tanah pada percobaan III (Gambar 5) berbeda dengan percobaan II (Gambar 4). Penurunan KA tanah pada percobaan III tidak secepat penurunan KA tanah pada percobaan II. Hal ini diduga disebabkan oleh kondisi temperatur yang berbeda pada saat percobaan II dan III. Pada percobaan II, temperatur di dalam rumah plastik relatif tinggi yaitu mencapai 30-35 oC, dengan kelembaban yang relatif rendah (60-65%) (Lampiran 4). Sementara pada percobaan III, temperatur di dalam rumah plastik relatif rendah yaitu sekitar 25-30
o
C dan kelembaban relatif tinggi yaitu 70-80% (Lampiran 4). Hal ini disebabkan oleh kondisi cuaca yang mendung dan hujan pada saat dilakukan percobaan III, sementara pada saat percobaan II, kondisi cuaca terang dan panas setiap hari.
Akumulasi metabolit dan aktivitas enzim pada daun dan akar
Untuk mengetahui respons tanaman terhadap cekaman air, umumnya dilakukan analisis biokimia terhadap sampel daun. Namun demikian, ketika tanaman mengalami cekaman kekeringan, bagian tanaman yang pertama kali memberikan respons adalah akar. Sebelumnya, belum pernah dilaporkan bagaimana respons biokimia akar tanaman kelapa sawit ketika mengalami cekaman kekeringan. Oleh karena itu, dalam penelitian ini sampling dilakukan pada bagian daun dan juga akar.
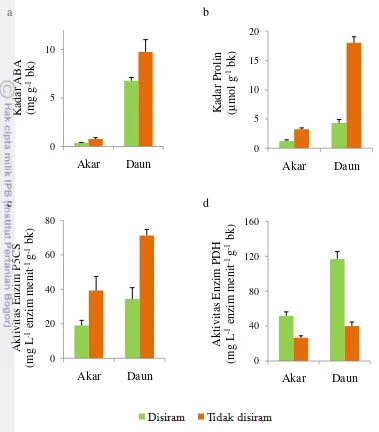
Kadar ABA, prolin, aktivitas enzim P5CS dan PDH lebih tinggi pada bagian daun dibandingkan dengan akar, baik pada perlakuan „disiram‟ maupun „tidak disiram‟ (Gambar 6). Biosintesis ABA sebelumnya diduga hanya terjadi di bagian akar, tetapi hasil penelitian selanjutnya menunjukkan bahwa ABA juga dibiosintesis di daun khususnya di dalam sel mesofil, jaringan vaskuler dan stomata (Zhang et al. 2012). Biosintesis ABA di akar memerlukan prekursor xantofil yang ditransfer dari daun (Ren et al. 2007). Peningkatan level ABA di daun menginduksi dan mengatur penutupan stomata, sedangkan peningkatan level ABA di akar meningkatkan konduktivitas hidrolik yang meningkatkan pengambilan dan transportasi air (Parent et al. 2009).
lebih tinggi pada bagian akar dibandingkan dengan daun baik perlakuan kontrol maupun perlakuan cekaman kekeringan (Valentovic et al. 2006).
a b
c d
Gambar 6 Nilai rata-rata kadar ABA (a), prolin (b), aktivitas enzim P5CS (c) dan PDH (d) pada akar dan daun dari 3 progeni uji pada pengamatan hari ke-27. bk = basis kering.
Nilai koefisien variasi (CV%) hasil analisis akar dan daun
Berdasarkan hasil analisis (Tabel 1) menunjukkan bahwa nilai CV lebih tinggi pada sampel akar dibandingkan dengan daun. Media tanah yang digunakan dalam percobaan ini memiliki komposisi tanah liat yang cukup tinggi. Pada saat dilakukan pencabutan akar dari media tanah, tampak bahwa banyak sekali kotoran berupa tanah lengket yang menempel pada akar, dan cukup sulit dibersihkan meskipun akar tersebut dicuci dengan air. Adanya pengotor yang menempel di akar bisa mempengaruhi hasil analisis di laboratorium. Pengaruh tersebut dapat
menyebabkan nilai CV semakin tinggi. Jadi sebaiknya jika akan dilakukan sampling pada akar, tanaman ditanam pada media tanam berupa tanah yang cukup gembur atau kandungan lempungnya sedikit, sehingga akar mudah dibersihkan. Selain itu, jika menggunakan sampling akar, agak sulit untuk mendapatkan konsistensi sampling. Konsistensi sampling pada daun bisa dilakukan dengan menggunakan sampel misalnya daun ke-0 s.d. ke-2 dari ujung. Namun kalau pada akar, sampling dilakukan secara acak.
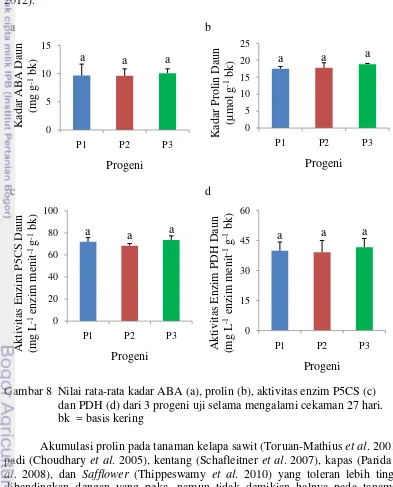
Tabel 1 Nilai rata-rata, standar deviasi (SD), dan koefisien variasi (CV%) untuk peubah kadar prolin, aktivitas enzim, kadar ABA, dan status air tanaman
Akumulasi metabolit dan aktivitas enzim pada selang waktu pengamatan yang berbeda
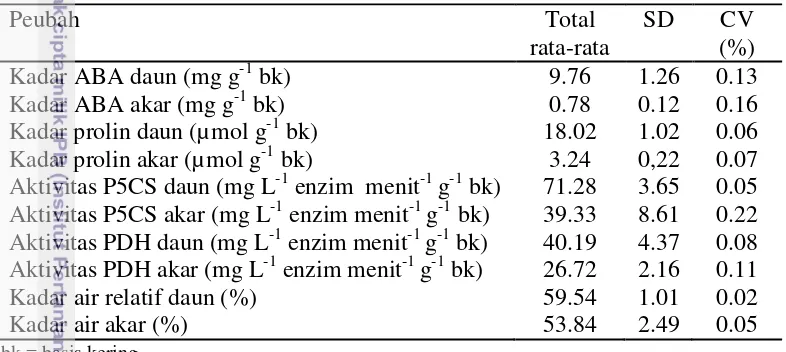
Data yang disajikan berikut ini (Gambar 7) merupakan hasil analisis yang diperoleh dari sampel daun. Untuk mengetahui lebih detail hasil analisis akar dan daun dapat dilihat pada Lampiran 5. Kadar ABA, prolin, aktivitas enzim P5CS, dan PDH pada perlakuan kontrol (disiram) relatif konstan. Tanaman yang tidak disiram memiliki kadar ABA, prolin, dan aktivitas enzim P5CS yang lebih tinggi dibandingkan tanaman yang disiram. Enzim P5CS merupakan enzim yang bertanggung jawab dalam biosintesis prolin. Meningkatnya aktivitas enzim P5CS diikuti dengan meningkatnya akumulasi prolin. Sebaliknya, aktivitas enzim PDH lebih tinggi pada tanaman yang disiram dibandingkan dengan tanaman yang tidak disiram. Enzim PDH merupakan enzim yang bertanggung jawab dalam katabolisme prolin. Ketika tanaman tidak disiram maka aktivitas enzim PDH dihambat sehingga akumulasi prolin meningkat.
tanaman yang diberi cekaman dan prolin terakumulasi hanya pada jaringan akar (Sziderics et al. 2010).
a b
c d
Gambar 7 Nilai rata-rata perubahan kadar ABA (a), prolin (b), aktivitas enzim P5CS (c) dan PDH (d) dari 3 progeni uji (sampel daun) pada pengamatan 0 hingga 27 hari perlakuan. bk = basis kering
Dalam kondisi normal (tidak mengalami cekaman), kadar ABA pada sel tanaman berada pada level rendah. Kadar ABA yang rendah diduga diperlukan untuk pertumbuhan tanaman secara normal. Kadar ABA meningkat selama cekaman air hingga 27 hari. ABA merupakan salah satu hormon tumbuh yang banyak kaitannya dengan kondisi cekaman lingkungan pada tanaman termasuk cekaman air. Level ABA diduga meningkat karena menurunnya kadar air media tanah sehingga tanaman mengalami cekaman air. Level ABA yang tinggi menghambat berbagai proses fisiologi tanaman, termasuk pemanjangan daun dan cabang serta pertumbuhan tanaman.
ABA meningkat dengan segera ketika tanaman mengalami cekaman air, sebagai respons terhadap cekaman air. Mekanisme respons tanaman terhadap
cekaman kekeringan terjadi melalui transduksi sinyal. Proses tersebut melibatkan reseptor sebagai penerima sinyal, phosphoprotein cascade sebagai penghantar sinyal, dan trans-acting factor sebagai pengaktif gen yang mengendalikan respons. Pada tanaman tertentu, ABA berperan sebagai reseptor sekunder yang menghubungkan reseptor utama di membran dengan phosphoprotein cascade (Mundree et al. 2002). Beberapa tanaman menunjukkan adanya akumulasi ABA secara signifikan ketika tanaman mengalami cekaman air.
Peningkatan akumulasi ABA diduga dapat memicu aktivitas enzim P5CS untuk mensintesis prolin. Akumulasi prolin merupakan respons yang sangat umum terjadi pada tanaman yang diberi cekaman kekeringan. Asam amino ini diduga memiliki pengaruh yang menguntungkan di dalam jaringan tanaman, khususnya melalui keterlibatan dalam penyesuaian osmotik. Prolin juga dapat bertindak sebagai bufer di dalam potensial redoks seluler, sebagai peredam radikal bebas dan stabiliser struktur subseluler. Prolin juga terlibat dalam sintesis protein dinding sel dimana prolin dikonversi menjadi hidroksiprolin. Selama tanaman mengalami cekaman, proses katabolisme prolin dihambat oleh aktivitas enzim PDH.
Potongan daun Canola (Brassica napus L.) yang diberi perlakuan hiper- dan hipo-osmotik menunjukkan bahwa aktivitas enzim P5CS relatif rendah pada potongan daun yang masih segar. Namun kemudian, aktivitasnya meningkat dengan cepat (hingga dua kali lipat dari sebelumnya) ketika potongan daun tersebut diberi kondisi shock osmotik (tekanan osmotik lebih tinggi, cekaman air), dan aktivitasnya menurun kembali ketika dipindahkan ke medium yang memiliki tekanan osmotik lebih rendah (Trotel-Aziz et al. 2003).
Akumulasi prolin sebagai respons terhadap kondisi cekaman kekeringan diatur oleh kedua rangsangan yaitu biosintesis oleh enzim P5CS dan penghambatan degradasi melalui inaktivasi enzim PDH (Trotel-Aziz et al. 2003). Aktivitas PDH menunjukkan kebalikan dari aktivitas P5CS. Artinya ketika aktivitas P5CS tinggi, maka aktivitas PDH rendah dan sebaliknya. Aktivitas PDH relatif tinggi pada potongan daun Canola yang masih segar, dan kemudian menurun ketika dalam kondisi cekaman. Aktivitas PDH meningkat kembali setelah daun mengalami rehidrasi (dipindahkan ke medium yang memiliki tekanan osmotik lebih rendah) (Trotel-Aziz et al. 2003).
Regulasi volume sel dengan penyesuaian keseimbangan osmotik antara dalam dan luar sel merupakan mekanisme penting untuk mengatasi cekaman kekeringan. Untuk menjaga keseimbangan osmotik, tanaman mensintesis „osmolit organik‟ seperti prolin dan glisin-betain. Semua tanaman mempunyai jalur biosintetik prolin sedangkan jalur biosintetik betain terbatas pada tanaman seperti Amaranthacesae. Level akumulasi osmolit ditentukan oleh laju biosintesis, metabolisme dan transport. Meskipun biosintesis prolin dan betain telah diketahui namun transportnya belum diketahui (Yamada et al. 2011).
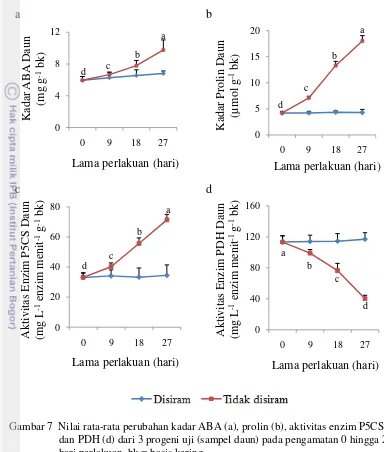
Perbedaan akumulasi metabolit dan aktvitas enzim pada progeni uji
ke-27 juga dapat dilihat pada Lampiran 6. Menurut Toruan-Mathius et al. (2001), terdapat perbedaan tingkat kadar ABA yang terbentuk antara tanaman yang toleran terhadap cekaman kekeringan dibandingkan dengan tanaman yang peka. Kadar ABA pada tanaman kelapa sawit yang toleran lebih tinggi dibandingkan dengan tanaman yang peka. P1 merupakan progeni standar (progeni kontrol) yang selalu digunakan untuk setiap percobaan yang dilakukan di PT. SMART Tbk. P2 merupakan progeni hasil persilangan antara induk jantan (Pisifera) yang diduga toleran dengan induk betina (Dura) yang diduga peka, sedangkan P3 merupakan progeni hasil persilangan antara kedua induk (Pisifera x Dura) yang diduga toleran berdasarkan hasil penelitian sebelumnya (Purwanti et al. 2009 dan Budinarta et al. 2012).
a b
c d
Gambar 8 Nilai rata-rata kadar ABA (a), prolin (b), aktivitas enzim P5CS (c) dan PDH (d) dari 3 progeni uji selama mengalami cekaman 27 hari. bk = basis kering
Akumulasi prolin pada tanaman kelapa sawit (Toruan-Mathius et al. 2001), padi (Choudhary et al. 2005), kentang (Schafleitner et al. 2007), kapas (Parida et
al. 2008), dan Safflower (Thippeswamy et al. 2010) yang toleran lebih tinggi