KAJIAN
IN VITRO
PRODUK ENKAPSULASI
NANOEMULSI EKSTRAK JINTAN HITAM (
Nigella sativa
)
ROVIE FARAH DIBA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian In Vitro Produk Enkapsulasi Nanoemulsi Ekstrak Jintan Hitam (Nigella sativa) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
RINGKASAN
ROVIE FARAH DIBA. Kajian In Vitro Produk Enkapsulasi Nanoemulsi Ekstrak Jintan Hitam (Nigella sativa). Dibimbing oleh SEDARNAWATI YASNI dan SRI YULIANI.
Jintan hitam (Nigella sativa) adalah tanaman herbal yang banyak tumbuh di negara Mediteranea dan dapat mengobati berbagai penyakit. Penelitian telah banyak dilakukan terhadap ekstrak jintan hitam, yaitu fraksi minyak atsiri dan oleoresin, serta khasiat jintan hitam. Beberapa hasil penelitian secara in vitro dan in vivo menyatakan bahwa jintan hitam dapat menghambat pertumbuhan mikroba, menurunkan kadar gula darah (hipoglikemi), dan meningkatkan imunitas tubuh. Banyak senyawa bioaktif yang bersifat lipofilik dan kelarutannya rendah dalam air memiliki penyerapan yang terbatas dalam saluran pencernaan. Sistem pengantaran enkapsulasi berbasis nanoemulsi minyak dalam air merupakan pendekatan yang efektif dalam memasukkan senyawa bioaktif. Enkapsulasi nanoemulsi dapat melindungi senyawa bioaktif terhadap degradasi selama penyimpanan, mengurangi dampak terhadap sifat organoleptik makanan dan meningkatkan bioavailabilitasnya. Ekstrak jintan hitam yang terdispersi dalam fase air menggunakan pengemulsi yang sesuai dapat dihasilkan dengan metode energi rendah, yaitu teknik emulsifikasi spontan. Penelitian ini bertujuan untuk memproduksi nanoemulsi dan enkapsulasi nanoemulsi ekstrak jintan hitam serta kajian sifat fungsional secara in vitro.
Metode penelitian yang dilakukan meliputi ekstraksi, pembuatan dan karakterisasi nanoemulsi ekstrak jintan hitam, proses enkapsulasi nanoemulsi ekstrak jintan hitam, pengujian disolusi untuk mengkaji kelarutan senyawa aktif (senyawa fenolik) dalam medium asam (buffer klorida) dan medium basa (buffer fosfat), serta mengkaji kemampuan ekstrak jintan hitam, nanoemulsi dan produk enkapsulasi dalam menurunkan kadar gula darah secara in vitro melalui uji penghambatan enzim alfa glukosidase. Dalam formulasi nanoemulsi digunakan fase organik ekstrak jintan hitam yang terlarut dalam pelarut organik etanol 70%, serta fase air terdiri dari Tween 80 dan pelarut air. Konsentrasi Tween 80 sebagai surfaktan yang digunakan meliputi 1%, 2%, dan 3% (w/w). Nanoemulsi terbaik ditentukan berdasarkan ukuran, kehomogenan, dan kestabilan partikel. Proses enkapsulasi menggunakan bahan penyalut maltodekstrin atau disebut M (100%) dan campuran maltodekstrin dengan isolat protein kedelai pada rasio 80 dan 20 (w/w), untuk kemudian disebut MSP.
enkapsulasi menunjukkan kemampuan penghambatan enzim alfa-glukosidase produk enkapsulasi MSP masih lebih tinggi dari produk enkapsulasi M.
Hasil uji disolusi pada medium asam menunjukkan bahwa pada 15 menit awal, sampel ekstrak jintan hitam, nanoemulsi, dan produk enkapsulasi M sudah mengalami pelepasan total fenol yang tinggi, sedangkan produk enkapsulasi MSP memiliki pelepasan total fenol terkendali pada medium asam dan pelepasan total fenol lebih tinggi pada medium basa.
Hasil penelitian ini menyatakan bahwa penerapan teknologi nano pada pembuatan nanoemulsi, produk enkapsulasi nanoemulsi jintan hitam dengan bahan pengisi maltodekstrin (M) dan campuran maltodekstrin dengan isolat protein kedelai (MSP) memiliki sistem pelepasan senyawa fenolik yang berbeda. Pelepasan senyawa fenol produk enkapsulasi MSP lebih terkendali pada medium asam dan lebih tinggi pada medium basa.
SUMMARY
ROVIE FARAH DIBA. In Vitro Analysis Nanoemulsion Encapsulation Product of Black Cumin Extract (Nigella sativa). Supervised by SEDARNAWATI YASNI dan SRI YULIANI.
Black cumin (Nigella sativa) is a medicinal plant that grows in Mediterranean countries and have been able to treat variety of diseases. Research has been widely carried out on the extraction of black cumin, especially in fraction of essential oil and oleoresin, then efficacy of black cumin. Black cumin had capability to inhibit microbial growth, lowering blood sugar levels (hypoglycemia), and enhancing the body's immunity based on in vitro and in vivo studies. Most of bioactive compounds had a certain characteristic of lipophilic and low solubility of water absorption in the digestive tract. Encapsulation delivery system based on oil in water nanoemulsion is an effective approach to incorporate bioactive compounds. Nanoemulsion encapsulation of bioactive compound has ability to protect against degradation during storage, reducing the impact on the organoleptic properties of the food and improving the bioavailability. Black cumin extract which dispersed in the water phase using suitable emulsifiers can be generated by a low energy method, namely the spontaneous emulsification technique. The purpose of this study is to produce nanoemulsion and process of encapsulation nanoemulsion of black cumin extract then study of their functional properties based on in vitro test.
This research method consisted of extraction, manufacturing and characterization nanoemulsion of black cumin extract, encapsulation process of nanoemulsion of black cumin extract, and dissolution test of encapsulation products to determine bioactive compound (phenolic compound) release in acidic medium (chloride buffer) and alkaline medium (phosphate buffer). Furthermore, the inhibition activity of alpha-glucosidase is measured in lowering blood sugar. Nanoemulsion is made from a mixture of extract ethanol 70% of black cumin and liquid phase of Tween 80 solution with concentration of 1%, 2%, and 3% (w/w). The best nanoemulsion is determined based on the size, homogeneity, and stability of the particles. Furthermore the best nanoemulsion is encapsulated using maltodextrin 100% (namely M) and mixture of maltodextrin with soy protein isolate at a ratio 80:20 (w/w, namely MSP) as a carrier material.
Results showed that black cumin nanoemulsion with 3% Tween 80 has homogeneity, good stability, and the smallest particle size, that is 10.93 nm. Reconstitution of nanoemulsion encapsulation product that has more spherical globula, indicated efficiently encapsulation process. Based on antioxidant capacity and phenolic content of black cumin extract, nanoemulsion, encapsulation product in each 1 gram extract content, showed that encapsulation product of MSP has high antioxidant capacity and phenolic content. These results indicated that form of encapsulation product of MSP can protect phenolic compounds from oxidation reaction during manufacturing process. The inhibition activity of alpha-glucosidase demonstrated the ability of encapsulation product of MSP was higher than encapsulation product of M.
at early 15 minutes, whereas encapsulation product of MSP has controlled release of total phenol in acid medium and more higher release of total phenol in alkaline medium.
The results of this study stated that application of nanotechnology in manufacturing of nanoemulsion and encapsulation products of black cumin nanoemulsion with maltodextrin and mixture of maltodextrin and soy protein isolate (80:20 w/w) carrier have different active compounds (phenolic) release system. The release of phenolic compounds encapsulation product of MSP more controllable in acid medium and more higher in alkaline medium.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
KAJIAN
IN VITRO
PRODUK ENKAPSULASI
NANOEMULSI EKSTRAK JINTAN HITAM (
Nigella sativa
)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
ii
iii
Judul Tesis : Kajian In Vitro Produk Enkapsulasi Nanoemulsi Ekstrak Jintan Hitam (Nigella sativa)
Nama : Rovie Farah Diba NIM : F251100021
Disetujui oleh Komisi Pembimbing
Prof. Dr Ir Sedarnawati Yasni, MAgr Ketua
Diketahui oleh
Dr Ir Sri Yuliani, MT Anggota
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
iv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2012 adalah pembuatan nanoemulsi jintan hitam, dengan judul Kajian In Vitro Produk Enkapsulasi Nanoemulsi Ekstrak Jintan Hitam.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Sedarnawati Yasni, M.Agr dan Ibu Dr. Ir. Sri Yuliani, MT selaku pembimbing, serta Ibu Dr. Ir. Hanifah N Lioe, MSi selaku penguji luar komisi yang telah banyak memberikan saran yang konstruktif. Di samping itu, ucapan terimakasih penulis sampaikan kepada Bapak Yahya, mba Yane, mba Nurul, mba Vera, Bu Antin, mba Ari, pak Rojak, pak Wahid, pak Adi, pak Taufiq, pak Sobirin, bu Rubiah, pak Gatot dan seluruh laboran di Laboratorium Departemen ITP IPB beserta Bapak Tri, Bu Dini, mba Citra, mba Dwi, serta seluruh staf di Laboratorium Pengolahan Pangan Balai Besar Pascapanen Pertanian Bogor.
Ungkapan terima kasih penulis sampaikan kepada keluarga besar IPN 2010, Umi, bu Irdha, bu Rara, bu Maria, bu Mardhiyah, bu Inneke, Tika, Fahma, Ame, Ayu, Intan, mba Fitri, Putu, Pak Cecep, Pak Ramlan, mba Diana, bu Sri, dan rekan-rekan lainnya yang tidak dapat disebutkan satu per satu atas dorongan, inspirasi, semangat, motivasi, doa, dan kebersamaan kepada penulis selama menjalankan kuliah dan penelitian. Ungkapan terima kasih juga penulis sampaikan kepada keluarga besar LPPOM MUI Pusat, mba Muti, bu Uning, Pak Lukman, bu Atik, bu Liesbet, mba Suryani, mba Bembi, bu Mira Suprayatmi, bu Mira Sofyaningsih, bu Lia, bu Susi, bu Tetty, bu Sri Muljani, mba Tina, mba Riasti, mba Yuni, pak Sri Harsojo, pak Zaenal, Ivon, Ratna, Rizka, Evrin, Catur, Aang, Heri, serta seluruh pengurus, auditor, dan staf yang tak dapat disebutkan satu per satu, atas dukungan, motivasi, semangat, doa kepada penulis selama menjalankan kuliah dan penelitian.
Terakhir, terima kasih tak terhingga kepada suami tercinta Harry Alexander, SH, MH, LLM dan anakku tersayang Yusuf Fatha Mubina, Yasmin Nada Shaliha, Yahya Adam Alexander, Yasmin Nisa Sakina atas kebersamaan, doa, motivasi dan kasih sayangnya. Kepada bapak ibu tercinta, Bapak Abduh Atmadiwirya dan Ibu Ida Azizah beserta ibu mertua Ibu Novemy Latin, terima kasih tak terhingga atas dukungan, motivasi, dan doa hingga penulis dapat menyelesaikan studi.
Semoga karya ilmiah ini bermanfaat.
v
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 4
Hipotesis 4
2 TINJAUAN PUSTAKA 4
Jintan Hitam 4
Tekonologi Nano 6
3 METODE 9 Waktu dan Tempat Penelitian 9
Bahan dan Alat 9 Metode penelitian 10 4 HASIL DAN PEMBAHASAN 18 Penelitian pendahuluan 18
Penelitian utama 24
Pembuatan dan karakterisasi nanoemulsi 24
Pembuatan dan karakterisasi produk enkapsulasi nanoemulsi 26
Uji disolusi ekstrak, nanoemulsi, dan produk enkapsulasi nanoemulsi 29
Penghambatan enzim alfa-glukosidase 33
5 SIMPULAN DAN SARAN 35
Simpulan 35
Saran 35
DAFTAR PUSTAKA 36
LAMPIRAN 43
vi
DAFTAR TABEL
1 Komposisi biji jintan hitam 4
2 Komposisi mineral biji jintan hitam 5
3 Profil asam lemak jintan hitam 6
4 Hasil analisis proksimat jintan hitam 18
5 Komposisi komponen volatil minyak atsiri biji jintan hitam
menggunakan SDE Lickens Nickerson 20
6 Rendemen ekstrak jintan hitam 21
7 Karakteristik ekstrak jintan hitam 21
8 Komponen kimia oleoresin jintan hitam 23
9 Ukuran partikel nanoemulsi jintan hitam berdasarkan konsentrasi
surfaktan 25
10 Ukuran partikel produk enkapsulasi nanoemulsi jintan hitam 27 11 Nilai kapasitas antioksidan dan nilai total fenol ekstrak, nanoemulsi,
dan produk enkapsulasi nanoemulsi jintan hitam 29
12 Nilai penghambatan enzim alfa-glukosidase 34
DAFTAR GAMBAR
1 Diagram alir penelitian pendahuluan 11
2 Diagram alir penelitian utama 13
3 Foto SEM produk enkapsulasi nanoemulsi 28
4 Hubungan waktu dan pelepasan total fenol pada medium asam 30 5 Hubungan waktu dan pelepasan total fenol pada medium basa 32
DAFTAR LAMPIRAN
1 Hasil minyak atsiri jintan hitam dengan metode destilasi air 43 2 Hasil ekstrak jintan hitam dengan metode refluks tiga jam 43 3 Pembuatan nanoemulsi jintan hitam dengan pengaduk magnetik 43 4 Produk enkapsulasi nanoemulsi dengan bahan penyalut (a)
maltodekstrin, (b) kombinasi maltodekstrin dan isolat protein kedelai 43
5 Uji statistik hasil ekstraksi 44
6 Uji statistik ukur an partikel nanoemulsi 45
7 Uji statistik kapasitas antioksidan 46
8 Uji statistik nilai total fenol 47
9 Hasil uji ukuran partikel nanoemulsi dengan konsentrasi 1% surfaktan 48 10 Hasil uji ukuran partikel nanoemulsi dengan konsentrasi 2% surfaktan 49 11 Hasil uji ukuran partikel nanoemulsi dengan konsentrasi 3% surfaktan 50 12 Kesetaraan ekstrak dgn nanoemulsi dan powder 51 13 Hasil uji penghambatan enzim alfa-glukosidase 52
1
PENDAHULUAN
Latar Belakang
Seiring dengan perkembangan teknologi, terjadi peningkatan kuantitas obat dan terapi herbal. Sebagian masyarakat banyak yang memilih untuk menyembuhkan penyakit dengan terapi herbal karena khawatir terhadap efek samping obat yang dapat membahayakan tubuh. Terapi herbal bertujuan untuk mencegah dan atau mengobati penyakit menggunakan bahan alami yang berasal dari tanaman. Tanaman dapat menghasilkan suatu bahan fitokimia yang sangat bermanfaat karena mengandung lemak rendah, bebas kolesterol, protein tinggi, serta mengandung serat larut dan tidak larut. Beberapa tanaman sayuran, buah, dan rempah dapat berpotensi sebagai obat karena kandungan senyawa antioksidan yang dimilikinya (Hernani 2006).
Masyarakat di Indonesia menggunakan rempah sebagai bumbu dalam masakannya. Selain berfungsi menambah citarasa makanan, rempah juga mengandung zat antioksidan. Beberapa tanaman rempah yang pernah diteliti khasiatnya antara lain jahe, kunyit, temugiring, temumangga, laos, kapulaga, cengkeh, temukunci, ketumbar, jintan, kencur, lada, pala, dan asam. Di antara tanaman rempah tersebut, ada salah satu jenis rempah yang telah digunakan dalam pengobatan sejak 3000 – 2000 tahun sebelum Masehi, yaitu jintan hitam, yang termasuk salah satu jenis dari tanaman jintan (Junaedi et al. 2011).
Jintan hitam (Nigella sativa) merupakan salah satu spesies dari genus Nigella yang memiliki 25 spesies tanaman yang termasuk dalam famili Ranunculaceae. Tanaman jintan hitam banyak tumbuh di negara Mediterania, Timur Tengah, Eropa Timur dan Asia Barat (Kumar 2011). Di beberapa negara, jintan hitam digunakan dalam hidangan tradisional yang manis, seperti pasta jintan hitam yang dimaniskan dengan madu atau sirup, dan bumbu makanan pada produk roti dan keju (Rouhou et al. 2007).
Berbagai penelitian telah dilakukan tentang cara mengekstrak senyawa aktif dan menguji khasiat yang terdapat dalam biji jintan hitam. Ekstraksi jintan hitam dengan metode refluks selama 3 jam menggunakan pelarut etanol memiliki kemampuan menghambat pertumbuhan mikroba (Yasni et al. 2009). Secara in vivo, substitusi bubuk jintan hitam sebanyak 7.5 % dalam ransum tikus dapat menurunkan tekanan darah, gula darah, dan serum kolesterol (Yasni et al. 2009 ; Fararh et al. 2004; Tasawar et al. 2011). Pengaruh antidiabetes pada tanaman telah dilaporkan oleh banyak peneliti, salah satunya jintan hitam (Ghorbani, 2013). Kemampuan jintan hitam dalam menurunkan kadar gula darah atau sebagai antihiperglikemik juga telah diujikan secara in vitro melalui uji penghambatan enzim alfa glukosidase dengan nilai IC50 172.81 µg/ml (Thirumurugan et al. 2011).
2
senyawa bioaktif yang terjerap dalam pangan fungsional. Enkapsulasi berbasis nanoemulsi minyak dalam air merupakan pendekatan yang efektif dalam memasukkan senyawa bioaktif ke dalam bahan pangan (Silva et al. 2012).
Penelitian menggunakan teknologi nano dengan bahan baku jintan hitam masih terbatas. Pada penelitian yang dilakukan oleh Ravindran et al. (2010), nanoemulsi jintan hitam dibuat menggunakan energi rendah dengan komposisi thymoquinone murni, asetonitril sebagai pelarut, pluronat F-68 sebagai surfaktan. Penelitian yang dilakukan oleh AlHaj et al. (2010), pembuatan nanopartikel menggunakan energi tinggi dengan komposisi ekstrak jintan hitam dengan metode ekstraksi superkritik (supercritical fluid extraction / SFE), palm oil, 1% tween 80, dan sorbitol. Tubesha et al. (2013) dalam penelitiannya melakukan pembuatan nanoemulsi jintan hitam menggunakan energi tinggi dengan komposisi thymoquinone murni, glyceroltrioleate, 2% tween 80, dan air demineralisasi. Pada ketiga penelitian nanopartikel jintan hitam tersebut, penggunaan bahan baku utama yang merupakan senyawa murni, ekstrak jintan hitam yang diperoleh dengan metode ekstraksi superkritik, adanya penggunaan energi tinggi, masih belum bernilai ekonomis apabila diaplikasikan pada industri pangan. Metode ekstraksi dan penggunaan metode energi rendah pada pembuatan nanoemulsi merupakan hal yang perlu dikaji agar dapat bersifat aplikatif. Selain itu, untuk mengetahui ketersediaan senyawa aktif jintan hitam bagi tubuh dan fungsi jintan hitam dalam menurunkan kadar gula darah (hipoglikemik), perlu dikaji pelepasan senyawa aktif jintan hitam dalam medium asam dan basa serta uji penghambatan enzim alfa glukosidase secara in vitro.
Perumusan Masalah
Sistem pengantaran berbasis emulsi merupakan cara yang mudah dalam melindungi senyawa bioaktif yang kurang larut dalam air. Nanoemulsi yang berisi partikel relatif kecil (r <100 nm), dapat lebih mudah meningkatkan penyerapan senyawa bioaktif yang bersifat hidrofobik. Ekstrak yang terdispersi dalam fase air menggunakan pengemulsi yang sesuai dapat dihasilkan dari metode yang menggunakan energi rendah, yakni metode emulsifikasi spontan. Pada metode emulsifikasi spontan, sistem emulsi terdiri dari fase organik (minyak dan pelarut organik) serta fase air (air dan surfaktan hidrofilik). Pembentukan nanoemulsi terjadi secara spontan setelah campuran minyak-surfaktan dimasukkan ke dalam fase air (Bouchemal et al. 2004).
3 ketersediaannya, juga memerlukan biaya tinggi dalam memperolehnya. Penggunaan metode ekstraksi superkritikal membutuhkan biaya untuk pengadaan alat ekstraksi superkritikal tersebut. Pembuatan nanopartikel menggunakan energi tinggi, memerlukan pasokan energi, seperti daya listrik disamping ketersediaan alat sehingga belum bersifat ekonomis. Berdasarkan keterbatasan penelitian nanopartikel jintan hitam yang telah ada tersebut, maka pada penelitian ini dilakukan pembuatan nanoemulsi jintan hitam menggunakan energi rendah dan melakukan kajian ketersediaan senyawa aktif jintan hitam didalam tubuh dan khasiat dalam menurunkan kadar gula darah secara in vitro. Senyawa aktif jintan hitam yang dimaksud pada penelitian ini adalah senyawa polifenol, terkait dengan senyawa aktif utama jintan hitam yaitu thymoquinone, yang termasuk dalam senyawa fenolik kuinonik.
Pada tahap awal penelitian dilakukan empat metode ekstraksi jintan hitam. Hasil terbaik dari keempat metode ekstraksi jintan hitam digunakan pada pembuatan nanoemulsi jintan hitam sebagai salah satu komponen fase organik. Penggunaan konsentrasi surfaktan dalam pembuatan nanoemulsi mengacu pada penelitian AlHaj et al. (2010) yakni 1% Tween 80 dan Tubesha et al. (2013) yang menggunakan 2% Tween 80. Metode ekstraksi jintan hitam yang digunakan mengacu pada penelitian Yasni et al. (2009) yang melakukan ekstraksi jintan hitam dengan metode refluks dengan pelarut 70% dan penelitian oleh Sugindro et al. (2008) yang melakukan ekstraksi jintan hitam dengan metode maserasi. Nanoemulsi ekstrak jintan hitam yang memiliki karakteristik terbaik dilakukan enkapsulasi. Pada pembuatan enkapsulasi nanoemulsi digunakan dua macam bahan penyalut untuk dapat dikaji karakteristiknya satu sama lain. Penelitian terkait senyawa aktif yang tersalut nanopartikel menunjukkan ketersediaan bagi tubuh meningkat yang dapat dikaji secara in vitro dengan melakukan uji disolusi (Gunasekaran et al. 2007). Oleh karena itu pada penelitian ini dilakukan uji disolusi untuk mengkaji ketersediaan senyawa aktif jintan hitam bagi tubuh dan mengkaji kemampuan ekstrak jintan hitam, nanoemulsi dan produk enkapsulasi dalam menurunkan kadar gula darah secara in vitro melalui uji penghambatan enzim alfa glukosidase.
Tujuan Penelitian
1. Mengkaji kondisi ekstraksi jintan hitam terhadap jumlah rendemen, kapasitas antioksidan
2. Melakukan pembuatan nanoemulsi jintan hitam menggunakan energi rendah dan mengkaji pengaruh konsentrasi surfaktan terhadap karakteristik nanoemulsi jintan hitam
3. Melakukan pembuatan produk enkapsulasi nanoemulsi jintan hitam
4. Melakukan uji disolusi untuk mengkaji kelarutan senyawa aktif jintan hitam dalam medium asam dan basa
4
Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi bahan referensi untuk pengembangan produk pangan fungsional berbasis jintan hitam dengan menggunakan teknologi nano.
Hipotesis
1. Konsentrasi surfaktan pada pembuatan nanoemulsi dapat mempengaruhi karakteristik nanoemulsi
2. Bahan penyalut pada enkapsulasi nanoemulsi mempengaruhi pelepasan senyawa aktif pada medium asam dan basa
2
TINJAUAN PUSTAKA
Jintan Hitam (Nigella sativa)
Jintan hitam (Nigella sativa) merupakan salah satu spesies dari genus Nigella yang memiliki kurang lebih 25 spesies tanaman yang termasuk dalam famili Ranunculaceae. Tanaman ini banyak tumbuh di negara Mediterania Timur Tengah, Eropa Timur dan Asia barat. Nama lain Nigella Sativa (Kumar 2011) diantaranya adalah Black Carraway seed, Black Cumin, Black Seed (English), Habbatus Sawda (Arab), Karun jiragam (Tamil), Karunshiragam (Malayalam), Kalonji (Urdu, Hindi), Karijirigi (Kannada), Nulajirakara (Telugu), Kalanjire (Marathi), Kalajira (Bengali), dan Shonaiz (Persian).
Komponen yang terkandung dalam jintan hitam antara lain nutrisi, senyawa fenolik, mineral, vitamin, dan minyak essensial. Komposisi nutrisi biji Nigella sativa terdiri dari protein, lemak, dan karbohidrat. Secara umum kandungan nutrisi dan senyawa fenolik yang terdapat pada biji jintan hitam dapat dilihat pada Tabel 1.
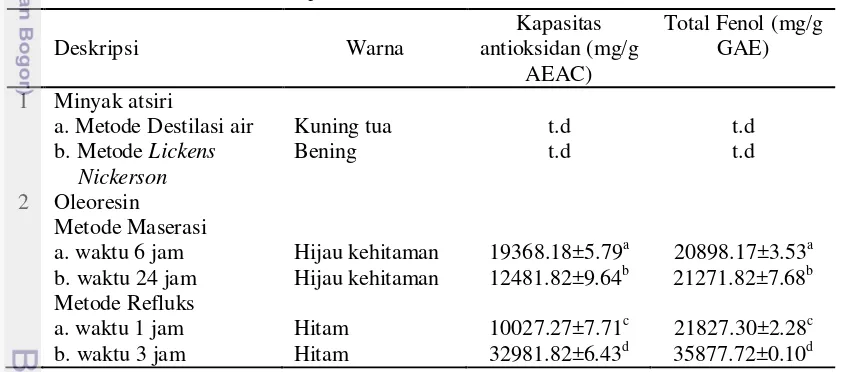
Tabel 1 Komposisi biji jintan hitam
Komposisi Nilai Mean ± SD (%)
Air Protein Lemak Serat Abu
Total Polifenol (mg asam galat/kg minyak)
6.46 ± 0.17 22.80 ± 0.60 31.16 ± 0.82 6.03 ± 0.16 4.20 ± 0.11 310.26 ± 6.82
5 Biji jintan hitam mengandung sejumlah mineral yang penting bagi tubuh. Kandungan fosfor dan kalsium pada biji jintan hitam lebih besar dari elemen mineral yang lain. Beberapa penelitian telah menentukan komposisi mineral pada biji jintan hitam, diantaranya yang dilakukan oleh Sultan et al. 2009 (Tabel 2).
Tabel 2 Komposisi mineral biji jintan hitam
Mineral (mg/100g) Jumlah
Kalsium (Ca)
Pada penelitian yang dilakukan oleh Harzallah et al. (2011), minyak atsiri atau essensial oil jintan hitam yang dideteksi menggunakan Gas Chromatography Mass Spectra (GC-MS) mengandung: p-cymene (49.48%), α -thujene (18.93%), α-pinene (5.44%), β-pinene (4.31%), y-terpinene (3.69%), dan thymoquinone (0.79%). Jintan hitam juga mengandung alkaloid seperti koumarin; nigellicine, nigellidine, dan nigellimine-N-oxide. Minyak atsiri jintan hitam mengandung dithymoquinone, thymohydroquinone, nigellone, carvacrol, limonene, d-citronellol, 2-(2-methoxypropyl)-5-methyl-1,4-benzenediol dan thymol yang memiliki aktivitas farmakologi, diantaranya sebagai penghilang sakit (analgesik), anti pembengkakan (antiinflamasi), anti alergi (anti histamin), mampu menghambat proliferasi (produksi) sel kanker, antiangiogenesis (menghentikan pembentukan pembuluh darah bagi sel kanker), antioksidan dan antimikroba (Junaedi et al. 2011). Kandungan thymoquinone dalam biji jintan hitam diduga merupakan bahan bioaktif utama dari minyak atsiri jintan hitam (Fararh et al. 2010) dan thymoquinone termasuk dalam senyawa fenolik kuinonik (Kumar 2011). Thymoquinone memiliki sifat antioksidan yang kuat, dapat melindungi jaringan yang bukan tumor dari kerusakan yang disebabkan oleh kemoterapi dan sebagai pelindung dari kerusakan hati (Fararh et al. 2005). Selain itu adanya senyawa β-pinene menunjukkan aktivitas antiproliferatif melawan sel tumor A-549 (Bourgou et al. 2010); senyawa longifolene sebagai antioksidan dan antibakteri, dan senyawa thymol sebagai antimikroba (Martos et al. 2011).
6
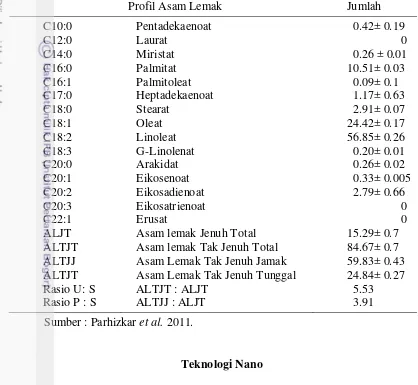
sehingga dapat disimpan lebih lama karena adanya kandungan polifenol (Junaedi et al. 2011). Komposisi asam lemak jintan hitam dapat dilihat pada Tabel 3.
Tabel 3 Profil asam lemak jintan hitam
Profil Asam Lemak Jumlah
C10:0
Asam lemak Jenuh Total Asam lemak Tak Jenuh Total Asam Lemak Tak Jenuh Jamak Asam Lemak Tak Jenuh Tunggal ALTJT : ALJT
7 Metode yang dapat digunakan meliputi kristalisasi, ekstraksi pelarut / evaporasi, sintesis mikrobial, reaksi biomassa (Cushen et al. 2011).
Beberapa aplikasi dari teknologi nano yang potensial adalah nanoemulsi dan pengantaran senyawa bioaktif atau delivery of bioactive components (Fathi et al. 2012). Nanoemulsi (juga dikenal sebagai miniemulsi atau submikron emulsi) merupakan emulsi yang terdiri dari fase terdispersi yang dibentuk oleh penyebaran satu cairan dalam larutan cairan lainnya yang memiliki kisaran ukuran antara 50 dan 1000 nm (Sanguansari dan Augustin 2006). Ada beberapa perbedaan antara nanoemulsi dan mikroemulsi, antara lain nanoemulsi terlihat secara optik lebih transparan, stabil secara kinetik, metastabil, dan dapat diencerkan dengan air tanpa perubahan dalam distribusi ukuran droplet. Mikroemulsi terlihat buram dan stabil secara termodinamik (Gupta et al. 2010). Nanoemulsi merupakan cara yang baik untuk pengantaran komponen makanan yang sulit larut dalam air, seperti minyak ikan dan vitamin lipofilik, sesuai dengan kemampuannya untuk meningkatkan kelarutan bioaktif dan penyerapan pada saluran pencernaan, yang disebabkan perubahan permeabilitas surfaktan. Setelah tertelan, droplet didistribusikan di dalam perut melalui droplet kecil nanoemulsi sehingga mendorong penyebaran senyawa bioaktif yang dienkapsulasi dalam saluran pencernaan (Fathi et al. 2012). Enkapsulasi nanoemulsi berbasis sistem pengantaran senyawa bioaktif merupakan pendekatan yang efektif untuk meningkatkan dispersi senyawa bioaktif produk makanan, melindungi terhadap degradasi atau interaksi dengan bahan lain, mengurangi dampak terhadap sifat organoleptik makanan dan meningkatkan bioavailabilitasnya (Donsi et al. 2011).
Sistem pengantaran senyawa bioaktif diartikan sebagai senyawa bioaktif yang diletakkan didalam zat pembawa untuk mengatur laju pelepasan zat bioaktif. Zat pembawa nano (nanocarriers) dapat melindungi senyawa bioaktif dari lingkungan yang kurang kondusif. Zat pembawa nano memiliki luas permukaan yang dapat meningkatkan kelarutan, bioavailabilitas, dan memperbaiki target pelepasan komponen pangan yang dienkapsulasi, bila dibandingkan dengan zat pembawa ukuran mikro. Secara umum, zat pembawa nano pada makanan dapat berbasis karbohidrat, protein atau lemak (Fathi et al. 2012).
Untuk memperoleh larutan yang stabil, bahan penstabil seperti pengemulsi atau surfaktan dapat ditambahkan ke dalam sistem emulsi (Fang dan Bhandari 2010). Surfaktan (surface active agent) atau zat aktif permukaan adalah senyawa organik yang memiliki komposisi struktur satu atau lebih ekor non polar hidrofobik yang terhubung dengan sebuah polar bagian kepala sebagai hidrofilik. Surfaktan dapat menurunkan tegangan permukaan air dengan mematahkan ikatan hidrogen pada permukaan. Hal ini dilakukan dengan menaruh kepala hidrofiliknya pada permukaan air dengan ekor hidrofobiknya terentang menjauhi permukaan air. Pada dasarnya karakteristik surfaktan merupakan manifestasi dari rasio antara bagian hidrofilik dan hidrofobik yang dikenal sebagai hydrophile lipophile balance atau HLB (Jaya 2010). Contoh surfaktan nonionik adalah Tween 80 (polietilena sorbitan monooleat), yang memiliki nilai HLB 15. Nilai HLB yang besar ini menyebabkan Tween 80 sangat cocok digunakan sebagai pengemulsi pada sistem emulsi minyak dalam air (Suprayogi dan Yudha 2004).
8
ultrasonikasi. Metode non mekanik menggunakan teknik difusi pelarut atau emulsifikasi spontan (Fathi et al. 2012).
Karakterisasi yang dilakukan terhadap droplet nano diantaranya nilai Poly Dispersity Index atau indeks polispersitas (PDI), zeta potensial, dan morfologi permukaan. Morfologi nanopartikel dapat ditentukan dengan mikroskop elektron transmisi (TEM) dan mikroskop elektron pemindai atau SEM (Lovelyn dan Attama 2011). Polidispersitas merupakan perbandingan dari standar deviasi terhadap rata-rata ukuran droplet, sehingga dapat menunjukkan keseragaman ukuran droplet dalam formulasi. Semakin tinggi polidispersitas menunjukkan semakin rendah keseragaman ukuran tetesan dalam formulasi. Instrumen Particle Size Analyzer dapat mengukur indeks polidispersitas, yaitu penyebaran distribusi ukuran partikel yang diturunkan dari analisis kumulatif hamburan cahaya dinamis. PDI menunjukkan kualitas atau homogenitas dispersi. Nilai PDI yang kecil berarti distribusi ukuran partikel sempit. Pengemulsi tidak hanya berfungsi sebagai penghalang mekanik, tetapi juga membentuk muatan permukaan zeta potensial, yang menghasilkan gaya tolak listrik diantara droplet minyak yang menghambat koalesensi. Zeta potensial mengukur keseluruhan muatan partikel yang diperlukan pada media spesifik yang menunjukkan kestabilan sebuah sistem. Jika sebuah partikel memiliki nilai zeta potensial yang besar (negatif atau positif) akan terjadi saling tolak menolak antar satu partikel dengan yang lain, dan hal ini menunjukkan kestabilan yang lebih tinggi dibandingkan muatan partikel yang netral. Jika nilai zeta potensial semakin negatif atau positif, maka muatan droplet semakin besar dan emulsi semakin stabil. Nilai zeta potensial yang lebih rendah dari -30 mV atau lebih besar dari +30 mV umumnya mengindikasikan tingkat kestabilan fisik yang tinggi (Gupta et al. 2010).
Spray Drying (Pengeringan Semprot)
Spray drying atau pengeringan semprot merupakan cara yang umum digunakan dalam enkapsulasi. Enkapsulasi merupakan metode yang terdiri dari bahan penyalut di sekitar bahan inti, yang dapat melindungi bahan inti dari oksidasi. Metode pengeringan semprot terdiri dari dua unit, yaitu emulsifikasi bahan inti dengan larutan pati termodifikasi dan dehidrasi pada ruang pengering yang sesuai. Bahan inti dihomogenisasikan dengan larutan pati, lalu emulsi tersebut dipompa dengan pengaturan jumlah tertentu ke atomizer pengering semprot. Partikel kering terbawa dalam aliran udara dan dipisahkan ke ruang pengumpul hasil (Farooqi et al. 2005). Metode pengeringan semprot dapat dilakukan melalui lima tahap, yaitu (1) konsentrasi, yakni produk dikonsentrasikan sebelum dimasukkan ke dalam alat penyemprot (sprayer), (2) atomisasi, yakni pada tahap atomisasi terjadi kondisi penguapan secara optimal menjadi produk kering sesuai karakteristik yang diinginkan, (3) kontak antara droplet-udara, didalam alat cairan yang teratomisasi berinteraksi dengan gas panas, menghasilkan uap air 95% yang terkandung dalam droplet, (4) pengeringan droplet, dan (5) pemisahan antara produk kering (aliran serbuk bebas) dan udara (Patel et al. 2009).
9 Penggunaan senyawa polifenol yang terenkapsulasi dapat secara efektif mengatasi kekurangan tersebut (Fang dan Bhandari 2010).
Setiap bahan penyalut memiliki kelebihan dan kekurangan dalam hal sifat, biaya, dan efisiensi enkapsulasi. Maltodekstrin merupakan turunan dari pati termodifikasi yang larut dan dapat digunakan secara tunggal atau kombinasi dengan bahan lain dalam pangan atau terkait dalam proses ekstraksi obat, bahan tambahan aromatik, karotenoid, dan vitamin. Fungsi maltodekstrin antara lain dapat digunakan dalam jumlah besar, membentuk film, mampu mengikat bahan flavor dan lemak, dan dapat mengurangi permeabilitas oksigen dinding bahan (Sansone et al. 2011). Maltodekstrin sering digunakan pada enkapsulasi senyawa polifenol (Fang dan Bhandari 2010).
Suhu pengeringan semprot dapat mempengaruhi kandungan total polifenol. Penelitian yang dilakukan oleh Sansone et al. (2011) menyatakan komponen polifenol akan hilang pada peningkatan suhu dari 120oC hingga 200oC. Namun suhu lebih rendah dari 120oC tidak dapat menguapkan keseluruhan pelarut (salah satunya air) yang menyebabkan terjadinya bubuk yang berkohesif tinggi. Protein pangan dapat mengikat berbagai molekul bioaktif ke dalam struktur polipeptida sehingga dapat melindungi molekul bioaktif lebih baik sampai pada sel yang dituju. Sebagai contoh, isolat protein kedelai berpotensi sebagai substrat untuk pengembangan sistem pengantaran.
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Pangan Departemen Ilmu dan Teknologi Pangan Fakultas Teknik Pertanian IPB, Laboratorium Biokimia Pangan Departemen Ilmu dan Teknologi Pangan Fakultas Teknik Pertanian IPB, dan Laboratorium Balai Besar Pascapanen, Kementerian Pertanian, Bogor, Laboratorium Farmasi dan Medikal BPPT Pusat Penelitian dan Teknologi Serpong. Penelitian berlangsung dari bulan April 2012 sampai Oktober 2013.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah biji jintan hitam yang diperoleh dari Mekah. Bahan surfaktan dan penyalut yang digunakan adalah Tween 80 (Sigma Co, USA), isolat protein kedelai (Solae, Switzerland) dan maltodekstrin yang dibeli dari Toko Setia Guna, Bogor. Bahan kimia dan analisis lain yang digunakan antara lain folin ciocealteau, DPPH (1,1 -diphenyl-2-picrylhydrazil), etanol, metanol, natrium sulfat anhidrat, natrium asetat, asam asetat glasial, NaH2PO4.H2O, Na2HPO4.2H2O, KCl, HCl, Na2CO3.
10
homogenizer Ultra Turrax T-25 (USA), penyemprot kering (Lab Plant Sd 05, Inggris), dissolution tester (Logan Dissolution Testing System, USA), Scanning Electron Microscopy / SEM (JEOL JSM-6360LA, Jepang), Elisa Reader (Epoch, Biotech, USA).
Metode Penelitian
Penelitian ini terdiri dari dua tahap, yaitu tahapan penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan dilakukan dengan tujuan untuk mendapatkan ekstrak minyak atsiri dan oleoresin jintan hitam akan digunakan pada penelitian utama. Penelitian utama bertujuan untuk mendapatkan nanoemulsi jintan hitam, melakukan proses enkapsulasi, mengkaji kelarutan senyawa aktif jintan hitam dalam medium asam dan basa melalui uji disolusi serta mengkaji potensi jintan hitam sebagai bahan antihiperglikemik melalui uji penghambatan enzim alfa-glukosidase.
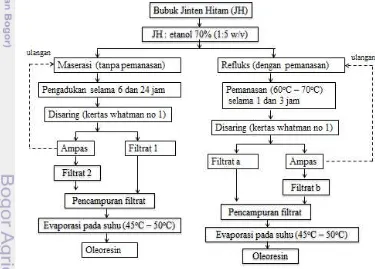
Penelitian Pendahuluan
11
Gambar 1 Proses ekstraksi minyak atsiri jintan hitam
12
Ekstraksi minyak atsiri bubuk jintan hitam
Metode penyulingan dilakukan dengan memanaskan campuran bubuk jintan hitam sebanyak 100 gram dan 500 mL air dalam labu didih 1 liter yang dihubungkan dengan alat penyuling minyak atsiri. Labu dididihkan selama 6 jam dan volume minyak atsiri yang tertampung diukur.
Metode Lickens Nickerson atau ekstraksi berkesinambungan dilakukan dengan memasukkan bubuk jintan hitam sebanyak 100 gram dan air 500 mL ke dalam erlenmeyer 3 L. Campuran tersebut kemudian didistilasi dan diekstraksi secara simultan menggunakan alat Lickens-Nickerson dengan pelarut dietil eter sebanyak 50 ml selama 1 jam (dihitung setelah sampel mendidih). Ekstrak yang diperoleh ditambahkan natrium sulfat anhidrat kemudian dipekatkan dengan menggunakan kolom Vigreux pada suhu 40°C – 50°C tanpa vakum selama 6 jam. Destilat yang dihasilkan lalu dihembuskan gas nitrogen untuk menguapkan semua pelarut dan vial ditutup serta diberi kertas parafilm selanjutnya sampel disimpan dalam refrigerator dan siap digunakan sebagai contoh.
Ekstraksi oleoresin bubuk jintan hitam
Ekstraksi biji jintan hitam dilakukan dengan metode pemanasan (refluks) dan tanpa pemanasan (maserasi) menggunakan pelarut etanol 70%. Bahan baku ditimbang sebanyak 50 gram dan ditambahkan pelarut dengan perbandingan 1:5 (w/v). Waktu ekstraksi refluks yang diujikan adalah 1 dan 3 jam dengan suhu 60oC-70 oC, sedangkan waktu maserasi yang diujikan adalah 6 dan 24 jam pada suhu ruang dan dilakukan pengadukan. Setelah itu pada masing-masing perlakuan dilakukan penyaringan sehingga diperoleh filtrat dan ampas. Untuk memaksimalkan proses ekstraksi, pada masing-masing ampas dilakukan penambahan pelarut dengan perbandingan 1 : 3 (w/v), diekstraksi kembali, disaring dan filtrat dikumpulkan kembali pada labu filtrat. Filtrat dari masing-masing metode ekstraksi dicampurkan dan dipekatkan dengan rotary vacuum evaporator (Buchi Rotavapor R-210 dan R-114) pada suhu 45oC- 50 oC.
Pengujian komponen kimia minyak atsiri dan ekstrak jintan hitam menggunakan GC-MS (Gas Chromatography Mass Spectrometry)
13
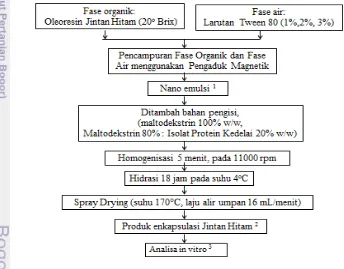
Penelitian Utama
Penelitian utama dimulai dengan melakukan pembuatan nanoemulsi jintan hitam dengan tiga konsentrasi surfaktan. Pada nanoemulsi jintan hitam yang memiliki karakteristik terbaik berdasarkan ukuran partikel terkecil, kehomogenan dan kestabilan yang baik, diberikan bahan pengisi atau bahan enkapsulan untuk selanjutnya dilakukan pengeringan dengan spray drying. Setelah itu dilakukan beberapa uji in vitro, diantaranya uji disolusi untuk mengkaji ketersediaan senyawa aktif jintan hitam bagi tubuh dan mengkaji kemampuan ekstrak jintan hitam, produk nanoemulsi jintan hitam dan produk enkapsulasi jintan hitam dalam menurunkan kadar gula darah melalui uji penghambatan enzim alfa glukosidase. Uji disolusi dilakukan pada dua medium, yaitu medium asam untuk mensimulasikan pencernaan di lambung dengan waktu tiga jam, dan medium basa untuk mensimulasikan pencernaan di usus dengan waktu enam jam. Senyawa aktif jintan hitam yang digunakan pada uji disolusi adalah komponen polifenol yang diperoleh dari pengukuran nilai total fenol. Diagram alir penelitian utama dapat dilihat pada Gambar 3.
Keterangan: 1
Karakterisasi nanoemulsi : ukuran droplet, indeks polidispersitas, zeta potensial 2
Karakterisasi produk enkapsulasi : ukuran partikel, indeks polidispersitas,morfologi 3
Analisa in vitro : Uji Disolusi, Uji Kapasitas Antioksidan, Uji Total Fenol, Uji Inhibisi enzim alfa- glukosidase
14
Nanoemulsifikasi ekstrak jintan hitam ( modifikasi Bouchemal et al. 2004)
Pembuatan nanoemulsi menggunakan teknik emulsifikasi spontan. Sistem emulsi terdiri dari fase organik (ekstrak jintan hitam dan etanol 70%) dan fase air (air dan Tween 80). Fase organik disiapkan dengan mencampurkan ekstrak kental jintan hitam dan pelarut etanol 70% hingga mencapai total padatan terlarut 20o brix. Teknik emulsifikasi spontan dilakukan dengan menambahkan fase organik ke dalam fase air melalui penetesan (tetes demi tetes). Pada saat meneteskan fase organik ke dalam fase air, fase air di aduk dengan menggunakan pengaduk magnetik. Surfaktan yang digunakan adalah Tween 80 dengan konsentrasi 1%, 2%, dan 3% dari volume emulsi yang akan dibuat. Formula emulsi terbaik ditentukan berdasarkan karakteristik terbaik (ukuran partikel, nilai indeks polidispersitas, zeta potensial) menggunakan light-scattering Particle Size Analyzer DelsaTM Nano C (Beckman Coulter, France).
Enkapsulasi nanoemulsi ekstrak jintan hitam
Setelah pembuatan nanoemulsi, ditambahkan bahan penyalut berupa maltodekstrin dan isolat protein kedelai dengan total padatan 26 % (w/w). Bahan penyalut yang dicobakan terdiri atas maltodekstrin dan campuran maltodekstrin dan isolat protein kedelai dengan perbandingan 80 : 20 (w/w). Setelah itu dilakukan homogenisasi selama 5 menit dengan alat homogenizer, kemudian dilakukan hidrasi selama 18 jam pada suhu 4oC. Setelah hidrasi, sesaat sebelum disemprotkeringkan dengan penyemprot kering, dihomogenisasi kembali selama 30 detik dengan kecepatan 11000 rpm. Semprot kering dilakukan dengan laju alir umpan 16 mL/menit dan suhu inlet 170°C.
Karakterisasi nanoemulsi dan produk enkapsulasi nanoemulsi
Karakterisasi nanoemulsi yang dilakukan meliputi pengukuran distribusi ukuran partikel, indeks polidispersitas dan kestabilan partikel berdasarkan nilai zeta potensial dengan menggunakan light-scattering Particle Size Analyzer DelsaTM Nano C (Beckman Coulter, France). Karakterisasi produk enkapsulasi nanoemulsi meliputi pengukuran distribusi ukuran partikel, indeks polidispersitas dan morfologi. Pengukuran distribusi ukuran partikel dan indeks polidispersitas menggunakan light-scattering Particle Size Analyzer DelsaTM Nano C (Beckman Coulter, France). Pengamatan morfologi produk enkapsulasi nanoemulsi dilakukan menggunakan alat Scanning Electron Microscopy (SEM) JEOL JSM-6360LA.
Uji disolusi (Departemen kesehatan 1995)
15 menirukan kondisi pencernaan di lambung selama 3 jam dan medium basa (larutan bufer fosfat pH 7.4) untuk menirukan kondisi usus selama 6 jam pada suhu (37 ±0.5) °C dengan kecepatan pengadukan 100 rpm. Volume medium disolusi yang digunakan sebanyak 500 mL. Pengambilan alikuot dilakukan setiap 15 menit dengan volume setiap kali pengambilan 15 mL. Setiap kali pengambilan alikuot, volume medium yang terambil digantikan dengan larutan medium yang baru dengan volume dan suhu yang sama. Sampel yang diambil tiap 15 menit diukur kandungan total fenolnya. Pengujian total fenol dijelaskan dibawah ini.
Uji total fenol (Strycharz dan Shetty 2002)
Larutan standar dibuat dengan melarutkan 10, 25, 50, 75, 100, 125, dan 150 ppm asam galat dalam air suling. Larutan reagen dibuat dengan mencampurkan 50 mL reagen folin-ciocalteau dengan 50 mL air suling. Larutan Na2CO3 dibuat dengan melarutkan 5 g Na2CO3 dalam 100 mL air suling. Larutan standar atau sampel sebanyak 1 mL dilarutkan dalam 5 mL air suling dan 0.5 mL larutan reagen. Setelah itu, larutan didiamkan selama 5 menit dalam ruang gelap kemudian ditambahkan 1 mL larutan Na2CO3 dan diinkubasi kembali dalam ruang gelap selama 1 jam. Setelah inkubasi, larutan divorteks dan diukur absorbansinya menggunakan spektrofotometer UV-Vis (Shimadzu UV 1800, Jepang) pada panjang gelombang 725 nm. Nilai total fenol dinyatakan sebagai mg/g GAE (Gallic Acid Equivalent).
Uji kapasitas antioksidan (modifikasi Kubo et al. 2003)
Larutan reaksi terdiri dari campuran 1.5 mL buffer asetat 100 mM (pH 5.5), 2.85 mL etanol, dan 150 µL larutan DPPH (100 mM) dalam 1.5 mM methanol yang dibuat segar setiap akan digunakan. Sampel sebanyak 45 µ L ditambahkan ke dalam larutan tersebut dan diinkubasi pada suhu ruang dan tempat gelap selama 30 menit. Untuk larutan blanko dilakukan dengan larutan reaksi yang sama tanpa penambahan sampel. Pengukuran dilakukan menggunakan spektrofotometer UV-Vis (Shimadzu UV 1800, Jepang) dengan penentuan nilai absorbansi pada panjang gelombang 517 nm. Kapasitas antioksidan dinyatakan sebagai mg/g AEAC (Ascorbic acid Equivalent Antioxidant Capacity).
Uji penghambatan enzim alfa glukosidase (Sancheti et al. 2009)
16
menggunakan alat Elisa Reader (Epoch, Biotech, USA) pada panjang gelombang 410 nm.
Penyiapan pereaksi, yakni enzim alfa-glukosidase sebanyak 1 mg dilarutkan dengan 10 mL 0, 1 M buffer fosfat pH 7 yang mengandung 100 mg BSA (Bovine Serum Albumin). Stok enzim tersebut diencerkan 25 kali dengan 0.1 M buffer fosfat pH 7. Larutan substrat dibuat dengan melarutkan 0.0753 gram pNG dalam 25 ml buffer fosfat pH 7. Kontrol positif yang digunakan adalah acarbose 1 % (b/v), dengan melarutkan tablet Glucobay (1 gram acarbose) dalam 100 mL HCl 2 N. Buffer kalium fosfat dibuat dengan melarutkan 1.37 gram KH2PO4 dengan air suling, 1.4246 gram K2HPO4 dengan air suling, kemudian dinaikkan pHnya menjadi 7 dengan penambahan NaOH 5%, lalu ditera menjadi 100 mL. Larutan natrium karbonat 0.2 M dibuat dengan melarutkan 0.5 gram dalam 25 mL buffer fosfat pH 7. Perhitungan persentase penghambatan alfa glukosidase dapat dihitung dengan menggunakan rumus sebagai berikut:
% daya hambat = A2 – A1
A2
x 100%
Keterangan : A2 = Absorbansi blanko – Absorbansi kontrol (-) A1 = Absorbansi sampel – Absorbansi kontrol (-)
Nilai IC50 menunjukkan konsentrasi yang dapat menghambat 50% aktivitas alfa glukosidase pada kondisi uji yang dilakukan. Nilai IC50 ditentukan dengan menggunakan persamaan regresi linear, konsentrasi sampel sebagai sumbu x dan % penghambatan sebagai sumbu y. Dari persamaan y= a + bx dapat dihitung nilai IC50 dengan menggunakan rumus :
IC50 = b 50 – a
Rendemen Ekstrak Jintan Hitam
Rendemen dihitung berdasarkan bobot ekstrak yang dihasilkan (setelah seluruh pelarut diuapkan) dibandingkan dengan bobot jintan hitam yang digunakan untuk ekstraksi (basis kering). Perhitungan rendemen sebagai berikut: Rendemen (%) = bobot ekstrak (g)
bobot jintan hitam basis kering (g)
x 100%
Kadar air (SNI 1992)
Metode analisis kadar air yang dipakai adalah metode oven. Prinsip dari metode ini adalah mengukur kehilangan bobot pada pemanasan 1050C yang dianggap sebagai kadar air yang terdapat pada sampel. Sebanyak 1 gram sampel ditempatkan ke dalam wadah kemudian dikeringkan pada oven suhu 1050C selama 3 jam. Setelah didinginkan di dalam desikator, sampel ditimbang kembali. Pengeringan kembali dilanjutkan hingga memperoleh bobot yang konstan. Kadar air dinyatakan sebagai persentase basis basah melalui perhitungan berikut:
17 % air = w/w1 x 100%
Keterangan: w = bobot sampel sebelum dikeringkan (gram) w1= kehilangan bobot setelah dikeringkan (gram)
Kadar protein (AOAC 1995)
Metode yang digunakan adalah metode kjeldahl dengan prinsip penghitungan jumlah nitrogen total yang kemudian dikali dengan faktor konversi. Sebanyak 250 mg sampel ditempatkan ke dalam labu Kjeldahl selanjutnya ditambahkan 1,9 gram K2SO4, 40 mg HgO, 2mL H2SO4 pekat dan beberapa butir batu didih untuk mencegah bumping. Sampel kemudian dipanaskan secara bertahap hingga diperoleh larutan jernih. Setelah dingin, sampel dipindahkan ke labu destilat kemudian ditambahkan 8 – 10mL larutan 60% NaOH-5% Na2S2O3. Pada tabung erlenmeyer ditempatkan 5mL H3BO3 dan beberapa tetes indikator merah metal – biru metil. Labu erlenmeyer kemudian ditempatkan di bawah kondensor dengan ujung kondensor yang terendam di dalam larutan. Proses distilasi dilakukan hingga diperoleh destilat sebanyak 15mL. Destilat yang didapatkan kemudian diencerkan sampai 50mL dengan akuades, selanjutnya dititrasi dengan larutan HCl 0,02N standar hingga terbentuk warna abu – abu, volume HCl yang terpakai untuk titrasi dicatat. Hal yang sama dilakukan pada larutan blanko. Kadar protein dinyatakan sebagai persentase basis basah melalui perhitungan dengan rumus berikut:
% N = [(v1 – v2) x N HCl x 14,007]/berat sampel x 100 % protein = %N x 6,25
Keterangan: v1 = volume larutan HCl untuk titrasi sampel v2 = volume larutan HCl untuk titrasi blanko 6,25 = faktor konversi nitrogen menjadi protein
Kadar lemak (SNI 1992)
Metode yang digunakan adalah metode soxhlet dengan prinsip mengekstrak lemak bebas dengan pelarut non polar. Sebanyak 1 gram sampel dimasukkan ke dalam selongsong kertas yang dialasi dengan kapas. Sumbat selongsong kertas berisi sampel dengan kapas lalu keringkan dalam oven dengan suhu maksimal 800C selama 1 jam. Selongsong selanjutnya dimasukkan ke dalam alat soxhlet yang telah dihubungkan dengan labu lemak berisi batu didih yang telah dikeringkan dan ditimbang. Sampel diekstraksi dengan pelarut heksana atau pelarut lemak lainnya selama 6 jam lalu heksana disulingkan dan ekstrak dikeringkan dalam oven pada suhu 1050C. Setelah dingin dilakukan penimbangan hingga tercapai bobot tetap. Kadar lemak dinyatakan sebagai persentase basis basah melalui perhitungan dengan rumus berikut:
18
Keterangan: w = berat sampel (gram)
w1 = berat lemak sebelum ekstraksi (gram) w2 = berat lemak setelah estraksi (gram) Kadar abu (SNI 1992)
Prinsip dari pengujian kadar abu adalah dengan menguraikan zat organik menjadi air dan CO2 sehingga hanya tersisa bahan anorganik. Sebanyak 2 gram sampel ditempatkan ke dalam cawan porselen kemudian dilakukan pengabuan dalam tanur listrik pada suhu maksimal 5500C. Sampel didinginkan di dalam desikator kemudian ditimbang hingga diperoleh bobot tetap. Kadar abu dinyatakan sebagai persentase basis basah melalui perhitungan berikut:
% Abu = (w1 – w2) / w x 100%
Keterangan: w = berat sampel sebelum diabukan (gram)
w1 = berat sampel dan cawan setelah diabukan (gram) w2 = berat cawan kosong (gram)
Analisis Data
Semua data ditunjukkan dalam bentuk nilai rata-rata ± standar deviasi, dengan dua kali pengulangan. Data dianalisis dengan analisis satu arah varians ANOVA (Analisis of Variance) menggunakan SPSS versi 17. Apabila dari hasil analisa terdapat pengaruh yang signifikan maka dilakukan uji Duncan dengan selang kepercayaan 5%.
4
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
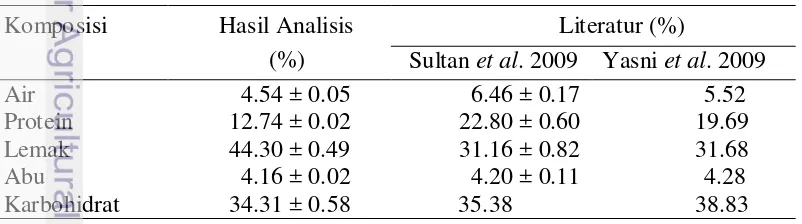
Jintan hitam yang digunakan pada penelitian ini berasal dari Mekah. Untuk mengetahui karakteristik jintan hitam yang digunakan maka dilakukan analisis proksimat. Hasil analisis proksimat dan perbandingannya dari data literatur dapat dilihat pada Tabel 4.
Tabel 4 Hasil analisis proksimat jintan hitam Komposisi Hasil Analisis
19
Tabel 4 memperlihatkan bahwa secara umum komposisi zat nutrisi berdasarkan hasil analisa proksimat jintan hitam yang digunakan pada penelitian ini sebanding dengan hasil analisis proksimat jintan hitam pada penelitian sebelumnya yang dilakukan oleh Sultan et al. (2009) dan Yasni et al. (2009). Kadar lemak jintan hitam yang digunakan pada penelitian ini lebih tinggi yakni 44%, dibandingkan kadar lemak pada penelitian oleh Sultan et al. 2009 dan Yasni et al. 2009, yakni 31%. Tingginya komposisi lemak pada hasil proksimat penelitian ini menunjukkan jintan hitam yang digunakan pada penelitian ini kaya kandungan asam lemak. Kadar protein sampel jintan hitam yang digunakan lebih rendah (12.74%) dibandingkan dengan hasil penelitian terdahulu. Jintan hitam yang merupakan salah satu dari tanaman herbal memiliki komposisi yang dapat bervariasi. Perbedaan komposisi nutrisi di antara jintan hitam dapat disebabkan antara lain perbedaan daerah penanaman, kondisi penyimpanan, tahap pematangan (Rouhou et al. 2007), distribusi geografi, waktu panen dan praktek agronomi (Sultan et al. 2009).
Pada penelitian pendahuluan dilakukan penentuan metode ekstraksi jintan hitam yang digunakan pada penelitian utama. Sebelum dilakukan ekstraksi, biji jintan hitam digerus menggunakan mortar agar memperluas permukaan sampel, mempersiapkan bahan siap diekstrak, dan menghindari terbuangnya sejumlah minyak yang ada dalam biji jintan hitam. Tahap penelitian pendahuluan ini diawali dengan pembuatan ekstrak minyak atsiri (essensial oil) dan ekstrak jintan hitam.
Ekstraksi minyak atsiri jintan hitam dilakukan dengan metode destilasi air dan ekstraksi destilasi berkesinambungan Lickens Nickerson. Dasar pertimbangan pemilihan kedua metode tersebut untuk mengetahui efisiensi proses ekstraksi terhadap minyak atsiri yang dihasilkan. Pada metode destilasi air, minyak atsiri jintan hitam yang diperoleh hanya sedikit, berupa dua titik minyak atsiri yang mengapung pada permukaan air (Lampiran 1). Sedikitnya minyak atsiri yang diperoleh sulit untuk dipisahkan sehingga tidak dapat digunakan pada tahap penelitian selanjutnya.
Penelitian ekstraksi biji jintan hitam menggunakan metode destilasi telah banyak dilakukan, diantaranya oleh Yasni et al. (2009), Borgou et al. (2010), Harzallah et al. (2011), dan Martos et al. (2011). Penelitian tersebut menggunakan cara steam destillation untuk memperoleh minyak atsiri jintan hitam. Berat jintan hitam yang digunakan pada berbagai penelitian tersebut bervariasi pada kisaran 100 gram hingga 500 gram, dengan variasi waktu antara lain 90 menit (Borgou et al. 2010), 2.5 jam (Harzallah et al. 2011), dan 3 jam (Martos et al. 2011 ) dengan rendemen hasil minyak atsiri yang diperoleh sebesar 0.5%, 0.8%, dan 1.2%.
20
Nickerson, dapat diperoleh komponen volatil dari jintan hitam. Komponen volatil dari jintan hitam, dan selanjutnya dilakukan identifikasi komponen kimianya dengan GC-MS (Tabel 5).
Tabel 5 Komposisi komponen volatil minyak atsiri biji jintan hitam menggunakan SDE Lickens Nickerson
Senyawa Golongan Kimia Area (%)
Hasil Literatur a p-cymene Hidrokarbon monoterpen 9.69 33.75 γ-terpinene Hidrokarbon monoterpen 3.24 2.40 alfa-thujene Hidrokarbon monoterpen 1.42 3.27 longifolene Hidrokarbon sesquiterpen 1.14 3.11
thymol Fenol terpen 1.02 26.78
alfa-pinene Hidrokarbon monoterpen 0.78 0.70 β-pinene Hidrokarbon monoterpen 0.50 1.12 a
Sumber:D’Antuono et al. 2002.
Pada Tabel 5 ditunjukkan komposisi komponen volatil dari penelitian ini cukup sesuai bila dibandingkan dengan literatur. Penelitian yang dilakukan oleh D’Antuono et al. 2002 terhadap ekstrak minyak atsiri jintan hitam menggunakan metode Lickens Nickerson menunjukkan komponen volatil setelah p-cymene berdasarkan luas areanya adalah thymol, thymoquinone, alfa-thujene, longifolene, γ-terpinene, β-pinene, dan alfa-pinene. Pada penelitian ini komponen kimia yang ada pada minyak atsiri jintan hitam, mengandung sebagian besar p-cymene (9.69%), γ-terpinene (3.24%), alfa-thujene (1.42%), thymol (1.02%), alfa-pinene (0.78%), t-anethole (0.71%), dan β-pinene (0.50%). Thymoquinone sebagai senyawa aktif utama tidak tampak pada hasil GC-MS dari metode Lickens Nickerson pada penelitian ini. Ketiadaan senyawa thymoquinone dalam minyak atsiri jintan hitam diduga oleh beberapa faktor, diantaranya (1) jenis jintan hitam yang digunakan pada penelitian ini, terkait ada beberapa jenis jintan hitam yang tidak mengandung thymoquinone (Edris 2009), (2) ada komponen volatil yang teruapkan selama proses preparasi sampel sebelum dilakukan identifikasi oleh alat GC-MS, (3) iklim lokal, lokasi geografis (Bourgou et al. 2010), (4) kondisi lingkungan, musim, geologi, bagian dari tanaman, metode yang digunakan dalam memperoleh minyak atsiri (Martos et al. 2011), serta (5) waktu penanaman, dan praktek agronomi (Sultan et al. 2009).
21 Data hasil ekstraksi jintan hitam dengan metode destilasi air, Lickens Nickerson, refluks, dan maserasi dapat dilihat pada Tabel 6 dan Tabel 7. Penghitungan rendemen ekstrak diperlukan untuk mengetahui efisiensi dari proses ekstraksi yang dilakukan.
Tabel 7 Karakteristik ekstrak jintan hitam
Deskripsi Warna
Angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Tabel 6 memperlihatkan bahwa metode Lickens Nickerson menghasilkan rendemen minyak atsiri (0.52%), walaupun rendemen tersebut sangat rendah dibandingkan dengan rendemen oleoresin etanol 70% jintan hitam (12-15%). Oleh karena itu ekstrak minyak atsiri jintan hitam tidak digunakan pada tahapan penelitian utama.
Perolehan rendemen oleoresin jintan hitam metode maserasi 6 jam dan 24 jam, serta refluks 1 jam dan 3 jam, berturut-turut adalah 12.26%, 13.79%, 14.49% dan 15.39%. Nilai rendemen oleoresin jintan hitam tersebut menunjukkan
Tabel 6 Rendemen ekstrak jintan hitam
Deskripsi Rendemen (%)
Minyak atsiri Oleoresin
1 Metode Destilasi air
(waktu 6 jam)
Tidak terdeteksi
(t.d) -
2 Metode Lickens Nickerson 0.52±0.057 -
3 Metode Maserasi
a. waktu 6 jam
22
ekstraksi menggunakan panas selama satu jam dan tiga jam lebih efektif bila dibandingkan ekstraksi tanpa menggunakan panas selama 6 dan 24 jam. Perolehan rendemen ekstrak jintan hitam dengan metode refluks satu jam (14.49%) serupa dengan nilai rendemen ekstrak jintan hitam dengan metode dan waktu yang sama yang dilakukan oleh Mashita (2011) yaitu 13.88%. Nilai rendemen ekstrak jintan hitam dari refluks 3 jam (15.39%) lebih tinggi dari nilai rendemen ekstrak jintan hitam 3 jam pada penelitian Yasni et al. (2009) yakni 8.39%. Tingginya rendemen oleoresin jintan hitam dengan metode refluks tiga jam pada penelitian ini disebabkan oleh ekstraksi dilakukan dua kali (duplo) penyaringan, sedangkan pada ekstraksi yang dilakukan Yasni et al. (2009) hanya dilakukan satu kali tahap penyaringan. Namun apabila dilihat secara statistik, nilai rendemen oleoresin jintan hitam dari metode refluks 1 jam dan 3 jam tidak berbeda nyata, yakni 14.49% dan 15.39%. Oleh karena itu penentuan metode ekstrak yang digunakan pada penelitian utama didasarkan pada jumlah rendemen, kapasitas antioksidan dan nilai total fenol ekstrak yang dihasilkan.
Analisa kapasitas antiosidan dan total fenol dilakukan untuk mengetahui sifat fungsional ekstrak, yakni kemampuan ekstrak jintan hitam dalam menghambat radikal bebas. Nilai kapasitas antioksidan ekstrak jintan hitam dengan metode refluks 3 jam lebih tinggi dari metode maserasi 6 jam, 24 jam, dan refluks 1 jam. Tingginya kapasitas antioksidan pada ekstrak jintan hitam metode refluks 3 jam berkorelasi dengan tingginya nilai total fenol (Tabel 7). Hal tersebut menunjukkan tingginya kapasitas antioksidan pada ekstrak jintan hitam metode refluks 3 jam dipengaruhi oleh adanya senyawa fenolik. Berdasarkan nilai rendemen, kapasitas antioksidan, dan nilai total fenol, maka ekstrak yang digunakan pada tahap penelitian utama adalah oleoresin jintan hitam dari metode refluks tiga jam (Lampiran 2).
23 Tabel 8 Komponen kimia oleoresin jintan hitam
Keberadaan beberapa asam lemak pada oleoresin jintan hitam (Tabel 8) mendukung hasil analisa proksimat jintan hitam yang kaya kandungan asam lemak. Butyric acid hydrazide, 2-propanone 1-hydroxy, propanoic acid 2-oxo- methyl ester, formic acid yang merupakan asam lemak rantai pendek memiliki
Senyawa Waktu
Retensi (menit)
Luas Area (%)
Butyric acid hydrazide 17.42 0.3267
Butanedial 18.36 0.1153
Pyrazine,methyl- 18.51 0.5198
2-Propanone, 1-hydroxy- 19.28 12.47924
Acetaldehyde, hydroxy- 19.61 3.6759
1-Propanol 20.29 0.6573
Acetic acid, hydroxy-, methyl ester 20.74 1.3180
Acetic acid 21.76 8.8705
Propanoic acid, 2-oxo-, methyl ester 22.04 1.3391
Furfural 22.48 0.5579
Formic acid 23.02 3.0160
Pyrrole 23.43 0.1827
Propanoic acid 23.67 0.2544
Methanone, dicyclopropyl- 24.83 0.4017
Butanoic acid 25.47 0.1983
2-Propenoic acid 25.63 0.2110
2-Furanmethanol 26.14 3.6196
Butyrolactone 26.25 1.3296
Cyclohexanone, 3-methyl-, (R)- 26.48 0.3042
Acetamide 28.14 0.2136
Vinyl Ether 28.74 0.2553
1-Pyrrolidineethanamine 28.85 0.6902
Heptanoic acid 29.46 0.1834
Phenol, 2-methoxy 30.07 0.1067
Octadecanoic acid 31.98 0.4978
Phenol 32.32 1.8133
Sulfurous acid, bis(2-pentyl) ester 33.01 0.8330
1,3-Propanediamine, N-methyl 34.35 5.3702
Hexadecanoic acid, methyl ester 35.57 7.8370
Oleic Acid 36.06 3.9768
6-Octadecenoic acid, (Z) 36.23 6.8204
8-Nonen-2one 36.99 1.2536
Heptadecanoic acid, 16-methyl-, methyl ester 38.89 0.8852 9-Octadecenoic acid (Z)-, methyl ester 39.39 7.2493
Dimethylamine 42.79 1.0543
Tetradecanoic acid 44.45 0.9993
1,2-Benzenediol 45.24 0.7312
24
titik didih rendah dan berat molekul kecil. Acetaldehyde hydroxy dapat digunakan sebagai bahan minyak atsiri buatan. Formic acid dapat berfungsi sebagai pengawet makanan. Oleic acid merupakan asam lemak yang mempunyai satu ikatan rangkap (dikenal dengan asam omega 9) dapat berfungsi sebagai antioksidan dalam tubuh.
Oleoresin terdiri dari campuran minyak atsiri, resin yang larut dalam pelarut organik yang digunakan dalam ekstraksi, dan kandungan lain yang terdapat dalam rempah yang bersifat non volatil (Lees 2003). Berdasarkan literatur, komposisi kimia senyawa aktif jintan hitam terdapat pada bagian minyak atsiri yang bersifat volatil, dengan ekstraksi sebagian besar menggunakan steam destilasi. Pada penelitian Sellami et al. (2007) yang menggunakan Soxhlet selama 6 jam dengan pelarut isopentan, dilanjutkan dengan dynamic headspace untuk mengekstrak senyawa aromanya, komponen kimia ekstrak jintan hitam yang diperoleh mengandung sebagian besar senyawa p-cymene, kemudian berturut turut alfa-thujene, thymol, β-pinene, γ-terpinene, dan alfa-pinene. Komponen kimia ekstrak jintan hitam tersebut menyerupai komponen kimia yang terdapat pada minyak atsiri jintan hitam.
Komponen kimia oleoresin jintan hitam pada penelitian ini yang dipreparasi sebelumnya menggunakan SPME, ternyata tak satupun komponen kimianya menyerupai komponen kimia pada minyak atsiri jintan hitam, misalnya tidak mengandung p-cymene, thymol, dan alfa-thujene. Perbedaan komponen kimia oleoresin jintan hitam pada penelitian ini dengan komponen kimia oleoresin jintan hitam pada penelitian Sellami et al. (2007) dapat disebabkan oleh beberapa hal, antara lain metode dan waktu ekstraksi yang digunakan, jenis pelarut, dan preparasi sampel sebelum dilakukan identifikasi komponen kimianya.
Penelitian Utama
Pembuatan dan karakterisasi nanoemulsi
Pembuatan nano emulsi dipersiapkan dengan mekanisme emulsifikasi spontan, yang terjadi saat fase organik dan fase air dicampur. Fase organik yaitu larutan homogen dari pelarut organik (etanol 70%) dan ekstrak jintan hitam. Untuk mengetahui komposisi perbandingan fase organik maka dilakukan pencampuran antara keduanya dimulai dari perbandingan terendah, yakni 1:1. Pada perbandingan ekstrak kental jintan hitam dengan pelarut 1:1 menunjukkan saling larut antara keduanya dengan nilai total padatan terlarut 31 Brix. Agar mendapatkan ekstrak jintan hitam dengan nilai total padatan terlarut 20 Brix yang digunakan pada pembuatan nano emulsi, maka ekstrak kental jintan hitam 1 gram memerlukan pelarut 5 gram.
25 tinggi (15.0 ± 1.0) dan digunakan untuk aplikasi o/w. Nilai HLB yang tinggi akan stabil pada sistem emulsi o/w karena memungkinkan hubungan yang lebih besar antara fraksi hidrofilik dengan matriks film hidrofilik yang dapat mengurangi jumlah air yang berikatan dengan fraksi hidrofobik (Brandelero et al. 2010).
Pencampuran air dan Tween 80 sebagai fase air dilakukan dengan pengaduk magnetik selama 30 menit pada suhu ruang. Fase organik disiapkan sebanyak 10 % dari total emulsi. Emulsifikasi terjadi saat fase organik diinjeksikan pada fase air (Schalbart et al. 2010). Pengadukan dilakukan selama 45 menit untuk mencapai keseimbangan sistem. Emulsi o/w terbentuk dengan adanya difusi pelarut organik pada sekeliling fase air membentuk nanodroplet. Pada emulsifikasi spontan, terjadi difusi cepat dari pelarut yang larut air, dalam hal ini etanol 70%, yang awalnya dilarutkan pada fase organik kepada fase air saat keduanya dicampur. Proses emulsifikasi spontan telah banyak dilaporkan terjadi pada sistem oil in water (Dewangan dan Suresh 2011). Pembuatan nanoemulsi dengan energi rendah tersebut telah mendapat perhatian terkait keefektifan biaya (Schalbart et al. 2010). Proses pembuatan nanoemulsi menggunakan energi rendah yakni emulsifikasi spontan dengan pengaduk magnetik dapat dilihat pada Lampiran 3.
Pada penelitian ini dilakukan perbandingan antara pembuatan emulsi menggunakan Tween 80 pada tiga konsentrasi (1%, 2%, 3%). Pada ketiga emulsi yang dihasilkan, masing-masing dilakukan karakterisasi berupa ukuran partikel, nilai zeta potensial, indeks polidispersitas. Adapun data ukuran partikel dapat dilihat pada Tabel 9.
Tabel 9 Ukuran partikel nanoemulsi jintan hitam berdasarkan konsentrasi surfaktan
No Sampel Konsentrasi
Tween 80
Angka pada kolom yang sama yang diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
26
Indeks polidispersitas mengindikasikan kualitas kehomogenan suatu dispersi. Nilai indeks polidispersitas yang kecil menunjukkan distribusi ukuran partikel yang sempit, yang berarti ukuran partikel semakin homogen (Lovelyn dan Attama, 2011). Berdasarkan hasil pada Tabel 2, nilai Indeks polidispersitas berturut-turut dari yang terbesar 0.62 (T2), 0.52 (T1), 0.31 (T3). Hal tersebut menunjukkan bahwa nanoemulsi T1 dengan ukuran partikel 25 nm lebih homogen dibandingkan T2 dengan ukuran partikel 21 nm. Ukuran partikel dan indeks polidispersitas terkecil dimiliki oleh T3, yang berarti ukuran partikel 10.93 nm pada T3 lebih homogen bila dibandingkan T1 dan T2. Secara statistik T3 berbeda nyata bila dibandingkan dengan T1 dan T2 untuk parameter ukuran partikel dan indeks polidispersitas. Penurunan ukuran partikel dan indeks polidispersitas seiring peningkatan konsentrasi surfaktan lebih jelas menunjukkan pengaruh konsentrasi surfaktan pada pembentukan nano droplet. Dengan rasio fase organik yang sama (10% w/w) pada ketiga emulsi, peningkatan konsentrasi surfaktan dapat mengurangi tegangan permukaan antara fase organik dan fase air sehingga droplet yang terbentuk lebih homogen, terjadi penurunan penggabungan droplet dan menstabilkan pembentukan droplet kecil (Karjiban et al. 2012).
Muatan permukaan zeta potensial menghasilkan gaya tolak listrik diantara droplet minyak yang dapat menghambat penggabungan droplet. Secara umum, partikel dengan nilai zeta potensial melebihi +30 mV atau kurang dari -30 mV menunjukkan kestabilan, karena muatan listrik dari droplet cukup kuat untuk menolak antara droplet yang dominan dalam sistem nanoemulsi (Trujillo et al. 2013). Kisaran nilai zeta potensial yang dihasilkan ketiga nanoemulsi pada penelitian ini 44 – 57 mV. Nilai zeta potensial yang melebihi +30 mV tersebut menandakan ketiga emulsi yang dihasilkan stabil. Dari data ketiga nanoemulsi yang dihasilkan pada penelitian ini, ukuran partikel terkecil dengan indeks polidispersitas yang kecil dan nilai zeta potensial melebihi +30 mV atau kurang dari -30 mV dimiliki oleh emulsi dengan konsentrasi surfaktan 3% (T3). Berdasarkan ukuran partikel pada tiga perbandingan konsentrasi surfaktan, maka nanoemulsi dengan konsentrasi 3% Tween 80 yang digunakan pada enkapsulasi. Pembuatan dan karakterisasi produk enkapsulasi nanoemulsi
Enkapsulasi nanoemulsi pada penelitian ini dilakukan dengan bahan penyalut maltodekstrin (100%), dan kombinasi maltodekstrin dan isolat protein kedelai pada perbandingan 80:20 (w/w). Maltodekstrin sering digunakan pada enkapsulasi senyawa polifenol (Fang dan Bhandari 2010). Maltodekstrin yang mempunyai sifat cepat larut dalam air, dapat digunakan secara tunggal sebagai bahan penyalut atau dikombinasikan dengan bahan penyalut lain. Dasar pertimbangan penggunaan isolat protein kedelai selain maltodekstrin pada penelitian ini, dikarenakan protein pangan dapat mengikat berbagai molekul bioaktif ke dalam struktur polipeptida sehingga dapat melindungi molekul bioaktif sampai pada sel tubuh yang dituju. Selain itu, kestabilan nanopartikel isolat protein kedelai telah diujikan secara in vitro pada pH asam dan basa (Zhang et al. 2012) serta nanopartikel yang dilapisi dengan protein dapat melindungi senyawa bioaktif pada saluran pencernaan (Chen et al. 2006).
27 semprot dan diatomisasi. Air yang terdapat dalam campuran nanoemulsi teruapkan oleh udara panas yang terhubungkan dengan bahan atomisasi. Bubuk yang diperoleh kemudian dikumpulkan setelah jatuh ke bagian bawah alat pengering. Penyemprotan kering dilakukan dengan laju alir umpan 16 mL/menit dan suhu inlet 170°C. Pada penelitian yang dilakukan oleh Desmawarni (2007), penggunaan suhu inlet 170°C dan laju alir umpan 16 mL/menit menghasilkan pengeringan yang cukup baik dari segi fisik produk. Hasil dari produk enkapsulasi dapat dilihat pada Lampiran 4.
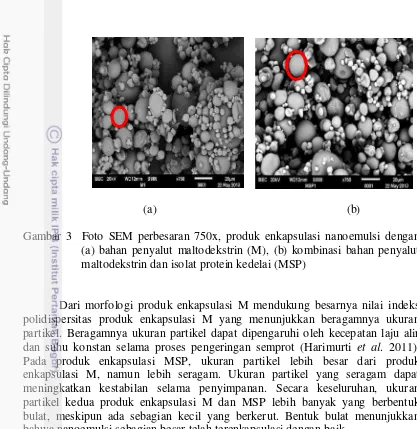
Proses rekonstitusi dilakukan terhadap produk enkapsulasi nanoemulsi dengan bahan penyalut maltodekstrin (M) dan kombinasi maltodekstrin dan isolat protein kedelai (MSP) untuk mengetahui ukuran partikel dan nilai indeks polidispersitasnya. Rekonstitusi dilakukan dengan penambahan air sehingga memiliki total padatan sama seperti sebelum dilakukan pengeringan semprot. Hasil ukuran partikel dan indeks polidispersitas produk enkapsulasi jintan hitam dapat dilihat pada Tabel 10.
Tabel 10 Ukuran partikel produk enkapsulasi hasil rekonstitusi nanoemulsi jintan hitam
Sampel Ukuran partikel (nm)
Indeks polidispersitas M 797.1 ± 57.77a 0.71± 0.19c MSP 1331.58± 32.49b 0.23± 0.08d
M: nanoemulsi yang dienkapsulasi dengan maltodekstrin; MSP: nanoemulsi yang dienkapsulasi dengan campuran maltodekstrin dan isolat protein kedelai 80:20 (w/w)
a
Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Ukuran partikel produk enkapsulasi yang telah direkonstitusi dengan air berkisar antara 700 – 1300 nm. Ukuran partikel produk enkapsulasi M yang telah direkonstitusi (797 nm), apabila dibandingkan dengan ukuran partikel nanoemulsi sebelum dilakukan enkapsulasi (10.93 nm), telah terjadi peningkatan ukuran partikel. Besarnya ukuran partikel pada produk enkapsulasi M dapat disebabkan kurang optimalnya proses rekonstitusi atau terjadi penggabungan pada sebagian droplet partikel sehingga yang terukur adalah partikel mikrokapsul (bubuk). Selain itu peningkatan suhu selama proses pengeringan semprot juga dapat menyebabkan masuknya udara ke dalam partikel sehingga meningkatkan diameter partikel (Sansone et al. 2011), sedangkan besarnya ukuran partikel pada produk enkapsulasi MSP (1331 nm) dapat dipengaruhi oleh ukuran partikel protein (Dickinson 2012). Nilai indeks polidispersitas produk enkapsulasi MSP (0.23) yang lebih kecil dari produk enkapsulasi M (0.71), menunjukkan bahwa produk enkapsulasi MSP dengan ukuran partikel 1331 nm lebih homogen dibandingkan produk enkapsulasi M yang ukuran partikelnya 797 nm.