BIODELIGNIFIKASI KAYU SENGON UNTUK PRODUKSI
BIOETANOL DENGAN TEKNIK SAKARIFIKASI
FERMENTASI SIMULTAN SEL TERAMOBIL
AZMI AZHARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Biodelignifikasi Kayu Sengon untuk Produksi Bioetanol dengan Teknik Sakarifikasi Fermentasi Simultan Sel Teramobil adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
AZMI AZHARI. Biodelignifikasi Kayu Sengon untuk Produksi Bioetanol dengan Teknik Sakarifikasi Fermentasi Simultan Sel Teramobil. Dibimbing oleh MARIA BINTANG dan SYAMSUL FALAH.
Delignifikasi adalah suatu proses pendahuluan penghilangan lignin pada material berlignoselulosa. Batang kayu sengon adalah salah satu biomassa lignoselulosa yang potensial sebagai sumber bahan baku etanol karena memiliki kadar selulosa yang tinggi dan kadar lignin yang cukup rendah. Penelitian ini bertujuan untuk mendelignifikasi kayu sengon dengan menggunakan Trametes versicolor untuk produksi etanol dengan teknik sakarifikasi dan fermentasi simultan menggunakan Trichoderma viride dan Zymomonas mobilis yang diamobilisasi Ca-Alginat. Metode yang digunakan meliputi pengamatan pertumbuhan Trametes versicolor dibandingkan dengan Phanerochaete chrysosporium, uji kualitatif degradasi lignin pada lindi hitam, delignifikasi kayu sengon, dan pengukuran kadar kimia sebelum dan setelah delignifikasi menggunakan Trametes versicolor dan produksi bioetanol.
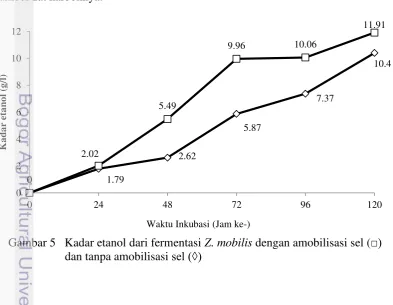
Hasil penelitian ini menunjukan bahwa Trametes versicolor dapat lebih cepat mendelignifikasi dibandingkan dengan Phanerochaete chrysosporium dalam uji kualitatif degradasi lignin pada lindi hitam. Kadar lignin dari kayu sengon mengalami penurunan sebesar 37.31% setelah delignifikasi oleh Trametes versicolor pada suhu ruang dalam waktu 20 hari. Uji kimia kayu sengon setelah proses delignifikasi menunjukkan penurunan kadar zat ekstraktif larut etanol benzena, holoselulosa, dan selulosa serta kenaikan kadar hemiselulosa. Kadar etanol yang dihasilkan selama 5 hari fermentasi tanpa teknik amobilisasi sel Zymomonas mobilis dengan pengambilan sampel pada jam ke-24, 48, 72, 96, dan 120, hasilnya berturut-turut sebesar 1.79 g/L, 2.62 g/L, 5.87 g/L, 7.37 g/L, dan 10.4 g/L. Hasil fermentasi selama 5 hari dengan teknik amobilisasi sel Z. mobilis dengan pengambilan sampel pada jam ke-24, 48, 72, 96, dan 120, hasilnya berturut-turut sebesar 2.02 g/L, 5.49 g/L, 9.96 g/L, 10.06 g/L, dan 11.91 g/L. Produksi etanol dengan menggunakan teknik amobilisasi sel bakteri Z. mobilis menghasilkan kadar etanol lebih tinggi dibandingkan dengan produksi etanol tanpa amobilisasi sel.
SUMMARY
AZMI AZHARI. Biodelignification of Falcata Wood for Bioethanol Production by Simultaneous Saccharification Fermentation Technique using Immobilized Cells. Supervised by MARIA BINTANG and SYAMSUL FALAH.
Delignification is a lignin degradation preliminary process of lignocellulose materials. Falcata wood is one of potensial lignocelullose for making bioethanol because it has high levels of cellulose and low level of lignin. The aim of this study was delignification Falcata wood by using Trametes versicolor, and bioethanol production by simultaneous saccharification fermentation technique using Trichoderma viride and immobilized Zymomonas mobilis with Ca-Alginat. The methods used include observation growth of Trametes versicolor compared with Phanerochaete chrysosporium, the rate of of lignin degradation (black liquor), delignification of Falcata wood using Trametes versicolor and the chemical assay of Falcata wood before and after delignification and bioethanol production.
The results of this study showed that lignin degradation at black liquor by Trametes versicolor is faster than Phanerochaete chrysosporium. Delignification by Trametes versicolor reduced lignin from Falcata wood by 37.31 % within 20 days at room temperature. Chemical assay performed on delignified Falcata wood showed decreased level of ethanol benzene soluble extractive substances, holocellulose, and cellulose and an increase of hemicellulose level. Ethanol production by fermentation for 5 days without cells immobilization technique of Zymomonas mobilis with sampling at 24, 48, 72, 96, and 120 hours, the results were 1.79 g/L, 2.62 g/L, 5.87 g/L, 7.37 g/L, and 10.4 g/L. Ethanol production by fermentation for 5 days with immobilization of Zymomonas mobilis cells with sampling at 24, 48, 72, 96, and 120 hours, the results were 2.02 g/L, 5.49 g/L, 9.96 g/L, 10.06 g/L, dan 11.91 g/L Production of ethanol using immobilized Zymomonas mobilis cells was higher than the production of bioethanol non-immobilized Zymomonas mobilis cells.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
BIODELIGNIFIKASI KAYU SENGON UNTUK PRODUKSI
BIOETANOL DENGAN TEKNIK SAKARIFIKASI
FERMENTASI SIMULTAN SEL TERAMOBIL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Biodelignifikasi Kayu Sengon untuk Produksi Bioetanol dengan Teknik Sakarifikasi Fermentasi Simultan Sel Teramobil
Nama : Azmi Azhari NIM : G851120141
Disetujui oleh Komisi Pembimbing
Prof. Dr. drh. Maria Bintang, MS Ketua
Dr. Syamsul Falah, S.Hut, M.Si Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof. Dr. drh. Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Shalawat serta salam semoga selalu tercurah kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya sampai akhir zaman.
Tesis ini berjudul Biodelignifikasi Kayu Sengon untuk Produksi Bioetanol dengan Teknik Sakarifikasi Fermentasi Simultan Sel Teramobil. Kegiatan penelitian ini yang merupakan salah satu syarat memperoleh gelar magister sains di Departemen Biokimia Sekolah Pascasarjana IPB. Kegiatan penelitian ini dilakukan dari bulan September hingga Februari 2014 bertempat di Laboratorium Biokimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada komisi pembimbing yaitu dengan Prof. Dr. drh. Maria Bintang, MS sebagai ketua dan Dr. Syamsul Falah, S.Hut, M.Si. sebagai anggota yang telah memberikan masukan dan saran serta kritik membangun demi penyusunan laporan penelitian ini.
Akhir kata penulis ucapkan terima kasih, dan semoga bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
2 METODE 3
Waktu dan Tempat Penelitian 3
Alat dan Bahan 3
Metode 3
3 HASIL DAN PEMBAHASAN 7
Pertumbuhan Phanerochaete chrysosporium dan Trametes versicolor 7 Degradasi Lignin pada Lindi Hitam oleh Trametes versicolor dan
Phanerochaete chrysosporium 9
Delignifikasi Kayu Sengon dengan Trametes versicolor 10
Produksi Bioetanol 14
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR GAMBAR
1 Pertumbuhan jamur Phanerochaete chrysosporium dan Trametes versicolor dalam media PDA pada suhu ruang (28ºC) 8 2 Degradasi lignin pada media PDA yang mengandung lindi hitam oleh
Phanerochaete chrysosporium dan Trametes versicolor 10
3 Kayu sengon berukuran 80 mesh 11
4 Delignifikasi kayu sengon dengan Trametes versicolor 11 5 Kadar etanol pada fermentasi tanpa amobilisasi sel dan amobilisasi sel
Z. mobilis 16
6 Kadar gula pereduksi pada fermentasi tanpa amobisasi sel
dan amobilisasi sel Z. mobilis 17
DAFTAR LAMPIRAN
1 Bagan alir penelitian 23
2 Kromatogram standar etanol 24
3 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-24 24
4 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-48 25
5 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-72 25
6 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-96 26
7 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-120 26
8 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel
Zymomonas mobilis pada jam ke-24 27
9 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel
Zymomonas mobilis pada jam ke-48 27
10 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel
Zymomonas mobilis pada jam ke-72 28
11 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel
Zymomonas mobilis pada jam ke-96 28
12 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel
1
PENDAHULUAN
Latar Belakang
Ketersediaan energi yang baru dan terbaharukan dewasa ini menjadi wacana penting dunia. Hal ini disebabkan karena energi fosil diambang krisis sedangkan kebutuhan manusia terhadap energi semakin lama semakin meningkat. Oleh sebab itu, diperlukanlah sebuah solusi untuk mengatasi masalah tersebut. Pengembangan energi dengan bahan baku nabati (bioetanol) diharapkan bisa memberikan kontribusi bagi ketersediaan energi dunia.
Produksi bahan bakar minyak (BBM) nasional Indonesia pada tahun 2006 mencapai 40.9 juta kilo liter atau turun sekitar 3.9% dibandingkan tahun sebelumnya. Kebutuhan BBM nasional pada tahun 2030 diproyeksikan dapat dipenuhi jika pemerintah mengimpor BBM sebesar 71.8% dari total kebutuhan atau sekitar 2,5 kali lipat produksi BBM nasional. Oleh sebab itu, kebijakan energi nasional melalui Perpres No. 5 Tahun 2006 yaitu alternatif bahan bakar nasional dapat berasal dari pemanfaatan bahan bakar nabati (bioetanol) (Kementrian Energi dan Sumber Daya Mineral 2008).
Sumber bahan baku penyediaan biofuel adalah bahan bergula, bahan berpati, dan bahan berlignoselulosa. Penyediaan bahan baku bioetanol yang berasal dari sumber pangan tidak dapat direkomendasikan, karena menimbulkan masalah baru bagi ketersediaan pangan. Salah satu bahan baku pembuatan etanol yang potensial berasal dari berlignoselulosa karena jumlahnya cukup besar di Indonesia. Pemanfaatan lignoselulosa sebagai sumber bahan bakar alternatif diharapkan akan menjadi salah satu cara untuk mengatasi krisis energi (Hermiati et al. 2010). Salah satu sumber lignoselulosa adalah kayu sengon. Kayu sengon (Paraserianthes falcataria (L.) Nielsen) adalah salah satu jenis pohon cepat tumbuh (fast growing species) dan banyak ditanam oleh masyarakat Indonesia. Sengon pada umumnya ditebang pada umur 5 sampai 7 tahun (Krisnawati et al. 2011). Biomassa ini mempunyai sumber selulosa yang cukup tinggi, namun kandungan ligninnya tidak terlalu besar sehingga dapat dijadikan sumber selulosa yang cukup potensial (Siagian et al. 2003).
Bahan penyusun lignoselulosa terdiri atas lignin dan polisakarida (hemiselulosa dan selulosa). Lignin berikatan kuat dengan hemiselulosa dan selulosa yang membentuk dinding sel tanaman. Pemanfatan polisakarida untuk produksi bioetanol dapat terganggu oleh adanya lignin. Oleh sebab itu, proses degradasi lignin (delignifikasi) perlu dilakukan. Delignifikasi yang digunakan dalam industri saat ini tidak ramah lingkungan karena menggunakan sulfat, alkali dan bahan kimia lainnya yang dapat menyebabkan masalah pencemaran. Selain itu, proses secara kimiawi ini membutuhkan penanganan khusus karena membutuhkan energi tinggi, reaktor yang tahan tekanan tinggi, dan tahan korosi (Fitria et al. 2006; Martina et al. 2002).
2
dan Phanerochaete chrysosporium paling efektif dalam mendegradasi lignin kayu (Perez et al. 2002). Keduanya memiliki enzim pendegradasi lignin cukup lengkap seperti lakase, manganase peroksidase, dan lignin peroksidase (Hossain dan Ananthraman 2006). Menurut penelitian Anita et al. (2011) T. versicolor dapat menghasilkan enzim ligninase lebih cepat dibandingkan P. chrysosporium. Delignifikasi sengon dalam penelitian ini menggunakan T. versicolor.
Sampel sengon hasil delignifikasi digunakan sebagai substrat untuk proses sakarifikasi dan fermentasi simultan menggunakan Trichoderma viride dan Zymomonas mobilis yang diamobilisasi Ca-Alginat. Keutamaan proses sakarifikasi dan fermentasi simultan ini dapat mempersingkat waktu proses dan rendemen etanol (Hermiati et al. 2010). Selain itu, teknik amobilisasi sel memiliki keuntungan seperti penggunaan sel yang dapat dipakai berulang, melindungi sel dari kerusakan, dan relatif mudah dalam pemisahan produk (Goksungur dan Zorlu 2001).
Dengan adanya penelitian pembuatan bioetanol dari kayu sengon dengan menggunakan teknik biodelignifikasi, dan proses sakarifikasi simultan sel yang diamobil, diharapkan akan memberikan kontribusi besar bagi ketersediaan energi yang baru dan terbaharukan di masa mendatang.
Perumusan Masalah
Produksi etanol dari kayu sengon meliputi delignifikasi, dan sakarifikasi fermentasi simultan. Proses delignifikasi menggunakan cara kimiawi tidak mudah penanganannya, mahal dan tidak ramah lingkungan, sehingga proses delignifikasi menggunakan cara biologis dapat dijadikan alternatif. Proses sakarifikasi dan fermentasi secara terpisah kurang efektif sehingga sakarifikasi fermentasi yang dilakukan secara simultan diharapkan dapat menyingkat proses. Selain itu, teknologi amobilisasi sel diharapkan dapat menjadi pilihan untuk meningkatkan produksi bioetanol.
Tujuan Penelitian
Penelitian ini bertujuan :
1. Melakukan uji kualitatif degradasi lignin pada lindi hitam oleh Trametes versicolor dan Phanerochaete chrysosporium.
2. Mendelignifikasi kayu sengon secara biologis dengan menggunakan Trametes versicolor.
3. Melakukan sakarifikasi dan fermentasi secara simultan kayu sengon dengan menggunakan Trichoderma viride dan Zymomonas mobilis teramobil dan tanpa amobil untuk produksi bioetanol.
Hipotesis
Hipotesis pada penelitian ini yaitu :
1. Lignin dalam lindi hitam dapat didegradasi oleh Trametes versicolor dan Phanerochaete chrysosporium.
3 3. Etanol dapat diproduksi dari kayu sengon dengan teknik sakarifikasi fermentasi simultan dengan menggunakan Trichoderma viride dan Zymomonas mobilis yang diamobil dan tanpa amobil.
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 6 bulan (September 2013-Februari 2014). Tempat pelaksanaannya di Laboratorium Biokimia, Departemen Biokimia, Institut Pertanian Bogor, BB Biogen (Balai Besar Litbang Bioteknologi dan Sumber Daya Genetik Pertanian), dan Laboratorium Kimia Hasil Hutan Insitut Pertanian Bogor.
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah biomassa kayu sengon yang berasal dari daerah Sumedang Jawa Barat yang berumur 5 tahun. Mikroorganisme yang digunakan untuk uji degradasi lignin pada lindi hitam dan delignifikasi adalah Phanerochaete chrysosporium dan Trametes versicolor, sedangkan Trichoderma viride dan Zymomonas mobilis digunakan dalam fermentasi bioetanol. Bahan lain yang digunakan antara lain media PDA (Potato Dextrose Agar), media PDB (Potato Dextrose Broth), media NA (Nutrient Agar), media NB (Nutrient Broth), etanol benzena, akuades, H2SO4, Na2ClO3,
CH3COOH, NaOH, HNO3, Na2SO3, (NH4)2PO4, MgSO4.7H2O, ekstrak yeast,
3,5-dinitrosalisilat, glukosa, CaCl2, dan Na-alginat.
Alat-alat yang digunakan dalam penelitian ini terdiri atas cawan Petri, tabung reaksi, labu Erlenmeyer, autoklaf, plat pemanas, pengaduk magnetik, jarum ose, laminar, oven, inkubator, mesin penggiling Willey Mill, saringan 80 mesh, sokhlet, corong buchner, jidal (Thimble), filter gelas, penangas air, pengaduk, pipet, lemari pendingin, syringe, spektrofotometer UV-Vis, dan kromatografi gas Pye Unicam PU4500.
Metode
Metode yang digunakan dalam penelitian ini meliputi pengamatan pertumbuhan P. chrysosporium dan T. versicolor, uji kualitatif degradasi lignin (lindi hitam) oleh P. chrysosporium dan T. versicolor, uji kimia kayu sengon sebelum dan setelah delignifikasi, delignifikasi dengan T. versicolor dan produksi bioetanol dengan teknik sakarifikasi dan fermentasi simultan sel Zymomonas mobilis yang diamobilisasi Ca-Alginat, dan analisis hasil fermentasi.
Pengamatan Pertumbuhan Phanerochaete chrysosporium dan Trametes versicolor
P. chrysosporium dan T. versicolor ditumbuhkan pada cawan Petri berisi media PDA dan diamati pertumbuhannya pada hari ke 1, 2, 5, dan 16. Pengamatan terdiri atas perbandingan visual kecepatan tumbuh yang dilihat dari ukuran besar/luas koloni kedua jamur tersebut.
4
Uji Kualitatif Degradasi Lignin pada Lindi Hitam
Inokulasi P. chrysosporium dan T. versicolor sebanyak 1 ose dilakukan pada media PDA yang mengandung lindi hitam dengan perbandingan 1:1 dan diamati selama 20 hari. Lindi hitam yang digunakan berasal dari 20 kali pengenceran dari proses kraft (40%) biomassa lignoselulosa. Pengamatan yang dilakukan adalah perubahan warna pada media padat. Degradasi lignin telah terjadi jika warna coklat medium berkurang (Risdianto et al. 2007).
Delignifikasi Sengon oleh Trametes versicolor dan Pengukuran Kadar Kimia Sengon
Kayu sengon tanpa kulit dipotong kecil-kecil, digiling dalam mesin Willey mill dan disaring sehingga diperoleh ukuran 80 mesh. Sampel lalu ditimbang sebanyak 150 gram dalam wadah plastik tahan panas, direndam selama 24 jam dalam akuades, dan disterilisasi dengan menggunakan autoklaf 1210C selama 15 menit. Setelah itu, diinokulasikan dengan 100 ml suspensi T. versicolor dalam media PDB dari labu Erlenmeyer 250 ml telah ditumbuhkan sebelumnya selama 7 hari. Sampel tersebut lalu diinkubasi dalam suhu ruang selama 20 hari. Analisis sampel sebelum dan setelah delignifikasi meliputi kadar zat ekstraktif, kadar lignin, holoselulosa, hemiselulosa, dan selulosa. Kontrol tanpa penambahan jamur diperlakukan dengan kondisi yang sama, dan dianalisis pada hari ke-20 (modifikasi Akhtar et al. 1997).
Pengukuran Kadar Zat Ekstraktif
Pengukuran ini berdasarkan SNI nomor 1032. Serbuk sengon kering berukuran 80 mesh ditimbang 2 gram, lalu dimasukkan ke dalam jidal dalam alat sokhlet. Jidal ditutup dengan kasa halus untuk menghindari hilangnya spesimen. Kemudian serbuk sengon diekstrak dengan etanol-benzena (1:2 v/v) selama 6 jam. Setelah itu, sengon dipindahkan ke dalam corong buchner, pelarut dihilangkan dengan vakum, jidal dicuci dengan etanol untuk menghilangkan benzena. Sengon dipindahkan ke dalam jidal, lalu diekstraksi dengan etanol 95% selama 4 jam. Sengon dipindahkan ke dalam corong buchner, pelarut dihilangkan dengan vakum, jidal dicuci dengan akuades untuk menghilangkan etanol. Selanjutnya sengon dipindahkan ke dalam gelas piala 1000 mL dan ditambahkan 500 mL akuades
5 selama 4 jam, volume sampel dijaga dengan menambahkan akuades panas. Lignin disaring dengan gelas filter dan dicuci dengan akuades panas hingga bebas asam. Sampel dikeringkan dalam oven pada suhu 105 ºC hingga bobotnya konstan, didinginkan, dan ditimbang (BSN 2008).
Kadar lignin = bobot lignin (g)/ bobot kering sampel (g) x 100%
Pengukuran Kadar Holoselulosa
Sebanyak 2 gram sampel sengon dimasukkan ke dalam labu Erlenmenyer 250 mL dan ditambahkan 80 ml akuades, 1 gram Na2ClO3, dan 0.5 mL
CH3COOH glasial. Setelah itu, dipanaskan pada penangas air dengan suhu 70 ºC.
Permukaan air dalam penangas air dijaga agar tidak lebih tinggi dari larutan di hingga beratnya konstan dan ditimbang (Browning 1967).
Holoselulosa = bobot holoselulosa (g)/ bobot kering sampel (g) x 100%
Pengukuran Kadar Selulosa
Sebanyak 2 gram sampel sengon dimasukkan ke dalam labu Erlenmeyer 300 mL, ditambahkan 125 mL larutan HNO3 3.5% dan dipanaskan dalam
penangas air selama 12 jam pada suhu 80ºC. Lalu sampel disaring dengan akuades hingga tidak berwarna, lalu dikeringkan di udara. Sampel dimasukkan ke dalam labu Erlenmeyer, lalu ditambahkan 125 mL larutan campuran NaOH dan Na2SO3
dan dipanaskan selama 2 jam pada suhu 50ºC. Sampel disaring dengan gelas filter dan dibilas dengan akuades hingga filtrat tidak berwarna dan ditambahkan 50 mL larutan Na2ClO3 10% dan dicuci dengan akuades hingga diperoleh endapan
berwarna putih. Lalu ditambahkan 100 mL CH3COOH 10% dan dicuci hingga
bebas asam. Sampel dikeringkan ke dalam oven pada suhu 105ºC dan ditimbang hingga bobotnya tetap (Cross dan Bevan 1912).
Selulosa = bobot selulosa (g)/ bobot kering sampel (g) x 100%
Pengukuran Kadar Hemiselulosa
6
NaOH 8.3%. Pembilasan dilanjutkan dengan akuades hingga semua sampel terpindahkan ke dalam cawan saring. Setelah itu pembilasan dilanjutkan dengan 250 mL akuades. Sampel dikeringkan pada suhu 105ºC selama 24 jam. Kemudian didinginkan dalam desikator dan ditimbang bobotnya hingga konstan (BSN 2009). Alfa selulosa = bobot alfaselulosa (g) / bobot kering sampel (g) x 100%
Produksi Bioetanol
Sampel sengon hasil delignifikasi oleh Trametes versicolor, digunakan untuk fermentasi bioetanol. Mikroba yang digunakan untuk fermentasi bioetanol adalah Trichoderma viride dan Zymomonas mobilis. Peremajaan Trichoderma viride dilakukan pada media PDA dengan suhu 30 ºC selama 7 hari. Peremajaan Zymomonas mobilis dilakukan pada media NA dengan suhu 30ºC selama 48 jam.
Amobilisasi sel
Amobilisasi hanya dilakukan pada bakteri Zymomonas mobilis. Sebelum melakukan amobilisasi, dilakukan optimasi konsentrasi alginat terlebih dahulu dengan menggunakan variasi natrium alginat steril 1%, 2%, 3%, dan 4%. Butiran gel yang terbentuk paling baik digunakan untuk amobilisasi sel seperti tidak terlalu kaku dan tidak terlalu mudah pecah. Sel ditambahkan ke dalam Na-alginat steril. Butiran gel yang dibuat dengan meneteskan suspensi sel dalam natrium alginat dengan syringe ke dalam 50 mL larutan CaCl2 0.2 M steril sambil diaduk
dengan pengaduk bermagnet dengan kecepatan 100 rpm. Butiran gel yang sudah terbentuk dibiarkan selama 2 jam dalam larutan CaCl2 0.2 M pada suhu 4ºC
supaya gel yang terbentuk lebih mengeras. Selanjutnya butiran gel disaring dengan kertas saring steril kemudian dipindahkan ke dalam labu Erlenmeyer steril untuk dicuci dengan akuades steril sebanyak 3 kali. Pencucian dengan akuades steril bertujuan untuk menghilangkan larutan CaCl2 yang masih menempel pada
butiran gel dan sel yang tidak terjebak oleh natrium alginat (modifikasi Becerra et al. 2001).
Fermentasi Bioetanol
Sengon hasil delignifikasi oleh Trametes versicolor ditimbang sebanyak 3 gram dan dimasukkan ke dalam media fermentasi (100 mL) dengan komposisi (NH4)2HPO4 1 g/L, MgSO4.7H2O 0.05 g/L, dan ekstrak yeast 2 g/L dengan pH
media 7. Setelah itu, ditambahkan 5% isolat Trichoderma viride dan 10% inokulum cair Zymomonas mobilis (v/v) yang telah diamobilisasi dengan Ca-alginat yang optimum dari tahapan sebelumnya. Inkubasi selama 5 hari tanpa agitasi pada suhu 30ºC. Setiap 0, 24, 48, 72, 96, 120 jam dilakukan pengambilan sampel, kemudian dianalisis kadar gula pereduksi, dan etanol. Fermentasi bioetanol tanpa amobilisasi sel juga dilakukan sebagai pembanding (modifikasi Ito et al. 2003).
Pengukuran Kadar Gula Pereduksi
7 dan 0.056% mg/L dan dicari nilai gula pereduksi dicari dengan metode DNS. Hasil yang didapatkan diplotkan dalam grafik secara linier. Sebanyak 1 mL sampel dimasukkan ke dalam tabung reaksi dan ditambah 3 mL pereaksi DNS, dipanaskan dalam air mendidih selama 5 menit, kemudian didinginkan sampai suhu kamar dan sampel diukur pada panjang gelombang 550 nm (Miller 1959).
Pengukuran Kadar Etanol
Pengukuran kadar etanol sampel amobil dan tanpa amobil dilakukan menggunakan GC (Gas Chromatography) Pye Unicam PU4500. Kolom yang digunakan adalah kolom OV-17. Gas pembawa adalah nitrogen. Laju alir 20-50 ml/menit dengan detektor FID (Flame Ionization Detector). Penentuan dilakukan dengan membandingkan waktu retensi sampel dengan waktu retensi standar etanol. Standar etanol yang diinjeksikan dengan konsentrasi 1% (v/v).
Kadar etanol = luas area sampel / luas area standar x konsentrasi standard
3
HASIL DAN PEMBAHASAN
Pertumbuhan Phanerochaete chrysosporium dan Trametes versicolor
Jamur pelapuk putih seperti P. chrysosporium dan T. versicolor adalah jamur yang dapat mendegradasi lignin (Akhtar et al. 1996; Hossain dan Ananthraman 2006; Irawati et al. 2009).. Lignin adalah bagian dari lignoselulosa yang berikatan cukup kuat dengan polisakarida. Pada proses konversi lignoselulosa menjadi etanol, bagian yang terpenting adalah polisakarida. Selulosa tidak dapat dikonversi menjadi etanol karena berasosiasi dengan lignin (Ingram dan Doram 1995). Oleh sebab itu, lignin ini harus dihilangkan. Pengamatan ini bertujuan untuk membandingkan pertumbuhan P. chrysosporium dan T. versicolor pada suhu ruang (28ºC). Pada Gambar 1, diperlihatkan kultur fungi yang tumbuh baik pada media PDA dengan suhu ruang (28ºC). Kedua jamur ini dipilih karena keduanya adalah jamur pelapuk putih yang memiliki enzim ligninase cukup lengkap (Hossain dan Ananthraman 2006). Pengamatan pertumbuhan pada suhu ruang ini dilakukan karena uji kualitatif degradasi lignin pada lindi hitam dan deliginifikasi kayu sengon dilakukan juga pada suhu ruang.
8
Pada Gambar 1, keduanya memiliki hifa berwarna putih mirip dengan kapas. Bentuk morfologi jamur ini sesuai dengan penelitian Guererro (2011) yang menunjukan bahwa jamur T. versicolor berhifa putih dan berbentuk seperti kapas. Pengamatan jamur P. chrysosporium juga seperti penelitian Fraser (2005) dan
A)
umur 1 hari
B)
umur 1 hari
umur 2 hari umur 2 hari
umur 5 hari umur 5 hari
umur 16 hari umur 16 hari
9 Nakasone (1990) yang memiliki hifa berwarna putih. Pada awalnya P. chrysosporium terlihat lebih cepat pertumbuhannya dilihat pada umur 5 hari, dengan ditunjukkan hifa yang sudah menyebar dan menutupi cawan Petri. Namun, pada hari keenam belas, T. versicolor terlihat lebih adaptif pada suhu ruang, ditunjukkan dengan tebalnya hifa dibanding dengan P. chrysosporium. Dengan dilihatnya perbandingan kedua pertumbuhan jamur pelapuk putih ini, dapat dijadikan pilihan untuk delignifikasi pada suhu ruang. Penelitian ini juga sesuai dengan penelitan Fadillah (2008), bahwa P. chrysosporium memiliki suhu optimum pertumbuhan 40ºC.
Degradasi Lignin pada Lindi Hitam oleh Trametes versicolor dan Phanerochaete chrysosporium
Pada tahapan ini, dibandingkan hasil degradasi lignin oleh kedua jamur pelapuk putih pada lindi hitam. Media yang digunakan dalam uji ini, berisi PDA yang ditambahkan lindi hitam. Lindi hitam berasal dari proses kraft yaitu proses pemasakan material berlignoselulosa dengan bahan kimia NaOH, dan Na2S 40%.
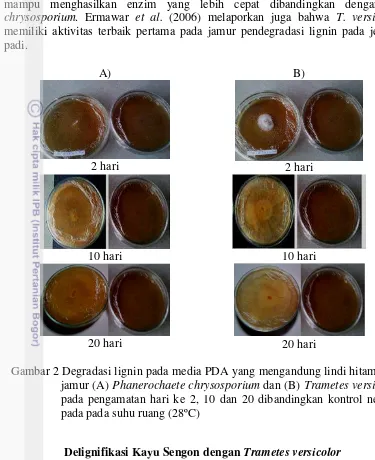
Proses ini dapat melarutkan lignin, sehingga lignin dapat terisolasi (Fengel dan Wegener 1995). Media PDA yang ditambahkan lindi hitam mengandung lignin yang berwarna coklat gelap, sehingga perlakuan ini dapat dipakai sebagai pendahuluan uji kualitatif jamur pendegradasi lignin. Gambar 2 menunjukkan perbandingan kecepatan degradasi lignin antara P. chrysosporium dan T. versicolor.
Degradasi lignin terjadi diperlihatkan dengan adanya perubahan warna coklat menjadi coklat keputihan (Gambar 2). Warna putih ini dipengaruhi oleh hifa putih kedua jamur tersebut yang menutupi media PDA yang mengandung lindi hitam, namun warna yang lebih terang mengindikasikan terjadinya kemampuan degradasi lignin sampai hari kedua puluh. Berdasarkan pengamatan pada Gambar 2, cawan Petri yang ditumbuhkan T. versicolor mengalami perubahan warna lebih terang dibandingkan P. chrysosporium. Warna antara keduanya memperlihatkan perbedaaan yang tidak cukup signifikan. Namun, dengan adanya perbedaan perubahan warna ini mendasari digunakannya isolat T. versicolor untuk mendelignifikasi kayu sengon.
Pada penelitian ini telah diperlihatkan bahwa kedua jamur dapat mendegradasi lignin dengan ditunjukkan perubahan warna pada Gambar 2. Kedua jamur ini memiliki kemampuan mendegradasi lignin karena memiliki enzim lakase dan perokidase yang terdiri atas lignin peroksidase dan manganese peroksidase (Howard et al. 2003). Pada awalnya media PDA ini berwarna coklat gelap karena adanya lignin, namun setelah ditumbuhkan jamur pelapuk putih, warnanya menjadi coklat keputihan. Hal ini dikarenakan terjadi degradasi lignin. Penelitian ini diperlukan sebagai uji pendahuluan sebelum delignifikasi kayu sengon selama 20 hari dalam suhu ruang dengan menggunakan jamur tersebut. Dengan adanya pemilihan jamur yang mendegradasi lignin lebih cepat dalam suhu ruang selama 20 hari, diharapkan dapat mendegradasi lignin lebih banyak.
10
dengan penelitian Anita et al. (2011) yang menunjukkan bahwa T. versicolor mampu menghasilkan enzim yang lebih cepat dibandingkan dengan P. chrysosporium. Ermawar et al. (2006) melaporkan juga bahwa T. versicolor memiliki aktivitas terbaik pertama pada jamur pendegradasi lignin pada jerami padi.
A)
2 hari
B)
2 hari
10 hari 10 hari
20 hari 20 hari
Gambar 2 Degradasi lignin pada media PDA yang mengandung lindi hitam oleh jamur (A) Phanerochaete chrysosporium dan (B) Trametes versicolor pada pengamatan hari ke 2, 10 dan 20 dibandingkan kontrol negatif pada pada suhu ruang (28ºC)
Delignifikasi Kayu Sengon dengan Trametes versicolor
Lignoselulosa adalah salah satu komponen organik yang berada di alam yang terdiri atas tiga tipe polimer seperti lignin, hemiselulosa dan selulosa. Komponen tersebut dapat digunakan sebagai sumber bahan baku produk seperti gula dari proses fermentasi, dan bahan bakar seperti etanol. Lignoselulosa dapat diperoleh dari bahan kayu, jerami, rumput-rumputan, limbah pertanian atau hutan dan bahan berserat lainnya. Kadar komponen lignoselulosa tergantung pada jenis bahannya. Salah satu contohnya adalah kadar selulosa kayu sekitar 45%, kadar hemiselulosa 25-30% (Perez et al. 2002), dan kadar lignin sekitar 20-40% tergantung jenis kayunya (Maryana 2006).
11 Beberapa mikroorganisme yang dapat mendegradasi lignin adalah Omphalina sp, Pleurotus ostreatus (Widyastuti et al. 2007), Lentinus squarrosulus, Psathyrella atroumbonata (Wuyep et al. 2003), P. chrysosporium (Irawati et al. 2009; Fadilah 2008), Lentinus edodes (Samsuri et al. 2007) dan Ceriporiopsis subfermispora (Lobos et al. 2001). Pada penelitian ini, jamur yang digunakan untuk proses delignifikasi adalah Trametes versicolor. Jamur ini cukup efektif dalam mendegradasi lignin (Akhtar et al. 1997).
Sengon yang memiliki kadar lignin yang tidak terlalu tinggi, dan sumber selulosa yang cukup tinggi, dapat menjadi sumber selulosa potensial untuk berbagai keperluan (Siagian 2003). Delignifikasi dilakukan pada kayu sengon segar yang berukuran 80 mesh (Gambar 3). Hal ini bertujuan agar T. versicolor lebih mudah tumbuh menyebar dalam sampel tersebut. Pemotongan dan penggilingan 80 mesh diharapkan akan meningkatkan daya serang enzim ligninase dari jamur tersebut. Foody et al. (1999) menyatakan bahwa perlakuan fisik seperti pemotongan dan penggilingan akan membantu untuk memperluas permukaan sehingga mudah didegradasi dalam pengurangan kadar lignin, sehingga pelakuan ini diperlukan untuk mengefektifkan proses delignifikasi.
Proses delignifikasi dilakukan selama 20 hari pada media yang sudah disterilisasi sebelumnya (Gambar 4). Sterilisasi bertujuan untuk menghilangkan mikroorganisme yang dapat mengganggu proses delignifikasi. Selain itu, proses sterilisasi dengan menggunakan suhu panas pada mesin autoklaf dapat menurunkan kadar lignin. Perlakuan panas ini dapat mempengaruhi ikatan lignin dan polisakarida (Foody et al. 1999). Sampel kayu sengon yang digunakan dalam proses delignifikasi telah direndam selama 24 jam dengan akuades dengan tujuan untuk membuat kelembaban pada sampel dan jamur T. versicolor dapat tumbuh dengan subur. T. versicolor tumbuh menyebar diatas kayu sengon (Gambar 4).
Gambar 3 Kayu sengon berukuran 80 mesh
12
Inkubasi selama 20 hari (Gambar 4) diharapkan akan mengurangi kadar lignin karena pada tahapan sebelumnya lignin pada lindi hitam sudah didegradasi oleh Trametes versicolor. Isolat T. versicolor sebelum digunakan dalam proses delignifikasi ditumbuhkan dalam media PDB yang mengandung sedikit glukosa. Penambahan glukosa ini bertujuan untuk mengoptimalkan pertumbuhan, dan menyediakan sumber karbon bagi T. versicolor untuk pertumbuhannya. Penelitian Fadilah et al. 2009 menunjukkan penambahan sedikit glukosa pada sampel untuk memacu pertumbuhan sel dan dapat membantu penurunan lignin karena dipakai untuk sumber energi dalam sintesis enzim ligninase. Selain itu, jamur tersebut ditumbuhkan dalam PDB dalam waktu tujuh hari agar pada saat dikulturkan dalam sampel, jamur tersebut sudah optimal (Morris et al. 1996).
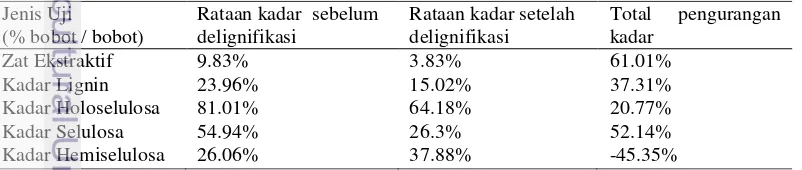
Kandungan kimia kayu sengon telah diteliti pada saat sebelum dan sesudah delignifikasi (Tabel 1). Hal ini bertujuan membandingkan pengaruh delignifikasi Trametes versicolor terhadap kandungan kimia kayu sengon. Dari tabel tersebut, terjadi pengurangan kadar zat ekstraktif, kadar lignin, kadar selulosa, dan kadar holoselulosa sedangkan kadar hemiselulosa mengalami peningkatan.
Kadar lignin dalam penelitian ini diukur dengan menggunakan metode Klason lignin. Prinsip metode ini adalah melarutkan polisakarida dengan menggunakan asam sulfat 72%, dan meninggalkan lignin sebagai sisa. Lignin yang dihitung harus benar-benar murni tanpa bahan lainnya untuk menghindari pengukuran menjadi bias. Oleh sebab itu, sebelum kadar lignin diuji, terlebih dahulu dilakukan bebas ekstraktif dengan etanol-benzena karena zat ekstraktif ini dapat berkondensasi dengan lignin sehingga mengganggu pembacaan (Fengel dan Wegener 1995).
Kadar zat yang terekstrak dengan dengan etanol-benzena setelah perlakuan delignifikasi mengalami penurunan sebesar 61.01% (Tabel 1). Perlakuan delignifikasi dapat menurunkan kadar ekstraktif. Menurut Daud (2010), kandungan zat ekstraktif dapat mengganggu proses hidrolisis selulosa menjadi gula sederhana, sehingga dengan adanya penurunan zat ekstraktif ini dapat membantu proses tersebut.
Kadar lignin dalam sampel kayu sengon setelah perlakuan delignifikasi terjadi penurunan sebesar 37.31% (Tabel 1). Lignin adalah polimer dengan struktur aromatik yang terbentuk dalam unit fenilpropan dan memiliki struktur kompleks dan heterogen sehingga sulit didegradasi (Perez et al. 2002). Namun, T. versicolor mampu menghidrolisis lignin dengan cara mengeluarkan enzim ligninase (Hossain dan Ananthraman 2006). Irawati et al. (2009) melakukan penelitian delignifikasi kayu sengon dengan P. chrysosporium selama 30 hari. Kadar lignin mengalami penurunan sebesar 2,51%-12.59%. Jika dibandingkan dengan penelitian tersebut, T. versicolor mampu mendegradasi lignin lebih besar dibandingkan dengan P. chrysosporium pada kayu sengon.
Tabel 1 Kandungan kimia kayu sengon Jenis Uji
Kadar Holoselulosa 81.01% 64.18% 20.77%
13
Beberapa penelitian tentang delignifikasi menggunakan proses biologis telah dilakukan. P. chrysosporium mendelignifikasi batang jagung sebesar 81.4% selama 30 hari dengan suhu 38ºC (Fadillah 2008). P. ostreatus dan T. versicolor dapat mendelignifikasi bambu betung dengan penurunan lignin berturut turut 12.20% dan 12.06% selama 30 hari (Fatriasari et al. 2009). Trametes sp. menurunkan kadar lignin sebesar 18.7% (15 jam) pada Paraserianthes sp. (Widjadja dan Andriyani 2002).
Holoselulosa adalah salah satu penyusun pada dinding sel tanaman yang terdiri atas hemiselulosa dan selulosa. Selulosa merupakan komponen utama
dalam penyusun dinding sel tanaman yang berikatan β-1,4 glukosida dalam rantai lurus (Lynd et al. 2002; Daniel 2003). Kadar holoselulosa dan selulosa setelah perlakuan delignifikasi mengalami penurunan secara berturut 20.77% dan 52.14%. Penurunan ini terjadi karena T. versicolor ini termasuk jamur non selektif dan mampu mendegradasi seluruh komponen lignoselulosa (Akhtar et al. 1997).
Kadar selulosa ini turun sejalan dengan turunnya kadar lignin. Hal ini terjadi karena T. versicolor merombak lignin dan menggunakan selulosa sebagai sumber karbonnya. Namun, jika dibandingkan P. ostreatus, T. versicolor menunjukkan kinerja yang lebih baik dalam pendegradasian lignin dibandingkan pendegradasi terhadap polisakarida (hemiselulosa dan selulosa) (Fatriasari et al. 2009). Penelitian ini juga sejalan dengan penelitian Irawati et al. (2009), setelah perlakuan delignifikasi pada kayu sengon selama 30 hari dengan P. chrysosporium, kadar selulosa sengon mengalami penurunan sebesar 21,06-42,41%. Dengan perbandingan penelitian ini dan penelitian Irawati et al. (2009), pengurangan kadar selulosa pada kayu sengon ini termasuk cukup besar, sehingga harus dijadikan pertimbangan dalam pemilihan jamur pelapuk putih untuk delignifikasi karena selulosa akan dipakai untuk keperluan tahapan selanjutnya.
Kadar hemiselulosa setelah perlakuan mengalami peningkatan sebesar 45.53%. Peningkatan kadar hemiselulosa ini diduga karena berkurangnya kadar selulosa dalam kayu, sehingga rasio hemiselulosa berbanding selulosa dalam holoselulosa menjadi meningkat. Perbandingan ini berdasarkan perhitungan konsentrasi hemiselulosa dari pengurangan holoselulosa dengan alfa-selulosa. Prinsip dari metode yang digunakan dalam penelitian ini adalah holoselulosa bebas lignin diberi perlakuan sodium hidroksida dan asam asetat. Residu dinyatakan sebagai alfa selulosa dan fraksi terlarut dinyatakan sebagai kadar hemiselulosa. Semakin banyak selulosa yang hilang, maka hemiselulosa yang dibaca akan semakin besar. Penelitian ini juga sebanding dengan hasil penelitian Camarero et al. (2001) yang mengatakan bahwa perlakuan menggunakan enzim peroksidase yang menyerang karbohidrat pada holoselulosa jerami gandum dapat meningkatkan nilai rendemen polisakarida dan penelitian Irawati et al. (2009), kadar hemiselulosa kayu sengon naik 205.3%-370.3% setelah didelignifikasi oleh P. chrysosporium.
14
lainnya. Dengan adanya teknik ini diharapkan proses delignifikasi dengan cara biologis dapat menjadi alternatif pilihan bagi industri dan lainnya karena murah, mudah, dan ramah lingkungan.
Produksi Bioetanol
Bahan baku yang digunakan untuk produksi etanol dapat berasal dari tiga kelompok yaitu gula, pati dan selulosa. Lignoselulosa adalah substrat yang cukup banyak tersedia di alam namun belum banyak dimanfaatkan sebagai sumber produksi etanol. Hal ini disebabkan karena lignoselulosa memiliki struktur yang cukup kompleks sehingga harus melalui beberapa tahapan, seperti delignifikasi, sakarifikasi dan fermentasi. Delignifikasi dengan tujuan untuk dapat melepas hemiselulosa dan selulosa dari ikatan kompleks lignin. Sakarifikasi bertujuan untuk menghidrolisis selulosa menjadi gula sederhana dan fermentasi merubah gula sederhana menjadi etanol (Anindyawati et al. 2009).
Pada proses sakarifikasi dan fermentasi simultan (SFS), hidrolisis dan fermentasi tidak dilakukan terpisah atau bertahap, namun secara simultan. Mikroba yang digunakan pada proses SFS dalam penelitian ini adalah kapang penghasil enzim selulase, seperti Trichoderma viride dan dikonversi langsung menjadi etanol oleh Zymomonas mobilis. Proses ini menggabungkan kedua mikroba tersebut dalam satu reaktor. Proses ini memiliki keuntungan yaitu polisakarida yang terkonversi menjadi monosakarida langsung difermentasi menjadi etanol (Samsuri et al. 2007).
Produksi etanol dengan menggunakan teknik SFS menghasilkan kadar etanol yang lebih tinggi dibandingkan dengan teknik sakarifikasi fermentasi terpisah (Loebis 2008). Penelitian Loebis ini membandingkan fermentasi SFS dan sakarifikasi fermentasi terpisah menggunakan Trichoderma sp dan Saccharomyces cerevisiae. Suhu yang digunakan dalam proses SFS ini merupakan kombinasi antara suhu optimum penghasil selulase yaitu Trichoderma viride dan suhu optimum Zymomonas mobilis yang dapat mengkonversi gula hasil hidrolisis menjadi etanol yaitu 300C.
Trichoderma viride adalah kapang yang dapat menghasilkan enzim selulase (Winarno 2010) yang cukup lengkap meliputi eksoselulase dan endoselulase. Inkubasi T. viride dilakukan selama 7 hari, karena kapang tersebut telah menghasilkan enzim selulase (Arnata 2009). Proses hidrolisis selulosa menggunakan enzim selulase memiliki efektifitas dan efesiensi dibandingkan dengan proses hidrolisis dengan asam karena tanpa proses netralisasi. Selulase dari T. viride memiliki aktivitas enzim selulase yang cukup tinggi dan dapat menghasilkan rendemen gula yang cukup baik (Kamara 2006) yang akan dipakai untuk fermentasi etanol. Beberapa mikroba lain yang dapat menghasilkan enzim selulase adalah Trichoderma reesei (Sim dan Oh 1993), Scopulariopsis brevicaulis TOF 1212 (Nakatani et al. 1998) , Ruminococcus albus (Ohara et al. 1998), Clostridium, Cellulomonas, Trichoderma, Penicillium, Neurospora, Fusarium, Aspergillus, dan lain-lain (Chandel et al. 2007).
15 dengan khamir (Ismail et al. 2009). Hemiselulosa yang telah terhidrolisis menjadi xilosa dapat difermentasikan menjadi etanol. Namun, bakteri Zymomonas mobilis tidak dapat memfermentasi xilosa atau xilitol. Mikroba yang dapat memfermentasikan xilosa adalah Pachysolen tannophilus, Candida shehatae (Sanchez et al. 1999) dan Saccharomyces cerevisiae (Samsuri 2007). Zymomonas mobilis memfermentasikan glukosa melalui jalur Entner Doudoroff. Bakteri ini menghasilkan enzim piruvat dekarboksilase yang merubah piruvat menjadi asetaldehida dan diubah menjadi etanol oleh enzim alkohol dehidrogenase. Beberapa mikroorganisme lain yang dapat memproduksi etanol adalah Saccharomyces cerevisiae, Kluyveromyces dan Candida (Lin dan Tanaka 2006).
Penelitian ini menggunakan Z. mobilis yang diamobilisasi dengan menggunakan Ca-alginat. Ca-alginat ini adalah bentuk produk setelah reaksi Na-alginat dan CaCl2. Alginat adalah heteropolisakarida linear dari asam
D-manuronat dan asam L-guluronat. Natrium alginat diperoleh dari isolasi galur alga seperti ganggang coklat Sargassum dan Turbinaria (Surini et al. 2003). Campuran sel dan natrium alginat (Na-alginat) yang diteteskan ke dalam larutan yang mengandung kation multivalen, misalnya kalsium klorida (CaCl2), akan
membentuk reaksi antara alginat dan kation multivalen (Ca-alginat). Matriks ini biasa digunakan pada amobilisasi sel (Najafpour et al. 2004).
Penggunaan amobilisasi sel memiliki banyak keuntungan dibandingkan sel bebas, diantaranya pemisahan produk mudah dilakukan, penggunaan kembali biokatalis, produktivitas volumetrik tinggi, meningkatkan kendali proses, dan mengurangi kontaminasi (Guksungur dan Zorlu 2001; Ahmed 2006; Carvalho et al. 2002). Menurut Carvalho et al. (2002), metode penjebakan sel adalah metode yang paling efektif dalam proses fermentasi. Alginat adalah matriks yang umum dipakai dalam amobilisasi sel karena murah, mudah digunakan, dan tidak beracun dan telah digunakan pada amobilisasi sejumlah sel seperti khamir, bakteri, sianobakteri, alga, fungi, protoplast tumbuhan, sel hewan, dan sel tumbuhan (Guksungur dan Zorlu 2001).
Pada proses sakarifikasi dan fermentasi simultan dalam penelitian ini dibandingkan hasil produksi etanol antara Zymomonas mobilis yang teramobil menggunakan Ca-Alginat dan fermentasi tanpa amobil. Menurut Muryanto (2012) produksi etanol dengan amobilisasi dengan menggunakan Ca-Alginat menghasilkan data produksi etanol lebih tinggi dibandingkan tanpa amobil. Selain itu, menurut Darmawan et al. (2010) produksi etanol dari Z. mobilis termutasi yang diamobil dengan matriks Ca-alginat menghasilkan produksi konsentrasi, yield, dan produktivitas etanol lebih besar dibandingkan dengan matriks K-karaginan. Dari beberapa penelitian tersebut, didasari penggunaan Ca-alginat dalam penelitian ini.
16
jam yaitu 10.06 g/L. Penelitian ini sesuai dengan penelitian Muryanto (2012) yaitu produksi etanol dari tandan kosong kelapa sawit dengan Rhizophus oryzae yang diamobilisasi Ca-Alginat lebih tinggi dibandingkan tanpa amobil.
Etanol telah diproduksi dari beberapa jenis lignoselulosa seperti kayu sengon, gmelina, kelapa sawit, dan pinus dengan berturut-turut 4.7, 4.2, 4.1, dan 3.9 g/L dengan menggunakan proses SFS dari enzim selulase 4% Aspergilus niger dan Saccharomyces cerevisiae dan inkubasi selama 96 jam (Daud 2010). Penelitian Samsuri et al. (2007) etanol diproduksi dari bagas yang telah didelignifikasi 4 minggu menggunakan Lentinus edodes dan menggunakan teknik SFS selama 96 jam dengan enzim xylanase dan Saccharomyces cereviseae menghasilkan kadar etanol 3,179 g/L dan dibandingkan tanpa perlakuan biodelignifikasi yaitu 2,639 g/L. Produksi etanol juga diteliti Irawati et al. (2009) dari serbuk kayu sengon, meranti dan jati hasil delignifikasi P. chrysosporium yang diinkubasi selama 30 hari secara berturut-turut 0.448, 0.016 dan 0.163 g/L dengan proses SFS dengan menggunakan enzim selulase dari T. viride dan Saccharomyces cerevisiae dengan waktu inkubasi 30 hari.
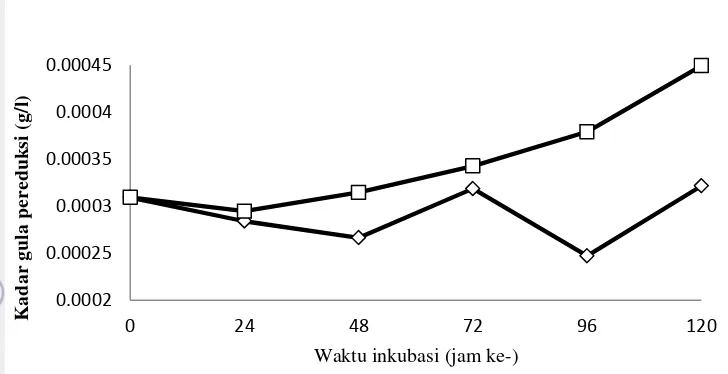
Etanol dapat diproduksi dari fermentasi gula sederhana dari hasil hidrolisis selulosa. Gula sederhana ini dapat diukur kadarnya dengan metode DNS gula pereduksi (Miller 1959) dan disajikan pada Gambar 6. Kadar gula pereduksi sisa pada media SFS dengan Z. mobilis tanpa amobil secara berturut pada jam ke-0, 24, 48, 72, 96 dan 120 adalah 0.00031 g/L, 0.00028 g/L, 0.00027 g/L, 0.00032 g/L, 0.00025 g/L dan 0.00032 g/L. Pada jam ke-0 sampai 48 terjadi penurunan kadar gula produksi disebabkan Z. mobilis telah memakai kadar gula untuk produksi etanol. Pada jam ke-72 terjadi kenaikan kadar gula pereduksi karena T. viride memproduksi gula pereduksi yang lebih besar dan tidak banyak digunakan oleh Z. mobilis. Pada jam ke-96 terjadi penurunan, dan pada jam ke-120 terjadi kenaikan. Kadar gula pereduksi yang mengalami kenaikan dan penurunan ini disebabkan oleh perbandingan kecepatan kedua mikroba tersebut dalam memetabolisme sumber zat karbonnya.
17
Gambar 6 Kadar gula pereduksi dari fermentasi Z. mobilis dengan amobilisasi
sel (□) dan tanpa amobilisasi sel (◊)
Kadar gula pereduksi pada media SFS dengan Z. mobilis yang diamobil secara berturut pada jam ke-0, 24, 48, 72, 96 dan 120 adalah 0.00031 g/L, 0.00029 g/L, 0.00031 g/L, 0.00034 g/L, 0.00038 g/L, dan 0.00045 g/L. Pada jam ke-24 terjadi penurunan kadar gula pereduksi disebabkan oleh digunakannya sumber gula untuk produksi etanol. Pada jam ke-48 sampai 120 terjadi kenaikan kadar gula pereduksi disebabkan oleh T. viride mampu menghidrolisis selulosa menjadi glukosa lebih banyak. Hal ini disebabkan karena T. viride lebih mendominasi pertumbuhannya dibandingkan dengan Z. mobilis yang diamobilisasi sehingga lebih banyak selulase dan memproduksi glukosa.
Perlakuan SFS dengan teknik amobilisasi sel Z. mobilis mampu menghasilkan kadar gula pereduksi dan kadar etanol lebih tinggi dibandingkan dengan perlakuan SFS tanpa amobilisasi sel. Dengan diamobilisasinya Z. mobilis memiliki keuntungan karena T.viride dapat lebih mendominasi pertumbuhannya dan menghasilkan gula pereduksi yang lebih banyak. Dengan adanya kadar gula pereduksi yang lebih besar, kadar etanol yang difermentasi oleh Z. mobilis dari gula tersebut lebih besar. Proses amobilisasi ini juga dapat menstabilkan kultur Z. mobilis dari perubahan lingkungan akibat fermentasi tersebut.
18
4
SIMPULAN DAN SARAN
Simpulan
Kayu sengon dapat didelignifikasi dengan menggunakan Trametes versicolor. Etanol dapat diproduksi dari sampel kayu sengon hasil delignifikasi dengan teknik sakarifikasi dan fermentasi simultan menggunakan Trichoderma viride dan Zymomonas mobilis. Produksi etanol dengan Zymomonas mobilis teramobil lebih tinggi dibandingkan tanpa amobil dalam sakarifikasi dan fermentasi simultan.
Saran
Optimasi pada perlakuan delignifikasi perlu dilakukan karena terjadi penurunan kadar selulosa yang cukup tinggi dari delignifikasi kayu sengon. Pemilihan penggunaan jamur pelapuk putih (white-rot fungi) untuk delignifikasi sengon harus dipertimbangkan, karena penggunaan jamur pelapuk putih yang berbeda akan menghasilkan penurunan kadar lignin dan selulosa yang berbeda pula. Dengan optimalnya proses delignifikasi, maka jumlah produksi bioetanol yang dihasilkan dari proses sakarifikasi dan fermentasi simultan akan lebih optimal.
DAFTAR PUSTAKA
Ahmed SA. 2006. Invertase production by Bacillus macerans immobilized on calcium alginate beads. J App Sci Res 4:1777-1781
Akhtar M, Blanchette RA, Kirk TK. 1997. Fungal delignification and biomechanical pulping of wood. Advance in Biochem Engineering/Biotech. 57:159-195.
Anindyawati T. 2009. Prospek enzim dan limbah lignoselulosa untuk produksi etanol. BS 44(1):49-56
Anita SH, Yanto DHY, Fatriasasi W. 2011. Lignin use of isolation from black liquor on the biopulping of Betung bamboo (Dendrocalamus asper) as selective media for white-rot-fungi. Penelitian Hasil Hutan 29:312-321.
Arnata IW. 2009. Pengembangan alternatif teknologi bioproses pembuatan bioetanol dari ubi kayu mengggunakan Trichoderma viride, Aspergilus niger, Saccaromyces cereviceae [tesis]. Bogor (ID): Institut Pertanian Bogor
Beccerra M, Baroli B, Fadda AM, Mendez JB, Siso MIG. 2001. Lactose bioconversion by calcium-alginat immobilization of Kluyveromycetes lactis cell. Enzyme Microb Technol 29:506-512
Browning BL. 1967. Methods of Wood Chemistry. Volume ke-2. New York (US): Interscience Publ
19 [BSN] Badan Standardisasi Nasional. 2008. Standar Nasional Indonesia Nomor 0492 tentang Pulp dan Kayu, Cara Uji Kadar Lignin Metode Klason. Jakarta (ID): Indonesia
[BSN] Badan Standardisasi Nasional. 2009. Standar Nasional Indonesia Nomor 0444 tentang Pulp, Cara Uji Kadar Selulosa Alfa, Beta dan Gamma. Jakarta (ID): Indonesia
Camarero S, Bochini P, Galletti GC, Martinez MJ dan Martinez AT. 2001. Compositional changes of wheat lignin by a fungal peroxidase analyzed by Pyrolysis-GC-MS. Anal and App Pyrolisis 58:413-423
Carvalho W, Silva SS, Converti A, Vitolo M, Felipe MG, Roberto IC, Silva MB, Mancilha IM. 2002. Use of immobilized Candida yeast cells for xylitol production from sugarcane bagasse hydrolysate. App Biochem and Biotechnol 98:489-496.
Chandel AK, Chan ES, Rudravaram R, Narasu ML, Rao LV, Ravindra P. 2007. Economics and environmental impact of bioethanol production technologies : an appraisal. Biotech and Mol Biology Review 2(1):14-32.
Cross CF, Bevan EJ. 1912. Researches on Cellulose III. London (GB): Longmans Green
Daniel G. 2003. Microview of wood under degradation by bacteria and fungi. Wood deterioration and preservation. Washington DC (US):ACS Symposium series
Darmawan R, Widjaja T, Mulyanto, Ardiyansyah ET. 2010. Studi perbandingan produksi etanol secara kontinyu menggunakan Z. mobilis termutasi teknik immobilisasi sel: Ca-alginat dan K-karaginan. Seminar Rekayasa Kimia dan Proses. [Waktu dan tempat pertemuan tidak diketahui]. Semarang (ID): Universitas Diponegoro
Daud M. 2010. Produksi bioetanol dari beberapa jenis kayu tropis melalui proses sakarifikasi dan fermentasi secara simultan [tesis]. Bogor (ID): Institut Pertanian Bogor
Ermawar RA, Yanto DHY, Fitria, Hermiati E. 2006. Biodegradation of lignin in rice straw pretreated by white-rot fungi. J Widya Riset 9(3):197-202
Fadilah, Distantina S, Artati EK, Jumari E. 2008. Biodelignifikasi batang jagung dengan jamur pelapuk putih Phanerochaete chrysosporium. Ekuilibrium 7(1):7-11
Fadilah, Distantina S, Dwiningsih SR, Marifah DS. 2009. Pengaruh penambahan glukosa dan ekstrak yeast terhadap biodelignifikasi ampas batang aren. Ekulibrium 8(1):29-33
Fatriasari W, Ermawar RA, Falah F, Yanto DHY, Hermiati E.2009. Pulping soda panas terbuka bambu Betung dengan praperlakuan fungi pelapuk putih (Pleurotus ostreatus dan Trametes versicolor). J Ilmu dan Teknologi Hasil Hutan 2(2):45-50
Fengel D. Wegener G. 1995. Kayu: Kimia, Ultrastruktur, Reaksi-Reaksi. Yogyakarta (ID): Gadjah Mada Universty Pr
Fitria. 2008. Pengolahan biomassa berlignoselulosa secara enzimatis dalam pembuatan pulp: studi kepustakaan. J Teknologi Pertanian 9(2):69-74.
20
Foody B, Tolan JS, Bernstein JD. 1999. Pretreatment process for conversion of cellulose to fuel ethanol. United States Patent US No. 6.090.595.
Fraser RJ. 2005. Intraspesific comparison of Phanerochaete chrysosporium strains: peroxidase production, pollutant degradation and mycelial differentiation [tesis]. Grahamstown (tZA): Rhodes Univ.
Goksungur Y, Zorlu N. 2001. Production of ethanol from beet molasses by Ca-alginate immobilized yeast cells in a packed-bed bioreactor. Tubitak:265-275. Guerrero DG, Martinez VE, and Almaraz RDLTA. 2011. Cultivation of Trametes
versicolor in Mexico. Micologia Aplicada International 23(2):55-58
Hermiati E, Djumali M, Sunarti TC, Suparno O dan Prasetya B. 2010. Pemanfaatan biomassa lignoselulosa ampas tebu untuk produksi bioetanol. J Litbang Pertanian 29(4):121-130
Hossain SM, Anantharaman N. 2006. Activity enhancement of ligninolyitic enzymes of Trametes versicolor with bagasse powder. Afri J Biotechnol. 5(1):189-194
Howard RT, Abotsi E, Jansen VREL, Howard S, 2003. Lignosellulose biotechnology: issue of bioconversion and enzyme production. Afri J Biotech 2:602-619.
Ingram LO & Doran JB. 1995. Convertion of cellulostic material to ethanol. FEMS Microbiology Reviews 16:235-241.
Irawati D, Azwar NR, Syafii W, Artika IM. 2009. Pemanfaan serbuk kayu untuk produksi etanol dengan perlakuan pendahuluan delignifikasi menggunakan jamur Phanerochaete chrysosporium. J Ilmu Kehutanan 3(1):13-22
Ismail T, Iksanti L, Jayanti ND. 2009. Etanol dari molases menggunakaan Zymomonas mobilis yang diamobilisasi dengan karaginan pada reaktor kontinyu. Seminar Nasional Teknik Kimia Indonesia. 2009 Okt 19-20; Bandung, Indonesia. Bandung (ID): STNKL
Ito H, Wada M, Honda Y, Kuwahara M, Watanabe T. 2003. Bioorganosolve Pretreatments for simultaneous saccarification and fermentation of Buch wood by ethanolysis and white-rot fungi. J Biotechnol 103:273-280
Kamara DS, Saada DR, Shabarni G. 2006. Degradasi enzimatik selulosa dari batang pohon pisang untuk produksi glukosa Dengan bantuan aktifitas selulotik Trichoderma viride. [Laporan Penelitian]. Penelitian Dasar (LITSAR) Bandung (ID): Universitas Padjajaran.
Kementrian Energi dan Sumber Daya Mineral. 2008. Ringkasan Eksekutif Kajian Pengembangan Kilang Indonesia ke Depan. [Internet]. [diunduh 2014 Jan 15]. Tersedia pada: http://www.esdm.go.id/batubara/doc_download/992-ringkasan-eksekutif-kajian-pengembangan-kilang-indonesia-kedepan.html
Krisnawati H, Varis E, Kallio M, Kanninen M. 2011. Paraserianthes falcataria (L.) Nielsen: Ecology, Silviculture and Productivity. Bogor (ID): CIFOR Lin, Yan, and S. Tanaka. 2006. Ethanol fermentation from biomass resources :
current state and prospects. App Microbiol Biotechnol 69:627-642.
Lobos S, Tello M, Polanco R, Larrondo LF, Manubens A, Salas L, Vicuna R.. 2001. Enzymology and molecular genetics of the lignolytic system of the basidiomycete Ceriporiopsis subvermispora. Current Science 81(8):992-997. Loebis EH. 2008. Optimasi proses hidrolisis kimiawi dan enzimatis tandan
21 Lynd LR, Weimer PJ, van Zyl WH, Pretorius IS. 2002. Microbial cellulose utilization: fundamentals and biotechnology. Microbiol Mol Biol Rev. 66(3):506-577.
Martina A, Yuli N, Sutisna M. 2002. Optimasi beberapa faktor fisik terhadap laju degradasi selulosa kayu albasia Paraserianthes falcataria (L) Nielsen dan karboksimetilselulosa (CMC) serta enzimatik oleh jamur. J Nat Ind 4:156-163. Maryana R. 2006. Pengembangan bioetanol dari starchy materials dan
lignoselulosa sebagai salah satu energi alternatif. Seminar Nasional Kimia dan Pendidikan. [Waktu dan tempat tidak diketahui]. Semarang (ID): penerbit tidak diketahui
Miller GC. 1959. Use of dinitrosalicylic acid reagent for the determination of reducing sugar. Anal Chem 31:420-428
Morris AJ, Byrne TC, Madden JF, Reller AB. 1996. Duration of incubation of fungal cultures. J clinical microbiology 34(6):1583-1585
Muryanto. 2012. Enkapsulasi Rhizopus oryzae dalam kalsium-alginat untuk produksi bioetanol dari tandan kosong kelapa sawit dengan sakarifikasi dan fermentasi serentak [tesis]. Depok (ID): Universitas Indonesia
Najafpour G, Younesi H, Ismail KSK. 2004. Ethanol fermentation in an immobilized cell reactor using Saccharomyces cerevisiae. Bioresource Tech 92:251-260.
Nakasone K. 1990. Mycologia Memoir 15. Michigan (US): Hafner Pr. p 224-225 Nakatani F, Minami K, Moriyama Y, Mitsuiki S, Kawaguchi T, Sumitani J,
Murao S, Arai M. 1998. Neutral cellulase from a Fungus Scopulariopsis brevicaulis TOF-1212. Proceeding of Mie Bioforum. [waktu dan tempat tidak diketahui]. Tsu (JP): Uni Publishers
Ohara O, Karita S, Kimura T, Sakka K, Ohmiya K. 1998. Cellulase complex from Ruminococcus albus. Annual Report of International Center for Biotechnology 21:358-369.
Perez J, Munoz D, Rubia TDL, Martinez T. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview. Int Microbiol. 5:53-63.
Risdianto H, Setiadi T, Suhardi SH, Nipoperbowo W. 2007. Pemilihan spesies jamur dan media amobilisasi untuk produksi enzim lignolitik. Seminar nasional rekayasa kimia dan proses. Semarang (ID): penerbit tidak diketahui Samsuri M, Gozan M, Mardias R, Baiquni M, Hermansyah H, Wijanarko A,
Prasetya B, Nasikin M. 2007. Pemanfaatan sellulosa bagas untuk produksi etanol melalui sakarifikasi dan fermentasi serentak dengan enzim xylanase. Makara Teknologi 11(1):17-24.
Sanchez S, Bravo V, Castro E, Moya AJ, Camacho F. 1999. Comparative study of the fermentation of d-glucose/d-xylose mixtures with Pachysolen tannophilus and Candida shehatae. J Bioprocess Eng 21:525-532.
Siagian RM, Suprapti S, Komarayati S. 2003. Peranan fungi pelapuk putih dalam proses biodelignifikasi kayu sengon (Paraserianthes falcataria (L) Nielsen). J Ilmu dan Teknologi Kayu Tropis 1(1):47-56
22
Surini S, Akiyama H, Morishita M, Takayama K, Nagai T. 2003. Poyion complex of chitosan and sodium hyaluronate as an ilmplant device for insulin delivery. S.T.P. Pharmasciences 13(1):1-4
Tuomela M, Vikman M, Hatakka A, Itavaara M. 2000. Biodegradation of lignin in a compost environment: a review. Biores Tech 72:169–183.
Widjaja A, Andriyani S, Pratami AA. 2002. Study of biodelignification on sengon and pine using white rot-fungu Phanerochaetae chrysosporium for development for pulp and paper industries in Indonesia. Asian Pasific Congress on Chemical Engineering. Christ Church(NZ): penerbit tidak diketahui
Widyastuti H, Siswanto, Suharyanto. 2007. Optimasi pertumbuhan dan aktivitas enzim lignolitik Omphalina sp dan Pleurotus ostreatus pada fermentasi padat. Menara Perkebunan 75(2):93-105.
Winarno FG. 2010. Enzim Pangan. Bogor(ID): M-BRIO Press.
Wuyep PA, Khan AU, Nok AJ. 2003. Production and regulation of lignin degrading enzymes from Lentinus squarrosulus (mont.) Singer and Psathyrella atroumbonata Pegler. African J. Biotechnol. 2(11):444-447
23
24
Lampiran 1 Bagan Alir Penelitian
25 Lampiran 2 Kromatogram standar etanol
26
Lampiran 4 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel Zymomonas mobilis pada jam ke-48
27 Lampiran 6 Kromatogram kadar etanol kayu sengon tanpa amobilisasi sel
Zymomonas mobilis pada jam ke-96
28
Lampiran 8 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel Zymomonas mobilis pada jam ke-24
29 Lampiran 10 Kromatogram kadar etanol kayu sengon dengan amobilisasi sel Zymomonas mobilis pada jam ke-72
30
31
RIWAYAT HIDUP
Penulis dilahirkan di kota Cirebon pada tanggal 6 Maret 1990 dari ayah yang bernama Khudlori, dan ibu yang bernama Rodliyah Zaenuddin. Penulis merupakan anak pertama dari dua bersaudara. Penulis pernah mengalami pendidikan di Sekolah Menengah Pertama di SMPN 1 Kota Cirebon dan Sekolah Menengah Atas di MAN Darussalam Ciamis. Penulis menempuh pendidikan sarjana di departemen Biokimia, Institut Pertanian Bogor dan lulus tahun 2012.