PENGHAMBATAN PERTUMBUHAN
Pyricularia oryzae
OLEH
AKTINOMISET FILOSFER PADI PENGHASIL KITINASE
CHARISA GLESIANDRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Penghambatan Pertumbuhan Pyricularia oryzae oleh Aktinomiset Filosfer Padi Penghasil Kitinase adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Charisa Glesiandra
RINGKASAN
CHARISA GLESIANDRA. Penghambatan Pertumbuhan Pyricularia oryzae oleh Aktinomiset Filosfer Padi Penghasil Kitinase. Dibimbing oleh ARIS TRI WAHYUDI dan ANJA MERYANDINI.
Blas adalah penyakit padi yang disebabkan oleh cendawan Pyricularia oryzae. Penyakit ini dapat menyerang pada seluruh fase pertumbuhan tanaman padi dan mampu menurunkan produksi hingga 70%. Penanggulangan penyakit blas menggunakan senyawa kimia pestisida dapat berakibat buruk terhadap lingkungan dan manusia yang mengkonsumsinya serta dapat menimbulkan resistensi patogen terhadap senyawa kimia tersebut oleh karena itu penelitian mengenai mikrob filosfer padi khususnya aktinomiset penghasil kitinase sebagai agens biokontrol penyakit blas perlu untuk dilakukan. Penelitian ini bertujuan mengisolasi dan melakukan penapisan aktinomiset filosfer padi yang memiliki aktivitas antagonistik terhadap P. oryzae secara in vitro, menguji aktivitas enzim kitinase isolat aktinomiset terpilih secara kualitatif dan kuantitatif, dan melakukan analisis pada sekuen gen penyandinya.
Pengambilan sampel daun padi dari tanaman padi sehat dilakukan di tiga lahan persawahan padi yang terserang penyakit blas, yaitu lahan persawahan padi Situgede, Sukabumi dan Jasinga (Jawa Barat, Indonesia). Pengambilan sampel dilakukan pada tanaman padi yang berusia 30 hingga 60 hari setelah tanam. Bagian daun padi yang tidak terendam air kira-kira 10 cm dari permukaan air dipotong secara aseptik. Sampel kemudian dibawa ke Laboratorium Mikrobiologi Institut Pertanian Bogor untuk dilakukan proses isolasi aktinomiset filosfer padi dengan menggunakan teknik pencucian dan media Humid acid vitamin.
Sepuluh isolat aktinomiset potensial dipilih berdasarkan hasil penapisan antagonistik terhadap P. oryzae dan nilai indeks kitinolitik dari 57 isolat aktinomiset filosfer yang telah berhasil diisolasi dari lahan persawahan padi di Situgede, Sukabumi dan Jasinga. Pengujian kuantitatif kitinase dilakukan terhadap sepuluh isolat terpilih dan memberikan hasil yang beragam. Isolat STG 10, JSN 3.1 dan STG 24 memiliki aktivitas kitinase tertinggi, yaitu 14.898 ± 0.048 (U/mg), 13.117 ± 0.048 (U/mg) dan 12.534 ± 0.193 (U/mg) yang diperoleh pada hari ke-8 waktu inkubasi. Supernatan isolat STG 10, JSN 3.1 dan STG 24 dapat menghambat pertumbuhan P. oryzae pada medium PDA dengan persen penghambatan 56.48%, 72.15% dan 65.97% dibandingkan dengan perlakuan kontrol. Gen kitinase famili 19 digunakan sebagai gen penanda untuk mengevaluasi aktivitas antifungi dari kitinase yang dihasilkan oleh isolat terpilih. Hasil analisis menggunakan program BLAST.X membagi 10 isolat terpilih menjadi 2 gen kitinase, yaitu 6 isolat kitinase A dan 4 isolat kitinase C. Aktivitas antifungi kitinase C famili 19 dari S. griseus
HUT 6037 telah dibuktikan dan dapat menghambat pertumbuhan hifa beberapa cendawan patogen. Isolat JSN 3.1, STG 24 dan STG 23 dengan hasil penapisan antagonistik terhadap P. oryzae, uji enzim dan uji penghambatan pertumbuhan P. oryzae yang relatif tinggi memiliki nilai similaritas 83 - 90% terhadap gen kitinase C S. griseus HUT 6037 dan S. globisporus.
SUMMARY
CHARISA GLESIANDRA. Inhibition of Pyricularia oryzae Growth by Rice Phyllosphere Actinomycetes Producing Chitinase. Supervised by ARIS TRI WAHYUDI and ANJA MERYANDINI.
Blast is a disease caused by Pyricularia oryzae fungus. This disease can infect rice plants in all growth phase and able to decrease rice production up to 70%. The countermeasures of blast disease using chemical pesticides can adversely impact the environment and humans who consume it, as well as stimulate pathogen resistance against chemical compounds thus as study about rice phyllosphere microbes especially actinomycetes producing chitinase as a biological control agent must be done. This study aims to isolate and screen rice phyllosphere actinomycetes which have antagonistic activity against P. oryzae, verify chitinase activity from selected actinomycetes isolates qualitatively and quantitatively, and conduct analysis of family 19 chitinase gene sequences on selected actinomycetes.
Leaf samples from health rice plants were collected from rice field areas which were infected by blast diseases in Situgede, Sukabumi and Jasinga (West Java, Indonesia). Sample collection was performed 30 to 60 days after seedling cultivation. The aerial parts of the rice plants were cut approximately 10 cm above the water level and immediately transferred to the Microbiology Laboratory at Bogor Agricultural University, where they were further processed to isolated rice phyllosphere actinomycetes using washing method and humid acid medium.
Ten potential actinomycete isolates were selected from 57 rice phyllosphere isolates isolated from rice fields in Situgede, Sukabumi in Jasinga based on antagonistic assay against P. oryzae and chitinase screening result. Chitinase qualitative and quantitative assays were conducted and gave a diverse result. Isolates STG 10, JSN 3.1 and STG 24 were had chitinase activity at 14.898 ± 0.048 (U/mg), 13.117 ± 0.048 (U/mg) and 12.534 ± 0.193 (U/mg) respectively which obtained at day 8th of incubation period. The supernatant of STG 10, JSN 3.1 and
STG 24 isolates also significantly reducing P. oryzae growth in PDA medium at 56.48%, 72.15% and 65,97% respectively compared with control treatment. Family 19 chitinase gene were used as marker to evaluating the antifungal activity of chitinase produced by the selected actinomycetes isolates. Analysis result using the BLAST.X program divided 10 selected isolates into 2 chitinases gene namely 6
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Progam Studi Mikrobiologi
PENGHAMBATAN PERTUMBUHAN
Pyricularia oryzae
OLEH
AKTINOMISET FILOSFER PADI PENGHASIL KITINASE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Penghambatan Pertumbuhan Pyricularia oryzae oleh Aktinomiset Filosfer Padi Penghasil Kitinase.
Nama : Charisa Glesiandra NIM : G351130221
Disetujui oleh Komisi Pembimbing
Prof Dr Aris Tri Wahyudi, MSi Ketua
Prof Dr Anja Meryandini, MS Anggota
Diketahui oleh
Ketua Progam Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2015 sampai Juni 2016 ini ialah biokontrol, dengan judul Penghambatan Pertumbuhan Pyricularia oryzae oleh Aktinomiset Filosfer Padi Penghasil Kitinase.
Terima kasih penulis ucapkan kepada Prof Dr Aris Tri Wahyudi, MSi sebagai ketua komisi pembimbing dan Prof Dr Anja Meryandini sebagai anggota komisi pembimbing, yang telah sabar memberikan nasehat, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Ir Abdjad Asih Nawangsih, MSi dan Dr Rika Indri Astuti, MSi selaku perwakilan dari Progam Studi Mikrobiologi IPB, yang telah memberikan nasehat dan masukan pada saat ujian sidang tesis.
Penulis juga mengucapkan terima kasih kepada Mbak Sari, Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi atas bantuan selama penulis melakukan penelitian di Laboratorium Mikrobiologi FMIPA Biologi IPB. Rekan satu team penelitian (Teh Ai, Noor, Mba Wiwiek, Maya, Desi, Mba Adit, Dita, Wendi, Eka, Laifa, Jefri), rekan penelitian di Laboratorium Mikrobiologi IPB (Kak Dita, Naswandi, Putri, Susi, Hidayah, Mery, Agesti, Masrukhin, Lia, Abang Risky, Ibu Rina, Pak Sipri, Ibu Leni, dan lainnya) dan sahabat program PARE IPB (Kak Yeni, Kak Rara, Kak Ria, Kak Yunita, Kak Wahyu, Kak Della, Kak Vanesa, Dailami, Kak Saputri) atas dukungan, motivasi dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis sampaikan kepada Ibunda Risma Yutikadiansyah, Ayahanda Christian Carnadi Ascaar, Mohammad Aziz Mahardika serta seluruh keluarga atas doa dan kasih sayangnya. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 atas bantuan, kerjasama, persaudaraan, dan kebersamaan yang diberikan selama penulis menjalani penelitian dan masa studi. Terimakasih kepada pemerintah Indonesia melalui Proyek KKP3N Kementrian Pertanian dan Beasiswa Progam Pascasarjana Dalam Negeri (BPPDN) Tahun 2013 sehingga penulis dapat menyelesaikan studi dengan baik.
Sebagian dari hasil penelitian ini telah dikirim ke jurnal internasional
Malaysian Journal of Microbiology (terindeks Scopus) untuk publikasi dengan judul “Inhibition of Pyricularia oryzae Growth by Rice Phyllosphere Actinomycetes Producing Chitinase”(under review).
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Penyakit Blas 2
Aktinomiset Filosfer dan Potensinya 4
Kitinase 4
3 METODE 7
Kerangka Penelitian 7
Waktu dan Tempat 8
Alat dan Bahan 8
Pengambilan Sampel Daun 8
Isolasi Aktinomiset Filosfer Padi 8
Penapisan Aktivitas Antagonistik Isolat Aktinomiset terhadap P. oryzae 9
Uji Aktivitas Enzim Kitinase secara Kualitatif 9
Uji Aktivitas Enzim Kitinase secara Kuantitatif 9
Penghambatan Pertumbuhan P. oryzae 10
Deteksi Gen Penyandi Kitinase F amili 19 10
Analisis Sekuen Gen Kitinase Famili 19 10
4 HASIL DAN PEMBAHASAN 11
Isolasi Aktinomiset Filosfer Padi 11
Aktivitas Antagonistik Isolat Aktinomiset terhadap P. oryzae 11
Aktivitas Kualitatif Enzim Kitinase 11
Aktivitas Kuantitatif Enzim Kitinase 15
Penghambatan Pertumbuhan P. oryzae 16
Karakteristik Gen Penyandi Kitinase famili 19 18
Hasil Analisis Sekuen Gen Kitinase Famili 19 19
SIMPULAN DAN SARAN 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Karakteristik enzim kitinase 5
2 3
Aktivitas antagonistik isolat aktinomiset terhadap P. oryzae
Nilai indeks kitinolitik (IK) isolat aktinomiset anti P. oryzae
12 14 4 Aktivitas maksimum enzim kitinase dari sepuluh aktinomiset terpilih 15 5
6 7
Persentase penghambatan petumbuhan Po oleh supernatan aktinomiset
Kuantitas DNA genom sepuluh aktinomiset terpilih
Analisis bioinformatika sekuen gen penyandi kitinase 19 aktinomiset 17
Daur hidup penyakit blas pada tanaman padi
Struktur kitin yang mengandung monomer N-asetilglukosamin
Pemutusan ikatan glikosida β-(1,4) oleh endokitinase, eksokitinase dan N-asetil-glukosaminidase Atas) dan mikroskopis koloni dengan perbesaran 400x dilihat dengan mikroskop cahaya (Gb. Bawah)
Penghambatan pertumbuhan P. oryzae oleh (A) isolat SKB 2.8, (B) SKB 2.14 dan (C) JSN 3.1.
11
13 7 Aktivitas kitinase isolat aktinomiset pada media agar-agar yang
mengandung 0.3% kitin.
14 8 Aktivitas enzim kitinase isolat STG 10, SKB 2.16, JSN 3.1 dan STG
24
16 9 Penghambatan pertumbuhan P. oryzae oleh supernatan isolat pada
media PDA
17 10 Elektroforesis gel agarose 0,8%. Gen kitinase famili 19 hasil
amplifikasi dengan PCR dari 10 aktinomiset terpilih
18 11 Pohon filogenetik gen penyandi kitinase famili 19 dari 10 isolat
aktinomiset terpilih dengan metode neighbor-joining dengan evaluasi bootstrap 1000 x
Penghitungan aktivitas enzim kitinase
Berat kering dan aktivitas enzim kitinase isolat aktinomiset terpilih selama 10 hari
1 PENDAHULUAN
Latar Belakang
Blas adalah penyakit padi yang disebabkan oleh cendawan Pyricularia oryzae. Penyakit ini dapat menyerang pada seluruh fase pertumbuhan tanaman padi dan mampu menurunkan produksi hingga 70% (Munoz et al. 2007). Berdasarkan data pada Direktorat Perlindungan Tanaman, Ditjen Tanaman Pangan. Luas serangan Blas pada tanaman padi Tahun 2012 seluas 55.643 ha terutama terjadi di Propinsi Jawa Timur (17.166 ha), Jawa Tengah (10.644 ha), Jawa Barat (8.068 ha), Lampung (3.479 ha) dan Sulawesi Tenggara (2.248 ha). Luas ini lebih tinggi apabila dibandingkan dengan tahun 2011 seluas 27.403 ha (puso: 198 ha) dan rata-rata 5 tahun (2006-2010) seluas 19.787 ha (puso: 64 ha) (BPS 2014). Menurut Amir dan Kardin (1991), serangan blas leher dapat mencapai 90% dan menyebabkan kehilangan hasil padi mencapai 50 - 90% pada varietas rentan. Daerah endemik penyakit blas di Indonesia adalah Lampung, Sumatera Selatan, Jambi, Sumatera Barat, Sulawesi Tengah, Sulawesi Tenggara, dan Jawa Barat (Sukabumi).
Penanganan hama tanaman menggunakan kontrol biologis cenderung lebih lambat, tetapi lebih tahan lama, dan tidak membahayakan organisme lain. Penyakit blas padi yang disebabkan oleh P. oryzae merupakan penyakit yang sangat penting karena penyakit ini terdistribusi secara luas di dunia dan menyebabkan penurunan produktivitas dalam jumlah besar (Ramanathan et al. 2002).
Penanggulangan penyakit blas karena P. oryzae menggunakan senyawa kimia seperti pestisida dapat berakibat buruk terhadap lingkungan dan manusia yang mengkonsumsinya serta dapat memacu resistensi patogen terhadap senyawa kimia tersebut. Mikroorganisme sebagai agen pengendali hayati memiliki potensi yang tinggi dalam mengendalikan patogen tanaman serta tidak memiliki efek terhadap lingkungan atau organisme bukan sasaran. Penggunaan beberapa mikrob pengendali hayati dilaporkan dapat mengurangi penggunaan senyawa kimia pertanian (Adesemoye et al. 2009). Sumber mikrob pengendali hayati patogen tanaman dapat berasal dari tanah (Zarandi et al. 2009) atau dari filosfer (Wang & Ma 2011).
Aktinomiset merupakan bakteri Gram positif yang menghasilkan 70% senyawa bioaktif yang dihasilkan oleh bakteri (Takahashi 2004). Aktinomiset mampu menghasilkan beragam metabolit sekunder dengan beragam fungsi biologi seperti antimikrob, inhibitor enzim, dan enzim pendegradasi bahan organik (Emmert & Handelsman 1999). Gopalakrishnan et al. (2013) melaporkan bahwa terdapat lima galur Streptomyces yang bersifat antagonis pada cendawan patogen
2
Perumusan Masalah
Penyakit blas pada padi yang disebabkan oleh Pyricularia oryzae dapat meenyebabkan kehilangan produksi padi 50 – 90% pada spesies rentan. Pengendalian penyakit blas yang aman bagi konsumen dan lingkungan belum banyak dikembangkan. Dinding sel P. oryzae yang tersusun atas kitin menjadi target penggunaan kitinase dalam mengendalikannya. Kajian penggunaan kitinase dari Aktinomiset sebagai biokontrol cendawan patogen pada tanaman komersial lainnya telah banyak digunakan dan dinilai lebih efektif, namun belum dikaji potensinya terhadap patogen P. oryzae.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi dan melakukan penapisan aktinomiset filosfer padi yang memiliki aktivitas antagonistik terhadap P. oryzae
secara in vitro. Mengukur aktivitas enzim kitinase isolat aktinomiset terpilih secara kualitatif dan kuantitatif, serta melakukan analisis sekuen protein gen family 19 pada aktinomiset terpilih.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi acuan dalam pencarian agen pengendali hayati P. oryzae penyebab blas padi yang bersifat ramah lingkungan sebagai pengganti pestisida kimia sintetis. Langkah tersebut bertujuan untuk meningkatkan produktivitas tanaman padi sehingga dapat mendukung ketahanan pangan nasional.
2 TINJAUAN PUSTAKA
Penyakit Blas
Penyakit blas pada padi disebabkan oleh Pyricularia oryzae Cavara (sinonim:
P. grisea Sacc) yang merupakan cendawan Ascomycota dan bersifat heterotalik (Zeigler 1994). Cendawan ini hanya ditemukan dalam bentuk aseksualnya saja di alam, sementara bentuk seksualnya yaitu Magnaporthe oryzae (sinonim: M. grisea
Hebert) hanya dapat dihasilkan dengan pengkulturan di laboratorium (Valent 1990). Secara morfologi cendawan ini memiliki konidia berbentuk bulat, lonjong, tembus cahaya, dan bersekat dua (3 ruangan) (Ou 1985).
Cendawan P. oryzae menyebabkan penyakit blas pada padi yang merupakan salah satu penyakit padi paling mematikan secara luas di dunia (Ou 1985). Patogen
P. oryzae cenderung berada di permukaan daun menyebabkan blas selama fase vegetatif atau bercak leher selama fase reproduktif. Lesi blas pada daun mengurangi laju fotosintesis individual daun (Bastiaans & Kropff 1991). Blas leher dianggap fase paling mematikan dan dapat terjadi tanpa dimulai dengan blas daun (Zhu et al.
3 kultivar yang resisten, lesi sering terlihat kecil (1-2 mm) dan berwarna coklat sampai coklat kehitaman (Tebeest et al. 2007).
Cendawan penyebab blas bersifat sangat spesifik pada padi, meskipun beberapa spesies dapat menyerang rumput liar. Cendawan yang telah menyerang padi memproduksi ribuan spora secara cepat yang dapat terbawa oleh angin dan hujan sehingga menjangkit tanaman padi tetangga (Brent 1995).
Daur penyakit blas meliputi 3 fase, yaitu infeksi, kolonisasi dan sporulasi (Gambar 1) (Zeigler et al. 1994). Fase infeksi diawali dengan pembentukan konidia bersepta tiga yang dilepaskan oleh konidiofor. Konidia kemudian berpindah ke permukaan daun sehat melalui percikan air atau angin. Penempelan konidia pada permukaan daun padi terjadi karena adanya getah pada ujung konidia (Hamer et al. 1989). Fase kolonisasi dimulai dengan perkecambahan konidia membentuk apresoria yang tersusun atas melanin, kemudian apresoria tersebut akan menembus kutikula daun (Bourett & Howard 1990). Proses penetrasi appresoria pada kondisi optimum berlangsung selama 8 – 10 jam (Chumley & Valent 1990). Pertumbuhan hifa P. oryzae pada permukaan daun padi menyebabkan terbentuknya lesi. Fase sporulasi ditandai dengan pembentukan lesi yang akan menghasilkan konidia (spora). Lesi pertama akan muncul 4 – 5 hari setelah infeksi konidia pada permukaan daun (Bonman. 1992). Perkembangan lesi kecil menjadi lesi besar akan berlangsung selama 8 hari. Lesi kecil mampu menghasilkan 50 – 300 spora selama 6 -7 hari, sedangkan lesi besar menghasilkan 2.500 – 6.000 spora selama 14 hari secara in vitro. Penyebaran spora selain dapat terjadi melalui air dan angin juga dapat terjadi melalui gabah yang terjangkit. Pada daerah tropis spora P. oryzae
mampu bertahan sepanjang tahun (Zeigler et al. 1994).
4
Aktinomiset filosfer dan Potensinya
Aktinomiset merupakan bakteri Gram positif yang membentuk percabangan filamen dan spora dengan komposisi basa DNA (Guanin + Cytosin) berkisar antara 63-78% (Miyadoh 1997). Aktinomiset diklasifikasikan sebagai berikut (Stackebrandt et al. 1997):
Secara klasifikasi molekuler aktinomiset terbagi dalam 10 subordo. Sebagian besar aktinomiset (95%) beranggotakan genus Streptomyces (Lachevalier
et al. 1977). Aktinomiset memiliki potensi sebagai agen biokontrol pengendali penyakit tanaman padi baik biomassa sel maupun kultur filtrat. Aktinomiset mampu memproduksi senyawa bioaktif yang bersifat antagonis terhadap fungi fitopatogen (Bressan 2003) dan dapat digunakan untuk mengontrol penyakit blas pada padi (Karthikeyan & Gnanamanickam 2008). Aktinomiset merupakan sumber senyawa bioaktif termasuk antibiotik, senyawa pemacu pertumbuhan tanaman, enzim dan substansi lainnya. Salah satu enzim yang dihasilkan aktinomiset adalah kitinase. Penghambatan pertumbuhan cendawan oleh aktinomiset salah satunya dapat terjadi karena dihasilkannya enzim kitinase yang dapat mendegradasi dinding sel cendawan dan berfungsi sebagai agen proteksi tanaman (Inbar & Chet 1991).
Habitat aerial daun tanaman yang dikolonisasi oleh mikrob disebut filosfer sehingga mikrob yang dapat mengkolonisasi bagian tersebut disebut mikrob filosfer. Mikrob filosfer diantaranya merupakan bakteri, cendawan dan aktinomiset. Beberapa penelitian mikrob filosper difokuskan pada daun yang merupakan struktur aerial dominan pada tanaman (Andrews dan Harris 2000). Potensi aktinomiset filosfer yang utama yaitu sebagai agens hayati pengendali penyakit tanaman yang dikolonisasinya (Boukaew & Prasertsan 2014; Srividya et al. 2012) Beberapa penelitian mengenai aktinomiset filosfer telah dilakukan, diantaranya Ilsan et al. (2016) berhasil mengisolasi 22 aktinomiset filosfer padi dari padi yang terserang penyakit Blight Leaf Bacterial (BLB). 6 isolat aktinomiset memiliki kemampuan antagonis terhadap Xanthomonas oryzae penyebab BLB dan dapat menurunkan persentase penyakit BLB hingga 25.87% pada padi varietas IR64 di rumah kaca. Wang dan Ma (2011) juga berhasil mengisolasi aktinomiset XN-1 dari filosfer mentimun yang dapat menghambat pertumbuhan hifa cendawan patogen Corynespora cassiicola hingga 78.34% pada media PDA, kultur filtratnya menghambat perkecambahan spora C. casiiocola hingga 96.50%. Chen dan Li (1994) berhasil mengisolasi 3050 isolat bakteri dan aktinomiset dari rizosfer dan filosfer berbagai tanaman, 94 isolat menghambat pertumbuhan cendawan patogen beberapa tanaman, 40% isolat aktinomiset menghasilkan kitinase pada media agar-agar yang mengandung kitin.
Kitinase
Kitin merupakan polisakarida (polimer) yang dibangun oleh unit monomer N-asetilglukosamin yang tersusun linier dengan ikatan β (1-4) glikosida. Struktur monomer kitin terangkai dengan ikatan β (1-4) glikosida (Gambar 2) (Hirano et al.
5
Gambar 2 Struktur kitin yang mengandung monomer N-asetilglukosamin (Bhatnagar & Sillanpaa 2009)
Kitin pada cendawan tersebar luas khususnya pada Chytridiomycota, Zygomycota, Ascomycota dan Basidiomycota sebagai komponen dari dinding sel, miselium dan spora (Roberts 1992). Kandungan kitin berbeda pada setiap genus cendawan. Dinding sel cendawan mengandung 80-90% polisakarida (Landecker 1996. Mayoritas cendawan mengandung kitin dan glukan sebagai polisakarida utama pada dinding selnya, kecuali oomycota yang mengandung selulosa dan glukan sebagai komponen dinding sel fibrilnya (Deacon 1997).
Kitinase tergolong dalam kelompok enzim hidrolase (Tabel 1). Kitinase dikelompokkan menjadi 3 famili glikosil hydrolase yaitu famili 18, 19 dan 20. Kitinase yang dihasilkan organisme prokariotik dan eukariotik termasuk dalam famili 18, sedangkan kitinase famili 19 ditemukan pada Streptomycetes dan tanaman tingkat tinggi (Susi 2002).
Tabel 1. Karakteristik enzim kitinase (Pratiwi et al. 2015)
6
berdasarkan cara kerjanya dalam menghidrolisis kitin, yaitu endokitinase, eksokitinase dan N-asetil-glukosaminidase. Endokitinase menghidrolisis ikatan
glikosida β-(1,4) secara acak menghasilkan dimer, trimer, tetramer dan oligomer gula. Eksokitinase menghidrolisis ikatan glikosida β-(1,4) hanya dari ujung non-reduksi. N-setil-glukosaminidase menghirdolisis ikatan glikosida β-(1,4) pada diasetilkitobiosa menghasilkan N-asetil-glukosamin (Gambar 3) (Bhattacharya et al. 2007).
Gambar 3 Pemutusan ikatan glikosida β-(1,4) oleh endokitinase, eksokitinase dan N-asetil-glukosaminidase (Hirose et al. 2010)
Kitinase telah banyak digunakan sebagai agens biokontrol dan efektif mengatasi cendawan serta hama serangga. Watanabe et al (1999) melaporkan bahwa kitinase dari Streptomyces sp. berfungsi sebagai agens biokontrol terhadap
Fusarium oxypsorum dan beberapa cendawan patogen lainnya.Aktinomiset filosfer yang bersahil diisolasi dari berbagai tanaman oleh Chen dan Li (1994) menghasilkan kitinase pada media agar-agar yang mengandung kitin dan dapat berperan sebagai agens biokontrol penyakit tanaman. Kawase et al. (2005) membuktikan bahwa kitinase Streptomyces coelicolor yang dapat ditemukan pada filosfer tanaman dapat menghambat pertumbuhan hifa cendawan pathogen
7
3 METODE
Kerangka Penelitian
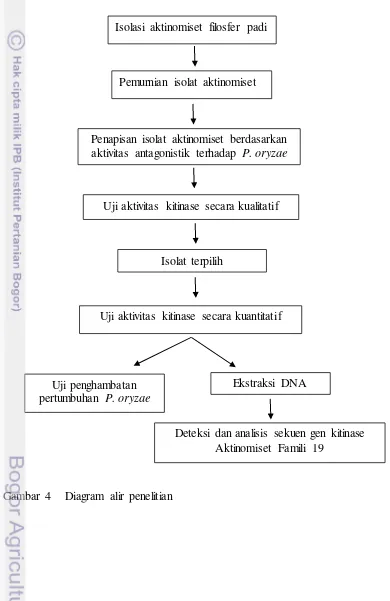
Kerangka penelitian ini meliputi isolasi aktinomiset filosfer padi, pengujian kitinase, pengujian penghambatan pertumbuhan P. oryzae serta deteksi dan analisis gen penyandi kitinase famili 19 (Gambar 4).
Gambar 4 Diagram alir penelitian
Pemurnian isolat aktinomiset
Penapisan isolat aktinomiset berdasarkan aktivitas antagonistik terhadap P. oryzae
Uji penghambatan pertumbuhan P. oryzae
Uji aktivitas kitinase secara kualitatif
Deteksi dan analisis sekuen gen kitinase Aktinomiset Famili 19
Isolat terpilih
Uji aktivitas kitinase secara kuantitatif Isolasi aktinomiset filosfer padi
8
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Mei 2015 sampai dengan April 2016 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB.
Alat dan Bahan
Bahan yang digunakan adalah media Humic Acid Vitamin (HV), Yeast Malt Extract (YM), Potato Dextrose Agar (PDA), Chitin Agar (CA), Chitin Broth
(CB), Agarose, Go-Taq green PCR mix dan kit isolasi genom bakteri Genomic DNA Mini Kit (Blood/Cultured Cell) Geneaid. Alat yang digunakan adalah
Laminar Air Flow (LAF), mesin sentrifuse, spektrofotometer, vortex, Thermal cycler, mesin elektroforesis, inkubator bergoyang serta alat-alat yang umum digunakan di laboratorium mikrobiologi. Galur patogen yang digunakan adalah P. oryzae koleksi dari Balai Besar Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian (BBIOGEN), Bogor.
Pengambilan Sampel Daun Padi
Daun padi dari tanaman padi sehat diambil dari lahan persawahan padi yang terserang penyakit blas di lahan persawahan padi di Situgede, Sukabumi dan Jasinga (Jawa barat, Indonesia). Pengambilan sampel dilakukan pada tanaman padi yang berusia 30 hingga 60 hari setelah tanam. Bagian daun padi yang tidak terendam air dipotong secara aseptik kira-kira 10 cm dari permukaan air, kemudian sampel daun dibawa ke Laboratorium Mikrobiologi Institut Pertanian Bogor untuk dilakukan isolasi aktinomiset filosfer dari sampel daun tersebut.
Isolasi Aktinomiset Filosfer Padi
Isolasi aktinomiset filosfer dilakukan dengan metode pencucian (Jacques dan Morris 1995). Sampel daun yang telah dikoleksi dari lahan persawahan padi Situgede, Sukabumi dan Jasinga ditimbang sebanyak 10 g, kemudian dilakukan proses heat schock pada temperatur 70 oC selama 15 menit. Daun padi kemudian
dipotong menjadi bagian kecil, lalu dimasukkan ke dalam botol Schott berisi 90 mL garam fisiologis (NaCl) steril. Selanjutnya suspensi diinkubasi dengan menggunakan inkubator goyang dengan kecepatan 150 rpm selama 30 menit pada suhu ruang untuk melepaskan aktinomiset dari filosfer daun padi. Selanjutnya dilakukan pengenceran pada suspensi dengan faktor 10-1, 10-2 dan 10-3. Kemudian
9
Penapisan Aktivitas Antagonistik Isolat Aktinomiset terhadap P. oryzae Penapisan aktivitas antagonistik isolat terhadap patogen tanaman padi penyebab penyakit blas dilakukan menggunakan metode dual culture (El-Tarabily
et al. 2000). Isolat aktinomiset digores pada cawan dengan medium Potato Dextrose Agar (PDA). Koloni cendawan diambil menggunakan pelubang steril berdiameter 6 mm dan di letakkan dengan jarak 3 cm dari koloni aktinomiset. Pengamatan interaksi diamati setelah 14 hari masa inkubasi pada suhu ruang. Penghitungan penghambatan dilakukan dengan rumus berikut:
H = � − �� � %
H = persentase hambatan pertumbuhan cendawan Po
r1= radius cendawan yang tidak mengarah ke isolat uji
r2= radius cendawan yang mengarah ke isolat uji.
Kriteria penghambatan; r (r1 - r2) < 1 mm (tidak ada penghambatan), 1-9 mm
(+), 10-19 mm (++) dan ≥ 20 mm (+++).
Uji Aktivitas Enzim Kitinase secara Kualitatif
Uji kualitatif aktivitas enzim kitinase dilakukan dengan cara isolat uji digoreskan pada medium Chitin Agar 0.3 % (3 g koloidal kitin, 1 g yeast extract, 1 g KH2PO4, 0.2 g MgSO4.7H2O, 20 g agar-agar, 1 L akuades) dengan tiga kali
ulangan dan diinkubasi pada suhu 37 oC (Agustiyani et al 2014). Reaksi positif
ditunjukan dengan terbentuknya zona bening di sekitar koloni. Kriteria pengamatan dilakukan dengan rumus:
IK = (d2– d1)/ d1
IK = indeks kitinase
d1= diameter koloni isolat aktinomiset
d2= diameter koloni aktinomiset + zona bening
Uji Aktivitas Enzim Kitinase secara Kuantitatif
Uji kuantitatif aktivitas enzim kitinase dilakukan dengan menggunakan koloidal kitin sebagai substrat. Isolat aktinomiset terpilih ditumbuhkan pada media
Chitin Broth 0.3% (3 g koloidal kitin, 1 g yeast extract, 1 g KH2PO4, 0.2 g
MgSO4.7H2O, 1 L akuades) kemudian diinkubasi selama 10 hari pada suhu 37 oC
di inkubator bergoyang dengan kecepatan 150 rpm. Suspensi isolat kemudian di sentrifugasi dengan kecepatan 5000 rpm selama 30 menit, sentrifugasi supernatan dilakukan setiap hari selama 10 hari bersamaan dengan pengukuran berat kering isolat aktinomiset (Srividya et al. 2012). Sebanyak 0.5 mL supernatan isolat yang diduga mengandung enzim kitinase ditambahkan ke dalam 0.5 mL substrat (1% koloidal kitin dalam bufer fosfat, pH 7), kemudian suspensi tersebut diinkubasi selama 30 menit pada suhu 35 oC pada inkubator bergoyang dengan kecepatan 150
10
dihasilkan. Satu unit aktivitas kitinase ditentukan sebagai jumlah enzim yang di produksi 1µmol gula pereduksi per menit (Saadoun et al. 2009; Srividya et al.
2012).
Penghambatan Pertumbuhan P. oryzae
Pengujian aktivitas antagonistik supernatan isolat aktinomiset terhadap Po
dilakukan dengan mencampurkan supernatan isolat aktinomiset terpilih yang dkulturkan pada medium CB selama 7 – 8 hari (berdasarkan hasil uji aktivitas kitinase secara kuantitatif) sebanyak ± 14 U/mg pada medium PDA steril yang belum memadat (40 oC) ke dalam cawan petri steril dan dihomogenisasi.
Selanjutnya plug agar cendawan P. oryzae berdiameter 6 mm diinokulasikan ke tengah cawan Petri tersebut dan diinkubasi selama 14 hari. Penghambatan pertumbuhan hifa dihitung dengan menggunakan formula sebagai berikut:
(% H) = 100 – [ �2
�2 x 100]
Keterangan: r adalah jari-jari koloni cendawan pada medium cawan PDA dengan adanya supernatan isolat dan R adalah jari-jari kontrol koloni cendawan pada medium cawan PDA (Boukaew dan Prasertsan 2014). Perlakuan control dilakukan dengan mengginokulasikan plug agar P. oryzae pada medium cawan PDA yang tidak dicampurkan dengan supernatan isolat aktinomiset.
Deteksi Gen Penyandi Kitinase Famili 19
Deteksi gen penyandi kitinase famili 19 pada isolat aktinomiset terpilih dilakukan dengan menggunakan primer f19atc forward 5’-AA GCT CGC SGC
(Kawase et al.2004). Produk PCR kemudian dielektroforesis untuk mengetahui ukuran dan kualitas produk yang dihasilkan. Elektroforesis dilakukan dengan menggunakan gel agarosa 0.8% dan migrasi pada 80 V selama 45 menit. Selanjutnya gel agarosa direndam di dalam 0.2% etidium bromida selama 20 menit kemudian divisualisasi di atas UV illuminator.
Analisis Sekuen Gen Kitinase Famili 19
Sekuensing produk PCR dilakukan melalui jasa sekuensing First Base
11
4 HASIL DAN PEMBAHASAN
Isolat Aktinomiset Filosfer Padi
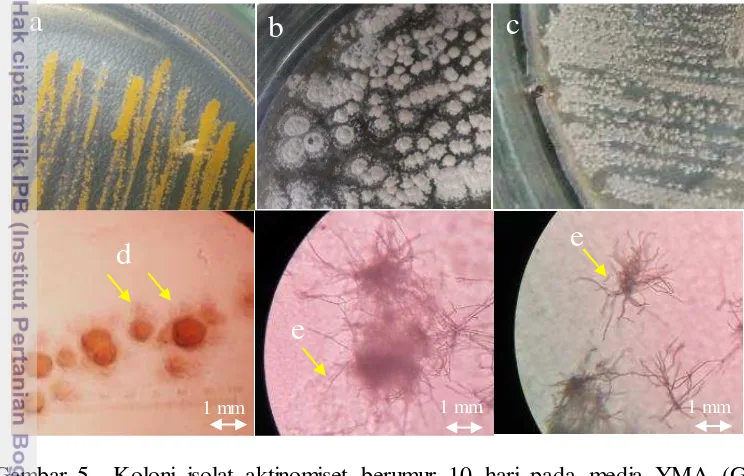
Sebanyak 57 isolat aktinomiset filosfer padi berhasil diisolasi dari lahan persawahan tanaman padi di tiga lokasi lahan persawahan tanaman padi yaitu 22 isolat dari lahan padi Situgede (kode STG), 19 isolat dari lahan padi Sukabumi (kode SKB) dan 16 isolat dari lahan padi Jasinga (kode JSN). Isolat aktinomiset yang berhasil diisolasi memiliki tipe dan warna koloni yang beragam. Tiga contoh bentuk koloni isolat ditampilkan pada Gambar 5.
Gambar 5 Koloni isolat aktinomiset berumur 10 hari pada media YMA (Gb. Atas) dan mikroskopis koloni dengan perbesaran 400x dilihat dengan mikroskop cahaya (Gb. Bawah). (a) isolat STG 10, (b) isolat SKB 2.14, dan (c) isolat JSN 3.1, (d) spora, (e) filamen.
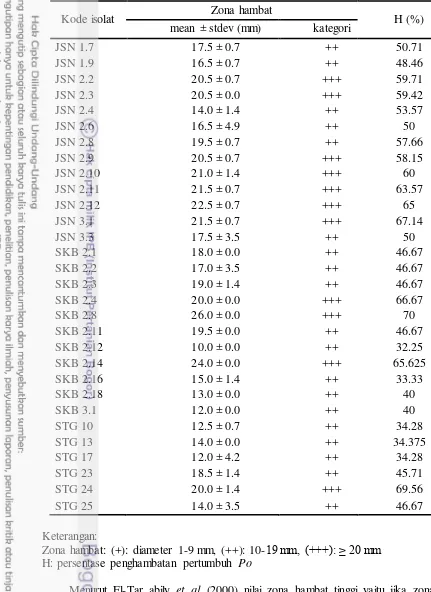
Aktivitas Antagonistik Isolat Aktinomiset terhadap P. oryzae
Hasil pengujian antagonistik positif ditandai dengan terbentuknya zona bening di antara cendawan dan aktinomiset, serta adanya hambatan pertumbuhan cendawan yang mengarah ke koloni aktinomiset. Sebanyak 57 isolat aktinomiset ditapis aktivitas antagonisnya terhadap P. oryzae. Hasil penapisan menunjukkan 52.63% (30/57) bersifat antagonis terhadap P. oryzae, yaitu 6 isolat kode STG, 11 isolat kode SKB, dan 13 isolat kode JSN (Tabel 2).
Kemampuan penghambatan isolat aktinomiset terhadap P. oryzae beragam, hal tersebut karena masing-masing isolat memiliki mekanisme berbeda untuk menghambat pertumbuhan P. oryzae. Aktinomiset diketahui mampu menghasilkan senyawa bioaktif seperti antibiotik, enzim dan substansi lainnya (Inbar dan Chet 1991). Senyawa yang dihasilkan oleh tiap isolat beragam sehingga kemampuan masing- masing isolat untuk menghambat pertumbuhan P. oryzae juga beragam.
c
b
a
1 mm 1 mm 1 mm
d
e
12
Tabel 2. Aktivitas antagonistik isolat aktinomiset terhadap P. oryzae
13 aktinomiset, dan (c) zona bening yang terbentuk.
Zona hambat yang dibentuk oleh isolat aktinomiset dari proses penapisan terhadap P. oryzae selama 14 hari di media PDA pada suhu ruang diduga merupakan kerja dari senyawa bioaktif atau enzim penghidrolisis dinding sel miselium cendawan seperti kitinase. Beberapa penelitian sebelumnya telah berhasil mengisolasi aktinomiset filosfer berbagai tanaman yang mampu menghambat pertumbuhan cendawan patogen (Wang dan Ma 2011; Chen dan Li 1994). Beberapa di antara aktinomiset filosfer tersebut mampu menghasilkan kitinase yang dapat menghidrolisis dinding sel cendawan dan berfungsi sebagai agens proteksi tanaman (Inbar dan Chet 1991).
Aktivitas Kualitatif Enzim Kitinase
Pengujian aktivitas enzim kitinase secara kualitatif dilakukan pada 30 isolat aktinomiset hasil penapisan antagonistik dengan P. oryzae. Hasil pengujian positif ditandai dengan terbentuknya zona bening di sektar isolat aktinomiset yang ditumbuhkan pada medium agar-agar kitin 0.3%. Hasil pengujian enzim kitinase secara kualitatif tertera pada Tabel 3.
Kemampuan isolat aktinomiset menghasilkan enzim kitinase ditandai dengan adanya zona bening yang terbentuk disekitar koloni aktinomiset. Zona bening yang terbentuk menandakan isolat aktinomiset mampu menghasilkan enzim kitinase dan dapat menghidrolisis koloidal kitin yang terkandung pada medium agar-agar kitin. Kitinase bekerja menghidrolisis polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin (Bhattacharya et al. 2007).
14
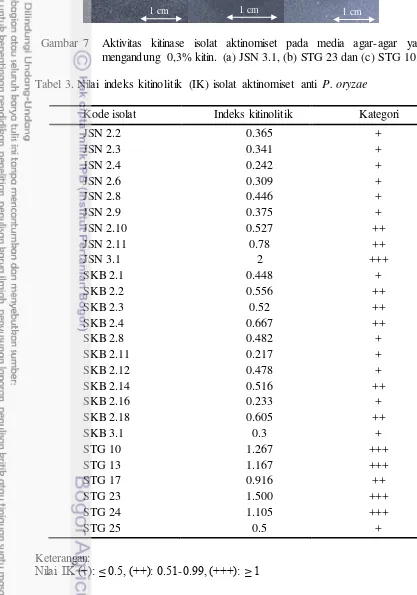
Gambar 7 Aktivitas kitinase isolat aktinomiset pada media agar-agar yang mengandung 0,3% kitin. (a) JSN 3.1, (b) STG 23 dan (c) STG 10. Tabel 3. Nilai indeks kitinolitik (IK) isolat aktinomiset anti P. oryzae
Kode isolat Indeks kitinolitik Kategori
JSN 2.2 0.365 +
JSN 2.3 0.341 +
JSN 2.4 0.242 +
JSN 2.6 0.309 +
JSN 2.8 0.446 +
JSN 2.9 0.375 +
JSN 2.10 0.527 ++
JSN 2.11 0.78 ++
JSN 3.1 2 +++
SKB 2.1 0.448 +
SKB 2.2 0.556 ++
SKB 2.3 0.52 ++
SKB 2.4 0.667 ++
SKB 2.8 0.482 +
SKB 2.11 0.217 +
SKB 2.12 0.478 +
SKB 2.14 0.516 ++
SKB 2.16 0.233 +
SKB 2.18 0.605 ++
SKB 3.1 0.3 +
STG 10 1.267 +++
STG 13 1.167 +++
STG 17 0.916 ++
STG 23 1.500 +++
STG 24 1.105 +++
STG 25 0.5 +
Keterangan:
Nilai IK (+): ≤ 0.5, (++): 0.51-0.99, (+++): ≥ 1
a
b
c
15
Penggunaan koloidal kitin sebagai substrat dalam pengujian ini dikarenakan koloidal kitin merupakan substrat kitin yang paling umum dapat dihidrolisis oleh semua jenis enzim kitinase famili 18 maupun 19. Berdasarkan nilai-nilai pada Tabel 2 dan 3 dipilih 10 isolat potensial untuk dilanjutkan ke uji selanjutnya, yaitu isolat STG 10, STG 23, STG 24, SKB 2.3, SKB 2.4, SKB 2.14, SKB 2.16, JSN 2.10, JSN 2.11 dan JSN 3.1.
Aktivitas Kuantitatif Enzim Kitinase
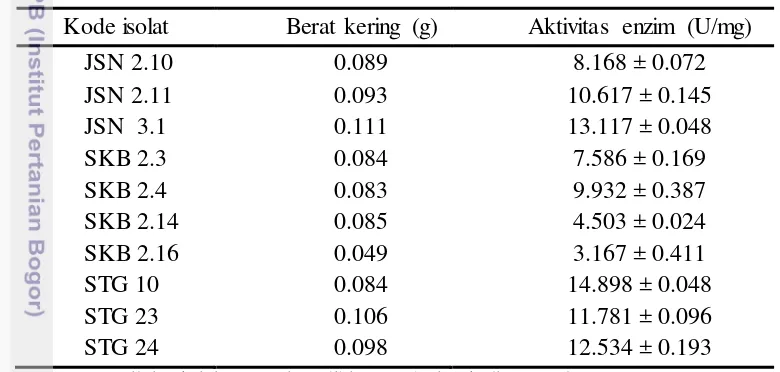
Nilai aktivitas maksimum enzim kitinase 10 isolat aktinomiset terpilih disajikan pada Tabel 4. Berdasarkan Tabel 4 diketahui bahwa isolat STG 10 Tabel 4. Aktivitas maksimum enzim kitinase dari sepuluh aktinomiset terpilih
Kode isolat Berat kering (g) Aktivitas enzim (U/mg)
Keterangan: nilai aktivitas enzim dihitung dari 2 kali pengulangan
16
memiliki nilai aktivitas kitinase yang cukup tinggi pula yaitu 12.534 ± 0.193 (U/mg) pada masa inkubasi hari ke-8 dengan berat kering 0.098 g (Gambar 8).
Gambar 8 Aktivitas enzim kitinase isolat STG 10, SKB 2.16, JSN 3.1 dan STG 24.
Pengujian aktivitas kuantitatif kitinase terhadap 10 isolat aktinomiset terpilih memberikan hasil yang beragam, hal tersebut terjadi karena kemampuan kitinase yang dihasilkan oleh masing-masing isolat aktinomiset memiliki kemampuan yang berbeda untuk menghidrolisis koloidal kitin sebagai substrat. Aktivitas kitinase dipengaruhi oleh beberapa faktor seperti suhu, pH dan tipe substrat (Kawase et al. 2005).
Wang et al. (2014) melaporkan bahwa aktinomiset penghasil kitinase galur Bn035 mampu menghasilkan 1.23 (U/mL) kitinase dan mampu menghambat pertumbuhan 4 cendawan patogen yaitu Bipolaris sorokiniana, Fusarium oxysporum, Rhizoctonia solani dan Pythium capsici. Sementara itu 10 isolat aktinomiset yang digunakan pada studi ini mampu menghasilkan kitinase yang lebih tinggi, yaitu berkisar antara 3.167 ± 0.411 to 14.898 ± 0.048 (U/mL), sehingga 10 isolat aktinomiset yang digunakan pada studi ini dimungkinkan dapat memberikan hasil yang lebih baik dalam menghambat pertumbuhan cendawan patogen.
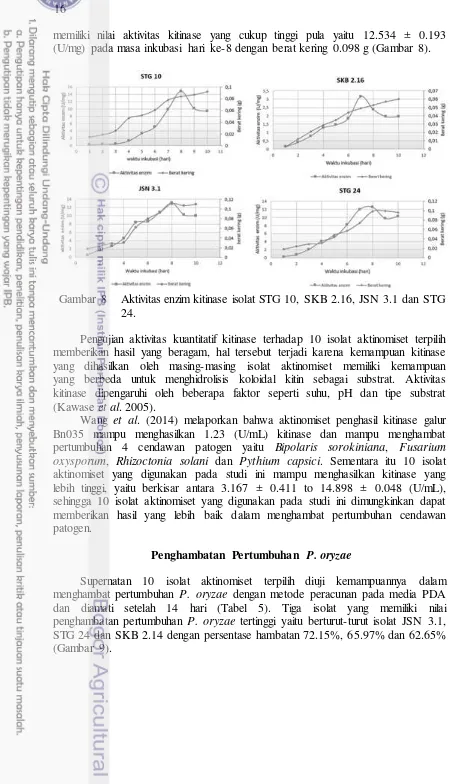
Penghambatan Pertumbuhan P. oryzae
17
Gambar 9 Penghambatan pertumbuhan P. oryzae oleh supernatan isolat aktinomiset yang dicampurkan pada medium PDA. (a) kontrol, (b) JSN 3.1, (c) STG 24, dan (d) SKB 2.14.
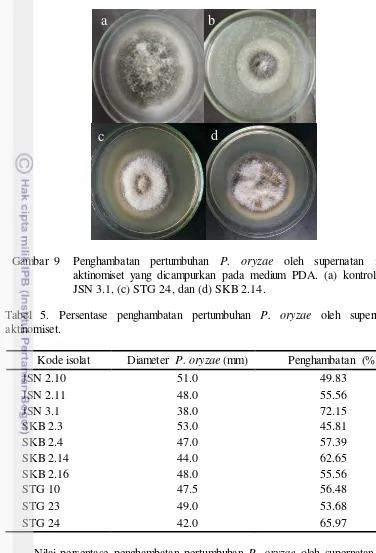
Tabel 5. Persentase penghambatan pertumbuhan P. oryzae oleh supernatan aktinomiset.
Kode isolat Diameter P. oryzae (mm) Penghambatan (%)
JSN 2.10 51.0 49.83
JSN 2.11 48.0 55.56
JSN 3.1 38.0 72.15
SKB 2.3 53.0 45.81
SKB 2.4 47.0 57.39
SKB 2.14 44.0 62.65
SKB 2.16 48.0 55.56
STG 10 47.5 56.48
STG 23 49.0 53.68
STG 24 42.0 65.97
Nilai persentase penghambatan pertumbuhan P. oryzae oleh supernatan isolat tidak berbanding lurus dengan nilai aktivitas enzim (kuantitatif), karena pada pengujian ini P. oryzae merupakan substrat, sehingga kemampuan supernatan isolat menghidrolisis koloidal kitin terlarut tidak dapat dikorelasikan dengan kemampuan menghidrolisis dinding sel P. oryzae. Kawase et al. (2005) melaporkan bahwa kemampuan kitinase aktinomiset menghidrolisis substrat kitin beragam bergantung pada jenis substrat kitin yang digunakan seperti kitin terlarut, koloidal kitin, glikol kitin dan kitin Kristal. Kemampuan kitinase aktinomiset untuk menghidrolisis dinding sel cendawan dimiliki oleh gen kitinase famili 19 (Watanabe et al. 1999).
b
a
18
Karakteristik Gen Penyandi Kitinase Famili 19
Isolasi DNA genom dilakukan pada sepuluh isolat aktinomiset terpilih. Konsentrasi DNA sepuluh isolat terpilih tersebut beragam, berkisar antara 6.8 hingga 90.2 ng/µL (Tabel 6). Kuantitas DNA tertinggi yang diperoleh ditunjukkan oleh isolat STG 24 sebesar 90.2 ng/µL, sedangkan konsentrasi DNA terendah ditunjukkan oleh isolat JSN 3.1 sebesar 6.6 ng/µL. Kemurnian DNA yang diperoleh berdasarkan rasio λ260/280 berkisar antara 1.14 hingga 2.11.
DNA isolat aktinomiset terpilih diamplifikasi menggunakan primer f19act
forward dan reverse untuk mendeteksi keberadaan gen kitinase family 19. Pita dengan ukuran ~400 bp menunjukkan adanya gen kitinase famili 19 (Gambar 10). Produk hasil amplifikasi PCR disekuensing menggunakan jasa sekuensing First Base, kemudian sekuen gen di analisis dan di translasikan menjadi asam amino dengan program Basic Local Alignment Search Tool (BLAST.X) untuk mengetahui kemiripan susunan asam amino-nya dengan data Genbank di National Center for Biotechnology Information (NCBI). Hasil sekuensing menghasilkan sekuen gen dengan panjang 385 bp. Pita berukuran 385 bp tersebut merupakan bagian dari gen kitinase famili 19 yang memiliki panjang pita ~800 hingga ~2000 bp (Tsujibo et al. 2000).
Tabel 6. Kuantitas DNA genom sepuluh aktinomiset terpilih
Kode isolat OD (Optical Density) λ260/280 Konsentrasi DNA (ng/µL)
λ 260 nm λ 280 nm
JSN 2.10 0.182 0.107 1.70 9.1
JSN 2.11 0.405 0.245 1.65 20.2
JSN 3.1 0.136 0.087 1.56 6.8
SKB 2.3 0.583 0.290 2.01 29,2
SKB 2.4 0.306 0.145 2.11 15,3
SKB 2.14 0.312 0.176 1.14 15.6
SKB 2.16 0.403 0.206 1.96 20.2
STG 10 1.100 0.579 1.90 55.0
STG 23 1.335 0.666 2.01 66.4
STG 24 1.807 0.956 1.89 90.2
19 Hasil Analisis Sekuen Gen Kitinase Famili 19
Sekuen gen kitinase famili 19 dengan panjang 385 bp dianalisis dengan BLAST.X dan dibandingkan dengan data Genbank di NCBI (Tabel 7), sehingga diketahui bahwa gen kitinase famili 19 sepuluh isolat terpilih aktinomiset memiliki kemiripan dengan 3 gen kitinase famili 19 yang terdapat pada data Genbank di NCBI, tiga gen tersebut adalah gen kitinase A S. cyaneus,kitinase C S. globisporus
dan kitinase C S. griseus HUT 6037. Nilai identitas pada Tabel 7 menunjukkan tingkat kemiripan sekuen gen isolat yang dianalisis dengan sekuen gen pembanding. Nilai persentase identitas yang semakin tinggi menunjukkan tingkat kemiripan yang semakin tinggi pula. Nilai identitas < 97% menunjukkan adanya indikasi substansi atau spesies novel, karena adanya perbedaan nukleotida sebesar
≥ 3% menunjukkan adanya variasi yang cukup tinggi (Stackebrandt & Goebel 1994).
Tabel 7. Analisis bioinformatika sekuen gen penyandi kitinase 19 aktinomiset
No Isolat Strain pembanding
20
5.2 dengan metode neighbor-joining dengan evaluasi bootstrap 1000 kali ditampilkan pada Gambar 11.
Gambar 11 Pohon filogenetik gen penyandi kitinase famili 19 dari 10 aktinomiset terpilih dengan metode neighbor-joining dengan evaluasi bootstrap 1000 x.
Berdasarkan hasil pemetaan pohon filogenetik gen kitinase famili 19 (Gambar 11) diketahui bahwa terdapat dua grup besar yang membedakan kesepuluh isolat terpilih, yaitu grup yang memiliki kemiripan dengan gen kitinase A S. cyaneus dan dengan gen kitinase C pada S. globisporus dan S. griseus
HUT6037. Pembagian kedua grup pada pohon filogenetuik tersebut menggambarkan tingkat homologi antara masing-masing sekuen isolat. Isolat-isolat dengan kemampuan hidrolisis kitin dan antagonisme terhadap P. oryzae
tertinggi yaitu isolat JSN 3.1, STG 23 dan STG 24 memiliki homologi dengan gen kitinase C pada S. globisporus dan S. griseus HUT 6037. Watanabe et al. (1999) telah membuktikan bahwa aktivitas antifungi Chitinase C famili 19 dapat menghambat pertumbuhan hifa Trichoderma reseei. Pernyataan tersebut didukung oleh Kawase et al. (2005) yang melaporkan S. coelicolor A3 memiliki 11 gen pengkode kitinase famili 18 dan dua gen pengkode kitinase famili 19, namun kemampuan kitinase sebagai senyawa antifungi lebih baik pada kitinase famili 19 yang mampu menghambat pertumbuhan hifa cendawan patogen seperti T. reseei,
T. viridae, Mucor javanicus, dan Fusarium solani.
Gen kitinase famili 18 dari Arabidopsis thaliana (Gambar 11) digunakan sebagai outgroup. Garis yang mendistribusikan gen kitinase menggambarkan tingkat variasi pada sekuen gen yang digunakan. Garis yang semakin pendek mengindikasikan tingkat variasi yang rendah, sementara garis yang semakin
Chitinase A
21 panjang mengindikasikan tingkat variasi yang tinggi.
Asam amino hasil analisis BLAST.X isolat terpilih dan beberapa isolat pembanding dari Genbank yang telah disejajarkan dan dibandingkan dengan menggunakan analisis clustal W disajikan pada Gambar 12.
Gambar 12 Hasil analisis clustal W asam amino gen kitinase famili 19. Asam amino yang identik ditandai dengan kotak merah. S. thermocarboxydus JSN 2.10 (1), S. bellus JSN 2.11 (2), L. albida
JSN 3.1 (3), S. albolongus SKB 2.3 (4), S. araujoniae SKB 2.4 (5),
22
cyaneus (13), chitinase C Streptomyces globisporus (14), ChiF S. coelicolor A3(2) (15), chitinase IS Streptomyces sp. AJ9463 (16), ChiN Streptomyces sp. ABRIINW 18 (17), Family 19 chitinase S. plicatus (18), MULTISPECIES: chitinase C Streptomyces (19), Chitinase C S. Griseus HUT 6037 (20), Chitinase B A. thaliana (21). Gen kitinase famili 19 sepuluh isolat terpilih yang telah berhasil di amplifikasi dan di translasikan menjadi 121 asam amino merupakan sebagian dari gen kitinase famili 19 yang memiliki panjang asam amino beragam antara 240 -380 asam amino (Tsujibo et al. 2000). Sekuen gen yang di translasikan menjadi 121 asam amino merupakan domain katalitik dari gen kitinase famili 19 (Ohno et al. 1996).
Kitinase berdasarkan homologi sekuen asam aminonya terbagi menjadi dua famili yaitu kitinase famili 18 dan kitinase famili 19. Kitinase famili 18 merupakan kitinase dari virus, bakteri, fungi, hewan dan kitinase kelas III dan V dari tanaman (Gijzen et al. 2001). Kitinase famili 19 merupakan kitinase kelas I, II dan IV dari tanaman dan kitinase dari Aktinomiset (Ohno et al. 1996). Pada mulanya kitinase yang tergolong dalam kitinase famili 19 hanya kitinase yang berasal dari tumbuhan, hingga pada tahun 1996 Ohno et al. mengemukakan bahwa domain katalitik dari kitinase C S. griseus HUT 6037 memiliki kemiripan yang signifikan dengan domain katalitik kitinase kitinase famili 19 tanaman kelas I, II dan IV. Gen kitinase famili 18 yaitu kitinase B dari Arabidopsis thaliana
menunjukkan perbedaan yang signifikan di antara sekuen gen kitinase famili 18 dan 19. Pada Gambar 10 terlihat bahwa daerah conserved pada sekuen gen kitinase famili 19 terletak pada asam amino dengan nomor urut 1 - 7, 48 - 54 dan 60 - 70. Studi ini membuktikan bahwa penghambatan pertumbuhan P. oryzae
terjadi karena adanya kitinase yang dihasilkan oleh aktinomiset filosfer padi. Hasil studi ini dapat dipertimbangkan sebagai informasi awal untuk penggunaan kitinase dari aktinomiset filosfer padi sebagai agens biokontrol cendawan patogen P. oryzae penyebab penyakit blas pada tanaman padi.
SIMPULAN DAN SARAN
23
DAFTAR PUSTAKA
Adesemoye AO, Kloepper JW. 2009. Plant microbes interactions in enhanced fertilizer-use efficiency. Appl Microbiol Biotechnol. 85 (1):1-12.
Agustiyani D, Nditasari A, Laili N, Antonius S. 2014. Penapisan dan identifikasi bakteri agens biokontrol penyakit layu fusarium hasil isolasi dari rizosfer pisang. J Fitopatol Ind. 10 (1):23-30.
Amir M, Kardin M. 1991. Pengendalian penyakit jamur. Puslitbang Padi 3:825-944.
Andrews JH dan Harris RF. 2000. The ecology and biogeography of microorganisms on plant surfaces. Ann Rev Phytopathol. 38:145-180
Badan Pusat Statistik. 2014. Berita Resmi Statistik. No. 80/11/Th. XVII. BPS.
Bonman JM. 1992. Durable resistances to rice blast disease-environmental influences. Euphytica. 63:115-123.
Boukaew S, Prasertsan P. 2014. Suppression of rice sheath blight disease using a heat stable culture filtrate from Streptomyces philanthi RM-1-138. Crop Protect. 61:1-10.
Bouret TM, Howard RJ. 1990. In vitro development of penetration structure in the rice vlast fungus Magnaporthe grisea. Can J Bot. 68:329-342.
Brent KJ. 1995. Fungicides Resistance in Crop Pathogens: How can it be Managed? FRAC Monograph No.1GIFAP, Brussels, Belgium.
Bressan W. 2003. Biological control of maize seed pathogenic fungi by use of actinomycetes. Biol Control. 48:233-240.
Chen S, Li J. 1994. Studies on the chitinase producing microorganisms at crop rhizopsphere and phyllosphere and their antifungal activities. Chinese J Biol. 10(2):58-61.
Chumley FG, Valent B. 1990. Genetic analysis of melanin deficient non pathogenic mutants of Magnaporthe grisea. Plant Microbe Interact. 3:135-143
Deacon JW. 1997. Modern Mycology. Ed Ke-3. Cambridge (GB): Blackwell Science.
El-Tarabily KA, Soliman MH, Nassar AH, Al-Hassani HA, Sivasithamparam K, McKenna F, Hardy GE. 2000. Biological control of Sclerotinia minor using a chitinolitic bacterium and actinomycetes. Plant Pathol. 49:573-583. Emmert EAB, Handelsman J. 1999. Biocontrol of plant disease: a Gram positive
perspective. FEMS Microbiol Lett. 171:1-9.
Fokkema NJ. 1973. The role of saprophytic fungi in antagonism against Drechslera sorokiniana (Helminthosporium sativurri) on agar plates and on rye leaves with pollen. Physiological Plant Pathol 3: 195-205.
24
Gopalakrishnan S, Srinivas V, Vidya MS, Rathore A. 2013. Plant growth-promoting activities of Streptomyces spp. in sorghum and rice. Springerplus. 2:574.
Hamer JE, Farral L, Orbach MJ, Valent B, Chumley FG. 1989. Host species-specific conservation of repeated DNA elements in the genome of a fungal plant pathogen. Proc NatlAcad Sci. 86: 9981-9985.
Hirano S, Nakahira T, Nakagawa M, Kim SK. 1999. The preparation and applications of functional fibers from crab shell chitin. J Biotechnol. 70: 373-380.
Hirose T, Sunazuka T, Omura S. 2010. Recent development of two chitinase inhibitors, Argifin and Argadin, produced by soil microorganisms. Proc Jpn Acad Ser B Phys Biol Sci. 86(2): 85-102.
Ilsan NA, Nawangsih AA, Triwahyudi AT. 2016. rice phyllosphere actinomycetes as biocontrol agent of bacterial leaf blight disease on rice. Asian J. Plant Pathol. 10(1-2): 1-8
Inbar J, Chet I. 1991. Evidence that chitinase produced by Aeromonas caviae is involved in the biological control of soil-borne plant pathognes by this bacterium. Soil Biol Biochem. 23:973-978.
Jacques MA, Morris CE. 1995. A review of issues related to the quantification of bacteria from the phyllosphere. FEMS Microb Ecol. 18:1-14.
Karthikeyan V, Gnanamanickam SS. 2008. Biological control of setaria blast (Magnaporthe grisea) with bacteria strains, Crop Protect. 27: 263–267. Kawase T, Saito A, Sato T, Kanai R, Fujii T, Nikaidou , Miyashita K, Watanabe T.
2004. Distribution and phylogenetic analysis of family 19 chitinases in Actinobacteria. Appl Environ Microb. 70(2): 1135-1144.
Kawase T, Yokokawa S, Saito A, Fujii T, Nikaidou N, Miyashita K, Watanabe T. 2005. Comparison of enzymatic and antifungal properties between family 18 and 19 chitinases from S. coelicolor A3(2). Biosci Biotechnol Biochem. 70(4):988-998.
Kim K, Ji H. 2001. Effect of chitin sources on production of chitinase and chitosanase by Streptomyces griseus HUT 6037. Biotechnol Bioprocess Eng.
6: 18-24.
Lachevalier MP, Bievre C de, Lachevalier HA. 1977. Chemotaxonomy of aerobic actinomycetes: phospholipid composition. Biochem Syst Ecol. 5:249-260. Landecker EM. 1996. Fundamental of the Fungi. New Jersey (AS): Prentice-Hall,
Inc.
Zeigler RS, Leong SA, Teng PS. 1994. Rice Blast Dissease. Wallingford (UK): CAB International IRRI
Miyadoh S. 1997. Morphology and Phylogeny of Actinomycetes. Atlas of Actinomycetes. Japan: The Society for Actinomycetes.
Munoz MC, Alvarez IL, Aguilar M. 2007. Resistance of rice cultivars to Pyricularia oryzae in southern Spain. Span J Agric Res. 5(1):59-66.
Ohno T, Armand S, Hata T, Nikaidou N, Henrissat B, Mitsutomi M, Watanabe T. 1996. A modular family 19 chitinase found in the prokaryotic organism Stretomyces griseus HUT 6037. J. Bacteriol. 178(7):5065-5070.
Ou SH. 1985. Rice Disease. 2nd Ed. Kew, Inggris: Common wealth Mycological
25 Pratiwi RS, Susanto TE, Wardani YAK, Sutrisno A. 2015. Enzim kitinase dan
aplikasi di bidang industri: kajian pustaka. JPA 3(3):878-887
Ramanathan A, Shanmugam V, Raghuchander T, Samiyappan R. 2002. Induction of systemic resistance in ragi against blast disease by Pseudomonas flourescens. Ann. PC Prot. Soc. 10:313-318.
Roberts GAF. 1992. Chitin Chemistry. London (GB): MacMillan Press.
Saadoun I, Al-Omari R, Jaradat Z, Ababneh Q. 2009. Influence of culture Streptomyces sp. (Strain S242) on chitinase production. Polish J Microbiol. 58 (4): 339-345
Srividya S, Adarshana T, Deepika V B, Kajingailu G, Nilanjay D. 2012. Streptomyces sp. 9p as effective biocontrol against chili soilborne fungal phytopathogens. Euro J Experiment Biol. 2(1):163-173.
Stackebrandt E, Rainey FA, Ward-Rainey NL. 1997. Proposal for a new hierarchic classification system, Actinobacteria classis nov. Int J Syst Bacteriol. 47:479-491.
Stackebrandt E, and Goebel BM. 1994. Taxonomic note: A place for DNA-DNA reassociation and 16S rRNA sequence analysis in the present species definition in bacteriology. Int J. Syst. Bacteriol. 44:846–849.
Standard Evaluation System for Rice. 1988. International Rice Pesting Program. Ed ke-3, Los Banos: IRRI.
Susi. 2002. Isolasi kitinase dari Scleroderma columnae dan Trichoderma harzianum. JID 3(1):30-35
Takahashi Y. 2004. Exploitation of new microbial resources for bioactive compounds and discovery of new Actinomycetes. Actinomycetologica 18:54-61.
Tamil Nadu Agricultural University (TNAU) Agritech Portal. 2014. Crop Protection.
Teebest DO, Guerber C, Ditmore M. 2007. Rice blast. Plant Health Instructor. DOI:10.1094/PHI-I-2007-0313-07
Tsujibo H, Okamoto T, Hatano N, Miyamoto K, Watanabe T, Mitsutomi M, Inamori Y. 2000. Family 19 chitinases from Streptomyces thermoviolaceus
OPC-520: molecular cloning and characterization. Biosci. Biotechnol. Biochem. 64(11):2445-2453
Valent B. 1990. APS planary session lecture (1989): rice blast as a model system for plant pathology. Phytopathology 80:33-36.
Wang M, Ma Q. 2011. Antagonistik actinomycete XN-1 from phyllosphere microorganisms of cucumber to control Corynespora cassiicola. Cur Gen Coop Rep. 33-34:17-21.
Wang Q, Duan B, Yang R, Zhao Y, Zhang L. 2014. Screening and Identification of Chitinolytic Actinomycetes and Study on the Inhibitory Activity against Turfgrass Root Rot Disease Fungi. J Biosci Med 3: 56-65.
Watanabe T, Kanai R, Kawase T, Tanabe T, Mitsutomi M, Sakuda S, Miyashita K. 1999. Family 19 chitinases of Streptomyces species: characterization and distribution. Microbiol. 145: 3353–3363
26
Zeigler RS, Tohme J, Nelson R, Levy M, Correa-Victoria FJ. 1994. Lineage exclusion: a proposal for linking blast population analysis to resistance breeding. Rice Blast Disease. CAB International IRRI 267-292.
27
28
Lampiran 1. Penghitungan aktivitas enzim kitinase
Hasil pengukuran absorbansi dimasukkan ke persamaan Y = 0,0043 X – 0,0409 yang di dapatkan dari kurva standar NAG, dengan nilai rata-rata absorbansi sebagai Y, sehingga nilai X diketahui, kemudian nilai aktivitas enzim dihitung dengan rumus
Aktivitas enzim (U/mg) = (X sampel – X kontrol) x FP x 1000
t x bmNAG
Keterangan:
FP: faktor pengenceran t: waktu inkubasi (30 menit)
bmNAG: berat molekul NAG (221,2)
Lampiran 2. Berat kering dan aktivitas enzim kitinase isolat aktinomiset terpilih selama 10 hari
Waktu inkubasi (hari) Berat kering (g) Aktivitas enzim (U/mg)
Isolat JSN 2.10
1 0,013 0,428 ± 0,024
2 0,026 0,582 ± 0,048
3 0,031 1,078 ± 0,169
4 0,033 1,986 ± 0,145
5 0,046 3,870 ± 0,048
6 0,060 7,654 ± 0,024
7 0,089 8,168 ± 0,072
8 0,082 7,038 ± 0,411
9 0,090 6,113 ± 0,121
10 0,087 5,702 ± 0,121
Isolat JSN 2.11
1 0,012 0,342 ± 0,048
2 0,019 1,095 ± 0,242
3 0,033 1,798 ± 0,024
4 0,035 2,551 ± 0,024
29
30
31 Lampiran 2. Berat kering dan aktivitas enzim kitinase isolat aktinomiset terpilih
selama 10 hari (lanjutan)
Lampiran 3. Sekuen gen Kitinase famili 19 isolat terpilih
JSN 2.10 GCGGCGTTCCTGGCCAACGTCAGCCACGAGACCGGCGGTCTGGTGCACGTGGTGGAGCAGA
JSN 2.11 GCGGCGTTCCTGGCCAACGTCAGCCACGAGACCGGCGGTCTGGTGCACGTGGTGGAGCAGA
JSN 3.1 GGCGCGGCGCTGGCCAACGTCTCCCACGAGACCGGCGGACTGTTCTACATCAAGGAACTCA
SKB 2.3 GCGGCGTTCCTCGCCAACGTCAGCCACGAGACCGGCGGTCTGGTGCACGTGGAGGAAGTCA
SKB 2.4 GCCGCGTTCCTCGCCAACGTCAGCCACGAGACCGGCGGTCTGGTGCACGTGGAGGAAGTCA
SKB 2.14 GCGGCGTTCCTCGCCAACGTCAGCCACGAGACCGGCGGTCTGGTGCACATGGTGGAGCAGA
SKB 2.16 GCGGCGTTCCTGGCCAACGTCAGCCACGAGACCGGCGGACTGTTGTACATCAAGGAAGTCA
STG 10 GCGGCGTTCCTGGCCAACGTCACCCACGAGACCGGCGGTCTCGTGCACCTCGTGGAGATCA
STG 23 GCCGCGTTCCTGGCCAACGTCAGCCACGAGACCGGCGGACTATTCTACGTCCAGGAACTCA
STG 24 GCCGCGTTCCTGGCCAACGTCAGCCACGAGACCGGCGGACTATTCTACGTCCAGGAACTCA
JSN 2.10 ACCAGGCCAACTACCCGCACTACTGCGACGCGGGCCAGCCGTACGGCTGCCCGGCCGGTCA
JSN 2.11 ACCAGGCCAACTACCCGCACTACTGCGACGCGGGCCAGCCGTACGGCTGCCCGGCCGGTCA
STG 10 ACCAGAGCGGCGACCCGCACTACTGCGACTGGAGCCAGTCCTACGGCTGCCCCGCGGGCCA
STG 23 ACGAGGCGAACTACCCGCACTACTGCGACACCACGCAGCCCTACGGCTGCCCGGCCGGCCA
STG 24 ACGAGGCGAACTACCCGCACTACTGCGACACCACGCAGCCCTACGGCTGCCCGGCCGGCCA
JSN 2.10 GGCCGCCTACTACGGCCGCGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCG
JSN 2.11 GGCCGCCTACTACGGCCGCGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCG
JSN 3.1 GTCCGCCTACTACGGCCGGGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCC
32
SKB 2.4 GGCAGCGTACTACGGCCGGGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCC
SKB 2.14 GGCCGCGTACTACGGCAAGGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCAGCC
SKB 2.16 GGCCGCCTACTACGGCCGCGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCC
STG 10 GGCCGCGTACTACGGCCGCGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCCGCG
STG 23 GTCCGCCTACTACGGCAACGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCGCCG
STG 24 GGCCGCCTACTACGGCAACGGCCCGATCCAGCTGAGCTGGAACTTCAACTACAAGGCGCCG
JSN 2.10 GGCGACGCGTTGGGCATCGACCTGCTCAACAACCCCTGGCTGGTGCAGAACGACGCGGCCG
JSN 2.11 GGCGACGCGTTGGGCATCGACCTGCTCAACAACCCCTGGCTGGTGCAGAACGACGCGGCCG
JSN 3.1 GGTGACGCGCTCGGCATCGACCTGCTCGCCAACCCCTACCTGGTCGAGAAGAACCCGGCCG
SKB 2.3 GGTGACGCCCTCGGCATCGACCTGCTGAACAACCCCTGGCTGGTCGAGAACGACGCGGCCG
SKB 2.4 GGTGACGCGCTCGGCATCGACCTGCTGAACAACCCCTACCTGGTCGAGAACGACGCGGCCG
SKB 2.14 GGTGACGCCCTCGGCATCGACCTGCTGAACAACCCCTGGCTGGTCCAGAACAACGCGGCCG
SKB 2.16 GGTGACGCGCTCGGCATCAACCTGCTCGCCAACCCCTACCTGGTGGAGCAGAACCCGGCCG
STG 10 GGCGACGCCCTCGGCATCGACCTGCTGAACAACCCCTACCTGGTGGAGACGAACGCCGCCG
STG 23 GGTGACGCCCTGGCCATCGACCTGCTGAACAACCCCTACCTGGTGGAGCCGCACGCGGCCG
STG 24 GGTGACGCCCTGGCCATCGACCTGCTGAACAACCCCTACCTGGTGGAGCCGCACGCGGCCG
JSN 2.10 TCGCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAGTCAGGACCGGGCACCATGACCGT
JSN 2.11 TCGCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAGTCAGGACCGGGCACCATGACCGT
JSN 3.1 TGGCCTGGAAGACCGGCCTCTGGTACTGGAACTCCCAGAACGGCACCGGCACCATGACGGC
SKB 2.3 TCGCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAGTCCGGCCCCGGCACGATGACGGC
SKB 2.4 TCGCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAGTCCGGCCCCGGCACGATCACGGC
SKB 2.14 TCTCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAAGACGGCCCGGGGTGGATGACCGC
SKB 2.16 TGGCCTGGAAGACCGCCCTCTGGTACTGGAACACCCAGACCGGCCCCGGCACCATGACCCC
STG 10 TCGGGTGGAAGACCGCGCTCTGGTACTGGAACACCCAGTGCGGCCCCGGCACCATGACCGG
STG 23 TGGCGTGGAAGACCGGCGTCTGGTACTGGAACTCCCAGTACGGCCCAGCCACCATGACCGT
STG 24 TGGCGTGGAAGACCGGCGTCTGGTACTGGAACTCCCAGTACGGCCCAGCCACCATGACCGT
JSN 2.10 GCACGCCGCCATGGTGAACGGGGCCGGATTCGGCCAGACGATCCGCAGCATCAACGGCGCC
JSN 2.11 GCACGCCGCCATGGTGAACGGGGCCGGATTCGGCCAGACGATCCGCAGCATCAACGGCGCC
JSN 3.1 GCACAACGCCATCGTCAACGGCGCCGGCTTCGGCGAGACGATCCGCTCGATCAACGGCGCC
SKB 2.3 GCACAACGCCATCGTCAACGGCCCCGGCTTCGGCGACACGATCCGCTCCATCAACGGCGCC
SKB 2.4 GCACAACGCCATCGTCAACGGCCCCGGCTTCGGCGACACGATCCGCTCCATCAACGGCGCC
SKB 2.14 GCACAACGCCATCGTCAACAGGCACGGCTTCGGCCAGACGATCCGCTCCATCAACGGCGCC
SKB 2.16 GCACAACGCCATCGTCAACGGCGCCGGCTTCGGCGAGACGATCCGCTCCATCAACGGCGCT
STG 10 CCACAGCGCGATGGTCAACGGGGGCGGCTTCGGCCAGACGATCCGCAGCATCAACGGCTCC
STG 23 GCACAACGCCATCGTCAACGGCCGCGGCTTCGGCGAGACGATCCGCTCGCTCAACGGCGCT
33 JSN 2.10 CTCGAGTGCAA
JSN 2.11 CTCGAGTGCAA
JSN 3.1 CTCGAGTGCAA
SKB 2.3 CTCGAGTGCAA
SKB 2.4 CTCGAGTGCAA
SKB 2.14 CTCGAGTGCAA
SKB 2.16 CTCGAGTGCAA
STG 10 CTCGAGTGCAA
STG 23 CTGGAGTGCAA
STG 24 CTGGAGTGCAA
Lampiran 4. Hasil BLAST.X sekuen isolat terpilih Isolat JSN 2.10
Chitinase A [Streptomyces cyaneus]
Sequence ID: dbj|BAG55920.1|
Query 9 AAFLANVSHETGGLVHVV EQNQANYPHYCDAGQPYGCPAGQAAYYGRGPIQLSWNFNYKA 188
AAFLANVSHETGGLVHVVEQNQANYPHYCD G+PYGCPAGQAAYYGRGPIQLSWNFNYKA
Sbjct 145 AAFLANVSHETGGLVHVVEQNQANYPHYCDWGRPYGCPAGQAAYYGRGPIQLSWNFNYKA 204
Query 189 AGDALGIDLLNNPWLVQNDAAVAWKTALWYWNTQSGPGTMTVHAA MVNGAGFGQTIRSIN 368
AGDALGIDLLNNPWLVQNDAAVAWKTALWYWNTQSGPGTMT HAAMVNGAGFGQTIRSIN Sbjct 205 AGDALGIDLLNNPWLVQNDAAVAWKTALWYWNTQSGPGTMTGHAAMVNGAGFGQTIRSIN 264
Query 369 GALEC 383
G+LEC
Sbjct 265 GSLEC 269
Isolat JSN 2.11
Chitinase A [Streptomyces cyaneus]
Sequence ID: dbj|BAG55920.1|
Query 9 AAFLANVSHETGGLVHVVEQNQANYPHYCDAGQPYGCPAGQAAYYGRGPIQLSWNFNYKA 188
AAFLANVSHETGGLVHVVEQNQANYPHYCD G+PYGCPAGQAAYYGRGPIQLSWNFNYKA
Sbjct 145 AAFLANVSHETGGLVHVVEQNQANYPHYCDWGRPYGCPAGQAAYYGRGPIQLSWNFNYKA 204
Query 189 AGDALGIDLLNNPWLVQNDAAVAWKTALWYWN TQSGPGTMTVHAAMVNGAGFGQTIRSIN 368
AGDALGIDLLNNPWLVQNDAAVAWKTALWYWNTQSGPGTMT HAAMVNGAGFGQTIRSIN
Sbjct 205 AGDALGIDLLNNPWLVQNDAAVAWKTALWYWNTQSGPGTMTGHAAMVNGAGFGQTIRSIN 264
Query 369 GALEC 383
G+LEC