PENENTUAN ZAT PEREDUKSI PADA GLISERIN DENGAN
MENGGUNAKAN SPEKTROFOTOMETER UV-VISIBLE
KARYA ILMIAH
RIZLINDA HAKIKI 072401040
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UN IVERSITAS SUMATERA UTARA
PENENTUAN ZAT PEREDUKSI PADA GLISERIN DENGAN
MENGGUNAKAN SPEKTROFOTOMETER UV-VISIBLE
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Ahli Madya pada Fakultas Matematika Dan Ilmu Pengetahuan Alam
RIZLINDA HAKIKI 072401040
PROGRAM STUDI DIPLOMA 3 KIMIA ANALIS DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UN IVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN ZAT PEREDUKSI PADA GLISERIN DENGAN MENGGUNAKAN SPEKTROFOTOMETER UV-VISIBLE
Kategori : KARYA ILMIAH Nama : RIZLINDA HAKIKI Nomor Induk Mahasiswa : 072401040
Program Studi : DIPLOMA 3 KIMIA ANALIS Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Juni 2010
Diketahui/disetujui oleh:
Ketua Departemen Kimia FMIPA USU Dosen Pembimbing
PERNYATAAN
PENENTUAN ZAT PEREDUKSI PADA GLISERIN DENGAN MENGGUNAKAN SPEKTROFOTOMETER UV-VISIBLE
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan. Beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2010
PENGHARGAAN
Puji dan syukur ke hadirat Allah SWT, karena berkat rahmat dan karunia-Nya tugas akhir yang berjudul “PENENTUAN ZAT PEREDUKSI PADA GLISERIN
DENGAN MENGGUNAKAN SPEKTROFOTOMETER UV-VIS” telah selesai
disusun dalam rangka memenuhi kewajiban penulis sebagai salah satu syarat memperoleh gelar Ahli Madya Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara. Shalawat beriring salam penulis kirimkan kepada Nabi Muhammad SAW beserta keluarga dan para sahabat beliau.
Dalam penulisan tugas akhir ini penulis ingin mengucapkan rasa hormat dan terima kasih yang tak terhingga kepada kedua orang tua tercinta, Ayahanda H. M. Hardi Husein, ST dan Ibunda Hj. Ratna Djuwita, Adik-adiku Rizqa Hayati, Sindy Arsitawati dan Raihan Akalili atas cinta kasih, dukungan, moril dan pengorbanan, serta doa tulus tiada hentinya demi kebaikan dan kebahagiaan penulis.
Selain itu penulis juga ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dr. Marpongahtun, M.Sc selaku dosen pembimbing tugas akhir yang telah banyak meluangkan waktu, tenaga, dan memberikan pemikiran serta masukan kepada penulis sehingga telah dapat menyelesaikan tugas akhir ini.
2. Bapak Prof. Dr. Eddy Marlianto, M.Sc selaku Dekan FMIPA USU
3. Ibu Dr. Rumondang Bulan, MS selaku Kepala Departemen Kimia FMIPA USU.
5. Ibu Sovia Lenny. SSi. MSi yang telah memberikan tambahan ilmu srta masukan kepada penulis.
6. Seluruh staf pengajar dan karyawan di FMIPA USU yang telah memberikan ilmu dan bantuannya kepada penulis.
7. Ibu Ratna Mawarni Siregar selaku Quality Assurance Head laboratorium dan pembimbing praktek kerja lapangan di PT. ECOGREEN OLEOCHEMICAL MEDAN PLANT.
8. Abang-abang dan Kakak-kakak kayawan di Laboratorium PT. Ecogreen Oleochemical Medan Plant, terimakasih atas bantuannya selama penulis melaksanakan praktek kerja lapangan, hingga penulis dapat menyelesaikan tugas akhir ini.
9. Teristimewa sahabat-sahabatku Rima, Naza, Zhila, Nena, Titin, Mega, devi dan Sofi. Terima kasih atas semangat, bantuan, doa, kebersamaan, nasehat dan sebuah persahabatan terindah yang telah diberikan selama penulis menjalani hari-hari suka dan duka sebagai mahasiswa.
10.Teman-teman PKL (Rima, Zhila, Andika) dan teman-teman seperjuangan di Kimia Analis 2007 yang namanya tidak dapat disebutkan satu persatu. Terima kasih atas kekompakkan, semangat, kebersamaan, bantuan, keceriaan, persaudaraan dan doa yang telah diberikan kepada penulis selama ini.
Dengan kerendahan hati penulis berharap semoga tugas akhir ini dapat memberikan sumbangsih dalam pengembangan ilmu pengetahuan. Penulis menyadari sepenuhnya bahwa tugas akhir ini belum sempurna, oleh karena itu kritik dan saran yang bersifat memperbaiki dan membangun penulisan tugas akhir ini sangat diharapkan untuk kesempurnaan.
Akhir kata, semoga tugas akhir ini dapat berguna bagi semua pihak yang membacanya dan juga bagi penulis khususnya..
( Rizlinda Hakiki ) ABSTRAK
DETERMINATION OF REDUCING SUBSTANCE IN GLYCERINE BY USING SPECTROPHOTOMETER UV-VIS
ABSTRACT
DAFTAR ISI
DAFTAR LAMPIRAN xi
BAB 1 PENDAHULUAN 1
1.1.Latar Belakang 1
1.2.Permasalahan 3 2.4.4. Instrumentasi Spektrofotometri UV-Vis 25 2.4.5. Kesalahan-kesalahan Dalam Spektrofotometri 26
BAB 3 BAHAN DAN METODE 28
3.1.3. Pembuatan Larutan 29 3.2. Prosedur 30 3.2.1. Pendeteksian gliserin dengan pereaksi tollens yang
menggunakan spektrofotometer UV-Vis 30 3.2.2. Pendeteksian gliserin dengan pereaksi benedict 31
3.3. Reaksi Percobaan 32
BAB 4 HASIL DAN PEMBAHASAN 33
4.1. Hasil 33
4.2. Pembahasan 33
BAB 5 KESIMPULAN DAN SARAN 38
5.1. Kesimpulan 38
5.2. Saran 38
DAFTAR TABEL
DAFTAR GAMBAR
DAFTAR LAMPIRAN
( Rizlinda Hakiki ) ABSTRAK
DETERMINATION OF REDUCING SUBSTANCE IN GLYCERINE BY USING SPECTROPHOTOMETER UV-VIS
ABSTRACT
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Tanaman kelapa sawit (Elaeis guinensis Jack) berasal dari Nigeria, Afrika barat. Meskipun demikian ada yang mengatakan bahwa kelapa sawit berasal dari Amerika Selatan yaitu Brazil karena lebih banyak ditemukan spesies kelapa sawit di hutan Brazil dibandingkan Afrika. Pada kenyataannya tanaman kelapa sawit hidup subur di luar daerah asalnya seperti Malaysia, Indonesia, Thailand dan Papua New Guinea. Bahkan memberikan hasil produksi per hektar yang lebih tinggi. Salah satunya adalah Indonesia yang merupakan salah satu produsen utama minyak sawit.
Adapun kegunaan minyak kelapa sawit untuk industri pangan adalah seperti minyak goreng, margarin butter, serta bahan untuk membuat kue-kue. Sedangkan untuk industri non-pangan seperti industri farmasi dan industri oleokimia (fatty acid,
fatty alcohol, dan glycerine). Minyak kelapa sawit diperoleh dari lapisan serabut /
kelapa sawit adalah minyak setengah padat (semi solid). Warna minyak kelapa sawit adalah merah jingga, dikarenakan adanya warna karotein dalam jumlah yang banyak. Minyak sawit memiliki bau yang khas dan sangat tajam terhadap “proses oksidasi”. Sifat ini disebabkan oleh adanya zat tokoferol. Minyak inti sawit diperoleh dari biji inti sawit. Minyak inti sawit yang baik berkadar asam lemak yang rendah dan berwarna kuning terang serta mudah dipucatkan.
Minyak sawit dapat dimanfaatkan di berbagai industri karena memiliki susunan dan kandungan gizi yang cukup lengkap. Industri yang banyak menggunakan minyak sawit sebagai bahan baku adalah industri pangan serta industri non pangan seperti kosmetik dan farmasi.
Minyak sawit yang digunakan untuk industri non pangan mempunyai potensi yang cukup besar untuk digunakan di industri farmasi dan industri oleokimia (fatty
acids, fatty alkohol, dan glycerine). Produk non pangan yang dihasilkan dari minyak
sawit dan minyak inti sawit diproses melalui proses hidrolisis (splitting) untuk menghasilkan asam lemak dan gliserin.
Oleokimia adalah bahan baku industri yang diperoleh dari minyak nabati, termasuk diantaranya adalah minyak sawit dan minyak inti sawit. Produksi utama minyak yang digolongkan dalam oleokemikal adalah asam lemak, lemak alkohol, asam amino, metal ester dan gliserin. Bahan-bahan tersebut mempunyai spesifikasi penggunaan sebagai bahan baku industri kosmetik dan aspal. Oleokimia juga digunakan dalam pembuatan bahan detergen.
Gliserin merupakan hasil pemisahan asam lemak. Gliserin terutama digunakan dalam industri kosmetika, antara lain sebagai bahan pelarut dan pengatur kekentalan shampoo, pomade, obat kumur dan pasta gigi. Selain itu gliserin berfungsi sebagai hemaktan pada industry rokok, permen karet, minyak pelincir, cat, adesif, plester dan sabun (Fauzi, 2002).
Salah satu keunggulan dari CCO (Crude Coconut Oil) terhadap CPO (Crude
Palm Oil) terletak pada hasil pemrosesannya, yaitu oleokimia menjadi asam lemak
(fatty acid), alkohol berlemak (fatty alcohol) dan gliserin. Pada pembuatan alkohol berlemak, misalnya, kandungan rantai menengah hidrokarbon (medium chain
hydrocarbon) pada CCO, yaitu C – 12 dan C – 14, mencapai 54 %, sedangkan pada
CPO hanya 1 %. Produk-produk tersebut lebih lanjut akan diolah oleh industri sabun, deterjen, farmasi, kosmetik dan tekstil (Sukamto, 2001).
Berdasarkan hal diatas perlu dilakukan cara analisa pendeteksian zat-zat pereduksi di dalam gliserin dengan pereaksi tollens yang menggunakan spektrofotometer UV-Visible pada panjang gelombang 400 nm dan dengan pereaksi benedict.
1.2. Permasalahan
1.3. Tujuan
1. Untuk mendeteksi adanya zat pereduksi dan kadar kemurnian yang terdapat dalam gliserin dengan menggunakan spektrofotometer UV-Visible.
2. Untuk mengetahui cara/metode pendeteksian zat pereduksi dalam gliserin
1.4. Manfaat
1. Mengetahui kadar zat pereduksi pada gliserin.
BAB 2
TINJAUAN PUSTAKA
2.1. Gliserin
2.1.1. Pengertian Gliserin
Gliserol ialah suatu trihidroksi alkohol yang terdiri atas 3 atom karbon. Jadi tiap atom karbon mempunyai gugus –OH. Satu molekul gliserol dapat mengikat satu, dua, tiga molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida dan trigliserida.
Adapun rumus molekul gliserin dapat ditunjukkan pada Gambar 1 : CH2OH
| CHOH | CH2OH
Gambar 1. Rumus Molekul Gliserin
- Merupakan cairan tidak berwarna - Tidak berbau
- Cairan kental dengan rasa yang manis - Densitas 1,261
- Titik lebur 18,2°C - Titik didih 290 °C
Gliserol juga digunakan sebagai penghalus pada krim cukur, sabun, dalam obat batuk dan syrup atau untuk pelembab (Hart, 1983).
Gliserol yang diperoleh dari hasil penyabunan lemak atau minyak adalah suatu zat cair yang tidak berwarna dan mempunyai rasa yang agak manis, larut dalam air dan tidak larut dalam eter (Poedjiadi, 2006).
2.1.2. Proses Terbentuknya Gliserol
Pada umumnya, lemak atau minyak tidak terdiri dari satu macam trigliserida melainkan campuran dari trigliserida. Trigliserida merupakan lipid sederhana dan merupakan cadangan lemak dalam tubuh manusia.
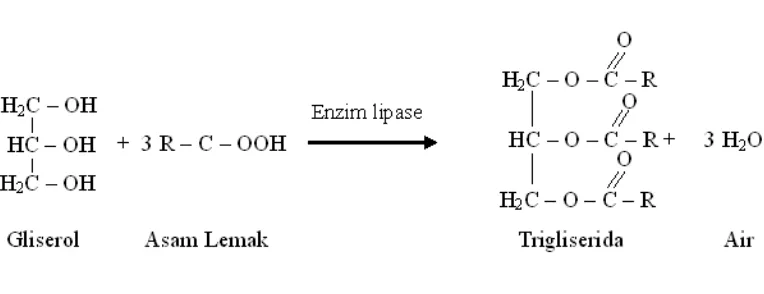
Reaksi pembentukan trigliserida ditunjukkan pada Gambar 2 :
Gambar 2. Reaksi Pembentukan Trigliserida
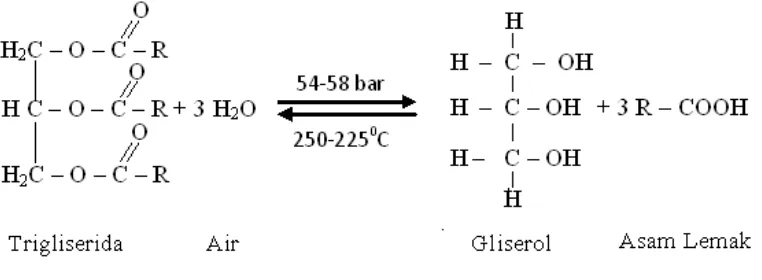
Gambar 3. Reaksi Pembentukan Gliserol
Dari reaksi kesetimbangan antara trigliserida dengan air dihasilkan gliserol dan asam lemak. Oleh sebab itu asam lemak atau gliserol harus segera dikeluarkan (Ketaren, 1986).
Istilah gliserol dan gliserin seringkali digunakan secara tertukar. Walaupun demikian, perbedaan yang tajam antara keduanya sangat terlihat. Gliserol adalah istilah yang digunakan untuk campuran murni, sedangkan gliserin berhubungan kepada tingkat komersialnya, terlepas dari kemurniannya.
Gliserol alami pada dasarnya diperoleh sebagai produk samping di dalam produksi asam lemak, ester lemak atau sabun dari minyak atau lemak. Di Malaysia, gliserol dihasilkan melalui pemecahan minyak sawit atau minyak inti sawit dengan menggunakan metode berikut :
- Splitting atau hidrolisis dari minyak inti sawit dibawah tekanan dan temperature yang tinggi untukmenghasilkan asam lemak dan sweetwater.
Sweetwater ini mengandung 10 – 20 % gliserol.
- Transesterifikasi dari minyak dengan metanol katalis untuk menghasilkan metal ester. Sejak proses tidak menggunakan air, konsentrasi gliserol lebih tinggi
Gliserin merupakan hasil pemisahan asam lemak. Gliserin terutama digunakan dalam industri kosmetika antara lain sebagai bahan pengatur kekentalan sampo, obat kumur, pasta gigi, dan sebagainya (Fauzi, 2002).
Kadar gliserol, relative density, refractive index, kadar air, senyawa terhalogenasi, arsenic dan logam berat adalah parameter-parameter penting yang sering digunakan dalam perdagangan gliserin juga digunakan untuk menentukan kemurnian dari produk. Ini merupakan suatu tes yang sulit karena gliserin bersifat sangat higroskopis, menyerap air dengan cepat dari sekitarnya.
Molekul gliserol mengandung gugus alkohol primer dan alkohol sekunder yang dapat mengalami reaksi oksidasi. Pada umumnya gugus alkohol sekunder lebih suka dioksidasi daripada gugus alkohol primer, sehingga apabila gliserol dioksidasi maka mula-mula akan terbentuk aldehida dan pada oksidasi selanjutnya akan membentuk asam karboksilat (asam gliserat atau asam tartronat).
Rumus molekul asam gliserat dan asam tartronat ditunjukkan pada Gambar 4 :
O O
CH – OH HC – OH H2C – OH C – OH
(Asam Gliserat) O
(Asam Tartronat)
Gambar 4. Rumus Molekul Asam Gliserat dan Asam Tartronat.
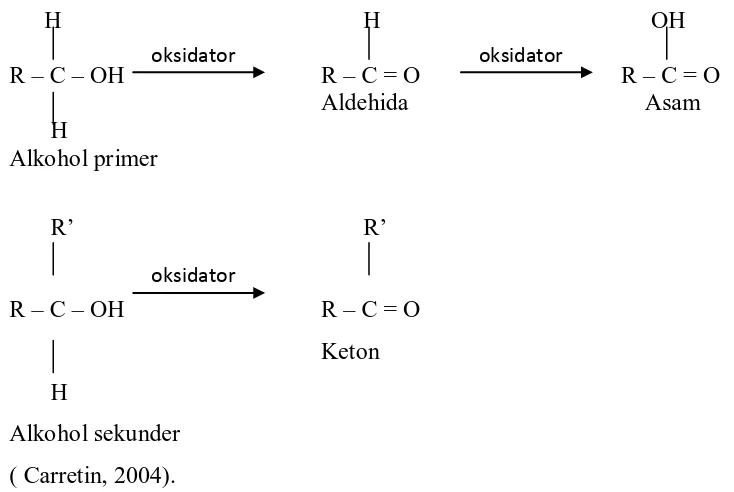
Alkohol dengan paling sedikit satu hidrogen melekat pada karbon pembawa gugus hidroksil dapat dioksidasi menjadi senyawa-senyawa karbonil. Alkohol primer menghasilkan aldehida yang dapat dioksidasi lebih lanjut menjadi asam karboksilat, alkohol sekunder menghasilkan keton.
Berikut ini proses teroksidasinya alkohol primer yang ditunjukkan pada Gambar 5 :
H H OH
R – C – OH R – C = O R – C = O Aldehida Asam H
Alkohol primer
R’ R’
R – C – OH R – C = O Keton H
Alkohol sekunder ( Carretin, 2004).
Gambar 5. Proses Teroksidasinya Alkohol Primer.
2.1.3. Kegunaan Gliserin
oksidator oksidator
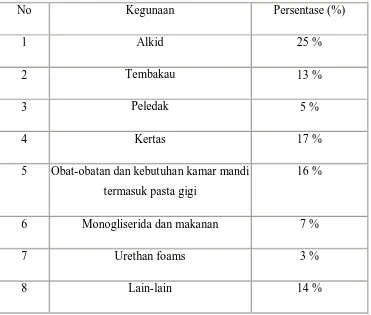
Gliserin mempunyai peran hampir di setiap industri. Penggunaan terbesar dari gliserin adalah pada industri resin alkid, dimana ± 35.000 ton/tahun. Industri kertas, dimana gliserin berfungsi sebagai bahan pelunak adalah pengguna terbesar berikutnya, yaitu 25.000 ton/tahun. Industri nitrogliserin sebesar 7.500 ton/tahun, tetapi pemasarannya berkurang 25 tahun terakhir, dengan digantikannya nitrogliserin oleh bahan peledak yang lebih murah. Berikut ini perkiraan penggunaan gliserin yang ditujukan pada Tabel.1
Tabel.1 Perkiraan Penggunaan Gliserin.
No Kegunaan Persentase (%)
1 Alkid 25 %
2 Tembakau 13 %
3 Peledak 5 %
4 Kertas 17 %
5 Obat-obatan dan kebutuhan kamar mandi termasuk pasta gigi
16 %
6 Monogliserida dan makanan 7 %
7 Urethan foams 3 %
8 Lain-lain 14 %
a. Makanan dan minuman
tidak beracun adalah syarat utama. Gliserin, sejak 1959 diakui sebagai satu diantara bahan yang aman oleh Food and Drug Administration.
Kegunaan sebagai :
1. Pelarut untuk pemberian rasa (seperti vanilla) dan pewarnaan makanan 2. Agen pengental dalam sirup
3. Pengisi dalam produk makanan rendah lemak (biskuit) 4. Pencegah kristalisasi gula pada permen dan es
5. Medium transfer panas pada kontak langsung dengan makanan saat pendinginan cepat
6. Pelumas pada mesin yang digunakan untuk pengolahan dan pengemasan makanan Pada tahun-tahun terakhir, poligliserol dan poligliserol ester meningkat,
Penggunaannya dalam makanan, khususnya mentega dan lemak. b. Obat-obatan dan kosmetik
1. Pada obat-obatan dan kedokteran gliserin adalah bahan dalam larutan alkohol dan obat penyakit
2. Gliserit pada kanji digunakan dalam selai dan obat salep 3. Obat batuk dan obat bius, seperti larutan gliserin-fenol 4. Pengobatan telinga dan media pembiakan bakteri 5. Turunannya digunakan sebagai obat penenang
6. Krim dan lotion untuk menjaga kehalusan dan kelembutan kulit
7. Bahan dasar pembentukan pasta gigi, sehingga diperoleh kehalusan, viskositas dan kilauan yang diinginkan.
c. Tembakau
2. Dengan pewarna, digunakan 3 % berat tembakau untuk mencegah daun menjadi rapuh dan hancur selama pengolahan
3. Pengolahan tembakau kunyah untuk menambah rasa manis dan mencegah pengeringan
4. Bahan pelunak pada kertas rokok.
d. Bahan Pembungkus dan Pengemas
Pembungkus daging, jenis khusus kertas, seperti glassine dan greasproof memerlukan bahan pelunak untuk memberi kelenturan dan kekerasan
e. Pelumas
1. Gliserin dapat digunakan sebagai pelumas jika minyak tidak ada. Ini disarankan untuk kompresor oksigen karena lebih tahan terhadap oksidasi daripada minyak mineral.
2. Pelumas pompa dan bantalan fluida seperti bensin dan benzen
3. Pada industri makanan, farmasi dan kosmetik, gliserin digunakan sebagai pengganti minyak
4. Textile oils dalam operasi penenunan dan perajutan pada industri tekstil. f. Lain-lain
Campuran semen, sabun, detergen, aspal, keramik, pengolahan kayu dan kulit, emulsifier, jangka, komponen patri.
Reaksi oksidasi dan reduksi sering diistilahkan dengan “reaksi redoks”, hal ini dikarenakan kedua peristiwa tersebut berlangsung secara simultan. Oksidasi merupakan perubahan dari sebuah atom atau kelompok atom (gugus) melepaskan elektron, bersamaan itu pula atom atau kelompok atom akan mengalami kenaikan bilangan oksidasi. Demikian pula sebaliknya reduksi adalah perubahan dari sebuah atom atau kelompok atom menerima atau menangkap elektron. Perhatikan contoh berikut yang menggambarkan peristiwa atau reaksi oksidasi.
Fe → Fe2+ + 2 e
Elektron dilambangkan dengan (e) yang dituliskan pada sebelah kanan tanda panah dari persamaan reaksi, jumlah elektron yang dilepaskan setara dengan jumlah muatan pada kedua belah persamaan. Dari reaksi diatas 2 e, menyetarakan muatan Fe2+.
Untuk reaksi reduksi dicontohkan oleh persitiwa reaksi dibawah ini: Cl2 + 2 e → 2 Cl
-Reaksi ini menunjukan adanya penarikan atau penangkapan elektron (e) molekul unsur Cl2 dan menyebabkan molekul tersebut berubah menjadi anion Cl-.
Untuk mempermudah pengertian, kita dapat sederhanakan makna Cl-, sebagai Cl kelebihan elektron karena menangkap elektron dari luar.
Reaksi redoks merupakan reaksi gabungan dari reaksi oksidasi dan reduksi, dan menjadi cirri khas bahwa jumlah elektron yang dilepas pada peristiwa oksidasi sama dengan jumlah elektron yang diterima atau di tangkap pada peristiwa reduksi, perhatikan contoh :
Reaksi oksidasi : Fe → Fe2+ + 2 e Reaksi reduksi : Cl2 + 2 e → 2 Cl
Total reaksi diatas mengindikasikan bahwa muatan dari besi dan klor sudah netral, demikian pula dengan jumlah electron yang sama dan dapat kita coret pada persamaan reaksi redoksnya.
Peristiwa reaksi redoks selalu melibatkan muatan, untuk hal tersebut sebelum kita lanjutkan dengan persamaan reaksi redoks, lebih dulu kita nahas tentang tingkat atau keadaan oksidasi suatu zat.
2.3. Karbohidrat
Karbohidrat (C6H12O6) dapat didefenisikan sebagai polihidroksialdehida
,polihidroksiketon atau senyawaan yang menghasilkan senyawa yang serupa pada
hidrolisis. Karbohidrat umumnya digolongkan menurut strukturnya yaitu monosakarida, oligosakarida dan polisakarida (Hart, 1987).
Penggolongan karbohidrat, berbagai senyawa yang termasuk kelompok karbohidrat mempunyai molekul yang berbeda-beda ukurannya yaitu senyawa yang sderhana yang mempunyai berat molekul 90 hingga senyawa yang mempunyai berat molekul 500.000 bahkan lebih. Berbagai senyawa itu dibagi dalam tiga golongan yaitu golongan monosakarida, oligosakarida dan polisakarida.
1. Monosakarida
aldoheksosa dan sering disebut dekstrosa karena mempunyai sifat dapat memutar cahaya terpolarisasi kearah kanan.
Berdasarkan letak gugus karbonilnya monosakarida dibedakan menjadi : aldosa dan ketosa. Sedangkan menurut jumlah atomnya dibedakan menjadi : triosa , tetrosa dan lain-lain. Monosakarida yang mengandung gugus aldehid dan gugus keton dapat mereduksi senyawa-senyawa pengoksidasi seperti : ferrisianida, hidrogen peroksida dan ion cupro. Pada reaksi ini gula direduksi pada gugus karbonilnya oleh senyawa pengoksidasi reduksi. Gula reduksi adalah gula yang mempunyai kemampuan untuk mereduksi. Sifat mereduksi ini disebabkan adanya gugus hidroksi yang bebas dan reaktif (lehninger,1982).
2. Oligosakarida
Oligosakarida mempunyai molekul yang terdiri atas beberapa molekul monosakarida. Dua molekul monosakarida yang berikatan satu dengan yang lain, membentuk satu molekul disakarida. Oligosakarida yang lain ialah trisakarida yaitu yang terdiri atas tiga molekul monosakarida dan tetrasakarida yang terbentuk dari empat molekul monosakarida.
dari ada tidaknya gugus hidroksil bebas yang reaktif yang terletak pada atom C nomor 1 sedangkan pada fruktosa terletak pada atom C nomor 2.
Sukrosa tidak mempunyai gugus hidroksil yang reaktif karena kedua gugus reaktifnya sudah saling berikatan. Pada laktosa karena mempunyai gugus hidroksil bebas pada molekul glukosanya maka laktosa bersifat reduktif.
3. Polisakarida
Polisakarida pada umumnya mempunyai molekul besar dan lebih kompleks daripada mono dan oligosakarida. Molekul polisakarida terdiri atas banyak molekul monosakarida. Berat molekul polisakarida bervariasi dari beberapa ribu hingga lebih dari satu juta. Contoh polisakarida adalah amilum, glikogen, dekstrin, selulosa dan mukopolisakarida. Polisakarida dibedakan menjadi dua yaitu homopolisakarida dan heteropolisakarida. Monosakarida dan disakarida mempunyai rasa manis sehingga disebut dengan gula. Rasa manis ini disebabkan karena gugus hidroksilnya. Sedangkan Polisakarida tidak terasa manis karena molekulnya yang terlalu besar tidak dapat dirasa oleh indera pengecap dalam lidah (Sudarmadji, 1996).
2.3.1. Sifat kimia karbohidrat
Sifat kimia karbohidrat berhubungan erat dengan gugus fungsi yang terdapat pada molekulnya, yaitu gugus –OH, gugus aldehida dan gugus keton.
Monosakarida dan beberapa disakarida mempunyai sifat dapat mereduksi, terutama dalam suasana basa. Sifat sebagai reduktor ini dapat digunakan untuk keperluan identifikasi karbohidrat maupun analisis kuantitatif. Sifat mereduksi ini disebabkan oleh adanya gugus aldehida atau keton bebas dalam molekul karbohidrat. Sifat ini tampak pada reaksi reduksi ion-ion logam misalnya ion Cu++ dan ion Ag+ yang terdapat pada pereaksi-pereaksi tertentu (Poedjadi, 2006).
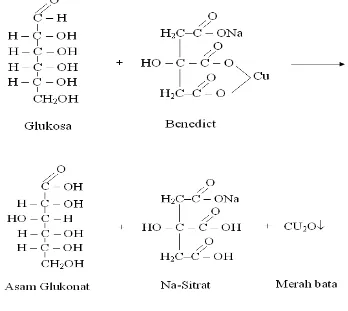
Bilamana monosakarida seperti glukosa dan fruktosa ditambahkan ke dalam larutan luff maupun benedict maka akan timbul endapan warna merah bata. Sedangkan sakarosa tidak dapat menyebabkan perubahan warna. Perbedaan ini disebabkan pada monosakarida terdapat gugus karbonil yang reduktif, sedangkan pada sakarosa tidak.
Gugus reduktif pada sakarosa terdapat pada atom C nomor 1 pada glukosa sedangkan pada fruktosa pada atom C nomor 2. Jika atom-atom tersebut saling mengikat maka daya reduksinya akan hilang, seperti apa yang terjadi pada sakarosa.
Larutan yang dipergunakan untuk menguji daya mereduksi suatu disakarida adalah larutan benedict. Unsur atau ion yang penting yang terdapat pada larutan tersebut adalah Cu2+ yang berwarna biru. Gula reduksi akan mengubah atau mereduksi ion Cu2+ menjadi Cu+ (Cu2O) yang mengendap dan berwarna merah bata. Zat pereduksi itu sendiri akan berubah menjadi asam.
Monosakarida stabil terhadap asam mineral encer dan panas. Asam yang pekat akan menyebabkan dehidrasi menjadi furfural, yaitu suatu turunan aldehid.
Pengaruh Alkali
Larutan basa encer pada suhu kamar akan mengubah sakarida. Perubahan ini terjadi pada atom C anomerik dan atom C tetangganya tanpa mempengaruhi atom-atom C lainnya. Jika D-glukosa dituangi larutan basa encer maka sakarida itu akan berubah menjadi campuran: D-glukosa, D-manosa, D-fruktosa. Perubahan menjadi senyawaan tersebut melalui bentuk-bentuk enediolnya. Bilamana basa yang digunakan berkadar tinggi maka akan terjadi fragmentasi atau polimerisasi. Sehingga monosakarida akan mudah mengalami dekomposisi dan menghasilkan pencoklatan non-enzimatis bila dipanaskan dalam suasana basa. Tetapi pada disakarida dalam suasana sedikit basa akan lebih stabil terhadap reaksi hidrolisis (Soeharsono, 1978).
2.3.2. Pereaksi Benedict
Pereaksi ini berupa larutan yang mengandung kuprisulfat, natrium karbonat dan natriumsitrat. Glukosa dapat mereduksi ion Cu++ dari kuprisulfat menjadi ion Cu+ yang kemudian mengendap sebagai Cu2O. Adanya natrium karbonat dan natrium
Tes Benedict, yang biasa digunakan sebagai uji aldehid. Tes ini dapat juga digunakan untuk membedakan karbohidrat yang mengandung gugus reduksi dari yang tidak mengandung gugus reduksi. Reagen ini mengandung CuSO4, Natrium sitrat dan natrium karbonat dan didalam alkalin, larutan tersebut tidak mengkatalisis reagen benedict menunjukkan tes positif.
Reaksi uji positif benedict terhadap glukosa ditunjukkan pada Gambar 6:
(Poedjadi, 2006)
Gambar 6. Reaksi Uji Positif Benedict Terhadap Glukosa.
2.3.3. Pereaksi Tollens
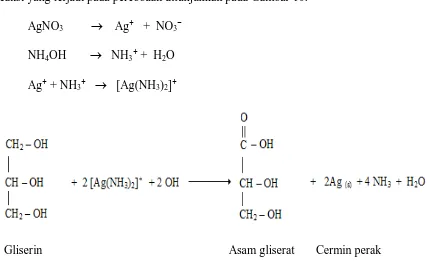
sebagai oksida (Ag2O) pada suhu tinggi, ditambahkan beberapa tetes larutan amonia.
Amonia membentuk kompleks larut air dengan ion perak : Ag+ + 2NH3 → [ Ag (NH3)2 ] +
Gambar 7. Reaksi Pembentuk Ion Komplek Amonia.
Jika aldehida dioksidasi dengan pereaksi tollens, terbentuk asam karboksilat, sdan pada saat itu ion perak direduksi menjadi logam perak. Contohnya, asetaldehida dioksidasi menjadi asam asetat. Perak biasanya mengendap sebagai cermin pada permukaan dalam tabung reaksi. Jika asetaldehida direaksikan dengan pereaksi tollens, persamaannya ditunjukkan pada Gambar 8.
O O
CH3–C–H + 2 (Ag(NH3)2]+ + 2 OH- → CH3–C–O–NH4+ + 2 Ag(s) + 3 NH3 + H2O
Asetaldehida Pereaksi As. asetat Perak Tollens (sebagai garam) (cermin)
amonium
Gambar 8. Reaksi Uji Positif Tollens Terhadap Asetaldehida.
Karena aldehida teroksidasi menjadi asam karboksilat, senyawa ini adalah pereduksi. Ion perak tereduksi menjadi logam perak; senyawa ini adalah pengoksidasi. Cermin sering dilapisi perak oleh pereaksi tollens. Proses niaga menggunakan glukosa atau formaldehida sebagai pereduksi (Wilbraham, 1992).
2.4. Spektrofotometri
Sebuah spektrofotometer adalah suatu instrument untuk mengukur transmitans atau absorbans suatu sampel sebagai fungsi panjang gelombang, pengukuran terhadap sederetan sampel pada suatu panjang gelombang tunggal dapat pula dilakukan. Instrumen semacam itu dapat dikelompokkan secara manual atau merekam atau sebagai berkas tungal atau berkas rangkap. Dalam praktik instrument berkas tunggal biasanya dijalankan secara manual, dan instrument berkas rangkap umumnya mnecirikan perekaman automatik terhadap spectra absorpsi, namun dimungkinkan untuk merekam atau spectrum dengan instrument berkas tunggal.
2.4.2. Prinsip Metode Spektrofotometri
Pada metode spektrofotometri, sampel menyerap radiasi (pemancar) elektromagnetis yang pada panjang gelombang tertentu dapat terlihat. Larutan tembaga misalnya berwarna biru karena larutan tersebut menyerap warna komplementer, yaitu kuning. Semakin banyak molekul tembaga per satuan volum, semakin banyak pula cahaya kuning yang diserap, dan semakin tua warna biru larutannya ( Alaerts, 1987 ).
2.4.3. Jenis-jenis Spektrofotometri
Berikut ini adalah jenis-jenis Spektrofotometri :
1. Spektrofotometri Visible (Spektro Vis)
merah, biru, hijau, atau apapun.. Selama ia dapat dilihat oleh mata, maka sinar tersebut termasuk ke dalam sinar tampak (visible).
Berikut ini Hubungan antara warna dengan panjang gelombang sinar tampak yang ditujukan pada tabel 2.
Tabel 2. Hubungan antara warna dengan panjang gelombang sinar tampak Panjang gelombang Warna yang diserap Warna yang diamati/
Warna komplementer 400 – 435 nm Ungu (lembayung) Hijau kekuningan 450 – 480 nm Biru Kuning
480 – 490 nm Biru kehijauan Orange 490 – 500 nm Hijau kebiruan Merah
500 – 560 nm Hijau Merah anggur 560 – 580 nm Hijau kekuningan Ungu (lembayung)
580 – 595 nm Kuning Biru
595 – 610 nm Orange Biru kekuningan 610 – 750 nm Merah Hijau kebiruan
Sumber sinar tampak yang umumnya dipakai pada spektro visible adalah lampu Tungsten. Tungsten yang dikenal juga dengan nama Wolfram merupakan unsur kimia dengan simbol W dan no atom 74. Tungsten mempunyai titik didih yang tertinggi (3422 ºC) dibanding logam lainnya. karena sifat inilah maka ia digunakan sebagai sumber lampu.
Oleh karena itu, untuk sampel yang tidak memiliki warna harus terlebih dulu dibuat berwarna dengan menggunakan reagent spesifik yang akan menghasilkan senyawa berwarna. Reagent yang digunakan harus betul-betul spesifik hanya bereaksi dengan analat yang akan dianalisa. Selain itu juga produk senyawa berwarna yang dihasilkan harus benar-benar stabil.
2. Spektrofotometri UV (ultraviolet)
Berbeda dengan spektrofotometri visible, pada spektrofotometri UV berdasarkan interaksi sampel dengan sinar UV. Sinar UV memiliki panjang gelombang 190-380 nm. Sebagai sumber sinar dapat digunakan lampu deuterium.
Deuterium disebut juga heavy hidrogen. Dia merupakan isotop hidrogen yang stabil yang terdapat berlimpah di laut dan daratan. Inti atom deuterium mempunyai satu proton dan satu neutron, sementara hidrogen hanya memiliki satu proton dan tidak memiliki neutron. Nama deuterium diambil dari bahasa Yunani, deuteros, yang berarti ‘dua’, mengacu pada intinya yang memiliki dua pertikel.
3. Spektrofotometri UV-Vis
Spektrofotometri ini merupakan gabungan antara spektrofotometri UV dan Visible. Menggunakan dua buah sumber cahaya berbeda, sumber cahaya UV dan sumber cahaya visible. Meskipun untuk alat yang lebih canggih sudah menggunakan hanya satu sumber sinar sebagai sumber UV dan Vis, yaitu photodiode yang dilengkapi dengan monokromator.
Untuk sistem spektrofotometri, UV-Vis paling banyak tersedia dan paling populer digunakan. Kemudahan metode ini adalah dapat digunakan baik untuk sampel berwarna juga untuk sampel tak berwarna.
diakses tanggal 22 Mei 2010).
2.4.4. Instrumentasi Spektrofotometer UV-Vis
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas auatu sistem optik dengan kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200-800 nm.
Suatu diagram sederhana spektrofotometer UV-Vis ditunjukkan dalam Gambar 9 dengan komponen-komponennya meliputi sumber-sumber sinar, monokromator, dan sistem optik.
Celah Celah Wadah
(split) (split) Sampel
Gambar 9. Diagram Sederhana Spektrofotometer UV-VIS.
i. Sumber-sumber lampu; lampu deuterium digunakan untuk daerah UV pada panjang gelombang 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visible (pada panjang gelombang antara 350-900 nm)
ii.Monokromator; digunakan untuk mendispersikan sinar ke dalam komponen-komponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah (split). Monokromator berputar sedemikian rupa sehingga kisaran panjang gelombang dilewatkan pada sampel sebagai scan instrument melewati spectrum.
iii.Optik-optik; dapat didesain untuk memecah sumber sinar sehingga sumber sinar melewati 2 kompartemen, dan sebagaimana dalam spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan ataua spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Rohman, 2007).
2.4.5. Kesalahan-kesalahan dalam spektrofotometri
- Sidik jari yang dapat menyerap radiasi ultra violet - Penempatan kuvet yang tidak tepat posisinya - Ukuran kuvet yang tidak seragam
- Adanya gelembung udara atau gas dalam lintasan radiasi panjang gelombang yang dihasilkan sudah tidak cocok dengan yang tertera pada instrument
BAB 3
BAHAN DAN METODE
3.1. Alat dan Bahan 3.1.1 Alat-alat
- Tabung Reaksi Pyrex - Beaker Glass 400 ml Duran - Beaker Glass 50 ml Pyrex - Gelas Ukur 50 ml Pyrex
- Safety Control as Hotplate IKA Ref. Basic C. - Statif & Klem
- Magnetic Stirer
- Alat Pengukur Suhu 400°C IKA °ETS_D4 Fuzzy - Labu Takar 100 ml Pyrex
- Top Loading Balance
- Spektrofotometer UV-Vis DR LANGE - Kuvet DR LANGE
3.1.2. Bahan-bahan - Refined glycerine - Dekstrosa 1,0 g/l - Larutan AgNO3 100 g/l
- Larutan Amonia 100g/l - Pereaksi Benedict
3.1.3. Pembuatan larutan
- Amoniak solution, 100 g/l
Encerkan larutan amoniak pekat 32% dengan menggunakan double destilat water, tambahkan 35,5 ml amoniak pekat 32%, tambahkan double destilat water hingga garis batas gelas ukur 100 ml
- Silver nitrat solution, 100 g/l
Larutkan 100 g AgNO3 dalam double destilat water, Encerkan hingga 1 liter
- Dekstrosa 1,0 g/l
Larutkan 1,0 g dekstrosa dengan double destilat water, Encerkan hingga 1 liter
Larutkan 173 g Kristal Natrium Sitrat dan 100 g Natrium Karbonat anhydrous didalam 800 ml aquadest , aduk dan saring, Tambahkan 17,3 g tembaga sulfat yang telah dilarutkan dalam 100 ml aquadest. Encerkan hingga 1 L
3.2. Prosedur
3.2.1. Pendeteksian gliserin dengan pereaksi tollens yang menggunakan spektrofotometer UV-Vis
- Tuangkan 6,25 ml sampel kedalam sebuah tabung reaksi, kedalam tabung yang lain, tambahkan 6,25 ml larutan dekstrosa.
- Tambahkan 5 ml larutan amoniak dalam tiap tabung, campur dengan baik. - Tempatkan tabung-tabung tersebut dalam beaker yang berisi air panas pada
suhu 60°C dan pertahankan selama 5 menit.
- Keluarkan tabung-tabung tersebut dari dalam beaker dan tambahkan dengan cepat memakai pipet sebanyak 0,25 ml larutan AgNO3 kedalam tiap tabung. Ujung dari pipet harus berada ditangah-tengah mulut tabung pereaksi, tidak boleh menyentuh dinding tabung. Kocok baik-baik dan biarkan selama 5 menit dalam tempat gelap.
- Bandingkan warna yang terbentuk.
( + ) = Jika warna terbentuk didalam tabung sampel berwarna lebih gelap dari pembanding dekstrosa.
- Untuk memastikan lebih jelas zat pereduksi yang terdapat dalam sampel maka sampel diukur besar transmitasinya dengan spektrofotometer UV-Vis LANGE.
Jika % T > 98 = ( - ) Jika % T < 98 = ( + )
3.2.2. Pendeteksian gliserin dengan pereaksi benedict
- Masukkan tabung reaksi 6,25 ml larutan dekstrosa dan kedalam tabung lain tambahkan 6,25 ml larutan sampel dan tambahkan masing-masing 15 tetes pereaksi benedict
- Campurkan
- Didihka n diatas api kecil selama 5 menit - Dinginkan
- Perhatikan warna yang terbentuk
Tabel 3. Daftar Penilaian Semikualitatif pada Uji Benedict WARNA PENILAIAN
Biru / hijau - keruh - Hijau / hijau
kekuningan
+1
Kuning kehijauan / kuning keruh
+2
3.3 Reaksi Percobaan
Reaksi yang terjadi pada percobaan ditunjukkan pada Gambar 10. AgNO3 → Ag⁺ + NO3⁻
NH4OH → NH3⁺ + H2O
Ag⁺ + NH3⁺ → [Ag(NH3)2]⁺
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil
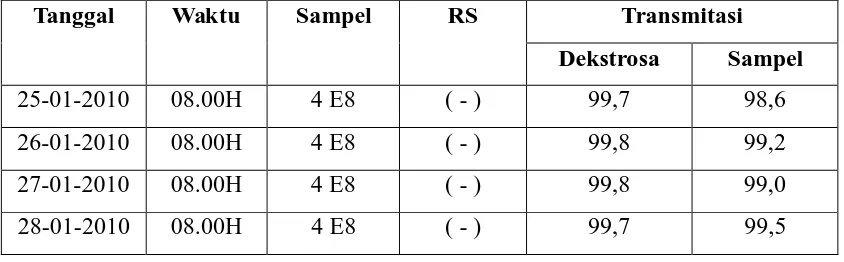
Dari analisis penentuan zat pereduksi pada refined glycerine didapat data transmitasi terhitung tanggal 25 januari 2010 s/d 28 januari 2010 yang dipaparkan pada tabel 4.1. Tabel 4. Data Nilai Transmitasi refined glycerine
Tanggal Waktu Sampel RS Transmitasi Dekstrosa Sampel 25-01-2010 08.00H 4 E8 ( - ) 99,7 98,6 26-01-2010 08.00H 4 E8 ( - ) 99,8 99,2 27-01-2010 08.00H 4 E8 ( - ) 99,8 99,0 28-01-2010 08.00H 4 E8 ( - ) 99,7 99,5
Salah satu produk yang dihasilkan oleh PT. Ecogreen Oleochemicals Medan Plant adalah gliserin ( Refined Glycerine ). Untuk mendapatkan gliserin ini, bahan baku berupa CPKO ( Crude Palm Kernel Oil ) dan CNO ( Crude Natural Oil ) di Splitting ( hidrolisa ) dengan temperatur 250 - 260°C dan tekanan 50 – 56 bar yang akan menghasilkan gliserin air ( glycerine water ) sebanyak 15 – 18%, selanjutnya di Evaporasi menggunakan pompa vakum akan menghasilkan gliserin kasar ( crude
glycerine ) sebanyak 85 – 88%, Tahap terakhir di Destilasi dan Bleaching yang akan
menghasilkan gliserin murni ( Refined Glycerine ) sebanyak 99,9% sebagai produk akhir.
Sebelum dipasarkan, gliserin dengan kemurnian 99,9% akan di periksa/di deteksi kadar zat pereduksinya. Adapun cara/metode pendeteksian daripada zat pereduksi tersebut adalah dengan pereaksi tollens yang menggunakan spektrofotometer UV-Visible pada panjang gelombang 400 nm dan dengan pereaksi benedict.
Pendeteksian zat pereduksi menggunakan larutan pembanding yaitu dextrose yang merupakan karbohidrat. Dimana karbohidrat dikelompokkan menjadi empat kelompok penting yaitu monosakarida, disakarida, oligosakarida, dan polisakarida. Monosakarida merupakan karbohidrat yang tidak dapat dihidrolisis dan tidak kehilangan sifat gulanya. Contoh dari monosakarida adalah ribosa, arabinosa, fruktosa, glukosa dan lainnya.
pengoksidasi adalah penerima elektron. Glukosa dan gula-gula lain yang mampu mereduksi senyawa pengoksidasi disebut gula pereduksi. Sifat ini berguna dalam analisis gula. Gula yang mengandung gugus aldehid atau keton bebas mereduksi indikator-indikator seperti kompleks ion kupri (Cu2+) menjadi bentuk kupro (Cu+) dan kompleks ion perak (Ag +) menjadi bentuk logam perak (Ag(s)). Bahan pereduksi pada
reaksi-reaksi ini adalah bentuk rantai terbuka aldosa dan ketosa. Ujung pereduksi dari suatu gula adalah ujung yang mengandung gugus aldehida atau keton bebas.
Untuk mengidentifikasi karbohidrat, biasanya dilakukan uji terhadap karbohidrat. Berbagai uji telah dikembangkan untuk analisis kualitatif maupun kuantitatif terhadap keberadaan karbohidrat, mulai dari yang membedakan jenis-jenis karbohidrat dari yang lain sampai pada yang mampu membedakan jenis-jenis karbohidrat secara spesifik. Uji reaksi tersebut meliputi uji Molisch, Barfoed, Benedict, Selliwanof dan uji Iod.
Dalam karya ilmiah ini hanya menjelaskan pereaksi tollens dan pereaksi benedict.
Pada pereaksi tollens mengandung ion diamminperak(I) yaitu [Ag(NH3)2]+.Ion
tollens adalah akan menghasilkan cermin perak, namun secara praktek pembacaan secara visual sulit dilakukan maka dilakukan dengan menggunakan spektrofotometer untuk mengukur nilai transmitasi dari gliserin.
Pengukuran nilai transmitasi ini bertujuan untuk mengetahui daya serap absorbansi suatu larutan. Hubungan absorbansi dengan transmitasi adalah berbanding terbalik artinya semakin besar nilai % transmitasi suatu larutan maka akan semakin kecil nilai absorbansinya dan dapat disimpulkan bahwa Jika nilai % transmitasi yang didapat lebih kecil daripada 98% maka hasilnya positif ( + ) artinya gliserin bersifat mereduksi yang dapat mengikat pengotor-pengotor lain akibatnya terjadi penurunan kemurnian gliserin.
Pada pereaksi benedict, digunakan larutan yang mengandung kuprisulfat, natrium karbonat dan natrium sitrat. Uji positif daripada pereaksi benedict adalah akan menghasilkan endapan merah bata tergantung pada jumlah konsentrasi karbohidrat yang diperiksa.Pada uji benedict, hasil uji positif ditunjukkan oleh fruktosa, glukosa, maltosa, dan laktosa, sedangkan untuk karbohidrat jenis sukrosa dan pati menunjukkan hasil negatif. Sekalipun aldosa atau ketosa berada dalam bentuk sikliknya, namun bentuk ini berada dalam kesetimbangannya dengan sejumlah kecil aldehida atau keton rantai terbuka, sehingga gugus aldehida atau keton ini dapat mereduksi berbagai macam reduktor, oleh karena itu karbohidrat yang menunjukkan hasil reaksi positif dinamakan gula pereduksi.
direduksi oleh gula yang mempunyai gugus aldehid atau keton bebas dengan membentuk kuprooksida yang berwarna. Gula pereduksi beraksi dengan pereaksi menghasilkan endapan merah bata (Cu2O). Pada gula pereduksi terdapat gugus
aldehid dan OH-laktol. OH laktol adalah OH yang terikat pada atom C pertama yang menentukan karbohidrat sebagai gula pereduksi atau bukan.
Uji benedict berdasarkan reduksi Cu 2+ menjadi Cu+ oleh gugus aldehid atau keton bebas dalam suasana alkalis, biasanya ditambahkan zat pengompleks seperti sitrat atau tatrat untuk mencegah terjadinya pengendapan CuCO3. Uji positif ditandai
dengan terbentuknya larutan hijau, merah, orange atau merah bata serta adanya endapan. Hal ini terjadi karena glukosa, maltosa dan fruktosa memiliki gugus yang masih memiliki ujung rantai yang bebas dan ikatan antar karbonnya cukup lemah sehingga mudah lepas karena pemanasan.
BAB 5
KESIMPULAN DAN SARAN
5.1.Kesimpulan
Dari hasil analisis yang dilakukan diperoleh kesimpulan sebagai berikut :
— Hasil analisa di laboratorium diperoleh hasil rata-rata nilai % transmitansi dalam gliserin ( refined glycerine ) adalah 99,1%. Dalam hal ini kadar zat pereduksi yang diperoleh berkisar 0,9%. Hasil menunjukkan telah memenuhi standart yang ditetapkan oleh PT. Ecogreen Oleochemical Medan Plant.
— Metode/cara pendeteksian zat pereduksi dalam gliserin ( refined glycerine ) yaitu dengan pereaksi tollens yang menggunakan spektrofotometer UV-Visible dan dengan pereaksi benedict.
5.2. Saran
hasil yang diperoleh sesuai dengan standart mutu yang telah ditetapkan oleh PT. Ecogreen Oleochemical Medan Plant.
— Sebaiknya sebelum menggunakan alat analisa, terlebih dahulu alat dibersihkan guna memperlancar keakuratan penilaian pada setiap parameter-parameter di PT. Ecogreen Oleochemical Medan Plant.
DAFTAR PUSTAKA
Alaert, G. 1987. Metode Penelitian Air. Surabaya : Penerbit Usaha Nasional.
Carrettin, S. 2004. Oxidation Of Glycerol Using Supported Gold Catalyst. Topics In Catalysis. Vol.27. Pages 1-4
Fauzi, Y. 2002. Kelapa Sawit ; Budidaya, Pemanfaatan, dan Manfaat Minyak Sawit. Edisi Revisi. Jakarta : Penerbit Penebar Swadaya.
Hart, H. 1987. Kimia Organik. Jakarta : Penerbit Erlangga.
Ketaren, S. 1986. Minyak dan Lemak Pangan. Jakarta : Penerbit Universitas Indonesia Press.
Lehninger. 1982. Dasar-Dasar Biokimia . Jilid 1. Jakarta : Penerbit Erlangga. Poedjiadi, A. 2006. Dasar – Dasar Biokimia. Edisi Revisi. Jakarta : Penerbit
Universitas Indonesia Press. Rohman, A. 2007. Kimia Farmasi Analisis. Cetakan I. Yogyakarta : Penerbit Pustaka
Pelajar.
Soeharsono, M. 1978. Biokimia. Cetakan Kedua. Yogyakarta : Penerbit Universitas Gadjah Mada Press.
Penerbit Penebar Swadaya.
Wilbraham, C. 1992. Pengantar Kimia Organik dan Hayati. Bandung : Penerbit ITB.
(www.satriaigin.wordpress.com,diakses tanggal 22 Mei 2010).