itLnrrtl T,utLtlt Lilm LntgktLrtgttrt, Vol, 7 No. 1,
April
2005: 6-10 /55Ni410-l-ji3
PENGARUH
VALENSI
I(ATION
DALAM
RUANG-ANTAR LAPISAN
VERMIKULIT
TERHADAP
PEMBENTUI(AN
DAN
I(ARAKTERISTIK
KIMIA
ALUMINIUMHIDROKSI-VERMIKULIT
Effect
of
Interlager
Cation
Valence
on Formation and Chemical Characteristics
of
Alu
minumhg
dro xg'V
er
muculite
Iskandar
Departemen Tanah,
Fakultas
Pertanian,
Institut Pertanian
Bogor,Jalan Meranti,
Kampus iPB Darmaga, Bogor
16680ABSTRACT
Altrntinumhl,dl.oxy-sntectite (AHS), knotvtt
also
ttspillared
clay, has some specificclaracteristics
such as: tt,ide specific',sttrface
areu,
high
basal
.spacing,and stable
at
signtficanl
high
temperalttre.
TheAHS
was producedfrom
smectiteantj
po11,1110, alyminunt-h1;droxt, .
In industrial
sector, this product can be used as cracking-catalyst, absorber, and molecular sieve up to 500 oC. Similarproduct
can be constructed.from vermiculite, and the aluminumhydroxy-vermiculite(AHV)
is predicted hat,e a betterthernat
stabitity than AHS due to higher" charge density oJ vermiculite that adsorb moreoluminunthydroxy
thttnlhal
of smectite.Related
to
the abovebackground the
objective,sof
the
researchwere
to
study the
effectso/ calion
valencein
the interlayer.space of vermiculite usingLi
andMg2
ionsin theformation
process and the chemical characteristics ofAHV.
Li-ctncl Mg-t,ertniculites
v)ith
different
particle
sizesare
reacted v,ith
polymer aluminum-hydroxy
at
100 "C
temperalure. SoltttionoJ 2'%
Locron
y)as used
as
source
oJ-aluminunt-hydroxy
The products
were
characterized chemically
andmineralogicttll.y'. The
chentical characteristic includes
lotaI
chemical analysis,
v,hereasthe
ntineralogical
characteri,stic' tonprise.s hLi.\.tl .tpactng iden/i/icationthat
x'crs meusured v'ithX-rat
clif.fi'actomeler (XRD). The results indicated that lheAHV
produtetl
fi'ont Lt-yermiculite shoved peokstlf
1.86 nm ond/.ll-l
l5
nntvith
increasing intensity of the 1.86 nm peaks as lhelorti('le
si--evas.finet'
TlteAHI'
producecl ,fi'ont.\/g-ternic'ulite
.shovetlonh
peakof
I.a5
nm, whereas theI
84 nm peak can ortl.\'be identi.lied os ashoultlet The,4Hl'vith
peak ofI
E6 nnt /,1Hl-I
86) cort keep its basal .spacingtoL68
nnt after 3 hour,sheating
ot
temperature of^-0()
'C,
vhereas
tlrc.4Hl'-1.15
nnt shrinkagesto
Ll0,/0.98
nmat
the some treatments. Chemical unaly.gis.shott'ecl that theinterls]er
space oJ'theAHr'-l
86 consists morealuntinum-h7'drory
than that of the AHV-1.15. Ratio o/OHiAl
of the itrterlat,er olttntinunt-hycfu6y1, in theAl{I:-l
86 vas 2 57, v'hereas thot of the AHV-1.45 was 2.40.Key
por4t;
Aluminunthydt'oxy-smectite, aluminumhydroxy-vermiculite,pillared
clay, polymer aluminurnhydroxychloride,.s me c I i le. ve rm ic ttl i te
PENDAHULUAN
N'lineral
liat
yang dapat dirnanfaatkanuntuk
berbagai keperluandi
bidangindustri
geoteknik adalahrnineral
liatl
angrremiliki
karakteristik spesifik. sepertimerniliki
.jarakbasal
tinggi.
luas
perurukaanspesiflk dan
diameter
poribesar. serta
stabii pada suhu
tinssi.
Untuk
nremenuhipersyaratau
tersebut penelrtran mengenai
penr isipanpolirler
alunriniurnhidroksi-
ke
dalam ruans
antarlapisansilikat
berlapis mengernbang dan nrengkerut akhir-akhir- ini semakinintensif dilakukan.
Mineral
Iiat
rane
,iieunakanumumnya
adalah mineral-mineral
filosilikat
bermuatan rendah ataukelompok smektit, seperli
beidelit
lBrindler
dan Sernpels,1997:
Schutzet
al.,
1987), montmorillcnit
(Lahav
et
al.,
1978;Occelli
danTindwa,
1983: Schutz erttl.,
1987'. Figueraset
al.,
1990),
laponit (Occelli er
.zi.1987). saponit (Matsuda
et
al.,
1988;
Schoonhei'dt dan Leeman, 1992; Chevalier et a1.,1992),dan hektorit (Occellidan
Finseth,
I986).
Penelitian-penelitian
tersebut rnenun.iukkan.bahwa
aluminiumhidroksi-smektit
(AHS) ataLrdikenal
dengan
istilah
liat
berpilar Qtilarred clol)
dapat dihasilkan tanpa kesulitan dengan
mereaksikanalurriniurnhidroksikhlorida
dengan
smektit pada
suhukamar. Produk yang dihasilkan
memiliki
luas
pemukaanspesifik
besar(250-300
r'
g-'),
jarak
basal lebar (1.8-1.9 nm), dan masih stabil pada suhu antara 300-500 oC. Dengansifat
tersebut
AHS
potensial untuk
digunakan
sebagaicracking-catatsl,
penjerap dan saringan molekular sampaisuhu
500
'C
(Occelli
et
al.,
1987
Schutzet
al.,
1987; Matsuda etal.,
1988).Sementara
itu
penyisipan polirner aluminiumhidroksi'ke
dalam ruang
antarlapisan vermikulit. yang
juga
nterupakan
silikat
berlapis dapat
mengembang seperti halnra
srnektit. lebih
sulit. Bila
vermikulit
direaksikan Jenganpolrmer aluminiumhidroksi*,
makajarak
basalnya mensembangmenjadi hanya
sekitar
L45
nm (Hsu
danBates. 1961: Brydon dan Turner, 1912;
Yeith,
1978. d'Espinosade la
Caillerie dan
Fripiat,
l99l;
Hsu,
1992).Hal ini
terjadi
karena butiran-butiranvermikulit
umurnnyalebih
besardan lebih kaku
dibandingkan
butiran-butiransnektit
Sementaraitu
ruang antarlapisandi
antara lapisan-lapisansilikat
padavermikulit
lebih
sernpit dibandingkan padasmektit.
Vermikulit juga memiliki
kerapatan muatanlebih
tinggi
dibandingkansmekrit. Kondisi
ini
menyebab-kan difusi polimer
aluminiumhidroksi*
ke
dalam
ruangantarlapisan
vermikulit
berlangsung
dengan
kecepatanJuntal Tantth dan Lingkungan, V oI. 7 No. 1,
April
2005: 6-10rendah
(Rich,
1968; Barnhisel dan Bertsch, 1989), sehingga tidak mampu mengembangkanvermikulit
lebihdari
1.4 nm. Iskandar dan Reichenbach(1993)
menemukan bahwaaluminiumhidroksi-vermikulit
(AHV) dapat
iuga
mengembang
sampai
1.9
nm
dengan
cara
mereaksikanvermikulit
berukuran
< 0.2 pm
dengan
polimeraluminiumhidroksi* pada
suhu 100 oC.
Reaksi
tersebut sangat bergantung pada suhu reaksi dan ukuranbutir. Bila
reaksi dilaksanakan pada suhu
<
100 "C atau ukuranbutir
>0.2
pm, makamineral yang
terbentuk akanmemiliki
dua fase, yaitu denganjarak basall.9l
nm dan 1.46 nm denganrasio
intensitasIrqr/lrao
bervariasi. Semakin besar ukuranbutir
atau semakin rendah suhu reaksi, maka rasio I1e1ll1.a6 semakin kecil.Vermikulit
yang digunakan dalam penelitian Iskandar dan Reichenbach (1993) semuanyaterlebih
dahulu dijenuhi dengankation natrium (Na-vermikulit). Jika
pembentukanAHV
fase
L9
nm
dipengaruhi
oleh
kecepatan difusi
polimer aluminiumhidroksi*
ke
dalam ruang
antarlapisan,maka valensi
kation
awal
dalam
ruang
antarlapisanvermikulit
nampaknyajuga
akan menentukan pembentukanAHV.
Semakin
kuat
kation
awal diikat
dalam
ruang antarlapisan, maka pembentukanAHV
fase 1.9 nm semakin sulit.Tujuan
penelitian
ini
adalah
untuk
mengetahuipengaruh
valensi
kation awal dalam ruang
antarlapisanu.rrit utit
menggunakan
ion
Li*
dan
Mg2*
terhadap pembentukan dan susunankimia AHV.
BAHAN
DAN
METODE
Vermikulit
yang
digunakan adalah
vermikulit
"Russland"
dari Firma
Thermax,Austria.
Setelah mineraldigiling
dengan
penggiling, kemudian
dihaluskan
lebih lanjut dalamair
dengan bantuanUltraturrax.
Fraksi mineral berbagai ukuran dipisahkan dengan cara sedimentasi untuk memperoleh ukuranbutir
0.2-0.6
ytm,0.6-2.0 pm,2.0-6.0
pm,
dan<
2
pm.
Bahan dasarvermikulit
ini
selanjutnyadijenuhi
masing-masing denganion
Li*
dan
Mg?'
dengan cara pencucian secara berulangkali.Locron
produksi
Firma
Hoechst digunakan
sebagaisenyawa
polimer
aluminiumhidroksi*. Senyawa
yangmemiliki rumus umum
Al2(OH)5C1.2,3H2Oini
adalah campuran yangterdiri
dari monomer, oligomer dan polimeraluminiumhidroksikhlorida dengan nisbah
OHiAI
sekitar2.5.
Larutan
segarLocron
2
o/o (setara dengan5.1 mg
Al
ml-r
denganpH
sekitar 4.6-4.1)
cocok
digunakan
untukmembentuk aluminiumhidroksi-vermikulit
(lskandar
dan Reichenbach. I 993).Aluminiumhidroksi-vermikulit
dihasilkan dengan cara sebagaiberikut:
50
ml
larutan Locron
2o/o dipanaskan dalam erlenmeyer 100ml
selama 10 menitdi
atas penangasair 100'C.
Selanjutnya sebanyak500 mg vermikulit
yangtelah
dijenuhi
denganMg2* ataupun
Li*
dimasukkan
kedalam
larutanLocron
panas tersebut. Pemanasandi
ataspenangas
air
dilanjutkan
selama
30
menit.
Aluminium
hidroksi-vermikulit
yang dihasilkandicuci
dengan aquadest berulangkali sampai bebaskhlorida
(uji
AgNO3), disaring dan dipanaskan dalam oven pada suhu 60'C.
Karakterisasi
AHV
dilakukan dengan
bantuandifraktometer
sinar-X
menggunakan
lampu
CuKa
dandiukur
pada sudut 2-
30'29.
Untuk
mengetahui ketahananproduk
terhadappanas, maka contoh
dipanaskan dalam lempeng gelas atau lempef,gkeramik
selama 3jam
padasuhu
105,300,
500,700
dan800'C.
Setelah didinginkandalam
eksikator,
jarak
basal contoh
diukur
dengandifraktometer sinar-X.
Analisis
kimia
dilakukan dengan
mencampurkancontoh yang
telah
dikeringkan pada
300 oC
dengan campuran pekat HCIO4 danHF,
dan didiamkan semalam di atas penangas pasir pada suhu sekitar240'C.
Selanjutnyacontoh dilarutkan
dengan
larutan
HCI
6
N
(Hermann, 1975).Dari
larutanini
ditetapkan unsur-unsurK,
Na,
Ca,Mg, Mn,
Al,
dan Fetotal
dengan bantuan spektrofotometer serapanatom. Kadar
Fe2oditetapkan
dengan melarutkancontoh
dengancampuran
pekat
HF
dan
H2SOadi
atas penangaspasir
pada suhu
sekitar
100
'C
selama
10-15menit.
Setelahcontoh
ditambah dengan asam borat jenuhdan
asam
fosfat pekat, larutan
dititar
dengan
KMnOa. UnsurSi
ditetapkan secara spektrofotometri menggunakan ammoniummolibdat (Hermann,
1975danHallmark
et al.,1 982).
HASIL
DAN PEMBAHASAN
Karakteristik
AHV
yang dihasilkan disajikan
darihasil
analisis mineralogi
dan kimia. Analisis
mineralogimencakup
penentuanjarak
basal dan
stabilitas
termal, sedangkananalisis
kimia terkait
dengan
susunan kimia total.Jarak
Basal danStabilitas Termal
Rumus
umum vermikulit yang
digunakan
sebagai bahan penelitian adalahNa1 asK6 s2Cao e;(Si6 6aAl1 ,uFat*o ,o)(Fe3*o uoFe2no 0,,
M95 zsMn6 or)O:o(OH)a
yang memiliki
jarak
basal sebesar 1.2I
nm
(lskandar dan Reichenbach, 1993). Setelah ruang antarlapisanvermikulit
tersebut
dijenuhi
masing-masing denganion
Li-
dan Mg2*,jarak
basalnya berubah berturut-turut menjadi 1.23 nm padaLi-vermikulit
dan 1.43 nm padaMg-vermikulit.
Perubahanjarak
basal tersebut disebabkan oleh perbedaan valensi ion,diameter
ion,
danjumlah molekul air yang
mengelilingiion-ion
Li*
dan
Mg'*
sebagai
hidrat dalam
ruangantarlapisannya.
Perlakuan terhadap
Li-vermikulit
dan Mg-vermikulit
dengan larutan Locron 2o/o pada suhu 100 oC menghasilkan pengembangan
vermikulit ke
dalam2
fasemineral AHV,
yaitu
fase
1.86nm dan
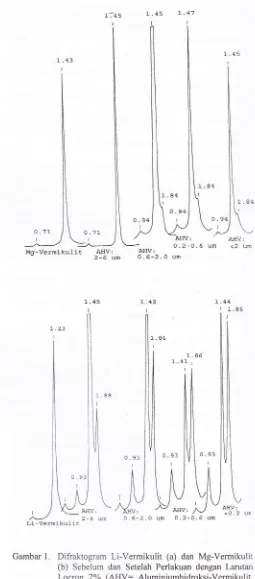
1.41-1.45nm. Difraktogram
pada GambarI
jelas
memperlihatkan bahwa pembentukanAHV
selain dipengaruhi oleh ukuran butir,
juga
dipengaruhi olehvalensi kation
yang
berada dalam ruang
antarlapisanvermikulit.
Difraktogram
AHV
yang
dihasilkan
dari
Li-vermikulit (Gambar
la)
menunjukkan
hasil yang
samaseperti
yang
diperoleh Iskandar dan
Reichenbach (1993) dariNa-vermikulit, yaitu
munculnyaAHV
fase 1.8-1.9 nmPcnthcntukan dan knrttkteristik kinria Ah'ntuniumhidroksi Vermikulit (Iskandar)
Perbedaan
difraktogram
padaGambar
I
ini
nampak sebagaihasil dari
perbedaanvalensi
kation
yang
beradadalam
ruang antarlapisanvermikulit.
Aluminiumhidroksi-vermikulit terbentuk melalui proses pertukaran
antara kation yang berada dalam ruang antarlapisan, dalam halini
ion
Li*
atau Mg2*, dengankation aluminiumhidroksi*.
Ion-ion
M92*
diikat lebih kuat
dalam ruang
antarlapisanvermikulit
dibandingkan
ion-ion
Li*.
Kation yang
diikat
Iebih kuat akan memerlukan energi
yang
lebih besar untuk menukarnya dan halini
akan menurunkan kecepatan difusipolimer
aluminiumhidroksi*
ketika
memasuki
ruangantarlapisan. Perubahan kecepatan
difusi
ini
selanjutnyaakan
menyebabkan
terpecahnya
polimer
aluminiumhidroksi* menjadi
monomer-monomer
atau
spesies lainyang lebih kecil,
sehingga akhirnya hanya
mampu mengembangkanAHV
denganjarak
basal 1.45 nm.Salah satu
ciri
istimewa dariAHV
adalah stabilitasnyaterhadap panas.
Jarak basal
AHV
setelah
dipanaskanselama
masing-masing3 jam
pada temperatur
berbeda disaj ikan pada Tabel I .Pada
Tabel
I
diperlihatkan bahwa
denganrnening-katnya
temperatur,
jarak
basal
vermikulit
dan
AHV
berkurang
secarakonsisten.
Vermikulit telah
mengkerut menjadi 1.02 nm pada temperatur 300 oC, dan padaAHV-1.45
jarak
basal sekitarI
nm baru tercapai pada temperatur500-700
oC.
Sementara
AHV-1.86 masih
mampumempertahankan
jarak
basalnya
pada 1.68
nm
sampai temperatur700
'C.
Nampaknyamolekul-molekul
air
danion-ion hidroksil
yang terikat
dengan
ion-ion alumnir-rmhidroksitdalam ruang
antarlapisan vermikulit
belum
dibebaskan secara sempurna.Aluminiumhidroksi-vermikulit
fase 1.86 baru mengkerut secara sempurna pada temperatur 800'C.
Susunan
Kimia
Perlakuan
vermikulit
dengan
polimer
aluminiumhidroksi*
(larr-rtanLocron
2o/o)telah
meningkatkan kadaraluminium
dalam contoh
dan
menimbulkan
efekpengenceran terhadap unsur-unsur
lainnya dalam
lapisansilikat
AHV
yang
terbentuk
(Tabel
2).
Analisis
kimia
menunjukkan bahwa
jumlah
oksida-oksida
dalam AHV
berkisar
antara 84-85%.
Hal ini
berarti
bahwaaluminiurnhidroksi*
yang
menempati
ruang
antarlapisandalam
vermikulit
masih
mengandungsejumlah
molekul-molekul
air
danion-ion hidroksil yang belum
dibebaskan secara sempurna pada pemanasan300
"C
saat persiapancontoh
untuk
analisiskimia.
Dalam
AHV
masih
terlihat pula sejumlahkecil
ion-ion Ca2*, Na* danK*
yang mungkin terperangkapdan tidak dapat ditukar lebih lanjut
oleh polimer aluminiumhidroksi* pada saat pertukaran kation.um 0.2-0-6 um
[image:3.595.302.557.62.641.2]Li -Vermikulit
Gambar
1.
DifraktogramLi-Vermikulit
(a) dan Mg-Vermikulit(b)
Sebelum dan Setelah Perlakuan dengan Larutan Lo cron
2Yo(AHV:
Aluminiumhidroksi-Vermikul it, dpaT dalam nm)1".43
I
Ms-Vermiku1i.
#lu i,*
q
AHV;
<2 um
A}IV: 0.5-2.0 um
1-45
I
1-.42
I
\.44 t1
L .23
0.93
AHV: AHV :
lurnnl Tntttlt dtttr l-ittghtngtut, Vol. 7 No. 1,
April
2005: 6-10Tabel
l.
Jarak Basal (nm) Vermikulit dan Aluminiumhidroksi-Vermikulit setelah Tiga Jam Pemanasan pada Temperatur BerbedaTemperatur (oC) Suhu Kamar t05
Na-VermikLrlit AHV- 1.45
AHV- 1.86
1.21
1.45
I .88/ r .46
l.l9
r.40 r.86
I .02 1.34
1.84
0.98 098 0.98
1'02
0.98t.26ll.t
I
l.l0/0.98t.68 1.84
Keterangan: AHV-1.45: AHV fase 1.45 nm
AHV-1.86:AHV fase 1.86 nm
"l'abel
2.
SusunanKimia Vermikulit
Sebelumdan
Sesudah Perlakuan dengan Polimer Aluminiumhidroksi* (% berat contoh kering 300'C)
Vermikulit AHV-1.45
AHV-l.86Tabel
3.
SusunanKimi4
Senyawa dalam Ruang AntarlapisanAluminiumhidroksi-Vermikulit
(Jumlah
Ion
atall Molekul per Satuan Sel)AHV.I
45
AHV-I
86sio2 Al2or
Fe"Oq
FeO Mgo MnO
CaC)
Na2O K:O
45.5 8
lt.92
7.02
0.3 9
26.'76
0.08 0.05 5.76 0.09
3 5.50
2l .88 5.42 0.31
20.53 0.06 0.05 0.t3 0.06
33.96 25.69 5.25 0.22 19.36
0.05 0.03 0.1 I
0.04
2.53 6.07 4.20 2.40 4.06
3.52 9.05 2.7 t
2.57 3.34 AI
OH H:O
ouiAl
(oH+HrOyAl
.lumlah 97.65 83.94 84.7 1
Keterangan AtlV-1.45: AHV fase 1.45 nm AHV- I .86: AHV iase I .86 nm
Setelah perlakuan dengan
larutan
Locron
2%oyang
menyebabkan
terjadinya
pertukarankation, maka
sebagaipengganti
ion Na*
dalam
ruang
antarlapisan vermikulit
terdapat aluminium, molekul-molekul
air
dan
ion-ionhidroksil
yangjumlahnya
tidak
diketahui. Oleh
sebab ituuntuk
menghitung
rumus struktural
vermikulit
setelahperlakuan
(AHV),
maka
diasurnsikan
bahwa
perlakuan dengan larutan Locron 2%otersebuttidak
mengubah struktur lapisansilikat.
Dengan asumsi tersebut hubungan unsur-unsur dalam lapisansilikat tidak
berubah, sehingga denganbantuan
kadar
Si02
sebagai acuan,
jumlah
aluminium dalam lapisansilikat
dan ruang antarlapisan dapat dihitung secara terpisah. Selanjutnya karenamuatan lapisan
padastruktur
silikat
juga tidak
berubah,
maka
denganmemperhatikan persyaratan
netralitas
elektronjumlah
ionhidroksil yang terikat
dengan
ion-ion aluminium
dalarn ruang antarlapisanjuga
dapatdihitung. Terakhir
kadar air dalarn contoh yang dikeringkan pada 300'C
dapat dihitung sebagai perbedaandari
total
kadar oksida terhadap
100.Dengan cara demikian
susunan
kimia
senyawa
yang terdapat dalam ruang antarlapisanvermikulit
dapat dihitung (Tabel 3).Keterangan:AHV-l.45: AHV fase 1.45 nm AHV-1.86: AHV fase 1.86 nm
Pengembangan
jarak
basalAHV
menjadi 1.45 nm dan1.86
nm
nampaknya
terkait
dengan susunan
kirrriaaluminiumhidroksi* dalam ruang
antarlapisan vermikulit. PadaTabel
3
diperlihatkan bahwa
AHV-1.86
memiliki
komponen
aluminiumhidroksi.
(Al
danOH)
danjuga
rasioOH/AI yang lebih
besardibandingkan
komponen sejenis padaAHV-1.45.
Menurut Hsu
dan Bates(1964)
semakinbesar
rasio
OH/Al,
semakin besar
ukuran
polimeraluminiumhidroksi*
yang terbentuk
dan
semakin
kecil muatanpositif
per atom aluminium.KESIMPULAN
Pembentukan
aluminiumhidroksi-vermikulit (AHV)
dipengaruhi
oleh valensi kation dalam
ruang antarlapisanvermikulit.
Aluminiumhidroksi-vermikulit yang
dihasilkandari
Li-vermikulit
memiliki jarak
basal 1.86 nm, sedangkanAHV
dari Mg-vermikulit
memilikijarak
basal 1.45 nm. lonMgt* diikat lebih kuat
daripada
Li*
dalam
ruang antarlapisanvermikulit
sehingga menghambatlaju
difusialuminiumhidroksi*
pada
saat proses pertukaran
kation.Penurunan
laju difusi ini
menyebabkan
polimeraluminiumhidroksi* terpecah menjadi
spesiesyang
lebihkecil.
Analisis
kimia
menunjukkan
bahwa
AHV
yangmengembang menjadi 1.86 nm
memilikijumlah Al
dan OH sertarasio
OH/Al yang lebih
besardaripada
komponen [image:4.595.44.551.66.536.2]Pcntberthtkan dnn kttrttkteristikkrmia Alumuniumhidroksi Vermikulit (Iskandar)
UCAPAN
TERIMAKASIH
Ucapan
terimakasih disampaikan
kepada Deutscher Akademischer AustauschDienst yang telah
memberikan kesempatan kepadapenulis
untuk
melakukan
penelitiandalarn rangka program lViedereinladung
di
Institut
fuer Bodenkunde. Universitaet Hannover. Jerman tahun 2001.DAFTAR PUSTAKA
Barnhisel, R.l. and P.M. Bertsch. I989. Chlorites and hydroxyl interlal,ered vermiculite and smectite. 1n J.B. Dixon and S.B. Weed (eds). Minerals in Soil Environments. 2nd ed. Soil Sci. Soc. Am., Madison, Wisconsin: p:729-788.
Brindlel,.
G.W. and R.E.
Sempels.1997.
Preparation and propertiesof
some hydroxyl-aluminum beidellites. C/aysC lay
\liner..
12: 229-237 .Br1,'don.
J.
E.
andR. C.
Turner. 1972. The natureol
Kenya vermiculite andits
aluminum hydroxy complexes. C/ays(- lt.r' .\ I i ner.- 20: l - I l.
Chevalier. S.. R. Franck, J.-F. Lambert,
D.
Barthomeuf andtl.
Suquet. 1992. Stability
of
Al-pillared saponites: Evidencefbr disorganization during storage
in
air. Clay Miner.,27: 245-248.d'E,spinosa
de
la
Caillerie.
J.-8.
and J.J. Fripiat.
1991 ."Dealumination"
and
aluminum intercalation ol
vernr i c u I i tes. C I a.v s C I a.v I'l i n e r., 3 9 (3) : 27 0 -280.
Figueras. F . Z. Klapyta. P. Massiani, Z. Mountassir, D. Tichit. F.
Fa.jula. C. Goegoen, J. Bousquet and
A.
Auroux. 1990. Useof
competitiVeion
exchange
for
intercalation of
rnontmorillonite
with
hydroxyl aluminurn species. C/ays(- I try ll{ine r.. 38(3):257 -264.
Hallmark. C.T.. L.P. Wilding and N.E. Smeck. 1982. Silicon. 1n
Page et al. (eds). Methods of Soil Analysis. Part 2, Chemical and Microbiological Properlies, Agronomy Monograph No.
9
2''d ed.,A.L., Soil
Sci.
Soc.Amer. Inc.,
Madison, Wisconsin LlS A. 263 -2'73.I{ermann.
A.G.
1975. Praktikum der Gesteinsanalyse. Springer-Verlag. llerlin. Heidelberg.Hsu, P.H. and T.F. Bates. J964. Formation of hydroxy-alLrminLrm polymers by verrniculite. Soil Sci. Soc. ,1n.
Prot'.28
749-768.Hsu, P.H. 1992. Reaction
of
OH-Al-polimers with smectites anclverrniculites. C I ays C lar- ful i n e r.. 40(3 ) : 300-305.
lskandar und
H.
Gral von Reichenbach. 1993.Zur
Einlagerr.rng von Aluminiumhydroxo-Komplexen in Vermiculit. Berichte der Deutschen Ton- und Tonmineralgruppe e.l'.,
Beitrage zur Jahrestagung Hannover 9-
Il.
September 1992. Lahar', N., U. Shani, and J. Shabtai. 1978. Cross-linked smecrires.I.
Synthesisand
properties
of
hydroxyl-aluminunr-montmori llonite. C I ays C lay M ine r., 26(2): I 0'/ - I I 5.Matsuda,
T.,
H. Nagashima and E. Kikuchi. 1988. Physical anclcatalytic properties of smectite clays pillared by alLrmina in disproportionation
of
1.2,4-trimethylbenzena. App. Catol.. 45: l'71-182.Occelli,
M.L.,
S.D.
Landau
and
T.J.
Pinnavaia.
1987. Physicochemical propertiesof
delaminated cla1, cracking catalyst..J C ata 1., 104 :33 l -338.Occelli,
M.L.
and
D.H.
Finseth. 1986. Surf'ace and catalytic propertiesol
some pillared hectorites.J.
Catal., 99'. 316-326.Occelli, M.L. and R.M. Tindwa. 1983. Physicochemical properties
of
montmorillonite interlayered with cationic oxyaluminum pillars. C/ays C lay Mine r., 3l(l):
22-28.Rich.
C.l.
I968. Hydroxy interlayers in expansible Iayer silicates. Clays Clay Miner. l6: I 5-30.Schoonheydt, R.A and H. Leeman. 1992. Pillaring olsaponite in concentrated medium. Clay Miner. 27:249-252.
Schutz,
A., D.
Plee.F.
Borg, P. .lacobs,G.
Poncelet and J..1.Fripiat. 1987.
Acidity
and catalityc propertiesol
pillared montmorillonite and beidellite. -1n Proc.Int.
Clay Conl.. Denver 1985,L.G.
Schultz,H.
van
Olphenand
F.A.Mumpton,
eds.
Clay
Miner. Soc.,
Bloomington. Indiana:305-3 I 0.Veith. J.A. 1978. Selectivity and adsorption capacity of smectite and vermiculite for aluminium of varying basicity. Clays Clay Miner. 26( 1 ):45-50.
;