KAJIAN KEEFEKTIFAN BEBERAPA KOMPONEN
PENGENDALIAN RAMAH LINGKUNGAN
TERHADAP PENYAKIT PUSTUL BAKTERI KEDELAI
Oleh
SUSKANDINI RATIH DIRMAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOCOR
ABSTRAK
SUSKANDINI RATIH DIRMA WATI. Kaj ian Keefekti fan Beberapa Komponen Pengendalian Ramah Lingkungan terhadap Penyakit Pustul Bakteri Kedelai. Di bawah bimbingan BUD1 TJAHJONO, MEITY SURADJI SINAGA, DIDY SOPANDIE, dan RUSMILAH SUSENO.
Di Indonesia, pengendalian penyakit tanaman yang bersifat ramah lingkungan diperlukan untuk mendukung sistem pertanian berkelanjutan. Penyakit pustul bakteri merupakan penyakit penting yang mengakibatkan rendahnya produksi kedelai di Indonesia. Penyebab penyakit pustul bakteri adalah Xanthomonas axonopodrs pv.
glycrnes. Untuk mengendalikan penyakit pustul bakteri kedelai dilakukan suatu seri percobaan untuk mengevaluasi pengaruh kombinasi pola tanam dengan aplikasi bakteri biokontrol atau bakterisida botani terhadap keparahan penyakit dan produksi kedelai
Penelitian dilakukan di Laboratorium Bakteriologi Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian, Laboratorium Kimia Terpadu Fakultas Matematika dan Ilmu Pengetahuan Alam, Laboratorium Rekayasa Bioproses Pusat Penelitian Bioteknologi, dan Kebun Percobaan Cikarawang-Darrnaga, Institut Pertanian Bogor. Penelitian berlangsung dari bulan Juni 2000 hingga Desember 2002.
Hasil penelitian menunjukkan bahwa (1) Formulasi cair P. Jluorescens GI 34 maupun B. subtrlrs BBO 1 dalam molase 1% sarnpai dengan umur simpan 60 hari efektif menginaktivasi bakteri Xag karena mekanisme pembentukan senyawa antimikroba oleh P. f7uorescens GI 34 (siderofor, biosurfaktan, dan hidrogen sianida) dan R. subtrlzs BBOl (biosurfaktan), (2) Ekstrak daun matoa dalam forrnulasi air 20 % paling efektif menginaktivasi Xag karena kandungan asam galat (8,2 mg/g daun matoa) lebih tinggi dibandingkan dengan ekstrak daun mimba, daun kipahit, daun paku papila, daun sereh wangi, rimpang lengkuas merah, dan buah kelapa sawit, (3) Strategi pengendalian bempa kombinasi pola tanam tumpangsari kedelai-jagung dengan aplikasi bakteri biokontrol paling efektif karena dapat menurunkan laju infeksi pustul bakteri dari O,11 unit/hari menjadi 0,06 unit/hari di musim kemarau dan dari 0,13 unit/hari menjadi 0,07 unit/hari di musim penghujan, (4) Kombinasi pola tanam tumpangsari kedelai-jagung dan aplikasi 1). Jluorescens GI 34 dan B. subtrlis BBOl mempakan strategi pengendalian pustul bakteri yang paling efisien dengan memberikan keuntungan usahatani paling besar yaitu Rp1.765.000700/ha di musim kemarau dan Rp1.363.000,00/ha di musim penghujan.
ABSTRACT
SUSKANDINI RATIH DIRMAWATI. Studies on the Effectivity of Several Enviromental Friendly Pest Management Components to Bacterial Pustule on Soybean. Under the Guidance of BUD1 TJAHJONO, MEITY SURADJI SINAGA, DIDY SOPANDIE, and RUSMILAH SUSENO.
Ecological approach of plant disease management is needed to enhance the sustainable agriculture in Indonesia. Bacterial pustule disease has been known as an important soybean disease because of its potential to reduce soybean yield in Indonesia. The causal agent of the disease is Xunthomonus uxonopodzs pv. glycmes. To control the pustule disease, series of experiments were done to determine the effect of combination of the culture system and using biocontrol agents or botanical bactericide on the disease severity and yield of soybean.
The researches have been conducted at the Bacteriology Laboratory of Plant Pest and Disease Department, the Agriculture Faculty, the Chemistry Laboratory of Mathematics and Natural Science Faculty, the Bioprocess Engineering Laboratory of Biotechnology Research Centre and Cikarawang Experimental Station, Bogor Agricultural University. The works have been done from June 2000 until December 2002.
The results of this work showed that (I) the liquid formulation of P. fluorescens
GI 34 in molasses 1% retarded X a . pv glycznes up to 60 days after storage by the exudation of siderofor, hydrogen cyanida, and biosurfactant and that of B subtzlzs BBO 1 also retarded Xu. pv glycznes by the exudation of biosurfactant, (2) the matoa leaf extract with gallic acid 8.2 mg/g leaf fresh weight in the concentration of 20 % in water gave the highest retardation to the bacterial pustule, (3) the combination of intercropped system soybean-corn with the application of biocontrol agents gave the highest retardation effect : decreasing the infection rate from 0.11 unit/days to 0.06 unit/days in dry season and decreased the infection rate from 0.13 unit/days to 0.07 unit/days in wet season, (4) the combination of intercropped system soybean-corn with the application of biocontrol agents gave the highest income (Rp 1,765,000.00/ha in dry season and Rp 1,363,000.00/ha in wet season).
PERNYATAAN
Dengan ini saya menyatakan bahwa disertasi yang berjudul:
KAJIAN KEEFEKTIFAN BEBERAPA KOMPONEN PENGENDALIAN RAMAH LINGKUNGAN TERHADAP PENYAKIT PUSTUL BAKTERI KEDELAI merupakan hasil gagasan dan penelitian saya sendiri yang belum pernah digunakan
untuk mencapai suatu gelar akademik apapun di perguruan tinggi lain. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperi ksa kebenarannya.
Bogor, Mei 2004
KAJIAN KEEFEKTIFAN BEBERAPA KOMPONEN
PENGENDALIAN RAMAH LINGKUNGAN
TERHADAP PENYAKIT PUSTUL BAKTERI KEDELAI
Oleh
SUSKANDINI
RATIH
DIRMAWATIDisertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Kaj ian Keefektifan Beberapa Komponen Pengendalian Ramah Lingkungan terhadap Penyakit Pustul Bakteri Kedelai Nama Mahasiswa : Suskandini Ratih Dirmawati
Nomor Mahasiswa : 985056
Program Studi : Entomologi Fitopatologi
Menyetujui
1. Komisi Pembimbing
Dr. Ir. H. ~ $ d i Tiahiono. M.Agr
I Ketua ~ n ~ ~ o t a
Prof. Dr. Ir. Didv Sopandie, M.Aar Prof. Dr. Ir. Rusmilah Suseno, M.Sc
Angggota Anggota
Mengetal 2. Ketua Program Studi
Entomologi Fitopatologi
go(,a&k
-3<Ldf[d
Dr. Ir. Sri Hendrastuti Hidayat,RI WAYAT HIDUP
Penulis lahir di Mojokerto, 2 Mei 1961 merupakan puteri tunggal Bapak Sentausa Edhi Soewarso (alm.) clan Ibu Dodi Srimurti. Tahun 1973 penulis menyelesaikan Sekolah Dasar di SD Santo Yusup Semarang dan pada tahun 1976 menyelesaikan SLTP di SMP Negeri 1 Salatiga. Pada tahun 1980 penulis menyelesaikan SLTA di SMA Negeri 1 Salatiga.
PRAKATA
Dengan mengucapkan syukur kepada Allah S.W.T, penelitian tentang pengendalian penyakit pustul bakteri kedelai benvawasan lingkungan dapat diselesaikan. Revolusi hijau berhasil melepaskan bangsa Indonesia dari kelaparan, tetapi meninggalkan dampak negatif akibat penggunaan pestisida kimia secara tidak rasional diantaranya punahnya serangga non hama maupun mikroorganisme non patogen yang bermanfaat. Oleh karena itu sistem pertanian Indonesia saat ini hendaknya memperhatikan kembali ekosistem secara menyeluruh. Dalam pengendalian penyakit pustul bakteri ramah lingkungan telah dibuktikan bahwa pendayagunaan keanekaragaman hayati di lingkungan pertanian Indonesia dapat berperan efektif dan efisien. Agens biokontrol dan bakterisida botani yang dapat digunakan untuk pengendalian penyakit pustul bakteri berturut-turut adalah bakteri
Pseudornonas Jluorescens, Bacillus subtilis, daun matoa, daun paku papila, daun kipahit, daun sereh wangi, rimpang lengkuas merah, dan buah kelapa sawit.
Pada kesempatan ini ucapan terimakasih disampaikan dengan hormat kepada:
(1) Bapak Dr. Ir. H. Budi Tjahjono, M.Agr. selaku Ketua Komisi Pembimbing yang penuh kesabaran dan keikhlasan membimbing penulis sehingga akhirnya penulis menyelesaikan penelitian dan tugas belajar secara menyeluruh dengan senantiasa menghargai waktu kehidupan serta menyikapinya dengan bijaksana.
(3) Bapak Prof Dr. Ir. Didy Sopandie, M.Agr. selaku Anggota Komisi Pembimbing yang membimbing penelitian ini dengan seksama.
(4) Ibu Prof Dr. Ir. Rusmilah Suseno, M.Sc. sebagai Anggota Komisi Pembimbing yang membimbing penelitian dan memberikan pengayoman atas diri penulis selama penulis tugas belajar .
Kepada Ibu Ir. Ivone 0. Sumaraw, M.Si. dan Ibu Ir. A. A.Nawangsih, M.Si di Laboratorium Bakteriologi Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian IPB disampaikan terima kasih atas dukungan moral dan semangat kepada penulis. Ucapan terima kasih juga disampaikan kepada teknisi di laboratorium Pangan dan Gizi, Laboratorium Rekayasa Bioproses, Laboratorium Kimia Terpadu, dan Kebun Percobaan Cikarawang-Darmaga, IPB yang membantu menyelesaikan penelitian ini.
Secara pribadi diucapkan terima kasih kepada Ibu Dra. Hj. Nurlaila N.Q. Mei Tientje, M.Pd. atas wawasan yang disampaikannya. Kepada suami Dr. Ir. H.
Tubagus Hasanudin, M.S. dan keempat anakku Ratu Nurina Risanty, Tubagus Arya Abdurachman, Tubagus Adytia Syarief Hidayat, dan Ratu Annisa Aulia Dien Safitrie, serta Ibunda Dodi Srimurti diucapkan terima kasih yang tiada tara atas keikhlasannya menerima semua perlakuan buruk maupun menyenangkan dari pribadi penulis selama penulis tugas belajar. Pada akhirnya, semoga tulisan ini bukan sekedar menjadi bahan pustaka tetapi dapat diwujudkan dalam pengendalian penyakit kedelai.
DAFTAR IS1 Halaman . . . ABSTRAK . . . ABSTRACT . . . RIWAYAT HIDUP . . . PRAKATA . . . DAFTAR IS1 . . . DAFTAR TABEL . . . DAFTAR GAMBAR . . . DAFTAR LAMPIRAN ... PENDAHULUAN
Latar Belakang ... . .
Tujuan Penelltian . . . Hipotesis Penelitian ...
... TINJAUAN PUSTAKA
... Penyakit Pustul Bakteri
PseudomonasJluorescens Migula sebagai Agens Biokontrol . . . Hucillus subtzlis (Ehrenberg) Cohn sebagai Agens Biokontrol ... Komponen Bioaktif Tanaman sebagai Bakterisida Botani . . .
... BAHAN DAN METODE PENELITIAN
. . . Waktu dan Tempat Penelitian
. .
. . . Metode Penelitian
Percobaan I . Evaluasi Keefektifan Forrnulasi Bakteri Biokontrol dan Identifikasi Senyawa Penghambat terhadap Penyakit Pustul Bakteri . . . I . I . Isolasi dan Identifikasi Bakteri Penyebab Pustul ... 1.2. Isolasi dan Identifikasi Bakteri Calon Biokontrol . . . 1.3. Pengujian Inaktivasi Xug in vitro oleh Filtrat dan
... Suspensi Bakteri Calon Biokontrol
1.4. Analisis Senyawa Inaktivasi dalam Filtrat Bakteri
Calon Biokontrol . . . 24 1.5. Formulasi Bakteri Biokontrol . . . 2 6 Percobaan 11. Evaluasi Keefektifan Bakterisida Botani Asal
Enam Jenis Tanaman dan Analisis Senyawa
Penghambat terhadap Penyakit Pustul Bakteri . . . 2 8 11. I. Ekstraksi Bahan Bakterisida Botani . . . .. 28 11.2. Pengujian Inaktivasi Xug invitro oleh Bakterisida Botani 2 9 11.3. Analisis Asarn Galat dalam Bakterisida Botani . . . 29
Percobaan III. Analisis Keefektifan dan Keefisienan Pengendalian Pustul Bakteri dengan Kombinasi Pola Tumpang sari atau Monokultur dan Aplikasi Bakteri Biokontrol atau Bakterisida Botani . . . 30
HASIL DAN PEMBAHASAN . . .
.
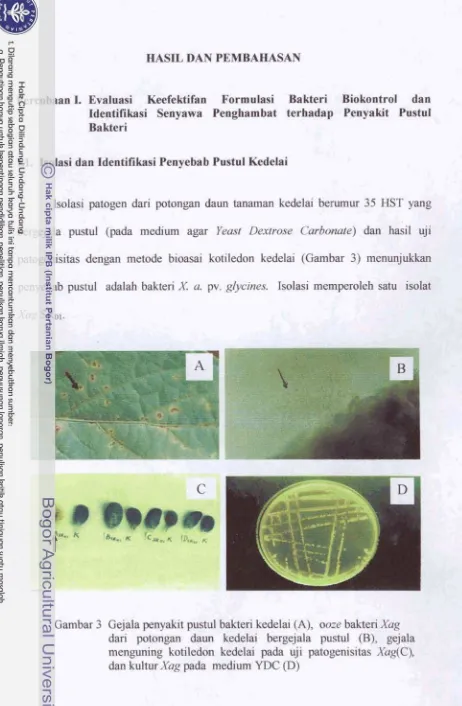
. . . 37 Percobaan I. Evaluasi Keefektifan Formulasi Bakteri Biokontrol danIdentifikasi Senyawa Penghambat terhadap Penyakit Pustul
Bakteri . . . 37 I. 1. Isolasi dan Identifikasi Penyebab Pustul Kedelai . . . .. 37 1.2. Isolasi dan Identifikasi Bakteri Calon Biokontrol . . . 38 1.3. Pengujian Inaktivasi Xag oleh Filtrat dan Suspensi
Bakteri Calon Biokontrol . . . 39
1.4. Analisis Senyawa Inaktivasi Xug dalam Filtrat Biokontrol . . . 44 1.5. Formulasi Bakteri Biokontrol selama Penyimpanan . . . 5 1
Percobaan 11. Evaluasi Keefektifan Bakterisida Botani Asal Enam Jenis Tanaman dan Analisis Senyawa Penghambat
terhadap Penyakit Pustul Bakteri . . . .. 59
Percobaan 111. Analisis Keefektifan dan Keefisienan Pengendalian Pustul Bakteri dengan Kombinasi Pola Turnpangsari atau
Monokultur dan Aplikasi Bakteri Biokontrol atau
KESIMPULAN ... . . . SARAN
DAFTAR PUSTAKA ... LAMPIRAN . . .
DAFTAR TABEL
Halaman
. . .
1. Sifat bakteri saprofit berfluoresensi 9
2. Deskripsi enam bahan tanaman yang dideterminasi sebagai bakterisida . . . . 18 . . .
3. Jenis metabolit antimikroba yang menginaktivasi Xug. 50
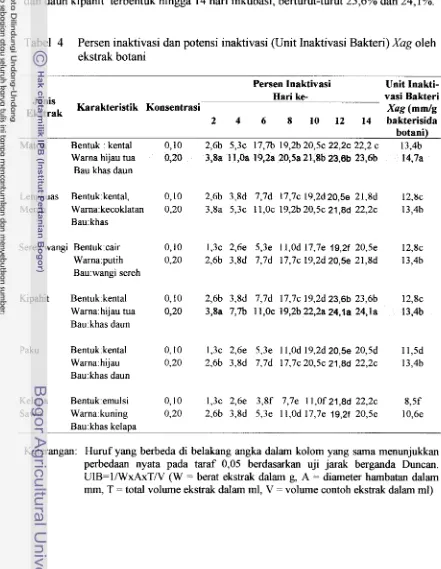
4. Persen inaktivasi dan potensi inaktivasi (Unit Inaktivasi Bakteri) Xug oleh
ekstraks botani ... 62 ...
5. Kuantitas asam galat dalam ekstrak botani yang menginaktivasi Xug 64 6. Kuantitas asam galat daun kedelai sehat, daun kedelai sakit bergejala pustul,
daun kedelai sakit yang dikendalikan dengan ekstrak botani ... 73 7. Pendapatan usahatani pola tanam tumpangsari atau monokultur kedelai
dikombinasikan dengan agens biokontrol, bakterisida botani atau bakterisida . .
DAFTAR GAMBAR
1. Hubungan jalur biosintesis metabolisme primer dan sekunder tumbuhan ... 15 2. Kategori serangan
Xa.
pv. glycines ... 34 3. Gejala penyakit pustul bakteri, ooze bakteriXcrg
dari potongan daun kedelaibergejala pustul, gejala menguning kotiledon kedelai pada uji patogenisitas ...
Xag,
dan kultur pada medium YDC4. Koloni bakteri pada medium agar darah 0,4% , koloni bakteri berwarna ... kuning kehijauan pada medium agar King's B
5. Tidak terbentuk zone inaktivasi
Xag
oleh suspensi sel bakteri biokontrol6 jsi, pembentukan zone inaktivasiXag
oleh suspensi bakteri biokontrol48 jsi,pembentukan zone inaktivasi
Xag
oleh filtrat bakteri biokontrol 24 jsi ... 40 6. Persen inaktivasiXag
yang dibentuk oleh filtrat maupun suspensi bakteri...
biokontrol 42
7. Absorbansi yang menunjukkan surfaktin dalam filtrat B.subtilisATCC2 1332,
H. subtilis BBO 1 ,absorbansi filtrat P. Jluorescens GI34 dan SL03 yang tidak
mengandung surfaktin ... 45 8. Absorbansi senyawa siderofor P.fluorescens GI 19, GI34, SLO 1, SL03, dan
X u ... 4 8 9. Hidrogen sianida yang diproduksi oleh P. Jluorescens GI34 mengubah asam
pikrat benvarna kuning pada kertas saring menjadi kecoklatan, asam pikrat berwarna kuning pada kertas saring sebagai pembanding ...
10. Puncak absorbansi yang menunjukkan kualitas dan kuantitas biosurfaktan B. subtilis BBO 1 dalam forrnulasi molase 1 % setelah 7 hari penyimpanan dan
...
60 hari penyimpanan 52
I I . Pengaruh lama penyimpanan pada suhu 2 7 ' ~ dan kelembaban 80% terhadap
tegangan pertnukaan formulasi agens biokontrol ... 5 3
12. Pertumbuhan bakteri biokontrol dalam molase 1% dan limbah cair tahu pada ...
suhu 2 7 ' ~ dan kelembaban 80% 57
14. Beberapa jenis tanaman yang digunakan sebagai bakterisida botani.. . . 60 15. Uji inaktivasi Xug pada 24 jsi dan 96 jsi . . . 6 1 16. Potensi inaktivasi Xug oleh ekstrak botani . . . .. 63 17. Laju infeksi pustul bakteri karena pengaruh kombinasi aplikasi bakteri
biokontrol dan pola tanam kedelai . . . . . . ... 69 18. Laju infeksi pustul bakteri karena pengaruh kombinasi aplikasi bakterisida
botani dan pola tanam kedelai.. . . 70 19. Populasi bakteri biokontrol di pemukaan daun kedelai . . . 72 20. Laju infeksi pustul bakteri karena pengaruh cara aplikasi agens pengendalian
dalam musim kemarau dan penghujan . . . 74 2 1. Produksi biji kedelai pada interaksi pola tanam kedelai dan agens pengendalian 77 22. Nilai persentase terhadap biaya pendapatan usaha tani, dan R/C berbagai
DAFTAR LAMPIRAN
Halaman 1. Tata letak petak percobaan keefektifan pengendalian pustul bakteri
dengan kombinasi pola tumpangsari atau monokultur dan aplikasi
bakteri biokontrol atau bakterida botani . ... .. .. .. ... ... ... .... ... .. ... .. ... .. .. ... .. 2. Beberapa hasil pengujian sifat fisik kimia bakteri biokontrol ... 3. Persen Inaktivasi Xug oleh filtrat bakteri biokontrol ... ... ... .. .. .. ... . 4. Persen Inaktivasi Xug oleh suspensi bakteri biokontrol .... ... ... ... 5. Keadaan formulasi cair bakteri biokontrol selama penyimpanan . . . 6. Komposisi kimia molase dan limbah cair tahu yang digunakan sebagai
bahan pembentuk formulasi cair bakteri biokontrol ... ... ... .. ... ... 7. Rata-rata keadaan cuaca di kebun percobaan Cikarawang, Bogor
(Juli 2000 - Januari 2002) ... 8. Analisis sifat kimia dan fisika tanah tempat penanaman kedelai di
kebun percobaan Cikarawang, Bogor ... ... ... . 9. Analisis sidik ragam pengaruh pola tanam, jenis bakteri biokontrol,
cara aplikasi, dan interaksinya terhadap laju infeksi pustul bakteri pada 35, 45, dan 55 HST ... ... ... 10. Analisis sidik ragam pengaruh pola tanam, jenis bakterisida botani,
cara aplikasi, dan interaksinya terhadap laju infeksi pustul bakteri
pada 35, 45, dan 55 HST ... ... .. .. .. ... ... ... .. .. ... 100 1 1. Rerata laju infeksi pustul bakteri pada kombinasi aplikasi bakteri
biokontrol dengan pola tanam kedelai, musim kemarau 20001200 11
2002 . . . , . . . ., . . . .. . . , . . . .. . . .. . , . . . 101 12. Rerata laju infeksi pustul bakteri pada kombinasi aplikasi
bakteri biokontrol dengan pola tanam kedelai, musim penghujan 20001
200 112002.. . . 102 13. Rerata laju infeksi pustul bakteri pada kombinasi aplikasi bakterisida
botani dengan pola tanam kedelai, musim keinarau 20001200 112002 . . . 103 14. Rerata laju infeksi pustul bakteri pada kombinasi aplikasi bakterisida
botani dengan pola tanam kedelai, musim penghujan 20001200 112002 .. 104
15. Laju infeksi pustul bakteri karena pengaruh interaksi pola tanam ... dan jenis bakteri biokontrol
16. Pengaruh interaksi aplikasi agens biokontrol dan pola tanam
kedelai terhadap populasi agens biokontrol pada daun kedelai ... 17. Laju infeksi pustul bakteri karena pengaruh cara aplikasi agens
... pengendali..
19. Pengaruh kombinasi aplikasi bakteri biokontrol atau bakterisida botani dengan pola tanam kedelai terhadap jumlah polong, persen polong hampa,
... serta produksi kedelai
19. Analisis pendapatan usahatani monokultur kedelai per ha tanpa pengendalian penyakit pustul bakteri ... 20. Analisis pendapatan usahatani monokultur kedelai per ha ramah lingkungan
... penyakit pustul bakteri
20. Analisis pendapatan usahatani monokultur kedelai per ha dengan
... streptomisin sulfat
22. Analisis pendapatan usahatani tumpangsari kedelai-jagung per ha ramah ... lingkungan
23. Analisis pendapatan usahatani tumpangsari kedelai-jagung per ha tanpa pengendalian penyakit pustul bakteri ... 24. Analisis pendapatan usahatani tumpangsari kedelai-jagung per ha
PENDAHULUAN
Latar Belakang
Kedelai (Glyczne max L. Merr.) merupakan sumber protein nabati yang penting bagi penduduk Indonesia. Departemen Pertanian (2002) menyatakan produksi kedelai di Indonesia tahun 200 1 dan 2002 berturut-turut sebanyak 1,38 dan
1,O 1 juta ton atau produktivitas rata-rata 1,2 tonlha. Menurut Badan Pusat Statistik
(2002), kebutuhan kedelai untuk konsumsi penduduk dan pakan ternak di Indonesia pada tahun 2002 sebanyak 3,27 juta ton. Kesenjangan kebutuhan kedelai yang terjadi dipenuhi dengan impor kedelai terutama dari Amerika dan Taiwan. Setiap tahun Indonesia mengimpor kedelai sebanyak 1,6 juta ton. Sejak krisis ekonomi pada pertengahan 1997 dan naiknya nilai dolar Amerika terhadap rupiah maka kebijakan mengimpor yang menghabiskan dana sebesar 5 trilyun rupiah per tahun (harga kedelai per kg adalah Rp 3500,OO) perlu dipertimbangkan.
Kebutuhan kedelai belum dapat terpenuhi oleh produksi kedelai nasional karena berbagai kendala, diantaranya masalah hama dan penyakit di pertanaman kedelai. Salah satu penyakit yang dapat mengurangi produksi di berbagai areal pertanaman kedelai di Indonesia adalah pustul bakteri yang disebabkan oleh
Xanthomonas axonopodz.~ pv. glycznes ( X d . Machmud (1 990), Aini ( 1 992), Rahayu
Sinclair dan Backman (1989) mengemukakan bahwa taktik pengendalian penyakit pustul bakteri yang dianjurkan diantaranya penanaman varietas kedelai
resisten, benih sehat, dan penggunaan bakterisida kimia. Namun demikian masing- masing taktik pengendalian tersebut memiliki kendala apabila dilakukan di
lapangan.
Bakteri Xug mempunyai banyak stru~n yang masing-masing menunjukkan genotip dan virulensi yang berbeda-beda dan telah dibuktikan melalui analisis sidik jari DNA (Rukayadi et u1. 1999). Patogen yang mempunyai banyak stru~n dan perkembangan penyakitnya tergolong berbunga majemuk seperti halnya pustul bakteri tidak dapat dikendalikan dengan penggunaan satu varietas kedelai dengan daya tahan vertikal.
disebabkan oleh Xanthornonas campestrw pv. oryzue (Tjahjono 2000, komunikasi pribadi). Selain hawar bakteri padi, penyakit pustul bakteri daun kedelai juga dilaporkan dapat dikendalikan dengan bakteri P.~eudomonas ,fluorescens B29 asal daun kedelai. Pengendalian dengan suspensi Pf B29 dapat menekan keparahan penyakit pustul bakteri dari 20,44 hingga 23,66 % bergantung kepada waktu aplikasi. Suspensi P j B29 yang diaplikasikan sebelum inokulasi Xag menurunkan keparahan penyakit 20,44 %, sedangkan Pf B29 yang diaplikasikan bersama-sama dengan Xug
menurunkan keparahan penyakit 23,66 %. Lama bertahannya Pf' B29 pada permukaan daun kedelai yang diaplikasikan dengan campuran xantan gum bertumtan
4 dan 9 hari setelah penyemprotan di musim kemarau dan penghujan (Nawangsih 1997). Kenyataan ini mengindikasikan bahwa keefektifan pengendalian dengan suspensi I'J B29 saja belum cukup, oleh karena itu keefektifan suspensi hams ditingkatkan lagi.
Selain dengan aplikasi agens biokontrol, pengendalian penyakit tanaman dapat juga dilakukan dengan memanfaatkan ekstrak tumbuhan sebagai bakterisida botani. Menurut Harborne (1987), senyawa fenolik yang terkandung dalam tumbuhan merupakan antibakteri yang efektif. Bakterisida botani yang sering digunakan untuk pengendalian penyakit tanaman adalah mimba (Azadzrachta zndzca
Juss) dengan memanfaatkan bagian daun, daging buah, biji, kulit batang, dan akar. Agens biokontrol atau bakterisida botani yang digunakan dalam pengendalian penyakit tanaman perlu dibuat dalam formulasi yang tidak toksik dan mendukung pertumbuhan tanaman sekaligus efektif mengendalikan organisme pengganggu
supaya agens biokontrol atau bakterisida botani terpilih sebagai bahan pengendalian penyakit tanaman adalah agens biokontrol atau bakterisida botani hams masih efektif selama 18 bulan dalam formulasi. Menurut Suastuti (1 998) medium cair yang terdiri atas glukosa dan garam anorganik berupa NH4N03, KH2P04, FeS04.7H20, serta MgS04.H20 penting untuk stabilisasi metabolisme bakteri yang dibiakkan di
dalamnya.
Pengaruh pola tanam tumpangsari terhadap produksi tanaman telah banyak diteliti, tetapi pengaruhnya terhadap keparahan penyakit tanaman masih belum konsisten. Lanter (1990) dan Bodreau et al. (1992) menyatakan bahwa penyakit bercak daun bersudut pada buncis yang disebabkan oleh cendawan Phaeosarropsrs grweolu lebih rendah intensitasnya pada pola pertanaman tumpangsari buncis dan jagung dibandingkan dengan monokultur buncis. Tanaman jagung menghalangi
penyebaran dan memerangkap spora P. grrseola.
Informasi ini penting untuk mengkaji beberapa strategi pengendalian penyakit pustul bakteri yang memprioritaskan penggunaan agens biokontrol atau bakterisida botani dalam formulasi yang efektif dan efisien dikombinasikan dengan pola tanam kedelai. Dengan strategi ramah lingkungan maka penggunaan bakterisida kimia yang tidak mendukung kelestarian ekosistem pertanian dapat dihindari.
Tujuan Penelitian
( 1 ) Mengevaluasi keefektifan formulasi bakteri biokontrol dan mengidentifikasi senyawa penghambat terhadap penyakit pustul bakteri.
( 2 ) Mengevaluasi keefektifan bakterisida botani asal enam jenis tanaman dan menganalisis senyawa penghambat terhadap penyakit pustul bakteri.
( 3 ) Menganalisis keefektifan dan keefisienan strategi pengendalian penyakit pustul bakteri berupa kombinasi pola tumpangsari atau monokultur dengan aplikasi bakteri biokontrol atau bakterisida botani.
Hipotesis Penelitian
( I ) Tingginya keeefektifan penghambatan formulasi cair bakteri biokontrol terhadap pustul bakteri berbeda-beda karena senyawa penghambat yang dihasilkan masing-masing bakteri biokontrol berbeda.
( 2 ) Tingginya keefektifan penghambatan enam jenis bakterisida botani terhadap pustul bakteri berkaitan dengan kandungan asam galat dalam bakterisida botani.
TINJAUAN PUSTAKA
1. Penyakit Pustul Bakteri
Penyakit pustul bakteri disebabkan oleh Xanthomonas uxonopod~.~ pv.
glycmes (Nakano) Dye Vauterin (Xag). Bakteri Xag berukuran 0,5-0,9 x 1,4-2,3 pm, berbentuk batang, memiliki satu flagel polar dan merupakan bakteri Gram negatif. Bakteri Xag dapat mencairkan gelatin dalam waktu 6 hari, membentuk asam sitrat dari arabinosa, glukosa, manosa, selobiosa, trehalosa, dan sukrosa dalam 2 hari, menguraikan protein susu dalam 13 hari, menghidrolisis pati dalam 2 hari, serta masih dapat tumbuh pada suhu 36" C. Sifat fisik yang mudah diamati ialah bentuk permukaan koloni mucold, sirkuler dengan tepi lembut yang cembung dan benvarna kuning pada agar yeast dextrose carbonate (YDC) (Moffett dan Croft 1983, Schaad dan Stall 1988).
kedelai yang gugur prematur menyebabkan produktivitas tanaman kedelai menurun berkaitan dengan jumlah polong hampa yang tinggi (Sinclair dan Backman 1989).
Gejala pustul bakteri berbeda dengan pustul karat yaitu pustul bakteri terdapat pada daun-daun muda pada bagian atas tanaman, sedangkan pustul karat terdapat mula-mula pada daun-daun tua di bagian bawah lalu berkembang ke daun yang lebih muda di bagian atas. Pada permukaan bawah helai daun kedelai yang bergejala pustul karat yang disebabkan oleh cendawan Phakopsora pachyrlzzz Syd. terdapat urediosorus yang tampak seperti gumpalan tanah benvarna coklat yang terasa kasar jika diraba (Hartman et a/. 1999).
Stadium kritis tanaman kedelai terhadap bakteri pustul yaitu 40 hari setelah tanam. Gejala pustul muncul pada daun muda dan gejala semakin parah pada kedelai berumur 60 hari setelah tanam terutama pada saat pengisian polong (Semangun 1990). Inokulasi dengan cara penyemprotan suspensi Xag berkerapatan 10' CFUIml pada daun kedelai berumur 25 hari setelah tanam menunjukkan bahwa periode inkubasi bervariasi antara 8 hingga 27 hari bergantung kepada ketahanan varietas kedelai. Suhu dan kelembaban udara relatif yang optimum selama masa inkubasi adalah 29' C dan 89 % (Dirmawati 1996).
kedelai yang dibenamkan minimum 15 cm di dalam tanah selama satu bulan. Menurut Sinclair dan Backman (1992), di Amerika Serikat bakteri pustul kedelai dilaporkan menyerang gulma Brunnichza cirrhosa Gaertn.
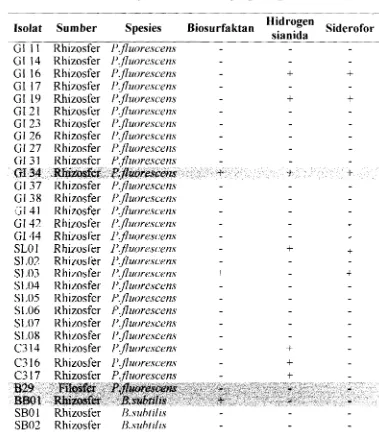
2. Pseudomonasfluorescens Migula sebagai Agens Biokontrol
P.seudomona.s fluorescens Migula. merupakan bakteri saprofit seperti halnya
/-'. uerugmosa P. putzda, P. chlororuphw, dan P. aureofaczens. Sifat fisik dan kimia bakteri saprofit berfluoresensi disajikan pada Tabel I . Beberapa peneliti melaporkan bahwa P. JEuorescens dapat digunakan sebagai agens biokontrol berbagai penyakit tanaman. Menurut Fravel et a/. (1998), I-'. ,fluorescens A506 yang diformulasikan dalam bentuk tepung dan secara komersial dikenal dengan merek dagang Blight Ban A506 efektif mengendalikan penyakit Erwmza amylovora pada buah apel, pir, kentang, tomat, dan stroberi. Formulasi suspensi P. fluorescens A506 dengan merek dagang Victus dinyatakan efektif mengendalikan I-'. tolu,~zl pada jamur merang.
Mekanisme P. fluorescens mengendalikan penyakit tumbuhan diantaranya dengan memproduksi siderofor, hidrogen sianida, dan antibiotik pirolnitrin, pyoluteorin serta 2,4-diasetilfluoroglusinol. Antibiotik 2,4-diasetilfluoroglusinol diproduksi P. ,fluore.scen.s P f 5 pada medium yang mengandung glukosa. Pada medium yang mengandung gliserol, bakteri ini tidak membentuk antibiotik 2,4- diasetilfluoroglusino1 ( Rodriguez dan Pfender 1997). Bakteri P. ,fluore.scens
Tabel 1 . Sifat bakteri saprofit berfluoresensi
Saprofit Pengujian
1'. aeruginou P. f1uorescen.s P. cl~lororaphrs P. aureofaciens P, putzda
-
Pembentukan levan
-
+
+
+
-Pencairan gelatin Tulnbuh pada suhu 4°C Tumbuh pada suhu 4 1 "C Penggunaan sumber karbon
D-galaktosa Trehalosa Butirat Sorbitol
[image:26.747.29.594.106.448.2]Pigrnen pioverdin terbentuk pada medium King's B (Schaad 1988). Pigrnen pioverdin merupakan molekul dengan berat 400-2000 dalton yang tidak larut dalam kloroform, tetapi larut dalam air. Senyawa pioverdin mengikat ion ~ e ) ' (Abdallah
199 1, Weisbeek dan Gerrits 2000).
Siderofor pada mikroorganisme atau tumbuhan berfungsi untuk pengambilan unsur besi dalam tanah yang pada umumnya terikat pada batu-batuan. Kelarutan ion besi di tanah yang dapat dimanfaatkan oleh organisme hanya 10-l8 M (Weisbeek dan Gerrits 2000). Menurut Hemming (l990), konsentrasi ion besi yang dapat larut dari mineral Fe(OH)3 dalam tanah 2 x 1
o-)'
M.Di lain pihak, semua makhluk hidup memerlukan ion ~ e ) + untuk pertumbuhan sel. Unsur besi berfungsi sebagai kofaktor enzim metabolisme dalam makhluk hidup. Tanaman membutuhkan ion besi 1 0 ' ~ hingga M, sedangkan mikroorganisme memerlukan lo-' hingga lo-' M. Tukey (1 990) melaporkan bahwa ion besi yang terkandung dalam eksudat tanaman sebanyak M.
Bakteri P. putida WCS358 membentuk senyawa siderofor yang disebut pseudobaktin. Pseudobaktin adalah senyawa kuinol yang dirangkaikan oleh rantai oligopeptida. Panjang rangkaian serta komposisi oligopeptida bervariasi dan menjadi karakteristik pembeda pseudobaktin. Pengikatan ion besi dijembatani oleh senyawa katekolat, hidroksamat, atau gabungan antara hidroksamat dan asam hidroksi aspartik. Selanjutnya setelah bakteri mengikat ion Fe3+, konsentrasi Fe3+di dalam sel selalu dijaga.
bakteri ditumbuhkan pada medium dengan kandungan ion ~ e " terbatas. Pengaturan ion besi yang dibutuhkan bakteri dikendalikan oleh gen Fur yang terdapat dalam sitoplasma. Menurut Litwin et al. (1993) dalam Weisbeek dan Gerrits (2000), gen Fur juga berperan dalam virulensi patogen.
Neilands dan Nakamura (1991) menyatakan bahwa molekul FeC13 sebanyak
0,l hingga 5,O pM per ml medium pertumbuhan dapat menghambat pembentukan
siderofor. Namun unsur sebanyak 0,03 pM per ml medium tumbuh memicu
pembentukan siderofor (dapat diamati pada kisaran panjang gelombang 400 hingga 600 nm). Menurut Scher dan Baker (1982), siderofor yang berupa katekol hidroksamat dalam filtrat bakteri dapat dideteksi dengan panjang gelombang 4 10 nm.
Menurut Mount dan Lacy (1982), pioverdin yang diproduksi oleh P.
jluorescens B 10 bersifat antibiotik terhadap Fusarzum spp. Neilands dan Nakamura ( 199 1 ) menyatakan bahwa siderofor pioverdin atau pseudobaktin yang diproduksi oleh P. jluorescens WCS374, P. Jluorescens ATCC 13525, dan P.Jluorescens 17400 adalah kromoforpeptida. Kromoforpeptida siderofor adalah struktur seperti membran yang mengandung pigrnen dan mengikat mineral besi. Menurut Matzanke (1991), kromoforpeptida siderofor yang diproduksi oleh I'.~eudomonas spp. adalah gabungan katekolat dan hidroksamat yaitu Tris N metiltioformohidroksamat yang dapat mengikat dua molekul Fe3+ Di lain pihak, senyawa Tris N metilformohidroksamat
Abdallah (199 1) menyatakan bahwa siderofor yang disebut pioverdin atau pseudobaktin diekskresikan ke luar sel oleh Pseudomonas spp. untuk mengikat ion ~e"dan mentranspornya ke dalam sel. Pioverdin dibentuk setelah inkubasi selama 40 jam yaitu pada fase stasioner.
Selain siderofor, Alstrom dan Burns (1989) menyatakan bahwa P.
fluorescens dapat memproduksi metabolit volatil diantaranya hidrogen sianida. Jumlah hidrogen sianida yang diproduksi P. fluorescens CHAO dalam kultur cair selama 36 jam kultivasi adalah 37 nmollml. Voisard et a/. (1989) melaporkan bahwa hidrogen sianida yang diproduksi oleh P. fluorescens CHAO dapat menekan infeksi
7'hreluvropsis baszcola pada akar tembakau, tetapi tidak meracuni akar tembakau.
3. Bacillus subtilis (Ehrenberg) Cohn sebagai Agens Biokontrol
Bacillus subtilis merupakan bakteri Gram positif yang membentuk spora. Spora berfungsi untuk bertahan hidup antara lain pada suhu lingkungan 70' hingga 100' C. Pelczar dan Chan (1988) menyatakan bahwa resistensi B. subtilis terhadap panas hilang jika bakteri disterilisasi dengan panas lembab maupun kering. Spora tidak tahan terhadap sterilisasi dengan panas lembab bersuhu 100" C selama 2 jam, sedangkan jika disterilisasi dengan panas kering bersuhu 11 5" C memerlukan waktu 40 menit.
diinokulasi B. suhtilis strain virulen (isolat VS) pada suhu 30-35" Can kelembaban udara relatif 98 % akan menunjukkan busuk berlendir 5 hari setelah inokulasi.
Sel H. suhtilis berbentuk batang, berukuran 0,3-2,2 x 1,2-7,O pm . dan mempunyai flagel peritrikus (Pelczar dan Chan 1988). Bakteri ini dapat membentuk endospora yang berbentuk oval di bagian sentral sel. Bakteri ini dapat tumbuh pada suhu 4 5 ' ~ ~ pH 5-7, NaCl 7 %, menghidrolisis pati, serta membentuk asam sitrat dari karbohidrat glukosa, arabinosa, manitol, dan silosa (Leary dan Chun 1988).
Bakteri B. subtili,~ yang bersifat antagonis mampu menekan pertumbuhan mikroorganisme lain karena memproduksi antibiotik berupa lipopeptida yang disebut basitrasin dengan mekanisme merusak membran sel bakteri (Leary dan Chan 1988). Jenis metabolit sekunder lain yang diproduksi B. suhtilis adalah biosurfaktan yang disebut surfaktin atau subtilisin. Surfaktin merupakan lipopeptida siklik yang
berfungsi menurunkan tegangan permukaan air dan juga bersifat antibiotik (Hommel dan Ratledge 1993, Desai dan Desai 1993).
Menurut Mulligan dan Gibbs (1993), produksi optimum surfaktin B.subtilis
dipengaruhi oleh komposisi medium tumbuh. Setiap liter medium pertumbuhan dengan komposisi glukosa 4 %, amonium nitrat 0,4 %, dan Fe SO4 0,32 mM meningkatkan produksi surfaktin dari 0,O g menjadi 8,O g selama 20 hingga 40 jam inkubasi. Produksi surfaktin dipengaruhi oleh jumlah minimum zat besi di dalam
4. Komponen Bioaktif Tanaman sebagai Bakterisida Botani
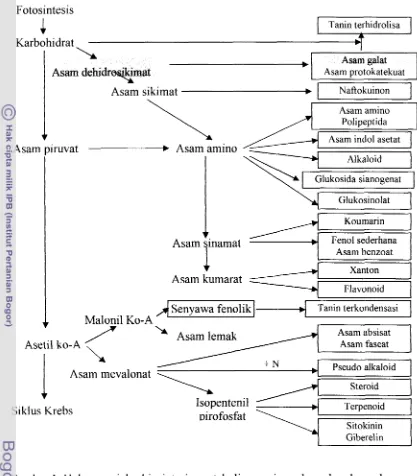
Fotosintesis atau fiksasi karbon dioksida merupakan proses biosintesis karbohidrat dalam tumbuhan berhijau daun. Karbohidrat merupakan salah satu bahan awal atau prekursor metabolisme sekunder. Metabolit sekunder adalah senyawa intermediet yang diproduksi dalam jumlah sedikit dan tidak diperlukan untuk fungsi pertumbuhan normal tanaman. Metabolit sekunder berfungsi sebagai antimikroba atau penolak serangga. Selama kondisi tanaman tidak menguntungkan karena terdapat stimuli lingkungan atau mikroba, maka jumlah metabolit sekunder meningkat dan mungkin tetap diproduksi setelah kondisi membaik. Metabolit yang berupa senyawa berbobot molekul rendah ini terakumulasi di dalam tanarnan (Sastrohamidjojo 1996, Vickery dan Vickery 198 1). Gambar 1 menunjukkan hubungan antara jalur metabolisme primer dan sekunder sehingga mengarah pada produksi komponen bioaktif tanaman, seperti halnya asam galat.
[image:31.530.61.471.71.721.2]Fotosintesis
4
[ Tanin terhidrolisa1
Karbohidrat -
\
Asam galatAsam dehidrw&pat Asam protokatekuat
Asam sikimat
.
1
[
Naflokuinon\ I 1
I
Asam aminoAsam indol asetat Asam piruvat
Alkaloid
Glukosida sianogenat
Koumarin
Asam sinamat Fenol sederhana
I Asam benzoat
I 1
A
senvawafenoi;I;1 Tanin terkondensasi1
4
AAsam kumarat --
4
7 1KO-A'
I I JAsarn lemak
4
Asam absisatAsetil ko-A , Asam faseat
Xanton
J
FlavonoidL
+ NAsam mevalonat
Siklus Krebs
Steroid
Isopentenil Terpenoid
oirofosfat
1
-Sitokinin
7
Giberelin1
Gambar 1 Hubungan jalur biosintesis metabolisme primer dan sekunder pada tumbuhan (Sumber: Vickery dan Vickery 198 1)
[image:32.530.75.492.77.553.2]Asam galat dibentuk dari aromatisasi asam dehidrosikimat (Manitto 1991, Vickery dan Vickery 1981). Menurut Prindle dan Wright (1991), asam galat mempunyai bobot molekul500-3000 dalton. Asam galat merupakan senyawa dengan struktur cincin aromatik yang mengandung satu atau dua gugus hidroksil dan dapat
membentuk ikatan silang yang stabil dengan protein, selulosa, dan pektin. Asam galat terdapat dalam vakuola sel dan mudah larut dalam air. Menurut Harborne
(1987), asam galat terdapat dalam daun sebagai fraksi yang larut dalam etanol, terutama pada daun yang membentuk lignin. Menurut Manitto (1991), asam galat dibentuk dalam daun maupun jaringan tumbuhan yang membentuk puru (gall) atau hipertrofi sel.
Dalam peranannya sebagai zat antibakteri, asam galat merusak perrneabilitas membran bakteri sehingga membocorkan metabolit dalam sel bakteri (Manitto 199 1 ). Pelczar dan Chan (1987) menyatakan bahwa asam galat membentuk ikatan yang stabil dengan membran sitoplasma bakteri sehingga merusak integritas membran sitoplasma dan mengakibatkan kebocoran substansi dalam sel bakteri. Oleh karena membran sel merupakan lokasi beberapa jenis enzim, diantaranya enzim ATP-ase maka kerusakan membran sel mengganggu fungsi enzim ATP-ase dalam produksi energi. Hambatan dalam produksi energi akan mengganggu pembentukan komponen sel bakteri.
inenggunakan ekstrak daun mimba 2 % dalam pelarut air untuk mengendalikan penyakit bercak daun cabai yang disebabkan oleh bakteri X a. pv. ve.szcutorzu. Daun inimba yang diemulsikan dalain etanol telah dikomersialkan dengan inerek dagang Margoside OK-80EC 0,05 % atau Margoside CK-20EC 0,I % untuk pengendalian penyakit bercak daun cabai.
Keefektifan ekstrak daun miinba segar konsentrasi 2 % dalam pelarut klorofonn saina dengan streptomisin 100 ppm dalam pengendalian penyakit bercak daun cabai. Pengendalian penyakit bercak daun dengan penggunaan biji mimba lebih efektif dibandingkan dengan daun karena bahan aktif yang terkandung dalain setiap g biji (setara 3,5 mg azadirachtin murni) lebih banyak dibandingkan dengan daun.
Heyne (1987) mengkoinpilasi berbagai jenis tanaman di Indonesia yang digunakan sebagai bakterisida penyakit manusia. Deskripsi beberapa bahan tanainan yang digunakan sebagai bakterisida pustul bakteri kedelai disajikan pada Tabel 2.
Tabel 2 Deskripsi enam bahan tanaman yang dideterminasi sebagai bakterisida
Nama tanaman Bagian tanaman
(Famili) yang digunakan Ekologi Senyawa aktif untuk bakterisida
A lpinia galanga S W
(lengkuas merah) (Zingiberaceae)
A ndropogon nardus var.genulnusHACK (sereh wangi) (Gramineae)
Elaeis guineensis J ACO (kelapa sawit) (Palmae)
I,ygodium scandens SWARTZ (paku ka- wat) (Schizaeceae)
I'ierasma , javanica
BL (kipait) (Simarubaceae)
Ponletia pinnata FORST (matoa) (Sapindaceae)
Rimpang berwarna Rumpun memerlu- 250 g rimpang me- merah kan cahaya matahari ngandung 0,15- 1,5%
minyak atsiri
Pelepah daun, helai Rumpun hidup di la- Daun mengandung daun. han kritis, di bawah 77-83%minyak atsi-
naungan ri
Buah berisi biji Ke- Pohon di pantai Buah mengandung
ras 40% lemak kuning
Daun menyirip me- Rumpun hidup di ta- Senyawa fenolik manjang nah lembab, di po-
hon
Daun dan kulit ba- Rumpun hidup di Senyawa fenolik tang yang tua pinggir sungai
Daun dan ranting Pohon di daerah Senyawa fenolik 100-1400 m dpl
[image:35.530.45.490.66.722.2]BAHAN DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari Juni 2000 sampai dengan Desember 2002 di laboratorium Bakteriologi Tumbuhan, Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian; laboratorium Kimia Terpadu Fakultas Matematika dan Ilmu Pengetahuan Alam; laboratoriurn Rekayasa Bioproses, Pusat Penelitian Bioteknologi, dan di kebun percobaan Cikarawang-Darrnaga, Institut Pertanian Bogor.
Metode Penelitian
Percobaan I. Evaluasi Keefektifan Formulasi Bakteri Biokontrol dan Identifi
-
kasi Senyawa Penghambat terhadap Penyakit Pustul Bakteri1.1. Isolasi dan Identifikasi Bakteri Penyebab Pustul
selama 24 jam. Koloni bakteri yang tumbuh yang benvarna kuning dengan permukaan mucord dimurnikan. Pemurnian dilakukan dengan cara membuat suspensi dari koloni tunggal bakteri benvarna kuning mucold dan menggoreskannya ke medium YDC yang baru. Biakan murni isolat patogen akan diuji sifat fisik kimianya (Schaad 1 988), penguj ian patogenisitas pada kotiledon kedelai (Hwang et a/. 1992), dan pengujian antagonisme agens biokontrol terhadap Xag m vitro ( van Chuyen 1982).
1.2. Isolasi dan Identifikasi Bakteri Calon Biokontrol
Isolasi bakteri calon biokontrol menggunakan teknik pencawanan (Lelliot & Stead 1987). Bakteri calon biokontrol diisolasi dari rizosfer tanaman kedelai varietas Wilis sehat umur 35 HST yang di sekitarnya terdapat tanaman kedelai bergejala pustul. Selain itu bakteri calon biokontrol juga diisolasi dari rizosfer tanaman tomat di sekitar tanaman kedelai tersebut di atas.
yaitu H. subtrlw. Tiap koloni yang tumbuh diisolasi dan dibuat biakan murni sebagai bakteri calon biokontrol.
Koloni murni bakteri benvarna kuning kehijauan dibiakkan di medium selektif agar King's B yang ditambah dengan rifampisin 50 ppm dan koloni mumi bakteri benvarna putih dibiakkan di medium agar darah 0,4 % yang ditambah dengan rifampisin 50 ppm.
Isolat bakteri yang diduga berpotensi sebagai agens biokontrol diidentifikasi sifat fisik kimianya untuk menentukan spesies Pseudomonas spp. atau Bacrllus spp. Identifikasi Hacrllus subtrlrs diantaranya reaksi Gram, pewarnaan endospora untuk mendeteksi bentuk dan letak spora di dalam sel, pertumbuhan sel pada suhu 45' dan 65'' C, pertumbuhan pada NaCl 7%, penggunaan sitrat, perubahan asam dari arabinosa, manitol, dan silosa, uji hidrolsis pati, serta penggunaan asentoin (Leary dan Chun 1988, Cowan 1974).
Identifikasi adanya endospora di tengah sel menunjukkan bahwa bakteri tersebut adalah H. subtrlw. Cara identifikasi endospora yaitu menfiksasi satu lup isolat bakteri uji umur 96 jam pada gelas obyek selama 3 menit, menggenanginya dengan lamtan malachrte green selama 10 menit, membilasnya dengan air destilata, meniriskan dan menggenangi dengan safranin selama 30 menit. Setelah pembilasan dengan air destilata, gelas obyek dikering udarakan selama 5 menit. Setelah kering, gelas obyek diamati dibawah mikroskop dengan perbesaran 1000 x. Endospora benvarna hijau sedangkan sel vegetatif bakteri benvarna merah.
MgSOj 0,2 g/l NH4H2P04 1,0 gll. K2HP04 2,O gll. NaN07 2,O d l , NaCl 5,O g/l ;
bromtimol biru 0,08 g/l dan agar 15 gll . Agar simmons sitrat yang semula benvarna hijau akan berubah menjadi biru pada suhu 27" C selama 24 jam inkubasi apabila bakteri menggunakan sitrat.
Cara identifikasi pembentukan asam yaitu membiakkan bakteri uji dalam silosa, arabinosa, manitol hroth benvarna merah yang berisi tabung Durham. Biakan diinkubasi pada suhu 27OC selama 24 jam sehingga terjadi perubahan warna medium menjadi kuning dan terbentuk gelembung udara yang menunjukkan terbentuknya asam.
Pengujian hidrolisis pati untuk menganalisis produksi enzim amilase oleh H.
suhtrlrs. Pengujian dilakukan dengan cara membiakkan bakteri uji dalam medium pati kemudian ditetesi dengan lug01 berwarna biru, dinkubasi pada suhu 27' C. Di sekeliling bakteri penghidrolisis pati akan mengalami perubahan warna biru menjadi bening setelah 24-48 jam inkubasi.
Uji pembentukan asentoin pada medium Voges Proskauer warna merah dilakukan untuk menentukan kemampuan bakteri memproduksi asentoin (asetil metil karbinol) yaitu senyawa metabolit sekunder dalam metabolisme karbohidrat. Asetil metil karbinol dengan adanya KOH dan udara teroksidasi menjadi diasetil. Diasetil bereaksi dengan alfa naftol dan asam amino yang terdapat dalam medium membentuk warna merah muda yang menunjukkan bahwa bakteri memproduksi asetoin.
asam yaitu membiakkan bakteri uji dalam arabinosa, galaktosa, trehalosa, sukrosa, sorbitol, dan inositol broth benvarna merah yang berisi tabung Durham. Biakan diinkubasi pada suhu 27" selama 24 jam sehingga terjadi perubahan warna medium menjadi kuning dan terbentuk gelembung udara yang menunjukkan terbentuknya asam.
1.3. Pengujian Inaktivasi Xag in vitro oleh Filtrat dan Suspensi Bakteri Calon Biokontrol
Bakteri calon biokontrol hasil isolasi dari pertanaman kedelai dan tomat dievaluasi daya inaktivasinya terhadap Xug menggunakan metode kertas cakram (van Chuyen et a/. 1982). Filtrat bakteri calon biokontrol diperoleh dengan mensentrifugasi suspensi bakteri umur 48 jam dengan kerapatan 1
o8
CFUIml menggunakan sentrifus (High Speed Micro Refrigerator Centrifuge MRX-151 Induction Drive) kecepatan 11000 rpm selama 30 menit. Supernatan disaring dengan membran nitroselulosa berporositas 0,2 ymzone bening dengan diameter cawan petri yang ditumbuhi seluruhnya oleh patogen. Persen inaktivasi patogen diamati selama 1 hingga 10 hari inkubasi.
Uji inaktivasi Xug juga dilakukan dengan menggunakan suspensi bakteri calon biokontrol. Metode yang digunakan sama dengan pengujian dengan menggunakan filtrat bakteri calon biokontrol.
Penghitungan perbedaan diameter zone hambatan yang dibentuk oleh masing- masing isolat bakteri calon biokontrol diuji dengan menggunakan rancangan acak lengkap dengan tiga ulangan, dilanjutkan dengan uji jarak berganda Duncan pada taraf kepercayaan 1 dan 5 %.
1.4. Analisis Senyawa Inaktivasi dalam Filtrat Bakteri Calon Biokontrol
Mekanisme inaktivasi bakteri Xug oleh filtrat bakteri calon biokontrol disebabkan oleh metabolit yang terkandung dalam filtrat yang diproduksi oleh bakteri calon biokontrol. Metabolit yang dapat berfungsi sebagai biokontrol antara lain adalah biosurfaktan, hidrogen sianida, dan siderofor. Oleh karenanya dilakukan analisis ketiga metabolit tersebut.
Analisis produksi senyawa biosurfaktan dilakukan dengan kromatografi cair kinerj a tinggi (HPLC) (Ohno et a/. 1 995). Preparasi dipersiapkan dengan mengasamkan suspensi bakteri calon biokontrol dengan HCl hingga pH 2. Suspensi
disentrifugasi dengan kecepatan 13000 rpm selama 10 menit dan supernatan yang diperoleh disaring dengan membran nitroselulosa berporositas 0,2 pm sehingga diperoleh suatu filtrat. Standar biosurfaktan yang digunakan adalah surfaktin yang diproduksi oleh B. subtzlrs ATCC-2 1332 (Sigma Laboratories).
Analisis produksi senyawa hidrogen sianida (Wey et al. 1990) dilakukan dengan cara menginfestasikan satu lup bakteri biokontrol berumur 48 jam dengan kerapatan 10' CFUI rnl pada medium agar Trzptlc Soy yang ditambah dengan glisin 4,4 g/l. Kertas saring steril dicelupkan ke dalam larutan asam pikrat (yaitu campuran asam pi krat 2,5 g/l dan Na2C03 12,5 g 11 air) dan diletakkan pada bagian dalam tutup cawan petri. Perubahan warna kertas saring diamati 2 hingga 6 hari inkubasi pada suhu 2 7 ' ~ . Produksi HCN diukur secara kualitatif dengan mengamati perubahan warna kertas saring kuning menjadi coklat muda (sedikit HCN), coklat (HCN sedang), merah bata (HCN banyak), dan tetap kuning (tidak menghasilkan HCN).
ditambah dengan 1 ml FeC13 lo-' M sebagai sumber senyawa besi yang terbatas, sedangkan untuk pembanding digunakan 3 ml supernatan tanpa ditambah dengan senyawa besi.
1.5. Formulasi Bakteri Biokontrol selama Penyimpanan
Bahan pembentuk formulasi cair yang digunakan adalah molase yaitu limbah cair industri gula tebu (Pabrik Gula Tersana Barn, PT Rajawali 11, Kabupaten Cirebon) dan limbah cair tahu (Pabrik Tahu di Gunung Batu, Kota Bogor). Molase diencerkan hingga konsentrasi 1 % berdasarkan kesamaan nilai tegangan permukaannya dengan limbah cair tahu. Tegangan permukaan bahan pembentuk formulasi diukur dengan alat tensiometer Du Nuoy CSC 70545.
Molase 1 % atau limbah cair tahu disaring dengan kertas saring untuk memisahkan kotoran. Sebelum diinfestasi dengan bakteri biokontrol, molase 1% atau limbah cair tahu disterilisasi pada suhu 121' C selama 30 menit. Analisis kandungan kimia molase 1 % dan limbah cair tahu dilakukan dengan metode gravimetri (Hadimuljono dan Soetikno 1990).
dua atau tiga jenis bakteri biokontrol dibuat dengan cara mencampur bakteri biokontrol dengan perbandingan 1 : 1. Kerapatan masing-masing bakteri 1
o6
CFU /ml.Umur simpan formulasi cair dievaluasi dengan mekanisme antagonisme
formulasi cair biokontrol setelah penyimpanan 7, 30, 60, 90, 180, dan 360 hari. Mekanisme antagonisme formulasi cair biokontrol terhadap Xug diantaranya dianalisis melalui jumlah senyawa biosurfaktan, tegangan permukaan formulasi, kerapatan bakteri biokontrol dalam formulasi, dan pH formulasi. Percobaan disusun dalam rancangan acak lengkap dan dilanjutkan dengan uji beda menggunakan uji jarak berganda Duncan pada taraf kepercayaan 1 dan 5 %.
Jumlah senyawa biosurfaktan dalam formulasi dianalisis dengan kromatografi cair kinerja tinggi (HPLC) (Ohno et ul. 1995). Cara analisis biosurfaktan dalam formulasi sama seperti yang dilakukan pada analisis biosurfaktan dalam filtrat bakteri calon biokontrol.
Kerapatan bakteri biokontrol dalam forrnulasi dihitung dengan metode pencawanan bakteri pada medium selektif. Medium agar King's B digunakan untuk formulasi yang berisi P. ,fluorescens GI34, agar Tryplic Soy untuk H. suhlilis
BBO 1, serta pencawanan pada medium agar King's B dan Tryptic Soy yang dilakukan sekaligus untuk formulasi yang berisi campuran bakteri biokontrol (Lelliot dan Stead 1987). Pengukuran pH formulasi molase atau limbah cair tahu dilakukan dengan pH meter.
Percobaan 11. Evaluasi Keefektifan Bakterisida Botani Asal Enam Jenis Tanaman dan Analisis Senyawa Penghambat terhadap Penyakit Pustul Bakteri
11.1. Ekstraksi Bahan Bakterisida Botani
Enam macam bahan tanaman calon bakterisida botani yaitu daun kipahit, daun
11.2. Pengujian Inaktivasi Xag in vitro oleh Bakterisida Botani
Ekstrak enam bahan tanaman calon bakterisida masing-masing sebanyak I mg dilarutkan dalam 10 ml air destilata steril (konsentrasi 10%) atau 5 ml air destilata steriI (konsentrasi 20%). Potongan kertas saring steril berbentuk cakram berdiameter 6 mm dicelupkan ke dalam larutan ekstrak botani pada masing-masing konsentrasi. Kertas saring mengandung ekstrak botani diinfestasikan pada medium agar Yeast Ijextrose Carbonate yang 4 jam sebelumnya telah diinfestasi dengan Xug.
Diameter zone penghambatan yang terbentuk diukur dengan kertas milimeter (Van Chu yen et ul. 1982). Berdasarkan diameter zone bening yang terbentuk, dihitung persen inaktivasi Xag dengan cara membandingkan diameter zone bening dengan diameter cawan petri yang ditumbuhi seluruhnya oleh Xag. Persen inaktivasi Xag
diamati selama 1 hingga 14 hari inkubasi.
Untuk mengetahui perbedaan persen inaktivasi Xag oleh bakterisida botani, percobaan disusun dalam rancangan acak lengkap dengan tiga ulangan. Uji beda penghambatan antar jenis bakterisida botani menggunakan uji jarak berganda Duncan pada taraf kepercayaan 1 dan 5 %.
11.3. Analisis Asam Galat dalam Bakterisida Botani
dengan kertas saring steril (Whatman 41). Supernatan sebanyak 1 ml dicampur dengan 1 ml etanol 95 % (Merck), 5 ml air destilata steril, dan 0,5 ml reagen Folin Ciocalteau 50 % (Sigma Chemical Co) menjadi larutan benvarna biru tua. Larutan didiamkan 5 menit, ditambah dengan 1 ml Na2C03 jenuh, dihomogenkan dengan vorteks dan disimpan ditempat gelap selama 1 jam. Sarnpel dihomogenisasi lagi sesaat sebelum pengukuran dengan spektrofotometer (Shimadzu V260) pada panjang gelombang 725 nm. Sebagai standar analisis digunakan asam galat (Fisher Scientific Co) dalam etanol95 %.
Rancangan percobaan yang digunakan untuk menganalisis perbedaan kandungan asam galat bakterisida botani yaitu rancangan acak lengkap dengan tiga ulangan. Uji beda antar perlakuan menggunakan uji jarak berganda Duncan pada taraf kepercayaan 1 dan 5 %.
Percobaan 111. Analisis Keefektifan dan Keefisienan Pengendalian Pustul Bakteri dengan Kombinasi Pola Tumpangsari atau Monokultur dan Aplikasi Bakteri Biokontrol atau Bakterisida botani
Jagung varietas Bisma (dari Laboratorium Teknologi Benih Departemen Budidaya Pertanian Fakultas Pertanian, Institut Pertanian Bogor) ditanam tiga minggu setelah penanaman kedelai dengan jarak tanam 100 x 80 cm. Pemupukan jagung dengan Urea, SP36, dan KC1 masing-masing sebanyak 30 kglha diberikan sekaligus pada 28 hari sesudah tanam. Pemupukan kedelai maupun jagung dilakukan secara tugal dengan jarak 7 cm di samping kiri kanan lubang tanam dan kedalaman 10 cm.
Percobaan aplikasi agens biokontrol dilakukan pada petak percobaan yang berbeda dengan percobaan aplikasi bakterisida botani, tetapi terletak pada satu lapangan di kebun percobaan Cikarawang, Darmaga, Bogor. Denah petak percobaan disajikan pada Lampiran I .
Bakteri biokontrol yang digunakan berupa
P.
fluorescens GI34, B29, dan B.subtrlls BBOl berbentuk formulasi cair umur 1 hingga 50 hari penyimpanan. Kerapatan bakteri biokontrol pada saat pembuatan lo6 CFUIml formulasi. Formulasi
yang digunakan berisi satu jenis bakteri dan campuran dua atau tiga jenis bakteri biokontrol.
Cara aplikasi bakteri biokontrol adalah (I) perlakuan setiap kg benih kedelai sebelum tanam dengan formulasi bakteri biokontrol konsentrasi 20 mlll air
streptomisin sulfat ( 2 g streptomisin sulfat dalam 1 1 air) dan molase 1 % ( 20 ml molase dalam 1 1 air).
Bakterisida botani yang digunakan adalah ekstrak daun matoa, daun kipahit, daun paku papila, daun sereh wangi, rimpang lengkuas merah, dan buah kelapa sawit dengan konsentrasi 100 mg ekstrak bakterisida botani1500 ml air. Sebagai pembanding digunakan ekstrak daun mimba (produk formulator) konsentrasi 2 g/l air, streptomisin sulfat (2 g streptomisin sulfat dalam 1 1 air), dan molase 1 % (20 ml molase dalam 1 1 air).
Aplikasi bakterisida botani adalah (1) perlakuan benih kedelai sebelum tanam dengan ekstrak bakterisida botani dilanjutkan dengan penyemprotan pada daun umur 30 dan 40 HST, dan 2) tanpa perlakuan benih tetapi hanya penyemprotan ekstrak bakterisida botani di daun pada tanaman kedelai 28,35, dan 42 HST.
Model statistika yang digunakan adalah :
Yijkl =
+
Ri + Pj + ai;+
Ak + (PA);k +Pijk
+ B1+ (PB)jI + (AB )kl + (PAB)jkl +EiSkl Keterangan: p = nilai tengah perlakuanR = tiga kali ulangan
P = pola tanam (2 cara budidaya)
a
= galat pola tanamA = jenis agens pengendalian (10 jenis)
(PA) = interaksi pola tanam dengan jenis agens
p
= galat jenis agens pengendalianB = cara aplikasi agens pengendalian (2 cara aplikasi)
(PB) = interaksi pola tanam dengan cara aplikasi
(AB) = interaksi jenis agens dengan cara aplikasi
(PAB) = interaksi cara aplikasi, jenis agens, dan pola tanam
E = galat cara aplikasi
Pengamatan di lapangan meliputi keparahan penyakit pustul bakteri, populasi bakteri biokontrol yang telah disemprotkan dan bertahan hidup di perrnukaan daun kedelai, kandungan asam galat daun kedelai yang tidak disemprot dengan bakterisida botani maupun yang disemprot dengan bakterisida botani, jumlah polong kedelai, persen polong hampa kedelai, berat biji kedelai serta berat biji jagung per tanaman.
Keparahan penyakit diukur dengan menggunakan rumus Townsend dan Hueberger (dalam Unterstenhofer 1973):
Kp = 1=0 x 100% Z x N
Keterangan : KP = keparahan penyakit
ni = jumlah tanaman yang terserang pada setiap kategori vi = nilai numerik masing-masing kategori serangan
Z = nilai numerik kategori serangan tertinggi
Kategori serangan tampak pada Gambar 2 dengan ketentuan: 0 = tidak ada gejala
I = bercak berdiameter 0,1 - 0,5 mm, antara 0 < X
<
10 %2
= bercak berdiameter > 0,5-1,O mm, antara 10 < X 5 30 %3 = bercak berdiameter > 1,O - 2,O mrn, antara 30 < X
<
50 %4 = bercak berdiameter > 2,O mm, lebih dari 50 %
(jam bar 2 Kategori Serangan X. a. pv. glycines
( Sumber: Can. Plant Dis. Surv. 1971 dimodifikasi j
Selanjutnya dari keparahan penyakit dihitung laju perkembangan penyakit (r) dengan rumus sebagai berikut (Zadoks dan Schein 1979):
Keterangan: r = laju infeksi
t2-tl = selang waktu pengamatan (pengamatan ke 2 - pengamatan ke 1)
x2 = keparahan penyakit pengamatan ke 2
Populasi bakteri biokontrol di perrnukaan daun kedelai dihitung antara 1 hingga 14 hari setelah penyemprotan menggunakan teknik pencawanan (plating)
(Lelliot dan Stead 1987). Dari setiap aplikasi bakteri biokontrol diambil tiga tanaman contoh dan masing-masing diambil tiga daun trifoliat ( tanaman bagian atas, tengah, dan bawah). Helai daun digunting dengan ukuran 5 x 5 mm dan dicampurkan dalam 20 ml bufer fosfat steril. Selanjutnya suspensi bakteri dalam bufer fosfat diencerkan hingga lo-'. Dari masing-masing pengenceran, diambil 0,l ml dan dibiakkan pada medium selektif berupa agar King's B yang ditambah dengan rifampisin 50 ppm dan atau agar triptlc soy yang ditambah dengan rifampisin 50 ppm. Rancangan percobaan yang digunakan untuk menganalisis perbedaan jumlah populasi bakteri biokontrol yang bertahan di permukaan daun kedelai yaitu rancangan acak lengkap dengan tiga ulangan. Uji beda antar jenis bakteri biokontrol menggunakan uji jarak berganda Duncan pada taraf kepercayaan 1% dan 5 %.
V260) pada panjang gelombang 725 nm. Sebagai standar analisis digunakan asam galat (Fisher Scientific Co) dalam etanol95 %.
Rancangan percobaan yang digunakan untuk menganalisis perbedaan kandungan asam galat daun kedelai yaitu rancangan acak lengkap dengan tiga ulangan. Uji beda antar penyemprotan jenis bakterisida terhadap kandungan asam galat daun kedelai menggunakan uji jarak berganda Duncan pada taraf kepercayaan 1 dan 5 %.
Keefektifan pola tumpangsari dibandingkan dengan monokultur berdasarkan
analisis produktivitas lahan. Produktivitas lahan dihitung dengan nisbah kesetaraan lahan (NKL) (IRRI 1973) sebagai berikut :
xi
Y, NKL =-+-
X j Y,
Keterangan : Xi = produksi jagung pada tumpangsari
Xj = produksi jagung pada monokultur
Yi = produksi kedelai pada tumpangsari
Yj = produksi kedelai pada monokultur
Keefisienan komponen pengendalian penyakit pustul bakteri pada usahatani
1. Formulasi cair P. fluorescens GI 34 maupun B. subtilis BBO 1 sampai dengan umur simpan 60 hari efektif menginaktivasi bakteri Xag
2. Molase sebagai bahan pembawa bakteri biokontrol meningkatkan produksi senyawa metabolit oleh P. fluorescens GI 34 dan B. subtilis BBO 1
3. Ekstrak daun matoa dalam forrnulasi air 20 % paling efektif menginaktivasi Xag karena kandungan asam galat (8,2 mglg daun matoa) lebih tinggi dibandingkan dengan ekstrak daun mimba, daun kipahit, daun paku papila, daun sereh wangi, rimpang lengkuas merah, dan buah kelapa sawit
4. Strategi pengendalian berupa kombinasi pola tanam tumpangsari kedelai- jagung dengan aplikasi bakteri biokontrol paling efektif karena dapat menurunkan laju infeksi pustul bakteri dari O,11 unithari menjadi 0,06 unitlhari di musim kemarau dan dari 0,13 unitlhari menjadi 0,07 unitlhari di musim penghujan
5. Kombinasi pola tanam tumpangsari kedelai-jagung dan aplikasi P. fluorescens
SARAN
1) Perlu diteliti lebih lanjut mengenai pencampuran antara sumber karbon (molase) dan sumber nitrogen (limbah cair tahu) yang optimum sebagai bahan formulasi bakteri biokontrol agar dapat meningkatkan keefektifan lebih dari 60 hari penyimpanan
2) Perlu diteliti formulasi ekstrak botani sebagai bakterisida dalam bahan pembawa selain air agar dapat meningkatkan keefektifannya terhadap penyakit pustul bakteri
DAFTAR PUSTAKA
Abdallah MA. 199 1. Pyoverdin and Pseudobactins. Dalam Winkelman G, editor. Handbook of Microbial Iron Chelates. CRC Press. Boca Raton. New York. Hlm 139-152
Aganval VK, Sinclair JB. 1996. Principles of Seed Pathology. Lewis Publishers. London
Aini MH. 1992. Penyakit Bakteri pada Kedelai di Kalimantan Selatan: Identifikasi, Kehilangan hasil, dan Kelangsungan Hidup Patogen. Disertasi. Program Pasca Sarjana, Institut Pertanian Bogor.
Badan Pusat Statistik. 2002. Produksi Tanaman Padi dan Palawija di Indonesia. Survei Pertanian. Jakarta.
Barberan SA, Chirife J, Bozzini JP. 1991. Antibacterial Effect and All Morphological Changes in Staphylococcus aureus subjected to Low Ethanol Concentrations. J. Food Sci. 58(2):435-43 8.
Beetsman GB. 1996. Emerging Techno1ogy:The Bases for New Generations of Pesticide Formulations. Dalam Foy CL, Pritchard DW, editor. Pesticide Formulations and Adjuvant Technology. CRC Press. Boca Raton. New York. Hlm 1 13-140.
Bodreau MA, Mundt CC. 1992. Mechanisms of Alteration in Bean Rust epidemiology Due to Intercropping with Mayze. Phytopathology 82(10): 105 1-1060.
Buttery RG, Ling CL. 1993. Volatile Components of Tomato Fruit and Plant Parts (Relations and Biogenesis). The American Chemical Society. Washington.
Cooper DG, CR Mac Donald, Duff SJB, Kosaric N. 198 1. Enhanced Production of Surfaktin from B. subtilts by Continuous Product Removal and Metal Cation Additions. App. Environ. Microbial. 42:408-4 12.
Cowan ST. 1974. Manual for the Identification of Medical Bacteria. Cambridge University Press. London.
Desai JD, Desai AJ. 1993. Production of Biosurfactants. Dalarn Kosaric N, editor Biosurfactants. Production. Properties. Applications. Marcel Dekker Inc. New York. Hlm 279-345.
Dirmawati SR. 1996. Ketahanan Kedelai Terhadap Xanthomonus campestris pv.
glycines Penyebab Penyakit Bisul Bakteri. Tesis. Program Pasca Sarjana. Universitas Gadjah Mada. Yogyakarta.
Eswaramurthy S, Mariappan V, Muthusamy M, Alagianalingam MN, Subharaniam K. 1993. Efficacy of Neem Products in Controlling Bacterial Blight of Paddy. World Neem Conference Abstr. Bangalore, India.
Field RJ, Dastgheib F. 1996. Enhancing Uptake and Translocation of Systemic Active Ingredients. CRC Press. Boca Raton. New York.
Fravel DR, Connick Jr WJ, Lewis JA. 1998. Formulation of Microorganisms to Control Plant Disease. Dalam Burges HD,editor. Formulation of Microbial Biopesticides: Benefacial Microorganism, Nematodes and Seed Treatments. . Kluwer Academic Publishers. Dordrecht. Hlm 187-20 1
Goto M. 1992. Fundamentals of Bacterial Plant Pathology. Academic Press Limited London.
Hadimuljono H, Soetikno S. 1990. Petunjuk Praktek Kimia Analisa. Direktorat Jendral Pendidikan Tinggi. Departemen Pendidikan Nasional. Jakarta. Hammerschmidt PA, Pratt DE. 1995. Phenolic of Dried Soybeans. The
Association of Official Analytical Chemists 4th ~ d . Arlington.
Harborne JB. 1987. Metode Fitokimia. Penuntun Cara Modern Menganalisis Tumbuhan (Terjemahan). Penerbit ITB, Bandung.
Hartman GL, Sinclair JB, Rupe JC. 1999. Compendium of Soybean Diseases. Fourth Ed. The American Phytopathology Society Press. United State of America.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Jilid I. Penerbit Yayasan Sarana Wana Jaya. Jakarta.
Heyne K. 1987. Turnbuhan Berguna Indonesia. Jilid 11. Penerbit Yayasan Sarana Wana Jaya. Jakarta.
Hisjam N. 1988. Iklim Mikro Suatu Sistem Panen Berganda (Multiple Cropping) Jagung dengan Kedelai. Tesis. Fakultas Pasca sarjana. Institut Pertanian Bogor.
Hildebrand DC, Schroth MN, Sands DC. 1988. l'seudomonas. Laboratory Guide for Identification of Plant Pathogenic Bacteria. 2 nd Edition. The American Phytopathol. Society. St. Paul Minnesota .
Hommel RK, Ratledge C. 1993. Biosynthetic Mechanism of Low Molecular Weight Surfactants and Their Precursor Molecules. Dalam Kosaric N, editor
Biosurfactans. Production. Properties. Applications. Marcel Dekker Inc. New York. Hlm 206-278.
Javaheri M, Gary EJ, Inney Mc MJ, Knapp RM. 1985. Anaerobic Production of Biosurfactants by Bacillus lichentformis JF-2. App. Environ. Microbiol.50: 698-700.
Jones KA, Burges HD. 1998. Technology of Formulation and Application. Dalam Burges HD, editor. Formulation of Microbial Biopesticides:Beneflicial Microorganism, Nematodes and Seed Tratments. Kluwer Academic
Publishers. Dordrecht. Hlm 7-29
Lang S, Wagner F. 1993. Bioconversion of Oils and Sugars to Glycolipids. Dalam Kosaric N, editor. Biosurfactans. Production. Properties. Application. Marcel Dekker. New York. Hlm 346-382.
Lanter J J. 1990. Epidemiology of Angular Leaf spot of Bean in Monocultures and in Bean-Mayze Intercrops. University of California Press. Berkeley.
Leary JV, Chun W. 1988. Baczllus. Laboratory Guide for Identification of Plant Pathogenic Bacteria. 2 nd Edition. The American Phytopathol. Society. St. Paul Minnesota .
Lehninger AL. 1982. Dasar-dasar Biokimia Jilid 2 (Terjemahan). Penerbit Erlangga Jakarta.
Lelliot RA, Stead DE. 1987. Methods for the Diagnosis of Bacterial Diseases of Plants. Blackwell Scientific Publication. Australia.
Machmud M. 1990. Penyakit Bakteri pada Tanaman Pangan dan Hortikultura: Masalah dan Strategi Pengendaliannya. Dalam Pawiroesoemardjo S et al.editor. 1990. Perlindungan Tanaman. Menunjang Terwujudnya Pertanian Tangguh dan Kelestarian Lingkungan. Penerbit PT Agricon. Bogor. Hlrn 233-25 1.
Maharishi RD. 1993. Management of Chili Diseases by Neem-based Preparations. World Neem Conference. Abstr. Bangalore, India.
Manitto P. 1981. Biosynthesis of the Natural Products. Ellis Horwood Limited Publishers. England.
Matzanke BF. 1990. Structures, Coordination, Chemistry, and Function of Microbial Iron Chelator. Dalam Winkelman G, editor. Handbook of Microbial Iron Chelates. CRC Press. Boca Raton. New York. Hlrn 15-60.
Mount MS, Lacy GH. 1982. Phytopathogenic Prokaryotes Volume 2. Academic Press New York.
Mortensen CN. 1989. Selected Bacterial Diseases of Soybean, Mungbean, and Rice, and Seed Health Testing Methods. Danish Government Institute of Seed Pathology for Developing Countries. Denmark.
Mulligan CN