LAMPIRAN
Tests of Between-Subjects Effects Dependent Variable: persentase daya hambat
Source Type III Sum of
Squares
df Mean Square F Sig.
Corrected Model 989.043a 4 247.261 3.423 .052 Intercept 4934.515 1 4934.515 68.315 .000
perlakuan 989.043 4 247.261 3.423 .052
Error 722.316 10 72.232
Total 6645.874 15
Corrected Total 1711.359 14
a. R Squared = .578 (Adjusted R Squared = .409)
Post Hoc Tests
Homogeneous Subsets
persentase daya hambat Duncana,b
bakteri kitinolitik N Subset
1 2
Vibrio logei 3 8.82367b
Aeromonas salmonicida 1 3 11.76500b
Aeromonas salmonicida 2 3 16.66700b 16.66700a
Aeromonas spp. 3 21.56867b 21.56867a b
Citrobacter diversus 3 31.86300a
Sig. .117 .063
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 72.232.
a. Uses Harmonic Mean Sample Size = 3.000.
Perlakuan Daya Hambat
Vibri logei
Ulangan 1
Ulangan 2
Perlakuan Daya Hambat
Aeromonas spp.
Ulangan 1
Ulangan 2
Perlakuan Daya Hambat
Aeromonas salmonicida
Ulangan 1
Ulangan 2
Perlakuan Daya Hambat
Citrobacter diversus
Ulangan 1
Ulangan 2
DAFTAR PUSTAKA
Acharya, T., 2013. Overview of biochemical test used to identify bacteria in microbiology laboratory.
Ayu, A., D. Suryanto, & I. Nurwahyuni. 2011. Potensi Bakteri Kitinolitik Dalam Pengendalian Aspergillus niger Penyebab Penyebab Penyakit Busuk Pangkal Akar pada Tanaman Kacang Tanah. Fakultas MIPA Universitas Sumatera Utara, Medan.
Bashan, Y., G. Holguin & R. Lifshitz. 1993. Isolation and Characterization of
Plant Growth-Promoting Rhizobacteria. Methods in Plant Molecular Biology and Biotechnology
Brurberg, M.B., B. Synstad, & S.S. Klemsdal, D.M.F.V. Aalten, L. Sundheim, V.G.H. Einjsink, 2000. Chitinases From Serratia marcescens. Manuscript. Recent Res. Develop. of Microbiol.
Bumunang, E. W., & O.O. Babalola, 2014. Characterization of Rhizobacteria from Field Grown Genetically Modified (GM) anad Non-GM Maizes.
Braz. Arch. Biol. Technol. Jan./Feb. 57(1):1-8.
Cappuccino, J. G. & N. Sherman. 1998. Micobiology: a Laboratory Manual. Benjamin/Cummings Science Publishing, California.
Daly, A. & G. Walduck. 2006. Fusarium Wilt of Bananas (Panama Disease) (Fusarium Oxysporum f. sp. cubense) diakses pada 15 Maret 2016
Denis, S., 2014. Ekspor Tembakau Bakal Tumbuh 10% pada 2015. http://
Dewi, I.R., 2007. Rhizobacteria Pendukung Pertumbuhan Tanaman Plant Growth
Promotor Rhizobacteria. Makalah. Fakultas Pertanian Universitas
Padjadjaran, Jatinangor.
Docan, A., V. Cristea, L. Dediu & A. Nica, 2012. Control of aeromonas salmonicida Infection in Rainbow Trout (Oncorhynchus mykiss) Reared in Recirculating Aquaculture System. Lucrarie
Stiintifice-Seria Zootehnie Vol.57.
Ginting, R. C. B., 2007. Kitinase. Saraswati, R., E. Husein, R.D.M. Simanungkalit
editor Metode Analisis Biologi Tanah. http://balittanah.litbang.deptan.go.id
Gonzales, A.M., D.E.Victoria & F.C.G. Merino, 2015. Efficiency of Plant Growth Promoting rhizobacteria (PGPR) in Sugarcane. Terra Latino Americana
33(4):321-330.
Gupta, H., 2013. Morphology and Ultrastructure of a Bacterial Cell (With Diagram). 2016
Gupta, G., S.S. Parihar, N.H. Ahirwar, S. K. Snehi & V. Singh, 2015. Palnt Growth Promoting Rhizobacteria (PGPR): Current and Future Prospect for Development of Suistanable Agriculture. J. Microb Biochem
Technol 2015 7(2):096-102.
Habib, S.H., H. Kausar, H.M. Saud, M.R. Ismail & R. Othman, 2016. Molecular Characterisation of Stress Tolerant Plant growth promoting Rhizobacteria (PGPR) for Growth Enhancement of Rice. Int. J. Agric. Biol.,
18:184-191.
Hanif, A., D. Suryanto & I. Nurwahyuni. 2011. Pemanfaatan Bakteri Kitinolitik dalam Menghambat Pertumbuhan Curvularia sp. Penyebab Penyakit Bercak Daun pada Tanaman Mentimun. Skripsi. Fakultas MIPA Universitas Sumatera Utara, Medan.
Hariprasad, P., S.P. Divakara, & S.R. Niranjana. 2011. Isolation and Charactherization of Chitinolytic Rhizobacteria for The Management of
Fusarium Wilt In Tomato. J. Crop Protection 30(2011) 1606-1612
Harni, R. & W. Amaria. 2012. Potensi Bakteri Kitinolitik Untuk Pengendalian Penyakit Busuk Pangkal Batang Lada (Phytophthora capsici). Buletin
RISTRI Vol. 3 (1) 2012 7-12
Holt, J.G., N.R. Krieg, P.H.A. Sneath, J.T. Staley, & S.T. Williams. 1994.
Bergey’s Manual of Determinative Bacteriology Ninth Edition. Lippincott
Williams & Wilkins. New York.
Kamil, Z., M. Rizk, M. Saleh, & S. Moustafa. 2007. Isolation and Identification of Rhizosfer Chitinolytic Bacteria and Their Potential in Antifungal Biocontrol. Global J. Mol. Sci., 2 (2): 57-66
Khaeruni, A., G. A. K. Sutariati, & S. Wahyuni. 2010. Karakterisasi dan Uji Aktivitas Bakteri Rizosfer Lahan Ultisol Sebagai Pemacu Pertumbuhan Tanaman dan Agensia Hayati Cendawan Patogen Tular Tanah Secara In
Vitro. J. HPT. Tropika. ISSN 1411-7525 Vol. 10 No.2: 123-130
Kochman, J., 2007. Contingency Plan- Fusarium wilt of Canola. Grains Research & Development Corporation, Australia.
Kusuma, S.A.F., 2009. Uji Biokimia Bakteri. Karya Ilmiah. Fakultas Farmasi Universitas Padjajaran
Ma, L.J., D.M. Geiser, R.H. Proctor, A.P. Rooney, K. O’Donell, F. Trail, D.M. Gardiner, J.M. Manners, & K. Kazan. 2013. Fusarium Pathogenomics. Annu. Rev. Microbiol 67: 399-416
Meruvu, H. & S.R. Donthireddy, 2013. Biochemical and Molecular Taxonomy of Chitinolytic Citrobacter freundii STR. NOV. HARITD11, Isolated From Indian Marine Environment. Int J Pharm Bio SCi 2013 Apr; 4(2): (B)
1168-1175.
Mclaughlin, J., 2001. Fusarium. Grower 101 Disease Primer Part III
Moretti, A. N., 2009. Taxonomy of Fusarium Genus, A Continuous Fight Between Lumpers and Splitters. Proc. Nat. Sci, Matica Srpska Novi Sad No. 117:7-13.
Muharni & H. Widjajanti. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfer Tanaman Karet. J. Penelitian Sains Vol. 14 No. 1(D) 11-19
Nugraheni, E. S., 2010. Karakterisasi Biologi Isolat-Isolat Fusarium sp. Pada Tanaman Cabai Merah (Capsicum annuum L.) Asal Boyolali. Skripsi. Universitas Sebelas Maret, Surakarta.
Nurhayati, 2011. Penggunaan Jamur Dan Bakteri Dalam Pengendalian Penyakittanaman Secara Hayati Yang Ramah Lingkungan. Prosiding Semirata Bidang Ilmu-ilmu Pertanian BKS-PTN Wilayah Barat Tahun 2011 ISBN: 978-979-8389-18-4
Ratmawati, I., 2015. Potensi Jamur Antagonis (Tricoderma spp.) Pengendalian Hayati Penyakit Lanas di Pembibitan Tembakau.
Reis, C. M.F., N.S.E. Barreto, R.H.S.F. Vieira, F.C.T. Carvalho, R.C.O. Torres, & E.S. Sant’anna, 2016. Aeromonas spp. Isolated From Oysters (Crassostera rhizophorea) from A Natural Oyster Bed, Ceara, Brazil.
Saharan, B.S. & V. Nehra, 2011. Plant Growth Promothing Rhizobacteria: A Critical Review. Life Sci. and Medic. Res. 2011(21).
Semangun, 2004. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Gadjah Mada University Press, Yogyakarta.
Shila, S.J., M.R.Islam, N.N.Ahmed, K.M.G.Dastogeer, & M.B.Meah. 2013. Detection of Pseudomonas Syringae pv. Lachrymans Associated with the Seeds of Cucurbits. Universal J. of Agr. Research. 1(1) : 1-8.
Simatupang, D.S. 2008. Berbagai Mikroorganisme Rizosfer Pada Tanaman Pepaya (Carica papaya L.) di Pusat Kajian Buah-buahan Tropika (PKBT) IPB Desa Ciomas, Kecamatan Pasirkuda, Kabupaten Bogor, Jawa Barat. Skripsi. IPB. Bogor.
Smith, S. N., 2007. An Overview of Ecological and Habitat Aspect in Genus Fusarium with Special emphasis on the Soil-Borne Pathogenic Forms. Plant Pathology Bulletin 16:97-120.
Sullia, S.B., S. Bakthavatchalu, S. Shivakumar. 2012. Identification of Multi-trait PGPR Isolates and Evaluation of Their Potential as Biocontrol Agents. Research Article, Acta Biol. Indica 1(1):61-67.
Thompson, F.L., T. Iida & J. Swings, 2004. Biodiversity of Vibrios. Microbio.
and Mol. Biol. Rev. 68(3):403-401.
Tombe, M., 2013. Potensi Rizobakteri Pemacu Tumbuh Tanaman Sebagai Agen Pengendali Hayati Penyakit Tanaman Perkebunan Yang Ramah Lingkungan. J. Perspektif Vol.12 No. 2 hlm 91-100 ISSN: 1412-8004 Woyesa, D., & F. Assefa. 2011. Diversity and Plant Growth Promoting Properties
of Rhizobacteria Isolated from tef (Eragrotis tef). Ethip. J. Educ. & Sc. 6
(2).
Yaqoob, C., H.A. Awan, A. Maqbool & K.A. Malik, 2013. Micobial Diversity of the Rhizosphere of Kochia (Kochia indica) Growing Under Saline Conditions. J. Bot. Jan. 45(S1):59-65
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara dengan ketinggian + 25m di atas permukaan laut pada bulan September 2015 sampai dengan Maret 2016.
Bahan dan Alat
Adapun bahan yang digunakan adalah sampel tanah disekitar perakaran
tanaman tembakau sebagai sumber isolat bakteri kitinolitik, isolat jamur
F. solani, media Tryptic Soy Broth (TSB) sebagai media isolasi awal, media agar
kitin sebagai media seleksi bakteri, media Nutrient Agar (NA), medium garam minimum kitin sebagai media seleksi dan uji potensi, media Potato Dextrose Agar (PDA) sebagai media kultur jamur dan media uji antagonisme.
Adapun alat yang digunakan adalah cawan petri, tabung reaksi, erlenmeyer, pipet tetes, micropipet, shaker, jarum ose, kaca preparat, kapas, alumunium foil, plastik perekat, label nama, lampu bunsen, autoklaf, oven, botol sampel, hotplate, laminar air flow, timbangan analitik, oven, mikroskop, plastik kaca, spidol, millimeter block dan kamera.
Metodologi Penelitian
SK1 = Isolat asal Desa Sunggal Kanan 1 SK2 = Isolat asal Desa Sunggal Kanan 2 SK3 = Isolat asal Desa Sunggal Kanan 3 SK4 = Isolat asal Desa Sunggal Kanan 4
Setiap perlakuan diulang sebanyak 3 kali ulangan, jadi jumlah cawan petri seluruhnya sebanyak 12.
Pelaksanaan Penelitian
Pengambilan Sampel Bakteri Kitinolitik dari Lapangan
Sampel yang diambil berupa tanah di sekitar perakaran tanaman tembakau di perkebunan tembakau milik warga di Desa Sunggal Kanan, Kecamatan Sunggal, Kabupaten Deli Serdang. Sampel ditentukan dari 5 titik sampling yang paling mewakili. Sebanyak 100 gram tanah yang menempel di akar beserta akarnya diambil dari masing-masing titik sampel, dimasukkan kedalam wadah steril lalu dibawa ke laboratorium (Muharni & Widjajanti, 2011).
Isolasi dan Seleksi Bakteri Kitinolitik
Sampel tanah sebanyak 2 g disuspensikan dalam 20 ml larutan Tryptic Soy
Broth (TSB) dihomogen dengan rotary shaker berkecepatan 150 rpm selama 30
menit, lalu dicawankan pada media agar kitin dan diinkubasi selama 24 jam pada suhu ruang (Bashan et al., 1993).
Koloni yang tumbuh dan membentuk zona bening disekitar koloni merupakan isolat bakteri kitinolitik (Muharni & Widjajanti, 2011).
Pengukuran Indeks Kitinolitik
dan membandingkan hasilnya dengan potensi antagonisme isolat yang terpilih (Muharni & Widjajanti, 2011).
Identifikasi Bakteri Morfologi Koloni
Isolat bakteri uji ditumbuhkan pada media NA selama 48 jam dan diamati karakter morfologi masing-masing isolat yang meliputi warna, bentuk koloni (Gambar 3), elevasi dan tepi koloni (Gambar 4) .
Gambar 3. Bentuk sel bakteri Sumber: Gupta (2013)
Uji Gram
Biakan bakteri yang berumur 24 jam dioleskan pada preparat steril. Olesan tersebut difiksasi dengan lampu bunsen agar merekat pada preparat. Diteteskan
Crystal Violet secara merata pada olesan tunggu 2-3 menit. Kemudian dibilas
dengan air mengalir dan dikeringkan secara perlahan. Diteteskan Iodin, kemudian didiamkan selama 1 menit, dibilas kembali dan dikeringkan. Acid Alkohol ditetesi selama 2-4 detik kemudian bilas dan keringkan kembali. Teteskan Safranin tunggu selama 1 menit , kemudian dibilas dan dikeringkan kembali. Ditetesi dengan minyak emulsi, lalu diamati dibawah mikrosop compound dengan perbesaran 100 kali (Shila et al., 2013).
Uji Diferensiasi
Uji oksidatif dan fermentatif menggunakan media yang kaya akan karbohidrat, dua media kemudian salah satu media bagian atasnya ditetesi cairan parafin untuk menciptakan kondisi anaerob. Oksidatif umumnya terjadi pada respirasi aerob menghasilkan CO2 dan H2O sedangkan fermentasi menghasilkan etanol dan gas. Kedua pengujian ini bertujuan untuk mengetahui kemampuan mikroorganisme menggunakan karbohidrat dengan cara fermentatif atau oksidatif (Acharya, 2013)..
Uji Biokimia
Uji biokimia yang akan dilakukan seperti:
gelap atau ungu pada area yang dioleskan dalam waktu 10 detik (Shila et al., 2013).
Uji enzim katalase dilakukan dengan cara menggoreskan koloni bakteri dengan menggunakan jarum ose pada gelas benda steril kemudian ditetesi H2O2 3%. Reaksi positif ditandai dengan timbulnya gelembung gas (Shila et al., 2013).
Uji produksi indol dengan menggunakan media Tryptone Broth yang mengandung substrat triptofan, ditambahkan beberapa tetes pereaksi Kovac’s yang terdiri dari p-dimetilaminobenzaldehid, butanol, dan asam, terbentuknya cincin yang berwarna merah cherry di permukaan biakan menandakan reaksi
positif, reaksi positif terjadi karena triptofan dikonversi menjadi indol (Kusuma, 2009).
Uji metil merah dengan cara mengocok biakan dengan 5 tetes larutan metil merah. Biakan yang menjadi berwarna merah menunjukkan reaksi positif. Warna merah terjadi karena fermentasi glukosa menghasilkan asam (Kusuma, 2009).
Uji Voges-Proskauer dilakukan dengan cara meneteskan larutan alfa naftol dan KOH 40% pada biakan. Reaksi positif ditandai dengan larutan berubah menjadi merah muda sampai merah menyala (Kusuma, 2009).
Uji Motilitas dan H2S menggunakan media SIM (Sulfide Indole Motility) pada reaksi positif media yang ditusuk bakteri akan berubah warna menjadi hitam sebagai tanda terbentuknya FeS hasil dari reduksi sulfat. Reaksi negatif yang menandakan bakteri tidak mampu mereduksi senyawa Sulfat dan menjadikannya sebagai sumber ATP, sehingga bakteri tidak memiliki energi yang bisa digunakannya untuk bergerak (Acharya, 2013).
Uji urease menunjukkan bakteri mampu mendegradasi urea menjadi amoniak yang kemudian menaikkan pH sehingga pada rteaksi positif media berubah menjadi warna merah muda (fuchsia) (Acharya, 2013).
Uji Triple Sugar Iron Agar (TSIA) menunjukkan kemampuan bakteri memfermentasi lebih dari satu jenis karbohidrat dan/atau bakteri dapat mereduksi sulfur, adanya reaksi ditandai dengan perubahan warna (Acharya,2013).
Uji fermentasi gula-gula dilakukan dengan menggunakan media yang mengandung masing-masing glukosa, maltose, manithol, maltosa, dan sukrosa. Hasil reaksi positif pada semua kandungan gula-gula tersebut ditandai dengan berubahnya media menjadi kuning cerah yang berarti bakteri mampu memfermentasi gula-gula yang terkandung pada media (Shila et al., 2013).
Uji antagonisme bakteri kitinolitik dengan jamur Fusarium solani
Hasil isolat bakteri kitinolitik selanjutnya diuji interaksinya dengan jamur
F. solani Pengujian dilakukan secara in vitro menggunakan metode uji tantang
suhu ruang selama 6 hari. Setiap jenis bakteri rizosfer diuji dengan pengulangan 3 kali (Geetha et al., 2014).
Pengamatan Hifa Abnormal
Dilakukan dengan mengamati ujung hifa F. solani yang bertemu dengan koloni bakteri (Hanif et al, 2011).
Peubah amatan Identifikasi bakteri
Identifikasi bakteri dilakukan dengan karakterisasi morfologi koloni dan morfologi bakteri, serta uji biokimia pada isolat bakteri tersebut. Setelah dilakukan karakterisasi, isolat-isolat diidentifikasi dengan menggunakan buku
Bergey’s Manual of Determinative Bacteriology Ninth Edition
(Holt et al, 1994).. Daerah Hambatan
Pengamatan terhadap persentase daya hambat bakteri rizosfer (DH) dilakukan dengan rumus :
DH = ��1−�2
�1 � x 100%
R1 adalah jari-jari pertumbuhan patogen ke arah tepi cawan Petri kontrol, R2
adalah patogen ke arah bakteri didalam cawan yang diberi perlakuan (Khaeruni et al., 2010).
Struktur Hifa Jamur Patogen
menggulung . Analisis Data
HASIL DAN PEMBAHASAN Isolasi dan Identifikasi Bakteri PGPR
[image:18.595.114.521.315.405.2]Isolasi bakteri kitinolitik diambil dari rizosfer pertanaman tembakau rakyat varietas Deli di desa Sunggal Kanan Kecamatan Sunggal Kabupaten Deli Serdang Sumatera Utara. Dari hasil isolasi bakteri kitinolitik yang berpotensi sebagai PGPR diperoleh sebanyak 12 isolat (tidak terlampir). Setelah dilakukan penapisan sebagai agen hayati dipilih sebanyak 4 isolat yang memiliki potensi penghasil enzim kitinase, yaitu sebagai berikut:
Tabel 1. Karakterisasi morfologi koloni bakteri
Kode Isolat Bentuk Koloni Tepi Koloni Elevasi Koloni Warna Koloni
SK1 Bulat Rata Cembung Kuning
SK2 Bulat Rata Cembung putih
SK4 Bulat Rata Cembung putih
[image:18.595.112.519.438.539.2]SK5 Bulat Rata Cembung Bening
Tabel 2. Karakterisasi fisiologi bakteri Kode
Isolat
Pengecatan
Gram Endospora Bentuk Sel Penataan Sel
SK1 Negatif Negatif Batang Monobacil
SK2 Negatif Negatif
Batang, Bulat
Monobacil, Monococcus
SK3 Negatif Negatif Batang Monobacil
SK4 Negatif Negatif Batang Monobacil
Tabel 3. Karakterisasi diferensial bakteri
Kode Isolat Oksidatif Fermentatif
SK1 Negatif Negatif
SK2 Negatif Negatif
SK3 Negatif Negatif
SK4 Negatif Negatif
Tabel 4. Uji biokimia bakteri
Jenis uji Isolat
SK1 SK2 SK3 SK4
[image:18.595.111.520.566.648.2]Jenis uji Isolat
SK1 SK2 SK3 SK4
Indol positif positif positif positif
MR
Metil glycon negatif negatif negatif negatif VP
Asetoin negatif positif positif negatif
SCA
Sitrat positif positif positif positif
SIM
H2S negatif negatif negatif negatif
Motilitas negatif negatif negatif positif UB
Urease positif positif positif positif
Gula-Gula
Gulkosa positif positif positif positif
Gas positif positif positif positif
Laktosa positif positif positif positif
Gas positif positif positif positif
Manitol positif positif positif positif
Gas positif positif positif positif
Maltosa positif positif positif positif
Gas positif positif positif positif
Sukrosa positif positif positif positif
Gas positif positif positif positif
Dari hasil karakterisasi morfologi, fisiologi, diferensial koloni, dan uji biiokimia, diperoleh hasil sebagai berikut:
SK 1 : Vibrio logei SK 2 : Aeromonas spp.
SK 3 : Aeromonas salmonicida SK 4 : Citrobacter diversus SK1 (Vibrio logei)
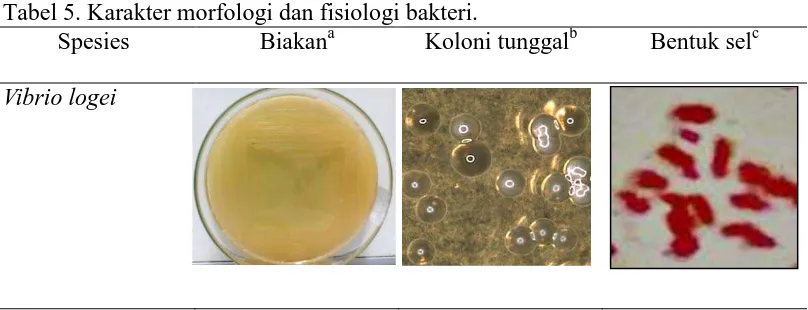
Bakteri ini (V. logei) tumbuh membentuk koloni berwarna kuning pada media karena kemampuannya menggunakan sukrosa sebagai sumber karbohidrat (Thomson, 2004). Terhadap uji fisiologi (Tabel 2) bakteri memiliki karakter gram negatif, tidak menghasilkan endospora, bentuk sel batang melengkung (koma) dan penataan sel monobasil. Hasil uji biokimia bakteri (Tabel 5) menunjukkan: oksidase positif ditandai dengan perubahan warna menjadi biru violet pada
Oxidase Test Strip Sitokrom Kovac’s yang telah digores bakteri. Hal ini
menandakan bakteri yang diuji bukan golongan Enterobacter. Uji fermentase glukosa bereaksi positif yang terlihat dengan perubahan warna kaldu glukosa menjadi kuning terang. Hal ini dikarenakan kemampuan Vibrio dalam memfermentasikan senyawa glukosa menjadi asam sehingga menurunkan pH media dan mengubah indikator metyl red menjadi warna kuning. Uji kemampuan isolat menggunakan Na+ untuk pertumbuhannya menunjukkan reaksi positif, bakteri dapat menghidrolisa lipid yang terkandung didalam media sehingga menghasilkan zona bening disekeliling koloni. V. logei menghasilkan pigmen luminescent yang dapat berpendar didalam kegelapan air dengan warna koloni kuning dan tidak dapat tumbuh pada suhu 300 C.
Berdasarkan Bergey’s Manual Determinative Bacteriology (1994) isolat SK 1 termasuk ke dalam famili Vibrionaceae, Gammaproteobacteria, yang merupakan gram negatif, berbentuk batang, mesofilik dengan metabolisme fermentasi yang fakultatif. Koloni V. logei dapat dilihat pada Tabel 5.
SK2 (Aeromonas spp.)
dan warna koloni putih (Tabel 2). Sedangkan karakterisasi fisiologi bakteri merupakan gram negatif, tidak memiliki endospora, bentuk sel batang dan penataan sel monobasil, namun ada juga monococcus. Menurut Reis (2006)
Aeromonas merupakan bakteri Gram negatif, tidak menghasilkan endospora,
berbentuk batang, dan fakultatif anaerobik. Hasil uji diferensial Aeromonas spp. oksidatif/fermentatif negatif dan uji katalase positif (Tabel 3).
Pada uji biokimia dasar Aeromonas spp. menunjukkan hasil positif uji oksidase, uji gula glukosa positif, tidak tumbuh membentuk zona bening pada media Na+. Berdasarkan Bergey’s Manual Determinative Bacteriology
Aeromonas memiliki karakteristik pada uji biokimia, yaitu positif pada uji
oksidase, dapat memfermentasi glukosa, tidak membentuk zona bening pada media Na+ , dan negatif pada uji VP. Karakter morfologi dan fisiologi Aeromonas spp. dapat dilihat pada Tabel 5.
SK3 (Aeromonas salmonicida )
Dari hasil identifikasi yang dilakukan pada SK3, bakteri ini memiliki karakter morfologi bentuk koloni bulat, tepi koloni rata dan elevasi koloni cembung, serta warna koloni putih. Karakter fisiologi, yaitu gram negatif, tidak menghasilkan endospora, bentuk sel batang dan penataan sel monobasil. Menurut Docan (2012) bakteri dengan Gram negatif berbentuk batang, tidak motil (tidak memiliki cilia), dengan panjang 0,8-1,2µm merujuk kepada katagori genus
Aeromonas, kriteria utama subspesies salmonicida adalah reaksi positif pada uji
oksidase dan ketiadaan motilitas.
(+), uji SIM H2S dan motilitas (-) merujuk pada spesies A. salmonicida sesuai dengan Bergey’s Manual Determinative Bacteriology. Karakter morfologi dan fisiologi bakteri dapat dilihat pada Tabel 5.
SK4 (Citrobacter diversus)
Pengamatan bakteri SK4 menunjukkan karakter morfologi bentuk koloni bulat, tepi koloni rata, elevasi koloni cembung, dan warna koloni bening. Karakter fisiologi bakteri gram negatif, tidak memiliki endospora, bentuk sel batang dan penataan sel monobasil. Hasil uji oksidatif/fermentatif (-/-) serta uji katalase positif. Menurut Meruvu & Donthireddy (2013) Citrobacter adalah genus dari gram negatif fakultatif anaerobik, berbentuk batang dan tidak menghasilkan endospora yang termasuk kedalam famili Enterobacter. Sesuai dengan namanya, bakteri ini menggunakan sitrat sebagai sumber karbon. Dalam penelitiannya
Citrobacter diisolasi dari sedimen semenanjung Bengal. Isolat yang didapatkan
termasuk ke dalam famili Enterobactericeae kelas Gammaproteobacteria dan menunjukkan aktivitas kitinolitik.
Uji biokimia dasar Citrobacter diversus uji oksidase (-), uji gula laktose (+), uji indol (+), uji sitrat (+), dan uji VP (-). Karakter morfologi dan fisiologi bakteri Citrobacter diversus dapat dilihat pada Tabel 5.
Tabel 5. Karakter morfologi dan fisiologi bakteri.
Spesies Biakana Koloni tunggalb Bentuk selc
Spesies Biakana Koloni tunggalb Bentuk selc
Aeromonas spp.
Aeromonas salmonicida
Citrobacter diversus
Keterangan : (a) kolonisasi bakteri pada media TSA 16 jam; (b) bentuk koloni tunggal dibawah mikroskop stereo perbesaran 4x10; (c) bentuk sel, penataan sel, dan pewarnaan Gram dibawah mikroskop compound 10x100.
Isolasi, Identifikasi dan Karakterisasi Penyakit Layu (Fusarium solani)
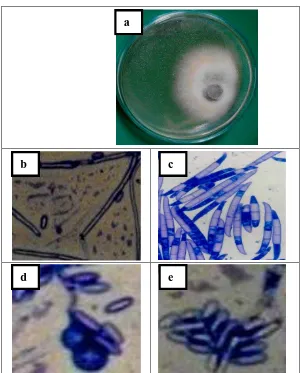
Gambar 6. (a). koloni Fusarium solani yang tumbuh di PDA dengan umur 18 hari;(b). hifa;(c). makrokonidia; (d). klamidiospora;(e). mikrokonidia
Presentase Daya Hambat
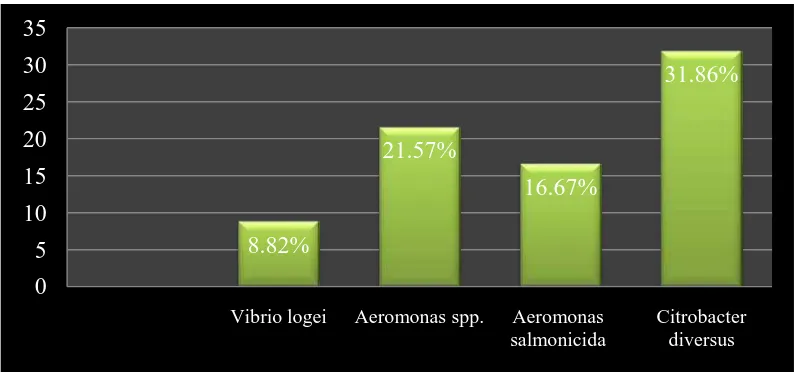
Hasil uji statistik menunjukkan presentase daya hambat bakteri kitinolitik terhadap F. solani menunjukkan nilai yang berbeda nyata (Gambar 9). Bakteri kitinolitik Citrobacter diversus menghambat F. solani dengan nilai terbesar, yaitu 31,863%. Kemudian disusul Aeromonas spp. 21,57% dan tidak berbeda nyata dengan perlakuan Aeromonas salmonicida sebesar 16,67%, tidak berbeda nyata dengan perlakuan Vibrio logei menghambat sebesar 8,82%.
a
e d
Kemampuan bakteri untuk memproduksi kitinase sangat bervariasi, mungkin disebabkan perbedaan suhu dan pH baik pada kondisi alami maupun perlakuan di laboratorium selama penelitian berlangsung (Dewi, 2008).
C. diversus menghambat pertumbuhan jamur F. solani dengan persentase
sebesar 31,86% berpotensi sebagai agen antagonis. Habib et al. (2016) menyatakan bahwa Citrobacter sp. efektif dalam mengkolonisasi akar sebagai PGPR maupun agen hayati karena memproduksi antibiotik, enzim ekstraseluler penghambat, kompetisi, parasitisme, menginduksi ketahanan sistemik dan mengkombinasi semua kemampuan tersebut sekaligus pada tanaman padi. Selain memiliki potensi kitinolitik sebagaimana yang telah diujikan, C. diversus juga memiliki kemampuan dalam menghasilkan IAA (Yaqoob et al., 2013) dan menghasilkan enzim selulotik yang mampu mendegradasi selulosa di dalam perut larva Holotrichia parallela (Huang et al., 2012).
Setelah identifikasi dilakukan ditemukan 3 bakteri dari genus Aeromonas, yaitu Aeromonas spp. dan A. salmonicida . Keduanya memiliki kemampuan yang berbeda dalam menghambat pertumbuhan F. solani. Genus Aeromonas ditemukan
8.82% 21.57% 16.67% 31.86% 0 5 10 15 20 25 30 35
Vibrio logei Aeromonas spp. Aeromonas salmonicida
Citrobacter diversus
mengkolonisasi rizosfer akar tanaman jagung GMO (Genetically Modified
Organism) mampu menghasilkan ammonia, hormon IAA, dan melkukan aktifitas
katalase yang penting dalam mendukung pertumbuhan tanaman (Bumunang & Babalola, 2014). Menurut Gupta et al. (2015) genus Aeromonas berperan penting sebagai PGPR karena mampu memproduksi siderofor. Gonzales et al. (2015) melaporkan bakteri A. salmonicida mendukung pertumbuhan tanaman tebu dengan menghasilkan hormon IAA yg cukup tinggi. Sedangkan bakteri V. logei yang sering ditemukan memarasit ikan juga memiliki potensi antagonisme dengan menghasilkan enzim kitinase. Bakteri genus Vibrio, yaitu V. vinelandii menghasilkan vibriobactin yang merupakan salah satu jenis siderofor (Saharan et
al., 2011)
Pertumbuhan Hifa Abnormal
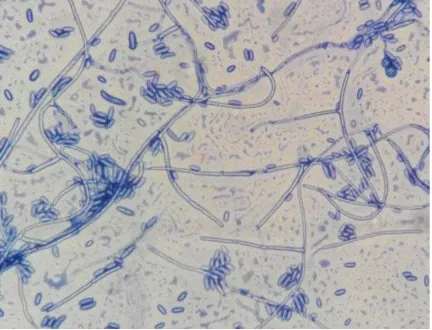
Uji daya hambat memperlihatkan pertumbuhan jamur abnormal (Tabel 6). Pertumbuhan abnormal berupa hifa lisis, melengkung ataupun memendek ataupun adanya pembengkakan hifa.
Tabel 6. Pertumbuhan hifa jamur patogen Fusarium solani abnormal pada uji daya hambat di media PDA.
Spesies Hifa Fusarium solani Abnormal Keterangan
Vibrio logei hifa bengkok,
menggulung menjauhi koloni bakteri
Hifa lisis.
Spesies Hifa Fusarium solani Abnormal Keterangan Hifa lisis.
Aeromonas salmonicida Hifa bengkok,
menggulung, membengkak dan lisis.
Hifa lisis,
mengeriting, dan menggulung.
Citrobacter diversus
Hifa yang mengalami lisis bisa dipastikan terjadi karena kemampuan bakteri mengahasilkan zat ekstraseluler berupa enzim selulase, protease, terutama enzim kitinase yang telah terbukti diproduksi oleh bakteri-bakteri yang berhasil diisolasi. Khaeruni et al. (2010) menyatakan kemampuan antagonis suatu suatu bakteri rizosfer melalui produksi siderofor, kitinase, antibiotik dan sianida merupakan salah satu mekanisme yang berperan dalam penghambatan pertumbuhan koloni cendawan patogen. Kamil et al. (2007) melaporkan hasil penelitian beberapa bakteri kitinolitik efektif menghambat pertumbuhan jamur patogen Rhizoctonia solani, Sclerotium rolfsii, Fusarium culmorum, Phytium sp.,
Alternaria alternate, dan Macrophomina phasiolina. Enzim kitinase yang
dihasilkan dapat menghidrolisis ikatan β-1,4 antar subunit N-asetilglukosamin (NAcGlc) pada polimer kitin. Mekanisme hidrolisis polimer kitin yang merupakan salah satu komponen penyusun dinding sel hifa jamur dapat menghambat pertumbuhan hifa (Ye & Ng, 2004).
KESIMPULAN DAN SARAN Kesimpulan
1. Dari hasil isolasi dan seleksi ditemukan 4 spesies bakteri kitinolitik
yang memiliki potensi antagonisme terhadap F. solani, yaitu
Vibrio logei, Aeromonas spp., Aeromonas salmonicida dan
Citrobacter diversus.
2. Persentase daya hambat bakteri kitinolitik menunjukkan hasil yang berbeda nyata di hari ketujuh setelah inokulasi. C. diversus menghambat F. solani dengan nilai terbesar, yaitu 31,86%. Kemudian disusul Aeromonas spp. 21,57% dan tidak berbeda nyata dengan perlakuan A. salmonicida sebesar 16,67%. V. logei menghambat sebesar 8,82%.
3. Pada uji daya hambat ditemukan adanya pertumbuhan hifa abnormal seperti hifa membengkok, mengeriting, menggulung, membengkak serta lisis.
Saran
TINJAUAN PUSTAKA Penyakit Layu (Fusarium solani)
Biologi
Secara taksonomi, Fusarium digolongkan ke dalam: Kingdom : Fungi
Filum : Ascomycota Kelas : Ascomycetes Ordo : Hypocreales Famili : Tuberculariaceae Genus : Fusarium
Spesies : Fusarium solani (Moretti, 2009).
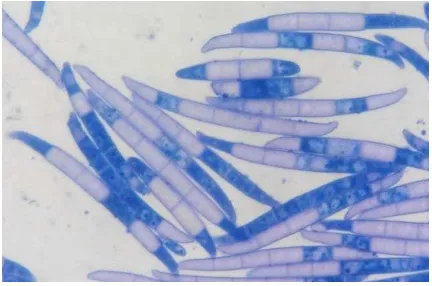
[image:31.595.190.406.556.721.2]Jamur yang termasuk ke dalam famili Tuberculariaceae ini diketahui menghasilkan konidia dalam bentuk tubercules, yang terdiri dari kumpulan konidiofor bercabang, sporodochia (Gambar 1). Dalam genus Fusarium makrokonidia ditularkan oleh sporodochia. Selanjutnya, agar dapat diidentifikasi sebagai Fusarium sp., makrokonidia ini harus panjang, ramping, bagian perut
melengkung, berbentuk seperti bulan sabit, bersekat, dan memiliki sebuah sel kaki basal (yaitu, sel basal dari sekat spora yang terletak pada sisi dorsal didekat titik menempelnya konidiofor). Makrokonidia muncul dari phialospores, bisa dikatakan diproduksi oleh phialide, yang merupakan lubang kecil di ujing konidiofor. Makrokonidia muncul satu persatu dan awalnya melekat pada konidiofor. Mereka diproduksi pada keadaan lembab, dalam tetesan-tetesan kecil, baik dikultur ataupun di alam. Makrokonidia tidak bertahan lama di dalam tanah (Smith, 2007).
Makrokonidia dari F. solani cenderung berbentuk silindris di bagian tengah, dinding sel nampak sejajar dan terhitung berat serta kuat. Makrokonidia jarang berbentuk melengkung, beberapa malah hampir lurus (Gambar 2). Mereka terbentuk dari phialides yang panjang, memproduksi sporodochia dan terkadang sangat banyak terbentuk di biakan, bentuknya menyatu dan meluar diatas permukaan. Spora-spora ini lebih kearah tumpul daripada runcing diujungnya, meskipun pangkalnya cukup jelas (Gambar 1). Makrokonidia sering mengandung pigmen biru, hijau atau kekuningan yang tidak bisa larut, yang terlihat sangat melekat pada bagian dalam dinding konidia (Smith, 2007).
[image:32.595.223.439.581.724.2]Siklus hidup Fusarium secara umum adalah sebagai berikut: organisme ini
tumbuh sebagai koloni hifa yang haploid, kecuali untuk dikaryotik (masing-masing sel mengandung dua inti induk haploid) dan diploid sebelum
tahap meiosis dan saat memproduksi sel haploid, spora diproduksi secara seksual (askospora). Askospora diproduksi dalam delapan kelompok kantung (askus) yang terkandung dalam struktur berbentuk labu (perithecium). Spesies yang Homotalik mampu melakukan pembuahan sendiri, memproduksi klon askospora (apomixis); sedangkan spesies heterotolik adalah steril (tidak dapat melakukan pembuahan sendiri). Tiga bentuk utama spora aseksual yang diproduksi dari proses mitosis, tergantung pada spesies. Spora aseksual kecil (mikrokonidia) diproduksi di miselium dalam struktur yang sederhana (konidiofor). Panjang, berbentuk seperti sampan, struktur spora bersekat (makrokonidia) diproduksi di agregasi konidiofor yang berbentuk seperti bantalan yang disebut sporodochia dan/atau konidiofor di miselium aerial. Spora resisten berdinding tebal (klamidiospora) diproduksi bersamaan dengan hifa atau makrokonidia (Ma et al., 2013).
Gejala Serangan
tetap perlu dilakukan untuk mengetahui cara pencegahan jamur ini menyebar ke tanaman yang lain (Mclaughlin, 2001).
Infeksi jamur Fusarium dimulai dari akar sekunder yang halus, kemudian meluas ke akar primer yang lebih besar melalui pembuluh xilem sebelum memasuki rimpang. Infeksi pada akar primer dan rimpang oleh patogen belum terlihat secara langsung. Jaringan xilem terdiri dari serangkaian pembuluh individual dengan ujung dinding berlubang di mana eksudat akar mengalir. Gerakan spora diblokir sementara oleh aliran eksudat, jadi spora menempel di bagian luar kemudian berkecambah dan hifa tumbuh melalui perforasi ke bagian dalam pembuluh dimana spora baru diproduksi (Daly & Walduck, 2006).
Faktor Yang Mempengaruhi
Suhu berpengaruh besar terhadap perkembangan jamur Fusarium. Suhu yang hangat akan menyebabkan ledakan penyakit. Ketika suhu berada dibawah 4.4o C pertumbuhan jamur akan tertekan, suhu yang lebih panas 10o akan mendukung pertumbuhan jamur. Semakin panas suhu, semakin besar kesempatan Fusarium akan berkembang dan menyerang lebih banyak jenis tanaman (Mclaughlin, 2001).
pada mesin pertanian, sepatu dan baju pekerja sebaik didalam tanah puing-puing tanaman terinfeksi dalam irigasi dan air banjir. Karena itu pertanian yang bersih
sangat penting dalam memperlambat penyebaran layu Fusarium (Kochman, 2007).
Pengendalian
Sebagaimana pencegahan dengan penyakit yang lain, langkah awal yang perlu dilakukan untuk pengamanan adalah memastikan benih atau bahan tanam yang digunakan bebas dari penyakit dan didapatkan pemasok yang terpercaya. Setelah infeksi, tidak banyak hal yang bisa dilakukan, tetapi sangat penting untuk memindahkan tanaman yang telah sakit secepat mungkin untuk meminimalisir penyebaran fungi. Tanaman tidak boleh dibiarkan layu akibat kekurangan air, rendahnya kelembapan tanaman merupakan salah satu penyebab pasti dari
Fusarium (Mclaughlin, 2001).
Pengendalian serangan penyakit di area yang sempit dapat dilakukan dengan cara mencabut tanaman yang terinfeksi beserta tanaman sehat sejauh 1-2 meter disekitarnya kemudian bakar didalam lubang tanah. Sedangkan untuk serangan dengan area yang lebih luas adalah dengan membunuh semua tanaman yang ada di area tersebut, lebih baik dengan herbisida lalu biarkan mati ditempat. Ketika seluruh tanaman telah mati dan hancur, budidayakan tanaman alternatif seperti serelia dan rumput-rumputan untuk mencegah erosi. Seluruh peralatan yang digunakan harus dibersihkan dengan desinfektan dan dibilas sampai benar-benar bersih. Limbah sisa pencucian harus diproses lebih lanjut agar tidak menjadi sumber inokulum dan mencemari lingkungan (Kochman, 2007).
Kitinase merupakan ketertarikan yang besar dalam bidang bioteknologi. Pertama, enzim-enzim ini mampu mengubah biomasa yang mengandung kitin menjadi komponen yang berguna (depolimerase). Kedua, kitinase bisa dimanfaatkan untuk mengendalikan jamur patogen dan hama tanaman. Ketiga, penghambat kitinase berpotensi menghambat pertumbuhan dari patogen dan hama yang mengandung kitin dan membutuhkan kitin dalam perkembangan normalnya (Brurberg et al. , 2000).
Penekanan bakteri kitinolitik terhadap jamur patogen adalah dengan melisis hifa jamur sebagai substrat untuk pertumbuhannya. Selain itu, bakteri juga dapat bersimbiosis dengan akar tanaman dan menghasilkan kitinase yang berperan sebagai pertahanan diri bagi tanaman dalam melawan patogen. Aplikasi bakteri kitinolitik dapat meningkatkan pertumbuhan tanaman lada terutama tinggi tanaman (Harni & Amaria, 2012).
Kemampuan antagonis dari bakteri kitinolitik terhadap pertumbuhan jamur akar putih ditandai dengan terhambatnya pertumbuhan jamur akar putih di sekitar koloni bakteri kitinolitik. Kemampuan isolat bakteri kitinolitik dalam menghambat pertumbuhan jamur akar putih disebabkan aktivitas enzim kitinase yang dihasilkan oleh isolat tersebut yang mampu mendegradasi kitin yang terkandung di dalam dinding sel jamur (Muharni & Widjajanti, 2011).
Berdasarkan penelitian Khaeruni et al. (2010) dari 25 isolat bakteri rizosfer yang diuji, semuanya mampu menghambat perkembangan cendawan
patogen Fusarium oxysporum, Rhizoctonia solani, Sclerotium rolfsii dan
Phytophthora capsici dan memiliki daya hambat lebih dari 30%. Kemampuan
tersebut memiliki sifat antagonis yang kuat terhadap berbagai jenis cendawan patogen tumbuhan. Kemampuan antagonis tersebut diduga erat kaitannya dengan kemampuan isolat-isolat tersebut memproduksi enzim ekstraseluler seperti kitinase, protease dan selulase.
Kamil et al. (2007) membuktikan bahwa dari 400 isolat bakteri kitinolitik yang diuji, dua puluh isolat menunjukkan aktivitas kitinase. Selanjutnya, isolat-isolat yang menunjukkan aktivitas kitinase tertinggi dibandingkan dengan isolat-isolat yang lainnya dan diidentifikasi sebagai Bacillus licheniformis, Stenotrophomonas
maltophilia, Bacillus licheniformis dan Bacillus thuringiensis, B. thuringiensis
terbukti aktif terhadap serangga Lepidoptera.
Hariprasad et al. (2011) menyatakan bahwa kitinolitik rhizobakteri isolat
Bacillus subtilis yang dipilih memiliki potensi tidak hanya untuk meningkatkan
pertumbuhan tanaman, tetapi juga untuk melindungi bibit tomat dari infeksi
F. oxysporum melalui kitinase memproduksi kemampuannya. Suplementasi kitin /
CFCW (crude fungal cell wall) meningkatkan kemampuan B. subtilis untuk mengurangi penyakit layu Fusarium dan juga meningkatkan populasi mereka di rizosfer.
tinggi selama mekanisme antagonisme efektif menghambat pertumbuhan jamur
A. niger. Aktivitas antagonisme bakteri kitinolitik dengan mekanisme enzimatik
dapat menghambat pertumbuhan hifa A. niger dengan cara merusak dinding selnya sehingga hifa A. niger membengkak, membengkok, mengeriting, mengecil, dan melisis (Ayu et al., 2011).
Aktivitas antagonis dari enam isolat bakteri kitinolitik memiliki penghambatan yang hampir sama, menyebabkan hifa Curvularia sp. mengalami pertumbuhan hifa yang abnormal diantaranya hifa lisis, hifa patah, hifa bengkok, hifa melilit, hifa menggulung, dan hifa kerdil. Hasil dari pengamatan struktur hifa abnormal Curvularia sp. menunjukkan bahwa isolat Bacillus sp. BK13 dan
Enterobacter sp. BK15 lebih banyak menyebabkan pertumbuhan hifa abnormal
PENDAHULUAN Latar Belakang
Sub-sektor perkebunan merupakan penyumbang ekspor terbesar di sektor pertanian dengan nilai ekspor yang jauh lebih besar dibandingkan nilai impornya. Sebagian besar produk perkebunan utama diekspor ke negara-negara lain. Ekspor komoditas perkebunan tumbuh dengan laju 6,9% per tahun. Laju pertumbuhan nilai ekspor komoditi tembakau mengalami percepatan bersama dengan komoditi teh dan kakao (Kementerian Pertanian, 2015).
Berita yang dimuat di dikutip pada tanggal 17 Juni 2015 berisi Aliansi Masyarakat Tembakau Indonesia (AMTI) menyatakan, ekspor dan produk tembakau olahan Indonesia diperkirakan tumbuh sekitar 10 persen menjadi US$ 1,1 miliar pada 2015 dari target ekspor tahun ini sebesar US$ 1 miliar (Denis, 2014).
Untuk meningkatkan pendapatan petani tembakau sekaligus meningkatkan ekspor, pemerintah telah menganjurkan kepada petani tembakau untuk melaksanakan intensifikasi. Dalam pelaksanaan intensifikasi ini agar petani tembakau berhasil maka perlu diatur langkah-langkahnya. Salah satu faktor yang menentukan keberhasilan intensifikasi adalah masalah proteksi tanaman atau perlindungan tanaman dari penyakit sejak dini (Ratmawati, 2015).
Salah satu penyakit yang disebabkan oleh cendawan adalah penyakit layu
Fusarium yang disebabkan oleh cendawan Fusarium sp. Penyebaran cendawan
Fusarium sangat cepat dan dapat menyebar ke tanaman lain dengan cara
lateral dan melalui luka-luka, yang kemudian menetap dan berkembang di berkas pembuluh. Setelah memasuki akar tanaman, miselium akan berkembang hingga mencapai jaringan korteks akar. Pada saat miselium cendawan mencapai xilem, maka miselium ini akan berkembang hingga menginfeksi pembuluh xilem. Miselium yang telah menginfeksi pembuluh xilem, akan terbawa ke bagian lain tanaman sehingga mengganggu peredaran nutrisi dan air pada tanaman yang menyebabkan tanaman menjadi layu (Semangun, 2005).
Pengendalian yang biasa dilakukan oleh petani untuk mengendalikan layu Fusarium yaitu membongkar dan membakar tanaman yang sakit. Pengendalian cendawan penyebab penyakit layu Fusarium ini perlu dikaji lebih dalam untuk mengetahui metode pengendalian yang tepat khususnya pengendalian yang ramah lingkungan (Nugraheni, 2010). Penggunaan mikroorganisme dari golongan jamur dan bakteri sebagai pengendali hayati penyakit tanaman mempunyai prospek yang sangat baik di masa yang akan datang. Hal ini dikarenakan kedua golongan mikroorganisme ini selain mudah dibiakkan dan diperbanyak juga dapat diperoleh di areal pertanian itu sendiri. Selain itu penggunaan agensia pengendali hayati dalam mengendalikan organisma pengganggu tanaman (OPT) semakin berkembang karena cara ini lebih unggul dibanding pengendalian berbasis pestisida. Beberapa keunggulan tersebut adalah: aman bagi manusia dan musuh alami; dapat mencegah timbulnya ledakan OPT sekunder; produk tanaman yang dihasilkan bebas dari residu pesti sida; muda didapat karena ada di sekitar pertanaman sehingga dapat mengurangi ketergantungan petani terhadap pestisida
Berbagai manfaat positif dari bakteri dalam rizosfer telah menjadikannya sumber potensial bagi ketersediaan nutrisi dalam tanah serta mendorong pertumbuhan tanaman sehingga menjadi lebih baik. Beberapa bakteri tanah berasosiasi dengan akar tanaman budidaya dan memberikan pengaruh yang bermanfaat pada tanaman inangnya. Bakteri ini dikelompokkan ke dalam PGPR (Plant Growth Promoting Rhizobacteria). Strain PGPR yang sering ditemukan di antaranya Pseudomonas fluorescence (Dewi, 2007).
Pengendalian penyakit tanaman dengan agen pengendali hayati (APH) seperti Plant Growth Promoting Rhizobacteria (PGPR) perlu dimanfaatkan dalam usaha tani perkebunan ramah lingkungan dan berkelanjutan. PGPR merupakan bakteri pemacu pertumbuhan yang hidup di akar dapat menghasilkan antibiotik, sebagai kompetitor, menginduksi ketahanan tanaman untuk pengendalian patogen penyakit dan hama, serta dapat mensekresikan senyawa-senyawa berguna bagi pertumbuhan tanaman (Tombe, 2013).
Pemanfaatan bakteri rizosfer sebagai agensia hayati dan pemacu pertumbuhan tanaman sangat menguntungkan tanaman karena tidak bersifat toksik bagi tanaman, efektif dalam mengendalikan patogen dan meningkatkan ketahanan tanaman, serta tidak menimbulkan dampak negatif terhadap lingkungan. Bakteri rizosfer juga efektif selama masa hidup tanaman dan dapat menghasilkan senyawa tertentu yang berfungsi sebagai hormon tumbuh, penyedia dan memobilisasi unsur hara sehingga memberi manfaat ganda sebagai pupuk hayati dan agens hayati (Khaeruni et al., 2010).
(biokontrol). Meskipun secara konseptual kedua efek ini sangat berbeda, dalam prakteknya sangat sulit bahkan hampir tidak mungkin untuk menentukan perbedaan dan batas antara keduanya. Biokontrol terhadap patogen tumbuhan tampaknya menjadi mekanisme utama dari PGPR (Plant Growth Promoting
Rhizobacteria). Penekanan patogen tumbuhan merupakan hasil dari produksi
metabolit sekunder atau datang pada tanaman dengan sendirinya sebagai sistem pertahanannya. PGPR berbasis inokula seharusnya dapat bersaing dengan mikroorganisme indigenous dan dengan efisien mendiami daerah perakaran tanaman untuk melindunginya. Satu pendekatan untuk menyeleksi organisme dengan potensi untuk mengontrol patogen tumbuhan tular tanah (soilborne
phytopathogens) adalah dengan mengisolasi organisme itu dari tanah suppresive
terhadap patogen itu (Dewi, 2007).
Salah satu jenis dari bakteri rizosfer akar adalah bakteri kitinolitik yang memproduksi enzim kitinase. Menurut Ginting (2007) pada tanaman, kitinase dihasilkan dan diakumulasi sebagai respon akibat infeksi jamur atau simbion jamur. Kitinase berperanan penting dalam pengendalian hayati jamur dan nematoda patogen tanaman dimana patogen tersebut menyerang tanaman dengan cara hidup parasit. Kitinase yang dihasilkan oleh rhizobakteri diyakini mempunyai peran aktif dalam pengendalian jamur patogen tanaman.
Sullia et al. (2012) melaporkan Pseudomonas spp. yang diisolasi dari tanaman kubis,gandum, padi, kentang dan tomat (famili solanaceae) mampu menekan pertumbuhan jamur patogen Alternaria brassicae, Alternaria
brassicicola, Alternaria alternate, Collectotrichum gleosporoides, Fusarium
menekan pertumbuhan jamur patogen karena menghasilkan siderofor,
hydrocyanid acid dan enzim seperti kitinase dan selulase.
Dari paparan diatas peneliti tertarik untuk melakukan penelitian mengenai potensi bakteri kitinolitik rizosfer tanaman tembakau sebagai agens antagonis untuk mengendalikan jamur patogen penyebab layu (F. solani).
Tujuan Penelitian
Untuk mengeksplorasi bakteri kitinolitik rizosfer akar tanaman tembakau (Nicotiana tabaccum) yang bersifat antagonis terhadap jamur patogen penyebab penyakit layu (F. solani) dan mengetahui potensinya dalam mengendalikan penyakit tersebut.
Hipotesis Penelitian
Terdapat bakteri kitinolitik pada rizosfer akar tanaman tembakau yang memiliki kemampuan antagonisme terhadap patogen F. solani.
Kegunaan Penelitian
ABSTRACT
“Potential antagonism of chitinolytic rhizosphere bacteria root colonizer of
tobacco (Nicotiana tabaccum) to control fungi wilt disease pathogen (Fusarium solani)”. Chitinolytic bacteria which has role as Plant growth
promoting rhizobacteria (PGPR) can control soil borne pathogen Fusarium solani that caused Fusarium wilt by producing chitinase enzyme. The purpose of this research is to explore chitinolytic bacteria that have potential antagonism as biocontrol agents against Fusarium wilt. The research was conducted at Plant Disease Laboratory, Department of Agroecotechnology, Faculty of Agriculture, University of Sumatera Utara, Medan from September 2015 to March 2016. It was arrange by using Completely Randomized Design (CRD) Non Factorial with four treatments : SK 1, SK 2, SK 3, SK 4. The identification results in morphological, physiological, and biochemical tests showed that the isolates were SK 1 (Vibrio logei), SK 2 (Aeromonas spp.), SK3 (Aeromonas salmonicida), SK 4 (Citrobacter diversus). The highest percentage of inhibiting zone was produced by
C. diversus (31.86%), followed by Aeromonas spp. (21.57%), A. salmonicida
(16.67%), and Vibrio logei (7.84%).
ABSTRAK
“Potensi Antagonisme bakteri kitinolitik rizosfer akar tembakau (Nicotiana tabaccum) Terhadap Penyakit Layu (Fusarium solani)”. Bakteri
kitinolitik yang memiliki peran sebagai Plant growth promoting rhizobacteria
(PGPR) dapat mengendalikan patogen tular tanah Fusarium solani penyebab
penyakit layu dengan menghasilkan enzim kitinase. Penelitian bertujuan untuk mendapatkan bakteri kitinolitik yang memiliki potensi antagonisme yang dapat digunakan sebagai agens hayati mengendalikan penyakit layu Fusarium. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan dari September 2015 sampai dengan Maret 2016. Penelitian ini menggunakan Rancangan Acak Lengkap nonfaktorial dengan 4 perlakuan, yaitu: SK 1, SK 2, SK 3, SK 4. Hasil identifikasi secara morfologi, fisiologi dan uji biokimia menunjukkan bahwa isolat-isolat yang didapat adalah sebagai berikut: SK1:
Vibrio logei, SK 2: Aeromonas spp., SK3: Aeromonas salmonicida, SK
4:Citrobacter diversus. Dari keempat isolat bakteri, isolat C. diversus memiliki pesentase daya hambat terhadap jamur F. solani paling besar (31.86%) kemudian diikuti Aeromonas spp. sebesar (21.57%), A. salmonicida (16.67%), dan
Vibrio logei (7.84%).
POTENSI ANTAGONISME BAKTERI KITINOLITIK RIZOSFER AKAR TANAMAN TEMBAKAU (Nicotiana tabaccum)TERHADAP
PENYAKIT LAYU (Fusarium solani)
SKRIPSI
OLEH :
INDRIA PRATIDINA
110301204 / AGROEKOTEKNOLOGI
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
POTENSI ANTAGONISME BAKTERI KITINOLITIK RIZOSFER AKAR TANAMAN TEMBAKAU (Nicotiana tabaccum )TERHADAP
PENYAKIT LAYU (Fusarium solani)
SKRIPSI
OLEH :
INDRIA PRATIDINA
110301204 / AGROEKOTEKNOLOGI
Skripsi Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa, karena berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan usulan penelitian ini tepat pada waktunya.
Adapun judul dari laporan ini adalah “Potensi Antagonisme Bakteri Kitinolitik Rizosfer Akar Tanaman Tembakau (Nicotiana tabaccum) Terhadap Penyakit Layu (Fusarium solani)” yang merupakan salah satu syarat untuk dapat melaksanakan penelitian di Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada komisi
pembimbing Ir. Mukhtar Iskandar Pinem, M.Agr. sebagai ketua dan Irda Safni, SP. M.C.P., Ph.D. sebagai Anggota yang telah membimbing dalam
memulai penelitian ini.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari kata sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan penelitian di masa mendatang. Akhir kata, penulis mengucapkan terima kasih.
Medan, Oktober 2016
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 5
Hipotesis Penelitian ... 5
Kegunaan Penulisan ... 5
TINJAUAN PUSTAKA Penyakit Layu (Fusarium solani) ... 6
Biologi Penyakit ... 6
Gejala Serangan ... 8
Faktor Yang Mempengaruhi ... 9
Pengendalian ... 10
Bakteri Kitinolitik ... 10
BAHAN DAN METODE Tempat Dan Waktu Percobaan ... 14
Bahan Dan Alat... 14
Metode Penelitian ... 14
Pelaksanaan Penelitian... 15
Pengambilan Sampel Bakteri Kitinolitik Dari Lapangan ... 15
Isolasi dan Seleksi Bakteri Kitinolitik ... 15
Pengukuran Indeks kitinolitik ... 15
Identifikasi Bakteri ... 16
Uji Antagonisme Bakteri Kitinolitik Terhadap Fusarium solani ... 19
Pengamatan Hifa Abnormal ... 20
Peubah Amatan ... 20
HASIL DAN PEMBAHASAN Isolasi dan Identifikasi Bakteri ... 22
Persentase Daya Hambat ... 28
KESIMPULAN DAN SARAN
Kesimpulan ... 34 Saran ... 34 DAFTAR PUSTAKA
DAFTAR TABEL
No. Keterangan Halaman
1. Karakterisasi morfologi koloni bakteri ... 22
2. Karakterisasi fisiologi bakteri ... 22
3. Karakterisasi diferensial bakteri ... 22
4. Uji biokimia bakteri ... 22
5. Karakter morfologi dan fisiologi bakteri ... 26
DAFTAR GAMBAR
No. Keterangan Halaman
1. Mikroskopis Fusarium solani ... 6
2. Makrokonidia Fusarium solani ... 7
3. Bentuk sel bakteri ... 16
4. Ukuran, bentuk, dan elevasi koloni bakteri ... 16
5. Karakter morfologi dan fisiologi bakteri ... 26
6. Makroskopis dan mikroskopis Fusarium solani... 28
7. Histogram persentase daya hambat ... 29
DAFTAR LAMPIRAN
No. Keterangan Halaman