PERTUMBUHAN EKSPLAN TUNAS APIKAL KELAPA
SAWIT (Elaeisguineensis
Jacq
.) PADA MEDIA MS DENGAN
KOMBINASI BAP DAN 2,4-D
HASIL PENELITIAN
Diajukan Untuk Melengkapi Tugas dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
NOVI ASTUTI 090805067
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN
ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERTUMBUHAN EKSPLAN TUNAS APIKAL KELAPA SAWIT
(ElaeisguineensisJacq.) PADA MEDIA MS DENGAN KOMBINASI BAP
DAN 2,4-D
ABSTRAK
Penelitian Kultur Tunas Apikal kelapa sawit (ElaeisguineensisJacq.)pada media MS dengan penambahan BAP dan 2,4-D telah dilakukan di Labaroratorium Kultur Jaringan, Departemen Biologi FMIPA Universitas Sumatera Utara. Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi Benzil Amino Purin(BAP)dan Asam 2,4-diklorofenoksi asetat (2-4D) terbaik terhadap pertumbuhan tunas apikal kelapa sawit dalam kultur in vitro. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) Faktorial dengan 2 faktorial yaitu faktor konsentrasi 2,4-Ddengan taraf 0; 110; 120; dan 130 ppm dan BAPdengan taraf 0; 0,17; 0,23; dan 0,29 ppm. Penelitian menggunakan lima variabel yaitu waktu tumbuh kalus, persentase kultur yang membentuk kalus, warna kalus, berat basah kalus dan persentase kalus embriogenik. Hasil analisis menunjukkan kalus pertama kali tumbuh pada perlakuan 130 ppm 2,4-D dan 0,29 ppm BAP. Persentase eksplan memebentuk kalus sebanyak 75%. Berat basah tertinggi pada perlakuan 130 ppm 2,4-D dan 0,29 ppm BAP. Warna kalus yang terbentuk putih kuning dan putih coklat. Pada penelitian yang sudah dilakukan di peroleh 50% kalus embriogenik.
Kata kunci: Tunas apikal, Kelapa Sawit (ElaeisguineensisJacq.), BAP, 2,4-D,
In vitro
THE EXPLANT GROWTH OF OIL PALM (Elaeis guineensis Jacq.)
ABSTRACT
The research about oil palm (Elaeis guineensis Jacq.) apical bud in the MS medium by using combination 2,4-D and BAP has been performed in Tissue Culture Laboratory, Departemen of Biology, University of Sumatera Utara.The aim of this research was to determine the effect of concentration of Benzyl Amino Purin (BAP) and 2,4- dichlorophenoxy acetic acid on the growth of the apical bud oil palm in vitro culture. Completely Randomized Design Method (RAL) with 2 factors namely 2,4-D with fourlevels 0; 110; 120; and 130 ppm, and BAP with four levels 0; 0,17; 0,23; and 0,29 ppm. The research uses five variables, those are time of callus oil palm, the percentage of callus, callus fresh weight and the percentage of embriogenic callus. The results of the statistical analysis showed that callus was initiated MS media enriched at 130 ppm and 0,29 ppm BAP. The percentage of explants forming callus as much as 75%. The highest fresh weight at 130 ppm 2-4-D and 0,29 ppm BAP . Calli were formed yellow white colour and white brown. Treatments have been carried out obtaining 50% embryogenic callus.
DAFTAR ISI
2.1 Botani Kelapa Sawit (Elaeis guineensis Jacq.) 4 2.2 Kultur Jaringan Kelapa Sawit 5 2.3 Media Kultur Jaringan 6
2.4 Eksplan 7
Ban 4 Hasil dan Pembahasan
4.1 Persentase Eksplan Yang Membentuk Kalus 15 4.2Waktu Tumbuh Kalus Tunas Apikal Kelapa Sawit 16
4.3 Berat Basah Kalus 18
4.4 Warna Kalus 20
Bab 5 Kesimpulan dan Saran
5.1 Kesimpulan 23
5.2 Saran 23
DAFTAR TABEL
Nomor Tabel
Halaman
Tabel 4.1 Persentase Kultur yang Membentuk Kalus 16 Tabel 4.2 Hasil Uji Rata- rata Waktu Tumbuh Kalus 17 Tabel 4.3 Hasil Uji Rata- rata Berat Basah Kalus 19 Tabel 4.4 Warna Kalus Eksplan Tunas Apikal Kelapa Sawit (Elaeis
guineensis Jacq.) pada Berbagai Konsentrasi BAP dan 2,4-D
secara In vitro
DAFTAR GAMBAR
Nomor Gambar
Halaman
DAFTAR LAMPIRAN
Nomor Lamp
Halaman
Lampiran 1 Data Persentase Kultur Yang membentuk Kalus 28 Data Pengamatan Waktu Tumbuh Kalus Tunas Apikal Kelapa
Sawit
29
Lampiran 3 Data Pengamatan Berat Basah Kalus 31 Lampiran 4 Data Persentase Kalus Embriogenik 33 Lampiran 5 Komposisi Media MS (Murashige & Skoog) 1962 34 Lampiran 6 Alur Kerja Pengkulturan Apical Bud Kelapa Sawit (Elaeis
guineensis Jacq.) dan Penambahan Media Ms dengan
Diperkaya BAP dan 2,4-D
PERTUMBUHAN EKSPLAN TUNAS APIKAL KELAPA SAWIT
(ElaeisguineensisJacq.) PADA MEDIA MS DENGAN KOMBINASI BAP
DAN 2,4-D
ABSTRAK
Penelitian Kultur Tunas Apikal kelapa sawit (ElaeisguineensisJacq.)pada media MS dengan penambahan BAP dan 2,4-D telah dilakukan di Labaroratorium Kultur Jaringan, Departemen Biologi FMIPA Universitas Sumatera Utara. Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi Benzil Amino Purin(BAP)dan Asam 2,4-diklorofenoksi asetat (2-4D) terbaik terhadap pertumbuhan tunas apikal kelapa sawit dalam kultur in vitro. Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) Faktorial dengan 2 faktorial yaitu faktor konsentrasi 2,4-Ddengan taraf 0; 110; 120; dan 130 ppm dan BAPdengan taraf 0; 0,17; 0,23; dan 0,29 ppm. Penelitian menggunakan lima variabel yaitu waktu tumbuh kalus, persentase kultur yang membentuk kalus, warna kalus, berat basah kalus dan persentase kalus embriogenik. Hasil analisis menunjukkan kalus pertama kali tumbuh pada perlakuan 130 ppm 2,4-D dan 0,29 ppm BAP. Persentase eksplan memebentuk kalus sebanyak 75%. Berat basah tertinggi pada perlakuan 130 ppm 2,4-D dan 0,29 ppm BAP. Warna kalus yang terbentuk putih kuning dan putih coklat. Pada penelitian yang sudah dilakukan di peroleh 50% kalus embriogenik.
Kata kunci: Tunas apikal, Kelapa Sawit (ElaeisguineensisJacq.), BAP, 2,4-D,
In vitro
THE EXPLANT GROWTH OF OIL PALM (Elaeis guineensis Jacq.)
ABSTRACT
The research about oil palm (Elaeis guineensis Jacq.) apical bud in the MS medium by using combination 2,4-D and BAP has been performed in Tissue Culture Laboratory, Departemen of Biology, University of Sumatera Utara.The aim of this research was to determine the effect of concentration of Benzyl Amino Purin (BAP) and 2,4- dichlorophenoxy acetic acid on the growth of the apical bud oil palm in vitro culture. Completely Randomized Design Method (RAL) with 2 factors namely 2,4-D with fourlevels 0; 110; 120; and 130 ppm, and BAP with four levels 0; 0,17; 0,23; and 0,29 ppm. The research uses five variables, those are time of callus oil palm, the percentage of callus, callus fresh weight and the percentage of embriogenic callus. The results of the statistical analysis showed that callus was initiated MS media enriched at 130 ppm and 0,29 ppm BAP. The percentage of explants forming callus as much as 75%. The highest fresh weight at 130 ppm 2-4-D and 0,29 ppm BAP . Calli were formed yellow white colour and white brown. Treatments have been carried out obtaining 50% embryogenic callus.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman penghasil minyak nabati utama di Indonesia. Ditinjau dari segi ekonomi, kelapa sawit memegang peranan penting untuk memenuhi kebutuhan minyak, meningkatkan pendapatan negara dan menggerakan pembangunan, khususnya diluar pulau jawa (Tondok, 1988). Untuk meningkatkan peranan kelapa sawit maka diperlukan bibit yang banyak dan seragam. Salah satu penyediaan bibit kelapa sawit yaitu melalui kultur jaringan. Kelebihan perbanyakan melalui kultur jaringan adalah mampu menghasilkan bibit dalam jumlah banyak dalam waktu yang singkat. Namun, kelapa sawit hasil perbanyakan kultur jaringan seringkali menghasilkan bunga dan buah yang abnormal, berbeda dengan tanaman dari benih (Touchet et al. 1991). Tanaman yang berasal dari benih sering terjadi abnormalitas pada saat mulai berbunga, namun menjadi stabil berbunga dan berbuah normal pada umur 2,5 tahun (Lubis, 1992)
Dalam usaha mengatasi abnormalitas tanaman kelapa sawit maka dilakukan kultur tunas apikal. Kultur tunas apikal adalah teknik mikropropagasi yang dilakukan dengan cara mengkulturkan eksplan yang mengandung meristem pucuk (apikal dan lateral) dengan tujuan merangsang dan perbanyakan kalus. Kelebihan kultur meristem adalah mampu menghasilkan bibit tanaman yang identik dengan induknya dan bebas virus. Rice et al. (1992), mengatakan bahwa kultur meristem meningkatkan laju induksi dan penggandaan tunas, mampu memperbaiki mutu bibit yang dihasilkan, mempertahankan sifat-sifat baik dari morfologi.
bulan. Cara ini disebut recloning untuk mempersingkat waktu dan mengenali karakter bibit.
Penelitian ini sudah dilakukan oleh Thuzar et al.(2012) pada kelapa sawit (Elaeis guineensis Jacq.) cv. Tenera. Zat Pengatur Tumbuh 2,4-D yang digunakan dengan konsentrasi 100, 120 dan 140 ppm. Hasil yang didapat kalus yang banyak tumbuh terdapat pada konsentrasi 120 ppm.
Dalam kultur jaringan, dua golongan ZPT yang sangat penting adalah sitokinin dan auksin (Gunawan, 1990). Menurut Gati & Mariska (1992), 2,4-D (asam 2,4-diklorofenoksi asetat) efektif untuk merangsang pembentukan kalus karena aktivitas yang kuat untuk memacu proses diferensiasi sel, organogenesis dan menjaga pertumbuhan kalus. Menurut George & Sherrington (1984) dalam perbanyakan in vitro, sitokinin berperan penting dalam memicu pembelahan dan pemanjangan sel sehingga dapat mempercepat perkembangan dan pertumbuhan kalus. Salah satu golongan sitokinin yang sering digunakan adalah BAP, hal ini dikarenakan sifat BAP yang stabil, mudah diperoleh dan lebih efektif.
Keberhasilan dalam penggunaan metode in vitro sangat tergantung pada media yang digunakan. Kultur media jaringan tanaman tidak hanya menyediakan unsur hara makro dan mikro saja tetapi juga vitamin, karbohidrat, dan ZPT (Pierik, 1987). Sel-sel memerlukan zat pengatur tumbuh untuk inisiasi dalam media kultur jaringan. Pembentukan kalus ditentukan oleh penggunaan- penggunaan yang tepat dari ZPT tersebut.
1.2 Permasalahan
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk memperoleh konsentrasi optimum BAP dan 2,4-D terhadap pertumbuhan tunas apikal kelapa sawit dalam kultur in vitro.
1.4 Hipotesis
Konsentrasi 2,4-D dan BAP yang tepat pada kultur jaringan tunas apikal kelapa sawit mampu menginduksi kalus embriogenik
1.5 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Botani Kelapa Sawit (Elaeis guineensis Jack.)
Kelapa sawit merupakan tanaman yang berasal dari Nigeria di Afrika Barat, kemudian menyebar ke Amerika Selatan dan sampai kesemenanjung Indo- Malaysia. Tanaman kelapa sawit masuk ke Indonesia untuk pertama kalinya dibawa oleh bangsa Belanda pada tahun 1848, tepatnya di kebun Raya Bogor. Tanaman kelapa sawit mulai dikenal di Indonesia dan dibudidayakan secara komersil dalam bentuk perusahaan perkebunan pada tahun 1911. Pada mulanya hanya berkembang di Sumatera Utara dan Riau yang kemudian berkembang di seluruh Indonesia (Hartley, 1917). Menurut Tjitrosomo (2000), klasifikasi kelapa sawit adalah sebagai berikut:
Kingdom : Plantae
Divisio : Tracheophyta
Subdivisio : Angiospermae
Subkelas : Monocotiledonae
Ordo : Arecales
Famili : Arecaceae
Genus : Elaeis
Spesies : Elaeis guineensis Jacq.
tulang-tulang daun sejajar. Panjang pelepah daun kelapa sawit adalah 5- 7 m, dalam satu pelepah terdapat 200- 400 helai anak daun. Dalam satu pohon kelapa sawit bisa terdapat lebih dari 60 pelepah (Hadi, 2004).
Menurut Hartley et al. (1977), kelapa sawit dibedakan ke dalam tiga tipe berdasarkan ketebalan cangkang buahnya yaitu dura, psifera, dan tenera. dura memiliki ketebalan cangkang 2- 8 mm, kandungan mesokarp sekitar 35- 55%. Tenera memiliki ketebalan cangkang 0,5- 4 mm, kandungan mesokarp sekitar 60- 90%. Psifera memiliki cangkang yang lebih tipis. Ketebalan cangkang dikendalikan oleh gen tunggal.
2.2 Kultur Jaringan Kelapa Sawit
Kultur jaringan terdiri dari dua kata yaitu kultur yang memiliki arti budidaya dan jaringan yang berarti sekelompok sel yang mempunyai bentuk dan fungsi yang sama (Nugroho & Sugito, 2005). Menurut George & Sherrington (1984), kultur jaringan tanaman merupakan teknik menumbuhkembangkan bagian tanaman baik berupa sel, jaringan atau organ dalam kondisi aseptik secara in vitro. Meskipun pada prinsipnya semua sel dapat ditumbuhkan, sebaiknya dipilih bagian tanaman yang masih muda dan mudah tumbuh.
Perbanyakan melalui kultur in vitro dapat dilakukan melalui 3 cara, yaitu pembentukan tunas adventif, proliferasi tunas lateral, dan embriogenesis somatik. Proliferasi tunas lateral dapat dilakukan dengan cara mengkulturkan tunas aksilar atau tunas terminal ke dalam media yang mempunyai komposisi yang sesuai untuk proliferasi tunas sehingga diperoleh penggandaan tunas dengan cepat. Setiap tunas yang dihasilkan dapat dijadikan sebagai sumber untuk penggandaan tunas selanjutnya sehingga diperoleh tunas yang banyak dalam waktu yang relatif lebih singkat. Menurut Mariska & Sukmadjaja (2003), faktor perbanyakan dengan teknik kultur in vitro jauh lebih tinggi dari cara konvensional. Selain itu, teknologi ini juga lebih menjamin keseragaman, bebas penyakit, dan biaya pengangkutan yang lebih murah.
Menurut Wetherell (1982), bahwa sel atau jaringan tanaman pada dasarnya dapat ditanam secara terpisah dalam suatu kultur (in vitro). Sel dan jaringan yang ditanam dengan cara ini, memiliki kemampuan untuk beregenerasi menjadi bagian yang diperlukan untuk bisa tumbuh normal, yaitu menjadi tumbuhan yang utuh. Dengan kata lain bahwa di dalam masing- masing sel tumbuhan mengandung informasi genetik dan atau sarana fisiologis tertentu yang mampu membentuk tanaman lengkap bila ditempatkan pada lingkungan yang sesuai. Kemampuan inilah yang kemudian dikenal sebagai totipotensi.
2.3 Media Kultur Jaringan
Media tanam untuk kultur jaringan adalah tempat tumbuh untuk eksplan. Media untuk menumbuhkan sel/eksplan tanaman pada dasarnya berisi unsur hara makro, mikro, dan gula sebagai sumber karbon. Selain itu, media kultur juga dilengkapi dengan zat besi, vitamin, mineral, dan ZPT. Zat Pengatur Tumbuh sangat besar peranannya didalam mengarahkan pertumbuhan sel tanaman. Kombinasi zat pengatur tumbuh yang tepat akan menghasilkan pertumbuhan sel yang optimal (Wattimena, 1992).
Media yang dipakai dalam kultur jaringan telah banyak dikembangkan oleh beberapa peneliti. Di dalam media tersebut biasanya terkandung senyawa- senyawa kimia yang diperlukan oleh jaringan tanaman (Drew 1980 dalam Wattimena et al. 1986). Senyawa-senyawa kimia yang terkandung dalam media disusun dalam perimbangan tertentu. Perimbangan yang tepat dari senyawa penyusun tersebut perlu dan menentukan tipe pertumbuhan yang akan terbentuk dari eksplan yang ditanam (Drew 1980; Murashige 1977 dalam Wattimena etal.1986).
untuk memenuhi kebutuhan banyak jenis sel tanaman dalam kultur (Gunawan, 1990).
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama disebabkan pengetahuan lebih baik tentang kebutuhan hara sel dan jaringan yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen tambahan. Komponen utama meliputi garam mineral, sumber karbon (gula), vitamin dan pengatur tumbuh. Komponen lain seperti senyawa nitrogen organik, berbagai asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat menguntungkan ketahanan sel dan perbanyakannya (Wetter & Constabel 1991).
Vitamin yang sering digunakan dalam media kultur jaringan adalah tiamin (B1), asam nikotin (niacin), dan piridoksin (B6). Vitamin ini berperan dalam reaksi enzimatik yang penting bagi pertumbuhan jaringan tanaman (George & Sherington, 1984). Selain itu penambahan mio-inisitol kedalam media juga diketahui dapat memperbaiki pertumbuhan bahan tanaman yang dikulturkan.
Gula merupakan komponen penting dalam media kultur untuk pertumbuhan dan perkembangan in vitro, sebab gula merupakan sumber energi yang biasa didapat tanaman dari atmosfer melalui proses fotosintesis. Sukrosa adalah sumber karbon terbaik (George & Sherrington, 1984). Agar sebagai bahan pemadat merupakan polisakarida yang diperoleh dari beberapa spesies alga. Penggunaan agar berfungsi untuk menyangga eksplan sehingga kontak antara eksplan dengan media terpenuhi (Pierik, 1987). Umumnya konsentrasi agar yang ditambahkan pada media kultur berkisar antara 0,6- 1% (Gunawan, 1988). Derajad asam (pH) media adalah faktor penting yang mempengaruhi fungsi membran sel dan pH sitoplasma. Pengaruh pH harus juga mempertimbangkan berbagai faktor, seperti kelarutan garam- garam penyusun medi. Serapan ZPT oleh eksplan, serta efisiensi pembekuan agar (Gunawan, 1988).
2.4 Eksplan
Eksplan adalah potongan/bagian jaringan yang diisolasi dari tanaman yang digunakan untuk inisiasi suatu kultur in vitro (Sandra & Karyaningsih 2000). Hendaryono & Wijayani (1994) menyatakan bahwa eksplan yang dipilih harus merupakan bagian-bagian tanaman yang mempunyai sel aktif membelah (sel meristem), karena sel tersebut mengandung hormon tanaman yang baik untuk membantu pertumbuhan. Eksplan yang diambil dari jaringan dewasa (in
deferensiasi) dalam waktu lama tidak akan membentuk kalus, sebab kemampuan
disebabkan karena proliferasi sel tidak terjadi sedangkan pada jaringan meristem akan terjadi penambahan sel.
Pada prinsipnya eksplan dapat diambil dari semua bagian tanaman baik dari jaringan akar, batang, dan daun. Biasanya sebagai bahan eksplan diambil bagian yang bersifat meristematik (Majnu 1975 dalam Wattimena et al.1986). penggunaan tunas pucuk, tunas samping, tunas bunga, daun bunga, daun, cabang muda, akar, umbi, bagian-bagian embrio, anther, dan beberapa bagian lainnya sering dilakukan dalam kultur jaringan beberapa tanaman tertentu (Haramaki & Heuser 1980 dalam Wattimena et al.1986).
Ukuran eksplan yang dikulturkan bervariasi tergantung tujuan pembiakannya. Eksplan ukuran besar lebih mudah terkontaminasi, sedangkan yang kecil lebih sedikit kemungkinannya terkena kontaminasi. Dalam hal ini ukuran eksplan yang baik digunakan adalah antara 0,5- 1 cm (Katuuk,1989).
2.5 Zat Pengatur Tumbuh
Salah satu komponen media yang menentukan keberhasilan kultur jaringan adalah jenis dan konsentrasi ZPT yang digunakan. Jenis dan konsentrasi ZPT tergantung pada tujuan dan tahap pengkulturan. Contohnya, pada kultur untuk menumbuhkan dan menggandakan tunas aksilar atau merangsang tumbuhnya tunas- tunas adventif, ZPT yang digunakan adalah campuran sitokinin dengan auksin rendah (Yusnita, 2003).
Menurut Hendaryono dan Wijayani (1994), ZPT dalam tanaman terdiri dari lima kelompok yaitu auksin, giberelin, sitokinin, etilen, dan inhibitor dengan ciri khas serta pengaruh yang berlainan terhadap proses fisiologis. Zat pengatur tumbuh sangat diperlukan sebagai komponen media bagi pertumbuhan dan diferensiasi. Tanpa penambahan ZPT dalam media, pertumbuhan sangat terhambat bahkan mungkin tidak tumbuh sama sekali. Pembentukan kalus dan organ-organ ditentukan oleh penggunaan yang tepat dari ZPT tersebut
dan pembentukan kalus. Auksin sintetik perlu ditambahkan karena auksin yang terbentuk secara alami sering tidak mencukupi untuk pertumbuhan eksplan (George
et al. 2007). Sementara sitokinin adalah zat pengatur tumbuh yang berperan mengatur pembelahan sel serta mempengaruhi diferensiasi tunas. Keseimbangan konsentrasi antara auksin dan sitokinin merupakan kunci keberhasilan dalam kultur jaringan (Pierik, 1987).
Auksin adalah salah satu hormon yang tidak terlepas dari proses pertumbuhan dan perkembangan suatu tanaman. Menurut Wetherell (1982) peran auksin dalam kultur jaringan yang pertama adalah merangsang pertumbuhan pucuk-pucuk baru, dan yang kedua adalah merangsang pembentukan akar. ZPT auksin seperti asam 2.4-D dan NAA merupakan jenis ZPT yang stabil dibandingkan dengan IAA. Zat pengatur tumbuh 2,4-D pada konsentrasi rendah dapat menginduksi terbentuknya kalus, tetapi pada konsentrasi tinggi akan menyebabkan timbulnya mutasi karena 2,4-D bersifat herbisida dan akan menyebabkan perubahan jaringan tanaman (Goldsworty & Mina, 1991).
Benzil amino purin salah satu jenis sitokinin yang sering digunakan dalam kultur jaringan. BAP merupakan turunan adenin yang disubstitusi pada posisi 6 yang bersifat paling aktif (Wattimena, 1988). Di antara berbagai hormon sitokinin sintetik, BAP paling sering digunakan karena sangat efektif menginduksi pembentukan daun dan penggandaan tunas, mudah didapat dan harganya relatif murah (George & Sherrington, 1984). Pada eksplan yang ditambahkan hormon BAP (sitokinin) akan tumbuh tunas (Satria, 2004). Oleh karena itu, untuk menghasilkan jumlah tunas maksimum, penentuan jenis ZPT dengan kombinasi metode pengkulturan merupakan salah satu kunci penting dalam kultur jaringan.
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Januari 2013 – November 2013. Penelitian ini dilakukan di Laboratorium Kultur Jaringan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2 Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah erlenmeyer, gelas ukur, pipet serologi, pH-meter, autoklaf, entkas, rak kultur yang dilengkapi dengan lampu
flourescent (neon) 500 lux, laminar air flow, kertas saring, alumunium foil, propipet, botol kultur, alat diseksi, beaker glass, neraca digital, handspayer, bunsen, cawan petri, pinset, dan pisau, shaker, plastik dan karet.
Bahan dalam penelitian ini meliputi tunas apikal kelapa sawit (Elaeis guineensis Jacq.) berumur 8 bulan yang berasal dari Pusat Penelitian Kelapa Sawit Marihat, larutan Na-hipoklorit, fungisida, alkohol 70%, akuades, HgCl2, betadin,
asam askorbat, BAP, 2,4-D, agar-agar, gula, hara makro dan hara mikro, arang aktif, tween 80, bahan- bahan penyusun media MS, NaOH 0,1N, HCl 0,1N.
(a) (b)
3.3 Rancangan Percobaan
Penelitian ini menggunakan metode percobaan dengan Rancangan Acak Lengkap (RAL) dengan 2 faktorial.
Faktor tingkat variasi 2,4-D (A) terdiri dari 4 taraf, yaitu: A0 = konsentrasi 0 ppm
A1 = konsentrasi 110 ppm
A2 = konsentrasi 120 ppm
A3 = konsentrasi 130 ppm
Faktor tingkat variasi BAP (B) terdiri dari 4 taraf, yaitu: B0 = konsentrasi 0 ppm
B1 = konsentrasi 0,17 ppm
B2 = konsentrasi 0,23 ppm
B3 = konsentrasi 0,29 ppm
Dengan demikian diperoleh 16 kombinasi perlakuan A0B0 A0B1 A0B2 A0B3
A1B0 A1B1 A1B2 A1B3
A2B0 A2B1 A2B2 A2B3
A3B0 A3B1 A3B2 A3B3
Setiap perlakuan dilakukan sebanyak 3 ulangan terdiri dari 16 perlakuan. Jumlah satuan botol kultur adalah 16 x 3 = 48 botol
3.4 Cara Kerja
3.4.1 Sterilisasi Alat
Seluruh alat gelas dan alat diseksi dicuci dengan bersih dan dikeringkan. Alat-alat tersebut dibungkus kertas dan disterilisasi dalam autoklaf pada suhu 1210C dengan
3.4.2 Pembuatan Media
Media yang digunakan pada tahap inisiasi dan tahap multiplikasi adalah media MS yang diberi perlakuan dengan penambahan BAP pada konsentrasi 0, 110, 120, dan 130 ppm dikombinasi dengan 2,4-D pada konsentrasi 0, 0,17, 0, 23, dan 0,29 ppm,. Tahap awal pembuatan media adalah pembuatan media adalah pembuatan larutan stok, yang terdiri dari stok hara mikro, mikro, myo-inositol, iron, vitamin, BAP dan 2,4-D. Sukrosa, agar, dan arang aktif ditimbang langsung sesuai kebutuhan tanpa harus dijadikan larutan stok.
Media yang digunakan sebanyak 1,6 liter. Pembuatan larutan MS dengan cara memasukan hara makro, iron, vitamin, sukrosa ke dalam erlenmeyer dan ditambahkan akuades hingga 100 ml kemudian ditambahkan akuades dibuat sampai volume 1000 ml, Larutan dibagi ke 16 perlakuan yang setiap perlakuan berisi 100 ml. Selanjutnya untuk setiap perlakuan dimasukkan BAP dan 2,4-D. Derajat keasaman media diukur pada setiap perlakuan dengan menggunakan pH meter 5,8. Untuk menetralkan pH ditambahkan NaOH 0,1 N atau HCl 0,1 N.
Setiap perlakuan media ditambahkan 0,8 gram agar, 3 gram gula, dan 0,3 gram arang aktif sambil dimasak. Media dimasukkan ke dalam botol-botol kultur, mulut botol kultur ditutup alumunium foil, dilapisi plastik kemudian diikat dengan karet. Botol-botol disterilkan dengan autoklaf pada tekanan 15 psi, pada suhu 1210C selama 30 menit, setelah selesai kemudian disimpan dalam rak kultur dalam ruangan AC.
3.4.3 Sterelisasi Bahan
Eksplan berupa tunas apikal kelapa sawit dipotong dan dicuci dengan air kran mengalir dan dibilas dengan akuades steril hingga bersih. Tunas apikal direndam dalam larutan fungisida (0,2g/ 100 ml) yang ditambahkan tween 80 sebanyak 2 tetes selama 30 menit dan dibilas dengan akudes steril sebanyak 2 kali. Tunas direndam dalam HgCl2 0,1 % selama 5 menit dan dibilas dengan akuades steril sebanyak 2
dengan akuades sebanyak 3 kali. Selanjutnya eksplan diletakkan ke dalam cawan petri dan dikeringkan dengan kertas saring steril
3.4.4 Penanaman Eksplan
Ruangan dalam keadaan bersih sebelum melakukan penanaman. Penanaman dilakukan di dalam Entkas yang telah disterilkan dengan UV. Alat-alat diseksi, lampu bunsen dan alkohol 70% dipersiapkan terlebih dahulu. Salah satu sisi tunas apikal dipotong satu per satu ditanam dalam media. Botol media hanya diisi oleh satu eksplan tunas apikal saja. Setelah selesai digunakan, pisau dicelupkan ke dalam alkohol 96% lalu dibakar bagian pisau yang akan memotong eksplan agar pisau tersebut steril. Botol berisi eksplan kemudian ditutup dengan alumunium foil, dilapisi plastik dan diikat dengan karet.
(a) (b)
(d) (c)
3.4.5 Pemeliharaan Eksplan
Botol kultur yang telah berisi eksplan diletakan pada rak kultur dengan kondisi ruangan yang steril. Intensitas cahaya dengan penyinaran lampu neon 500 lux. Botol-botol berisi eksplan tersebut disusun dengan rapi sehingga memudahkan dalam pengamatan. Ruangan diupayakan dalam keadaan steril atau dengan penyemprotan alkohol 70% setiap harinya.
3.4.6 Variabel Pengamatan
Pengamatan dilakukan setiap minggu. Variabel yang diamati dalam penelitian ini adalah:
a. Waktu tumbuh kalus
b. Persentasi kultur yang membentuk kalus (%)
Persentasi kultur membentuk kalus = Jumlah eksplan yang berkalus Jumlah botol seluruh perlakuan
c. Berat basah kultur (g) d. Warna kalus
e. Persentasi kalus embriogenik(%)
Persentasi kalus embriogenik = Jumlah kalus embriogenik Jumlah botol seluruh perlakuan
3.5 Analisis Data
Data dianalisis dengan Analisis of Variance (ANOVA). Jika perbedaan yang nyata (p>0,05), dilanjutkan dengan Uji Duncan New Mutiple Range (DNMRT) (Sasatrosupadi, 2004).
x 100%
BAB 4
HASIL DAN PEMBAHASAN
4.1.Persentase Kultur Yang Membentuk Kalus
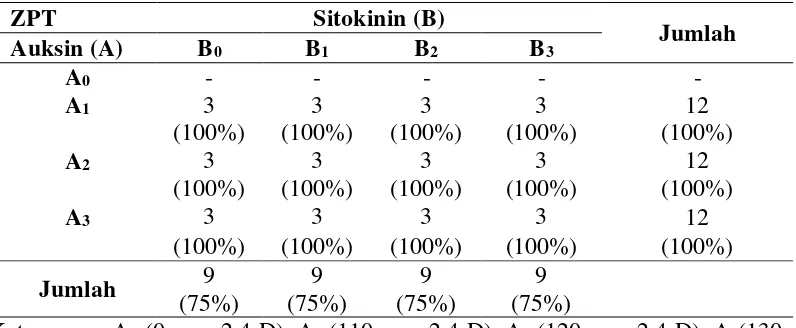
Tabel pengamatan kultur yang membentuk kalus dapat dilihat pada Lampiran 2 (halaman 31). Dari hasil pengamatan, persentase kultur yang membentuk kalus adalah 34 botol dari 48 botol atau 75%. Pembentukan kalus rata-rata terjadi pada minggu ke-7. Persentase kultur yang membentuk kalus dapat dilihat pada Tabel 4.1.
Tabel 4.1. Persentase Kultur Yang Membentuk Kalus
ZPT Sitokinin (B)
Berdasarkan Tabel 4.1. dapat dilihat bahwa persentase kultur yang membentuk kalus terdapat pada perlakuan A1B0, A1B1, A1B2, A1B3, A2B0, A2B1,
A2B2, A2B3, A3B0, A3B1, A3B2, dan A3B3. Hal ini disebabkan karena kombinasi antara
in vitrokarena zat pengatur tumbuh ini berfungsi dalam pembelahan sel dan diferensiasi kalus.
Menurut Gamborg (1991), keberhasilan suatu kultur sangat dipengaruhi oleh pengetahuan yang baik tentang kebutuhan hara sel jaringan yang dikulturkan. Komposisi media yang sama mungkin akan memberikan pengaruh yang berbeda pada tanaman kelapa sawit. Begitu juga dengan jenis dan ZPT yang digunakan akan memberikan pengaruh yang berbeda.Pertumbuhan in vitro dipengaruhi oleh adanya interaksi dan keseimbangan antara zat pengatur tumbuh yang ditambah dalam media dan hormon pertumbuhan yang diproduksi oleh sel tanaman secara endogen oleh sel- sel yang dikultur (George & Sherrington, 1984). Menurut Katuuk (1989), hormon endogen yang terkandung dalam eksplan berbeda- beda tergantung pada tanaman induk sumber eksplan. Hal ini meliputi keadaan pertumbuhan sel meristem serta kondisi umum pada tanaman itu.
4.2.Waktu Tumbuh Kalus Tunas Apikal Kelapa Sawit
Salah satu indikator pertumbuhan dalam kultur adalah munculnya kalus pada eksplan. Kalus merupakan proliferasi massa sel yang belum terdiferensiasi dan terdiri dari sel yang tidak teratur.Eksplan yang membentuk kalus dapat dilihat pada Gambar 4.1.
Gambar 4.1. Waktu Tumbuh Kalus (a). Kalus; (b). Sisa eksplan
Berdasarkan Gambar 4.1. kalus pertama kali muncul pada bagian tepi eksplan. Kalus dihasilkan dari pelukaan jaringan dan respon terhadap hormon (ZPT). Munculnya kalus pada bagian yang dilukaidisebabkan karena adanya rangsangan dari jaringan pada eksplan untuk menutupi luka. Hal ini sesuai pendapat George & Sherrington (1984), bahwa pembelahan sel pada terbentuknya kalus
a
akibat adanya respon terhadap luka dan suplai hormon endogen dan eksogen.Kalus yang muncul pada tepi eksplan memiliki struktur yang kompak (non friable). Secara visual kalus berstruktur kompak (non friable) sulit untuk dipisahkan dan sangat padat. Pierik (1987), menyatakan bahwa struktur pada kalus dapat bervariasi dari kompak hingga remah, tergantung pada jenis tanaman yang digunakan, komposisi nutrien media, ZPT dan kondisi lingkungan kultur.
Dari data pengamatan waktu tumbuh kalus dapat dilihat bahwa perlakuan 2,4-D (A) memberikan pengaruh berbeda nyata terhadap kultur yang membentuk kalus. Hasil uji rata- ratawaktu terbentuk kalus dapat dilihat pada Tabel 4.2.
Tabel 4.2. Hasil Uji Rata- rata Waktu Tumbuh Kalus
ZPT Sitokinin (B)
Berdasarkan Tabel 4.1. dapat dilihat bahwa kalus yang pertama kali tumbuh terdapat pada perlakuan A3B0 (130 ppm 2,4-D dan 0,29 ppm BAP) sedangkan kalus
Menurut Suryowinoto (1996), proses mulai terbentuk kalus sampai diferensiasi berbeda- beda tergantung macam dan bagian tanaman yang digunakan sebagai eksplan.Menurut Tisserat (1985 dalam Irawati, 2005), di dalam suatu tumbuhan, jaringan yang muda umumnya mempunyai kemampuan berdiferensiasi lebih baik. Pemilihan ZPT juga merupakan salah satu faktor yang sangat menentukan pembentukan kalus tanaman yang dikulturkan.
Pada perlakuan A0B0 (0 ppm 2,4-D dan0 ppm BAP) tidak terbentuknya
kalus, eksplan hanya memperlihatkan penebalan dan tidak terbentuknya kalus walaupun dikultur dalam jangka waktu yang lama. Hal ini disebabkan karena hormon endogen dan eksogen yang terdapat pada eksplan tidak dapat mencukupi untuk merangsang pembentukan kalus,dengan kata lain eksplan mempunyai kandungan auksin yang rendah, sehingga masih membutuhkan tambahan auksin eksogen pada media kultur. Seperti yang dikatakan oleh Pierik (1987) bahwa auksin dikenal sebagai hormon yang mampu berperan menginduksi kalus.
Menurut Klaus dan Haensch (2007) bahwa kombinasi tanpa 2,4-D tidak menunjukkan apapun embriogenesis somatik. Embriogenesis somatik adalah proses terbentuknya embrio yang berasal dari sel-sel somatik (tidak merupakan hasil dari peleburan gamet jantan dan gamet betina). Eksplan sering mati atau tidak mengalami perubahan. Sebagian dari eksplan tersebut membentuk sedikit kalus.Menurut Marlin (2005), pertumbuhan dan morfogenesis tanaman secara in
vitro dikendalikan oleh keseimbangan dan interaksi ZPT yang ada dalam eksplan
baik hormon endogen maupun eksogen. Menurut Gunawan (1987), konsentrasi zat pengatur tumbuh yang berbeda memberikan respon yang berbeda terhadap induksi kalus.
4.3. Berat Basah Kalus
Tabel 4.3. Hasil Uji Rata- rata Berat Basah Kalus Tunas Apikal Kelapa
Berdasarkan Tabel 4.3. dapat dilihat bahwa berat kalus yang paling tinggi terdapat pada perlakuan A3B1( 130 ppm 2,4-D dan 0,17 ppm BAP)sedangkan kalus
yang yang memiliki berat terendah pada perlakuan A1B0( 110ppm 2,4-D dan 0ppm
BAP). Dari Tabel 4.3. dapat diketahui bahwa 2,4-D memberikan pengaruh yang berbeda nyata terhadap berat basah kalus hal ini disebabkan karena konsentrasi auksin yang sesuai dan tepat dalam memacu pembesaran dan perbanyakan sel sehingga berat kultur menjadi meningkat. Menurut Ruswaningsih (2007), berat segar secara fisiologis terdiri dari dua kandungan yaitu air dan biomasa. Berat basah yang besar ini disebabkan karena kandungan airnya yang tinggi. Menurut Rahayu
et al. (2003), berat basah yang dihasilkan sangat tergantung pada kecepatan sel- sel tersebut membelah diri , memperbanyak diri, dan dilanjutkan dengan pembesaran kalus.
Menurut Salisbury & Ross (1995) zat pengatur tumbuh yang diberikan dalam jumlah yang tepat memberikan pengaruh terhadap berat kultur. Auksin berperan pada perbesaran sel, sedangkan sitokinin merangsang pembelahan sel. Interaksi antara kedua zat pengatur tumbuh tersebut akan meningkatkan jumlah pada ukuran sel dalam jaringan sehingga dapat meningkatkan jumlah dan ukuran sel dalam jaringan sehingga dapat meningkatkan bobot berat basah. Hal ini terjadi pada perlakuan A3B1 pengaruh auksin terhadap pertumbuhan jaringan diduga
Pada perlakuan A1B0 memberikan berat basah kalus yang terendah. Hal ini
menunjukan bahwa kombinasi kedua ZPT pada taraf konsentrasi tersebut kurang tepat untuk pertumbuhan kalus. Kecepatan sel membelah diri dipengaruhi oleh kombinasi auksin dan sitokinin dalam konsentrasi tertentu, selain itu juga tergantung pada jenis tumbuhan faktor- faktor seperti media, ketersediaan unsur hara makro/ mikro, karbohidrat, adanya bahan tambahan seperti air kelapa dan juga faktor faktor fisik seperti cahaya, suhu, dan pH (Gunawan, 1991).
4.4. Warna Kalus
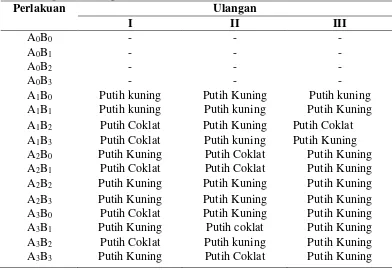
Salah satu tanda pertumbuhan dari eksplan pada budidaya in vitro berupa warna kalus yang menggambarkan penampilan visual kalus. Kalus masih memiliki sel- sel yang aktif membelah atau sudah mati. Jaringan kalus yang dihasilkan oleh eksplan biasanya memunculkan warna yang berbeda- beda. Data pengamatan warna kalus dapat dilihat pada Tabel 4.3. dari tabel tersebut dapat diketahui warna kalus dari setiap perlakuan
Tabel 4.4. Warna kalus eksplan tunas apikal kelapa sawit (Elaeis guineensis) pada berbagai konsentrasi BAP dan 2,4-D secara in vitro
&Sherrington (1984), tanaman yang berasal dari varietas yang sama dapat membentuk kalus yang berbeda baik tekstur maupun warna. Menurut Rahayu et al.
(2002), konsentrasi 2,4-D yang tinggi pada media mengakibatkan warna kalus cenderung kuning. Kalus yang bewarna putih kuning mununjukan bahwa sel- sel yang dewasa menuju fase pembelahan yang aktif.
Warna kalus kecoklatan terdapat pada sebagian perlakuan yang terbentuk kalus. Warna kecoklatan pada kalus (browning) ini akibat adanya metabolisme senyawa fenol bersifat berlebihan, yang terangsang akibat proses sterilisasi eksplan (Andaryani, 2010). Peristiwa pencoklatan tersebut merupakan suatu peristiwa alamiah dan proses perubahan adaptif bagian tanaman akibat adanya pengaruh fisik seperti pengupasan, pemotongan. Gejala pencoklatan merupakan tanda- tanda kemunduran fisiologis eksplan (Rohmah, 2007).
4.5. Persentase Kalus Embriogenik
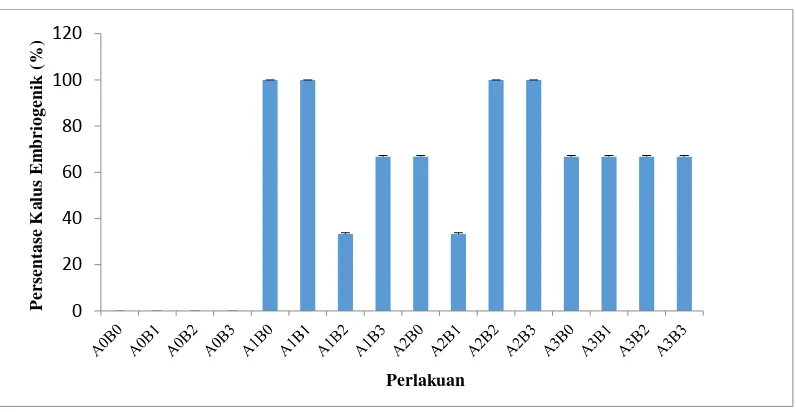
Hasil persentase jumlah kalus embriogenik dari eksplan kelapa sawit merupakan tanda bahwa eksplan yang digunakan dari tunas apikal berhasil diinduksi oleh media MS dengan penambahan kombinasi 2,4-D dan BAP . Tabel persentase kalus embriogenik dapat dilihat pada Lampiran 4 (halaman 34). Dari hasil pengamatan yang diperoleh, jumlah kultur yang membentuk kalus embriogenik adalah 24 botol dari 48 botol atau 50%.
Gambar 4.2. Jumlah Kultur Yang Membentuk Kalus Embriogenik
Kalus yang embriogenik biasanya ditandai dengan kalus yang bewarna putih kuning, mengkilat dan remah (mudah dipisahkan membentuk fragmen). Sedangkan kalus yang non embriogenik berwarna kuning kecoklatan, agak pucat dan lembek berair sehingga sulit dipisahkan (Peterson & Smith, 1991). Kalus embriogenik dapat dilihat pada Gambar 4.3.
Gambar 4.3. (a). Kalus Embriogenik
Kalus embriogenik umumnya dapat diinduksi dengan menggunakan ZPT auksin seperti 2,4-D, NAA, 2,4,5 T, Picloram dan Dicamba (Sagare et al. 1993) dan dengan kombinasi sitokinin. Kalus embriogenik dapat terbentuk secara langsung atau melalui subkultur berulang baik pada perlakuan yang samamaupun pada perlakuan yang berbeda. Kalus embriogenik mengandung sel- sel meristematik yang dilokasikan pada permukaan kalus. Pada bagian kalus yang meristematik akan cepat membentuk embrio somatik ke tahap globular (Kysely & Jacobsen, 1990).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil pembahasan dari penelitian ini dapat disimpulkan sebagai berikut:
a. Perlakuan ZPT 2,4-D memberikan pengaruh yang berbeda nyata terhadap waktu tumbuh kalusdan berat basah kalus
b. Perlakuan yang optimum untuk kultur yang membentuk kalus adalah A3B0 (130
ppm 2,4D + 0 ppm BAP) selama (78 hari) dan A3B1 (130 ppm 2,4-D + 0, 17
ppm BAP) selama (81 hari) dan perlakuan yang optimum pada berat basah kultur adalah A3B1 (130 ppm 2,4-D + 0, 17 ppm BAP ) sebesar (0,843 g)
5.2 Saran
DAFTAR PUSTAKA
Bhagyalakshmi dan Sing, N. S. 1988. Meristem Culture and Micropropogation of a Variety of Ginger (Zinger officinale Rosch) with a High Yield of Oleoresin. Journal of Hort. Sci. 63( 2): 321- 327;3
Gamborg, O.L 1991. Kalus dan Kultur Sel, dalam L.R. Wetter & Constabel. Metode
Kultur Jaringan Tanaman. Terjemahan. ITB Bandung.
Gati, E dan I. Mariska. 1992. Pengaruh auksin dan sitokinin terhadap kalus Mentha piperitaLinn. BuletinLittri. 3: 1-4.
George, E. F.dan P.D. Sherrington. 1984. Plant Propogation by Tissue Culture. England. Eastern Press.
George, E. F., M. A. Hall, L, dan G. J. de Klerk. 2007. Plant Propagation By Tissue Culture. 3rd Edition. Vol 1. Netherland. The Background Springer. hlm. 504.
Goldsworthy, A.dan M.G. Mina. 1991.Electrical patterns of tobacco cells in media containing indole-3-acetic acid or 2,4-D. Planta.183:386-373.
Gunawan, L.W. 1990. Teknik Kultur Jaringan Tumbuhan. Laboratorium Kultur Jaringan. Pusat Antar Universitas (PAU) Bioteknologi. Bogor. IPB. hlm . 304.
Hadi, M. M. 2004. Teknik Berkebun Kelapa Sawit. Yogyakarta. Adicita Karya Nusa.
Harjoko, D. 1999. Pengaruh Macam-macam Auksin terhadap Poliploidisasi Kalus Tanaman Semangka pada Kultur in Vitro. Surakarta. Fakultas Pertanian UNS.
Hartley, C. W. S. 1977. The Oil Palm. Second Edition. Longman London. 706 p.
Hendaryono, D. P. S. Dan A. Wijayani. 1994. Teknik Kultur Jaringan Pengenalan
dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern.
Yogyakarta: Kanisius.
Ibrahim K, KB, Alromaihi dan KMS Elmeer. 2009. Influence of different media on in vitro roots and leaves of date palm embryos Cvs. Kapkap and Tharlaj. American-Eurasian J Agric & Environ. 6(1): 100-103.
Katuuk, J. R. 1989. Teknik Kultur Jaringan Dalam Mikropropagasi Tanaman. Jakarta: Departemen Pendidikan dan Kebudayaan.
Keese, R. J., Rupert, E. A. dan Carter, G. E. Physiologia Plantarum. An International Journal for Plant Biology. 81(4): 513.
Litz, R.E dan Jaiswal. V. S. 1991. Micropropagation of Tropical And Subtropical fruit. Kluwer Academic Publishers. London.
Lubis, A.U. 1992. Kelapa Sawit di Indonesia. Pusat Penelitian Perkebunan Marihat. Bandar Kuala, Sumatra Utara. hlm. 435 .
Madon, M. dan Clyde, M. 1995. Cytologycal Analysisof Elaeis guineensis.
Elaeis.17(2): 124- 134.
Mariska, I. dan Sukmadjaja, D. 2003. Kultur Jaringan Abaka. Balai Penelitian Bioteknologi dan Sumberdaya Genetika Pertanian.
Marlin. 2005. Regenerasi in vitro Planlet Jahe Bebas Penyakit Layu Bakteri Pada Beberapa Taraf Konsentrasi 6- Benzyl Amino Purin (BAP) dan 1- Naphthalentic Acetil Acid (NAA). Jurnal Ilmu Pertanian Indonesia.7(1): 9.
Nizam K dan S Te-Chato. 2009. Optimizing of root induction in oil palm plantlets for acclimatization by some potent plant growth regulators (PGRs).J. Agri Technol.5(2): 371-383.
Nugroho, A. & H. Sugito. 2005. Teknik kultur jaringan. Penebar Swadaya. Jakarta.
Nurwahyuni, I., dan Puspa, D, T., 1994, Induksi Kalus Dan Regenerasi Dioscorea composita Hemsl, Hayati, Juni 1994.
Palupi, A. D., Solichatun, dan S. D. Marliana. 2004. Pengaruh Asam 2,4-Diklorofenoksiasetat (2,4-D) dan Benziladenin (BA) terhadap Kandungan Minyak Atsiri Kalus Daun Nilam (Pogostemon cablin Benth.).
BioSMART.6(2): 99-103
Peterson, G. Dan R.Smith.1991. Effect of Abscicic Acid and Callus Steze on Regenerstion of American And International Rice Varieties. Plant Cell Rep. 10: 35-38.
Pierik, R.L.M. 1987. In Vitro Culture Of Higher Plants.Martinus Nijhoff Publisher. Netherland.
Rahayu,B., Solichatun dan E. Anggarwulan. 2003. Pengaruh Asam 2,4 Dichlorophenoxyacetic Acid (2,4-D) Terhadap Pertumbuhan Kalus Serta Kandungan Flavanoid Kultur Kalus Acalypha Indica L.Biofirms.1(1): 1-6
Rice, R.D., Anderson, P.G., Hall J.f dan Ranchod, A. 1992. Micropropagation: Principles and Commercial Practise dalam Plant Biotechnology. Fowler, M.W., Warren, G.S. dan Moo, Y.M. (Ed). Pergamon Press Oxford, New York, Seoul, Tokyo. hlm. 130-149.
Riyadi I & JS Tahardi. 2009. Perbanyakan in vitro tanaman kina (Cinchona ledgeriana Moens) melalui tunas aksiler dan apikal. Menara Perkebunan.77(1): 36-46.
Ruswaningsih, F. 2007. Pengaruh Konsentrasi Ammonium Nitrat dan BAP
terhadap Pertumbuhan Eksplan Pucuk Artemisia annua L. pada Kultur In
Vitro. Skripsi Fakultas Pertanian UNS. Surakarta.
Sagare, A.P., K. Suhasini and K.V. Krishnamurthy. 1993. Plant Regeneration Via Somatic Embryogenesis In Chick Pea ( Cicer arietinum L.). Plant Cell Reports.12 : 652 – 655.
Sandra, E. 2003. Kultur Jaringan Anggrek Skala Rumah Tangga. Agro Media Pustaka. Jakarta.
Santoso, U. dan F. Nursandi. 2004. Kultur Jaringan Tanaman. Universitas
Muhammadiyah. Malang Press. Malang.
Sastrosupadi, A. 2004. Rancangan Percobaan Praktis Bidang Pertanian. Edisi Revisi. Kanisius. Yogyakarta.
Satria, B. 2004. Perbanyakan Vegetatif Klon Kentang Unggul (Solanum tuberrosum L.) Dengan pemberian konsentrasi BAP pada Media MS Melalui Kultur Jaringan. Jurnal Stigma.12(1): 14-18
Satria, B dan Zainal, A. 2004 Perbanyakan Vegetatif Durian Aripan (Durio Zibethinus Murr.) melalui Regenerasi Kalus In Vitro. Jurnal Stigma.12(1): 19-24
Setyamidjaja, D. 2006. Kelapa Sawit, Teknik Budidaya, Panen dan Pengolahan. Kanisius. Yogyakarta. hlm 127
Suryowinoto, M. 1996. Pemuliaan Tanaman secara In Vitro. Yogyakarta. Kanisius
Tjitrosomo, G. 2000. Taksonomi Tumbuhan (SpermatopHyta). Yogyakarta. UGM-Press.
Tondok, A.R. 1998. Production and Marketing of Indonesia Palm Oil.
Touchet, B. Pannetier, C. dan De Duval, Y. Plant Regeneration From Embryogenic Suspensions Culture of Oil Palm (Elaeis guineensis Jacq.). Plant Cell Rep. 10: 529- 532
Wattimena, G. A., L. W. Gunawan, dan S. S. Harjadi. 1986. Penelitian Kultur
Jaringan Beberapa Tanaman Hortikultur Penting. Bogor.
BudidayaPertanian Fakultas Pertanian IPB.
Wattimena, G.A. 1992. Bioteknologi Tanaman. Departemen Pendidikan dan Kebudayaan. IPB. Bogor.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas. Bogor. IPB. hlm. 145.
Wetherell, D. F. 1982. Pengantar Propagasi Tanaman secara In Vitro. Penerjemah: Koesmardiyah. New Jersey. Avery Publishing Group Inc
Wetter, L. R. dan F. Constabel. 1991. Metode Kultur Jaringan Tanaman. Edisi Ke-2 Widianto MB, penerjemah. Bandung. Institut Teknologi Bandung. Terjemahan dari: Plant Tissue Culture Methods.
Yusnita, Aprilia, dan Hapsoro. D. 1996. Pengaruh Benziladenine, Adenin, dan Asam Indol Asetat terhadap Perbanyakan Tunas Nanas (Annanas comosus L.) In Vitro. Jurnal Agrotropika. 1(1): 29-32.
Yusnita, Aprilia, dan Hapsoro. D. 1999. Pengaruh Benziladenine dan Napthaleneacetic Terhadap Perbanyakan Tunas Nanas (Annanas comosus L.) In Vitro. Jurnal Agrotropika. 4(2): 6- 10.
Yusnita. 2004. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. PT. Agro Media Pustaka. Jakarta.