pada BERBAGAI PERMUKAAN PADAT
SKRIPSI
NIALUSI HUTAGAOL 100805023
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
salmonicidapada BERBAGAI PERMUKAAN PADAT
SKRIPSI
NIALUSI HUTAGAOL 100805023
Skripsiinidiajukansebagaisalahsatusyaratuntukmendapatkan GelarSarjanaSainsFakultasMatematikadanIlmuPengetahuanAlam
Universitas Sumatera Utara Medan
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Isolasi dan Uji EkstrakBA Perairan Tawar dalam Mengendalikan Biofilm Aeromonas salmonicida Pada Berbagai PermukaanPadat
Kategori : Skripsi
Nama : Nialusi Hutagaol
Nomor Induk Mahasiswa : 100805023
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di Medan, Mei 2015
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Nunuk Priyani M.Sc Dr. It Jamilah M.Sc
NIP. 196404281996032001 NIP.196310121991032003
DisetujuiOleh
Departemen Biologi FMIPA USU Ketua,
ISOLASI dan UJI EKSTRAK BAKTERI ASAM LAKTAT PERAIRAN
TAWAR dalam MENGENDALIKAN BIOFILM Aeromonas
salmonicidapada BERBAGAI PERMUKAAN PADAT
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2015
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Kuasa yang telah memberikan berkat dan kasih-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini dengan judul Isolasi dan Uji Senyawa AntimikrobBAL Perairan Tawar dalam Mengendalikan Biofilm Aeromonas salmonicida pada Berbagai Permukaan Padat.
Pada kesempatan ini penulis ingin mengucapkan terimakasih banyak kepada IbuDr. It Jamilah,M.Sc selaku Dosen Pembimbing I dan Ibu Dra. Nunuk Priyani,M.Sc selaku Dosen Pembimbing II yang telah banyak memberikan nasehat, saran dan bimbingan kepada penulis dalam menyelesaikan penyusunan skripsi ini. Terimakasih kepada BapakProf. Dr. Dwi Suryanto, M.Sc selaku Dosen Penguji I danIbu Dr. Hesty Wahyuningsih, MSi selaku Dosen Penguji II yang telah memberikan kritik dan saran yang membangun dalam penyusunan skripsi ini.Terimakasih kepada Ibu Dr. Nursahara Pasaribu, M.Scselaku Ketua Departemen Biologi dan Ibu Dr. Saleha Hanum, M.Scselaku Sekretaris DepartemenBiologi FMIPA USU, Bapak Dr. Sutarman, M.Scselaku Dekan FMIPA USU, Ibu Dr. Marpongahtun, M.Scselaku PembantuDekan I, Bapak Drs. Nursal,M.Siselaku Pembantu Dekan II danBapak Drs. Krista Sebayang, M.Siselaku Pembantu Dekan III. Penulis juga mengucapkan terimakasih kepada Bapak Drs. Mhd Zaidun Sofyan,M.Si selaku dosen pembimbing akademik, dan kepada BapakdanIbuDosen Biologi FMIPA USU serta Ibu Roslina Ginting dan Abang Erwin selaku pegawa administrasi Departemen Biologi FMIPA USU.
TAWAR dalam MENGENDALIKAN BIOFILM Aeromonas
salmonicidapada BERBAGAI PERMUKAAN PADAT
ABSTRAK
Aeromonassalmonicidamerupakanbakteripenyebabfurunculosis yang mampu membentuk
biofilm pada permukaan padat. Penelitian ini bertujuan untuk mengendalikan biofilm
Aeromonassalmonicida dengan memanfaatkan senyawa anti mikrobasamlaktat (BAL) yang
di isolasi dari usus ikan mas (Cyprinuscarpio) asal Medan, Sumatera Utara. Dari 12
isolathasilisolasipada media MRSA di dapat kanisolat UM1 yang paling potensial dalam
menghambat Aeromonassalmonicida dengan diameter zona hambat8,35mm. Perhitungan
jumlah sel dan hasil pengendalian biofilm pada sisik ikan mas dan plastik PVC dilakukan
dengan metode pelepasan sel biofilm dengan serbuk kacahalus (glass bead), kemudian kultur
disebar pada cawan untuk perhitungan cawan total (TPC). Pembentukan biofilm dilakukan
pada hari ke 1, 3 dan 5. Biofilm Aeromonassalmonicida pada lempeng PVC mampu
membentuk biofilm dengan jumlah sel tertinggi pada hari ke-3 yaitu sebesar 0,74 x 109
CFU/lempeng dan lempeng sisik ikan mampu membentuk biofilm dengan jumlah sel
tertinggi pada hari ke-3 yaitu sebesar 0,90 x 109 CFU/lempeng. Senyawa anti mikrob BAL
UM1 mampu menurunkan jumlah sel biofilm pada masing-masing uji sebesar 101
CFU/lempeng.
Surface
ABSTRACT
Aeromonassalmonicida is a bacterium that causefurunculosis on fish and is able to form biofilm on solid surface. The aim of this research is to control biofilm Aeromonassalmonicida using antimicrobial compound of Lactid Acid Bacteria (LAB) isolated from fresh water of intestinum gold fish (Cyprinuscarpio) pond around Medan city, North Sumatera. There were 12 (LAB isolated) from fresh water. The selected isolate, UM1, was found as a potential biocontrol agent of Aeromonassalmonicida which showed the highest inhibition 8.5 mmcompared to other 12 isolates. Further more UM1 was used to produce antimicrobial compound to control biofilm cell’s of Aeromonassalmonicida on gold fish scale and polyvinyl chloride (PVC). Biofilm formation of Aeromonassalmonicidawas performed in 1, 3 and 5 days in Nutrient Broth on fish scale and PVC then were detached with micro glass bead for bacterial counting. The highestnumber of biofilm cells were found at 3 days of incubation, 0.74 x 109 CFU/unit on PVC and 0.90 x 109 CFU/unit on fish scale. Controling of biofilm cell of Aeromonassalmonicida with antimicrobial compound of LAB isolate reduced up to 101CFU/unit biofilm cell of Aeromonassalmonicida.
Halaman
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
BAB 1. PENDAHULUAN
1.1 Latar Belakang 1
1.2 Permasalahan 3
1.3 Tujuan Penelitian 3
1.4Manfaat 3
BAB 2. TINJAUAN PUSTAKA
2.1Penyakit Pada Ikan 4
2.1.1Penyebab Penyakit Ikan Golongan Bakteri 4
2.1.2Penyebab Penyakit Ikan Golongan Jamur 6
2.2Bakteri Asam Laktat (BAL) 9
2.2.1Probiotik 10
2.2.2Manfaat Probiotik 11
2.3 Biofilm 12
BAB 3. BAHAN DAN METODE
3.1 Waktu danTempat 13
3.2 Alat dan Bahan 13
3.3 Rancangan Percobaan 13
3.4 Isolasi dan Karakterisasi BAL 14
3.5 Seleksi BAL Potensial 15
3.6 Kurva Pertumbuhan Isolat BAL 15
3.7 Produksi Estrak Kasar Senyawa Antimikroba BAL 15
3.8 Uji Aktivitas Estrak Kasar Senyawa Antimikroba BAL 16
3.9 Pembentukan Sel Biofilm Aeromonassalmonicida 16
3.10 Pengendalian Sel Biofilm Aeromonas salmonicida 17
BAB 4. HASIL DAN PEMBAHASAN
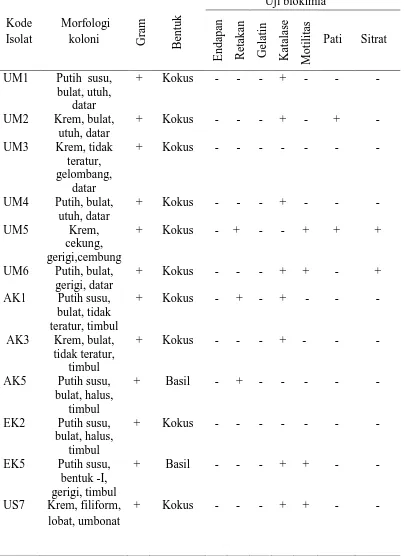
4.1 Isolasi dan Karakterisasi BAL 18
4.2 Seleksi BAL Potensial 20
4.3 Kurva Pertumbuhan BAL Potensial 24
4.4 Uji Estrak Kasar Senyawa Antimikroba BAL 4.5 Pembentukan Sel Biofilm A. salmonicida
DAFTAR TABEL
NomorTabel Judul Halaman
4.1. KarakteristikMorfologiBakteriAsam Laktat
dariPerairan Tawar
23
4.2. UjiAntagonisIsolatBakteriAsam
LaktatterhadapAeromonas salmonicida
24
4.3.
4.4.
4.5.
UjiAktivitasEkstrak Kasar Senyawa Antimikroba Bakteri Asam Laktat
Perhitungan Rata-rata Jumlah Sel Biofilm Aeromonas salmonicida
Penurunan Rata-rata Jumlah Sel Biofilm Aeromonas salmonicida
28
27
DAFTAR GAMBAR
NomorGambar Judul Halaman
4.1. UjiAntagonisIsolat BAL
TerhadapMikrobaPatogenAeromonassalmonicida (a) Isolat UM1 selama 48 jam (b) Isolat UM4 selama 48 jam.
22
4.2.
4.3
HasilUjiAntagonisEkstrak Kasar
Senyawaantimikroba BAL selama 48 jam (a) Senyawaantimikrob UM1 (b)
SenyawaantimikrobUM4
terhadapAeromonassalmonicida
KurvaPertumbuhanisolatterpilih
DAFTAR LAMPIRAN
NomorLampiran Judul Halaman
1 Isolasi Bakteri Asam Laktat 38
2 AlurKerjaKarakterisasiBakteri Asam Laktat 39
3 AlurKerjaSeleksi Bakteri Asam Laktat 40
4 Alur Kerja Kurva Pertumbuhan Bakteri Asam
Laktat
41
5 AlurKerjaProduksi Estrak Kasar Senyawa
Antimikroba Bakteri Asam Laktat
41
6 AlurKerjaUjiAktivitasEkstrakKasar Senyawa
AntimikrobaBakteri Asam
LaktatterhadapAeromonas salmonicida
42
7 AlurKerjaPembentukan Biofilm Aeromonas
salmonicida
43
8 Alur Kerja Pengendalian Biofilm Aeromonas
salmonicida
TAWAR dalam MENGENDALIKAN BIOFILM Aeromonas
salmonicidapada BERBAGAI PERMUKAAN PADAT
ABSTRAK
Aeromonassalmonicidamerupakanbakteripenyebabfurunculosis yang mampu membentuk
biofilm pada permukaan padat. Penelitian ini bertujuan untuk mengendalikan biofilm
Aeromonassalmonicida dengan memanfaatkan senyawa anti mikrobasamlaktat (BAL) yang
di isolasi dari usus ikan mas (Cyprinuscarpio) asal Medan, Sumatera Utara. Dari 12
isolathasilisolasipada media MRSA di dapat kanisolat UM1 yang paling potensial dalam
menghambat Aeromonassalmonicida dengan diameter zona hambat8,35mm. Perhitungan
jumlah sel dan hasil pengendalian biofilm pada sisik ikan mas dan plastik PVC dilakukan
dengan metode pelepasan sel biofilm dengan serbuk kacahalus (glass bead), kemudian kultur
disebar pada cawan untuk perhitungan cawan total (TPC). Pembentukan biofilm dilakukan
pada hari ke 1, 3 dan 5. Biofilm Aeromonassalmonicida pada lempeng PVC mampu
membentuk biofilm dengan jumlah sel tertinggi pada hari ke-3 yaitu sebesar 0,74 x 109
CFU/lempeng dan lempeng sisik ikan mampu membentuk biofilm dengan jumlah sel
tertinggi pada hari ke-3 yaitu sebesar 0,90 x 109 CFU/lempeng. Senyawa anti mikrob BAL
UM1 mampu menurunkan jumlah sel biofilm pada masing-masing uji sebesar 101
CFU/lempeng.
Kata Kunci : Bakteri Asam Laktat, Aeromonassalmonicida, biofilm, sisik ikan dan plastik PVC
Surface
ABSTRACT
Aeromonassalmonicida is a bacterium that causefurunculosis on fish and is able to form biofilm on solid surface. The aim of this research is to control biofilm Aeromonassalmonicida using antimicrobial compound of Lactid Acid Bacteria (LAB) isolated from fresh water of intestinum gold fish (Cyprinuscarpio) pond around Medan city, North Sumatera. There were 12 (LAB isolated) from fresh water. The selected isolate, UM1, was found as a potential biocontrol agent of Aeromonassalmonicida which showed the highest inhibition 8.5 mmcompared to other 12 isolates. Further more UM1 was used to produce antimicrobial compound to control biofilm cell’s of Aeromonassalmonicida on gold fish scale and polyvinyl chloride (PVC). Biofilm formation of Aeromonassalmonicidawas performed in 1, 3 and 5 days in Nutrient Broth on fish scale and PVC then were detached with micro glass bead for bacterial counting. The highestnumber of biofilm cells were found at 3 days of incubation, 0.74 x 109 CFU/unit on PVC and 0.90 x 109 CFU/unit on fish scale. Controling of biofilm cell of Aeromonassalmonicida with antimicrobial compound of LAB isolate reduced up to 101CFU/unit biofilm cell of Aeromonassalmonicida.
BAB 1 PENDAHULUAN
1.1. Latar Belakang
Perkembangan intensifikasi budi daya dan industri akuakultur di Indonesia sudah
maju sedemikian pesat, namun menghadapi berbagai kendala seperti tingginya
angka mortalitas yang disebabkan oleh masalah penyakit. Salah satu bakteri
patogen penyebab penyakit pada ikan ialah Aeromonas salmonicida. Pada tahun
1890, Emmerich dan Weibel pertama kali menemukan A. salmonicida pada ikan
trout di Jerman. Strain dari A. salmonicida dapat menimbulkan gejala furunculosis
dan carp erytrodermatitis yaitu pembengakakan dibawah kulit yang biasanya
menjadi infeksi sistemik pada seluruh tubuh ikan (Holt et al., 1994). Wabah A.
salmonicida pernah terjadi pada bulan Oktober 1980, terutama di daerah Jawa
Barat mengakibatkan rendahnya konversi pakan atau menghasilkan produk yang
tidak bermutu, bahkan kematian ikan yang berarti hilangnya pendapatan.
Kerugian yang ditimbulkannya kira-kira mencapai 4 milyar rupiah (Departemen
Kelautan dan Perikanan, 2007). Serangan bakteri ini baru terlihat apabila
ketahanan tubuh ikan menurun akibat stres yang disebabkan oleh penurunan
kualitas air, kekurangan pakan atau penanganan yang kurang tepat (Afrianto dan
Liviawaty, 1992). Bakteri obligat A. salmonicida dapat menginfeksi ikan salmon
maupun non salmon diperairan laut maupun tawar seperti ikan mas, koi dan lele
(Austin dan Austin, 2007).
Bakteri patogen cenderung menempel pada permukaan padat dan apabila
kondisi memungkinkan, bakteri planktonik dalam perairan akan cenderung
membentuk biofilm di berbagai permukaan baik biotik maupun abiotik
(Characklis and Marshall, 1990). Pada saat sekarang ini, penelitian mengenai
biofilm di bidang industri pangan semakin meluas. Hal ini terjadi karena
potensinya yang besar sebagai sumber kontaminan yang berperan terhadap
menunjukkan bahwa jika mikroba dapat membentuk biofilm pada proses
pertumbuhannya, daya tahan terhadap kondisi-kondisi buruk lebih tinggi jika
dibandingkan dengan pertumbuhannya sebagai sel planktonik (Donlan, 2002).
Penyakit pada ikan biasanya diatasi dengan antibiotik dan desinfektan.
Akan tetapi, penggunaan antibiotik berdampak negatif yaitu dapat menyebabkan
timbulnya bakteri yang resisten terhadap jenis antibiotik tertentu, penumpukan
residu jenis antibiotik tertentu pada daging ikan dan udang, dan pencemaran
lingkungan. Salah satu alternatif untuk mengatasi penyakit bakterial pada
organisme akuakultur adalah penggunaan bakteri probiotik. Penggunaan probiotik
dianggap mampu memperbaiki kondisi perairan sehingga menjadi alternatif
pembudidaya ikan saat ini. Menurut Verschuere et al., (2000), probiotik adalah
agen mikroba hidup yang mampu memberikan keuntungan bagi inang dengan
memodifikasi komunitas mikroba atau berasosiasi dengan inang, memperbaiki
nilai nutrisi dan pemanfaatan pakan, meningkatkan respon inang terhadap
penyakit, menghalangi mikroorganismse patogen dalam usus dan lingkungan
dengan melepas enzim-enzim yang membantu proses pencernaan makanan
sehingga dapat meningatkan laju pertumbuhan dan memperbaiki kualitas
lingkungan ambangnya.
Probiotik yang telah banyak diteliti dari organisme perairan untuk
digunakan dalam akuakultur adalah dari kelompok bakteri asam laktat. Misalnya
L. acidophilus, Streptococcus cremoris, L. bulgaricus-56 dan L. bulgaricus-57
menekan pertumbuhan V. alginolyticus secara in vitro dan secara in vivo pada
udang Penaeus indicus (Ajitha et al., 2004). L. plantarum 44a yang mempunyai
mekanisme penghambatan berdasarkan produksi asam, dan L.brevis 18f sebagai
produser H2O2, diisolasi dari intestin ikan air tawar (Bream, Abramis barma dan
African catfish, Clarias gariepinis), menghambat A. hydrophila secara kuat pada
pH 6 (Bucio et al., 2004). Lactobacillus agilis yang potensial dalam menghambat
patogen Micobacterium fortuitum pada ikan (Sitepu et al., 2013), Lactobacillus
acidophilus potensial menghambat bakteri Aeromonas hydrophila (Harahap et al.,
2013), dan Lactobacillus plantarum potensial dalam menghambat petumbuhan
1.1 Rumusan Permasalahan
Rumusan masalah dalam penelitian ini ialah:
1. Jenis BAL yang manakah yang efektif dalam menghambat pertumbuhan bakteri
patogen A. salmonicida penyebab penyakit pada ikan perairan tawar.
2. Apakah isolat A. salmonicida mampu membentuk biofilm pada permukaan
PVC dan sisik ikan.
3. Apakah senyawa antimikrob BAL terplih mampu mengendalkan biofilm A.
salmonicida.
1.2 Tujuan Penelitian
Tujuan dari penelitian ini ialah:
1. Penapisan isolat BAL yang potensial dalam menghanbat pertumbuhan A.
salmonicida yang bersifat patogen pada ikan.
2. Mengetahui aktivitas antimikrob BAL potensial dalam menghambat
pertumbuhan A. salmonicida yang bersifat patogen pada ikan.
3. Mengetahui kemampuan bakteri patogen A. salmonicida dalam membentuk
biofilm dan kemampuan senyawa antimikrob BAL terpilih dalam
pengendaliaan biofilm A. salmonicida.
1.5 Manfaat Penelitian
Melalui penelitian ini didapatkan isolat BAL perairan tawar yang memiliki
kemampuan mengendalikan A. salmonicida yang bersifat patogen pada ikan.
Penelitian ini juga bermanfaat bagi masyarakat sebagai informasi dengan
memanfaatkan potensi aktivitas antimikroba bakteri asam laktat yang dapat
dikembangkan lebih lanjut untuk pemecahan masalah serangan patogen pada
BAB 2
TINJAUAN PUSTAKA
2.1. Penyakit Pada Ikan
Penyakit ikan adalah segala sesuatu yang dapat menimbulkan gangguan pada
ikan, baik secara langsung maupun tidak langsung. Penyakit ikan tidak timbul
sebagai kejadian mandiri tanpa adanya dukungan dari faktor lain tetapi merupakan
hasil interaksi anatara jasad penyebab penyakit itu sendiri dan kondisi lingkungan
hidupnya. Interaksi yang tidak serasi ini menyebabkan stress pada ikan, sehingga
mekanisme pertahanan diri yang dimilikinya menjadi lemah dan akhirnya mudah
diserang oleh penyakit (Afrianto dan Liviawaty, 1992). Selain itu makanan yang
tidak mencukupi kebutuhan nutrisi baik dalam jumlah maupun mutunya serta
kondisi lingkungan yang buruk dapat menyebabkan munculnya penyakit.
Terdapat banyak faktor yang menentukan seekor ikan menjadi sakit.
Faktor utamanya adalah host (organisme peliharaan/inang), patogen (mikroba,
parasit) dan lingkungan yang menyangkut fisik, kimia atau tingkah laku seperti
stres. Penyakit non parasiter yaitu penyakit yang disebabkan bukan oleh hama
maupun organisme parasit. Penyakit ini dapat dikelompokkan berdasarkan faktor
penyebabnya yaitu lingkungan (dalam hal ini air sebagai media hidup,
parameter-parameternya yaitu suhu, pH, oksigen terlarut, senyawa beracun,
kekeruhan/kecerahan air, salinitas) dan pakan. Penyakit-penyakit parasiter yang
menyerang ikan mas dan nila umumnya disebabkan oleh virus, bakteri, jamur,
protozoa dan cacing. Penyakit dapat merugikan usaha budidaya ikan karena secara
potensial dapat menurunkan produksi dan kualitas ikan (Yurisman, 1994).
2.1.1. Penyebab Penyakit Ikan Golongan Bakteri
Beberapa jenis penyebab penyakit ikan golongan bakteri yang sering
menimbulkan kerugian dalam usaha budidaya ikan antara lain meliputi
Edwardsiella tarda, Edwardsiella ictaluri, Streptococcus, Pasteurella, Yersinia
ruckeri, dan Streptomyces.
Bakteri Aeromonas hydrophila merupakan penyebab penyakit
haemorrhagic septicaemia yang juga disebut sebagai MAS (Motile Aeromonad
Septicaemia), ditandai dengan adanya luka di permukaan tubuh, lokal hemorrhagi
terutama pada insang, borok, abses, exopthalmia dan perut kembung (Austin dan
Austin, 1993).
Kemampuan menimbulkan penyakit dari bakteri Aeromonas hydrophila
cukup tinggi. Gejala yang menyertai serangan bakteri ini antara lain ulser yang
berbentuk bulat/tidak teratur dan berwarna merah keabu-abuan, inflamasi dan
erosi di dalam rongga dan di sekitar mulut seperti penyakit mulut merah (red
mouth disease). Tanda lain adalah haemorhagi pada sirip dan eksopthalmia (pop
eye) yaitu mata membengkak dan menonjol (Nitimulyo et al., 1993). Selain itu
ciri-ciri lainnya adalah pendarahan pada tubuh, sisik terkuak, borok, nekrosis,
busung, dan juga ikan lemas sering di permukaan atau dasar kolam (Angka,
1990).
Bakteri A. salmonicida juga dimasukkankan ke dalam kelompok bakteri
gram negatif dengan ciri-ciri berbentuk batang, non motil, serta terdapat
diperairan air tawar, payau, dan laut, penyebab utama penyakit pada ikan
salmonid dengan penyakit yang dikenal dengan nama furunkulosis. Tanda-tanda
klinis serangan A. salmonicida antara lain adanya hemorrhage pada otot tubuh
dan bagian tubuh lainnya, jaringan subkutan seperti melepuh dan berkembang
menjadi borok yang dalam (ulcerative dermatitis). Pada beberapa kasus
septicemia terjadi pembengkakan limpa, ginjal, dan ascites, necrosis pada
jaringan, serta akumulasi sel bakteri dan sel inflamatori (sel fagositosis) akibat
eksotoksin leukositolitik (Angka, 2005).
Bakteri Mycobacterium merupakan penyebab penyakit Tuberkulosis ikan.
Bakteri ini telah diketahui menyerang 157 spesies ikan, 11 spesies amphibia, dan
27 spesies reptilia. Semua jenis salmon sangat mudah diserang. Mycobacterium
fortuitum, M. marinum, M. chelonei ternyata memungkinkan menyerang tangan
Bakteri ini tersebar di seluruh dunia. Sumber infeksi utama Mycobacterium adalah
ikan sakit, tetapi dimungkinkan juga dari sumber bukan ikan (air dan alat-alat
karena bakteri ini diduga bersifat oportunistik). Cara penularan dan penyebaran
diduga melalui beberapa cara yang memungkinkan yaitu melalui pakan dan air
serta transovarian. Ikan yang terserang Tuberkulosis akan mengalami kerusakan
organ dalam, kurus dan kemudian mati. Apabila terjadi luka akan kehilangan
protein plasma dan ikan sangat mudah terserang Infeksi sekunder.
Penyakit Edwardsiellosis disebabkan oleh bakteri dari genus Edwardsiella
yaitu Edwardsiella tarda dan Edwardsiella ictaluri. Bakteri ini menyerang spesies
spesies ikan di daerah tropis. Bakteri E. tarda dan E.ictaluri bisa bertahan hidup
di air. Beberapa inang alamiah bisa bertahan sebagai carrier. Penularan secara
horizontal yaitu kontak antara inang satu dengan inang lainnya atau melalui air.
Gejala eksternal ikan yang terserang Edwardsiellosis pada infeksi ringan, hanya
menampakkan luka-luka kecil. Ukuran luka sebesar 3 – 5 mm. Luka tersebut
berada disamping bagian belakang badan (posterio-lateral). Sebagai
perkembangan penyakit lebih lanjut, luka bernanah berkembang dalam otot rusuk
dan lambung. Pada kasus akut akan terlihat luka bernanah secara cepat bertambah
dengan berbagai ukuran. Perkembangan lebih lanjut, luka-luka (rongga-rongga)
berisi gas. Terlihat bentuk cembung, menyebar ke seluruh tubuh. Ikan tampak
kehilangan warna, dan luka-luka kemudian merata di seluruh tubuh. Jika luka
digores, bau busuk (H2S) tersebar. Bekas jaringan mati bisa berisi 3 rongga.
2.1.2. Penyebab Penyakit Ikan Golongan Jamur
Salah satu kelompok jamur yang sering menyerang ikan air tawar adalah
Saprolegnia sp. yang merupakan penyebab penyakit saproligniasis. Penyakit ini
dikenal dengan nama fish mold yang dapat menyerang ikan dan telur ikan.
Saprolegnia sp termasuk ke dalam Subdivisi Zygomycotina/ Zygomycetes, Kelas
Oomycetes, Ordo Saprolegniales dan kelompok fungi non septat. Jamur ini
bereproduksi secara seksual (spora~oospora) dan juga aseksual (antheridia dan
oogonia) yang mengalami kematangan. Jamur ini menyerang sebagian besar ikan
menyerang ikan kakap yang dipelihara di salinitas rendah. Jenis lain penyakit
jamur yang termasuk berbahaya untuk ikan antara lain adalah Aspergillus flavus
flavus, Aphanomyces, Branchiomyces, dan Ichthyophonus.
A. flavus merupakan jamur yang mampu memproduksi aflatoksin
(Handajani & Purwoko, 2008) dan merupakan jamur patogen potensial yang dapat
mengakibatkan aspergillosis (Malau, 2012). Aflatoksin merupakan suatu
metabolit sekunder yang terbentuk setelah fase logaritmik pertumbuhan kapang A.
flavus (Mehan et al., 1991), yang terdiri dari empat komponen induk yaitu,
aflatoksin B1 (AFB1), aflatoksin B2 (AFB2), aflatoksin G1 (AFG1) dan
aflatoksin G2 (AFG2). Di antara keempat jenis aflatoksin ini, diketahui aflatoksin
B1 (AFB1) dan aflatoksin B2 (AFB2) termasuk yang berbahaya, sehingga
pengembangan penelitian banyak difokuskan pada aflatoksin jenis ini (Coallier &
Idzack, 1985). Serangan cendawan A.flavus mengakibatkan berbagai kerusakan
meliputi kerusakan fisik, kimia, bau, warna, tekstur, dan nilai nutrisi, serta
berakibat pada kesehatan manusia dan hewan (Talanca & Mas’ud, 2009).
A. flavus merupakan kapang saprofit. Koloni yang sudah menghasilkan
spora akan berwarna cokelat kehijauan hingga kehitaman. Miselium yang semula
berwarna putih tidak tampak lagi ketika spora mulai muncul. Koloni A. flavus
dapat mencapai diameter 3-5 cm dalam waktu tujuh hari, dan berwarna hijau
kekuningan karena lebatnya konidiofor yang terbentuk. Kepala konidia khas
berbentuk bulat, kemudian merekah menjadi beberapa kolom, dan berwarna hijau
kekuningan hingga hijau tua kekuningan. Konidiofor berwarna hialin, kasar dan
dapat mencapai panjang 1,0 mm (ada yang sampai 2,5 mm). Vesikula berbentuk
bulat hingga semibulat, dan berdiameter 25-45 µm. Fialid terbentuk langsung
pada vesikula atau pada metula, dan berukuran (6-10) x (4,0-5,5) µm. Metula
berukuran (6,5-10) x (3-5) µm. Konidia berbentuk bulat hingga semibulat,
berdiameter 3,6 µm, hijau pucat dan berduri (Gandjar et al., 1999). Secara
makroskopis jamur yang tumbuh terlihat warna koloni hijau kekuningan yang
merupakan indikator adanya jamur A. flavus. Secara mikroskopis pada A. flavus
tampak vesikel agak lonjong dengan dinding konidia lebih halus dan tidak
Kondisi optimum jamur ini untuk menghasilkan aflatoksin adalah pada
suhu 25-35 0C, kelembaban relatif 85 % dan kadar air 16 %, serta pH 6.
Kontaminasi aflatoksin pada bahan pangan terjadi bila strain aflatoxigenic
berhasil tumbuh dan membentuk koloni serta selanjutnya memproduksi
aflatoksin. Jamur A. flavus akan menghasilkan 50 % strain aflatoxigenic (Cotty &
Melon, 2004).
Jamur Apanomyces dilaporkan menyerang lobster air tawar, crayfish, sea
mullet, yellow fin bream, dan sand whiting. Jamur ini menyerang organ
persendian dan pergerakan. Ikan yang terserang mengalami paralisis, terlihat diam
terlentang di dasar akuarium atau kolam sampai mati. Tidak ada respon terhadap
rangsangan eksternal yang diberikan. Jaringan yang terinfeksi umumnya daerah
persendiaan berwarna kekuningan atau cokelat dan mengalami nekrosis.
Aphanomyces merupakan parasit obligat, menginfeksi daerah lunak persendian
dan ruas abdomen. Jamur ini membentuk hifa disepanjang syaraf ventral dan
ganglion otak. Keadaan ini menimbulkan gangguan serta kerusakan organ
lokomotor dan juga sistim kekebalan dari ikan yang terinfeksi.
Branchiomycosis adalah penyakit ikan yang disebabkan jamur
Branchiomyces sanguinis. Inang definitif dari jamur ini dilaporkan meliputi
Cyprinus carpio, Tinca tinca, Carrasius auratus, Esox lucius, Gasterosteus
aculeatus, dan Salmonid. Tandatanda klinis serangan Branchiomycosis meliputi
adanya nekrosis pada insang yang berwarna keputihan. Ikan mengalami kesulitan
bernafas atau asphyxia, megap-megap di permukaan air. Insang memperlihatkan
tanda-tanda hemorhagik. Ikan terlihat berkumpul di daerah pemasukan air dan
tidak mau makan. Kejadian infeksi dipengaruhi oleh suhu perairan. Infeksi hanya
terjadi pada musim panas, terutama pada bulan Juli – Agustus di daerah yang
bermusim empat. Morbiditas penyakit ini dapat mencapai 50 %, sedang pada
infeksi yang bersifat akut dapat menimbulkan kematian sebanyak 30 – 50 % dari
populasi ikan yang terinfeksi dalam waktu 2 – 4 hari, terutama diakibatkan karena
terjadinya anorexia. Branchiomycosis akut dapat dikenali dengan terjadinya nodul
putih pada insang sebagai suatu luka patogenomonik. Infeksi dari jamur ini dapat
tertelan (Anderson, 1995). Sand paper disease adalah penyakit yang disebabkan
jamur Ichthyophonus hofferi. Inang definitif cendawan ini dilaporkan meliputi
Clupea harengus harengus, Salmo gairdneri, Salvelinus fontinalis.
2.2. Bakteri Asam Laktat (BAL)
BAL ditemukan pertama kali oleh Pasteur, seorang profesor kimia di University of
Lille pada tahun 1878. Pada tahun 1889, Tissier, peneliti Prancis menemukan
bakteri yang mendominasi saluran usus bayi yang minum air susu ibu yaitu
Bifidobacterium. BAL berbentuk bulat maupun batang, Gram positif dan (dengan
sedikit perkecualian) tidak motil, katalase negatif, tidak mempunyai sitokrom,
aerotoleran, anaerobik hingga mikroaerofolik, serta membutuhkan nutrisi yang
kompleks seperti asam amino, vitamin (B1, B6, B12 dan biotin), purin dan
pirimidin (Surono, 2004). Walaupun BAL dapat hidup dengan dan tanpa oksigen,
sumber energi terbesarnya untuk tumbuh adalah fermentasi gula. Bakteri ini
mempunyai kapasitas respirasi yang sangat terbatas dan tidak dapat memperoleh
ATP dari proses respirasi (Salminen & Wright, 2004).
BAL dibagi menjadi tiga grup berdasarkan pola fermentasinya, yaitu :
a. Grup I : BAL homofermentatif obligatif, yang mengubah heksosa menjadi asam
laktat melalui jalur Embden-Meyerhof, namun tidak bias memfermentasikan
pentosa ataupun glukonat. BAL grup ini termasuk dalam termobakterium, yang
kekurangan glukosa-6 fosfat dehidrogenase dan 6-fosfoglukonat. Sebagian besar
BAL grup ini tumbuh pada suhu 450C namun tidak tumbuh pada suhu 150C
(Hopzapfel, 1998).
b. Grup II : BAL heterofermentatif fakultatif, yang memfermentasikan heksosa
secara homofermentatif namun sebagian galur pada beberapa kondisi mempunyai
metabolisme heterofermentatif dari heksosa menjadi asam laktat, karbondioksida
dan ethanol atau asam asetat. Pentosa difermentasi melalui fosfoketolase menjadi
asam laktat, karbondioksida dan ethanol atau asam asetat. Produksi asam asetat
terjadi jika NAD+ dapat diregenerasi tanpa pembentukan ethanol, misalnya
streptobakterium, yang mempunyai dua enzim dehidrogenase tetapi menggunakan
jalur Embden-Meyerhof untuk fermentasi glukosa (Hopzapfel, 1998).
c. Grup III : BAL heterofermentatif obligatif, yang memfermantasikan heksosa
menjadi asam laktat, karbondioksida dan etanol atau asam asetat, jika terdapat
akseptor elektron alternatif. Pentosa diubah menjadi asam laktat dan asam asetat.
BAL grup ini termasuk dalam betabakterium, yang kekurangan fruktosa 1.6
difosfat aldolase (Hopzapfel, 1998). BAL sering ditemukan secara alamiah dalam
bahan pangan. Bakteri ini hidup pada susu, daging segar, dan sayur-sayuran. Pada
proses fermentasi daging spontan, BAL yang berasal dari bahan mentah atau
lingkungan menyebabkan terbentuknya asam laktat dari penggunaan karbohidrat,
maupun rendahnya nilai pH (5.9 sampai 4.6) (Surono, 2004).
2.2.1. Probiotik
Probiotik yaitu suplementasi sel mikroba atau komponen sel mikroba pada pakan
yang menguntungkan inang (Irianto, 2003). Beberapa jenis bakteri-bakteri
probitiok yang telah banyak diaplikasikan pada budi daya air tawar, air payau dan
air laut diantaranya: Bacillus sp. (Boonthai et al., 2011); Bacillus subtilis
(El-Dakar et al., 2007; Keysami et al., 2012; Keysami et al., 2007; Kumar et al.,
2008; Merrifield et al., 2010; Mohapatra et al., 2012); Bacillus licheniformis
(Merrifield et al., 2010); Enterococcus faecium (Gopalakannan and Arul, 2011;
Merrifield et al., 2010); B. coagulans- Rhodopseudomonas palustris-
Lactobacillus acidophilus ( Wang, 2011); Lactococcus lactis dan Saccharomyces
cerevisae.
Pada budi daya ikan, probiotik diberikan sebagai campuran makanan dan
ada yang ditaburkan pada kolam pemeliharaan. Untuk probiotik yang dicampur
pakan, bisa dicampurkan dengan pakan buatan pabrik (pelet) maupun pakan alami
seperti dedaunan. Penebaran probiotik pada kolam akan membantu tumbuhnya
plankton-plankton dan mikroorganisme lainnya dalam air kolam sebagai makanan
alami ikan. Probiotik jenis ini akan menggemburkan dasar kolam sekaligus
diguyurkan ke air kolam pada pagi hari setiap dua minggu sekali supaya air selalu
sehat, tidak blooming dan penuh dengan plankton sebagai pakan alami.
Aplikasi probiotik tidak hanya berfungsi sebagai agen biokontrol untuk
mengurangi serangan penyakit atau bioremediasi untuk memperbaiki kualitas
lingkungan, melainkan dapat pula meningkatkan nilai nutrisi pakan dan laju
penyerapan nutrien sehingga memungkinkan udang mencapai pertumbuhan yang
maksimum. Aplikasi bakteri probiotik dalam perbaikan nutrisi pakan dapat
dilakukan baik melalui pengkayaan pakan alami maupun pakan buatan
(Widanarni et al., 2008a)
Mikroflora saluran pencernaan ikan gurame yang terpilih sebagai kandidat
probiotik adalah mikrob yang menguntungkan serta dapat menjaga keseimbangan
mikroflora dalam saluran pencernaan ikan. Mikroflora menguntungkan yang
ditemukan pada saluran pencernaan ikan gurame adalah Moraxella sp., Bacillus
sp., Carnobacterium sp., Lactobacillus sp,. dan Streptococcus sp., yang dapat
berperan sebagai nutrien tambahan bagi ikan dan suplemen dalam kultur pakan
alami, yaitu bermanfaat melalui metabolit seperti vitamin B12 dan enzim yang
disekresikannya ke dalam medium kultur, selain itu dapat juga meningkatkan
kecernaan nutrien pakan melalui enzim pencernaan eksogen yang
disekresikannya.
2.2.2. Manfaat Probiotik
Probiotik merupakan makanan tambahan berupa sel-sel mikroba hidup, yang
memiliki pengaruh menguntungkan bagi hewan inang yang mengkonsumsinya
melalui penyeimbangan flora mikroba intestinalnya (Fuller, 1987). Selanjutnya
Verschuere et al., (2000) menyatakan bahwa probiotik sebagai penambah mikroba
hidup yang memiliki pengaruh menguntungkan bagi komunitas mikroba
lingkungan hidupnya. Pendapat lain oleh Salminen et al., (1999) bahwa probiotik
merupakan segala bentuk preparasi sel mikroba atau komponen sel mikroba yang
memiliki pengaruh menguntungkan bagi kesehatan dan kehidupan inang.
Irianto (2003) menyatakan bahwa probiotik dapat mengatur lingkungan
melepas enzim-enzim yang membantu proses pencernaan makanan sehingga
dapat meningkatkan laju pertumbuhan. Dalam proses peningkatan aktivitas
pencernaan, probiotik memiliki mekanisme dalam menghasilkan beberapa enzim
exogenous untuk pencernaan pakan seperti amilase, protease, lipase, dan selulase
(Bairage et al., 2002; Aslamyah, 2006; Taoka et al., 2007; Wang, 2007 & Wang
et al., 2008). Hasil penelitian Widanarni et al., (2009) menunjukkan bahwa
bakteri SKT-b mampu menghasilkan enzim protease dan amilase. Enzim
exogenous tersebut akan membantu enzim endogenous pada inang untuk
menghidrolisis nutrien pakan.
2.3. Biofilm
Biofilm tidak hanya berupa kumpulan sel mikroorganisme yang menempel pada
permukaan padat dalam lingkungan yang berair, namun secara struktural dan
dinamis berupa sistem biologi yang komplek (Stoodley et al., 2006). Biofilm
mampu menempel pada permukaan stainless steel pada alat pengolahan makanan
laut (Jamilah et al., 2004).
Penempelan biofilm dapat terjadi pada permukaan biotik dan nonbiotik.
Faktor pembentukan dan penyebaran biofilm diantaranya sistem quorum sensing
dan molekul seperti autoinduser 2 (Abee et al., 2011). Bakteri patogen yang
membentuk biofilm memerlukan usaha pengontrolan yang lebih keras dibanding
keadaan planktonik (Silitonga, 2013).
Pembentukan biofilm tersusun dari beberapa tahapan (Aparna and Yadav,
2008). Tahap pertama terbentuknya biofilm dimulai dengan perlekatan sel
mikroba planktonik pada permukaan substrat. Setelah itu, koloni akan mengikatan
diri lebih kuat pada permukaan dengan menggunakan pili. Selama tahap ini sel
bakteri mengalami pertumbuhan logaritmik.
Tahap kedua, bakteri mengalami multifikasi sambil mengeluarkan sinyal
kimia untuk berkomunikasi secara internal. Substansi EPS mulai dihasilkan
berdasarkan mekanisme genetik. Tahap ketiga biofilm terus tumbuh sejalan
dengan pertumbuhan koloni. Pada tahap in ketebalan biofilm lebih dari 10
lebih dari 100 nanometer dan dapat mencapai 300-400 milimeter seperti yang
dibentuk oleh algal mats. Beberapa hari setelah tahap ke empat, biofilm akan
memasuki tahap kelima. Pada tahap ini terjadi dispersi sel sehingga
memungkinkan beberapa bakteri meninggalkan biofilm untuk berkembang
kembali menjad sel planktonik (Aparna and Yadav, 2008)
BAB 3
BAHAN DAN METODE
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Mei sampai dengan Desember 2014
bertempat di laboratorium Mikrobiologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam, dan di laboratorium Terpadu Fakultas Kedokteran,
Universitas Sumatera Utara, Medan.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini antara lain tabung reaksi, cawan
petri, pro pipet, pipet serologi, spatula, jarum ose, autoklaf, inkubator, beaker
glass, bunsen, mikroskop cahaya, obyek glass, shaker, spektrofotometer, pH
meter, water bath, hot plate, cork borer, sentrifuse dan vortex. Sedangkan
bahan-bahan yang digunakan dalam penelitian ini antara lain usus ikan mas (C. carpio)
yang sehat diambil dari penjual komersil, akuades, alkohol 70 %, larutan Mc
Farland, media MRS broth, media MRS agar, media MHA, media NB larutan
pepton steril, kultur stok Lactobacillus sp., dari koleksi Laboratorium
Mikrobiologi FMIPA, Universitas Sumatera Utara, Medan. A. salmonicida dan A.
3.3. Rancangan Percobaan
Penelitian ini merupakan penelitian deskriptif yang dimulai dengan isolasi
dan karakterisasi BAL dari sumber isolasi usus ikan Mas (C. carpio) yang sehat
diambil dari penjual komersil sebanyak 4 ekor. Penapisan atau seleksi BAL dalam
menghambat pertumbuhan A. salmonicida. Uji aktivitas senyawa antimikroba
ekstrak kasar BAL isolat potensial dalam menghambat pertumbuhan A.
salmonicida pada kepadatan sel 108 CFU/mL. Data diperoleh disajikan dalam
gambar dan tabel.
3.4. Isolasi dan Karakterisasi BAL
Isolasi BAL dilakukan menurut metode Bucio et al., (2006) dengan
modifikasi. Saluran pencernaan ikan sehat dipisahkan dari rongga tubuh, diambil,
disayat untuk kemudian dibersihkan isinya. Selanjutnya ditiriskan dinding usus
bagian dalam dikerik dengan menggunakan spatula steril. Cairan mukosa usus
diambil sebanyak 1 mL dan dihomogenkan di dalam 9 mL larutan PBS (phosphat
buffer saline) kemudian dilakukan pengenceran hingga 10-8 secara berseri. Dari
setiap pengenceran 10-4 hingga 10-8 diambil 0,1 ml dan disebarkan pada medium
MRS agar, diinkubasi pada suhu 28 0C selama 24-48 jam. Koloni yang tumbuh
terpisah, berwarna putih pada MRSA dimurnikan dengan metode kuadran gores
hingga diperoleh koloni murni. Kultur murni ditandai dengan morfologi yang
seragam. Seluruh isolat yang telah diperoleh dikarakterisasi berdasarkan pada
karakteristik morfologi dan uji biokimiawi yaitu:
a. Uji Morfologi dan Pengecatan Gram
Isolat murni ditumbuhkan pada media cair MRS dan diinkubasikan selama 24
jam, pada suhu 30 oC kemudian dilakukan pengecatan Gram sekaligus diamati
bentuk selnya (bulat, bulat batang, tetrad, batang).
b. Uji Motilitas
Uji motilitas dilakukan dengan menumbuhkan kultur pada media SIM dan
pertumbuhan bakteri pada media di dalam tabung reaksi. Bakteri yang tidak motil
hanya tumbuh terbatas pada bekas goresan jarum inokulasi.
c. Uji biokimiawi (Uji Katalase, Uji Sitrat dan Uji TSIA)
Uji katalase dilakukan dengan meneteskan larutan H2O2 3% pada kultur muda
(umur 24 jam). Sifat reaksi terhadap uji katalase ditentukan dengan pemunculan
gelembung gas yang memberikan indikasi pembentukan gas CO2. Uji sitrat
dilakukan dengan media SCA (Simon Citrat Agar), uji positif terjadi jika terdapat
perubahan warna pada media yang semula berwarna hijau menjadi biru. Uji TSIA
dilakukan dengan media miring TSIA. Gores permukaan media dengan ose
bengkok, kemudian tusuk bagian tengah media secara lurus dan diinkubasi selama
24-48 jam. Uji positif dilihat dengan adanya endapan hitam.
3.5. Seleksi BAL Potensial dalam menghambat pertumbuhan A. salmonicida
Seleksi BAL potensial dalam menghambat bakteri A. salmonicida dilakukan
dengan metode Banerjee et al., (1999) untuk menentukan isolat terpilih yang
nantinya akan diteruskan pada pengujian selanjutnya. Patogen uji sebanyak 5-10
koloni dikultur dalam 50 mL media NB dan diinkubasi 24 jam pada suhu 28 0C
yang telah dibuat dengan OD600 = 0,5 setara 108 CFU/ml yang diukur dengan
menggunakan spektrofotometer diusap kultur cair patogen A. salmonicida dengan
cotton bud steril pada media MHA, uji antagonis dengan mentotolkan kultur
bakteri BAL dengan tusuk gigi steril pada media MHA yang telah diusap kultur
cair patogen tersebut, diinkubasi pada suhu 28 0C selama 24-48 jam. Diameter
zona penghambatan diukur dengan mengamati zona bening yang terbentuk.
3.7. Kurva Pertumbuhan Isolat BAL
Sebanyak 5 ose kultur BAL terpilih dimasukkan kedalam 30 mL media cair
MRSB, kemudian diinkubasi pada suhu 28 0C, pada rentang waktu 3 jam selama
24 jam, dihitung nilai kerapatan optik atau optical density (OD) isolat terpilih
BAL dengan menggunakan spektrofotometer pada panjang gelombang 600 nm
3.8. Produksi Senyawa Antimikroba BAL
Produksi Senyawa Antimikroba dilakukan dengan memproduksi senyawa
antimikroba ekstrak kasar BAL yang berasal dari kultur cair berumur 15 jam.
Kultur cair MRS ditambahkan sebanyak 10 mL ke dalam 400 mL media NB,
diinkubasi pada suhu 28 0C selama 15 jam. Kemudian sebanyak 100 mL kultur
disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4 0C selama 15 menit.
Selanjutnya dilakukan penyaringan senyawa antimikroba dengan kertas saring
0,22 µm (MS® Syringe filter) sehingga diperoleh ekstrak kasar senyawa
antimikroba BAL.
3.9. Uji Aktivitas Senyawa Antimikroba BAL terhadap bakteri patogen A.
salmonicida.
Pengujian terhadap bakteri patogen dilakukan dengan menyebarkan
suspensi kultur bakteri uji di atas media MHA. Kertas cakram ditetesi dengan
senyawa antimikroba sebanyak 30 μl dan diletakkan di atas sebaran biakan
patogen uji dengan OD600=0,5, lalu diinkubasi pada suhu 28-30 °C selama tiga
hari. Pengamatan dilakukan terhadap pengukuran zona hambat yang terbentuk di
sekitar cakram kertas yang menunjukkan adanya aktivitas antimikroba.
Kertas cakram kloramfenikol 10 μg digunakan sebagai pembanding dengan
senyawa antmikro. Pengujian kemampuan senyawa antimikrob dilakukan dengan
metode difusi cakram.
3.10. Pembentukan Dan Penghitungan Sel Biofilm A. salmonicida
Lempeng permukaan padat dibuat untuk pengujian in vitro dalam hal ini
permukaan plastik PVC dan sisik ikan. Lempeng plastik PVC dan sisik ikan
dipotong seluas 1 cm2 kemudian dicuci dengan larutan detergen pada bak
sonikator selama 15 menit. Kedua lempeng lalu di autoklaf selama 15 menit,
tekanan 1 atm pada suhu 121 0C. Sisik ikan dan PVC dianalogikan sebagai
Isolat murni A. salmonicida ditumbuhkan pada media NB sebanyak 50 ml
dengan konsentrasi sel 108 CFU/ml dalam labu erlenmeyer. Secara terpisah
masing-masing lempeng dimasukkan ke dalam labu erlenmeyer, kemudian
diaerasi selama 15 menit setiap harinya pada suhu ruang 28 0C. Pembentukan
biofilm diamati pada periode 1, 3 dan 5 hari untuk melihat penempelan sel
biofilm. Lempeng diangkat dari kultur, masing-masing dibilas sebanyak 3 kali
dengan 10 ml akuades steril kemudian dimasukkan ke 9 ml larutan garam
fisiologis NaCl 0,85 % yang ditambah dengan 0,5 g manik-manik kaca mikro
(glass bead), kemudian dihomogenkan untuk melepas sel biofilm selama 2 menit.
Selanjutnya dilakukan pengenceran berseri. Sebanyak 0,1 ml kultur disebar pada
media PCA, diinkubasi pada suhu 28 0C selama 24 jam. Setelah itu dilakukan
perhitungan jumlah sel dengan metode TPC. Perlakuan diulang sebanyak 2 kali.
Kontrol berupa larutan yang berisi masing-masing lempeng tanpa penambahan sel
A. salmoncida menurut metode (Jamilah dan Priyani, 2012).
3.11. Pengendalian Sel Biofilm A. salmonicida dengan Senyawa Antimikrob BAL Potensial
Lempeng plastik PVC dan sisik ikan yang telah ditumbuhi biofilm A.
salmoncida yang berumur 1, 3, dan 5 hari disiapkan. Masing-masing lempeng
plastik PVC dan sisik ikan yang terpisah dimasukkan ke dalam tabung steril yang
berbeda lalu ditambahkan masing-masing senyawa antimikrob BAL terpilih pada
suhu 28 0C dengan waktu kontak 1 jam dan diaerasi selama 15 menit. Setelah
waktu kontak 1 jam lempeng diangkat dari kultur dan masing-masing dibilas
sebanyak 3 kali dengan 10 ml akuades steril lalu dimasukkan ke 9 ml larutan
garam fisiologis NaCl 0,85 % yang ditambah dengan 0,5 g manik-manik kaca
mikro (glass bead), kemudian dihomogenkan untuk melepas sel biofilm selama 2
menit, selanjutnya dilakukan pengenceran berseri. Sebanyak 0,1 ml kultur disebar
pada media PCA secara aerobik, kemudian diinkubasi pada suhu 28 0C selama 24
jam, dilakukan perhitungan jumlah sel dengan metode TPC. Perlakuan diulang
BAB 4
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Karakterisasi Bakteri Asam Laktat
Hasil isolasi BAL yang diisolasi dari usus ikan mas diperoleh 6 isolat
bakteri yaitu UM1, UM2, UM3, UM4, UM5, dan UM6 yang berbeda dari segi
warna, bentuk, tepian dan elevasi koloni. Beberapa isolat BAL yang diujikan
dalam penelitian ini diperoleh dari stok kultur laboratorium Mikrobiologi
Universitas Sumatera Utara yang diisolasi dari usus ikan nila oleh Harahap et al.,
2013 yaitu US7. Isolat AK1, AK3, dan AK5 diisolasi dari air kolam oleh
Mayasari et al., 2013, sedimen kolam 2 isolat yaitu EK2 dan EK5 yang diisolasi
oleh Sitepu et al., 2013 juga digunakan dalam penelitian ini. Isolat yang berbeda
dipisahkan dengan menggunakan metode cawan gores pada media MRSA
sehingga diperoleh biakan murni untuk keperluan karakterisasi.
Berdasarkan pengamatan morfologi isolat BAL yang diperoleh dari usus
ikan mas bervariasi umumnya bentuk koloni bulat, tidak beraturan dan cekung.
Tepi koloni umumnya tidak teratur namun beberapa ada yang halus dan
bergelombang. Warna koloni BAL umumnya putih susu dan krem. Elevasi dari
koloni BAL hasil isolasi juga bervariasi diantaranya datar, berbukit dan timbul
(Tabel 4.1).
Hasil pewarnaan Gram pada seluruh isolat BAL merupakan bakteri Gram
positif. Bakteri gram positif mempunyai dinding sel yang tebal tersusun dari
lapisan peptidoglian yang terdri atas protein, asam teikoat, dan polisakarida serta
bagian luar dielilingi dan dibungus oleh lapisan sulfur protein (Capucino dan
Sherman, 2001). Berdasarkan pengamatan terhadap hasil uji biokima, secara
umum isolat bakteri asam laktat menunjukkan uji negatif terhadap hidrolisis pati,
uji sitrat dan hidrolisis gelatin. Pada uji katalase bakteri asam laktat postif namun
beberapa negatif yaitu UM3, UM5, AK5 dan EK2. Pada uji motilitas UM5 dan
AK = Air Kolam
EK = Endapan Kolam
US = Usus ikan Nila
Bakteri asam laktat merupakan kelompok bakteri probiotik yang dapat
memberikan efek yang menguntungkan bagi kesehatan inangnya dengan cara
meningkatkan sifat-sifat dari mikroflora dalam saluran pencernaan. Spesies
mikroba yang umum digunakan sebagai probiotik adalah Lactobacillus,
Bifidobacteria, Enterococcus, Saccharomyces, dan Lactococcus. Menurut Cowan
(1974) bahwa bakteri probiotik merupakan bakteri berbentuk batang, beberapa
berbentuk kokus, tergolong bakteri Gram positif pada kultur muda dan akan
menjadi bakteri Gram negatif ketika memasuki fase stasioner dalam
pertumbuhannya, bersifat motil, memproduksi spora (endospora) yang biasanya
resisten pada panas, aerob (beberapa spesies anaerob fakultatif), katalase positif
dan oksidasi bervariasi. Namun beberapa spesies dapat membentuk katalase atau
sitokrom pada media yang mengandung hematin atau senyawa terkait dan
beberapa lactobacilli juga dapat menghasilan non-heme katalase yang dissebut
pseudocatalase, yang menyebaban kebingungan untuk identifikasi BAL (Holzapel
et al., 2001).
4.2. Seleksi Bakteri Asam Laktat Potensial dalam Menghambat Bakteri Patogen Aeromonas salmonicida dengan Difusi Cakram
Hasil seleksi isolat BAL yang potensial memperlihatkan bahwa terdapat
hasil yang bervariasi dalam menghambat mikroba patogen Aeromonas
salmonicida. Sembilan isolat mampu menghambat mikroba uji Aeromonas
salmonicida yaitu isolat UM1, UM2, UM3, UM4, UM5, UM6, AK1, EK5 dan
EK2 sedangkan 3 isolat lainnya yaitu US7, AK3 dan AK5 tidak mampu
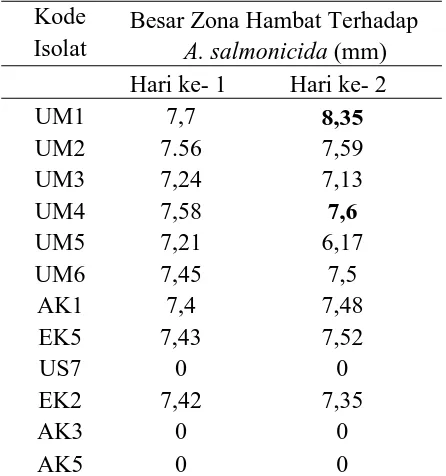
menghambat mikroba uji Aeromonas salmonicida. UM1 memiliki luas zona
hambat terbesar pada Aeromonas salmonicida sebesar 8,35 mm. UM4 memiliki
zona hambat terbesar kedua dalam menghambat Aeromonas salmonicida sebesar
7,6 mm. Isolat UM1 dan UM4 ini dikategorikan memiliki zona hambat yang
tergolong kuat. Menurut Pan et al (2009), zona bening yang berdiameter hambat
hambat lebih besar dari 6 mm tergolong kuat. Hasil uji antagonis isolat BAL
terpilih terhadap Aeromonas salmonicida dan dapat dilihat pada Tabel 4.2.
Tabel 4.2. Uji Antagonis Isolat BAL terhadap Mikroba Patogen Aeromonas salmonicida
Kode Besar Zona Hambat Terhadap
Isolat A. salmonicida (mm)
Tabel 4.2 terlihat bahwa aktivitas antagonistik terhadap bakteri patogen
uji Aeromonas salmonicida oleh bakteri asam laktat ternyata menunjukkan
kemampuan menghambat yang berbeda. Adanya perbedaan ukuran zona hambat
pada setiap isolat BAL mungkin disebabkan senyawa antibakteri yang
dihasilkan pada setiap isolat berbeda sehingga berpengaruh terhadap ukuran
zona bening yang terbentuk. Bakteri asam laktat yang mengandung probiotik
misalnya Lactobacillus spp. menghasilkan enzim-enzim pencernaan seperti
lactase yang memanfaatkan karbohidrat yang tidak dapat dicerna menjadi dapat
dicerna serta dapat meningkatkan kekebalan tubuh. Bacillus sp. dimanfaatkan
sebagai agen biokontrol (probiotik) karena memiliki kemampuan dalam
mendegradasi senyawa organik dan menggunakannya untuk menunjang
pertumbuhannya. Hal ini disebabkan karena, Bacillus sp. memiliki enzim
proteolitik yang dihasilkan secara ekstraseluler yang berperan dalam menguraikan
lemak sehingga mampu mendegradasi sampah-sampah organik yang dipecah
menjadi senyawa-senyawa yang lebih sederhana (Mansyur et al., 2008).
Beberapa hasil penelitian menunjukkan hasil berbeda yang diiisolasi dari
keju oleh Susanti et al., (2007) pengujian senyawa aktivitas antagonistik terhadap
S. aureus isolat KJ-1 yang diisolasi dari keju menunjukkan aktivitas
penghambatan yang terbesar yaitu 5,5 mm dengan metoda difusi agar, sedangkan
Lactobacillus mesenteroides FNCC023 memberikan penghambatan yang kecil
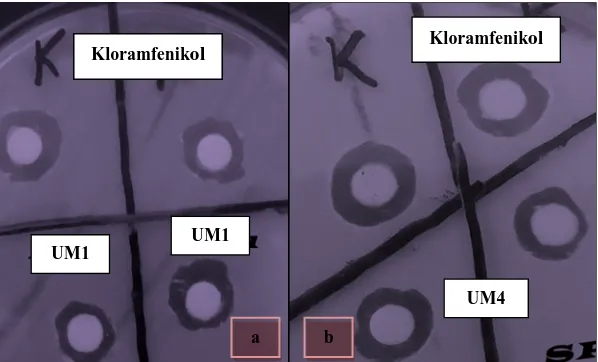
terhadap B. cereus yaitu sebesar 4,0 mm. Lactobacillus mesenteroides FNCC023
memberikan penghambatan yang kecil terhadap E. coli yaitu sebesar 3,8 mm.
Gambar 4.1. Uji Antagonis Isolat BAL Terhadap Mikroba Patogen Aeromonas salmonicida (a) Isolat UM1 selama 48 jam (b) Isolat UM4 selama 48 jam.
Pada isolat UM3, UM5 dan EK2 terhadap Aeromonas salmonicida
diperoleh data zona hambat yang menurun pada hari kedua. Hal ini dapat
disebabkan karena beberapa faktor, antara lain yaitu tidak dihasilkan lagi
metabolit sekunder dalam menghambat pertumbuhan mikroba uji. Selain itu juga
tergantung dari sifat isolat bakteri, baik bersifat bakteriostatik maupun
bakteriosidal.
Beberapa isolat tidak mampu menghambat patogen uji dugaan yang
menyebabkan isolat tersebut tidak mampu menghambat mikroba patogen yang
diuji yaitu isolat bakteri tersebut menghasilkan senyawa antibakteri namun tidak
bersifat aktif terhadap bakteri uji Aeromonas salmonicida. Bakteri menghasilkan
senyawa antibakteri secara intraseluler sehingga senyawa antibakteri yang
b a
dihasilkan oleh bakteri tersebut tidak terekskresi dan terakumulasi dalam media
tumbuh. Dari hal ini dapat diketahui bahwa setiap isolat bakteri asam laktat yang
diperoleh menghasilkan metabolit dan kemampuan menghambat yang
berbeda-beda pada beberapa mikroba patogen.
Verschuere et al., (2000) mengemukakan bahwa mekanisme bakteri
antagonis yang dapat digunakan sebagai biokontrol adalah menghasilkan senyawa
penghambat pertumbuhan patogen, terjadi kompetisi pemanfaatan senyawa
tertentu atau kompetisi pemanfaatan energi dan kompetisi tempat menempel.
Aktivitas antibakteri terbentuk setelah memasuki fase stasioner mengikuti
mekanisme quorum sensing yang merupakan sistem komunikasi antar sel dalam
merespon perubahan lingkungan. Pembentukan senyawa metabolit ini merupakan
suatu bentuk respon bakteri untuk pertahanan melawan mikroba lain (Abee et al.,
2011; Whitehead et al., 2001; Tinaz, 2003). Selain itu juga faktor yang
mempengaruhi pembentukan metabolit yaitu nutrien dan laju pertumbuhan
bakteri.
4.3. Kurva Pertumbuhan BAL Potensial
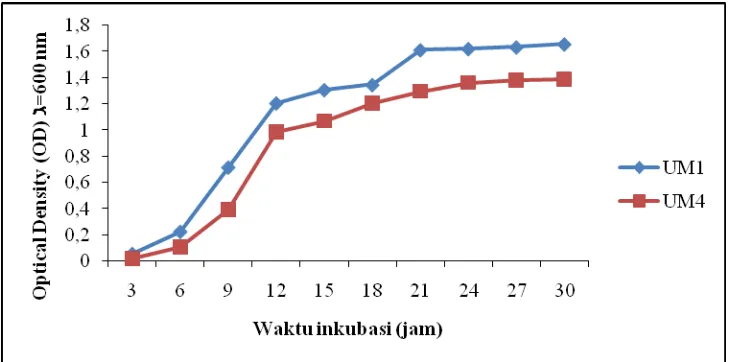
Pertumbuhan biakan isolat potensial UM1 dan UM4 diamati dengan mengukur
densitas optik (OD) pada rentang waktu 3 jam selama 30 jam. Pertumbuhan isolat
UM1 dan UM4 ditandai dengan meningkatnya nilai densitas medium selama
rentang waktu inkubasi. Penentuan kurva pertumbuhan BAL bertujuan untuk
mengetahui fase stasioner pada isolat UM1 dan UM4 karena senyawa antimikrob
dihasilkan pada fase tersebut (Drider, 2006).
Kurva pertumbuhan (Gambar 4.3) menunjukkan bahwa isolat UM1 dan
UM4 memiliki fase adaptasi pada waktu pertumbuhan dari 0 hingga 6 jam
pertama. Fase adaptasi yang cukup lama disebabkan karena bakteri tersebut
tumbuh sebelumnya pada media yang berbeda. Media tumbuh isolat sebelumnya
adalah media MRSA selanjutnya dilakukan penyegaran pada media NB. Menurut
Ghali et al., (2003), jika media dan lingkungan pertumbuhan sama seperti media
dan lingkungan sebelumnya maka mungkin tidak diperlukan waktu adaptasi.
Gambar 4.3. Kurva pertumbuhan isolat UM1 dan UM4 pada media NB
Bakteri mengalami pertumbuhan yang lambat dan memasuki fase stasioner
isolat BAL pada jam ke-21. Isolat BAL mengalami fase pertumbuhan yang
relatif tetap hingga jam ke-30 dikarenakan jumlah sel yang tumbuh sama dengan
jumlah sel yang mati. Produksi atau pemanenan senyawa antimikrob isolat UM1
dalam pengendalian biofilm Aeromonas salmonicida dilakukan pada fase akhir
logaritimik atau fase awal stasioner berdasarkan kurva pertumbuhan yaitu jam
ke-21. Pemanenan pada fase ini dilakukan dengan harapan bakteri mulai
memproduksi senyawa metabolit antmikrob BAL. Pada saat fase ini terjadi
kondisi biakan rutin, akumulasi produk limbah, kekurangan nutrien, perubahan
pH, dan faktor lain yang mendesak senyawa antimikrob BAL keluar sehingga
pada fase inilah diduga senyawa antimikrob telah dihasilkan oleh BAL misalnya
seperti produk-produk yang mungkin dapat menghambat pertumbuhan patogen
penyebab penyakit pada ikan seperti asam laktat, asam piruvat, bakteriosin dan
lain sebagainya.
Hasil yang berbeda ditemukan pada penelitian Mayasari et al., 2013 yaitu
bakteri asam laktat Lactobacillus plantarum yang diinkubasi pada media NB pada
suhu 37 0C mencapai fase akhir logaritmik atau fase awal stasioner pada jam
ke-15. Hal ini menunjukkan kecepatan pertumbuhan sel BAL dipengaruhi oleh faktor
4.4. Uji Aktivitas Senyawa Antimikroba Isolat BAL Potensial UM1 dan UM4 Terhadap Mikroba Patogen Aeromonas salmonicida
Dari hasil pengukuran besar zona hambat yang diperoleh dari
masing-masing isolat BAL terhadap mikroba patogen uji, dua isolat yaitu UM1 dan UM4
yang memiliki zona hambat paling besar digunakan untuk produksi senyawa
antibakterinya dan dilihat efetivitasnya dalam menghambat bakteri patogen uji
Aeromonas salmonicida. Hasil pengamatan pada uji ativitas senyawa antimikrob
UM1 dan UM4 memiliki potensi antimikrob yang berbeda pada hari pertama dan
hari kedua, dapat ditunjukkan oleh Tabel 4.3.
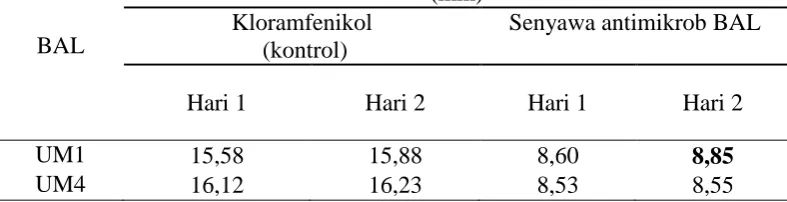
Tabel 4.3. Hasil uji aktivitas senyawa antimikrob BAL terhadap bakteri uji Aeromonas salmonicida
BAL
Diameter Zona Hambat terhadap Patogen Aeromonas salmonicida (mm)
Kloramfenikol (kontrol)
Senyawa antimikrob BAL
Hari 1 Hari 2 Hari 1 Hari 2
UM1 15,58 15,88 8,60 8,85
UM4 16,12 16,23 8,53 8,55
Dari tabel diatas diperoleh hasil bahwa masing-masing isolat memiliki
kemampuan menghambat yang bervariasi. Secara umum, besar zona hambat yang
ditunjukkan dari hari pertama sampai hari kedua terjadi peningkatan. Hal ini
disebabkan karena pada hari ke dua metabolit sekunder dari BAL tersebut
dihasilkan lebih banyak sehingga penghambatannya lebih terlihat jelas pada hari
kedua dibandingkan dengan hari pertama. Senyawa atau metabolit antibakteri
BAL lebih efektif daripada isolat BAL dilihat dari besar zona penghambatan yang
dihasilkan pada senyawa antibakteri BAL. Efektivitas senyawa antibakteri BAL
dalam menghambat bakteri patogen dipengaruhi oleh kepadatan dan strain BAL
serta komposisi media. Selain itu, produk substansi penghambat dari BAL
dipengaruhi oleh media pertumbuhan, pH dan suhu lingkungan. Menurut
Salminem et al., (2004), BAL mampu menghasilkan zat atau senyawa
antimikroba yang dapat menghambat pertumbuhan dan aktivitas mikroba. Selain
itu juga dapat memproduksi senyawa asam organik yang berfungsi sebagai
asidulan atau pengawet.
Gambar 4.5. Hasil Uji Antagonis Senyawa antimikrob selama 48 jam (a) Senyawa antimikrob UM1 (b) Senyawa antimikrob UM4 terhadap Aeromonas salmonicida
Dalam penelitian ini tidak diidentifikasi jenis antimikroba apa yang
dihasilkan, tetapi beberapa penelitian telah membuktikan bahwa bakteri asam
laktat menghasilkan beberapa senyawa yang menghambat pertumbuhan mikroba.
Isolat BAL menghasilkan senyawa antimikroba diantaranya adalah asam laktat,
asam-asam organik, hidrogen peroksida, dan selain itu juga menghasilkan
bakteriosin yang merupakan senyawa komplek protein spesifik yang bersifat
bakterisidal (Permanasari, 2004). Bakteriosin yang dihasilkan oleh BAL diketahui
mampu menghambat pertumbuhan bakteri patogen. Bakteriosin merupakan
senyawa yang banyak dihasilkan oleh bakteri asam laktat (Lubas et al., 2012).
Penelitian Isnansetyo et al., (2002), menemukan Pseudomonas sp. AMSN mampu
menghambat pertumbuhan V. alginolyticus karena menghasilkan senyawa 2,4
diacetylploroglucinol. Penelitian Saputri (2012), Pediococcus pentosaceus mampu
menghasilkan agen antimikroba (bakteriosin) yaitu Pediosicin yang menghambat
beberapa spesies patogen seperti Listeria monocytogenesis yang dapat UM4
UM1
a
Kloramfenikol Kloramfenikol
UM1
menyebabkan Listeriosis. LA-5 juga memproduksi CH5 bakteriosin yang ditandai
tidak hanya sebagai antibakteri jangkauan luas, tetapi juga mempunyai aksi
penghambatan terhadap ragi tertentu (Salminen, 2004).
4.5. Pembentukan biofilm
Pembentukan biofilm dilakuan pada bakteri uji Aeromonas salmonicida
yang dibentuk pada dua lempeng yaitu sisik ikan yang dianalogikan sebagai
permukaan biotik dan plastik PVC dianalogikan sebagai permukaan abiotik
pada permukaan padat lingkungan akuakultur. Biofilm merupakan pertumbuhan
mikroorgansime secara terstruktur pada permukaan padatan sehingga membentuk
lapisan tipis (Prakas, 2003).
Tabel 4.4. Perhitungan rata-rata jumlah sel biofilm A. salmonicida pada lempeng sisik ikan dan plastik PVC
Rata-Rata Jumlah Sel Biofilm CFU/Lempeng Permukaan
Lempeng Hari Ke-1 Hari Ke-3 Hari Ke-5
Sisik 0,83 x 108 0,90 x 109 0,69 x 107
PVC 0,68 x 108 0,74 x 109 0,46 x 108
Pada rentang hari ke-3 terlihat adanya peningkatan jumlah sel biofilm
sebesar 10 kali. Peningkatan jumlah sel biofilm ini terjadi karena adanya faktor
yang mempengaruhi penempelan bakteri pada permukaan meliputi ketersediaan
nutrisi, suhu, pH dan aliran material yang dapat mengikat antara bakteri dengan
permukaan lempeng (Kumar dan Ramjee, 2006). Selain itu juga pada tahap ini
kemungkinan ekstrapolisakarida (EPS) sudah banyak dihasilkan. Pada dasarnya
EP berperan dalam proses penempelan, akan tetapi EPS juga berperan dalam
perlindungan sel biofilm. EPS melindungi dengan cara menyelubungi koloni
bakteri yang menempel. Pada kondisi ekstrim misalnya kehadiran senyawa
antimikroba EP akan menghalangi antimikroba masuk ke membran bakteri
Hasil jumlah sel biofilm Aeromonas salmonicida rata-rata diperoleh sangat
besar jika dibandingkan dengan hasil biofilm yang sudah diteliti oleh peneliti
yang sebelumnya Harahap et al., (2013) terhadap biofilm Aeromonas hydrophilla.
Hal ini pada umumnya dikarenakan, ketersediaan nutrisi, suhu air dan laju alir
cairan yang memadai serta karakteristik bakteri seperti adanya flagela dan
permukaan sel yang terasosiasi dengan polisakarida atau protein yang
mempercepatan proses pelekatan. Aeromonas salmonicida mempunyai faktor
virulensi dari flagella motil. Flagella yang dideskripsikan oleh Rabaan et al., 2001
dan Kirov et al., 2002 berfungsi sebagai alat untuk menempel pada inang dan
sebagai faktor untuk mempermudah kolonisasi.
Menurut Olson (2002), mikroba dalam biofilm hidup dan berkembang
dalam matriks yang diproduksi oleh mikroba itu sendiri dari bahan EPS yang
membentuk lingkungan bagi mikroba tersebut. EPS yang terkandung dalam
biofilm seperti DNA ekstraseluler (eDNA), polisakarida ekstraseluler, serat
amiloid dan protein biofilm saling terkait. Komponen matrik ini menjadi target
untuk berkombinasi dengan enzim seperti DNAse dan protease (Abee et al.,
2011).
Pada hari ke-5 A. salmonicida mengalami penurunan jumlah sel biofilm
rata-rata sebesar 102 pada sisik dan plastik PVC. Hal ini kemungkinan
disebabkan oleh beberapa sel mengalami kematian karena ketersediaan nutrisi
yang berkurang dan sel biofilm pada hari ke-5 terlepas dari permukaan
membentuk sel planktonik. Selain itu juga umur sel biofilm merupakan faktor
yang menyebabkan berbedanya ketahanan sel biofilm (Jamilah et al., 2004).
Pembentukan biofilm bakteri melalui 3 tahapan proses, yaitu tahap pelekatan
bakteri pada permukaan padatan (attachment), kolonisasi, dan tahap pertumbuhan
biofilm (Prakash et al., 2003).
Pada kedua jenis permukaan diketahui PVC cenderung lebih rata
permukaannya dibandingkan dengan sisik ikan. Jumlah sel biofilm pada
permukaan sisik lebih banyak dari plastik PVC, hal ini dapat disebabkan oleh
karena mikroba lebih senang membentuk biofilm serta melekat pada permukaan
akan mengikatkan diri lebih kuat pada permukaan dengan menggunakan pili
(Aparna dan Yadav, 2008).
Hasil penelitian Sastrawidana dan Sukarta (2010), menunjukkan hasil
yang berbeda, yang melakukan kajian pembentukan biofilm konsorsium bakteri
lokal pada reaktor anaerob-aerob menggunakan batu vulkanik. Konsorsium
bakteri lokal pada batu vulkanik terdiri dari Pseudomonas sp., Aeromonas sp., dan
Flavobacterium sp. Hasil perhitungan menggunakan metode total plate count
menunjukkan jumlah koloni bakteri sebesar 20,51x109 CFU/gram batu vulkanik.
4.6. Pengendalian Biofilm
Biofilm Aeromonas salmonicida mengalami penurunan jumlah sel setelah
dikontakkan dengan senyawa antimikrob UM1 selama 1 jam. Jumlah sel biofilm
mengalami penurunan sebanyak 101 CFU/lempeng pada masing-masing lempeng
sisik dan plastik PVC. Hasil penelitian ini menunjukkan biofilm Aeromonas
salmonicida pada PVC dan sisik ikan dianggap kurang efisien karena hanya 101
setelah dikontakkan 1 jam. Menurut Cutright (2001), jumlah bakteri yang
dianggap efisien digunakan untuk merombak limbah adalah sebesar 103-108
cfu/liter limbah cair atau 104-107CFU/gram limbah padat. Penurunan jumlah sel
biofilm A. salmonicida senyawa antimikrob dapat dilihat pada Tabel 4.5. berikut:
Tabel 4.5. Penurunan rata-rata jumlah sel biofilm A. salmonicida pada lempeng sisik ikan dan plastik PVC setelah kontak 1 jam dengan senyawa antimikrob UM1.
Permukaan lempeng
Rata-rata jumlah sel CFU/lempeng sebelum dan setelah kontak dengan senyawa ekstrak kasar BAL
Hari ke-1 Hari ke-3 Hari ke-5 sebelum setelah sebelum setelah sebelum setelah Sisik 0,83 x 108 0,55 x 107 0,90 x 109 0,26 x 108 0,69 x 107 0,16 x 106 PVC 0,68 x 108 0,37 x 107 0,74x 109 0,21 x 107 0,46 x 108 0,17 x 107
Penurunan biofilm A. salmonicida yang hanya 10 kali dapat disebabkan
sehingga pengendalian dengan senyawa antimikrob yang dikontakkan selama 1
jam kurang efektif. Selain disebabkan olehmekanisme substrat bakteri asam laktat
yang terpilih yaitu UM1 kurang selektif untuk mengendalikan biofilm A.
salmonicida sehingga berdampak pada kinerja probiotik tersebut, biofilm A.
salmonicda juga mempunyai senyawa ekstrapolisakarida (EPS) yang dapat
menjadi sistem pertahanan bagi A. salmonicida tersebut. Senyawa antimikrob
yang menghambat dan mengendalikan sel bakteri bergantung pada banyak faktor
yaitu ketahanan sel bakteri terhadap senyawa antimikrob tertentu, jumlah sel,
suhu, dan waktu yang digunakan selama dikontakkan dengan senyawa antimikrob
(Astuti, 2012). Asam laktat yang dihasilkan oleh bakteri probiotik akan berdifusi ke dalam sel mikroba patogen sehingga mengganggu sistem transportasi sel bateri
patogen. Selain Jenis bakteri yang dapat digunakan sebagai agen pengendali
hayati sangat bervariasi, terdiri dari berbagai genus dan spesies, akan tetapi
sifatnya sangat strain spesifik (Salminen, 2004). Perbedaan dalam karakteristik
spesies probiotik dan strain yang berbeda berarti langkah yang harus diambil ialah
memilih strain yang paling tepat untuk aplikasi bakteri patogen tertentu. Jadi
kemungkinan bakteri asam laktat UM1 tidak spesifik sebagai agen pengendali
biofilm A. salmonicida. Biofilm A. salmonicida juga menghasilkan senyawa
ekstrapolisakarida yang berfungsi untuk melindungi bakteri. Matriks ekstraselular
dikeluarkan oleh bakteri untuk membantu penempelannya pada PVC dan sisik.
Semakin banyak jumlah senyawa ekstraselular tersebut semakin menghalangi
kemampuan penetrasi senyawa antimikrob. Selain menghalangi penetrasi,
kehadiran senyawa ekstraselular yang sebagian besar merupakan senyawa
organik, akan menghambat mekanisme kerja senyawa antimkrob tidak semua
bakteri dapat dibunuh, tapi yang rusak ialah senyawa ekstrapolisakarida dan
sebagian bakteri yang dekat dengan permukaan (Dewanti & Wong, 1995).
Penelitian yang sama dalam mengendalikan biofilm dan hasil yang sama
dengan penelitian ini adalah penelitian Mayasari et al., (2013) pengendalian
biofilm patogen Streptococcus agalactiae yang dikontakkan dengan senyawa
antimikrob BAL Lactobacillus plantarum selama 1 jam adalah sebesar 10 kali.