INTISARI
Jamu beras kencur merupakan salah satu obat tradisional Indonesia yang biasa dikonsumsi oleh masyarakat dan dipercaya memiliki khasiat menghilangkan pegal-pegal serta dapat meningkatkan nafsu makan.
Tujuan penelitian ini adalah untuk mengetahui Angka Lempeng Total (ALT) dan mengidentifikasi keberadaan bakteri Escherichia coli dalam jamu beras kencur yang dijual di Pasar Tradisional Sambilegi di wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta. Persyaratan mutu obat tradisional telah diatur dalam Peraturan KBPOM RI No.12 Tahun 2012. Adanya E.coli dan ALT yang melebihi batas pada jamu beras kencur tentu dapat membahayakan kesehatan masyarakat.
Penelitian ini merupakan penelitian non eksperimental dengan rancangan deskriptif komparatif. Tahapan penelitian yang dilakukan meliputi penentuan tempat pengambilan sampel, pemilihan dan pengumpulan sampel, pengujian ALT dan analisis hasil berpedoman pada SNI 2897 tahun 2008, serta identifikasi E.coli dan analisis hasil uji berpedoman pada MA PPOMN tahun 2006.
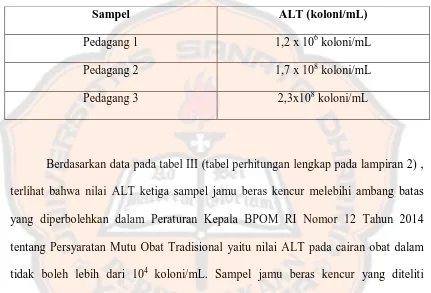
Hasil pengujian menunjukkan ALT sampel jamu beras kencur yang melebihi persyaratan. Nilai ALT pada pedagang 1 sebesar 1,2 x 106 koloni/mL ; pedagang 2 sebesar 1,7 x 108 koloni/mL ; pedagang 3 sebesar 2,3 x 108 koloni/mL, serta terdapat cemaran bakteri E.coli pada pedagang 1 dan pedagang 2.
ABSTRACT
Jamu beras kencur was one of Indonesian traditional medicine were usually consumed by Indonesian public and believed to have efficacy eliminate aches and can increase appetite.
The aims of this research were to determine Total Plate Count (TPC) and identify the presence of E.coli in jamu beras kencur were sold at Sambilegi traditional market in the region Maguwoharjo Depok Sleman, Yogyakarta. The quality requirements of traditional medicine in Regulation KBPOM RI No.12 of 2012. ALT values in jamu beras kencur that exceed the limit and contained of E.coli can endanger public health.
This research is non-experimental research with comparative descriptive design. Stages of research was conducted on the determination location of the sampling, sampling and collection of jamu beras kencur, ALT testing referred to SNI 2897;2008 and identification of E.coli bacteria referred to MA PPOMN 2006.
The results of tests conducted on jamu beras kencur samples were not comply the requirements. ALT values of seller number 1 are 1,2 x 106 colonies/mL ; seller number 2 are 1,7 x 108 colonies/mL ; seller number 3 are 2,3 x 108 colonies/mL, and there are E.coli contamination on seller 1 and 2.
UJI ANGKA LEMPENG TOTAL DAN IDENTIFIKASI Escherichia coli DALAM JAMU GENDONG BERAS KENCUR YANG DIJUAL DI PASAR
SAMBILEGI WILAYAH MAGUWOHARJO KECAMATAN DEPOK KABUPATEN SLEMAN YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Ni Komang Meyla Wulandari NIM : 128114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
TOTAL DAN IDENTIFIKASI Escherichia coli DALAM JAMU GENDONG BERAS KENCUR YANG DIJUAL DI PASAR SAMBILEGI WILAYAH
MAGUWOHARJO KECAMATAN DEPOK KABUPATEN SLEMAN YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
Ni Komang Meyla Wulandari NIM : 128114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Asmad vakkayacittaistu nacaredasubham narah,
subhasubham hyacarati tasya tasyasnute phalam
“Oleh karenanya, inilah yang harus diusahakan seseorang, jangan
biarkan kata-kata, perbuatan dan pikiran melakukan perbuatan
buruk, karena orang yang melakukan sesuatu yang baik,
kebaikanlah yang diperolehnya ; jika kejahatan merupakan
perbuatannya, celaka yang ditemukan olehnya “
(Sarasamuccaya, Sloka : 156)
Ku persembahkan skripsi ini untuk: Ida Sang Hyang Widhi Wasa penjaga penuntun dan penolongku Orangtua, kakak-kakakku dan keluargaku yang selalu mendukung
baik suka maupun duka Almamaterku yang aku banggakan dan semua orang yang Tuhan hadirkan dalam hidup ku Terimakasih
vii PRAKATA
Puji syukur penulis panjatkan ke hadirat Ida Sang Hyang Widi Wasa/ Tuhan Yang Maha Esa atas berkat dan penyertaan-Nya, penulis dapat menyelesaikan skripsi dengan judul “Uji Angka Lempeng Total dan Identifikasi Escherichia coli dalam Jamu Gendong Beras Kencur yang dijual di Pasar Sambilegi Wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta” sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Penyelesaian skripsi ini tentunya tidak lepas dari bantuan berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu penulis ingin mengucapkan terima kasih kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Ibu Dr. Erna Tri Wulandari, M.Si., Apt selaku Dosen Pembimbing skripsi atas segala kesabaran untuk selalu membimbing, memberi motivasi dan memberi masukan kepada penulis selama proses penyusunan skripsi ini. 3. Bapak Yohanes Dwiatmaka, M.Si. selaku dosen penguji atas pengarahan,
viii
4. Ibu Damiana Sapta Candrasari, S.Si., M.Sc. selaku dosen penguji atas pengarahan, kritik dan saran yang diberikan kepada penulis sehingga skripsi ini menjadi lebih baik.
5. Seluruh staf serta karyawan Balai Laboratorium Kesehatan Daerah Istimewa Yogyakarta atas bimbingan, dukungan, kesabaran serta kerjasamanya dalam proses penyelesaian skripsi ini.
6. Kedua orang tuaku Ir. I Ketut Suana dan Putu Marwati S.Pd yang selalu memberikan kasih sayang, dukungan dan semangat baik moral maupun materi selama menjalani perkuliahan hingga terselesainya skripsi ini.
7. Kakakku tersayang Ni Putu Yuni Prahida Sastra Y. dan Ni Kadek Ari Frida Paramitha yang selalu memberi semangat dan dukungan kepada penulis. 8. Seluruh keluarga, keponakanku Odit, Rara, Yuri, Nayla yang selalu
menghibur dan menjadi motivasi penulis.
9. I Putu Abhiseka Pranajaya S.Farm yang selalu mendampingi dengan sabar, memberikan dukungan, semangat dan keceriaan selama proses pembuatan skripsi ini.
ix
11.Rekan-rekan penelitian seperjuangan Angga Dewi, Graciano, Nataya Anita, Caritas Cindy, Bernadita, Meylisa Mutiara dan Maria Dora, untuk semangat kerjasama yang selalu diberikan selama proses penyusunan skripsi
12.Teman-teman Farmasi USD angkatan 2012, teman-teman FKK A 2012 dan FSM B 2012 atas kebersamaan, keceriaan selama proses perkuliahan.
13.Teman-teman Kos Difa No 7777 Paingan 3 lantai bawah, Kak Shinta, Kak Meland, Kak Defi, Cece Putri, Inge, Liana, Heidy, Vita, atas bantuan, perhatian, dan canda tawa yang diberikan.
14.Pihak-pihak lain yang turut membantu penulis namun tidak dapat disebutkan satu persatu.
Dengan segala kerendahan hati penulis menyadari bahwa skripsi ini jauh dari sempurna karena keterbatasan pikiran, waktu dan tenaga. Oleh karena itu, penulis sangat mengharapkan kritik dan saran yang membangun guna perbaikan dan penyempurnaan skripsi ini.
Penulis berharap bahwa skripsi ini dapat bermanfaat bagi semua pihak, baik mahasiswa, lingkungan akademisi, masyarakat, serta dapat memberikan sumbangan kecil bagi perkembangan ilmu pengetahuan khususnya di bidang kefarmasian.
Yogyakarta, Januari 2016
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
xi
A. Latar Belakang ... 1
B. Rumusan Masalah ... 8
C. Keaslian Penelitian ... 8
D. Manfaat Penelitian... 9
E. Tujuan Penelitian ... 10
BAB II PENELAAHAN PUSTAKA ... 11
A. Obat Tradisional, Jamu dan Cairan Obat Dalam ... 11
B. Jamu Gendong Beras Kencur... 13
C. Cara Pembuatan Obat Tradisional yang Baik (CPOTB) ... 15
D. Angka Lempeng Total (ALT) ... 18
E. Escherichia coli ... 20
F. Identifikasi Escherichia coli ... 23
G. Pengecatan Gram ... 27
H. Media ... 29
I. Sterilisasi... 32
J. Landasan Teori ... 34
K. Hipotesis ... 36
BAB III METODE PENELITIAN ... 37
A. Jenis dan Rancangan Penelitian ... 37
B. Variabel dan Definisi Operasional ... 37
xii
2. Variabel pengacau ... 37
3. Definisi operasional ... 38
C. Bahan Penelitian... 39
D. Alat Penelitian ... 40
E. Tata Cara Penelitian ... 40
1. Pemilihan dan Pengambilan Sampel ... 40
2. Penanganan Wadah dan Penyiapan Sampel... 40
3. Tahap Pra-Pengkayaan ... 40
4. Uji Angka Lempeng Total (ALT) ... 41
5. Uji Identifikasi Escherichia coli ... 42
F. Analisis Hasil ... 46
1. Uji ALT... 47
2. Identifikasi Escherichia coli ... 52
BAB IV HASIL DAN PEMBAHASAN ... 53
A. Pemilihan dan Pengumpulan Sampel Jamu Gendong Beras Kencur ... 54
B. Sterilisasi Media, Alat dan Ruangan ... 56
C. Homogenisasi dan Pengenceran Sampel ... 58
D. Uji Angka Lempeng Total (ALT) ... 59
E. Identifikasi Escherichia coli ... 65
1. Tahap Pengkayaan pada media Escherichia coli Broth ... 65
xiii
3. Tahap Identifikasi dan Konfirmasi keberadaan E.coli ... 72
a. Uji Fermentasi Karbohidrat ... 73
b. Uji Sulfur (H2O) ... 80
c. Uji Indol ... 82
d. Uji Motilitas ... 83
e. Uji Metil Merah ... 85
f. Uji Voges-Proskauer ... 86
g. Uji Sitrat ... 88
h. Pengecatan Gram ... 90
BAB V KESIMPULAN DAN SARAN... 96
A. Kesimpulan ... 96
B. Saran ... 96
DAFTAR PUSTAKA ... 98
LAMPIRAN ... 102
xiv
DAFTAR TABEL
Halaman
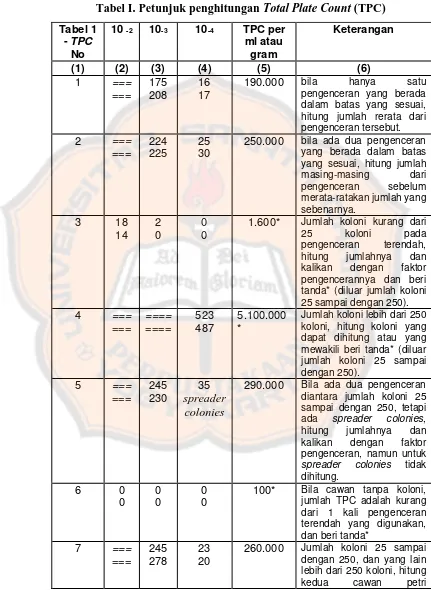
Tabel I. Petunjuk Penghitungan Total Plate Count (TPC)... 50
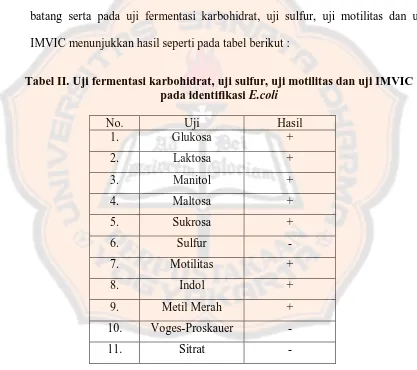
Tabel II. Uji fermentasi karbohidrat, uji sulfur, uji motilitas dan uji IMVIC pada identifikasi E.coli ... 52
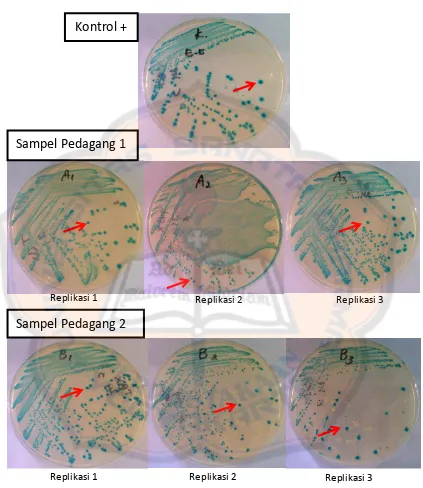
Tabel III. Angka Lempeng Total (ALT) dari ke-3 sampel Jamu Beras Kencur ... 63
Tabel IV. Hasil uji biokimia dan pengecatan Gram dalam sampel jamu beras kencur pedagang 1 ... 92
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Sampel jamu beras kencur dalam botol steril dan coolbox ... 55
Gambar 2. Kontrol media dan kontrol pelarut... 62
Gambar 3. Hasil Uji Pengkayaan E.coli pada media ECB ... 66
Gambar 4. Hasil isolasi E.coli pada sampel jamu beras kencur dalam media Tryptone Bile X-Glucuronide (TBX) ... 70
Gambar 5. Hasil isolasi E.coli pada sampel jamu beras kencur dalam Nutrient Agar Miring ... 72
Gambar 6. Hasil uji fermentasi glukosa pada sampel jamu beras kencur ... 75
Gambar 7. Hasil uji fermentasi laktosa pada sampel jamu beras kencur ... 76
Gambar 8. Hasil uji fermentasi manitol pada sampel jamu beras kencur ... 77
Gambar 9. Hasil uji fermentasi maltosa pada sampel jamu beras kencur ... 78
Gambar 10. Hasil uji fermentasi sukrosa pada sampel jamu beras kencur ... 80
Gambar 11. Hasil uji sulfur, Indol dan motilitas sampel jamu beras kencur pada media SIM ... 84
xvi
Gambar 13. Hasil uji Voges-Proskauer sampel jamu beras kencur... 87
Gambar 14. Hasil uji sitrat sampel jamu beras kencur ... 89
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat ijin penelitian di Balai Laboratorium Kesehatan Yogyakarta ... 103
Lampiran 2. Nilai ALT dan perhitungan ALT sampel jamu beras kencur
Pedagang 1 inkubasi 48 jam ... 104
Lampiran 3. Nilai ALT dan perhitungan ALT sampel jamu beras kencur
Pedagang 2 inkubasi 48 jam ... 105
Lampiran 4. Nilai ALT dan perhitungan ALT sampel jamu beras kencur Pedagang 3 inkubasi 48 jam ... 107
Lampiran 5. Foto ALT sampel jamu beras kencur pada inkubasi 48 jam
xviii INTISARI
Jamu beras kencur merupakan salah satu obat tradisional Indonesia yang biasa dikonsumsi oleh masyarakat dan dipercaya memiliki khasiat menghilangkan pegal-pegal serta dapat meningkatkan nafsu makan.
Tujuan penelitian ini adalah untuk mengetahui Angka Lempeng Total (ALT) dan mengidentifikasi keberadaan bakteri Escherichia coli dalam jamu beras kencur yang dijual di Pasar Tradisional Sambilegi di wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta. Persyaratan mutu obat tradisional telah diatur dalam Peraturan KBPOM RI No.12 Tahun 2012. Adanya E.coli dan ALT yang melebihi batas pada jamu beras kencur tentu dapat membahayakan kesehatan masyarakat.
Penelitian ini merupakan penelitian non eksperimental dengan rancangan deskriptif komparatif. Tahapan penelitian yang dilakukan meliputi penentuan tempat pengambilan sampel, pemilihan dan pengumpulan sampel, pengujian ALT dan analisis hasil berpedoman pada SNI 2897 tahun 2008, serta identifikasi E.coli dan analisis hasil uji berpedoman pada MA PPOMN tahun 2006.
Hasil pengujian menunjukkan ALT sampel jamu beras kencur yang melebihi persyaratan. Nilai ALT pada pedagang 1 sebesar 1,2 x 106 koloni/mL ; pedagang 2 sebesar 1,7 x 108 koloni/mL ; pedagang 3 sebesar 2,3 x 108 koloni/mL, serta terdapat cemaran bakteri E.coli pada pedagang 1 dan pedagang 2.
xix ABSTRACT
Jamu beras kencur was one of Indonesian traditional medicine were usually consumed by Indonesian public and believed to have efficacy eliminate aches and can increase appetite.
The aims of this research were to determine Total Plate Count (TPC) and identify the presence of E.coli in jamu beras kencur were sold at Sambilegi traditional market in the region Maguwoharjo Depok Sleman, Yogyakarta. The quality requirements of traditional medicine in Regulation KBPOM RI No.12 of 2012. ALT values in jamu beras kencur that exceed the limit and contained of E.coli can endanger public health.
This research is non-experimental research with comparative descriptive design. Stages of research was conducted on the determination location of the sampling, sampling and collection of jamu beras kencur, ALT testing referred to SNI 2897;2008 and identification of E.coli bacteria referred to MA PPOMN 2006.
The results of tests conducted on jamu beras kencur samples were not comply the requirements. ALT values of seller number 1 are 1,2 x 106 colonies/mL ; seller number 2 are 1,7 x 108 colonies/mL ; seller number 3 are 2,3 x 108 colonies/mL, and there are E.coli contamination on seller 1 and 2.
1 BAB I
PENGANTAR
A. Latar Belakang
Pada saat ini terdapat kecenderungan masyarakat untuk lebih memilih menggunakan pengobatan berdasarkan pada “back to nature” (kembali ke alam) dikarenakan asumsi masyarakat yang berpendapat bahwa pengobatan yang memanfaatkan bahan-bahan alam apabila digunakan secara tepat akan memberikan efek samping yang relatif lebih kecil dibandingkan pengobatan dengan obat modern/kimia, bahan baku yang mudah ditemukan serta harganya yang terjangkau. Hal inilah yang menyebabkan semakin meningkatnya perkembangan obat tradisional (Sholichah, 2012).
Salah satu obat tradisional yang terkenal di Indonesia adalah jamu. Khususnya di pulau Jawa, kebiasaan minum jamu sudah menjadi salah satu budaya. Jamu digunakan sebagai sarana perawatan kesehatan sehari-hari maupun sebagai sarana pemulihan kesehatan dengan memperhatikan aspek keamanan, mutu dan khasiatnya (Wasito, 2011). Jamu dapat dikategorikan dalam cairan obat dalam. Berdasarkan Keputusan Menteri Kesehatan RI No. 661/ Menkes/SK/VII/1994 cairan obat dalam merupakan sediaan obat tradisional berupa larutan emulsi atau suspensi dalam air, bahan bakunya berasal dari serbuk simplisia atau sediaan galenik dan digunakan sebagai obat dalam (DepKes RI, 1994). Pemanfaatan dan pemasaran cairan obat dalam seperti jamu di Indonesia sangat beragam, misalnya dalam bentuk cair yang biasa disebut jamu gendong.
Tahun 2012 tentang Registrasi Obat Tradisional. Dalam Pasal 2 ayat (1) disebutkan bahwa obat tradisional yang diedarkan di wilayah Indonesia wajib memiliki izin edar, namun pada Pasal 4 menyebutkan bahwa pengecualian dari ketentuan sebagaimana dimaksud dalam Pasal 2 ayat (1) terhadap obat tradisional yang dibuat oleh usaha jamu racikan dan usaha jamu gendong. Oleh karena itu perlu dilakukan uji untuk mengetahui kebersihan dalam proses pembuatan serta jaminan kualitas mutu dari jamu gendong agar tetap aman dikonsumsi (DepKes RI, 2012).
Salah satu jamu gendong yang sering dikonsumsi masyarakat adalah jamu beras kencur (Susan, 2001). Komposisi utama dari jamu beras kencur adalah beras (Oryza sativa L.) dan kencur (Kaempferia galangal L.). Bahan tambahan yang sering digunakan dalam pembuatan jamu beras kencur yaitu jahe, cengkeh, adas, asam jawa, gula merah maupun garam. Jamu beras kencur dipercaya memiliki khasiat menghilangkan kelelahan dan rasa pegal-pegal pada tubuh, meningkatkan nafsu makan serta menghindari terkena flu (Suharmiati, 2003).
memanfaatkan pelayanan kesehatan tradisional. Jenis pelayanan kesehatan tradisional yang dimanfaatkan oleh rumah tangga terbanyak adalah keterampilan tanpa alat dan 49 % diantaranya memilih penggunaan jamu (DepKes RI, 2013). Data Riskesdas tersebut menunjukkan bahwa jamu sebagai bagian obat tradisional telah digunakan secara luas dan diterima oleh masyarakat Indonesia untuk menjaga kesehatannya.
Jamu yang diproduksi harus memenuhi kriteria sesuai dengan PerMenKes RI No. 003/MENKES/PER/I/2010 pada pasal 4 yaitu : aman sesuai dengan persyaratan yang khusus untuk itu, klaim khasiat dibuktikan berdasarkan data empiris yang ada dan memenuhi persyaratan mutu (DepKes RI, 2010). Persyaratan jaminan keamanan, kemanfaatan dan mutu yang khusus itu telah diatur dalam Keputusan Menteri Kesehatan RI No. 661/ Menkes/SK/VII/1994 dan telah diperbaharui dalam Peraturan KBPOM Republik Indonesia Nomor 12 Tahun 2014 tentang Persyaratan Mutu Obat Tradisional yang mensyaratkan : (1) Keseragaman volume, (2) Angka Lempeng Total kurang dari atau sama dengan 104 koloni/mL, (3) Angka Kapang Khamir kurang dari atau sama dengan 103 koloni/mL, (4) Tidak mengandung mikroba patogen meliputi Eschericia coli, Salmonella spp, Shigella spp, Pseudomonas aeruginosa, Staphylococcus aureus, (5) Kadar aflatoksin total (aflatoksin B1, B2, G1 dan G2) ≤ 20 µg/kg dengan syarat aflatoksin B1 ≤ 5 µg/kg. (6) Tidak terdapat cemaran logam
berat (BPOM RI, 2014).
(ALT) dan identifikasi adanya cemaran bakteri patogen Eschericia coli dalam jamu gendong beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta. Peneliti memilih Pasar Tradisional Sambilegi sebagai lokasi sampling karena letaknya yang strategis dan ukuran pasarnya yang cukup luas menyebabkan Pasar Sambilegi menjadi salah satu pasar yang ramai dikunjungi oleh masyarakat dibandingkan dengan pasar tradisional lainnya yang berada di wilayah Maguwoharjo. Selain itu, berdasarkan observasi yang dilakukan peneliti pada bulan Februari, di Pasar Sambilegi terdapat cukup banyak pedagang jamu tradisional sehingga masyarakat di sekitar wilayah tersebut apabila ingin mengkonsumsi jamu akan membeli jamu di Pasar Sambilegi. Minat masyarakat dalam mengkonsumsi jamu masih cukup tinggi. Hal tersebut diketahui dari hasil observasi dan wawancara yang dilakukan peneliti pada saat mengunjungi pasar, yaitu jamu yang dijual oleh tiga pedagang terjual habis setiap harinya. Jamu beras kencur menjadi jamu yang paling banyak peminatnya diantara berbagai jenis jamu yang dijual di Pasar Sambilegi. Jamu beras kencur diminati karena rasanya yang enak dibandingkan dengan jamu lainnya serta manfaat menghangatkan tubuh yang dirasakan oleh para konsumen.
diperhatikan hal-hal seperti air yang digunakan, kondisi pembuat jamu, bahan baku, peralatan, serta wadah yang digunakan. Higienitas saat pengolahan jamu beras kencur oleh pedagang kurang mendapat perhatian dari konsumen. Saat melakukan observasi di lapangan, peneliti melihat penjual jamu tidak menggunakan sabun dan air mengalir pada saat mencuci tangan sebelum membuat jamu. Botol dan gelas yang akan digunakan sebagai wadah jamu yang siap diminum juga kurang diperhatikan kebersihannya, hanya dicuci dengan cara mencelupkan botol kedalam ember yang berisi air. Ketidakhigienisan dalam proses pengolahan jamu dan kurangnya kebersihan pada peralatan yang digunakan saat mengolah jamu memungkinkan adanya kontaminasi bakteri.
Uji Angka Lempeng Total digunakan untuk menghitung banyaknya bakteri yang tumbuh dan berkembang dalam sampel serta merupakan salah satu acuan untuk dapat menentukan keamanan dan kualitas secara mikrobiologis dari sediaan obat tradisional. Apabila nilai ALT melebihi batas yang telah ditentukan, maka dikhawatirkan terdapat bakteri dengan jumlah yang sangat banyak dan bersifat patogen yang dapat menyebabkan berbagai macam penyakit infeksi akibat mengkonsumsi jamu yang telah terkontaminasi bakteri (Radji, 2010).
sebagai bahan pembuatan jamu, dalam air sebagai bahan pelarut jamu, alat pembuatan jamu, bahan pengemas maupun bagian tubuh dari pembuat jamu (Radji, 2010). Selain itu, menurut Zulaikhah (2005) bakteri patogen yang paling banyak ditemukan sebagai kontaminan adalah kelompok coliform. E. coli merupakan salah satu jenis bakteri coliform dalam saluran pencernaan manusia dan hewan yang dapat hidup lebih lama di dalam tanah maupun air dibandingkan dengan bakteri patogen lainnya yang terdapat dalam saluran pencernaan. Masuknya E. coli kedalam tubuh manusia dengan jumlah yang berlebih melalui jamu yang telah terkontaminasi dapat menyebabkan masalah kesehatan seperti infeksi saluran kemih, infeksi meningitis pada neonatus dan infeksi intestinal seperti diare dan komplikasi masalah pencernaan lainnya (BPOM RI, 2008).
B. Rumusan Masalah
1. Apakah ALT dalam jamu beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta memenuhi persyaratan keamanan berdasarkan Peraturan KBPOM RI No.12 Tahun 2014 tentang Persyaratan Mutu Obat Tradisional ?
2. Adakah cemaran bakteri E. coli dalam jamu beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta?
C. Keaslian Penelitian
Penelitian terkait jamu gendong beras kencur pernah dilakukan oleh Jinarwanto (2008) dengan judul “Uji Escherichia coli pada Jamu Beras Kencur yang beredar di 3 Pasar Di Kotamadya Yogyakarta”. Hasil penelitian tersebut menunjukan bahwa dari 15 sampel yang diambil, 6 sampel positif mengandung Escherichia coli. Penelitian lain dilakukan oleh Pramudya (2008) dengan judul “Uji Kapang/Khamir pada Jamu Gendong Beras Kencur yang beredar di Tiga Pasar Di Kotamadya Yogyakarta”. Nurrahman, Mifbakhuddin dan Dewi Purnamasari pernah melakukan
Sedangkan publikasi penelitian mengenai Uji Angka Lempeng Total dan identifikasi Escherichia coli dalam jamu gendong beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta belum pernah dilakukan. Hal yang membedakan penelitian ini dengan penelitian yang pernah dilakukan sebelumnya adalah periode dan tempat pengambilan sampel beras kencur yang diteliti.
D. Manfaat Penelitian 1. Manfaat Teoritis
Penelitian ini diharapkan dapat memberikan data dan pengetahuan mengenai Angka Lempeng Total dan ada tidaknya cemaran bakteri Escherichia coli dalam jamu beras kencur yang dijual di Pasar Sambilegi wilayah Kecamatan Depok Kabupaten Sleman Yogyakarta.
2. Manfaat Praktis
E. Tujuan Penelitian 1. Tujuan Umum
Penelitian ini bertujuan untuk mengetahui kualitas mikrobiologis jamu beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta dalam parameter Angka Lempeng Total dan keberadaan E. coli.
2. Tujuan Khusus
a. Untuk mengetahui apakah Angka Lempeng Total jamu beras kencur yang dijual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta memenuhi persyaratan keamanan berdasarkan Peraturan KBPOM RI No. 12 Tahun 2014 tentang Persyaratan Mutu Obat Tradisional.
11 BAB II
PENELAAHAN PUSTAKA
A. Obat Tradisional, Jamu dan Cairan Obat Dalam
Peraturan Kepala Badan Pengawas Obat dan Makanan RI Nomor 12 Tahun 2014 tentang Persyaratan Mutu Obat Tradisional pada Bab I Ketentuan Umum dalam pasal 1 menyebutkan bahwa yang dimaksud dengan obat tradisional adalah bahan atau ramuan bahan yang berupa bahan tumbuhan, bahan hewan, bahan mineral, sediaan sarian (galenik) atau campuran dari bahan tersebut yang secara turun temurun telah digunakan untuk pengobatan, dan dapat diterapkan sesuai dengan norma yang berlaku di masyarakat (BPOM RI, 2014).
Pemanfaatan obat tradisional lebih sering digunakan untuk tujuan pencegahan (preventif) dalam upaya meningkatkan kesehatan. Obat tradisional juga digunakan dalam usaha perawatan kecantikan maupun kosmetik (Soegihardjo, 2002). Dengan semakin berkembangnya obat tradisional dan minat masyarakat untuk kembali ke alam (back to nature) menyebabkan popularitas obat tradisional semakin meningkat (Santoso, 2000).
menjadi tiga yaitu Jamu, Obat Herbal Terstandar (OHT) dan Fitofarmaka (BPOM RI, 2004). Ketiga produk obat tradisional tersebut harus memenuhi kriteria keamanan sesuai dengan persyaratan yang ditetapkan serta memenuhi persyaratan mutu yang berlaku. Jamu, OHT dan Fitofarmaka memiliki perbedaan dalam tingkat pembuktian keamanan, khasiat serta standarisasi bahan baku dan produk. Jamu merupakan ramuan yang terbuat dari bahan tumbuhan, bahan hewan, bahan mineral, sediaan galenik atau campuran bahan tersebut yang telah digunakan untuk pengobatan berdasarkan pengalaman dan klaim khasiat dibuktikan berdasarkan data empiris yang ada. OHT adalah sediaan obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik dan telah dilakukan standarisasi terhadap bahan baku yang digunakan dalam produk jadi. Fitofarmaka adalah sediaan obat bahan alam yang telah dibuktikan keamanan dan khasiatnya secara ilmiah dengan uji praklinik pada hewan percobaan dan uji klinik pada manusia serta bahan baku dan produk jadinya telah distandarisasi (BPOM RI, 2005). Obat tradisional tidak boleh mengandung :
1. Bahan kimia obat yang merupakan hasil isolasi atau sintetik berkhasiat obat. 2. Narkotika maupun psikotropika, atau bahan lain yang berdasarkan pertimbangan kesehatan dan berdasarkan penelitian dapat membahayakan kesehatan.
Cairan obat dalam adalah sediaan obat tradisional berupa minyak, larutan, suspensi atau emulsi, terbuat dari serbuk simplisia atau ekstrak dan digunakan sebagai obat dalam. Jamu termasuk dalam cairan obat dalam, sebagaimana diatur dalam Peraturan Menteri Kesehatan RI No.007 Tahun 2012 menyebutkan usaha jamu seperti jamu racikan dan jamu gendong tidak wajib memiliki izin edar, namun harus memenuhi persyaratan mutu yang ditentukan yang telah diatur dalam Peraturan Kepala BPOM RI Nomor 12 Tahun 2014 terkait persyaratan obat tradisional meliputi keseragaman volume, cemaran mikroba patogen, Angka Kapang Khamir, Angka Lempeng Total, aflatoksin total, cemaran logam berat, bahan tambahan seperti penggunaan pengawet, pemanis dan pewarna. Persyaratan obat tradisional yang baik bertujuan untuk melindungi konsumen dan menjaga mutu dari obat tradisional itu sendiri (BPOM RI, 2014).
B. Jamu Gendong Beras Kencur
Jamu beras kencur dipercaya oleh sebagian besar masyarakat memberikan manfaat yang dapat menghilangkan pegal-pegal pada tubuh, menghangatkan tubuh, serta banyak pula yang berpendapat bahwa jamu beras kencur dapat menambah daya tahan tubuh dan meningkatkan nafsu makan. Terdapat beberapa variasi bahan yang digunakan dalam pembuatan jamu beras kencur, namun terdapat dua bahan pokok yang selalu dipakai yaitu beras dan kencur. Kencur (Kaempferia galanga L.) adalah salah satu jenis empon-empon/tanaman obat yang tergolong dalam suku temu-temuan (Zingiberaceae). Senyawa yang terkandung dalam rimpang kencur adalah pati (4,14%), mineral (13,73%) dan minyak atsiri (0,02%) berupa sineol, asam metil kanil, penta dekaan, etil aster, asam sinamik, borneol, kamfena, paraeumarin, asam anisik, alkaloid dan gom (Agoes, 2010). Kencur biasa digunakan sebagai campuran tanaman obat untuk penyakit-penyakit seperti radang lambung, masuk angin, sakit kepala, keseleo, kelelahan dan lain-lain (Arisandi, 2009).
Bahan-bahan lain yang biasa ditambahkan ke dalam racikan jamu beras kencur adalah biji kedawung, rimpang jahe, biji kapulaga, buah asam, buah pala, garam dan jeruk nipis. Gula merah maupun gula putih digunakan sebagai bahan pemanis dalam racikan jamu beras kencur. Antara penjual jamu satu dengan yang lainnya mempunyai ramuan yang relatif berbeda tergantung dari bahan tambahan yang digunakan (Suharmiati, 2003).
membiarkan sampai dingin. Mula-mula beras disangan selanjutnya ditumbuk sampai halus. Bahan-bahan lain sesuai dengan komposisi racikan kemudian ditumbuk. Kedua bahan ini kemudian dicampur, diperas melalui kain pembungkus bahan atau disaring dengan saringan. Sari perasan bahan dicampurkan ke dalam air matang yang telah disiapkan lalu diaduk rata. Selanjutnya dimasukkan ke dalam botol-botol dan jamu siap dijual kepada konsumen (Suharmiati, 2003).
C. Cara Pembuatan Obat Tradisional yang Baik (CPOTB)
Cara Pembuatan Obat Tradisional yang Baik yang selanjutnya disingkat CPOTB adalah seluruh aspek kegiatan pembuatan obat tradisional yang bertujuan untuk menjamin agar produk yang dihasilkan senantiasa memenuhi persyaratan mutu yang ditetapkan sesuai dengan tujuan penggunaannya. Mutu produk tergantung dari bahan awal, proses produksi dan pengawasan mutu, bangunan, peralatan dan personalia yang menangani (DepKes RI, 2010).
memerlukan ijin edar karena lingkup distribusinya yang kecil sehingga pengawasannya dianggap mudah (DepKes RI, 2012).
Menurut Sembiring (2007), pembuatan ramuan obat tradisional dapat dilakukan dengan tahapan-tahapan meliputi :
1. Pemilihan bahan baku
Bahan baku yang digunakan adalah bagian tanaman yaitu biji, buah, daun, rimpang, bunga, kayu dan herba. Pada waktu panen/pengambilan bahan, peralatan dan tempat yang digunakan harus bersih dan bebas dari cemaran serta dalam keadaan kering.
2. Penyortiran
Penyortiran dilakukan setelah selesai panen, dimaksudkan untuk memisahkan kotoran-kotoran atau bahan-bahan asing.
3. Pencucian
Pencucian dilakukan untuk menghilangkan kotoran-kotoran yang melekat pada bahan. Air yang digunakan untuk mencuci bahan dan peralatan yang digunakan adalah air bersih.
4. Pengeringan
5. Peralatan
Semua peralatan yang digunakan untuk pembuatan ramuan obat tradisional harus dicuci bersih sebelum dan sesudah digunakan. Peralatan yang terbuat dari kuningan atau besi harus dihindari untuk mencegah timbulnya endapan atau racun akibat terjadinya reaksi kimia.
6. Meramu
Sebelum meramu, tangan dicuci sampai bersih, bahan disiapkan dan diletakkan pada wadah yang bersih.
7. Penggunaan
Cara penggunaan ramuan obat tradisional harus diketahui sebelum digunakan baik dengan cara diminum atau digunakan sebagai obat luar. 8. Aturan minum dan jangka waktu pemakaian
D. Angka Lempeng Total (ALT)
Salah satu parameter yang disyaratkan dalam Peraturan Kepala BPOM RI Nomor 12 Tahun 2014 adalah Angka Lempeng Total (ALT). Pengujian ALT merupakan metode kuantitatif yang digunakan untuk mengetahui jumlah mikroba yang ada pada suatu sampel. Uji ALT lebih tepatnya ALT bakteri aerob mesofil menggunakan media padat dengan hasil akhir berupa koloni bakteri yang dapat diamati secara visual dan dihitung dalam satuan koloni (CFU) per mL/g. Prinsip pengujian ALT menurut Metode Analisis Mikrobiologi (MA PPOMN nomor 95/mik/00) yaitu pertumbuhan koloni bakteri aerob mesofil setelah cuplikan diinokulasikan pada media lempeng agar dengan metode pour plate dan diinkubasi pada suhu yang sesuai. Selain itu, menurut SNI 01-2897 tahun 1992 terkait Cara Uji Cemaran Mikroba, prinsip pengujian ALT yaitu pertumbuhan bakteri mesofil aerob setelah sampel diinkubasikan dalam perbenihan atau media yang cocok selama 24-48 jam pada suhu 35±1oC.
atas permukaan cawan-agar (agar plate) dengan menggunakan alat steril yang terbuat dari kaca. Cawan agar kemudian diinkubasikan sampai koloni-koloni bakteri muncul sehingga jumlahnya dapat dihitung. Pada metode taburan, suatu volume dari kultur sebanyak 0,1-1,0 mL, diteteskan dengan pipet ke sebuah cawan petri kemudian dibubuhi dengan media-agar yang telah dicairkan yang bersuhu 45±1oC. Oleh karena itu, organisme yang akan dihitung harus tahan terhadap suhu media-agar tersebut sebelum diinkubasikan (Tarigan, 1988). Pada pengujian ALT dengan pour plate method menggunakan media Plate Count Agar (PCA) sebagai media padatnya dan Buffered Peptone Water (BPW) sebagai larutan pengencer (BSN, 2008).
E. Escherichia coli
Klasifikasi Escherichia coli yaitu :
Divisi : Protophyta Kelas : Schizomycetes Ordo : Eubacteriales Suku : Enterobacteriaceae Marga : Escherichia
Jenis : Escherichia coli (Holt et al., 2000)
E. coli merupakan bakteri Gram-negatif, berbentuk kokobasil (berbatang pendek), bersifat fakultatif anaerob, mempunyai flagel, berukuran 0,4-0,7 µ m x 1,4 µ m dan mempunyai simpai. E. coli tumbuh dengan baik hampir pada semua media perbenihan, dapat meragi laktosa dan bersifat mikroaerofilik. E. coli adalah golongan Enterobacteriaceae. Bakteri-bakteri Enterobacteriaceae merupakan jenis bakteri yang paling sering menyebabkan penyakit infeksi pada saluran cerna. Bakteri ini dapat hidup dalam usus besar manusia dan hewan, dalam tanah dan dalam air. Karena hidup dalam usus besar manusia, bakteri-bakteri ini sering disebut dengan bakteri enterik (Radji, 2010).
menimbulkan komplikasi yang disebut dengan sindrom uremik hemolitik. Sekitar 2-7% infeksi E. coli menimbulkan komplikasi. Sebagian besar penyakit yang disebabkan oleh infeksi E. coli ditularkan melalui makanan yang tidak dimasak dan daging yang terkontaminasi. Penularan penyakit dapat terjadi melalui kontak langsung dan biasanya terjadi di tempat yang memiliki sanitasi dan lingkungan yang kurang bersih (Radji, 2010).
Berdasarkan sifat virulensinya, E. coli dikelompokkan menjadi E. coli yang menyebabkan infeksi intestin dan E. coli yang menyebabkan infeksi ekstraintestin.
E. coli yang menyebabkan infeksi intestin antara lain :
1. Escherichia coli enteropatogenik (EPEC)
Jenis ini merupakan penyebab utama diare pada bayi. EPEC memiliki fimbria, toksin yang tahan terhadap panas (ST), dan toksin yang tidak tahan panas (LT). Infeksi EPEC mengakibatkan diare berair yang biasanya dapat sembuh sendiri, tetapi ada juga yang menjadi kronis.
2. Escherichia coli enterotoksigenik (ETEC)
3. Escherichia coli enteroinvasif (EIEC)
Mekanisme patogenik EIEC mirip dengan patogenesis infeksi yang disebabkan oleh Shigella. EIEC masuk dan berkembang dalam epitel sel-sel kolon sehingga menyebabkan kerusakan pada sel kolon. Gejala diare biasanya disertai dengan demam.
4. Escherichia coli enterohemoragik (EHEC)
Jenis bakteri ini menghasilkan suatu toksin yang dikenal dengan verotoksin. EHEC dapat menyebabkan kolitis berdarah (diare berat yang disertai pendarahan) dan sindrom uremik hemolitik.
5. Escherichia coli enteroagregatif (EAEC)
Bakteri ini menimbulkan diare akut dan kronis yang merupakan penyebab utama diare pada masyarakat berkembang. EAEC diperkirakan memproduksi entero aggregative ST toxin (EAST) yaitu suatu enterotoksin yang tidak tahan panas.
Sedangkan E. coli yang menyebabkan infeksi ekstra intestin antara lain :
1. Escherichia coli uropatogenik (UPEC)
ini juga menghasilkan hemolisin yang bersifat sitotoksik terhadap membran sel hospes.
2. Escherichia coli meningitis neonates (NMEC)
NMEC dapat menyebabkan meningitis pada bayi baru lahir. Galur bakteri ini dapat menginfeksi 1 dalam 2000-4000 bayi. Perjalanan infeksi biasanya terjadi setelah E. coli masuk ke dalam pembuluh darah melalui nasofaring atau saluran gastrointestinal dan kemudian masuk ke dalam sel-sel otak (Radji, 2010).
F. Identifikasi Escherichia coli
Menurut MA PPOMN No. 97/MIK/00 Tahun 2006 terkait cara uji Echerichia coli dalam obat tradisional, prinsip identifikasi E. coli yaitu pengujian yang dilakukan dengan uji pendugaan ditandai dengan terbentuknya gas di dalam tabung Durham setelah diinkubasikan dalam media yang cocok pada suhu 44oC selama 24-48 jam, dilanjutkan dengan uji konfirmasi melalui uji biokimia Indole, Methyl red, Voges-Proskauer dan Citrate (IMViC).
keberadaan bakteri (Soemarno, 2000). Uji tambahan yang dapat dilakukan untuk menegaskan keberadaan E. coli yaitu dengan mengamati pertumbuhan bakteri pada media SIM. Komposisi media SIM memungkinkan untuk melakukan tiga pengujian sekaligus dalam satu media, diantaranya uji Sulfur (H2S), uji Indol dan uji Motilitas.
Kandungan Ferrous Ammonium Sulfate dan Sodium Thiosulfate dalam media SIM dapat digunakan untuk uji H2S, kandungan Nutrien Agar (NA) dapat digunakan untuk
uji Motilitas sedangkan uji Indol perlu penambahan reagen Kovacs (Nugraheni, 2010). Berikut uji identifikasi E. coli yang dilakukan antara lain :
2. Uji Sulfur Indol Motility (SIM)
Uji ini terdiri dari tiga parameter pengamatan yaitu uji pembentukan sulfur (H2S), uji pembentukan Indol dari hasil peruraian asam amino dan
pengamatan pergerakan pertumbuhan bakteri dalam media tabung. Uji sulfur bertujuan untuk mengetahui kemampuan bakteri dalam menguraikan asam amino menjadi sulfur. Hasil peruraian sulfur dapat diamati dengan penambahan garam-garam logam berat kedalam medium. Hasil positif apabila H2S bereaksi dengan senyawa-senyawa ini yang ditandai dengan
terbentuknya logam sulfit yang berwarna hitam. Hasil negatif yaitu tidak terbentuk logam sulfit yang berwarna hitam karena bakteri yang berada dalam medium tidak mampu menghidrolisis logam-logam berat yang terkandung dalam medium (Nugraheni, 2010).
Uji motilitas merupakan metode yang digunakan untuk mengidentifikasi E. coli terhadap bakteri lainnya berdasarkan penyebaran koloni karena E. coli memiliki kemampuan bergerak atau motil dalam media SIM. Apabila dalam media terdapat pertumbuhan bakteri yang menyebar, maka dinyatakan bakteri yang diidentifikasi tersebut adalah golongan Enterobacter termasuk E. coli (Holt et.al., 2000).
3. Uji IMViC a. Uji Indol
triptofanase. Adanya indol dapat diketahui dengan menambahkan reagen Kovacs. Hasil positif ditunjukkan oleh terbentuknya lapisan berwarna merah diatas biakan (Soemarno, 2000).
b. Uji Metil Merah
Pada umumnya glukosa merupakan sumber energi bagi mikroorganisme. Sebagian besar mikrooranisme enterik seperti E. coli memfermentasikan glukosa dengan memproduksi asam organik. Adanya penambahan indikator pH metil merah dapat mendeteksi adanya asam yang dihasilkan oleh mikroorganisme ditandai dengan penurunan pH dari 6 menjadi 4 serta terjadinya perubahan warna media dari kuning menjadi merah (Cappuccino, 2008).
c. Uji Voges Proskauer
d. Uji Sitrat
Uji sitrat bertujuan untuk mengetahui kemampuan suatu mikroorganisme dalam menggunaan sitrat sebagai satu-satunya sumber karbon dan energi. Simmon’s Citrate Agar (SCA) adalah salah satu medium yang umum digunakan untuk menguji kemampuan semacam itu diantara bakteri. Medium ini juga mengandung indikator bromtimol biru yang dapat berubah warna dari hijau menjadi biru bila keadaan menjadi basa. Apabila bakteri yang diuji mampu menggunakan sitrat sebagai sumber karbon satu-satunya, maka akan terjadi peningkatan pH, terdapat pertumbuhan pada permukaan agar miring serta berubahnya warna media dari hijau menjadi biru (Hadioetomo, 1985).
G. Pengecatan Gram
spesies bakteri. Jenis pengecatan diferensial yang banyak digunakan adalah pengecatan Gram (Radji, 2010).
Pengecatan Gram merupakan salah satu teknik pengecatan yang sangat penting yang banyak digunakan dalam bidang bakteriologi. Cara pengecatan ini dikembangkan oleh seorang ahli bakteriologi bernama Hans Christian Gram pada tahun 1884 (Tarigan, 1988). Prosedur pengecatan Gram terdiri atas beberapa langkah yaitu :
1. Sediaan bakteri difiksasi/direkatkan di atas gelas preparat dan diwarnai dengan karbol kristal ungu selama 5 menit.
2. Zat warna kristal ungu tersebut kemudian dicuci dan dibilas.
3. Sediaan diwarnai dengan larutan lugol (larutan I2 + KI) dan didiamkan
selama 45-60 detik.
4. Larutan lugol ditiriskan dan sediaan dicuci dengan alkohol 95% selama 15-30 detik atau digoyang-goyangkan sampai tidak ada zat warna yang mengalir lagi.
5. Sediaan dicuci dengan air dan diwarnai dengan air fuksin selama 1-2 menit. 6. Sediaan dicuci, dikeringkan dan diperiksa dibawah mikroskop.
kelompok yang lain dapat mempertahankan zat warna ungu tersebut. Bakteri yang tidak mempertahankan zat warna ungu pada pencucian dengan alkohol 96% merupakan bakteri Gram-negatif, sedangkan kelompok bakteri yang mempertahankan zat warna ungu tersebut merupakan bakteri Gram-positif (Radji, 2010). Bakteri golongan Gram-positif tetap berwarna ungu dan tidak dipengaruhi oleh safranin karena Bakteri Gram-positif mempunyai struktur dan komposisi dinding sel yang lebih tebal dibandingkan bakteri negatif. Susunan dinding sel bakteri Gram-positif terdiri atas lapisan peptidoglikan yang sangat tebal sehingga permeabilitas dinding sel bakteri Gram-positif kurang dan kompleks ungu kristal iodium tidak dapat keluar dari dinding sel. Lapisan peptidoglikan bakteri Gram-negatif sangat tipis yaitu hanya 1-2 lapisan sehingga permeabilitas dinding sel bakteri Gram-negatif lebih besar dan memungkinkan keluarnya kompleks ungu kristal iodium dari dinding sel (Suriawiria, 1986).
H. Media
Media perbenihan harus memenuhi persyaratan sebagai berikut :
1. Mengandung nutrisi yang tepat untuk bakteri spesifik yang akan dibiakkan seperti sumber karbon, nitrogen, sulfur, fosfor dan faktor pertumbuhan organik lainnya.
2. Kelembapan harus cukup, pH sesuai dan kadar oksigen yang cukup baik. 3. Media perbenihan harus steril dan tidak mengandung mikroorganisme lain
serta diinkubasi pada suhu tertentu (Radji, 2010).
Penggunaan media bukan hanya untuk pertumbuhan dan perkembang biakan mikroba, tetapi juga untuk tujuan-tujuan lain misalnya untuk isolasi, seleksi, evaluasi dan diferensiasi biakan (Jutono, 1972). Penggunaan beberapa jenis zat tertentu yang mempunyai pengaruh terhadap pertumbuhan dan perkembang biakan mikroba banyak dilakukan dan dipergunakan, sehingga masing-masing media mempunyai sifat (spesifikasi) tersendiri sesuai dengan tujuannya. Berdasarkan sifat-sifatnya, media dibedakan menjadi :
a. Media umum : suatu media yang dapat digunakan untuk pertumbuhan dan perkembangan bermacam-macam mikroba.
b. Media pengkaya : suatu media yang dipergunakan dengan maksud “memberikan kesempatan” terhadap suatu jenis/kelompok mikroba untuk
c. Media selektif : media yang hanya dapat ditumbuhi oleh satu atau lebih jenis mikroba tertentu dan mungkin dapat menghambat pertumbuhan atau mematikan jenis-jenis mikroba lain yang tidak diharapkan.
d. Media diferensial : media yang digunakan untuk menumbuhkan mikroba tertentu serta dapat digunakan untuk membedakan/menentukan sifat-sifatnya. Contohnya yaitu Media agar-darah (blood agar) yang digunakan untuk membedakan bakteri hemolitik dengan bakteri nonhemolitik.
e. Media penguji : media yang digunakan untuk pengujian senyawa atau benda tertentu dengan bantuan mikroba. Misalnya media penguji vitamin, asam amino, antibiotika dan sebagainya.
f. Media perhitungan : media yang digunakan untuk menghitung jumlah mikroba pada suatu bahan. Media ini dapat berbentuk media umum, media selektif, media diferensial maupun media penguji (Suriawiria, 1986).
identifikasi bakteri E. coli digunakan media pengkaya Escherichia coli broth (ECB) dan media diferensial berbentuk padat yaitu Tryptone Bile X-Glucoronide (TBX). Media TBX dapat digunakan untuk mengadakan isolasi serta mendeteksi Enterobacteriaceae dan campuran spesies-spesies bakteri yang berbentuk batang coliform (Tarigan, 1988).
I. Sterilisasi
Sterilisasi dalam mikrobiologi merupakan suatu proses yang dilakukan dengan tujuan mematikan atau menghilangkan semua mikroorganisme dalam suatu bahan atau peralatan yang tidak diharapkan kehadirannya, baik yang akan menggangu/merusak media maupun mengganggu kehidupan dan proses yang sedang dikerjakan. Pemilihan metode didasarkan pada sifat bahan yang akan disterilkan. Ada tiga cara utama yang umum dipakai dalam sterilisasi yaitu penggunaan panas, penggunaan bahan kimia dan penyaringan (filtrasi) (Hadioetomo, 1985).
tidak begitu tinggi karena uap air berkondensasi pada bahan-bahan yang disterilkan, dilepaskan panas sebanyak 686 kalori per gram uap air pada suhu 121oC. Bahan-bahan yang biasa disterilkan dengan cara ini antara lain media biakan yang umum, air suling, peralatan laboratorium, biakan yang akan dibuang, media tercemar dan bahan-bahan dari karet. Apabila dibandingkan dengan panas lembab, panas kering kurang efisien dan membutuhkan suhu lebih tinggi serta waktu yang lebih lama untuk sterilisasi. Sterilisasi panas kering dapat diterapkan pada apa saja yang tidak menjadi rusak, menyala, hangus atau menguap pada suhu setinggi itu. Bahan-bahan yang biasa disterilkan dengan cara ini antara lain bahan pecah belah seperti pipet, tabung reaksi, cawan petri dari kaca, botol sampel, dan peralatan seperti jarum suntik serta bahan-bahan yang tidak tembus uap seperti gliserin, minyak, vaselin dan bahan-bahan berupa bubuk. Bahan-bahan yang disterilkan harus dilindungi dengan cara membungkus, menyumbat atau menaruhnya dalam suatu wadah tertutup untuk mencegah kontaminasi setelah dikeluarkan dari oven (Radji, 2010).
1. Lamanya waktu yang diperlukan sesudah perlakuan untuk menghilangkan semua sisa bahan kimia yang digunakan.
2. Daya bakar bahan kimia yang bersangkutan 3. Persyaratan peralatan dan biaya pelaksanaan
Sterilisasi dengan radiasi dapat dilakukan dengan sinar gama. Sinar ultraviolet juga dapat digunakan tetapi tidak begitu baik karena daya tembusnya lemah. Penggunaan sterilisasi dengan radiasi sangat terbatas karena menuntut persyaratan keamanan dan biaya yang tinggi (Hadioetomo, 1985).
Proses sterilisasi lain yang dilakukan pada suhu kamar adalah sterilisasi dengan penyaringan (filtrasi). Sterilisasi ini digunakan untuk mensterilkan medium laboratorium dan larutan-larutan yang sangat peka terhadap panas atau relatif tidak tahan terhadap pemanasan. Dengan cara ini larutan atau suspensi dibebaskan dari semua organisme hidup dengan cara melewatkan pada saringan dengan ukuran pori yang kecil sehingga bakteri dan sel-sel yang lebih besar tertahan diatasnya, sedangkan filtratnya ditampung di dalam wadah yang steril. Beberapa contoh bahan yang biasa disterilkan dengan cara ini yaitu serum, larutan bikarbonat, enzim, toksin bakteri, media sintetik tertentu dan antibiotika (Cappucino, 2008).
J. Landasan Teori
herbal terstandar dan fitofarmaka. Jamu merupakan obat tradisional yang termasuk dalam cairan obat dalam. Obat tradisional yang dibuat oleh usaha jamu racikan maupun jamu gendong, tidak wajib memiliki izin edar. Hal tersebut berdasarkan Peraturan Menteri Kesehatan RI No.007 Tahun 2012 tentang Registrasi Obat Tradisional.
Berdasarkan fakta tersebut, maka jamu yang diproduksi harus tetap dijamin keamanannya agar layak dikonsumsi dan memenuhi kriteria sesuai dengan PerMenKes RI No. 003/MENKES/PER/I/2010 yang menyebutkan bahwa jamu harus aman sesuai dengan persyaratan mutu kefarmasian. Persyaratan mutu obat tradisional telah diatur dalam Peraturan KBPOM Republik Indonesia Nomor 12 Tahun 2014. Beberapa persyaratannya yaitu Angka Lempeng Total harus kurang dari atau sama dengan 104 koloni/mL serta tidak mengandung mikroba patogen.
Faktor-faktor yang dapat menyebabkan tingginya jumlah ALT dan kemungkinan adanya cemaran bakteri E. coli adalah kurangnya higienitas para penjual jamu di Pasar Sambilegi. Saat melakukan observasi, peneliti melihat penjual jamu tidak menggunakan sabun dan air mengalir pada saat mencuci tangan sebelum membuat jamu. Botol dan gelas yang akan digunakan sebagai wadah jamu yang siap diminum juga kurang diperhatikan kebersihannya, yaitu hanya dicuci dengan mencelupkan ke dalam air pada ember. Bahan baku berupa rimpang yang berasal dari tanah yang digunakan oleh penjual jamu kemungkinan mengandung banyak mikroba patogen. Apabila air yang digunakan oleh penjual jamu beras kencur di Pasar Sambilegi tercemar E. coli, maka akan terjadi kontaminasi pada saat pembuatan maupun penyajian jamu beras kencur. Masuknya E. coli kedalam tubuh manusia tentu berbahaya, karena dapat menyebabkan masalah kesehatan seperti infeksi intestinal misalnya diare serta komplikasi masalah pencernaan lainnya.
K. Hipotesis
37 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian non eksperimental dengan rancangan penelitian deskriptif komparatif, yaitu mendeskripsikan Angka Lempeng Total dan mengidentifikasi keberadaan Escherichia coli dalam jamu gendong beras kencur yang diuji. Hasil pengujian ALT dan identifikasi E.coli kemudian dibandingkan dengan persyaratan keamanan yang telah ditetapkan dalam Peraturan KBPOM Republik Indonesia Nomor 12 Tahun 2014 tentang Persyaratan Mutu Obat Tradisional.
B. Variabel dan Definisi Operasional 1. Variabel utama
a. Variabel bebas : jamu beras kencur yang di jual di Pasar Sambilegi wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta
b. Variabel tergantung : Angka Lempeng Total (ALT) dan keberadaan cemaran Escherichia coli
2. Variabel pengacau
a. Variabel pengacau terkendali :
Tryptone Bile X-Glucuronide (TBX), media Simmon Citrate Agar, media SIM, media Methyl Red-Voges Proskauer, Kovacks, larutan metil merah, larutan alfa naftol, larutan kalium hidroksida, kristal violet, larutan iodium, safranin. Suhu inkubasi (35oC) dan waktu inkubasi (24-48 jam) untuk uji ALT, suhu inkubasi (37-44oC) dan waktu inkubasi (24-48 jam) untuk uji identifikasi E.coli.
b. Variabel pengacau tak terkendali : Kualitas bahan yang digunakan, cara pembuatan jamu beras kencur, cara penyimpanan jamu setelah pembuatan.
3. Definisi Operasional
a. Jamu gendong beras kencur yang digunakan adalah jamu cair dengan bahan utama beras dan kencur dalam botol plastik yang dijual di Pasar Sambilegi di wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta. b. Uji Angka Lempeng Total (ALT) adalah suatu uji cemaran mikroba yang dilakukan dengan menghitung jumlah bakteri aerob mesofil yang terdapat dalam jamu gendong beras kencur sesuai metode SNI 2897:2008 yang merupakan standar revisi dari SNI 01-2897-1992 terkait cara uji cemaran mikroba.
sehingga dapat diketahui ada atau tidaknya keberadaan E.coli dalam jamu beras kencur.
C. Bahan Penelitian
1. Bahan utama yang digunakan yaitu jamu beras kencur yang di jual di Pasar Sambilegi di wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta.
2. Media yang digunakan untuk pengujian ALT adalah Plate Count Agar (PCA). Media selektif E.coli yaitu media E.coli Broth (ECB) dan media isolasi yang digunakanyaitu media Tryptone Bile X-Glucuronide (TBX). Untuk uji konfirmasi E.coli menggunakan media Sulphur Indol Motility (SIM), Methyl-Red Voges Proskauer (MR-VP), Simon’s Citrate Agar (SCA). Media untuk uji fermentasi karbohidrat antara lain larutan gula-gula (glukosa, laktosa, manitol, maltosa dan sukrosa).
3. Bakteri baku sebagai standar pembanding atau kontrol positif adalah E.coli ATCC 25922.
D. Alat Penelitian
Autoklaf, inkubator, oven, mikroskop, mikropipet, pipet tetes, tabung reaksi dilengkapi tabung Durham, cawan petri, pipet volume, gelas beker, gelas ukur, neraca analitik, Colony Counter, Erlenmeyer, magnetic stirrer, vortex, jarum ose, Bunsen, plastik steril, botol steril.
E. Tata Cara Penelitian 1. Pemilihan dan Pengambilan Sampel
Sampel jamu yang dipilih adalah jamu beras kencur yang diperoleh dari penjual jamu di Pasar Sambilegi di wilayah Maguwoharjo Kecamatan Depok Kabupaten Sleman Yogyakarta. Metode sampling yang digunakan dalam penelitian ini adalah Convinience sampling (sampling pekoleh). Metode ini dipilih karena tidak semua populasi dapat diidentifikasi (Sedarmayanti, 2011). Sampel diambil dari 3 penjual jamu di pasar Sambilegi. Masing-masing penjual diambil 1 sampel dengan satu kali pengambilan kemudian diuji dengan melakukan replikasi sebanyak 3 kali pada masing-masing sampel yang diambil. 2. Penanganan Wadah dan Penyiapan Sampel
Sampel yang telah diambil dipindahkan ke dalam botol steril. Pengambilan sampel dari botol steril dilakukan dengan cara membersihkan tutup botol dengan kapas beralkohol 70% kemudian dibuka secara aseptis di dekat nyala api Bunsen. 3. Tahap Pra-Pengkayaan
Secara aseptis diambil sebanyak 25 mL sampel dan dimasukkan ke dalam labu ukur 250 mL kemudian ditambahkan 225 mL Buffered Peptone Water (BPW) hingga batas tanda sehingga diperoleh pengenceran 10-1.
b. Pengenceran sampel untuk uji ALT
Pengenceran 10-1 dari hasil homogenisasi pada penyiapan sampel dipipet sebanyak 1 mL dengan cara aseptis dan dimasukkan ke dalam tabung yang telah diisi 9 mL BPW hingga diperoleh pengenceran 10-2 kemudian dihomogenkan menggunakan vortex. Selanjutnya dibuat pengenceran 10-3, 10-4, 10-5 hingga 10-6 dengan cara yang sama (BSN, 2008).
4. Uji Angka Lempeng Total (ALT)
a. Pembuatan Media Plate Count Agar (PCA)
Sebanyak 29 g PCA ditimbang dan dilarutkan dengan 1650 mL aquadest steril, pH diatur 7,0 dan dipanaskan hingga larutan jernih. Selanjutnya disterilkan dengan autoklaf selama 15 menit pada suhu 121oC. b. Larutan Pengencer Buffered Pepton Water (BPW)
Sebanyak 20 g serbuk BPW dilarutkan dalam 1 L aquadest steril dan diukur pH 7,0 ± 1. Kemudian disterilkan dengan menggunakan autoklaf selama 15 menit pada suhu 121oC.
c. Uji Angka Lempeng Total (ALT)
dengan hati-hati agar sampel tersebar merata dengan media dan biarkan hingga memadat. Dilakukan uji kontrol untuk mengetahui sterilitas media dan pengencer. Uji sterilitas media dilakukan dengan cara menuangkan media PCA ke dalam suatu cawan petri dan dibiarkan memadat. Uji sterilitas pengencer dilakukan dengan cara menuangkan media PCA dan 1 mL pengencer BPW lalu dibiarkan memadat. Seluruh cawan petri diinkubasi terbalik pada suhu 35oC-37oC selama 24 jam hingga 48 jam. Jumlah koloni yang tumbuh diamati dan dihitung. Angka Lempeng Total dihitung dalam 1 mL contoh dengan mengkalikan jumlah rata-rata koloni pada cawan dengan faktor pengenceran yang digunakan (BSN, 2008).
5. Uji Identifikasi Escherichia coli
a. Uji Pengkayaan dalam media Escherichia coli Broth
Suspensi hasil homogenisasi sampel dipipet sebanyak 1 mL dan diinokulasikan pada 9 mL ECB. Kemudian diinkubasi pada suhu 44oC selama 24 jam. Timbulnya gas pada tabung Durham dan kekeruhan pada media menunjukkan karakteristik E.coli.
b. Isolasi dalam media Tryptone Bile X-Glucuronide (TBX)
c. Identifikasi E.coli dengan uji biokimia
Satu koloni spesifik dipilih dari media Tryptone Bile X-Glucuronide (TBX) diinokulasikan pada Nutrien Agar (NA) miring, kemudian diinkubasi pada suhu 35oC-37oC selama 24 jam. Koloni pada biakan NA miring akan dilanjutkan dengan uji biokimia melalui uji fermentasi karbohidrat, uji Sulfur, uji Motilitas, uji IMViC (Indol, Metil Merah, Voges Proskauker, Sitrat) sebagai berikut :
1. Uji fermentasi glukosa
Satu sengkelit biakan NA miring diinokulasikan pada media glukosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange kemerahan menjadi kuning (Soemarno, 2000).
2. Uji fermentasi laktosa
Satu sengkelit biakan NA miring diinokulasikan pada media laktosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange menjadi kuning .
3. Uji fermentasi manitol
4. Uji fermentasi maltosa
Satu sengkelit biakan NA miring diinokulasikan pada media maltosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange kemerahan menjadi kuning.
5. Uji fermentasi sukrosa
Satu sengkelit biakan NA miring diinokulasikan pada media sukrosa dan diinkubasi pada suhu 35-37oC selama 24 jam. Hasil positif ditandai dengan adanya perubahan warna media dari orange menjadi kuning 6. Uji sulfur
Satu sengkelit biakan NA miring diinokulasikan pada media SIM (Sulphur Indol Motility) selanjutnya diinkubasi selama 24 jam pada suhu 37oC. Hasil positif terbentuknya sulfur ditunjukkan dengan adanya warna hitam di sepanjang bekas inokulasi sedangkan hasil negatif ditunjukkan dengan tidak adanya endapan hitam atau tidak terdapat warna hitam disepanjang bekas inokulasi.
7. Uji motilitas
8. Uji Indol
Satu sengkelit biakan NA miring diinokulasikan pada media SIM dan diinkubasikan pada suhu 35-37oC selama 24 jam. Setelah diinkubasi, ditambahkan 1 mL pereaksi indol (Reagen Kovac’s) ke dalam masing-masing tabung dan dikocok beberapa menit. Warna merah muda yang membentuk cincin pada permukaan biakan menunjukkan reaksi indol positif.
9. Uji metil merah
Satu sengkelit biakan NA miring diinokulasikan pada media MR-VP dan diinkubasikan pada suhu 35-37oC selama 48 jam. Setelah diinkubasi tambahkan 2 tetes sampai dengan 5 tetes indikator metil merah dan dikocok homogen selama beberapa menit. Warna kuning menunjukkan hasil reaksi negatif dan warna merah menunjukkan hasil reaksi positif. 10.Uji Voges Proskauer
Satu sengkelit biakan NA miring diinokulasikan pada media MR-VP dan diinkubasi pada suhu 35-37oC selama 48 jam. Setelah diinkubasi tambahkan 3 tetes larutan alfa naftol dan 2 tetes larutan KOH 40%. Dikocok kemudian didiamkan selama beberapa menit. Jika warna biakan menjadi merah muda hingga merah menyala menunjukkan reaksi positif, jika warna tidak berubah maka menunjukkan reaksi negatif.
Satu sengkelit biakan NA miring diinokulasikan pada media Simmon’s Citrate Agar lalu diinkubasikan pada suhu 35-37oC selama 24-48 jam. Perubahan warna media dari hijau menjadi biru serta adanya kekeruhan pada perbenihan menunjukkan reaksi positif.
d. Uji konfirmasi keberadaan E.coli dengan pengecatan Gram
Sediaan dibuat di atas kaca alas, selanjutnya dikeringkan di udara dan difiksasikan dengan panas. Sedian diwarnai dengan larutan crystal violet-ammonium oxalate selama 1 menit. Kemudian sediaan dicuci dengan air dan ditiriskan. Larutan-larutan lugol (Gram iodine) dibubuhkan selama 1 menit. Selanjutnya sediaan dicuci dengan air dan ditiriskan. Warna dihilangkan dengan dicuci menggunakan alkohol 95% selama 30 detik. Sediaan dicuci dengan air dan ditiriskan kemudian dibubuhkan larutan safranin selama 10-30 detik. Sediaan dicuci kembali dengan air lalu ditiriskan. Sediaan kemudian diserap dengan kertas saring, dikeringkan dan dilakukan pengamatan dengan menggunakan mikroskop pada perbesaran 1000 kali (SNI, 2008).
F. Analisis Hasil
1. Uji ALT
1.1Penghitungan jumlah koloni
Perhitungan ALT sesuai dengan metode SNI 2897:2008. Jumlah koloni pada setiap seri pengenceran dihitung kecuali cawan petri yang terdapat koloni menyebar (spreader colonies). Pilih cawan petri (simplo dan duplo) dari satu pengenceran yang menunjukkan jumlah koloni 25 sampai dengan 250 setiap cawan. Semua koloni dalam cawan petri dihitung dengan menggunakan alat penghitung koloni (colony counter). Hitung rata-rata jumlah koloni dan kalikan dengan faktor pengenceran. Hasilnya dinyatakan sebagai jumlah bakteri per milliliter atau gram.
1.2Interpretasi hasil
1.2.1Cawan dengan jumlah koloni kurang dari 25
Bila cawan duplo dari pengenceran terendah menghasilkan koloni kurang dari 25, hitung jumlah yang ada pada cawan dari setiap pengenceran. Rerata jumlah koloni per cawan dan kalikan dengan faktor pengencerannya untuk menentukan nilai TPC (Total Plate Count). Tandai nilai TPC dengan tanda bintang (Tabel 1 nomor 3) untuk menandai bahwa penghitungannya diluar 25 koloni sampai dengan 250 koloni per cawan.
1.2.2Cawan dengan jumlah koloni lebih dari 250
Tandai penghitungan TPC dengan tanda bintang untuk menandai bahwa penghitungannya diluar 25 koloni sampai dengan 250 koloni per cawan (Tabel 1 nomor 4).
1.2.3 Spreaders
Koloni yang menyebar (spreaders) biasanya dibagi dalam 3 bentuk: a) Rantai koloni tidak terpisah secara jelas disebabkan oleh disintegrasi
rumpun bakteri.
b) Terbentuknya lapisan air antara agar dan dasar cawan. c) Terbentuknya lapisan air pada sisi atau permukaan agar.
Bila cawan yang disiapkan untuk sampel lebih banyak ditumbuhi oleh spreader seperti (a), dan total area yang melebihi 25% dan 50% pertumbuhannya dilaporkan sebagai cawan spreader. Rerata jumlah koloni dari setiap pengenceran, kemudian laporkan jumlahnya sebagai TPC (Tabel 1 nomor 5).
1.2.4Cawan tanpa koloni
Bila cawan petri dari semua pengenceran tidak menghasilkan koloni, laporkan TPC sebagai kurang dari 1 kali pengenceran terendah yang digunakan. Tandai TPC dengan tanda bintang bahwa penghitungannya diluar 25 koloni sampai dengan 250 koloni (Tabel 1 nomor 6).
1.2.5Cawan duplo, cawan yang satu dengan 25 koloni sampai dengan 250 koloni dan cawan yang lain lebih dari 250 koloni
Bila cawan yang satu menghasilkan koloni antara 25 sampai dengan 250 dan yang lain lebih dari 250 koloni, hitung kedua cawan dalam penghitungan TPC (Tabel 1 nomor 7).
1.2.6Cawan duplo, satu cawan dari setiap pengenceran dengan 25 koloni sampai dengan 250 koloni
1. 3 Pelaporan hasil
(i) Bulatkan angka menjadi 2 angka yang sesuai, bila angka ketiga 6 atau di atasnya, maka angka ketiga menjadi 0 (nol) dan angka kedua naik 1 angka, misalnya 456 menjadi 460 (4,6 x 102).
(ii) Bila angka ketiga 4 atau dibawahnya, maka angka ketiga menjadi 0 (nol) dan angka kedua tetap, misalnya 454 menjadi 450 (4,5 x 102).
2. Identifikasi Escherichia coli
Identifikasi bakteri dilakukan dengan uji sifat biokimia dan pengecatan gram. Sampel dikatakan positif mengandung E.coli apabila menunjukkan hasil positif pada pengecatan Gram yaitu berwarna merah muda (Gram negatif) dan berbentuk batang serta pada uji fermentasi karbohidrat, uji sulfur, uji motilitas dan uji IMVIC menunjukkan hasil seperti pada tabel berikut :
Tabel II. Uji fermentasi karbohidrat, uji sulfur, uji motilitas dan uji IMVIC pada identifikasi E.coli
No. Uji Hasil
1. Glukosa +
2. Laktosa +
3. Manitol +
4. Maltosa +
5. Sukrosa +
6. Sulfur -
7. Motilitas +
8. Indol +
9. Metil Merah +
10. Voges-Proskauer -
11. Sitrat -
53 BAB IV
HASIL DAN PEMBAHASAN