TEKNIK TRANSFORMASI GENETIK BEBERAPA TANAMAN
MENGGUNAKAN
Agrobacterium tumefaciens
ARIEF PAMBUDI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ARIEF PAMBUDI. Teknik Transformasi Genetik beberapa Tanaman Menggunakan Agrobacterium tumefaciens. Dibimbing oleh MIFTAHUDIN dan TETTY CHAIDAMSARI.
Transformasi genetik adalah proses introduksi gen dari satu organisme ke organisme lain yang memungkinkan untuk memunculkan sifat harapan tanpa mengubah sifat lain. Penggunaan Agrobacterium tumefaciens sebagai vektor transformasi memiliki keunggulan karena tidak membutuhkan peralatan khusus serta efisiensi transformasi dan salinan tunggal dari gen yang ditransformasi relatif tinggi. Penelitian ini merupakan penelitian transformasi komparatif pada beberapa tanaman yang memiliki karakter berbeda, yaitu manggis sebagai tanaman apomiksis, tembakau sebagai tanaman model, anggrek sebagai perwakilan dari kelas monokotil, dan kopi sebagai perwakilan dari kelas dikotil. Transformasi dilakukan dengan metode yang sama dan dilanjutkan dengan regenerasi pada media seleksi yang mengandung antibiotik. Konfirmasi sisipan gen hasil transformasi dilakukan dengan teknik Polimerase Chain Reaction (PCR). Hasil konfirmasi dari sampel tanaman yang mampu tumbuh pada media seleksi menunjukkan hanya tembakau yang positif tersisipi oleh gen yang ditransfomasi. Hal ini menunjukkan bahwa tanaman hasil transformasi yang mampu hidup di media seleksi belum merupakan jaminan tersisip oleh gen yang diintroduksi sebelum dilakukan pengujian molekuler. Beberapa optimasi dalam sterilisasi, teknik infeksi, peningkatan jumlah eksplan yang ditransformasi dan jumlah sampel yang diuji perlu dilakukan untuk peningkatan efisiensi transformasi.
Kata kunci : Transformasi genetik, Agrobacteriumtumefaciens, tanaman transgenik.
ABSTRACT
ARIEF PAMBUDI. Agrobacterium tumefaciens-mediated Transformation Techniques in Several Plants. Supervised by MIFTAHUDIN and TETTY CHAIDAMSARI.
Genetic transformation is a process to introduce foreign gene from one organism to other organisms. This process is a site directed mutagenesis that can improve a good character without changing the existing characters. The use of Agrobacterium tumefaciens as a vector in genetic transformation has several advantages compared to other transformation techniques. It is a simple method, does not need special equipment, and produces high transformation efficiency in transfering a single copy of insert gene. This research is a comparative genetic transformation among several plants that have different characters. They are mangosteen as an apomixis plant, tobacco as a model plant, orchid as a monocotyledon plant, and coffee as a dicotyledon plant. The transformation were conducted in a same method and continued with regeneration step in antibiotic selectable medium. Gene insert confirmation using Polimerase Chain Reaction (PCR) technique showed that only tobacco the expected gene insert. The result suggested that the plant ability to grow in selective medium was not guaranteed as a transgenic plant before being confirmed using molecular assay approach. Some optimation in explants sterilization, infection techniques, number of transformed explants and tested transformed samples are required to be increases to achieve high transformation efficiency.
3
TEKNIK TRANSFORMASI GENETIK BEBERAPA TANAMAN
MENGGUNAKAN
Agrobacterium tumefaciens
ARIEF PAMBUDI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Teknik Transformasi Genetik beberapa Tanaman Menggunakan
Agrobacterium tumefaciens
Nama : Arief Pambudi
NIM :
G34104067
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Miftahudin, M.Si)
(Dr. Tetty Chaidamsari, M.Si)
NIP. 131 851 281
NIK. 110 400 241
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP. 131 578 806
5
PRAKATA
Alhamdulillah, puji syukur atas limpahan rahmat, karunia, dan hidayah yang diberikan oleh Allah SWT kepada penulis sehingga karya ilmiah yang berjudul Teknik Transformasi Genetik beberapa Tanaman Menggunakan Agrobacterium tumefaciens dapat diselesaikan.
Penulis mengucapkan terima kasih kepada Dr. Ir. Miftahudin, M.Si dan Dr. Tetty Chaidamsari M.Si selaku pembimbing yang telah memberikan dukungan, bantuan, pengarahan, dan bimbingan kepada penulis selama pelaksanaan penelitian. Juga kepada Dr. Anja Meryandini M.Si selaku dosen penguji yang banyak memberikan masukan dalam penulisan dan perbaikan karya ilmiah ini.
Terima kasih juga kepada Mbak Herti, Mbak Nina, Mas Topan, Mbak Riana, Mbak Retno, dan Bu Dewi atas bantuan teknisnya, Winda, Kusnandar, Syamsul, Ruth, teman-teman di lab BMRG dan Fistum, David, Yanti, Amie, Icha, Resti, Arlyn, Andik, Puspita, Uci, keluarga besar Lab BMRG, Lab Fistum, kontrakan Delapan, teman-teman Biologi angkatan 41, para praktikan, dan semua pihak yang tidak dapat disebutkan satu-persatu. Tidak lupa ucapan terima kasih kepada Papa, Mama, Annis, Ipul, Han, dan seluruh keluarga yang selalu memberi dukungan, kasih sayang, doa, dan dorongan semangat yang tiada henti untuk menjadikan penulis lebih baik.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 14 April 1987 dari pasangan Bapak Sumarmadji dan Ibu Susiana. Penulis merupakan anak pertama dari empat bersaudara. Tahun 1998 penulis lulus dari SDN Malabar 1 Bogor, tahun 2001 lulus dari SMPN 2 Lubuk Pakam, kemudian melanjutkan ke SMAN 1 Medan. Tahun 2004 lulus dari SMAN 1 Medan dan di tahun yang sama penulis diterima sebagai mahasiswa Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama studi di IPB, penulis aktif di Himpunan Mahasiswa Biologi (Himabio) sebagai Staf Bioworld 2006/2007 dan ketua divisi Biosains tahun 2007/2008. Penulis pernah menjadi asisten praktikum Biologi Dasar, Fisiologi Tumbuhan Dasar, Sistematika Tumbuhan Berpembuluh, dan pengajar biologi bimbingan belajar dan tutorial mahasiswa Be Expert.
7
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN...1
Latar Belakang...1
Tujuan ...1
BAHAN DAN METODE ...1
Waktu dan Tempat ...1
Bahan dan Alat ...1
Metode ...2
Kultur bakteri A. tumefaciens...2
Transformasi genetik dan regenerasi...2
Isolasi DNA Total...2
Uji kuantitatif dan kualitatif DNA...2
Uji Insersi dengan PCR...2
HASIL ...3
Transformasi dan regenerasi ...3
Manggis...3
Tembakau...4
Anggrek...4
Kopi...4
Isolasi DNA dan uji insersi dengan PCR...4
PEMBAHASAN ...5
Transformasi dan regenerasi ...5
Manggis...5
Tembakau...6
Anggrek...6
Kopi...6
Isolasi DNA dan uji insersi dengan PCR...7
SIMPULAN...7
SARAN...8
DAFTAR PUSTAKA ...8
DAFTAR TABEL
Halaman
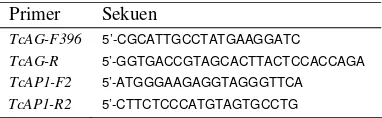
1. Primer spesifik yang digunakan dalam uji insersi...2
2. Hasil transformasi tembakau setelah 8 minggu...4
3. Hasil transformasi anggrek ...4
4. Absorbansi dan konsentrasi DNA total hasil isolasi ...4
DAFTAR GAMBAR
Halaman 1 Sumber eksplan daun tanaman manggis yang diambil dari rumah kaca yang masih berwarna merah (A), daun in-vitro (B), dan biji (C)...32 Pola pertunasan biji (A, B, C) dan pengkalusan daun manggis (D, E, F) yang bukan berasal dari luka. ...3
3 Eksplan transformasi daun rumah kaca (A), kontrol transformasi rumah kaca (B), kontrol negatif rumah kaca (C), transformasi daun in-vitro (D), kontrol transformasi in-vitro (E), kontrol negatif in-vitro (F) ...3
4 Persentase kalus manggis hasil transformasi daun asal rumah kaca...3
5 Persentase kalus manggis hasil transformasi daun in-vitro...3
6 Pola pertumbuhan tunas tembakau (tanda panah) berasal dari bekas luka...4
7 Planlet tembakau hasil transformasi dengan TcAG (A), kontrol (B), dan TcAP1 (C)...4
8 Planlet kultur in-vitro anggrek hasil transformasi
TcAG
(A), kontrol (B), dan TcAP1 (C) ...49 Planlet kopi hasil transformasi TcAG terlihat menguning (A), kontrol (B), kopi TcAP1 (C)...4
10 Elektroforesis 200 ng DNA hasil isolasi ...5
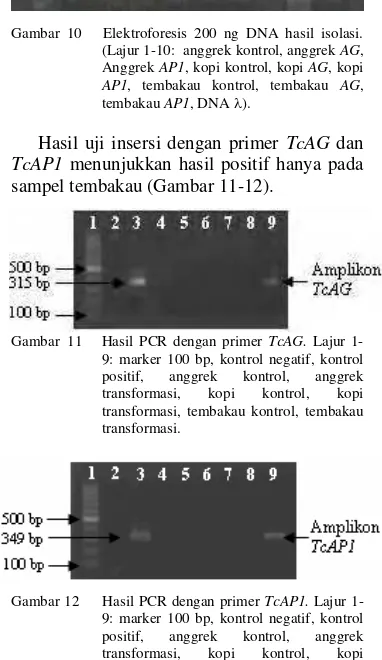
11 Hasil PCR dengan primer TcAG...5
12 Hasil PCR dengan primer TcAP1...5
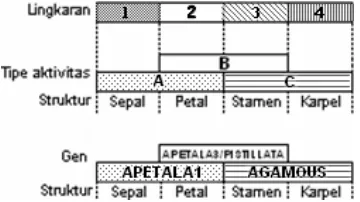
13 Konsep model ABCpada pembentukan organ bunga...6
DAFTAR LAMPIRAN
Halaman 1 Pembuatan larutan MS (Murashige & Skoog) ...102 Pembuatan buffer SDS...10
3 Komposisi media LB (Luria Bertani Broth)...10
4 Komposisi media ko-kultivasi ...10
5 Komposisi media eliminasi...10
6 Komposisi media seleksi...11
7 Komposisi MS vitamin ...11
8 Pembuatan larutan antibiotik ...11
9 Peta plasmid pBIN-AG dan pBIN-AP1...11
9
PENDAHULUAN
Latar Belakang
Pemuliaan tanaman telah dimulai sejak dimulainya peradaban manusia. Secara konvensional, pemuliaan dapat dilakukan dengan berbagai cara seperti seleksi sifat tertentu, persilangan, dan mutasi buatan. Penemuan gen sebagai substansi penentu sifat, diikuti dengan penemuan teknik isolasi gen, transfer gen, dan pengekspresiannya pada sel lain memberikan alternatif baru dalam pemuliaan melalui bioteknologi (Suwanto 1998). Hal ini memungkinkan penyisipan gen-gen penting saja, sedangkan sifat lain yang telah ada diharapkan tidak berubah.
Transformasi genetik yang merupakan proses introduksi gen dari satu organisme ke organisme lain adalah salah satu bentuk dari bioteknologi. Proses transformasi genetik dapat dilakukan secara langsung (particle bombardment, penggunaan polietilen-glikol (PEG), elektroporasi) maupun tidak langsung menggunakan bantuan Agrobacterium tumefaciens.
Setiap teknik transformasi memiliki keunggulan dan kekurangan masing-masing. Transformasi secara langsung memiliki keunggulan karena cakupannya yang luas pada berbagai spesies tanaman, namun gen yang tersisip cenderung dalam jumlah salinan yang banyak sehingga peluang terjadinya penyusunan kembali (re-arrangement) gen lebih tinggi (Hansen & Chilton 1996).
Transformasi tidak langsung meng-gunakan A. tumefaciens memiliki keunggulan karena tidak membutuhkan peralatan khusus, dapat dilakukan dengan peralatan laboratorium yang sederhana dan sisipan gen tunggal berpeluang lebih tinggi dibanding transformasi langsung, sehingga stabilitas ekspresi gen lebih tinggi (Hansen & Chilton 1996; Dai et al. 2001; Rahmawati 2006). Namun transformasi tidak langsung memiliki kekurangan yaitu sekuen yang ditransfer ke genom target bersifat acak, ada kemungkinan yang ditransfer bukan gen target (Wenck et al. 1997; Gelvin 2003).
Secara alami A. tumefaciens hanya dapat menginfeksi tanaman dikotil, sehingga pada awalnya transformasi menggunakan A. tumefaciens hanya terbatas pada tanaman dikotil. Perkembangan penelitian dasar mengenai mekanisme infeksi A. tumefaciens telah memberikan pemahaman baru sehingga beberapa modifikasi metode transformasi
dapat dilakukan untuk tanaman monokotil (Slamet-Loedin 1994).
Penelitian ini merupakan penelitian transformasi gen terhadap beberapa spesies tanaman dengan karakteristik yang berbeda dengan menggunakan sistem dan metode yang sama. Hasil penelitian ini diharapkan mampu memberikan informasi baru mengenai teknik transformasi yang efektif menggunakan A. tumefaciens pada berbagai jenis tanaman.
Tujuan
Penelitian ini bertujuan untuk mencari sistem yang tepat dalam melakukan introduksi gen menggunakan A. tumefaciens strain AGL0 pada beberapa spesies tanaman yang memiliki karakter berbeda yaitu manggis (tanaman apomiksis), tembakau (tanaman model), anggrek (kelas monokotil), dan kopi (kelas dikotil).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Februari 2008 hingga November 2008 di Laboratorium Biologi Molekuler dan Rekayasa Genetika (BMRG) Balai Penelitian Bioteknologi Perkebunan Indonesia dan Laboratorium Fisiologi dan Biologi Molekuler Tumbuhan Departemen Biologi, FMIPA IPB.
Bahan dan Alat
Bahan tanaman yang digunakan antara lain tanaman manggis, kultur in-vitro tembakau, kultur in-vitro anggrek, kopi, dan tembakau hasil transformasi. Bakteri untuk transformasi merupakan koleksi Laboratorium BMRG, yaitu A. tumefaciens strain AGL0 pembawa konstruksi gen Agamous asal kakao (TcAG) dangen Apetala1 asal kakao (TcAP1). Kultur in-vitro menggunakan media Murashige & Skoog (MS) (Lampiran 1) dengan pemberian antibiotik kanamisin dan cefotaksim. Isolasi DNA menggunakan buffer SDS (Lampiran 2). Uji insersi menggunakan Polimerase Chain Reaction (PCR) kit RBC (Real Biotech Corp., Taiwan) dengan primer spesifik gen target (Tabel 1).
deep freezer, mesin PCR, pipet mikro, perangkat elektroforesis, dan gel doc.
Tabel 1. Primer spesifik yang digunakan dalam uji insersi
Metode
Kultur bakteri A. tumefaciens
Sebanyak 1 lup suspensi A. tumefaciens dari gliserol stok diremajakan pada media Luria Bertani Agar (LA) (Lampiran 3) + antibiotik kanamisin 25 mg/L dan rifampisin 25 mg/L. Kemudian diinkubasi selama 18 jam pada suhu maksimum 28 oC. Pengkayaan kultur dilakukan dalam media Luria Bertani Broth (LB) (Lampiran 3) + kanamisin 25 mg/L dan rifampisin 25 mg/L dalam shaker incubator dengan kecepatan 150 rpm, suhu maksimum 28 oC (kondisi gelap). Hasil pengkayaan diresuspensi dengan media ko-kultivasi cair (Lampiran 4) dan diinkubasi pada kondisi yang sama selama 2-3 jam.
Transformasi genetik dan regenerasi
Sumber eksplan manggis yang digunakan dalam transformasi adalah daun manggis asal rumah kaca, daun in-vitro dan biji. Daun asal rumah kaca yang digunakan sebagai sumber eksplan adalah tunas daun dengan lebar 3-3,5 cm yang masih berwarna kemerahan. Daun in-vitro yang digunakan sebagai sumber eksplan berasal dari kultur in-vitro yang sudah memunculkan sepasang daun dengan ukuran lebar 1-1,5 cm berwarna hijau kemerahan.
Eksplan biji manggis didapatkan dengan membersihkan biji dari arilusnya yang berwarna putih, kemudian direndam dalam larutan Dithane M45 0,8% yang diberi 500 mg/L PVP (polivinilpirolidon). Selanjutnya, biji yang telah disterilisasi dipotong melintang menjadi 3-4 potongan sebelum ditanam pada media atau ditransformasi.
Transformasi pada eksplan daun manggis asal rumah kaca diawali dengan sterilisasi permukaan menggunakan alkohol 70% dan klorox 1%. Potongan eksplan diinokulasi dalam suspensi bakteri A. tumefaciens pembawa gen insert dalam larutan MS cair + acetosiringone 200 mg/L selama 15 menit dalam shaker incubator 75 rpm (kondisi
gelap). Lalu eksplan dikeringkan dengan tisu steril dan ditanam pada media ko-kultivasi padat (Lampiran 4) yang diberi kertas saring selama 2 hari. Transformasi pada tembakau menggunakan sumber eksplan daun in-vitro. Prosedur transformasi pada eksplan tembakau, kopi, dan anggrek sama dengan prosedur transformasi pada daun manggis.
Eksplan hasil ko-kultivasi kemudian dicuci dengan media eliminasi (Lampiran 5) hingga jernih. Eksplan yang telah dikeringkan kemudian dikultur pada media seleksi (Lampiran 6) pada suhu 26 oC kondisi gelap. Sub-kultur ke media baru dilakukan setiap 4-6 minggu sekali dan persentase planlet berkalus diamati tiga minggu sekali selama masa percobaan.
Isolasi DNA Total
Isolasi DNA total dilakukan dengan menggunakan buffer SDS (Lampiran 2) menggunakan 100 mg sampel jaringan daun.
Uji kuantitatif dan kualitatif DNA
DNA total hasil isolasi kemudian diuji kuantitatif untuk mengetahui konsentrasinya dengan mengukur perbandingan serapan pada panjang gelombang 260 nm dan 280 nm. Konsentrasi DNA yang tinggi digambarkan dengan nilai serapan tinggi pada panjang gelombang 260 nm. Kemurnian DNA dibanding dengan makromolekul lain dapat dilihat dari perbandingan serapan antara 260/280 yang berkisar antara 1,8-2,0 (Sambrook et al. 1989). Menghitung konsentrasi DNA dilakukan dengan persamaan :
Kons (ng/µl) = A260nm x k x fp
A260nm : Serapan pada 260 nm
k : Konstanta konsentrasi (50 untuk DNA) fp : Faktor pengenceran
Uji kualitatif DNA dilakukan dengan teknik elektroforesis gel agarose 1% pada tegangan 65V, 40 menit menggunakan 0.5x buffer TBE.
Uji Insersi dengan PCR
Uji insersi dilakukan untuk mengetahui integrasi gen insert pada genom tanaman sampel. PCR dilakukan dengan total volum sebesar 15 µl yang terdiri atas 100 ng DNA template, 1X buffer PCR (+ MgCl2), 0.1 µM
TEKNIK TRANSFORMASI GENETIK BEBERAPA TANAMAN
MENGGUNAKAN
Agrobacterium tumefaciens
ARIEF PAMBUDI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ARIEF PAMBUDI. Teknik Transformasi Genetik beberapa Tanaman Menggunakan Agrobacterium tumefaciens. Dibimbing oleh MIFTAHUDIN dan TETTY CHAIDAMSARI.
Transformasi genetik adalah proses introduksi gen dari satu organisme ke organisme lain yang memungkinkan untuk memunculkan sifat harapan tanpa mengubah sifat lain. Penggunaan Agrobacterium tumefaciens sebagai vektor transformasi memiliki keunggulan karena tidak membutuhkan peralatan khusus serta efisiensi transformasi dan salinan tunggal dari gen yang ditransformasi relatif tinggi. Penelitian ini merupakan penelitian transformasi komparatif pada beberapa tanaman yang memiliki karakter berbeda, yaitu manggis sebagai tanaman apomiksis, tembakau sebagai tanaman model, anggrek sebagai perwakilan dari kelas monokotil, dan kopi sebagai perwakilan dari kelas dikotil. Transformasi dilakukan dengan metode yang sama dan dilanjutkan dengan regenerasi pada media seleksi yang mengandung antibiotik. Konfirmasi sisipan gen hasil transformasi dilakukan dengan teknik Polimerase Chain Reaction (PCR). Hasil konfirmasi dari sampel tanaman yang mampu tumbuh pada media seleksi menunjukkan hanya tembakau yang positif tersisipi oleh gen yang ditransfomasi. Hal ini menunjukkan bahwa tanaman hasil transformasi yang mampu hidup di media seleksi belum merupakan jaminan tersisip oleh gen yang diintroduksi sebelum dilakukan pengujian molekuler. Beberapa optimasi dalam sterilisasi, teknik infeksi, peningkatan jumlah eksplan yang ditransformasi dan jumlah sampel yang diuji perlu dilakukan untuk peningkatan efisiensi transformasi.
Kata kunci : Transformasi genetik, Agrobacteriumtumefaciens, tanaman transgenik.
ABSTRACT
ARIEF PAMBUDI. Agrobacterium tumefaciens-mediated Transformation Techniques in Several Plants. Supervised by MIFTAHUDIN and TETTY CHAIDAMSARI.
Genetic transformation is a process to introduce foreign gene from one organism to other organisms. This process is a site directed mutagenesis that can improve a good character without changing the existing characters. The use of Agrobacterium tumefaciens as a vector in genetic transformation has several advantages compared to other transformation techniques. It is a simple method, does not need special equipment, and produces high transformation efficiency in transfering a single copy of insert gene. This research is a comparative genetic transformation among several plants that have different characters. They are mangosteen as an apomixis plant, tobacco as a model plant, orchid as a monocotyledon plant, and coffee as a dicotyledon plant. The transformation were conducted in a same method and continued with regeneration step in antibiotic selectable medium. Gene insert confirmation using Polimerase Chain Reaction (PCR) technique showed that only tobacco the expected gene insert. The result suggested that the plant ability to grow in selective medium was not guaranteed as a transgenic plant before being confirmed using molecular assay approach. Some optimation in explants sterilization, infection techniques, number of transformed explants and tested transformed samples are required to be increases to achieve high transformation efficiency.
3
TEKNIK TRANSFORMASI GENETIK BEBERAPA TANAMAN
MENGGUNAKAN
Agrobacterium tumefaciens
ARIEF PAMBUDI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Teknik Transformasi Genetik beberapa Tanaman Menggunakan
Agrobacterium tumefaciens
Nama : Arief Pambudi
NIM :
G34104067
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Miftahudin, M.Si)
(Dr. Tetty Chaidamsari, M.Si)
NIP. 131 851 281
NIK. 110 400 241
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP. 131 578 806
5
PRAKATA
Alhamdulillah, puji syukur atas limpahan rahmat, karunia, dan hidayah yang diberikan oleh Allah SWT kepada penulis sehingga karya ilmiah yang berjudul Teknik Transformasi Genetik beberapa Tanaman Menggunakan Agrobacterium tumefaciens dapat diselesaikan.
Penulis mengucapkan terima kasih kepada Dr. Ir. Miftahudin, M.Si dan Dr. Tetty Chaidamsari M.Si selaku pembimbing yang telah memberikan dukungan, bantuan, pengarahan, dan bimbingan kepada penulis selama pelaksanaan penelitian. Juga kepada Dr. Anja Meryandini M.Si selaku dosen penguji yang banyak memberikan masukan dalam penulisan dan perbaikan karya ilmiah ini.
Terima kasih juga kepada Mbak Herti, Mbak Nina, Mas Topan, Mbak Riana, Mbak Retno, dan Bu Dewi atas bantuan teknisnya, Winda, Kusnandar, Syamsul, Ruth, teman-teman di lab BMRG dan Fistum, David, Yanti, Amie, Icha, Resti, Arlyn, Andik, Puspita, Uci, keluarga besar Lab BMRG, Lab Fistum, kontrakan Delapan, teman-teman Biologi angkatan 41, para praktikan, dan semua pihak yang tidak dapat disebutkan satu-persatu. Tidak lupa ucapan terima kasih kepada Papa, Mama, Annis, Ipul, Han, dan seluruh keluarga yang selalu memberi dukungan, kasih sayang, doa, dan dorongan semangat yang tiada henti untuk menjadikan penulis lebih baik.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, Jawa Barat pada tanggal 14 April 1987 dari pasangan Bapak Sumarmadji dan Ibu Susiana. Penulis merupakan anak pertama dari empat bersaudara. Tahun 1998 penulis lulus dari SDN Malabar 1 Bogor, tahun 2001 lulus dari SMPN 2 Lubuk Pakam, kemudian melanjutkan ke SMAN 1 Medan. Tahun 2004 lulus dari SMAN 1 Medan dan di tahun yang sama penulis diterima sebagai mahasiswa Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama studi di IPB, penulis aktif di Himpunan Mahasiswa Biologi (Himabio) sebagai Staf Bioworld 2006/2007 dan ketua divisi Biosains tahun 2007/2008. Penulis pernah menjadi asisten praktikum Biologi Dasar, Fisiologi Tumbuhan Dasar, Sistematika Tumbuhan Berpembuluh, dan pengajar biologi bimbingan belajar dan tutorial mahasiswa Be Expert.
7
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN...1
Latar Belakang...1
Tujuan ...1
BAHAN DAN METODE ...1
Waktu dan Tempat ...1
Bahan dan Alat ...1
Metode ...2
Kultur bakteri A. tumefaciens...2
Transformasi genetik dan regenerasi...2
Isolasi DNA Total...2
Uji kuantitatif dan kualitatif DNA...2
Uji Insersi dengan PCR...2
HASIL ...3
Transformasi dan regenerasi ...3
Manggis...3
Tembakau...4
Anggrek...4
Kopi...4
Isolasi DNA dan uji insersi dengan PCR...4
PEMBAHASAN ...5
Transformasi dan regenerasi ...5
Manggis...5
Tembakau...6
Anggrek...6
Kopi...6
Isolasi DNA dan uji insersi dengan PCR...7
SIMPULAN...7
SARAN...8
DAFTAR PUSTAKA ...8
DAFTAR TABEL
Halaman
1. Primer spesifik yang digunakan dalam uji insersi...2
2. Hasil transformasi tembakau setelah 8 minggu...4
3. Hasil transformasi anggrek ...4
4. Absorbansi dan konsentrasi DNA total hasil isolasi ...4
DAFTAR GAMBAR
Halaman 1 Sumber eksplan daun tanaman manggis yang diambil dari rumah kaca yang masih berwarna merah (A), daun in-vitro (B), dan biji (C)...32 Pola pertunasan biji (A, B, C) dan pengkalusan daun manggis (D, E, F) yang bukan berasal dari luka. ...3
3 Eksplan transformasi daun rumah kaca (A), kontrol transformasi rumah kaca (B), kontrol negatif rumah kaca (C), transformasi daun in-vitro (D), kontrol transformasi in-vitro (E), kontrol negatif in-vitro (F) ...3
4 Persentase kalus manggis hasil transformasi daun asal rumah kaca...3
5 Persentase kalus manggis hasil transformasi daun in-vitro...3
6 Pola pertumbuhan tunas tembakau (tanda panah) berasal dari bekas luka...4
7 Planlet tembakau hasil transformasi dengan TcAG (A), kontrol (B), dan TcAP1 (C)...4
8 Planlet kultur in-vitro anggrek hasil transformasi
TcAG
(A), kontrol (B), dan TcAP1 (C) ...49 Planlet kopi hasil transformasi TcAG terlihat menguning (A), kontrol (B), kopi TcAP1 (C)...4
10 Elektroforesis 200 ng DNA hasil isolasi ...5
11 Hasil PCR dengan primer TcAG...5
12 Hasil PCR dengan primer TcAP1...5
13 Konsep model ABCpada pembentukan organ bunga...6
DAFTAR LAMPIRAN
Halaman 1 Pembuatan larutan MS (Murashige & Skoog) ...102 Pembuatan buffer SDS...10
3 Komposisi media LB (Luria Bertani Broth)...10
4 Komposisi media ko-kultivasi ...10
5 Komposisi media eliminasi...10
6 Komposisi media seleksi...11
7 Komposisi MS vitamin ...11
8 Pembuatan larutan antibiotik ...11
9 Peta plasmid pBIN-AG dan pBIN-AP1...11
9
PENDAHULUAN
Latar Belakang
Pemuliaan tanaman telah dimulai sejak dimulainya peradaban manusia. Secara konvensional, pemuliaan dapat dilakukan dengan berbagai cara seperti seleksi sifat tertentu, persilangan, dan mutasi buatan. Penemuan gen sebagai substansi penentu sifat, diikuti dengan penemuan teknik isolasi gen, transfer gen, dan pengekspresiannya pada sel lain memberikan alternatif baru dalam pemuliaan melalui bioteknologi (Suwanto 1998). Hal ini memungkinkan penyisipan gen-gen penting saja, sedangkan sifat lain yang telah ada diharapkan tidak berubah.
Transformasi genetik yang merupakan proses introduksi gen dari satu organisme ke organisme lain adalah salah satu bentuk dari bioteknologi. Proses transformasi genetik dapat dilakukan secara langsung (particle bombardment, penggunaan polietilen-glikol (PEG), elektroporasi) maupun tidak langsung menggunakan bantuan Agrobacterium tumefaciens.
Setiap teknik transformasi memiliki keunggulan dan kekurangan masing-masing. Transformasi secara langsung memiliki keunggulan karena cakupannya yang luas pada berbagai spesies tanaman, namun gen yang tersisip cenderung dalam jumlah salinan yang banyak sehingga peluang terjadinya penyusunan kembali (re-arrangement) gen lebih tinggi (Hansen & Chilton 1996).
Transformasi tidak langsung meng-gunakan A. tumefaciens memiliki keunggulan karena tidak membutuhkan peralatan khusus, dapat dilakukan dengan peralatan laboratorium yang sederhana dan sisipan gen tunggal berpeluang lebih tinggi dibanding transformasi langsung, sehingga stabilitas ekspresi gen lebih tinggi (Hansen & Chilton 1996; Dai et al. 2001; Rahmawati 2006). Namun transformasi tidak langsung memiliki kekurangan yaitu sekuen yang ditransfer ke genom target bersifat acak, ada kemungkinan yang ditransfer bukan gen target (Wenck et al. 1997; Gelvin 2003).
Secara alami A. tumefaciens hanya dapat menginfeksi tanaman dikotil, sehingga pada awalnya transformasi menggunakan A. tumefaciens hanya terbatas pada tanaman dikotil. Perkembangan penelitian dasar mengenai mekanisme infeksi A. tumefaciens telah memberikan pemahaman baru sehingga beberapa modifikasi metode transformasi
dapat dilakukan untuk tanaman monokotil (Slamet-Loedin 1994).
Penelitian ini merupakan penelitian transformasi gen terhadap beberapa spesies tanaman dengan karakteristik yang berbeda dengan menggunakan sistem dan metode yang sama. Hasil penelitian ini diharapkan mampu memberikan informasi baru mengenai teknik transformasi yang efektif menggunakan A. tumefaciens pada berbagai jenis tanaman.
Tujuan
Penelitian ini bertujuan untuk mencari sistem yang tepat dalam melakukan introduksi gen menggunakan A. tumefaciens strain AGL0 pada beberapa spesies tanaman yang memiliki karakter berbeda yaitu manggis (tanaman apomiksis), tembakau (tanaman model), anggrek (kelas monokotil), dan kopi (kelas dikotil).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Februari 2008 hingga November 2008 di Laboratorium Biologi Molekuler dan Rekayasa Genetika (BMRG) Balai Penelitian Bioteknologi Perkebunan Indonesia dan Laboratorium Fisiologi dan Biologi Molekuler Tumbuhan Departemen Biologi, FMIPA IPB.
Bahan dan Alat
Bahan tanaman yang digunakan antara lain tanaman manggis, kultur in-vitro tembakau, kultur in-vitro anggrek, kopi, dan tembakau hasil transformasi. Bakteri untuk transformasi merupakan koleksi Laboratorium BMRG, yaitu A. tumefaciens strain AGL0 pembawa konstruksi gen Agamous asal kakao (TcAG) dangen Apetala1 asal kakao (TcAP1). Kultur in-vitro menggunakan media Murashige & Skoog (MS) (Lampiran 1) dengan pemberian antibiotik kanamisin dan cefotaksim. Isolasi DNA menggunakan buffer SDS (Lampiran 2). Uji insersi menggunakan Polimerase Chain Reaction (PCR) kit RBC (Real Biotech Corp., Taiwan) dengan primer spesifik gen target (Tabel 1).
deep freezer, mesin PCR, pipet mikro, perangkat elektroforesis, dan gel doc.
Tabel 1. Primer spesifik yang digunakan dalam uji insersi
Metode
Kultur bakteri A. tumefaciens
Sebanyak 1 lup suspensi A. tumefaciens dari gliserol stok diremajakan pada media Luria Bertani Agar (LA) (Lampiran 3) + antibiotik kanamisin 25 mg/L dan rifampisin 25 mg/L. Kemudian diinkubasi selama 18 jam pada suhu maksimum 28 oC. Pengkayaan kultur dilakukan dalam media Luria Bertani Broth (LB) (Lampiran 3) + kanamisin 25 mg/L dan rifampisin 25 mg/L dalam shaker incubator dengan kecepatan 150 rpm, suhu maksimum 28 oC (kondisi gelap). Hasil pengkayaan diresuspensi dengan media ko-kultivasi cair (Lampiran 4) dan diinkubasi pada kondisi yang sama selama 2-3 jam.
Transformasi genetik dan regenerasi
Sumber eksplan manggis yang digunakan dalam transformasi adalah daun manggis asal rumah kaca, daun in-vitro dan biji. Daun asal rumah kaca yang digunakan sebagai sumber eksplan adalah tunas daun dengan lebar 3-3,5 cm yang masih berwarna kemerahan. Daun in-vitro yang digunakan sebagai sumber eksplan berasal dari kultur in-vitro yang sudah memunculkan sepasang daun dengan ukuran lebar 1-1,5 cm berwarna hijau kemerahan.
Eksplan biji manggis didapatkan dengan membersihkan biji dari arilusnya yang berwarna putih, kemudian direndam dalam larutan Dithane M45 0,8% yang diberi 500 mg/L PVP (polivinilpirolidon). Selanjutnya, biji yang telah disterilisasi dipotong melintang menjadi 3-4 potongan sebelum ditanam pada media atau ditransformasi.
Transformasi pada eksplan daun manggis asal rumah kaca diawali dengan sterilisasi permukaan menggunakan alkohol 70% dan klorox 1%. Potongan eksplan diinokulasi dalam suspensi bakteri A. tumefaciens pembawa gen insert dalam larutan MS cair + acetosiringone 200 mg/L selama 15 menit dalam shaker incubator 75 rpm (kondisi
gelap). Lalu eksplan dikeringkan dengan tisu steril dan ditanam pada media ko-kultivasi padat (Lampiran 4) yang diberi kertas saring selama 2 hari. Transformasi pada tembakau menggunakan sumber eksplan daun in-vitro. Prosedur transformasi pada eksplan tembakau, kopi, dan anggrek sama dengan prosedur transformasi pada daun manggis.
Eksplan hasil ko-kultivasi kemudian dicuci dengan media eliminasi (Lampiran 5) hingga jernih. Eksplan yang telah dikeringkan kemudian dikultur pada media seleksi (Lampiran 6) pada suhu 26 oC kondisi gelap. Sub-kultur ke media baru dilakukan setiap 4-6 minggu sekali dan persentase planlet berkalus diamati tiga minggu sekali selama masa percobaan.
Isolasi DNA Total
Isolasi DNA total dilakukan dengan menggunakan buffer SDS (Lampiran 2) menggunakan 100 mg sampel jaringan daun.
Uji kuantitatif dan kualitatif DNA
DNA total hasil isolasi kemudian diuji kuantitatif untuk mengetahui konsentrasinya dengan mengukur perbandingan serapan pada panjang gelombang 260 nm dan 280 nm. Konsentrasi DNA yang tinggi digambarkan dengan nilai serapan tinggi pada panjang gelombang 260 nm. Kemurnian DNA dibanding dengan makromolekul lain dapat dilihat dari perbandingan serapan antara 260/280 yang berkisar antara 1,8-2,0 (Sambrook et al. 1989). Menghitung konsentrasi DNA dilakukan dengan persamaan :
Kons (ng/µl) = A260nm x k x fp
A260nm : Serapan pada 260 nm
k : Konstanta konsentrasi (50 untuk DNA) fp : Faktor pengenceran
Uji kualitatif DNA dilakukan dengan teknik elektroforesis gel agarose 1% pada tegangan 65V, 40 menit menggunakan 0.5x buffer TBE.
Uji Insersi dengan PCR
Uji insersi dilakukan untuk mengetahui integrasi gen insert pada genom tanaman sampel. PCR dilakukan dengan total volum sebesar 15 µl yang terdiri atas 100 ng DNA template, 1X buffer PCR (+ MgCl2), 0.1 µM
11
dan ddH2O hingga mencapai volume 15 µl.
Program termal yang digunakan sesuai dengan Chaidamsari et al. (2006b) antara lain 95 oC selama 5 menit (pra-denaturasi), 95 oC 30 detik (denaturasi), 50 oC 30 detik (penem-pelan), 70 oC 1.5 menit (pemanjangan), yang diulang 35 siklus dan diakhiri dengan pemanasan 70 oC 5 menit. Hasil PCR di-elektroforesis dengan gel agarose 1% pada tegangan 75 V selama 40 menit menggunakan 0.5x buffer TBE kemudian divisualisasi dengan pewarna etidium bromida diatas UV transluminator.
HASIL
Transformasi dan regenerasi
Manggis
Sumber eksplan tanaman manggis yang digunakan dalam kultur in-vitro dan transformasi dapat dilihat pada Gambar 1.
Gambar 1 Sumber eksplan daun tanaman manggis yang diambil dari rumah kaca yang masih berwarna merah (A), daun in-vitro (B), biji (C).
Kontaminasi kultur in-vitro baik dari sumber eksplan daun maupun biji sangat tinggi (74,19% untuk transformasi daun yang diambil dari rumah kaca, 13,79% untuk transformasi yang berasal dari daun in-vitro, dan 72,62% untuk kultur biji). Hal ini salah satunya disebabkan permukaan eksplan yang tidak halus, kandungan polifenolik serta mucilage (karbohidrat kompleks) yang tinggi pada manggis sehingga sterilisasi permukaan kurang maksimal. Optimasi sterilisasi perlu dilakukan untuk menurunkan tingkat kontaminasi dengan cara pengocokan menggunakan shaker lalu diikuti screening eksplan asal rumah kaca sebelum dilakukan transformasi.
Pola pertunasan dan pengkalusan pada manggis tidak berasal dari bekas luka (Gambar 2). Hasil transformasi daun manggis asal rumah kaca dan in-vitro yang ditransformasi menggunakan gen TcAP1 dapat dilihat pada Gambar 3-5.
Gambar 2 Pola pertunasan biji (A, B, C) dan pengkalusan daun manggis (D, E, F) yang bukan berasal dari luka.
Gambar 3 Eksplan transformasi daun rumah kaca (A), kontrol transformasi rumah kaca (B), kontrol negatif rumah kaca (C), transformasi daun in-vitro (D), kontrol transformasi in-vitro (E), kontrol negatif in-vitro (F). Garis menunjukkan ukuran sepanjang 5 mm.
Gambar 4 Persentase kalus manggis hasil transformasi daun asal rumah kaca.
Gambar 5 Persentase kalus manggis hasil transformasi daun in-vitro.
3
A B C
A B C
D E F
A B C
12
Eksplan manggis yang diamati belum mengalami regenerasi membentuk tunas. Pertumbuhannya masih sampai tahap kalus sehingga eksplan belum bisa diambil untuk pengujian molekuler.
Tembakau
Tingkat keberhasilan transformasi tembakau dan kultur tembakau hasil transformasi dengan gen TcAG dan TcAP1 berturut-turut dapat dilihat pada Tabel 2 dan Gambar 6-7.
Tabel 2. Hasil transformasi tembakau setelah 8 minggu
Gambar 6 Pola pertumbuhan tunas tembakau (tanda panah), berasal dari bekas luka. Garis menunjukkan ukuran sepanjang 2 cm.
Gambar 7 Planlet tembakau hasil transformasi dengan
TcAG (A), kontrol (B), dan TcAP1 (C). Garis menunjukkan ukuran sepanjang 2 cm.
Anggrek
Tingkat keberhasilan transformasi anggrek dan kultur anggrek hasil transformasi dengan gen TcAG dan TcAP1 berturut-turut dapat dilihat pada Tabel 3 dan Gambar 8.
Tabel 3. Hasil transformasi anggrek ,,,
Gambar 8 Planlet kultur in-vitro anggrek hasil transformasi TcAG (A), kontrol (B), dan
TcAP1 (C).
Kopi
Kultur kopi hasil transformasi dua jenis gen pengatur pembungaan asal tanaman kakao, TcAG dan TcAP1 dapat dilihat pada Gambar 9.
Gambar 9 Planlet kopi hasil transformasi TcAG terlihat menguning (A), kontrol (B), kopi TcAP1
(C).
Isolasi DNA dan uji insersi dengan PCR
Absorbansi dan konsentrasi DNA hasil isolasi disajikan pada Tabel 4. Elektroforesis 200 ng DNA hasil isolasi berdasarkan hasil spektrofotometri menunjukkan pita dengan intensitas ketebalan yang berbeda (Gambar 10) oleh karena itu, dilakukan penyesuaian perhitungan konsentrasi antara hasil spektro-fotometri dengan hasil elektroforesis.
Tabel 4. Absorbansi dan konsentrasi DNA total hasil isolasi
No Sampel 260 nm 280 nm 260/280 [ng/ml]
1 Kontrol anggrek 0.032 0.018 1.778 640
2 Anggrek AG 0.026 0.013 2.000 260
3 Anggrek AP1 0.027 0.013 2.077 271
4 Kontrol kopi 0.014 0.022 1.564 208
5 Kopi AG 0.040 0.034 1.176 100
6 Kopi AP1 0.016 0.009 1.778 160
7 Kontrol tembakau 0.038 0.024 1.583 228
8 Tembakau AG 0.049 0.031 1.581 216
9 Tembakau AP1 0.239 0.130 1.838 1793
A B C
13
Gambar 10 Elektroforesis 200 ng DNA hasil isolasi. (Lajur 1-10: anggrek kontrol, anggrek AG, Anggrek AP1, kopi kontrol, kopi AG, kopi
AP1, tembakau kontrol, tembakau AG, tembakau AP1, DNA λ).
Hasil uji insersi dengan primer TcAG dan TcAP1 menunjukkan hasil positif hanya pada sampel tembakau (Gambar 11-12).
Gambar 11 Hasil PCR dengan primer TcAG. Lajur 1-9: marker 100 bp, kontrol negatif, kontrol positif, anggrek kontrol, anggrek transformasi, kopi kontrol, kopi transformasi, tembakau kontrol, tembakau transformasi.
Gambar 12 Hasil PCR dengan primer TcAP1. Lajur 1-9: marker 100 bp, kontrol negatif, kontrol positif, anggrek kontrol, anggrek transformasi, kopi kontrol, kopi transformasi, tembakau kontrol, tembakau transformasi.
PEMBAHASAN
Transformasi dan regenerasi
Manggis
Daun rumah kaca yang memenuhi persyaratan sebagai sumber eksplan adalah daun dengan umur yang tidak terlalu muda dan tidak terlalu tua (berumur sekitar 2 bulan sejak tunas muncul) dengan lebar kira-kira 3 cm. Daun yang lebih muda, akan memiliki tingkat browning yang tinggi, sedang daun yang lebih tua tingkat browning sudah berkurang, karena produksi metabolit sekunder/mucilage (karbohidrat kompleks) juga menurun. Tingginya tingkat kontaminasi manggis, salah satunya disebabkan karena struktur permukaan eksplan yang tidak rata, sehingga sterilisasi permukaan kurang efektif. Untuk itu, perlu dilakukan pengocokan
menggunakan shaker selama proses sterilisasi agar sterilisasi efektif. Selain itu, screening bagi eksplan asal rumah kaca setelah dilakukan sterilisasi permukaan juga perlu dilakukan. Hasil screening yang tidak terkontaminasi yang kemudian digunakan untuk transformasi.
Kandungan metabolit sekunder diharapkan
dapat mempermudah infeksi oleh A. tumefaciens. Hal ini biasanya terlihat dari
perubahan eksplan menjadi coklat (browning) setelah dilukai. Namun, hal ini tidak terjadi pada manggis karena kalus tidak terinduksi dari bekas luka tersebut. Hal lain yang dapat diamati setelah proses transformasi adalah sulitnya mengeliminasi A. tumefaciens karena A. tumefaciens mengkolonisasi di bagian yang tidak dilukai yang mempunyai kandungan mucilage dan polifenol yang tinggi.
Hasil penelitian menunjukkan pola pembentukan kalus berbeda antara tanaman manggis dan tembakau. Manggis merupakan tanaman apomiksis yang memiliki banyak embrio (poliembrio) dalam bijinya dan dapat berkembang tanpa terjadinya fertilisasi (Eckardt 2003). Hal ini menjadikan biji manggis merupakan sumber eksplan yang potensial digunakan dalam perbanyakan massal tanaman manggis secara in-vitro. Namun setelah diamati ternyata pola pertunasan yang tidak keluar dari bekas luka (Gambar 2) dan letak embrio yang belum diketahui secara pasti di dalam biji menyebabkan transformasi dengan A. tumefaciens sulit untuk dilakukan pada biji
manggis. Penggunaan metode particle bombardment dapat dilakukan sebagai alternatif dalam proses transformasi gen karena penembakan partikel DNA secara langsung pada biji, memungkinkan peluang terintegrasinya DNA insert pada banyak embrio cukup tinggi.
Transformasi menggunakan eksplan daun juga belum efektif dalam perakitan tanaman transgenik. Pengkalusan eksplan daun manggis memiliki pola yang sama dengan pola pengkalusan pada biji. Kalus tumbuh dari dalam, memecah tulang daun. Bukan berasal dari bekas luka pada mesofil daun yang mengalami kontak langsung dengan media seleksi (Gambar 2). Hal ini akan menyulitkan infeksi oleh A. tumefaciens yang masuk melalui luka, sehingga transformasi menggunakan sumber eksplan daun juga belum efektif dalam perakitan tanaman transgenik.
14
Eksplan daun manggis mengalami regenerasi tidak langsung melalui pembentukan kalus. Hasil penelitian menunjukkan pembentukan kalus memiliki laju peningkatan yang tinggi pada lima minggu pertama (Gambar 5 dan 6). Hal ini menjadikan kalus sebagai sumber eksplan alternatif dalam transformasi pada tanaman manggis. Sebagai upaya peningkatan efisiensi infeksi oleh A. tumefaciens, perlu dilakukan optimasi dalam proses infeksi. Beberapa cara dan perlakuan fisik yang dapat dilakukan untuk meningkatkan efektivitas transformasi menggunakan A. tumefaciens antara lain dengan perlakuan pre-kultur (Venkatachalam et al. 2000), pelukaan, penggoresan, atau pemberian suara ultrasonik (Shrestha et al. 2007). Sebagai konfirmasi insersi gen dari hasil transformasi, perlu dilakukan analisis DNA atau RNA. Namun, pertumbuhan kalus manggis yang sangat lambat menjadi faktor pembatas dalam penelitian ini.
Tembakau
Berbeda dengan manggis, transformasi dan regenerasi pada tanaman tembakau lebih banyak diketahui. Selain itu, tembakau juga responsif terhadap introduksi gen asing, mudah diamati perubahannya, dan cocok tumbuh di daerah tropis. Berbeda dengan Arabidopsis thaliana yang hanya dapat tumbuh optimum di daerah subtropis. Beberapa sifat dan kelebihan ini menyebabkan tembakau banyak digunakan sebagai tanaman model dalam transformasi genetik (Chaidamsari et al. 2006a), khususnya di daerah tropis. Pola pembentukan tunas pada eksplan juga berbeda dengan pola pengkalusan pada manggis. Tembakau mengalami regenerasi langsung dan tunas yang tumbuh berasal dari luka potongan saat transformasi (Gambar 6).
Transformasi dua gen pengatur pembungaan asal tanaman kakao, Agamous (TcAG) dan Apetala1 (TcAP1) pada tembakau sudah menunjukkan perkembangan pada minggu kedua setelah transformasi. Memasuki usia 8 minggu, terlihat perubahan per-tumbuhan pada tanaman yang ditransformasi dengan gen TcAG, TcAP1, dan kontrol. Planlet AP1 mengalami pertumbuhan yang lebih cepat dibandingkan dengan planlet kontrol dan planlet AG (Gambar 7). Kemampuan tanaman hasil transformasi untuk tumbuh pada media seleksi memberi indikasi bahwa planlet tembakau tersebut telah
mengalami introduksi gen melalui transformasi genetik.
Anggrek
Transformasi anggrek dengan dua gen pengatur pembungaan kelompok MADS-Box asal kakao, TcAG dan TcAP1 menunjukkan perbedaan pertumbuhan dengan planlet kontrol. Anggrek yang ditransformasi dengan gen TcAG memiliki perkembangan yang terhambat, daun memutih, dan persentase pertunasannya rendah (Tabel 3 dan Gambar 8A). Berbeda dengan tanaman anggrek yang ditransformasi dengan TcAG, anggrek yang ditransformasi dengan TcAP1 memiliki pertumbuhan lebih cepat dan persentase pertunasannya lebih tinggi (Tabel 3) namun menampilkan morfologi abnormal pada saat awal perkembangan dengan membentuk struktur mirip sepal, bergantung pada kekuatan tingkat ekspresinya (Gambar 8C).
Kemampuan planlet anggrek hasil transformasi kedua gen insert untuk tumbuh pada media seleksi dan perubahan morfologi pada planlet anggrek menunjukkan bahwa planlet tersebut sudah terinduksi oleh fragmen plasmid ekspresi melalui transformasi.
Kopi
Transformasi dua gen pembungaan (TcAG dan TcAP1) pada eksplan kopi menunjukkan hasil yang hampir sama seperti pada eksplan tembakau dan anggrek (Gambar 9). Berdasar atas kemampuannya tumbuh di media seleksi, planlet yang tumbuh diduga membawa fragmen plasmid.
Regulasi gen-gen pembungaan dan pembentukan organ bunga mengikuti konsep model ABC(Gambar 13). Antara gen kelas A (AP1) dan gen kelas C (AG) memiliki regulasi antagonistik (Putterill et al. 2004). Over ekspresi pada gen kelas A akan menekan ekspresi gen kelas C, begitu juga sebaliknya.
15
Informasi lain yang diketahui dari tanaman model Arabidopsis adalah bahwa regulasi pada kelompok MADS-Box memiliki jaringan regulasi yang tidak searah. Over ekspresi salah satu kelas gen dapat menginduksi beberapa dan atau sekaligus menghambat ekspresi gen kelas lainnya.
Selain menekan gen kelas C, transformasi dan over ekspresi gen AP1 juga dapat menginduksi gen induk pembungaan, LFY. Terekspresinya gen LFY akan menginduksi kembali gen dari semua kelas, termasuk kelas C yang semula ditekan (Jack 2004). Ekspresi fenotipe akan terlihat seperti bunga yang normal namun berbeda pada tingkat pertumbuhannya. Terekspresinya gen LFY karena induksi oleh AP1 akan memacu pertumbuhan tanaman lebih cepat dari tanaman normal.
Isolasi DNA dan uji insersi dengan PCR
Isolasi DNA dan uji insersi dilakukan sebagai konfirmasi hasil transformasi, apakah planlet sudah terinsersi oleh gen target atau tidak, walaupun sudah dapat tumbuh di media seleksi. Hasil uji insersi dengan primer gen insert menunjukkan bahwa tanaman putatif transgenik anggrek dan kopi yang diuji tidak terinsersi oleh gen AG dan AP1, sedangkan tanaman tembakau terinsersi. Hal ini ditunjukkan dengan munculnya amplikon sebesar 315 bp (gen AG) dan 349 bp (gen AP1) pada sampel tanaman tembakau tetapi tidak munculnya amplikon pada sampel anggrek dan kopi (Gambar 11-12). Kejadian seperti ini wajar terjadi, karena efisiensi transformasi memiliki persentase yang kecil. Pengujian hanya dapat dilakukan pada satu tanaman tiap perlakuan karena keterbatasan sampel.
Kemampuan tanaman anggrek dan kopi untuk hidup di media seleksi menunjukkan tanaman ini sudah mengalami transformasi. Namun tertransformasinya tanaman tersebut tidak dapat dipastikan oleh T-DNA yang membawa gen insert atau backbone (tulang punggung) plasmid Ti, yaitu daerah plasmid Ti diluar batas right border (RB) dan left border (LB) T-DNA (daerah non T-DNA). Kedua fragmen (T-DNA dan tulang punggung) dalam konstruksi plasmid Ti yang digunakan dalam transformasi sama-sama mengandung marker antibiotik nptII, yaitu gen penyandi resisten kanamisin. Bagian fragmen dari plasmid Ti yang mana yang akan terintegrasi pada kromosom tanaman tidak dapat dipastikan karena merupakan
rekombinasi secara acak (Gelvin 2003) dan memiliki peluang yang sama pada sistem vektor biner (Wenck et al. 1997).
Informasi bahwa bagian backbone plasmid Ti biner dapat ditransfer pada genom tanaman pertama kali dilaporkan oleh Martineau et al. (1994). Penelitian transformasi yang di-lakukan oleh Ramanathan & Veluthambi (1995) pada tanaman tembakau juga menunjukkan insert yang terintegrasi pada genom tembakau adalah gen penyandi resisten kanamisin (nptII) yang terdapat pada daerah backbone plasmid biner. Begitu pula penelitian yang dilakukan oleh Kononov et al. (1997) yang menunjukkan bahwa daerah backbone terdapat pada genom tanaman yang ditransformasi dan mencapai 75% dari total tanaman yang ditransformasi. Mekanisme tertransfernya daerah backbone merupakan konsekuensi alami dari mekanisme kerja protein VirD2 dalam mentransfer DNA (Kononov et al. 1997), karena selain mengikat kovalen pada ujung 5’ T-DNA, VirD2 juga dapat mengikat kovalen pada ujung 5’ utas non-T-DNA (Durrenberger et al. 1989).
Dengan demikian, kemampuan hidup kultur hasil transformasi pada media seleksi belum dapat dijadikan indikator suatu tanaman merupakan tanaman transgenik pembawa suatu gen insert sebelum dilakukan pengujian molekuler.
SIMPULAN
Transformasi dengan A. tumefaciens pada manggis menggunakan sumber eksplan biji dan daun sulit dilakukan tanpa optimasi teknik transformasi terlebih dahulu karena pola pertumbuhan kalus tidak berasal dari luka. Kalus atau embrio somatik berpotensi digunakan sebagai sumber eksplan dalam transformasi manggis melihat pertumbuhan-nya yang cepat pada awal perkembangan.
Transformasi dengan A. tumefaciens pada tembakau dapat dilakukan dengan baik dan perubahannya mudah diamati. Pengujian insersi pada anggrek dan kopi hasil transformasi yang diduga membawa gen insert memberikan hasil negatif karena keterbatasan jumlah sampel yang diujikan, mengingat efisiensi transformasi memiliki persentase yang rendah.
Kemampuan tanaman hidup pada media seleksi, belum merupakan jaminan tanaman tersebut tersisipi oleh gen asing yang diintroduksi sebelum dilakukan beberapa uji molekuler.
16
SARAN
Penggunaan shaker selama proses sterilisasi permukaan serta screening eksplan asal rumah kaca perlu dilakukan untuk menekan tingkat kontaminasi. Biji manggis lebih memungkinkan ditransformasi dengan particle bombardment karena sifatnya yang poliembrio. Perlu penelitian lebih lanjut mengenai struktur anatomi biji manggis dan letak embrionya agar transformasi tepat sasaran. Optimasi teknik dalam transformasi manggis dapat dilakukan dengan perlakuan fisik, optimasi waktu inokulasi dan ko-kultivasi. Peningkatan efisiensi transformasi dapat dilakukan dengan meningkatkan jumlah eksplan yang ditransformasi. Pengujian molekuler perlu dilakukan pada jumlah sampel yang lebih banyak agar lebih mewakili populasi yang diamati.
DAFTAR PUSTAKA
Chaidamsari T, Samanhudi, Budiani A, Poerwanto R, Santoso D. 2006a. Ekspresi fenotipe gen APETALA1 kakao (TcAP1) pada eksplan tembakau. Menara Perkebunan 74(1): 1-9.
Chaidamsari T, Samanhudi, Sugiarti H, Santoso D, Angenent GC, Maagd RA de. 2006b. Isolation and characterization of an AGAMOUS homologue from cocoa. Plant Sci. 170: 368-975.
Dai S, Zheng P, Marmey P, Zhang S, Tian W, Chen S, Beachy RN, Fauquet C. 2001. Comperative analysis of transgenic rice plants obtained by Agrobacterium -mediated transformation and particle bombardment. Mol. Breed. 7: 25-33. Durrenberger F, Crameri A, Honh B,
Koukolikova-Nicola Z. 1989. Covalently bound VirD2 protein of Agrobacterium tumefaciens protects the T-DNA from exonucleolytic degradation. Proc. Natl. Acad. Sci .USA 86: 9154-9158.
Eckardt NA. 2003. Pattern of gene expression in apomixis. Plant Cell 15: 1499-1501. Gelvin SB. 2003. Agrobacterium-mediated
plant transformation: the biology behind the “gene-jockeying” tool. Microbiol. Mol. Biol. Rev. 67(1): 16-37.
Hansen G, Chilton MD. 1996. “Agrolistic” transformation of plant cells : Integrated of T-strands generated in planta. Proc. Natl. Acad. Sci. USA 93: 14978-14983.
Jack T. 2004. Molecular and genetic mechanisms of floral control. Plant Cell 16: S1-S17.
Kononov ME, Bassuner B, Gelvin SB. 1997. Integration of T-DNA binary vector ‘backbone’ sequences into the tobacco genome: evidence for multiple complex patterns of integration. Plant J 11(5): 945-947.
Martineau B, Voelker TA, Sanders RA. 1994. On defining T-DNA. Plant Cell 6: 1032-1033.
Putterill J, Laurie R, Macknight R. 2004. It’s time to flower: the genetic control of flowering time. BioEssays 26: 1-11. Rahmawati S. 2006. Status perkembangan
perbaikan sifat genetik padi menggunakan transformasi Agrobacterium. J. Agrobiogen. 2(1): 36-44.
Ramanathan V, Veluthambi K. 1995. Transfer of non-T-DNA portions of Agrobacterium tumefaciens Ti plasmid pTiA6 from the left terminus of TL-DNA. Plant. Mol. Biol
28: 1149-1154.
Sambrook J, Fritsch EF, Maniatis T. 1989, Nolan C, editor. Molecular Cloning, A Laboratory Manual. New York: Cold Spring Harbor Laboratory.
Shrestha BR, Chin DP, Tokuhara K, Mii M. 2007. Efficient production of transgenic plantls of Vanda through sonication-assisted Agrobacterium-mediated trans-formation of protocorm-like bodies. Plant Biotech. 24 : 429-434.
Slamet-Loedin IH. 1994. Transformasi genetik pada tanaman: Beberapa teknik dan aspek penting. Hayati 1(2): 66-67. Suwanto A. 1998. Bioteknologi molekuler:
Mengoptimalkan manfaat keanekaragaman hayati melalui teknologi DNA rekom-binan. Hayati 5: 25-28.
Venkatachalam P, Geetha N, Khandelwal A, Shaila MS, Sita GL. 2000. Agrobacterium-mediated genetic transformation and regeneration of transgenic plants from cotyledon explants of groundnut (Arachis hypogaea L) via somatic embryogenesis. Curr. Sci. 78(9): 1130-1136.
17
18
Lampiran 1. Pembuatan larutan MS (Murashige & Skoog)
Lampiran 2.Pembuatanbuffer SDS
Komposisi Larutan stok Konsentrasi akhir
SDS (% b/v) 10 2
Glisin (M) 1 0,1
NaCl (M) 5 0,05
EDTA pH 8 (M) 0,5 0,01
Lampiran 3.Komposisi media LB (Luria Bertani Broth) Komposisi Konsentrasi akhir (g/L)
Tripton 10
Yeast Extract 5
NaCl 5 Bacto Agar 15 (untuk LA)
pH diatur sampai 7,2 dengan larutan KOH 1N dan 0,1N.
Lampiran 4.Komposisi media ko-kultivasi Komposisi Konsentrasi akhir Larutan MS
Gula pasir (g/L) 30
Agar (g/L) 8 (hanya untuk media padat) BAP (µM) 2,2 (untuk daun) 22,2 (untuk biji) TDZ (µM) 2,27 (hanya untuk eksplan daun) PVP (µM) 1,39
Acetosiringone (mg/L) 200
pH diatur sampai 5,7-5,8 dengan larutan KOH 1N dan 0,1N.
Lampiran 5. Komposisi media eliminasi Komposisi Konsentrasi akhir Larutan MS
Gula pasir (g/L) 30
Agar (g/L) 8 (hanya untuk media padat) BAP (µM) 2,2 (untuk daun) 22,2 (untuk biji) TDZ (µM) 2,27 (hanya untuk eksplan daun) PVP (µM) 1,39
Cefotaksim (mg/L) 250
pH diatur sampai 5,7-5,8 dengan larutan KOH 1N dan 0,1N. Stok Kode
Stok Senyawa mg/L mg/250 ml
Vol pemakaian stok per liter MS (ml)
Konsentrasi akhir (mg/L)
A NH4OH 82500 20 1650
B KNO3 95000 20 1900
C CaCl2 . 2H2O 22000 5 440
D
H3BO3
KH2PO4
CoCl2 . 6H2O
Na2MoO4 . 2H2O
KI 310 8500 1,3 12,5 41,5 5 6,2 170 0,025 0,25 0,83 E
MgSO4 . 7H2O
MnSO4 . 4H2O
ZnSO4 . 7H2O
CuSO4 . 5H2O
18500 752,7 430 1,3 5 370 22,3 8,6 0,025 F Na2- EDTA
FeSO4 . 7H2O
1,86
1,39 5
19
Lampiran 6.Komposisi media seleksi
Komposisi Konsentrasi akhir Larutan MS
Gula pasir (g/L) 30
Agar (g/L) 8 (hanya untuk media padat) BAP (µM) 2,2 (untuk daun) 22,2 (untuk biji) TDZ (µM) 2,27 (hanya untuk eksplan daun) PVP (µM) 1,39
Cefotaksim (mg/L) 250 Kanamisin (mg/L) 25
pH diatur sampai 5,7-5,8 dengan larutan KOH 1N dan 0,1N.
Lampiran 7.Komposisi MS vitamin Senyawa mg/L g/100 ml
Myo-inositol 100 1
Thiamine 10 0,1
Nicotinic acid 1 0,01
Pyridoxine-HCl 1 0,01
Lampiran 8.Pembuatan larutan antibiotik
Senyawa Konsentrasi Stok (mg/L) Pelarut g/ml
Kanamisin 100000 Air 0,1
Cefotaksim 250000 Air 0,25
Rifampisin 25000 Air 0,025
Acetosiringone 250000 DMSO + Etanol absolut 0,25
Lampiran 9. Peta plasmid pBIN-AG dan pBIN-AP1
20
Lampiran 10. Bagan alur penelitian
A. tumefaciens AGL0 dengan konstruk
pBIN-AP1 dan pBIN-AG
Eksplan daun manggis dan tembakau
Ko-kultivasi
Media eliminasi dan seleksi
Planlet putatif transgenik manggis dan tembakau
Planlet putatif transgenik anggrek dan kopi
Isolasi DNA
Uji insersi (PCR)