POTENSI
CAJUPUTS CANDY
NON SUKROSA SEBAGAI
PENGHAMBAT AKTIVITAS
STREPTOCOCCUS MUTANS
DALAM PEMBENTUKAN BIOFILM
WINNY IFTARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Cajuputs Candy Non Sukrosa sebagai Penghambat Aktivitas Streptococcus mutans dalam Pembentukan Biofilm adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2013
RINGKASAN
Winny Iftari. Potensi Cajuputs Candy Non Sukrosa sebagai Penghambat Aktivitas Streptococcus mutans dalam Pembentukan Biofilm. Dibimbing oleh Dedi Fardiaz, C. Hanny Wijaya, dan Boy M. Bachtiar.
Cajuputs candy merupakan produk fungsional yang berkhasiat melegakan tenggorokan. Komponen flavor pada cajuputs candy, yaitu ekstrak kayu putih dan peppermint dilaporkan mampu menghambat pembentukan biofilm oleh S. mutans serotip C dalam penelitian sebelumnya. Cajuputs candy telah dikembangkan menjadi cajuputs candy non sukrosa dengan mengganti sukrosa sebagai komponen utama menjadi isomalt.
Penelitian ini dilakukan untuk mengetahui potensi cajuputs candy non sukrosa dalam menghambat aktivitas S. mutans membentuk biofilm dengan mengidentifikasi senyawa volatil yang terdapat di dalamnya, dan mengamati penghambatan pembentukan biofilm. Pada penelitian ini, dibuat tiga jenis model uji. Model uji kontrol (K) merupakan permen non sukrosa tanpa penambahan komponen flavor, model uji cajuput candy non sukrosa (CC1) merupakan permen non sukrosa dengan ekstrak kayu putih sebagai komponen flavor, dan model uji cajuputs candy non sukrosa (CC2) merupakan permen non sukrosa yang menggunakan ekstrak kayu putih dan ekstrak peppermint sebagai komponen flavor.
Identifikasi senyawa volatil dilakukan dengan menggunakan Gas Chromatography Mass Spectra (GC-MS) di laboratorium flavor Balai Besar Pusat Penelitian Padi, Sukamandi-Subang, Jawa Barat dengan kolom kapiler DB-5 MS. Senyawa volatil dalam ekstrak kayu putih dan peppermint digunakan sebagai informasi awal untuk mengetahui senyawa volatil apa saja yang masih terdapat dalam CC1 dan CC2.
Potensi penghambatan aktivitas S. mutans dalam pembentukan biofilm diamati melalui pendekatan analisis penghambatan viabilitas massa biofilm dan kuantifikasi mRNA gtfB-gtfC bakteri ini pada masa inkubasi selama 4 dan 6 jam. Analisis viabilitas massa biofilm dan kuantifikasi mRNA gtfB-gtfC dilakukan di laboratorium oral biologi FKG, Universitas Indonesia. Viabilitas massa biofilm setelah pemberian model uji, diperoleh dengan mengamati nilai absorbansi suspensi biofilm dengan menggunakan microplate Enzyme Linked Immunosorbent Assay (ELISA) Reader. Level ekspresi mRNA gtfB dan gtfC diperoleh dengan mengamati nilai CT
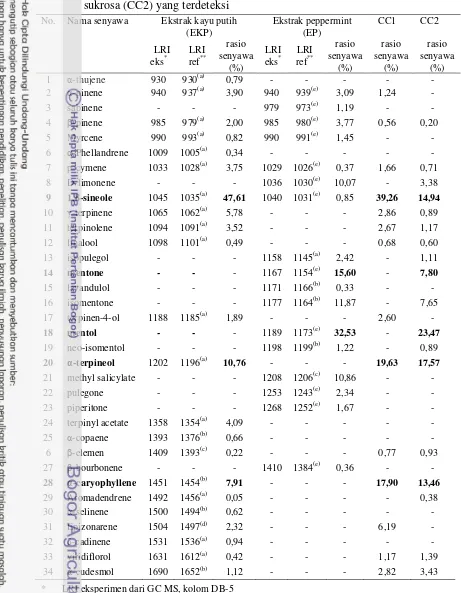
Hasil analisis senyawa volatil dengan GC-MS menunjukkan bahwa berdasarkan nilai LRI-nya terdapat 22 senyawa volatil dalam ekstrak kayu putih dan 17 senyawa volatil dalam ekstrak peppermint. Ekstrak kayu putih teridentifikasi mengandung senyawa utama berturut-turut: 1,8-sineol (47,61%), α
-terpineol (10,76%), α-karyofilen (7,91%), -terpinen (5,78%), terpinyl asetat
(4,09%), α-pinen (3,90%), p-cymene (3,75%), dan terpinolen (3,52%). Sedangkan ekstrak peppermint teridentifikasi mengandung senyawa volatil utama berturut-turut: mentol (32,53%), menthon (15,60%), isomenthon (11,87%), metil salisilat (10,86%), D-limonen (10,07%), -pinen (3,77%), dan α-pinen (3,09%).
Komposisi senyawa volatil dari ekstrak kayu putih dan peppermint ini dijadikan senyawa volatil target pada model. Berdasarkan hasil analisis senyawa volatil terhadap model uji, diketahui bahwa terdapat 14 senyawa volatil pada CC1 dan 18 senyawa volatil terdapat pada CC2. Senyawa volatil yang masih terdapat pada pada CC1 adalah 1,8-sineol (39,26%), α-terpineol (19,6γ%), dan α-karyofilen (17,90%). Senyawa volatil pada CC2 adalah mentol (23,47%), α-terpineol (17,57%), 1,8-sineol (14,94%), α-karyofilen (13,46%), menthone (7,80%), dan isomenthone (7,65%).
Berdasarkan hasil penelitian yang diperoleh, diketahui bahwa kemampuan model uji K, CC1, dan CC2 dalam menghambat pembentukan massa biofilm optimum pada masa inkubasi 4 jam dengan potensi penghambatan sebesar 63,98% oleh K, 48,34% oleh CC1, dan 65,64% oleh CC2. Pada masa inkubasi 6 jam, potensi penghambatan pembentukan massa biofilm oleh seluruh model uji < 50%, hanya model uji CC2 yang memiliki potensi penghambatan > 40%.
Level ekspresi mRNA gtfB akibat pemberian model uji K, CC1, dan CC2 justru lebih tinggi dibandingkan blanko (tanpa model uji) pada masa inkubasi 4 jam. Pemberian model uji baru dapat menghambat ekspresi mRNA gtfB pada masa inkubasi 6 jam. Pola yang berbeda ditunjukkan oleh mRNA gtfC, pemberian model uji K, CC1 dan CC2 sudah dapat menghambat ekspresi mRNA gtfC mulai dari masa inkubasi 4 jam. Model uji CC2 yang mengandung senyawa volatil utama berupa mentol dan α-terpineol diketahui memiliki kemampuan penghambatan ekspresi mRNA gtfB dan gtfC paling baik.
Hasil penelitian membuktikan bahwa cajuputs candy non sukrosa (model uji CC2) dapat menghambat pembentukan massa biofilm oleh S. mutans dengan masa inkubasi optimum selama 4 jam dan potensi penghambatan sebesar 65,64%. Pada masa inkubasi 4 jam, cajuputs candy non sukrosa menghambat pembentukan biofilm oleh S. mutans dengan cara menghambat ekspresi mRNA gtfC, meskipun ekspresi mRNA gtfB baru dapat dihambat setelah masa inkubasi 6 jam.
SUMMARY
Winny Iftari. The Potency of Non Sucrose Cajuputs Candy to Inhibit the Activity of Streptococcus mutans in Biofilm Formation. Supervised by Dedi Fardiaz, C. Hanny Wijaya, and Boy M. Bachtiar.
Cajuputs candy is a confectionery considered as functional product effective for throat lozenges. Flavor compounds of cajuputs candy has been reported as inhibitor of biofilm formation by S. mutans serotype C. Non sucrose cajuputs candy is a product of cajuputs candy developed by replacing sucrose as the main component by isomalt.
The aim of this research is to observe the potency of non sucrose cajuputs candy to inhibit the activity of S. mutans in biofilm formation by identifying the volatil components of candy and monitoring the formation of biofilm. This study has three experiment models. Control model (K) is non sucrose candy without flavor compounds, CC1 model is cajuput candy non sucrose with cajuput extract as flavor compound, and CC2 model is cajuputs candy non sucrose with cajuput and peppermint extract as flavor compounds.
The volatil components was identified using Gas Chromatography Mass Spectra (GC-MS) with capillary column DB-5 MS in flavor laboratory of Indonesia Rice Research Center, Sukamandi-Subang, West Java. The volatil components of cajuput and peppermint extract is used as former information that could verify volatil components in CC1 and CC2.
The inhibition of S. mutans activity in biofilm formation was monitored by analysis of biofilm mass viability and quantification of gtfB-gtfC mRNA with 4 and 6 hours incubation time. The viability of biofilm mass analysis and mRNA quantification was conducted in biology oral laboratory of Dentistry Faculty-University of Indonesia. The viability of biofilm mass obtained by monitoring the absorbance of biofilm suspension using microplate Enzyme Linked Immunosorbent Assay (ELISA) Reader. Expression level of gtfB-gtfC mRNA obtained by monitoring the CT
1,8-cineole (14,94%), α-caryophyllene (13,46%), menthone (7,80%), dan isomenthone (7,65%).
This research showed that the optimum inhibition of biofilm mass formation occured in 4 hours incubation with inhibition potency of K, CC1, and CC2 consecutively are 63,98%, 48,34%, and 65,64%. The inhibition potency of all models are less than 50% in 6 hours incubation, only CC2 has inhibition potency more than 40%.
The expression level of gtfB mRNA in K, CC1, and CC2 model is higher than blank during 4 hours incubation. The experiment models K, CC1, and CC2 could inhibit the expression of gtfB mRNA later (6 hours incubation). Meanwhile, the existence of K, CC1, and CC2 could inhibit gtfC mRNA expression since 4 hours incubation. The experiment model CC2 containing mentol, α-terpineol, and 1,8-cineole as main volatil components has the best effect in inhibiting gtfB and gtfC mRNA expression.
This study prove that non sucrose cajuputs candy (CC2) could inhibit S. mutans activity in biofilm formation with optimum inhibition in 4 hours incubation with inhibition percentage 65,64%. Non sucrose cajuputs candy inhibit biofilm formation by inhibiting S. mutans activity in expressing mRNA gtfC although the inhibition of mRNA gtfB occured later.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
POTENSI
CAJUPUTS CANDY
NON SUKROSA SEBAGAI
PENGHAMBAT AKTIVITAS
STREPTOCOCCUS MUTANS
DALAM PEMBENTUKAN BIOFILM
WINNY IFTARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Cajuputs Candy Non Sukrosa sebagai Penghambat Aktivitas Streptococcus mutans dalam Pembentukan Biofilm
Nama : Winny Iftari
NRP : F251100131
Disetujui oleh
Komisi Pembimbing
Ketua
Prof Dr Ir Dedi Fardiaz, MSc
Prof Dr Ir C Hanny Wijaya, MAgr
Anggota Anggota
Prof drg Boy M Bachtiar, MS PhD
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Pangan
Dr Ir Ratih Dewanti Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Penghargaan dan terima kasih penulis sampaikan kepada Bapak Prof Dr Ir Dedi Fardiaz, MSc, Ibu Prof Dr C Hanny Wijaya, MAgr, dan Bapak Prof drg Boy M Bachtiar, MS, Phd selaku komisi pembimbing yang telah bersedia meluangkan waktunya untuk memberikan bimbingan dan dorongan. Ucapan terima kasih juga penulis sampaikan kepada Bapak Dr Ir Anton Apriyantono, MS yang bersedia meluangkan waktu untuk membagikan ilmunya, kepada Bapak Dr Ir Bram Kusbiantoro, MS selaku kepala laboratorium flavor di BB Pusat Penelitian Padi – Sukamandi, Subang, Jawa Barat yang telah mengizinkan penulis untuk melaksanakan penelitian di sana serta Ibu Prof Dr Ir Sedarnawati Yasni, MAgr yang telah bersedia menjadi dosen penguji di luar komisi pembimbing.
Terima kasih penulis sampaikan kepada seluruh staf pengajar di program studi Ilmu Pangan yang telah banyak memberikan ilmu pengetahuan selama masa studi. Penulis ingin menyampaikan rasa terima kasih setulus-tulusnya kepada seluruh staf dan pegawai di departemen Ilmu dan Teknologi Pangan yang telah banyak membantu penulis baik dalam hal administrasi maupun di laboratorium selama penulis menuntut ilmu di program studi Ilmu Pangan. Terima kasih juga penulis sampaikan kepada para teknisi di laboratorium Biologi Oral FKG-UI dan laboratorium flavor di BB Pusat Penelitian Padi – Sukamandi, Subang, Jawa Barat atas segala bantuannya kepada penulis dalam menyelesaikan penelitian.
Penulis ingin menyampaikan terima kasih kepada Ibu Dr Ir Herla Rusmarilin, MS dan Dr Elisa Julianti, STP, Msi dari departemen Ilmu dan Teknologi Pangan – Universitas Sumatera Utara yang senantiasa memberikan dukungan kepada penulis untuk menempuh pendidikan pascasarjana di program studi Ilmu Pangan, IPB. Terima kasih tak lupa pula penulis sampaikan kepada teman-teman CHWers yang senantiasa mengingatkan dan memberikan semangat kepada penulis. Terima kasih kepada teman-teman seperjuangan di program studi Ilmu Pangan angkatan 2010 yang telah bersama-sama melewati banyak perjuangan untuk dapat betahan dan menyelesaikan studi, saling mengingatkan dan menguatkan. Tak lupa pula penulis sampaikan terima kasih kepada saudara-saudaraku sehalaqoh dan wisma Andika yang senantiasa mengingatkan, menasihati, dan menyemangati penulis, begitu pun kepada saudara-saudara di HIMMPAS IPB dan ISC Al Hurriyyah, terima kasih Saudaraku.
Terakhir, terima kasih kepada kedua orangtua penulis yaitu Drs Nispiansyah, MPd dan Dra Hastuti atas doa, perhatian, dan kasih sayang yang tiada putus sehingga penulis senantiasa terpacu untuk dapat menyelesaikan pendidikan. Terima kasih kepada adik-adikku Luki Itsardi, ST dan Nesti Gayatri atas doa dan perhatiannya.
Semoga tesis ini dapat bermanfaat bagi kita dalam mengemban dan melaksanakan tugas kemasyarakatan.
Bogor, Mei 2013
DAFTAR ISI
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN xiii PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA Minyak Kayu Putih (Cajuput Oil) ... 3
Minyak Peppermint (Peppermint Oil) ... 4
Cajuputs candy ... 5
Isomalt ... 6
Karies Gigi ... 7
Streptococcus mutans ... 7
Biofilm Oral ... 8
Glukosiltransferase ... 10
METODE PENELITIAN Bahan dan Alat Penelitian ... 11
Waktu dan Lokasi Penelitian ... 11
Prosedur Penelitian ... 11
Pembuatan Model uji ... 12
Analisis Senyawa Volatil ... 13
Analisis Penghambatan Aktivitas Pembentukan Biofilm Pembiakan S. mutans ... 15
Analisis Penghambatan Viabilitas Massa Biofilm ... 15
Analisis Penghambatan Ekspresi mRNA gtfB dan gtfC Ekstraksi RNA Total ... 17
Sintesis cDNA ... 18
HASIL DAN PEMBAHASAN
Komposisi Senyawa Volatil ... 19
Penghambatan Aktivitas Pembentukan Biofilm ... Penghambatan Viabilitas Massa Biofilm ... 27
Penghambatan Ekspresi mRNA gtfB ... 28
Penghambatan Ekspresi mRNA gtfC ... 29
Hubungan Komposisi Senyawa Volatil dengan Penghambatan Aktivitas Pembentukan Biofilm ... 31
SIMPULAN DAN SARAN Simpulan ... 32
Saran ... 32
DAFTAR PUSTAKA ... 33
LAMPIRAN ... 38
DAFTAR TABEL
1 Senyawa volatil dalam minyak kayu putih ... 4
2 Senyawa volatil dalam minyak peppermint ... 5
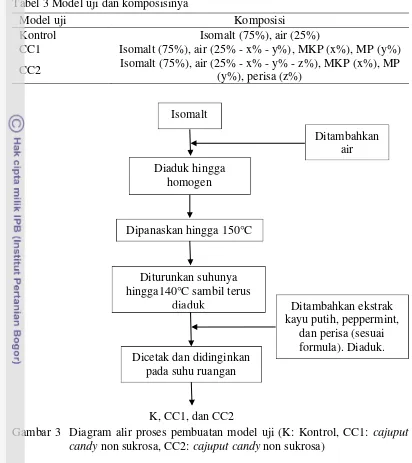
3 Model uji dan komposisinya ... 13
4 Sekuen nukleotida primer mRNA gtfB, mRNA gtfC, dan
housekeeping gene (16S rRNA) ... 18 5 Senyawa volatil (dalam rasio) dari ekstrak kayu putih, ekstrak peppermint,
cajuput candy non sukrosa (CC1), dan cajuputs candy non sukrosa (CC2) .
yang terdeteksi ... 20
6 Hasil analisis senyawa volatil ekstrak kayu putih (EKP), ekstrak
peppermint (EP), cajuput candy non sukrosa (CC1), dan cajuputs candy
non sukrosa digolongkan berdasarkan hidrokarbon penyusunnya ... 21
7 Persentase penghambatan viabilitas massa biofilm oleh kontrol (K),
DAFTAR GAMBAR
1 Tahap pembentukan biofilm ... 9
2 Diagram alir langkah kerja penelitian ... 12
3 Diagram alir proses pembuatan model uji ... 13
4 Diagram alir analisis senyawa volatil ... 14
5 Diagram alir analisis penghambatan viabilitas massa biofilm dan ekspresi mRNA gtfB-gtfC ... 16
6 Struktur bangun 1,8-sineol (a), α-terpineol (b), menton (c), mentol (d) ... 22
7 Kromatogram senyawa volatil dari ekstrak kayu putih ... 23
8 Kromatogram senyawa volatil dari ekstrak peppermint ... 24
9 Kromatogram senyawa volatil dalam cajuput candy non sukrosa (CC1) ... 25
10 Kromatogram senyawa volatil dalam cajuputs candy non sukrosa (CC2) .. 26
11 Ekspresi mRNA gtfB oleh S. mutans pada blanko, kontrol (K), cajuput candy non sukrosa (CC1), dan cajuputs candy non sukrosa (CC2) selama inkubasi 2, 4, dan 6 jam ... 28
DAFTAR LAMPIRAN
1 Hasil identifikasi senyawa volatil dalam ekstrak kayu putih ... 38
2 Hasil identifikasi senyawa volatil dalam ekstrak peppermint ... 39
3 Hasil identifikasi senyawa volatil dalam cajuput candy (CC1) 40 4 Hasil identifikasi senyawa volatil dalam cajuputs candy (CC2) ... 41
5 Hasil amplifikasi mRNA gtfB pada blanko (ulangan I) ... 43
6 Hasil amplifikasi mRNA gtfB pada blanko (ulangan II)... 43
7 Hasil amplifikasi mRNA gtfB pada masa inkubasi 4 jam (ulangan I) ... 43
8 Hasil amplifikasi mRNA gtfB pada masa inkubasi 4 jam (ulangan II) ... 43
9 Hasil amplifikasi mRNA gtfB pada masa inkubasi 6 jam (ulangan I) ... 44
10 Hasil amplifikasi mRNA gtfB pada masa inkubasi 6 jam (ulangan II) ... 44
11 Hasil amplifikasi mRNA gtfC pada blanko (ulangan I) ... 44
12 Hasil amplifikasi mRNA gtfC pada blanko (ulangan II) ... 44
13 Hasil amplifikasi mRNA gtfC pada masa inkubasi 4 jam (ulangan I) ... 45
14 Hasil amplifikasi mRNA gtfC pada masa inkubasi 4 jam (ulangan II) ... 45
15 Hasil amplifikasi mRNA gtfC pada masa inkubasi 6 jam (ulangan I) ... 45
16 Hasil amplifikasi mRNA gtfC pada masa inkubasi 6 jam (ulangan II) ... 46
PENDAHULUAN
Latar Belakang
Tanaman kayu putih (Melaleuca cajuputi Roxb.) merupakan tanaman khas Indonesia yang dapat menghasilkan minyak kayu putih. Minyak kayu putih diperoleh sebagai hasil penyulingan dari daun dan ranting tanaman kayu putih (Guenther 1990). Minyak kayu putih sangat digemari karena memiliki aroma yang khas serta warna yang hijau bening, selain itu juga memiliki banyak manfaat bagi tubuh.
Penduduk pribumi di Malaysia menggunakan minyak kayu putih sebagai
obat dalam untuk sakit perut dan saluran pencernaan (Guenther 1990). Di Indonesia, minyak kayu putih telah lama dipercaya sebagai obat tradisional
yang memiliki banyak manfaat, baik sebagai obat luar maupun obat dalam. Meskipun penggunaannya sebagai obat dalam masih sangat jarang ditemukan di Indonesia, minyak kayu putih telah lama digunakan sebagai obat tradisional untuk mengobati sakit gigi karena minyak kayu putih memiliki kemampuan sebagai antiseptik. Minyak kayu putih dapat digunakan untuk melegakan tenggorokan, mencegah iritasi, mengobati luka, dan menghambat jamur (Budavari 1989).
Pemanfaatan minyak kayu putih sebagai kekayaan herbal lokal berbasis pangan fungsional telah dilakukan oleh Wijaya et al. (2002) yang telah mendapatkan hak paten (ID 0 000 385 S) atas komposisi cajuputs candy sebagai pelega tenggorokan. Cajuputs candy merupakan produk konfeksioneri fungsional dengan komponen utama yaitu sukrosa dan komponen flavor yaitu ekstrak kayu putih dan ekstrak peppermint alami.
Minyak kayu putih dan minyak peppermint telah lama diketahui mengandung senyawa volatil yang dapat berperan sebagai antimikroba. Jedlickova (1994) melaporkan bahwa senyawa volatil (1,8- sineol, linalool, terpineol, dan terpinen-4-ol) yang diisolasi dari minyak kayu putih Vietnam memiliki kemampuan menghambat pertumbuhan Streptococcus spp. A, B, C, dan G. Sementara itu, kemampuan antimikroba minyak peppermint menurut Inouye et al. (2001) ditentukan oleh keberadaan senyawa volatil mentol dan menton. Hasil penelitian sebelumnya oleh Nurramdhan (2010) menunjukkan bahwa formula cajuputs candy yang mengandung ekstrak kayu putih dan ekstrak peppermint, mampu menghambat pembentukan biofilm oleh S. mutans.
Penggunaan sukrosa sebagai komponen utama pada cajuputs candy masih berpotensi menginduksi pembentukan biofilm mengingat sukrosa dapat dimanfaatkan oleh S. mutans untuk menghasilkan polisakarida ekstraseluler (EPS) (Leme et al. 2006). Penelitian terus dikembangkan untuk meningkatkan khasiat cajuputs candy sebagai produk fungsional. Christie (2012) melalui penelitian yang dilakukannya telah mendapatkan formulasi terbaik untuk cajuputs candy non sukrosa dengan menggunakan isomalt sebagai pengganti sukrosa. Isomalt diketahui lebih rendah kalori dan tidak mampu dimanfaatkan oleh S. mutans untuk membentuk biofilm pada gigi (Mitchell 2006).
Biofilm adalah komunitas mikroorganisme yang melekat pada permukaan gigi dan dilapisi oleh polisakarida ekstraseluler (EPS) tidak larut yang
S. mutans membentuk biofilm dengan memanfaatkan karbohidrat yang tertinggal dalam mulut dan mensekresikan enzim glukosiltransferase B dan C (GTFB dan GTFC) untuk membentuk EPS. Sekresi enzim GTFB dan GTFC dikodekan oleh gen gtfB dan gtfC (Kuramitsu 1993). Biofilm yang terdapat pada permukaan gigi merupakan pemicu terjadinya karies pada gigi (Simon 2007).
Survei Kesehatan Rumah Tangga (SKRT) pada tahun 2004 yang dilakukan oleh Depkes RI menunjukkan prevalensi karies gigi di Indonesia berkisar antara 85% - 99% dan cenderung mengalami peningkatan (Sintawati dan Tjahya 2009). Tingginya prevalensi karies gigi di Indonesia memberikan peluang bagi cajuputs candy non sukrosa untuk dijadikan produk oral care (perawatan gigi dan mulut) jika terbukti berpotensi menghambat pembentukan biofilm oleh S. mutans.
Penelitian ini dilakukan untuk mengetahui potensi cajuputs candy non sukrosa dalam menghambat aktivitas pembentukan biofilm oleh S. mutans, melalui pendekatan analisis senyawa volatil, penghambatan viabilitas massa biofilm, dan penghambatan ekspresi mRNA gtfB-gtfC. Proses pembuatan cajuputs candy non sukrosa yang menerapkan suhu tinggi diyakini dapat mengubah komposisi senyawa volatil di dalamnya padahal aktivitas antimikroba pada minyak atsiri menurut Inouye et al. (2001) sangat ditentukan oleh stabilitas senyawa volatil di dalamnya. Perubahan komposisi senyawa volatil dalam cajuputs candy non sukrosa yang terjadi diharapkan masih dapat menghambat ekspresi mRNA gtfB dan gtfC oleh S. mutans sehingga tetap berpotensi menghambat aktivitasnya membentuk biofilm. Hasil penelitian ini diharapkan dapat dijadikan awalan untuk melakukan uji klinis cajuputs candy non sukrosa.
Perumusan Masalah
Senyawa volatil dalam minyak kayu putih dan peppermint telah lama diketahui memiliki aktivitas antimikroba. Hasil penelitian Nurramdhan (2010) menegaskan bahwa formula cajuputs candy yang mengandung ekstrak kayu putih
dan ekstrak peppermint, mampu menghambat pembentukan biofilm oleh S. mutans. Namun belum diketahui bagaimana aktivitas antimikroba ekstrak kayu
putih dan peppermint setelah diterapkan pemanasan pada suhu tinggi saat proses pembuatan cajuputs candy non sukrosa, apakah senyawa volatil yang memiliki aktivitas antimikroba paling baik masih terdapat di dalam cajuputs candy non sukrosa? Hal ini mendasari penulis untuk mengamati komposisi senyawa volatil yang terdapat di dalam ekstrak kayu putih, ekstrak peppermint, maupun cajuputs candy non sukrosa itu sendiri. Analisis senyawa volatil yang dilakukan diharapkan dapat mempertegas apa yang menyebabkan terhambatnya aktivitas S. mutans dalam membentuk biofilm, apakah komponen flavor atau isomalt yang digunakan?
biomassa biofilm yang terbentuk yang ditandai dengan penurunan nilai Optical Density (OD) (Honda 2005). Dengan diketahuinya komposisi senyawa volatil dari komponen flavor yang digunakan pada cajuputs candy non sukrosa dan aktivitas S. mutans mengekspresikan mRNA gtfB dan gtfC untuk pembentukan biofilm maka dapat ditentukan potensi cajuputs candy non sukrosa sebagai penghambat aktivitas S. mutans dalam pembentukan biofilm.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui potensi cajuputs candy non sukrosa terhadap penghambatan aktivitas pembentukan biofilm oleh S. mutans sebagai salah satu faktor penyebab karies gigi dengan pendekatan analisis senyawa volatil, viabilitas massa biofilm, dan kuantifikasi mRNA gtfB-gtfC.
Hipotesis
Cajuputs candy non sukrosa memiliki kemampuan untuk menghambat aktivitas pembentukan biofilm oleh S. mutans.
TINJAUAN PUSTAKA
Minyak Kayu Putih (Cajuput Oil)
Kayu putih atau gelam (Melaleuca cajuputi Roxb.) merupakan tanaman perdu dengan batang pohon kecil dan anak cabang yang banyak menggantung ke bawah. Tanaman ini dapat tumbuh liar di daerah berhawa panas. Kayu putih tidak memiliki syarat tumbuh yang spesifik karena memiliki toleransi yang cukup baik untuk berkembang. Kayu putih biasa dimanfaatkan sebagai sumber minyak kayu putih (cajuputs oil) yang merupakan hasil ekstraksi terutama dari daun dan ranting tanamannya yang biasanya menggunakan cara penyulingan dengan uap (Lutony 1994). Daun pohon kayu putih sangat aromatik sehingga paling banyak disuling untuk menghasilkan minyak kayu putih yang biasanya beraroma seperti kamper (camphor), rosemary atau biji kapulaga (cardamom seeds), serta memiliki rasa yang pahit (Grieve 1995). Minyak atsiri hasil penyulingan daun kayu putih berwarna kekuning-kuningan hingga kehijau-hijauan (Ipteknet 2005).
FDA (Food and Drug Administration), JECFA (Join Expert FAO/WHO Committee on Food Aditives) seta FEMA (Flavor Extract Manufacturer’s Association) mengizinkan penggunaan minyak kayu putih sebagai flavoring agent pada bahan pangan karena tergolong bahan flavor yang alami (Burdock 2010). FEMA melaporkan bahwa Possible Average Daily Intake (PADI) minyak kayu putih sebesar 0,831 mg dengan penggunaannya dalam soft candy secara umum adalah sebesar 6,80 ppm dan maksimal 9,5 ppm (Burdock 2010).
bronchitis, serta jika diteteskan ke dalam gigi dapat mengurangi rasa sakit gigi (Lutony 1994). Minyak kayu putih telah lama digunakan sebagai obat tradisional untuk mengobati berbagai penyakit karena diyakini memiliki sifat sebagai antiseptik. Jedlickova (1994) dalam hasil penelitiannya melaporkan bahwa senyawa volatil (1,8-sineol, linalool, terpineol, dan terpinen-4-ol) yang diisolasi dari minyak kayu putih Vietnam memiliki kemampuan menghambat pertumbuhan 23 strain Staphylococcus aureus, 11 strain Escherichia coli, dan Pseudomonas aeruginosa. Efek penghambatan komponen-komponen fitokimia minyak kayu putih Vietnam paling baik adalah terhadap bakteri Candida albicans, Streptococcus spp. A, B, C, dan G, Enterobacter spp., Salmonella spp., dan Klebsiella pneumonia.
Aktivitas antimikroba minyak atsiri diperoleh dari komponen terpen dan fenol yang terdapat secara alami di dalam minyak atsiri. Aktivitas terpen dan fenol berhubungan dengan karakter lipofiliknya, kedua senyawa ini terakumulasi di membran kemudian terjadi asosiasi dengan membran sehingga terjadi penurunan energi pada mikroba (Conner 1993). Selain itu, Moreira et al. (2005) dalam hasil penelitiannya melaporkan bahwa komponen fenolik dalam minyak atsiri mensintesis fosfolipid bi-layer pada membran sel yang dapat menyebabkan peningkatan permeabilitas dan kebocoran penyusun intraseluler penting atau gangguan sistem enzim mikroba.
Tabel 1 Senyawa volatil dalam minyak kayu putih
No. Senyawa volatil Kadar (%)
1 1,8-sineol 22,45
2 α-terpineol 12,45
3 E-kariofilena 6,9
4 -pinena 5,74
5 α-humulena 4,70
6 -selinena 3,82
7 -mirsena 3,58
8 α-selinena 2,9
9 α-terpenil asetat 2,74
Sumber: Muchtaridi et al. (2004).
Aktivitas antimikroba minyak kayu putih diharapkan juga terdapat pada cajuputs candy dalam penelitian ini guna membuktikan khasiat permen tersebut untuk mencegah karies gigi. Untuk itu, perlu dilakukan verifikasi komponen volatil minyak kayu putih dan permen minyak kayu putih dengan menggunakan GC-MS.
Minyak Peppermint (Peppermint Oil)
peppermint maksimum dalam permen adalah sebesar 0,104%. Senyawa volatil dalam minyak peppermint secara umum ditunjukkan pada tabel berikut ini.
Tabel 2 Senyawa volatil dalam minyak peppermint
No. Senyawa volatil Kadar (%)
1. Mentol 29-48
2. Menton 20-31
3. Mentofuran 6,8
4. Mentil asetat 3-10
Sumber: Leung (1980).
Selain senyawa volatil seperti pada Tabel 2, masih terdapat komponen lainnya seperti flavonoid (12%), polimer polifenol (19%), karoten, tokoferol, betain, kolin, dan tannin. Dengan komponen volatil tersebut, minyak peppermint efektif sebagai antibakteri, terutama terhadap bakteri gram positif yaitu Staphylococcus aureus dan Streptococcus pyogenes dibandingkan dengan bakteri gram negatif yaitu Escherichia coli dan Klebsiella pnumoniae (Singh et al. 2011).
Dari hasil analisis minyak peppermint dengan GC-MS yang dilakukan oleh Aflatuni (2005), diketahui bahwa minyak peppermint mengandung 16 senyawa volatil, yaitu α-pinen, sabinen, -pinen, mirsen, limonen, 1,8-sineol,
cis-p-menth-2-en-1-ol, mentofuran, menton, mentol, pulegon, piperiton, mentil asetat, -borbonen, -kadinen, dan -karyofilen.
Cajuputs Candy
Produk konfeksioneri merupakan produk pangan dengan gula sebagai kandungan utamanya (Lawrence 1991). Permen sebagai salah satu produk konfeksioneri dibagi atas dua kelas yaitu permen kristalin dan non kristalin. Hard candy merupakan permen non kristalin yang memiliki tekstur keras, penampakan mengkilat, dan bening (Jackson 1995). Berdasarkan ciri-ciri tersebut, maka cajuputs candy tergolong pada hard candy.
Komposisi Cajuputs candy sebagai pelega tenggorokan telah dipatenkan (ID 0 000 385 S) oleh Wijaya et al. (2002) dengan nama produk cajuputs candy original. Cajuputs candy yang berkhasiat melegakan tenggorokan ini dapat dijadikan sebagai produk konfeksioneri fungsional khas Indonesia. Pengembangan cajuputs candy sebagai produk konfeksioneri fungsional terus dilakukan agar dapat memiliki khasiat yang lebih baik daripada sebelumnya. Salah satu pengembangan yang dilakukan adalah dengan mengganti penggunaan sukrosa dan glukosa pada cajuputs candy menjadi isomalt (Christie 2012). Isomalt diketahui merupakan gula yang tidak menyebabkan karies pada gigi (Mitchell 2006).
(2012) diterapkan dalam pembuatan cajuputs sugarfree candy sebagai model uji dalam penelitian ini.
Isomalt
Pemanis golongan poliol diketahui bersifat toothfriendly sehingga sering digunakan oleh industri konfeksioneri untuk menggantikan sukrosa atau gula glukosa untuk menghasilkan produk yang aman bagi kesehatan gigi. Secara umum, pemanis dari golongan poliol memiliki beberapa keunggulan dibandingkan dengan sukrosa, diantaranya aman bagi gigi, rendah kalori dan indeks glikemik atau dapat menurunkan nilai keduanya, merupakan pemanis bebas gula (sugar free) yang dapat memberikan kesan bulky pada produk, stabil secara kimia dan enzimatis, stabil terhadap mikroba, nonkariogenik, dan beberapa diantaranya dapat memberikan sensasi dingin di mulut (Wijaya dan Mulyono 2010).
Pemanis dari golongan poliol yang digunakan dalam penelitian ini adalah isomalt. Isomalt merupakan pemanis bebas gula yang dapat memberikan kesan bulky pada produk, berbentuk kristal yang bersifat non higroskopis dan tidak berbau (odorless), stabil terhadap hidrolisis kimiawi maupun enzimatis, serta tidak dapat difermentasi oleh mikroorganisme. Tingkat kemanisan isomalt adalah 0,45 hingga 0,6 kali dibandingkan dengan sukrosa (=1,0). Kemanisan isomalt sangat mirip dengan sukrosa, dan tidak menimbulkan aftertaste. Kristal isomalt tidak memberikan efek dingin seperti yang dimiliki oleh pemanis poliol lainnya. Sifat isomalt yang non higroskopis memudahkan penyimpanan karena kadar airnya cenderung tidak berubah pada suhu 25°C dengan RH 85% sehingga umur simpannya panjang. Sifatnya yang tidak higroskopis ini memberikan keuntungan jika digunakan dalam permen keras, yaitu tidak mudah lengket (sticky) meskipun disimpan lama. Isomalt memiliki kelarutan yang lebih rendah daripada sukrosa. Kelarutan isomalt semakin meningkat dengan meningkatnya suhu. Viskositas isomalt yang dipanaskan bergantung pada kecepatan pengadukan, pada pembuatan permen, viskositas isomalt yang dipanaskan menunjukkan viskositas yang lebih rendah daripada sirop sukrosa pada suhu yang sama. Pada pembuatan permen keras menggunakan isomalt, dibutuhkan pemanasan pada suhu yang lebih tinggi daripada pembuatan permen keras dengan sukrosa, hal ini bertujuan untuk memperoleh kadar air akhir permen yang lebih rendah (Sentko dan Bernard 2012). Dengan sifat fisik maupun kimia isomalt seperti yang telah disebutkan, isomalt merupakan pengganti gula yang ideal untuk industri pangan maupun farmasi. Isomalt sangat tepat digunakan dalam industri konfeksioneri berbasis sugar free, dengan aplikasi terbaik pada permen keras (Sentko dan Ettle 2006).
Karies Gigi
Karies gigi merupakan masalah gigi penyebab utama gigi berlubang, yang dapat menimbulkan rasa nyeri dan infeksi. Di dalam mulut terdapat banyak bakteri patogen oportunis yang hidup dengan memanfaatkan sisa-sisa makanan yang tertinggal sebagai bahan baku metabolismenya. Bakteri-bakteri ini dapat mengubah gula yang tersisa pada gigi menjadi asam laktat. Karies gigi terjadi ketika asam laktat hasil fermentasi yang dilakukan oleh bakteri anaerob ini lebih banyak jumlahnya daripada kecepatan remineralisasi kalsium dan fosfat oleh saliva. Asam laktat yang dihasilkan dapat menurunkan pH mulut, sehingga bakteri yang mendominasi rongga mulut hanya bakteri yang asidofilik, terutama Streptococcus mutans (Marsh 1994).
Kondisi demineralisasi yang dilaporkan oleh Marsh (1994), merupakan tahap awal terjadinya karies pada gigi yang kemudian membentuk plak. Segera setelah gigi dibersihkan, protein saliva yang terdiri dari glikoprotein, sisa-sisa sel bakteri, dan asam akan tereabsorsi ke permukaan enamel gigi. Gigi kemudian membentuk lapisan yang disebut pelikel, yang mengawali terbentuknya biofilm pada permukaan gigi (Davey dan O’toole 2000).
Pelikel dan matriks plak merupakan hasil dari host dan produk bakteri yang terdiri dari beberapa komponen meliputi albumin, lisozim, amilase, imunoglobulin A, prolin, dan mucins. Lapisan pelikel pada permukaan gigi dikolonisasi oleh bakteri gram positif seperti S. mutans (Haake dan Kinder 2009). Glukosiltransferase dan glukan yang berperan dalam perlekatan bakteri juga terdapat dalam pelikel (Marsh dan Martin 2009).
Sukrosa yang sering ditambahkan dalam makanan dan minuman disimpulkan sebagai penyebab utama karies gigi (Colby dan Russel 1997). Sukrosa merupakan karbohidrat dengan berat molekul rendah sehingga dapat cepat digunakan oleh mikroflora mulut sebagai substrat untuk sintesis polisakarida ekstraseluler (EPS) dan intraseluler (IPS). EPS berperan dalam akumulasi bakteri ke permukaan gigi dan menyebabkan perubahan biokimia dan struktur dalam matriks biofilm, sedangkan IPS merupakan sumber endogen karbohidrat yang dapat dimetabolisme untuk menghasilkan asam selama nutrien terbatas (Leme et al. 2006).
Streptococcus mutans
Di dalam mulut terdapat jutaan bakteri patogen oportunis, namun tidak semua bakteri tersebut mampu bertahan hidup pada kondisi lingkungan mulut yang asam akibat dihasilkannya asam laktat oleh bakteri fermentatif dalam mulut. Loesche (1986) melaporkan bahwa S. mutans merupakan satu-satunya bakteri dominan yang terdapat dalam jumlah besar dalam mulut seseorang yang menderita karies gigi. S. mutans merupakan bakteri gram positif yang berbentuk bulat dan oval dengan diameter sekitar 2 mµ. S. mutans memerlukan CO2 untuk
S. mutans memiliki kemampuan untuk melekat pada permukaan gigi dengan membentuk glukan yang tidak larut. Lapisan polisakarida ini kemudian membentuk plak pada gigi. S.mutans yang menjadi penyebab utama karies gigi dapat melekat pada enamel karena adanya pelikel saliva ataupun plak yang telah lebih dulu dibentuk oleh bakteri lain (Lamont et al. 1991). S. mutans memiliki reseptor dekstran pada permukaan dinding selnya sehingga memudahkan bakteri ini untuk melekat pada permukaan gigi untuk memetabolisme sukrosa menjadi dekstran ekstraseluler sehingga terjadi agregasi bakteri dan peningkatan koloni (Roeslan 2002).
Metabolisme dekstran atau glukan ekstraseluler oleh S. mutans dilakukan dengan mensekresikan enzim glucosyltransferase (GTF). Kemampuan S. mutans memetabolisme sukrosa menjadi asam lebih cepat dibandingkan dengan bakteri lain dalam agregasi. Glukan tidak larut yang kaya ikatan α-1,3-glukosidik yang terutama dihasilkan oleh S. mutans ini dapat juga bertindak sebagai mediator agregasi bakteri pada permukaan gigi. Oleh sebab itu, glukan tidak larut yang pembentukannya dikatalisis oleh GTF merupakan ekspresi esensial dari virulensi S. mutans (Roeslan 2002).
Biofilm Oral
Biofilm di dalam mulut merupakan komunitas mikroorganisme yang melekat pada permukaan gigi dan dilapisi oleh matriks ekstraselular (polisakarida), yang disekresikan oleh bakteri itu sendiri maupun diperoleh dari lingkungan di sekitar mikroorganisme itu tumbuh (Marsh dan Martin 2009). Biofilm adalah lapisan yang terbentuk oleh koloni sel-sel mikroba dan melekat pada permukaan substrat, berada dalam keadaan diam, berlendir, dan tidak mudah terlepas (Madigan et al. 2006).
S. mutans memiliki kemampuan untuk melekat pada permukaan gigi dengan membentuk glukan yang tidak larut air. Lapisan polisakarida ini kemudian membentuk plak pada gigi. Terbentuknya plak gigi memberikan lingkungan yang ideal bagi pertumbuhan bakteri patogen dalam mulut. S. mutans merupakan jenis bakteri patogen oportunis dalam mulut yang merupakan penyebab utama karies gigi. Pembentukan plak gigi adalah tahap awal terjadinya karies gigi, kondisi lingkungan mulut seperti ini dapat mempermudah komunitas mikroorganisme yang melekat pada gigi untuk membentuk biofilm (Simon 2007).
Aparna dan Yadav (2008) menyatakan bahwa pembentukan biofilm secara umum terdiri atas lima tahap, yang diilustrasikan pada Gambar 1. Tahap pertama terbentuknya biofilm dimulai dengan perlekatan sel mikroba pada permukaan substrat. Pada tahap ini, sel-sel mikroba tidak melekat dengan kuat karena hanya mengandalkan kekuatan ikatan van der Waals. Selama tahap ini, sel bakteri mengalami pertumbuhan logaritmik.
Tahap ketiga adalah tahap maturasi. Pada tahap ini, biofilm terus tumbuh yang sejalan dengan pertumbuhan koloni di dalamnya. Ketebalan lapisan biofilm
pada tahap ini dapat mencapai lebih dari 10 μm. Tahap keempat merupakan tahap maturasi II, dimana biofilm yang dibentuk semakin tebal dan semakin melekat kuat (Aparna danYadav 2008).
Gambar 1 Tahap pembentukan biofilm
Pada tahap kelima, terjadi dispersi sel-sel mikroba yaitu terlepasnya sel-sel mikroba penyusun koloni baik dalam keadaan sendiri ataupun bersama dengan sebagian komponen matriks penyusun biofilm untuk berkembang kembali menjadi sel mikroba seperti pada keadaan awal (Aparna dan Yadav 2008). Pembentukan biofilm merupakan tanda adanya proses lanjutan yang mengkarakterisasi perubahan aktivitas gen dan regulasinya yang diperlukan pada berbagai langkah pembentukan biofilm (Shemesh 2007).
Keberadaan sukrosa, yang dimediasi oleh enzim glukosiltransferase (GTF) diketahui memiliki peran terhadap virulensi S.mutans (Kuramitsu 1993). Shemesh (2007) membuktikan bahwa penambahan sukrosa pada media pertumbuhan TY (Tryptone Yeast) dapat meningkatkan populasi sel S. mutans secara signifikan,
dengan ketebalan biofilm mencapai γ80 μm melalui analisa dengan Confocal Laser Scanning Microscopy (CLSM).
Glukosiltransferase
Glukosiltransferase (GTF) merupakan enzim yang bertanggung jawab menghasilkan glukan larut dan glukan tidak larut dengan menggunakan sukrosa sebagai substrat. GTF sangat penting dalam proses kolonisasi bakteri S. mutans (Hamada dan Slade 1980). Glukan yang dihasilkan menempel pada permukaan gigi merupakan tanda awal terjadinya karies pada gigi (Colby dan Russell 1997). GTF yang disekresikan oleh S. mutans terdapat dalam pelikel pada permukaan gigi dan berperan penting dalam proses perlekatan bakteri (Marsh dan Martin 2009).
S. mutans menghasilkan tiga enzim GTF, yaitu GTFB, GTFC dan GTFD yang diperlukan untuk pembentukan plak gigi (Colby dan Russel 1997). Glukan yang larut air dihasilkan oleh GTFD yang didominasi oleh α-1,6-glukosidik. (Kuramitsu 1993). Glukan tidak larut dihasilkan oleh S. mutans dengan bantuan GTFB dan GTFC (Aoki et al. 1986).
1988). GTFB dan GTC bersifat patogen karena polimer glukosa yang dihasilkan oleh kedua enzim ini merupakan mediator agregasi bagi bakteri pada permukaan gigi (Yamashita et al. 1992). Glukan tidak larut didominasi oleh α-1,3-glukosidik. Polimer glukosa yang dihasilkan berkontribusi terhadap intensitas ketebalan dan intensitas struktur plak gigi yang nantinya akan berkembang dan dapat menjadi karies (Chia et al. 1995).
Kelarutan glukan atau dekstran dalam air berpengaruh terhadap pembentukan koloni S. mutans pada permukaan gigi (Marsh dan Martin 2009). Metabolisme sukrosa ekstraselular oleh S. mutans yang memproduksi dekstran
yang tidak larut dalam air dengan rantai α-(1,3) sangat mempengaruhi pembentukan plak dan peningkatan kolonisasi dari bakteri pada plak, semakin tidak larut air maka pembentukan plak akan semakin baik (Roeslan 2002).
GTFB dan GTFC yang terabsorpsi menyediakan sisi pengikatan spesifik untuk kolonisasi bakteri pada permukaan gigi dan bakteri satu sama lain, mengatur pembentukan biofilm yang sangat erat (Kuramitsu 1993). Menurut Ooshima et al. (2001), GTFC memiliki peran yang lebih besar terhadap pembentukan glukan tidak larut yang melekat sangat kuat daripada GTFB.
S. mutans secara konstitutif akan mensekresikan enzim GTF yang dikode oleh gen gtf. Gen gtf utama yang berperan dalam pembentukan karies adalah gtfB dan gtfC, adanya kedua gen ini menunjukkan bahwa bakteri S. mutans tersebut berpotensi menyebabkan karies gigi (Soemantadireja 2005).
Ekspresi suatu gen secara molekuler dapat dideteksi pada tahap transkripsi (mRNA) maupun translasi (protein). Deteksi ekspresi gen pada tingkat mRNA lebih sulit dibandingkan pada tahap protein karena memerlukan tahapan isolasi mRNA pada fase atau bagian yang mengekspresikan gen tersebut dan memerlukan alat yang sensitif (Litbang 2010). Keberadaan GTFB dan GTFC pada S. mutans diekspresikan oleh gen gtfB dan gtfC yang mengkode kedua enzim tersebut. Ekspresi mRNA gtfB dan gtfC dapat diamplifikasi dengan teknik PCR menggunakan primer mRNA gtfB dan gtfC.
Hudson dan Curtiss (1990) menyelidiki peran gtf promoter dengan menggunakan chloramphenicol dengan berdasarkan hipotesis bahwa gtfB dan gtfC merupakan bagian dari operon tunggal, dan mendapatkan bahwa asetiltransferase mengkode gen dari berbagai strain S. mutans. Kemudian Smorawinska dan Kuramitsu (1995) dan Fujiwara et al. (1996) melaporkan bahwa gtfB dan gtfC diekspresikan terpisah oleh S. mutans. Belakangan, dengan menggunakan plasmid based luciferase reporter assay, Goodman dan Gao, (2000) membuktikan bahwa promoter gtfB dan gtfC adalah berbeda.
Fujiwara et al. (2002) melakukan penelitian untuk mengetahui intensitas ekspresi mRNA gtfB, gtfC, dan gtfD pada awal, pertengahan, dan akhir fase eksponensial pertumbuhan S. mutans. Hasil penelitian yang dilakukan Fujiwara et al. (2002), menunjukkan bahwa ekspresi mRNA gtfB menurun pada pertengahan dan meningkat dua kali lipat pada akhir fase eksponensial dibandingkan dengan awal fase eksponensial, sedangkan ekspresi mRNA gtfC cenderung menurun pada fase pertengahan hingga akhir. Fujiwara, et al., (2002) menyimpulkan bahwa adanya perbedaan ekspresi mRNA gen gtfB dan gtfC disebabkan karena perbedaan promoter yang mengendalikan aktivitas gtfB dan gtfC.
mengkuantifikasi reporter fluoresen. Sinyal fluoresen akan meningkat seiring dengan bertambahnya produk PCR dalam reaksi. Dengan mendeteksi jumlah emisi fluoresen pada setiap siklus, amplifikasi selama fase logaritmik dapat dipantau. Peningkatan produk PCR yang signifikan pada fase eksponensial berhubungan dengan jumlah inisiasi gen target. Semakin tinggi emisi fluoresen maka semakin banyak DNA yang diamplifikasi (Litbang 2010).
METODE PENELITIAN
Bahan dan Alat Penelitian
Bakteri yang digunakan pada penelitian ini adalah S. mutans XC (serotip C) yang terdapat di Laboratorium Biologi Oral FKG UI. Bahan-bahan yang digunakan dalam pembuatan permen (sebagai model uji) adalah isomalt, ekstrak kayu putih, ekstrak peppermint, perisa, dan air.
Bahan-bahan yang digunakan dalam eksperimen adalah medium kultur Brain Heart Infusion (BHI) broth dan BHI agar, air destilata steril, gas CO2,
Phosphate Buffer Saline (PBS, pH 7,2) steril, kristal violet 0,5%, etanol 95%, Trizol® Reagent, DEP-C water, RNAse free water, chloroform, isopropanol, etanol 75% (dalam DEP-C water), Invitrogen SuperScriptTM III cDNA synthesis kit, primer gtfB dan gtfC, heksan (GC grade), 1,4-diklorobenzen, sulfat anhidrat, dan standar alkana C8 s.d. C20
Peralatan penelitian yang digunakan adalah peralatan gelas, timbangan, pipet mikro, pipet tip, anaerobic jar, inkubator, cawan petri, bunsen, 6-24-96-multiwell plate, tube 1,5 ml, PCR-tube, centrifuge (SORVALL
.
®
Legend RT) dengan kecepatan mencapai 12000 x g, microplate ELISA reader (BIORAD), Real Time PCR (AB Applied Biosystem), Gas Chromatography-Mass Spectra (Agilent) kolom DB-5.
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada Juni hingga Desember 2012. Penelitian ini dilaksanakan di Laboratorium Pengolahan Bahan Pangan Departemen Ilmu dan Teknologi Pangan FATETA IPB; Laboratorium Biologi Oral FKG UI; dan Laboratorium Flavor Balai Besar Pusat Penelitian Padi – Sukamandi, Subang, Jawa Barat.
Prosedur Penelitian
pengamatan senyawa volatil terhadap model uji dilakukan setelahnya. Potensi penghambatan aktivitas pembentukan biofilm oleh model uji diamati melalui analisis penghambatan viabilitas massa biofilm sesuai prosedur yang dilakukan oleh Sandasi et al. (2011) dan penghambatan ekspresi mRNA gtfB-gtfC dengan menggunakan RT-PCR.
Gambar 2 Diagram alir langkah kerja penelitian
Pembuatan Model Uji
Pembuatan model uji yang dilakukan pada penelitian ini mengacu pada prosedur pembuatan cajuputs candy non sukrosa oleh Christie (2012). Pada penelitian ini dibuat tiga jenis model uji yang berbeda formulasinya yaitu permen non sukrosa tanpa penambahan komponen flavor sebagai kontrol (K), cajuput candy non sukrosa (CC1) dengan minyak kayu putih sebagai komponen flavor, dan cajuputs candy non sukrosa (CC2) yang menggunakan ekstrak kayu putih (EKP) dan ekstrak peppermint (EP) sebagai komponen flavor. Perbandingan bahan padat (isomalt) dengan bahan cair (air, komponen flavor, dan perisa) pada setiap model uji adalah 3:1. Komposisi model uji secara lengkap dapat dilihat pada Tabel 3. Proses pembuatan model uji diilustrasikan pada Gambar 3.
Analisis penghambatan
viabilitas massa biofilm
Analisis penghambatan ekspresi mRNA
gtfB-gtfC
Analisis senyawa volatil Pembuatan model
uji
Analisis penghambatan aktivitas pembentukan
biofilm
Analisis senyawa volatil terhadap ekstrak
Tabel 3 Model uji dan komposisinya
Model uji Komposisi
Kontrol Isomalt (75%), air (25%)
CC1 Isomalt (75%), air (25% - x% - y%), MKP (x%), MP (y%)
CC2 Isomalt (75%), air (25% - x% - y% - z%), MKP (x%), MP (y%), perisa (z%)
Gambar 3 Diagram alir proses pembuatan model uji (K: Kontrol, CC1: cajuput candy non sukrosa, CC2: cajuput candy non sukrosa)
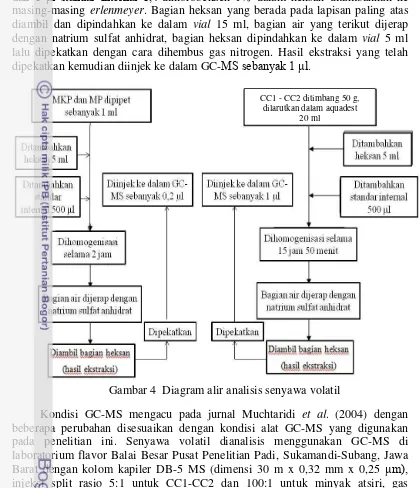
Analisis Senyawa Volatil
Senyawa volatil dalam ekstrak kayu putih dan peppermint merupakan informasi awal untuk dapat membandingkan senyawa volatil dari CC1 dan CC2. Ekstrak kayu putih dan peppermint masing-masing dilarutkan dalam 5 ml heksan
lalu ditambahkan 500 μl standar internal 1,4-diklorobenzen 1% dalam heksan kemudian dihomogenisasi dengan shaker pada kecepatan 160 rpm selama 2 jam. Bagian heksan diambil dan dipindahkan ke dalam vial 12 ml lalu ditambahkan natrium sulfat anhidrat untuk menjerap air yang terikut. Heksan yang bebas air dipindahkan ke dalam vial 5 ml lalu dipekatkan dengan cara dihembus gas nitrogen. Hasil ekstraksi yang telah dipekatkan diinjek ke dalam GC-MS
sebanyak 0,β μl.
Senyawa volatil dari CC1 dan CC2 diekstraksi terlebih dahulu. Sebanyak 50 g CC1 dan CC2 masing-masing ditimbang ke dalam erlenmeyer 250 ml lalu
Dipanaskan hingga 150°C
Diturunkan suhunya hingga140°C sambil terus
diaduk Ditambahkan ekstrak kayu putih, peppermint,
dan perisa (sesuai formula). Diaduk. Dicetak dan didinginkan
pada suhu ruangan
Ditambahkan air
Diaduk hingga homogen
ditambahkan 20 ml air destilat dan 5 ml heksan (GC grade) kemudian dihomogenisasi dengan shaker pada kecepatan 160 rpm selama 15 jam 50 menit
dan 1 μl standar internal 1,4-diklorobenzen 1% dalam heksan ditambahkan ke masing-masing erlenmeyer. Bagian heksan yang berada pada lapisan paling atas diambil dan dipindahkan ke dalam vial 15 ml, bagian air yang terikut dijerap dengan natrium sulfat anhidrat, bagian heksan dipindahkan ke dalam vial 5 ml lalu dipekatkan dengan cara dihembus gas nitrogen. Hasil ekstraksi yang telah dipekatkan kemudian diinjek ke dalam GC-MS sebanyak 1 μl.
Gambar 4 Diagram alir analisis senyawa volatil
Kondisi GC-MS mengacu pada jurnal Muchtaridi et al. (2004) dengan beberapa perubahan disesuaikan dengan kondisi alat GC-MS yang digunakan pada penelitian ini. Senyawa volatil dianalisis menggunakan GC-MS di laboratorium flavor Balai Besar Pusat Penelitian Padi, Sukamandi-Subang, Jawa Barat dengan kolom kapiler DB-5 MS (dimensi 30 m x 0,32 mm x 0,25 μm), injeksi split rasio 5:1 untuk CC1-CC2 dan 100:1 untuk minyak atsiri, gas pembawa Helium tekanan 80 kPa, program suhu 60°C ditahan selama 5 menit kemudian dinaikkan hingga suhu 250°C ditahan selama 2 menit (laju kenaikan 10°C/menit).
Perhitungan nilai LRI ditentukan dengan persamaan :
LRIx
LRI
= 100
x
t
= indeks retensi linier komponen x (yang diperiksa)
x = waktu retensi komponen x (menit)
CC1 - CC2 ditimbang 50 g, dilarutkan dalam aquadest
tn
t
= waktu retensi alkana standar, dengan n atom karbon yang muncul sebelum waktu komponen x
n+1
n = jumlah atom karbon alkana standar yang muncul sebelum komponen x = waktu retensi alkana standar, dengan n+1 atom karbon yang muncul
setelah waktu komponen x
Analisis Penghambatan Aktivitas Pembentukan Biofilm Pembiakan S. mutans
S. mutans XC diambil sebanyak 1 ose dari stok bakteri yang disimpan di dalam lemari pendingin pada suhu -80°C, kemudian digoreskan pada medium BHI agar dan diinkubasi selama 48 jam pada suhu 37°C dengan kondisi mikroaerofilik (kadar CO2
S. mutans XC yang telah dibiakkan dalam BHI broth diambil sebanyak 200
μl lalu ditempatkan ke dalam 96-multiwell plate untuk ditentukan konsentrasinya dengan menggunakan microplate ELISA reader pada panjang gelombang 450 nm. Setelah diketahui konsentrasi S. mutans XC yang telah dibiakkan, selanjutnya konsentrasi awal S. mutans XC diseragamkan menjadi 10
5%) di dalam anaerobic jar. Diambil masing-masing 1 ose S. mutans XC dari 2 koloni berbeda dan ditumbuhkan pada 5 ml media kultur BHI broth untuk selanjutnya diinkubasi kembali selama 24 jam pada suhu 37°C dengan kondisi mikroaerofilik di dalam anaerobic jar.
6
V
CFU/ml dengan pengenceran menggunakan BHI broth. Untuk mengetahui jumlah BHI broth yang harus ditambahkan, dilakukan perhitungan dengan menggunakan rumus berikut,
1 x M1 = V2 x M
= Konsentrasi S. mutans XC yang dibaca dengan microplate ELISA reader
2
M
= Volume BHI broth yang dibutuhkan untuk mengencerkan
2 = Konsentrasi S. mutans XC yang diharapkan (106 CFU/ml)
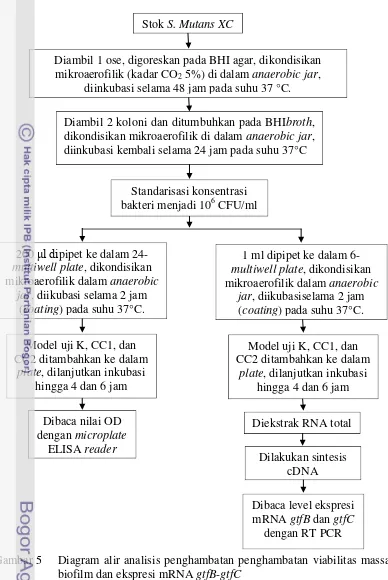
Analisis Penghambatan Viabilitas Massa Biofilm
Analisis penghambatan viabilitas massa biofilm dilakukan sesuai prosedur Sandasi et al. (2011) dengan beberapa perubahan yang disesuaikan pada tujuan penelitian. S. mutans XC dengan konsentrasi awal 106 CFU/ml dipindahkan
sebanyak β00 μl ke dalam β4-multiwell plate lalu diinkubasi pada kondisi mikroaerofilik (kadar CO2 5%), suhu 37°C selama 2 jam (coating). Coating
dilakukan untuk mendapatkan biofilm awal sehingga dapat diketahui kemampuan pembentukan kembali biofilm oleh S.mutans setelah kontak dengan model uji. Model uji (K, CC1, dan CC2) yang telah dilarutkan dalam BHI broth (2:1) ditambahkan ke dalam 24-multiwell plate setelah coating kemudian diinkubasi kembali hingga 4 jam dan 6 jam. Setelah diinkubasi, semua cairan dalam plate dibuang sehingga hanya meninggalkan biofilm yang melekat pada dasar plate. Tiap plate kemudian dicuci sebanyak 3 kali dengan larutan PBS. Plate kemudian difiksasi di atas api agar biofilm melekat kuat pada plate lalu ditambahkan β00 μl
Gambar 5 Diagram alir analisis penghambatan penghambatan viabilitas massa biofilm dan ekspresi mRNA gtfB-gtfC
Setelah itu, cairan di dalam plate dibuang kemudian ditambahkan β00 μl etanol 95% sehingga didapat suspensi biofilm dalam etanol 95%. Suspensi yang
diperoleh dipindahkan sebanyak β00 μl ke dalam 96-multiwell plate untuk dibaca nilai OD-nya dengan microplate ELISA reader pada panjang gelombang 450 nm. Metode yang sama namun tanpa model uji diterapkan pada blanko yang hanya terdiri dari BHI broth. Blanko digunakan sebagai kalibrator untuk setiap
Stok S. Mutans XC
Diambil 1 ose, digoreskan pada BHI agar, dikondisikan mikroaerofilik (kadar CO2 5%) di dalam anaerobic jar,
diinkubasi selama 48 jam pada suhu 37 °C.
Diambil 2 koloni dan ditumbuhkan pada BHIbroth, dikondisikan mikroaerofilik di dalam anaerobic jar, diinkubasi kembali selama 24 jam pada suhu 37°C
Standarisasi konsentrasi bakteri menjadi 106 CFU/ml
200 μl dipipet ke dalam 24-multiwell plate, dikondisikan mikroaerofilik dalam anaerobic
jar, diikubasi selama 2 jam (coating) pada suhu 37°C.
perlakuan. Persentase penghambatan pembentukan massa biofilm pada K, CC1, dan CC2 ditentukan dengan persamaan berikut
Persen penghambatan = x 100%
Analisis Penghambatan Ekspresi mRNA gtfB dan gtfC Ekstraksi RNA Total
Sebanyak 1 ml S. mutans dengan konsentrasi 106 CFU/ml dipindahkan ke dalam 6-multiwell plate kemudian diinkubasi selama 2 jam (coating) pada suhu 37°C dengan kondisi mikroaerofilik (kadar CO2
Ekstraksi RNA total S.mutans dilakukan berdasarkan panduan Trizol 5%). Coating dilakukan untuk mendapatkan biofilm awal sehingga dapat diketahui kemampuan pembentukan kembali biofilm oleh S. mutans setelah kontak dengan model uji. Model uji K, CC1, dan CC2 yang telah dilarutkan dalam BHI broth (2:1) ditambahkan ke dalam 6-multiwell plate setelah coating, selanjutnya diinkubasi kembali hingga 4 dan 6 jam. Metode yang sama namun tanpa model uji diterapkan pada blanko yang hanya terdiri dari BHI broth. Blanko digunakan sebagai kalibrator untuk setiap perlakuan. Setelah proses inkubasi selesai, tahap persiapan selanjutnya adalah ekstraksi RNA total S.mutans.
®
Reagent yang digunakan. S. mutans dalam 6-multiwell plate disuspensikan dalam Trizol® Reagent. Suspensi dipindahkan ke dalam tube 1,5 ml lalu ditambahkan 0,2 ml chloroform per 1 ml Trizol®
Lapisan RNA dipindahkan ke dalam tube baru kemudian ditambahkan 0,5 ml isopropanol 100% per 1 ml Trizol
yang digunakan, dihomogenisasi dengan tangan selama 15 detik lalu dikondisikan pada suhu ruang selama 2-3 menit. Suspensi disentrifugasi pada suhu 4°C dengan kecepatan 12000 x g selama 15 menit sehingga diperoleh bagian RNA (lapisan paling atas).
®
Pelet RNA kemudian dicuci dengan 1 ml etanol 75% per 1 ml Trizol
yang digunakan, dikondisikan pada suhu ruang selama 10 menit kemudian disentrifugasi kembali pada suhu 4°C dengan kecepatan12000 x g selama 10 menit. Bagian supernatan kemudian dibuang sehingga hanya menyisakan pelet RNA.
®
Amplifikasi dalam RT-PCR memerlukan template DNA, maka RNA yang diperoleh harus diubah terlebih dahulu menjadi cDNA. Untuk itu, perlu ditentukan terlebih dahulu konsentrasi RNA dengan menggunakan spektrofotometer. MiliQ water sebanyak 500μl digunakan sebagai blanko. Masing-masing suspensi RNA dipipet 495 μl ke dalam cuvet lalu ditambahkan
5 μl miliQ water ke dalamnya lalu dibaca sebagai sampel.
Sintesis cDNA
Konsentrasi RNA yang digunakan ditetapkan sebesar 5 μg/μl. RNA total sebanyak 5 μl dipindahkan ke dalam tube PCR lalu ditambahkan random hexamers 50 ng/μl sebanyak 1 μl, 10mM dNTP mix sebanyak 1 μl, dan DEPC-water sebanyak 3 μl sehingga volume total yang diperoleh sebanyak 10 μl. Campuran kemudian diinkubasi dalam PCR pada suhu 65°C selama 5 menit, setelahnya langsung ditempatkan dalam kotak es selama 1 menit. Setelah itu ditambahkan ke dalam tube PCR: 10 x RT buffer sebanyak β μl, β5 mM MgCl2 sebanyak 4 μl, 0,1 M DTT sebanyak β μl, RNase OUT (40U/μl) sebanyak 1 μl, dan Superscript III RT (β00U/μl) sebanyak 1 μl. Setelah ditambahkan, campuran kemudian diinkubasi kembali pada suhu 25°C selama 10 menit, dilanjutkan pada suhu 50°C selama 50 menit lalu diterminasi pada suhu 85°C selama 5 menit. Kemudian ditambahkan 1 μl RNase H ke dalam masing-masing tube dan diinkubasi kembali selama 20 menit pada suhu 37°C. Hasil cDNA disimpan pada suhu -20°C atau langsung digunakan untuk analisis dengan RT-PCR.
Penentuan Level Ekspresi mRNA gtfB dan gtfC
Amplifikasi, deteksi, dan analisis mRNA dilakukan dengan AB Applied RT-PCR dengan SYBR Green RT-PCR master mix yang disesuaikan. cDNA yang diperoleh diencerkan terlebih dahulu dengan DEPC-water sehingga didapat konsentrasi cDNA sebesar 50 ng. Disiapkan campuran pereaksi terdiri dari 5 μl SYBR Green PCR master mix, 1 μl forward primer gen (10μM), 1 μl reverse primer gen (10μM), dan 1 μl ddH2O. Campuran pereaksi yang telah disiapkan
kemudian dipindahkan sebanyak 8 μl ke dalam tube PCR baru, lalu ditambahkan
β μl cDNA (50 ng) sehingga diperoleh volume total dalam tube sebanyak 10 μl. Campuran yang telah disiapkan kemudian disentrifugasi dengan kecepatan 2000 rpm selama 1 menit sebelum dianalisis dengan RT-PCR.
Tabel 4 Sekuen nukleotida primer mRNA gtfB, mRNA gtfC, dan housekeeping gene (mRNA 16S rRNA)
mRNA Sekuens Primer (5’-3’)
Forward Reverse
gtfB AGCAATGCAGCCAATCTACAAAT ACGAACTTTGCCGTTATTGTCA gtfC GGTTTAACGTCAAAATTAGCTGTATTAGC CTCAACCAACCGCCACTGTT
16S Rrna CCGCCTAAGGTGGGATAGATGATT ACCTTCCGATACGGCTACCTTGTTAC
Sumber: Shemesh et al. (2007).
Selanjutnya dilakukan amplifikasi di dalam PCR dengan program awal sebagai berikut. Periode denaturasi pada suhu 95°C selama 10 menit, diikuti 40 siklus amplifikasi masing-masing pada suhu 95°C selama 15 detik dan annealing pada suhu 60°C selama 1 menit, dilanjutkan proses melting dengan menaikkan suhu kembali 95°C selama 15 detik lalu suhu diturunkan kembali hingga 60°C, ditahan selama 1 menit, lalu suhu dinaikkan kembali hingga 95°C selama 15 detik. Selama proses analisis dengan RT-PCR berlangsung, dilakukan pengamatan terhadap nilai Ct
Dalam penelitian ini, mRNA gtfB dan gtfC merupakan mRNA target dan mRNA16S Rrna S. mutans sebagai standar internal (mRNA referensi). Level
ekspresi mRNA gtfB dan gtfC pada blanko dijadikan kalibrator bagi K, CC1, dan CC2. Level ekspresi mRNA gtfB dan gtfC diperoleh dengan rumus berikut
ΔCт (kalibrator) = CтmRNA target - Cт mRNA referensi ΔCт (sampel) = CтmRNA target - Cт mRNA referensi
∆ΔCт (sampel) = ΔCт (sampel) - ΔCт (kalibrator)
Level Ekspresi mRNA = 2(-∆ΔCт)
HASIL DAN PEMBAHASAN
Komposisi Senyawa Volatil
Hasil analisis senyawa volatil dengan GC-MS pada Tabel 5, menunjukkan bahwa berdasarkan nilai LRI-nya terdapat 22 senyawa volatil dalam ekstrak kayu putih dan 17 senyawa volatil dalam ekstrak peppermint yang terdeteksi. Ekstrak kayu putih teridentifikasi mengandung senyawa utama berturut-turut: 1,8-sineol (47,61%), α-terpineol (10,76%), α-karyofilen (7,91%), -terpinen (5,78%),
terpinyl asetat (4,09%), α-pinen (3,90%), p-cymene (3,75%), dan terpinolen (3,52%). Sedangkan ekstrak peppermint teridentifikasi mengandung senyawa volatil utama berturut-turut: mentol (32,53%), menton (15,60%), isomenton (11,87%), metil salisilat (10,86%), D-limonen (10,07%), -pinen (3,77%), dan α -pinen (3,09%).
Senyawa volatil dari ekstrak kayu putih yang digunakan dalam penelitian ini menegaskan hasil penelitian sebelumnya oleh Muchtaridi et al. (2004) yang melaporkan bahwa senyawa volatil utama yang terdapat dalam minyak kayu putih adalah 1,8-sineol (22,45%), α-terpineol (12,45%), dan E-karyofilena (6,9%). Hasil analisis senyawa volatil terhadap ekstrak peppermint dalam penelitian ini menegaskan hasil penelitian Leung, (1980) bahwa senyawa volatil utama dalam minyak peppermint adalah mentol (29-48%) dan menton (20-31%).
Berdasarkan Tabel 5, diketahui bahwa terdapat 14 senyawa volatil pada CC1 dan 18 senyawa volatil terdapat pada CC2. Senyawa volatil yang masih terdapat pada pada CC1 adalah 1,8-sineol (39,26%), α-terpineol (19,63%), dan
α-karyofilen (17,90%). Senyawa volatil pada CC2 adalah mentol (23,47%),
α-terpineol (17,57%), 1,8-sineol (14,94%), α-karyofilen (13,46%), menton (7,80%), dan isomenton (7,65%).
Model uji CC1 hanya menggunakan ekstrak kayu putih sebagai komponen flavor sehingga senyawa volatil utama yang terdapat di dalamnya tidak berbeda dari ekstrak kayu putih yaitu 1,8-sineol dan α-terpineol. Model uji CC2 yang menggunakan ekstrak kayu putih dan peppermint sebagai komponen flavor, mengandung senyawa volatil utama berupa mentol dan α-terpineol. Senyawa volatil 1,8-sineol yang merupakan senyawa volatil utama dari ekstrak kayu putih, mendominasi komposisi senyawa volatil dalam CC1 dan persentase rasionya cukup besar dalam CC2. Namun, aktivitas antimikroba dari 1,8-sineol dilaporkan sangat lemah oleh Inouye et al. (2001), hasil penelitiannya menunjukkan bahwa
Tabel 5 Senyawa volatil (dalam rasio) dari ekstrak kayu putih, ekstrak peppermint, cajuput candy non sukrosa (CC1), dan cajuputs candy non sukrosa (CC2) yang terdeteksi
No. Nama senyawa Ekstrak kayu putih (EKP)
Selain itu, dilaporkan bahwa aktivitas antimikroba α-terpineol pada minyak kayu putih setara dengan mentol pada minyak peppermint. Keberadaan senyawa volatil dalam model uji CC1 dan CC2 diharapkan mampu menghambat aktivitas pembentukan biofilm oleh S. mutans dengan menghambat ekspresi enzim pembentuk biofilm, sesuai dengan yang dilaporkan oleh Gronroos (2000) bahwa senyawa volatil yang dilepaskan oleh minyak atsiri dapat mengganggu sistem pertahanan mikroba dengan cara menghambat kerja enzim di dalam sel.
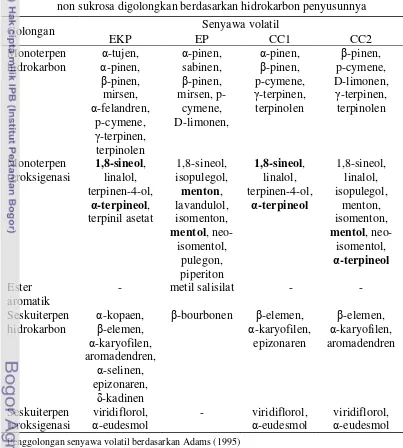
Tabel 6 Hasil analisis senyawa volatil ekstrak kayu putih (EKP), ekstrak peppermint (EP), cajuput candy non sukrosa (CC1), dan cajuputs candy non sukrosa digolongkan berdasarkan hidrokarbon penyusunnya
Golongan Senyawa volatil
Penggolongan senyawa volatil berdasarkan Adams (1995)
CC1, dan model uji CC2 merupakan golongan monoterpen teroksigenasi. Dominasi senyawa volatil dari golongan monoterpen teroksigenasi pada ekstrak kayu putih dan peppermint diduga disebabkan oleh derajat kelarutan monoterpen teroksigenasi dalam pelarut n-heksana lebih tinggi daripada monoterpen hidrokarbon, seperti yang dilaporkan oleh Wartini (2009) bahwa senyawa volatil golongan monoterpen teroksigenasi dari ekstrak flavor daun salam dalam pelarut n-heksana relatif lebih banyak jumlahya daripada monoterpen hidrokarbon.
Berdasarkan Tabel 6, senyawa volatil dari golongan monoterpen teroksigenasi pada model uji CC2 lebih beragam daripada CC1. Dominasi senyawa volatil dari golongan monoterpen teroksigenasi pada model uji CC2 diharapkan dapat memberikan aktivitas antimikroba yang lebih baik daripada model uji CC1, sebab menurut Carson dan Riley (1995) monoterpen teroksigenasi sangat signifikan lebih aktif sebagai antimikroba dibandingkan dengan monoterpen hidrokarbon pada ekstrak Melaleuca alternifolia.
Senyawa volatil 1,8-sineol, α-terpineol, menton, dan mentol tergolong monoterpen teroksigenasi karena memiliki atom oksigen (O) pada struktur bangunnya. Berdasarkan gugus fungsinya, maka 1,8-sineol termasuk monoterpen
eter, menton tergolong monoterpen keton, sedangkan α-terpineol dan mentol merupakan monoterpen alkohol. Aktivitas antimikroba senyawa volatil dari golongan monoterpen alkohol dilaporkan oleh Inouye et al. (2001) tidak lebih tinggi dari golongan terpen aldehid, namun lebih tinggi daripada terpen keton, terpen eter, dan terpen hidrokarbon. Dengan ini, dapat diduga bahwa model uji CC2 yang mengandung senyawa volatil utama dari golongan monoterpen alkohol memiliki aktivitas antimikroba yang tidak lebih baik daripada model uji CC1 yang mengandung senyawa volatil utama dari golongan terpen eter.
Gambar 6 Struktur bangun 1,8-sineol (a), α-terpineol (b), menton (c), mentol (d)
Senyawa volatil pada CC1 dan CC2 yang memiliki gugus hidroksil seperti
α-terpineol dan mentol diduga berperan terhadap terganggunya permeabilitas membran, seperti yang dilaporkan oleh Lambert et al. (2001) bahwa senyawa volatil thymol dan carvacrol yang memiliki gugus hidroksil mampu mengganggu permeabilitas sel bakteri. Terganggunya permeabilitas sel bakteri oleh keberadaan senyawa volatil dengan gugus hidroksil dilaporkan Ultee et al. (2000) disebabkan oleh bergabungnya senyawa volatil yang memiliki gugus hidroksil dengan rantai asam lemak kemudian menyebabkan ketidakstabilan membran sel. Senyawa volatil yang memiliki gugus karbonil seperti menton pada model uji CC2, diduga berperan terhadap penghambatan dekarboksilasi asam amino dengan mengikat sisi protein bakteri, seperti yang telah dilaporkan oleh Wendakoon dan Sakaguchi (1995).
(d) (c)
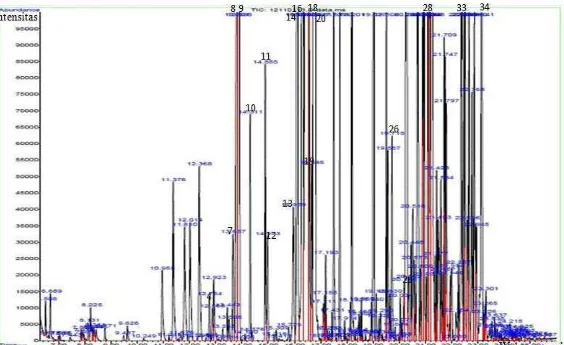
Gambar 7 Kromatogram senyawa volatil dari ekstrak kayu putih, (kode angka yang digunakan mengacu pada nama senyawa volatil di dalam Tabel 5)
2
Gambar 9 Kromatogram senyawa volatil dalam cajuput candy non sukrosa atau CC1, (kode angka yang digunakan mengacu pada nama senyawa volatil di dalam Tabel 5)
2
Penghambatan Aktivitas Pembentukan Biofilm
Penghambatan Viabilitas Massa Biofilm
Penghambatan aktivitas S. mutans dalam pembentukan biofilm ditandai dengan terhambatnya viabilitas massa biofilm oleh S. mutans yang dapat dikonfirmasi dengan terhambatnya ekspresi mRNA gtfB dan gtfC bakteri tersebut selama masa inkubasi 2, 4, dan 6 jam. Semakin banyak massa biofilm yang dibentuk maka semakin tinggi nilai Optical Density (OD) yang ditandai dengan semakin tingginya absorbasi suspensi biofilm (Honda 2005). Besarnya nilai OD hasil pengamatan dalam penelitian ini dapat dirujuk pada Lampiran 17. Pada penelitian ini, pengamatan penghambatan viabilitas massa biofilm berarti mengamati massa biofilm yang menempel pada permukaan multiwell plate saja, tidak termasuk massa biofilm pada fase planktoniknya. Potensi penghambatan pembentukan massa biofilm menunjukkan efektivitas model uji dalam menghambat aktivitas pembentukan biofilm oleh S. mutans.
Tabel 7 Persentase penghambatan viabilitas massa biofilm oleh kontrol (K), cajuput candy non sukrosa (CC1), dan cajuputs candy non sukrosa (CC2)
Masa inkubasi Penghambatan (%)
Kontrol CC1 CC2
4 jam 63,98 48,34 65,64
6 jam 29,14 31,13 44,37
Berdasarkan hasil analisis penghambatan viabilitas massa biofilm pada Tabel 7, dapat diketahui bahwa penghambatan pembentukan massa biofilm paling optimum adalah hingga masa inkubasi 4 jam. Setelah masa inkubasi 4 jam terlewati, yaitu pada masa inkubasi 6 jam, kemampuan penghambatan viabilitas massa biofilm kurang dari 50%. Hasil ini menunjukkan bahwa aktivitas penghambatan viabilitas massa biofilm optimum oleh CC1 dan CC2 terjadi pada awal fase logaritmik karena massa biofilm yang dihasilkan masih sangat lemah sehingga pelekatan massa biofilm pada permukaan multiwell plate dapat dihambat. Hasil penelitian ini sejalan dengan yang dilaporkan oleh Beckers dan Hoeven (1982) bahwa aktivitas pembentukan biofilm oleh S. mutans pada kondisi normal sudah dimulai 2 jam setelah bakteri ditumbuhkan dengan kondisi biofilm pada awal fase log masih sangat lemah. Penghambatan viabilitas massa biofilm menurun pada masa inkubasi 6 jam, diduga hasil ini disebabkan massa biofilm yang dibentuk oleh S. mutans memasuki tahap pematangan sehingga lebih sulit dihambat viabilitasnya, seperti yang dilaporkan oleh Mikx dan Svanberg (1978) bahwa pada akhir fase log, biofilm melekat lebih kuat dan mulai memasuki tahap pematangan.