KETAHANAN DAN PERTUMBUHAN
BEBERAPA STRAIN NILA PADA MEDIA BER-pH ASAM
SRI SUKMAWARDANI HERMIATI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
SRI SUKMAWARDANI HERMIATI. Ketahanan dan Pertumbuhan Beberapa
Strain Ikan Nila pada Media Ber-pH Asam. Dibimbing oleh EDDY SUPRIYONO dan HARTON ARFAH.
Budidaya perikanan di daratan harus terus ditingkatkan akibat dari penggunaan wilayah daratan untuk berbagai aspek kehidupan. Lahan gambut tersebar di beberapa pulau di Indonesia. Namun masih sangat minim pemanfaatannya dalam bidang perikanan, karena memiliki tingkat keasaman yang tinggi dengan warna air kehitaman dan dengan kandungan oksigen yang rendah. Gambut tropika biasanya bersifat masam dengan kisaran pH sebesar 4 sampai 5. Penelitian ini bertujuan untuk mengkaji pemanfaatan air ber-pH asam sebagai media budidaya untuk pembesaran beberapa strain ikan nila, serta menentukan strain ikan nila yang memiliki ketahanan terhadap pH asam ditinjau dari kelangsungan hidup, pertumbuhan panjang dan bobot, efisiensi pakan, dan histologi insang ikan nila berbagai strain yang dipelihara di media ber-pH asam. Hasil penelitian menunjukkan ikan nila strain BEST dan GIFT tidak dapat bertahan hidup, yaitu tingkat kelangsungan hidup sebesar 0%. Sedangkan yang dapat bertahan hidup pada media asam adalah ikan nila Merah, dengan tingkat kelangsungan hidup sebesar 30%, laju pertumbuhan bobot 1,34±1,20%, laju pertumbuhan panjang 0,66±0,40%, dan efisiensi pakan 45,26±22,56% selama 30 hari pemeliharaan. Perlakuan pH asam pada media dapat menyebabkan kerusakan lamella insang, yaitu kerusakan berupa hiperplasia, hipertropi, fusi, nekrosis, hemorrage, dan lapisan epitel terangkat dengan tingkat kerusakan berbeda.
ABSTRACT
SRI SUKMAWARDANI HERMIATI. Resilience and Growth Some Tilapia
Strains in Acid Media. Supervised by EDDY SUPRIYONO and HARTON ARFAH.
Aquaculture in the mainland should be improved as a result of the use of land areas for various aspects of life. Peatlands spread across several islands in Indonesia. The utilization of peat lands for aquaculture activity is still low, because it have caracteristic high acidity level, black color water and low oxygen content. Tropical peatlands are typically sour with a pH range of 4 to 5. The objective of study is to determine utilization of acidic water as a medium of several strains of tilapia farming, analyze tilapia strains that have resistance to acid pH in terms of survival, length and weight growth, feed efficiency, and gills of tilapia histology various strains were maintained in acidic water. The results of research showed thatBEST tilapia and GIFT strains couldn’t survive. It’s showed by 0% of survival rate. Red tilapia strain could survive in the media's treatment of acid, the survival rate was 30%, specific growth rate was 1.34 ± 1.20%, length growth rate of 0.66 ± 0.40%, with a feed efficiency of 45.26 ± 22.56% for 30 days. The acidity treatment on media could caused damaged in gill lamella include the damage such as hypertrophy, hyperplasia, fuse, necrosis, hemorrage, and epithelial lining up with different levels of damage.
KETAHANAN DAN PERTUMBUHAN
BEBERAPA STRAIN NILA PADA MEDIA BER-pH ASAM
SRI SUKMAWARDANI HERMIATI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
KETAHANAN DAN PERTUMBUHAN BEBERAPA STRAIN NILA PADA MEDIA BER-pH ASAM
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Oktober 2011
Judul Skripsi : Ketahanan Dan Pertumbuhan Beberapa Strain Nila Pada Media Ber-pH Asam
Nama Mahasiswa : Sri Sukmawardani Hermiati Nomor Pokok : C14070010
Disetujui
Pembimbing I
Dr. Ir. Eddy Supriyono, M. Sc NIP. 19630212 198903 1 003
Pembimbing II
Ir. Harton Arfah, M. Si. NIP. 19661111 1991103 1 003
Mengetahui
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M. Sc. NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia, taufik, dan hidayah-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2011 sampai dengan Juni 2011 adalah lingkungan ikan, dengan judul ”Ketahanan dan Pertumbuhan Beberapa Strain Nila pada Media Asam”.
Penulis mengucapkan terima kasih kepada Dr. Ir. Eddy Supriyono, M. Sc. dan Ir. Harton Arfah, M. Si. selaku dosen pembimbing, serta Dr. Sri Nuryati, M. Si. selaku dosen penguji atas arahan dan masukan yang telah diberikan dalam penyusunan skripsi ini. Disamping itu, penulis menyampaikan terimakasih kepada kedua orang tua, Bapak Suhermin dan Ibu Sri Sukmawati, kakak penulis Sukma Adhyanto Hermansyah SE., serta rekan-rekan yang selalu memberikan do’a, semangat, dan kasih sayangnya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan karena keterbatasan pengetahuan dan wawasan penulis. Oleh karena itu, penulis mengharapkan saran, masukan, dan kritikan untuk perbaikan hasil penelitian di kemudian hari. Semoga skripsi ini dapat bermanfaat.
Bogor, Oktober 2011
Sri Sukmawardani Hermiati
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada tanggal 3 Maret 1989 dari Bapak Suhermin dan Ibu Sri Sukmawati. Penulis merupakan anak kedua dari dua bersaudara.
Pendidikan formal yang dilalui penulis adalah SMAN 1 Sindang Indramayu dan lulus tahun 2007. Pada tahun yang sama, penulis diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) dan memilih mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, dengan minor Kewirausahaan Agribisnis, Institut Pertanian Bogor.
Selama mengikuti perkuliahan, penulis pernah melaksanakan praktek lapang pembenihan ikan bawal bintang di Balai Budidaya Laut Batam. Penulis juga pernah menjadi asisten pada mata kuliah Fisika Kimia Perairan 2010/2011 dan Manajemen Kualitas Air 2011. Pada tahun 2009 penulis melaksanakan Program Kreatifitas Mahasiswa yang didanai berjudul Penggunaan Tepung Tapioka dalam Pengembangan Teknologi Bio-Flocs pada Budidaya Ikan Bawal Colossoma macropomum. Selain itu penulis juga aktif menjadi anggota Music Agriculture Expression (MAX!!) periode 2008- sekarang, anggota Gentra Kaheman periode 2007- sekarang.
DAFTAR ISI
2.3.1 Laju Pertumbuhan Bobot Spesifik Harian ... 5
2.3.2 Kelangsungan Hidup ... 5
3.1.1 Tingkat Kelangsungan Hidup ... 7
3.1.2 Laju Pertumbuhan Bobot Spesifik Harian ... 9
3.1.3 Pertambahan Panjang Mutlak ... 10
DAFTAR TABEL
Halaman
1 Hasil analisis perubahan struktur insang ikan nila O. niloticus pada masa pemeliharaan dalam media asam ...
DAFTAR GAMBAR
Halaman
1 Kelangsungan hidup ikan nila O. niloticus strain BEST pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 ... 7 2 Kelangsungan hidup ikan nila O. niloticus strain GIFT pada media
pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 .. ... 8 3 Kelangsungan hidup ikan nila O. niloticus strain Merah pada media
pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 .. ... 8 4 Laju pertumbuhan bobot spesifik harian ikan nila O. niloticus strain
BEST pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 .. ... 9 5 Laju pertumbuhan bobot spesifik harian ikan nila O. niloticus strain
GIFT pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 .. ... 9 6 Laju pertumbuhan bobot spesifik harian ikan nila O. niloticus strain
Merah pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 ... 10 7 Laju pertambahan panjang harian ikan nila O. niloticus strain BEST
pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30.. .. 11 8 Laju pertambahan panjang harian ikan nila O. niloticus strain GIFT pada
media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30 ... 11 9 Laju pertambahan panjang harian ikan nila O. niloticus strain Merah
pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30.. .. 12 10 Efisiensi pakan ikan nila O. niloticus strain BEST pada media
pemeliharaan asam dan normal selama 30 hari .. ... 12 11 Efisiensi pakan ikan nila O. niloticus strain GIFT pada media
pemeliharaan asam dan normal selama 30 hari .. ... 13 12 Efisiensi pakan ikan nila O. niloticus strain Merah pada media
pemeliharaan asam dan normal selama 30 hari .. ... 13 13 Kerusakan insang nila BEST pada media asam; 1a pada awal
pemeliharaan dan 1b pada hari ke-15 ... 15 14 Kerusakan insang nila GIFT pada media asam; 2a pada awal
15 Kerusakan insang nila Merah pada media asam; 3a pada awal pemeliharaan, 3b pada hari ke-15 dan 3c pada hari ke-30 ... 16 16 Nilai harian pH dalam media pemeliharaan pada ikan nila strain BEST,
Merah, dan GIFT ... 17 17 Nilai harian suhu dalam media pemeliharaan pada ikan nila strain
BEST, Merah, dan GIFT ... 17 18 Nilai karbondioksida dalam media pemeliharaan pada ikan nila strain
BEST, Merah, dan GIFT ... 18 19 Nilai alkalinitas dalam media pemeliharaan pada ikan nila strain BEST,
Merah, dan GIFT ... 19 20 Nilai TAN dalam media pemeliharaan pada ikan nila strain BEST,
Merah, dan GIFT ... 19 21 Nilai DO dalam media pemeliharaan pada ikan nila strain BEST, Merah,
dan GIFT ... 19 22 Nilai kekeruhan dalam media pemeliharaan pada ikan nila strain BEST,
DAFTAR LAMPIRAN
Halaman
1 Tahapan Pembuatan Preparat Histologi ... 31
2 Rumus perhitungan laju pertumbuhan bobot spesifik harian (SGR), pertambahan panjang mutlak, efisiensi pakan, dan kelangsungan hidup (SR) ... 33
3 Pengaruh perlakuan terhadap beberapa parameter uji ... 34
4 Kisaran parameter kualitas air ... 34
I. PENDAHULUAN
Budidaya perikanan di daratan harus terus ditingkatkan akibat dari penggunaan wilayah daratan untuk berbagai aspek kehidupan. Contohnya adalah penggunaan wilayah daratan untuk pemukiman, perkantoran, dan wilayah perkotaan. Untuk itu masih diperlukan suatu tindakan untuk peningkatan sektor budidaya perikanan sebagai pemenuh kebutuhan pangan masyarakat yang terus meningkat setiap tahunnya. Menurut Statistik Indonesia (2007), luas usaha perikanan budidaya di kolam air tawar meningkat secara nyata yaitu 99.740 Ha pada tahun 2004 menjadi 107.785 Ha pada tahun 2005. Sebenarnya masih terdapat potensi untuk melakukan ekstensifikasi budidaya perikanan di daratan diantaranya adalah dengan memanfaatkan lahan gambut.
Visi Indonesia sebagai penghasil produk kelautan dan perikanan terbesar 2015, dilakukan dengan memprioritaskan budidaya ikan sebagai andalan dengan kenaikan produksi mencapai 353% sampai 2014 dan menetapkan ikan nila sebagai salah satu unggulan (Direktorat Jendral Perikanan Budidaya, 2010). Oleh karena itu, perlu dilakukan adanya uji beberapa strain ikan nila pada media dengan tingkat keasaman relatif tinggi seperti halnya kawasan pada lahan gambut sehingga dapat diketahui jauh adaptasi masing-masing strain ikan nila terhadap pH asam berdasarkan kelangsungan hidup, pertumbuhan, jumlah konsumsi pakan, efisiensi pakan, dan histologi insang dari nila tersebut.
II. METODOLOGI PENELITIAN
2.1 Bahan Penelitian
Ikan nila (Oreochromis niloticus) yang digunakan adalah ikan nila strain GIFT merupakan hasil pemuliaan berasal dari Instalasi Tiset Plasma Nutfah, Cijeruk dengan ukuran panjang rata-rata 4,30±0,44cm dan bobot 1,61±0,52 gram, ikan nila BEST berasal dari danau Lido milik Balai Riset Perikanan Budidaya Air Tawar (BRPBAT) Bogor dengan ukuran panjang rata-rata 3,68±0,46 cm dan bobot 0,98±0,32 gram, dan ikan nila merah jenis red NIFI (National Inland Fishery Institute) juga diambil dari danau Lido milik Balai Riset Perikanan Budidaya Air Tawar (BRPBAT) Bogor dengan ukuran panjang rata-rata 4,57±0,70 cm dan bobot 1,74±0,56 gram. Jumlah ikan yang ditebar dalam akuarium sebanyak 10 ekor per akuarium, dan diberi pakan buatan (pellet) yang diberikan 3 kali sehari pada pukul 08.00, 13.00, dan 17.00 dengan metode pemberian pakan tetap diberikan secara at satiation.
Wadah yang digunakan dalam penelitian berupa akuarium berukuran 20x20x20 cm sebanyak 18 unit dengan tahapan persiapan wadah meliputi pencucian akuarium, pengeringan akuarium, dan pengisian air. Pencucian akuarium dilakukan dengan menggunakan detergen untuk menghilangkan lumut atau kotoran-kotoran yang menempel pada dinding akuarium. Kemudian setiap wadah diisi dengan air setinggi 10 cm yang sebelumnya telah diendapkan dan diaerasi dalam tandon selama beberapa hari. Setiap akuarium dilengkapi dengan sistem aerasi satu titik pada setiap akuarium yang besumber dari hi-blow.
ber-pH asam dan ber-pH normal dengan perbandingan 1:1. Kualitas air dikelola dengan dilakukannya penyiponan kotoran dan air pemeliharaan diganti setiap 10 hari sekali (Rahmawati, 2009).
Preparat histologi organ insang difiksasi terlebih dahulu dengan larutan Bouin’s selama 24 jam untuk mencegah pembusukkan jaringan. Setelah itu dilakukan tahap dehidrasi dengan menggunaka alkohol 70% selama 24 jam, kemudian direndam dengan alkohol berturut-turut 80, 90, 95, dan 95% masing-masing selama 2 jam dan dilanjutkan direndam alkohol 100% selama 12 jam. Tahap selanjutnya adalah clearing, yaitu jaringan direndam dengan xylol alkohol selama 30 menit, kemudian direndam dengan xylol I, xylol II, xulol III masing-masing selama 30 menit. Kemudian tahap impregnasi, yaitu jaringan direndam dalam paraffin I, paraffin II, paraffin III dalam oven dengan suhu 65-70o C masing-masing selama 45 menit. Setelah itu dilakukan blocking dengan dicetaknya jaringan, kemudian baru dapat dilakukan pencetakkan dan pewarnaan dengan Hematoksilin Eosin. Preparat histologi diamati di bawah mikroskop dengan perbesaran 400x. jaringan insang yang dibuat preparat histologi memiliki ketebalan 5 mikron (Lampiran 1).
2.2 Metode Penelitian 2.2.1 Rancangan Percobaan
Penelitian dilakukan menggunakan rancangan acak lengkap (RAL) dengan enam perlakuan dan setiap perlakuan menggunakan tiga ulangan, yaitu:
1. Perlakuan menggunakan ikan nila BEST dengan media asam 2. Perlakuan menggunakan ikan nila merah dengan media asam 3. Perlakuan menggunakan ikan nila GIFT dengan media asam 4. Perlakuan menggunakan ikan nila BEST dengan media normal 5. Perlakuan menggunakan ikan nila merah dengan media normal 6. Perlakuan menggunakan ikan nila GIFT dengan media normal
ij Yij=μ+τ+ε Keterangan:
Yij = Data perlakuan ke-i dan ulangan ke-j µ = Nilai tengah data
τ = Pengaruh perlakuan ke-I = 1, 2, 3,….,n ij
ε = Kesalahan perlakuan percobaan pada perlakuan ke-I dan ulangan ke-j
2.2.2 Analisis Data
Data yang didapatkan dianalisis menggunakan Microsoft Excel 2007, yang meliputi:
1.Analisis keragaman dengan one way anova dengan selang kepercayaan 95%, digunakan untuk mengetahui pengaruh antar perlakuan pada derajat kelangsungan hidup.
2.Untuk melihat pengaruh perlakuan terhadap laju pertumbuhan harian, diambil data individu sebagai ulangan dengan bobot dan panjang awal yang seragam.
3.Analisis deskripsi yang digunakan untuk melihat kelayakan air pemeliharaan, membaca keterangan kematian pada ikan yang disajikan dalam bentuk gambar dan tabel.
2.3 Parameter yang Diamati
2.3.1 Laju Pertumbuhan Bobot Spesifik Harian (SGR)
Laju Pertumbuhan harian adalah laju pertumbuhan bobot individu dalam persen (%). Laju pertumbuhan harian dihitung dengan menggunakan rumus (Huisman, 1987).
2.3.2 Kelangsungan Hidup
2.3.3 Laju Pertumbuhan Panjang Harian
Laju pertumbuhan panjang harian adalah laju pertumbuhan panjang individu dalam persen (%). Laju pertumbuhan panjang harian dihitung dengan menggunakan rumus (Huisman, 1987).
2.3.4 Efisiensi Pakan
Efisiensi pemberian pakan menunjukkan seberapa banyak pakan yang dimanfaatkan oleh ikan dari total pakan yang diberikan. Efisiensi pakan dihitung dengan menggunakan rumus (Zonneveld et al., 1991)
2.3.5 Pengamatan Histologi
Preparasi histologi dibuat dengan sampel organ insang setiap strain yang digunakan dalam penelitian. Sampling dilakukan setiap 15 hari sekali sebanyak satu setiap akuarium. Pengamatan histologi dilakukan dengan tujuan untuk mengetahui kerusakan yang terjadi pada insang yang diakibatkan oleh perlakuan pH rendah. Beberapa kerusakan lamella pada insang diantaranya hipertropi, hiperplasia, fusi, nekrosis, hemorrage dan lapisan epitel terangkat (Roberts, 1978).
2.3.6 Pengukuran Kualitas Air
Pengukuran kualitas air meliputi parameter fisika kimia air, diukur setiap hari untuk parameter suhu dan pH sedangkan parameter lainnya diukur setiap 10 hari sekali, yaitu oksigen terlarut (DO), TAN, alkalinitas, CO2 bebas, dan
kekeruhan. Pengukuran suhu dilakukan dengan menggunakan thermometer dan pH dilakukan dengan pH-pen. Amoniak diukur dengan menggunakan metode phenat (spektrofotometer), kekeruhan diukur dengan alat turbiditimeter, oksigen terlarut diukur dengan DO meter, sedangkan alkalinitas dan CO2 bebas diukur
III. HASIL DAN PEMBAHASAN
3.1 Hasil
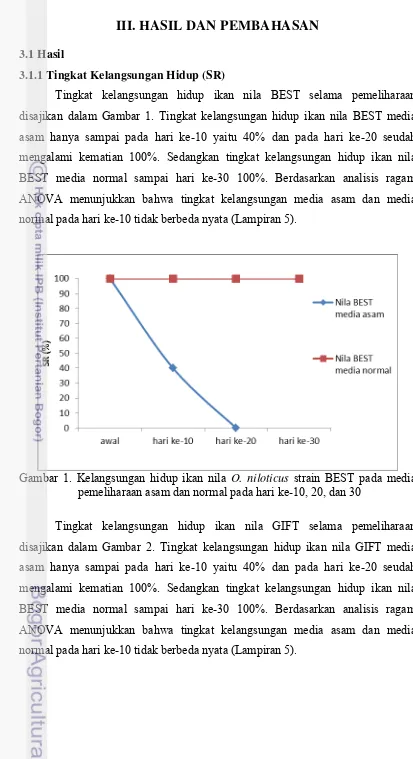
3.1.1 Tingkat Kelangsungan Hidup (SR)
Tingkat kelangsungan hidup ikan nila BEST selama pemeliharaan disajikan dalam Gambar 1. Tingkat kelangsungan hidup ikan nila BEST media asam hanya sampai pada hari ke-10 yaitu 40% dan pada hari ke-20 seudah mengalami kematian 100%. Sedangkan tingkat kelangsungan hidup ikan nila BEST media normal sampai hari ke-30 100%. Berdasarkan analisis ragam ANOVA menunjukkan bahwa tingkat kelangsungan media asam dan media normal pada hari ke-10 tidak berbeda nyata (Lampiran 5).
Gambar 1. Kelangsungan hidup ikan nila O. niloticus strain BEST pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
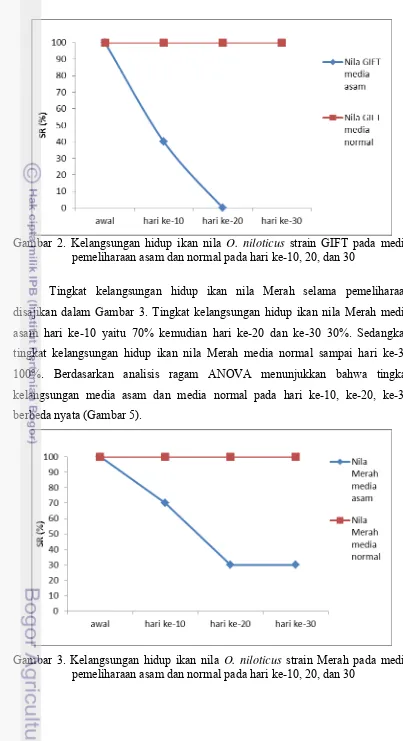
Gambar 2. Kelangsungan hidup ikan nila O. niloticus strain GIFT pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
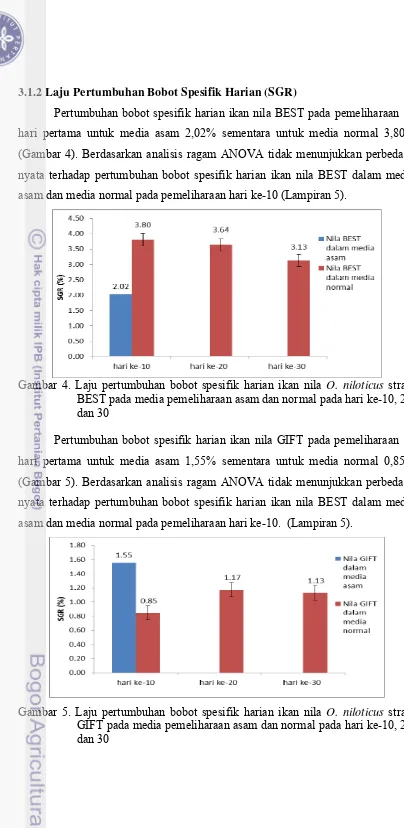
Tingkat kelangsungan hidup ikan nila Merah selama pemeliharaan disajikan dalam Gambar 3. Tingkat kelangsungan hidup ikan nila Merah media asam hari ke-10 yaitu 70% kemudian hari ke-20 dan ke-30 30%. Sedangkan tingkat kelangsungan hidup ikan nila Merah media normal sampai hari ke-30 100%. Berdasarkan analisis ragam ANOVA menunjukkan bahwa tingkat kelangsungan media asam dan media normal pada hari ke-10, ke-20, ke-30 berbeda nyata (Gambar 5).
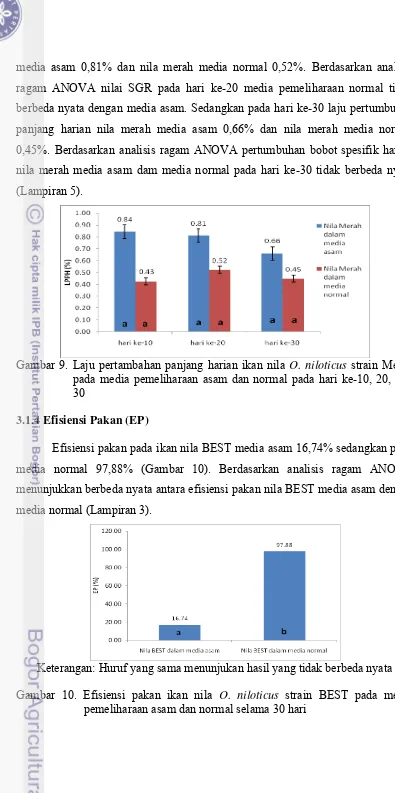
3.1.2 Laju Pertumbuhan Bobot Spesifik Harian (SGR)
Pertumbuhan bobot spesifik harian ikan nila BEST pada pemeliharaan 10 hari pertama untuk media asam 2,02% sementara untuk media normal 3,80% (Gambar 4). Berdasarkan analisis ragam ANOVA tidak menunjukkan perbedaan nyata terhadap pertumbuhan bobot spesifik harian ikan nila BEST dalam media asam dan media normal pada pemeliharaan hari ke-10 (Lampiran 5).
Gambar 4. Laju pertumbuhan bobot spesifik harian ikan nila O. niloticus strain BEST pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
Pertumbuhan bobot spesifik harian ikan nila GIFT pada pemeliharaan 10 hari pertama untuk media asam 1,55% sementara untuk media normal 0,85% (Gambar 5). Berdasarkan analisis ragam ANOVA tidak menunjukkan perbedaan nyata terhadap pertumbuhan bobot spesifik harian ikan nila BEST dalam media asam dan media normal pada pemeliharaan hari ke-10. (Lampiran 5).
Pertumbuhan bobot spesifik harian ikan nila strain Merah pada pemeliharaan 10 hari pertama yaitu pada media asam 0,97% sementara pada media normal 2,07% (Gambar 6). Berdasarkan analisis ragam ANOVA menunjukkan, perlakuan media normal berbeda nyata dengan perlakuan media asam (Lampiran 5). Hari ke-20 pemeliharaan nilai pertumbuhan bobot spesifik harian nila merah media asam 1,31% dan nila merah media normal 1,67%. Berdasarkan analisis ragam ANOVA nilai SGR pada hari ke-20 media pemeliharaan normal tidak berbeda nyata dengan media asam. Sedangkan pada hari ke-30 pertumbuhan bobot spesifik harian nila merah media asam 1,34% dan nila merah media normal 1,41%. Berdasarkan analisis ragam ANOVA pertumbuhan bobot spesifik harian nila merah media asam dan media normal pada hari ke-30 tidak berbeda nyata (Lampiran 5).
Keterangan: Huruf yang sama menunjukan hasil yang tidak berbeda nyata Gambar 6. Laju pertumbuhan bobot spesifik harian ikan nila O. niloticus strain
Merah pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
3.1.3 Pertambahan Panjang Mutlak
Gambar 7. Laju pertambahan panjang harian ikan nila O. niloticus strain BEST pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
Laju pertumbuhan panjang harian hari ke-10 pada ikan nila GIFTmedia asam 0,78% sementara pada media normal 0,58% (Gambar 8). Berdasarkan analisis ragam anova pertumbuhan panjang harian ikan nila BEST media asam dan media normal pada hari ke-10 tidak berbeda nyata. Pada hari ke-20 laju pertumbuhan panjang harian ikan nila GIFT media normal 0,53%. Sementara pada hari ke-30 laju pertumbuhan panjang harian menjadi 0,45% (Lampiran 3).
Gambar 8. Laju pertambahan panjang harian ikan nila O. niloticus strain GIFT pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
media asam 0,81% dan nila merah media normal 0,52%. Berdasarkan analisis ragam ANOVA nilai SGR pada hari ke-20 media pemeliharaan normal tidak berbeda nyata dengan media asam. Sedangkan pada hari ke-30 laju pertumbuhan panjang harian nila merah media asam 0,66% dan nila merah media normal 0,45%. Berdasarkan analisis ragam ANOVA pertumbuhan bobot spesifik harian nila merah media asam dam media normal pada hari ke-30 tidak berbeda nyata (Lampiran 5).
Gambar 9. Laju pertambahan panjang harian ikan nila O. niloticus strain Merah pada media pemeliharaan asam dan normal pada hari ke-10, 20, dan 30
3.1.4 Efisiensi Pakan (EP)
Efisiensi pakan pada ikan nila BEST media asam 16,74% sedangkan pada media normal 97,88% (Gambar 10). Berdasarkan analisis ragam ANOVA menunjukkan berbeda nyata antara efisiensi pakan nila BEST media asam dengan media normal (Lampiran 3).
Keterangan: Huruf yang sama menunjukan hasil yang tidak berbeda nyata Gambar 10. Efisiensi pakan ikan nila O. niloticus strain BEST pada media
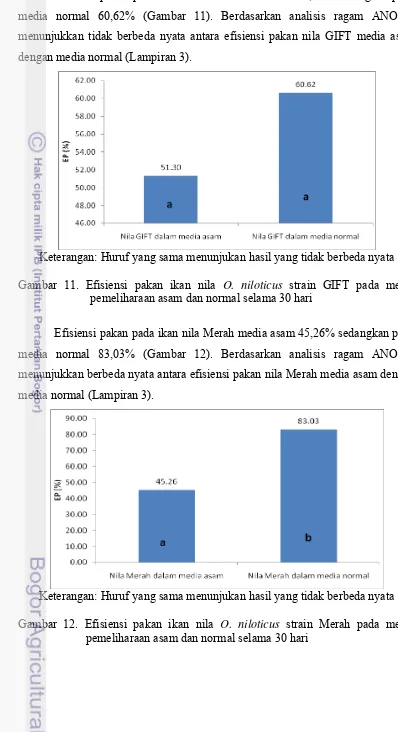
Efisiensi pakan pada ikan nila GIFT media asam 51,30% sedangkan pada media normal 60,62% (Gambar 11). Berdasarkan analisis ragam ANOVA menunjukkan tidak berbeda nyata antara efisiensi pakan nila GIFT media asam dengan media normal (Lampiran 3).
Keterangan: Huruf yang sama menunjukan hasil yang tidak berbeda nyata Gambar 11. Efisiensi pakan ikan nila O. niloticus strain GIFT pada media
pemeliharaan asam dan normal selama 30 hari
Efisiensi pakan pada ikan nila Merah media asam 45,26% sedangkan pada media normal 83,03% (Gambar 12). Berdasarkan analisis ragam ANOVA menunjukkan berbeda nyata antara efisiensi pakan nila Merah media asam dengan media normal (Lampiran 3).
Keterangan: Huruf yang sama menunjukan hasil yang tidak berbeda nyata Gambar 12. Efisiensi pakan ikan nila O. niloticus strain Merah pada media
3.1.5 Kerusakan Insang
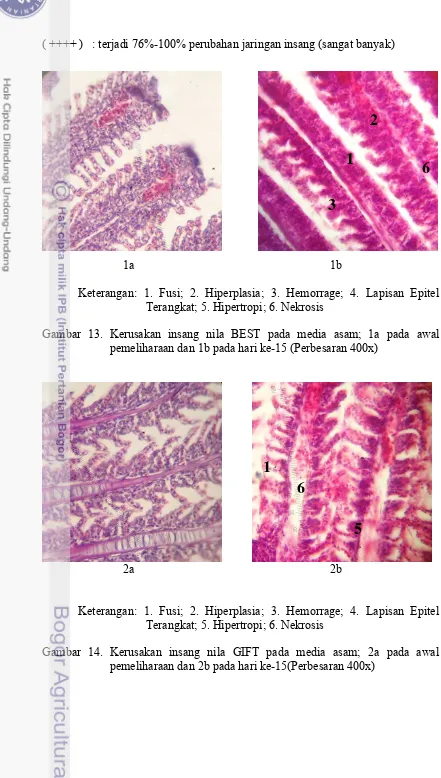
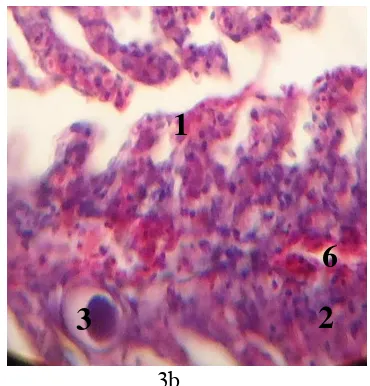
Pada Tabel 1, dapat dilihat tidak terjadi kerusakaan mikroanatoni insang pada seluruh strain ikan sebelum dilakukan pemeliharaan. Namun setelah pemeliharaan dan dilakukan pembedahan pada hari ke-15 terlihat bahwa kerusakan insang pada masing-masing strain sudah mulai nampak (Gambar 14 dan 15). Ikan nila BEST mengalami banyak perubahan mikroanatomi hiperplasia dan fusi, dan juga terdapat sedikit perubahan mikroanatomi nekrosis dan hemorrage. Ikan nila Merah mengalami banyak perubahan mikroanatomi mulai pada hari ke-15 yaitu terdapat banyak hiperplasia dan hemorrage, juga terjadi perubahan fusi dan nekrosis. Sementara pada hari ke-30 terjadi penambahan jumlah hiperplasia dan fusi yang terdapat pada insang. Penambahan jumlah hiperlasia dan fusi tersebut diikuti dengan munculnya hipertropi dan lepasnya lapisan epitel pada insang. Pada hari ke-15, ikan nila GIFT ditemukan banyak kerusakan nekrosis, kerusakan hipertropi, dan sedikit kerusakan fusi. Nila GIFT dan nila BEST tidak dilakukan pembedahan pada hari ke-30 karena ikan nila tersebut memiliki SR 0% pada hari ke-30. Kerusakan insang ikan meliputi fusi, hiperplasia, hemorrage, lapisan epitel terangkat, hipertropi, dan nekrosis.
Hasil analisis perubahan struktur mikroanatomi insang pada ikan nila O. niloticus selama masa pemeliharaan 30 hari dapat dilihat pada Tabel 1 berikut: Tabel 1. Hasil analisis perubahan struktur insang ikan nila O. niloticus pada masa
pemeliharaan dalam media asam No Perlakuan
Waktu Pembedahan
(hari)
Hiperplasia Hipertropi Fusi Nekrosis Hemorrage
Lapisa
( ++++ ) : terjadi 76%-100% perubahan jaringan insang (sangat banyak)
1a 1b
Keterangan: 1. Fusi; 2. Hiperplasia; 3. Hemorrage; 4. Lapisan Epitel Terangkat; 5. Hipertropi; 6. Nekrosis
Gambar 13. Kerusakan insang nila BEST pada media asam; 1a pada awal pemeliharaan dan 1b pada hari ke-15 (Perbesaran 400x)
2a 2b
Keterangan: 1. Fusi; 2. Hiperplasia; 3. Hemorrage; 4. Lapisan Epitel Terangkat; 5. Hipertropi; 6. Nekrosis
Gambar 14. Kerusakan insang nila GIFT pada media asam; 2a pada awal pemeliharaan dan 2b pada hari ke-15(Perbesaran 400x)
3
1
2
6
6
3a 3b
3c
Keterangan: 1. Fusi; 2. Hiperplasia; 3. Hemorrage; 4. Lapisan Epitel Terangkat; 5. Hipertropi; 6. Nekrosis
Gambar 15. Kerusakan insang nila Merah pada media asam; 3a pada awal pemeliharaan, 3b pada hari ke-15, 3c pada hari ke-30 (Perbesaran 400x)
3.1.6 Fisika Kimia Air
Parameter fisika kimia air yang diamati pada penelitian ini adalah suhu, pH, TAN, DO (dissolved oxygen), alkalinitas, CO2, dan kekeruhan. Pengukuran
pH dan suhu dilakukan setiap hari, sedangkan untuk parameter lainnya diukur setiap 10 hari sekali. Hasil parameter fisika kimia air disajikan dalam Gambar 16-22 berikut ini.
1
4
5
2
1
2
6
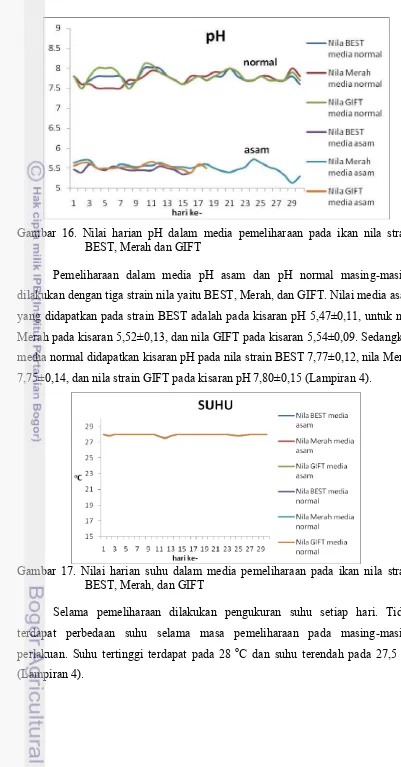
Gambar 16. Nilai harian pH dalam media pemeliharaan pada ikan nila strain BEST, Merah dan GIFT
Pemeliharaan dalam media pH asam dan pH normal masing-masing dilakukan dengan tiga strain nila yaitu BEST, Merah, dan GIFT. Nilai media asam yang didapatkan pada strain BEST adalah pada kisaran pH 5,47±0,11, untuk nila Merah pada kisaran 5,52±0,13, dan nila GIFT pada kisaran 5,54±0,09. Sedangkan media normal didapatkan kisaran pH pada nila strain BEST 7,77±0,12, nila Merah 7,75±0,14, dan nila strain GIFT pada kisaran pH 7,80±0,15 (Lampiran 4).
Gambar 17. Nilai harian suhu dalam media pemeliharaan pada ikan nila strain BEST, Merah, dan GIFT
Gambar 18. Nilai karbondioksida dalam media pemeliharaan pada ikan nila strain BEST, Merah, dan GIFT
Nilai CO2 tertinggi terdapat pada ikan nila Merah yang dipelihara pada
media asam yaitu berkisar antara 36,91-47,94 mg/L. sedangkan nilai CO2 terendah
yaitu pada nila GIFT yang dipelihara pada media normal dengan kisaran 14,64-19,96mg/L (Lampiran 4).
Gambar 19. Nilai alkalinitas dalam media pemeliharaan pada ikan nila strain BEST, Merah, dan GIFT
Merah media normal 128 mg/L, dan nila GIFT media normal 112 mg/L. Nilai alkalinitas mengalami penurunan pada pengukuran hari ke-20 (Lampiran 4).
Gambar 20. Nilai TANdalam media pemeliharaan pada ikan nila strain BEST, Merah, dan GIFT
Nilai TAN pada awal pemeliharaan untuk media asam 1,26 mg/L sementara media normal 0,26 mg/L. Seluruh media mengalami peningkatan kadar TAN sampai pada hari ke-20, ikan nila GIFT media normal sebesar 2,38 mg/L. Pada hari ke-30 seluruhnya mengalami penurunan dengan nilai TAN terendah pada nila Merah media asam yaitu 0,45 mg/L. Nilai TANnila BEST dan GIFT media asam terakhir pada pengukuran hari ke-10 adalah 1,40 mg/L untuk nila BEST media asam, dan 1,54 mg/L untuk nila GIFT media asam (Lampiran 4).
Nilai DO pada media pemeliharaan asam yang terukur adalah 3,36 mg/L sedangkan pada media normal 3,66 mg/L. DO ikan nila BEST, GIFT media normal dan nila Merah media asam mengalami penurunan sampai pada nilai terendah pengukuran hari ke-20 yaitu pada ikan nila merah media asam yaitu 3,07 mg/L lalu meningkat di hari ke-30 dengan nilai tertinggi untuk nila GIFT media normal sebesar 3,35 mg/L. Sedangkan nila Merah pada media normal mengalami peningkatan nilai DO pada pengukuran hari ke-20 menjadi 3,35 mg/L dan menurun di hari ke-30 menjadi 3,11 mg/L. Nilai DO nila strain BEST dan GIFT media asam terakhir pada pengukuran hari ke-10 yaitu 3,33 mg/L untuk nila BEST media asam dan 3,37 mg/L untuk nila GIFT media asam (Lampiran 4).
Gambar 22. Nilai kekeruhan dalam media pemeliharaan pada ikan nila strain BEST, Merah, dan GIFT
3.2 Pembahasan
Menurut Boyd (1982), tingkat keasaman (pH) merupakan logaritma negatif dari konsentrasi ion hidrogen. Kebanyakan perairan alami mempunyai nilai pH 6,5 – 9, titik lethal asam dan basa untuk ikan adalah pH 4 dan 11. Pada penelitian ini digunakan media asam dengan pH pada kisaran 5 dan media normal dengan pH kisaran 7 sedangkan untuk ikan perlakuan digunakan 3 strain ikan nila yaitu BEST (Bogor Enchanced Strain Tilapia), Merah, dan GIFT (Genetic Improvement of Farm Tilapia Project).
Menurut Macketreth et al. (1989) dalam Effendi (2003) menyatakan bahwa perubahan pH pada media pemeliharaan menyebabkan perubahan pada beberapa parameter kualitas air diantaranya alkalinitas, amonia (NH3), dan CO2.
Alkalinitas diartikan sebagai kapasitas penyangga terhadap perubahan keasaman suatu media perairan. Alkalinitas sering disebut juga sebagai konsentrasi basa atau bahan yang menunjukkan kemampuan pembufferan. Nilai alkalinitas pada awal pemeliharaan untuk media asam adalah 80 mg/L, sedangkan untuk media normal 64 mg/L. Kisaran nilai alkalinitas yang dipelihara pada media normal pada nila BEST yaitu 36-136 mg/L, pada nila Merah yaitu 36-128 mg/L, pada nila GIFT 40-112 mg/L. sedangkan kisaran nilai alkalinitas yang dipelihara pada media asam pada nila BEST yaitu 80-92 mg/L, pada nila Merah yaitu 34,67-96 mg/L, dan nila GIFT 80-93,33 mg/L (Gambar 4). Nilai-nilai alkalinitas tersebut masih dalam kisaran yang baik karena menurut Effendi (2003) alkalinitas yang baik berkisar antara 30-500 mg/L.
media normal berkisar antara 0,26-2,38 mg/L sedangkan untuk media asam berkisar 1,26-1,54 mg/L (Gambar 5). Hasil tersebut sesuai dengan pernyataan Boyd (1990) bahwa amonia akan meningkat seiring dengan meningkatnya nilai pH. Kisaran TAN pada setiap perlakuan selama pemeliharaan tersebut masih dalam kisaran yang dapat ditoleransi oleh ikan nila dan hal tersebut sesuai dengan pernyataan Lovell (1989) bahwa ikan nila memiliki toleransi terhadap TAN hingga 2,4 mg/L. Toksisitas amonia lebih besar daripada suhu dan pH tinggi (The European Inland Fisheries Advisory Commision, 1973 dalam Boyd, 1982). Oleh karena itu untuk mengatasi konsentrasi amonia yang tinggi dalam media pemeliharaan dilakukan pengelolaan air yaitu penyiponan dan pergantian air secara rutin.
Parameter kualitas air selanjutnya yang dipengaruhi oleh pH adalah karbondioksida. Kandungan karbondioksida ikan nila BEST pada media normal berkisar antara 19,96-29,96 mg/L sedangkan untuk media asam berkisar 31,96-39,96 mg/L. Kandungan karbondioksida ikan nila Merah pada media normal berkisar antara 19,96-29,96 mg/L sedangkan untuk media asam berkisar 27,96-47,94 mg/L. Kandungan karbondioksida ikan nila GIFT pada media normal berkisar antara 19,96-26,55 mg/L sedangkan untuk media asam berkisar 35,96-39,96 mg/L (Gambar 3). Hasil tersebut sesuai dengan pernyataan Ropiah dan Mahyudin (2000) dalam Darussalam (2005) semakin asam suatu perairan maka semakin tinggi nilai karbondioksidanya karena semakin banyak H2CO3 yang
terbentuk sehingga kondisi perairan semakin asam. Kisaran karbondioksida yang terdapat pada setiap perlakuan selama masa pemeliharaan tersebut masih terdapat kisaran yang dapat ditoleransi oleh ikan nila. Hal ini sesuai dengan pernyataan Hart 1944 dalam Boyd 1982 bahwa sebagian organisme aquatik masih dapat bertahan hidup hingga kadar karbondioksida bebas mencapai 60 mg/l. Selain itu Boyd (1982) menyatakan perairan yang diperuntukkan bagi perikanan sebaiknya memiliki kadar CO2 bebas <5 mg/L.
dapat mengurangi penetrasi cahaya ke perairan. Nilai kekeruhan tertinggi terdapat pada ikan nila GIFT pada media asam yaitu berkisar 0,325-2,5 NTU kemudian berturut-turut ikan nila merah media asam berkisar 0,325-1,98 NTU, ikan nila BEST media asam 0,325-1,55 NTU, ikan nila BEST media normal berkisar 0,02-0,84 NTU, ikan nila Merah media normal berkisar 0,02-0,335 NTU, dan ikan nila GIFT media normal berkisar 0,02-0,275 NTU (Gambar 7). Peningkatan nilai turbiditas pada perairan dangkal dan jernih sebesar 25 NTU dapat mengurangi 13%-50% produktivitas primer. Peningkatan kekeruhan sebesar 5 NTU di danau dan di sungai dapat mengurangi produktivitas primer berturut-turut sebesar 75% dan 3%-13%. Kekeruhan yang tinggi dapat mengakibatkan terganggunya sistem osmoregulasi, misalnya pernafasan dan daya lihat organisme akuatik (Effendi, 2003).
Insang merupakan alat pernafasan utama pada ikan. Letak insang, struktur dan mekanisme kontak dengan lingkungan menjadikan insang sangat rentan terhadap perubahan kondisi lingkungan. Kualitas air yang tidak sesuai atau melebihi batas toleransi ikan dapat menyebabkan kerusakan mikroanatomi pada insang. Ikan nila terdiri dari dua rangkaian yang tersusun atas empat lengkungan tulang rawan dan empat lembar insang. Setiap lembaran insang terdiri dari sepasang filamen yang banyak mengandung lamela (lapisan tipis). Pada filamen terdapat pembuluh darah yang mengandung kapiler sehingga memungkinkan terjadinya pertukaran gas oksigen dan karbondioksida pada proses pernafasan sehingga insang berhubungan langsung dengan dengan media pemeliharaan. Kondisi insang sangat menentukkan kelangsungan hidup ikan. Pengamatan histologi pada insang ikan bertujuan memperlihatkan bahwa ikan yang diberi perlakuan terdapat perubahan seperti fusi, hiperplasia, hemorrage, lapisan epitel terangkat, hipertropi, dan nekrosis. Kerusakan pada insang akan menyebabkan terganggunya mekanisme pernafasan pada ikan. Kerusakan pada sistem pernafasan dapat menyebabkan terhambatnya system transport elektron dan fosforilasi oksidatif pada rangkaian pernafasan. Sehingga akan mempengaruhi metabolisme dan pertumbuhan (Connel dan Miller, 1995).
serta nekrosis dan hemorrage sebesar 26-50% (Tabel 1). Menurut Takashima dan Hibiya (1995) hiperplasia pada lamella primer maupun sekunder pada umumnya disebabkan oleh adanya pengaruh dari parasit kronis, bakteri, atau iritasi yang dikarenakan kondisi lingkungan yang tidak sesuai. Hiperplasi adalah pembentukan jaringan secara berlebihan karena bertambahnya jumlah sel. Fusi merupakan pembengkakan pada sel insang (edema). Menurut Laksman (2003) dalam Ayuningtyas (2010) fusi lamella sekunder mengakibatkan fungsi lamella sekunder terganggu dalam pengambilan oksigen sehingga berpengaruh terhadap kematian. Kondisi media pemeliharaan yang tidak sesuai dengan batas tolerir ikan menyebabkan insang mengeluarkan mucus (lendir) untuk melindungi insang terhadap kondisi media yang tidak sesuai tersebut, akan tetapi mucus yang dihasilkan tersebut menutupi permukaan lamella insang sehingga pertukaran oksigen dan karbondioksida terhambat. Hal tersebut menyebabkan ikan banyak mengeluarkan lendir sehingga sulit bernafas dalam media pemeliharaan bahkan mengalami kematian.
Keterangan: A. Sel Klorid; B. Sel Pillar; C. Erytrosit; D. Kartilago; E. Sel mukosa
Gambar 23. Struktur Jaringan Insang Ikan Normal (Takashima, F and Hibiya, T. 1995).
Pada perlakuan ikan nila GIFT yang dipelihara pada media asam terdapat kerusakan jaringan insang ikan berupa fusi 26-50%, hipertropi 51-75%, dan nekrosis 76-100%, kerusakan tersebut terjadi pada pembedahan hari ke-20 (Tabel 1). Nekrosis adalah kematian sel atau jaringan yang terjadi pada waktu individu ikan masih hidup. Nekrotik sel hati memberikan warna yang hampir sama ke sitoplasma, pengurangan ukuran pada nukleus, dan konsentrasi di sekeliling kromatin. Hipertropi merupakan pembekakan sel dan bertambah besar yang disebabkan oleh nekrosis. Secara histologis kerusakan jaringan berupa hypertropi ditandai dengan terjadinya pembengkakan lapisan epithelium.
Selain terdapat kerusakan insang pada ikan selama masa pemeliharaan, kandungan DO (dissolved oxygen) yang rendah juga diduga merupakan menjadi penyebab proses respirasi terganggu. Kisaran DO pada ikan nila BEST media asam 3,33-3,36 mg/L sedangkan pada media normal 3,15-3,66 mg/L. ikan nila Merah media asam memiliki kisaran DO 3,07-3,37 mg/L sedangkam media normal 3,11-3,66. Nila GIFT media asam memiliki kisaran DO 3,36-3,37 mg/L sedangkan media normal 3,22-3,66 mg/L. Popma dan Lovshin (1996) dalam
A
B
C
D
Maryam (2010) menyatakan bahwa ikan nila dapat bertahan hidup pada perairan dalam kadar oksigen terlarut (DO) lebih rendah dari 0,5 mg/L, namun DO minimum yang harus dipertahankan dalam pemeliharaan ikan nila harus lebih tinggi dari 3 mg/L. kandungan DO yang rendah pada hasil pemeliharaan tersebut diduga disebabkan oleh kerapatan molekul dalam media tinggi sehingga penyebaran oksigen di dalam media pemeliharaan rendah, hal ini bersesuaian dengan hasil penelitian dari Ayuningtyas (2010). Sementara parameter suhu relatif rata untuk setiap perlakuan dengan kisaran suhu 27,5-28 oC. Nilai tersebut sesuai dengan pendapat Sumantadinata (1982) dalam Faisal (1995) yang menyatakan bahwa ikan nila dapat tumbuh dan berbiak secara optimal pada suhu 25-30 oC, meskipun pada suhu 14-38 oC masih dapat hidup.
Menurut Effendi (2003) kadar oksigen yang rendah pada media pemeliharaan tersebut menyebabkan keberadaan oksigen tidak dapat memenuhi kebutuhan organism akuatik (ikan) selain untuk respirasi juga untuk metabolisme. Metabolism tubuh ikan yang tidak berjalan secara normal mengakibatkan energi yang dihasilkan menjadi rendah. Energi yang rendah menyebabkan penurunan nafsu makan ikan, sehingga pertumbuhan, baik itu pertumbuhan panjang maupun pertumbuhan bobot harian menjadi menurun. Terdapat pengecualian pada perlakuan ikan nila Merah yang dipelihara pada media asam yang mengalami peningkatan pertumbuhan bobot harian hari ke-10 0,97%, hari ke-20 1,31%, dan hari ke-30 menjadi 1,34% (Gambar 10). Sementara pertumbuhan panjang harian pada ikan nila Merah terjadi peningkatan dari hari ke-10 0,43% menjadi 0,52% pada hari ke-20 kemudian menurun di hari ke-30 menjadi 0,45% (Gambar 13). Penelitian ini laju pertumbuhan diduga dipengaruhi oleh komposisi kimia air pada media pemeliharaan yang bersifat asam. Media pemeliharaan asam mempengaruhi proses biokimiawi dan fisiologis dalam system metabolism ikan. Hal ini sesuai dengan pernyataan Royce (1973) dalam Ayuningtyas (2010) yang menyatakan bahwa derajat keasaman suatu media pemeliharaan mempengaruhi proses kecepatan reaksi kimiawi dalam air dan biokimiawi dalam tubuh ikan.
media asam lebih rendah dibandingkan dengan media normal. Ikan nila BEST yang dipelihara media asam memiliki nilai efisiensi pakan 16,74% sedangkan media normal 97,88%. Ikan nila Merah yang dipelihara media asam memiliki nilai efisiensi pakan 45,26% sedangkan media normal 83,03%. Ikan nila GIFT yang dipelihara media asam memiliki nilai efisiensi pakan 51,30% sedangkan media normal 60,62% (Lampiran 4). Rendahnya efisiensi pakan pada media asam diduga disebabkan oleh faktor kualitas air yang tidak sesuai dengan batas toleransi ikan tersebut. Hal ini sesuai dengan pernyataan Schmittou (1992) yang menjelaskan bahwa terdapat beberapa faktor yang dapat mempengaruhi efisiensi pakan pada suatu organism, yakni kualitas pakan, jumlah pakan, spesies ikan, ukuran ikan, dan kualitas air.
Effendi (1997) menyatakan bahwa tingkat kelangsungan hidup merupakan suatu nilai perbandingan antara jumlah organisme awal saat penebaran yang dinyatakan dalam bentuk persen dimana semakin besar nilai persentase menunjukan semakin banyak organism yang hidup selama pemeliharaan. Ikan nila BEST pada pemeliharaan media asam hanya dapat bertahan 40% sampai hari ke-10 hari berikutnya tidak bertahan hidup sedangkan pada media normal ikan nila BEST dapat bertahan hidup sampai akhir pemeliharaan 100% (Gambar 18). Seperti hal nya ikan nila BEST, ikan nile GIFT media asam juga hanya dapat mempertahankan 40% sampai hari ke-10 selanjutanya tidak bertahan hidup (Gambar 2), sedangkan ikan nila GIFT media normal dapat bertahan 100% sampai akhir pemeliharaan. Ikan nila Merah pada media asam hanya 30% yang dapat bertahan hidup sampai akhir pemeliharaan sementara pada media normal dapat bertahan hidup 100% (Gambar 20).
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Ikan nila O. niloticus strain BEST dan GIFT tidak dapat bertahan hidup pada media asam, ditunjukkan dengan tingkat kelangsungan hidup sebesar 0% pada hari ke-30. Ikan nila BEST mengalami kematian total pada hari ke-15, dan nila GIFT pada hari ke-19. Sedangkan yang dapat bertahan hidup pada media asam adalah ikan nila Merah dengan tingkat kelangsungan hidup 30%, dengan laju pertumbuhan bobot 1,34±1,20% dan laju pertumbuhan panjang 0,66±0,40% selama 30 hari pemeliharaan. Dengan demikian, ikan nila Merah dapat dikembangkan dalam lahan gambut yang ber-pH asam.
4.2 Saran
DAFTAR PUSTAKA
Ayuningtyas, A. 2010. Kinerja Pertumbuhan Ikan Nila Oreochromis niloticus Strain BEST pada Media Pemeliharaan dengan Derajat Kemasaman Berbeda. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Boyd, C. E. 1982. Water Quality Management for Pond Fish Culture. Amsterdam. Elsevier Scientific Publishing Company: New York.
Chen dan Chen. 2002. Effect of pH on Survival, Growth, Molting, and Feeding of Giant Freshwater Prawns Macrobrachium rosenbergii. Aquaculture (218): 613-623
Connel, D. W. and G. J. Miller. 1995. Chemistry and Exotoxicology of Pollution. A Willey Interscience Publ. New York.
Darusalam. 2005. Kondisi Kualitas Air Tambak Udang Windu (Penaeus monodon Farb.) dengan Pemanfaatan Larutan Nutrien. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Direktorat Jendral Perikanan Budidaya. 2010. Program peningkatan produksi perikanan budidaya tahun 2010-2014. Forum akselerasi pembangunan perikanan budidaya 2010. Batam 25-28 Januari 2010.
Effendi, H. 2003. Telaah Kualitas Air Bagi Pengelola Sumber Daya dan Lingkungan Perairan. Kanasius: Yogyakarta.
Effendie, M. I. 1979. Metode Biologi Perikanan. Yayasan Dewi Sri, Bogor. Effendie, M. I. 1997. Biologi Perikanan. Yayasan Pustaka Nusatama. Yogyakarta. Faisal, A. 1995. Studi tentang Daya Taha Nila Merah Oreochromis niloticus dalam Bak Penampungan Selama Operasi Penangkapan dengan Longline. [Skirpsi]. Departemen Pemanfaatan Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Goddard, S. 1996. Feed Management in Intensive Aquaculture. Chapman and Hall. New York.
Huisman , E. A. 1987. The Principles of Fish Culture Production. Departemen of Aquaculture. Wageningen University. Netherland.
KKP. 2009. Nila Andalan Produk Perikanan. http://www.kkp.go.id/index.php/ arsip/c/1854/Nila-Andalan-Produk-Perikanan-/ [3 Agustus 2011]
Maryam. 2010. Budidaya Super Intensif Ikan Nila Merah Oreochromis sp. dengan teknologi Bioflok: Profil Kualitas Air, Kelangsungan Hidup dan Pertumbuhan. [Skripsi]. Program Sarjana. Institut Pertanian Bogor.
Noor, M. 2001. Pertanian Lahan Gambut: Potensi dan Kendala. Kanisius: Yogyakarta.
Rahmawati, P. A. 2009. Evaluasi Kelangsungan Hidup dan Pertumbuhan Udang Galah Macrobachium rosenbergii De Man Strain Sulawesi, Jawa, dan Jenerik pada Media ber-pH Asam. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor. Roberts, R. J. 1978. Fish Phatology. Bailliare Tindal. London.
Schmittou, H.R. 1992. Produksi Ikan dalam Keramba Mini. Pedoman Teknis Proyek Penelitian dan Pengembangan Perikanan. Puslitbang Perikanan. Jakarta (Tidak dipublikasikan). 126 hal.
Statistik Indonesia. 2007. Badan Pusat Statistik Indonesia: Jakarta.
Suyanto R. 2010. Pembenihan dan Pembesaran Nila. Niaga Swadaya: Jakarta. Takashima, F. and Hibiya, T. 1995. An Atlas of Fish Histology Normal and
Pathological Features Second Edition. Japan.
Wanasuria. 2008. Nila Gifts (Tilapias). http://suharjawanasuria.tripod.com/species this week nila gift.htm. [4 Agustus 2011]
Wibowo T. N. 2001. Toksisitas Air Waduk Cirata pada Tingkat Kedalaman Berbeda terhadap Kelangsungan Hidup Ikan Bandeng dan Ikan Nila Gift. [Skripsi]. Program Sarjana. Institut Pertanian Bogor.
Lampiran 1. Tahapan Pembuatan Preparat Histologi 1. Diagram alir pembuatan blok paraffin
2. Diagram alir proses pemberian warna pada sediaan jaringan dengan pewarna haematoksilin dan eosin
Sampel organ ikan uji
Fiksasi dalam larutan Bouin’s selama 24 jam
Rendam dalam alkohol 70% atau larutan formalin 4%, selama 24 jam
Alkohol 70%, selama 24 jam
Alkohol 80%, selama 2 jam
Alkohol 90%, selama 2 jam
Alkohol 95%, selama 2 jam
Alkohol absolut I, selama 12 jam
Alkohol absolut II, selama 1 jam
Alkohol : Xylol (1:1), selama 30 menit
Xylol I, selama 30 menit
Xylol II, selama 30 menit
Xylol III, selama 30 menit
Infiltrasi paraffin dalam oven 60 oC
Xylol : paraffin (1:1), selama 45 menit
Paraffin I, selama 45 menit
Paraffin II, selama 45 menit
Paraffin III, selama 45 menit
Dicetak dalam blok paraffin Fiksasi Jaringan
Dehidrasi
Clearing
Impregnasi
Embedding
Preparat jaringan
Dicelup dalam larutan xylol I, 5 menit
Alkohol absolut I, 2-3 menit
Alkohol absolut II, 2-3 menit
Alkohol 95%, 2-3 menit
Alkohol 90%, 2-3 menit
Alkohol 80%, 2-3 menit
Alkohol 70%, 2-3 menit
Alkohol 50%, 2-3 menit
Bilas dengan air mengalir (aquadest), 2 menit
Lampiran 2. Rumus perhitungan laju pertumbuhan bobot spesifik harian (SGR), pertambahan panjang mutlak, efisiensi pakan, dan kelangsungan hidup (SR)
a. Laju pertumbuhan bobot spesifik harian (Huisman, 1987)
- 1 x 100%
Keterangan: α = Laju pertumbuhan harian
ωt = Bobot rata-rata ikan pada waktu ke-t pemeliharaan (gram) ωo = Bobot rata-rata ikan pada awal pemeliharaan (gram)
t = Waktu pemeliharaan
b. Laju pertumbuhan panjang harian (Huisman, 1987)
- 1 x 100%
Keterangan: α = Laju pertumbuhan harian
ℓt = Panjang rata-rata ikan pada waktu ke-t (gram)
ℓo = Panjang rata-rata ikan pada awal pemeliharaan (gram)
t = Waktu pemeliharaan
c. Kelangsungan hidup (Goddard, 1996)
Keterangan: SR = Kelangsungan hidup benih (%)
Nt = Jumlah ikan pada akhir pemeliharaaan (ekor) No = Jumlah ikan pada awal pemeliharaan (ekor) d. Efisiensi pakan (Zooneveld et al., 1991)
Keterangan: EP = Efisiensi Pakan
F = Jumlah pakan yang dihabiskan selama pemeliharaan Wt = Bobot total ikan akhir pemeliharaan (gram)
Wo = Bobot total ikan awal pemeliharaan (gram) Wd = Bobot total ikan mati (gram)
Lampiran 3. Pengaruh perlakuan terhadap beberapa parameter uji
Parameter
Perlakuan
Nila BEST Nila Merah Nila GIFT
media asam media normal media asam media normal media asam media normal
SR hari ke-30 (%) 0±0 100±0 30±26,46 100±0 0±0 100±0
LPPH hari ke-30
(% cm /hari) 0±0 1,23±0.15 0,66±0,40 a
0,45±0,08a 0±0 0,45±0,15
SGR hari ke-10
(% gram /hari) 2,02±1,84 3,80±0,98 0,97±1,13 a
2,07±0,66b 1,55±1,70 0,85±0,49
SGR hari ke-20
(% gram /hari) 0±0 3,64±0,18 1,31±1,10 a
1,67±0,17a 0±0 1,17±0,24
SGR hari ke-30
(% gram /hari) 0±0 3,13±0,17 1,34±1,20 a
1,41±0,10a 0±0 1,13±0,08
EP (%) 16,74±15,21a 97,88±0,58b 45,26±22,56a 83,03±7,02a 51,30±45,40a 60,62±3,18a
Lampiran 4. Kisaran parameter kualitas air Parameter
Kualitas Air
Nila BEST Nila Merah Nila GIFT Pustaka
Media asam Media
normal Media asam
Media
normal Media asam
Media normal
CO2 (mg/L) 31,96-39,96 19,96-29,96 27,96-47,94 19,96-29,96 35,96-39,96 19,96-26,55 <60 (Boyd, 1982)
NH3 (mg/L) 1,26-1,4 0,26-2,29 0,45-1,34 0,26-2,11 1,26-1,54 0,26-2,38
<2,4 (Lovell, 1989 dalam Ayuningtyas,
2010) DO (mg/L) 3,33-3,36 3,15-3,66 3,07-3,37 3,11-3,66 3,36-3,37 3,22-3,66 >3 (Wibowo, 2001) Kekeruhan 0,325-1,55 0,02-0,835 0,045-1,98 0,02-0,335 0,325-2,5 0,006-0,275
Alakalinitas 80-92 16-136 34,67-96 16-128 80-93,33 40-112 30-500(Effendi, 2003) Suhu (oC) 27,5- 28 27,5- 28 27,5- 28 27,5- 28 27,5- 28 27,5- 28 25-33 (Suyanto, 2010)
Lampiran 5. Pengolahan Data menggunakan SPSS 16.0 Oneway SGR by Perlakuan Nila Merah
Descriptives
Between Groups 1.829 1 1.829 12.402 .024
Within Groups .590 4 .147
Total 2.419 5
Within Groups 2.476 4 .619
Total 2.669 5
SGR
Within Groups 2.910 4 .728
Total 2.917 5
Between Groups 2.262 1 2.262 11.498 .028
Within Groups .787 4 .197
Total 3.048 5
Lower
Within Groups .717 4 .179
Total .981 5
Within Groups .642 4 .160
Between Groups .066 1 .066 .806 .420
Within Groups .329 4 .082
Total .396 5
Within Groups 1.443 4 .361
Total 1.500 5
asam 3 16.7445 15.21128 8.78223 -21.0424 54.5314 .00 29.71 Nila BEST media
normal 3 97.8783 .58113 .33551 96.4347 99.3219 97.35 98.50 Total 6 57.3114 45.46974 18.56294 9.5938 105.0290 .00 98.50
ANOVA
Efisiensi Pakan Sum of Squares df Mean Square F Sig.
Between Groups 9874.046 1 9874.046 85.224 .001 Within Groups 463.441 4 115.860
Total 10337.487 5
Descriptives
Efisiensi Pakan N Mean Std.
Deviation Std. Error
95% Confidence
Lower Bound
Upper Bound
Nila Merah media
asam 3 45.2634 22.56214 13.02626 -10.7840 101.3109 23.83 68.80 Nila Merah media
normal 3 83.0344 7.01737 4.05148 65.6023 100.4665 77.18 90.81 Total 6 64.1489 25.52081 10.41883 37.3665 90.9314 23.83 90.81
ANOVA
Efisiensi Pakan Sum of Squares df Mean Square F Sig.
Between Groups 2139.971 1 2139.971 7.666 .051 Within Groups 1116.587 4 279.147
Total 3256.558 5
asam 3 51.3022 45.39654 26.20970 -61.4691 164.0734 4.34 94.95 Nila GIFT media
normal 3 60.6194 3.18041 1.83621 52.7188 68.5200 58.26 64.24 Total 6 55.9608 29.23059 11.93334 25.2851 86.6364 4.34 94.95
ANOVA
Efisiensi Pakan Sum of Squares df Mean Square F Sig.
Between Groups 130.216 1 130.216 .126 .741 Within Groups 4141.921 4 1035.480