ABSTRAK
DIANIA RAHMAWATI. Penentuan pH dan Suhu Optimum Aktivitas Kitinase Bacillus cereus I.5 dan Pengujian Kitinase dalam Mendegradasi Eksoskeleton Kutu Bertepung Putih (Ferrisia virgata Cockerel). Dibimbing oleh NISA RACHMANIA MUBARIK dan ALINA AKHDIYA.
Bacillus cereus I.5 merupakan isolat bakteri kitinolitik yang telah diisolasi dari perakaran tanaman cabai. Enzim kitinasenya dapat diaplikasikan sebagai agen biokontrol terhadap hama tanaman. Pemekatan enzim salah satunya dengan cara pengendapan protein oleh amonium sulfat diketahui dapat meningkatkan aktivitas enzim spesifik. Tujuan penelitian ini ialah untuk menentukan pH dan suhu optimum aktivitas kitinase Bacillus cereus I.5 dan menguji kemampuannya dalam mendegradasi kitin pada eksoskeleton hama tanaman jarak kutu bertepung putih Ferrisia virgata. Aktivitas enzim tertinggi dihasilkan pada pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%, yaitu 20 kali dibandingkan enzim ekstrak kasarnya. Aktivitas enzim spesifik meningkat dari 0,039 unit/mg dalam bentuk enzim ekstrak kasarnya menjadi 0,778 unit/mg setelah enzim dipekatkan. Aktivitas kitinase B. cereus I.5 yang terukur lebih tinggi terdapat pada pH 7,0 dan suhu 55 oC meskipun aktivitas kitinase terukur pula pada pH 5,0-9,0 dan pada suhu 26-≤55 oC . Aplikasi kitinase ekstrak kasar dan hasil pemekatan dalam mendegradasi kitin eksoskeleton Ferrisia virgata bekerja lebih baik jika diinkubasi terlebih dahulu pada suhu optimumnya.
Kata kunci: kitinase, amonium sulfat, pH, kutu bertepung putih
ABSTRACT
DIANIA RAHMAWATI. Determination of Optimum pH and Temperature of Chitinase Activity of Bacillus cereus I.5 and Tested Its Ability to Degrade the Exoskleton of Striped Mealy Bug (Ferrisia virgata Cockerell). Supervised by NISA RACHMANIA MUBARIK and ALINA AKHDIYA.
Bacillus cereus I.5 is one of chitinolytic bacteria isolated from chilli rhizosphere. The chitinase could be apply as a biocontrol of plant pest. One method to precipitate enzyme by using ammonium sulphate. It could increase specific activity enzyme. This research was conducted to determine optimum pH and temperature of chitinase activity of Bacillus cereus I.5 and tested its ability to degrade chitin exoskeleton of Ferrisia virgata
Cockerell, one of Jatropha’s pest. Enzyme activity was obtained at the 10% ammonium sulphate saturation level, which is 20 times higher compared to crude enzyme. Specific enzyme activity increased from 0,039 U/mg of crude extract to 0,778 U/mg after ammonium sulphate precipitation. Chitinase of B. cereus i.5 showed highest activity at pH 7,0 and 55 °C although the enzyme also showed its activity at pH 5,0-9,0 and temperature 26-≤55 oC. Application of crude chitinase and the enzyme after ammonium sulphate precipitation on degrading of chitin Ferrisia virgata showed it worked better if incubated firstly at its optimum temperature.
PENDAHULUAN Latar Belakang
Di Indonesia tanaman jarak merupakan salah satu tanaman yang sangat berpotensi sebagai sumber bahan bakar alternatif pengganti bahan bakar minyak (BBM). Potensi jarak sebagai sumber bahan bakar alternatif disebabkan oleh tingginya kandungan minyak dalam biji yang merupakan bahan baku biodiesel. Selain itu, tanaman jarak juga tahan terhadap kekeringan, dan dapat ditanam di lahan kritis (Hambali et al. 2006)
Keberadaan hama merupakan salah satu faktor penting yang mempengaruhi tingkat produksi tanaman jarak. Salah satu jenis serangga hama yang umumnya menyerang tanaman jarak yaitu kutu bertepung putih (Ferrisia virgata Cockerell). Hama ini menyerang bagian daun, buah, atau bagian pucuk dengan cara menghisap cairan tanaman sehingga menimbulkan gejala daun atau pucuk menjadi kuning, kering, dan akhirnya mati. Serangan pada tangkai buah mengakibatkan kelayuan sehingga buah menjadi gugur. Hama F. virgata memiliki kisaran inang cukup banyak, yaitu tanaman jarak, kakao, kopi, dan jeruk (Dadang 2006). Serangan hama ini dapat menurunkan tingkat produksi tanaman jarak. Oleh karena itu, diperlukan penanganan yang baik agar serangan hama tersebut dapat diminimalkan.
Salah satu upaya untuk mengurangi serangan hama tersebut ialah melalui penggunaan agen biokontrol. Selain dapat mengurangi serangan hama, upaya ini dapat mengurangi jumlah residu kimia yang diakibatkan oleh penggunaan pestisida yang dapat merusak lingkungan, serta dapat meminimalkan terjadinya resistensi serangga (hama) akibat penggunaan pestisida tersebut.
Eksoskeleton serangga tersusun dari lapisan kutikula yang dapat dibedakan menjadi lapisan epikutikula dan lapisan prokutikula. Lapisan prokutikula ini tersusun oleh protein dan kitin (Hogenkamp 2006, Schwarz & Moussian 2007). Kitin dapat diurai menjadi oligomer dan monomernya oleh enzim kitinase dapat menghidrolisis
ikatan glikosidik β-1,4 kitin (Lonhienne et al. 2001).
Enzim kitinase dihasilkan oleh bakteri yang biasa disebut dengan bakteri kitinolitik. Salah satu bakteri yang dapat menghasilkan enzim kitinase ialah Bacillus cereus. Hasil penelitian sebelumnya menunjukkan bahwa
enzim kitinase ekstrak kasar B. cereus I.5 dapat mendegradasi kitin eksoskeleton Bemisia tabaci (Mahagiani 2008). Untuk mengetahui potensi bakteri ini dalam mengendalikan hama jarak, perlu dilakukan penelitian untuk mengetahui aktivitas dan karakterisasi kitinase B. cereus I.5 dalam mendegradasi kitin pada eksoskeleton Ferrisia virgata.
Tujuan
Penelitian ini bertujuan untuk menentukan pH dan suhu optimum aktivitas kitinase Bacillus cereus I.5 dan menguji kemampuan enzim tersebut dalam mendegradasi kitin eksoskeleton hama tanaman jarak kutu bertepung putih (Ferrisia virgata Cockerell).
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Maret 2010 hingga Oktober 2010 di Laboratorium Mikrobiologi dan Laboratorium Mikroteknik, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE Bahan
Bahan yang digunakan antara lain bakteri Bacillus cereus (I.5) koleksi laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Serangga hama tanaman jarak Ferrisia virgata yang diambil dari daun tanaman jarak di rumah kaca PAU, IPB.
Metode
Peremajaan dan Penyimpanan Kultur. Bacillus cereus I.5. Isolat I.5 diremajakan pada media agar-agar nutrien (NA) dengan cara digores kuadran, kemudian diinkubasi pada suhu 37o C selama 48 jam. Kultur yang telah diremajakan digunakan sebagai biakan kerja dan disimpan pada suhu 10 o C.
PENDAHULUAN Latar Belakang
Di Indonesia tanaman jarak merupakan salah satu tanaman yang sangat berpotensi sebagai sumber bahan bakar alternatif pengganti bahan bakar minyak (BBM). Potensi jarak sebagai sumber bahan bakar alternatif disebabkan oleh tingginya kandungan minyak dalam biji yang merupakan bahan baku biodiesel. Selain itu, tanaman jarak juga tahan terhadap kekeringan, dan dapat ditanam di lahan kritis (Hambali et al. 2006)
Keberadaan hama merupakan salah satu faktor penting yang mempengaruhi tingkat produksi tanaman jarak. Salah satu jenis serangga hama yang umumnya menyerang tanaman jarak yaitu kutu bertepung putih (Ferrisia virgata Cockerell). Hama ini menyerang bagian daun, buah, atau bagian pucuk dengan cara menghisap cairan tanaman sehingga menimbulkan gejala daun atau pucuk menjadi kuning, kering, dan akhirnya mati. Serangan pada tangkai buah mengakibatkan kelayuan sehingga buah menjadi gugur. Hama F. virgata memiliki kisaran inang cukup banyak, yaitu tanaman jarak, kakao, kopi, dan jeruk (Dadang 2006). Serangan hama ini dapat menurunkan tingkat produksi tanaman jarak. Oleh karena itu, diperlukan penanganan yang baik agar serangan hama tersebut dapat diminimalkan.
Salah satu upaya untuk mengurangi serangan hama tersebut ialah melalui penggunaan agen biokontrol. Selain dapat mengurangi serangan hama, upaya ini dapat mengurangi jumlah residu kimia yang diakibatkan oleh penggunaan pestisida yang dapat merusak lingkungan, serta dapat meminimalkan terjadinya resistensi serangga (hama) akibat penggunaan pestisida tersebut.
Eksoskeleton serangga tersusun dari lapisan kutikula yang dapat dibedakan menjadi lapisan epikutikula dan lapisan prokutikula. Lapisan prokutikula ini tersusun oleh protein dan kitin (Hogenkamp 2006, Schwarz & Moussian 2007). Kitin dapat diurai menjadi oligomer dan monomernya oleh enzim kitinase dapat menghidrolisis
ikatan glikosidik β-1,4 kitin (Lonhienne et al. 2001).
Enzim kitinase dihasilkan oleh bakteri yang biasa disebut dengan bakteri kitinolitik. Salah satu bakteri yang dapat menghasilkan enzim kitinase ialah Bacillus cereus. Hasil penelitian sebelumnya menunjukkan bahwa
enzim kitinase ekstrak kasar B. cereus I.5 dapat mendegradasi kitin eksoskeleton Bemisia tabaci (Mahagiani 2008). Untuk mengetahui potensi bakteri ini dalam mengendalikan hama jarak, perlu dilakukan penelitian untuk mengetahui aktivitas dan karakterisasi kitinase B. cereus I.5 dalam mendegradasi kitin pada eksoskeleton Ferrisia virgata.
Tujuan
Penelitian ini bertujuan untuk menentukan pH dan suhu optimum aktivitas kitinase Bacillus cereus I.5 dan menguji kemampuan enzim tersebut dalam mendegradasi kitin eksoskeleton hama tanaman jarak kutu bertepung putih (Ferrisia virgata Cockerell).
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Maret 2010 hingga Oktober 2010 di Laboratorium Mikrobiologi dan Laboratorium Mikroteknik, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE Bahan
Bahan yang digunakan antara lain bakteri Bacillus cereus (I.5) koleksi laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Serangga hama tanaman jarak Ferrisia virgata yang diambil dari daun tanaman jarak di rumah kaca PAU, IPB.
Metode
Peremajaan dan Penyimpanan Kultur. Bacillus cereus I.5. Isolat I.5 diremajakan pada media agar-agar nutrien (NA) dengan cara digores kuadran, kemudian diinkubasi pada suhu 37o C selama 48 jam. Kultur yang telah diremajakan digunakan sebagai biakan kerja dan disimpan pada suhu 10 o C.
menginokulasi 100 ml media yang sama. Selanjutnya media yang telah diinokulasi tersebut diinkubasi pada suhu yang sama. Setelah 36 jam kultur disentrifus pada kecepatan 6000 rpm (8400 g), pada suhu 4oC, selama 15 menit. Supernatan yang diperoleh masing-masing sebanyak 10 ml ditambah (NH4)2SO4 sedikit demi sedikit sambil diaduk
dengan pengaduk magnet sampai tingkat kejenuhan (10%-70% dengan selang 10%) (Lampiran 2). Setiap perlakuan tingkat kejenuhan amonium sulfat yang berbeda menggunakan wadah yang terpisah. Supernatan yang telah diberi amonium sulfat kemudian disimpan semalam pada suhu 10 oC, lalu disentrifus 8400 g pada suhu 4oC, selama 15 menit. Pelet protein diambil dan dilarutkan dengan 1 ml bufer fosfat 50 mM pH 7,0.
Pengukuran Aktivitas Kitinase dan Kadar Protein. Aktivitas enzim kitinase supernatan dan enzim hasil pemekatan diukur dengan metode Spindler (1997). Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang membebaskan 1 µmol gula pereduksi N-asetilglukosamin (NAG) per menit. Kadar protein dalam supernatan dan enzim hasil pemekatan diukur dengan metode Bradford (1976) (Lampiran 3). Sebagai standar monomer hasil hidrolisis digunakan larutan N-asetilglukosamin, sedangkan untuk standar pada pengukuran protein digunakan larutan Bovin Serum Albumin (BSA).
Penentuan pH dan Suhu Optimum Aktivitas Kitinase. Pengukuran aktivitas kitinase pada berbagai pH dilakukan dalam rentang pH 5,0-9,0 (selang 1 unit) dengan menggunakan bufer yang sesuai (bufer sitrat 50 mM pH 5,0, bufer fosfat 50 mM pH 6,0-8,0, dan bufer glisin-NaOH 50 mM pH 9,0). Sedangkan untuk penentuan suhu optimum, dilakukan pengukuran aktivitas kitinase pada pH optimum tetapi dengan suhu inkubasi yang bervariasi (26, 45, 50, 55, 60, dan 65 oC).
Uji Aktivitas Kitinase dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata. Supernatan dan enzim pekat masing-masing diinkubasi pada suhu ruang (±26 oC) dan pada suhu optimum selama 30 menit. Sebanyak 20 µl sampel enzim yang telah diinkubasi tersebut dimasukkan ke dalam tabung mikro yang masing-masing telah diisi 2 ekor kutu bertepung putih. Sebagai kontrol,
digunakan 20 µl akuades steril sebagai pengganti cairan enzim.
Penguraian kitin pada eksoskeleton serangga diamati setiap hari selama 4 hari berturut-turut dengan menggunakan mikroskop cahaya pada perbesaran 400x dan mikroskop stereo dengan perbesaran 100x. Masing-masing kutu yang akan diamati dan telah diberi perlakuan enzim maupun kontrol difiksasi dengan etanol 70% selama 10 menit. Selanjutnya didehidrasi dengan etanol bertingkat (80%, 95%, 100%) masing-masing selama 10 menit. Setelah dijernihkan dengan xilol, kutu kemudian diletakkan pada gelas objek dan ditutup dengan kaca penutup yang bagian tepi-tepinya diberikan perekat entellan (Nurdebyandaru et al. 2010).
HASIL
Aktivitas Kitinase Ekstrak Kasar dan Enzim Hasil Pemekatan dengan Amonium Sulfat
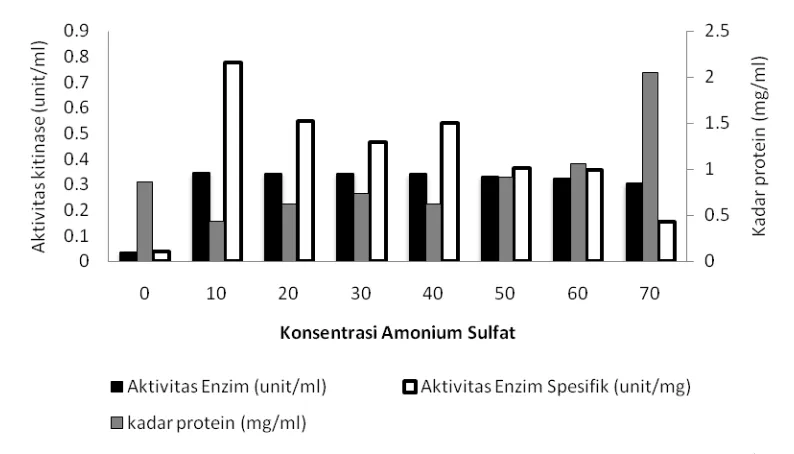
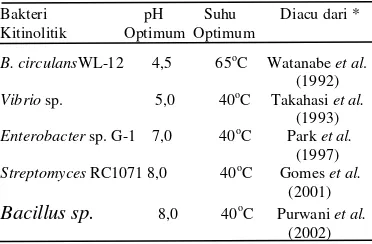
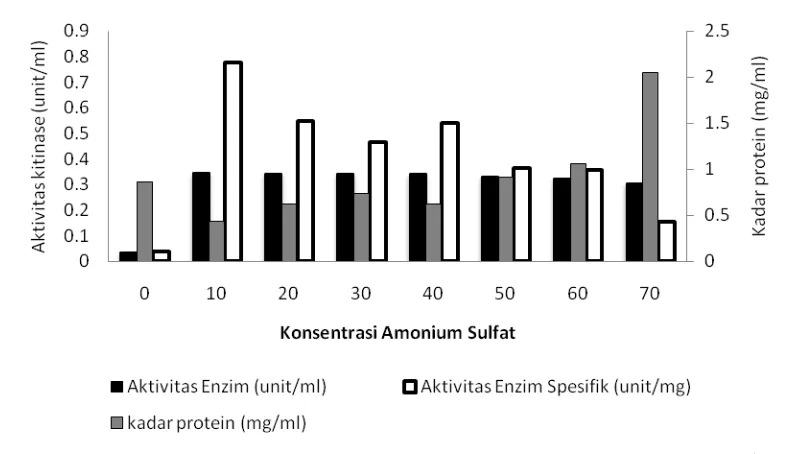
Hasil pemekatan enzim ekstrak kasar dengan menggunakan amonium sulfat mulai konsentrasi 10%-70% menunjukkan kecenderungan kenaikan perolehan kadar protein seiring dengan kenaikan tingkat konsentrasi amonium sulfat yang ditambahkan ke dalam enzim ekstrak kasar. Hasil pengukuran aktivitas kitinase dan aktivitas spesifik tertinggi enzim hasil pemekatan dicapai pada tingkat kejenuhan amonium sulfat 10% (Gambar 1, Lampiran 4).
menginokulasi 100 ml media yang sama. Selanjutnya media yang telah diinokulasi tersebut diinkubasi pada suhu yang sama. Setelah 36 jam kultur disentrifus pada kecepatan 6000 rpm (8400 g), pada suhu 4oC, selama 15 menit. Supernatan yang diperoleh masing-masing sebanyak 10 ml ditambah (NH4)2SO4 sedikit demi sedikit sambil diaduk
dengan pengaduk magnet sampai tingkat kejenuhan (10%-70% dengan selang 10%) (Lampiran 2). Setiap perlakuan tingkat kejenuhan amonium sulfat yang berbeda menggunakan wadah yang terpisah. Supernatan yang telah diberi amonium sulfat kemudian disimpan semalam pada suhu 10 oC, lalu disentrifus 8400 g pada suhu 4oC, selama 15 menit. Pelet protein diambil dan dilarutkan dengan 1 ml bufer fosfat 50 mM pH 7,0.
Pengukuran Aktivitas Kitinase dan Kadar Protein. Aktivitas enzim kitinase supernatan dan enzim hasil pemekatan diukur dengan metode Spindler (1997). Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang membebaskan 1 µmol gula pereduksi N-asetilglukosamin (NAG) per menit. Kadar protein dalam supernatan dan enzim hasil pemekatan diukur dengan metode Bradford (1976) (Lampiran 3). Sebagai standar monomer hasil hidrolisis digunakan larutan N-asetilglukosamin, sedangkan untuk standar pada pengukuran protein digunakan larutan Bovin Serum Albumin (BSA).
Penentuan pH dan Suhu Optimum Aktivitas Kitinase. Pengukuran aktivitas kitinase pada berbagai pH dilakukan dalam rentang pH 5,0-9,0 (selang 1 unit) dengan menggunakan bufer yang sesuai (bufer sitrat 50 mM pH 5,0, bufer fosfat 50 mM pH 6,0-8,0, dan bufer glisin-NaOH 50 mM pH 9,0). Sedangkan untuk penentuan suhu optimum, dilakukan pengukuran aktivitas kitinase pada pH optimum tetapi dengan suhu inkubasi yang bervariasi (26, 45, 50, 55, 60, dan 65 oC).
Uji Aktivitas Kitinase dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata. Supernatan dan enzim pekat masing-masing diinkubasi pada suhu ruang (±26 oC) dan pada suhu optimum selama 30 menit. Sebanyak 20 µl sampel enzim yang telah diinkubasi tersebut dimasukkan ke dalam tabung mikro yang masing-masing telah diisi 2 ekor kutu bertepung putih. Sebagai kontrol,
digunakan 20 µl akuades steril sebagai pengganti cairan enzim.
Penguraian kitin pada eksoskeleton serangga diamati setiap hari selama 4 hari berturut-turut dengan menggunakan mikroskop cahaya pada perbesaran 400x dan mikroskop stereo dengan perbesaran 100x. Masing-masing kutu yang akan diamati dan telah diberi perlakuan enzim maupun kontrol difiksasi dengan etanol 70% selama 10 menit. Selanjutnya didehidrasi dengan etanol bertingkat (80%, 95%, 100%) masing-masing selama 10 menit. Setelah dijernihkan dengan xilol, kutu kemudian diletakkan pada gelas objek dan ditutup dengan kaca penutup yang bagian tepi-tepinya diberikan perekat entellan (Nurdebyandaru et al. 2010).
HASIL
Aktivitas Kitinase Ekstrak Kasar dan Enzim Hasil Pemekatan dengan Amonium Sulfat
Hasil pemekatan enzim ekstrak kasar dengan menggunakan amonium sulfat mulai konsentrasi 10%-70% menunjukkan kecenderungan kenaikan perolehan kadar protein seiring dengan kenaikan tingkat konsentrasi amonium sulfat yang ditambahkan ke dalam enzim ekstrak kasar. Hasil pengukuran aktivitas kitinase dan aktivitas spesifik tertinggi enzim hasil pemekatan dicapai pada tingkat kejenuhan amonium sulfat 10% (Gambar 1, Lampiran 4).
Gambar 1 Pengaruh tingkat kejenuhan amonium sulfat terhadap aktivitas kitinase B. cereus I.5. Pengukuran aktivitas enzim pada pH 7,0 dan suhu 55 oC. Keterangan: 0 merupakan enzim ekstrak kasar (tanpa pemekatan dengan ammonium sulfat) merupakan kontrol perlakuan.
pH dan Suhu Optimum Aktivitas Kitinase Hasil optimasi pH menunjukkan bahwa enzim ekstrak kasar masing-masing memiliki aktivitas yang relatif sama pada kisaran pH 5,0-8,0. Aktivitas enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% tidak terukur pada pH 9,0. Hasil pengukuran aktivitas kitinase tertinggi pada ekstrak kasar dan hasil pemekatan amonium sulfat 10% terdapat pada pH 7,0 (Gambar 2, Lampiran 5).
Hasil optimasi suhu menunjukkan bahwa enzim aktif bekerja pada suhu kamar (26oC), dan pada suhu 45oC hingga 55 oC, enzim juga aktif bekerja. Aktivitas enzim ekstrak kasar dan hasil pemekatan amonium sulfat tingkat kejenuhan 10 % tidak terdeteksi pada suhu 60 oC dan 65 oC. Nilai akivitas kitinase tertinggi diperoleh pada suhu 55oC (Gambar 3, Lampiran 5).
Gambar 3 Pengaruh suhu terhadap kitinase B. cereus I.5 enzim ekstrak kasar dan enzim hasil pemekatan dengan amonium sulfat 10%.
Aktivitas Kitinase B. cereus I.5 dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata
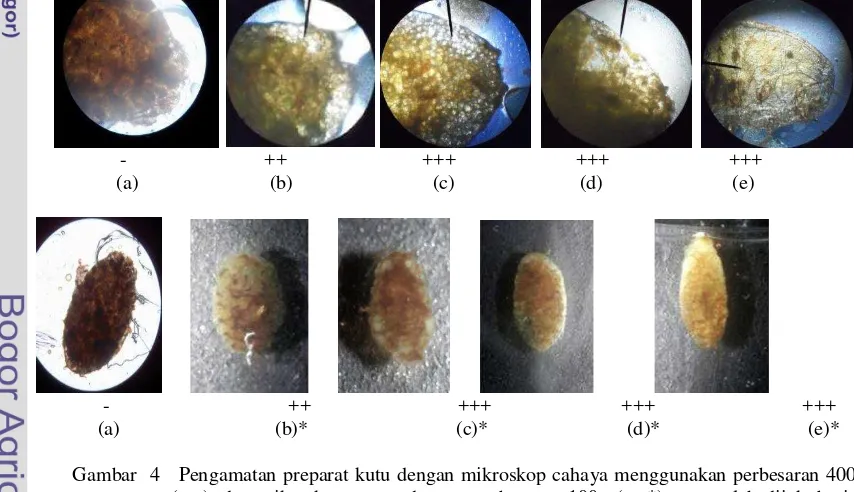
Kutu-kutu F. virgata yang telah diberi perlakuan dengan cairan enzim ekstrak kasar maupun hasil pemekatan diinkubasi pada suhu ruang. Hasil yang diperoleh terjadi penipisan pada lapisan eksoskeleton (Gambar 4, Lampiran 6).
Enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% bekerja lebih cepat
satu hari dalam mendegradasi kutu eksoskeleton F. virgata dibandingkan dengan enzim ekstrak kasar. Inkubasi enzim pada suhu optimum 55oC baik ekstrak kasar maupun enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% memberikan hasil lebih baik yaitu proses yang lebih cepat dalam mendegradasi kitin eksoskeleton F. virgata dibandingkan dengan enzim yang diinkubasi pada suhu ruang.
- ++ +++ +++ +++ (a) (b) (c) (d) (e)
- ++ +++ +++ +++
(a) (b)* (c)* (d)* (e)* Gambar 4 Pengamatan preparat kutu dengan mikroskop cahaya menggunakan perbesaran 400x
PEMBAHASAN
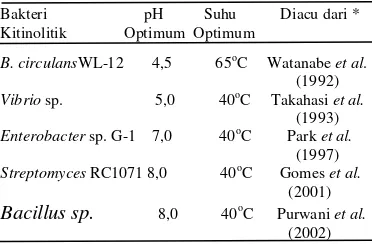
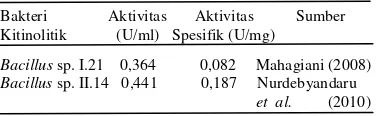
Enzim kitinase yang dihasilkan oleh isolat I.5 ini memiliki nilai aktivitas enzim yang masih relatif rendah, sebesar 0,034 unit/ml dengan nilai aktivitas enzim spesifiknya 0,039 unit/mg, dibandingkan dengan kitinase ekstrak kasar yang diproduksi oleh bakteri Bacillus sp. lainnya yang diukur dengan perlakuan yang sama (Tabel 1). Berdasarkan pada kemampuan aktivitasnya dalam mendegradasi lapisan/komponen kitin Aphis gosypii, kitinase isolat Bacillus 1.21 dan II.14 (Tabel 1) memiliki aktivitas yang lebih tinggi dibandingkan dengan kitinase B. cereus I.5. Aktivitas enzim B. cereus yang rendah disebabkan antara lain ekstrak kasar masih bercampur dengan protein dan senyawa lain dari media atau metabolit lain yang dihasilkan bakteri selama pertumbuhannya sehingga diperlukan pemurnian untuk memisahkannya dari senyawa-senyawa lainnya (Yurnaliza 2002). Tingkat kemurnian suatu enzim diketahui dari aktivitas enzim spesifik tersebut yang semakin meningkat (Septiningrum & Moeis 2008).
Tabel 1 Aktivitas enzim ekstrak kasar kitinase Bacillus I.21 dan II.14
Bakteri Aktivitas Aktivitas Sumber Kitinolitik (U/ml) Spesifik (U/mg)
Bacillus sp. I.21 0,364 0,082 Mahagiani (2008) Bacillus sp. II.14 0,441 0,187 Nurdebyandaru
et al. (2010)
Pemurnian parsial enzim dapat dilakukan dengan beberapa cara, yaitu: ultrafiltrasi, liofiliasi, dan pengendapan protein dengan amonium sulfat, aseton, etanol, atau polietilen glikol (Scopes 1994). Proses purifikasi dapat meningkatkan kemurnian enzim, sehingga meningkatkan nilai aktivitas enzimnya, demikian pula dengan nilai aktivitas enzim spesifiknya. Pemurnian enzim dengan cara pengendapan protein dengan amonium sulfat paling banyak dilakukan karena selain mudah didapatkan, amonium sulfat juga memiliki harga yang relatif murah, serta bersifat menstabilkan enzim (Scopes 1994).
Pemekatan enzim kitinase isolat I.5 dilakukan dengan cara pengendapan protein menggunakan amonium sulfat. Kehadiran garam amonium sulfat pada konsentrasi tertentu berpengaruh pada kelarutan protein. Pengendapan protein dengan menggunakan amonium sulfat terjadi saat kelarutan ionik meningkat sehingga kelarutan protein menurun (salting out). Sebaliknya, salting in
terjadi ketika kekuatan ionik larutan rendah (Scopes 1994).
Setelah dipekatkan, dengan menggunakan amonium sulfat, aktivitas enzim spesifik kitinase B. cereus I.5 meningkat dibandingkan enzim ekstrak kasarnya. Aktivitas enzim spesifik tertinggi diperoleh dari hasil pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%, enzim spesifik meningkat dari 0,039 unit/mg menjadi 0,778 unit/mg. Pemekatan juga dapat meningkatkan kemurnian suatu enzim. Tingkat kemurnian suatu enzim dapat dihitung dengan cara membagi nilai enzim spesifik hasil pemurnian dengan nilai enzim spesifik ekstrak kasarnya (Minch 1989).
Aktivitas enzim unit/ml dan aktivitas spesifik enzim hasil pemekatan dengan amonium sulfat tercapai pada tingkat kejenuhan 10%. Aktivitas kitinase kemudian menurun setelah tingkat pemekatan pada kejenuhan 10%. Sedangkan kadar protein yang diperoleh makin meningkat seiring dengan meningkatnya kejenuhan amonium sulfat yang ditambahkan ke enzim. Pada tingkat kejenuhan ammonium sulfat 60% dan 70%, kadar protein yang diperoleh melebihi kadar protein pada enzim ekstrak kasar. Hal ini dapat disebabkan oleh adanya interaksi senyawa lain misalnya bufer fosfat cenderung memberikan intervensi pada pereaksi Bradford (Bradford 1976).
Berdasarkan hasil karakterisasi, diketahui bahwa enzim hasil pemekatan tidak mengalami pergeseran pH maupun suhu optimum. Uji aktivitas enzim yang dilakukan pada suhu di atas 55 oC menunjukkan hilangnya aktivitas kitinase. Hal ini disebabkan oleh adanya pengaruh panas terhadap stabilitas enzim. Panas menyebabkan kerusakan enzim karena mengakibatkan terjadinya denaturasi protein. Protein yang terdenaturasi oleh panas akan kehilangan struktur uniknya sehingga sifat-sifat kimia, fisik, dan biologinya berubah (Abun 2005). Rahayu et al. (2004) melaporkan bahwa kisaran suhu optimal untuk aktivitas kitinase termostabil bersifat cukup luas dengan kisaran 45-85 oC.
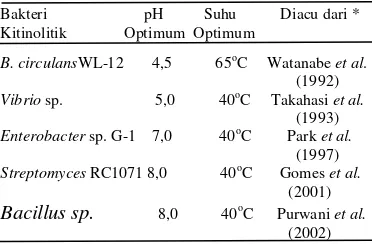
Aktivitas kitinase yang tinggi pada pH optimum disebabkan oleh terjadinya ionisasi asam-asam amino pada sisi aktif enzim, sehingga terjadi interaksi yang optimum antara enzim dengan substrat (Pujiyanto 2001). Hasil penelitian Toharisman (2004) menunjukkan enzim-enzim pendegradasi kitin bekerja optimum pada pH asam hingga netral, namun diketahui pula bahwa ada beberapa enzim yang yang optimum bekerja pada pH alkali (Tabel 2). Enzim kitinase asal isolate B. cereus I.5 yang terukur pada penelitian ini memiliki nilai aktivitas yang cenderung sama pada pH 5,0-8,0 dan kisaran suhu 26 oC, 45 oC, 50 oC, dan 55 oC baik ekstrak kasar maupun hasil pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%. Tabel 2 pH dan suhu optimum kitin berbagai
bakteri kitinolitik
Bakteri pH Suhu Diacu dari * Kitinolitik Optimum Optimum
B. circulansWL-12 4,5 65oC Watanabe et al.
(1992) Vibrio sp. 5,0 40oC Takahasi et al.
(1993) Enterobacter sp. G-1 7,0 40oC Park et al.
(1997) Streptomyces RC1071 8,0 40oC Gomes et al.
(2001) Bacillus sp. 8,0 40oC Purwani et al.
(2002) Keterangan: *Sumber: Toharisman et al .(2004)
Enzim kitinase merupakan enzim pendegradasi kitin. Kitin terdapat pada eksoskeleton arthropoda seperti insekta, ketam dan udang. Telah diketahui sebelumnya bahwa 80% komponen eksoskeleton serangga tersusun atas senyawa kitin. Dalam pengujian enzim diperoleh hasil pengamatan yang menunjukkan bahwa kedua enzim baik ekstrak kasar maupun dan enzim pekat dapat mendegradasi kitin dari kutu tersebut. Hal ini terlihat dari preparat kutu yang semakin transparan karena terjadi penipisan eksoskeleton serangga hama tersebut (Lampiran 6).
Eksoskeleton kutu kontrol tanpa perlakuan enzim tampak sangat berbeda dengan kutu yang ditetesi enzim. Eksoskeleton kutu kontrol tetap terlihat gelap sampai hari ketiga inkubasi. Sedangkan kutu yang diberi enzim, eksoskeletonnya semakin transparan dan tampak berlubang-lubang halus. Semakin transparan preparat kutu menandakan semakin tipisnya eksoskeleton. Penipisan eksokleton tersebut merupakan akibat degradasi komponen kitin oleh aktivitas kitinase Bacillus cereus I.5. Oleh karena itu,
semakin transparan eksoskeleton kutu berarti semakin banyak kitin yang terdegradasi (Nurdebyandaru et al. 2010).
Degradasi eksoskeleton terbaik ditunjukkan oleh perlakuan menggunakan enzim yang telah dipekatkan. Perlakuan dengan enzim ekstrak kasar maupun enzim pekat yang telah diinkubasi pada suhu optimum 55 oC memberikan hasil yang lebih baik dibandingkan dengan enzim yang diinkubasi pada suhu ruang. Hal ini terlihat dari degradasi eksoskeleton yang mencapai lapisan lebih dalam dan proses penguraian kitin lebih cepat satu hari untuk enzim yang telah diinkubasi sebelumnya pada suhu optimum 55 oC.
Aplikasi kitinase sebagai agen biokontrol dapat diantaranya dapat dilakukan dengan cara penyemprotan secara langsung larutan kitinase pada tanaman, atau dengan cara penaburan kitin di sekitar tanaman untuk menginduksi sekresi kitinase oleh mikrob yang tergolong kitinolitik (Metcalfe et al. 2002). Cara lainnya yaitu dengan penyisipan gen kitinase terhadap tanaman sehingga dapat meningkatkan ketahanan terhadap serangan patogen, seperti yang telah dilaporkan Koga (2005) tanaman stroberi transgenik yang telah disisipi oleh gen kitinase lebih tahan terhadap serangan cendawan patogen. Fakamizo et al. (1996) juga melaporkan bahwa serangan patogen oleh Fusarium dapat ditekan karena degradasi dinding selnya oleh aktivitas kitinase B. pumilus.
SIMPULAN
Aktivitas kitinase yang tinggi pada pH optimum disebabkan oleh terjadinya ionisasi asam-asam amino pada sisi aktif enzim, sehingga terjadi interaksi yang optimum antara enzim dengan substrat (Pujiyanto 2001). Hasil penelitian Toharisman (2004) menunjukkan enzim-enzim pendegradasi kitin bekerja optimum pada pH asam hingga netral, namun diketahui pula bahwa ada beberapa enzim yang yang optimum bekerja pada pH alkali (Tabel 2). Enzim kitinase asal isolate B. cereus I.5 yang terukur pada penelitian ini memiliki nilai aktivitas yang cenderung sama pada pH 5,0-8,0 dan kisaran suhu 26 oC, 45 oC, 50 oC, dan 55 oC baik ekstrak kasar maupun hasil pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%. Tabel 2 pH dan suhu optimum kitin berbagai
bakteri kitinolitik
Bakteri pH Suhu Diacu dari * Kitinolitik Optimum Optimum
B. circulansWL-12 4,5 65oC Watanabe et al.
(1992) Vibrio sp. 5,0 40oC Takahasi et al.
(1993) Enterobacter sp. G-1 7,0 40oC Park et al.
(1997) Streptomyces RC1071 8,0 40oC Gomes et al.
(2001) Bacillus sp. 8,0 40oC Purwani et al.
(2002) Keterangan: *Sumber: Toharisman et al .(2004)
Enzim kitinase merupakan enzim pendegradasi kitin. Kitin terdapat pada eksoskeleton arthropoda seperti insekta, ketam dan udang. Telah diketahui sebelumnya bahwa 80% komponen eksoskeleton serangga tersusun atas senyawa kitin. Dalam pengujian enzim diperoleh hasil pengamatan yang menunjukkan bahwa kedua enzim baik ekstrak kasar maupun dan enzim pekat dapat mendegradasi kitin dari kutu tersebut. Hal ini terlihat dari preparat kutu yang semakin transparan karena terjadi penipisan eksoskeleton serangga hama tersebut (Lampiran 6).
Eksoskeleton kutu kontrol tanpa perlakuan enzim tampak sangat berbeda dengan kutu yang ditetesi enzim. Eksoskeleton kutu kontrol tetap terlihat gelap sampai hari ketiga inkubasi. Sedangkan kutu yang diberi enzim, eksoskeletonnya semakin transparan dan tampak berlubang-lubang halus. Semakin transparan preparat kutu menandakan semakin tipisnya eksoskeleton. Penipisan eksokleton tersebut merupakan akibat degradasi komponen kitin oleh aktivitas kitinase Bacillus cereus I.5. Oleh karena itu,
semakin transparan eksoskeleton kutu berarti semakin banyak kitin yang terdegradasi (Nurdebyandaru et al. 2010).
Degradasi eksoskeleton terbaik ditunjukkan oleh perlakuan menggunakan enzim yang telah dipekatkan. Perlakuan dengan enzim ekstrak kasar maupun enzim pekat yang telah diinkubasi pada suhu optimum 55 oC memberikan hasil yang lebih baik dibandingkan dengan enzim yang diinkubasi pada suhu ruang. Hal ini terlihat dari degradasi eksoskeleton yang mencapai lapisan lebih dalam dan proses penguraian kitin lebih cepat satu hari untuk enzim yang telah diinkubasi sebelumnya pada suhu optimum 55 oC.
Aplikasi kitinase sebagai agen biokontrol dapat diantaranya dapat dilakukan dengan cara penyemprotan secara langsung larutan kitinase pada tanaman, atau dengan cara penaburan kitin di sekitar tanaman untuk menginduksi sekresi kitinase oleh mikrob yang tergolong kitinolitik (Metcalfe et al. 2002). Cara lainnya yaitu dengan penyisipan gen kitinase terhadap tanaman sehingga dapat meningkatkan ketahanan terhadap serangan patogen, seperti yang telah dilaporkan Koga (2005) tanaman stroberi transgenik yang telah disisipi oleh gen kitinase lebih tahan terhadap serangan cendawan patogen. Fakamizo et al. (1996) juga melaporkan bahwa serangan patogen oleh Fusarium dapat ditekan karena degradasi dinding selnya oleh aktivitas kitinase B. pumilus.
SIMPULAN
PENENTUAN pH DAN SUHU OPTIMUM AKTIVITAS KITINASE
Bacillus cereus
I.5 DAN PENGUJIAN KITINASE DALAM
MENDEGRADASI EKSOSKELETON KUTU BERTEPUNG PUTIH
(
Ferrisia virgata
Cockerell)
DIANIA RAHMAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
meningkatkan kemampuan enzim tersebut dalam mendegradasi kitin eksoskeleton F. virgata.
DAFTAR PUSTAKA
Abun. 2005. Protein dan asam amino pada unggas [skripsi]. Bandung: Universitas Padjajaran.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem 72: 248-254. Dadang. 2006. Pengenalan hama utama dan
potensial tanaman jarak pagar (Jatropha curcas Linn.). Di dalam: Dadang, editor. Hama dan Penyakit Tanaman Jarak Pagar (Jatropha carcass Linn) Potensi Kerusakan dan Teknik Pengendaliannya. Prosiding workshop; Bogor, 5-6 Desember 2006. Bogor: Pusat Penelitian dan Bioenergi LPPM-IPB. hlm 8-16.
Fakamizo TY, Honda H, Ouchi S, Goto S. 1996. Chitinous component of cell wall of Fusarium oxysporum, its structure deduced from chitosanase digestion. Bioschi Biotech Biochem 60: 1705-1708.
Hambali et al. 2006. Jarak Pagar Penghasil Tanaman Biodiesel. Jakarta: Penebar Swadaya.
Hogenkamp DG. 2006. Chitin metabolism in insect: chitin synthases and beta-n-acetylglucosaminidases [disertasi]. Manhattan: Biochemistry Post Graduate School, Kansas State University.
Koga D. 2005. Application of chitinase in agriculture. J Met Mater Miner 15: 33-36.
Lonhienne et al. 2001. Cloning, sequences, and characterizm of two chitinase genes from the Antarctic Athrobacter sp. Strain TAD20: isolation and partial characterization of the enzymes. J Bacterial 183: 1773-1779.
Mahagiani I. 2008. Isolasi enzim kitinase dari bakteri perakaran tanaman cabai dan aplikasinya pada kutu kebul [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Metcalfe AC, Krsek M, Gooday GW, Prosser J, Wellington EMH. 2002. Molecular analysis of a bacterial chitinolitic community in an upland pasture. Appl Anviron Microbiol 68: 5042-5050. Minch MJ. 1989. Experiments in
Biochemistry: Project and Procedures. New Jersey: Englewood Cliffs.
Mubarik et al. 2010. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and its application as biocontrol for whitefly (Bemisia tabaci Genn.). Am J Agric Biol 5: 430-435.
Nurdebyandaru N. Mubarik NR, Prawasti TS. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and application as biocontrol for Aphiis gosyppi. Microbiol Indones 4: 103-107.
Pujiyanto S. 2001. Isolasi dan karakterisasi bakteri kitinolitik serta kloning shotgun gen kitinase dari ekosistem air hitam, Kalimantan Tengah [tesis]. Bogor: Institut Pertanian Bogor.
Rahayu et al. 2004. Study of thermostable chitinase enzymes from Indonesian Bacillus K-29-14. J. Microbiol. Biotechnol. 14: 647-652.
Scharz H, Moussian B. 2007. Electron microscopic and genetic dissection of arthropod cuticle differentiation. Di dalam: Mendez-Villaz, Diaz J, editor. Modern research and Educational Topics in Microscopy. Tuebingen: Formatex. hlm 316-325.
Spindler KD. 1997. Chitinase and chitosanase assays. Di dalam: Muzarelli RAA, MG Peter, editor. Chitin Handbook. Grottamare: Alda Tecnografica. hlm 229-235.
Scopes RK. 1994. Protein Purification, Principles and Practice. Ed. ke-2. New York: Springer-Verlag.
Septiningrum K, Moeis RM. 2009. Isolasi dan karakterisasi xilanase dari Bacillus circulans. Berita Selulosa 44(1): 31-40.
Toharisman A. 2004. Purification and characterization of thermostable chitinases from Bacillus licheniformis MS-2 [disertasi]. Bogor: Institut Pertanian Bogor.
PENENTUAN pH DAN SUHU OPTIMUM AKTIVITAS KITINASE
Bacillus cereus
I.5 DAN PENGUJIAN KITINASE DALAM
MENDEGRADASI EKSOSKELETON KUTU BERTEPUNG PUTIH
(
Ferrisia virgata
Cockerell)
DIANIA RAHMAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DIANIA RAHMAWATI. Penentuan pH dan Suhu Optimum Aktivitas Kitinase Bacillus cereus I.5 dan Pengujian Kitinase dalam Mendegradasi Eksoskeleton Kutu Bertepung Putih (Ferrisia virgata Cockerel). Dibimbing oleh NISA RACHMANIA MUBARIK dan ALINA AKHDIYA.
Bacillus cereus I.5 merupakan isolat bakteri kitinolitik yang telah diisolasi dari perakaran tanaman cabai. Enzim kitinasenya dapat diaplikasikan sebagai agen biokontrol terhadap hama tanaman. Pemekatan enzim salah satunya dengan cara pengendapan protein oleh amonium sulfat diketahui dapat meningkatkan aktivitas enzim spesifik. Tujuan penelitian ini ialah untuk menentukan pH dan suhu optimum aktivitas kitinase Bacillus cereus I.5 dan menguji kemampuannya dalam mendegradasi kitin pada eksoskeleton hama tanaman jarak kutu bertepung putih Ferrisia virgata. Aktivitas enzim tertinggi dihasilkan pada pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%, yaitu 20 kali dibandingkan enzim ekstrak kasarnya. Aktivitas enzim spesifik meningkat dari 0,039 unit/mg dalam bentuk enzim ekstrak kasarnya menjadi 0,778 unit/mg setelah enzim dipekatkan. Aktivitas kitinase B. cereus I.5 yang terukur lebih tinggi terdapat pada pH 7,0 dan suhu 55 oC meskipun aktivitas kitinase terukur pula pada pH 5,0-9,0 dan pada suhu 26-≤55 oC . Aplikasi kitinase ekstrak kasar dan hasil pemekatan dalam mendegradasi kitin eksoskeleton Ferrisia virgata bekerja lebih baik jika diinkubasi terlebih dahulu pada suhu optimumnya.
Kata kunci: kitinase, amonium sulfat, pH, kutu bertepung putih
ABSTRACT
DIANIA RAHMAWATI. Determination of Optimum pH and Temperature of Chitinase Activity of Bacillus cereus I.5 and Tested Its Ability to Degrade the Exoskleton of Striped Mealy Bug (Ferrisia virgata Cockerell). Supervised by NISA RACHMANIA MUBARIK and ALINA AKHDIYA.
Bacillus cereus I.5 is one of chitinolytic bacteria isolated from chilli rhizosphere. The chitinase could be apply as a biocontrol of plant pest. One method to precipitate enzyme by using ammonium sulphate. It could increase specific activity enzyme. This research was conducted to determine optimum pH and temperature of chitinase activity of Bacillus cereus I.5 and tested its ability to degrade chitin exoskeleton of Ferrisia virgata
Cockerell, one of Jatropha’s pest. Enzyme activity was obtained at the 10% ammonium sulphate saturation level, which is 20 times higher compared to crude enzyme. Specific enzyme activity increased from 0,039 U/mg of crude extract to 0,778 U/mg after ammonium sulphate precipitation. Chitinase of B. cereus i.5 showed highest activity at pH 7,0 and 55 °C although the enzyme also showed its activity at pH 5,0-9,0 and temperature 26-≤55 oC. Application of crude chitinase and the enzyme after ammonium sulphate precipitation on degrading of chitin Ferrisia virgata showed it worked better if incubated firstly at its optimum temperature.
PENENTUAN pH DAN SUHU OPTIMUM AKTIVITAS KITINASE
Bacillus cereus
I.5 DAN PENGUJIAN KITINASE DALAM
MENDEGRADASI EKSOSKELETON KUTU BERTEPUNG PUTIH
(
Ferrisia virgata
Cockerell)
DIANIA RAHMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Penentuan pH dan Suhu Optimum Aktivitas Kitinase
Bacillus cereus
I.5 dan Pengujian Kitinase dalam
Mendegradasi Eksoskeleton
Kutu Bertepung Putih
(Ferrisia virgata Cockerell)
Nama
: Diania Rahmawati
Nomor Pokok
: G34060742
Menyetujui:
Pembimbing I,
Pembimbing II,
Dr. Nisa Rachmania Mubarik, M.Si
Alina Akhdiya, M.Si
NIP. 19671127 199302 2 001
NIP
19681208 200112 2 001
Mengetahui,
Ketua Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas rahmat-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian yang dilaporkan dalam karya ilmiah ini dilakukan mulai Maret 2010 sampai dengan Oktober 2010, di Laboratorium Mikrobiologi dan Laboratorium Mikroteknik, Departemin Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Judul yang diambil dalam penelitian ini adalah Penentuan pH dan Suhu Optimum Aktivitas Kitinase Bacillus cereus I.5 dan Pengujiannya untuk Mendegradasi Eksoskeleton Kutu Bertepung Putih (Ferrisia virgata Cockerell).
Terima kasih penulis ucapkan kepada Ibu Nisa Rachmania Mubarik dan Ibu Alina Akhdiya atas bimbingan dan arahan yang diberikan. Ucapan terima kasih penulis sampaikan pula kepada Bapak Tri Atmowidi selaku wakil komisi pendidikan atas saran dan masukan yang diberikan. Penulis ucapkan pula terima kasih kepada Ibu Taruni yang telah memberikan kesempatan untuk bekerja di laboratorium Mikroteknik dan atas informasinya dalam aplikasi enzim kitinase terhadap serangga hama, serta kepada Ibu Tini atas arahan dalam pengerjaan aplikasi. Tak lupa penulis ucapkan rasa terima kasih kepada kedua orang tua dan kakak-kakak tercinta atas doa, perhatian, kasih sayang, dan dukungan yang diberikan selama ini. Terima kasih penulis ucapkan pula kepada staf dan teknisi laboratorium dan teman-teman di Laboratorium Mikrobiologi atas bantuan dan kerja sama, serta kepada semua sahabat-sahabat tersayang yang setia mendukung dan mendampingi selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2011
RIWAYAT HIDUP
Diania Rahmawati dilahirkan di Cianjur pada tanggal 02 Mei 1988 sebagai anak keenam dari 6 bersaudara dari pasangan Ibu Hj. Siti Rochmah dan Bapak H. EM. Yusuf (Alm.).
Penulis menyelesaikan pendidikan di SMAN 2 Cianjur pada tahun 2006, kemudian melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur USMI pada tahun 2006. Setelah menjalani masa Tingkat Persiapan Bersama, penulis diterima di Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE Bahan ... 1
Metode... 1
Peremajaan dan Penyimpanan Kultur Bacillus cereus I.5. ... 1
Produksi dan Pemekatan Kitinase. ... 1
Pengukuran Aktivitas Kitinase dan Kadar Protein. ... 2
Penentuan pH dan Suhu Optimum Aktivitas Kitinase. ... 2
Uji Aktivitas Kitinase dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata ... 2
HASIL Aktivitas Kitinase Ekstrak Kasar dan Enzim Hasil Pemekatan dengan Amonium Sulfat.. 2
pH dan Suhu Optimum Aktivitas Kitinase. ... 3
Aktivitas Kitinase B. cereus I.5 dalam Mendegradasi Eksoskeleton Ferrisia virgata... 4
PEMBAHASAN ... 5
SIMPULAN ... 6
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1. Aktivitas enzim ekstrak kasar kitinase Bacillus I.21 dan II. 14... 5 2. pH dan suhu optimum kitin berbagai bakteri kitinolitik... 6
DAFTAR GAMBAR
Halaman
DAFTAR LAMPIRAN
Halaman
1. Komposisi media dan reagen yang digunakan………...………... 9 2. Jumlah (gram) amonium sulfat yang ditambahkan pada enzim
(untuk 1 Liter) (Scopes 1994)………..…………. 10 3. Metode pengukuran aktivitas kitinase (Spindler 1997) dan pengukuran
kadar protein (Bradford 1976)………..………..… 11 4. Hasil uji pemekatan kitinase B. cereus I.5 dengan amonium sulfa…...………… 13 5. Data karakterisasi pH dan suhu……….……….………....………… 14 6. Pengamatan mikroskopik uji degradasi kitin kutu Ferrisia virgata…..………… 15 1 Pengaruh tingkat kejenuhan amonium sulfat terhadap aktivitas kitinase
B. cereus I.5………..…. 3 2 Pengaruh pH terhadap aktivitas kitinase B. cereus I.5 enzim ekstrak kasar
dan enzim hasil pemekatan dengan amonium sulfat 10%………...……..……… 3 3 Pengaruh suhu terhadap aktivitas kitinase B. cereus I.5 enzim ekstrak kasar
dan enzim hasil pemekatan dengan amonium sulfat 10%………….……… 4 4 Pengamatan preparat kutu dengan mikroskop cahaya menggunakan perbesaran
PENDAHULUAN Latar Belakang
Di Indonesia tanaman jarak merupakan salah satu tanaman yang sangat berpotensi sebagai sumber bahan bakar alternatif pengganti bahan bakar minyak (BBM). Potensi jarak sebagai sumber bahan bakar alternatif disebabkan oleh tingginya kandungan minyak dalam biji yang merupakan bahan baku biodiesel. Selain itu, tanaman jarak juga tahan terhadap kekeringan, dan dapat ditanam di lahan kritis (Hambali et al. 2006)
Keberadaan hama merupakan salah satu faktor penting yang mempengaruhi tingkat produksi tanaman jarak. Salah satu jenis serangga hama yang umumnya menyerang tanaman jarak yaitu kutu bertepung putih (Ferrisia virgata Cockerell). Hama ini menyerang bagian daun, buah, atau bagian pucuk dengan cara menghisap cairan tanaman sehingga menimbulkan gejala daun atau pucuk menjadi kuning, kering, dan akhirnya mati. Serangan pada tangkai buah mengakibatkan kelayuan sehingga buah menjadi gugur. Hama F. virgata memiliki kisaran inang cukup banyak, yaitu tanaman jarak, kakao, kopi, dan jeruk (Dadang 2006). Serangan hama ini dapat menurunkan tingkat produksi tanaman jarak. Oleh karena itu, diperlukan penanganan yang baik agar serangan hama tersebut dapat diminimalkan.
Salah satu upaya untuk mengurangi serangan hama tersebut ialah melalui penggunaan agen biokontrol. Selain dapat mengurangi serangan hama, upaya ini dapat mengurangi jumlah residu kimia yang diakibatkan oleh penggunaan pestisida yang dapat merusak lingkungan, serta dapat meminimalkan terjadinya resistensi serangga (hama) akibat penggunaan pestisida tersebut.
Eksoskeleton serangga tersusun dari lapisan kutikula yang dapat dibedakan menjadi lapisan epikutikula dan lapisan prokutikula. Lapisan prokutikula ini tersusun oleh protein dan kitin (Hogenkamp 2006, Schwarz & Moussian 2007). Kitin dapat diurai menjadi oligomer dan monomernya oleh enzim kitinase dapat menghidrolisis
ikatan glikosidik β-1,4 kitin (Lonhienne et al. 2001).
Enzim kitinase dihasilkan oleh bakteri yang biasa disebut dengan bakteri kitinolitik. Salah satu bakteri yang dapat menghasilkan enzim kitinase ialah Bacillus cereus. Hasil penelitian sebelumnya menunjukkan bahwa
enzim kitinase ekstrak kasar B. cereus I.5 dapat mendegradasi kitin eksoskeleton Bemisia tabaci (Mahagiani 2008). Untuk mengetahui potensi bakteri ini dalam mengendalikan hama jarak, perlu dilakukan penelitian untuk mengetahui aktivitas dan karakterisasi kitinase B. cereus I.5 dalam mendegradasi kitin pada eksoskeleton Ferrisia virgata.
Tujuan
Penelitian ini bertujuan untuk menentukan pH dan suhu optimum aktivitas kitinase Bacillus cereus I.5 dan menguji kemampuan enzim tersebut dalam mendegradasi kitin eksoskeleton hama tanaman jarak kutu bertepung putih (Ferrisia virgata Cockerell).
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Maret 2010 hingga Oktober 2010 di Laboratorium Mikrobiologi dan Laboratorium Mikroteknik, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE Bahan
Bahan yang digunakan antara lain bakteri Bacillus cereus (I.5) koleksi laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Serangga hama tanaman jarak Ferrisia virgata yang diambil dari daun tanaman jarak di rumah kaca PAU, IPB.
Metode
Peremajaan dan Penyimpanan Kultur. Bacillus cereus I.5. Isolat I.5 diremajakan pada media agar-agar nutrien (NA) dengan cara digores kuadran, kemudian diinkubasi pada suhu 37o C selama 48 jam. Kultur yang telah diremajakan digunakan sebagai biakan kerja dan disimpan pada suhu 10 o C.
menginokulasi 100 ml media yang sama. Selanjutnya media yang telah diinokulasi tersebut diinkubasi pada suhu yang sama. Setelah 36 jam kultur disentrifus pada kecepatan 6000 rpm (8400 g), pada suhu 4oC, selama 15 menit. Supernatan yang diperoleh masing-masing sebanyak 10 ml ditambah (NH4)2SO4 sedikit demi sedikit sambil diaduk
dengan pengaduk magnet sampai tingkat kejenuhan (10%-70% dengan selang 10%) (Lampiran 2). Setiap perlakuan tingkat kejenuhan amonium sulfat yang berbeda menggunakan wadah yang terpisah. Supernatan yang telah diberi amonium sulfat kemudian disimpan semalam pada suhu 10 oC, lalu disentrifus 8400 g pada suhu 4oC, selama 15 menit. Pelet protein diambil dan dilarutkan dengan 1 ml bufer fosfat 50 mM pH 7,0.
Pengukuran Aktivitas Kitinase dan Kadar Protein. Aktivitas enzim kitinase supernatan dan enzim hasil pemekatan diukur dengan metode Spindler (1997). Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang membebaskan 1 µmol gula pereduksi N-asetilglukosamin (NAG) per menit. Kadar protein dalam supernatan dan enzim hasil pemekatan diukur dengan metode Bradford (1976) (Lampiran 3). Sebagai standar monomer hasil hidrolisis digunakan larutan N-asetilglukosamin, sedangkan untuk standar pada pengukuran protein digunakan larutan Bovin Serum Albumin (BSA).
Penentuan pH dan Suhu Optimum Aktivitas Kitinase. Pengukuran aktivitas kitinase pada berbagai pH dilakukan dalam rentang pH 5,0-9,0 (selang 1 unit) dengan menggunakan bufer yang sesuai (bufer sitrat 50 mM pH 5,0, bufer fosfat 50 mM pH 6,0-8,0, dan bufer glisin-NaOH 50 mM pH 9,0). Sedangkan untuk penentuan suhu optimum, dilakukan pengukuran aktivitas kitinase pada pH optimum tetapi dengan suhu inkubasi yang bervariasi (26, 45, 50, 55, 60, dan 65 oC).
Uji Aktivitas Kitinase dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata. Supernatan dan enzim pekat masing-masing diinkubasi pada suhu ruang (±26 oC) dan pada suhu optimum selama 30 menit. Sebanyak 20 µl sampel enzim yang telah diinkubasi tersebut dimasukkan ke dalam tabung mikro yang masing-masing telah diisi 2 ekor kutu bertepung putih. Sebagai kontrol,
digunakan 20 µl akuades steril sebagai pengganti cairan enzim.
Penguraian kitin pada eksoskeleton serangga diamati setiap hari selama 4 hari berturut-turut dengan menggunakan mikroskop cahaya pada perbesaran 400x dan mikroskop stereo dengan perbesaran 100x. Masing-masing kutu yang akan diamati dan telah diberi perlakuan enzim maupun kontrol difiksasi dengan etanol 70% selama 10 menit. Selanjutnya didehidrasi dengan etanol bertingkat (80%, 95%, 100%) masing-masing selama 10 menit. Setelah dijernihkan dengan xilol, kutu kemudian diletakkan pada gelas objek dan ditutup dengan kaca penutup yang bagian tepi-tepinya diberikan perekat entellan (Nurdebyandaru et al. 2010).
HASIL
Aktivitas Kitinase Ekstrak Kasar dan Enzim Hasil Pemekatan dengan Amonium Sulfat
Hasil pemekatan enzim ekstrak kasar dengan menggunakan amonium sulfat mulai konsentrasi 10%-70% menunjukkan kecenderungan kenaikan perolehan kadar protein seiring dengan kenaikan tingkat konsentrasi amonium sulfat yang ditambahkan ke dalam enzim ekstrak kasar. Hasil pengukuran aktivitas kitinase dan aktivitas spesifik tertinggi enzim hasil pemekatan dicapai pada tingkat kejenuhan amonium sulfat 10% (Gambar 1, Lampiran 4).
Gambar 1 Pengaruh tingkat kejenuhan amonium sulfat terhadap aktivitas kitinase B. cereus I.5. Pengukuran aktivitas enzim pada pH 7,0 dan suhu 55 oC. Keterangan: 0 merupakan enzim ekstrak kasar (tanpa pemekatan dengan ammonium sulfat) merupakan kontrol perlakuan.
pH dan Suhu Optimum Aktivitas Kitinase Hasil optimasi pH menunjukkan bahwa enzim ekstrak kasar masing-masing memiliki aktivitas yang relatif sama pada kisaran pH 5,0-8,0. Aktivitas enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% tidak terukur pada pH 9,0. Hasil pengukuran aktivitas kitinase tertinggi pada ekstrak kasar dan hasil pemekatan amonium sulfat 10% terdapat pada pH 7,0 (Gambar 2, Lampiran 5).
Hasil optimasi suhu menunjukkan bahwa enzim aktif bekerja pada suhu kamar (26oC), dan pada suhu 45oC hingga 55 oC, enzim juga aktif bekerja. Aktivitas enzim ekstrak kasar dan hasil pemekatan amonium sulfat tingkat kejenuhan 10 % tidak terdeteksi pada suhu 60 oC dan 65 oC. Nilai akivitas kitinase tertinggi diperoleh pada suhu 55oC (Gambar 3, Lampiran 5).
Gambar 3 Pengaruh suhu terhadap kitinase B. cereus I.5 enzim ekstrak kasar dan enzim hasil pemekatan dengan amonium sulfat 10%.
Aktivitas Kitinase B. cereus I.5 dalam Mendegradasi Kitin Eksoskeleton Ferrisia virgata
Kutu-kutu F. virgata yang telah diberi perlakuan dengan cairan enzim ekstrak kasar maupun hasil pemekatan diinkubasi pada suhu ruang. Hasil yang diperoleh terjadi penipisan pada lapisan eksoskeleton (Gambar 4, Lampiran 6).
Enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% bekerja lebih cepat
satu hari dalam mendegradasi kutu eksoskeleton F. virgata dibandingkan dengan enzim ekstrak kasar. Inkubasi enzim pada suhu optimum 55oC baik ekstrak kasar maupun enzim hasil pemekatan amonium sulfat tingkat kejenuhan 10% memberikan hasil lebih baik yaitu proses yang lebih cepat dalam mendegradasi kitin eksoskeleton F. virgata dibandingkan dengan enzim yang diinkubasi pada suhu ruang.
- ++ +++ +++ +++ (a) (b) (c) (d) (e)
- ++ +++ +++ +++
(a) (b)* (c)* (d)* (e)* Gambar 4 Pengamatan preparat kutu dengan mikroskop cahaya menggunakan perbesaran 400x
PEMBAHASAN
Enzim kitinase yang dihasilkan oleh isolat I.5 ini memiliki nilai aktivitas enzim yang masih relatif rendah, sebesar 0,034 unit/ml dengan nilai aktivitas enzim spesifiknya 0,039 unit/mg, dibandingkan dengan kitinase ekstrak kasar yang diproduksi oleh bakteri Bacillus sp. lainnya yang diukur dengan perlakuan yang sama (Tabel 1). Berdasarkan pada kemampuan aktivitasnya dalam mendegradasi lapisan/komponen kitin Aphis gosypii, kitinase isolat Bacillus 1.21 dan II.14 (Tabel 1) memiliki aktivitas yang lebih tinggi dibandingkan dengan kitinase B. cereus I.5. Aktivitas enzim B. cereus yang rendah disebabkan antara lain ekstrak kasar masih bercampur dengan protein dan senyawa lain dari media atau metabolit lain yang dihasilkan bakteri selama pertumbuhannya sehingga diperlukan pemurnian untuk memisahkannya dari senyawa-senyawa lainnya (Yurnaliza 2002). Tingkat kemurnian suatu enzim diketahui dari aktivitas enzim spesifik tersebut yang semakin meningkat (Septiningrum & Moeis 2008).
Tabel 1 Aktivitas enzim ekstrak kasar kitinase Bacillus I.21 dan II.14
Bakteri Aktivitas Aktivitas Sumber Kitinolitik (U/ml) Spesifik (U/mg)
Bacillus sp. I.21 0,364 0,082 Mahagiani (2008) Bacillus sp. II.14 0,441 0,187 Nurdebyandaru
et al. (2010)
Pemurnian parsial enzim dapat dilakukan dengan beberapa cara, yaitu: ultrafiltrasi, liofiliasi, dan pengendapan protein dengan amonium sulfat, aseton, etanol, atau polietilen glikol (Scopes 1994). Proses purifikasi dapat meningkatkan kemurnian enzim, sehingga meningkatkan nilai aktivitas enzimnya, demikian pula dengan nilai aktivitas enzim spesifiknya. Pemurnian enzim dengan cara pengendapan protein dengan amonium sulfat paling banyak dilakukan karena selain mudah didapatkan, amonium sulfat juga memiliki harga yang relatif murah, serta bersifat menstabilkan enzim (Scopes 1994).
Pemekatan enzim kitinase isolat I.5 dilakukan dengan cara pengendapan protein menggunakan amonium sulfat. Kehadiran garam amonium sulfat pada konsentrasi tertentu berpengaruh pada kelarutan protein. Pengendapan protein dengan menggunakan amonium sulfat terjadi saat kelarutan ionik meningkat sehingga kelarutan protein menurun (salting out). Sebaliknya, salting in
terjadi ketika kekuatan ionik larutan rendah (Scopes 1994).
Setelah dipekatkan, dengan menggunakan amonium sulfat, aktivitas enzim spesifik kitinase B. cereus I.5 meningkat dibandingkan enzim ekstrak kasarnya. Aktivitas enzim spesifik tertinggi diperoleh dari hasil pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%, enzim spesifik meningkat dari 0,039 unit/mg menjadi 0,778 unit/mg. Pemekatan juga dapat meningkatkan kemurnian suatu enzim. Tingkat kemurnian suatu enzim dapat dihitung dengan cara membagi nilai enzim spesifik hasil pemurnian dengan nilai enzim spesifik ekstrak kasarnya (Minch 1989).
Aktivitas enzim unit/ml dan aktivitas spesifik enzim hasil pemekatan dengan amonium sulfat tercapai pada tingkat kejenuhan 10%. Aktivitas kitinase kemudian menurun setelah tingkat pemekatan pada kejenuhan 10%. Sedangkan kadar protein yang diperoleh makin meningkat seiring dengan meningkatnya kejenuhan amonium sulfat yang ditambahkan ke enzim. Pada tingkat kejenuhan ammonium sulfat 60% dan 70%, kadar protein yang diperoleh melebihi kadar protein pada enzim ekstrak kasar. Hal ini dapat disebabkan oleh adanya interaksi senyawa lain misalnya bufer fosfat cenderung memberikan intervensi pada pereaksi Bradford (Bradford 1976).
Berdasarkan hasil karakterisasi, diketahui bahwa enzim hasil pemekatan tidak mengalami pergeseran pH maupun suhu optimum. Uji aktivitas enzim yang dilakukan pada suhu di atas 55 oC menunjukkan hilangnya aktivitas kitinase. Hal ini disebabkan oleh adanya pengaruh panas terhadap stabilitas enzim. Panas menyebabkan kerusakan enzim karena mengakibatkan terjadinya denaturasi protein. Protein yang terdenaturasi oleh panas akan kehilangan struktur uniknya sehingga sifat-sifat kimia, fisik, dan biologinya berubah (Abun 2005). Rahayu et al. (2004) melaporkan bahwa kisaran suhu optimal untuk aktivitas kitinase termostabil bersifat cukup luas dengan kisaran 45-85 oC.
Aktivitas kitinase yang tinggi pada pH optimum disebabkan oleh terjadinya ionisasi asam-asam amino pada sisi aktif enzim, sehingga terjadi interaksi yang optimum antara enzim dengan substrat (Pujiyanto 2001). Hasil penelitian Toharisman (2004) menunjukkan enzim-enzim pendegradasi kitin bekerja optimum pada pH asam hingga netral, namun diketahui pula bahwa ada beberapa enzim yang yang optimum bekerja pada pH alkali (Tabel 2). Enzim kitinase asal isolate B. cereus I.5 yang terukur pada penelitian ini memiliki nilai aktivitas yang cenderung sama pada pH 5,0-8,0 dan kisaran suhu 26 oC, 45 oC, 50 oC, dan 55 oC baik ekstrak kasar maupun hasil pemekatan dengan amonium sulfat pada tingkat kejenuhan 10%. Tabel 2 pH dan suhu optimum kitin berbagai
bakteri kitinolitik
Bakteri pH Suhu Diacu dari * Kitinolitik Optimum Optimum
B. circulansWL-12 4,5 65oC Watanabe et al.
(1992) Vibrio sp. 5,0 40oC Takahasi et al.
(1993) Enterobacter sp. G-1 7,0 40oC Park et al.
(1997) Streptomyces RC1071 8,0 40oC Gomes et al.
(2001) Bacillus sp. 8,0 40oC Purwani et al.
(2002) Keterangan: *Sumber: Toharisman et al .(2004)
Enzim kitinase merupakan enzim pendegradasi kitin. Kitin terdapat pada eksoskeleton arthropoda seperti insekta, ketam dan udang. Telah diketahui sebelumnya bahwa 80% komponen eksoskeleton serangga tersusun atas senyawa kitin. Dalam pengujian enzim diperoleh hasil pengamatan yang menunjukkan bahwa kedua enzim baik ekstrak kasar maupun dan enzim pekat dapat mendegradasi kitin dari kutu tersebut. Hal ini terlihat dari preparat kutu yang semakin transparan karena terjadi penipisan eksoskeleton serangga hama tersebut (Lampiran 6).
Eksoskeleton kutu kontrol tanpa perlakuan enzim tampak sangat berbeda dengan kutu yang ditetesi enzim. Eksoskeleton kutu kontrol tetap terlihat gelap sampai hari ketiga inkubasi. Sedangkan kutu yang diberi enzim, eksoskeletonnya semakin transparan dan tampak berlubang-lubang halus. Semakin transparan preparat kutu menandakan semakin tipisnya eksoskeleton. Penipisan eksokleton tersebut merupakan akibat degradasi komponen kitin oleh aktivitas kitinase Bacillus cereus I.5. Oleh karena itu,
semakin transparan eksoskeleton kutu berarti semakin banyak kitin yang terdegradasi (Nurdebyandaru et al. 2010).
Degradasi eksoskeleton terbaik ditunjukkan oleh perlakuan menggunakan enzim yang telah dipekatkan. Perlakuan dengan enzim ekstrak kasar maupun enzim pekat yang telah diinkubasi pada suhu optimum 55 oC memberikan hasil yang lebih baik dibandingkan dengan enzim yang diinkubasi pada suhu ruang. Hal ini terlihat dari degradasi eksoskeleton yang mencapai lapisan lebih dalam dan proses penguraian kitin lebih cepat satu hari untuk enzim yang telah diinkubasi sebelumnya pada suhu optimum 55 oC.
Aplikasi kitinase sebagai agen biokontrol dapat diantaranya dapat dilakukan dengan cara penyemprotan secara langsung larutan kitinase pada tanaman, atau dengan cara penaburan kitin di sekitar tanaman untuk menginduksi sekresi kitinase oleh mikrob yang tergolong kitinolitik (Metcalfe et al. 2002). Cara lainnya yaitu dengan penyisipan gen kitinase terhadap tanaman sehingga dapat meningkatkan ketahanan terhadap serangan patogen, seperti yang telah dilaporkan Koga (2005) tanaman stroberi transgenik yang telah disisipi oleh gen kitinase lebih tahan terhadap serangan cendawan patogen. Fakamizo et al. (1996) juga melaporkan bahwa serangan patogen oleh Fusarium dapat ditekan karena degradasi dinding selnya oleh aktivitas kitinase B. pumilus.
SIMPULAN
meningkatkan kemampuan enzim tersebut dalam mendegradasi kitin eksoskeleton F. virgata.
DAFTAR PUSTAKA
Abun. 2005. Protein dan asam amino pada unggas [skripsi]. Bandung: Universitas Padjajaran.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem 72: 248-254. Dadang. 2006. Pengenalan hama utama dan
potensial tanaman jarak pagar (Jatropha curcas Linn.). Di dalam: Dadang, editor. Hama dan Penyakit Tanaman Jarak Pagar (Jatropha carcass Linn) Potensi Kerusakan dan Teknik Pengendaliannya. Prosiding workshop; Bogor, 5-6 Desember 2006. Bogor: Pusat Penelitian dan Bioenergi LPPM-IPB. hlm 8-16.
Fakamizo TY, Honda H, Ouchi S, Goto S. 1996. Chitinous component of cell wall of Fusarium oxysporum, its structure deduced from chitosanase digestion. Bioschi Biotech Biochem 60: 1705-1708.
Hambali et al. 2006. Jarak Pagar Penghasil Tanaman Biodiesel. Jakarta: Penebar Swadaya.
Hogenkamp DG. 2006. Chitin metabolism in insect: chitin synthases and beta-n-acetylglucosaminidases [disertasi]. Manhattan: Biochemistry Post Graduate School, Kansas State University.
Koga D. 2005. Application of chitinase in agriculture. J Met Mater Miner 15: 33-36.
Lonhienne et al. 2001. Cloning, sequences, and characterizm of two chitinase genes from the Antarctic Athrobacter sp. Strain TAD20: isolation and partial characterization of the enzymes. J Bacterial 183: 1773-1779.
Mahagiani I. 2008. Isolasi enzim kitinase dari bakteri perakaran tanaman cabai dan aplikasinya pada kutu kebul [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Metcalfe AC, Krsek M, Gooday GW, Prosser J, Wellington EMH. 2002. Molecular analysis of a bacterial chitinolitic community in an upland pasture. Appl Anviron Microbiol 68: 5042-5050. Minch MJ. 1989. Experiments in
Biochemistry: Project and Procedures. New Jersey: Englewood Cliffs.
Mubarik et al. 2010. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and its application as biocontrol for whitefly (Bemisia tabaci Genn.). Am J Agric Biol 5: 430-435.
Nurdebyandaru N. Mubarik NR, Prawasti TS. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and application as biocontrol for Aphiis gosyppi. Microbiol Indones 4: 103-107.
Pujiyanto S. 2001. Isolasi dan karakterisasi bakteri kitinolitik serta kloning shotgun gen kitinase dari ekosistem air hitam, Kalimantan Tengah [tesis]. Bogor: Institut Pertanian Bogor.
Rahayu et al. 2004. Study of thermostable chitinase enzymes from Indonesian Bacillus K-29-14. J. Microbiol. Biotechnol. 14: 647-652.
Scharz H, Moussian B. 2007. Electron microscopic and genetic dissection of arthropod cuticle differentiation. Di dalam: Mendez-Villaz, Diaz J, editor. Modern research and Educational Topics in Microscopy. Tuebingen: Formatex. hlm 316-325.
Spindler KD. 1997. Chitinase and chitosanase assays. Di dalam: Muzarelli RAA, MG Peter, editor. Chitin Handbook. Grottamare: Alda Tecnografica. hlm 229-235.
Scopes RK. 1994. Protein Purification, Principles and Practice. Ed. ke-2. New York: Springer-Verlag.
Septiningrum K, Moeis RM. 2009. Isolasi dan karakterisasi xilanase dari Bacillus circulans. Berita Selulosa 44(1): 31-40.
Toharisman A. 2004. Purification and characterization of thermostable chitinases from Bacillus licheniformis MS-2 [disertasi]. Bogor: Institut Pertanian Bogor.
9
Lampiran 1 Komposisi media dan reagen yang digunakan Media Produksi Kitinase (1 Liter)
Komposisi:
MgSO4.7H2O 0,1 g
K2HPO4 1 g
NaCl 1 g
Ekstrak khamir 7 g
Koloidal kitin 10 g
Reagen Schales (1 Liter) Komposisi:
K3Fe3(CN)6 0,5 g
Na2CO3 52,995 g
Cara membuat: Na2CO3 dilarutkan dalam 1 liter aquades kemudian K3Fe3(CN)6 dilarutkan ke
dalam larutan Na2CO3 dan disimpan dalam botol cokelat (botol gelap)
Reagen Bradford (1 Liter) Komposisi:
Coomassie Blue G-250 100 mg
Etanol 95% 50 ml
H3PO4 100 ml
H2O 850 ml
Cara membuat: Semua bahan dicampur (dilarutkan) dalam akuades kemudian disaring dengan menggunakan kertas saring, Setiap akan digunakan, reagen diencerkan terlebih dahulu menggunakan akuades dengan perbandingan 1:5
Larutan Standar Protein Komposisi:
Bovin serum albumin 10 mg
Akuades 10 ml
Lampiran 2 Jumlah (gram) amonium sulfat yang ditambahkan pada enzim (untuk 1 liter) (Scopes 1994)
Konsentrasi Amonium sulfat
(%) (gram)
0 0
10 55
20 113
30 176
40 242
50 314
60 390
11
Lampiran 3 Metode pengukuran aktivitas kitinase (Spindler 1997) dan pengukuran kadar protein (Bradford 1976)
Metode pengukuran aktivitas kitinase
Kultur disentrifuse 4400 g, 10 menit
Bahan Sampel (µl) Kontrol (µl) Kontrol Enzim(µl)
Substrat koloidal kitin 900 900 - Bufer fosfat 0,05 mM pH 7 450 450 -
Enzim 450 - 450
Diinkubasi 30 menit, suhu 55 oC Reaksi dihentikan, suhu 100 oC, 5 menit
Campuran didinginkan selama 10 menit, Kontrol Enzim kemudian dicampurkan pada kontrol
Disentrifuse 4400 g, 5 menit
Bahan Sampel (µl) Kontrol (µl) Blanko (µl)
Campuran enzim 600 600 - Bufer fosfat 0,05 mM pH 7 1500 1500 2100 Reagen Schales 3000 3000 3000
Direbus 10 menit, suhu 100oC diukur pada λ = 420 nm
Rumus:
# Aktivitas enzim: Y(absorbansi) = (Ab-As)-(Ab-Ac) Unit/ml = ppm x fp
X = konsentrasi (ppm) BM x V x t
# Aktivitas spesifik: Unit/mg = Aktivitas enzim (U/ml) Kadar protein (mg/ml) Keterangan:
U : Unit
As : Absorbansi sampel Ab : Absorbansi blanko Ac : Absorbansi kontrol
BM : Berat Molekul N-asetilglukosamin (221,1 Dalton) V : Volume enzim yang digunakan
t : Waktu inkubasi (30 menit)
Metode pengukuran kadar protein
Pereaksi Blanko (ml) Standar (ml) Sampel (ml)
Standar Protein (BSA) 0 0,1 0
Akuades 0,1 0 0
Enzim 0 0 0,1
Reagen Bradford 5 5 5
Campuran kemudian dikocok kuat dengan vortex, didiamkan selama 20 menit, kemudian di