Crocidolomia pavonana
DAN PENGARUH FITOTOKSISITAS
PADA BIBIT BROKOLI
CATUR HERTIKA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
(Lauraceae) terhadap Crocidolomia pavonana dan Pengaruh Fitotoksisitas pada
Bibit Brokoli. Dibimbing oleh GUSTINI SYABIRIN dan DADANG.
Aktivitas insektisida minyak atsiri daun 13 spesies Cinnamomum terhadap ulat
krop kubis Crocidolomia pavonana diuji dengan metode celup daun. Hasil
pengujian menunjukkan bahwa perlakuan dengan minyak atsiri daun C.
celebicum, C. multiflorum, C. sintoc, dan C. verum pada konsentrasi 1% (b/v)
mengakibatkan mortalitas berturut-turut 21.45, 93.65, 60.30, dan 76.10%.
Berdasarkan hasil uji fitotoksisitas dan aktivitas insektisida, dilakukan uji lanjutan
terhadap
C.
multiflorum
dalam 6 taraf konsentrasi.
Pada semua perlakuan,
mortalitas larva sudah terjadi pada 24 jam setelah perlakuan (JSP) dan meningkat
pada 48 JSP. LC
50minyak atsiri C. multiflorum pada 24 dan 48 JSP
masing-masing 0.504 dan 0.396%. Perlakuan dengan minyak atsiri C. multiflorum pada
konsentrasi
≤
0.31% tidak menghambat perkembangan larva C. pavonana.
Identifikasi komponen minyak atsiri 13 spesies Cinnamomum
dilakukan dengan
GCMS. Total komponen yang teridentifikasi mencapai 345 senyawa.
Metileugenol merupakan senyawa yang paling banyak ditemukan dalam minyak
atsiri
C. multiflorum dan diduga sebagai senyawa aktif yang memiliki aktivitas
insektisida terhadap ulat C. pavonana. LC
50metileugenol murni diperoleh pada
0.365% (48 JSP) dan 0.363% (72 JSP). Hasil pengujian menunjukkan bahwa C.
multiflorum
lebih efektif dengan nilai LC
50ekuivalen dengan kandungan
metileugenol sebesar 0.32% (24 JSP) dan 0.24% (48 JSP).
ABSTRACT
CATUR HERTIKA. Insecticidal Activity of Essential Oils Leaves of
Cinnamomum spp. (Lauraceae) against Crocidolomia pavonana and Their
Phytotoxicity on Broccoli Seedlings. Supervised by GUSTINI SYABIRIN and
DADANG.
Crocidolomia pavonana
DAN PENGARUH FITOTOKSISITAS
PADA BIBIT BROKOLI
CATUR HERTIKA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama
:
Catur Hertika
NIM :
G44086030
Disetujui
Pembimbing I
Dr. Gustini Syabirin, MS.
NIP 19600819 198903 2 002
Pembimbing II
Dr. Ir. Dadang, MSc.
NIP 19640204 199002 1 002
Diketahui
Ketua Departemen Kimia
Prof. Dr. Ir. Tun Tedja Irawadi, MS.
NIP 19501227 197603 2 002
Penulis dilahirkan di Lampung pada tanggal 24 April 1987 dari Ayah
Karnen dan Ibu Sri Utami. Penulis adalah putri keempat dari empat bersaudara.
Tahun 2005 penulis lulus dari SMA Negeri 8 Bogor dan pada tahun yang sama
lulus ujian seleksi masuk Program Keahlian Analisis Kimia Direktorat Program
Diploma Institut Pertanian Bogor (IPB). Lulus pada tahun 2008, penulis kemudian
diterima di Departemen Kimia Program Penyelenggaraan Khusus, Fakultas
Matematika dan Ilmu Pengetahuan Alam IPB.
PRAKATA
Segala puji dan syukur ke hadirat Tuhan Yang Maha Esa karena limpahan
kasih, anugerah, berkat yang tercurah, dan pertolongan-Nya sehingga penulis
dapat menyelesaikan karya ilmiah dengan judul “Aktivitas Insektisida Minyak
Atsiri Daun Cinnamomum spp. (Lauraceae) terhadap Crocidolomia pavonana dan
Pengaruh Fitotoksisitas pada Bibit Brokoli”.
Penulis mengucapkan terima kasih kepada Dr. Gustini Syahbirin, MS dan
Dr. Ir. Dadang, MSc. selaku pembimbing serta Ir. Djoko Prijono, MAgrSc. selaku
Kepala Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi
Tanaman IPB atas bimbingan, kepercayaan, arahan, dan doa yang telah diberikan
kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada seluruh staf
Laboratorium Kimia Organik Pak Sobur dan Bu Aah, serta kepada Pak Asep, Pak
Didi, dan Pak Saefudin serta staf Laboratorium Fisiologi dan Toksikologi
Serangga, kepada staf Bagian Pembibitan & Kesekretariatan Kebun Raya Bogor
(KRB) atas bantuan pengadaan sampel, Pak Jaswanto dan Ibu Eva di Bagian
Analisis Instrumental Puslabfor, serta pihak Balittro atas segala kerja sama yang
diberikan.
Terima kasih tak terhingga penulis ucapkan kepada Papah, Ibu, Mbak, dan
Mas serta seluruh keluarga atas doa, dukungan, kepercayaan dan kasih sayang
yang diberikan. Kepada Rina, Paul, Tetty, Lia, Rima, Ricky, Asha, Yoga, dan
teman-teman Ekstensi angkatan 2008, penulis ucapkan terima kasih untuk segala
bantuan, semangat, dan pengorbanan yang diberikan. Pun kepada rekan-rekan tim
penelitian Kak Nella, Astri, Siva, Ridho, Tito, Ibu Eka, Mbak Herma, Mbak Nia,
dan Kak Elsa yang telah membantu memberi tenaga, motivasi, doa, dan saran,
penulis ucapkan terima kasih.
Data yang dilaporkan dalam karya ilmiah ini berasal dari penelitian yang
merupakan bagian dari proyek penelitian berjudul “Pengembangan Formulasi
Insektisida Nabati Berbasis Ekstrak Tanaman Tephrosia vogelii untuk
Mengendalikan Hama Kubis Crocidolomia pavonana dan Hama Kutu Paracoccus
marginatus” dengan Peneliti Utama Ir. Djoko Prijono, MAgrSc. Proyek ini
dibiayai oleh Program Insentif Riset Terapan, Kementerian Negara Riset dan
Teknologi, Republik Indonesia. Untuk itu, penulis mengucapkan terima kasih atas
dukungan dana yang diberikan.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, Mei 2011
DAFTAR ISI
Halaman
DAFTAR TABEL... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Kayu Manis (Cinnamomum spp.)
... 1
Minyak Atsiri ... 2
Komponen Kimia Minyak Atsiri ... 2
Insektisida
Nabati...
4
Ekstraksi Komponen ... 4
Kromatografi Gas Spektroskopi Massa ... 5
Crocidolomia pavonana... 5
BAHAN DAN METODE
Bahan dan Alat... 5
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Analisis Sifat Fisik ... 7
Uji Fitotoksisitas ... 9
Aktivitas Insektisida... 9
Pengaruh Minyak Atsiri Terpilih terhadap Mortalitas dan Perkembangan
Larva C. pavonana ...
10
Identifikasi Komponen Minyak Atsiri dan Kegunaannya ... 13
Identifikasi dan Uji Aktivitas Senyawa Aktif... 14
SIMPULAN DAN SARAN
Simpulan ... 15
Saran... 15
DAFTAR PUSTAKA ... 15
LAMPIRAN... 19
DAFTAR TABEL
Halaman
1.
Indeks bias dan warna minyak atsiri 15 jenis sampel Cinnamomum spp… 8
2.
Gejala fitotoksisitas pada bibit brokoli yang diberi perlakuan minyak
atsiri Cinnamomum spp. 1% (b/v)……… 9
3.
Pendugaan hubungan konsentrasi-mortalitas minyak atsiri C. multiflorum,
minyak mimba, dan metileugenol terhadap larva instar II C. pavonana
dengan metode celup daun... 12
4.
Pengaruh minyak atsiri C. multiflorum dan minyak mimba pada
konsentrasi tertentu terhadap perkembangan larva C. pavonana...
13
DAFTAR GAMBAR
Halaman
1
Daun dan kulit kayu manis... 2
2
Struktur kimia komponen minyak atsiri... 3
3
Rendemen minyak atsiri daun Cinnamomum spp……… 8
4
Mortalitas larva C. pavonana pada perlakuan 15 jenis minyak atsiri
Cinnamomum spp………. 10
5
Perkembangan mortalitas larva C. pavonana pada perlakuan minyak
atsiri daun C. multiflorum...
11
6
Perkembangan mortalitas larva C. pavonana pada perlakuan minyak
mimba………... 11
7
Perkembangan mortalitas larva C. pavonana pada perlakuan metil-
eugenol………. 15
8 Struktur
metileugenol………... 15
DAFTAR LAMPIRAN
Halaman
1
Bagan alir penelitian... 20
2
Daftar spesies Cinnamomum spp.yang digunakan dalam penelitian... 21
3
Kadar air & rendemen minyak atsiri daun Cinnamomum
spp. dan kulit
kayu C. burmanii... 22
4
Warna minyak atsiri Cinnamomum spp. hasil distilasi dengan metode uap
air... 23
5
Pengaruh fitotoksisitas minyak atsiri Cinnamomum
spp konsentrasi 1%
pada bibit brokoli... 24
6
Hasil uji pendahuluan pengaruh minyak atsiri C. multiflorum terhadap
mortalitas larva C. pavonana instar II ... 25
7
Hasil uji lanjutan pengaruh minyak atsiri Cinnamomum spp. dan minyak
mimba terhadap mortalitas larva C. pavonana instar II berdasarkan
pengamatan pada fase perkembangan instar... 25
8
Hasil uji lanjutan pengaruh minyak atsiri Cinnamomum
spp. terhadap
mortalitas larva C. pavonana instar II... 26
9
Komponen utama minyak atsiri dari 15 spesies Cinnamomum spp... 27
10
Kromatogram minyak atsiri C. multiflorum menggunakan GCMS... 32
11 Fragmentasi senyawa metileugenol...
33
12 Hasil uji aktivitas insektisida metileugenol terhadap mortalitas larva C.
pavonana instar II... 34
PENDAHULUAN
Peningkatan produksi pertanian di Indonesia tidak lepas kaitannya dengan penggunaan pestisida. Pestisida telah lama digunakan sebagai pengendali hama, penyakit tumbuhan, serta gulma. Seiring dengan peningkatan kebutuhan akan produk pertanian, penggunaan pestisida semakin meningkat. Peningkatan tersebut disebabkan oleh sistem pertanian yang terlalu bergantung pada penggunaan pestisida sintetik (Sudarmo 1991). Gusfi (2002) melaporkan, sebanyak 95.5% petani sayuran di Jawa Barat bergantung pada pestisida sintetik dalam pengendalian hama dan penyakit. Kebergantungan ini dinilai karena pestisida sintetik memiliki keunggulan seperti lebih praktis dalam aplikasi, hasil pengendalian lebih cepat diketahui, dan lebih efisien dari segi waktu dan ekonomi, serta karena kurangnya ketersediaan teknik/strategi pengendalian lain (Dadang & Prijono 2005). Pemakaian pestisida sintetik dengan frekuensi yang tinggi dan aplikasi yang tidak bijaksana dapat memberikan dampak negatif terhadap lingkungan, pengguna, serta konsumen. Dampak tersebut antara lain residu yang berbahaya terhadap organisme bukan sasaran, ledakan hama, serta timbulnya resistensi terhadap pestisida tersebut.
Salah satu upaya memecahkan masalah ini, khususnya penggunaan insektisida sintetik, adalah dengan meningkatkan kualitas biopestisida (insektisida) melalui pengembangan formulasi insektisida nabati (Dadang & Prijono 2005). Insektisida nabati memiliki kelebihan seperti mudah terurai di lingkungan (biodegradabel), aman terhadap makhluk bukan sasaran, tidak menimbulkan resistensi, serta dapat dipadukan dengan cara pengendalian hama lain (Prijono 2005a).
Lima famili tanaman yang banyak menghasilkan insektisida nabati dan telah dikomersialkan adalah Solanaceae, Compositae, Leguminosae, Labiatae, dan Chenopodiceae (Feinstein 1952). Famili Meliaceae, Rutaceae, Asteraceae, Annonaceae, Labiatae, dan Cannellaceae juga mempunyai prospek yang cukup menjanjikan untuk pengembangan pestisida nabati. Bahan nabati lain yang dapat dimanfaatkan untuk pengendalian hama serangga adalah tanaman penghasil minyak atsiri. Minyak atsiri dilaporkan tidak hanya sebagai penolak serangga, tetapi memiliki efek kontak dan fumigan terhadap serangga tertentu serta memiliki aktivitas fungisida (Isman 2000).
Beberapa penelitian menyebutkan minyak atsiri famili Lauraceae, khususnya kayu manis (Cinnamomum spp.), memiliki potensi sebagai insektisida nabati (Kim et al. 2003; Jantan et al. 2005). Jantan et al. (2005) melaporkan adanya aktivitas insektisida minyak atsiri dari 8 jenis daun Cinnamomum spp. terhadap nyamuk Aedes aegypti dan A. Albopictus.
Efek yang kuat ditunjukkan terhadap larva dewasa setelah pemaparan selama 3 jam. Kandungan benzil benzoat dan benzil salisilat yang tinggi dari C. rhynchophyllum diduga menjadi sumber utama aktivitas insektisida tersebut. Pada C. osmopholeum kandungan sinamaldehida dapat menghambat pertum-buhan larva A. albopictus. Kandungan α-metil sinamaldehida, benzaldehida, dan trans -sinamaldehida menunjukkan aktivitas larvasida yang kuat (Cheng et al. 2003).
Aktivitas insektisida nabati dari
Cinnamomum spp. terhadap serangga
pemakan daun belum pernah dilaporkan sebelumnya. Oleh karena itu, diperlukan penelitian untuk mengetahui potensi minyak atsiri kayu manis sebagai sumber pestisida nabati untuk mengendalikan serangga pemakan daun. Kerugian produksi pertanian akibat serangan hama, termasuk produksi tanaman sayuran, sangat besar. Salah satu hama perusak adalah Crocidolomia pavonana,
yang lazim menyerang tanaman kubis-kubisan dan serangannya bersamaan dengan Plutella xylostella dapat menurunkan produksi hingga 100% (Rukmana 2001).
Penelitian ini bertujuan mengetahui komponen minyak atsiri kulit kayu manis C. burmanii, minyak atsiri C. cassia komersial dan daun kayu manis (Cinnamomum spp.) dari 13 spesies dengan kromatografi gas spektroskopi massa (GC-MS) serta membandingkan aktivitas insektisidanya terhadap hama ulat kubis (C. pavonana) dan fitotoksisitasnya terhadap bibit brokoli. Aktivitas insektisida minyak mimba digunakan sebagai pembanding.
TINJAUAN PUSTAKA
Kayu Manis (Cinnamomum spp.)
diperoleh dari pohon induk berumur minimum 10 tahun dan telah masak sempurna (Towaha & Indriarti 2008). Kendala budi daya tanaman ini adalah serangan penyakit bengkak dan bercak daun yang disebabkan oleh Aecidium cinnamon, Pestalotia cinnamon, dan
Cephaleuros virescens yang menyebabkan daun membusuk dan gugur. Penanaman kayu manis menghendaki tanah yang subur, gembur dengan pengairan yang baik, serta kaya bahan organik. Ketinggian daerah tanam berpengaruh pada produk kulit kayu manis yang dihasilkan. Semakin tinggi tempat tumbuh, warna kulit akan berubah mendekati cokelat sampai kecokelatan. Ketinggian terbaik adalah 500–900 m dpl.
Jenis kayu manis yang dikenal di dunia sebanyak 300 spesies dan beberapa spesies kayu manis di Indonesia antara lain C. burmanii, C. camphora, C. cassia, C. celebicum, C. grandiflorum, C. iners, C. javanicum, C. kinabaluense, C. sintoc, C. multiflorum, C. verum, C. subavenium, dan C. porrectum. Hasil utama tanaman kayu manis adalah kulit (Gambar 1), batang, dan dahan, sedangkan hasil sampingannya adalah ranting dan daun. Beberapa produk yang dihasilkan tanaman kayu manis adalah kulit utuh (stik), kayu manis, minyak atsiri, oleoresin, dan pestisida botani (Towaha & Indriarti 2008).
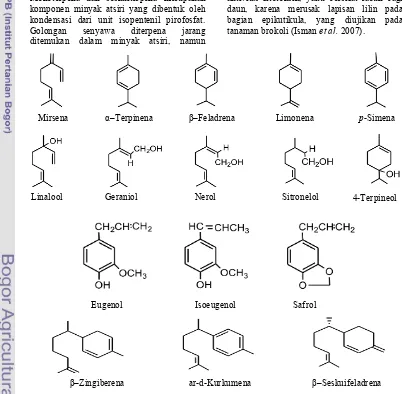
Gambar 1 Daun dan kulit kayu manis.
Kulit batang, dahan, dan ranting dapat digunakan untuk bahan minyak dan obat, serta dapat dihasilkan minyak atsiri yang banyak digunakan dalam industri kosmetika, farmasi, dan makanan. Maxwell & Tran (2007) menyatakan bahwa kayu manis tidak hanya digunakan sebagai pemberi aroma, tetapi juga dapat dimanfaatkan dalam bidang farmakologi seperti antimikrob, antiradang, antioksidan, dan antijamur.
Minyak Atsiri
Minyak atsiri merupakan zat yang memberikan aroma dan memiliki komponen atsiri yang khas pada beberapa tumbuhan. Minyak tersebut hanya dihasilkan oleh
tumbuhan yang memiliki sel kelenjar, yang terbentuk di dalam protoplasma sel serta tersimpan dalam bentuk mikrodroplet dalam sel kelenjar (Agusta 2000)
Famili tumbuhan yang umumnya dapat menghasilkan minyak atsiri antara lain: Lauraceae, Myrtaceae, Rutaceae, Astereaceae, Apocynaceae, Umbeliferae, Pinaceae, Rosaceae, dan Labiatae (Ketaren 1985). Tumbuhan dari famili Lauraceae seperti kayu manis menghasilkan minyak atsiri dengan komponen kimia bergantung pada spesiesnya. Perbedaan komponen minyak atsiri pada spesies Cinnamomum yang sama dapat disebabkan oleh faktor genotipe, ontogeni, pencahayaan, air, suhu, dan hara tanaman tersebut (Lin et al. 2007). Aroma yang dimiliki oleh minyak atsiri umumnya spesifik sesuai kandungan kimianya. Komposisi kimia tersebut mendasari penentuan aroma, kegunaan, ataupun mutu dari suatu minyak atsiri. Agusta (2000) melaporkan bahwa minyak atsiri dari jenis C. burmanii memiliki komponen utama sinamaldehida (Gambar 2), sedangkan spesies lain seperti C. zeylanicum
memiliki kadar sinamaldehida lebih rendah dengan kadar eugenol lebih besar (Hidayat & Ma’mun 1996).
Minyak atsiri tanaman kayu manis dapat diperoleh dari daun, ranting, kulit, dan serbuk kayu dengan cara melakukan proses distilasi uap, distilasi air, maupun proses ekstraksi. Rendemen minyak kulit kayu dahan berkisar 0.16%−1.26% dan kulit ranting 0.15%−1.18% berdasarkan bobot kering (Towaha & Indriarti 2008), sedangkan pada daun kayu manis segar dan kering berturut-turut 0.295 ± 0.015% dan 0.435 ± 0.027%. Cara pengeringan ber-pengaruh terhadap rendemen dan mutu minyak atsiri yang diperoleh (Windono et al.
1996). Kandungan minyak atsiri ditentukan pula oleh umur tanaman. Kandungan minyak atsiri pada tanaman yang berumur 6−12 tahun masih rendah, sedangkan kandungan tertinggi (3.5%−4.5%) ada pada tanaman dengan umur >15 tahun.
Komponen Kimia Minyak Atsiri
Terpena. Senyawa yang termasuk dalam golongan terpena antara lain mirsena, pinena, terpinena, limonena, p-simena, serta α dan feladrena. Senyawa terpenoid merupakan golongan terpena yang mengandung oksigen seperti kelompok monoterpena alkohol (geraniol, linalool, borneol, mentol), aldehida alifatik (sitral, sitronelal), keton monosiklik, dan keton monoterpena bisiklik (verbenona, fenchona)
Fenilpropena. Senyawa yang termasuk dalam fenilpropena antara lain golongan fenol aromatik seperti sinamaldehida, eugenol, anetol, safrol, dan metil salisilat. Kelompok asam dalam minyak atsiri antara lain asam sinamat dan asam sitronelat.
Seskuiterpena. Senyawa ini memiliki rantai karbon C15 seperti nerolidol, seskuifeladrena, farnesol, dan zingiberena. Monoterpena dan seskuiterpena merupakan komponen minyak atsiri yang dibentuk oleh kondensasi dari unit isopentenil pirofosfat. Golongan senyawa diterpena jarang ditemukan dalam minyak atsiri, namun
terkadang dijumpai sebagai produk samping(Koul et al.2008). Beberapa struktur kimia komponen minyak atsiri disajikan pada Gambar 2.
Minyak atsiri sering dimanfaatkan karena bioaktivitas komponennya, seperti mentol sebagai antiradang, eugenol sebagai germisida dan fungisida. Beberapa jenis minyak atsiri lain juga dikenal psikoaktif (psikotropika), antara lain karena kandungan safrol. Sinamaldehida pada kayu manis bersifat fungisida dan insektisida terhadap hama
Blattella germanica L (Towaha & Indriarti 2008). Senyawa sinamaldehida juga memberikan efek antifeedant untuk melawan hama pengganggu saat proses penyimpanan gandum seperti Tribolium castaneum dan S. zeamais (Ravidran et al. 2004). Eugenol dalam minyak kayu manis juga memiliki aktivitas fitotoksik, yaitu bersifat racun bagi daun, karena merusak lapisan lilin pada bagian epikutikula, yang diujikan pada tanaman brokoli (Isman et al. 2007).
Gambar 2 Struktur kimia komponen minyak atsiri (Koul et al. 2008). Mirsena
Isoeugenol
–Feladrena Limonena p-Simena
Linalool Geraniol Nerol
Eugenol
Sitronelol 4-Terpineol
α–Terpinena
Safrol
Insektisida Nabati
Insektisida nabati merupakan salah satu pestisida yang diperuntukan membasmi hama khususnya serangga. Pestisida dapat diartikan secara luas sebagai zat yang dapat bersifat racun, menghambat pertumbuhan dan perkembangan, memengaruhi tingkah laku, perkembangbiakan, dan kesehatan, me-mengaruhi hormon, menghambat bertelur, menghambat makan, membuat mandul, memikat, menolak, atau memiliki aktivitas lainnya yang memengaruhi organisme pengganggu tanaman (OPT) (Kardinan 1998).
Pestisida digolongkan menjadi 2 jenis, yaitu pestisida sintetik dan alami. Aplikasi pestisida sintetik umum digunakan dalam pengendalian hama karena dianggap paling praktis, mudah diperoleh, hasilnya cepat terlihat, dan mudah dikerjakan. Namun, aplikasi pestisida sintetik yang berlebihan menimbulkan dampak negatif karena sifatnya yang non-spesifik sehingga memiliki spektrum daya bunuh yang luas terhadap organisme lain. Di samping itu, terdapat kemungkinan dampak pencemaran lingkungan, keracunan terhadap manusia dan hewan, serta resistensi dan resurgensi pada hama serangga (Dadang & Prijono 2005).
Pestisida nabati relatif lebih aman dibandingkan dengan pestisida sintetik. Kurang stabilnya bahan aktif pestisida nabati di lingkungan merupakan suatu kelebihan untuk mengatasi masalah residu (Soetopo 1996). Pestisida nabati merupakan hasil ekstraksi bagian tertentu dari tanaman baik dari daun, buah, biji, atau akar yang memiliki senyawa atau metabolit sekunder bersifat racun terhadap hama dan penyakit tertentu (Sitepu 1999). Insektisida nabati dapat mengakibatkan satu atau lebih pengaruh berikut: mematikan langsung serangga dan bekerja sebagai racun saraf, sebagai repelen,
antifeedant, mencegah proses penetasan telur, mengacaukan sistem hormon, atau sebagai atraktan, serta memenuhi syarat untuk digunakan dalam pengendalian hama. Syarat insektisida nabati yang baik antara lain efektif pada konsentrasi cukup rendah, tidak meracuni tanaman, aman terhadap musuh alami dan hewan bukan sasaran, serta sumber tanaman mudah ditemukan dan dibudidayakan (Prijono 2005a).
Ravidran et al. (2004) melaporkan hasil uji laboratorium terhadap minyak kayu manis untuk pengendalian hama. Penelitian tersebut menunjukkan adanya efek toksisitas, menolak, menghambat pertumbuhan, pada hama kacang
Callosobruchus chinensis. Ekstrak petroleum eter dari kulit kayu manis dan minyaknya ditemukan bersifat racun bagi hama kacang tersebut dengan LD50 kurang dari 200 mg/mL. Senyawa sinamaldehida juga memberikan efek antifeedant untuk melawan hama pengganggu saat proses penyimpanan gandum seperti Tribolium castaneum dan S. zeamais
(Ravidran et al. 2004). Eugenol dalam minyak kayu manis juga memiliki aktivitas fitotoksik, yaitu bersifat racun bagi daun, karena merusak lapisan lilin pada bagian epikutikula, yang diujikan pada tanaman brokoli (Isman et al.
2007).
Kim et al. (2003) melaporkan adanya aktivitas insektisida pada ekstrak minyak atsiri akar C. siboldii hingga mencapai kematian 100% pada S. oryzae setelah 2 jam perlakuan.
C. cassia juga dilaporkan memberikan efek fumigan yang kuat terhadap hama tersebut (Lee et al. 2008).
Ekstraksi Komponen
Ekstraksi merupakan proses pengambilan senyawa tunggal atau majemuk dari suatu bahan dengan menggunakan pelarut tertentu berdasarkan distribusinya pada fase yang tidak bercampur. Metode ekstraksi yang tepat secara alamiah bergantung pada tekstur dan kandungan air serta jaringan tumbuhan yang akan diisolasi. Pengambilan minyak atsiri dapat dilakukan dengan metode distilasi, ekstraksi dengan pelarut, dan metode pengempaan. Metode distilasi paling umum digunakan.
Pada distilasi air, bahan yang akan disuling mengalami kontak langsung dengan air mendidih. Distilasi ini disebut distilasi langsung, sedangkan distilasi uap disebut distilasi tidak langsung. Perbedaannya, air penghasil uap ditempatkan secara terpisah kemudian uap dialirkan ke bagian bawah bahan tanaman yang akan didistilasi (Lutony & Rahmawati 1994). Untuk mempermudah proses pengambilan minyak, ukuran bahan harus diperkecil namun tidak terlampau halus. Ukuran bahan yang terlampau kecil (halus) akan mempersempit ruang antarpartikel yang menyebabkan proses distilasi berlangsung lama dan tidak efektif. Sebaliknya, jika bahan tidak diperkecil, minyak akan tetap tinggal di dalam jaringan tanaman.
akan berubah dan memengaruhi aroma yang dihasilkan.
Kromatografi Gas Spektroskopi Massa (GCMS)
Kromatografi gas spektroskopi massa (GCMS) mengombinasikan peralatan kromatografi gas-cair dengan spektroskopi massa. Instrumen ini digunakan untuk mengidentifikasi dan menentukan komponen organik atsiri dan semiatsiri dalam campuran yang kompleks. Selain itu, metode ini dapat menentukan bobot molekul dan komposisi dasar, serta struktur komponen organik yang tidak diketahui dengan mencocokkan spektrum dengan spektrum rujukan dan menginterpretasinya.
Metode ini telah lama digunakan untuk analisis minyak atsiri. Komponen minyak atsiri juga dapat diidentifikasi dengan kombinasi GC dengan detektor ionisasi nyala (FID) dan penentuan indeks bias, atau GC dengan deteksi unsur selektif. Identifikasi komponen minyak atsiri dengan GCMS didasarkan pada data spektrum massa dan waktu retensi, menggunakan screener library
(David et al. 2002).
Spektroskopi massa menyediakan informasi struktur lengkap untuk hampir semua komponen yang dapat diidentifikasi secara tepat, namun tidak dapat memisahkannya. Pada aplikasinya, spektrum komponen diterima oleh MS setelah keluar dari kolom GC, dan kemudian terfragmentasi menjadi bentuk ionnya (Skoog et al. 1998).
Kombinasi 2 teknik ini berkembang setelah perkembangan GC pada pertengahan 1950. GCMS digunakan untuk analisis kualitatif maupun kuantitatif. Analisis kualitatif dapat dilakukan dengan menganalisis kromatogram GC dan spektrum massa dari masing-masing puncak kromatogram tersebut. Analisis kuantitatif dapat dilakukan berdasarkan area puncak atau dari pemantauan ion selektif. Namun, dengan cara kedua ini MS tidak dapat menganalisis massa keseluruhan. Instrumen akan berpindah dari massa terpilih ke massa yang lain. Keuntungan pendekatan ini adalah efisiensi waktu, nisbah sinyal dan derau dapat dikurangi, dan meningkatnya kepekaan (Skoog et al. 1998).
Crocidolomia pavonana
C. pavonana merupakan salah satu hama umum tanaman famili Brassicaceae
(kubis-kubisan) yang dikenal dengan nama ulat krop kubis. Hama ini bersifat oligofag, tersebar di Afrika Selatan, Asia Tenggara, Australia dan Kepulauan di Pasifik, serta menyerang tanaman pada fase vegetatif dan generatif (Kalshoven 1981). Serangan hama ini bersama P. xylostella dapat menurunkan produksi hingga 100% pada musim kemarau (Rukmana 2001).
Metamorfosis ulat ini sampai mencapai pupa membutuhkan waktu ±27 hari, dengan siklus hidup ±4 minggu. Telur ulat yang berwarna kehijauan tersusun secara tumpang tindih pada permukaan bawah daun. Larva terdiri dari 5 instar, dengan instar awal hidup berkelompok di sekitar tempat telur diletakkan. Pada tahap selanjutnya instar masuk ke dalam krop dan memakan bagian dalamnya, namun apabila tanaman kubis belum membentuk krop, larva lebih suka makan bagian pucuk. Pupa terbentuk dalam tanah dalam kokon yang terbuat dari benang sutera dan butiran tanah, sedangkan imago berwarna putih kelabu dengan sepasang bercak cokelat pada sayap depan, dan bersifat nokturnal.
Pengendalian hama ulat kubis ini umumnya menggunakan pestisida sintetik. Namun, penggunaan pestisida dalam menekan populasi hama dengan cepat dapat menimbulkan efek yang tidak diinginkan. Pengendalian secara biologi dapat dilakukan dengan introduksi musuh alami (parasitoid) seperti Inareolata argentopilosa dan Stnermia incospianoides (Sastrosiswojo & Setiawati 1992). Namun, pengendalian ini belum dapat menekan populasi hama secara efektif. Insektisida nabati merupakan salah satu alternatif pengendalian yang cukup aman dan sesuai konsep pengendalian hama terpadu (PHT). Beberapa penelitian telah melaporkan adanya aktivitas insektisida terhadap hama C. pavonana, antara lain dari ekstrak biji Aglaia harmsiana (Meliaceae), ranting Dysoxylum acutangulum (Meliaceae), biji D. mollissimum
(Meliaceae), serta daun Tephrosia vogelii
(Leguminosae) (Abizar & Prijono 2010, Prijono 2005b, Wiyantono et al. 2001).
BAHAN DAN METODE
Bahan dan Alat
subavenium, C. sintoc, C. verum) yang di peroleh dari Kebun Raya Bogor, minyak atsiri kulit kayu manis C. burmanii, minyak atsiri C. cassia komersial, minyak mimba, akuades, Na2SO4 anhidrat, heksana, metanol, dan Tween-80.
Alat-alat yang digunakan ialah radas distilasi uap air, GCMS Agilent GC-MSD 5975s, vial kaca (diameter 1.5 cm X 4 cm), pipet mikro, cawan petri, dan alat kaca yang lazim digunakan di laboratorium.
Metode Penelitian
Metode penelitian ini terdiri atas tahap penapisan, uji pendahuluan, dan uji lanjutan. Tahap penapisan diawali dengan distilasi sampel daun dan pengujian minyak atsiri untuk memperoleh minyak dengan aktivitas tertinggi, serta pengujian fitotoksisitas. Tahap kedua adalah uji aktivitas insektisida pendahuluan dan lanjutan. Diagram alir penelitian ditunjukkan pada Lampiran 1.
Distilasi Sampel (Ketaren 1985)
Sampel daun kayu manis dari 13 spesies dikering-anginkan selama 7 hari (Wuri et al.
2004). Sampel sebanyak 800–1500 g ditimbang lalu diletakkan di atas piringan berupa ayakan yang terletak beberapa cm di atas permukaan air dalam ketel penyuling. Sampel kemudian didistilasi dengan menggunakan alat distilasi uap air selama 6–7 jam pada suhu 90–100 °C. Uap dari ketel mengalir ke kondensor, dan mengalami kondensasi, dan kondensat masuk ke dalam pipa. Air dan minyak akan terpisahkan dan dikeluarkan melalui cerat. Minyak yang diperoleh ditambahkan Na2SO4 anhidrat untuk menyerap sisa air yang ada.
Penetapan Kadar Air (AOAC 1990) Cawan porselen dikeringkan dalam oven selama 1 jam pada suhu 105 °C, kemudian didinginkan dalam eksikator dan ditimbang. Sampel sebanyak 2 g dimasukkan ke dalam cawan tersebut dan dikeringkan dalam oven pada suhu 105 °C sampai bobot konstan. Penentuan kadar air dilakukan terhadap semua bahan sebelum distilasi, dihitung dengan rumus berikut: awal bobot akhir bobot awal Bobot air
Kadar
Analisis Sifat Fisik Minyak Atsiri
Analisis fisika dilakukan dengan menganalisis warna, kejernihan, rendemen
berdasarkan bobot kering dan bobot basah, serta indeks bias.
Analisis GCMS (Vogler & Setzer 2006) Minyak atsiri dianalisis dengan GCMS Agilent GC-MSD 5975s yang dilengkapi kolom Hewlett-Packard 5MS (30 m X250 µm X 0.25 µm), dan gas pembawa helium. Suhu injektor 250 °C, kondisi oven diatur suhu awalnya 60 °C selama 5 menit kemudian dinaikkan 4 °C/menit sampai 240 °C selama 5 menit. Volume injeksi 2 μL dan split flow
1:30. Spektrum massa masing-masing puncak hasil analisis GC-MS selanjutnya diidentifikasi dengan spektrum massa senyawa yang telah diketahui pada basis data pustaka Wiley7n.L.
Uji Aktivitas Insektisida (Dadang & Prijono 2005)
Uji Penapisan. Minyak atsiri hasil distilasi 13 spesies dilarutkan dalam campuran metanol:Tween-80 (5:1) sampai konsentrasi 1% (b/v). Pakan berupa daun brokoli dipotong-potong berbentuk bujur sangkar (4 cm X 4 cm). Setiap daun dicelupkan ke dalam masing-masing larutan tersebut ±5 detik hingga basah merata lalu ditiriskan. Daun tersebut kemudian dimasukkan ke dalam cawan petri (diameter 9 cm) yang beralaskan tisu, kemudian 15 larva instar II C. pavonana
yang telah berganti kulit dimasukkan ke dalam cawan tersebut. Kontrol negatif ialah pakan yang dicelupkan ke dalam pelarut metanol:Tween-80 (5:1) sebanyak 1.2 mL dalam 100 mL. Setiap perlakuan diulangi 6 kali. Perlakuan terhadap ulat dilakukan selama 2 X 24 jam. Setelah 24 jam, pakan ditambah dengan daun brokoli baru yang telah dicelupkan pada minyak atsiri uji. Pengamatan dilakukan pada 48 jam setelah perlakuan (JSP) disertai dengan penggantian pakan dengan daun tanpa pencelupan terhadap minyak atsiri uji kemudian diamati sampai hari ketiga. Jumlah ulat yang mati dicatat.
Perhitungan kematian terkoreksi ulat dihitung dengan rumus sebagai berikut:
% 100 100 Kematian % Po Pc Po
Po= % kematian kumulatif pada perlakuan, Pc
= % kematian kumulatif pada kontrol (Perry
et al. 1998).
Minyak atsiri ditimbang dan ditambahkan campuran metanol:Tween-80 dalam labu takar 25 mL dan ditera dengan akuades. Konsentrasi akhir campuran metanol:Tween-80 dalam larutan adalah 1.2% (v/v), sedangkan konsentrasi minyak atsiri dibuat 1, 0.50, dan 0.01% (v/v). Daun pakan dipotong seragam dicelupkan ke dalam larutan pada konsentrasi yang telah dibuat sebelumnya, ditiriskan hingga pelarut kering, lalu dimasukkan ke dalam cawan petri yang diberi alas tisu. Sebanyak 15 ekor larva C. pavonana
instar II yang telah berganti kulit dimasukkan ke dalam cawan petri tersebut. Penambahan pakan dengan daun brokoli yang telah dicelupkan minyak atsiri uji dilakukan setelah 24 JSP, dan diganti dengan daun tanpa minyak atsiri uji setelah 48 JSP. Pengamatan dilakukan dengan menghitung ulat yang mati dan yang hidup setelah 48 JSP dan sampai hari yang ketiga.
Uji Lanjutan. Konsentrasi minyak atsiri yang cukup efektif pada uji tersebut, yaitu mengakibatkan kematian ≥50% diuji lebih lanjut pada 6 taraf konsentrasi dengan pengulangan sebanyak 6 kali. Cara pengujian yang dilakukan sama seperti pada uji pendahuluan dengan pengamatan kematian serta perkembangan larva setiap 24 jam sekali sampai larva mencapai instar IV. Data kematian kumulatif kemudian diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987).
Uji Fitotoksisitas
Bibit brokoli yang berusia 3 minggu disiapkan. Larutan minyak atsiri dari 13 spesies serta kontrol disiapkan dengan konsentrasi 1% kemudian diaplikasikan pada bibit brokoli dengan cara disemprotkan pada beberapa lembar daun pada bibit tersebut. Pengamatan dilakukan pada hari kedua sampai hari ketujuh
HASIL DAN PEMBAHASAN
Analisis Sifat Fisik
Perlakuan pendahuluan untuk daun
Cinnamomum spp. yang digunakan
(Lampiran 2) adalah pelayuan atau pengeringan dengan metode kering angin. Pengeringan ini bertujuan menguapkan sebagian air dalam bahan sehingga mempercepat dan mempermudah proses ekstraksi. Pada proses pengeringan, minyak atsiri akan berdifusi dan akhirnya dapat
menguap (Ketaren 1985). Metode ini dipilih untuk menghindari penguapan berlebihan fraksi minyak atsiri tersebut.
Distilasi dilakukan dengan uap air. Uap akan berpenetrasi secara merata ke jaringan bahan, dan suhu dapat dipertahankan sampai 100 °C. Distilasi dilakukan selama ±6 jam, laju distilasi berpengaruh terhadap perolehan minyak, namun tidak terhadap mutu minyak (Ketaren 1985). Dalam proses ini akan diperoleh campuran azeotrop, yaitu campuran yang komposisi fase uapnya sama dengan fase cairnya (Distantina 2009). Karena itu, pada proses distilasi, uap minyak akan bercampur dengan uap air dan terkondensasi secara bersamaan tanpa memengaruhi komposisi minyak tersebut. Distilasi uap air lebih baik dibandingkan dengan distilasi air karena uap berpenetrasi secara merata ke dalam jaringan bahan sehingga rendemen yang dihasilkan lebih besar (Ketaren 1985).
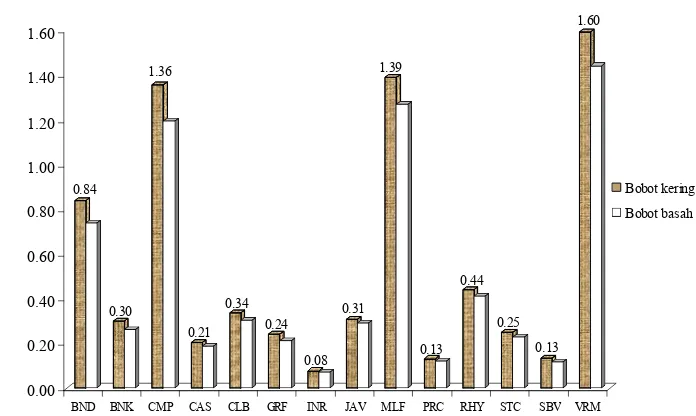
Perhitungan rendemen ekstrak hasil distilasi didasarkan pada bobot basah dan bobot kering (Lampiran 3). Koreksi kadar air sampel ditetapkan sebelum distilasi. Penetapan kadar air dimaksudkan untuk mengetahui bobot mutlak bahan (kadar air 0%). Berdasarkan bobot kering, rendemen minyak atsiri berkisar antara 0.08 dan 1.60%.
Terlihat pada Gambar 3, rendemen tertinggi diperoleh dari daun C. burmanii, C. camphora, C. multiflorum, dan C. verum
berturut-turut 0.84, 1.36, 1.39, dan 1.60%.
Rendemen ini dapat dipengaruhi oleh faktor luar antara lain perlakuan sebelum distilasi seperti pengeringan yang mengakibatkan hilangnya minyak atsiri (Ketaren 1985), kadar air bahan yang berkaitan dengan lamanya proses pengeringan, sifat fisik/ketebalan daun yang memengaruhi aliran uap selama distilasi serta proses distilasi yang digunakan.
Pada daun yang lebih tebal, proses hidrofusi, yaitu ekstraksi minyak dari sel kelenjar pada suatu jaringan tanaman, akan lebih lama. Rendahnya nilai rendemen tentunya juga dapat dikarenakan kecilnya produksi minyak dalam spesies tersebut.
0.84
0.30 1.36
0.21 0.34
0.24
0.08 0.31
1.39
0.13 0.44
0.25
0.13 1.60
0.00 0.20 0.40 0.60 0.80 1.00 1.20 1.40 1.60
R
en
d
em
en
(
%
)
BND BNK CMP CAS CLB GRF INR JAV MLF PRC RHY STC SBV VRM
Bobot kering
Bobot basah
Gambar 3 Rendemen minyak atsiri daun Cinnamomum spp. ( BND: C. burmanii daun, BNK: C. burmanii kayu, CMP: C. camphora, CAS: C. cassia, CLB: C. celebicum, GRF: C grandiflorum, INR: C. iners, JAV: C. javanicum, MLF: C. multiflorum, PRC: C. porrectum, RHY: C. rhynchophyllum, STC: C. sintoc, SBV: C. subavenium, VRM: C.
verum).
Indeks bias merupakan salah satu sifat optik yang lazim digunakan untuk menentukan mutu dan kemurnian suatu bahan. Diperoleh kisaran nilai indeks bias 1.4741– 1.5570 (Tabel 1). Hasil tersebut berbeda dengan indeks bias minyak daun kayu manis
asal Ceylon yang dianalisis oleh Gildemeister dan Hoffman yang berkisar 1.531 1.540 (20 °C) (Guenther 1990). Hal ini disebabkan perbedaan lokasi tumbuh dan perbedaan kandungan dari minyak atsiri tersebut.
Tabel 1 Hasil pengukuran indeks bias dan warna minyak atsiri dari 15 jenis sampel Cinnamomum
spp
No Sampel Indeks
bias Warna Intensitas warna
1 C. burmanii daun 1.5543 Kuning kecokelatan ++++ 2 C. burmanii kayu 1.5071 Kuning kecokelatan +++++
3 C. camphora 1.4741 Kuning kecokelatan ++++
4 C. cassia 1.5761 Kuning kecokelatan +++++
5 C. cassia komersial 1.5570 Kuning kecokelatan ++++++
6 C. celebicum 1.5351 Kuning kehijauan +++
7 C. grandiflorum 1.4952 Kuning kehijauan ++
8 C. iners 1.4850 Kuning kecokelatan +++++
9 C. javanicum 1.5502 Kuning kecokelatan +++
10 C. multiflorum 1.5253 Kuning kehijauan +
11 C. porrectum 1.5014 Kuning kehijauan ++++
12 C. rhynchophyllum 1.4759 Kuning kehijauan +++
13 C. sintoc 1.5351 Kuning kehijauan ++++
14 C. subavenium 1.4854 Kuning kehijauan +++
15 C. verum 1.5351 Kuning kecokelatan ++++++
Uji Fitotoksisitas
Aplikasi insektisida nabati di lapangan tidak hanya berakibat pada hama, namun dapat memengaruhi pula tanaman tempat hama berada. Efek merusak pada tanaman yang terpajan disebut fitotoksisitas. Zat-zat nonpolar yang berwujud minyak dalam ekstrak kasar sering kali bersifat fitotoksik dengan merusak lapisan lilin kutikula daun atau membran sel (Prijono 2005a).
Efek fitotoksik terlihat dengan gejala daun tampak melepuh di bagian epidermis (nekrosis), warna kecokelatan, mongering, dan akhirnya meninggalkan bercak putih pada daun. Hasil pengujian menunjukkan pada konsentrasi 1% gejala fitotoksisitas tidak terlihat pada C. burmanii kayu, C. camphora, C. javanicum, C. multiflorum, C. rhyn-chophyllum, dan C. subavenium, namun pada 10 sampel lain terlihat gejala fitotoksik (Tabel 2). Pada hari pertama setelah pemberian perlakuan, fitotoksisitas terlihat dengan gejala daun mulai melepuh. Beberapa hari kemudian epidermis mulai terpisah dan setelah 3 hari, terlihat bercak putih (Lampiran 5).
Tabel 2 Gejala fitotoksisitas pada bibit brokoli yang diberi perlakuan minyak atsiri Cinnamomum spp. 1% (b/v)
Sampel Gejala
C. burmanii daun Sedikit melepuh
C. burmanii kayu Normal
C. cassia Bercak melepuh,
epidermis terpisah, muncul bercak putih
C. campora Normal
C. celebicum Bercak (melepuh)
C. gradiflorum Bercak (melepuh)
C. iners Bercak (melepuh)
C. javanicum Normal
C. multiflorum Normal
C. porrectum Bercak melepuh, epidermis terpisah, muncul bercak putih
C. rhynchophyllum Normal
C. sintoc Bercak melepuh,
epidermis terpisah, muncul bercak putih
C. subavenium Normal
C. verum Bercak melepuh,
bercak putih merata di tiap daun
Kerusakan terparah terjadi pada perlakuan minyak atsiri uji C. verum. Pada konsentrasi
1%, daun mengalami nekrosis pada hari kedua yang kemudian disusul dengan munculnya bercak putih hampir merata pada setiap daun uji, sedangkan pada sampel lain kerusakan tidak merata dan jumlah bercak putih hanya sedikit
Permukaan daun tanaman brokoli ditutupi oleh lapisan malam (wax) (Dono 2004). Lapisan pada kutikula daun inilah yang dirusak oleh keberadaan komponen nonpolar seperti minyak atsiri yang juga dapat merusak membran sel daun. Gejala fitotoksisitas yang ditimbulkan hanya bersifat lokal (semisistemik). Ekstrak hanya diserap oleh jaringan tanaman khususnya daun, tetapi tidak atau hanya sedikit ditranslokasikan ke bagian tanaman lainnya (Djojosumarto 2008). Telah dibuktikan bahwa pucuk daun yang tumbuh setelah pemberian perlakuan terhadap tanaman dapat tumbuh normal. Hanya bagian daun yang diberi perlakuan mengalami gejala fitotoksisitas
Aktivitas Insektisida
Untuk mengetahui potensi minyak atsiri daun kayu manis sebagai insektisida nabati pada penelitian ini, dilakukan uji aktivitas insektisida yang meliputi uji mortalitas dan pengaruh ekstrak terhadap perkembangan larva. Uji dilakukan terhadap larva C. pavonana instar II. Instar merupakan salah satu tahapan perkembangan dalam metamorfosis yang ditandai dengan pergantian kulit larva.
Instar II dipilih karena pada fase ini larva sangat aktif, mulai makan banyak (rakus), dan menyebabkan kerusakan yang berat terhadap inangnya. Digunakan instar yang baru saja berganti kulit dan belum sempat memakan daun. Pada saat proses pergantian kulit larva cenderung tidak memakan daun (puasa). Karena itu, saat proses tersebut selesai merupakan waktu yang tepat untuk memberi pakan yang telah diberi perlakuan minyak atsiri uji.
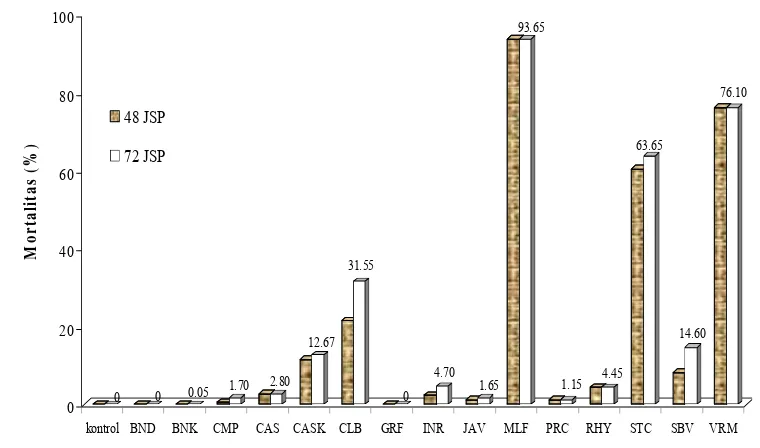
Uji mortalitas pendahuluan (penapisan) dilakukan dengan menguji 15 jenis minyak atsiri pada konsentrasi 1% (b/v). Pengujian ini bertujuan mengetahui spesies Cinnamomum
spp. yang memberikan aktivitas insektisida paling efektif. Uji mortalitas menunjukkan bahwa minyak atsiri dari C. celebicum, C. multiflorum, C sintoc, dan C. verum
dari keempat spesies tersebut memberikan kematian yang lebih tinggi dibandingkan dengan 11 minyak atsiri uji lainnya yang hanya memberikan mortalitas ≤8.15% sehingga dianggap kurang toksik terhadap larva C. pavonana.
Berdasarkan daya bunuh yang terjadi pada 48 JSP, diketahui bahwa efek minyak atsiri bekerja secara cepat, dengan kematian cenderung konstan seiring lamanya waktu perlakuan. Hal ini dapat disebabkan oleh cara masuknya racun serta mekanisme kerja minyak atsiri yang diduga sebagai racun saraf dengan mengganggu neuromodulator oktopamin dalam tubuh serangga target (Kostyukovsky et al. 2002). Minyak atsiri bekerja dengan menekan aktivitas sistem saraf, yaitu reseptor asam butirat –amino (GABA) sehingga menyebabkan hiper-aktivitas saraf maupun menyebabkan paralisis (kelumpuhan) (Djojosumarto 2006, Priestly et al. 2003).
Volatilitas minyak astiri yang besar oleh karena kandungan monoterpena yang tinggi, menyebabkan minyak atsiri dapat berperan sebagai fumigan (racun inhalasi), yaitu racun yang bekerja melalui sistem pernafasan (Kim
et al. 2003). Minyak atsiri masuk kefdalam tubuh serangga melalui sistem pernafasan dan selanjutnya ditransportasikan ke tempat racun
tersebut bekerja seperti pada sistem saraf. Buckle (1999) melaporkan adanya interaksi yang cepat dari komponen aroma minyak atsiri saat dihirup. Senyawa dalam minyak tersebut secara cepat berinteraksi dengan sistem saraf pusat dan langsung merangsang sistem olfaktori. Adanya aroma dari minyak atsiri juga ada yang memengaruhi aktivitas lokomotorik (Buchbauer et al. 1991).
Pengaruh Minyak Atsiri Terpilih terhadap Mortalitas dan Perkembangan
Larva C. pavonana
Pengujian lanjutan dilakukan terhadap jenis minyak atsiri yang tidak meracuni tanaman dan memberikan persentase kematian yang tinggi. Berdasarkan kriteria tersebut, minyak atsiri dari spesies C. multiflorum dipilih untuk diuji lebih lanjut. Uji pendahuluan juga dilakukan pada C. multiflorum untuk menentukan rentang konsentrasi yang diharapkan dapat mematikan serangga uji antara 0% dan 100% (Dadang & Prijono 2005). Hasil uji pendahuluan disajikan pada Lampiran 6, dengan persen mortalitas pada konsentrasi 0.5% mencapai ≤100%.
0 0 0.05 1.70 2.80 12.67 31.55 0 4.70 1.65 93.65 1.15 4.45 63.65 14.60 76.10 0 20 40 60 80 100 M o r ta lit a s ( % )
kontrol BND BNK CMP CAS CASK CLB GRF INR JAV MLF PRC RHY STC SBV VRM
48 JSP
72 JSP
Gambar 4 Mortalitas larva C. pavonana pada perlakuan 15 jenis minyak atsiri Cinnamomum spp.
(BND: C. burmanii daun, BNK: C. burmanii kayu, CMP: C. camphora, CAS: C. cassia, CASK: C. cassia komersial, CLB: C. celebicum, GRF: C. grandiflorum, INR:
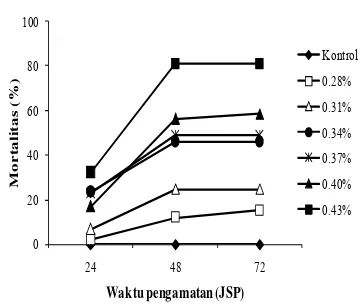
Hasil pengujian lanjutan minyak atsiri C. multiflorum pada 6 taraf konsentrasi memberikan tingkat kematian pada 24 JSP dan meningkat pada 48 JSP (Gambar 5). Peningkatan kematian larva tidak terjadi lagi setelah 48 JSP, yaitu setelah pergantian daun tanpa perlakuan (bebas minyak atsiri uji). Pola perkembangan mortalitas larva C. pavonana
tersebut menunjukkan bahwa bahwa senyawa aktif dalam minyak atsiri C. multiflorum
bekerja relatif cepat, sehingga kematian lebih banyak terjadi pada instar II, yaitu sebelum instar mengalami pergantian kulit menuju fase berikutnya (Lampiran 7 & 8).
0 20 40 60 80 100
24 48 72
M o r ta lit a s ( % )
Waktu pengamatan (JSP)
Kontrol 0.15% 0.23% 0.31% 0.39% 0.47% 0.55%
Gambar 5 Perkembangan mortalitas larva C. pavonana pada perlakuan minyak atsiri daun C. multiflorum.
Gambar 5 memperlihatkan mortalitas yang meningkat seiring dengan meningkatnya konsentrasi minyak atsiri uji. Keefektifan membunuh larva terlihat pada konsentrasi 0.31−0.55%, sedangkan konsentrasi 0.15 dan 0.23% belum cukup efektif. Nilai konsentrasi tersebut dapat disebut konsentrasi toleransi, yaitu batas konsentrasi yang masih dapat ditoleransi oleh serangga (Dadang & Prijono 2005).
Mortalitas larva C. pavonana pada konsentrasi 0.55% mencapai 75 hingga 96%. Hal ini menunjukkan bahwa minyak atsiri C. multiflorum berpotensi baik sebagai insektisida nabati. Dadang & Prijono (2005) menyatakan bahwa insektisida nabati yang diekstraksi dengan pelarut organik memiliki potensi yang baik apabila pada konsentrasi
≤1% sudah dapat mengakibatkan mortalitas serangga uji ≥80%.
Aktivitas insektisida minyak atsiri C. multiflorum juga dibandingkan dengan aktivitas insektisida minyak mimba
(Azadirachta indica, famili Meliaceae) pada 6 taraf konsentrasi. Mimba merupakan salah satu sumber insektisida botani berbahan aktif azadiraktin yang telah banyak diproduksi di India dan beberapa produk komersial insektisida telah terdaftar pada Komisi Pestisida (Prijono 2005a).
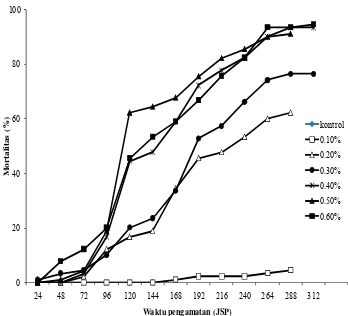
Berbeda dengan minyak atsiri C.
multiflorum yang cenderung memiliki efek mortalitas yang cepat, mortalitas larva C. pavonana yang diberi perlakuan minyak mimba baru mulai terjadi pada hari kedua perlakuan dan meningkat hingga hari ke-11 pada konsentrasi 0.20−0.60% (Gambar 6). Konsentrasi terendah (0.10%) tidak memberi peningkatan mortalitas yang cukup signifikan.
0 20 40 60 80 100
24 48 72 96 120 144 168 192 216 240 264 288 312
M o r ta lita s ( % )
Waktu pengamatan (JSP)
kontrol 0.10% 0.20% 0.30% 0.40% 0.50% 0.60%
Gambar 6 Perkembangan mortalitas larva C. pavonana pada perlakuan minyak mimba.
Mortalitas larva instar III akibat perlakuan minyak mimba ditemukan lebih banyak daripada instar II. Kematian larva instar II berkisar 1−36%, sedangkan kematian instar III berkisar 4−85% (Lampiran 7). Pada konsentrasi 0.60%, mortalitas larva instar II ditemukan pada hari kedua hingga hari ke-6 pengamatan, sebesar 36.67%. Sementara pada konsentrasi 0.20−0.40% mortalitas larva instar II hanya terjadi sampai hari ke-3 dan ke-4. Mortalitas instar III mulai terjadi pada hari ke-4 dan terus meningkat hingga akhir pengamatan (hari ke-14). Mortalitas instar III lebih banyak ditemukan pada konsentrasi 0.40%, kemudian diikuti oleh konsentrasi 0.50, 0.30, 0.20, dan 0.60%.
Minyak atsiri uji C. multiflorum
masih mampu bertahan akan kembali normal dan dapat bertumbuh mencapai instar akhir. Serangga uji yang diberi perlakuan minyak mimba memberikan perlakuan yang berbeda. Kematian lebih banyak ditemukan setelah pergantian daun tanpa perlakuan, yaitu setelah serangga mengonsumsi daun perlakuan dan tercerna dalam tubuh.
Secara umum, mortalitas larva sebagian besar terjadi pada hari ke-4 hingga ke-11. Setelah itu, kematian hanya mengalami sedikit kenaikan hingga akhir pengamatan.Pola perkembangan mortalitas larva C. pavonana
tersebut menunjukkan bahwa senyawa aktif dalam minyak mimba bekerja relatif lambat. Kandungan senyawa aktif dalam mimba antara lain azadiraktin, salanin, meliantriol, dan nimbin (Rukmana & Oesman 2002). Racun azadiraktin bekerja mengganggu proses fisiologis seperti mengganggu nafsu makan atau pertumbuhan serangga (Perry et al.
1998), serta bersifat sebagai racun perut, racun kontak, dan penolak hama. Meskipun efek kerja azadiraktin relatif lambat, namun setelah 7−10 hari setelah aplikasi serangga akan mati (Rukmana & Oesman 2002). Hal tersebut konsisten dengan hasil penelitian yang dilakukan, larva mengalami peningkatan kematian hingga hari ke-11 pengamatan. Gunasena & Marambe (1998) menyebutkan bahwa minyak mimba efektif digunakan pada hama ulat kubis.
Toksisitas minyak atsiri C. multiflorum
ditentukan sebagai konsentrasi letal (LC) pada jam setelah perlakuan yang masih memberikan kematian, yaitu 24 dan 48 JSP, sedangkan toksisitas minyak mimba
ditentukan pada konsentrasi yang mampu menyebabkan kematian pada instar II dan instar II+III. Minyak atsiri C. multiflorum
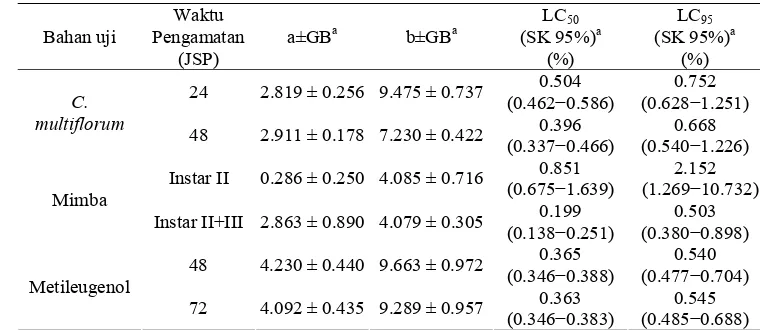
memberikan LC50 kurang dari 0.50% yang berarti cukup toksik. Sementara, LC95 menunjukkan nilai 0.67% pada 48 JSP dan 0.75% pada 24 JSP. Hasil analisis probit untuk semua perlakuan menunjukkan nilai LC50 dan LC95 pada 48 jam lebih kecil dibandingkan dengan 24 jam (Tabel 3). Hal tersebut sesuai dengan pola perkembangan mortalitas larva yang meningkat pada 48 JSP
C. multiflorum lebih toksik jika daripada minyak mimba. Nilai LC50 C. multiflorum sebagai insektisida baru cukup mendekati nilai LC50 minyak mimba. Minyak mimba yang memiliki cara kerja racun yang relatif lambat sehingga kematian terbanyak ditemukan pada perkembangan instar menuju dan mencapai instar III. Cara kerja racun dari C. multiflorum
yang relatif cepat dapat memberikan keuntungan, yaitu mengurangi besarnya residu yang tertinggal pada tanaman yang terpajan.
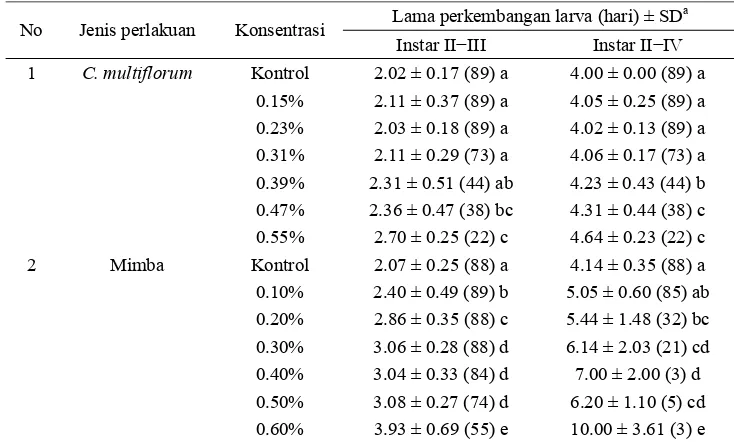
Pengaruh minyak atsiri uji terhadap larva tidak hanya kematian akibat toksisitas, namun juga pengaruh terhadap perkembangan larva, yaitu kemampuan larva menuju tahap instar berikutnya. Kisaran perkembangan larva akibat pemberian ekstrak uji dapat dilihat pada Tabel 4. Lama perkembangan larva instar II ke III hasil perlakuan terhadap minyak atsiri berkisar 2.3−2.7 hari, sedangkan lama perkembangan larva kontrol berkisar 2 hari. Perkembangan larva instar II−IV berkisar 4.2−4.6 hari, sedangkan pada kontrol berkisar 4 hari.
Tabel 3 Pendugaan hubungan konsentrasi-mortalitas minyak atsiri C. multiflorum, minyak mimba, dan metileugenol terhadap larva instar II C. pavonana dengan metode celup daun
Bahan uji
Waktu Pengamatan
(JSP)
a±GBa b±GBa
LC50 (SK 95%)a
(%)
LC95 (SK 95%)a
(%) 24 2.819 ± 0.256 9.475 ± 0.737 0.504
(0.462−0.586)
0.752 (0.628−1.251)
C. multiflorum
48 2.911 ± 0.178 7.230 ± 0.422 0.396 (0.337−0.466)
0.668 (0.540−1.226) Instar II 0.286 ± 0.250 4.085 ± 0.716 0.851
(0.675−1.639)
2.152 (1.269−10.732) Mimba
Instar II+III 2.863 ± 0.890 4.079 ± 0.305 0.199 (0.138−0.251)
0.503 (0.380−0.898) 48 4.230 ± 0.440 9.663 ± 0.972 0.365
(0.346−0.388)
0.540 (0.477−0.704) Metileugenol
72 4.092 ± 0.435 9.289 ± 0.957 0.363 (0.346−0.383)
0.545 (0.485−0.688)
a
Tabel 4 Pengaruh ekstrak C. multiflorum dan minyak mimba pada konsentrasi tertentu terhadap perkembangan larva C .pavonana.
a
SD = standar deviasi. Rataan pada lajur yang sama diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan (α = 0.05). Angka dalam kurung menunjukkan jumlah larva yang bertahan hidup.
Pengaruh minyak atsiri uji C. multiflorum
pada konsentrasi 0.15 hingga 0.31% tidak berbeda nyata dengan kontrol. Hasil berbeda nyata terlihat pada konsentrasi 0.39−0.55%, baik pada perkembangan instar II III maupun II IV. Hasil menunjukkan bahwa ekstrak uji
C. multiflorum di bawah nilai LC50 tidak cukup memengaruhi proses perkembangan larva. Pada konsentrasi tersebut serangga uji menyerap senyawa asing dari ekstrak uji, namun tubuh serangga masih mampu menetralkan tanpa mengganggu kemampuannya untuk berganti kulit. Berbeda pada konsentrasi 0.39 hingga 0.55% C. multiflorum serta minyak mimba pada semua konsentrasi, tubuh serangga mendetoksifikasi senyawa yang terserap dalam tubuh dan sebagai akibatnya, perkembangan akan lebih lama daripada keadaan normal (Nenotek 2010).
Senyawa aktif azadiraktin pada minyak mimba tidak membunuh secara cepat, namun strukturnya mirip dengan ekdison, hormon yang mengatur metamorfosis serangga dari larva hingga pupa dewasa. Akibatnya, senyawa tersebut menghambat siklus sintesis hormon ini dalam tubuh serangga (Gunasena & Marambe 1998). Pada perlakuan ekstrak C. multiflorum, serangga uji tidak hanya mengonsumsi residu yang terdapat pada daun perlakuan, namun juga dipengaruhi oleh aroma minyak atsiri ekstrak uji. Kematian
serta pengaruh terhadap perkembangan larva diduga akibat aroma minyak atsiri yang memengaruhi sistem saraf serangga tersebut.
Identifikasi Komponen Minyak Atsiri dan Kegunaannya
Identifikasi yang dilakukan terhadap 15 jenis minyak atsiri dari 13 spesies menghasilkan 345 senyawa dan 117 senyawa di antaranya memiliki kemiripan karena ditemukan hampir di setiap sampel uji. Senyawa monoterpena ditemukan hampir di setiap spesies dengan komposisi terbesar berupa golongan monoterpenoid. C. burmanii,
C. cassia, dan C. cassia komersial memiliki komposisi senyawa sinamaldehida terbanyak, yaitu berturut-turut 35.8, 27, dan 85%. Berdasarkan uji aktivitas sebelumnya, besarnya kandungan sinamaldehida pada ketiga sampel tersebut tidak menunjukkan efek insektisida yang cukup efektif terhadap mortalitas larva (Gambar 4). Meskipun mortalitas larva pada perlakuan C. cassia
komersial lebih tinggi dan sebanding dengan banyaknya sinamaldehida yang dimiliki, senyawa tersebut tidak cukup toksik terhadap
C. pavonana.
Pada C. celebicum dan C. verum, eugenol ditemukan sebagai komponen utama. Pada tanaman yang memiliki lapisan malam epikutikular, eugenol menyebabkan penu-Lama perkembangan larva (hari) ± SDa No Jenis perlakuan Konsentrasi
Instar II−III Instar II−IV 1 C. multiflorum Kontrol 2.02 ± 0.17 (89) a 4.00 ± 0.00 (89) a
runan senyawa elektrolit yang diindikasikan dengan rusaknya membran sel serta menghambat pertumbuhan benih secara signifikan (Isman et al. 2007). Karena itu, pada bibit brokoli yang diberi perlakuan ekstrak uji C. verum dan C. celebicum terlihat melepuh dan timbul bercak putih. Kandungan eugenol serta sinamaldehida pada C. verum
diduga memberikan efek sinergis yang menyebabkan tingginya mortalitas larva (Gambar 4). Berbeda dengan C. celebicum
yang walaupun komposisi utamanya eugenol (61.7%), tidak mengandung sinamaldehida sehingga tidak cukup toksik, dan mortalitas larva hanya mencapai 21.45%.
Komponen utama C. sintoc dan C. subavenium adalah senyawa safrol, yakni sebesar 62 dan 23.4%, dengan kandungan eugenol yang cukup berimbang, yaitu 3%. Pada uji sebelumnya, C. sintoc lebih toksik daripada C. subavenium. Pada Gambar 4, persentase kematian pada perlakuan ekstrak uji C. sintoc lebih besar dibandingkan dengan
C. subavenium. Demikian pula pada uji fitotoksisitas, ekstrak C. sintoc menyebabkan lapisan daun melepuh, sedangkan C. subavenium terlihat normal. Toksisitas C. sintoc tersebut dapat dipengaruhi oleh adanya senyawa benzil benzoat, yang tidak ditemukan pada C. subavenium. Menurut Jantan et al.
(2005), kandungan benzil benzoat dan benzil salisilat pada minyak atsiri Cinnamomum spp. memberikan efek insektisida yang kuat pada pengujian terhadap nyamuk A. aegypti dan A. albopictus. Safrol juga merupakan bahan dasar dalam pembuatan heliotropin (piperonal), yaitu bahan dasar untuk sintesis piperonal butoksida (PBO). Senyawa ini berperan kritis sebagai sinergis bagi insektisida yang inti aktifnya piretrum alami (Sait & Lubis 1996).
Senyawaan fenol seperti safrol, eugenol, dan metileugenol memiliki toksisitas yang lebih baik dibandingkan dengan senyawaan monoterpena (Koul et al. 2008). Spesies yang memiliki senyawaan tersebut memberikan aktivitas insektisida lebih tinggi, berturut-turut
C. sintoc, C. verum, dan C. multiflorum,
namun efek fitotoksik tidak ditemukan pada perlakuan ekstrak uji C. multiflorum.
Kandungan metileugenol dalam C. multiflorum sebesar 49.4% (Lampiran 9). Hasil ini berbeda dengan penelitian Thantsin
et al. (2008) yang menyebutkan kandungan utama dalam C. multiflorum dari Myanmar ialah sinamaldehida sebesar 29.57%. Perbedaan ini dapat dikarenakan perbedaan geografi tempat tumbuh. Tambahan pula,
spesies C. burmanii kulit kayu, C. porrectum,
dan C. javanicum dengan kandungan utama monoterpena seperti o-simena, sabinena, dan
α-kopaena tidak memberikan aktivitas insektisida yang tinggi.
Identifikasi dan Uji Aktivitas Senyawa Aktif
Hasil GCMS terhadap minyak atsiri terpilih (C. multiflorum) memperlihatkan area terbesar diperoleh pada puncak senyawa metileugenol, yaitu sebesar 49.4% dengan waktu retensi 25.14 menit (Lampiran 10). Pada waktu retensi tersebut diperkirakan suhu mencapai ±140 ºC, yang menandakan metileugenol menguap pada suhu tersebut. Fragmentasi yang diperoleh memiliki kesamaan dengan pustaka dengan qual 98% (Lampiran 11), serta dengan metileugenol pembanding. Berdasarkan hasil identifikasi GCMS diketahui komponen penyusun minyak atsiri C. multiflorum didominasi oleh golongan fenol (Lampiran 9). Komponen utamanya antara lain metileugenol (49.4%), linalool (6.4%), α-selinena (5.4%), (±)-7-epi-amitol (4.0%), -kubebena (3.6%), p-eugenol (3.5%), -selinena (3.3%), dan –feladrena (2.8%).
Berdasarkan analisis GCMS menggunakan metode pemantauan ion selektif(SIM), dapat diketahui besarnya kadar metileugenol dalam minyak atsiri C. multiflorum. Sebagai pembanding, digunakan produk insektisida yang diketahui memiliki kandungan senyawa aktif metileugenol sebesar 76.35% ≈ 0.7635 g/mL. Kurva standar menunjukkan nilai regresi 0.964 dengan kadar metileugenol dalam C. multiflorum sebesar 62.83% ≈ 0.6283 g/mL (Lampiran 13).
Senyawa aktif metileugenol juga diuji aktivitas insektisidanya terhadap C. pavonana.
Berdasarkan percobaan dengan 6 taraf konsentrasi, diperoleh pola yang hampir sama dengan aktivitas insektisida C. multiflorum,
0 20 40 60 80 100
24 48 72
Mo r t a li t a s (% )
Waktu pengamatan (JSP)
Kontrol 0.28% 0.31% 0.34% 0.37% 0.40% 0.43%
Gambar 7 Perkembangan mortalitas larva C.
pavonana pada perlakuan
metileugenol.
Hasil perhitungan menunjukkan bahwa senyawa aktif metileugenol memiliki nilai LC50 sebesar 0.365% pada 48 JSP dan 0.363% pada 72 JSP. Dibandingkan dengan LC50 C.
multiflorum (Tabel 3), dengan nilai LC50 0.504% atau ekuivalen dengan 0.32% metileugenol (24 JSP), dan 0.396% atau 0.24% metileugenol (48 JSP), maka minyak atsiri C. multiflorum lebih bersifat bioaktif. Hal tersebut memperlihatkan bahwa mortalitas yang diperoleh turut dikontribusi oleh adanya senyawa lain dalam minyak atsiri tersebut. Metileugenol (Gambar 8) merupakan feromon alami yang dapat menarik serangga sehingga dimanfaatkan sebagai atraktan pada dosis rendah.
Gambar 8 Struktur metil eugenol.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil pengujian 15 jenis minyak atsiri dari 13 spesies, spesies C. multiflorum memiliki aktivitas insektisida tertinggi, rendemen terbesar, dan tidak fitotoksik terhadap bibit brokoli. Ekstrak tersebut memiliki toksisitas cukup kuat dengan nilai LC50 sebesar 0.396% (48 JSP)
dan 0.504% (24 JSP), serta menghambat perkembangan larva pada konsentrasi
≥0.31%. Toksisitas ekstrak tersebut lebih lemah jika dibandingkan dengan minyak mimba.
Sebanyak 345 senyawa teridentifikasi dengan GCMS, dan 117 di antaranya dimiliki oleh hampir semua minyak atsiri uji. Metileugenol merupakan komponen utama minyak atsiri daun C. multiflorum yang memberikan aktivitas insektisida. Perbandingan LC50 minyak atsiri C.
multiflorum dan metileugenol menunjukkan bahwa senyawa lain dalam minyak atsiri turut berkontribusi pada aktivitas insektisida sehingga minyak atsiri tersebut lebih berpotensi untuk dimanfaatkan sebagai bahan alternatif pengendalian hama C. pavonana
dibandingkan dengan senyawa murni metileugenol.
Saran
Perlu dilakukan pengujian di lapangan untuk mengevaluasi efektivitas minyak atsiri serta kestabilan bahan di lingkungan serta pengujian lebih lanjut guna melihat mekanisme kerja racun terhadap tubuh target. Isolasi senyawa aktif lebih lanjut juga diperlukan guna mengetahui aktivitas senyawa aktif bahan tersebut. Selain itu, proses pengeringan serta penyulingan perlu ditingkatkan untuk mendapat mutu minyak terbaik.
DAFTAR PUSTAKA
Abizar M, Prijono D. 2010. Aktivitas insektisida ekstrak daun & biji Tephrosia vogelii J. D. Hooker (Leguminosae) & ekstrak buah Piper cubeba L. (Piperaceae) terhadap larva Crocidolomia pavonana
(F.) Lepidoptera Crambidae. J HPT Tropika 10:1-12.
Agusta A. 2000. Minyak Atsiri Tumbuhan Tropika Indonesia. Bandung: ITB Pr.
[AOAC] Association of Official Analytical Chemists. 1990. Official Methods of Analysis. Ed ke-15. Maryland: AOAC Int.
Buckle J. 1999. Use of aromatheraphy as complementary treatment for cronic pain.
J Alternative Ther 5:42-51.
Cheng SS, Chang HT, Chang ST, Tsai KH, Chen WJ. 2003. Bioctivity of selected plant essential oils against the yellow fever mosquito Aedes aegypti larvae. J Biores Technol 89:99-102.
Dadang, Prijono D. 2005. Insektisida Nabati;
Prinsip, Pemanfaatan & Pengembangan.
Bogor: Institut Pertanian Bogor.
David F, Scanlan F, Sandra P, Szelewski M. 2002. Analysis of Essential Oil Compounds Using Retention Time Locked Methods and Retention Time Database.
Wilmington: Agilent Technologies.
Distantina S. 2009. Keseimbangan uap cair. http://distantina.staff.uns.ac.id/files/2009/1 0/1keseimbangan-uap-cair-s1-pdf [25 Jan 2011].
Djojosumarto P. 2008. Pestisida dan Aplikasinya. Jakarta: Agromedia Pustaka.
Dono D. 2004. Aktivitas insektisida rokaglamida dan penghambatan respon imunitas larva Crocidolomia pavonana
(Fabricus) parasitoid Eriborus argenteopilosus (Cameron) [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Feinstein L. 1952. Insecticides from plant. Di dalam: United States Department of Agriculture Insect. Kuala Lumpur: University of Malaya Pr.
Guenther E. 1990. Minyak Atsiri. Jilid IV. Ketaren RS, penerjemah. Jakarta: UI pr.
Gunasena HPM, Marambe B. 1998. Neem in Srilanka, A Monograph. Srilanka: University of Peradeniya.
Gusfi V. 2002. Persepsi petani sayuran di Cipanas terhadap insektisida sintesis dan botani [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Harris R. 1990. Tanaman Minyak Atsiri. Jakarta: Penebar Swadaya.
Hidayat T, Ma’mun. 1996. Karakteristik minyak dari daun tiga jenis kayu manis. Di
dalam: Prosiding Simposium Nasional I Tumbuhan Obat dan Aromatik; Bogor, Balai Penelitian Tanaman Rempah dan Obat.
Isman MB 2000. Plant essential oils of pest and disease management. J Crop Protect
19:603-608.
Isman MB, Machial CM. Miresmailli S. Bainard LD. 2007. Essential Oil-Based Pesticides: New insight From Old Chemistry. Di dalam: Ohkawa H, Miyagawa H, Lee PW, editor. Pesticide. Chemistry Crop Protection, Public Health, Environmental Safety. Weinhein: Wiley-VCH Verlag GmbH, hlm. 201–209.
Jantan I, Yalvema MF, Ahmad NW, Jamal JA. 2005. Insecticidal activities of leaf oils of eight Cinnamomum spesies against
Aedes aegepty and Aedes albopictus. J Pharm Biol 43:526-532.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. PA van der Laan, (editor). Jakarta: Ichtiar Baru-Van Hoeve.
Kardinan A. 1998. Prospek penggunaan pestisida nabati di Indonesia. Litbang Pertanian 17:1‒8.
Ketaren IRS. 1985. Pengantar Teknologi Minyak Atsiri. Jakarta: Balai Pustaka.
Kim SI, Roh JY, Kim DH, Lee HS, Ahn YJ. 2003. Insecticidal activities of aromatic plant extract and essential oil against
Sitophilus oryzae and Callosobruncus chinensis. J Stored Product 39: 293‒303.
Kostyukovsky M, Rafaeli A, Gileadi C, Demchenko N, Shaaya E. 2002. Activation of octopaminergic receptors by essential oil constituents isolated from aromatic plants: Possible mode of action against insect pest. Pest Manag Sci 58:1101–1106
Koul O, Walia S, Djaliwal GS. 2008. Essential oil as green pesticides: Potential and constraints. J Biopestic Int 4:63‒84.
Lee EJ, Kim JR, Choi DR, Ahn YJ. 2008. Toxicity of cassia and cinnamon oil compounds to Sitophilus oryzae
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (CA): LeOra Software.
Lin KH et al. 2007. Major chemotypes and antioxidative activity of the leaf essential oils of Cinnamomum osmophloeum Kaneh from a clonal orchard. J Food Chem 105: 133-139.
Liu CH et al. 2006. Repellent and insecticidal activities of essential oil from Artemesia princieps and Cinnamomum camphora and their effect on seed germination of wheat & broad bean. J Biores Technol
97:1969‒1973.
Lutony TL, Rahmawati Y. 1994. Produksi dan Perdagangan Minyak Atsiri. Bandung: Penebar Swadaya.
Maxwell AE, Tran T. 2007. Cinnamon. More Than Flavor Agent. Amsterdam. Cassia Co-Op.
Nenotek PS. 2010. Bioaktivitas ekstrak kulit batang beberapa jenis tumbuhan Simaroubaceae dan daun Tephrosia vogelii
terhadap larva Crocidolomia pavonana
(F.) (Lepidoptera: Crambidae) [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Perry AS, Yamamoto I, Ishaaya I, Perry RY. 1997. Insecticides in Agriculture and Environment Retrospects and Prospects. New-York: Springer-Verlag.
Priesley CM, Williamson EM, Wafford KA, Sattelle DB. 2003. Thymol, a constituent of thyme essential oil is a positive allosteric modulator of human GABA receptors and a homo-oligomerid GABA receptor from Drosophila melanogaster.Br. J Pharmacol 140:1363– 1372.
Prijono D. 2005a. Pengembangan dan Pemanfaatan Insektisida Botani. Di dalam:
Bahan Pelatihan Singkat Pengembangan Agen Hayati dan Insektisida Botani; Kendari, 25‒30 Jul 2005. Bogor: Institut Pertanian Bogor.
Prijono D. 2005b. Polytomous quantal response of Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) to extracts of
Aglalia spp. & Dysoxylum spp. (Meliaceae). J HPT Tropika 5:1-10.
Ravindran PN, Babu NK, Shylaja M. 2004.
Cinnamon and Cassia. New York: CRC Pr.
Rukmana RH. 2001. Bertanam Kubis.
Yogyakarta: Kanisius.
Rukmana RH, Oesman YY. 2002. Nimba, Tanaman Penghasil Pestisida Alami. Yogyakarta: Kanisius.
Sait S, Lubis EH. 1996. Sintesis heliotropin dari minyak atsiri kulit sintok (Cinnamomum sintok Blume). Di dalam:
Prosiding Simposium Nasional I Tumbuhan Obat dan Aromatik; Bogor: Balai Penelitian Tanaman Rempah dan Obat.
Sastrosiswojo S, Setiawati W. 1992. Biology and control of Crocidolomia binotalis in Indonesia. Di dalam: Talekar NS, editor.
Proceedings of the Second International Workshop on Diamondback Moth and Other Crucifer Pest; Tainan, 10–14 Des 1996. Tainan: AVRDC. hlm 81–90.
Sitepu D. 1999. Prospek pestisida di Indonesia. Litbang Pertanian 11:1‒8.
Skoog DA, Hooler FJ, Nieman TA. 1998.
Principles of Instrumental Analysis. Ed ke-5. Orlando: Harcout Brace.
Soetopo D. 1996. Potensi mimba (Azadarictha indica A. juss) sebagai insektisida dan penolak makan serangga penggerek batang lada (Lophobaris piperis
Marsh.). Di dalam: Prosiding Simposium Penelitian Bahan Obat Alami VIII; Bogor, 24 Nov 1994. Bogor: Perhimpunan Peneliti bahan Obat Alami (Perhipba). hlm 116−118.
Sudarmo S. 1991. Pestisida. Yogyakarta: Kanisius.
Thantsin K, Zhang Q, Yang J, Wang Q. 2008. Compositition of semivolatile compounds of 10 Cinnamomum spesies from China and Myanmar. Nat Prod Res 20:576‒583.
Warta Litbang Tanaman Industri.
14:14‒16.
Vogler B, Setzer Wn. 2006. Natural Products From Plant. Ed ke-2. Leland J et al. (editor) Boca Raton: Taylor & Francis, hlm. 319-384.
Windono T, Santoso MH, Tajanti JE. 1996. Pengaruh cara pengeringan terhadap kadar dan kualitas minyak atsiri daun kayu manis (Cinnamomum zeylanicum Garc. Ex. BI). Di dalam: Prosiding Simposium Penelitian Obat Alami VIII; Bogor, 24
Nov 1994. Bogor: Perhimpunan Peneliti bahan Obat Alami (Perhipba). hlm 108– 114.
Wiyantono, Prijono D, Manuwoto S. 2001. Bioaktivitas ekstrak biji Aglaia harmsiana
terhadap ulat krop kubis, Crocidolomia binotalis. J Pertan Indones 10:1-7.
Wuri Y, Darmadji P, Rahardja B. 2004. Sifat sensoris minyak atsiri daun kayu manis (Cinnamomum burmanii Nees ex Blume).
Lampiran 1 Bagan alir penelitian
Pengeringan daun
Distilasi uap air
Minyak atsiri
Fitoto