15
Lampiran 1 Alur kerja penelitian
Isolasi oligosakarida madu
Deteksi dan isolasi oligosakarida dengan KLT
16
Lampiran 2 Rendemen madu hutan Gunung Tambora Sumbawa
Sampel B1 B0 % rendemen
S150 0,1159 5,02 2,308765 S250 0,0937 5,0057 1,871866
SI80 0,3923 5,0297 7,799670 S280 0,3776 5,0768 7,437756
Lampiran 4 Pengkondi
kondisian alat untuk standar maltotriosa
Lampiran 5 Pengkondi
kondisian alat untuk standar maltotetraosa
20
Lampiran 6 Kromatogram hasil identifikasi standar glukosa, maltotriosa, dan maltotetraosa
Standar
21
Lampiran 7 Kromatogram hasil identifikasi glukosa, maltotriosa, dan maltotetraosa pada madu murni
Madu murni
22
Lampiran 8 Kromatogram hasil identifikasi glukosa, maltotriosa, dan maltotetraosa pada isolat oligosakarida
Isolat Madu
23
Lampiran 9 Rekapaitulasi data identifikasi oligosakarida madu menggunakan
LC-MS
Senyawa tipe ulangan ke- RT Area Konsentrasi Rata-rata
Maltotriosa Standar 1 2,26 2932,514 10,6 10
2 2,26 2781,206 10,05
3 2,26 2586,791 9,35
Madu murni Analit 1 2,24 69493,89 251,17 246,9433
2 2,24 68857,38 248,87
3 2,24 66623,36 240,79
Isolat Analit 1 2,23 25661,38 92,75 95,03
2 2,24 26693,76 96,48
3 2,23 26522,78 95,86
Senyawa tipe ulangan ke- RT Area Konsentrasi Rata-rata
Maltotetraosa Standar 1 2,24 2.045 10,62 10
2 2,24 1799,042 9,35
3 2,23 1930,791 10,03
Madu murni Analit 1 2,22 4682,381 24,32 23,26667
2 2,22 4464,522 23,19
3 2,22 4291,054 22,29
Isolat Analit 1 2,12 22287,77 115,78 118,7133
2 2,11 23133,91 120,18
3 2,11 23135 120,18
Senyawa tipe ulangan ke- RT Area Konsentrasi Rata-rata
Glukosa Standar 1 2,31 10583,51 9,55 10,00333
2 2,31 11094,92 10,01
3 2,31 11583,46 10,45
Madu murni Analit 1 2,4 2438709 2199,55 2182,957
2 2,4 2426388 2188,35
3 2,4 2395928 2160,97
Isolat Analit 1 2,38 309484,1 279,13 278,3433
2 2,29 307260,5 277,13
3 2,29 309075,6 278,77
12
of honey. Tohoku Journal of Agriculture Research11: 101-108.
Astwood K, Lee B, Manley-Harris M. 1998. Oligosaccharides in New Zealand Honeydew Honey. J. Agric. Food Chem.46: 4958-4962
Balasubramanyam MV. 2011. Role of invertase enzyme in ripening of honey of indigenous hive honeybee
apis cerana indica. J Chem Bio Phys1: 322-327
Biedrzycka, Bielecka M. 2004. Prebiotic effectiveness of fructans different degrees polymerization. Trends in Food Sci & Tech15: 170-175.
Bogdanov S, Jurendic T, Sieber R,Gallmann P. 2008. Honey for Nutrition and Health: a Review. J Am Coll Nutr.
27: 677-689
Bogdanov S. 2009. The Book of Honey Chapter 5: Honey Composition.
Bee Product Science [terhubung berkala]. www.bee-hexagon.net.[20 November 2011].
Bradbear N. 2009. Bees and Their Role in Forest Livelihoods. Roma: FAO.
Dwisaputri NZ. 2009. Uji potensi antibakteri madu dari lebah Apis mellifera
terhadap Pseudomonas aeruginosa in vitri [Skripsi]. Yogyakarta: Fakultas Kedokteran, Universitas Islam Indonesia.
[FAO] Food Agriculture Organization. 2007.
FAO Technical Meeting on Prebiotics. Roma: FAO.
Fauzan A. 2002. Perancangan Penurun Kadar Air Madu (Honey Dehydrator).
Research Report from JIPTUMM
[terhubung berkala].
http://digitlib.itb.ac.id/index.php.[2 6 September 2009].
Gheldof N, Engeseth NJ. 2002. Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in
human serum samples. J Agric Food Chem. 20: 3050-3055.
Hernandez O, Ruiz-Matute AI, Olano A, Moreno FJ, Sanz ML. 2009. Comparison of fractionation techniques to obtain prebiotic galactooligosaccharides.
International Dairy Journal 19: 531-536.
Joshi et al. 2000. Physico-chemical characteristics of Apis dorsata, A. ceranaandA. melliferahoney from Chitwan district, central Nepal.
Apidologie.31: 367-375.
Kim UT et al. 1995. Purification and Characterization of a Maltotetraose-Forming Alkaline a-Amylase from an Alkalophilic
Bacillus Strain, GM8901. Appled and Environtmental Microbiology.
61: 3105-3112.
Karimah U. 2010. Isolasi Oligosakarida Madu Lokal dan Analisis Aktivitas Prebiotiknya. [skripsi]. Bogor. Fakultas matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Morales V, Sanz ML, Olano A, Corzo N. 2006. Rapid Separation on Activated Charcoal of High Oligosccharides in Honey.
Chromatographia.64: 233-238
Mort AJ, Pierce MC. 2002.Preparation of carbohydrates for analysis by modern chromatography and electrophoresis. Journal of Chromatography Library66: 3-35.
Nanda V.Sarkar BC, Sharma HK, Bawa AS. 2003. Physico-chemical properties and estimation of mineral content in honey produced from different plants in Northern India. Journal of Food Composition and Analysis16: 613-619.
13
Pontoh J. 2001. Isolation, Purification, and Characterization of Glucosidases From Three Honey Bee Species (Apis mellifera, A. Cerana, A. Dorsata). [Thesis]. Kanada: Departement of Applied Microbiology and Food Science, University of Saskatchewan.
Pontoh J, Low NH. 2002. Purification and characterization of betaglucosidase from honey bees (Apis mellifera). Insect Biochemistry and Molecular Biology32: 679-690.
Prihartini I. 2000. Program Penerapan IPTEK untuk Pengembangan Usaha Kecil dan Menengahdalam Memicu Ekspor Non Migas. [Skripsi]. Malang: Fakultas Pertanian dan Peternakan, Univesitas Muhamdiyah Malang.
Refiyanti E. 2011. 70% Produk RI Dipasok Produk Impor. [terhubung berkala]. www.bisnis.com/articles/ 70- percent-kebutuhan-madu-ri-dipasok-produk-impor. [12 Juli 2011].
Rittig F. 2001. Chemische und Enzymatische Herstellung von Oligosacchariden, Deren Isolierung Charakteriserung und Prufung auf Funktionelle Eigenschaften. Bayreuth University.
Roberfroid M. 2007. Prebiotics: the concept revisited.J Nut137:830-837.
Ruiz-Matute AI, Brokl M, Soria AC, Sanz ML, Matinez-Castro. 2010. Gas chromatographic-mass
spectrometric 13haracterization of tri- and tetrasaccharides in honey.
Food Chem120: 637-642.
Schneider P, Ralton JE, McConville MJ,
Ferguson MAJ. 1993.
Characterization of glycoinositol phospholipids in the amastigote stage of the protozoan parasite
Leishmania major. Anal Biochem.
210: 106-112.
Soga T. 2002. Analysis of carbohydrates in food and bevarages by HPLC and
CE. Journal of Chromatography Library66: 483-502.
Vazquez C, Perez Coello MS, Cabezudo MD. 2003. Analysis of volatile compounds of rosemary honey: comparison of different extraction techniques Chromatographia 57: 227-233.
Vergara CMAC, Honorato TL, Maia GA, Rodrigues S. 2010. Prebiotic effect of fermented cashew apple (Anacardium occidentale L) juice. Food Science and Technology 43: 141-145.
Wetzel DLB, Charalombus G. 1998.
Instrumental Methods in Food and Beverage Analysis. Amsterdam: Elsevier.
Weston RJ, Brockleblank LK. 1999. The oligosaccharide composition of some New Zealand honeys. Food Chem 64: 33-37.
Whistler RL, Durso DF. 1950. Chromatographic Separation of Sugars on Charcoal. J Am Chem Soc72: 677-679.
Wichienchot S, Jatupornpipat M, Rastall RA. 2010. Oligosaccharides of pitaya (dragon fruit) flesh and their probiotic properties. Food Chem
120: 850-857.
Yao et al. 2003. Flavonoids, phenolic acids and abscisic acid in Australian and New Zealand Leptospermum
ISOLASI DAN
HUTA
FAKULTAS MA
N IDENTIFIKASI OLIGOSAKARID
TAN GUNUNG TAMBORA SUMBAWA
YOGI NUR ANGGOWO
DEPARTEMEN BIOKIMIA
ATEMATIKA DAN ILMU PENGETAHU
INSTITUT PERTANIAN BOGOR
BOGOR
2012
IDA MADU
WA
ABSTRAK
YOGI NUR ANGGOWO. Isolasi dan Identifikasi Oligosakarida Madu Hutan
Gunung Tambora Sumbawa. Dibimbing oleh SYAMSUL FALAH dan WARAS
NURCHOLIS.
ABSTRACT
YOGI NUR ANGGOWO. Isolation and Identification of Oligosaccharides from
Forest Honey of Mount Tambora Sumbawa. Under the direction of SYAMSUL
FALAH and WARAS NURCHOLIS.
ISOLASI DAN IDENTIFIKASI OLIGOSAKARIDA MADU
HUTAN GUNUNG TAMBORA SUMBAWA
YOGI NUR ANGGOWO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul skripsi : Isolasi dan Identifikasi Oligosakarida Madu Hutan Gunung
Tambora Sumbawa
Nama
: Yogi Nur Anggowo
NIM
: G84061557
Disetujui
Komisi Pembimbing
Dr. Syamsul Falah, S.Hut, M.Si.
Waras Nurcholis, M.Si.
Ketua
Anggota
Diketahui
PRAKATA
Alhamdulillah, puji syukur penulis panjatkan kehadirat Allah SWT atas
segala nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian
ini. Penelitian ini berjudul Isolasi dan Identifikasi Oligosakarida Madu Hutan
Gunung Tambora Sumbawa. Kegiatan ini merupakan bagian dari pelaksanaan
Program Kreativitas Mahasiswa Bidang Penelitian (PKM-P) yang didanai oleh
Direktorat Jenderal Pendidikan Tinggi (DIKTI). Kegiatan penelitian sudah
dilaksanakan di Laboratorium Penelitian Departemen Biokimia, FMIPA, IPB, dari
bulan Juli 2010 hingga Maret 2011.
Penulis mengucapkan terima kasih kepada Bapak Dr. Syamsul Falah, S.Hut,
M.Si. selaku pembimbing utama, dan Bapak Waras Nurcholis, M.Si. selaku
anggota yang telah memberikan saran, kritik, dan bimbingannya. Terima kasih
kepada keluarga besar Biokimia atas semua kerja samanya, serta teman-teman di
Biokimia angkatan 43 yang selalu memotivasi penulis, khususnya kepada Umul
Karimah sebagai rekan seperjuangan yang sangat luar biasa peranannya dalam
proses perencanaan, pengerjaan di Lab, serta penyusunan karya ilmiah ini.
Ucapan terima kasih juga penulis sampaikan kepada orang tua, kakak
penulis, serta Emmi Kustianti beserta keluarga untuk semua dukungan dan doanya
yang sangat berarti bagi penulis. Semoga seluruh bagian penelitian ini dapat
memberikan manfaat bagi semua orang yang membacanya.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 29 November 1988 dari Ayah
Mukadji dan Ibu Maryatun. Penulis merupakan anak ke-4 dari 4 bersaudara.
Tahun 2006 penulis lulus dari SMAN 89 Jakarta dan pada tahun yang sama
lulus seleksi masuk IPB melalui Seleksi Penerimaan Mahasiswa Baru (SPMB).
Penulis memilih Mayor Biokimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
11
contoh, merupakan hasil dari transfer satu unit molekul glukosa dari sukrosa ke gugus 4-hidroksil di glukosa dalam satu molekul sukrosa.
β-Glukosidase juga telah ditemukan di dalam madu. Enzim ini dihasilkan di kelenjar hipoparingeal lebah yang disekresikan ke dalam proboskis pada saat pemberian pakan larva lebah, ditransfer ke dalam sarang lebah, dan selanjutnya sampailah ke dalam madu (Pontoh dan Low 2002). Enzim tersebut bekerja pada ikatan β-(1-4), menghidrolisis β -D-glukosidase menjadi glukosa, dan juga mengkatalisis pemindahan D-glukosa ke molekul akseptor yang sesuai (molekul glukosa lain atau molekul glukosa tersubtitusi) (Pontoh 2001).
Invertase ragi terdapat di dalam madu. Enzim ini berasal dari ragi yang terbawa bersama serbuk sari tumbuhan penghasil nektar. Enzim ini merupakan enzim fruktosidase yang mengkatalisis pemindahan D-kelompok fruktofuranosil ke gula lain, membentuk oligosakarida yang mengandung D-fruktosa (Balasubramanyam 2011).
Oligosakarida pada madu memiliki potensi sebagai prebiotik. Karimah (2010) telah melakukan uji aktivitas prebiotik dari madu hutan Gunung Tambora Sumbawa. Dalam studinya, Karimah (2010) membandingkan aktivitas stimulasi bakteri usus besar yang dihasilkan oleh isolat oligosakarida madu tersebut dengan oligosakarida komersil yang telah banyak digunakan yaitu inulin. Hasil studinya menyatakan bahwa isolat oligosakarida madu hutan Gunung Tambora Sumbawa memberikan stimulasi pertumbuhan bakteri probiotik yang lebih baik dibandingkan prebiotik sintetik inulin. Oligosakarida pada madu umumnya memiliki DP 2-6. Jika dibandingkan dengan Inulin yang memiliki DP 10-60, oligosakarida madu yang larut air, berantai pendek, dan tanpa percabangan akan lebih mudah dimanfaatkan oleh bakteri probiotik. Biedrzycka & Bielecka (2004) tersebut telah membandingkan aktivitas prebiotik dari inulin dan fruktooligosakrida (FOS) yang memiliki DP rata-rata 3.7.
Fruktooligosakarida (FOS) dan Galaktooligosakarida (GOS) merupakan prebiotik sintetik yang telah banyak digunakan dalam industri pangan. FOS diperoleh dari sukrosa dengan bantuan enzim transfruktosilase atau hidrolisis enzimatik terkontrol dari ekstrak alami. GOS diperoleh dari laktosa melalui proses transglikosilasi (Roberfroid 2000). Produksi FOS ataupun
GOS tentu saja memerlukan biaya serta waktu yang tidak sedikit. Biaya serta waktu tersebut dapat dihemat dengan cara mengkonsumsi madu yang tersedia melimpah di alam, yang dapat memenuhi kebutuhan prebiotik serta memiliki berbagai manfaat lainnya bagi tubuh.
SIMPULAN DAN SARAN
Simpulan
Oligoskarida DP 3-4 dapat diisolasi dan diidentifikasi dari madu hutan Gunung Tambora Sumbawa. Oligosakarida DP 3-4 dapat diisolasi menggunakan metode arang aktif dengan penambahan etanol 10% untuk penghilangan monosakarida dan 50% untuk pemulihan oligosakarida. Campuran eluen KLT butanol: asam asetat: air (3:1:1 v/v) memberikan keterpisahan lebih baik dibanding butanol: etanol: air (4:3:3 v/v). Kandungan glukosa (DP 1), maltotriosa (DP 3), dan maltotetraosa (DP 4) madu murni masing-masing 2182.96, 246.94, dan 23.27 (µg/mL), sedangkan di dalam isolat oligosakarida, kadarnya masing-masing 278.34, 95.03, dan 118. 71 (µg/mL). Adanya glukosa dan penurunan konsentrasi maltotriosa pada isolat madu menunjukkan bahwa masih diperlukan optimasi metode yang digunakan dalam penelitian ini.
Saran
Optimasi metode isolasi oligosakarida masih diperlukan untuk dapat mengurangi atau meniadakan kandungan monosakarida pada isolat oligosakarida madu dan meningkatkan konsentrasi perolehan oligosakarida dengan ≥DP 3. Optimasi dapat dilakukan melalui pengujian beberapa konsentrasi larutan etanol pada saat fraksinasi. Selanjutnya optimasi KLT dapat dilakukan dengan penggunaan plat KLT amina atau plat KLT C-18 sebagai pengganti plat KLT silika untuk memperbaiki proses pemisahan. Identifikasi perlu dilakukan pada isolat hasil perolehan oligosakarida yang menggunakan etanol 80%, dan akan lebih baik jika digunakan standar karbohidrat tambahan dengan DP 5-7.
DAFTAR PUSTAKA
4
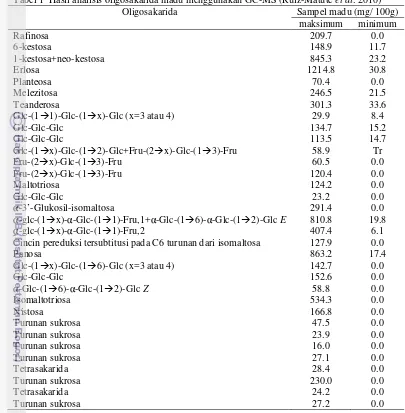
Tabel 1 Hasil analisis oligosakarida madu menggunakan GC-MS (Ruiz-Matuteet al. 2010)
Oligosakarida Sampel madu (mg/ 100g)
maksimum minimum
Rafinosa 209.7 0.0
6-kestosa 148.9 11.7
1-kestosa+neo-kestosa 845.3 23.2
Erlosa 1214.8 30.8
Planteosa 70.4 0.0
Melezitosa 246.5 21.5
Teanderosa 301.3 33.6
Glc-(11)-Glc-(1x)-Glc (x=3 atau 4) 29.9 8.4
Glc-Glc-Glc 134.7 15.2
Glc-Glc-Glc 113.5 14.7
Glc-(1x)-Glc-(12)-Glc+Fru-(2x)-Glc-(13)-Fru 58.9 Tr
Fru-(2x)-Glc-(13)-Fru 60.5 0.0
Fru-(2x)-Glc-(13)-Fru 120.4 0.0
Maltotriosa 124.2 0.0
Glc-Glc-Glc 23.2 0.0
α-3’-Glukosil-isomaltosa 291.4 0.0
α-glc-(1x)-α-Glc-(11)-Fru,1+α-Glc-(16)-α-Glc-(12)-GlcE 810.8 19.8
α-glc-(1x)-α-Glc-(11)-Fru,2 407.4 6.1
Cincin pereduksi tersubtitusi pada C6 turunan dari isomaltosa 127.9 0.0
Panosa 863.2 17.4
Glc-(1x)-Glc-(16)-Glc (x=3 atau 4) 142.7 0.0
Glc-Glc-Glc 152.6 0.0
α-Glc-(16)-α-Glc-(12)-GlcZ 58.8 0.0
Isomaltotriosa 534.3 0.0
Nistosa 166.8 0.0
Turunan sukrosa 47.5 0.0
Turunan sukrosa 23.9 0.0
Turunan sukrosa 16.0 0.0
Turunan sukrosa 27.1 0.0
Tetrasakarida 28.4 0.0
Turunan sukrosa 230.0 0.0
Tetrasakarida 24.2 0.0
Turunan sukrosa 27.2 0.0
Kromatografi gas (GC) memberikan hasil yang paling baik untuk analisis kualitatif. Pada kromatografi gas, oligosakarida yang akan dianalis dibuat senyawa turunannya. Dua jenis cara membuat senyawa turunan oligosakarida, yang pertama yaitu dengan trimetilsilil (TMS). Senyawa turunannya berasal langsung dari senyawa oligosakarida. Metode yang kedua adalah alditol asetat. Semua karbohidrat direduksi menjadi alditol dengan natrium borohidrida (Wetzel & Charalombous 1998).
Perkembangan penggunaan GC dalam analisis madu dilakukan oleh Ruiz-Matute et al.(2010). Dalam studinya dilakukan analisis kandungan enam madu asal Spanyol dan enam madu asal Selandia Baru menggunakan Kromatografi Gas-Spektroskopi Massa (GC-MS. Hasil analisis ditemukan bahwa erlosa dan panosa sebagai komponen trisakarida
terbesar. Keseluruhan hasil yang didapat ditampilkan pada Tabel 1.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain adalah sampel madu yang berasal dari Hutan Kampung Bukit Gunung Tambora, Bima, Pulau Sumbawa. Bahan yang digunakan dalam isolasi dan deteksi oligosakarida adalah arang aktif, etanol 10%, 50%, dan 80%, air deioinisasi, millipore 0.22
5
karbohidrat DP 3 maltotriosa (AppliChem) dan DP 4 maltotetraosa (AppliChem).
Alat yang digunakan dalam penelitian ini adalah peralatan gelas, oven, neraca analitik OHAUS GA 200, vakum, kertas alumunium, pengering rambut, chamber KLT, botol semprot, pipet mikro, pipet kapiler, pengaduk magnetik, kertas saring Whatman No.1, dan instrumen Liquid Chromatography-Mass Spectrometry (LC-MS) Waters di PT Omega Farma Medika Jakarta.
Metode
Preparasi oligosakarida madu hutan Gunung Tambora Sumbawa melalui adsorpsi arang aktif dan pengadukan dalam etanol (Moraleset al.2006)
Preparasi Oligosakarida. Preparasi karbohidrat dengan perlakuan arang aktif terbagi ke dalam dua proses yaitu pemisahan mono- dan disakarida serta perolehan kembali oligosakarida dengan menggunakan pelarut etanol-air yang memiliki konsentrasi 50%. Seluruh perlakuan dilakukan dengan dua kali ulangan.
Eliminasi monosakarida. Sebanyak 5 g sampel madu dilarutkan dalam 1000 mL etanol 10% (v/v). Ke dalam larutan tersebut ditambahkan 30 g arang aktif 100 mesh. Larutan selanjutnya diaduk menggunakan pengaduk magnetik dengan kecepatan 800 rpm selama 30 menit. Setelah itu, larutan disaring menggunakan kertas saring Whatman No.1 dalam kondisi vakum. Kemudian residu dibilas menggunakan 250 mL pelarut yang sama.
Pemulihan oligosakarida. Residu hasil pemisahan mono- dan disakarida dilarutkan kembali dengan 1000 mL pelarut etanol dengan konsentrasi 50% (Moraleset al.2006) dan 80% (Wichiencot et al. 2010). Larutan diaduk menggunakan pengaduk magnetik selama 30 menit dengan kecepatan 800 rpm. Setelah itu larutan disaring menggunakan kertas Whatman No.1 dalam keadaan vakum. Filtrat yang didapatkan kemudian dievaporasi dalam keadaan vakum pada suhu 400C. Efektivitas konsentrasi etanol 50% dan 80% diuji secara kualitatif dengan KLT selanjutnya. Proses preparasi dilakukan sebanyak dua kali ulangan.
Deteksi dan isolasi oligosakarida dengan Kromatografi Lapis Tipis (KLT) modifikasi metode Vergara et al. (2010)
serta Optimasi Eluen yang Digunakan.
Hasil preparasi sampel madu yang diperoleh dideteksi dengan KLT Whatman
K6F lempeng silika dengan ketebalan 250μ m.
Jumlah spot yang terbentuk dapat digunakan untuk membandingkan konsentrasi etanol yang lebih baik dalam proses perolehan kembali oligosakarida pada saat preparasi sampel sebelumnya. Untuk proses deteksi digunakan lempeng KLT ukuran panjang x lebar 10 x 5 cm. Sebanyak 10μ L ditotolkan ke lempeng KLT dengan jarak 0.5 cm dari bagian bawah lempeng. Lempeng dielusi dengan campuran pelarut yang terdiri atas butanol: asam asetat: air (3:1:1 v/v) (Kim et al. 1995) dan butanol: etanol: air (4:3:3 v/v) (Schneideret al.1993) (Campuran eluen yang menghasilkan spot dengan keterpisahan yang lebih baik yang akan digunakan pada tahap KLT preparatif). Lempeng kemudian disemprot dengan larutan indikator yang berisi 0.3g/100 mL N*(1-naftil) etilendiamina dihidroklorida pada suatu sistem pelarut yang terdiri atas metanol: H2SO4 (97:3 v/v). Lempeng dipanaskan pada oven dengan suhu 1200C hingga spot dapat terlihat yakni sekitar 8-10 menit. KLT juga dilakukan terhadap sampel madu yang belum mengalami isolasi.
Isolasi oligosakarida selanjutnya dilakukan terhadap sampel yang menghasilkan spot terbaik pada saat deteksi oligosakarida. Urutan kerja yang dilakukan sama seperti pada saat deteksi, namun mengikuti kaidah teknik KLT preparatif, dilakukan dengan plat berukuran 20 x 20 cm dan aplikasi sampel dilakukan pada jarak 2 cm dari bawah lempeng. Setelah lempeng KLT dipanaskan dalam oven, pita yang terbentuk diukur Rf-nya. Pita yang memiliki Rf> dari standar DP 2 dikerok. Selanjutnya, silika hasil pengerokan di larutkan dalam 40 mL etanol dengan konsentrasi yang sama pada saat pemulihan oligosakarida yang menghasilkan keterpisahan spot terbaik, dan kemudian larutan diaduk dengan kecepatan 600 rpm selama 10 menit. Selanjutnya, larutan disentrifugasi dengan kecepatan 5000 rpm selama 30 menit. Supernatan dipisahkan dengan penyaringan menggunakan millipore 0.22 μ m kemudian dievaporasikan dalam keadaan vakum pada suhu 400C.
Identifikasi oligosakarida menggunakan LC-MS (modifikasi HPLC Astwood et al.
1998)
Pelarut % rendemen
Etanol 50% 2,09
S5 S8 Std Std S5 S8
G M G
M 0,65
Rt = 2.26
Rt = 2.24
Rt = 2.23
1
2
3 0.22
0.38
9
Standar
Madu
Isolat Oligosakarida
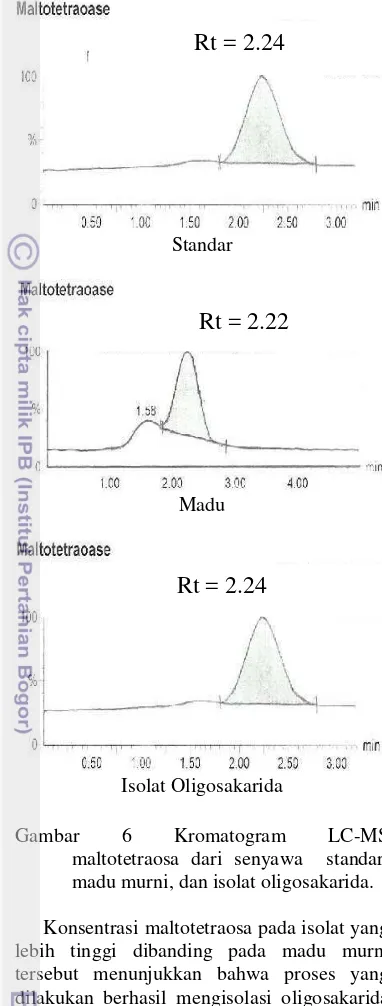
Gambar 6 Kromatogram LC-MS
maltotetraosa dari senyawa standar, madu murni, dan isolat oligosakarida.
Konsentrasi maltotetraosa pada isolat yang lebih tinggi dibanding pada madu murni tersebut menunjukkan bahwa proses yang dilakukan berhasil mengisolasi oligosakarida dengan DP 4 pada konsentrasi yang signifikan. Hasil yang berbeda terjadi pada maltotriosa dengan DP 3, dimana konsentrasi oligosakarida tersebut menurun setelah proses isolasi dilakukan.
Standar
Madu
[image:26.598.324.508.84.485.2]Isolat Oligosakarida
Gambar 7 Kromatogram LC-MS glukosa dari senyawa standar, madu murni, dan isolat oligosakarida.
Penurunan konsentrasi DP 3 tidak mendukung sebagaimana yang disebutkan dalam Karimah (2010) bahwa konsentrasi oligosakarida dengan DP>2 berada pada konsentrasi yang lebih signifikan setelah madu mengalami proses isolasi. Penurunan konsentrasi perolehan oligosakarida DP 3 setelah isolasi memberikan alasan tambahan perlunya dilakukan optimasi metode isolasi yang digunakan.
Tabel 3 Hasil identifikasi kandungan oligosakarida madu murni dan isolat oligosakarida menggunakan LC-MS
Standar Konsentrasi (µg/mL) Kadar senyawa isolat/madu murni (%) Madu murni Isolat
Glukosa (DP 1) 2182,96 278,34 12,75
Maltotriosa (DP 3) 246,94 95,03 38,48
Maltotetraosa (DP 4) 23,27 118,71 510,23
Rt = 2.24
Rt = 2.24
Rt = 2.22
Rt = 2.31
Rt = 2.40
[image:26.598.106.297.87.590.2]10
Tabel 4 Jenis-jenis trisakarida (C18H32O16, BM = 504.4) dalam madu (Ruiz-Matute et. al 2010)
Nama Senyawa Rumus Molekul
Centosa α-D-Glcp-(1→4)-α-D-Glcp-(1→2)-D-Glcp
Erlosa α-D-Glcp-(1→4)-α-D-Glcp-(1↔2)-β-D-Fruf
Isomaotriosa α-D-Glcp-(1→6)-α-D-Glcp-(1→6)-D-Glcp
Isomelezitosa α-D-Glcp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp
Isopanosa α-D-Glcp-(1→4)-α-D-Glcp-(1→6)-D-Glcp
1-Kestosa β-D-Fruf-(2→1)-β-D-Fruf-(2↔1)-α-D-Glcp
6-Kestosa β-D-Fruf-(2→6)-β-D-Fruf-(2↔1)-α-D-Glcp
Laminaritriosa β-D-Glcp-(1→3)-β-D-Glcp-(1→3)-D-Glcp
Maltotriosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-D-Glcp
Melezitosa α-D-Glcp-(1→3)-β-D-Fruf-(2↔1)-α-D-Glcp
Neokestosa β-D-Fruf-(2→6)-α-D-Glcp-(1↔2)-β-D-Fruf
Panosa α-D-Glcp-(1→6)-α-D-Glcp-(1→4)-D-Glcp
Planteosa α-D-Galp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp
Raffinosa α-D-Galp-(1→6)-α-D-Glcp-(1↔2)-β-D-Fruf
Theanderosa α-D-Glcp-(1→6)-α-D-Glcp-(1↔2)-β-D-Fruf
Isomaltosylglukosa α-D-Glcp-(1→6)-α-D-Glcp-(1→3)-D-Glcp
4-α-Gentobiosilglukosa (sorborosa) β-D-Glcp-(1→6)-α-D-Glcp-(1→4)-D-Glcp
Tabel 5 Jenis-jenis tetrasakarida (C24H42O21, BM = 666.6) dalam madu (Astwood et al. 1998; Rittig 2001; Ruiz Matute et al 2010).
Nama Senyawa Rumus Molekul
α-4’-glukosilerlosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-α-D-Glcp-(1↔2)-β-D-Fruf α-6’-glukosilerlosa α-D-Glcp-(1→6)-α-D-Glcp-(1→4)-α-DGlcp-(1↔2)-β-D-Fruf
Fruktosilisomelezitosa Fru-(?→?)-α-D-Glcp-(1→6)-β-D-Fruf-(2↔1)-α-D-Glcp
Isomaltotetraosa α-D-Glcp-(1→6)-α-D-Glcp-(1→6)-α-DGlcp-(1→6)-D-Glcp Maltotetraosa α-D-Glcp-(1→4)-α-D-Glcp-(1→4)-α-DGlcp-(1→4)-D-Glcp
Nistosa β-D-Fruf-(2→1)-β-D-Fruf-(2→1)-β-D-Fruf-(2↔1)-α-D-Glcp
Stakiosa α-D-Galp-(1→6)-α-D-Galp-(1→6)-α-DGlcp-(1↔2)-β-D-Fruf
Metode identifikasi oligoskarida menggunakan LC-MS pada studi ini belum cukup untuk menentukan jenis oligosakarida DP 3 & DP 4 yang terkandung dalam madu hutan Gunung Tambora Sumbawa secara spesifik. Modifikasi metode lain diperlukan seperti GC-MS dalam Ruiz-Matute et al
(2010) ataupun instrumen tambahan seperti
Matrix Assisted Laser Desoprtion Ionisatian-Time of flight Mass Spectrometry (MALDI-TOF-MS). Tabel 4 dan 5 memperlihatkan jenis-jenis DP 3 dan DP 4 dari madu mancanegara yang telah berhasil diidentifikasi sampai saat ini.
Komposisi Oligosakarida,
Pembentukannya, serta Potensinya sebagai Prebiotik
Komposisi kimia madu, termasuk kandungan oligosakarida di dalamnya dapat bervariasi bergantung pada tanaman sumber nektar, pengaruh musim dan iklim, serta letak geografis dari sumber nektar. Senyawa senyawa dalam madu berasal dari: pematangan dari madu, penambahan dari lebah, dan lainnya merupakan derivat dari tanaman (Bogdanov 2009). Lebih dari 95%
padatan di dalam madu merupakan karbohidrat di alam dan 85-95% nya adalah fruktosa dan glukosa sebagai pembentuk oligosakarida (Bogdanov 2009). Oligosakarida pada madu merupakan produk proses enzimatik yang dilakukan oleh beberapa enzim, yaitu: α-Glukosidase, β -Glukosidase, dan Invertase ragi ( Pontoh 2001,Pontoh & Low 2002, Balasubramanyam 2011).
Enzim α-Glukosidase merupakan enzim yang bertanggung jawab pada proses hidrolisis nektar hingga menjadi glukosa dan sukrosa. Enzim α-Glukosidase ini merupakan enzim yang ditambahkan oleh lebah madu ke dalam madu, yang bertanggung jawab atas hidrolisis sukrosa (DP 2) pada nektar menjadi glukosa dan fruktosa. Enzim ini juga memiliki fungsi transglikosilasi (Pontoh 2001). Transglikosilasi merupakan proses
[image:27.598.107.518.95.311.2]2
tergantung pada sumber nektarnya diantaranya manuka (Leptospermum), cengkeh (Trifolium), blewah (Nothofagus), dan heather (Calluna). Madu mengandung berbagai campuran zat yang tergolong ke dalam gula, mineral, antioksidan, enzim, senyawa aromatik, dan air (Bradbear 2009).
Komponen gula terbesar di dalam madu adalah fruktosa. Tetapi terdapat pula madu yang lebih banyak mengandung glukosa. Komponen madu terbesar ketiga adalah air. Madu memiliki berbagai oligosakarida. Madu manuka (Leptospermum) dan cengkeh (Trifolium) mengandung berbagai oligosakarida antara lain isomaltosa, kojibiosa, turanosa (atau gentiobiosa), nigerosa, dan maltosa sebagai komponen utamanya. Sedangkan madu heather (Calluna) mengandung isomaltosa sebagai komponen utamanya. Madu asal bunga blewah memiliki komponen oligosakarida yang lebih rumit dengan trisakarida melezitosa dan panosa sebagai komponen yang paling melimpah (Weston & Brocklebank 1999).
Madu dapat menggantikan gula dalam berbagai makanan dan minuman karena mengandung sekitar 69% fruktosa dan glukosa. Kalori yang dihasilkan dari satu sendok makan madu adalah 64 kalori. Nilai ini lebih besar dibandingkan gula yang hanya menghasilkan 50 kalori, sehingga madu menjadi sumber energi yang baik. Madu sebagai pemanis memiliki daya rusak gigi yang lebih rendah dibanding dengan sukrosa biasa. Madu juga dapat menyembuhkan diare serta sangat baik untuk dikonsumsi oleh balita (Bogdanovet al. 2008).
Banyak penelitian yang membuktikan sifat antimikrob dari madu. Madu bahkan dapat membunuh bakteri yang resisten terhadap antibiotik. Kemampuan ini berasal dari kandungan hidrogen peroksida pada madu pada taraf yang dapat membunuh mikrob namun tetap aman untuk jaringan di sekitarnya. Dwisaputri (2009) menyebutkan bahwa madu dari lebah Apis mellifera
memiliki aktivitas antibakteri terhadap
Pseudomonas aeruginosa secara in vitro
dengan KHM (Konsentrasi Hambat Minimum) 16,6% dan KBM (Konsentrasi Bunuh Minimal) 16,6%.
Kandungan antioksidan pada madu juga sangat bermanfaat bagi kesehatan. Antioksidan yang terdapat pada madu antara lain flavonoid, asam fenolik, dan asam absisat. Komponen flavonoid utama dari jelly bush honey (Leptospermum poygalifolium) antara
lain mirisetin, luteolin, dan trisetin dengan kadar 2,22 mg/100g. Asam fenolik yang paling banyak ditemukan adalah asam galat dan kumarat dengan kadar 5,14 mg/100g sedangkan asam absisat berjumlah 11,6 mg/100g. Madu manuka Leptospermum scopariummengandung flavonoid yang terdiri dari kuersetin, isorhamnetin, krisin, dan luteloin 3,06 mg/10g (Gheldof & Engeseth 2002). Total asam fenolik mencapai 14 mg/100g dengan asam galat sebagai komponen utamanya sementara asam absisat mencapai 32,8 mg/100g (Yao et al. 2003). Selain antioksidan yang membantu melindungi sel-sel tubuh dari radikal bebas, manfaat lainnya dari madu adalah madu yang di campur dengan susu dapat membantu menghaluskan kulit.
Madu juga mengandung senyawa volatil. Analisis dengan kromatografi gas dan spektofotometri massa pada madu rosemari menemukan adanya 122 senyawa volatil yang tergolong ke dalam alkohol, keton, aldehid, asam, eter, terpen, hidrokarbon, fenol, furan, dan piran (Vazquezet al.2003).
Madu Indonesia
Madu di Indonesia baik yang telah dihasilkan dari peternakan maupun yang berasal dari alam diambil dari madu lebah hutan. Spesies lebah hutan yang hidup di Indonesia adalah Apis dorsata. Dalam pengembangan sektor peternakan, industri peternakan lebah madu memiliki masa depan yang prospektif karena seluruh produk yang dihasilkan sangat bermanfaat sehingga bernilai tinggi seperti madu, royal jelly, malam (wax/lilin), propolis, apitoksin dan paket bibit lebah madu (Fauzan 2002).
PENDAHULUAN
Madu adalah salah satu campuran karbohidrat yang paling rumit di alam. Kandungan gula terbesar pada madu adalah fruktosa dan glukosa. Serta terdapat juga triosa dan oligosakarida (Bogdanov 2009). Kandungan lain yang terdapat di dalam madu diantaranya mineral (Nanda et al. 2003), antioksidan (Gheldof & Engeseth 2002), senyawa fenolik (Yaoet al.2003), enzim, dan air.
Secara umum madu tersusun atas komponen yang sama, tetapi keragaman nektar bunga yang menjadi sumber madu serta spesies lebah madu yang memproduksi madu dari nektar tersebut dapat memberikan keragaman yang unik pada kandungan madu termasuk oligosakarida yang terdapat didalamnya. Semua spesies lebah dari genus
Apis menghasilkan madu. Tetapi hanya Apis melliferadanApis ceranayang madunya telah dimanfaatkan secara luas untuk tujuan komersil sehingga lebih dikenal di mancanegara, khususnya di Eropa, Australia, dan Amerika. Penelitian mengenai kandungan oligosakarida kedua madu tersebut telah banyak dilakukan di mancanegara.
Oligosakarida merupakan molekul karbohidrat yang tersusun atas 2 atau lebih monosakarida yang dihubungkan dengan ikatan glikosidik (Nelson & Cox 2004). Oligosakarida telah banyak digunakan dalam berbagai produk makanan dengan tujuan sebagai sumber prebiotik yang merupakan komponen pangan yang tidak tercerna dan memberikan keuntungan melalui modulasi mikroba yang berguna bagi kesehatan usus besar (probiotik) (FAO 2007).
Isolasi oligosakarida madu lokal asal Sumbawa dan Kalimantan serta uji aktivtas prebiotiknya sudah dilaporkan. Karimah (2010) melaporkan bahwa isolat oligosakarida asal Sumbawa dan Kalimantan memiliki aktivitas prebiotik. Aktivitas prebiotik dari isolat oligosakarida tersebut kemungkinan disebabkan oleh adanya oligosakarida rantai pendek, dengan derajat polimerisasi (DP) antara 3-4. Kemungkinan tersebut diperkuat oleh Biedrzycka & Bielecka (2004) yang menyebutkan bahwa oligosakarida rantai pendek tanpa percabangan yang larut dalam air akan lebih mudah dimanfaatkan oleh bakteri probiotik. Aktivitas prebiotik isolat oligosakarida madu lokal asal Sumbawa memiliki aktivitas prebiotik yang lebih tinggi dibanding dengan inulin yang merupakan prebiotik komersil (Karimah 2010).
Keberadaan oligosakarida dengan DP 3-4 yang telah diduga memiliki potensi prebiotik pada madu hutan Gunung Tambora Sumbawa perlu dibuktikan. Untuk itu, perlu diadakan identifikasi oligosakarida madu hutan Gunung Tambora Sumbawa, yang bertujuan memperkuat hasil penelitian sebelumnya serta menambah informasi ilmiah mengenai studi oligosakarida pada madu lokal.
Tujuan penelitian ini adalah mengisolasi dan mengidentifikasi oligosakarida madu hutan Gunung Tambora Sumbawa dengan DP 3-4 serta mendapatkan optimasi metode yang sesuai dalam prosesnya. Hipotesis dari penelitian ini adalah bahwa oligosakarida dengan DP 3-4 dapat diisolasi dari madu Hutan Gunung Tambora Sumbawa.
Hasil penelitian ini diharapkan dapat bermanfaat khususnya untuk memberikan informasi teknis mengenai proses isolasi dan identifikasi oligosakarida dari madu yang mungkin dapat diaplikasikan pada sampel oligosakarida dari sumber yang berbeda. Selain itu, penelitian ini diharapkan dapat memperkaya pengetahuan mengenai sumber oligosakarida yang terdapat di alam, menambah pengetahuan mengenai kandungan oligosakarida serta kemungkinan proses pembentukan oligosakarida tersebut di dalam madu, dan memberikan tambahan informasi mengenai potensi sumber daya lokal khususnya madu lokal Hutan Gunung Tambora Sumbawa.
TINJAUAN PUSTAKA
Madu dan Manfaatnya
Madu adalah zat kaya nutrisi yang dihasilkan oleh lebah madu dari nektar yang berasal dari bunga, batang, atau ujung daun tanaman. Selain itu, madu juga dapat berasal dari zat ekskresi serangga seperti
Ultracoelostoma assimile yang menghisap cairan floem yang disebut honeydew. Madu sudah dikenal dan merupakan bagian dari pengobatan kuno yang telah ada selama ribuan tahun. Sejarah menuliskan pemanfaatan madu dimulai sejak tahun 2100 SM, dan dipercaya bahwa manusia telah mengenal madu pada peradaban yang lebih kuno (Bradbear 2009)
ABSTRAK
YOGI NUR ANGGOWO. Isolasi dan Identifikasi Oligosakarida Madu Hutan
Gunung Tambora Sumbawa. Dibimbing oleh SYAMSUL FALAH dan WARAS
NURCHOLIS.
ABSTRACT
YOGI NUR ANGGOWO. Isolation and Identification of Oligosaccharides from
Forest Honey of Mount Tambora Sumbawa. Under the direction of SYAMSUL