DAFTAR ISI
Identifikasi dan biotypingB. abortus ...23
Iradiasi sinar Gamma B. abortus ...25
Uji in vivoB. abortus iradiasi ke marmot (Cavia cobaya) ...26
Identifikasi dan biotypingB. abortus ...31
Latar Belakang
Brucellosis merupakan salah satu penyakit hewan menular strategis yang
disebabkan oleh Brucella sp. (Permentan 2010). Brucellosis menyerang berbagai
hewan yaitu sapi (Brucella abortus, B. abortus), kambing (B. melitensis), domba
(B. ovis), babi(B. suis), anjing(B. canis)dan rodensia (B. neotomae). Penyakit ini
pada sapi menyebabkan abortus (keguguran) temporer maupun permanen,
kematian dini pedet baru lahir (stillbirth), gangguan reproduksi (infertilitas dan
sterilitas), dan penurunan produksi susu. Abortus yang disebabkan penyakit ini
terjadi pada umur kebuntingan 6 - 9 bulan. Brucellosis bersifat zoonosis pada
manusia menyebabkan "demam undulant", "demam Mediterania" atau "demam
Malta" (Corbel 2006). Penyakit ini menyebar diseluruh dunia, dengan daerah
endemik Mediterania, Timur Tengah, Afrika utara dan timur, Amerika Latin dan
Asia tengah dan selatan (Corbel 1997; Corbel 2006). Brucellosis menyebabkan
lebih dari 500.000 manusia terinfeksi baru setiap tahun (Pappas et al. 2006).
Brucellosis pada manusia di Indonesia belum pernah dipublikasikan, namun hasil
uji serologi terhadap pekerja kandang sapi perah, kandang babi dan rumah potong
hewan (RPH) di DKI Jakarta terdeteksi adanya titer antibodi terhadap Brucella
(Sudibyo 1995).
Spesies Brucella yang menginfeksi sapi di Indonesia adalah strain B.
abortus biotipe 1. Hasil penelitian oleh Sudibyo (1995) menyatakan di DKI
Jakarta diperoleh B. abortus biotipe 1 (76,3,%), biotipe 2 (13,2%) dan biotipe 3
(9,2%). Beberapa propinsi di Indonesia masih banyak yang belum bebas penyakit
brucellosis. Pulau Jawa merupakan daerah populasi sapi perah tertinggi, dan
prevalensi kasus brucellosis rata-rata 2 – 3 %.
Brucellosis pada sapi di Indonesia ditetapkan sebagai penyakit hewan
menular strategis berdasarkan Peraturan Menteri Pertanian Nomor. 16/
Permentan/OT.140/1/2010 dan program pengendalian penyakit dalam mendukung
Program Swasembada Daging sapi (PSDS) tahun 2014. Kerugian ekonomi akibat
brucellosis pada industri peternakan mencapai 138,5 milyar rupiah setiap tahun
Pemberantasan brucellosis pada ternak dapat dilakukan dengan cara
vaksinasi dan potong bersyarat (test and slaughter). Vaksinasi dilakukan pada
daerah dengan prevalensi > 2 %, sedangkan test and slaughter di daerah dengan
prevalensi < 2 % (Ditkeswan 2001).
Ada beberapa permasalahan yang dihadapi dalam upaya pengendalian dan
pemberantasan brucellosis adalah kebutuhan vaksin yang tersedia tidak
mencukupi, kontrol lalu lintas sapi yang tidak maksimal, sehingga memungkinkan
terjadinya penyebaran penyakit brucellosis, metode test dan slaughter belum
dilakukan secara optimal karena tingginya jumlah yang harus dipotong dan
berkaitan dengan kompensasi dari pemerintah ke peternak yang terbatas, peternak
belum siap melakukan slaughter sapi perah produksi, identifikasi dan sertifikasi
pasca vaksinasi brucellosis belum serempak dilaksanakan di Pulau Jawa (Noor
2006).
Vaksin yang digunakan dalam program pengendalian brucellosis pada sapi
di Indonesia saat ini adalah vaksin B. abortus strain 19 (S19) dan vaksin B.
abortus RB51.Vaksin B. abortus S19 merupakan strain (galur) hidup yang sudah
dilemahkan dan memiliki sifat stabil, dan memberikan proteksi terhadap infeksi
70 - 80%. Namun vaksin B. abortus S19 menyebabkan masalah karena antibodi
yang diproduksi dapat menyebabkan reaksi positif palsu pada tes serologi
terhadap infeksi Brucella, aborsi pada sapi bunting dan virulen pada manusia.
Sedangkan vaksin B. abortus RB51 merupakan mutan kasar (rough colony) dari
B. abortus virulen strain 2308 (S2308). Ternak yang divaksin dengan strain RB51
tidak terdeteksi dengan uji serologi standar pada diagnosa brucellosis dan aman
apabila diberikan pada sapi betina bunting. Sampai saat ini vaksin RB51 yang
dipakai untuk program vaksinasi masih harus impor dan harganya relatif mahal
dibandingkan dengan vaksin S19 yang sudah dapat diproduksi oleh Pusat
Veterinaria Farma (PUSVETMA).
Berdasarkan pertimbangan-pertimbangan di atas maka pada penelitian ini
akan dikembangkan vaksin brucellosis dengan menggunakan teknik iradiasi.
Teknik iradiasi telah digunakan untuk diagnosa penyakit, industri pangan, serta
inaktivasi mikroorganisme patogen. Sumber-sumber sinar gamma yang digunakan
(0,662 MeV) sedangkan untuk pengobatan digunakan sinar X. Penggunaan sinar
gamma memiliki keunggulan dibandingkan dengan teknik konvensional seperti
pemanasan atau kimia karena kemampuan mempertahankan sifat
imunogenisitasnya (Kochman 2006). Sel yang terpapar radiasi gamma akan
kehilangan kemampuan replikasinya di dalam tubuh inang, namun tidak
menghentikan aktivitas metaboliknya. Sel tetap mempunyai metabolik aktif,
sehingga mampu menghasilkan senyawa imunogenik untuk menstimulus respon
imun protektif pada inang (Sanakkayala et al. 2005).
Perumusan Masalah
Salah satu kegiatan untuk pemantapan ketahanan pangan adalah
peningkatan kualitas subsektor peternakan. Penyakit merupakan salah satu
kendala yang menghambat keberhasilan dalam usaha peternakan. Brucellosis pada
sapi merupakan penyakit bakterial dan bersifat zoonosis, disebabkan oleh B.
abortus yang memiliki dampak sosial ekonomi luas. Prevalensi brucellosis di
Indonesia pada sapi perah masih tinggi sekitar 1 – 40 % sehingga banyak
menimbulkan kerugian ekonomi. Selain itu adanya program pemerintah dalam
mendukung Program Swasembada Daging Sapi (PSDS) adalah pembebasan
beberapa daerah dari penyakit brucellosis. Sampai saat ini dari 21 provinsi target
penanggulangan gangguan reproduksi, sebanyak 7 provinsi telah bebas, 11
provinsi lainnya memiliki prevalensi Brucellosispada sapi potong 0 – 2 % dan 4
provinsi memiliki kasus tinggi pada sapi potong. Prevalensi brucellosis sapi perah
di Jawa sekitar 2 – 3 % dan vaksin yang digunakan yaitu vaksin RB51 harus
impor dan harga relatif mahal. Kasus brucellosis di lapang yang hanya sebagian
dilaporkan dan didiagnosa serologi, akan mengakibatkan kasus seperti fenomena
gunung es (iceberg phenomena).
Maka, salah satu upaya dalam menunjang PSDS tahun 2014 tersebut
adalah penelitian untuk menghasilkan vaksin brucellosis yang protektif sehingga
dapat membantu pemenuhan kebutuhan vaksin untuk mengurangi kasus
brucellosis dan mengurangi ketergantungan impor vaksin brucellosis. Pada
penelitian ini dilakukan pendekatan untuk mengembangkan vaksin iradiasi
Tujuan dan Manfaat Penelitian Tujuan Penelitian
Tujuan penelitian ini adalah mengembangkan kandidat vaksin iradiasi B.
abortus isolat lapang melalui beberapa tahapan penelitian yaitu :
1. Memperoleh B. abortus strain lapang.
2. Mengetahui biotypingB. abortus strain lapang yang diperoleh.
3. Menentukan dosis radiasi B. abortus untuk pengembangan bibit vaksin
iradiasi brucellosis pada sapi.
4. Melakukan uji in vivo kandidat isolat B. abortus pada hewan coba
marmot (Cavia cobaya).
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi
pengembangan kandidat vaksin iradiasi B. abortus isolat lapang yang dapat
TINJAUAN PUSTAKA
Etiologi Brucellosis
Brucellosis atau penyakit abortus atau keluron menular merupakan
penyakit bakterial bersifat zoonosis, yang disebabkan oleh berbagai spesies
Brucella. Brucella ditemukan oleh Sir David Bruce pada tahun 1886, bakteri
diisolasi dari limpa seorang prajurit yang sakit kemudian disebut Demam Malta.
Terdapat 6 spesies Brucella pada hewan yaitu B. abortus, B. melitensis, B. ovis, B.
suis, B. canis dan B. neotomae. Klasifikasi terutama berdasarkan pada perbedaan
patogenitas dan inangnya. B. melitensis merupakan spesies Brucella yang paling
patogen dan invasif pada kesehatan manusia, diikuti oleh B. suis, dan B. abortus
(Young 1995, Dokuzoguz et al. 2005; Rajashekara et al. 2006; Franco et al. 2007;
Lee & Stanek 2010).
Tabel 1 Karakteristik biovar spesies dari genus Brucella
Spesies Morfologi
koloni Biovar CO2
Produksi H2S
Pertumbuhan Aglutinasi
Oxidase Katalase Urease Thionin Basic
Fuchin
Sumber: Alton et al. (1988); Barrow & Feltham (1993)
Keterangan : + : positif, - : negatif.
Bakteri Brucella merupakan bakteri gram negatif, tidak berspora, tidak
motil, berbentuk kokobasilus dengan panjang 0,6 – 1,5 µm dan lebar 0.5 – 0,7 µm,
dalam set fagosit. Koloni Brucella di media padat terlihat setelah inkubasi selama
2 - 3 hari. Setelah inkubasi 4 hari, koloni berbentuk bulat, berdiameter 1-2 mm,
dengan tepi halus, seperti madu pucat pada media transparan dan koloni convex.
Karakteristik spesies Brucella berdasarkan kebutuhan CO2 dalam
pertumbuhannya, produksi H2S, aktivitas urease dan pertumbuhan pada thionin
serta basic fuchsin (Alton et al. 1988; Quinn et al. 2002).
Bovine Brucellosis disebabkan B. abortus. Brucella abortus terdapat 7
biotipe, B. melitensis 3 biotipe, B. canis 4 biotipe, dan B. ovis, B. suis, B.
neotomae masing-masing 1 biotipe (Corbel 2006; OIE 2009; CFSPH 2009).
Karakter biovar spesies Brucella dapat dilihat pada Tabel 1.
Penularan
Brucellosis dapat ditularkan antar hewan melalui rute oral karena ternak
menjilati produk abortus (plasenta, janin) dan cairan vagina dari hewan yang
terinfeksi. Hewan yang terkontaminasi oleh bakteri Brucella juga diperoleh
melalui inhalasi, inokulasi konjungtiva, kontaminasi kulit dan inokulasi ambing
(Plommet & Fensterbank 1976). Infeksi bakteri Brucella dapat terjadi pada anak
sapi yang diberi kolostrum atau susu dari induk yang terinfeksi. Pada sapi jantan,
brucellosis tidak selalu mengakibatkan infertilitas, meskipun akan mempengaruhi
kualitas semen. Selain itu penularan juga terjadi melalui perkawinan alam sapi
jantan penderita sewaktu mengawini sapi betina dan inseminasi buatan. Sapi
tersebut menularkan Brucella selama fase akut dari penyakit, dan shedding
Brucella dapat berhenti maupun bersifat intermitent. Penularan langsung bakteri
Brucella dapat dibantu oleh satwa liar, burung dan saluran air yang terkontaminasi
urin dan kotoran uterus sapi yang abortus. Anjing membawa potongan plasenta
atau janin abortus dari satu tempat ke tempat lain. Penyebaran bakteri Brucella
juga dapat melalui kandang, pakan, padang rumput dan air yang tercemar oleh
produk abortus. Ekskresi bakteri Brucella terjadi setelah keguguran sampai sekitar
15 hari. Jumlah bakteri Brucella yang diekskresikan dari uterus akan berkurang,
namun ternak terinfeksi dapat menjadi pembawa Brucella yang mengeluarkan
bakteri secara persisten selama bertahun-tahun (Quinn et al. 2002; CFSPH 2009).
pada hewan yang sudah matang secara seksual. Hewan muda sering resisten
terhadap infeksi, meskipun infeksi dapat bersifat laten dan menimbulkan bahaya
ketika dewasa. Vaksinasi ternak dengan B. abortus S19 atau RB51 dapat
mengurangi kerentanan seribu kali lipat atau lebih pada spesies yang homolog
(Corbel 2006).
Brucella dapat bertahan hidup pada berbagai kondisi lingkungan dalam
waktu tertentu. Brucella sensitif terhadap sinar matahari langsung, desinfektan
dan pasteurisasi (CFSPH 2009). Brucella tahan terhadap kekeringan, terutama bila
terdapat bahan organik seperti protein, dan bertahan hidup dalam debu serta tanah.
Bakteri dapat bertahan hidup di air keran selama beberapa bulan pada 4 - 8 °C, 2,5
tahun di 0 ºC, dan beberapa tahun pada jaringan beku atau media. Bakteri
Brucella tahan di tanah basah sampai 60 hari, di permukaan air selama 144 hari,
di dalam urin selama 30 hari, pada janin abortus selama 75 hari dan di eksudat
uterus lebih dari 200 hari. Pada bedding yang terkontaminasi Brucella, bakteri
mati pada 56 °C - 61 °C dalam waktu 4,5 jam. Selain itu telah ditemukan bahwa
Brucella dapat bertahan hidup dalam kotoran selama 53 hari pada musim dingin,
120 - 210 hari di musim semi, 1 hari di musim panas, dan 50 - 120 hari di musim
gugur (Bharde & Bhuktar 2005; Corbel 2006). Pada jaringan yang dikeluarkan
sewaktu keguguran, B. abortus dapat tahan hidup sampai 6 bulan apabila terhindar
dari sinar matahari (Quinn et al. 2002; Soeharsono 2002).
Usia, jenis kelamin, periode kebuntingan dan resistensi alami terhadap
Brucella mempengaruhi perkembangan infeksi. Ternak betina bunting cenderung
mudah terinfeksi daripada ternak tidak bunting atau jantan. Hal ini karena uterus
ternak bunting terdapat gula erythritol yang menopang pertumbuhan bakteri
Brucella (Bharde & Bhuktar 2005; Islam et al. 2009).
Pada manusia, penularan dapat terjadi secara oral, inhalasi dan lewat
konjungtiva, namun sumber utama infeksi yaitu kontak dengan produk abortus
hewan, mengkonsumsi produk peternakan terkontaminasi seperti susu dan produk
tidak dipasteurisasi (keju, susu mentah, mentega dan es krim), daging yang
dimasak kurang matang, kontak dengan kultur bakteri dan sampel jaringan di
laboratorium. Infeksi dapat terjadi pada pekerja yang berprofesi tertentu misalnya
petugas rumah pemotongan hewan, tukang perah susu yang bekerja di daerah atau
hewan tertular atau menangani fetus abortus dan plasenta penderita brucellosis
(Corbel 1997; OIE 2009; Godfroid et al. 2010; Bennet 2010). Kandungan bakteri
pada jaringan otot relatif rendah namun konsumsi organ hewan seperti hati dan
limpa sebagai salah satu penyebab terjadinya infeksi pada manusia (Pappas et al
2005).
Gejala klinis
Brucella menyebabkan brucellosis pada manusia dan berbagai spesies
hewan (Cloeckaert et al., 2003). Penyakit ini biasanya tanpa gejala pada hewan
betina bunting. Setelah adanya infeksi oleh B. abortus pada hewan bunting dapat
menyebabkan plasentitis dan endometritis (Quinn et al. 2002; Poester et al. 2006;
OIE 2009). Penyakit ini dapat bersifat akut dengan terjadinya abortus pada ternak
yang sehat. Brucella mengakibatkan abortus pada 6 sampai 9 bulan kebuntingan.
Setelah abortus dan kelahiran normal berikutnya, sebagian besar bakteri
diekskresikan ke plasenta, cairan fetus, susu dan leleran vagina (OIE 2009).
Sehingga pada ternak bunting yang terinfeksi mengakibatkan kelahiran dini,
penurunan produksi susu, konsepsi tertunda dan infertilitas sementara atau
permanen. Pada hewan jantan terinfeksi mengakibatkan orchitis dan epididimiitis
yang menyebabkan infertilitas (Corbel 1997; Quinn et al. 2002). Hewan jantan
yang terinfeksi dapat ditemukan Brucella di dalam semennya sehingga berpotensi
sebagai sumber penularan penyakit jika digunakan untuk Inseminasi Buatan. Pada
infeksi akut, Brucella ditemukan dalam organ tubuh yang paling utama yaitu
kelenjar getah bening (Quinn et al. 2002). Di beberapa negara tropis, satu-satunya
indikator yang jelas adanya infeksi kronis brucellosis pada hewan yaitu higroma
pada persendian kaki. Pembesaran kantung persendian carpus atau tarsus terlihat
mencolok sehingga dapat terlihat dari jauh (Godfroid et al. 2004; Bharde &
Bhuktar 2005). Dilaporkan bahwa di Arab Saudi, domba yang menderita higroma
pada kakinya dapat diisolasi B. melitensis (Ramadan et al. 2012)
Pada manusia, brucellosis menyebabkan deman malta (demam undulant),
dan mengakibatkan komplikasi penyakit muskulo skeletal, kardiovaskular dan
dingin (Corbel 1997; Quinn et al. 2002, Bennet 2010). Kerentanan terhadap
brucellosis pada manusia tergantung pada berbagai faktor, termasuk status
kekebalan tubuh, rute infeksi, jumlah inokulum dan spesies Brucella (Young
1995, Pappas et al. 2005; Corbel 2006).
Patogenesis
Spesies Brucella sebagai bakteri patogen fakultatif intraselular mampu
bertahan dan bereplikasi dalam sel fagosit tubuh inang (Halling et al., 2005).
Patogenesis Brucella terutama berdasarkan kemampuannya untuk masuk,
bertahan hidup dan berkembang biak dalam sel inang (Gorvel & Moreno 2002).
Setelah masuk ke tubuh, Brucella tertelan oleh leukosit polymorphonuclear
(PMLs), yang akan tertarik ke lokasi inokulasi. Faktor virulensi utama adalah sel
dinding lipopolisakarida (LPS). Hal ini dikarenakan LPS B. abortus mengandung
komponen 5-guanosin monofosfat. Dengan adanya kemampuan tersebut, hampir
15 – 30% bakteri ini mampu bertahan di dalam sel polymorphonuclear atau
mononuclear (Al Nassir 2011). Brucella mampu bertahan dan bereplikasi dalam
sel fagosit dari sistem retikuloendotelial dan sel non-fagosit seperti trofoblas.
Kemampuan tersebut melibatkan fusi sementara dari vakuola yang mengandung
Brucella dengan lisosom, selanjutnya pada protein lisosomal (Young 1995; Star et
al. 2008). Setelah proses ini, vakuola yang mengandung Brucella terhubung
dengan retikulum endoplasma (RE). Retikulum endoplasma terhubung lagi
dengan kompartemen tempat untuk replikasi intraseluler Brucella dalam
makrofag, sel epitel dan trofoblas plasenta. Bakteri dapat menyebabkan infeksi
kronis pada tempat tersebut (Xavier et al. 2010). Forestier et al. (1999)
menunjukkan bahwa LPS dari B. abortus terakumulasi dalam lisosom dan
kemudian ke permukaan sel makrofag membentuk kelompok besar yang disebut
macrodomains.
Faktor serum normal, termasuk komplemen, terlibat dalam opsonisasi
organisme untuk fagositosis, namun PMLs membatasi kemampuan untuk
membunuh bakteri dalam fagosit. Beberapa faktor yang melindungi Brucella dari
PMLs adalah copper-zink superoksida dismutase, O-polisakarida, dan nukleotida.
organ-organ sistem retikuloendotelial (hati, limpa, sumsum tulang) dan
berkembang biak di makrofag dan monosit. Beberapa sistem organ dapat terlibat
dalam penyakit brucellosis (sistem syaraf pusat, jantung, persendian, sistem
genitourinari, sistem paru-paru, dan kulit). Brucellosis tersebut menyebabkan
infeksi bersifat lokal maupun sistemik yang dapat melibatkan hampir seluruh
organ. Setelah infeksi, dihasilkan antibodi humoral terhadap LPS dan antigen
dinding sel lainnya. Namun, pengembangan imunitas berperantara sel merupakan
prinsip mekanisme saat pemulihan. Kekebalan selular melibatkan peran T limfosit
sitotoksik dan aktivasi makrofag sehingga meningkatkan aktivitas bakterisidal
melalui pelepasan sitokin (misalnya gamma interferon dan tumor necrosis faktor)
dari Thelper limfosit (Bharde & Bhuktar 2005; Corbel 2006; Bennett 2010).
Brucellosis menyebabkan hewan lahir lemah atau aborsi pada trimester
terakhir kebuntingan ketika B. abortus berpindah ke uterus. Lokalisasi dan
replikasi B. abortus pada hewan bunting dikaitkan dengan adanya empat-karbon
alkohol erythritol. Erythritol dapat merangsang dan meningkatkan pertumbuhan
Brucella. Bakteri menetap di sel-sel yang mampu menyediakan nutrisi yaitu
saluran kelamin hewan. Bharde & Bhuktar (2005), erythritol ditemukan pada
plasenta sapi, domba, kambing, babi dan anjing serta vesikula seminalis dan testis
pada hewan jantan. Brucella menggunakan erythritol (glukosa) tersebut sebagai
sumber karbon utama dan energi sehingga dilengkapi satu set enzim untuk
mengubah glukosa menjadi berbagai jenis molekul gula yang digunakan dalam
kelangsungan hidup B. abortus. Erythritol dalam jumlah miligram dapat
meningkatkan pertumbuhan B. abortus secara in vitro (Anderson & Smith 1965;
Anderson & Cheville 1986; Haag et al. 2010).
Koleksi material
Diagnosis brucellosis hewan melalui pemeriksaan kultur,
dan pemilihan sampel yang tergantung pada pengamatan tanda-tanda klinis.
Sampel diagnosis termasuk janin abortus (isi lambung, limpa dan paru-paru),
membran fetus, plasenta induk, leleran vagina (swab), susu, semen dan cairan
higroma. Apabila menggunakan bangkai hewan sebagai sampel, maka jaringan
kelenjar susu dan limpa), kebuntingan terakhir atau uterus awal melahirkan, dan
ambing. Pertumbuhan normal bakteri setelah 4 - 5 hari, tetapi kultur dapat
diamati sampai 2 – 3 minggu sebelum dinyatakan negatif (Alton et al. 1988;
Quinn et al. 2002; OIE 2009, Godfroid et al. 2010).
Sampel jaringan, leleran vagina, susu, serum dan produk peternakan harus
segera didinginkan setelah pengambilan, dan dibawa ke laboratorium secepatnya.
Sampel (susu dan jaringan) yang tidak langsung dikultur harus disimpan dalam
kondisi beku (Alton et al. 1988).
Diagnosis Brucellosis
Diagnosis brucellosis dilakukan secara serologi dan pemeriksaan
bakteriologis. Uji serologi dapat dilakukan dengan Rose Bengal Test (RBT),
Complement Fixation Test (CFT), Serum agglutination test (SAT) dan Enzyme
Linked Immunosorbent Assays (ELISA). Buffered Brucella Antigen Tests
(BBATs) seperti RBT dan Buffered Plate Agglutination Test (BPAT) dan
Fluorescence Polarisation Assay (FPA) dapat dilakukan sebagai uji screening.
Pengujian pada kelompok sapi perah dapat dilakukan dengan uji Milk Ring Test
(MRT) (OIE 2009).
Pemeriksaan bakteriologis dilakukan dengan isolasi dan identifikasi bakteri
penyebab brucellosis. Isolasi bakteri berasal dari spesimen organ janin keguguran
dan pada sapi jantan dapat diisolasi dari semennya (Alton et al. 1988; OIE 2009;
Godfroid et al. 2010). Apabila uji serologi dilakukan untuk pemberantasan
penyakit brucellosis maka pengujian dilakukan melalui dua tahap yaitu uji
screening (penyaringan) dengan menggunakan uji yang memiliki sensitivitas yang
sangat tinggi (RBT dan MRT) sehingga seluruh hewan yang terinfeksi terjaring.
Hasil screening yang menunjukkan hasil positif kemudian dikonfirmasi dengan uji
yang memiliki spesifisitas yang sangat tinggi seperti CFT atau ELISA (Godfroid
et al. 2010).
Pengobatan pada hewan yang menderita brucellosis secara efektif belum
ada. Pada manusia, pengobatan dilakukan dengan memberikan antibiotika
tetracycline 500 mg/ 6 jam/ peroral selama 6 minggu, doxycycline 100mg/ 12
minggu pada terapi awal ditambah tetracycline atau doxycycline (Corbel 2006).
Pada percobaan mencit yang diinfeksi B. abortus kemudian dilakukan pengobatan
dengan gentamisin selama tiga hari menunjukkan bahwa jumlah bakteri di limpa
setelah 1 dan 3 minggu pengobatan tidak mengalami penurunan (Prior et al. 2005)
Epidemiologi
Kegiatan penanggulangan gangguan reproduksi dilakukan melalui
pengendalian penyakit hewan yang memiliki nilai ekonomis tinggi untuk menekan
jumlah kematian ternak dan meningkatkan produktivitas ternak. Brucellosis
sebagai salah satu penyakit reproduksi pada ternak mempunyai pengaruh penting
terhadap nilai ekonomi. Di Indonesia wabah brucellosis terjadi pertama kali tahun
1983 pada sapi potong di Propinsi Sulawesi Selatan (Ditkeswan 2001). Tahun
1986 diketahui 16 propinsi tertular dan tahun 1991 meningkat menjadi 26 propinsi
kecuali propinsi Bali, sehingga brucellosis dinyatakan sebagai penyakit hewan
endemik di Indonesia.
Program pengendalian dan pemberantasan PHM brucellosis dilakukan
secara bertahap. Pada tahun 2002, pulau Bali dinyatakan bebas historis penyakit
brucellosis melalui Keputusan Menteri Pertanian No. 443/Kpts/TN.540/7/2002,
sementara pulau Lombok, Provinsi Nusa Tenggara Barat, dinyatakan bebas
penyakit brucellosis melalui program pemberantasan dalam Keputusan Menteri
Pertanian No. 444/Kpts/TN.540/7/2002. Pulau Sumbawa provinsi Nusa tenggara
Barat bebas Brucella berdasar SK Menteri Pertanian No. 97/Kpts/PO.660/2/2006.
Di tahun 2009, Provinsi Sumatera Barat, Riau, Jambi, dan Kepulauan Riau
dinyatakan bebas dari penyakit brucellosis pada sapi dan kerbau melalui
Keputusan Menteri Pertanian No. 2541/Kpts/PD.610/6/2009. Pulau Kalimantan
juga dinyatakan bebas dari penyakit brucellosis pada sapi dan kerbau melalui
Keputusan Menteri Pertanian No. 2540/Kpts/PD.610/6/2009 menyatakan Pulau
Kalimantan bebas dari penyakit hewan keluron menular (brucellosis) pada sapi
dan kerbau.
Pada saat ini, target penanggulangan gangguan reproduksi di 21 provinsi,
11 provinsi memiliki prevalensi brucellosis pada sapi potong sangat rendah
Sulawesi Tengah, Gorontalo dan Sulawesi Barat, 4 provinsi memiliki kasus tinggi
pada sapi potong yaitu Nangroe Aceh Darussalam, Nusa Tenggara Timur (P.
Timor yaitu TTU dan Belu), Sulawesi Selatan dan Sulawesi Tenggara dan
sebanyak 7 provinsi telah bebas brucellosis berdasarkan Keputusan Menteri
Pertanian (Ditjennak 2010). Namun tahun 2011, Provinsi Sumatera Selatan,
Bengkulu, Lampung & Kepulauan Bangka Belitung ditetapkan bebas dari
penyakit hewan keluron menular pada sapi berdasarkan Keputusan Menteri
Pertanian No. 5681/kpts/PD.620/12/2011. Peta situasi brucellosis di Indonesia
sampai tahun 2011 terlihat pada Gambar 1.
Di Pulau Jawa yang merupakan populasi tertinggi sapi perah, kasus
Brucellosis masih relatif tinggi dengan prevalensi rata-rata 2 - 3%. Upaya
pemberantasannya dilakukan dengan vaksinasi karena prevalensi lebih dari 2%
sehingga test and slaughter belum dilakukan mengingat tingginya jumlah yang
harus dipotong dan mahalnya biaya kompensasi.
Gambar 1 Peta situasi brucellosis di Indonesia sampai tahun 2011 (Ditkeswan 2012)
Secara serologi, sekitar 80,5% dari ternak yang mengalami abortus
disebabkan oleh bakteri B. abortus (positif CFT). Sekitar 48,5% kejadian abortus
terjadi pada umur kebuntingan trimester dua (4 - 6 bulan) dan sekitar 48,5%
97% kejadian abortus terjadi pada umur kebuntingan lebih tua dari tiga bulan
(Putra 2005).
Kontrol Brucellosis
Usaha pengendalian brucellosis di lapangan berdasarkan Keputusan
Menteri Pertanian No.828/Kpts/OT.210/10/98 mengenai Pedoman Pemberantasan
Brucellosis pada ternak di Indonesia. Dua strategi pemberantasan berdasarkan
tingkat kejadiannya yaitu apabila prevalensi reaktor ≥ 2 % dengan kategori
tertular berat, maka metode pemberantasannya dengan cara vaksinasi. Sedangkan
pada daerah kategori tertular rendah (prevalensi < 2%), ditetapkan dengan teknik
potong bersyarat (test and slaughter).
Pengendalian penyakit brucellosis pada ternak melalui vaksinasi dapat
dilakukan dengan menggunakan vaksin hidup dan mati yang dilemahkan. Vaksin
hidup yang dilemahkan mempunyai beberapa kelebihan dibanding vaksin mati
yang pada umumnya mampu menghasilkan imunitas cukup lama dan merangsang
reaksi kekebalan pada tubuh inang yaitu cell-mediated. Oleh karena vaksin
diberikan hidup, maka bakteri mereplikasi dalam tubuh inang sehingga vaksin
lebih murah. Namun, vaksin hidup yang dilemahkan dapat menyebabkan aborsi.
Vaksin B. abortus Strain 45/20 dengan adjuvant merupakan vaksin mati
yang dikembangkan karena adanya kemungkinan reverse apabila menggunakan
vaksin hidup. Strain 45/20 berasal dari Brucella S45/0 yang diisolasi dari material
sapi abortus sebelum tahun 1922 dengan morfologi smooth dan virulen pada
marmot. Brucella S45/0 selanjutnya dipassase 20 kali pada marmot sehingga
morfologi menjadi rough atau kasar sehingga secara umum disebut Strain 45/20.
Vaksin diberikan pada ternak dewasa dan memberikan perlindungan sekitar 70 %
(Morgan 1982; WHO 1997).
Saat ini terdapat dua vaksin hidup yang dilemahkan untuk mencegah
brucellosis pada sapi adalah vaksin B. abortus Strain 19 (S19) dan RB51. Strain
19 memiliki smooth lipopolisakarida yang ditentukan oleh panjang rantai O
polisakarida pada permukaan sel. Lipopolisakarida B. abortus tipe smooth terdiri
dari lipid A, inti oligosakarida dan rantai khas O polisakarida (O-antigen). Vaksin
vaksin S19 adalah timbulnya respon antibodi yang tinggi sehingga memberikan
proteksi pada sapi yang divaksin. Tetapi vaksin ini menyebabkan masalah karena
antibodi yang diproduksi menimbulkan positif palsu pada tes serologi terhadap
infeksi Brucella (Stevens et al. 1995; Cardoso et al. 2006). Vaksin S19
merupakan vaksin stabil yang tidak akan kembali menjadi virulen. Dosis
pemberian 5 - 8 X 1010
CFU/ml yang diberikan subcutan.Vaksin diberikan pada
sapi umur 3 – 6 bulan yang dapat memberikan perlindungan sampai 5 kali
kebuntingan dan mungkin dapat lebih (Morgan 1982; OIE 2009). Strain 19
memiliki efek aborsi pada sapi bunting dan virulen pada manusia (Cardoso et al.
2006). Morgan (1982) menyatakan bahwa penggunaan vaksin S19 memberikan
perlindungan yang lebih baik dari vaksin S45/20 dengan adjuvant.
Pada tahun 2004, Departemen Pertanian RI mengijinkan peredaran vaksin
strain RB51. Strain RB51 merupakan mutan kasar dari B. abortus virulen strain
2308 (S2308) dan dibuat dengan melakukan passase berulang B. abortus 2308
dalam media yang mengandung rifampisin dan penisillin. Strain RB51 tidak
memiliki rantai O antigen (Schurig et al. 1991). Ternak yang divaksin dengan
strain RB51 tidak memproduksi antibodi terhadap O antigen yang terdeteksi pada
uji serologi brucellosis (Schurig et al. 1991; Cheville et al. 1993). Strain RB51
resisten terhadap rifampisin (Miranda 2009). Seperti vaksin S19, strain RB51 juga
menyebabkan infeksi pada manusia. Selain itu terdapat vaksin B. melitensis Rev. 1
untuk vaksinasi kambing dan domba.
Teknik potong bersyarat (test and slaughter) yaitu setiap hewan yang diuji
secara serologi dan hewan dengan reaksi positif (reaktor) harus dipotong. Pada
daerah tertular rendah (prevalensi < 2%) maka dilakukan test and slaughter. Test
and slaughter dilakukan pada 50 % populasi sapi dan kerbau betina di tingkat
provinsi apabila terdapat sumberdaya yang memadai. Dan tahun kedua dilakukan
50% sisanya serta desa-desa yang positif CFT dari hasil uji pertama. Test and
slaughter tahun ketiga dilakukan di kecamatan atau desa dengan kasus positif
CFT dalam dua tahun terakhir. Tahun kelima dilakukan pada desa dengan kasus
positif CFT dalam dua tahun terakhir. Daerah bebas brucellosis apabila prevalensi
Radiasi
Radiasi merupakan energi yang dipancarkan dalam bentuk partikel atau
gelombang. Radiasi diklasifikasikan sebagai radiasi non pengion (energi rendah)
atau pengion (energi tinggi). Jenis radiasi non pengion seperti sinar ultraviolet,
cahaya tampak, radiasi inframerah, radiasi frekuensi radio dan gelombang mikro.
Radiasi pengion dari matahari (sinar kosmik), bahan radioaktif, dan mesin X-ray.
Radiasi pengion dikelompokkan menjadi dua golongan sesuai dengan komponen
fisiknya yaitu memiliki masa dan bermuatan atau tidak bermuatan, dan hanya
memiliki energi saja. Empat jenis utama dari radiasi pengion (1) partikel. alpha
bermuatan positif terdiri dari dua neutron dan dua proton, relatif berat dan
bergerak lambat dari emisi radioaktif lainnya, (2) partikel beta merupakan partikel
bermuatan negatif terdiri dari elektron dan lebih ringan serta cepat dibandingkan
partikel alpha, (3) sinar gamma adalah radiasi gelombang elektromagnetik pendek
yang dipancarkan oleh peluruhan radioaktif atom tidak stabil dan mempunyai
penetrasi yang tinggi, dan (4) sinar X mempunyai energi lebih rendah dan
kemampuan penetrasinya kurang daripada sinar gamma. Sinar X yang
dipancarkan berasal dari proses luar inti, sementara sinar gamma berasal dari inti
(Czarnecki 2009).
Sinar gamma
Sinar gamma berupa radiasi elektromagnetik panjang gelombang pendek
dipancarkan oleh isotop radioaktif sebagai inti tidak stabil dan meluruh untuk
mencapai bentuk stabil. Deoxyribonucleic acid (DNA) merupakan target selular
yang mengatur hilangnya viabilitas setelah terpapar sinar gamma. Kerusakan
DNA terjadi secara dominan oleh efek tidak langsung sinar gamma, yang
berinteraksi dengan atom lainnya atau molekul, khususnya air sehingga
mengalami hidrolisis dan menghasilkan radikal bebas. Radikal bebas
menyebabkan kerusakan materi sel. Efek langsung adalah terjadinya pemutusan
ikatan senyawa-senyawa penyusun sel. Kematian sel dominan disebabkan oleh
terputusnya untai ganda DNA, terpisahnya beberapa pasangan basa, yang
umumnya tidak dapat diperbaiki oleh sel. Efek sinar gamma terhadap viabilitas
seperti perubahan dalam site pengikatan primer atau pengurangan DNA menjadi
fragmen-fragmen yang lebih kecil dari target (Hall & Giaccia 2006). Radiasi
ionisasi menyebabkan atom dan molekul menjadi terionisasi atau tereksitasi
sehingga terputusnya ikatan kimia, menghasilkan ikatan kimia baru dan adanya
ikaatan antar makromolekul, adanya kerusakan molekul yang mengatur aktivitas
sel (misalnya DNA, RNA, protein) baik pada stuktur maupun ikatan proteinnya
(Tubiana et al. 1990). Ketahanan radiasi DNA pada sel-sel hidup banyak
ragamnya, DNA dalam sel hidup lebih tahan radiasi daripada ekstrak DNA karena
massa molekul rendah sehingga menyerap radikal bebas dalam sel (Hall &
Giaccia 2006).
Penggunaan sinar gamma beragam manfaatnya seperti untuk sterilisasi
alat-alat medis, pengawetan makanan dan pengolahan jaringan allografts dan
komponen darah, dan menghindarkan kebutuhan suhu tinggi yang dapat merusak
suatu produk. Selain itu sinar gamma juga digunakan untuk membuat vaksin yang
lebih efektif daripada pemanasan atau inaktivasi kimiawi. Penelitian penggunaan
vaksin yang dilemahkan dengan memberikan paparan radiasi pengion terhadap
suspensi mikroorganisme dilakukan pada bakteri (Gordon et al. 1964) dan virus
(Sykes 1965). Sinar gamma yang dimanfaatan untuk inaktivasi yaitu radiasi
elektromagnetik panjang gelombang pendek yang memiliki kemampuan penetrasi
tinggi dan memiliki karakteristik tanpa memberikan radiaoaktivitas pada materi
yang terpapar. Beberapa penelitian menunjukkan bahwa kemampuan infektivitas
akan rusak namun sifat antigenesitas tetap utuh (Reitman & Tribble 1967). Vaksin
iradiasi bakteri Listeria monocytogenes meningkatkan respon imun dibandingkan
teknik konvensional. Bakteri diiradiasi mendorong respon imun dari sistem
kekebalan sel T (Kochman 2006). Sinar gamma juga digunakan untuk
melemahkan Plasmodium (WHO 2001). Vaksin lain dengan teknik iradiasi yaitu
metaserkaria iradiasi yang mampu mengurangi jumlah Fasciola hepatica pada
anak sapi, penggunaan radiasi sinar X pada larva stadium kedua yang menetas
dari telur cacing paru Dictyocaulus viviparus penyebab pneumoni verminosa
(Tizard 1988).
Inaktivasi patogen melalui iradiasi merupakan metode yang dapat
penyakit patogen (IAEA 2012). Hal ini ditunjukkan dengan munculnya vaksin
anti-parasit iradiasi untuk malaria pada manusia. Dosis iradiasi gamma yang
relatif rendah dari sumber 60Co digunakan untuk menonaktifkan organisme,
misalnya malaria iradiasi 150 Rad, Fasciola iradiasi 30 Gy, Brucella iradiasi 6
kGy, sedangkan patogen virus memerlukan dosis yang lebih tinggi misalnya RVF
iradiasi pada 25 kGy (IAEA 2012). Vaksin aktif protozoa malaria dari stadium
sporozoit menggunakan dosis iradiasi berkisar 150 – 200 Gy (Hoffman et al.
2002). Radiasi gamma dari sumber 60Co juga digunakan untuk inaktivasi Lansing
poliomyelitis, St. Louis encephalitis. Western equine encephalomyelitis dan
vaccinia viruses (Russell & Kempe 1956). Paparan radiasi gamma pada B.
neotomae dan strain rekombinan overexpressing superoxide dismutase serta
protein periplasmik 26 kDa tidak menyebabkan replikasi bakteri (Moustofa et al.
2011).
Bakteri Brucella rekombinan iradiasi gamma masih mempunyai
kemampuan metabolik aktif (Sanakkayala et al. 2005). Agen hidup yang diradiasi
dengan iradiasi gamma mencegah replikasi agen dalam inang, tapi tidak
menghentikan aktivitas metabolik agen. Agen tetap aktif secara metabolik,
sehingga mampu menghasilkan senyawa imunogenik yang mampu menstimulasi
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian berlangsung dari bulan Mei 2011 sampai November 2012 di
Laboratorium Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan
Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan Institut Pertanian
Bogor (IPHK FKH IPB), Balai Besar Penelitian Veteriner (Bbalitvet) dan Pusat
Aplikasi Tehnologi Isotop dan Radiasi (PATIR) BATAN Jakarta .
Bahan dan Alat
Bahan yang digunakan adalah antigen Milk Ring Test (MRT) Bbalitvet untuk
screening brucellosis; media untuk isolasi: Triptone soya agar (TSA), Triptone
soya broth (TSB), Brucella selective supplement (Polymixin B, Bacitracin,
Cycloheximide, Nalidixic acid, Nystatin dan Vancomycin), 2 – 5% Fetal Calf
Serum (FCS), saline; serta bahan untuk identifikasi : pereaksi oksidase (1%
NNN’N’-tetramethyl-p-phenylene diamine dihydrochloride), H2O2 3%, Kertas
Plumbum asetat (Pb asetat), urea agar base, Simon’s Citrate Agar, supplement
urea 40%, Brucella monospesific M serum (M, Veterinary Laboratories Agency),
Brucella monospesific A serum (A, Veterinary Laboratories Agency), CO2,
fuchsin dan thionin. Bahan untuk uji serologi : antigen reagen RBT Bbalitvet, antigen
CFT Bbalitvet, komplemen, hemolisin, sel darah merah (eritrosit) domba, kontrol
serum positif dan negatif brucellosis.
Alat yang digunakan adalah Biological safety cabinets (BSC) kelas IIA,
mikroskop, spektrofotometer, inkubator, irradiator Gamma chamber, microtube,
tabung 10 ml, Erlenmeyer, pipet 1 - 10 ml, mikropipet, inkubator CO2, cawan
Petri, cawan mikro dasar U (U bottom), rotary agglutinator, shaker, kaca
pembesar (loop),cawan hemaglutinasi WHO (WHO hemagglutination plate), box
Metode Penelitian Koleksi sampel
Sampel diperoleh dari sampel susu sapi perah di Bandung Jawa Barat (91
sampel), cairan amnion sapi perah sampel diagnostik di Bbalitvet Bogor (1
sampel) dan cairan higroma sapi potong di Belu, Nusa Tenggara Timur (15
sampel). Semua sampel dikoleksi oleh Laboratorium Brucellosis Bbalitvet Bogor.
Sampel susu
Sampel susu diambil secara aseptik setelah mencuci dan mengeringkan
ambing keseluruhan dan desinfeksi puting. Sampel diambil dari semua kuartir,
dan susu diambil 10 - 20 ml dari setiap puting sapi. Pancaran pertama dibuang dan
sampel diperah langsung ke tabung steril. Sampel diuji dengan antigen Milk Ring
Test dan sisanya disimpan pada suhu -20 0C sampai dilakukan isolasi bakteri.
Sampel amnion
Sampel amnion diperoleh dari sampel diagnosik sapi simmental yang
mengalami keguguran pada kebuntingan 6 bulan. Selain itu juga dilakukan
pemeriksaan serologi terhadap serum sapi tersebut.
Sampel higroma
Sampel higroma dikoleksi dengan menggunakan syringe steril kemudian
cairan higroma dimasukkan ke tabung. Selain itu dilakukan pemeriksaan terhadap
serum sapi yang dikoleksi untuk pemeriksaan serologi. Sampel disimpan pada
suhu -20 0C sampai dilakukan isolasi.
Milk Ring Test (MRT)
Milk Ring Test digunakan untuk screening B. abortus dengan antigen
MRT. Uji MRT yaitu sebanyak 1 - 2 ml susu dalam tabung reaksi ditambahkan
dengan 0,03 – 0,05 ml antigen MRT, kemudian diaduk-aduk sehingga terlihat
warna biru. Tabung diinkubasi selama 1 jam pada suhu 37 °C, kemudian dibaca
reaksinya dengan kriteria sebagai berikut: negatif (-), lapisan krim di bagian atas
lapisan krim berwarna sama dengan bagian susu dibawahnya; positif ++ (+2),
warna biru pada cairan krim lebih tua dibandingkan dengan warna susu
dibawahnya; positif +++ (+3), cincin krim jelas berwarna biru dengan sedikit biru
ada pada bagian susu dibawahnya; dan positif ++++ (+4), cincin krim jelas
berwarna biru dan bagian susu dibawahnya berwarna putih.
Serologi
Rose Bengal Test (RBT) dan Complement Fixation Test (CFT) digunakan
untuk diagnosa serologi terhadap brucellosis.
Rose Bengal Test (RBT). Sebanyak 25 µl serum diambil menggunakan
mikropipet dan dicampurkan dengan 25 µl antigen RBT (Bbalitvet) di masukkan
ke dalam sumur cawan. Larutan dicampur hingga rata dengan menggerakkan
cawan berputar kekiri dan ke kanan kemudian cawan digoyang di atas rotary
agglutinator selama 4 menit. Pada setiap pengujian selalu menggunakan kontrol
positif dan negatif. Hasil reaksi dinilai negatif (-): tidak ada aglutinasi, tidak ada
batas pinggir dan campuran antigen dan serum homogen; positif (+1), terlihat
penggumpalan yang halus dan batas pinggir terjadi seperti garis putus-putus;
positif (+2) terlihat jelas penggumpalan yang halus dengan garis tepi yang lebar;
positif (+3) terlihat penggumpalan yang kasar dan cairan terlihat jernih.
Complement Fixation Test (CFT). Setiap sumur cawan mikro dengan dasar
U (U bottom) pada baris A masing-masing diisi serum 0.05 ml (termasuk serum
kontrol positif dan negatif), kemudian diinaktivasi pada suhu 58 ºC selama 30
menit di penangas air. Semua sumur kecuali baris A diisi saline sebanyak 0,025
ml. Selanjutnya serum diencerkan dalam saline dengan cara memindahkan 0,025
ml serum dari A ke sumur cawan di baris B, seterusnya sampai baris H, sehingga
diperoleh enceran serum ½, ¼, 1/8, 1/16 dan seterusnya. Setiap sumur pada baris
C sampai H diisi dengan antigen 0,025 ml. Kemudian baris B sampai H ditambah
0,025 komplemen pada setiap sumur. Semua sumur pada baris B ditambah diluen
0,025 ml dan digunakan sebagai kontrol terhadap adanya aktivitas komplementer.
masa inkubasi selesai, setiap sumur dari baris B sampai H ditambahkan 0,025 ml
eritrosit yang telah disensitifkan dengan hemolisin. Kemudian cawan diinkubasi
pada temperatur 37 ºC selama 30 menit sambil dikocok dengan alat pengocok
(shaker). Cawan mikro diputar pada kecepatan 2000 rpm selama 5 menit atau
didiamkan pada suhu 4 ºC semalam.
Hasil reaksi CFT dibaca sebagai negatif (-), terjadi hemolisis sempurna,
cairan dalam sumur berwarna merah, tidak ada endapan eritrosit didasar sumur;
Positif + (+1), terjadi hemolisis hampir sempurna, cairan dalam sumur berwarna
merah, terdapat sedikit endapan eritrosit didasar sumur; Positif ++ (+2), sebagian
besar hemolisis, cairan berwarna merah, endapan eritrosit agak melebar dengan
tepi rata; +++ (+3), sebagian besar eritrosit tidak lisis, warna cairan agak merah,
endapan eritrosit terlihat jelas; ++++ (+4), tidak terjadi hemolisis, cairan dalam
sumur bening, endapan eritrosit terlihat nyata dengan batas pinggir rata.
Interpretasi hasil uji pengikatan komplemen berdasarkan terjadinya 50%
hemolisis pada pengenceran serum tertinggi. Serum dengan titer CFT 1:4 (1/4)
atau lebih dikategorikan positif.
Isolasi B. abortus
Isolasi sampel. Isolasi dilakukan berdasarkan Alton et al. (1988) dan OIE
(2009).
Sampel susu
Sampel susu disentrifugasi pada 3000 rpm selama 30 menit dalam tabung
tertutup. Krim dan endapan diaduk kemudian dikultur menggunakan swab dari
kapas ke media TSB yang mengandung FCS dan Brucella selective supplement.
selanjutnya tabung diinkubasi pada suhu 37 °C dengan 5 % CO2 selama 3 - 4 hari
di inkubator CO2 untuk diamati kekeruhannya. Kemudian bakteri dikultur ke
cawan Petri yang mengandung media TSA dan Brucella selective supplement.
Cawan Petri diinkubasi pada suhu 37 °C dengan 5 % CO2 selama 3 - 4 hari di
inkubator CO2. Bakteri yang dicurigai kemudian disubkultur pada media selektif
TSA di cawan Petri dan diinkubasi suhu 37 °C dengan 5 % CO2 selama 3 - 4 hari
Sampel amnion
Isolasi B. abortus dari cairan amnion sapi simental yang mengalami
abortus pada kebuntingan 6 bulan. Cairan amnion dimasukkan ke dalam tabung
berisi TSB, FCS dan Brucella selective supplement. Selanjutnya cairan amnion
diinkubasi pada suhu 37 °C selama 3 - 4 hari di inkubator CO2 untuk diamati
kekeruhannya. Setelah terlihat kekeruhannya maka bakteri dikultur pada media
yang mengandung TSA dan Brucella selective supplement. Koloni yang terpisah
dan dicurigai disubkultur pada media TSA dan diinkubasi selama 3 - 4 hari di
inkubator CO2.
Sampel higroma
Isolasi B. abortus dari cairan higroma sapi yang dicurigai menderita
brucellosis kronis. Sebanyak 0,5 ml cairan higroma dimasukkan ke dalam tabung
berisi 3 ml TSB yang mengandung FCS dan Brucella selective supplement.
Selanjutnya dilakukan isolasi seperti cairan amnion.
Identifikasi dan biotypingB. abortus
Identifikasi dan bioytping mengikuti metode Alton et al. (1988), Barrow &
Feltham (1993) dan OIE (2009).
Cawan Petri diinkubasi pada suhu 37 °C dengan 5 % CO2 selama 4 hari di
inkubator CO2 untuk mengetahui keberadaan koloni Brucella. Identifikasi bakteri
Brucella meliputi morfologi koloni, pewarnaan Gram dan uji biokimiawi
(oksidase, katalase dan uji sitrat) dilanjutkan dengan biotyping isolat terhadap
penggunaan CO2, produksi H2S, aktifitas urease, pertumbuhan pada zat warna
basic fuchsin dan thionin dan uji aglutinasi dengan Brucella monospesific M
serum dan Brucella monospesific A serum.
Pewarnaan Gram. Gelas objek dibersihkan dari lemak dengan alkohol 70
% dan diberi label. Satu tetes akuades steril diletakkan pada permukaan gelas
objek. Isolat diambil dengan jarum Őse kemudian di campur dengan akuades dan
diulas merata pada permukaan gelas objek. Preparat difiksasi dengan melewatkan
di atas api sampai terlihat kering. Larutan crystal violet diteteskan pada preparat
Kemudian larutan iodine lugol diteteskan pada preparat sampai merata, dan
diamkan selama 1 menit. Preparat dicuci dengan air mengalir dan
dikeringanginkan. Larutan alkohol aseton diteteskan pada preparat sampai merata
dan diamkan. Preparat dicuci dengan air mengalir. Larutan safranin diteteskan
pada preparat sampai merata dan diamkan selama 15 detik. Preparat dicuci dengan
air mengalir dan dikeringanginkan. Preparat diamati menggunakan mikroskop
pada perbesaran 10 x 100. Sifat bakteri gram positif ditandai dengan sel bakteri
berwarna ungu dan gram negatif ditandai dengan sel bakteri berwarna merah.
Uji Oksidase. Kertas saring dibasahi dengan pereaksi oksidase. Satu loop
isolat bakteri diambil dengan jarum Őse dan digoreskan pada kertas saring yang
diberi pereaksi oksidase (1% NNN’N’-tetramethyl-p-phenylene diamine
dihydrochloride). Reaksi dinyatakan negatif jika tidak ada perubahan warna pada
kertas saring dan positif jika terjadi perubahan warna biru keunguan pada goresan
dalam waktu 10 detik.
Uji katalase. Gelas objek ditetesi larutan H2O2 3% 1 tetes. Isolat diambil
dengan jarum Őse kemudian dicampurkan pada reagen H2O2 pada gelas objek.
Reaksi positif apabila terbentuk gelembung-gelembung udara kurang dari 10
detik.
Uji Sitrat. Pengujian dilakukan dengan menginokulasikan isolat ke
Simmon’s citrate agar. Tabung diinkubasi pada suhu 37 °C selama 4 hari di
inkubator CO2. Hasil uji positif apabila media biru.
Penggunaan CO2. Bakteri dilakukan pengujian kebutuhan karbondioksida
dengan melakukan subkultur pada dua agar miring dan diinkubasi, satu tabung
dengan menambahakan 5 % CO2 dan tabung lainnya tanpa CO2. Pengamatan
dilakukan setelah 3 - 4 hari inkubasi. Penentuan kebutuhan CO2 berdasarkan
kemampuan bakteri tumbuh pada tabung dengan CO2 atau tanpa CO2.
Produksi H2S. Pengujian dilakukan dengan menginokulasikan isolat ke
TSA miring dan dilengkapi dengan strip kertas yang mengandung Pb asetat 10%
yang ditempatkan di lubang tabung, tapi tidak kontak dengan medium. Kertas Pb
asetat akan berubah menjadi hitam apabila diproduksi H2S. Pengamatan dilakukan
Aktifitas urease. Pengujian dilakukan dengan menginokulasikan isolat ke
ke urea agar base miring yang mengandung urea supplement 4%. Tabung
diinkubasi pada suhu 37 °C selama 4 hari di inkubator CO2. Hasil uji positif
apabila media berubah menjadi purple – pink.
Pertumbuhan pada zat warna basic fuchsin dan thionin. Isolat
ditumbuhkan pada medium TSA yang mengandung thionin dengan kadar 1 :
25.000, 1 : 50.000 dan 1: 100.000 dan basic Fuchin dengan kadar 1 : 50.000 dan
1: 100.000. Pengamatan dilakukan setelah 3 sampai 4 hari. Isolat yang peka maka
tidak tumbuh pada media TSA yang mengandung zat warna tersebut, dan
sebaliknya yang tidak peka maka akan tumbuh.
Uji aglutinasi. Isolat Brucella diuji aglutinasi dengan Brucella
monospesific A serum (A) dan Brucella monospesific M serum (M). Pengujian
dilakukan dengan mencampur masing-masing serum monospesifik A atau M
dengan suspensi isolat pada gelas objek. Reaksi positif ditunjukkan dengan
terjadinya aglutinasi.
Iradiasi sinar Gamma B. abortus
Jumlah koloniB. abortus sebelum perlakuan iradiasi dapat dihitung secara
tidak langsung dengan membuat kurva standar B. abortus. Pembuatan kurva
standar adalah sebagai berikut isolat B. abortus dari TSA miring diinokulasikan
ke 75 ml TSB, kemudian diinkubasi pada suhu 37 °C selama 3 hari di inkubator
CO2 dengan penambahan 5% CO2. Selanjutnya suspensi diukur absorbansi
(Optical Density, OD) menggunakan spektrofotmeter pada panjang gelombang
640 nm. Suspensi yang telah diukur absorbansinya selanjutnya dilakukan
pengenceran berseri dan ditanam ke TSA. Bakteri diinkubasi selama 3 hari dengan
menambahakan 5 % CO2 di inkubator CO2. Kemudian jumlah koloni dihitung
pada masing - masing pengenceran, dan dibuat kurva standar dengan menggambar
hubungan antara nilai absorbansi dengan jumlah koloni bakteri.
Iradiasi dilakukan mengikuti metode El – Zawahry & Grecz 1981; Cassidy
II 2010; Enright et al. 2001. B. abortus dikultur pada media TSA miring pada
suhu 37° C selama 3 hari. Bakteri dipanen dari TSA dengan menambahkan 5 ml
TSA, botol Roux digoyang – goyang supaya suspensi menyebar rata pada
permukaan botol. Brucella diinkubasi sesuai fase log titik pertumbuhan tercepat
pada suhu 37°C selama 3 hari di inkubator CO2. Kultur dipanen dengan
menambahkan larutan saline ke botol Roux kemudian kultur disentrifugasi selama
10 – 15 menit pada 3000 rpm dengan sentrifuse Sorvall berpendingin (2 - 4°C).
Supernatan dibuang dan pelet dicuci dua kali dengan larutan saline. Setelah
pencucian, kepadatan sel dihitung dengan menggunakan spektrofotometer
sehingga konsentrasi 108 Colony forming units (CFU)/ml. Suspensi ditempatkan
dalam 5 microtube untuk diradiasi pada dosis 0, 50, 100, 150, dan 200 Gy dalam
iradiator Gamma Chamber di PATIR BATAN. Setelah itu suspensi bakteri
ditanam pada media TSA dan diinkubasi selama 3 – 5 hari pada 37 °C dengan 5
% CO2. Jumlah koloni bakteri yang tumbuh dihitung sehingga dapat ditentukan
dosis radiasi yang menyebabkan kematian 50% (Lethal Dose50, LD50).
Uji in vivoB. abortus iradiasi ke marmot (Cavia cobaya)
Metode pengujian in vivo merupakan modifikasi OIE (2009). Pengujian ini
digunakan untuk mengetahui efek pemberian strain B. abortus iradiasi yang
dilemahkan sebagai kandidat vaksin. Pada penelitian ini menggunakan 8 ekor
marmot jantan dengan bobot badan kira – kira 650 gram. Marmot diaklimatisasi
selama 1 minggu sebelum penelitian dan dibagi dalam 8 kelompok (Tabel 2).
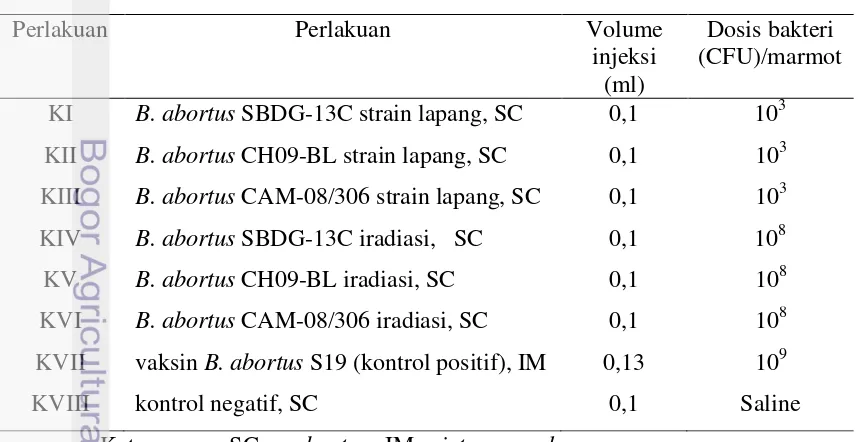
Tabel 2 Kelompok, volume dan dosis bakteri perlakuan pada uji in vivo
Keterangan : SC = subcutan; IM = intramuscular
Jumlah CFU/ml dihitung dengan pengenceran berseri berdasarkan
standard plate counts pada media TSA untuk mengkonfirmasi perkiraan jumlah
koloni tersebut (Olsen 2000). Pengujian dilakukan selama 3 minggu. Kelompok
kontrol negatif (KVIII) dipelihara diruang terpisah dari kelompok lainnya.
Marmot diberi pakan rumput, ubi dan konsentrat.
Pengambilan data serum dilakukan setiap minggu yaitu pada minggu ke 0
(sebelum perlakuan), minggu ke-1, minggu ke-2, dan minggu ke-3. Marmot dibius
terlebih dahulu untuk pengambilan darah dengan ketamin dosis 40 mg/kg berat
badan dan xylazin dosis 5 mg/kg berat badan secara intraperitoneal (Meredith &
Redrobe 2002).
Tiga minggu setelah infeksi, semua marmot dieuthanasi dengan pemberian
ketamin dan xylacin. Limpa dari marmot diambil secara aseptik selanjutnya
ditimbang dan dibuat suspensi dan dibiakkan pada media TSA yang ditambahkan
Brucella selective supplement. Sampel serum dipisahkan dari darah kemudian
disimpan pada suhu - 20°C untuk pemeriksaan serologi RBT dan CFT. Parameter
yang digunakan untuk mengetahui uji ini yaitu pengamatan lesi (pembesaran
limpa dan atau nodul), jumlah koloni per gram limpa dan perbandingan berat
limpa/bobot badan.
Perhitungan bakteri dalam limpa marmot. Masing-masing limpa
dilepaskan secara aseptik dan ditimbang beratnya. Selanjutnya limpa dihancurkan
menggunakan pelumat secara aseptik dengan menambahkan larutan saline 1 : 1
kemudian suspensi limpa dibuat seri pengenceran. Setiap pengenceran dikultur
pada media TSA yang ditambahkan Brucella selective supplement kemudian
diratakan dengan spreader dan diamkan beberapa menit. Bakteri diinkubasi pada
37 ºC selama 3 – 4 hari di inkubator CO2 dengan 5 % CO2. Jumlah koloni Brucella
per gram limpa yang tumbuh dilakukan penghitungan (Alton et al. 1988; OIE
2009).
Analisis data
Data yang diperoleh dianalisa menggunakan statistik deskriptif dengan
menyajikan dalam bentuk tabel dan grafik serta dianalisa menggunakan software
HASIL DAN PEMBAHASAN
Hasil
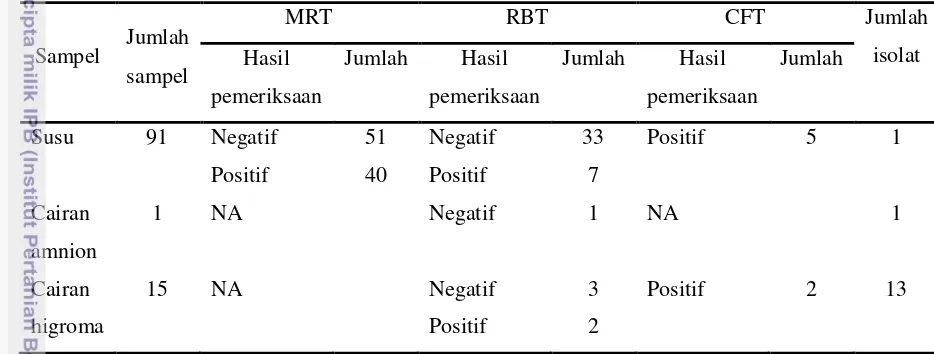
Koleksi sampel
Sampel lapang untuk penyaringan brucellosis diperoleh dari susu, cairan
amnion dan cairan higroma (Tabel 3). Sampel susu diuji dengan MRT dengan
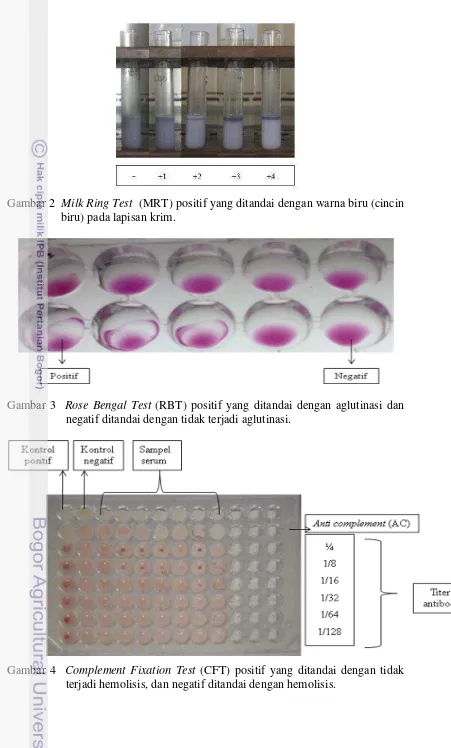
hasil pemeriksaan positif apabila adanya warna biru pada lapisan krim (Gambar 2)
Hasil MRT menunjukkan sebanyak 51 sampel negatif, 15 sampel positif +, 10
sampel positif ++, 12 sampel positif +++, dan 3 sampel positif ++++. Sampel
susu, higroma dan cairan amnion dilakukan pengujian serologi terhadap serum
dengan uji RBT. Hasil RBT positif ditandai dengan adanya aglutinasi, dan negatif
apabila tidak adanya aglutinasi (Gambar 3). Hasil uji RBT susu diperoleh 2
sampel positif (+1), 3 sampel positif (+2) dan 2 sampel positif (+3). Selanjutnya
sampel susu RBT positif dikonfirmasi dengan CFT. Pada uji CFT diperoleh 5
sampel positif terhadap uji CFT. Hasil uji CFT serum positif ditandai dengan tidak
terjadinya hemolisis, sedangkan serum negatif ditandai dengan terjadinya
hemolisis (Gambar 4). Uji RBT pada cairan amnion menunjukkan hasil negatif.
Pada sampel cairan higroma tidak semua serum diperoleh. Serum yang diperoleh
sebanyak 5 buah serum. Pemeriksaan RBT dari serum sampel cairan higroma
diperoleh hasil 3 sampel negatif (-), 1 sampel positif (+1) dan 1 sampel positif
(+3). Dua sampel cairan higroma positif RBT tersebut dilakukan uji konfirmasi
dengan CFT dan hasilnya positif terhadap uji CFT. Hasil uji MRT, RBT dan CFT
ditunjukkan pada Tabel 4.
Tabel 3 Sampel, hewan, lokasi pengambilan dan jumlah sampel lapang pada uji penyaringan brucellosis
Sampel Hewan Lokasi Pengambilan Jumlah
Susu Sapi perah Bandung, Jawa Barat 91
Cairan amnion Sapi simental Sampel diagnostik Bbalitvet Bogor 1
Gambar 2 Milk Ring Test (MRT) positif yang ditandai dengan warna biru (cincin biru) pada lapisan krim.
Gambar 3 Rose Bengal Test (RBT) positif yang ditandai dengan aglutinasi dan negatif ditandai dengan tidak terjadi aglutinasi.
Isolasi B. abortus
Sampel yang digunakan pada penelitian ini merupakan sampel dari Balai
Besar Penelitian Veteriner (Bbalitvet). Berdasarkan hasil isolasi yang diperoleh
(Tabel 4) selanjutnya dipilih masing – masing 1 sampel untuk digunakan
penelitian (Tabel 5).
Tabel 4 Hasil pemeriksaan MRT, RBT dan CFT sampel susu, cairan amnion dan cairan higroma
Tabel 5 Sampel lapang yang digunakan pada penelitian
Sampel Kode sampel Pemeriksaan
Identifikasi digunakan untuk membuktikan bahwa bakteri yang diisolasi
murni B. abortus. Hasil kultur B. abortus pada media TSA memperlihatkan
gambaran makroskopik yaitu bentuk koloni bulat, halus, permukaan cembung
dan tepi rata (Gambar 5). Sampel dari cairan amnion mempunyai kecenderungan
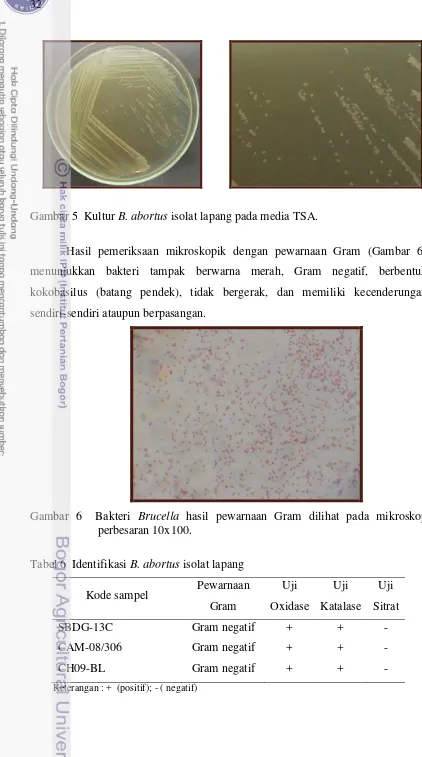
Gambar 5 Kultur B. abortus isolat lapang pada media TSA.
Hasil pemeriksaan mikroskopik dengan pewarnaan Gram (Gambar 6)
menunjukkan bakteri tampak berwarna merah, Gram negatif, berbentuk
kokobasilus (batang pendek), tidak bergerak, dan memiliki kecenderungan
sendiri-sendiri ataupun berpasangan.
Gambar 6 Bakteri Brucella hasil pewarnaan Gram dilihat pada mikroskop perbesaran 10x100.
Tabel 6 Identifikasi B. abortus isolat lapang
Kode sampel Pewarnaan
Gram
Uji
Oxidase
Uji
Katalase Uji
Sitrat
SBDG-13C Gram negatif + + -
CAM-08/306 Gram negatif + + -
CH09-BL Gram negatif + + -
a. b. c.
Gambar 7 Pengujian bakteri yang diisolasi dari susu, cairan amnion dan cairan higroma.
a. Warna biru keunguan di kertas saring pada uji oksidase
b. Terbentuknya gelembung udara di gelas objek pada uji katalase c. Tidak ada perubahan warna pada media Simmon’s citrate agar
Hasil identifikasi biokimiawi ketiga isolat menunjukkan hasil positif pada
uji oksidase, katalase dan hasil negatif pada uji sitrat yang dapat dilihat pada
Tabel 6 dan Gambar 7.
Penentuan biotyping B. abortus terhadap ketiga isolat dapat dilihat pada
Tabel 7 dan Gambar 8 dimana semua isolat membutuhkan CO2 dalam
pertumbuhannya, memproduksi gas H2S, mempunyai kemampuan menghidrolisis
urea, tidak tumbuh pada zat warna basic fuchsin dan tumbuh pada zat warna
thionin. Serta pada uji aglutinasi dengan Brucella monospesific A serum
menunjukkan positif sedangkan dengan Brucella monospesific M serum
menunjukkan hasil negatif. Berdasarkan hasil uji-uji diatas isolat B. abortus
SBDG-13C, CAM-08/306 dan CH09-BL termasuk dalam B. abortus biovar 1.
Tabel 7 Hasil Biotyping tiga isolat lapang B. abortus
Isolat Penggunaan CO2
Produksi
H2S
Aktivitas
Urease
Pertumbuhan Aglutinasi
Thionin BasicFuchin A M
SBDG-13C + + + - + + -
CAM-08/306 + + + - + + -
CH09-BL + + + - + + -
Biovar 1 + + + - + + -
a b
c
d
Gambar 8 Pertumbuhan B. abortus pada beberapa media pengujian.
a. Warna kertas saring menjadi hitam kecoklatan pada TSA miring b. Warna purple – pink pada media urea agas base
c. Pertumbuhan bakteri pada TSA yang mengandung basic Fuchsin d. Tidak ada pertumbuhan bakteri pada TSA yang mengandung
thionin
Keterangan : 1. B. abortus SBDG-13C; 2. CAM-08/306; 3. CH09-BL
Iradiasi B. abortus
Pada penelitian ini dibuat kurva standar untuk menghitung jumlah bakteri
Brucella secara tidak langsung. Penentuan jumlah bakteri yang akan diradiasi
dengan memasukkan nilai absorbansi ke dalam persamaan kurva seperti terlihat
pada Gambar 9.
Efek radiasi sinar Gamma terhadap viabilitas B. abortus dapat dilihat pada
Gambar 10 dan diperoleh persamaan regresi masing – masing isolat yaitu
CAM-08/306 y = -0.021x - 0.0158, R² = 0.99; CH09-BL y = -0.0193x - 0.0704, R² =
0.97; dan SBDG-13C y = -0.0136x - 0.0574, R² = 0.90. Dengan persamaan regresi
tersebut dapat ditentukan nilai LD50 isolat CAM-08/306, CH09-BL dan
SBDG-13C berturut turut adalah: 13,5 ;11,9; dan 17,9 Gy. Dosis tersebut selanjutnya
digunakan sebagai dosis untuk melemahkan B. abortus isolat lapang sebagai
a.
b. c. Gambar 9 Kurva standar B. abortus.a. SBDG-13C; b. CAM-08/306; c. CH09-BL
Gambar 10 Efek radiasi sinar Gamma pada isolat B. abortus SBDG-13C, CAM-08/306 dan CH09-BL.
Keterangan: N = suspensi bakteri radiasi; No= suspensi bakteri tidak radiasi
Uji in vivoB. abortusiradiasi ke marmot (Cavia cobaya)
Kelompok perlakuan marmot yang digunakan pada uji in vivo terdiri atas
8 kelompok yaitu kelompok I (KI, diinfeksi B. abortus SBDG-13C strain
lapang), kelompok II (KII, diinfeksi B. abortus CH09-BL strain lapang),
kelompok III (KIII, diinfeksi B. abortus CAM-08/306 strain lapang), kelompok
IV (KIV, diinfeksi B. abortus SBDG-13C iradiasi), kelompok V (KV,diinfeksi B.
abortus CH09-BL iradiasi), kelompok VI (KVI, diinfeksi B. abortus
CAM-08/306 iradiasi), kelompok VII (KVII, diinfeksi vaksin B. abortus strain S19) dan
kelompok VIII (KVIII, kontrol negatif). Sebanyak 32 buah serum marmot
perlakuan diperiksa secara serologi terhadap terhadap B. abortus menggunakan
metode RBT. Delapan buah serum memberikan hasil positif RBT kemudian
pengujian dilanjutkan ke uji CFT dan sebanyak 6 serum memberikan positif CFT
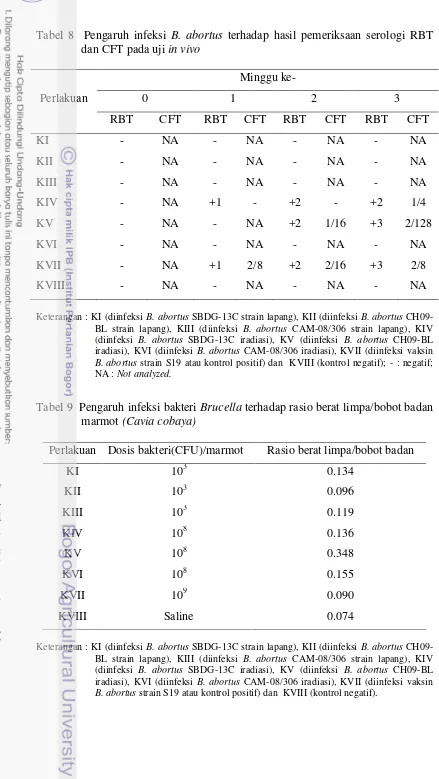
Tabel 8 Pengaruh infeksi B. abortus terhadap hasil pemeriksaan serologi RBT
Keterangan : KI (diinfeksi B. abortus SBDG-13C strain lapang), KII (diinfeksi B. abortus CH09-BL strain lapang), KIII (diinfeksi B. abortus CAM-08/306 strain lapang), KIV (diinfeksi B. abortus SBDG-13C iradiasi), KV (diinfeksi B. abortus CH09-BL iradiasi), KVI (diinfeksi B. abortus CAM-08/306 iradiasi), KVII (diinfeksi vaksin
B. abortus strain S19 atau kontrol positif) dan KVIII (kontrol negatif); - : negatif; NA : Not analyzed.
Tabel 9 Pengaruh infeksi bakteri Brucella terhadap rasio berat limpa/bobot badan marmot (Cavia cobaya)
Keterangan : KI (diinfeksi B. abortus SBDG-13C strain lapang), KII (diinfeksi B. abortus CH09-BL strain lapang), KIII (diinfeksi B. abortus CAM-08/306 strain lapang), KIV (diinfeksi B. abortus SBDG-13C iradiasi), KV (diinfeksi B. abortus CH09-BL iradiasi), KVI (diinfeksi B. abortus CAM-08/306 iradiasi), KVII (diinfeksi vaksin
B. abortus strain S19 atau kontrol positif) dan KVIII (kontrol negatif).
Perlakuan Dosis bakteri(CFU)/marmot Rasio berat limpa/bobot badan