PRODUKSI BIOETANOL DARI HIDROLISAT PATI SINGKONG
RACUN DENGAN FERMENTASI
REPEATED-BATCH
OLEH
Saccharomyces cerevisiae
TERIMOBILISASI PADA
AMPAS SINGKONG
AHMAD JAELANI MANURUNG
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini, saya menyatakan bahwa skripsi berjudul “Produksi Bioetanol dari Hidrolisat Pati Singkong Racun dengan Fermentasi Repeated-Batch oleh
Saccharomyces cerevisiae Terimobilisasi pada Ampas Singkong” adalah karya
saya dengan arahan dari dosen pembimbing serta belum diajukan dalam bentuk apapun kepada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks serta dicantumkan dalam Daftar Pustaka.
Bogor, Mei 2013
Ahmad Jaelani Manurung
ii
ABSTRAK
AHMAD JAELANI MANURUNG. Produksi Bioetanol dari Hidrolisat Pati Singkong Racun dengan Fermentasi Repeated-Batch oleh Saccharomyces cerevisiae Terimobilisasi pada Ampas Singkong. Dibawah bimbingan LIESBETINI HADITJAROKO dan KHASWAR SYAMSU.
Produksi bioetanol secara curah oleh sel mikroba bebas memiliki kelemahan, yaitu produktivitas dan efisiensi yang relatif masih rendah. Di samping itu, produksi bioetanol berbasis pati singkong menghasilkan ampas singkong yang belum dimanfaatkan secara optimal. Oleh karena itu, dalam penelitian ini sel Saccharomyces cerevisiae diimobilisasi dengan menggunakan ampas singkong. Penelitian ini bertujuan mengkaji proses produksi bioetanol dari pati singkong secara repeated-batch oleh Saccharomyces cerevisiae terimobilisasi pada ampas singkong. Metode penelitian ini terdiri atas ekstraksi pati, pembuatan hidrolisat secara enzimatis, perlakuan terhadap ampas singkong oleh HCl 3% (v/v), imobilisasi Saccharomyces cerevisiae pada ampas singkong, serta fermentasi secara repeated-batch. Pada penelitian ini diperoleh rendemen pati sebesar 26.20% (b/b) serta efisiensi konversi pati menjadi hidrolisat sebesar 36.89% (b/b). Penggunaan ampas singkong hasil perlakuan oleh HCl 3% (v/v) telah mampu mengimobilisasi sel sebanyak 1.76x1011 sel per gram carrier. Fermentasi secara repeated-batch oleh Saccharomyces cerevisiae terimobilisasi pada ampas singkong dengan kadar total gula awal 140 g/L menghasilkan etanol berkadar 42.72-63.66 g/L, produktivitas 1.78-2.66 g/L/jam, persentase konversi gula sebesar 90.80-95.74%, yield sebesar 0.33-0.47 g etanol/g gula, serta efisiensi sebesar 65.91-93.13%. Hasil penelitian ini menunjukkan metode imobilisasi yang digunakan memiliki kestabilan yang baik, serta didapatkan produktivitas bioetanol, persentase konversi gula, dan efisiensi tinggi dengan fermentasi secara
repeated-batch.
Kata kunci: ampas singkong, bioetanol, fermentasi, repeated-batch, Saccharomyces cerevisiae
ABSTRACT
AHMAD JAELANI MANURUNG. Bioethanol Production from Hydrolyzed Cassava Starch with Repeated-Batch Fermentation Using Saccharomyces cerevisiae Immobilized on Cassava Bagasse. Supervised by LIESBETINI HADITJAROKO and KHASWAR SYAMSU.
iii
cassava bagasse. Research method consists of starch extraction, starch hydrolysis, cassava bagasse treatment by HCl 3% (v/v), immobilization of Saccharomyces cerevisiae on cassava bagasse, and fermentation by repeated-batch method. The resulting yield of starch was 26.20% (w/w) and conversion efficiency of starch to hydrolyzed starch was 36.89% (w/w). The use of cassava bagasse treated by HCl 3% (v/v) is capable to immobilize 1.76x1011 cells/g carrier. The resulting ethanol concentration was 42.72-63.66 g/L, productivity 1.78-2.66 g/L/h, sugar conversion 90.80-95.74%, yield 0.33-0.47 g/g, and efficiency 65.91-93.13%. This result showed that ethanol production with repeated-batch fermentation by Saccharomyces cerevisiae immobilized on cassava bagasse has good stability, high productivity, sugar conversion, and efficiency.
Keywords: bioethanol, cassava bagasse, fermentation, repeated-batch,
v
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
PRODUKSI BIOETANOL DARI HIDROLISAT PATI SINGKONG
RACUN DENGAN FERMENTASI
REPEATED-BATCH
OLEH
Saccharomyces cerevisiae
TERIMOBILISASI PADA
AMPAS SINGKONG
AHMAD JAELANI MANURUNG
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
vii Judul Skripsi : Produksi Bioetanol dari Hidrolisat Pati Singkong Racun dengan Fermentasi Repeated-Batch oleh Saccharomyces cerevisiae
Terimobilisasi pada Ampas Singkong Nama : Ahmad Jaelani Manurung
NIM : F34080050
Disetujui oleh
Dr Ir Liesbetini Haditjaroko, MS Pembimbing I
Prof Dr Ir Khaswar Syamsu, MSc Pembimbing II
Diketahui oleh
Prof Dr Ir Nastiti Siswi Indrasti Ketua Departemen
viii
PRAKATA
Dengan mengucap syukur alhamdulillah, penulis dapat menyelesaikan skripsi berjudul “Produksi Bioetanol dari Hidrolisat Pati Singkong Racun dengan Fermentasi Repeated-Batch oleh Saccharomyces cerevisiae
Terimobilisasi pada Ampas Singkong” ini dengan baik.
Penulis menyampaikan terima kasih kepada Ibu Dr Ir Liesbetini Haditjaroko, MS dan Bapak Prof Dr Ir Khaswar Syamsu, MSc selaku pembimbing dalam penyelesaian skripsi ini, serta Ibu Dr. Ir. Ika Amalia Kartika, MT selaku dosen penguji atas saran yang telah diberikan. Penulis juga memberikan penghargaan kepada Ibu Pepi Elvavina dan Ibu Emi Sumiati dari Laboratorium Rekayasa Bioproses, PPSHB-IPB, Ibu Egnawati dan Bapak Gunawan dari Laboratorium DIT, Departemen Teknologi Industri Pertanian, FATETA-IPB, yang telah membantu pelaksanaan penelitian. Ungkapan terima kasih tiada terkira disampaikan kepada Ibunda, Ayahanda, serta seluruh keluarga, Bapak serta Ibu guru, juga segenap rekan-rekan seperjuangan atas segala doa dan motivasinya.
Semoga karya ilmiah ini bermanfaat bagi pengembangan sains dan teknologi di Indonesia. Aamiin.
Bogor, Mei 2013
ix
DAFTAR ISI
ABSTRAK………. ii
HALAMAN PENGESAHAN... vii
PRAKATA………. viii
DAFTAR ISI... ……... ix
DAFTAR TABEL……….. x
DAFTAR GAMBAR………. x
DAFTAR LAMPIRAN……….. x
I. PENDAHULUAN……….. 1
1.1 Latar Belakang……….1
1.2 Tujuan……….. 2
1.3 Ruang Lingkup Penelitian………... 2
II. METODOLOGI PENELITIAN………. 2
2.1 Bahan dan Peralatan……… 2
2.2 Metode Penelitian……… 3
2.2.1 Ekstraksi Pati Singkong... 4
2.2.2 Pembuatan Hidrolisat Pati……….4
2.2.3 Penyiapan Carrier dan Imobilisasi Saccharomyces cerevisiae…… 5
2.2.4 Penyiapan Media dan Fermentasi Repeated-Batch………….5
2.3 Parameter Fermentasi……….. 6
III. HASIL DAN PEMBAHASAN……….. 7
3.1 Ekstraksi Pati dan Pembuatan Hidrolisat Pati………. 7
3.2 Penyiapan Carrier dan Imobilisasi Saccharomyces cerevisiae…………...9
3.3 Fermentasi secara Repeated-Batch……….. 12
IV. PENUTUP……….. 18
4.1 Simpulan……….. 18
4.2 Saran……… 18
DAFTAR PUSTAKA……… 19
x
DAFTAR TABEL
Tabel 1. Hasil analisa proksimat singkong varietas SPP……….. 7
Tabel 2. Hasil ekstraksi pati singkong varietas SPP………. 8
Tabel 3. Efisiensi konversi dan kadar total gula hidrolisat pati singkong... 8
Tabel 4. Perbandingan parameter fermentasi antara sel Saccharomyces cerevisiae terimobilisasi dan free cell………. 18
DAFTAR GAMBAR
Gambar 1. Diagram alir penelitian……… 3Gambar 2. Diagram alir produksi hidrolisat pati singkong………... 4
Gambar 3. Hidrolisat pati singkong varietas SPP………. 9
Gambar 4. Carrier sebelum (a) dan sesudah (b) perlakuan oleh HCl 3%... 10
Gambar 5. Ampas yang mengandung sel terimobilisasi (a) dan Saccharomyces cerevisiae terimobilisasi dengan perbesaran 400x (b)………. 11
Gambar 6. Kadar etanol dan kadar gula sisa pada setiap siklus repeated-batch….. 13
Gambar 7. Produktivitas dan yield etanol pada setiap siklus repeated-batch..……. 14
Gambar 8. Tingkat penggunaan substrat dan efisiensi pada setiap siklus repeated-batch……… 16
DAFTAR LAMPIRAN
Lampiran 1. Prosedur Analisa Parameter Fermentasi………...21Lampiran 2. Hasil Analisa Parameter Fermentasi………. 22
Lampiran 3. Hasil Uji T Kadar Gula Sisa dan Kadar Etanol oleh Program SPSS… 23 Lampiran 4. Hasil Uji T Yield Etanol oleh Program SPSS……… 24
I.
PENDAHULUAN
1.1 Latar Belakang
Krisis energi sedang dialami oleh berbagai negara, termasuk Indonesia. Menurut Prihandana (2007), diperkirakan cadangan minyak bumi Indonesia akan habis pada 2025. Ketersediaan cadangan bahan baku BBM yang demikian tipis berbahaya bagi sektor lain, terutama perekonomian. Kemenristek RI (2006) menyatakan bahwa jika tidak dilakukan upaya-upaya solutif, maka Indonesia akan menjadi net importer minyak mentah dan BBM sebanyak 207.2 juta barel pada 2020, meningkat 1.7 kali dibandingkan tahun 2002. Oleh karena itu, diperlukan solusi untuk menangani permasalahan ketahanan energi tersebut.
Salah satu solusi untuk menangani krisis energi di Indonesia adalah pemanfaatan bioetanol. Bahan tersebut merupakan sumber energi alternatif sebagai pensubstitusi bensin. Bioetanol diproduksi dengan memanfaatkan bahan baku berupa sumber nabati melalui proses fermentasi. Jika dikaitkan dengan industrialisasi, maka diperlukan bahan baku yang memiliki ketersediaan melimpah. Dalam hal ini, singkong merupakan sumber nabati yang potensial untuk digunakan sebagai bahan baku bioetanol. Data dari BPS (2013) memperlihatkan bahwa produksi singkong nasional pada 2012 mencapai 23922075 ton atau meningkat sebesar 9.05% dibandingkan dengan produksi pada 2008 (21756991 ton). Salah satu jenis singkong yang sangat baik untuk bahan baku bioetanol adalah singkong racun. Selain tidak dapat dikonsumsi secara langsung, singkong racun pun memiliki produktivitas lebih tinggi (400 kuintal per hektar dan rendemen pati 30%) dibandingkan varietas lain, seperti varietas Mangi (200 kuintal per hektar dan rendemen pati 37%) dan varietas Betawi (300 kuintal per hektar dan rendemen pati 34.4%) (Rukmana, 1997).
Meskipun singkong memiliki potensi baik sebagai bahan baku bioetanol, namun pemanfaatan sumber nabati tersebut belum optimal, terutama berkaitan dengan ampas. Pada produksi bioetanol menggunakan singkong akan dihasilkan ampas sekitar 11.4% (Tjokroadikoesoemo dalam Purnawati, 2007). Dengan demikian, jika dikaitkan dengan produksi singkong nasional pada tahun 2012 sebanyak 23922075 ton, maka akan dihasilkan ampas sekitar 2727116.5 ton. Oleh karena itu, diperlukan upaya untuk mengoptimalkan pemanfaatan singkong sebagai bahan baku bioetanol, termasuk pemanfaatan ampas.
Telah dikembangkan berbagai metode fermentasi untuk menghasilkan bioetanol. Salah satu metode umum dalam produksi bioetanol adalah fermentasi secara curah yang menghasilkan produktivitas dan efisiensi rendah (Reddy et al.,
2006). Untuk mengatasi hal tersebut, dikembangkan metode repeated-batch guna memaksimalkan produktivitas dan efisiensi dengan menggunakan sel terimobilisasi.
Pacheco et al. (2010) melakukan penelitian perbandingan produktivitas dan efisiensi antara metode curah oleh sel mikroba bebas dan metode repeated-batch oleh sel terimobilisasi. Hasil penelitian tersebut menunjukkan metode
2
mete sebagai carrier. Secara keseluruhan, hasil penelitian tersebut memperlihatkan fermentasi secara repeated-batch oleh sel terimobilisasi pada ampas jambu mete memiliki kestabilan proses yang baik, serta produktivitas dan efisiensi lebih tinggi dibandingkan dengan fermentasi secara curah oleh sel bebas. 1.2 Tujuan
Penelitian ini bertujuan memproduksi bioetanol dari pati singkong racun menggunakan fermentasi secara repeated-batch oleh Saccharomyces cerevisiae
terimobilisasi pada ampas singkong. Secara lebih terperinci, tujuan penelitian ini ialah sebagai berikut.
1. Melakukan imobilisasi Saccharomyces cerevisiae secara adsorpsi dengan menggunakan ampas singkong sebagai carrier.
2. Memproduksi bioetanol secara repeated-batch serta mendapatkan gambaran jumlah siklus fermentasi batch dengan menganalisis parameter kestabilan proses, kadar etanol, produktivitas, yield, persentase konversi gula, serta efisiensi proses.
1.3 Ruang Lingkup Penelitian
Ruang lingkup yang menjadi batasan dalam penelitian ini ialah sebagai berikut.
1. Melakukan karakterisasi singkong racun varietas SPP serta melakukan ekstraksi pati dari singkong tersebut.
2. Memproduksi hidrolisat pati secara enzimatis oleh α-amilase dan amiloglukosidase serta menganalisis efisiensi konversi dan kadar total gula yang dihasilkan.
3. Memberikan perlakuan asam terhadap ampas singkong untuk dijadikan
carrier serta mengimobilisasi Saccharomyces cerevisiae secara adsorpsi oleh
carrier tersebut.
4. Memproduksi bioetanol secara repeated-batch oleh Saccharomyces cerevisiae terimobilisasi pada ampas singkong serta menganalisis parameter fermentasi dari proses produksi bioetanol tersebut.
II.
METODOLOGI PENELITIAN
2.1 Bahan dan Peralatan
3 (Nutrient Agar), NB (Nutrient Broth), glukosa, yeast extract, (NH4)2SO4, KH2PO4, MgSO4•7H2O, ZnSO4, HCl, NaCl, serta methylene blue.
Peralatan yang digunakan di antaranya adalah labu erlenmeyer 500 mL,
rotary shaking incubator, waterbatch shaker, sentrifus, penyaring vakum, oven, neraca analitik, autoklaf, pH-meter, mikropipet, spektrofotometer dan HPLC merk Water 2695 dengan detektor photodiode detector array.
2.2 Metode Penelitian
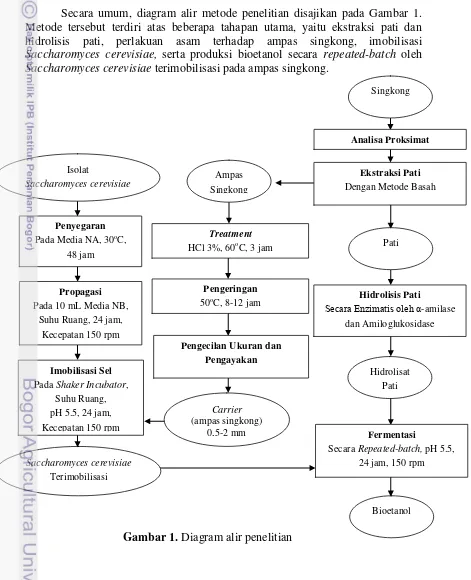
Secara umum, diagram alir metode penelitian disajikan pada Gambar 1. Metode tersebut terdiri atas beberapa tahapan utama, yaitu ekstraksi pati dan hidrolisis pati, perlakuan asam terhadap ampas singkong, imobilisasi
Saccharomyces cerevisiae, serta produksi bioetanol secara repeated-batch oleh
Saccharomyces cerevisiae terimobilisasi pada ampas singkong.
Gambar 1. Diagram alir penelitian
4
2.2.1 Ekstraksi Pati Singkong
Ekstraksi pati dilakukan secara basah. Proses ini diawali dengan analisis proksimat terhadap singkong racun, meliputi kadar air, kadar abu, kadar lemak, kadar protein, kadar serat kasar dan kadar karbohidrat (AOAC, 1995). Kemudian singkong dibersihkan dan diparut disertai penambahan air sebanyak 1:3 (b:v). Singkong hasil pemarutan diperah untuk mengekstrak pati. Penambahan air serta pemerahan dilakukan sebanyak tiga kali pengulangan untuk memaksimalkan ekstraksi pati. Suspensi hasil pemerahan didekantasi selama 14 jam. Pati yang terdekantasi dipisahkan dari cairan. Selanjutnya, pati dan ampas dikeringkan pada suhu 50oC selama 8-12 jam. Pati yang telah kering digiling dan diayak dengan saringan berukuran 150 mesh, sedangkan ampas kering disimpan untuk digunakan sebagai carrier dalam imobilisasi Saccharomyces cerevisiae.
2.2.2 Pembuatan Hidrolisat Pati (Modifikasi Akyuni, 2004)
Suspensi pati 30% (b/v air) digelatinisasi pada 70-80oC. Pati tergelatinisasi dilikuifikasi selama 180 menit menggunakan α-amilase 1.75 U/g pati (1 mL/kg pati) disertai pengadukan secara konstan dan suhu dipertahankan pada 85-95oC. Hasil likuifikasi disakarifikasi selama 48 jam oleh amiloglukosidase 0.3 U/g pati (1 mL/kg pati) pada 60oC dengan pengadukan 150 rpm. Hasil sakarifikasi dipanaskan pada 105oC selama 5 menit dan disaring vakum. Jika telah disaring dan dianalisa kadar total gula, hidrolisat pati dapat digunakan sebagai bahan baku bioetanol. Diagram alir produksi hidrolisat pati disajikan pada Gambar 2.
Gambar 2. Diagram alir produksi hidrolisat pati singkong
(Modifikasi Akyuni, 2004)
180 menit, suhu 85-95oC, pengadukan konstan
Sakarifikasi; Suhu 60oC, 48 jam, 150 rpm
5 2.2.3 Penyiapan Carrier dan Imobilisasi Saccharomyces cerevisiae
(Modifikasi Pacheco et al., 2010)
Penyiapan carrier untuk imobilisasi sel dimulai dengan perendaman ampas singkong dalam larutan HCl 3% (v/v) selama 180 menit pada suhu 60-70oC. Ampas hasil perendaman dicuci dengan air dan dikeringkan pada 50oC selama 8-12 jam. Ampas singkong yang telah kering dikecilkan ukurannya dengan cara digerus hingga berukuran 0.5-2 mm dan disimpan untuk digunakan sebagai
carrier dalam imobilisasi sel.
Imobilisasi Saccharomyces cerevisiae diawali oleh penyiapan kultur dengan penyegaran pada NA steril. Sebanyak 2-3 jarum Ose isolat Saccharomyces cerevisiae diinokulasikan pada agar miring dan diinkubasi pada 30oC selama 48 jam. Hasil penyegaran sebanyak 3 jarum Ose digunakan untuk propagasi pada 10 mL media NB steril dalam labu erlenmeyer yang diinkubasi pada inkubator goyang berkecapatan 150 rpm dan bersuhu ruang selama 24 jam.
Sebanyak 6% (b/v media fermentasi) ampas singkong hasil perlakuan asam disterilisasi pada 121oC selama 15 menit dan dimasukkan ke dalam 100 mL media cair steril yang terdiri atas (g/L): 30 glukosa, 5 yeast extract, 10 (NH4)2SO4, 4.5 KH2PO4, 1 MgSO4•7H2O, dan 0.65 ZnSO4, serta mengandung 10 mL inokulum hasil propagasi. Keseluruhan bahan tersebut dikultivasi selama 24 jam pada suhu ruang dalam inkubator goyang dengan kecepatan 150 rpm. Hasil kultivasi didekantasi untuk memisahkan sel imobil dari cairan kultivasi. Sel terimobilisasi pada ampas singkong tetap dibiarkan dalam labu erlenmeyer dan dicuci dengan 100 mL aquades steril. Dengan demikian, sel imobil telah siap untuk digunakan dalam fermentasi secara repeated-batch.
2.2.4 Penyiapan Media dan Fermentasi Repeated-Batch (Modifikasi Kopsahelis et al., 2007)
Penyiapan media diawali dengan pembuatan hidrolisat pati berkadar total gula 140 g/L disertai penambahan beberapa nutrien berikut (g/L): 2.5 (NH4)2SO4, 0.50 KH2PO4, 0.65 MgSO4•7H2O, dan 0.65 ZnSO4. Selanjutnya, pH diatur menjadi 5.5 dengan penambahan HCl 1N. Sebanyak 100 mL dari larutan tersebut disterilisasi pada 121oC selama 15 menit.
Fermentasi secara repeated-batch diawali dengan memasukkan 100 mL media steril ke dalam labu erlenmeyer 500 mL yang di dalamnya telah terdapat
6
2.3 Parameter Fermentasi (Pacheco et al., 2010)
Perhitungan parameter fermentasi dilakukan berdasarkan data di akhir setiap siklus fermentasi repeated-batch, meliputi kadar gula sisa, kadar etanol, produktivitas, yield, persentase konversi gula, serta efisiensi produksi. Produktivitas volumetrik etanol (Qp; g/L/jam) dihitung sebagai rasio dari konsentrasi etanol pada akhir fermentasi (Pf; g/L) terhadap waktu fermentasi (t; jam). Rumus perhitungan produktivitas volumetrik etanol adalah sebagai berikut.
Qp = Pf (1)
t
Yield etanol untuk setiap penggunaan substrat hidrolisat pati (Yp/s; g etanol/g substrat) dihitung sebagai rasio antara konsentrasi etanol pada akhir fermentasi (Pf) terhadap selisih konsentrasi total gula awal (So; g/L) dan konsentrasi total gula akhir (Sf; g/L). Rumus perhitungan yield etanol adalah sebagai berikut.
Yp/s = Pf (2)
(So-Sf)
Persentase konversi gula (%) dihitung sebagai rasio selisih kadar total gula awal (So; g/L) dan kadar total gula akhir (Sf) terhadap kadar total gula awal (So; g/L). Rumus perhitungan persentase konversi gula adalah sebagai berikut.
Persentase konversi gula = (So-Sf) x 100% (3)
So
Efisiensi konversi substrat menjadi etanol (Ƞ; %) dihitung sebagai rasio
yield etanol (Yp/s; g etanol/g substrat) terhadap yield teoritikal dari Yp/s (Yth; 0.51 g etanol/g substrat). Yield teoritikal diperoleh dengan asumsi hanya gula pereduksi yang digunakan untuk memproduksi etanol berdasarkan persamaan reaksi berikut.
C6H12O6 2C2H5OH + 2CO2
Gula Pereduksi Etanol Karbondioksida (Glukosa atau Fruktosa)
Berdasarkan persamaan reaksi di atas, dapat diketahui bahwa untuk setiap penggunaan 1 gram glukosa atau fruktosa akan dihasilkan 0.51 gram etanol. Dengan asumsi hanya gula pereduksi (glukosa dan fruktosa) yang dikonversi menjadi etanol oleh Saccharomyces cerevisiae, nilai tersebutlah yang menjadi pembanding dalam perhitungan nilai efisiensi. Rumus perhitungan efisiensi konversi substrat menjadi etanol adalah sebagai berikut.
Ƞ = Yp/s x 100% (4)
7 Terhadap berbagai parameter fermentasi dilakukan analisis statistik dengan menggunakan Uji T. Analisis statistik dengan menggunakan Uji T ini bertujuan mengetahui signifikansi perbedaan antar-siklus pada parameter yang dianalisis, sehingga tingkat kestabilan proses pun dapat diketahui. Analisis statistik dilakukan dengan bantuan program SPSS 16.0 (Riduan dan Akdon, 2010).
III.
HASIL DAN PEMBAHASAN
3.1 Ekstraksi Pati dan Pembuatan Hidrolisat Pati
Bagian singkong yang digunakan dalam penelitian ini ialah daging umbi. Dengan memanfaatkan 12.42 kg singkong segar, diperoleh 8.88 kg (71.49%) daging umbi dan 3.54 kg (28.51%) kulit. Hasil ini lebih rendah dibandingkan dengan hasil penelitian Setiawan (2006), yaitu 75.89% daging umbi dan 24.11% kulit. Perbedaan hasil penelitian ini disebabkan oleh perbedaan varietas singkong serta perbedaan teknik pemotongan.
Varietas singkong yang digunakan pada penelitian ini ialah singkong varietas SPP, sedangkan varietas singkong yang digunakan oleh Setiawan (2006) ialah varietas Bogo. Salah satu ciri singkong varietas SPP ialah kondisi kulit yang melekat kuat pada daging umbi. Hal ini mengakibatkan terdapat bagian daging umbi yang terbawa bersama kulit ketika dikupas. Ciri yang berbeda terdapat pada singkong varietas Bogor. Dalam hal ini, kulit umbi singkong varietas Bogo tidak melekat kuat pada daging umbi. Selain itu, jika dianalisis berdasarkan teknik pemotongan yang digunakan, maka dimungkinkan terdapat perbedaan jarak pemotongan antara umbi singkong dengan pangkal akar. Kedua hal tersebutlah yang menjadi faktor atas perbedaan hasil penelitian ini dengan hasil penelitian Setiawan (2006) dalam aspek daging umbi dan kulit singkong yang diperoleh.
Hasil analisa proksimat terhadap bahan baku berupa daging umbi singkong disajikan pada Tabel 1. Berdasarkan tabel tersebut, diketahui bahwa komponen utama yang terdapat dalam bahan baku adalah air dan karbohidrat (masing-masing 64.45% dan 33.30%). Kadar air yang lebih dari 15% ini dapat menyebabkan singkong mudah mengalami kerusakan akibat aktivitas mikroorganisme (Winarno, 1992). Komponen lain, seperti abu, lemak, protein, dan serat kasar berada dalam persentase rendah.
Tabel 1. Hasil analisis proksimat singkong varietas SPP
Parameter Jumlah (%) (b/b) Setiawan (2006) (%) (b/b)
Kadar Karbohidrat*) 33.30 37.77
8
Kadar pati hasil penelitian ini lebih rendah dibandingkan dengan hasil penelitian Setiawan (2006) yang mencapai 37.77%. Selain disebabkan oleh faktor perbedaan varietas singkong dan keikutsertaan serat kasar dalam perhitungan kadar pati, perbedaan hasil ini pun diakibatkan oleh perbedaan usia panen. Singkong varietas SPP yang digunakan pada penelitian ini memiliki usia panen 7 bulan, sedangkan usia panen singkong varietas Bogo yang digunakan pada penelitian Setiawan (2006) ialah 9 bulan. Rukmana (1997) menyampaikan bahwa usia panen yang baik bagi singkong ialah berkisar antara 9-10 bulan. Usia panen yang semakin lama akan semakin meningkatkan kandungan pati dalam umbi singkong.
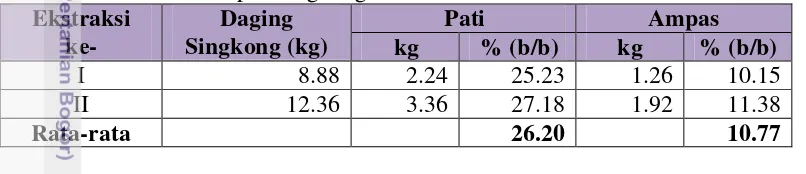
Pati dalam singkong diekstraksi terlebih dahulu sebelum dihidrolisis. Hasil ekstraksi disajikan pada Tabel 2. Berdasarkan tabel tersebut, diketahui bahwa rendemen pati yang dihasilkan sebanyak 26.20% (b/b). Nilai ini lebih rendah dari hasil penelitian Setiawan (2006), yaitu 28.67% (b/b). Selain disebabkan oleh perbedaan varietas dan usia panen, perbedaan rendemen juga dimungkinkan akibat perbedaan teknik ekstraksi, terutama pada tahap pemerahan. Pemerahan pada penelitian ini dilakukan sebanyak 3 kali pengulangan yang disertai penambahan air. Jika pengulangan semakin banyak, maka jumlah pati yang diperoleh pun akan semakin banyak.
Tabel 2. Hasil ekstraksi pati singkong varietas SPP Ekstraksi α-amilase dan amiloglukosidase sebelum digunakan sebagai bahan baku bioetanol. Hasil hidrolisis disajikan pada Tabel 3.
Tabel 3. Efisiensi konversi dan kadar total gula hidrolisat pati singkong Ulangan Berat
9 efisensi konversi hasil penelitian ini lebih rendah dibandingkan dengan hasil Aremu et al. (2010) juga disebabkan oleh lama sakarifikasi. Aremu et al. (2010) melakukan sakarifikasi selama 72 jam, sedangkan penelitian ini melakukan sakarifikasi selama 48 jam. Peningkatan lama proses sakarifikasi berbanding lurus dengan peningkatan konsentrasi total gula pada hidrolisat yang dihasilkan, sehingga nilai efisiensi konversi pun menjadi semakin tinggi. Hidrolisat pati hasil penelitian ini disajikan pada Gambar 3.
Berdasarkan Gambar 3, dapat diketahui bahwa hidrolisat hasil penelitian ini memiliki warna coklat-bening. Karakter fisik lain dari hidrolisat tersebut ialah berwujud cair viscous. Hidrolisat pati inilah yang digunakan sebagai bahan utama dalam fermentasi secara repeated-batch untuk menghasilkan bioetanol.
3.2 Penyiapan Carrier dan Imobilisasi Sachharomyces cerevisiae
Carrier yang digunakan untuk imobilisasi Saccharomyces cerevisiae
adalah ampas singkong hasil perlakuan oleh HCl 3%. Penggunaan larutan asam (HCl 3%) terhadap carrier tersebut didasarkan pada kandungan pati dalam ampas singkong yang mencapai 34.75% (Atika dan Apsari, 2012). Keberadaan pati akan mempersulit adsorpsi sel ke dalam pori-pori ampas saat imobilisasi
Saccharomyces cerevisiae. Pati tersebut akan menghalangi gaya elektrostatik antara selulosa pada ampas singkong dengan gugus amina pada membran sel.
Selain itu, keberadaan pati dalam ampas akan mempersulit proses masuknya media kultivasi ataupun fermentasi ke dalam pori-pori carrier tersebut. Oleh karena itu, HCl 3% digunakan sebagai penghidrolisis pati dalam ampas singkong. Proses hidrolisis oleh HCl berlangsung melalui reaksi berikut.
HCl
(C6H10O5)n + nH2O n(C6H12O6) Pati Air Glukosa
Carrier ampas singkong sebelum dan sesudah perlakuan oleh HCl 3% disajikan pada Gambar 4. Karakter fisik dari ampas singkong sebelum diberi perlakuan oleh HCl 3% adalah berwujud gumpalan padat dengan bentuk tidak beraturan, bersifat rapuh (fragile), serta berwarna putih. Setelah diberi perlakuan oleh HCl 3%, karakter fisik ampas singkong pun menjadi berwujud gumpalan
10
padat dengan bentuk pipih, bersifat padat tidak rapuh, serta berwarna putih-kecoklatan.
Teknik imobilisasi yang digunakan dalam penelitian ini ialah adsoprsi oleh material organik (ampas singkong). Secara umum, Shuler dan Kargi (2002) menyampaikan bahwa terdapat tiga teknik utama dalam mengimobilisasi sel, yaitu adsorpsi, penjeraban (entrapment), serta covalent binding. Teknik imobilisasi secara adsorpsi merupakan pelekatan sel pada permukaan carrier dengan memanfaatkan gaya kimia-fisik, seperti gaya Van der Waals, gaya akibat perbedaan muatan pada dua atau lebih gugus kimia, serta gaya dispersi. Syarat utama dari teknik ini adalah carrier yang digunakan harus bersifat tidak larut dalam air. Material tersebut dapat berupa bahan organik, inorganik ataupun resin ion-exchange (Dowex, Amberlite, atau Shepadex).
Teknik penjeraban (entrapment) merupakan pengurungan sel secara fisik dalam matriks atau membran tertentu. Teknik imobilisasi ini merupakan metode yang paling umum digunakan pada beberapa skala fermentasi. Secara lebih spesifik, beberapa jenis teknik imobilisasi sel yang tergolong dalam entrapment di antaranya ialah penjeraban dalam matrik, dalam mikroenkapsulasi, serta penjeraban antara membran enkapsulasi. Meskipun cukup umum digunakan, Ariyajaroenwong et al. (2012) menyampaikan bahwa fermentasi oleh sel terimobilisasi secara entrapment (terutama pada Ca-alginat) memiliki beberapa kelemahan, yaitu terdapat pembatasan difusi (diffusion limitation) bagi substrat dan nutrien lain ke dalam bead, terdapat pengurangan peran sisi aktif sel dalam mengonversi substrat menjadi etanol, kerusakan pertikel bead akibat respirasi sel yang menghasilkan CO2, kestabilan fisik dan kimia yang lemah dari alginat, serta harga carrier yang cukup mahal.
Teknik lainnya yaitu imobilisasi dengan memanfaatkan ikatan kovalen. Teknik ini merupakan penempatan sel pada permukaan carrier melalui pembentukan ikatan kovalen. Grup fungsional yang terdapat pada permukaan membran sel akan berikatan dengan carrier melalui gugus spesifik, seperti gugus amino, karboksil, hidroksil, ataupun gugus sulfihidril. Sedangkan grup fungsional pada carrier sebagian besar diaktivasi oleh suatu reagen kimia, seperti cyanogens bromide, carbodiimide dan glutaraldehyde. Secara lebih spesifik, beberapa jenis
(a) (b)
11 imobilisasi yang tergolong dalam teknik ikatan kovalen di antaranya ialah ikatan kovalen terhadap carrier dan ikatan kovalen terhadap permukaan sel lain.
Dalam penelitian ini, sel Saccharomyces cerevisiae diimobilisasi ke dalam pori-pori ampas singkong yang berperan sebagai carrier. Selain akibat gaya elektrostatik antara selulosa pada carrier dengan gugus amina pada membran sel, adsorpsi pun berlangsung akibat keberadaan media kultivasi dalam pori-pori ampas singkong. Kondisi ini akan mengarahkan Saccharomyces cerevisiae
memasuki pori-pori untuk mengonsumsi media. Media inilah yang berperan sebagai pengikat antara carrier dan Saccharomyces cerevisiae.
Imobilisasi Saccharomyces cerevisiae pada ampas singkong dengan komponen terbanyak berupa selulosa merupakan teknik imobilisasi yang relatif baru. Menurut de Vasconcelos et al. (2004), teknik imobilisasi pada serat selulosa yang berasal dari bahan alami memiliki beberapa kelebihan, yaitu pertumbuhan sel dapat berlangsung lebih cepat yang ditunjukan oleh doubling time lebih singkat, akses yang lebih mudah terhadap substrat, dan harga bahan carrier yang murah serta ketersediaannya melimpah. Selain itu, fermentasi untuk menghasilkan bioetanol oleh sel terimobilisasi pada serat selulosa cenderung memiliki produktivitas dan efisiensi yang lebih baik dibandingkan dengan oleh sel terimobilisasi pada Ca-alginat.
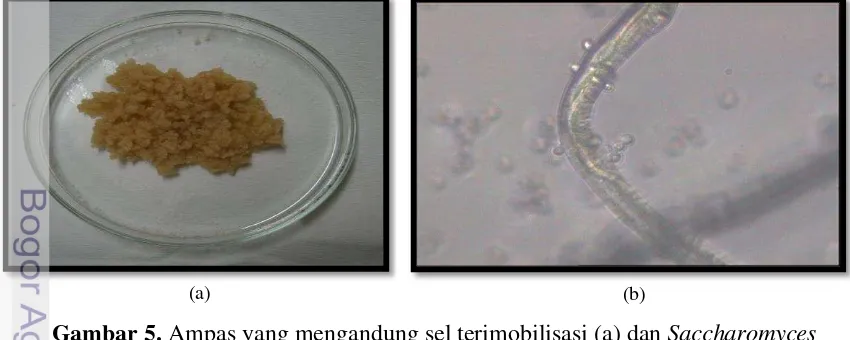
Proses imobilisasi dalam penelitian ini dilakukan bersamaan dengan kultivasi Saccharomyces cerevisia pada kondisi aerobik selama 24 jam. Kondisi aerobik bertujuan agar substrat digunakan oleh Saccharomyces cerevisiae untuk pertumbuhan sel. Shuler dan Kargi (2002) menyatakan bahwa kultivasi dalam kondisi aerobik mengakibatkan media dimanfaatkan oleh Saccharomyces cerevisiae untuk proses pertumbuhan. Jika kultivasi dilakukan dalam kondisi anerobik, maka media akan digunakan untuk menghasilkan etanol. Ampas yang mengandung sel terimobilisasi dan Saccharomyces cerevisiae terimobilisasi disajikan pada Gambar 5.
Jumlah Saccharomyces cerevisiae terimobilisasi pada akhir kultivasi mencapai 1.76x1011 sel per gram carrier. Jumlah sel inilah yang menjadi total sel awal dalam fermentasi secara repeated-batch. Jika dibandingkan dengan penelitian lain, maka jumlah sel terimobilisasi pada penelitian ini lebih banyak Gambar 5. Ampas yang mengandung sel terimobilisasi (a) dan Saccharomyces cerevisiae terimobilisasi dengan perbesaran 400x (b)
12
dibandingkan dengan hasil penelitian lain, yaitu Kopsahelis et al. (2007) dengan jumlah sel terimobilisasi sekitar 109 sel per gram carrier. Hal ini disebabkan oleh perbedaan kondisi proses dan jenis carrier. Kopsahelis et al. (2007) mengimobilisasi Saccharomyces cerevisiae dari ragi roti pada volume kerja 800 mL dengan menggunakan ampas gandum sebagai carrier, sedangkan penelitian ini mengimobilisasi Saccharomyces cerevisiae yang ditumbuhkan dari isolat murni pada volume kerja 100 mL dengan menggunakan ampas singkong sebagai carrier.
3.3 Fermentasi secara Repeated-Batch
Fermentasi pada penelitian ini dilakukan secara repeated-batch sebanyak 6 siklus. Kopsahelis et al. (2007) melakukan penelitian produksi bioetanol secara
repeated-batch oleh Saccharomyces cerevisiae terimobilisasi pada ampas gandum. Penelitian tersebut memperlihatkan bahwa jumlah siklus batch yang dapat dicapai ialah 6 kali. Hasil tersebut menjadi dasar penentuan jumlah siklus yang digunakan dalam penelitian ini.
Pada dasarnya, mekanisme konversi glukosa menjadi etanol dalam fermentasi secara repeated-batch ini terdiri atas dua tahapan utama, yaitu pembentukan piruvat dan pembentukan etanol dari piruvat tersebut. Pembentukan piruvat berlangsung melalui jalur glikolisis yang merupakan rangkaian reaksi-reaksi fosforilasi dan defosforilasi. Senyawa yang berperan sebagai donor dan akseptor fosfat dalam jalur glikolisis ialah ATP dan ADP (Didu, 2010). Secara keseluruhan, reaksi yang berlangsung dalam jalur glikolisis ialah sebagai berikut.
C6H12O6 + 2ADP + 2NAD+ + 2Pi 2priuvat + 2ATP + 2(NADH+H+) Gulkosa Adenosin Fosfat Adenosin
difosfat inorganik trifosfat
Dalam tahapan selanjutnya, piruvat yang telah dihasilkan dari jalur glikolisis diubah menjadi asetaldehid oleh enzim piruvat dekarboksilase disertai pelepasan CO2. Reaksi terakhir ialah konversi asetaldehid menjadi etanol oleh enzim alkohol dehidrogenase. Secara keseluruhan, reaksi yang berlangsung dalam proses konversi piruvat menjadi etanol ialah sebagai berikut.
gula-13 gula lain, salah satunya ialah sukrosa. Dalam hal ini, sukrosa pun dapat dikonversi menjadi etanol oleh Saccharomyces cerevisiae melalui dua tahap utama. Tahap pertama adalah pemecahan sukrosa menjadi glukosa dan fruktosa, sedangkan tahap kedua adalah konversi glukosa ataupun fruktosa menjadi etanol (Ageng, 2009). Secara umum, reaksi konversi sukrosa menjadi etanol adalah sebagai berikut.
C12H22O11 + H2O C6H12O6 + C6H12O6
Sukrosa Air Glukosa Fruktosa
C6H12O6 2C2H5OH + 2CO2 + Kalor Glukosa Etanol Karbondioksida
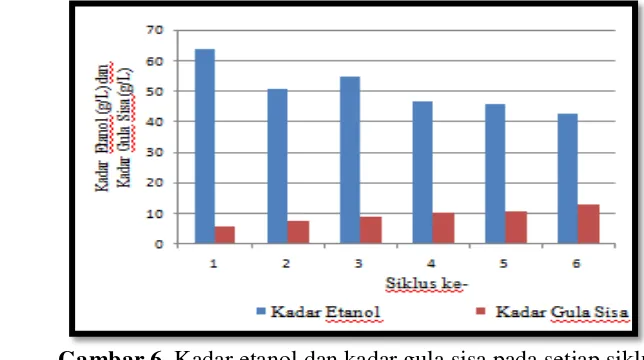
Kadar etanol hasil penelitian ini adalah 42.72-63.66 g/L. Hasil analisa terhadap kondisi setiap siklus menunjukkan telah terjadi penurunan kadar etanol dan peningkatan kadar gula sisa seiring dengan peningkatan jumlah siklus. Kadar etanol tertinggi dihasilkan pada siklus pertama, yaitu 63.66 g/L dan pada siklus yang sama kadar gula sisa berada pada konsentrasi terendah (5.96 g/L). Kadar etanol terendah dihasilkan pada siklus terakhir, yaitu 42.72 g/L dan pada siklus yang sama kadar gula sisa berada pada konsentrasi tertinggi (12.88 g/L). Penurunan kadar etanol bersamaan dengan peningkatan kadar gula sisa ini disebabkan oleh sel perlu beradaptasi terhadap lingkungan baru. Adaptasi berlangsung sebagai konsekuensi dari media fermentasi yang berbeda dengan media imobilisasi. Selain itu, adaptasi pun berlangsung disebabkan oleh kondisi imobilisasi sel dalam keadaan aerobik, sedangkan fermentasi dalam keadaan anerobik. Gambar 6 menyajikan kadar etanol dan kadar gula sisa hasil penelitian ini (data lengkap disajikan pada Lampiran 2.a).
Untuk mengetahui perbedaan antara satu siklus dengan siklus berikutnya, dilakukan analisa statistika menggunakan Uji T dengan nilai α=0.05 (Riduan dan Akdon, 2010). Hasil Uji T tersebut (disajikan pada Lampiran 3) memperlihatkan bahwa terdapat perbedaan secara signifikan antara kadar etanol dan kadar gula sisa pada siklus pertama dengan siklus kedua, sedangkan antara siklus kedua dan
Gambar 6. Kadar etanol dan kadar gula sisa pada setiap siklus
14
siklus-siklus selanjutnya tidak terdapat perbedaan yang signifikan. Perbedaan signifikan antara siklus pertama dan kedua memperlihatkan bahwa proses berlangsung tidak stabil yang ditunjukkan dengan penurunan kadar etanol cukup tinggi (selisih 12.92 g/L atau turun sebesar 20.28%). Penurunan produksi kadar etanol ini disebabkan oleh sel perlu beradaptasi terhadap media dan kondisi proses yang berbeda dari media dan kondisi saat imobilisasi sel. Media kultivasi yang digunakan saat imobilisasi ialah media sintetik serta dilangsungkan dalam kondisi aerobik, sedangkan media saat fermentasi ialah hidrolisat pati singkong serta dilangsungkan dalam kondisi anaerobik.
Hasil Uji T menunjukkan bahwa fermentasi secara repeated-batch
berlangsung stabil pada siklus kedua hingga siklus terakhir. Kondisi tersebut sesuai dengan target dari fermentasi secara repeated-batch, yaitu diharapkan proses pada setiap siklus berlangung stabil (Pacheco et al., 2010). Dengan demikian, hasil penelitian ini mengindikasikan bahwa ampas singkong cocok dan baik untuk digunakan sebagai carrier pada imobilisasi sel Saccharomyces cerevisiae.
Kadar etanol hasil penelitian ini (42.72-63.66 g/L) lebih tinggi dibandingkan dengan hasil penelitian lain, yaitu 19.82-37.83 g/L (Pacheco et al.,
2010), 40.92-51.67 g/L (Kopsahelis et al., 2007), dan 51.30 g/L (Plessas et al.,
2007). Kadar etanol hasil penelitian ini lebih tinggi disebabkan oleh kemampuan ampas singkong yang lebih banyak mengimobilisasi sel dibandingkan dengan jenis carrier lain, seperti ampas jambu mete (Pacheco et al., 2010), ampas gandum (Kopsahelis et al., 2007), dan kulit jeruk (Plessas et al., 2007). Kadar etanol hasil penelitian ini lebih tinggi juga dipengaruhi oleh perbedaan kadar total gula awal, kondisi pH awal, serta jumlah total sel awal. Berbagai faktor tersebut dibahas secara lebih spesifik bersamaan dengan pembahasan pada parameter-parameter selanjutnya. Parameter lain berupa produktivitas dan yield hasil penelitian ini disajikan pada Gambar 7 (data lengkap disajikan pada Lampiran 2.2).
Produktivitas merupakan perbandingan antara kadar etanol yang dihasilkan terhadap lama fermentasi (Pacheco et al., 2010). Hal ini berarti bahwa terdapat dua faktor utama yang mempengaruhi produktivitas fermentasi, yaitu
Gambar 7. Produktivitas dan yield etanol pada setiap siklus
15 lama fermentasi dan kadar etanol. Dengan lama fermentasi yang sama (24 jam), semakin tinggi kadar etanol yang dihasilkan, produktivitas pun akan semakin tinggi. Produktivitas etanol hasil penelitian ini adalah sebesar 1.78-2.66 g/L/jam. Lama fermentasi yang relatif sama pun digunakan oleh Kopsahelis et al. (2007) yang menghasilkan produktivitas fermentasi lebih rendah, yaitu 1.52-2.00 g/L/jam. Perbedaan produktivitas ini disebabkan oleh beberapa faktor, yaitu jenis
carrier, kondisi proses, dan nilai pH awal.
Nilai pH awal pada penelitian ini adalah 5.5, sedangkan Kopsahelis et al.
(2007) menggunakan pH awal 7-7.5. Casida seperti disitir oleh Supatmawati (2010) menyatakan bahwa pH optimal bagi aktivitas Saccharomyces cerevisiae
adalah 3-6. Dengan demikian, penelitian ini menggunakan pH awal dalam kisaran optimal, sedangkan penelitian Kopsahelis et al. (2007) di luar kisaran pH optimal. Hal tersebutlah yang menyebabkan produktivitas pada penelitian ini lebih tinggi dibandingkan dengan penelitian Kopsahelis et al. (2007). Meskipun demikian, produktivitas hasil penelitian ini lebih rendah dari penelitian Plessas et al. (2007), yaitu 5.13 g/L/jam. Perbedaan produktivitas ini disebabkan oleh perbedaan kadar total gula awal dan jumlah total sel awal. Kadar total gula awal pada penelitian ini ialah 140 g/L dengan jumlah total sel awal sebanyak 1.76x1011 sel per gram
carrier, sedangkan kadar total gula awal pada penelitian Plessas et al. (2007) adalah 125 g/L dengan jumlah total sel awal 1013 sel per gram carrier. Kondisi total gula awal lebih rendah serta jumlah total sel awal lebih tinggi menyebabkan konversi gula menjadi etanol berlangsung lebih cepat, sehingga produktivitas pun lebih tinggi.
Yield merupakan perbandingan jumlah etanol yang dihasilkan terhadap jumlah substrat yang digunakan (Pacheco et al., 2010). Dengan demikian, selain faktor jumlah etanol yang dihasilkan, parameter yield pun dipengaruhi oleh jumlah substrat yang dimanfaatkan oleh Saccharomyces cerevisiae. Pemanfaatan substrat dalam jumlah lebih banyak tidak secara pasti akan menghasilkan yield
dalam jumlah yang lebih tinggi. Kondisi ini dikarenakan substrat tidak hanya dikonversi menjadi etanol oleh Saccharomyces cerevisiae, melainkan juga dimanfaatkan untuk pertumbuhan dan pemenuhan energi bagi sel-sel tersebut.
Yield etanol yang dihasilkan dalam penelitian ini adalah 0.33-0.47 g etanol/g substrat. Nilai yield ini menunjukkan bahwa dihasilkan etanol sekitar 0.33-0.47 gram untuk setiap penggunaan 1 gram hidrolisat pati oleh Saccharomyces cerevisiae.
Untuk mengetahui kestabilan proses selama fermentasi, dilakukan analisa statistik guna mengevaluasi signifikansi perbedaan nilai yield antara satu siklus dengan siklus-siklus berikutnya. Analisa statistik yield dilakukan secara terpisah dari analisa statistik kadar etanol disebabkan oleh perbedaan faktor yang mempengaruhi kedua parameter tersebut. Dalam perhitungan parameter yield
dilakukan perbandingan terhadap jumlah hidrolisat pati yang dikonsumsi sel, sedangkan dalam perhitungan kadar etanol tidak dilakukan perbandingan serupa.
Hasil Uji T dengan nilai α=0.05 memperlihatkan bahwa terdapat perbedaan signifikan antara yield etanol pada siklus pertama dengan siklus kedua, sedangkan pada siklus-siklus selanjutnya tidak terdapat perbedaan signifikan (data lengkap pada Lampiran 3). Hal ini berarti bahwa terdapat perbedaan nyata antara
16
siklus kedua disebabkan oleh kondisi lingkungan dan proses fermentasi. Fermentasi pada siklus pertama dilakukan oleh Sacchaaromyces cerevisiae hasil kultivasi saat imobilisasi secara aerobik menggunakan media sintetik. Akan tetapi, proses fermentasi secara repeated-batch dilakukan secara anaerobik dalam media berupa hidrolisat pati. Dengan demikian, siklus pertama digunakan oleh
Saccharomyces cerevisiae untuk beradaptasi, sehingga pada siklus-siklus berikutnya kinerja sel terimobilisasi tersebut menjadi stabil.
Yield etanol hasil penelitian ini lebih besar dibandingkan dengan penelitian
lain, yaitu 0.27-0.33 g etanol/g substrat (Kopsahelis et al., 2007) dan 0.34 g etanol/g substrat (Plessas et al., 2007). Hal ini disebabkan oleh perbedaan
total sel awal dan lama fermentasi. Yield hasil penelitian Kopsahelis et al. (2007) lebih rendah disebabkan oleh total sel awal sebanyak 109 sel per gram carrier, sedangkan total sel awal pada penelitian ini ialah 1.76x1011 sel per gram carrier.
Dengan total gula awal dan lama fermentasi setiap siklus yang relatif sama, biokatalis yang lebih banyak menyebabkan substrat yang terkonversi menjadi etanol pun lebih banyak, sehingga yield pun semakin meningkat. Hasil penelitian Plessas et al. (2007) lebih rendah disebabkan oleh lama fermentasi lebih singkat, yaitu 10 jam, sedangkan lama fermentasi pada penelitian ini adalah 24 jam. Semakin singkat proses fermentasi, maka waktu yang dimiliki Saccharomyces cerevisiae untuk mengonversi substrat menjadi etanol pun semakin sedikit. Parameter lain berupa persentase konversi gula dan efisiensi, disajikan pada Gambar 8 (data lengkap pada Lampiran 2.2).
Pacheco et al. (2010) menyampaikan bahwa persentase konversi gula merupakan perbandingan jumlah gula yang dikonversi terhadap jumlah total gula awal. Dalam hal ini, parameter persentase konversi gula tidak hanya mencakup penggunaan hidrolisat untuk menghasilkan etanol, melainkan juga untuk pertumbuhan dan untuk pemenuhan kebutuhan energi sel-sel Saccharomyces cerevisiae. Persentase konversi gula dalam penelitian ini ialah 90.80-95.74%. Hasil ini menunjukkan bahwa dengan kadar total gula awal sebesar 140 g/L, jumlah gula yang dimanfaatkan oleh Saccharomyces cerevisiae selama fermentasi berkisar antara 127.12-134.04 g/L. Hasil ini tergolong cukup tinggi serta tidak jauh berbeda dengan hasil penelitian lain, yaitu 95.30% (Kopsahelis et al., 2007) dan 96.80% (Plessas et al., 2007). Tingginya persentase konversi gula ini
17 menunjukkan bahwa Saccharomyces cerevisiae terimobilisasi pada ampas singkong memiliki kemampuan baik dalam memanfaatkan substrat.
Berdasarkan persamaan Gay-Lussac, secara teroritis dari setiap penggunaan 1 gram glukosa akan dihasilkan 0.51 gram etanol. Hasil etanol teoritis tersebut dijadikan faktor pembanding dalam penentuan efisiensi produksi. Dalam hal ini, efisiensi merupakan pembandingan jumlah etanol yang dihasilkan terhadap faktor pembanding berupa kadar etanol teoritis (Pacheco et al., 2010). Perhitungan efisiensi ini dilakukan dengan asumsi hanya gula pereduksi yang dikonversi menjadi etanol oleh Saccharomyces cerevisiae terimobilisasai pada ampas singkong. Persamaan Gay-Lussac yang dimaksud ialah sebagai berikut.
C6H12O6 2C2H5OH + 2CO2 + Kalor
1 mol glukosa 2 mol etanol 2 mol karbokdioksida =180 gram glukosa =92 gram etanol
Secara prinsip, nilai efisiensi menunjukkan kemampuan Saccharomyces cerevisiae untuk mengubah hidrolisat yang dikonsumsi menjadi etanol. Semakin tinggi nilai efisiensi, jumlah etanol yang dihasilkan berdasarkan substrat yang dikonsumsi pun semakin tinggi. Nilai efisiensi yang dihasilkan dalam penelitian ini ialah 65.91-93.13%. Dengan demikian, akan dihasilkan 92.27-130.38 gram etanol untuk setiap 140 gram hidrolisat pati yang dikonsumsi oleh Saccharomyces cerevisiae.
Jika dilakukan analisis terhadap setiap siklus, telah terjadi penurunan efisiensi dari siklus fermentasi pertama ke siklus fermentasi kedua (selisih 16.76%). Penurunan ini dimungkinkan akibat proses adaptasi disebabkan oleh fermentasi dalam kondisi anaerobik. Kondisi tersebut mengakibatkan terjadi penurunan jumlah sel hidup yang dalam keadaan sama sel-sel tersebut juga melakukan adaptasi. Kondisi Saccharomyces cerevisiae yang telah mampu beradaptasi saat memasuki siklus kedua menjadi faktor kestabilan proses dari siklus tersebut hingga siklus terakhir.
Nilai efisiensi sebesar 65.91-93.13% yang dihasilkan pada penelitian ini lebih besar dibandingkan dengan nilai efisiensi hasil penelitian lain, yaitu 52.29-65.15% (Kopsahelis et al., 2007) dan 66.18% (Plessas et al., 2007). Nilai efisiensi hasil penelitian ini lebih besar disebabkan oleh faktor yang sama sebagaimana terjadi pada yield etanol.
Untuk melihat kelebihan fermentasi oleh Saccharomyces cerevisiae
terimobilisasi pada ampas singkong dari fermentasi oleh Saccharomyces cerevisiae bebas, diperlukan perbandingan antara kedua jenis fermentasi tersebut. Hal ini akan menjadi dasar guna mengetahui kemampuan ampas singkong sebagai
18
Tabel 4. Perbandingan parameter fermentasi antara sel Saccharomyces cerevisiae terimobilisasi dan sel bebas Media Fermentasi Hidrolisat Pati Singkong Hidrolisat Pati Singkong
Lama fermentasi (jam) 24 64
Kadar total gula awal (g/L) 140.00 40.00
Kadar gula akhir (g/L) 6.00-12.80 1.15
Kadar etanol (g/L) 42.46-64.01 34.07
Produktivitas (g/L/jam) 1.77-2.67 0.53
Tingkat konversi (%) 90.86-95.72 97.12
Data pada tabel 4 memperlihatkan bahwa produksi bioetanol oleh
Saccharomyces cerevisiae terimobilisasi pada ampas singkong lebih baik dari produksi bioetanol oleh Saccharomyces cerevisiae bebas. Hal ini berdasarkan waktu fermentasi lebih singkat serta kadar total gula awal, kadar etanol yang dihasilkan dan produktivitas yang lebih tinggi.
IV.
PENUTUP
4.1 Simpulan
Pemanfaatan pati singkong racun varietas SPP memiliki potensi yang baik untuk digunakan sebagai bahan baku bioetanol berdasarkan kadar patinya yang mencapai 33.30% (b/b). Rendemen pati yang dihasilkan pada penelitian ini adalah 26.20% (b/b) dan efisiensi konversi pati menjadi hidrolisat sebesar 36.89% (b/b). Ampas singkong hasil perlakuan oleh HCl 3% (v/v) dengan ukuran 0.5-2 mm mampu mengimobilisasi Saccharomyces cerevisiae sebanyak 1.76x1011 sel per gram ampas. Imobilisasi tersebut dipengaruhi oleh dua faktor, yaitu gaya adsorpsi dari pori-pori ampas singkong dan media yang terdapat dalam pori-pori tersebut.
Fermentasi secara repeated-batch oleh Saccharomyces cerevisiae
terimobilisasi pada ampas singkong dengan pengulangan 6 siklus serta kadar total gula awal sebesar 140 g/L telah menghasilkan etanol berkadar 42.72-63.66 g/L, produktivitas 1.78-2.64 g/L/jam, yield 0.33-0.47 g etanol/g substrat, persentase konversi gula sebesar 90.80-95.74%, serta efisiensi sebesar 65.91-93.13%. Hasil ini mengindikasikan bahwa fermentasi secara repeated-batch oleh Saccharomyces cerevisiae terimobilisasi pada ampas singkong memiliki kestabilan proses yang baik, serta produktivitas, persentase konversi gula dan efisiensi proses yang tinggi.
4.2 Saran
19 1. Untuk meningkatkan efisiensi konversi pati menjadi gula, diperlukan pengondisian nilai pH 4-4.5 serta waktu proses yang lebih lama saat sakarifikasi dalam menghidrolisis pati singkong varietas SPP.
2. Perlu dilakukan penelitian optimasi nisbah jumlah carrier dan kadar total gula awal terbaik berdasarkan jumlah sel terimobilisasi, kadar etanol, produktivitas, serta efisiensi.
3. Perlu dikaji lebih lanjut fermentasi secara repeated-batch lebih dari 6 kali siklus untuk mengetahui tingkat kestabilan maksimum ampas singkong sebagai carrier pada imobilisasi secara adsorpsi.
DAFTAR PUSTAKA
Ageng, D.S. 2009. Profil Fermentasi Sukrosa Menjadi Etanol Menggunakan Zymomonas mobilis yang Dikoamobilkan dengan Ekstrak Invertase. [Skripsi]. Surabaya (ID): Jurusan Kimia, Fakultas MIPA, ITS.
Akyuni, D. 2004. Pemanfaatan Pati Sagu (Metroxylon sp.) untuk Pembuatan Sirup Glukosa Menggunakan α-Amilase dan Amiloglukosidase. [Skripsi]. Bogor (ID): Fakultas Teknologi Pertanian, IPB.
Apriyantono A, Fardiaz, D., Puspitasari N.L., Sedarnawati dan Budiyanto S. 1989. Analisa Pangan. Bogor (ID): IPB Press.
Aremu, M.O., Layokun, S.K., dan Solomon, B.O. 2010. Production of Poly ( 3-hydroxybutyrate) from Cassava Starch Hydrolysate by Pseudomonas aeruginosa NCIB 950. American Journal of Science and Industrial Research 1 (3): 421-426.
Ariyajaroenwong, p., Laopaiboon, P., Jaisil, P. dan Laopaiboon, L. 2012.
Repeated-batch Ethanol Production from Sweet Sorghum Juice by Saccharomyces cerevisiae Immobilized on Sweet Sorgum Stalks. Energies Vol 5: 1215-1228.
Atika, R.D. dan Apsari, A.D. 2012. Pengaruh Konsentrasi Asam Sulfat pada Hidrolisa Asam dalam Pembuatan Etanol dari Onggok (Limbah Padat Tepung Tapioka). [laporan penelitian]. Surabaya (ID): Departemen Teknik Kimia, ITS.
[BPS] Badan Pusat Statistik. 2013. Produksi Singkong Nasional 2008-2012. Jakarta (ID): Badan Pusat Statistik RI.
de Vasconcelos, J.N., Lopes, C.E. dan de Franca, F.P. 2004. Contonuous Ethanol Production Using Yeast Immobilized on Sugar-cane Stalks. Brazilian Journal of Chemical Engineering, Vol. 21 (03): 357-365.
Didu, N. 2010. Produksi Bioetanol dari Sirup Glukosa Ubi Jalar (Ipomea batatas
L.) secara Fed-Batch dengan Menggunakan Saccharomyces cerevisiae.
20
[Kemenristek] Kementerian Riset dan Teknologi RI. 2006. Penelitian, Pengembangan dan Penerapan Ilmu Pengetahuan dan Teknologi Bidang Sumber Energi Baru dan Terbarukan untuk Mendukung Keamanan Ketersediaan Energi Tahun 2025. Jakarta (ID): Kemenristek RI.
Kopsahelis, N., Nikolas, A., Bekatorou, A., dan Kanellaki, M. 2007. Comparative Study of Spent Grains and Delignified Spent Grains as Yeast Support for Alcoholic Production from Molasses. Bioresource Technology (98): 1440-1447.
Nadir, N., Mel, M., Karim, M.I.A., dan Yunus, R.M. 2009. Comparison of Sweet Sorghum and Cassava for Ethanol Production by Using Saccharomyces cerevisiae. Journal of Applied Science 9 (17): 3068-3073.
Pacheco, A.M., Gondim, D.R., Goncalves, L.R.B. 2010. Ethanol Production by Fermentation Using Immobilized Cells of Saccharomyces cerevisiae in Cashew Apple Bagasse. Appl Biochemistry and Biotechnology (161): 209-217.
Plessas, S., Bekatorou, A., Koutinas, A.A., Soupioni, M., Banat, I.M., dan Marchant. 2007. Use of Saccharomyces cerevisiae Cells Immobilized on Orange Peel as Biocatalyst for Alcoholic Fermentation. Bioresource Technology (98): 860-865.
Prihandana, R. 2007. Bioetanol Ubi kayu Bahan Bakar Masa Depan. Jakarta (ID): Agromedia.
Purnawati, R. 2007. Pengembangan Produksi Bioinsektisida oleh Bacillus thuringiensis subsp. israelensis secara Curah Menggunakan Substrat Onggok. Bogor (ID): Sekolah Pascasarjana, IPB.
Reddy, L.V.A., Reddy, Y.H.K., dan Reddy, O.V.S. 2006. Wine Production by Guava Pieces Immobilized Yeast from Indian Cultivar Grapes and Its Volatile Composition. Biotechnology 5 (4): 449-454.
Riduan dan Kadon. 2010. Rumus dan Data dalam Aplikasi Statistika. Bandung
Setiawan, W.M. 2006. Produksi Hidrolisat Pati dan Serat Pangan dari Singkong Melalui Hidrolisis dengan menggunakan α-Amilase dan Asam Klorida. [skripsi]. Bogor (ID): Departemen TIN, IPB.
Supatmawati. 2010. Rekayasa Bioproses Produksi Bioetanol dari Hidrolisat Pati Sagu (Metroxylon sp) Menggunakan Saccharomyces cerevisiae var.ellipsoides pada Kultivasi Nir-sinambung dan Semi Sinambung. [tesis]. Bogor (ID): Sekolah Pascasarjana, IPB.
21 Lampiran 1. Prosedur Analisa Parameter Fermentasi
1. Jumlah Total Sel (Modifikasi Pacheco et al., 2010)
Jumlah Saccharomyces cerevisiae teradsorbsi pada ampas singkong dikuantifikasi menggunakan Hemasitometer dengan bantuan mikroskop optik. Sebanyak 1 gram ampas singkong yang telah mengandung sel terimobilisasi dimasukkan ke dalam 50 mL larutan NaCl 0.85%, kemudian campuran tersebut dikocok pada shaker selama 24 jam dengan kecepatan 150 rpm. Setelah itu, 0.1 mL larutan (mengandung sel bebas) ditempatkan pada Hemasitometer dan dihitung dengan bantuan mikroskop optik.
2. Kadar Total Gula (Apriyantono et al., 1989)
Prinsip metode ini adalah gula sederhana, oligosakarida, polisakarida dan turunannya dapat bereaksi dengan fenol dalam asam sulfat pekat menghasilkan warna orange-kekuningan yang stabil.
Pembuatan Kurva Standar
Sebanyak 2 mL larutan glukosa standar yang mengandung 0, 10, 20, 30, 40, dan 60 μ glukosa masing-masing dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 mL larutan fenol 5% dan dikocok. Selanjutnya ditambahkan dengan cepat 5 mL larutan asam sulfat pekat dan dibiarkan selama 10 menit, dikocok lalu dipanaskan dalam penangas air selama 15 menit. Setelah dingin, absorbansi larutan standar diukur pada panjang gelombang 490 nm dan dibuat kurva standar yang menunjukkan hubungan konsentrasi glukosa dengan absorbansi.
Penetapan Sampel
Untuk menetapkan total gula, sampel harus berupa cairan yang jernih. Sebanyak 2 mL sampel dimasukkan ke dalam tabung reaksi lalu ditambahkan 1 mL larutan fenol 5% dan dikocok. Selanjutnya ditambahkan dengan cepat 5 mL larutan asam sulfat pekat dan dibiarkan selama 10 menit, dikocok lalu dipanaskan dalam penangas air selama 15 menit. Setelah dingin, absorbansinya diukur dengan spektrofotometer pada panjang gelombang 490 nm. Sampel sebelumnya diencerkan dengan tingkat pengenceran yang sesuai sehingga dapat terbaca pada kisaran 20-80% absorban. Nilai rata-rata absorbansi sampel hasil pengukuran dimasukkan ke persamaan kurva standar sehingga didapatkan nilai konsentrasi total gula.
3. Kadar Etanol (Modifikasi Pacheco et al., 2010)
22
Lampiran 2. Hasil Analisa Parameter Fermentasi 1. Kadar Etanol dan Kadar Gula Sisa
Siklus ke- Konsentrasi Total Gula Awal (g/L)
Kadar Gula Sisa (g/L)
Kadar Etanol (g/L)
I 140 5.96±0.03 63.66±0.30
II 140 7.81±0.14 50.75±0.89
III 140 9.03±0.69 54.98±3.54
IV 140 10.44±0.25 46.84±1.11
V 140 10.78±0.63 45.73±2.68
VI 140 12.88±0.27 42.72±0.91
2. Produktivitas, Yield, Persentase Konversi Gula, dan Efisiensi Fermentasi Siklus
ke-
Produktivitas (g/L/jam)
Yield
(g etanol/g substrat)
Persentase Konversi Gula
(%)
Efisiensi (%)
I 2.66±0.11 0.47±0.01 95.74±0.02 93.13±0.46
II 2.11±0.04 0.38±0.01 94.42±0.98 75.27±1.41
III 1.91±0.15 0.35±0.03 93.55±0.49 66.87±5.66
IV 1.95±0.05 0.36±0.01 92.54±0.17 70.92±1.82
V 1.90±0.11 0.35±0.02 92.30±0.45 69.40±4.42
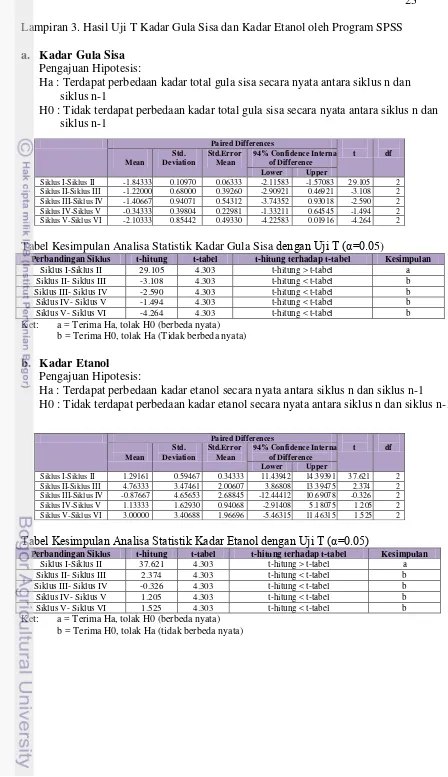
23 Lampiran 3. Hasil Uji T Kadar Gula Sisa dan Kadar Etanol oleh Program SPSS a. Kadar Gula Sisa
Pengajuan Hipotesis:
Ha : Terdapat perbedaan kadar total gula sisa secara nyata antara siklus n dan siklus n-1
H0 : Tidak terdapat perbedaan kadar total gula sisa secara nyata antara siklus n dan siklus n-1
Tabel Kesimpulan Analisa Statistik Kadar Gula Sisa dengan Uji T (α=0.05)
Perbandingan Siklus t-hitung t-tabel t-hitung terhadap t-tabel Kesimpulan
Siklus I-Siklus II 29.105 4.303 t-hitung > t-tabel a b = Terima H0, tolak Ha (Tidak berbeda nyata)
b. Kadar Etanol Pengajuan Hipotesis:
Ha : Terdapat perbedaan kadar etanol secara nyata antara siklus n dan siklus n-1 H0 : Tidak terdapat perbedaan kadar etanol secara nyata antara siklus n dan siklus n-1
Tabel Kesimpulan Analisa Statistik Kadar Etanol dengan Uji T (α=0.05)
Perbandingan Siklus t-hitung t-tabel t-hitung terhadap t-tabel Kesimpulan
Siklus I-Siklus II 37.621 4.303 t-hitung > t-tabel a b = Terima H0, tolak Ha (tidak berbeda nyata)
24
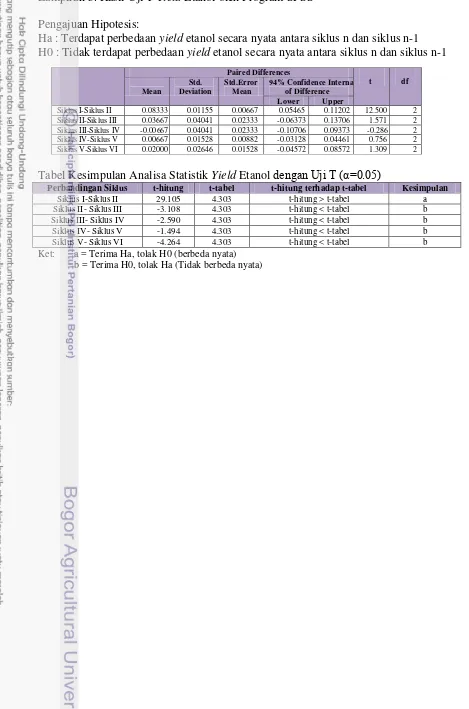
Lampiran 3. Hasil Uji T Yield Etanol oleh Program SPSS Pengajuan Hipotesis:
Ha : Terdapat perbedaan yield etanol secara nyata antara siklus n dan siklus n-1 H0 : Tidak terdapat perbedaan yield etanol secara nyata antara siklus n dan siklus n-1
Tabel Kesimpulan Analisa Statistik Yield Etanol dengan Uji T (α=0.05)
Perbandingan Siklus t-hitung t-tabel t-hitung terhadap t-tabel Kesimpulan
Siklus I-Siklus II 29.105 4.303 t-hitung > t-tabel a
Siklus II- Siklus III -3.108 4.303 t-hitung < t-tabel b Siklus III- Siklus IV -2.590 4.303 t-hitung < t-tabel b
Siklus IV- Siklus V -1.494 4.303 t-hitung < t-tabel b
Siklus V- Siklus VI -4.264 4.303 t-hitung < t-tabel b
Ket: a = Terima Ha, tolak H0 (berbeda nyata) b = Terima H0, tolak Ha (Tidak berbeda nyata)
Paired Differences
t df
Mean
Std. Deviation
Std.Error Mean
94% Confidence Internal of Difference Lower Upper
Siklus I-Siklus II 0.08333 0.01155 0.00667 0.05465 0.11202 12.500 2
Siklus II-Siklus III 0.03667 0.04041 0.02333 -0.06373 0.13706 1.571 2
Siklus III-Siklus IV -0.00667 0.04041 0.02333 -0.10706 0.09373 -0.286 2
Siklus IV-Siklus V 0.00667 0.01528 0.00882 -0.03128 0.04461 0.756 2
25 RIWAYAT HIDUP
Terlahir sebagai putera kedua dari empat bersaudara dari pasangan Yunus Manurung dan Naelah, penulis untuk pertama kalinya menatap dunia pada tanggal 13 Oktober 1989 di Katulampa, Kota Bogor, Jawa Barat. Penulis memulai pendidikan formal di SD Negeri Katulampa 3 pada tahun 1996 dan lulus pada tahun 2002. Kemudian penulis melanjutkan jenjang pendidikan dengan memasuki SMP Negeri 2 Ciawi, Kabupaten Bogor pada tahun 2002 dan lulus pada tahun 2005. Pada 2005, penulis melanjutkan akademik ke MA Negeri 2 Kota Bogor dan berhasil menyandang predikat Lulusan Terbaik pada 2008. Melalui jalur USMI (Undangan Seleksi Masuk IPB), penulis memasuki jenjang akademik S1 Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, IPB dan lulus pada tahun 2013.
Selama berada di jenjang akademik S1, penulis diamanahi posisi strategis di beberapa organisasi, baik intrakampus maupun ekstrakampus. Dalam tataran intrakampus, penulis menjadi Ketua HRD UKM FORCES (Forum for Scientific Studies)-IPB 2010-2011 dan Ketua Angkatan 2008 di organisasi yang sama pada 2008-2011, Penanggung Jawab Pendidikan Program Kakak Asuh BEM FATETA-IPB pada tahun 2010, dan Bendahara Umum DKM TPB-FATETA-IPB 2008-2009. Dalam tataran ekstrakampus, penulis diamanahi menjadi Pionir Pembentukan CIDES-ICMI Chapter Mahasiswa 2012, Ketua Science Community BEB-C 2010-2011, dan Ketua Kampoeng Produktif Desa Galuga 2010. Selain itu, penulis pun aktif di berbagai kompetisi tingkat mahasiswa serta berhasil memperoleh beberapa penghargaan, di antaranya Pendanaan Proyek Biogas dari Kementerian Riset dan Teknologi RI 2012; Presenter pada International Conference AMSTECS 2011 dari ISTECS Chapter Japan joint with Tokyo Institute of Technology, Tokyo, Jepang; Presenter pada International Conference SUSTAIN’s 2010 oleh PPI
Kyoto joint with Kyoto University, Kyoto, Jepang; Best Scientific Paper oleh ISA of Tokyo Institute of Technology, Tokyo, Jepang; serta berbagai penghargaan lain dari DIKTI dan beberapa kampus di tanah air.
Pada tahun 2011, penulis menjalankan Praktek Lapangan di PG.Ngadiredjo, PTPN X, Kediri, dengan judul “Mempelajari Aspek Pengawasan Mutu pada Produksi Gula Kristal Putih di PG.Ngadiredjo, PTPN X, Kediri”.