i
PERANAN SUMBER KARBON EKSTERNAL YANG
BERBEDA DALAM PEMBENTUKAN BIOFLOK DAN
PENGARUHNYA TERHADAP KUALITAS AIR SERTA
PRODUKSI PADA SISTEM BUDIDAYA UDANG VANAME
Litopenaeus vannamei
MUHAMMAD HANIF AZHAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis berjudul Peranan Sumber Karbon Eksternal yang Berbeda Dalam Pembentukan Bioflok Pengaruhnya Terhadap Kualitas Air dan Produksi pada Sistem Budidaya Udang Vaname Litopenaus vannamei dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 22 Juli 2013
iv
RINGKASAN
MUHAMMAD HANIF AZHAR. Peranan sumber karbon eksternal yang berbedadalam pembentukan bioflok pengaruhnya terhadap kualitas air dan produksi pada sistem budidaya udang vaname Litopenaeus vannamei. Dibimbing oleh EDDY SUPRIYONO dan KUKUH NIRMALA.
Total ammonia nitrogen (TAN) merupakan salah satu masalah pada budidaya udang vaname. Untuk mengurangi level TAN agar tetap dalam batas yang ditentukan dalam proses budidaya maka dilakukan penambahan sumber karbon organik untuk meningkatkan C/N rasio yang bertujuan untuk mendorong pertumbuhan bakteri heterotrof.
Penelitian terdiri dari dua tahap. Tahap satu bertujuan untuk mengetahui penurunan konsentrasi TAN. Penelitian ini menggunakan rancangan acak lengkap dengan 4 perlakuan dan 4 ulangan berupa penambahan sumber karbon (A) molase; (B) tapioka; (C) dedak; (D) onggok dengan penggunan C/N rasio 10, 15 dan 20. Parameter yang diamati adalah berupa penurunan konsentrasi TAN serta DO, pH dan suhu. Data dianalisa secara statistik dengan one-way analysis of variance (ANOVA) menggunakan software Minitab (versi 16.0) pada selang kepercayaan 95% (P<0,05).Pengukuran TAN dengan C/N rasio yang berbeda memberikan nilai yang berbeda pula dimana C/N rasio 20 memiliki pengaruh yang tidak berbeda nyata dengan C/N rasio 15 namun memiliki pengaruh yang berbeda nyata dengan C/N rasio 10 pada semua perlakuan sumber karbon setelah 24 jam.
Penelitian Tahap dua bertujuan untuk mengetahui efek pemberian sumber karbon terhadap profil bioflok, parameter kualitas air dan kinerja pertumbuhan dari udang vaname. Penelitian ini terdiri dari empat perlakuan penambahan sumber karbon berupa (A) molase; (B) tapioka; (C) dedak; (D) tapioka dan satu perlakuan tanpa karbon dengan penggunaan C/N rasio 15 serta 4 kali ulangan. Parameter yang diamati antara lain kualitas air berupa TAN, nitrit, nitrat dan ammonia. Profil bioflok yang diamati berupa identifikasi bakteri, jumlah bakteri Vibrio dan jumlah total bakteri pada air dan usus udang. Parameter produksi yang diamati berupa laju pertumbuhan spesifik, konversi pakan, tingkat kelangsungan hidup dan bobot rata-rata dari udang vaname. Parameter kualitas air terutama TAN, nitrit serta ammonia menurun pada saat akhir pemeliharaan. Hasil dari profil bioflok ditemukan beberapa mikroorganisme berupa cacing, fitoplankton dan zooplankton. Genus Bacillus sp. ditemukan pada semua perlakuan sumber karbon. Jumlah total bakteri tertinggi terdapat pada perlakuan molase (air dan usus udang). Penghitungan jumlah bakteri Vibrio tertinggi terdapat pada perlakuan tanpa karbon (air dan usus udang). Konversi pakan pada perlakuan tanpa karbon (1.67±0.10) berbeda nyata dengan perlakuan tapioka (1.41±0.13). Tingkat kelangsungan hidup udang vaname selama pemeliharaan pada perlakuan tanpa karbon (84.17±3.20%) berbeda nyata dengan perlakuan onggok (92.50±5.00%).
v SUMMARY
MUHAMMAD HANIF AZHAR. Effect of Different Carbon Sources on bioflocs formation effect on water quality and production in White Shrimp Culture System Litopenaeus vannamei. Under direction of EDDY SUPRIYONO and KUKUH NIRMALA.
Total ammonia nitrogen (TAN) is one issue on White shrimp cultivation. To reduce the TAN levels in order to remain within the limits specified in the cultivation process, the addition of organic carbon sources to improve the C / N ratio which aims to encourage the growth of heterotrophic bacteria. The study consisted of two phases.
Phase one aims to determine the decrease in the concentration of TAN. This study uses a completely randomized design with four treatments and four reaply such as the addition of a carbon source (A) molasses; (B) tapioca; (C) rice bran; (D) the use of cassava by product with C/N ratio of 10, 15 and 20. Parameters is observed as a decrease in the concentration of TAN and DO, pH and temperature. Data were statistically analyzed by one-way analysis of variance (ANOVA) using Minitab software (version 16.0) at the 95% confidence interval (P <0,05).The measurements of TAN with different C/N ratios giving different values where the C/N ratio of 20 has effect not significantly different from C/N ratio of 15, but has a significantly different effect with the C/N ratio of 10 in all treatments of carbon sources after 24 hours.
Phase two study aimed to determine the effect of carbon sources on bioflocs profile, water quality parameters and growth performance of White shrimp. The study consisted of 4 treatments such as the addition of a carbon source (A) molasses; (B) tapioca; (C) rice bran; (D) cassava by product and without carbon, use of C/N ratio of 15 and four reaply. Parameter of water quality are TAN, nitrite, nitrate and ammonia. Bioflocs profile observed is identification of bacteria, Vibrio bacterial counts and the total number of bacteria in the water and shrimp intestine. Production parameters observed is specific growth rate, feed conversion, survival rates and average weights of White shrimp. Water quality parameters, especially TAN, nitrite and ammonia decreased at the end of maintenance period. Results of profile bioflocs found some microorganisms such as worms, phytoplankton and zooplankton. Genus Bacillus sp. was found in all treatments of carbon sources. Highest total number of bacteria present in molasses treatment (water and intestinal shrimp). Vibrio bacteria counts are highest in the no-carbon treatment (water and shrimp intestine). Vibrio bacteria counts are highest in the no-carbon treatment (Water and shrimp intestine). Feed conversion on treatment without carbon carbon (1.67 ± 0.10) were significantly different with the treatment of tapioca (1.41 ± 0.13). White shrimp survival rate during the maintenance treatment without carbon (84.17 ± 3.20%) was lower in all treatments and were significantly different with cassava by product treatment (92.50% ± 5.00).
vi
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
vii
PERANAN SUMBER KARBON EKSTERNAL YANG
BERBEDA DALAM PEMBENTUKAN BIOFLOK DAN
PENGARUHNYA TERHADAP KUALITAS AIR SERTA
PRODUKSI PADA SISTEM BUDIDAYA UDANG VANAME
Litopenaeus vannamei
MUHAMMAD HANIF AZHAR
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
ix Judul Penelitian : Peranan sumber karbon eksternal yang berbeda dalam
pembentukan bioflok dan pengaruhnya terhadap kualitas air serta produksi pada sistem budidaya udang vaname Litopenaeus vannamei
Nama : Muhammad Hanif Azhar NRP : C151110251
Disetujui Komisi Pembimbing
Dr Ir Eddy Supriyono, MSc. Dr Ir Kukuh Nirmala, MSc. Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Ilmu Akuakultur
Prof Dr Ir Enang Harris MS Dr Ir Dahrul Syah, MSc.Agr
x
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian dan pemulisan tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada tahun 2012 ini adalah Peranan Sumber Karbon Eksternal yang Berbeda dalam Pembentukan Bioflok dan pengaruhnya Terhadap Kualitas Air serta Produksi pada Sistem Budidaya Udang Vaname Litopenaeus vannamei.
Pada kesempatan ini penulis mengucapkan terimakasih kepada:
1. Bapak Dr Ir Eddy Supriyono, MSc dan Bapak Dr Ir Kukuh Nirmala, MSc. selaku tim komisi pembimbing atas arahan, bimbingan dan masukan-masukannya sejak penyusunan rencana penelitian sampai penyusunan tesis ini.
2. Ibu Julie Ekasari Spi MSc. atas bimbingan dan arahaan yang telah diberikan.
3. Bapak Dr Dedi Jusadi MSc. selaku wakil Program Studi Ilmu Akuakultur atas arahan, masukan dan perbaikan tesis ini.
4. Ibu Dr Widanarni MSi. selaku penguji luar komisi, atas arahan dan masukan untuk perbaikan dalam penyusunan tesis ini.
5. Ayah dan Ibu tercinta, Bude Faria serta saudara-saudaraku atas doa’, semangat serta dukungan yang tak pernah surut selama ini.
6. Bapak Mardi selaku teknisi di Lab terpadu Ilmu Kelautan IPB Ancol serta Alm. Ibu Ince, Erfan dan Erfin atas bantuan serta masukannya selama penelitian.
7. Teknisi Laboratorium BDP IPB; Bapak Ranta (Lab Kesehatan Ikan FPIK IPB), Bapak Jajang (Lab Lingkungan FPIK IPB), Bapak Wasjan dan mbak Retno (Lab Nutrisi FPIK IPB) yang telah membantu penulis selama melakukan analisa laboratorium.
8. Rekan-rekan yang telah membantu selama penelitian berlangsung: Titi, Nurlita, Firstya, Dani, Ial, Azis, Fariq, Adni, Dewi, Epro, Apep, Dudi, putra dll.
9. Semua Rekan-rekan mahasiswa Program Mayor Ilmu Akuakultur angkatan 2011 atas kebersamaan dan kerjasama yang baik serta bantuannya dalam perkuliahan, penelitian dan penyelesaian karya ilmiah ini.
Penelitian ini merupakan bagian dari penelitian yang berjudul
“Enhancement of nutrient efficiency in integrated multi-trophic aquaculture with bioflocs as nutrient converting agent” diketuai oleh Julie Ekasari Spi MSc. yang dibiayai oleh program ICP Ph.D. Scholarship Vlaamse Interuniversitaire Raad, Belgia.
Bogor, 22 Juli 2013
xi
DAFTAR ISI
DAFTAR ISI v
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii 1 PENDAHULUAN Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 Hipotesis 2 2 TINJAUAN PUSTAKA Akuakultur Sistem Intensif 2 Nitrogen dalam Akuakultur Intensif : Jenis, Efeknya terhadap Organisme Budidaya dan lingkungan 4
Teknologi Bioflok 5
Sumber Karbon 6
3 METODE PENELITIAN Waktu dan Tempat Penelitian 9
Tahapan Penelitian 9
Prosedur Penambahan Sumber Karbon Eksternal 10
Parameter Biologi 11
Parameter Kualitas Air 13
Parameter Produksi Budidaya 13
Analisa Data 14
4 HASIL DAN PEMBAHASAN Hasil 14
Pembahasan 27
5 SIMPULAN Simpulan 30
DAFTAR PUSTAKA 30
LAMPIRAN 34
xii
8 Kisaran parameter kualitas air pada media percobaan 17
9 Hasil Identifikasi Bakteri Bioflok 18
10 Kisaran Kualitas air Media Pemeliharaan Udang Vaname 24
DAFTAR GAMBAR
1 Gambar struktur flok dalam sistem BFT dan komposisinya 6 2 Penurunan konsentrasi TAN dengan sumber karbon molase 15 3 Penurunan konsentrasi TAN dengan sumber karbon tapioka 15 4 Penurunan konsentrasi TAN dengan sumber karbon dedak 16 5 Penurunan konsentrasi TAN dengan sumber karbon onggok 16 6 Mikrograf bioflok yang diambil dari media pemeliharaan udang vaname
pada sistem bioflok dengan sumber karbon berbeda 18 7 Berbagai macam mikroorganisme yang terdapat di dalam bioflok pada
semua perlakuan dengan sumber karbon 19
8 Total presumtive vibrio count dan total kelimpahan bakteri pada air dan
usus udang 20
9 TAN pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 20
10 NO2--N pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 21
11 NO3--N pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 21
12 NH3- pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 22
13 pH pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon yang berbeda 22
14 DO pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon yang berbeda 23
15 TSS pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 23
16 VSS pada media pemeliharaan udang vaname dengan sistem bioflok
menggunakan sumber karbon berbeda 24
17 Volume flok pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon yang berbeda 24 18 Laju pertumbuhan spesifik udang vaname berdasarkan perlakuan
xiii 18 Konversi pakan udang vaname berdasarkan perlakuan dengan sumber
karbon serta tanpa sumber karbon (kontrol) 26
18 Tingkat kelangsungan hidup udang vaname berdasarkan perlakuan dengan sumber karbon serta tanpa sumber karbon (kontrol) 26 19 Bobot rata-rata dari udang vaname berdasarkan perlakuan dengan
sumber karbon serta tanpa sumber karbon (kontrol) 27
DAFTAR LAMPIRAN
1 Manajemen pemberian pakan pada pembesaran ikan lele 34 2 Tabel Feed Rate (FR) pada udang vaname Litopenaeus vannamei 35
3 Karakterisasi sifat fisiologi dan biokimia bakteri 35 4 Hasil karakterisasi morfologi, fisiologi dan biokimia bakteri bioflok 36
1
1 PENDAHULUAN
Latar Belakang
Budidaya udang vaname Litopenaeus vannamei di Indonesia semakin maju dan berkembang pesat dalam beberapa tahun belakangan ini. Dengan semakin majunya budidaya dan semakin banyaknya persaingan maka diperlukan usaha budidaya yang kompetitif dengan menggunakan teknologi yang efisien dalam segala aspek antara lain aspek produktifitas, kualitas, kotinuitas, biosecurity yang sesuai dengan permintaan pasar.
Akuakultur dengan sistem intensif diterapkan untuk efisiensi dengan penggunaan padat tebar pada ikan atau udang. Namun efek yang ditimbulkan pada sistem ini adalah akumulasi dari pakan yang tidak termakan, bahan organik dan nitrogen anorganik yang menjadi limbah serta bersifat toksik pada spesies yang dibudidayakan. Hal ini disebabkan karena ikan atau udang memanfaatkan hanya 20 sampai 30% dari pakan yang diberikan. Sisanya diekskresi dan biasanya terakumulasi di dalam air (Avnimelech dan Ritvo 2003). Untuk menanggulangi akumulasi limbah budidaya maka perlu diterapkan teknologi baru yang lebih efisien dan mudah dalam penerapannya. Teknologi bioflok menjadi salah satu alternatif pemecahan masalah limbah budidaya yang paling menguntungkan karena dapat menurunkan limbah nitrogen anorganik (Crab et al. 2007).
Teknologi bioflok (BFT) merupakan salah satu alternatif baru dalam mengatasi masalah kualitas air dalam akuakultur yang diadaptasi dari teknik pengolahan limbah domestik secara konvensional (Avnimelech 2006; De Schryver et al. 2008). BFT menjadi salah satu alternatif pemecahan masalah limbah budidaya yang paling menguntungkan karena selain dapat menurunkan limbah nitrogen anorganik, BFT juga dapat menyediakan pakan tambahan berprotein untuk kultivan sehingga dapat menaikan pertumbuhan dan efisiensi pakan. BFT dapat dilakukan dengan menambahkan sumber karbon organik ke dalam media budidaya untuk merangsang pertumbuhan bakteri heterotrof dan meningkatkan C/N rasio (Crab et al. 2007).
2
(Chamberlain et al. 2001). Dari beberapa penelitian yang dilakukan dengan menggunakan beberapa sumber karbon berupa molase, gula, asetat, gliserol, glukosa, tepung gandum, tapioka serta kanji diperoleh hasil bahwa penggunaan sumber karbon yang berbeda berpengaruh terhadap komposisi flok, tingkat asimilasi nitrogen serta kandungan nutrisi pada flok (Avnimelech et al. 2012).
Sumber karbon yang digunakan dalam BFT sering diperoleh dari produk turunan dari manusia atau dari industri makanan ternak lokal yang banyak tersedia. Sumber karbon yang murah seperti molase dan beberapa produk dari industri pertanian (seperti tepung gandum, tepung jagung, tapioka, dedak padi) banyak digunakan selama proses budidaya dari fase pembenihan sampai fase pembesaran yang bertujuan untuk mempertahankan C/N rasio yang terdapat pada perairan serta mengontrol nitrogen anorganik yang terdapat pada kolam budidaya. Ada banyak pertimbangan yang dilakukan dalam penggunaan sumber karbon dalam sistem BFT antara lain berupa harga, ketersediaan bahan di daerah tersebut, biodegradabilitas (penguraian oleh mikroorganisme) serta efisiensi asimilasi bakteri (Emerenciano et al. 2013). Oleh sebab itu, pemilihan sumber karbohidrat harus dilakukan dengan tepat karena berpengaruh terhadap penerapan BFT pada sistem budidaya. Pemilihan sumber karbohidrat yang tepat pada sistem BFT berpengaruh terhadap perbaikan kualitas air media pemeliharaan serta dapat meningkatkan produktifitas budidaya.
Perumusan Masalah
Total ammonia Nitrogen (TAN) merupakan salah satu masalah yang dihadapi pada budidaya udang vaname. Untuk mengurangi level TAN agar tetap dalam batas yang ditentukan dalam proses budidaya maka digunakan C/N rasio yang bertujuan untuk mendorong pertumbuhan bakteri heterotrof serta pemanfaatan nitrogen yang berasal dari protein pakan serta ammonia yang dihasilkan oleh udang. Jenis sumber karbon yang digunakan dalam sistem bioflok akan menentukan efisiensi pemanfaatan nitrogen oleh bakteri.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk evaluasi mengenai pengaruh dari berbagai jenis sumber karbon eksternal terhadap penurunan TAN, profil bioflok, parameter kualitas media pemeliharaan dan kinerja pertumbuhan udang vaname serta mencari sumber karbon eksternal yang terbaik dalam memperbaiki kualitas air serta meningkatkan produksi budidaya.
Manfaat Penelitian
Manfaat dari penelitian ini adalah merekomendasikan sumber karbon eksternal yang efektif dan efisien dalam perbaikan kualitas air pada sistem budidaya udang vaname.
Hipotesis Penelitian
3
2 TINJAUAN PUSTAKA
Akuakultur Sistem Intensif
Akuakultur didefinisikan sebagai kegiatan budidaya dibawah kondisi terkontrol dengan tujuan adalah untuk menghasilkan produk perikanan yang secara efisien dengan biaya seefektif mungkin (Ebelling et al. 2006). Sistem budidaya pada udang secara umum dapat dibagi menjadi tiga yaitu ekstensif/ tradisional, semi intensif serta sistem intensif (Rossenbery 2000). Perbedaan dari sistem tersebut adalah pada pemanfaatan lahan, padat tebar, penggunaan pakan serta teknologi. Sistem budidaya intensif banyak dipilih oleh petani udang karena memiliki keunggulan dalam pemanfaatan lahan dengan padat tebar yang tinggi yang dapat meningkatkan nilai produksi udang dengan waktu produksi yang lebih singkat. Seiring dengan berjalannya waktu, sistem budidaya intensif memiliki kekurangan antara lain penggunaan air yang berlebih serta menghasilkan bahan organik yang melimpah. Kandungan bahan organik yang melimpah pada wadah budidaya dapat menurunkan kualitas air yang akan memicu stress pada udang yang dibudidayakan sehingga mudah teserang penyakit. Beberapa penyakit yang ditimbulkan dari budidaya udang sistem antara lain Taura syndrome virus (TSV) yang menyerang pada budidaya udang di Amerika Selatan (Brock et al. 1997), White spot syndrome virus (WSSV) yang menyerang pada budidaya udang di Amerika (Lightner 1999) dan Infectious myocardiosis necrosis virus (IMNV) yang menyerang pada budidaya udang di pantai timur Brazil (Lightner dan Pantoja 2004). Perkembangan budidaya udang intensif pada industri akuakultur juga memberikan dampak terhadap lingkungan berupa buangan limbah organik berupa sisa pakan yang tidak termakan dan feses dari udang. Pembuangan dari kegiatan budidaya ke dalam lingkungan perairan mengandung kadar nutrisi yang tinggi, berbagai senyawa organik dan anorganik seperti karbon organik yang terlarut, amonium dan fosfor (Piedrahita 2003).
Pengembangan budidaya udang semakin membutuhkan strategi untuk meningkatkan sistem produksi, meningkatkan biosecurity dan mengurangi dampak terhadap lingkungan (Avella et al. 2010). Selama tahun 1990, negara Amerika telah menerapkan strategi pada kolam produksi udang vaname yang mencapai 5000 kg/ha dengan sedikit atau tanpa pergantian air (zero or limited water exchange) (Browdy et al. 2001). Keuntungan dari sistem ini adalah untuk mengurangi penggunaan air dan pembuangan air limbah serta mengurangi dampak terhadap lingkungan karena berkurangnya nutrisi yang dibuang selama siklus produksi berlangsung (Cuzon et al. 2004). Pergantian air yang minimal dapat mengurangi resiko masuk dan menyebarnya penyakit serta memberikan keuntungan dalam pemanfaatan nutrisi dari produksi alami yang berasal dari kolam budidaya (McIntosh et al. 2000).
4
kadar protein sebesar 30% dan 40% dalam tangki yang dikelola secara intensif tanpa pertukaran air. Selama beberapa tahun terakhir, manajemen dengan sistemvzero water exchange telah dikembangkan untuk skala produksi besar kolam, di mana substrat karbon ditambahkan pada sistem untuk mendukung metabolisme mikroba (Avnimelech 1999; McIntosh 2000). Dengan rasio karbon tinggi terhadap nitrogen (C/N) rasio, bakteri heterotrof akan mengasimilasi ammonia-nitrogen langsung dari air dan metabolisme ammonia langsung ke biomassa sel. Banyak peneliti telah menerapkan konsep ini untuk sistem produksi dalam ruangan dengan kepadatan tinggi (Van Wyk, 1999).
Nitrogen Dalam Akuakultur Intensif : Jenis, Efeknya Terhadap Organisme Budidaya dan Lingkungan
Nitrogen adalah merupakan elemen yang esensial bagi pertumbuhan mikroorganisme, tumbuhan, dan hewan yang sering juga disebut sebagai biostimulan. Senyawa kimia nitrogen sangat kompleks karena memiliki beberapa tahapan oksidasi yang dapat merubah senyawa kimia nitrogen. Proses oksidasi tersebut dipengaruhi oleh organisme hidup (Metcalf dan Eddy 1991). Di perairan, nitrogen berupa nitrogen anorganik dan nitrogen organik. Nitrogen anorganik terdiri atas ammonia (NH3+), amonium (NH4+), nitrit (NO2-), nitrat (NO3-) dan
molekul nitrogen (N2) dalam bentuk gas. Nitrogen organik berupa protein, asam
amino dan urea (Effendi 2003).
Ammonia di perairan digunakan oleh bakteri autotrof dan tumbuhan dalam asimilasi nitrogen anorganik (ammonia dan nitrat) untuk membentuk nitrogen organik. Sumber ammonia di perairan adalah pemecahan nitrogen organik (protein dan urea) dan nitrogen yang berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur. Proses ini disebut dengan istilah amonifikasi (Effendi 2003). Ikan juga menghasilkan limbah nitrogen berupa ammonia melalui insang dalam proses osmoregulasi serta sisa makanan yang tidak tercerna. Proses amonifikasi dan nitrifikasi dapat dilihat pada persamaan berikut :
N organik + O2 NH3+ - N + O2 NO2--N + O2 NO3-- N (1)
Amonifikasi Nitrifikasi
Reduksi nitrat (denitrifikasi) oleh aktivitas mikroba terjadi pada kondisi anaerob dan merupakan proses yang biasa terjadi pada pengolahan limbah yang juga menghasilkan gas ammonia serta gas-gas lain misalnya NO2-, NH3+, N2O dan N2
(Novotny dan Olem, 1994) terlihat pada persamaan berikut :
NH3+ (Ammonia)
NO3- NO2-
(Nitrat) (Nitrit) N2O (Dinitrogen oksida) N2 (Gas) (2)
Denitrifikasi
Ammonia terdapat 2 bentuk di air, yaitu yang terionisasi (amonium) dan yang tidak terionisasi (ammonia). Ammonia yang tidak terionisasi berbahaya bagi organisme akuatik, karena bersifat toksik (Masser et al. 1999). Nilai NH3+
5
Ammonia adalah masalah serius yang terdapat dalam kegiatan akuakultur. Tsai menyatakan (1989) bahwa batas aman ammonia pada udang adalah 0,1 mg/L. Kadar Ammonia mulai berpengaruh terhadap pertumbuhan sebesar 50% adalah pada kadar 0.45 mg/L, sedang pada kadar 1.29 mg/L menyebabkan kematian. Lin dan Chen (2001) melaporkan bahwa nilai LC50 ammonia untuk PL
udang vaname dengan perendaman selama 24, 48, 72 dan 96 jam pada salinitas 35 ppt adalah 2.78 mg/L, 2.18 mg/L, 1.82 mg/L dan 1.60 mg/L.
Nitrit (NO2-) pada perairan alami biasanya ditemukan dalam jumlah yang
sangat sedikit, lebih sedikit daripada nitrat karena bersifat tidak stabil dengan keberadaan oksigen. Nitrit merupakan bentuk peralihan antara ammonia dan nitrat (nitrifikasi) serta antara nitrat dan gas nitrogen (denitrifikasi). Nitrit adalah produk setengah jadi dari ammonia baik dalam proses nitrifikasi ammonia atau proses denitrifikasi nitrat. Telah dilaporkan bahwa konsentrasi dari nitrit langsung meningkat seiring dengan berjalannya proses budidaya dan dapat mencapai hingga 4,6 mg/l nitrit-N (nitrit sebagai nitrogen) di air kolam (Chen et al. 1989).
Akumulasi nitrit di dalam perairan dapat menurunkan kualitas air, menghambat pertumbuhan, meningkatkan konsumsi oksigen dan ekskresi ammonia serta dapat menyebabkan tingkat kematian yang tinggi pada udang (Chen dan Chen 1992; Cheng dan Chen 1998). Telah dilaporkan bahwa 96 jam setelah LC50 didapatkan hasil yang bervariasi antar 37.71 sampai dengan 54.76
mg/l dari nitrit-N, namun masih sedikit informasi yang diperoleh mengenai tingkat kematian oleh nitrit dengan level salinitas yang berbeda pada udang (Chen dan Lin 1991).
Nitrat merupakan produk akhir dari proses nitrifikasi, dimana dengan bantuan bakteri Nitrobacter nitrit diubah menjadi nitrat yang relatif tidak toksik (Van Wyk 1999; Masser et al. 1999). Senyawa ini dihasilkan dari proses oksidasi senyawa nitrogen di perairan. Nitrifikasi adalah proses oksidasi ammonia menjadi nitrit dan nitrat. Nitrifikasi merupakan proses yang penting dalam siklus nitrogen dan berlangsung pada kondisi aerob. Oksidasi ammonia menjadi nitrit dilakukan oleh bakteri Nitrosomonas, sedangkan oksidasi nitrit menjadi nitrat dilakukan oleh bakteri Nitrobacter (Novotny dan Olem 1994). Perubahan bentuk nitrogen dalam proses nitrifikasi oleh bakteri dapat dilihat pada persamaan berikut :
2 NH3 + 3 O2 2 NO2- + 2 H+ + 2 H2O (1)
Nitrosomonas
2 NO2 + O2 2NO3- (2)
Nitrobacter
6
Teknologi Bioflok
Teknologi bioflok (BFT) pada akuakultur didefinisikan sebagai teknik pengelolahan manajamen kualitas air yang berbasis kepada pemanfaatan dan pengendalian bakteri heterotrof yang terdapat dalam sistem budidaya tanpa pergantian air. Bioflok tersusun dari suspensi yang terdapat didalam air yang terdiri bakteri, alga, partikel anorganik, pemakan bakteri seperti protozoa dan zooplankton (Avnimelech 2006). Pada sistem BFT, kontrol terhadap nitrogen anorganik yang terdapat di dalam kolam didasarkan pada metabolisme karbon dan nitrogen. Bakteri dan mikroorganisme lainnya menggunakan karbohidrat (gula, pati dan selulosa) sebagai makanan untuk menghasilkan energi dan untuk tumbuh antara lain memproduksi protein dan sel-sel baru (Avnimelech 1999). Flok adalah padatan tersuspensi dalam kolam yang terdiri atas fitoplankton, bakteri, kumpulan partikel organik yang hidup dan mati serta pemakan mikroorganisme (Hargreaves 2006).
Proses pembentukan flok dari kumpulan mikrobial merupakan proses yang kompleks. Dalam matriks flok, kombinasi fisik, kimia dan biologi berjalan. Mekanisme pembentukan flok masih belum diketahui secara pasti. Komponen utama yang dapat ditemukan di dalam matriks flok adalah subtansi ekstraseluler polimer. Struktur ini membentuk matriks yang membungkus sel-sel mikroba dan berperan dalam mengikat komponen flok (Hantula dan Bamford 1991; Liu dan Fang 2003).
Gambar 1 A. Gambar struktur flok dalam sistem BFT-dan komposisinya; B. protozoa yang terdapat di tepi flok yang melepaskan dan meninggalkan sel-sel flok (De schryver et al. 2008).
Sumber Karbon
7 bakteri berupa karbohidrat dan selanjutnya nitrogen dalam air akan terserap oleh sintesis protein mikroba (Avnimelech 1999).
Sumber karbon organik yang dapat digunakan meliputi alkohol, gula, sagu, dan bahan berserat (fiber). Alkohol dan gula mudah untuk dicerna, dapat menstimulus pertumbuhan bakteri lebih cepat, sehingga mampu untuk berkompetisi dengan fitoplankton dalam mengabsorbsi nitrogen dan fosfor dalam kolam budidaya. Karbohidrat kompleks seperti jagung, sagu dan tepung terigu lebih lambat di metabolisme (dicerna) dibandingkan alkohol dan gula, tetapi keunggulan dari penggunaan karbohidrat kompleks adalah dapat menyediakan partikel-partikel yang dapat dijadikan tempat menempel bakteri. Partikel tersebut juga akan memudahkan proses pelepasan karbon organik. Karbohidrat kompleks membutuhkan enzim bakteri yang cocok dalam proses dekomposisinya. Enzim-enzim tersebut akan meningkatkan proses pencernaan spesies akuakultur (Chamberlain et al. 2001). Bahan berupa fiber (berserat) sangat dihindari penggunaannya, karena bahan berserat relatif tidak terdekomposisi dengan baik. Tetapi bahan berserat menyediakan partikel yang tahan lama sebagai substrat bakteri (Chamberlain et al. 2001). Penggunaan beberapa sumber karbon yang berbeda pada penelitian ini didasarkan pada jenis sumber karbon, kandungan C organik, ketersediaan serta harga di pasaran.
Molase merupakan buangan akhir proses pengolahan gula setelah mengalami proses kristalisasi berulang dan berwarna coklat kehitaman serta berbentuk cairan kental. Molase mengandung 48 sampai 56 % gula dan sedikit bahan atau unsur-unsur mikro (trace element) yang penting bagi kehidupan organisme seperti cobalt, boron, iodium, tembaga, mangan dan seng. Selain itu molase juga mengandung vitamin dan pigmen (Paturau 1982). Komposisi kimia molase disajikan pada Tabel 1.
Tabel 1 Komposisi Kimia Molase
Komponen Rata-rata (%)
8
Tepung tapioka merupakan pati yang diekstrak dari singkong (Manihot esculenta). Pati tersusun dari dua macam polimer glukosa, yaitu amilosa dan amilopektin. Amilosa merupakan polimer glukosa yang dihubungkan melalui
ikatan α 1,4 sehingga membentuk rantai lurus, sedangkan amilopektin merupakan
polimer glukosa yang dihubungkan oleh ikatan α 1.4 dan α 1.6 sehingga membentuk molekul yang bercabang-cabang (Whistler et al. 1984). Komposisi kimia dari tepung tapioka dapat dilihat pada Tabel 2.
Tabel 2 Komposisi kimia dari tepung tapioka
Sumber : Grace (1977).
Ubi kayu merupakan tanaman yang memiliki kandungan protein yang tinggi berkisar antara 16.7 sampai 39.9 % bahan kering (Ravindran 1991). Onggok merupakan hasil sampingan industri tapioka yang berbentuk padat. Komponen penting yang terdapat dalam onggok adalah pati dan serat kasar. Kandungan ini berbeda untuk setiap daerah asal, jenis, mutu ubi kayu, teknologi yang digunakan dan penanganan ampas itu sendiri. Ditinjau dari komposisi zat makanan, onggok mempunyai sumber energi dengan kandungan karbohidrat sekitar 97.29%, namun kandungan protein kasar onggok sangat rendah yaitu sekitar 1.45% dengan serat kasar yang tinggi sekitar 10.94% (Sitompul 2006). Tabel 3 menunjukkan komposisi kimia dari onggok (ampas tapioka).
Tabel 3 Komposisi kimia onggok (ampas tapioka)
Komposisi I(%) II(%) III(%)
Sumber : Analisis Balai Industri Semarang (1983) dalam Muzirman (2000). Keterangan :
I : Sampel dari pati, proses ekstrasi dengan saringan getar, dikeringkan tanpa ditekan. II : Sampel dari pati, proses ekstrasi dengan tangan, ditekan dan dikeringkan.
III : Sampel dari pati, proses ekstrasi dengan tangan, langsung dikeringkan tanpa ditekan.
Dedak padi merupakan hasil samping dari pengolahan beras giling. Pada penggilingan padi akan menghasilkan dedak padi kira-kira sebanyak 10% dari
Komposisi Jumlah
9 total bahan (Sunaryanto 2003). Dedak padi tersusun dari berbagai macam senyawa kimia. Selain kaya karbohidrat dan lemak, dedak padi juga banyak mengandung protein, vitamin dan mineral. Vitamin yang terdapat dalam dedak padi adalah vitamin B dan vitamin E, sedangkan mineralnya berupa kalsium, fosfor dan besi (Sunaryanto 2003). Tabel 4. menunjukkan komposisi kimia dari dedak padi sebagai berikut :
Tabel 4 Komposisi kimia dedak padi
Komponen Kadar (%)
Penelitian ini terdiri dari 2 tahap dan dilaksanakan pada bulan Agustus 2012 - Maret 2013. Tempat penelitian dilakukan di laboratorium lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor serta Laboratorium Perikanan Terpadu Ilmu Kelautan Ancol IPB. Analisa mikrobiologi dilakukan di laboratorium Kesehatan Ikan FPIK Institut Pertanian Bogor. Analisa proksimat dari pakan dilakukan di Laboratorium Nutrisi Ikan FPIK Institut Pertanian Bogor. Uji C-organik dilakukan di Laboratorium Tanah Balai Besar Sumberdaya Lahan Pertanian Balai Penelitian Tanah Bogor serta uji kualitas air laboratorium Lingkungan FPIK, Institut Pertanian Bogor.
Tahap 1
Pengaruh Sumber Karbon Eksternal dan Nisbah C/N yang Berbeda Terhadap Penurunan Total Ammonia Nitrogen
10
serta KH2PO4 31 mg/Ldan Na2HPO4 63,7 mg/L sebagai makronutrien (Ekasari
2008; De schryver dan Verstraete 2009). Parameter yang di uji adalah konsentrasi TAN, pH, suhu dan DO. Konsentrasi TAN diukur setiap 2 jam sekali sedang pH, suhu dan DO diukur tiap pagi dan sore hari.
Penelitian terdiri dari 4 perlakuan sumber karbon eksternal yaitu molase, tepung tapioka, dedak padi dan onggok (ampas singkong) dengan tiga C/N rasio yaitu 10, 15 dan 20 serta 4 ulangan. Penambahan sumber karbon dilakukan secara langsung pada wadah percobaan.
Tahap 2
Pengaruh Pemberian Sumber Karbon Eksternal yang Berbeda Terhadap Kualitas Air pada Budidaya Udang Vaname
Penelitian pada tahapan kedua dilakukan pada akuarium berukuran 90cm x 45cm x 25cm dengan volume 90 L yang dilengkapi dengan aerasi dengan kecepatan 2000 mL/ menit. Akuarium dibersihkan dan dilakukan proses sterilisasi dengan menggunakan kaporit dosis 100 mg/L dan dibiarkan selama 3 hari sebelum digunakan.
Pemeliharaan udang dilakukan selama 40 hari. Jumlah udang yang ditebar sebanyak 30 ekor dengan rata-rata biomass 60 g. Pemberian pakan dilakukan sebanyak 4 kali sehari yaitu pada pukul 06.00, 10.00, 14.00 dan 19.00 Pemberian pakan diberikan berdasarkan pada biomass dan persentase pakan berdasarkan bobot dari udang. Pakan yang digunakan memiliki kandungan protein sebesar 30%.
Penelitian yang dilaksanakan terdiri dari 5 perlakuan berupa 4 perlakuan dengan pemberian sumber karbon eksternal serta 1 perlakuan tanpa pemberian sumber karbon eksternal sebagai kontrolserta 4 ulangan. Penambahan sumber karbon eksternal dilakukan secara langsung ke dalam akuarium pemeliharaan udang dan diberikan sebanyak 1 kali dalam sehari dengan waktu 2 jam setelah pemberian pakan pagi.
Prosedur Penambahan Sumber Karbon Eksternal
Udang hanya memanfaatkan 10% nitrogen dalam pakan sedang sisanya diekskresi berupa sebagai NH
4 atau sebagai N organik yang terdapat dalam feses
dan residu pakan (Ebeling et al. 2006). Efisiensi konversi mikroba diasumsikan 40 - 60%, sehingga jumlah nitrogen yang terbuang dalam perairan dapat dihitung berdasarkan dari jumlah pakan, kandungan %N dalam pakan serta %N yang di ekskresi. Jumlah karbon yang harus ditambahkan untuk mendukung proses pertumbuhan bakteri dihitung dengan rumus (Avnimelech 1999) sebagai berikut :
Keterangan :
11 %N ekskresi : Kandungan nitrogen yang dibuang oleh ikan atau udang.
[C/N]mic : C/N rasio bakteri.
%C : Kandungan karbon dalam pakan dan sumber karbon tambahan. E : efisiensi konversi mikroba.
Sumber karbon yang digunakan sebagai perlakuan terlebih dahulu dilakukan uji proksimat. Hasil dari uji proksimat dari sumber karbon dapat dilihat pada Tabel 5.
Tabel 5 Hasil uji proksimat molase, tapioka, dedak dan onggok sebagai sumber karbon pada budidaya udang vaname dengan sistem BFT
Kode dilakukan dengan menggunakan metode Walkley and Black (1934).
C - org metode Walkley and Black
Prinsip dari uji ini adalah berdasarkan jumlah bahan organik yang mudah teroksidasi mereduksi Cr2O72+yang berlebihan. Reaksi ini berjalan dengan energi
yang dihasilkan dari pencampuran dua bagian H2SO4 pa (pekat) dengan satu bagian
K2Cr2O7 N. Sisa Cr2O7 dapat diketahui dari hasil titrasi dengan FeSO4 yang diketahui
normalitasnya. Feroin 0,025 M sebagai penunjuk titik akhir merah anggur (Page, 1982).
Hasil dari uji kandungan C organik yang terdapat dalam sumber karbon yang digunakan sebagai perlakuan dapat dilihat pada Tabel 6.
Tabel 6 Hasil uji kandungan C organik molase, tapioka, dedak dan onggok sebagai sumber karbon pada budidaya udang vaname dengan sistem BFT (%Berat Basah)
Kode sampel Kadar Air (%) Pengabuan C-Organik (%)
12
Profil Bioflok
Profil bioflok pada air media pemeliharaan dilakukan dengan cara pengamatan dibawah mikroskop dengan perbesaran 100x dan 400x. Sampel yang diperiksa diambil langsung dari media pemeliharaan dan langsung dilakukan pengamatan.
Identifikasi Bakteri Bioflok
Proses identifikasi flok dilakukan dengan pengamatan morfologi, fisiologi dan biokimia yang terdapat pada media air pemeliharaan dari udang vaname. Pengamatan morfologi, fisiologi dan biokimia dilakukan dengan menggunakan uji oxidatif/ fermentatif, uji motilitas, uji oksidase serta uji katalase (Bergey et al. 1993).
Uji Oxidatif/ Fermentatif
Uji Oxidatif/ Fermentatif dilakukan untuk pengujian fisio metabolisme suatu bakteri yakni untuk mengetahui kemampuan memecah karbohidrat (glukosa) dalam suasana aerobik (oksidatif) atau anaerobik (fermentatif). Alat yang digunakan dalam uji oxidative/ fermentatif ini antara lain Jarum ose, botol semprot, bunsen, inkubator, alkohol 70% serta kamera. Sedangkan bahan yang digunakan dalam uji oxidatif/ fermentatif ini adalah biakan bakteri yang berumur 24 jam dan diperoleh dari air pemeliharaan dari udang vaname (di dalam tabung media agar miring) serta O/F media.
Uji Motilitas
Uji Motilitas merupakan pengujian fisio-metabolisme suatu bakteri yakni untuk mengetahui kemampuan membentuk indol (produk hasil degradasi protein), ikatan sulfide dan motilitas atau pergerakan bakteri. Alat yang digunakan dalam uji motilitas ini antara lain Jarum ose, botol semprot, bunsen, alkohol 70%, inkubator serta kamera. Sedangkan bahan yang digunakan dalam uji motilitas ini adalah biakan bakteri yang berumur 24 jam dan diperoleh dari media air pemeliharaan dari udang vaname (di dalam tabung media agar miring) serta media SIM (Sulfida Indol Motility).
Uji Oksidase
Uji Oksidase merupakan pengujian untuk mengetahui awal oksidasi suatu substrat enzim oleh jasad renik, hydrogen dipindahkan dari substrat itu oleh enzim khusus yaitu dehidrogenase. Alat yang digunakan dalam uji oksidase ini antara lain Jarum ose, Objek glass, kertas saring, botol semprot, bunsen, inkubator, alkohol 70% serta kamera. Sedangkan bahan yang digunakan untuk uji oksidase adalah p-aminodimethylaniline-oxalat 1%.
Uji Katalase
Uji Katalase merupakan pengujian untuk mengetahui ada tidaknya enzim katalase. Enzim tersebut merupakan katalisator dalam penguraian hydrogen-peroksida (H2O) untuk menghasilkan oksigen dan air. Alat yang digunakan dalam
13 70% serta kamera. Sedangkan bahan yang digunakan untuk uji Katalase adalah Hydrogen-peroksida (H2O2).
Total Presumtive VibrioCount (TVC)
Penghitungan koloni bakteri Vibrio sp. yang terdapat di dalam air pemeliharaan dan usus udang dilakukan pada saat akhir masa pemeliharaan dengan cara mengambil sampel pada air pemeliharaan dan usus udang. Kemudian dihitung dengan menggunakan metode cawan sebar dengan cara terlebih dahulu dilakukan pengenceran berseri pada tingkat pengenceran 10-1, 10-2, 10-3 lalu disebar pada media media TCBS (Thiosulphate Citrate Bile-Salt Sucrose). Setelah disebar pada cawan petri dan diinkubasi selama 24 jam kemudian dilakukan penghitungan jumlah koloni yang terbentuk dengan menggunakan rumus (Madigan et al. 1997):
Keterangan :
Fp = faktor pengenceran.
Total Kelimpahan Bakteri
Penghitungan kelimpahan bakteri yang terdapat di dalam air pemeliharaan serta usus dilakukan pada saat akhir masa pemeliharaan dengan cara mengambil sampel pada air pemeliharaan dan usus udang. Kemudian dihitung dengan menggunakan metode cawan sebar dengan cara terlebih dahulu dilakukan pengenceran berseri pada tingkat pengenceran 10-5, 10-6, 10-7 lalu disebar pada media SWC (Sea water Complete). Setelah disebar pada cawan petri dan diinkubasi selama 24 jam kemudian dilakukan penghitungan jumlah koloni yang terbentuk dengan menggunakan rumus sama seperti pada penghitungan TVC.
Parameter Kualitas Air
Parameter kualitas air yang diukur meliputi TAN (Total ammonia nitrogen), nitrit, nitrat, suhu, pH, DO (Dissolved oxygen), alkalinitas, BOD (Biological oxygen demand), TSS (Total suspended solids) dan VSS (Volatile suspended solids). Pengukuran TAN, nitrit, nitrat, alkalinitas, BOD, TSS dan VSS dilakukan setiap 1 minggu sekali setelah sampling. Sedang suhu dan DO dilakukan 1 kali dalam sehari yaitu setiap sore. Parameter kualitas air berupa TAN, nitrit dan nitrat diukur dengan menggunakan alat spektrofotometer. Parameter alkalinitas diukur dengan metode titrasi. Parameter BOD diukur dengan menggunakan alat DO meter, TSS (Total suspended solid) diukur dengan menggunakan metode centrifugasi. Untuk VSS (Volatile Suspended solid) ditentukan oleh substraksi abu dengan berat padatan tersuspensi. Metode pengukuran kualitas air didasarkan pada pustaka acuan APHA (1989).
14
Parameter yang dihitung dalam penelitian ini meliputi laju pertumbuhan spesifik, konversi pakan, tingkat kelangsungan hidup dan bobot rata-rata. Untuk mengetahui laju pertumbuhan spesifik, konversi pakan, tingkat kelangsungan hidup dan bobot rata-rata maka dilakukan dengan cara sampling. Sampling dilakukan setiap 7 hari sekali.
Pertumbuhan Spesifik (Specific Growth Rate/ SGR)
Laju pertumbuhan spesifik adalah persentase pertambahan berat udang setiap harinya selama pemeliharaan. Laju pertumbuhan spesifik udang dihitung dengan menggunakan rumus (Huisman 1987) sebagai berikut :
Keterangan :
SGR : Laju pertumbuhan spesifik
Wo : Bobot tubuh pada awal pertumbuhan (Gram)
Wt : Bobot tubuh pada akhir pertumbuhan (Gram)
t : Waktu pemeliharaan (Hari)
Konversi Pakan (Food Conversion Ratio/ FCR)
Rata-rata konversi pakan dihitung dengan menggunakan rumus (Tacon 1987) sebagai berikut :
Keterangan :
FCR : Konversi pakan
∑Pakan : Jumlah pakan yang diberikan (G)
ΔBiomassa : Selisih biomassa ikan pada awal dan akhir pemeliharaan (G)
Tingkat Kelangsungan Hidup (Sintasan/ SR)
Tingkat kelangsungan hidup adalah persentase udang yang hidup dari jumlah seluruh udang yang dipelihara dalam suatu wadah atau perbandingan antara jumlah udang yang hidup pada saat tebar serta pada saat akhir masa pemeliharaan. Tingkat kelangsungan hidup dapat dihitung dengan menggunakan rumus (Effendi 2004) sebagai berikut :
Keterangan:
SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah udang yang hidup di akhir pemeliharaan (ekor)
15 Analisa Data
Penelitian ini dirancang dengan menggunakan Rancangan acak lengkap (RAL) dengan 5 perlakuan dan 4 ulangan. Data yang diperoleh dianalisa dengan menggunakan One way analysis of variance dengan selang kepercayaan 95%. Untuk melihat perbedaan perlakuan maka dilanjutkan dengan menggunakan uji Tukey.
HASIL
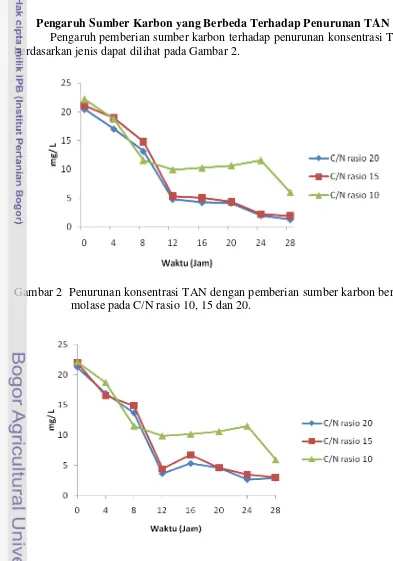
Pengaruh Sumber Karbon yang Berbeda Terhadap Penurunan TAN Pengaruh pemberian sumber karbon terhadap penurunan konsentrasi TAN berdasarkan jenis dapat dilihat pada Gambar 2.
16
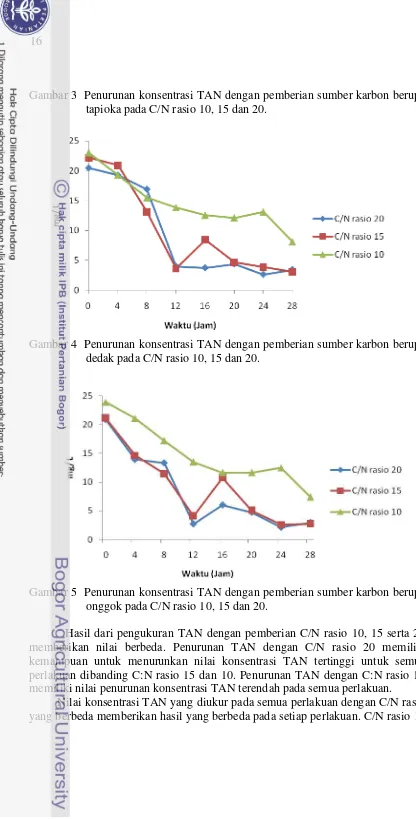
Gambar 3 Penurunan konsentrasi TAN dengan pemberian sumber karbon berupa tapioka pada C/N rasio 10, 15 dan 20.
Gambar 4 Penurunan konsentrasi TAN dengan pemberian sumber karbon berupa dedak pada C/N rasio 10, 15 dan 20.
Gambar 5 Penurunan konsentrasi TAN dengan pemberian sumber karbon berupa onggok pada C/N rasio 10, 15 dan 20.
Hasil dari pengukuran TAN dengan pemberian C/N rasio 10, 15 serta 20 memberikan nilai berbeda. Penurunan TAN dengan C/N rasio 20 memiliki kemampuan untuk menurunkan nilai konsentrasi TAN tertinggi untuk semua perlakuan dibanding C:N rasio 15 dan 10. Penurunan TAN dengan C:N rasio 10 memiliki nilai penurunan konsentrasi TAN terendah pada semua perlakuan.
17 memberikan pengaruh yang tidak berbeda nyata diantara semua perlakuan. Molase dan tapioka mampu menurunkan nilai konsentrasi hingga 11, 54 mg/ L setelah 24 jam diikuti dedak (13.12 mg/ L) dan onggok (12.51 mg/ L). C/N rasio 15 memberikan hasil yang tidak berbeda nyata pada semua perlakuan. Molase mampu menurunkan nilai konsentrasi TAN hingga 2.14 mg/ L setelah 24 jam diikuti tapioka (3.51 mg/ L), dedak (3.88 mg/ L) serta onggok (2.60 mg/ L). C/N rasio 20 memberikan pengaruh yang berbeda nyata antara perlakuan molase dengan perlakuan lainnya. Molase mampu menurunkan nilai konsentrasi TAN hingga 1.98 mg/ L setelah 24 jam. Tapioka mampu menurunkan nilai konsentrasi TAN hingga 2.64 mg/ L diikuti onggok (2.12 mg/ L) dan dedak 2.62 mg/ L).
Laju penurunan Nilai konsentrasi TAN berbeda pada perlakuan C/N rasio 10, 15 dan 20. Laju penurunan nilai konsentrasi TAN pada C/N rasio 15 dan 20 secara drastis terjadi setelah 4 jam sampai 12 jam. Laju penurunan nilai konsentrasi TAN pada C/N rasio 10 menurun secara bertahap yang dimulai dari awal hingga 24 jam.
Hasil persentase reduksi penurunan konsentrasi TAN berdasarkan bahan sumber karbon dan nisbah C/N dengan analisa statistik terdapat pada Tabel 7. Tabel 7 Persentase reduksi konsentrasi TAN berdasarkan bahan sumber karbon
dan C/N rasio yang digunakan
Sumber karbon Reduksi TAN (%)
C/N10 C/N15 C/N 20
Simbol yang berbeda menandakan nilai pada baris yang sama berbeda nyata (P<0.05). Huruf yang berbeda menandakan nilai pada kolom yang sama berbeda nyata (P<0.05).
Analisa statistik diatas berdasarkan dari huruf diperoleh hasil bahwa penggunaan sumber karbon yang berbeda dengan C/N rasio 10 memiliki pengaruh yang tidak berbeda nyata (P>0.05) diantara semua perlakuan sumber karbon. Pada C/N rasio 15, penggunaan sumber kabon molase memilik pengaruh yang berbeda nyata (P<0.05) dengan sumber kabon onggok dan dedak namun memiliki pengaruh yang tidak berbeda nyata (P>0.05) dengan perlakuan sumber karbon tapioka. Pada C/N rasio 20, oenggunaan sumber karbon molase memiliki pengaruh yang berbeda nyata (P<0.05) dengan sumber karbon tapioka, onggok dan dedak dengan penggunaan C/N rasio 20.
Analisa statistik bersarkan dari simbol diperoleh hasil pada semua perlakuan dengan menggunakan sumber karbon yang berbeda (molase, tapioka, onggok dan dedak) memiliki pengaruh yang berbeda nyata (P<0.05) antara C/N rasio 10 dengan C/N rasio 15 dan 20 namun memberikan pengaruh yang tidak berbeda nyata (P>0.05) antara C/N rasio 15 dan 20.
18
A
A
digunakan untuk penelitian tahap kedua karena lebih efisien dibanding dengan C/N rasio 20.
Parameter kualitas air yang diukur pada penelitian tahap satu berupa pH, suhu DO dan salinitas disajikan pada Tabel 8.
Tabel 8 Kisaran parameter kualitas air pada media percobaan air laut
Kualitas air Pelakuan
Molase Tapioka Dedak Onggok
Suhu 26.2 - 27.6 26.2 - 27.1 26.4 - 27.5 26.1 - 27.7 DO 4.9 - 5.9 4.9 - 5.8 5.0 - 5.8 4.9 - 5.8 pH 7.91 - 8.56 8.32 - 8.56 8.25 - 8.52 8.36 - 8.59 Salinitas 30.0 - 30.6 30.1 - 30.5 30.0 - 30.6 30.0 - 30.6
Pengukuran kualitas air dilakukan pada pagi hari dan sore hari. Hasil pengukuran menunjukkan nilai kualitas air pada semua perlakuan masih dalam kondisi optimal yang digunakan dalam budidaya udang vaname.
Pengaruh Sumber Karbon yang Berbeda Terhadap Profil Bioflok, Kualitas Air dan Kinerja Pertumbuhan Udang Vaname
Profil Bioflok
Profil bioflok dari pengamatan yang dilakukan diperoleh hasil berupa mikrograf bioflok dan identifikasi bakteri pembentuk bioflok. Gambar mikrograf bioflok yang diambil dari media pemeliharaan udang vaname dengan sumber karbon yang berbeda dilakukan dengan menggunakan mikroskop perbesaran 100x dan 400x terdapat pada Gambar 6 dan 7.
A B
19 Gambar 6 Mikrograf bioflok yang diambil dari media pemeliharaan udang
vaname pada sistem bioflok dengan sumber karbon berbeda A) Molase; B) Tapioka; C) Dedak; dan D) Onggok 9 (Perbesaran 100x).
Gambar 7 Berbagai macam mikroorganisme yang terdapat di dalam bioflok yang diambil dari media pemeliharaan udang vaname pada semua perlakuan dengan sumber karbon A) Cacing; B) Phytolankton; C dan D) Zooplankton (Perbesaran 400x).
Hasil identifikasi bakteri penyusun bioflok yang diperoleh disajikan pada Tabel 9.
Tabel 9 Hasil identifikasi bakteri bioflok yang diambil dari media pemeliharaan udang vaname.
Perlakuan Hasil identifikasi bioflok
Molase Bacillus, Alcaligenes, Kurthia Tapioka Bacillus, Actinobacter Dedak Bacillus, Eikenella
Onggok Bacillus, Actinobacter, Actinobacillus, Enterobacteria
Berdasarkan dari hasil identifikasi, secara umum diperoleh bakteri yang dominan yang terdapat pada semua perlakuan berasal dari kelompok genus Bacillus. Kelompok bakteri dari genus Acinetobacter ditemukan pada perlakuan tapioka dan onggok.
Jumlah Total Bakteri dan Total Presumptive Vibrio Count
C
D
A B
20
Hasil penghitungan total bakteri dan total presumptive vibrio di dalam air dan usus udang terdapat pada Gambar 8.
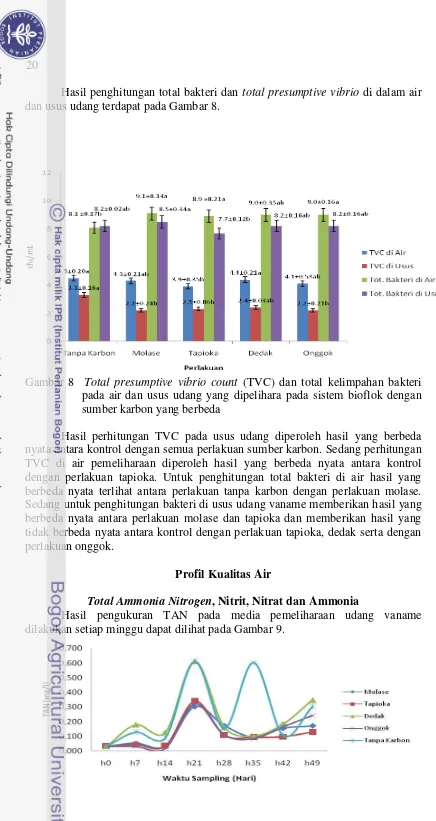
Gambar 8 Total presumptive vibrio count (TVC) dan total kelimpahan bakteri pada air dan usus udang yang dipelihara pada sistem bioflok dengan sumber karbon yang berbeda
Hasil perhitungan TVC pada usus udang diperoleh hasil yang berbeda nyata antara kontrol dengan semua perlakuan sumber karbon. Sedang perhitungan TVC di air pemeliharaan diperoleh hasil yang berbeda nyata antara kontrol dengan perlakuan tapioka. Untuk penghitungan total bakteri di air hasil yang berbeda nyata terlihat antara perlakuan tanpa karbon dengan perlakuan molase. Sedang untuk penghitungan bakteri di usus udang vaname memberikan hasil yang berbeda nyata antara perlakuan molase dan tapioka dan memberikan hasil yang tidak berbeda nyata antara kontrol dengan perlakuan tapioka, dedak serta dengan perlakuan onggok.
Profil Kualitas Air
Total Ammonia Nitrogen, Nitrit, Nitrat dan Ammonia
21
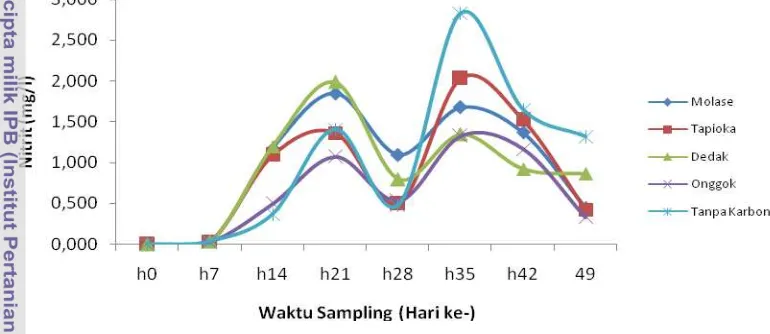
Gambar 9 TAN pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon berbeda.
Konsentrasi TAN pada media pemeliharaan fluktuatif sampai akhir masa pemeliharaan. Konsentrasi TAN tertinggi terjadi pada hari ke-21 untuk semua perlakuan dan diikuti pula oleh konsentrasi Nitrit yang tinggi.
Hasil pengukuran nitrit (NO2--N) pada media pemeliharaan udang vaname
dilakukan setiap minggu dapat dilihat pada Gambar 10.
Gambar 10 NO2--N pada media pemeliharaan udang vaname dengan sistem
bioflok menggunakan sumber karbon berbeda.
Hasil pengukuran nitrat (NO3--N) pada media pemeliharaan udang vaname
dilakukan setiap minggu dapat dilihat pada Gambar 11.
Gambar 11 NO3--N pada media pemeliharaan udang vaname dengan sistem
22
Konsentrasi nitrit serta nitrat selama masa pemeliharaan fluktuatif. Akan tetapi nilai konsentrasi nitrit cenderung menurun pada masa akhir pemeliharaan untuk kontrol maupun perlakuan. Sedangkan nilai konsentrasi nitrat cenderung naik untuk semua perlakuan pada masa akhir pemeliharaan kecuali pada kontrol.
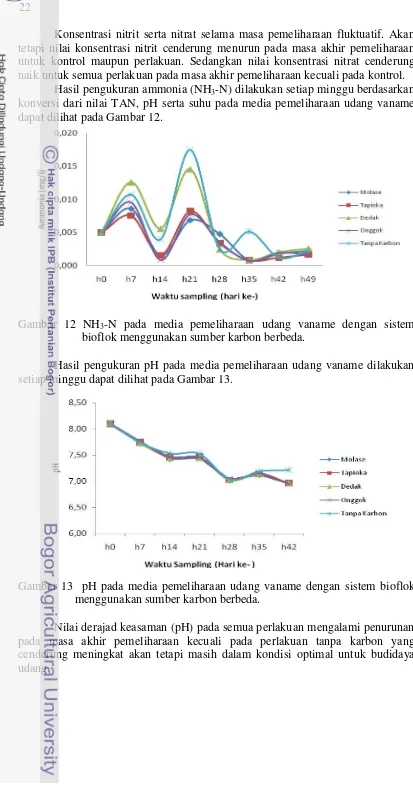
Hasil pengukuran ammonia (NH3-N) dilakukan setiap minggu berdasarkan
konversi dari nilai TAN, pH serta suhu pada media pemeliharaan udang vaname dapat dilihat pada Gambar 12.
Gambar 12 NH3-N pada media pemeliharaan udang vaname dengan sistem
bioflok menggunakan sumber karbon berbeda.
Hasil pengukuran pH pada media pemeliharaan udang vaname dilakukan setiap minggu dapat dilihat pada Gambar 13.
Gambar 13 pH pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon berbeda.
23 Hasil pengukuran DO pada media pemeliharaan udang vaname dilakukan setiap minggu dapat dilihat pada Gambar 14.
Gambar 14 DO pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon berbeda.
Nilai konsentrasi oksigen terlarut hanya mengalami penurunan pada hari ke-7 dan cenderung stabil sampai akhir masa pemeliharaan pada semua perlakuan.
TSS, VSS dan Volume Flok
Hasil dari pengukuran TSS (Total Suspended Solid) pada media pemeliharaan udang vaname dilakukan setiap minggu dapat dilihat pada Gambar 15.
Gambar 15 TSS pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon yang berbeda.
24
Hasil dari pengukuran VSS (Volatile Suspended Solid) pada media pemeliharaan udang vaname dilakukan setiap minggu dapat dilihat pada Gambar 16.
Gambar 16 VSS pada media pemeliharaan udang vaname dengan sistem bioflok menggunakan sumber karbon berbeda.
Nilai TSS (Total suspended solid) serta VSS (Volatile suspended solid) yang diperoleh selama masa pemeliharaan menunjukkan nilai konsentrasi yang semakin meningkat pada masa akhir pemeliharaan.
Hasil pengukuran dari volume flok selama masa pemeliharaan udang vaname dapat dilihat pada Gambar 17.
25 Volume flok pada semua perlakuan meningkat hingga akhir masa pemeliharaan udang vaname.
Hasil pengukuran parameter kualitas air pada media pemeliharaan udang vaname selama masa pemeliharaan berupa suhu, DO, pH, salinitas, alkalinitas serta BOD pada media pemeliharaan udang vaname dapat dilihat pada Tabel 10.
Tabel 10 Kisaran parameter kualitas air berupa suhu, DO (Dissolved Oxygen), pH, salinitas, alkalinitas serta BOD (Biological Oxygen Demand) pada media pemeliharaan udang vaname yang dipelihara.
Kualitas air Perlakuan
Kontrol Molase Tapioka Dedak Onggok
Suhu (oC)
Laju Pertumbuhan Spesifik, Konversi Pakan, Tingkat Kelangsungan Hidup dan Bobot Rata-Rata
Laju pertumbuhan spesifik dari udang vaname selama masa pemeliharaan dapat dilihat pada Gambar 18.
26
Laju pertumbuhan spesifik (SGR) dari udang vaname selama masa pemeliharaan menunjukkan pengaruh yang tidak berbeda nyata antara perlakuan tanpa karbon dengan semua perlakuan.
Konversi pakan (FCR) yang diperoleh selama masa pemeliharaan dapat dilihat pada Gambar 19.
Gambar 19 Konversi pakan udang vaname yang dipelihara dengan sistem BFT dengan sumber karbon yang berbeda.
Konversi pakan pada perlakuan tanpa karbon memiliki nilai tertinggi diantara semua perlakuan. Perlakuan tanpa karbon (1.67±0.10) berbeda nyata dengan perlakuan tapioka (1.41±0.13) dan onggok (1.44±0.13).
Tingkat kelangsungan hidup dari udang vaname selama masa pemeliharaan dapat dilihat pada Gambar 20.
Gambar 20 Tingkat kelangsungan hidup udang vaname yang dipelihara dengan sistem BFT dengan sumber karbon yang berbeda.
27 Bobot rata-rata (ABW) dari udang vaname selama masa pemeliharaan dapat dilihat pada Gambar 21.
Gambar 21 Bobot rata-rata dari udang vaname yang dipelihara dengan sistem BFT dengan sumber karbon yang berbeda.
Bobot rata-rata dari udang vaname selama masa pemeliharaan menunjukkan pengaruh yang tidak berbeda nyata antara perlakuan tanpa karbon dengan semua perlakuan karbon.
PEMBAHASAN
Pengukuran TAN dengan C/N rasio yang berbeda memberikan nilai yang berbeda pula dimana C/N rasio 20 memiliki pengaruh yang tidak berbeda nyata dengan C/N rasio 15 namun memiliki pengaruh yang berbeda nyata dengan C/N rasio 10 pada semua perlakuan sumber karbon. C/N rasio 20 memiliki kemampuan paling tinggi dalam menurunkan nilai konsentrasi nitrogen yang terdapat di dalam perairan dibandingkan dengan C/N rasio 10 namun memiliki hasil yang tidak berbeda nyata dengan C/N rasio 15. Dengan penggunaan C/N rasio yang tinggi pada perairan, maka akan menyediakan sumber karbon yang mencukupi dimana bakteri akan memanfaatkan sumber karbon yang melimpah sebagai energi untuk mengasimilasi nitrogen menjadi massa bakteri. Selain itu penggunaan jenis sumber karbon yang berbeda memberikan hasil yang berbeda pula dalam pembentukan komposisi flok. Avnimelech et al. (2009) menyatakan bahwa penggunaan jenis sumber karbon yang berbeda akan memberikan hasil yang berbeda dimana komposisi flok bisa sangat berbeda tergantung pada substrat karbon yang digunakan untuk menumbuhkan flok.
28
gula sederhana sehingga dapat dengan mudah dimanfaatkan oleh koloni bakteri untuk mempercepat pertumbuhan. Dedak dan onggok merupakan karbon kompleks sehingga perlu waktu untuk bakteri dalam mencernanya serta memanfaatkannya sebagai sumber energi. Kemampuan bakteri untuk dapat mengurangi nitrogen anorganik dalam lingkungan budidaya dan memproduksi protein mikrobial tergantung pada koefisien konversi mikroba, C/N rasio, biomassa bakteri, serta kandungan karbon dari bahan yang ditambahkan (Avnimelech 1999).
Bioflok merupakan campuran heterogen dari mikroorganisme, partikel, koloid, polimer organik, kation dan sel mati (De Schryver et al. 2008). Berdasarkan pengamatan yang dilakukan pada semua perlakuan bioflok, ditemukan beberapa mikroorganisme yang menjadi penyusun bioflok antara lain cacing, zooplankton, phytoplankton serta protozoa. Bakteri heterotrof merupakan salah satu pembentuk komunitas biofloc yang paling dominan selain fitoplankton, kumpulan bahan organik hidup dan mati dan pemakan bakteri (Hargreaves 2006). Hasil identifikasi bakteri dari semua perlakuan dengan sumber karbon yang berbeda menghasilkan beberapa genus bakteri yang berbeda antara lain dari genus Alcaligenes, Acinetobacter, Actinobacillus, Bacillus, Enterobacteria, Eikenella serta Kurthia yang semuanya masuk dalam golongan bakteri heterotrof. Bacillus merupakan genus bakteri yang ditemukan pada semua perlakuan. Bakteri heterotrof akan tumbuh maksimal melalui peningkatan rasio C/N dengan menambahkan sumber karbon organik secara kontinu seperti molase, tepung terigu dan tepung tapioka (Avnimelech 1999).
Perhitungan bakteri vibrio yang terdapat pada air pemeliharaan atau usus udang menunjukkan bahwa jumlah bakteri yang terdapat pada kontrol memiliki jumlah yang lebih tinggi dibanding semua perlakuan bioflok. Hal ini menunjukkan bahwa bakteri dari bioflok mampu menekan pertumbuhan bakteri Vibrio spp. yang terdapat di media pemeliharaan maupun yang terdapat di dalam usus udang. Vibrio spp. merupakan jenis bakteri yang umum ditemukan dalam budidaya udang windu maupun vaname. Jumlah bakteri Vibrio spp. yang meningkat di perairan disebabkan oleh tingginya bahan organik serta menurunnya kualitas air dari budidaya. Efek dari peningkatan bakteri Vibrio spp. pada perairan diduga dapat meningkatkan peluang penyakit vibriosis. Vibriosis adalah penyakit bakterial pada udang penaeid, dan Vibrio spp. merupakan agen penyakit ini. Vibriosis juga terlibat sebagai penyebab kematian tinggi dalam udang penaeid juvenil seluruh dunia (Castex et al. 2010). Dengan adanya bakteri bioflok diharapkan dapat menekan pertumbuhan dari bakteri Vibrio yang terdapat pada perairan serta usus udang.
29 TSS pada media air pemeliharaan udang vaname berkisar antara 50 sampai 300 mg/ L sesuai dengan teknologi akuakultur berbasis bioflok dimana TSS yang dianjurkan berkisar 200 sampai 1000 mg/L (De Schryver et al. 2008). VSS merupakan parameter yang penting dalam sistem budidaya dengan menggunakan sistem bioflok meskipun belum ada data mengenai kisaran yang dianjurkan pada budidaya yang berbasis bioflok (De Schryver et al. 2008). Meningkatnya nilai TSS dan VSS ini berkaitan dengan jumlah bakteri total yang terdapat dalam perairan.
Volume flok dari semua perlakuan menunjukkan nilai yang cenderung meningkat sampai akhir masa pemeliharaan untuk semua perlakuan baik dengan penambahan sumber karbon maupun pada kontrol. Selama pemeliharaan udang vaname, pergantian air dilakukan pada kontrol setiap seminggu sebanyak 50 %, sedangkan pada perlakuan dengan sistem bioflok tidak dilakukan pergantian air sama sekali hanya dilakukan penambahan air untuk menggantikan air yang hilang akibat proses evaporasi. Pada perlakuan kontrol terdapat bioflok meskipun telah dilakukan penyiponan sebanyak 50% menandakan bahwa perlakuan kontrol pun terjadi proses pembentukan flok. Volume flok merupakan salah satu indikator terjadinya flokulasi pada media pemeliharaan.
Parameter kualitas air meliputi suhu, DO dan salinitas cenderung stabil hingga masa akhir pemeliharaan dan masih berada dalam kisaran normal untuk pertumbuhan udang vaname. Nilai BOD cenderung naik pada akhir masa pemeliharaan. Sedangkan pH dan alkanitas cenderung menurun pada akhir masa budidaya. Kenaikan nilai konsentrasi BOD berkaitan dengan melimpahnya mikroorganisme yang terdapat pada media pemeliharaan. Sedang menurunnya konsentrasi pH dan alkalinitas dapat disebabkan oleh adanya proses nitrifikasi (Avnimelech et al. 2009). Alkalinitas pada media budidaya harus diatas 50 mg sebagai CaCO3/l dan nilai pH berkisar 7 sampai 9. Alkalinitas dan pH biasanya
stabil pada kolam BFT meskipun pengalaman menunjukkan bahwa ada kebutuhan untuk menambah alkalinitas dalam kasus kepadatan tebar tinggi (Ray et al. 2009; Wasielesky et al. 2006). Peranan penting alkalinitas antara lain menekan fluktuasi pH dan penentu kesuburan alami perairan. Penurunan alkalinitas di media pemeliharaan udang vaname dapat disebabkan oleh bakteri autotrof yang memanfaatkan alkalinitas pada saat proses nitrifikasi serta oleh bakteri hetrotrof meskipun jumlahnya lebih sedikit (Ebeling et al. 2006).
Konversi pakan kontrol lebih tinggi dengan semua perlakuan terutama dengan sumber karbon tapioka (1.41±0.13) dan onggok (1.44±0.13). Burford et al. (2004) melaporkan bahwa hingga 29% dari asupan pakan harian Litopenaeus vannamei berasal dari bakteri alga/ bakteri flok yang berasal dari sistem budidaya heterotrof. Biomassa bakteri heterotrof dapat membentuk agregat (flok) bersama dengan mikroba lain, yang selanjutnya dapat dimanfaatkan oleh organime budidaya (De Schryver et al. 2008). Pada beberapa spesies lain yang dibudidayakan memberikan hasil dimana bioflok dapat digunakan sebagai sumber pakan alami yang memiliki kandungan protein 37-38% (Azim and Little 2008).
30
berbagai macam bakteri pada air media pemeliharaan yang di duga akan berkompetisi dengan bakteri lainnya yang bersifat patogen pada udang.
Parameter kualitas air dari media pemeliharaan pada semua perlakuan memberikan hasil yang lebih baik dibanding dengan kontrol dalam menurunkan konsentrasi TAN dan ammonia yang terdapat di air pemeliharaan meskipun pada perlakuan kontrol kualitas air tetap dijaga dengan cara siphon dan mengganti air sebanyak 50% setiap 1 minggu.
Parameter produksi menunjukkan bahwa perlakuan dengan penambahan sumber karbon menunjukkan nilai yang berbeda nyata dibandingkan dengan kontrol pada FCR dan sintasan meskipun SGR serta ABW tidak berbeda nyata pada perlakuan serta kontrol. Rendahnya nilai FCR pada semua perlakuan di duga karena adanya pemanfaatan pakan alami yang terdapat pada flok. Sintasan yang tinggi pada semua perlakuan dibanding dengan kontrol diduga karena adanya bermacam bakteri yang tumbuh dan mampu berkompetisi dengan bakteri patogen pada udang vaname antara lain bakteri Vibrio spp. Biomassa udang vaname pada perlakuan onggok setelah panen memiliki hasil tertinggi yaitu sebesar 202.16 gr dan diikuti oleh perlakuan tapioka yang memiliki biomassa sebesar 201.50 gr, perlakuan dedak (191.36 gr), perlakuan molase (188.76 gr) serta perlakuan tanpa karbon (178.50 gr). Berdasarkan dari harga, sumber karbon onggok memiliki harga termurah yaitu sebesar Rp. 3000/ kg, diikuti oleh dedak sebesar Rp. 4500/ kg, molase (Rp. 5000/ kg) serta perlakuan tapioka (Rp. 7500/ kg). Berdasarkan ketersediannya, sumber karbon yang digunakan banyak ditemukan di pasaran.
SIMPULAN
Simpulan
Berdasarkan penelitian di dapatkan :
1. C/N rasio 15 dan 20 merupakan C/N rasio yang terbaik dalam menurunkan konsentrasi TAN pada media. C/N rasio 15 disarankan untuk digunakan karena lebih efisien dibanding dengan C/N rasio 20.
2. Sumber karbon dalam BFT memiliki kemampuan dalam memperbaiki kualitas air terutama dalam menurunkan TAN yang terdapat pada media pemeliharaan udang vaname serta peforma udang terutama SR.
3. Onggok merupakan sumber karbon yang terbaik dalam mempertahankan kualitas air terutama TAN dan nitrit serta memberikan hasil produksi tertinggi dibanding dengan sumber karbon yang lainnya berdasarkan pada biomassa serta harga.
DAFTAR PUSTAKA