IDENTIFIKASI PEPTIDA GURIH DAN SENYAWA BERNITROGEN
SERTA KARAKTERISASI SENSORI SENYAWA
BERNITROGEN YANG BERKONTRIBUSI TERHADAP RASA
GURIH EKSTRAK IKAN ASIN JAMBAL ROTI
SOFHIANI DEWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Identifikasi Peptida Gurih dan Senyawa Bernitrogen serta Karakterisasi Sensori Senyawa Bernitrogen yang Berkontribusi terhadap Rasa Gurih Ekstrak Ikan Asin Jambal Roti adalah karya saya sendiri dibawah bimbingan Dr. Ir. Anton Apriyantono, M.S dan Dr. Ir. Feri Kusnandar M.Sc. Tesis ini belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, November 2005
ABSTRAK
SOFHIANI DEWI. Identifikasi Peptida Gurih dan Senyawa Bernitrogen serta Karakterisasi Sensori Senyawa Bernitrogen yang Berkontribusi terhadap Rasa Gurih Ekstrak Ikan Asin Jambal Roti. Dibimbing oleh ANTON APRIYANTONO dan FERI KUSNANDAR.
Ekstrak air ikan asin jambal roti yang mengandung peptida berberat molekul rendah (dibawah 1000 Da) hasil ultrafiltrasi dengan MWCO 1000 Da, telah difraksinasi dengan Sephadex G-10 dan menghasilkan 5 fraksi ekstrak ikan asin jambal roti yang mempunyai rasa gurih, khususnya fraksi 1. Penelitian ini bertujuan untuk mengetahui jenis peptida serta peranan senyawa-senyawa bernitrogen yang terdapat pada masing-masing fraksi terhadap pembentukan rasa gurih ekstrak ikan asin jambal roti.
Identifikasi peptida dilakukan menggunakan LC-MS/MS terhadap Fraksi 1, 3, 4 dan 5. Fraksi 2 tidak dianalisa karena merupakan fraksi garam. Sebelum identifikasi dengan LC-MS/MS, Fraksi 1 difraksinasi menggunakan SPE (Solid Phase Extraction) dengan fase diam C-18 sehingga menghasilkan 9 fraksi (Fraksi Tidak Tertahan (FTT), F-A, F-B, F-C, F-D, F-E, F-G, dan F-H) yang berbeda tingkat kepolarannya. Fraksi 2, 3, 4 dan 5 langsung dianalisa. Identifikasi senyawa bernitrogen dilakukan menggunakan Capillary Electrophoresis (CE) terhadap kelima fraksi. Pada senyawa yang teridentifikasi dilakukan karakterisasi sensori oleh 10-11 orang panelis terlatih menggunakan uji skoring rasa gurih dan asin dengan skala 0-150. Pengujian dilakukan menggunakan omission test terhadap 3 model dasar yaitu (1) larutan MSG 4 mM, (2) larutan NaCl 80 mM dan (3) campuran MSG 4 mM dan NaCl 80 mM.
Identifikasi LC-MS/MS menunjukkan bahwa pada Fraksi 1 terdapat peptida yang mengandung L-Glutamat (Glu) dan L-Aspartat (Asp) yaitu peptida yang terdapat pada FTT (BM 375.1 Da) dan F-A (BM 444.1 Da). Peptida lainnya adalah peptida yang hanya mengandung Glu yaitu pada Fraksi 1 [ F-B (BM 465.1), F-E (BM 364.0) dan F-G (BM 365.0)], Fraksi 3 (BM 473.6 dan 378.5) dan Fraksi 5 (BM 377.9). Peptida-peptida ini diduga berkontribusi terhadap pembentukan rasa gurih ekstrak ikan asin jambal roti.
Berdasarkan hasil CE, Fraksi 1 mengandung L-Histidin (His) dan dipeptida anserin/karnosin. Pada Fraksi 2 terdapat kreatinin dan L-Fenilalanin (Phe), sedangkan pada Fraksi 4 terdapat L-Tirosin (Tyr), Phe dan kreatinin. Adapun Fraksi 5 mengandung Phe dan L-Triptofan (Trp). Hasil uji sensori menunjukkan bahwa campuran kreatinin, Phe dan Tyr pada konsentrasi di bawah nilai threshold-nya (1.5 mM) berpengaruh terhadap peningkatan rasa gurih campuran MSG dan NaCl. Kreatinin berperan terhadap peningkatan rasa gurih campuran MSG, Tyr dan Phe. Sedangkan Phe berpengaruh terhadap peningkatan rasa gurih campuran NaCl, Tyr, kreatinin dan campuran MSG, NaCl, Tyr, kreatinin. Campuran Phe (1 mM) dan Trp (1 mM) tidak berpengaruh terhadap rasa gurih dan asin larutan MSG, NaCl dan campurannya.
IDENTIFIKASI PEPTIDA GURIH DAN SENYAWA BERNITROGEN
SERTA KARAKTERISASI SENSORI SENYAWA BERNITROGEN
YANG BERKONTRIBUSI TERHADAP RASA GURIH
EKSTRAK IKAN ASIN JAMBAL ROTI
SOFHIANI DEWI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi Peptida Gurih dan Senyawa Bernitrogen serta Karakterisasi Sensori Senyawa Bernitrogen yang Berkontribusi terhadap Rasa Gurih Ekstrak Ikan Asin Jambal Roti
Nama : Sofhiani Dewi
NRP : F251020161
Disetujui
Komisi Pembimbing
Dr. Ir. Anton Apriyantono, M.S. Dr. Ir. Feri Kusnandar, M.Sc Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, M.S. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunianya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2004 ini adalah identifikasi peptida gurih, dengan judul Identifikasi Dan Karakterisasi Peptida Gurih Dari Ekstrak Ikan Asin Jambal Roti.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Anton Apriyantono, M.S. dan Bapak Dr. Ir. Feri Kusnandar, M.Sc. selaku pembimbing, serta Ibu Prof. Dr. Ir. Winiati Puji Rahayu, M.S. selaku dosen penguji yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dr. Diana Hermawati, M.S. beserta staf dari Balai Pengujian Mutu Produk Peternakan atas bantuannya mengijinkan penulis menggunakan alat untuk identifikasi peptida. Ungkapan terima kasih juga disampaikan kepada suami, anak-anak (Dzaky dan Nissa), mama, bapak serta seluruh keluarga tercinta, atas dukungan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, November 2005
RIWAYAT HDUP
Penulis dilahirkan di Cimahi pada tanggal 20 Pebruari 1976 dari ayah K. Surya Permana dan ibu Titi Sumiati. Penulis merupakan putri kedua dari dua bersaudara.
Tahun 1994 penulis lulus dari SMA Negeri 2 Cimahi dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Ujian Masuk Perguruan Tinggi Negeri (UMPTN). Penulis memilih Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian dan lulus pada tahun 1999. Setelah itu, penulis bekerja sebagai Penanggung Jawab Praktikum pada Program Studi Supervisor Jaminan Mutu Pangan (D3), Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pangan IPB hingga tahun 2000. Pada 2002, penulis melanjutkan studi di Sekolah Pascasarjana pada Program Studi Ilmu Pangan dengan biaya sendiri.
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... xii
PENDAHULUAN... 1
TINJAUAN PUSTAKA ... 4
Peptida Pemberi Rasa Gurih ... 4
Sumber Peptida Pemberi Rasa Gurih ... 6
Teknik Isolasi Peptida ... 8
Identifikasi Peptida ... 11
BAHAN DAN METODE ... 17
Bahan dan Alat ... 17
Metode ... 17
PEMBAHASAN ... 23
Identifikasi Peptida... 23
Karakterisasi Sensori (Omission Test) ... 63
SIMPULAN DAN SARAN ... 73
Simpulan ... 73
Saran ... 74
DAFTAR PUSTAKA ... 75
DAFTAR TABEL
Halaman
1 Peptida-peptida yang mempunyai rasa gurih pada pH 6 ... 5
2 Sistem pengacakan sampel pada uji segitiga rasa asam-pahit dan
asin-gurih ... 21
3 Jenis dan konsentrasi larutan sampel untuk uji rangking pada
pelatihan panelis ... 21
4 Senyawa-senyawa yang teridentifikasi dari ekstrak ikan asin jambal
roti dengan menggunakan CE ... 24
5 Ion-ion yang terbentuk sebagai dasar penentuan dugaan kandungan
asam amino peptida yang diduga mempunyai rasa gurih ... 31
6 Berat molekul senyawa dan dugaan kandungan asam amino yang
ada pada FTT Fraksi 1 ulangan 1 dan 2... 36
7 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi A Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2 ... 39
8 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi B Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 42
9 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi C Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 45
10 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi D Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 47
11 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi E Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 49
12 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi F Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
13 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi G Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 53
14 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi H Fraksi 1 ekstrak ikan asin jambal roti ulangan 1
dan 2... 55
15 Berat molekul senyawa dan dugaan kandungan asam amino yang
ada pada Fraksi 3 ekstrak ikan asin jambal roti ulangan 1 dan 2... 58
16 Berat molekul senyawa dan dugaan kandungan asam amino yang
ada pada Fraksi 4 ekstrak ikan asin jambal roti ulangan 1 dan 2... 60
17 Berat molekul senyawa dan dugaan kandungan asam amino yang
ada pada Fraksi 5 ekstrak ikan asin jambal roti ulangan 1 dan 2... 62
DAFTAR GAMBAR
Halaman
1 Skema isolasi peptida pemberi rasa gurih ... 10
2 Skema komponen-komponen utama pada sistem Capillary
Electrophoresis ... 11
3 Skema proses ionisasi elektrospray ... 14
4 Pola fragmentasi peptida (Harrison et al. 2000) ... 15
5 Cara isolasi peptida dari fraksi 1 ekstrak ikan asin jambal roti menggunakan teknik Solid Phase Extraction (SPE) ... 19
6 Electropherogram senyawa standar secara berurutan : kreatinin, karnosin, anserin, arginin, histidin, SI, kreatinin, kreatin, triptofan,
metionin, fenilalanin, tirosine dan hipoksantin ... 23
7 Electropherogram fraksi 1 ekstrak ikan asin jambal roti goreng yang telah difraksinasi menggunakan kromatografi gel, Sephadex G 10 dan spektrum UV masing-masing peak : a) Spektrum UV peak pada waktu retensi 7.849 menit, b) 8.644 menit,c) 21.875 menit ... 25
8 Electropherogram fraksi 2 ekstrak ikan asin jambal roti goreng yang telah difraksinasi menggunakan kromatografi gel, Sephadex G 10 dan spektrum UV masing-masing peak: a) spektrum UV pada waktu retensi 7.026 menit, b) 8.171 menit, c) 22.161 menit ... 27 9 Electropherogram fraksi 3 ekstrak ikan asin jambal roti goreng yang
telah difraksinasi menggunakan kromatografi gel, Sephadex G 10 dan spektrum UV masing-masing peak : a) spektrum UV pada peak dengan waktu retensi 7.028 menit, b) 8.669 menit, c) 20.234 menit, d) 22.034
menit dan d) 22.857 menit... 28 10 Electropherogram fraksi 4 ekstrak ikan asin jambal roti goreng yang
telah difraksinasi menggunakan kromatografi gel, Sephadex G 10 dan spektrum UV masing-masing peak, a: spektrum UV peak dengan waktu retensi 18.942 menit, b) 19.565 menit dan c) 20.560
menit... 29 11 Electropherogram fraksi 5 ekstrak ikan asin jambal roti goreng yang
12 Kromatogram FTT hasil fraksinasi Fraksi 1 ulangan 1ikan asin jambal roti goreng (14 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 35 13 Kromatogram FTT hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal
roti goreng (16.3 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 35
14 Kromatogram Fraksi A hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (23.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit ... 38
15 Kromatogram Fraksi A hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (7.8 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 38
16 Kromatogram Fraksi B hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (16.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 41
17 Kromatogram Fraksi B hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (8 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 41
18 Kromatogram F-C hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (0 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit...
44 19 Kromatogram Fraksi C hasil fraksinasi Fraksi 1 ulangan 2 ikan asin
jambal roti goreng (1.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 44
20 Kromatogram Fraksi D hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (2.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 46
21 Kromatogram Fraksi D hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (8 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 46
22 Kromatogram Fraksi E hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (7.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 48
23 Kromatogram Fraksi E hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1ml/menit... 48
24 Kromatogram Fraksi F hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (7 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit
... 50
25 Kromatogram Fraksi F hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (3 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 50
26 Kromatogram Fraksi G hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (1 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit 52
27 Kromatogram Fraksi G hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (6 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit 52
28 Kromatogram Fraksi H hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 54
29 Kromatogram Fraksi H hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 54
30 Kromatogram Fraksi 3 ulangan 1 ikan asin jambal roti goreng (2 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 57
31 Kromatogram Fraksi 3 ulangan 2 ikan asin jambal roti goreng (6.2 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 57
32 Kromatogram Fraksi 4 ulangan 1 ikan asin jambal roti goreng menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 59
33 Kromatogram Fraksi 4 ulangan 2 ikan asin jambal roti goreng menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 59
34 Kromatogram Fraksi 5 ulangan 1 ikan asin jambal roti goreng (4.1 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1ml/menit ... 61
35 Kromatogram Fraksi 5 ulangan 2 ikan asin jambal roti goreng (5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit... 61
36 Pengaruh penambahan histidin (His) 1 mM terhadap skor rasa gurih dan asin dari MSG, NaCl dan campuran MSG dan NaCl, oleh 10 panelis terlatih. Skor: 0-150 ... 64
37 Pengaruh penambahan kreatinin (crn) 1.5 mM dan fenilalanin (phe) 1.5 mM terhadap skor rasa gurih dan asin dari MSG (4 mM), NaCl (80 mM) dan campuran keduanya, oleh 10 panelis terlatih dengan skor 0 -150... 65 38 Pengaruh penghilangan L-Phe pada campuran kreatinin (crn) 1.5 mM
dan L-Phe 1.5 mM terhadap skor rasa gurih dan asin dari MSG (4 mM), NaCl (80 mM) dan campuran keduanya, oleh 10 panelis terlatih. Skor:
0-150………... 66
39 Pengaruh penambahan kreatinin (crn) terhadap skor rasa gurih dan asin dari MSG, NaCl dan campuran MSG dan NaCl, oleh 10 panelis terlatih. Skor: 0-150 ... 66 40 Pengaruh penambahan kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM
dan tirosin (tyr) 1.5 mM terhadap skor rasa gurih dan asin dari MSG, NaCl dan campuran MSG dan NaCl, oleh 10 panelis terlatih. Skor: 0-15 67 41 Pengaruh penghilangan tirosin (tyr) terhadap skor rasa gurih dan asin
dari campuran MSG, NaCl, kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM, oleh 10 panelis terlatih. Skor: 0-150 …… 68 42 Pengaruh penghilangan fenilalanin terhadap skor rasa gurih dan asin dari
campuran MSG, NaCl, kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM, oleh 10 panelis terlatih. Skor 0-150 ………….. 69 43
uh penghilangan fenilalanin (phe) dan tirosin (tyr) terhadap skor rasa gurih dan asin dari campuran MSG, NaCl, kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM, oleh 10 panelis terlatih. Skor:
0-150 ………. 69
44
uh penghilangan kreatinin (crn) terhadap skor rasa gurih dan asin dari campuran MSG, NaCl, kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM, oleh 10 panelis terlatih. Skor: 0-150 ……. 70 45 Pengaruh penambahan fenilalanin (phe) dan triptofan (trp) terhadap
skor rasa gurih dan asin dari MSG, NaCl, dan campuran MSG dan NaCl, oleh 10 panelis terlatih. Skor: 0-150………... 71 46 Pengaruh penghilangan fenilalanin (phe) 1 mM terhadap skor rasa gurih
dan asin dari MSG 4 mM, NaCl 80 mM, dan triptofan (trp) 1 mM, oleh 10 panelis terlatih. Skor: 0-150... 72 47 Pengaruh penambahan triptofan (trp) 1 mM terhadap skor rasa gurih dan
asin dari MSG 4 mM, NaCl 80 mM dan campuran MSG,NaCl, oleh 11 panelis terlatih. Skor: 0-150………... 72
DAFTAR LAMPIRAN
Halaman
1 Format isian uji rasa dasar... 80
2 Format isian uji segitiga rasa asam-pahit ... 81
3 Format isian uji segitiga rasa asin-gurih... 82
4 Format isian uji rangking rasa asin/gurih ... 83
5 Format isian uji skoring/pengujian sampel untuk rasa gurih dan asin 84 6 Hasil seleksi panelis untuk uji rasa dasar... 85
7 Hasil seleksi panelis untuk uji segitiga rasa... 87
8 Hasil pelatihan panelis yang telh lolos seleksi dengan menggunakan uji peringkat rasa asin dan rasa gurih... 88
9 Hasil uji skoring rasa gurih pada pelatihan panelis dengan menggunakan sampel ekstrak kecap ikan berberat molekul kurang dari 1000 Da... 89
10 Hasil uji skoring rasa asin pada pelatihan panelis dengan menggunakan sampel ekstrak kecap ikan berberat molekul kurang dari 1000 Da... 90
11 Spektrum UV senyawa-senyawa standar untuk identifikasi dengan Capillary Electrophoresis ……….. 91
12 Contoh spektrum massa peptida berberat molekul 430.0 Da (waktu retensi 16.1 menit) yang terdapat pada FTT Fraksi 1 ulangan 1, (a) spektrum massa pada MS1 dan (b) fragmentasi lebih lanjut (MS2) dari ion dengan m/z 149.9... 93
13 Contoh spektrum massa peptida berberat molekul 375.1 Da (waktu retensi 26.7 menit) yang terdapat pada FTT Fraksi 1 ulangan 2 (a) spektrum massa pada MS1 dan (b) fragmentasi lebih lanjut (MS2) dari ion dengan m/z 376.2... 93
15 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi Tidak Tertahan (FTT) hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 95
16 Spektrum massa (pola fragmentasi pada MS1) peptida berberat molekul 375.1 yang terdapat pada Fraksi Tidak Tertahan (FTT) hasil fraksinasi Fraksi 1, (a) peptida dengan waktu retensi 27.7 (ulangan 1) dan 26.7 menit(ulangan 2), (b) peptida dengan waktu retensi 44.7 (ulangan 1) dan 45.3 menit (ulangan 2)... 96
17 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi A hasil fraksinasi Fraksi 1 ulangan 1ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 97
18 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi A hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 99
19 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi B hasil fraksinasi Fraksi 1 ulangan 1 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction).. 100
20 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi B hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction).. 102
21 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi C hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction).. 103
22 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi D hasil fraksinasi Fraksi 1 ulangan 1 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 103
23 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi D hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 104
24 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi E hasil fraksinasi Fraksi 1 ulangan 1 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 104
25 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi E hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 105
26 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi F hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 106
27 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi G hasil fraksinasi Fraksi 1 ulangan 1 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 107
28 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi G hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 107
29 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi H hasil fraksinasi Fraksi 1 ulangan 1 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 108
30 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi H hasil fraksinasi Fraksi 1 ulangan 2 ekstrak ikan asin jambal roti goreng menggunakan SPE (Solid Phase Extraction)... 108
31 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi 3 ulangan 1 ekstrak ikan asin jambal roti... 109
32 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi 4 ulangan 1 ekstrak ikan asin jambal roti... 110
33 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi 4 ulangan 2 ekstrak ikan asin jambal roti... 110
34 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi 5 ulangan 1 ekstrak ikan asin jambal roti... 111
35 Identifikasi berat molekul dan dugaan kandungan asam amino peptida pada Fraksi 5 ulangan 2 ekstrak ikan asin jambal roti... 112
36 Pengaruh penambahan Histidin (His) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl... 113
37 Uji sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan histidin 1 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran keduanya... 114
38 Pengaruh penambahan kreatinin (Crn) 1.5 mM dan fenilalanin (phe) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl... 115
39 Uji sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan kreatinin (crn) 1.5 mM dan fenilalanin (phe) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran keduanya... 116
40 Pengaruh penghilangan fenilalanin (phe) pada campuran kreatinin (Crn) 1.5 mM dan fenilalanin (phe) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl... 117
41 Uji sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan fenilalanin (phe) terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM, kreatinin (crn) 1.5 mM dan fenilalanin (phe) 1.5 mM... 118
42 Pengaruh penambahan creatinin (Crn) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl... 119
43 Uji sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan creatinin 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran keduanya... 120
44 Pengaruh penambahan Kreatinin (Crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl... 121
45 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan kreatinin (crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campurannya... 122
46 Pengaruh penghilangan tirosin (tyr) terhadap skor rasa gurih dan asin campuran MSG 4 mM, NaCl 80 mM, kreatinin (Crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 123
47 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan tirosin (tyr) 1.5 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM fenilalanin (phe) 1.5 mM dan creatinin 1.5 mM... 124
48 Pengaruh penghilangan fenilalanin (phe) terhadap skor rasa gurih dan asin campuran MSG (4 mM), NaCl (80 mM), kreatinin (Crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 125
49 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan fenilalanin (phe) 1.5 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM, kreatinin (crn) 1.5 mM, fenialalanin (phe) dan tirosin (tyr) 1.5 mM...
126
50 Pengaruh penghilangan fenilalanin (phe) dan tirosin (tyr) terhadap skor rasa gurih dan asin campuran MSG (4 mM), NaCl (80 mM), kreatinin (Crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 127
51 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan creatinin 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 128
52 Pengaruh penghilangan kreatinin (crn) terhadap skor rasa gurih dan asin campuran MSG (4 mM), NaCl (80 mM), kreatinin (Crn) 1.5 mM, fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 129
53 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan kreatinin (crn) 1.5 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80, kreatinin (crn) 1.5 mM, mM fenilalanin (phe) 1.5 mM dan tirosin (tyr) 1.5 mM... 130
54 Pengaruh penambahan fenilalanin (phe) 1 mM dan triptofan (trp) 1 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80
mM dan campuran MSG, NaCl... 131
55 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan fenilalanin (phe) 1 mM dan triptofan (trp) 1 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan
campurannya... 132
56 Pengaruh penghilangan fenilalanin (phe) 1 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan triptofan (trp) 1
57 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penghilangan fenilalanin (phe) 1 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM, triptofan (trp) 1 mM dan fenilalanin (phe) 1 mM... 134
58 Pengaruh penambahan triptofan (trp) 1 mM terhadap skor rasa gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campuran MSG, NaCl 135
59 Analisis sidik ragam (ANOVA) dan uji lanjut Duncan pengaruh penambahan triptofan (trp) 1 mM terhadap skor gurih dan asin larutan MSG 4 mM, NaCl 80 mM dan campurannya... 137
PENDAHULUAN
Latar Belakang
Telah diketahui bahwa peptida-peptida yang mempunyai berat molekul kurang dari 1000 Da mempunyai kontribusi terhadap rasa dan flavor bahan pangan, dimana salah satunya adalah memberikan rasa umami (Yamasaki dan Maekawa, 1978). Rasa umami adalah rasa yang ditimbulkan oleh senyawa monosodium glutamate (MSG) dan 5’ nukleotida seperti 5’-inosine monophosphate (IMP) dan 5’-guanosine monohosphate (GMP) (Maga, 1994). Rasa umami ini menjadi penting karena ternyata sejak lama telah dijadikan sebagai dasar dari pemilihan makanan (McBride, 1991). Dalam penelitian ini, rasa umami diasumsikan dengan rasa gurih, karena rasa gurih merupakan rasa yang paling dekat dengan umami dan merupakan rasa yang lebih dikenal oleh masyarakat Indonesia.
Isolasi terhadap peptida-peptida yang berkontribusi terhadap pembentukan flavor bahan pangan, khususnya rasa gurih, masih perlu dilakukan. Hal ini dikarenakan senyawa-senyawa pemberi rasa umami yang telah dikomersialisasi secara luas baru dilakukan pada MSG diikuti oleh IMP dan GMP. Dengan adanya senyawa lain dari golongan peptida yang juga dapat berfungsi sebagai pemberi rasa gurih, diharapkan dapat dijadikan alternatif ingredient pangan selain juga menambah nilai nutritif dari makanan tersebut.
Peptida-peptida yang mempunyai rasa umami pada umumnya terdapat pada bahan pangan yang mempunyai kadar protein tinggi seperti hidrolisat protein ikan (Fujimaki et al., 1973), daging sapi (Yamasaki dan Maekawa, 1978) dan kacang kedelai (Apriyantono et al., 2003 dan Lioe et al., 2003). Sedangkan peptida umami yang pertama kali berhasil diisolasi dan diidentifikasi adalah oktapeptida (Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala) yang dikenal sebagai delicious peptide atau Beefy Meaty Peptide (BMP) yang berasal dari kaldu daging sapi (Yamasaki dan Maekawa, 1978).
asin jambal roti, ikan peda putih dan kecap ikan (Saleha, 2003). Produk-produk ini disukai oleh masyarakat di Indonesia karena rasanya gurih. Hasil fraksinasi menggunakan Sephadex G-10 dari ekstrak air ikan asin jambal roti dan kecap ikan berberat molekul kurang dari 1000 Da menghasilkan fraksi-fraksi yang mempunyai rasa gurih (Priliandari 2004 dan Rahmawaty 2004) berberat molekulRasa gurih pada produk-produk tersebut salah satunya diduga berasal dari peptida yang merupakan hasil hidrolisis protein secara enzimatis pada saat fermentasi.
Tujuan
Tujuan penelitian ini secara umum adalah melakukan isolasi, identifikasi dan karakterisasi peptida gurih dari ekstrak larut air ikan asin jambal roti. Sedangkan secara khusus, penelitian ini bertujuan untuk :
1. Mendapatkan fraksi peptida dari Fraksi 1 ekstrak ikan asin jambal roti berberat molekul kurang dari 1000 Da yang telah difraksinasi dengan kromatografi gel (Sephadex G-10).
2. Mendapatkan identitas peptida dan asam amino yang terdapat pada fraksi-fraksi ikan asin jambal roti dengan menggunakan Capillary Electrophoresis (CE) dan Liquid Chromatography – Mass Spectrometry (LC-MS).
3. Mendapatkan karakterisasi sensori asam amino dan peptida yang teridentifikasi terhadap pembentukan rasa gurih dan asin dengan menggunakan teknik ommision test.
Hipotesa
Manfaat Penelitian
TINJAUAN PUSTAKA
Peptida Pemberi Rasa Gurih
Pada umumnya, peptida yang mempunyai rasa gurih mengandung asam amino glutamat (Glu) dan aspartat (Asp) seperti terlihat pada Tabel 1. Adanya residu asam amino asam ini sangat penting untuk menghasilkan rasa dari peptida-peptida yang ada dalam bahan pangan (Tamura et al. 1989). Akan tetapi, bukan berarti rasa gurih dari suatu peptida hanya ditentukan oleh kedua jenis asam amino tersebut. Asam amino yang bersifat hidrofilik seperti serin (Ser), threonin (Thr), glisin (Gly) dan glutamin (Gln) apabila diikat melalui ikatan peptida bersama dengan asam amino glutamat dan aspartat, juga menghasilkan rasa gurih (Noguchi et al 1975).
Rasa gurih dari suatu peptida juga dipengaruhi oleh urutan asam amino penyusunnya dan jenis garam yang ditambahkan untuk mencapai pH 6 (Nakata et al, 1995). Di-peptida Asp-Glu mempunyai rasa gurih dengan nilai threshold 3.32 mM, sedangkan di-peptida Glu-Asp mempunyai rasa asin dengan nilai threshold 1.74 mM. Tamura et al. (1989) menemukan bahwa posisi Asp dan Glu dalam garam sodium peptida asam merupakan faktor yang sangat penting untuk menghasilkan rasa gurih. Contohnya adalah garam sodium dipeptida Asp-Glu.2 Na menghasilkan rasa gurih yang lebih kuat dibandingkan Glu-Asp.2Na. Selain itu, ia juga menduga bahwa suatu peptida yang menghasilkan rasa gurih dan asin memiliki kation dan anion yang berdekatan.
Tabel 1 Peptida-peptida yang mempunyai rasa gurih pada pH 6
Lys-Gly-Asp-Glu-Glu-Ser-Leu-Ala**** - - 1.25
a
pH pada saat sebelum ditambahkan NaOH
b
jumlah ion sodium (mol) yang ditambahkan hingga mencapai pH 6 (mM) c
satuannya : mg%
* sumber: Nakata et al. (1995) ** sumber: Noguchi et al. (1975) *** sumber: Kuramitsu et al. (1996)
**** sumber: Yamasaki dan Maekawa (1978)
diduga dihasilkan oleh lokalisasi kation pada fragmen basa dan anion pada fragmen asam (Nakata et al. 1995).
Sumber Peptida Pemberi Rasa Gurih
Seperti disebutkan di atas, peptida yang mempunyai rasa gurih, pertama kali diisolasi dari kaldu daging sapi oleh Yamasaki dan Maekawa (1978). Berawal dari penemuan ini, banyak dilakukan penelitian mengenai keberadaan peptida gurih pada bahan pangan yang mempunyai rasa gurih seperti hidrolisat protein ikan, keju dan moromi dari kacang kedelai.
Konsentrat Protein Ikan
Pada tahun 1973, Fujimaki et al. melakukan hidrolisis konsentrat protein ikan dengan menggunakan enzim pronase dan kemudian difraksinasi untuk mengetahui hubungan antara distribusi berat molekul dengan sifat organoleptik hidrolisat protein ikan. Senyawa yang bertanggung jawab terhadap rasa gurih hidrolisat protein ikan adalah peptida asam yang memiliki residu asam amino hidrofilik, dimana peptida ini mempunyai berat molekul di bawah 1000 dalton.
Keju
Kacang Kedelai
Sumber peptida gurih lainnya adalah kacang kedelai. Protein kacang kedelai dapat langsung dihidrolisis baik secara enzimatik, hidrolisis dengan asam ataupun dengan cara hidrolisis enzimatik yang direaksikan dengan glukosa melalui pemanasan menghasilkan Hydrolyzed Vegetable Protein (HVP) yang mempunyai rasa gurih (Aaslyng et al. 1998).
Selain itu, peptida gurih dapat diambil dari fermentasi kacang kedelai dalam bentuk moromi yang merupakan salah satu tahap dalam pembuatan kecap, dimana penelitian mengenai hal ini telah dilakukan oleh Apriyantono et al. (2003). Mereka menemukan bahwa peptida yang berkontribusi terhadap rasa gurih kecap adalah peptida berberat molekul kurang dari 500 Da yang dihasilkan dari proses ultrafiltrasi ekstrak moromi. Selanjutnya Lioe et al. (2003) melakukan fraksinasi fraksi yang mengandung peptida kurang dari 500 Da dengan kromatografi filtrasi gel dan menghasilkan 4 fraksi. Dari keempat fraksi yang diuji, fraksi ke 2 mengandung asam glutamat dalam jumlah yang paling besar (15.48%), akan tetapi kandungan asam glutamat bebasnya hanya 1.43% (b/b). Hal ini menunjukkan bahwa asam glutamat yang ada didalam fraksi 2 berada terikat dalam suatu peptida yang menghasilkan rasa gurih.
Produk Olahan Ikan Tradisional
senyawa-senyawa yang berperan terhadap rasa gurih ketiga ekstrak adalah senyawa-senyawa berberat molekul kurang dari 1000 Da.
Keberadaan peptida yang mempunyai rasa gurih pada ekstrak ikan asin jambal roti goreng (Rahmawaty 2004) dan ekstrak kecap ikan cap ikan merah (Priliandari 2004) diketahui setelah dilakukan fraksinasi lebih lanjut menggunakan kromatografi gel dengan kolom Sephadex G 10. Penggunaan kolom ini dapat menghasilkan 5 fraksi peptida yang terpisah dengan garamnya, dimana pada umumnya garam terdapat pada fraksi 2. Dugaan adanya peptida yang mempunyai rasa gurih pada ketiga ekstrak adalah tingginya skor rasa gurih pada fraksi 1. Fraksi 1 ini tidak mengandung garam dan mempunyai proporsi asam glutamat bebas per total asam glutamat yang kecil, sehingga diduga asam glutamat terikat dalam bentuk peptida yang memberikan rasa gurih.
Teknik Isolasi Peptida
Tahap-tahap yang dilakukan untuk mengisolasi peptida yang memberikan rasa gurih secara umum adalah ekstraksi, filtrasi dan fraksinasi hingga mendapatkan satu fraksi yang berpotensi mengandung peptida gurih. Setelah itu dilakukan pemurnian dengan teknik elektroforesis untuk mendapatkan senyawa tunggal (peptida gurih). Tahap akhir adalah identifikasi untuk mendapatkan struktur primer peptida gurih. Skema isolasi peptida yang mempunyai rasa gurih dapar dilihat pada Gambar 1.
mempunyai bentuk campuran cairan dan padatan, sehingga untuk mengekstrak peptidanya cukup dengan menghomogenisasi moromi dan memerasnya hingga didapat ekstrak moromi (Apriyantono et al.2003 dan Lioe et al 2003). Senyawa-senyawa lain yang ikut terekstrak seperti lemak, karbohidrat dan lain sebagainya, dapat dihilangkan dengan cara sentrifugasi.
Tahap isolasi selanjutnya adalah penyaringan ekstrak larut air dengan menggunakan teknik ultrafiltrasi. Pada umumnya, ultrafiltrasi dilakukan hingga mendapatkan fraksi peptida dengan berat molekul kurang dari 1000 Da (Salles et al. 2000; Molina et al. 1999 dan Mojarro-Guerra et al. 1991), akan tetapi Apriyantono et al (2003) dan Lioe et al. (2003) melakukannya hingga mendapatkan fraksi berberat molekul kurang dari 500 Da. Selain dengan menggunakan teknik ultrafiltrasi, penyaringan juga dapat dilakukan dengan menggunakan kromatografi filtrasi gel dengan menggunakan kolom sephadex G-25 (Yamasaki dan Maekawa 1978) dan sephadex G-15 (Oka dan Nagata (1974).
• untuk mendapatkan fraksi terpilih dapat dilakukan dengan beberapa teknik kromatografi
Gambar 1 Skema isolasi peptida pemberi rasa gurih
Bahan pangan
¬ Air panas
¬ Enzimatis
Identifikasi :
Elektroforesis, LC-MS, peptide sequencer
Fraksinasi dengan kromatografi Ultrafiltrasi
Ekstraksi
Fraksi 1 Fraksi 2 …….. Fraksi n
Fraksi tergurih
………
Fraksi B
Fraksi A Fraksi n
Profil peptida yang terdapat pada fraksi berpotensi hasil fraksinasi dapat diketahui dengan menggunakan teknik elektroforesis, baik elektroforesis kertas (Yamasaki dan Maekawa, 1978 dan Oka dan Nagata, 1974) maupun Capillary Electroforesis (Lioe et al. 2003). Teknik lainnya adalah dengan menggunakan High Performance Liquid Chromatography (HPLC) (Mojarro-Guerra et al. 1991; Fernandez et al. 1998 dan Molina et al. 1999).
Tahap akhir dari isolasi peptida adalah menentukan urutan asam amino penyusun peptida tersebut yang dapat dilakukan dengan metode degradasi Edman untuk menentukan urutan N – terminal dan metode Carboxypeptidase A (Cpase A) untuk menentukan urutan C-terminal terpisah (Yamasaki dan Maekawa 1978). Metode lainnya adalah gas phase isothiocyanate degradation yang merupakan modifikasi degradasi Edman (Mojarro-Guerra et al. 1991). Cara lain yang lebih mudah dan cepat adalah dengan menggunakan peptide sequencer (Wassenar et al. 1995) atau asam amino analyzer (Fernandez et al. 1998).
Identifikasi Peptida
Capillary Electrophoresis (CE)
Gambar 2 Skema komponen-komponen utama pada sistem Capillary Electrophoresis
Mode pemisahan yang dapat digunakan untuk peptida adalah Capillary Zone Electrophoresis (CZE), Capillary Isoelectric Focusing (CIF), Micellar Electrokinetic Capillary Chromatography (MECC) dan Capillary Gell Electrophoresis (CGE). Akan tetapi, yang banyak digunakan adalah mode CZE karena mempunyai efisiensi yang tinggi terhadap molekul-molekul kecil, mudah diotomatisasi, memungkinkan untuk kuantifikasi secara langsung (Schoneich et al. 1993). Kolom kapiler dalam mode ini terdiri dari fused silica yang permukaannya bermuatan negatif karena terionisasinya gugus silanol (SiO-), dimana derajat muatannya tergantung dari pH larutan dalam kapiler (Sorensen et al. 1999).
ionisasi permukaan silanol akan ditekan sehingga interaksi peptida bermuatan positif (pH<pI) akan diminimisasi (Schöneich et al. 1993).
Detektor yang dapat digunakan untuk mendeteksi peptida adalah Diode Array Detector dengan menerapkan absorbansi UV/VIS sehingga didapat informasi spektral yang sangat penting dalam identifikasi dan purifikasi (Kitagishi 1997). Adanya peptida dapat dideteksi dengan menggunakan panjang gelombang 215 nm yang merupakan daerah penyerapan ikatan peptida, selain itu panjang gelombang 230 atau 254 nm juga sering digunakan (Bailey 1992). Untuk asam amino aromatik seperti L-Phe, L-Tyr dan L-Trp dapat dilakukan pendeteksian pada panjang gelombang 280 nm (Bailey 1992). Dari 20 asam amino, hanya 3 asam amino inilah yang dapat menyerap sinar UV secara nyata (Cancalon 1997).
Liquid Chromatography Tandem Mass Spectrometry (LC-MS/MS)
Liquid Chromatography tandem MS (LC-MS/MS) merupakan alat yang banyak digunakan untuk mengidentifikasi campuran beberapa peptida baik hasil sintesis maupun yang berasal dari sampel biologi. Di dalam reviewnya, Mehlis dan Kertscher (1997), memperlihatkan luasnya aplikasi LC-MS/MS untuk analisis peptida yaitu telah melebihi 100 peptida dan protein yang terdaftar pada review biannual (1994/95).
berberat molekul rendah (20 dipeptida, 2 tripeptida dan glutathione teroksidasi) dengan menggunakan ion pair reverse phase LC-ESI-MS tanpa melakukan derivatisasi.
Untuk mendapatkan hasil yang optimum dalam mengidentifikasi peptida menggunakan LC-MS/MS perlu dilakukan pengembangan metode LC dan MS-nya sehingga dapat menghasilkan spketrum massa yang baik tetapi tidak merusak sistem detektor MS (Careri dan Mangia 2003). Penelitian untuk mendapatkan kondisi pemisahan yang optimum telah banyak dilakukan. Dalam reviewnya, Mehlis dan Kertscher (1997) menyatakan bahwa standar fase gerak yang digunakan pada lebih dari 90% penelitian mengenai analisis peptida dengan LC-MS/MS adalah campuan asetonitril (ACN) dengan air dan diasamkan oleh trifluoroacetic acid (TFA, 0.05-0.1%). Penggunaan ACN/air sebagai solven disebabkan oleh karakteristik campuran ini yang dapat membentuk larutan terprotonasi sebagai akibat dari reaksi solven dengan asam lemah seperti asam asetat, asam format atau asam propionat yang ditambahkan (Cech dan Enke 2001). Adapun teknik elusi yang umum digunakan adalah gradien agar dapat memperkecil kemungkinan hilangnya peptida yang sangat polar karena terelusi terlalu cepat atau kehilangan peptida yang sangat tidak polar karena berikatan kuat dengan fase diam (Mehlis dan Kertscher 1997).
Penggunaan zat aditif berupa ion pairing agent banyak digunakan untuk lebih mengoptimalkan pemisahan peptida dan untuk mempertajam bentuk peak (Petritis et al. 2002, McCalley 2004, Toll et al., 2005). Pada mulanya zat aditif yang banyak ditambahkan pada eluen adalah TFA (Trifluoroacetic acid), akan tetapi penelitian lebih lanjut menunjukkan bahwa penggunaan TFA dapat menurunkan sensitiftas MS (McCalley 2004). Sebagai alternatif penggunaan ion pairing agent dapat dengan menggunakan ammonium format (McCalley 2004), NFPA (Nonafluoropentanoic acid) dan TDFHA (Tridecafluoroheptaenoic acid) (Petritis et al. 2002).
dari ESI-MS in adalah solven polar yang mengandung ion-ion analit di semprot dari ujung logam kapiler, jika disertai potensial yang tinggi (4-5 kV, positif atau negatif dan tergantung dari muatan ion-ion analit) antara kapiler dengan lempeng logam, maka akan terbentuk droplet bermuatan tinggi (diameter 1 – 3 µm). Droplet tersebut dibantu oleh aliran gas inert kering dan panas (bukan prasyarat untuk pembentukan spray) kemudian bergerak menuju lempeng logam yang berpotensial lebih rendah. Hal ini menyebabkan droplet-droplet berkumpul dan akhirnya akan dikeluakan dari bentuk droplet menjadi fase gas (Mehlis dan Kertscher 1997). Untuk lebih jelasnya Cech dan Enke (2001) menjelaskan prinsip kerja ESI dengan menggunakan skema seperti terlihat pada Gambar 3.
Gambar 3 Skema proses ionisasi elektrospray. Larutan analit dipompa melalui needle dimana tegangan tinggi diberikan. ”Taylor cone’ dengan muatan positif berlebih dipermukaannya terbentuk sebagai hasil daru perbedaan medan listrik antar ESI needle dengan eletroda yang berlawanan. Droplet bermuatan terbentuk dari ujung Taylor cone dan droplet-droplet ini diuapkan dan masuk ke MS untuk menghasilkan molekul analit bebas dan bermuatan yang dapat dianalisa rasio massa per muatannya (m/z) (Cech dan Enke, 2001).
fragmentasi, dimana kemungkinan pembentukan ion-ionnya sangat banyak tergantung jenis peptidanya (Gambar 4).
Secara umum pada fragmentasi peptida, jika energi tumbukan relatif tinggi, maka fragmentasi melibatkan pemecahan ikatan tunggal dan terbentuklah ion-ion tipe b. Sedangkan jika energi tumbukan relatif kecil, maka kerusakan ikatan akan terjadi secara simultan sehingga akan terbentuk ion-ion tipe y (Staudenmann et al. 2000 Di dalam : Petritis et al. 2002). Berdasarkan penelitian yang dilakukan Petritis et al. (2000) diketahui bahwa energi tumbukan (CAD) untuk dipeptida yang paling optimum adalah 15 eV.
Gambar 4 Pola fragmentasi peptida (Harrison et al. 2000)
Berdasarkan ion-ion yang terbentuk dapat dilakukan identifikasi kandungan asam amino serta urutannya. Wysocki et al. (2003) mengemukakan modifikasi penentuan urutan asam amino suatu peptidauntuk interpretasi dari spektrum sector-TOF SID yang bermuatan +1, yaitu (1) menentukan berat molekul peptida yang tidak diketahui dari m/z ion prekursor dan informasi komposisi dari ion-ion immonium, (2) menandai residu terminal-C dari ion-ion y1
dan y2, (3) menemukan pasangan ion b/a (kemudian residu terminal-N) dengan
adanya ion yn-2, (4) menandai secara langsung ion b2 dengan adanya yn-1, selisih
BAHAN DAN METODE
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah ekstrak ikan asin jambal roti yang telah difraksinasi menggunakan kromatografi gel dengan Sephadex G10 yang telah dilakukan oleh Rahmawaty (2004). Bahan-bahan lainnya untuk identifikasi adalah air bebas ion, asetonitril (Merck), metanol (Merck) dan akuades. Sedangkan untuk uji sensori digunakan NaCl dan monosodium glutamate (MSG) sebagai larutan standar, L-Fenilalanin (Sigma), L-Triptofan (Sigma), L-Tirosin (Sigma), L-Histidin-HCl (Sigma) dan kreatinin (Sigma). Untuk seleksi dan pelatihan panelis diperlukan larutan NaCl (Merck), MSG (Quest), asam sitrat, sukrosa dan kafein. Larutan untuk uji sensori diencerkan menggunakan air minum dalam kemasan merk Aceros.
Alat-alat yang digunakan dalam penelitian ini adalah pH meter, freeze dryer, Solid Phase Extraction (SPE) dengan kolom C18 (LC-18) dari Supelco, LC-MS/MS (Liquid Chromatography-Mass Spectrometry): LC (agilent 1100 series), MS (Bruker Daltonics Esquire 6000), kolom C8 (Agilent Eclipse XDB-C8, 5 µm (4,6 x 150 mm). Alat lainnya adalah Capillary Electrophoresis (CE) Hewlett Packard Capillary Zone electrophoresis dan HP ChemStation untuk sistem kontrol, pengumpulan dan analisis data.
Metode
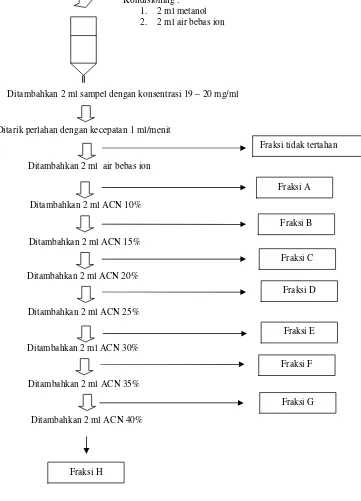
Isolasi Peptida Dari Fraksi Tergurih menggunakan Solid Phase Extraction (Herraiz dan Casal, 1995)
Teknik ini merupakan mode pemisahan kromatografi yang menggunakan fase diam C18. Kolom disposible yang digunakan mengandung 500 mg adsorben (40 ì m, 60 • ) dengan volume kolom 2.8 ml). Sebelum digunakan, dilakukan
sebanyak 1 ml larutan sampel (kurang lebih 150 nmol) dimasukkan ke dalam kolom dan ditarik secara perlahan dengan kecepatan 1 ml/menit dalam kondisi vakum bertekanan 20 inHg. Eluat yang keluar kolom ditampung sebagai fraksi tidak tertahan. Setelah itu, ditambahkan 2 ml air bebas ion yang mengandung TFA 0.1% dan eluatnya ditampung sebagai fraksi 1. Fraksi 2 hingga 8 didapatkan secara berurutan setelah menambahkan 2 ml solvent yang mengandung 10% - 40% ACN yang mengandung 0.1% TFA dengan interval kenaikan ACN 5% (Gambar 5).
Identifikasi Peptida menggunakan CE
Peptida dan asam amino yang terdapat pada fraksi-fraksi hasil fraksinasi menggunakan kromatografi gel dengan Sephadex G10 yang telah dilakukan oleh Rahmawaty (2004) diidentifikasi menggunakan CE. Identifikasi peptida dengan CE dilakukan dengan menggunakan Capillary Zone Electrophoresis yaitu Hewlett Packard Capillary Zone electrophoresis dan HP ChemStation untuk sistem kontrol, pengumpulan dan analisis data. Kondisi yang diterapkan : kolom yang digunakan adalah fused silica dengan panjang 48.5 cm dan diameter dalam 50 ì m. Tegangan 15 kV dengan jumlah sampel yang diinjeksikan sebanyak 50 nl. Detektor yang digunakan adalah Diode Array Detector pada panjang gelombang 190 – 600 nm. Suhu eksternal 25oC dan buffer yang digunakan adalah asam fosfat 100 mM, pH 2.5.
Identifikasi Peptida menggunakan LC-MS
Gambar 5 Cara isolasi peptida dari fraksi 1 ekstrak ikan asin jambal roti menggunakan teknik Solid Phase Extraction (SPE)
Kondisioning : 1. 2 ml metanol 2. 2 ml air bebas ion
Ditambahkan 2 ml sampel dengan konsentrasi 19 – 20 mg/ml
Ditambahkan 2 ml ACN 35%
Ditambahkan 2 ml ACN 40% Ditambahkan 2 ml ACN 30%
Fraksi H
Fraksi G Fraksi F Ditambahkan 2 ml ACN 15%
Ditarik perlahan dengan kecepatan 1 ml/menit
Ditambahkan 2 ml air bebas ion
Ditambahkan 2 ml ACN 10%
Fraksi tidak tertahan
Fraksi E Fraksi D Fraksi C Fraksi B Fraksi A
Ditambahkan 2 ml ACN 20%
selama 10 menit. Setelah itu, konsentrasi ACN diturunkan hingga 2% dan dipertahankan selama 10 menit. Flow rate solvent adalah 0.1 ml/menit. Detektor yang digunakan adalah mass spectrometry.
Seleksi Panelis
Seleksi panelis bertujuan untuk mendapatkan panelis yang mempunyai kemampuan dalam membedakan lima rasa dasar (manis, asam, asin, pahit dan gurih), mampu membedakan 2 rasa yang berdekatan dan mampu membedakan intensitas rasa. Uji-uji yang dilakukan adalah :
1. Uji Lima Rasa Dasar
Tujuan pengujian ini adalah untuk mendapatkan panelis yang dapat mendeteksi dan mengenali 5 rasa dasar (manis, asam, asin, pahit dan gurih). Jumlah panelis (calon panelis) yang diikutsertakan adalah 30-60 orang. Sedangkan metode pengujiannya dilakukan sebagai berikut : panelis diminta untuk menentukan rasa dasar dari 5 larutan yang diujikan seperti pada formulir isian yang disediakan (Lampiran 1). Pengujian ini dilakukan dengan 2 kali ulangan. Adapun cara penyajiannya adalah:
♦ Dalam 1 booth disediakan 5 set larutan yang masing-masing terdiri dari rasa manis (larutan sukrosa 1 %), asin (larutan NaCl 0.2%), asam (larutan asam sitrat 0.04%), pahit (larutan kafein 0.05%) dan gurih (larutan MSG 0.06%)
♦ Sebagai penetral disajikan air minum dan roti tawar
Panelis yang lolos seleksi adalah panelis yang mampu menjawab dengan benar paling sedikit 75%.
2. Uji Segitiga Rasa
Tujuan pengujian ini adalah untuk mengetahui kemampuan panelis dalam membedakan 2 rasa yang berdekatan yaitu rasa asam dan pahit serta rasa asin dan gurih. Dalam setiap pengujian yang dilakukan sebanyak 2 kali ulangan, setiap panelis akan mendapatkan pengacakan seperti pada Tabel 2.
sama untuk masing-masing rasa dengan uji rasa dasar. Panelis diminta untuk mendeteksi larutan mana yang berbeda seperti pada form isian pada Lampiran 2 dan 3. panelis yang lolos seleksi adalah panelis yang mampu menjawab benar minimal 75%.
Tabel 2 Sistem pengacakan sampel pada uji segitiga rasa asam-pahit dan asin-gurih
Panelis Sesi 1 Sesi 2 Panelis Sesi 1 Sesi 2
1 AAB BBA 7 ABB BAA
2 BBA ABA 8 ABA ABB
3 BAA BAB 9 BAB AAB
4 ABA ABB 10 BBA ABA
5 ABB BAA 11 AAB BBA
6 BAB AAB 12 BAA BAB
3. Uji Rangking
Tujuan pengujian ini adalah untuk mengetahui kemampuan panelis dalam membedakan tingkat intensitas rasa asin dan gurih. Metode uji yang digunakan adalah uji pasangan. Larutan sampel yang diujikan seperti tertera pada Tabel 3.
Table 3 Jenis dan konsentrasi larutan sampel untuk uji rangking pada pelatihan panelis
Rasa Stimuli Konsentrasi (g/L)
Asin NaCl 1.0 2.0 5.0 10.0
Gurih MSG 0.6 1 1.8 3.5
Pelatihan Panelis
Pelatihan panelis dilakukan pada 14 orang panelis yang telah lolos seleksi. Pelatihan bertujuan agar panelis mengenal sampel yang akan diuji (ekstrak ikan asin jambal roti, ekstrak ikan peda putih dan kecap ikan berberat molekul kurang dari 1000 Da). Selain itu, pelatihan bertujuan agar panelis terbiasa/terlatih untuk melakukan uji skoring dalam menguji intensitas rasa asin dan gurih sampel. Pelatihan dilakukan dengan menyajikan 3 sampel, 3 standar rasa asin dan 3 standar rasa gurih. Sampel disajikan pada 3 konsentrasi berbeda yaitu 0.1% (b/v), 0.5% (b/v) dan 1.0% (b/v). Standar rasa asin adalah NaCl dengan konsentrasi 0.25% (b/v) untuk skor 50, 0.50% (b/v) untuk skor 80 dan 1.25% (b/v) untuk skor 150. Sedangkan standar rasa gurih digunakan larutan MSG dengan konsentrasi 0.05% (b/v) untuk skor 50, 0.10% (b/v) untuk skor 80 dan 0.20% (b/v) untuk skor 150. Panelis diminta untuk menilai intensitas rasa asin bersamaan dengan rasa gurih sampel uji setelah mencicip ke tiga standar. Intensitas rasa asin dan gurih dinilai dari skor 1 – 150 pada garis lurus sepanjang 15 cm. Form isian pelatihan panelis terdapat pada Lampiran 5. Selama pelatihan dilakukan pengujian kinerja panelis dengan mengamati rata-rata standar deviasi respon terhadap rasa asin dan gurih untuk masing-masing panelis.
Omission test (Engel et al., 2000)
PEMBAHASAN
Identifikasi Peptida Gurih menggunakan LC-MS/MS
Liquid Chromatography – Mass Spectrometry digunakan untuk mengetahui berat molekul peptida dan asam amino penyusunnya yang ada pada masing-masing fraksi. Campuran peptida yang ada pada fraksi akan dipisahkan berdasarkan kesamaan kepolaran dan selektifitasnya terhadap fase gerak (campuran air dan asetonitril) serta interaksinya dengan fase diam (C8). Setelah itu masing-masing senyawa akan diionisasi menggunakan teknik electrospray ionization (ESI) sehingga membentuk ion-ion molekul bermuatan positif yang akan dideteksi oleh MS1 untuk mengetahui massa peptida. Kemudian dilakukan seleksi parent ion (dari MS1) untuk kemudian dideteksi fragmentasinya (product ion) oleh MS2 sehingga dapat dilakukan identifikasi asam amino penyusunnya. Hal ini berlaku bagi senyawa yang menghasilkan muatan lebih dari 1, akan tetapi senyawa yang hanya menghasilkan muatan +1, identifikasi asam amino dapat dilakukan dari MS1 (Wysocki et al., 2003).
Kandungan asam amino pada peptida diduga berdasarkan spektrum MS (baik MS1 maupun MS2) yaitu dari adanya peak yang sesuai dengan berat molekul asam amino+1 [M+H]+, ion immonium dan adanya peak yang menunjukkan pelepasan H2O (kehilangan massa 18) ataupun NH3 (kehilangan
massa 17) (Petritis et al., 2000; Petritis et al., 2002 dan Chimbault et al., 1999). Selain itu, kandungan asam amino diduga dari adanya kehilangan massa yang sesuai dengan massa asam amino yang kehilangan H2O karena telah berikatan
dengan asam amino lain membentuk ikatan peptida (Covey et al., 1991 dan D’Agostino et al., 1998). Adapun urutan dari asam amino belum dapat ditentukan karena memerlukan identifikasi yang lebih intensif dan memerlukan software khusus agar kesalahan penentuan urutan asam amino tidak terlalu besar.
dan 103.9 pada MS1. Ion-ion tersebut secara berturut-turut sesuai dengan massa Met + 1 ([Met+H]+), Met + 1 yang kehilangan NH3 ([Met+H-NH3]+) dan ion
immonium Met. Hasil fragmentasi lebih lanjut dari ion dengan m/z 149.9 pada MS2 lebih menguatkan dugaan bahwa ion tersebut adalah Met (Lampiran 6b). Hal ini didasarkan pada kesesuaian fragmentasi asam amino Met yang menghasilkan ion-ion dengan m/z 149.9, 132.8 dan 103.9 (Chaimbault et al. 1999 dan Petritis et al. 2000).
Contoh lainnya adalah pendugaan asam amino yang terkandung pada peak ke 13 pada FTT Fraksi 1 ulangan 2 yang mempunyai waktu retensi 26.7 menit dan berat molekul 375.1 Dalton. Hasil fragmentasi ion pada MS1 (Lampiran 7a) menghasilkan ion-ion dengan m/z 131.9 dan 86.0. Diduga ion-ion menunjukkan adanya asam amino leusin (Leu) atau Isoleusin (Ile), dimana masing-masing ion adalah Leu/Ile+1 ([Leu/Ile+H]+) dan ion immonium Leu/Ile (Chaimbault et al. 1999 dan Petritis et al. 2000). Selanjutnya, pendugaan kandungan asam amino dilakukan berdasarkan fragmentasi kedua ion molekul dengan m/z 376.2. Seperti yang terlihat pada Lampiran 7 b, ion-ion yang dihasilkan menunjukkan adanya kehilangan H2O dengan adanya ion bermassa 358.0 yang umum terjadi pada
fragmentasi peptida (). Kemudian terdapat pula ion dengan m/z 242.9 yang menunjukkan adanya kehilangan massa 115.1. Massa ini sesuai dengan massa asam aspartat (Asp) yang kehilangan H2O [Asp-H2O]. Selain itu, terdapat pula
ion dengan m/z 147.9 yang diduga merupakan asam glutamat (Glu) + 1 [Glu+1]. Berdasarkan ion-ion yang dihasilkan baik oleh MS1 maupun MS2, diduga senyawa (Peak ke 13) ini mengandung Leu/Ile, Asp dan Glu. Demikian seterusnya dilakukan pada peak-peak lainnya dan hasilnya ditampilkan dalam bentuk tabel.
amino lainnya yang berperan terhadap pembentukan peptida berasa gurih seperti Lys dan Gly (Yamasaki dan Maekawa, 1980 di dalam Nishimura dan Kato, 1988) serta Ser dan Thr (Noguchi et al., 1975 di dalam Nishimura dan Kato, 1988). Keberadaan asam-asam amino ini dideteksi berdasarkan [M+H]+, [M+H-H2O]+,
[M+H-NH3]+, [M-H2O] dan ion immoniumnya [Im] seperti terlihat pada Tabel 4.
Tabel 4 Ion-ion yang terbentuk sebagai dasar penentuan dugaan kandungan asam amino peptida yang diduga mempunyai rasa gurih
Asam amino [M+H]+ [M+H-H2O]+ [M+H-NH3]+ [M-H2O]* [Im]
Glu 148 130 129 102
Asp 134 116 115 88
Lys 147 - 130 128 -
Gly 76 - - 57 -
Ser 106 88 - 87 60
Thr 120 102 101 -
Sumber : Chaimbault et al., 1999
* Covey et al., 1991; D’Agostino et al., 1998 dan Yates et al., 1993
Fraksi I
Fraksi I hasil fraksinasi kromatografi gel (Sephadex G10) merupakan fraksi tergurih yang paling banyak mengandung senyawa-senyawa larut air dibandingkan fraksi lainnya berdasarkan hasil CE (Gambar 31). Oleh karena itu, diperlukan suatu tahap fraksinasi untuk memisahkan senyawa-senyawa tersebut agar memudahkan identifikasi menggunakan LC-MS/MS.
Teknik fraksinasi yang digunakan adalah Solid Phase Extraction (SPE). Prinsip fraksinasi ini sama dengan metode kromatografi kolom, akan tetapi fase diam yang digunakan di pak dalam kolom plastik kecil yang disposible (sekali pakai) yang berisi 0.1-0.5 g sorben (Synder et al., 1997). Untuk memisahkan peptida-peptida yang terdapat dalam ekstrak sekaligus memekatkannya dilakukan pemisahan menggunakan fase diam hidrofobik (C18). Teknik ini sangat efisien karena membutuhkan waktu yang lebih singkat untuk ekstraksi dan pemekatan peptida (Herraiz dan Casal 1995).
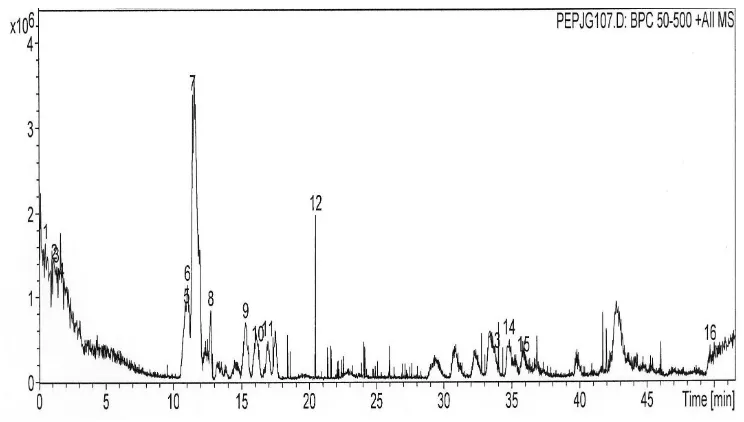
a. Fraksi Tidak Tertahan (FTT)
Fraksi pertama dinamakan Fraksi Tidak Tertahan (FTT) karena mengandung senyawa-senyawa yang tidak ditahan oleh fase diam SPE (C18) yaitu senyawa-senyawa yang sangat polar. Kromatogram fraksi ini baik pada ulangan 1 (Gambar 6) maupun ulangan 2 (Gambar 7) menunjukkan bahwa pemisahan senyawa-senyawa yang ada tidak optimal sehingga peak tidak tajam yang kemungkinan dalam 1 peak yang melebar terdapat lebih dari 1 senyawa. Hal ini dapat disebabkan oleh teknik fraksinasi dengan SPE yang kurang optimal seperti penggunaan fase diam yang terlalu tidak polar (C18) sehingga senyawa-senyawa polar yang banyak terdapat pada fraksi tidak dapat ditahan.
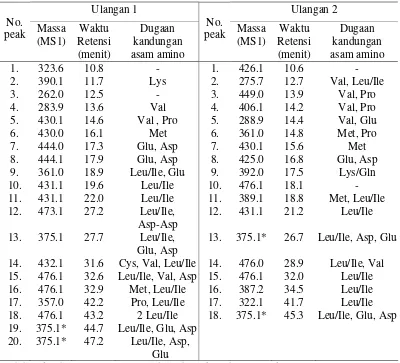
Hasil identifikasi MS/MS menunjukkan pada fraksi ini terdapat sekitar 20 senyawa (20 senyawa pada ulangan 1 dan 18 senyawa pada ulangan 2). Senyawa-senyawa ini diduga merupakan peptida dengan berat molekul berkisar dari 262.0 hingga 476.1 Dalton (Tabel 5). Jenis peptida yang ada pada ulangan 1 dan 2 berbeda-beda, hanya 4 jenis peptida yang diduga ada pada kedua ulangan yaitu peptida berberat molekul 430.0 (15.6 – 16.1 menit) yang mengandung Met, 375.1 (26.7 – 27.7 menit) yang mengandung Leu/Ile, Asp, Glu, 476.1 (32.0 – 32.6 menit) yang mengandung Leu/Ile, Val, Asp dan 375.1 (44.7 – 45.3 menit) yang mengandung Leu/Ile, Glu dan Asp. Dua dari peptida-peptida ini diduga mempunyai rasa gurih karena kedua peptida ini mengandung Glu dan Asp yang diduga mempunyai peranan terhadap pembentukan rasa gurih dari suatu peptida (Nakata et al. 1995). Peptida lainnya yang diduga mempunyai rasa gurih adalah peptida dengan berat molekul 444.0 (17.3 menit) dan 444.1 (17.9 menit) pada ulangan 1 serta peptida berberat molekul 425.0 (16.8 menit) pada ulangan 2. Ketiga peptida tersebut teridentifikasi mengandung Glu dan Asp (Tabel 5 dan Lampiran 8 dan 9).
Gambar 6 Kromatogram FTT hasil fraksinasi Fraksi 1 ulangan 1ikan asin jambal roti goreng (14 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit.
Tabel 5 Berat molekul senyawa dan dugaan kandungan asam amino yang ada
* diduga kandungan asam amino telah teridentifikasi dengan lengkap
dengan waktu retensi sekitar 26.7 dan 27. 7 menit mempunyai base peak pada m/z 376.1 sedangkan peptida dengan waktu retensi 44.7 dan 45.3 menit mempunyia base peak pada m/z 247.0.
b. Fraksi A
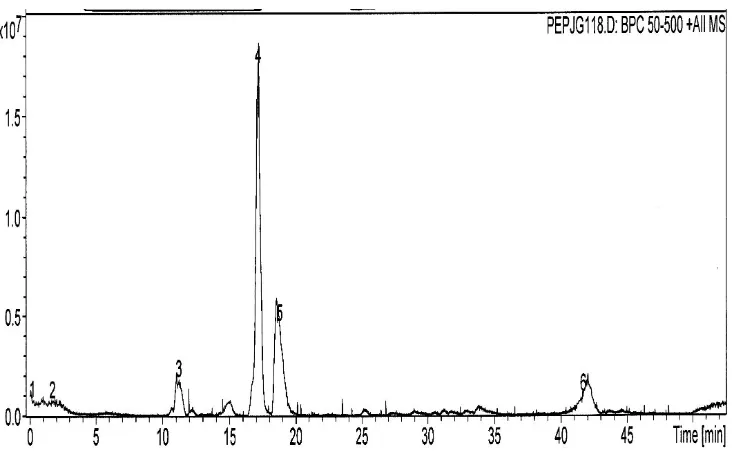
Fraksi berikutnya adalah Fraksi A yang mengandung senyawa-senyawa yang sangat polar karena dielusi menggunakan air bebas ion. Pemisahan senyawa-senyawa yang ada pada fraksi ini, baik pada ulangan 1 maupun ulangan 2, juga tidak optimal seperti pada FTT (Gambar 8 dan 9). Bentuk peak yang melebar dan tidak tajam menunjukkan bahwa kemungkinan terdapat lebih dari satu senyawa pada masing-masing peak yang tidak dapat dipisahkan dengan sistem gradien yang diterapkan pada LC. Diduga senyawa-senyawa yang ada pada Fraksi 1 ekstrak ikan asin jambal roti merupakan senyawa-senyawa yang sangat polar sehingga mempunyai waktu retensi yang hampir bersamaan.
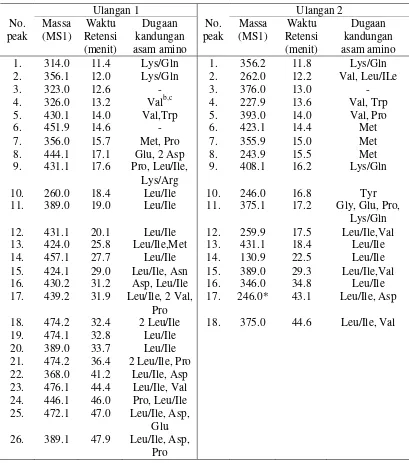
Kandungan senyawa, yang diduga peptida, pada fraksi ini berbeda antara ulangan 1 dengan ulangan 2. Pada ulangan 1 terdapat 26 senyawa, sedangkan pada ulangan 2 terdapat 18 senyawa (Tabel 6). Perbedaan ini dapat disebabkan oleh perbedaan waktu penyimpanan ikan asin jambal roti sehingga penguraian protein menjadi peptida-peptida juga berbeda. Semakin banyak jumlah peptida berberat molekul kecil menunjukkan semakin banyaknya protein yang diuraikan yang sebanding dengan lamanya waktu penyimpanan. Dari sekian banyaknya peptida yang terkandung pada Fraksi A, hanya 2 jenis peptida yang terdapat pada kedua ulangan yaitu peptida berberat molekul 356.1 dengan waktu retensi 12.0 menit pada ulangan 1 dan 11.8 menit pada ulangan 2 dan peptida berberat molekul 356.0 dengan waktu retensi 15.7 dan 15.0 menit secara berurutan untuk ulangan 1 dan 2. Walaupun kedua peptida tersebut mempunyai berat molekul yang sama, tetapi kandungan asam aminonya berbeda. Pada peptida yang terelusi pada waktu 11.8 dan 12.0 menit mengandung asam amnio Lys/Gln yang ditandai adanya peak dengan m/z 146.9 [Lys/Gln+H]+ dan 129.9 [Lys/Gln+H-NH3]+ (Lampiran 11 dan
12). Asam amino Lys dan Gln sulit dibedakan karena mempunyai berat molekul yang sama, akan tetapi peptida ini diduga mengandung asam amino Lys yang
Gambar 8 Kromatogram Fraksi A hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (23.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit.
Gambar 9 Kromatogram Fraksi A hasil fraksinasi Fraksi 1 ulangan 2 ikan asin jambal roti goreng (7.8 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit.
Tabel 6 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi A Fraksi 1 ekstrak ikan asin jambal roti ulangan 1 dan 2
Ulangan 1 Ulangan 2
(Covey et al., 1991). Sedangkan peptida dengan waktu retensi lebih banyak menunjukkan mengandung asam amino Met yang ditandai adanya peak dengan m/z 149.8 [Met+H]+, 132.8 [Met+H-NH3]+ dan 103.9 yang merupakan ion
immonium dari Met (Lampiran 11 dan 12).
Pada ulangan 1, keberadaan Glu hanya terdeteksi pada 2 peptida yaitu peptida dengan BM 444.1 (17.1 menit) dan 472.1 (47.0 menit). Selain Glu, pada kedua peptida ini juga terdeteksi adanya Asp, sehingga peptida ini diduga mempunyai rasa gurih. Sedangkan pada ulangan 2, terdapat 1 peptida yang mengandung Glu yaitu peptida dengan berat molekul 375.1 (17.2 menit). Pada peptida ini, tidak terdeteksi adanya Asp akan tetapi terdeteksi adanya Gly yang diketahui berperan penting bersamaan dengan Lys terhadap pembentukan rasa gurih oktapeptida BMP dari kaldu daging sapi (Yamasaki dan Maekawa 1980 di dalam Nishimura dan Kato 1988). Asam amino Lys sulit dibedakan dengan Gln karena merupakan isomernya. Akan tetapi, penelitian dari Petritis et al. (2002) menunjukkan dipeptida yang mengandung Lys dapat dibedakan dengan dipeptida yang mengandung Gln yaitu adanya ion dengan m/z 129 yang dihasilkan dipeptida yang mengandung Lys tetapi tidak oleh peptida yang mengandung Gln. Adapun peptida yang ada pada fraksi ini menghasilkan ion dengan m.z 129 (Lampiran 11 dan 12) sehingga diduga asam amino yang ada pada peptida ini adalah Lys. Berdasarkan hal tersebut, diduga peptida ini berpotensi mempunyai rasa gurih.
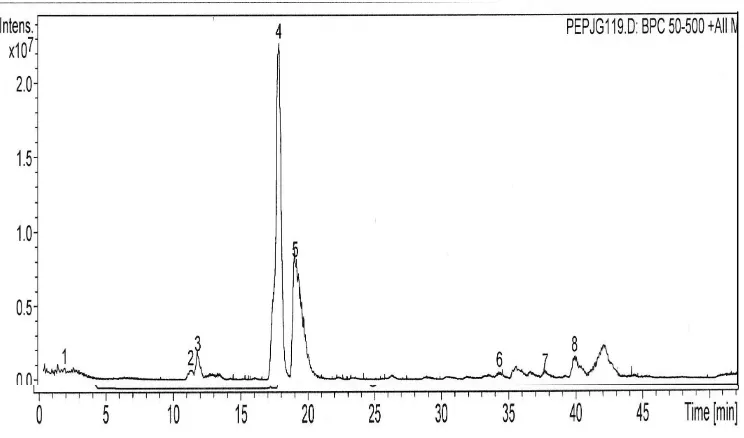
c. Fraksi B
Fraksi B mengandung senyawa-senyawa dengan tingkat kepolaran 10% asetonitril dalam air bebas ion. Pada fraksi ini terdapat 25 senyawa pada ulangan 1 dan 21 senyawa pada ulangan 2 (Gambar 10 dan 11). Peak-peak yang ada pada kromatogram Fraksi B masih menunjukkan banyaknya senyawa-senyawa yang belum terisahkan secara optimal. Hal ini menunjukkan bahwa pada Fraksi B banyak terdapat senyawa-senyawa yang polar.
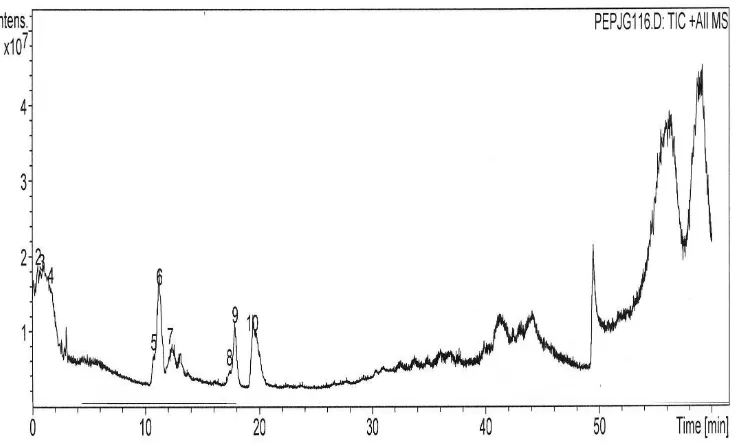
Gambar 10 Kromatogram Fraksi B hasil fraksinasi Fraksi 1 ulangan 1 ikan asin jambal roti goreng (16.5 mg/ml) menggunakan kolom C8, elusi gradien 2% ACN yang mengandung 0.1% asam format hingga 50% ACN yang mengandung 0.1% asam format selama 50 menit, flow rate 0.1 ml/menit.
Tabel 7 Berat molekul senyawa dan dugaan kandungan asam amino yang ada pada Fraksi B Fraksi 1 ekstrak ikan asin jambal roti ulangan 1 dan 2
Ulangan 1 Ulangan 2
402.0 (50.6 menit pada ulangan 1 dan 50.7 pada ulangan 2) yang mengandung Leu/Ile. Fragmentasi ion-ionnya dapat dilihat pada Lampiran 13 dan 14.
Pada Fraksi B ulangan 2, identifikasi senyawa dimulai pada peak ketiga dengan waktu retensi 11.6 menit (Tabel 7). Hal ini disebabkan peak 1 dan 2 merupakan peak yang ada hampir pada semua fraksi sehingga diduga peak-peak tersebut merupakan pengotor. Peak-peak-peak ini juga mempunyai profil MS yang sama dengan peak-peak yang keluar pada waktu retensi diatas 50 menit.
d. Fraksi C
Fraksi berikutnya adalah Fraksi C yang mengandung senyawa-senyawa yang mempunyai kepolaran setara dengan 15% asetonitril dalam air bebas ion. Pada fraksi ini, ulangan 1 menunjukkan bahwa pada fraksi ini tidak mengandung satu senyawa pun (Gambar 12). Hal ini sesuai dengan hasil penimbangan padatan fraksi ini yang menunjukkan bahwa pada fraksi ini tidak terdapat padatan (0 mg). Adapun peak-peak yang terdeteksi adalah peak-peak pengotor yang hampir selalu ada pada setiap fraksi, yaitu peak-peak dengan waktu retensi kurang dari 3 menit dan lebih dari 50 menit. Adanya peak ini memperkuat dugaan bahwa peak-peak tersebut adalah pengotor karena pada fraksi yang tidak ada padatannya pun peak-peak ini tetap ada.
Berbeda dengan ulangan pertama, Fraksi C ulangan kedua masih dapat dideteksi mengandung 5 senyawa walaupun peak-peaknya tidak setinggi fraksi-fraksi lainnya (Gambar 13). Dari kelima senyawa tersebut, hanya 1 senyawa yang dapat dideteksi adanya asam amino (Tabel 8) yaitu peptida dengan berat molekul 356.1 dengan waktu retensi 11.3 menit. Peptida ini mengandung asam amino Lys/Gln, dimana fragmentasi ionnya dapat dilihat pada Lampiran 15.