RESPONS PEMBERIAN COUMARIN TERHADAP PRODUKSI MIKRO TUBER PLANLET KENTANG (Solanum tuberosumL.)
VARIETAS GRANOLA
SKRIPSI OLEH:
VIVI ULFIA HASNI / 090301191
BUDIDAYA PERTANIAN DAN PERKEBUNAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
RESPONS PEMBERIAN COUMARIN TERHADAP PRODUKSI MIKRO TUBER PLANLET KENTANG (Solanum tuberosumL.)
VARIETAS GRANOLA
SKRIPSI OLEH :
VIVI ULFIA HASNI / 090301191
BUDIDAYA PERTANIAN DAN PERKEBUNAN
Skripsi sebagai salah satu syarat memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Respons Pemberian Coumarin Terhadap Produksi Mikro Tuber Planlet Kentang (Solanum tuberosum L.) Varietas Granola Nama : Vivi Ulfia Hasni
NIM : 090301191
Program Studi : Agroekoteknologi
Minat : Budidaya Pertanian dan Perkebunan
Disetujui Oleh : Komisi Pembimbing
Ir. Asil Barus, MS. Ferry Ezra T. Sitepu SP, MSi. Ketua Anggota
Diketahui Oleh :
ABSTRAK
VIVI ULFIA HASNI : Respons Pemberian Coumarin Terhadap Produksi Mikro Tuber Planlet Kentang (Solanum tuberosum L.) Varietas Granola, dibimbing oleh ASIL BARUS dan FERRY EZRA T. SITEPU.
Penelitian ini bertujuan untuk mengetahui respons pemberian coumarin terhadap produksi mikro tuber planlet kentang (Solanum tuberosum L.) varietas Granola. Penelitian dilaksanakan di Laboratorium Kultur Jaringan Kebun Percobaan Brastagi yang berada pada ketinggian ± 1340 m di atas permukaan laut, mulai dari bulan Oktober 2013 hingga Februari 2014, menggunakan rancangan acak lengkap faktorial dengan dua faktor yaitu konsentrasi coumarin (kontrol; 0,025; 0,050; dan 0,075 gram/l) dan volume coumarin (30, 60, 90, dan 120 ml). Parameter yang diamati adalah persentase planlet yang menghasilkan umbi mikro, persentase planlet yang mati, jumlah umbi mikro, bobot umbi mikro per planlet, bobot per umbi mikro, dan diameter umbi mikro.
Hasil penelitian menunjukkan bahwa pemberian konsentrasi coumarin bepengaruh nyata terhadap persentase planlet yang menghasilkan umbi mikro (1-2 BSA) dan diameter umbi mikro per planlet. Volume coumarin berpengaruh nyata terhadap persentase planlet yang menghasilkan umbi mikro (1-2 BSA), jumlah umbi mikro per planlet, bobot umbi mikro per planlet, bobot per umbi mikro dan diameter umbi mikro per planlet.
ABSTRACT
VIVI ULFIA HASNI : Response in giving coumarin on production of Micro-Tuber
Plantlets Potato (Solanum tuberosum L.) Varieties Granola, supervised by ASIL BARUS and FERRY EZRA T. SITEPU.
The aim of this experiment is to determine the response to the administration of coumarin in micro-tuber production of potato plantlets (Solanum tuberosum L.) varieties of granola. The research was conducted at Tissue Culture Laboratory Experiment Berastagi at ± 1340 m above sea level, starting from October 2013 until February 2014 using a completely randomized
factorial design with two factors, that is concentrations of coumarin (control; 0,025;
0,050; and 0,075 gram/l) and the volume of coumarin (30, 60, 90, 120 ml).
Parameters observed were the percentage of plantlets which produces micro tubers, the percentage of plantlets were dead, the number of tubers on each micro planlet, the weight of tubers on each micro planlet, weight of each micro tuber, and diametres of tuber in each planlet.
The results showed that administration of coumarin concentration significantly affected the percentage of plantlets which produces micro tubers (1-2 BSA) and the diameter of micro tubers of each plantlet. Coumarin volume significantly affect the percentage of plantlets which produces micro tubers (1-2 BSA), the number of tubers on each micro planlet, the weight of tubers on each micro planlet, weight of each micro tuber, and diametres of tuber in each planlet.
RIWAYAT HIDUP
Penulis dilahirkan di Lhokseumawe pada tanggal 17 Februari 1991 dari
ibu Nuryani dan ayah Hasbuh Yahya. Penulis merupakan putri ketiga dari tiga
bersaudara.
Tahun 2009 penulis lulus dari SMA Negeri 1 di Lhokseumawe dan pada
tahun yang sama masuk ke Fakultas Pertanian USU melalui jalur Seleksi Nasional
Masuk Perguruan Tinggi Negeri (SNMPTN). Penulis memilih minat Budidaya
Pertanian dan Perkebunan, Program Studi Agroekoteknologi.
Selama mengikuti perkuliahan, penulis aktif sebagai pengurus Himpunan
Mahasiswa Agroekoteknologi (Himagrotek), sebagai asisten praktikum di
Laboratorium Budidaya Tanaman Obat dan Rempah dan Laboratorium Dasar
Agronomi.
Penulis melaksanakan praktek kerja lapangan (PKL) di PT. Perkebunan
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa,
karena atas berkat dan kasih karunia-Nya lah penulis dapat menyelesaikan skripsi
yang berjudul “Respons Pemberian Coumarin Terhadap Produksi Mikro Tuber
Planlet Kentang (Solanum tuberosum L.) Varietas Granola”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada bapak
Ir. Asil Barus, MS. dan bapak Ferry Ezra T. Sitepu SP, MSi. selaku ketua dan
angota komisi pembimbing yang telah banyak memberikan masukan dan
bimbingan kepada penulis selama proses penulisan dan penyelesaian skripsi ini,
serta Ibu Rina Christina Hutabarat, SP. selaku pembimbing lapangan. Penulis
mengucapkan terimakasih kepada kedua orang tua yang telah memberikan
dukungan finansial dan spiritual. Ucapan terimakasih juga ditujukan kepada
seluruh staf pengajar, pegawai serta sahabat dan teman di lingkungan Fakultas
Pertanian Universitas Sumatera Utara yang telah berkontribusi dalam kelancaran
studi dan penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, untuk itu
penulis mengharapkan saran dan kritik yang bersifat membangun. Semoga hasil
skripsi ini bermanfaat bagi budidaya kentang serta bermanfaat bagi pihak yang
membutuhkan. Akhir kata penulis mengucapkan terimakasih.
Medan, April 2014
DAFTAR ISI Persentase Planlet Yang Menghasilkan Umbi Mikro (%) ... 19
Persentase Planlet Yang Mati (%) ... 20
Bobot Umbi Mikro Per Planlet (gram) ... 20 Bobot Per Umbi Mikro (gram) ... 20 Diameter Umbi Mikro Per Planlet (mm) ... 20
HASIL DAN PEMBAHASAN
Hasil ... 21 Pembahasan ... 36
KESIMPULAN DAN SARAN
Kesimpulan ... 40 Saran ... 40
DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal.
1. Rataan persentase planlet yang menghasilkan umbi mikro (%) 1-2 BSA pada perlakuan konsentrasi dan volume coumarin ... 22 2. Rataan persentase planlet yang mati (%) pada perlakuan konsentrasi
dan volume coumarin ... 27 3. Rataan jumlah umbi mikro per planlet (umbi) pada perlakuan
konsentrasi dan volume coumarin ... 28 4. Rataan bobot umbi mikro per planlet (gram) pada perlakuan
konsentrasi dan volume coumarin ... 30 5. Rataan bobot per umbi mikro (gram) pada perlakuan konsentrasi dan
volume coumarin ... 32 6. Rataan diameter umbi mikro per planlet (mm) pada perlakuan
konsentrasi dan volume coumarin ... 34
DAFTAR GAMBAR
No. Hal.
1. Hubungan persentase planlet yang menghasilkan umbi mikro 1 BSA dengan perlakuan konsentrasi coumarin ... 24 2. Hubungan persentase planlet yang menghasilkan umbi mikro
1 BSA dengan perlakuan volume coumarin ... 24 3. Hubungan persentase planlet yang menghasilkan umbi mikro
2 BSA dengan perlakuan konsentrasi coumarin ... 25 4. Hubungan persentase planlet yang menghasilkan umbi mikro
2 BSA dengan perlakuan volume coumarin ... 26 5. Hubungan jumlah umbi mikro per planlet dengan perlakuan volume
coumarin ... 29 6. Hubungan bobot umbi mikro per planlet dengan perlakuan volume
coumarin ... 31 7. Hubungan bobot per umbi mikro dengan perlakuan volume coumarin ... 33 8. Hubungan diameter umbi mikro per planlet dengan perlakuan
konsentrasi coumarin ... 35 9. Hubungan diameter umbi mikro per planlet dengan perlakuan volume
DAFTAR LAMPIRAN
No. Hal.
1. Deskripsi kentang varietas granola ... 43
2. Komposisi media murashige dan skoog (ms) ... 44
3. Bagan penelitian ... 45
4. Rencana kegiatan penelitian ... 46
5. Data persentase planlet yang menghasilkan umbi mikro 1 BSA (%) ... 47
6. Sidik ragam persentase planlet yang menghasilkan umbi mikro 1 BSA ... 47
7. Data persentase planlet yang menghasilkan umbi mikro 1 BSA (%) setelah transformasi arcsin ... 48
8. Sidik ragam persentase planlet yang menghasilkan umbi mikro 1 BSA setelah transformasi arcsin ... 48
9. Data persentase planlet yang menghasilkan umbi mikro 2 BSA (%) ... 49
10. Sidik ragam persentase planlet yang menghasilkan umbi mikro 2 BSA ... 49
11. Data persentase planlet yang menghasilkan umbi mikro 2 BSA (%) setelah transformasi arcsin ... 50
12. Sidik ragam persentase planlet yang menghasilkan umbi mikro 2 BSA setelah transformasi arcsin ... 50
13. Data persentase planlet yang mati (%) ... 51
14. Sidik ragam persentase planlet yang mati ... 51
15. Data persentase planlet yang mati (%) setelah transformasi arcsin ... 52
16. Sidik ragam persentase planlet yang mati setelah transformasi arcsin ... 52
17. Data jumlah umbi mikro (umbi) ... 53
23. Data bobot umbi mikro per planlet (gram) setelah transformasi �X + 0,5 ... 56
31. Data diameter umbi mikro per planlet (mm) setelah transformasi
�X + 0,5 ... 60
32. Sidik ragam diameter umbi mikro per planlet setelah transformasi �X + 0,5 ... 60
33. Foto sprout yang telah di tanam di media MS ... 61
34. Foto planlet yang telah di sub-kultur ... 61
35. Foto umbi per perlakuan ... 62
36. Foto planlet kentang varietas granola ... 64
PENDAHULUAN Latar Belakang
Kentang (Solanum tuberosum L.) berasal dari negara beriklim dingin (Belanda, Jerman). Tanaman kentang sudah dikenal di Indonesia (Pengalengan,
Lembang, dan Karo) sejak sebelum perang dunia II yang disebut Eugenheimer.
Kentang merupakan hasil seleksi di Negara Belanda pada tahun 1890, berkulit
umbi kekuning – kuningan, berdaging kuning, dan rasanya enak. Kelemahan dari
kentang ini adalah peka terhadap penyakit busuk daun, virus Y dan A, dan peka
terhadap penyakit layu (Soelarso, 1997).
Kentang merupakan tanaman hortikultura yang mempunyai prospek cerah
untuk terus dikembangkan. Hal ini dikarenakan kentang mempunyai kandungan
zat karbohidrat yang lebih tinggi dibandingkan dengan beras, gandum atau jagung
sehingga dapat membantu memenuhi kebutuhan pangan pokok masyarakat. Selain
itu, kentang banyak digunakan oleh beberapa kalangan tertentu seperti penderita
diabetes dan yang sedang menjalani diet karena kadar gula yang terkandung
dalam kentang rendah.
Menurut Badan Pusat Statistik (2012), produksi kentang pada tahun 2011
adalah 123,078 ton. Hasil tersebut mengalami penurunan sebesar 2,48%
dibandingkan produksi kentang tahun 2010 yaitu 126,203 ton. Penurunan
produksi kentang ini diperkirakan terjadi akibat penurunan luas panen sebesar 769
hektar (9,65%).
Rendahnya produktivitas kentang di Indonesia disebabkan oleh :
1. Rendahnya mutu benih yang digunakan oleh petani;
3. Menanam kentang secara terus – menerus;
4. Kehilangan hasil akibat serangan hama dan penyakit;
5. Umur panen yang kurang tepat;
6. Penyimpanan yang kurang baik;
7. Permodalan petani yang terbatas
(Soelarso, 1997).
Kendala yang dihadapi petani kentang Indonesia adalah sulitnya
memperoleh umbi yang berkualitas tinggi, karena umumnya benih lokal yang
digunakan saat ini sudah mengalami kemunduran (degenerasi) dan tertular dengan
berbagai macam penyakit, terutama disebabkan oleh virus. Hal ini menyebabkan
rendahnya produktifitas kentang, sehingga hasil yang diperoleh petani sedikit.
Mengatasi masalah ini, perlu dilakukan pembenihan kentang yang menghasilkan
benih bebas virus dan penyakit serta berkualitas tinggi (Mariani, 2011).
Usaha untuk memperbaiki kualitas kentang di Indonesia telah
dilaksanakan dengan beberapa program kegiatan. Salah satunya adalah melalui
perbanyakan mikro, diantaranya penanaman stek secara in vitro yang merupakan aspek yang menarik dari penerapan kultur jaringan. Metode kultur jaringan
merupakan cara untuk menghasilkan kentang bebas virus disamping itu tanaman
dapat diperbanyak setiap saat tanpa tergantung musim karena dilakukan di ruang
tertutup, daya multiplikasinya tinggi dari bahan tanaman yang kecil, tanaman
yang dihasilkan seragam, dan bebas penyakit terutama bakteri dan cendawan
(Sakya, dkk., 2002).
Zat penghambat tumbuh merupakan faktor yang menentukan tipe
dan penghambat biosintesis GA. Pada pengumbian kentang secara in vitro, retardan berperan penting dalam mendorong pembentukan umbi mikro,
terhambatnya pertumbuhan dapat meningkatkan akumulasi asimilat pada batang
dan daun sehingga mampu menginduksi terbentuknya umbi (Dewi, 2011).
Untuk mendapatkan umbi mikro kentang yang bermutu dalam waktu yang
relatif pendek perlu pemberian zat pengatur tumbuh pada media, karena pembentukan
umbi mikro secara in vitro tergantung dari nisbah zat tumbuh pendorong dan
penghambat pengumbian. Nisbah ini dapat dilakukan dengan pemberian pendorong,
mengurangi penghambat, atau kombinasi keduanya. Zat penghambat tumbuh yang
berperan dalam pengumbian diantaranya adalah coumarin dan aspirin, sedangkan zat
pendorongnya adalah sitokinin (Sakya, dkk., 2002).
Varietas kentang yang digunakan dalam penelitian ini adalah varietas
granola. Menurut Hani (2012), varietas granola tahan terhadap penyakit kentang
umumnya, misalnya bila daya serang suatu penyakit terhadap varietas kentang
lain bisa 30%, tetapi granola hanya 10%. Umur panen normal 90 hari, meskipun
umur 80 hari sudah bisa dipanen.
Berdasarkan uraian di atas maka penulis tertarik untuk melakukan
penelitian untuk mengetahui lebih jauh respon pemberian coumarin terhadap
produksi mikro tuber planlet kentang varietas Granola.
Tujuan Penelitian
Untuk mengetahui respons pemberian coumarin terhadap produksi mikro
Hipotesis Penelitian
Ada repsons pemberian konsentrasi dan volume coumarin terhadap
produksi mikro tuber planlet kentang varietas Granola serta interaksi kedua faktor
tersebut.
Kegunaan Penelitian
Penelitian ini berguna sebagai bahan penulisan skripsi yang merupakan
salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara, Medan dan sebagai bahan informasi bagi pihak yang
TINJAUAN PUSTAKA Botani Tanaman
Menurut Hartus (2001), kentang (Solanum tuberosum L.) masih satu famili dengan cabai, tomat, terung, paprika, dan tembakau. Kentang termasuk
dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae,
ordo (bangsa) Tubiflorae, suku (famili) Solanaceae, genus (marga) Solanum, dan
spesies (jenis) Solanum tuberosum L.
Tanaman kentang yang berasal dari umbi tidak terdapat akar utama tetapi
hanya akar halus atau akar serabut saja yang panjangnya dapat mencapai 60 cm.
Dalam tanah, akar – akar banyak terdapat pada kedalaman 20 cm
(Soelarso, 1997).
Batang di bawah permukaan tanah (rizoma), umumnya disebut stolon,
menimbun dan menyimpan produk fotosintesis dalam umbi yang membengkak
dekat bagian ujung. Karbohidrat ditranslokasikan sebagai sukrosa ke dalam
stolon, yang pembelahan dan pembesaran selnya menyebabkan pertumbuhan
umbi; sukrosa yang ditransportasikan dikonversi dan disimpan dalam bentuk
butiran pati (Rubatzky dan Yamaguchi, 1998).
Daun tanaman kentang merupakan daun majemuk yang terdiri atas tangkai
daun utama (rachis), anak daun primer (pinnae), dan anak daun sekunder (folioles)
yang tumbuh pada tangkai daun utama diantara anak daun primer. Bagian rachis
di bawah pasangan daun primer yang terbawah disebut petiola (Soelarso, 1997).
Bunga yang bergerombol membentuk tandan simosa, memiliki lima
lembar mahkota yang menyatu, dengan warna berkisar antara putih hingga merah
dengan perantaraan angin, tetapi serangga dapat juga melakukan penyerbukan
(Rubatzky dan Yamaguchi, 1998).
Satu minggu setelah penyerbukan, bakal buah membesar dan berkembang
menjadi buah. Buah kentang berwarna hijau tua sampai keunguan, berbentuk
bulat, bergaris tengah ± 2 ½ cm dan berongga dua. Buah kentang mengandung
500 bakal biji dan yang dapat berkembang menjadi biji hanyalah berkisar antara
10 – 300 biji. Buah kentang dapat dipanen kira – kira 6 – 8 minggu setelah
penyerbukan (Soelarso, 1997).
Secara morfologi, umbi adalah batang pendek, tebal dan berdaging dengan
daun berubah menjadi kerak atau belang, berdampingan dengan tunas samping
(aksilar), yang dikenal sebagai mata. Tunas tersebut membentuk susunan spiral
yang tertekan pada permukaan umbi, dengan jumlah yang makin banyak
mendekati titik apikal. Mata berada pada belang ketiak daun yang tetap dorman
selama pembesaran umbi. Permukaan umbi dapat halus atau kasar akibat jala-jala
dengan warna epidermis coklat hingga coklat cerah, merah atau ungu tua. Warna
daging umbi biasanya kuning muda atau putih; ada kultivar yang berwarna kuning
cerah, jingga, merah atau ungu. Bentuk umbi beragam; memanjang, kotak, bulat
atau pipih (Rubatzky dan Yamaguchi, 1998).
Syarat Tumbuh Iklim
Di Indonesia, tanaman kentang diusahakan di daerah yang memiliki
ketinggian 500 m – 3000 m di atas permukaan laut, dan pada ketinggian optimum
antara 1000 – 2000 m di atas permukaan laut. Suhu yang paling tepat bagi
malam hari. Suhu yang cocok selama periode pertumbuhan dari bertunas sampai
stadium primordia bunga adalah 12o C – 16o C. Jika suhu rata-rata melebihi 23o C,
daun biasanya akan menjadi kecil dan jarak antar ruas menjadi panjang
(Soelarso, 1997).
Tanaman kentang menghendaki penyinaran penuh. Naungan berpengaruh
negatif terhadap pertumbuhan dan perkembangannya. Kerapatan fluks intensitas
radiasi surya rendah akan mengakibatkan laju fotosintesis menurun. Beberapa
kultivar kentang menghendaki hari pendek (short day). Maksudnya lama penyinaran kurang dari 12 jam. Namun ada pula kultivar yang menghendaki hari
panjang (long day), yakni 16 – 18 jam (Hartus, 2011).
Berdasarkan tipe fotosintesis, tumbuhan dibagi ke dalam tiga kelompok
besar, yaitu C3, C4 dan CAM (crassulacean acid metabolism). Tumbuhan C4 dan CAM lebih adaptif di daerah panas dan kering dibandingkan dengan tumbuhan
C3. Sebagian besar tanaman pertanian seperti gandum, kentang, kedelai, kacang –
kacangan, dan kapas merupakan tanaman dari kelompok C3 (Deptan, 2010).
Curah hujan yang diketahui tanaman kentang adalah antara
200 mm – 300 mm tiap bulan atau rata – rata 1000 mm selama masa
pertumbuhan. Pertumbuhan kentang pada periode awal sampai pertengahan, saat
daun sedang aktif tumbuh, memerlukan air adalah jumlah yang cukup. Sedangkan
pada periode pertengahan sampai akhir membutuhkan keadaan yang sedikit
kering. Kelembapan tanah yang paling baik adalah 40% - 60%. Kelembapan udara
Tanah
Tanah dengan pH antara 5 – 5,5 paling optimal untuk pertumbuhan dan
perkembangan tanaman kentang. Pada pH kurang dari 5, tanaman mudah
terserang penyakit bintil – bintil pada umbi yang disebabkan oleh serangan
nematoda. Di samping itu, tanaman akan mengalami defisiensi fosfor (P) dan
magnesium (Mg) serta keracunan mangan (Mn). Pada pH tinggi, tanaman
mengalami defisiensi kalium (K) (Hartus, 2001).
Tanaman kentang dapat tumbuh baik pada tanah yang mempunyai struktur
cukup halus atau gembur, drainase baik, tanpa lapisan kedap air, debu atau debu
berpasir, dan sedikit kering, dengan pH 5,0 – 6,5 (Soelarso, 1997).
Permeabilitas tanah menggambarkan kemampuan tanah untuk dapat
ditembus oleh air. Porositas tanah melukiskan kemampuan tanah dalam menyerap
dan merembeskan air. Kedua sifat tanah ini penting bagi kentang karena drainase
tanah yang baik dibentuk oleh kedua sifat di atas. Selesai hujan, tidak boleh ada
genangan air. Hal ini dapat berlangsung apabila drainasenya baik. Tanah dengan
tekstur lempung berpasir sudah pasti mempunyai sistem drainase yang baik
(Hartus, 2001).
Umbi Mikro
Target mutu pada benih kentang adalah kesehatan benih (seed health) dan kebenaran varietasnya. Oleh karena itu persoalan pokok pada benih kentang
adalah bagaimana agar benih kentang yang diproduksi itu sehat, bebas dari infeksi
dan infestasi penyakit. Benih kentang yang dipakai sekarang berupa organ
vegetatif (umbi), sehingga sekalipun diperbanyak berkali-kali tidak akan terjadi
pada setiap generasi benih kentang yang diperbanyak/ditanam secara terus
menerus disebabkan oleh infestasi penyakit yang terakumulasi pada setiap
generasi dan terus terbawa pada regenerasi benih (Kuntjoro, 2000).
Propagula in vitro yang banyak digunakan dalam usaha menghasilkan benih kentang bermutu adalah tunas mikro dan umbi mikro (Wattimena 1991).
Selanjutnya propagula ini dapat digunakan untuk produksi umbi mini, yaitu umbi
dengan bobot 1 – 10 gram yang diinduksi dalam rumah kaca atau ketat serangga
(screen house). Umbi mini diinduksi secara in vitro sehingga biayanya lebih murah (Rainiyati, dkk., 2011).
Menurut Donelly, dkk., (2003) beberapa penelitian menunjukkan bahwa umbi
mikro dapat dimanfaatkan dalam produksi benih berupa generasi awal (G0) maupun
generasi lanjut bergantung pada kondisi lingkungan untuk memenuhi standar mutu
benih yang diharapkan.
Dalam penelitian ini persentase kontaminasi antara 20 - 30 % dari total
jumlah kultur. Kontaminasi ini merupakan faktor pembatas dalam keberhasilan
kultur jaringan yang dapat disebabkan atau berasal dari (a) bahan tanaman/eksplan
baik external maupun internal, (b) organisme yang masuk ke media/ kultur,
(c) peralatan yang kurang baik, (d) lingkungan kerja, ruang kultur yang tidak
mendukung, (e) kecerobohan dalam pelaksanaan. Jenis kontaminasi yang
ditemukan adalah jamur dengan hifa yang berwarna putih dan sedikit merah
muda, jamur yang berwarna hijau kehitaman, dan bakteri berwarna putih susu.
Jenis kontaminasi ini dapat dikenali dari penampakan fisiknya. Dari keempat
jenis kontaminasi jamur berwarna hijau kehitaman adalah kontaminasi
terbentuknya spora-spora berwarna hijau gelap dan mampu menutupi seluruh
permukaan media. Akibatnya tanaman tidak mampu bersaing dan akhirnya mati
(Karjadi dan Buchory, 2007).
Perbanyakan tanaman kentang dengan kultur jaringan dapat menghasilkan
benih berupa umbi mini dan umbi mikro. Penggunaan umbi mikro memiliki
beberapa keuntungan, yaitu bebas dari patogen terutama virus, menghasilkan
tanaman yang seragam, dan umur panen sama dengan propagul umbi biasa,
kebutuhan umbi mikro sebagai benih hanya 4-5 kg per hektar dibandingkan
dengan umbi biasa yang memerlukan 1-2 ton per hektar, mudah dalam
penyimpanan dan transportasi serta mudah memenuhi persyaratan karantina untuk
lalu lintas propagul baik dalam maupun luar negeri. Keuntungan lainnya adalah
tidak dibutuhkan lahan untuk memproduksi benih G0 dan tidak tergantung pada
iklim dan musim, sehingga benih G0 dapat diproduksi sepanjang tahun
(Halimah, dkk., 2008).
Ada beberapa faktor yang mempengaruhi pembentukan umbi mikro yaitu
temperatur, waktu penyinaran/photoperiode, konsentrasi sumber karbohidrat, zat
pengatur tumbuh yang dipergunakan dan kandungan nitrogen pada media tumbuh
(Karjadi dan Buchory, 2007).
Kriteria umbi mikro berkualitas baik adalah umbi dengan bobot basah
lebih dari 100 mg per umbi dan berdiameter 5-10 mm serta mempunyai bahan
kering lebih dari 14%. Umbi mikro dapat tumbuh secara langsung dari ketiak
tunas eksplan dan secara tidak langsung pada ketiak atau terminal tunas baru
Varietas Granola
Varietas adalah suatu kelompok tumbuhan tertentu asli di alam dalam
suatu spesies yang mempunyai ciri atau sifat tertentu. Yang dimaksud varietas
disini berbeda dengan pengertian orang awam. Istilah varietas yang sering
digunakan oleh orang awam sebenarnya lebih tepat disebut kultivar. Apabila
orang menyebut varietas Granola sebenarnya lebih tepat dikatakan kultivar
Granola. Varietas dalam pengertian botanis adalah subspesies (Hartus, 2001).
Di Indonesia, Balai Penelitian Tanaman Sayuran Lembang telah
mengoleksi plasma nutdah kentang lebih dari 300 nomor klon atau varietas.
Namun, varietas unggul yang telah dilepas (dirilis) baru sedikit, antara lain
varietas Cosima, Desiree, Eigenheimer, Patrones, Rapan 106, Cipanas, Thung
151 C, Segunung, Katela dan Granola. Dalam beberapa tahun terakhir dikenalkan
pula beberapa varietas unggul kentang indtroduksi, misalnya Hertha, LBC, dan
Atlantic. Diantara varietas – varietas unggul kentang, ternyata varietas Granola
dan Atlantic paling disukai konsumen (pasar) di dalam negeri. Varietas Granola
mempunyai sifat multiguna, baik untuk konsumen rumah tangga dan konsumen
lembaga, maupun sebagai bahan baku industri (Rukmana, 2002).
Saat ini yang ditanam secara luas oleh para petani adalah varietas Granola
dan sudah tersedia bibit bebas penyakit dari keturunan program kultur jaringan
(tissue cultur). Varietas – varietas lainnya yang ditanam oleh sebagian petani adalah varietas Diaman, Atlantik (benih impor) dan Herta (Soelarso, 1997).
Untuk pasar umum, dikehendaki kentang dengan warna umbi kuning dan
kadar gula tinggi. Itulah sebabnya masyarakat konsumen lebih memilih Granola
genjah (80 – 90 hari), dan tahan terhadap beberapa penyakit berbahaya. Potensi
hasil tinggi, yakni dapat mencapai 30 – 35 ton per hektar (Hartus, 2001).
Terjadi perbedaan respons antara varietas atlantik dengan granola, dimana
rata-rata waktu pembentukan umbi varietas granola lebih cepat dibandingkan
dengan atlantik, baik pada pemberian ekstrak daun gamal maupun pada pemberian
filtrat diplodia. Salah satu faktor yang mempengaruhi pertumbuhan maupun
produksi tanaman kentang adalah jenis tanaman yang berkaitan dengan genotipe.
Perbedaan waktu pembentukan umbi pada kedua varietas dikarenakan perbedaan
genotipe yang mempengaruhi proses metabolisme dalam jaringan tanaman. Cepat
lambatnya pembentukan umbi dipengaruhi oleh varietas, fotoperiode dan zat
pengatur tumbuh (Halimah, dkk., 2008).
Coumarin
Coumarin ialah suatu zat kimia yang menyebabkan pengembangan sel. Zat
ini lazim kedapatan di dalam tanaman. Penyelidikan membuktikan, bahwa
coumarin mempergiat pengembangan sel – sel pada koleoptil dan lembaran –
lembaran daun. Oleh karena itu, layaklah jika coumarin itu dimasukkan di dalam
golongan fitohormon (Dwidjoseputro, 1980).
Coumarin dan turunannya adalah antikoagulan utama. Coumarin tidak
larut air, namun 4-hydroxy mensubstitusi sifat asam lemah dengan molekul yang
membuatnya larut dalam air di bawah sedikit kondisi basa,
Pembentukan umbi mikro perlu diinduksi dengan pemberian sitokinin dan
retardan. Menurut Wattimena (2000) jenis sitokinin yang dapat digunakan terdiri dari
air kelapa 10 %, BA 5 mg/l, adenin sulfat 100 mg/l dan Benomyl 150 mg/l.
Jenis retardan yang biasa digunakan adalah Cycocel 600 mg/l, Alar (B9) 10 mg/l,
Coumarin 25 mg/l, Ancymidol 10 mg/l, Paclobutrazol 10 mg/l dan Uniconazol 3 mg/l
(Warnita, 2008).
Coumarin adalah fitokimia dengan seperti rasa vanili. Coumarin adalah
heterosiklik oksigen. Coumarin dapat terjadi baik secara bebas atau
dikombinasikan dengan glukosa (glikosida kumarin). Coumarin ditemukan dalam
beberapa tanaman, termasuk kacang tonka, lavender, licorice, stroberi, aprikot,
ceri, kayu manis, dan semanggi manis
Menurut Warnita (2008), jumlah umbi dipengaruhi oleh komposisi media
yang digunakan. Tampak bahwa jumlah umbi tertinggi didapat pada media yang
diberi alar.Pembentukan umbi mikro membutuhkan zat pengatur tumbuh sebagai
inisiator atau pendorong dalam pertumbuhan tanaman. Retardan (alar) mampu
merangsang pengumbian dengan jalan menghambat biosintesis giberelin yang
berperan dalam pertumbuhan tanaman. Terhambatnya pertumbuhan
mengakibatkan akumulasi asimilat pada batang dan daun sehingga mampu
menginduksi terbentuknya umbi.
Berdasarkan hasil pengamatan Sakya, dkk., (2002) rata-rata persentase
plantlet yang menghasilkan umbi terbanyak terdapat pada plantlet dengan
pemberian coumarin konsentrasi 45 mg/l, sedangkan plantlet tanpa pemberian
coumarin menunjukkan persentase paling kecil. Adanya penghambatan
45 mg/l akan mempercepat masuknya tanaman ke fase generatif karena energi
untuk melakukan pertumbuhan tersebut diakumulasikan untuk pembentukan
umbi. Dengan demikian, plantlet yang diperlakukan dengan coumarin konsentrasi
45 mg/l ini akan lebih banyak yang dapat menghasilkan umbi.
Pemberian coumarin berpengaruh nyata terhadap tinggi planlet, jumlah
planlet yang berumbi, jumlah buku, jumlah akar, waktu pembentukan umbi, dan
berat kering umbi. Jumlah planlet yang berumbi dari sepuluh ulangan mulai
1 MST sampai 8 MST mengalami peningkatan. Hal ini dikarenakan pertumbuhan
umbi mikro sangat baik dalam menyerap unsur hara pada media kultur dan adanya
penghambatan pertumbuhan vegetatif yang terjadi dengan pemberian coumarin
25 mg/l (Yudistira, 2010).
Semakin lama masa kultur semakin banyak fotosintat yang diperoleh,
selanjutnya fotosintat tersebut digunakan untuk menambah jumlah sel di seluruh
tubuh planlet, hasilnya planlet bertambah tinggi dan diameter batangnya semakin
besar. diameter planlet kentang setelah masa inkubasi selama 21 hari dalam
perlakuan intensitas cahaya 3000 lux lebih kecil ukurannya, tetapi setelah masa
inkubasi selama 28 hari ukuran diameter batang planlet kentang relatif tidak
berbeda satu dengan lainnya. Dalam percobaan terlihat pada planlet yang
dikulturkan dalam perlakuan dengan intensitas cahaya yang lebih rendah (3000
lux), tumbuh relatif lebih tinggi dengan diameter batang yang relatif lebih kecil
ukurannya (Pertamawati, 2010).
Pengumbian in vitro dapat terjadi karena kondisi lingkungan tumbuh dan
komposisi media yang digunakan mampu mendorong inisiasi umbi, terutama bila
salah satu faktor yang menentukan arah perkembangan kultur selain komposisi
medium, eksplan dan lingkungan kultur seperti suhu lingkungan yang rendah
(18-20 oC), keadaan gelap pada saat pengumbian dan konsentrasi sukrosa yang
tinggi. Hal ini juga dikarenakan fungsi dari inhibitor (coumarin) untuk
menginduksi pengumbian dengan cara menghambat sintesis giberelin dan proses
pertumbuhan secara umum, karena inisiasi umbi mikro membutuhkan gibberelin
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Kebun
Percobaan Berastagi yang berada pada ketinggian ± 1340 m di atas permukaan
laut pada bulan Oktober 2013 sampai Februari 2014.
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah planlet kentang
granola, media MS, coumarin, aquadest, alkohol, spiritus, agar-agar, gula pasir,
air kelapa muda, khlorox, pembersih dengan bahan aktif Natrium Alkil Benzena
Sulfonat, tisu, masker, sarung tangan, antispetik dengan bahan aktif Povidone
Iodine 10%, kain hitam dan label nama.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow, lampu
UV, botol kultur, petridish, gunting, pinset, bunsen, water distilator, kamera,
timbangan analitik, jangka sorong dan baki penanaman.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) dengan
2 faktor perlakuan, yaitu:
Faktor I = Konsentrasi Coumarin dengan 4 taraf
K0 = 0,000 gram/l
K1 = 0,025 gram/l
K2 = 0,050 gram/l
K3 = 0,075 gram/
Faktor II = Volume Coumarin per 200 cc botol kultur dengan 4 taraf:
V2 = 60 ml
V3 = 90 ml
V4 = 120 ml
Sehingga diperoleh 16 kombinasi perlakuan, yaitu:
K0V1 K1V1 K2V1 K3V1
K0V2 K1V2 K2V2 K3V2
K0V3 K1V3 K2V3 K3V3
K0V4 K1V4 K2V4 K3V4
Jumlah ulangan : 2 ulangan
Jumlah eksplan/botol kultur : 5 eksplan
Jumlah botol kultur seluruhnya : 32 botol
Jumlah eksplan seluruhnya : 160 eksplan
Data hasil penelitian dianalisis dengan menggunakan sidik ragam dengan
model linear sebagai berikut :
Yijk = µ + αi + βj + (αβ)ij + εijk
i = 1,2,3,4 j = 1,2,3,4 k = 1,2
dimana :
Yijk : Hasil pengamatan pada blok ke-i akibat pengaruh konsentrasi coumarin
(K) taraf ke-j dan pengaruh volume coumarin (V) pada taraf ke-k
µ : Nilai tengah
αi : Efek perlakuan konsentrasi coumarin pada taraf ke-i
βj : Efek perlakuan volume coumarin pada taraf ke-j
(αβ)ij : Interaksi antara perlakuan konsentrasi coumarin taraf ke-i dan perlakuan
εijk : Galat dari blok ke-i, konsentrasi coumarin ke-j dan volume coumarin
ke-k
Jika dari hasil analisis sidik ragam menunjukkan pengaruh yang nyata, maka
dilanjutkan dengan uji beda rataan berdasarkan Duncan Multiple Range Test
(DMRT) pada taraf 5 %.
Pelaksanaan Penelitian Pensterilan Alat
Alat – alat yang digunakan dalam penelitian ini seperti botol kultur,
petridish, gunting, dan pinset disterilkan di dalam autoklaf selama 60 menit
dengan suhu 121o C.
Persiapan Media Tanam
Dalam penelitian ini, media tanam yang digunakan adalah media
Murashige dan Skoog (MS). Larutan stok media MS yang telah dipersiapkan
terlebih dahulu ditakar sesuai takaran yang ada (Lampiran 2). Setelah itu,
dimasukkan ke dalam botol kultur berukuran 200 cc yang telah di sterilisasi
terlebih dahulu sebanyak 25 ml.
Persiapan Bahan Tanam
Bahan tanam yang digunakan berasal dari kentang hasil stek sprout (stek
tunas) varietas Granola yang berjumlah 160 stek.
Penanaman Eksplan
Sebelum dilakukan penanaman di Laminar Air Flow, terlebih dahulu
Laminar Air Flow dihidupkan selama 1 jam untuk mensterilkan Laminar Air
Flow. Sambil menunggu Laminar Air Flow di sterilkan, sprout (tunas) yang
dalam Povidone Iodine 10% selama 5 menit. Setelah sprout di sterilkan dan
Laminar Air Flow siap digunakan, sprout di tanam ke dalam botol kultur yang
telah berisi media MS sebanyak 5 tunas dan botol kultur diletakkan di dalam
ruang kultur yang bersuhu 23 oC. Setelah tunas tumbuh setinggi mulut botol
kultur (2-3 Minggu Setelah Tanam (MST)), tunas tersebut di sub-kultur menjadi 3
bagian. Diusahakan bagian tunas dan pertumbuhannya bagus. Tunas yang sudah
di sub-kulturkan tersebut ditanam kembali ke media MS yang baru sebanyak 5
tunas (tunas berdaun 2). Setelah tumbuh sampai mulut botol kultur, di sub-kultur
kembali dan di tanam ke media MS baru (dalam penelitian ini sub-kultur
dilakukan sebanyak 2 kali) dan diletakkan di rak kultur yang ditutupi dengan kain
hitam yang bersuhu 18 oC. Jumlah eksplan dalam botol berjumlah 5 eksplan.
Aplikasi Coumarin
Hal pertama yang dilakukan adalah menghitung coumarin sebanyak 0,025
gram, 0,050 gram dan 0,075 gram. Kemudian masing-masing konsentrasi
coumarin dilarutkan ke dalam 1 liter aquadest. Setelah itu, di aplikasikan pada
planlet yang telah berumur 3 MST dengan konsentrasi coumarin (0,000 gram/l,
0,025 gram/l, 0,050 gram/l dan 0,075 gram/l) dan volume coumarin (30 ml, 60 ml,
90 ml, 120 ml) sesuai dengan perlakuan yang di uji.
Pengamatan Parameter
Persentase Planlet Yang Menghasilkan Umbi Mikro (%)
Persentase planlet yang menghasilkan umbi mikro diamati pada umur
1 bulan dan 2 bulan setelah aplikasi (BSA) dengan rumus :
% Planlet Yang Menghasilkan Umbi Mikro = planletmenghasilkanumbimikro
Persentase Planlet Yang Mati (%)
Persentase planlet yang mati diamati pada umur 2 bulan setelah aplikasi
(BSA) dengan rumus :
% Planlet Yang Mati = planletyangmati
planletseluruhnya x 100 %
Jumlah Umbi Mikro Per Planlet (umbi)
Jumlah umbi mikro per planlet di setiap perlakuan diamati pada umur
3 bulan setelah aplikasi (BSA).
Bobot Umbi Mikro Per Planlet (gram)
Bobot umbi mikro per planlet di setiap perlakuan dihitung pada umur
3 bulan setelah aplikasi (BSA) dengan menggunakan timbangan analitik.
Bobot Per Umbi Mikro (gram)
Bobot per umbi mikro di setiap perlakuan dihitung pada umur
3 bulan setelah aplikasi (BSA) dengan menggunakan timbangan analitik.
Diameter Umbi Mikro Per Planlet (mm)
Diameter umbi mikro per planlet di setiap perlakuan dihitung pada umur
HASIL DAN PEMBAHASAN Hasil
Berdasarkan hasil penelitian dan sidik ragam (Lampiran 5-32) diketahui
bahwa perlakuan konsentrasi coumarin berpengaruh nyata terhadap parameter
persentase planlet yang menghasilkan umbi mikro 1 BSA dan 2 BSA serta
diameter umbi mikro per planlet. Perlakuan volume coumarin berpengaruh nyata
terhadap parameter persentase planlet yang menghasilkan umbi mikro 1 BSA dan
2 BSA, jumlah umbi mikro per planlet, bobot umbi mikro per planlet, bobot per
umbi mikro dan diameter umbi mikro per planlet. Interaksi antara pemberian
konsentrasi dan volume coumarin berpengaruh tidak nyata terhadap semua
parameter.
Persentase Planlet Yang Menghasilkan Umbi Mikro (%)
Berdasarkan data peneltian dan hasil sidik ragam (Lampiran 5 – 12),
diketahui bahwa perlakuan konsentrasi coumarin berpengaruh nyata terhadap
persentase planlet yang menghasilkan umbi mikro pada umur 1 BSA dan 2 BSA,
perlakuan volume coumarin berpengaruh nyata terhadap persentase planlet yang
menghasilkan umbi mikro pada umur 1 BSA dan 2 BSA. Interaksi perlakuan
konsentrasi dan volume coumarin berpengaruh tidak nyata terhadap persentase
planlet yang menghasilkan umbi mikro.
Rataan persentase planlet yang menghasilkan umbi mikro pada umur
1 BSA dan 2 BSA pada perlakuan konsentrasi dan volume coumarin dapat dilihat
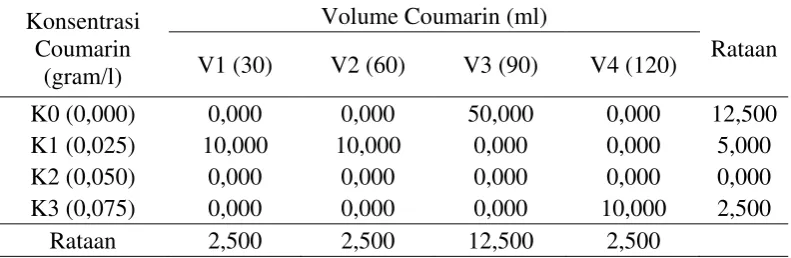
Tabel 1. Rataan persentase planlet yang menghasilkan umbi mikro (%) 1-2 BSA pada perlakuan konsentrasi dan volume coumarin
Konsentrasi
Keterangan : Angka yang diikuti huruf yang sama pada baris dan kolom yang sama adalah berbeda tidak nyata berdasarkan Uji Duncan taraf 5%
Tabel 1 menunjukkan bahwa persentase planlet yang menghasilkan umbi
mikro 1 BSA pada taraf pemberian konsentrasi coumarin 0,075 gram/l (K3)
menunjukkan persentase planlet yang menghasilkan umbi mikro tertinggi
(80,000) yang berbeda nyata dengan K0 dan K1 namun berbeda tidak nyata
dengan K2. Pada taraf pemberian konsentrasi coumarin 0,025 gram/l (K1) dan
konsentrasi coumarin 0,050 gram/l (K2) menunjukkan persentase planlet yang
menghasilkan umbi mikro tertinggi (95,000) pada umur 2 BSA yang berbeda
nyata dengan K0 namun tidak berbeda nyata dengan K3.
Persentase planlet yang menghasilkan umbi mikro 1 BSA pada taraf
pemberian volume coumarin 90 ml (V3) menunjukkan persentase planlet yang
menghasilkan umbi mikro tertinggi (75,000) yang berbeda nyata dengan V1 dan
V2 namun tidak berbeda nyata dengan V4. Pada taraf pemberian volume
mikro tertinggi (97,500) pada umur 2 BSA yang berbeda nyata dengan V1, V2
dan V3.
Berdasarkan Tabel 1 terlihat bahwa pemberian konsentrasi coumarin
0,075 gram/l menunjukkan persentase planlet yang menghasilkan umbi mikro
tertinggi (80,000) pada umur 1 BSA dimana semakin tinggi konsentrasi coumarin
yang diberikan maka persentase planlet yang menghasilkan umbi mikro semakin
meningkat. Pada persentase planlet yang menghasilkan umbi mikro 2 BSA
menunjukkan bahwa pemberian konsentrasi coumarin 0,050 gram/l (95,000)
adalah persentase planlet yang menghasilkan umbi mikro tertinggi dimana
semakin tinggi konsentrasi coumarin yang diberikan maka persentase planlet yang
menghasilkan umbi mikro semakin meningkat namun mengalami penurunan pada
konsentrasi 0,075 gram/l.
Pada pemberian volume coumarin 90 ml menunjukkan persentase planlet
yang menghasilkan umbi mikro 1 BSA tertinggi (75,00) namun pada umur
2 BSA kembali mengalami peningkatan persentase planlet yang menghasilkan
umbi mikro 2 BSA tertinggi pada pemberian volume coumarin 120 ml (97,500)
dimana semakin tinggi volume coumarin yang diberikan maka persentase planlet
yang meghasilkan umbi mikro semakin meningkat.
Grafik hubungan persentase planlet yang menghasilkan umbi mikro pada
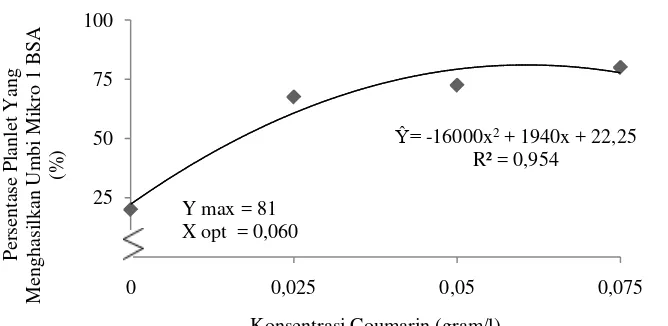
Gambar 1. Hubungan persentase planlet yang menghasilkan umbi mikro 1 BSA dengan perlakuan konsentrasi coumarin
Dari gambar 1 dapat dilihat bahwa persentase planlet yang menghasilkan
umbi mikro pada umur 1 BSA dengan perlakuan beberapa konsentrasi coumarin
tertinggi yaitu 80,000 % diperoleh pada pemberian 0,075 gram/l dimana semakin
tinggi konsentrasi yang diberikan maka persentase planlet yang menghasilkan
umbi mikro semakin meningkat.
Grafik hubungan persentase planlet yang menghasilkan umbi mikro pada
umur 1 BSA dengan perlakuan volume coumarin dilihat pada gambar 2.
Gambar 2. Hubungan persentase planlet yang menghasilkan umbi mikro 1 BSA dengan perlakuan volume coumarin
Dari gambar 2 dapat dilihat bahwa persentase planlet yang menghasilkan
umbi mikro pada umur 1 BSA dengan perlakuan beberapa volume coumarin
tertinggi yaitu 75,000 % diperoleh pada pemberian volume coumarin 90 ml
namun mengalami penurunan persentase planlet yang menghasilkan umbi mikro
pada volume coumarin 120 ml seiring dengan peningkatan volume coumarin.
Grafik hubungan persentase planlet yang menghasilkan umbi mikro pada
umur 2 BSA dengan perlakuan konsentrasi coumarin dilihat pada gambar 3.
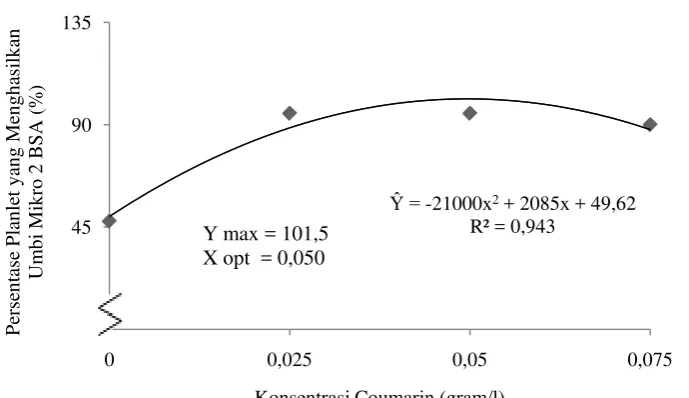
Gambar 3. Hubungan persentase planlet yang menghasilkan umbi mikro 2 BSA dengan perlakuan konsentrasi coumarin
Dari gambar 3 dapat dilihat bahwa persentase planlet yang menghasilkan
umbi mikro pada umur 2 BSA dengan perlakuan beberapa konsentrasi coumarin
tertinggi yaitu 95,000 % diperoleh pada pemberian konsentrasi coumarin
0,050 gram/l sedangkan semakin meningkatnya pemberian konsentrasi coumarin
yaitu 0,075 gram/l menurunkan persentase planlet yang menghasilkan umbi mikro
Grafik hubungan persentase planlet yang menghasilkan umbi mikro pada
umur 2 BSA dengan perlakuan volume coumarin dilihat pada gambar 4.
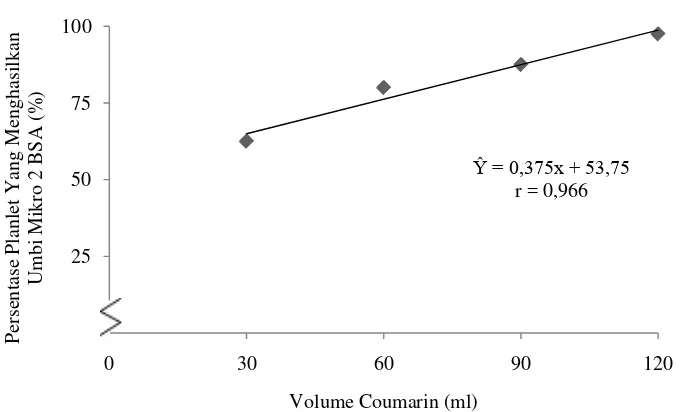
Gambar 4. Hubungan persentase planlet yang menghasilkan umbi mikro 2 BSA dengan perlakuan volume coumarin
Dari gambar 4 dapat dilihat bahwa persentase planlet yang menghasilkan
umbi mikro pada umur 2 BSA dengan perlakuan beberapa volume coumarin
tertinggi pada pemberian volume 120 ml yaitu 97,500 %. Semakin tinggi
konsentrasi yang diberikan maka persentase planlet yang menghasilkan umbi
mikro 2 BSA semakin meningkat.
Persentase Planlet Yang Mati (%)
Berdasarkan data penelitian dan hasil sidik ragam (Lampiran 13 – 16),
diketahui bahwa pemberian perlakuan konsentrasi coumarin dan perlakuan
volume coumarin serta interaksi pemberian coumarin dan volume coumarin
berpengaruh tidak nyata terhadap persentase planlet yang mati.
Rataan persentase planlet yang mati pada perlakuan konsentrasi dan
volume coumarin dapat dilihat pada Tabel 2.
Tabel 2. Rataan persentase planlet yang mati (%) pada perlakuan konsentrasi
Berdasarkan Tabel 2 terlihat bahwa pemberian konsentrasi coumarin
0,000 gram/l menunjukkan persentase planlet yang mati tertinggi (12,500) dimana
semakin tinggi konsentrasi yang diberikan maka persentase planlet yang mati
cenderung menurun namun cenderung mengalami peningkatan pada pemberian
konsentrasi coumarin 0,075 gram/l.
Pada pemberian coumarin 90 ml menunjukkan persentase planlet yang
mati tertinggi (12,500) dimana semakin banyak volume coumarin yang diberikan
maka semakin tinggi persentase planlet yang mati namun mengalami penurunan
persentase planlet yang mati pada pemberian volume coumarin 120 ml.
Jumlah Umbi Mikro Per Planlet (Umbi)
Berdasarkan data penelitian dan hasil sidik ragam (Lampiran 17 - 20),
diketahui bahwa pemberian perlakuan konsentrasi coumarin berpengaruh tidak
nyata terhadap jumlah umbi mikro, perlakuan volume coumarin berpengaruh
nyata terhadap jumlah umbi mikro. Interaksi pemberian konsentrasi coumarin dan
volume coumarin berpengaruh tidak nyata terhadap parameter jumlah umbi
Rataan jumlah umbi mikro pada perlakuan konsentrasi dan volume
coumarin dapat dilihat pada Tabel 3.
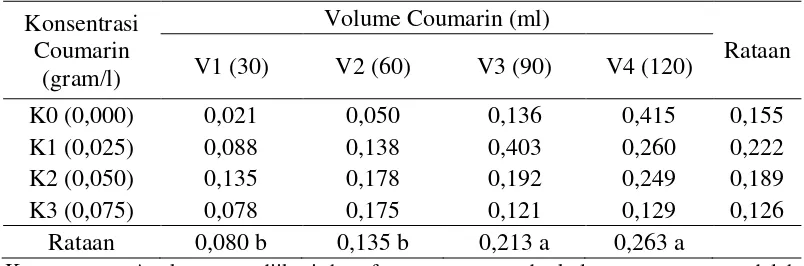
Tabel 3. Rataan jumlah umbi mikro per planlet (umbi) pada perlakuan konsentrasi dan volume coumarin
Konsentrasi berbeda tidak nyata berdasarkan Uji Duncan taraf 5%
Berdasarkan Tabel 3 terlihat bahwa pemberian konsentrasi coumarin 0,025
gram/l menunjukkan jumlah umbi mikro per planlet tertinggi (1,675) dimana
semakin tinggi konsentrasi coumarin yang diberikan maka jumlah umbi mikro per
planlet cenderung menurun.
Pada perlakuan volume coumarin 120 ml menunjukkan jumlah umbi
mikro per planlet tertinggi (1,975) dimana semakin tinggi volume coumarin yang
diberikan maka jumlah umbi mikro per planlet semakin meningkat.
Tabel 3 menunjukkan bahwa jumlah umbi mikro per planlet pada taraf
pemberian volume coumarin 120 ml (V4) menunjukkan jumlah umbi mikro per
planlet yang tertinggi (1,975) yang berbeda nyata dengan V1, V2 dan V3.
Grafik hubungan jumlah umbi mikro per planlet dengan perlakuan volume
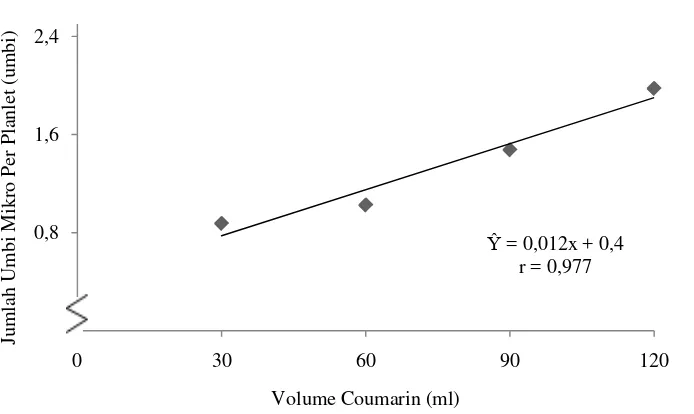
Gambar 5. Hubungan jumlah umbi mikro per planlet dengan perlakuan volume coumarin
Dari gambar 5 dapat dilihat bahwa jumlah umbi mikro per planlet dengan
perlakuan beberapa volume coumarin tertinggi yaitu 1,975 umbi pada pemberian
volume 120 ml dimana semakin tinggi volume coumarin yang diberikan maka
jumlah umbi mikro yang dihasilkan semakin meningkat.
Bobot Umbi Mikro Per Planlet (gram)
Berdasarkan data penelitian dan hasil sidik ragam (Lampiran 21 – 24),
diketahui bahwa pemberian perlakuan konsentrasi coumarin berpengaruh tidak
nyata terhadap bobot umbi mikro per planlet, perlakuan volume coumarin
berpengaruh nyata terhadap bobot umbi mikro per planlet. Interaksi pemberian
konsentrasi coumarin dan volume coumarin berpengaruh tidak nyata terhadap
parameter bobot umbi mikro per planlet.
Rataan bobot umbi mikro per planlet pada perlakuan konsentrasi dan
volume coumarin dapat dilihat pada Tabel 4.
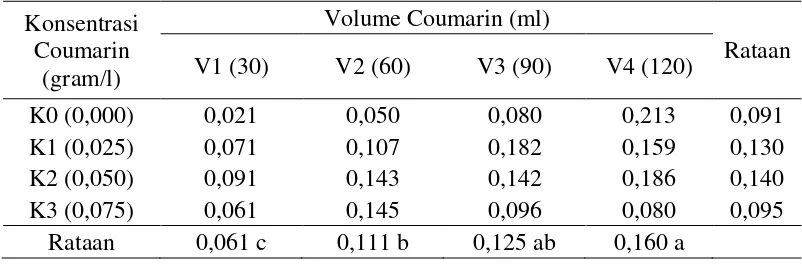
Tabel 4. Rataan bobot umbi mikro per planlet (gram) pada perlakuan konsentrasi berbeda tidak nyata berdasarkan Uji Duncan taraf 5%
Berdasarkan Tabel 4, terlihat bahwa pemberian konsentrasi coumarin
0,025 gram/l menunjukkan bobot umbi mikro per planlet tertinggi (0,222) dimana
semakin tinggi konsentrasi yang diberikan maka bobot umbi mikro per planlet
cenderung menurun.
Pada pemberian volume coumarin 120 ml menunjukkan bobot umbi mikro
per planlet tertinggi (0,263) dimana semakin tinggi volume coumarin yang
diberikan maka bobot umbi mikro per planlet semakin meningkat.
Tabel 4 menunjukkan bahwa bobot umbi mikro per planlet pada taraf
pemberian volume coumarin 120 ml (V4) menunjukkan bobot umbi mikro per
planlet yang tertinggi (0,263) yang berbeda nyata dengan V1 dan V2 namun tidak
berbeda nyata dengan V3.
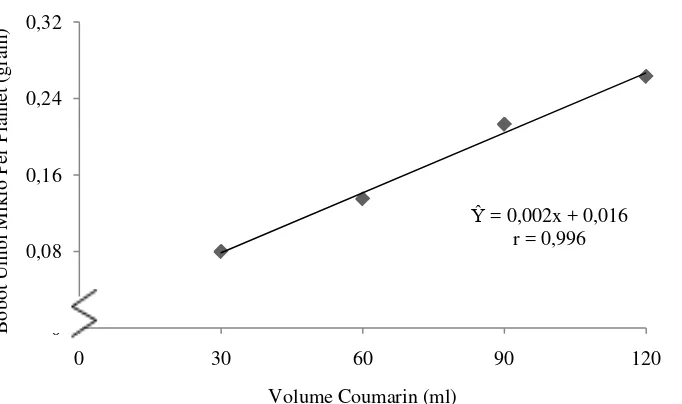
Grafik hubungan bobot umbi mikro per planlet dengan perlakuan volume
Gambar 6. Hubungan bobot umbi mikro per planlet dengan perlakuan volume coumarin
Dari gambar 6 dapat dilihat bahwa bobot umbi mikro per planlet dengan
perlakuan beberapa volume coumarin tertinggi pada pemberian volume 120 ml
yaitu 0,263 gram. Semakin tinggi konsentrasi yang diberikan maka bobot umbi
mikro per planlet semakin meningkat.
Bobot Per Umbi Mikro (gram)
Berdasarkan data penelitian dan hasil sidik ragam (Lampiran 25 - 28),
diketahui bahwa pemberian perlakuan konsentrasi coumarin berpengaruh tidak
nyata terhadap bobot per umbi mikro, perlakuan volume coumarin berpengaruh
nyata terhadap bobot per umbi mikro. Interaksi pemberian konsentrasi coumarin
dan volume coumarin berpengaruh tidak nyata terhadap parameter bobot per umbi
mikro.
Rataan bobot per umbi mikro pada perlakuan konsentrasi dan volume
coumarin dapat dilihat pada Tabel 5.
Tabel 5. Rataan bobot per umbi mikro (gram) pada perlakuan konsentrasi dan
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama adalah berbeda tidak nyata berdasarkan Uji Duncan taraf 5%
Berdasarkan Tabel 5, terlihat bahwa konsentrasi coumarin 0,050 gram/l
menunjukkan bobot per umbi mikro tertinggi (0,140) dimana cenderung
mengalami peningkatan dengan semakin tinggi konsentrasi coumarin yang
diberikan namun cenderung menurun pada konsentrasi coumarin 0,075 gram/l.
Pada pemberian volume coumarin 120 ml menunjukkan bobot per umbi
mikro tertinggi (0,160) dimana semakin tinggi volume coumarin yang diberikan
maka bobot per umbi mikro semakin meningkat.
Tabel 5 menunjukkan bahwa bobot per umbi mikro pada taraf pemberian
volume coumarin 120 ml (V4) menunjukkan bobot per umbi mikro yang tertinggi
(0,160) yang berbeda nyata dengan V1 dan V2 namun berbeda tidak nyata dengan
V3.
Grafik hubungan bobot per umbi mikro dengan perlakuan volume
Gambar 7. Hubungan bobot per umbi mikro dengan perlakuan volume coumarin
Dari gambar 7 dapat dilihat bahwa bobot per umbi mikro dengan
perlakuan beberapa volume coumarin tertinggi terdapat pada pemberian volume
coumarin 120 ml yaitu sebesar 0,263 gram. Semakin tinggi volume coumarin
yang diberikan maka bobot per umbi mikro semakin meningkat.
Diameter Umbi Mikro Per Planlet (mm)
Berdasarkan data penelitian dan hasil sidik ragam (Lampiran 29 – 32),
diketahui bahwa pemberian perlakuan konsentrasi coumarin berpengaruh nyata
terhadap diameter umbi mikro per planlet, perlakuan volume coumarin
berpengaruh nyata terhadap diameter umbi mikro per planlet. Interaksi pemberian
konsentrasi coumarin dan volume coumarin berpengaruh tidak nyata terhadap
parameter diameter umbi mikro per planlet.
Rataan diameter umbi mikro per planlet pada perlakuan konsentrasi dan
volume coumarin dapat dilihat pada Tabel 6.
Tabel 6. Rataan diameter umbi mikro per planlet (mm) pada perlakuan konsentrasi dan volume coumarin
Konsentrasi
Keterangan : Angka yang diikuti huruf yang sama pada baris dan kolom yang sama adalah berbeda tidak nyata berdasarkan Uji Duncan taraf 5%
Berdasarkan Tabel 6, terlihat bahwa konsentrasi coumarin 0,050 gram/l
menunjukkan diameter umbi mikro per planlet tertinggi (0,519) dimana
mengalami peningkatan dengan semakin tinggi konsentrasi coumarin yang
diberikan namun menurun pada konsentrasi coumarin 0,075 gram/l.
Pada pemberian volume coumarin 120 ml menunjukkan diameter umbi
mikro per planlet tertinggi (0,525) dimana semakin tinggi volume coumarin yang
diberikan maka semakin diameter umbi mikro per planlet semakin meningkat.
Tabel 6 menunjukkan bahwa diameter umbi mikro per planlet pada taraf
pemberian konsentrasi coumarin 0,050 gram/l (K2) menunjukkan diameter umbi
mikro per planlet yang tertinggi (0,519) yang berbeda nyata dengan K0 dan K3
namun berbeda tidak nyata dengan K1 sedangkan pada pemberian volume
coumarin 120 ml (V4) menunjukkan diameter umbi tertinggi (0,525) yang
berbeda nyata dengan V1 dan V2 namun berbeda tidak nyata dengan V3.
Grafik hubungan diameter umbi mikro per planlet dengan perlakuan
Gambar 8. Hubungan diameter umbi mikro per planlet dengan perlakuan konsentrasi coumarin
Dari gambar 8 dapat dilihat bahwa diameter umbi mikro per planlet
dengan perlakuan beberapa konsentrasi coumarin tertinggi pada pemberian
konsentrasi coumarin 0,050 gram/l yaitu 0,519 mm sedangkan pada pemberian
konsentrasi coumarin 0,075 gram/l mengalami penurunan diameter umbi mikro
yaitu 0,4222 mm.
Grafik hubungan diameter umbi mikro per planlet dengan perlakuan
volume coumarin dilihat pada gambar 9.
Dari gambar 9 dapat dilihat bahwa diameter umbi mikro per planlet
dengan perlakuan volume coumarin tertinggi terdapat pada pemberian volume
coumarin 120 ml yaitu 0,525 mm. Semakin tinggi volume coumarin yang
diberikan maka diameter umbi mikro semakin meningkat.
Pembahasan
Pengaruh konsentrasi coumarin terhadap produksi mikro tuber planlet kentang (Solanum tuberosumL.)
Berdasarkan hasil penelitian bahwa perlakuan konsentrasi coumarin
berpengaruh nyata terhadap parameter persentase planlet yang menghasilkan umbi
mikro 1 – 2 BSA dan diameter umbi mikro per planlet.
Pada parameter persentase planlet yang menghasilkan umbi mikro
(Tabel 1) berpengaruh nyata pada umur 1 – 2 BSA. Rataan persentase planlet
yang menghasilkan umbi mikro tertinggi pada umur 1 BSA terdapat pada taraf
0,075 gram/l (K3) yakni 80,000 %. Rataan persentase planlet yang menghasilkan
umbi mikro tertinggi 2 BSA pada taraf 0,025 gram/l (K1) dan 0,050 gram/l (K2)
yakni 95,000 %. Dalam hal ini, menurut saya konsentrasi terbaik adalah 0,025
gram/l karena di tinjau dari segi ekonomis yaitu penggunaan coumarin yang lebih
sedikit sehingga dapat menekan biaya (seperti kita ketahui bahwa bahan kimia
tersebut harganya mahal). Terjadi perbedaan pengaruh pemberian konsentrasi
coumarin yaitu 1 BSA pada taraf 0,075 gram/l sedangkan 2 BSA pada taraf
0,025 gram/l. Hal ini disebabkan bahwa pada umur planlet 1 BSA, coumarin
belum bersifat sebagai penghambat pertumbuhan vegetatif dari planlet tersebut
melainkan bersifat sebagai nutrisi untuk pertumbuhan planlet tersebut. Setelah
planlet berumur 2 BSA, baru terlihat dari sifat coumarin tersebut yaitu
tanaman yang berpengaruh pada kemampuan metabolisme tanaman dalam
mengabsorbsi zat pengatur tumbuh. Halimah, dkk., (2008) menyatakan bahwa
salah satu faktor yang mempengaruhi pertumbuhan maupun produksi tanaman
kentang adalah jenis tanaman yang berkaitan dengan genotipe. Perbedaan waktu
pembentukan umbi pada kedua varietas dikarenakan perbedaan genotipe yang
mempengaruhi proses metabolisme dalam jaringan tanaman. Cepat lambatnya
pembentukan umbi dipengaruhi oleh varietas, fotoperiode dan zat pengatur
tumbuh.
Berdasarkan Tabel 6, perlakuan konsentrasi coumarin berpengaruh nyata
terhadap parameter diameter umbi mikro per planlet pada taraf 0,050 gram/l (K2)
sebesar 0,519 mm. Hal tersebut dikarenakan coumarin sebagai retardan berfungsi
untuk menghambat pertumbuhan vegetatif. Dengan terhambatnya pertumbuhan
vegetatif, maka dapat meningkatkan akumulasi asimilat pada daun sehingga dapat
menginduksi terbentuknya umbi. Hal ini didukung oleh Wattimena (2005) yaitu
kriteria umbi mikro berkualitas baik adalah umbi dengan bobot basah lebih dari
100 mg per umbi dan berdiameter 5-10 mm serta mempunyai bahan kering lebih
dari 14%. Umbi mikro dapat tumbuh secara langsung dari ketiak tunas eksplan
dan secara tidak langsung pada ketiak atau terminal tunas baru.
Pengaruh volume coumarin terhadap produksi mikro tuber planlet kentang (Solanum tuberosumL.)
Berdasarkan hasil penelitian bahwa perlakuan volume coumarin
berpengaruh nyata terhadap parameter persentase planlet yang menghasilkan umbi
mikro 1 BSA – 2 BSA, jumlah umbi mikro per planlet, bobot umbi mikro per
Berdasarkan Tabel 1, parameter persentase planlet yang menghasilkan
umbi mikro menunjukkan bahwa perlakuan volume coumarin berpengaruh nyata
pada umur 1 BSA. Persentase planlet yang menghasilkan umbi mikro pada umur
1 BSA dengan pemberian volume coumarin 90 ml (V3) menunjukkan persentase
planlet yaang menghasilkan umbi mikro tertinggi yaitu 75,000 %. Pada parameter
persentase planlet yang menghasilkan umbi mikro umur 2 BSA, pemberian
volume coumarin 120 ml (V4) menunjukkan persentase planlet yang
menghasilkan umbi mikro tertinggi yaitu 97,5000 %. Pada Tabel 3, pemberian
volume coumarin berpengaruh nyata terhadap perlakuan jumlah umbi mikro per
planlet dengan jumlah umbi tertinggi terdapat pada taraf 120 ml (V4) yaitu
sebanyak 1,975 umbi. Pada Tabel 4, perlakuan bobot umbi mikro per planlet
dengan bobot umbi mikro tertinggi pada taraf 120 ml (V4) yaitu sebesar 0,263
gram. Pada Tabel 5, perlakuan bobot per umbi mikro dengan bobot umbi mikro
tertinggi pada taraf 120 ml (V4) yaitu sebesar 0,160 gram. Pada Tabel 6,
perlakuan diameter umbi mikro per planlet dengan diameter tertinggi pada taraf
120 ml (V4) yaitu sebesar 0,525 mm. Hal ini sesuai dengan cara kerja coumarin
sebagai penghambat pertumbuhan ke atas seperti batang dan daun. Semakin
banyak volume coumarin yang diberikan maka efek dari penghambatan tersebut
semakin besar sehingga pertumbuhan dan produksi umbi mikro semakin
meningkat. Hal ini sesuai dengan Warnita (2008) yang menyatakan bahwa jumlah
umbi dipengaruhi oleh komposisi media yang digunakan. Tampak bahwa jumlah
umbi tertinggi didapat pada media yang diberi alar. Pembentukan umbi mikro
membutuhkan zat pengatur tumbuh sebagai inisiator atau pendorong dalam
jalan menghambat biosintesis giberelin yang berperan dalam pertumbuhan
tanaman. Terhambatnya pertumbuhan mengakibatkan akumulasi asimilat pada
batang dan daun sehingga mampu menginduksi terbentuknya umbi.
Pengaruh interaksi konsentrasi dan volume coumarin terhadap produksi mikro tuber planlet kentang (Solanum tuberosumL.)
Berdasarkan hasil penelitian bahwa interaksi konsentrasi coumarin dan
volume coumarin berpengaruh tidak nyata terhadap perlakuan persentase planlet
yang menghasilkan umbi mikro 1 – 2 BSA, persentase planlet yang mati, jumlah
umbi mikro per planlet, bobot umbi mikro per planlet, bobot per umbi mikro dan
KESIMPULAN DAN SARAN Kesimpulan
1. Perlakuan konsentrasi coumarin berpengaruh nyata terhadap parameter
persentase planlet yang menghasilkan umbi mikro 1 BSA – 2 BSA dan
diameter umbi mikro per planlet dengan pemberian konsentrasi coumarin
terbaik yaitu 0,050 gram/l.
2. Perlakuan volume coumarin berpengaruh nyata terhadap persentase planlet
yang menghasilkan umbi mikro 1 BSA – 1 BSA, jumlah umbi mikro per
planlet, bobot umbi mikro per planlet, bobot per umbi mikro dan diameter
umbi mikro per planlet dengan pemberian volume coumarin terbaik yaitu
120 ml.
3. Interaksi konsentrasi coumarin dan volume coumarin berpengaruh tidak nyata
terhadap persentase planlet yang menghasilkan umbi mikro 1 BSA – 2 BSA,
persentase planlet yang mati, jumlah umbi mikro per planlet, bobot umbi
mikro per planlet, bobot per umbi mikro dan diameter umbi mikro per planlet.
Saran
Berdasarkan penelitian ini, volume coumarin terbaik terdapat pada
pemberian volume coumarin 120 ml. Pada pemberian konsentrasi coumarin 0,025
gram/l menunjukkan hasil terbaik namun diperlukan penelitian lanjutan untuk
DAFTAR PUSTAKA
Badan Pusat Statistik. 2012. Perkembangan Beberapa Indikator Utama Sosial – Ekonomi Indonesia. Badan Pusat Statistik, Jakarta.
Deptan. 2010. Tanaman C3, C4 dan CAM. Diunduh 18 Maret 2014.
Dewi, Y. P. 2011. Pengaruh Pemberian Beberapa Konsentrasi Coumarin Terhadap Umbi G1 Kentang (Solanum tuberosum L.). Skripsi. Universitas
Andalas, Padang.
Donelly, D. J., W. K. Coleman., dan E. Shirlyn. 2003. Potato Microtuber Production And Performance : A Review. Am. J. Pot. Res. 80(2):03-115. Dwidjoseputro, D. 1980. Pengantar Fisologi Tumbuhan. PT. Gramedia, Jakarta.
Gunawan, L. W. 1987. Teknik Kultur Jaringan Tumbuhan. Lab. Kultur Jaringan PAU. Bioteknologi IPB. Di Jen Pend. Tinggi P&K.
Halimah, S., M. Ansyar., T. Kuswinanti., R. Sjahril., Baharuddin., A. Ala., dan E. Sam’un. 2008. Kajian Pemanfaatan Filtrat Cendawan Lasiodiplodia
theobromae Dan Ekstrak Daun Gamal Sebagai Penginduksi Umbi Mikro Kentang Secara In-Vitro Dalam Seminar Nasional Pekan Kentang Lembang, 20-21 Agustus 2008. 13 hlm.
Hani, A. M. 2012. Pengeringan Lapisan Tipis Kentang (Solanum tuberosum. L) Varietas Granola. Skripsi. Universitas Hasanuddin, Makassar.
Hartus, T. 2001. Usaha Pembibitan Kentang Bebas Virus. Penebar Swadaya, Jakarta.
Jain, P. K. dan H. Joshi. 2012. Coumarin: Chemical and Pharmacological Profile.
J. App. Pharma. Sci. 02(06): 236-240.
Karjadi, A. K. dan Buchory, A. 2007. Pengaruh Konsentrasi BAP dan Sumber Karbohidrat Gula Terhadap Induksi Umbi Mikro Kentang. J. Agrivigor
6(3):197-205.
Kuntjoro, A. S. 2000. Produksi Umbi Mini Kentang G0 Bebas Virus melalui Perbanyakan Planlet secara Kultur Jaringan di PT. Intidaya Agrolestari (Inagro) Bogor – Jawa Barat. Skripsi. Jurusan Budi Daya Pertanian Fakultas Pertanian IPB. 62p.
Kecamatan Sungai Puar Kabupaten Agam. Skripsi. Universitas Andalas, Padang.
Rainiyati., Jasminarni., Neliyati., dan H. Henny. 2011. Proses Penyediaan Bahan Setek Kentang Asal Kultur Jaringan Untuk Produksi Bibit Kentang Mini Pada Kelompok Tani Kentang Di Kecamatan Kayu Aro Kabupaten Kerinci Provinsi Jambi. Jurnal Pengabdian Pada Masyarakat 52:1-7.
Rubatzky, V. E. dan Yamaguchi, M. 1998. Sayuran Dunia 1. Penerbit ITB, Bandung.
Rukmana, R. 2002. Usaha Tani Kentang Sistem Mulsa Plastik. Kanisius, Yogyakarta.
Sakya, A. T., A. Yunus., Samanhudi., dan U. Baroroh. 2002. Pengaruh Coumarin Dan Aspirin Dalam Menginduksi Umbi Mikro Kentang (Solanum Tuberosum L.). Agros 5(1):20-24.
Soelarso, B. 1997. Budidaya Kentang Bebas Penyakit. Kanisius, Yogyakarta.
Ummah, K. dan P. Agus. 2009. Budidaya Tanaman Kentang (Solanum tuberosum
L.) Dengan Aspek Khusus Pembibitan di Hikmah Farm, Pengalengan, Bandung, Jawa Barat. Makalah Seminar Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB, Bogor.
Warnita. 2008. Modifikasi Media Pengumbian Kentang Dengan Beberapa Zat Penghambat Tumbuh. Jerami 1(1):50-52.
Wattimena, G. A. 2000. Pengembangan Propagul Kentang Bermutu dari Kultivar Unggul dalam Mendukung Peningkatan Produksi Kentang di Indonesia. Orasi Ilmiah Guru Besar Tetap Ilmu Hortikultura Fakultas Pertanian IPB, Bogor.
______________. 2005. Aspirin sebagai Subtitusi Coumarin dalam Pengumbian In Vitro Kentang. Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB dan Jurusan Agronomi dan Hortikultura, Fakultas Pertanian. IPB.
Lampiran 1. Deskripsi Kentang Varietas Granola
Ketahanan Terhadap Penyakit : 1. Tahan terhadap PVA dan PVY
2. Agak tahan terhadap PLRV
3. Agak peka terhadap penyakit layu bakteri dan busuk daun.
Rekomendasi : Baik ditanam pada musim kemarau dan dapat
juga ditanam di musim hujan.
Keterangan : Baik digunakan sebagai kentang meja dan kentang sayur
Lampiran 2. Komposisi Media Murashige and Skoog (MS)
Lampiran 4. Rencana Kegiatan Penelitian
No. Kegiatan Minggu
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
1. Pensterilan Alat X
2. Persiapan Media
Mikro Per Planlet X
Bobot Umbi
Mikro Per Planlet X
Bobot Per Umbi
Mikro X
Diameter Umbi
Lampiran 5. Data Persentase Planlet Yang Menghasilkan Umbi Mikro 1 BST (%)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 7. Data Persentase Planlet Yang Menghasilkan Umbi Mikro 1 BST (%) setelah Transformasi Arcsin
Perlakuan Ulangan Total Rataan
1 2
Lampiran 8. Sidik Ragam Persentase Planlet Yang Menghasilkan Umbi Mikro 1 BST setelah Transformasi Arcsin
Lampiran 9. Data Persentase Planlet Yang Menghasilkan Umbi Mikro 2 BST (%)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 11. Data Persentase Planlet Yang Menghasilkan Umbi Mikro 2 BST (%) setelah Transformasi Arcsin
Perlakuan Ulangan Total Rataan
1 2
Lampiran 12. Sidik Ragam Persentase Planlet Yang Menghasilkan Umbi Mikro 2 BST setelah Transformasi Arcsin
Lampiran 13. Data Persentase Planlet Yang Mati (%)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 14. Sidik Ragam Persentase Planlet Yang Mati
Lampiran 15. Data Persentase Planlet Yang Mati (%) setelah Transformasi Arcsin
Perlakuan Ulangan Total Rataan
1 2
Lampiran 17. Data Jumlah Umbi Mikro Per Planlet (Umbi)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 18. Sidik Ragam Jumlah Umbi Mikro Per Planlet
Lampiran 19. Data Jumlah Umbi Mikro Per Planlet (Umbi) setelah Transformasi ��+�,�
Perlakuan Ulangan Total Rataan
1 2
Lampiran 21. Data Bobot Umbi Mikro Per Planlet (gram)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 22. Sidik Ragam Bobot Umbi Mikro Per Planlet
Lampiran 23. Data Bobot Umbi Mikro Per Planlet (gram) setelah Transformasi ��+�,�
Perlakuan Ulangan Total Rataan
1 2
Lampiran 25. Data Bobot Per Umbi Mikro (gram)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 26. Sidik Ragam Bobot Per Umbi Mikro
Lampiran 27. Data Bobot Per Umbi Mikro (gram) setelah Transformasi ��+�,�
Perlakuan Ulangan Total Rataan
1 2
Lampiran 29. Data Diameter Umbi Mikro Per Planlet (mm)
Perlakuan Ulangan Total Rataan
1 2
Lampiran 30. Sidik Ragam Diameter Umbi Mikro Per Planlet
Lampiran 31. Data Diameter Umbi Mikro Per Planlet (mm) setelah Transformasi ��+�,�
Perlakuan Ulangan Total Rataan
1 2