DAFTAR PUSTAKA
Abidin Z. 2004. Pengendalian Hama dan Penyakit Utama Pada Tanaman Tembakau. Balai Penelitian Tembakau Deli. Medan.
Ahmad M, A Ghaffar and M Rafiq. 2013. Host plants of leaf worm, Spodoptera
litura (fabricius) (lepidoptera: noctuidae) in Pakistan. Asian J. Agr. Biol. 1(1):23-28.
Amir AM. 2009. Pemantauan Resistensi Hama Tembakau Terhadap Insektisida. Balai Penelitian Tanaman Tembakau Dan Serat Malang. J. Ilmiah Tan.
Tembakau 8(3):376–380.
Anaisie, PV, Y Eziah and EO Owusu. 2011. The potential of indigenous entomopathogenic fungi for the management of the diamondback moth, Plutella xylostella L. (Lepidoptera: yponomeutidae) in Ghana.
Internat. Res. J. Biochem. Bioinform. 1(10):275-281.
Beilharz VC, Parberry DG and HJ Swart. 1982. Dodine: A selective agent for certain soil fungi. Trans. British Mycol. Soc .79:507-511.
Boucias DG dan JC Pendland. 1998. Invertebrata Fungal Elicitors In: Fungal
Antigen Isolation, Purification, and Detections. (E. Drouhet, G.T.
Cole, L. DeRepentigny, J.P. Latge and B. Dupont, eds) Plenum Press, NY. Pp 121-137.
Clarkson JM and AK Charnley. 1996. New insight into mechanisms of fugal patogenesis insect. Trends microbiology 4(5). 203, May 1996.
BPTD. 2004. Strategi Pengendalian Hama dan Penyakit Tanaman Tembakau. BPTD PTP Nusantara II. Medan.
Cardona EV, CS Ligat dan MP.Subang. 2007. Life History of Common Cutworm,
Spodoptera litura Fabricius (Noctuidae : Lepidoptera) In Benguet.
Progress Report. BSU Research In- House Review.
Chase AR, LS Osborne and VM Ferguson. 1986. Selective isolation of the entomopathogenic fungi, Beauveria bassiana and Metarhizium
anisopliae from an artificial potting medium. Florida Entomol.
69:285-292.
Departemen Kesehatan RI. 1997. Pedoman Gizi Pada Bahan Pangan. Direktorat Jenderal Kesehatan Masyarakat Direktorat Gizi Masyarakat, Jakarta. Deshpande MV and Pune. 2011. Diversity of Fungi with Special Reference to
Fardiaz S. 1989. Mikrobiologi Pangan. Jurusan Teknologi Pangan dan Gizi. Fateta IPB. Bogor.
__________1992. Mikrobiologi Pangan I. Gramedia Pustaka Utama, Jakarta. Gams W, HA Van der Aa, AJ Van Der Plaats Niternik, RA Samson and JA
Stalpers. 1987. CBS Course of Mycology. Centralbereau Voor Chimmel Cultures. Belanda.
Gupta, D.K. 2004. Pesticide Exposure. Indian Scene Toxicol. 198:83- 90.
Hasnah, Husni and F. Ade. 2012.Pengaruh ekstrak rimpang jeringau (Acorus
calamus L.) terhadap mortalitas ulat grayak Spodoptera litura F. J. Floratek. 7:115-124.
IFAS. 2007. Tropical Research and Education Center. Ornamental Entomology University of Florida,18905 SW 280th Street Homestead, FL 33031. Kathiresan K and S Manivannan. 2006. Cellulase Production by Penicillium
fellutanum Isolated from Coastal Mangrove Rhizosphere Soil. Res.
J. Microbiol. 1(5):438-442.
Keller SP,P. Kessler and C Schweizer. 2003. Distribution of insectpathogenic soil fungi in Switzerland with special referenceto Beauveria brongniartii and Metharhizium anisopliae.Biocontrol 48, 307-319.
Kershaw ER, RB Moorhuose , SE Reynolds and AK Charnley. 1999. The Role of Destruxins in the Pathogenicity of Metarhizium anisopliae for Three Species of Insect . Diakses melalui http://www.Sciendirect.com/Science/Journal/ pada tanggal 03 Agustus
2016.
Koch R. 1881. Zur Untersuchung von Pathogenen Organismen, Mitthdungen uus dem Kaiserlichen Gesundbeitsamte. 1(1):1-48.
Laoh J. 2003. Kerentanan Larva Spodoptera litura F. terhadap Virus Nuklear Polyhedrosis. Universitas Riau. Pekanbaru. J. Natur Indonesia 5(2):145-151.
Lukitaningsih D, 2009. Macam – Macam Pestisida Nabati/Alami dan Cara Pembuatannya. Bul. Teknik Pertanian 1(4):37-44.
Mark SG and GI Douglas. 1997. Fungi: Hyphomycetes. In: LaceyL, ed. Manual
of Techniques in Insect Pathology. San Diego,California: Academic
Meyling NV and J Eilenberg. 2006. Isolation and characterisationof Beauveria
bassiana isolates from phylloplanes of hedgerow vegetation. Mycol. Res. 110:188-195.
Nio. O. K. 1992. Daftar Analisa Bahan Makanan. UI-Press. Jakarta.
Nurariaty. 2006. Identifikasi Cendawan Entomopatogen dan Perannya sebagai Agen Hayati Pupa Penggerek Buah Kakao (Conopomorpha cramerella snellen) (Lepidoptera : Gracillariidae) di Pertanaman Kakao. Bul.
Penelitian Seri Hayati . 9(2):94-180.
Nurariaty A, PS Annie, A Rosmana and T Meitri, 2013. Potensi cendawan rhizosfer sebagai agens pengendali hayati hama dan penyakit tanaman kakao. Makassar. Sulawesi Selatan.
Nwodo Chinedu S, C Obinna Nwinyi and VI Okochi. 2008. Properties of Endoglucanase of Penicillium chrysogemum PCL501. Austr. J.
Basic Appl. Sci. 2(3):738-746.
Pasaru F, Alam A, Tutik K, Mahfud and Shahabuddin. 2014. Prospective of Entomopathogenic Fungi Assosiated with Helopeltihs Spp.(Hemipter : Miridae) on Cacao Plantation. Int. J. Curr.Res. Acad. Rev. 2(11) 227 -234.
Paterson RRM, Simmonds MSJ, Blaney WM. 1987. Mycopesticidal effects of characterized extracts of Penicillium isolates and purified secondary metabolites (including mycotoxins) on Drosophila melanogaster and Spodoptora littoralis. J. Invertebr Pathol 50:124–133.
Peterson SW. 1992. Neosartorya pseudofischeri sp. nov. Andits relationship to other species in Aspergillus section Fumigati. Mycol. Res. 96:547–554. ____________. 2000. Phylogenetic analysis of Penicillium based onITS and
LSU-rDNA sequences. In: Samson RA, Pitt JIeds. Classification of Penicillium and Aspergillus: integration of modern taxonomic methods. Reading, UK Harwood Publishers. 163–178.
Pitt JI and RA Samson (1993) Species names in current use in the Trichocomaceae (Fungi, Eurotiales). In: Greuter W (ed) Names in current use in the families Trichocomaceae, Cladoniaceae, Pinaceae, and Lemnaceae, Regnum Vegetabile, Koeltz Scientific Books, Königstein, Germany, 128, pp 13-57
Prayogo Y, W Tengkano dan Suharsono. 2002. Jamur Entomopatogen pada
Spodoptera litura dan Helicoverpa armigera. Prosiding Seminar
Prayogo Y dan W Tengkano. 2002. Pengaruh umur larva Spodoptera litura terhadap efektivitas Metarhizium anisopliae isolat Kendal payak.
Majalah Ilmiah Biologi Biosfera 3(19):70−76.
Priyanti S. 2009. Kajian Patogenitas Cendawan Metarhizium anisopliae Pada Media Koalin untuk Pengendalian Oryctes rhinoceros. Dalam Prosiding Simposium I Badan Penelitian dan Pengembangan. Bogor 20 Januari 2009. Hal. 150.
Purnama HA. 2003. Hama dan Penyakit Tembakau Deli.BPTD PTPP Nusantara II. Medan.
Sabouraud R. 1892. Contribution a líetude de la trichophytie humaine. Etude clinique, microscopique et bacterioloqique sur la pluralite destrichophytons de líhomme. Ann. Dermatol. Syphil. 3:1061-1087. Safawi MI, I Iwaki and T Miura. 2004. The segregation tendency in the vibration
of high fluidity concrete. Chem. Concr. Res. 34(2): 219-226.
Samson RA, HC Evan and JP Latge. 1988. Atlas of Entomopatogenic Fungi. Tokyo. Prinjesverlag Berlin Heifelberg, New York, London. 188.
Samson R.A. 1992. Tropical Fruit Longman Scientifik and Technical. Essex. England. 336.
SAS. Institute. Inc.1992. SAS/ETS. 6.12. Cory, NC, USA, SAS, Institute. Inc . Sindhu R, Nair G. Suprabha dan S. Shashidhar. 2011. Media Engineering
For The Production Of Cellulase From Penicillium Species (SBSS 30) Under Solid State Fermentation. Research Article, Biotechnol.
Bioinf. Bioeng. 343-349.
Shimazu M dan Sato H .1996. Media for selective isolation of anentomogenous fungus, Beauveria bassiana (Deuteromyco-tina: Hyphomycetes). Appl Entomol Zool 31, 291-298.
Shimazu M, H Sato H and N Maehara. 2002. Density of the entomopathogenic fungus, Beauveria bassiana Vuillemin (Deuteromycotina:
Hyphomycetes) in forest air and soil. Appl. Entomol Zool. 37(1):19-26. Sintim HO, T Ashiro and N Motoyama. 2009. Response of the cutworm
Spodoptera litura to sesame leaves or crude extracts in diet. 13pp. J. Insect Sci. 9: 52.
Sudarmo, S. 1992. Tembakau.Penerbit Kanisius. Yogyakarta.
Sutarma. 2000. Kultur media bakteri. Teew Tebds Fungsiarroi ron Penkd. J.
hayati. Bogor.
Tanada Y and H K. Kaya, 1993. Insect Pathology. Academic Press Inc, London. Thom C and Church MB. 1926, The Aspergilli, Williams and Wilkins Co.,
Baltimore.
Tohir. 2010. Teknik ekstraksi dan aplikasi beberapa pestisida nabati untuk menurunkan palatabilitas ulat grayak (Spodoptera litura Fabr.) di Laboratorium. Bul. Teknik Pertanian. 15(1):37–40.
Trizelia. 2005. Cendawan Entomopatogen Beauveria bassiana (Bals) Vuil. (Deuteriomycotina: Hypomycetes). Keanekaragaman Fisiologi dan Virulensinya terhadap Crocidolomia pavonana (F) [Disertasi]. Bogor : Institut Pertanian Bogor.
Vega FE. 2008. Insect Pathology and Fungal Endophytes. J. Invert. Pathol. 98:277-279.
Visagie C.M, KA Seifert, and J. Houbraken. 2014. Diversity of Penicillium section Citrina within the fynbos biome of South Africa, including a new species from a Protea repens infructescence Mycol. 106 (2014), 537-552.
Widayat W dan DJ Rayati. 1993. Hasil penelitian jamur entomopatogenik local dan prospek penggunaannya sebagai insektisida hayati. Dalam E Martono, E Mahrub, NS Putra, & Y Trisetyawati (Eds.). Simposium Patologi Serangga I. Universitas Gadjah Mada,Yogyakarta, 12−13 Oktober 1993. hlm. 61-74.
BAHAN DAN METODE Tempat dan Waktu Percobaan
Penelitian dilaksanakan di Laboratorium Penyakit Fakultas Pertanian Universitas Sumatera Utara, Medan. (± 25 m di atas permukaan laut) mulai Januari– Agustus 2016.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah Penicillium sp. yang berasal dari Spodoptera sp. yang terinfeksi, Spodoptera sp., air destilasi, dextrose, agar, kentang, alkohol 96%, sukrose, bacto peptone, glukose, yeast extract agar, gelatin, CuCl2, kristal violet, PDA, CDA, SDA, D0C2-4, dan tepung tubuh
Spodoptera sp.
Alat yang digunakan dalam penelitian adalah hameositometer, cawan petri, autoclave, timbangan, beaker glass, laminar air flow, inkubator, oven, hand counter, gelas ukur, burnsen, cling warp, alumunium foil, kapas, cork borer, handsprayer, blender, saringan, kain muslim, gunting, sungkup, corong dan seluruh alat yang mendukung penelitian ini.
Metode Penelitian
Penelitian menggunakan Rancangan Acak Lengkap (RAL) non-faktorial : Perlakuan :Media biakan Penicillium sp.
M0 = PDA (Kontrol)
M1 = SDA (Sabouraud Dextrose Agar) M2 = D0C2
M3 = CDA (Czapek Dox Agar) M4 = Tepung tubuh Spodopterasp.
Pelaksanan Percobaan Isolasi Penicillium sp.
Penicillium sp.diisolasi dari S. litura yang terinfeksi Penicillium sp. di
lapangan selanjutnya Spodoptera sp. dicuci dengan air mengalir selama 15 menit,dimasukkan ke dalam beker glass 150 ml. Spodoptera sp. yang telah bersih kemudian direndam dengan NaOCl 5% selama 1 menit kemudian dibilas dengan akuades steril. Selanjutnya Spodoptera sp. direndam dengan alkohol 95% selama 1 menit dan dibilas dengan akuades. Setelah itu Spodoptera sp. direndam dengan akuades steril selama 15 menit sebanyak dua kali. Eksplorasi cendawan
Penicillium sp. dengan cara menggerus Spodoptera sp. di dalam mortar. Air
gerusan Spodoptera sp. digoreskan pada media PDA dan diamati pertumbuhan cendawan Penicillium sp. selama 7 hari dan dilakukan permurnian isolat.
Perbanyakan larva Spodoptera sp.
Larva Spodoptera sp. diperbanyak dengan cara dibiakkan di laboratorium. Telur Spodoptera yang berasal dari lapangan pada berbagai pertanaman kedelai dikumpulkan. Telur kemudian di sterilisasi dengan formalin 0,005% selama 3 detik dan dimasukkan kedalam tabung reaksi yang berisi pakan buatan (Gupta et al., 2004). Pakan buatan yang digunakan berupa subsrat padat.
Introduksi Spodoptera sp.
Spodoptera sp. yang digunakan adalah larva instar 3, kemudian
Inokulasi Penicillium sp.
Perbanyakan cendawan Penicillium sp. dilakukan pada berbagai medium berdasarkan perlakuan kemudian cendawan diambil 5 cokebor dan dimasukkan dalam medium cair sesuai medium perlakuan.
Kultur metabolit skunder Penicilium sp. dilakukan dengan proses fermentasi. Penicillium sp. yang diambil sebelumnya dipindahkan ke dalam 5 ml medium sesuai perlakuan. Kemudian dihomogenkan menggunakan tube stirrer hingga mencapai kerapatan 1x108 propagul/ ml. Suspensi koloni jamur tersebut kemudian diambil sebanyak 1 ml dan dipindahkan ke dalam tabung Eppendorf yang telah berisi 9 ml medium sesuai perlakuan. Eppendorf yang telah berisi suspensi jamur kemudian diinkubasi selama 30 hari pada suhu 300C dan kecepatan 130 rpm. Setelah 30 hari, medium yang telah berisi suspensi jamur kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit. Supernatan yang terbentuk diambil dengan menggunakan mikro pipet steril dan dimasukkan ke dalam vial steril. Supernatan tersebut yang akan digunakan sebagai uji peyemprotan pada pakan Spodoptera sp.
Peubah amatan
Perilaku dan Morfologi Spodoptera sp.
Persentase Mortalitas (%)
Pengamatan terhadap ulat grayak yang mati dilakukan setiap hari mulai 1 -10 jam setelah introduksi. Persentase mortalitas dilakukan dengan menghitung larva yang mati dengan menggunakan rumus:
P = �
� � 100%
Keterangan : P = Mortalitas (%)
n = Jumlah Spodoptera sp.mati N = Jumlah seluruh Spodoptera sp. (Laohet al.,2003).
Waktu Kematian Spodoptera sp. (LT 50)
Lethal Time 50% pada Spodoptera sp. dilakukan dengan mengamati berapa lama waktu yang dibutuhkan untuk membunuh 50% serangga yang di uji.
HASIL DAN PEMBAHASAN Perilaku dan Morfologi Spodoptera sp.
Hasil pengamatan yang dilakukan terlihat jelas bahwa terjadi perubahan perilaku dan morfologi larva Spodopera sp. setelah dilakukan aplikasi metabolit sekunder
Penicilium sp. Perubahan perilaku yang terjadi pada larva satu hari setelah
aplikasi menunjukkan gerakan yang mulai melambat, aktifitas makan mulai menurun, larva banyak yang menempel pada permukaan atas tanaman. Hal ini sesuai pernyataan Priyanti (2009) bahwa ada ciri perilaku yang terjadi dikenal sebagai summit disease, dimana serangga yang mati karena jamur entomopatogen menunjukkan perilaku akan naik ke permukaan atas tanaman dan melekatkan diri disana. Fenomena ini oleh beberapa pakar dikatakan sebagai usaha untuk menyelamatkan populasi lain yang sehat dari infeksi jamur entomopatogen.
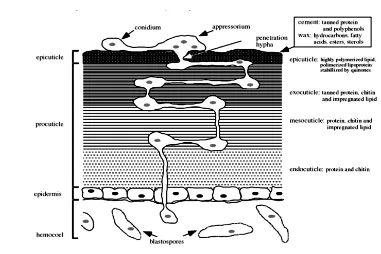
dengan cara menembus langsung tubuh larva dan termakan oleh pakan yang telah diaplikasikan. Penetrasi dilakukan secara mekanis atau kimiawi dengan mengeluarkan enzim yang disebut kitinase. Menurut Trizelia (2005) bahwa akibat terjadinya mekanisme infeksi serangga secara enzimatis dan kimia akan menyebabkan terjadinya kenaikan pH darah, penggumpalan darah dan terhentinya peredaran darah pada serangga sehingga akan menyebabkan kematian dan larva yang sudah mati akan berubah menjadi berkerut dan hitam (Gambar 2).
Gambar 2.Gejala kematian Spodoptera sp. yang keracunan metabolik skunder
Penicillium sp.
Mortalitas Larva Spodoptera sp. (%)
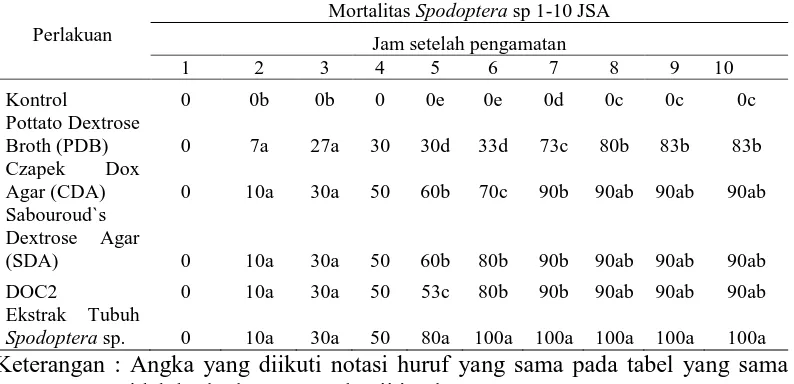
Hasil pengamatan terhadap mortalitas larva Spodoptera sp. dengan perlakuan berbagai medium kultur matabolit skunder Penicillium sp. yang berbeda menunjukkan fluktuasi terhadap kematian larva Spodoptera sp. Persentase mortalitas larva Spodoptera sp. dapat dilihat pada Tabel 1.
Tabel 1. Mortalitas Spodoptera sp. 1-10 jsa (jam setelah aplikasi) di laboratorium. Perlakuan
Mortalitas Spodoptera sp 1-10 JSA
Jam setelah pengamatan
Keterangan : Angka yang diikuti notasi huruf yang sama pada tabel yang sama tidak berbeda nyata pada uji jarak Duncan 5 %.
Nilai mortalitas Spodoptera tertinggi terdapat pada komposisi medium ekstrak tubuh Spodoptera sp. hal ini dikarenakan medium ekstrak tubuh mengandung senyawa paling komplek dalam susunan protein lemak dan senyawa mineral yang berasal dari Spodoptera sp. itu sendiri. Jamur yang dikulturkan pada medium ini akan mengabsobsi substansi yang paling menyamai dengan tubuh serangga uji. Hal ini yang menyebabkan toksisitas metabolik menjadi sangat meningkat. Hal yang sama juga dinyatakan tubuh Spodoptera mengandung senyawa utama sebagai substrat obligat pada cendawan entomopatogen. Tubuh
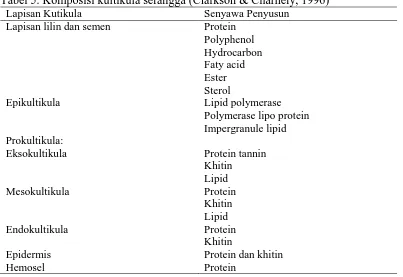
Spodoptera mengandung protein, polyphenol, hydrocarbon, faty acid, ester, khitin
dan tannin (Clarkson dan Charnely, 1996).
Medium ini mengandung beberapa fungisida (seperti oxgall, tembaga sulfat, tembaga (II) klorida (CuCl), benomyl dan dodine) dan antibiotik (seperti cholramphenicol, tetracygline dan streptomisin) serta media selektif (Beilhartz et
al, 1982;. Chase et al., 1986; Shimazu dan Sato, 1996 Mark dan Douglas, 1997 ;
Keller et al., 2003; Shimazu et al.,2002; Meyling dan Eilenberg 2006;;). Di antara medium tersebut, dodine dan CuCl telah dievaluasi karena lebih efektif untuk
isolasi cendawan entomopatogen dari tanah (Chase et al, 1986;. Shimazu dan Sato, 1996).
askorbat 17 mg (Nio, 1992) berfungsi sebagai sumber nitrogen dan vitamin bagi cendawan. Dekstrosa (C6H12O6) berbeda dengan gula yang di konsumsi, dekstrosa merupakan wujud murni gula yang berasal dari sumber alami langka merupakan wujud lain dari L-gulkosa. Dextrosa berfungsi sebagai komber karbon bagi cendawan. Agar berfungsi sebagai pemadat pada substrat yang telah di homogenkan. Tingginya kadar karbohidrat menyebabkan meningkatkan laju vegetatif jamur dan menghambat pembentukan metabolik sekunder (Koch, 1881). Lethal time 50 (LT50). (Jam)
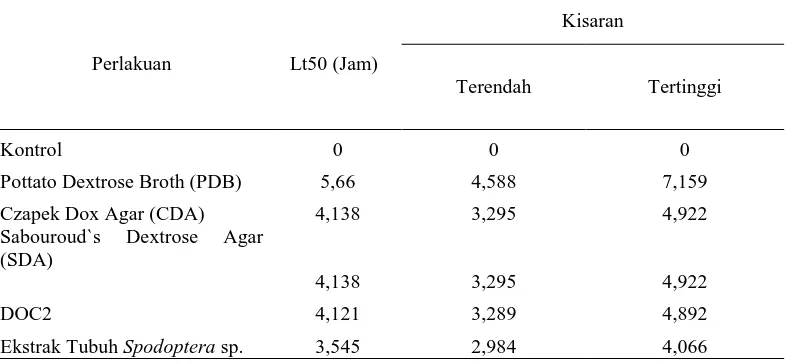
Hasil penelitian menunjukkan waktu kematian tercepat terdapat pada perlakuan medium tubuh Spodoptera dengan waktu 3,545 jam, diikuti perlakuan DOC sebesar 4,121 jam, kemudian SDA dan CDA memiliki waktu kematian yang sama yaitu 4,138 dan terendah terdapat pada perlakuan PDB yaitu 5,66 jam (Tabel 2)
Tabel 2. LT50 Metabolit sekunder Penicillium pada berbegai medium terhadap
Spodoptera sp.
Perlakuan Lt50 (Jam)
Kisaran
Terendah Tertinggi
Kontrol 0 0 0
Pottato Dextrose Broth (PDB) 5,66 4,588 7,159
Czapek Dox Agar (CDA) 4,138 3,295 4,922
Sabouroud`s Dextrose Agar (SDA)
4,138 3,295 4,922
DOC2 4,121 3,289 4,892
Ekstrak Tubuh Spodoptera sp. 3,545 2,984 4,066
dan merangsang cendawan biakan untuk dapat beradaptasi dengan medium ini. Hal ini mempermudah jamur untuk dapat mencerna medium ini dan meningkatkan toksisitasnya terhadap nutrisi medium dan menyebabkan jamur mangalami kondisi obligat. Perubahan sistem biokima jamur pun merangsan cendawan untuk menghasilkan metabolik sekunder yang toksisitasnya tinggi untuk dapat membunuh Spodoptera uji pada waktu tercepat. Seperti yang dinyatakan oleh Clarkson dan Charnely (1996) bahwa perubahan sistem biokima jamur merangsang cendawan untuk menghasilkan metabolit sekunder yang toksisitasnya tinggi untuk dapat membunuh Spodoptera uji pada waktu tercepat. Hal ini berkorelasi positif terhadap substrat dan host yang diuji.
Medium DOC2 merupakan medium selektif entomopatogen. Medium ini akan menghambat pertumbuhan cendawan ke periode vegetatife dengan senyawa tembaga didalamnya, sehingga toksin akan segera dihasilkan pada metabolisme sekunder. Namun medium ini tidak meningkatkan selektifitas obligat jamur sehingga waktu kematian di bawah medium ekstrak tubuh Spodoptera. Hal yang sama juga dinyatakan Beilhartz et al, 1982;. Chase et al., 1986; Shimazu dan Sato, 1996; Mark dan Douglas, 1997; Shimazu et al.,2002; Keller et al., 2003; Meyling dan Eilenberg 2006; bahwa dodine dan CuCl telah dievaluasi karena lebih efektif untuk isolasi cendawan entomopatogen dari tanah dan menghambat priode vegetatife dan merangsang eksudat kimia (Chase et al, 1986;. Shimazu dan Sato, 1996).
dinyatakan Thom dan Church (1926) bahwa kedua medium tersebut digunakan untuk isolasi jamur dermatifit manusia yang merangsang pemparasitan sel namun tidak merangsang jamur masuk ke fase kimiawi penghasil toksin.
KESIMPULAN
Medium yang memiliki toksisitas tertinggi terhadap Spodoptera sp. adalah medium ekstrak tubuh Spodoptera sp. dengan mortalitas 100 % pada pengamatan jam ke enam dan LT 50 pada 3,545 jam setelah aplikasi.
SARAN
TINJAUAN PUSTAKA Ulat Grayak Spodoptera sp. ( Lepidotera : Noctuidae )
Spodoptera sp. merupakan serangga hama yang terdapat di berbagai
negara seperti Indonesia, India, Jepang, Cina, dan negara-negara lain di Asia Tenggara (Sintim et al., 2009). Kerusakan yang disebabkan oleh ulat grayak pada tanaman tembakau dapat mencapai 40 – 50% atau tanaman tembakau tidak bisa dipanen daunnya (BPTD, 2004). Telur diletakkan secara berkelompok pada helaian daun sebelah bawah sebanyak 250-300 butir. Telur ditutupi jaringan halus warna putih kekuningan (Gambar 1) dan menetas setelah berumur 3-5 hari (Purnama, 2003).
Larva yang baru keluar dari kelompok telur pada mulanya bergerombol sampai instar ketiga. Larva berwarna hijau kelabu hitam. Larva terdiri 5-6 instar (BPTD, 2004). Lama stadia larva 17-26 hari, yang terdiri dari larva instar 1 berkisar 5-6 hari, instar 2 berkisar 3-5 hari, instar 3 berkisar 3-6 hari, instar 4 berkisar 2-4 hari, dan instar 5 berkisar 3-5 hari (Cardona et al., 2007) (Gambar 1). Stadia larva berkisar antara 15-30 hari.
Pupa berada di dalam tanah atau pasir. Pupa berbentuk oval memanjang dan berwarna cokelat mengkilat. Pupa memiliki panjang dan lebar antara 22,29 + 0,7 mm dan 7,51 + 0,36 mm, lama stadia pupa 9-14 hari Dapat dilihat pada (Gambar 1) (Cardona et al., 2007).
sayap depan berwarna coklat atau keperakan, sayap belakang S.litura berwarna keputihan dengan noda hitam. Panjang ngengat betina 14 mm sedangkan jantan 17 mm (UF/IFAS Pest Alert, 2007). Ngengat aktif pada malam hari dan serangga betina bila meletakkan telur secara berkelompok dan satu kelompok dapat mencapai 200-300 butir. Seekor betina dapat meletakkan telur mencapai 800-1000 butir. Lama hidup imago 5-9 hari. Daur hidup hama ini adalah 24-41 hari (Subandrijo et al., 1992) (Gambar 1).
Gejala Serangan
Akibat serangan ini daun-daun akan berlubang-lubang sehingga daun tembakau menjadi tidak utuh, dan secara langsung akan menurunkan rendemen cerutu dari setiap daun yang rusak (Abidin, 2004). Kerusakan daun yang diakibatkan larva yang masih kecil merusak daun dengan meninggalkan sisa-sisa epidermis bagian atas, transparan dan tinggal tulang-tulang daun saja. Larva instar lanjut merusak tulang daun. Pada serangan berat menyebabkan gundulnya tanaman (Sudarmo, 1992). Serangan yang ditimbulkan akan kelihatan daun transparan karena daging daun habis dimakan. Pada instar ke-4 dan ke-5 larva menyebar ke tanaman didekatnya terutama bila daun sebagai sumber pakannya sudah berkurang (BPTD, 2004) (Gambar 1).
Pengendalian
nematoda (dalam bentuk serbuk). Pacar cina mengandung minyak atsiri, alkaloid, saponin, flavonoin, dan tanin. Efektif untuk mengendalikan hama ulat. Umbi gadung mengandung diosgenin, steroid saponin, alkohol dan fenol. Efektif untuk mengendalikan ulat dan hama penghisap. Srikaya mengandung annonain dan resin. Efektif untuk mengendalikan ulat dan hama pengisap. Pengendalian hayati seperti pemanfaatan parasitoid, predator dan entomopatogen mempunyai harapan besar dimasa mendatang untuk menggantikan insektisida karena tidak mempunyai dampak negatif terhadap kelestarian lingkungan. Cendawan patogen merupakan salah satu komponen pengendalian yang dapat memberi peluang yang cukup baik. Hasil pengamatan uji patogenitas cendawan
Beauveria bassiana di lapangan menunjukkan bahwa cendawan tersebut masih
tetap efektif meskipun telah disimpan di dalam lemari pendingin selama 4 bulan (Yasin et al., 2014).
Gambar 1. (a). Kelompok telur Spodoptera sp., (b). Larva Spodoptera sp., (c).pupa Spodoptera sp., (d).Imago jantan Spodoptera sp. dan (e). Gejala serangan Spodoptera sp. pada tanaman cacao. Sumber : UF/IFAS Pest Alert ( 2007).
A B C
Cendawan Penicillium sp.
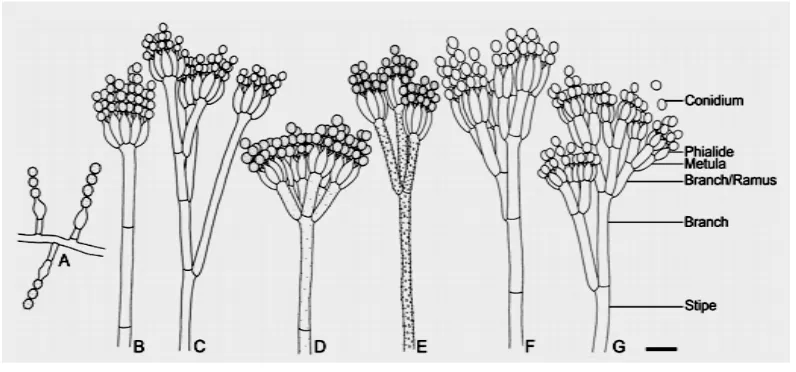
Cendawan Penicillium sp. digolongkan dalam Kingdom: Fungi, Phylum: Ascomycetes, Kelas: Eurotiomycetes, Ordo:Eurotiales, Family: Trichocomaceae, Genus: Penicillium dan Spesies: Penicillium sp. Pitt dan Samsons (1993), menyatakan bahwa kurang lebih 223 spesies Penicillium. Pada dasarnya, cendawan Penicillium sp. terdiri dari 4 sub genus yaitu Penicillium: Penicillium,
Furcatum, Aspergiloides dan Biverticillium (Peterson, 2000).
Penicillium sp. memiliki ciri hifa bersepta dan membentuk badan spora
yang disebut konidium. Konidium memiliki cabang-cabang yang disebut phialides sehingga tampak membentuk gerumbul. Tangkai konidium disebut konidiofor, dan spora yang dihasilkannya disebut konidia. Badan buah biasanya berbentuk seperti sapu yang diikuti sterigma dan konidia yang bersusun seperti rantai. Sterigma adalah lapisan dari pialid yang merupakan tempat pembentukan dan pematangan spora. Konidia adalah spora yang dibentuk pada ujung hifa (Fardiaz, 1998).
Penicillium sp. adalah jenis cendawan yang bersporulasi hijau. Hampir
semua mempunyai spesies konidia pada saat masih muda berwarna hijau kemudian berubah menjadi kecoklatan. Menurut Gams et al. (1987), koloni
Penicillium sp. biasanya berwarna hijau, kadang putih, sebagian besar memiliki
berbentuk rantai panjang, divergent atau kolom, globular, elips atau fusiform, transparan atau kehijauan dengan dinding mulus atau bergelombang.
Penicillium sp. Mucor sp, dan Trichoderma sp, adalah cendawan saprofit
yang paling umum dijumpai dalam tanah. Nurariaty et al., (2013) melaporkan bahwa rhizosfer pertanaman kakao, selain cendawan Penicillium sp. juga ditemukan Aspergillus spp., dan Trichoderma spp. Cendawan Penicillium sp. merupakan cendawan opurtunistik dengan suatu senjata berupa enzim-enzim yang disekresikan untuk menyerang inang-inangnya. Penicillium sp., Fusarium sp.,
Aspergillus sp., digolongkan opurtunistik karena hampir semua sampel larva
Plutella xylostella yang mati terdapat cendawan-cendawan ini. Vega (2008),
selalu menggolongkan ketiga genus cendawan ini ke dalam cendawan-cendawan opportunistik, yang selalu berasosiasi dengan serangga di berbagai negara (Deshpande dan Pune, 2011).
Diketahui terdapat sekitar 200 spesies Penicillium sp. yang peranannya berbeda-beda. Cendawan tersebut diketahui sebagai entomopatogen karena menyerang hama-hama tertentu dan memproduksi metabolit yang beracun untuk serangga. Beberapa racun metabolit tersebut adalah Ochratoxin A, Brevianamide A, Penicillic Acid, dan Citrinin yang menyebabkan kematian pada larva
Drosophila melanogaster dan Spodoptera littoralis (Paterson et al., 1987; Tanada
dan Kaya, 1993).
Penicillium sp., Aspergillus sp., dan Trichoderma sp. merupakan
pada berbagai tanaman masih belum banyak dikaji sehingga masih kurang informasi tentang peranan cendawan tersebut.
Cendawan Penicillium sp. merupakan cendawan saprottrofik yang dapat diisolasi dari tanah, bahan organik yang membusuk, makanan, selulosa, biji-bijian, tumpukan kompos serta dapat juga ditemukan pada tanaman.
Penicillium sp. sangat penting di alam serta bermanfaat untuk produksi makanan
dan obat-obatan. Cendawan ini menghasilkan penicillin, sebuah molekul yang digunakan sebagai antibiotik.
Gambar 2. Bentuk percabangan konidiofor Penicillium sp. (a). konidiofor tunggal, (b). Monoverticillate. (c.) Divaricate. (d) & (e.) Biverticillate. (f.) Terverticillate
(g.)Quaterverticillate. Sumber : Visagie (2014).
Medium Tumbuh dan Substrat Penicillium sp.
Media pertumbuhan mikroorganisme merupakan suatu bahan yang terdiri dari campuran zat-zat makanan atau nutrisi yag diperlukan mikroorganisme untuk pertumbuhannya. Mikroorganisme memanfaatkan nutrisi media yang berupa molekul-molekul kecil yang dirakit untuk menyusun komponen sel. Dengan media pertumbuhan dapat dilakukan isolat mikroorganisme menjadi kultur murni
Media dapat diklasifikasikan menjadi beberapa macam yaitu: (1). Media minimal yaitu media minimalis untuk pertumbuhan mikroba, (2). Media kompleks yaitu media dengan senyawa penyusun tidak diketahui pasti karena kekompleksannya, (3). Media diferensial yaitu media untuk membedakan beberapa mikroba, jadi keduanya tidak terbunuh. Media ini bertujuan untuk mengidentifikasi mikroba dari campurannya berdasarkan karakter khusus yang ditunjukkan pada media diferensial (4). Media Selektif yaitu media untuk menyeleksi mikroba, sehingga salah satu jenis mikroba akan terbunuh. Terbunuhnya salah satu mikroba dikarenakan dalam media tersebut selain nutrisi juga ditambahkan suatu zat tertentu sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan (5). Media sintetik terdefinisi: media dengan senyawa penyusun yang diketahui pasti (6). Media kaya dan diperkaya: media dengan komponen dasar untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah, serum, kuning telur. Media kaya dan diperkaya juga bersifat selektif untuk mikroba tertentu. Bakteri yang ditumbuhkan dalam media ini tidak hanya membutuhkan nutrisi sederhana untuk berkembang biak, tetapi membutuhkan komponen kompleks (Widayat dan Rayati, 1993).
PDA (Potato Dextrose Agar)
Merupakan media umum komplek dan media diferensiasi untuk pertumbuhan jamur serta yeast sehingga sering digunakan sebagai uji untuk menentukan jumlah jamur dan yeast dengan menumbuhkan mikroba pada permukaan sehingga akan membentuk koloni yang dapat dilihat dan dihitung Selain itu PDA (Potato Dextrose Agar) juga digunakan untuk pertumbuhan, isolasi dan enumerasi dari kapang serta khamir pada bahan makanan dan bahan lainnya (Faridaz, 1998).
Tabel 1. Komposisi medium PDA (Potato Dextrose Agar) (Koch, 1881)
Komponen Penyusun Volume / l Pati dari ekstrak kentang 4g
Dextrose (C6H12O6) 20g
Agar 15g
Pati ektrak kentang setiap 100 g mengandung energi 85 kal, air 77,8 g, protein 2g, lemak 0,2g, karbohidrat 19,1g, mineral 1g, kalsium 11mg, fosfor 56 mg, besi 0,7mg, thiamine 0,11mg, asam askorbat 17 mg (Nio, 1992) berfungsi sebagai sumber nitrogen dan vitamin bagi cendawan. Dekstrosa (C6H12O6) berbeda dengan gula yang di konsumsi, dekstrosa merupakan wujud murni gula yang berasal dari sumber alami langka merupakan wujud lain dari L-gulkosa. Dextrosa berfungsi sebagai komber karbon bagi cendawan dan Agar berfungsi sebagai pemadat pada substrat yang telah di homogenkan (Koch, 1881)
SDA (Sabouroud`s Dextrose agar)
terfokus pada bakteri dan jamur yang menyebabkan luka kulit, ragi dan
Malassezia (Sabouraud, 1986).
Tabel 2. Komposisi medium SDA (Sabouroud`s Dextrose agar)
Komponen Penyusun Volume/l
Pepton dari daging 10g
Gulkosa (C6H12O6) 40g
Agar 15g
Pepton dipakai dalam kultur media sebagai sumber nitrogen, banyak senyawa nitrogen dan asam amino esensial sederhana terkandung dalam pepton, sehingga mudah dilepas unsur nitrogennya (Sutarma, 2000). Gulkosa merupakan senyawa sumber karbohidrat pada biakan jamur Agar berfungsi sebagai pemadat pada substrat yang telah di homogenkan (Robert Koch, 1881).
CDA (Czapek Dox Agar)
CDA (Czapek Dox Agar) merupakan medium spesifik kultur Aspergillus,
Penicillium dan Paecilomyces (Thom & Church, 1926). Medium kultur ini
mengandung sukrosa sebagai sumber karbon sendiri dan nitrat sebagai sumber nitrogen sendiri .
Tabel 3. Komposisi medium CDA (Czapek Dox Agar)
Komponen Penyusun Volume / l
Sukrosa 30g
Sodium Nitrat (NaNO3)
Magnesium Sulfat (MgSO4)
Potassium Clorida (KCl)
Iron (III) Sulfat (Eisen (III) SO4)
Di-Potassium Hidrogen Phosphat (K2HPO4)
3g
tembaga sulfat, tembaga (II) klorida (CuCl), benomyl dan dodine) dan antibiotik (seperti cholramphenicol, tetracygline dan streptomisin). Media selektif (Beilhartz
et al, 1982;. Chase et al., 1986; Shimazu dan Sato, 1996; Mark dan Douglas,
1997; Shimazu et al., 2002 ; Keller et al., 2003; Meyling dan Eilenberg 2006;). Di antara mereka, dodine dan CuCl telah dievaluasi karena lebih efektif untuk isolasi cendawan entomopatogendari tanah (Chase et al, 1986;. Shimazu dan Sato, 1996). Tabel 4. Komposisi medium D0C2-4
Komponen Penyusun Volume/l
Pepton dari daging 3g
Cuprum di Clorida (CuCl2)
Krital Violet
0,2g 0,002g
Agar 15g
Medium Substrat Tubuh Spodoptera sp.
Substrat tubuh Spodoptera sp. merupakan medium organik guna menumbuhkan cendawan entomopatogen yang bersifat obligat. Tubuh Spodoptera sp. mengandung beberapa senyawa organik pada berbagai lapisan kulitnya antara lain :
Tabel 5. Komposisi kultikula serangga (Clarkson & Charnely, 1996)
PENDAHULUAN Latar Belakang
Ulat grayak (Spodoptera sp.) merupakan hama utama pemakan daun pada tanaman pangan, perkebunan dan hortikultura. Hama ini merusak pertanaman kapas, jatar (Sesbania sesban), kembang kol dan arum (Colocasia esculenta) dengan intensitas serangan 70-98% serta menyebabkan gagal panen di negara Pakistan (Ahmad et al., 2013). Di Indonesia hama ini merusak 112 jenis tanaman antara lain : tembakau sebesar 30 %, kedelai 80%, sawi 90%, kubis 98%, kacang tanah 30%, kentang 60% cabai 53% dan sayuran lainya sebesar 34%. Serangan terberat Spodoptera sp. terdapat pada instar 3, 4 dan 5, hama ini dapat menyerang tulang daun hingga tangkai daun menyebabkan tanaman menjadi botak dan mati (Hasnah et al., 2012).
Berbagai upaya yang dilakukan untuk mengendalikan hama ini antara lain: pemakaian insektisida kimia dapat menekan sebesar 30-70% (Amir, 2009) dan pemakaian insektisida nabati dapat menekan 20-30% (Tohir, 2011) pada pertanaman tembakau. Agens hayati yang sering digunakan untuk mengendalikan hama ini antara lain: Beauveria bassiana, Entomopthora spp., Metarizium spp.,
Aspergillus sp. dapat membunuh Spodoptera sp. sebesar 50-78% pada skala
Nwodo et al., 2008) dan dapat tumbuh pada kisaran pH antara 2-9 (Sindhu, 2011). Cendawan entomopatogen Penicillium sp. (Prayogo et al., 2002) telah dilaporkan menginfeksi ulat grayak pada tanaman kedelai di Jawa Jimur. Sementara itu, Nurariaty (2006), menemukan cendawan Penicillium sp. juga menginfeksi penggerek buah kakao dan Spodoptera sp. di Sulawesi.
Efektivitas dan virulensi pertumbuhan cendawan entomopatogen
Penicillum sp. sangat bergantung pada jenis medium yang digunakan. Media
yang dipakai untuk menumbuhkan cendawan entomopatogen sangat menentukan laju pembentukan koloni dan jumlah konidia selama pertumbuhan. Jumlah konidia akan menentukan keefektifan cendawan entomopatogen dalam mengendalikan serangga (Widayat dan Rayati, 1993). Adanya perbedaan sporulasi atau jumlah konidia yang dihasilkan oleh masing-masing substrat terkait dengan banyak atau sedikitnya kandungan nutrisi yang terdapat pada medium.
Medium yang sering digunakan untuk menumbuhkan Penicillium sp. entomopatogen antara lain : medium kultur umum kompleks mikroorganisme PDA (Potato Dextrose Agar) medium ini sering digunakan untuk mengisolasi khamir, molds, actinomycetes dan bakteri (Koch, 1881). Medium diperkaya seperti SDA (Sabouroud `s Dextrose Agar) merupakan medium kaya nutrisi untuk menstimulasi pertumbuhan optimum cendawan dermatofungi yang menyerang integument mahluk hidup (Sabouroud, 1892). Medium spesifik cendawan udara seperti CDA (Czapek Dox Agar) merupakan medium spesifik kultur Aspergillus,
Penicillium dan Paecilomyces (Thom dan Church, 1926). Medium diferensial
Spodoptera sp. yang telah ditepungkan guna menumbuhkan cendawan dalam
keadaan virulensi tinggi (obligat).
Berbagai jenis medium memiliki komposisi yang berbeda sehingga menunjukkan pertumbuhan dan virulensi yang berbeda. Berdasarkan hal tersebut maka dianggap perlu dilakukan penelitian untuk mengetahui penggunaan media yang paling berpotensi menghasilkan virulensi yang tinggi sebagai media perbanyakan cendawan entomopatogen Penicillium sp. dan paling efektif mengendalikan serangga hama Spodoptera sp. di laboratorium.
Tujuan Penelitian
Mempelajari toksisitas metabolit sekunder Penicillium sp. dari berbagai media kultur untuk mengendalikan Spodoptera sp. secara in vitro.
Hipotesis Penelitian
Metabolit sekunder Penicillium sp. dari berbagai media kultur dapat mengendalikan Spodoptera sp. secara in vitro.
Kegunaan Penelitian
ABSTRAK
Penelitian untuk mempelajari toksisitas metabolit sekunder Penicillium sp. pada berbagai media kultur untuk mengendalikan Spodoptera sp. (Lepidoptera: Noctuidae) secara in vitro. Penelitian dilakukan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara mulai bulan Januari hingga Agustus 2016. Penelitian menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan 5 perlakuan (Potato Dextrose Agar, Sabouraud Dextrose Agar, D0C2, Czapek Dox Agar, dan tepung yang berasal dari tubuh Spodoptera sp.) dan empat ulangan. Hasil penelitian menunjukkan mortalitas Spodoptera sp. tertinggi (100%) terdapat pada perlakuan media tepung yang berasal dari tubuh
Spodoptera sp. pada pengamatan 6 jam setelah aplikasi dan Lt50 terjadi 3,545 jam
setelah aplikasi.
ABSTRACT
This research was aimed to study the secunder metabolit toksicity of
Penicillium sp on various media of culture for controlling Spodoptera sp.
(Lepidoptera: Noctudae) by in vitro. This reseach was done in Plant Disease Laboratory of Agriculture Faculty, North Sumatera University from January till August, 2016. A Non Factorial Complexcitiy Randomized Design with 5 (five) treatment ( Potato Dextrose Agar, Sabouraud Dextrose Agar, DOC2, Czapex Dox Agar, and the flour which derived from the Spodoptera sp. body) and four replication was applied in this research. The result shown that the highest mortality of Spodoptera sp. (100%) was found on the treatment which used flour which derived from the body of Spodoptera sp.as media on the 6th hours observation after application and Lt50 was occured on the 3,545th hours after application.
TOKSISITAS METABOLIT SEKUNDER PENICILLIUM SP. PADA
BERBAGAI MEDIA KULTUR UNTUK MENGENDALIKAN
SPODOPTERA SP. SECARA IN VITRO
SKRIPSI
OLEH :
EKO MURI SANJAYA 090301010 / AET-HPT
Skripsi merupakan salah satu syarat untuk dapat memeperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Penelitian : Toksisitas Metabolit Skunder Penicillium sp. Pada Berbagai Media Kultur Untuk Mengendalikan
Spodoptera sp. secara In Vitro
Nama Mahasiswa : Eko Muri Sanjaya
NIM : 090301010
Prodi : Agroekoteknologi
Minat : Hama dan Penyakit Tumbuhan
Disetujui Oleh: Komisi Pembimbing
Diketahui Oleh :
(Prof. Dr. Ir. T. Sabrina, M.Sc) Ketua Program Studi Prof.Dr.Dra.M.Cyccu Tobing, MS
Ketua
ABSTRAK
Penelitian untuk mempelajari toksisitas metabolit sekunder Penicillium sp. pada berbagai media kultur untuk mengendalikan Spodoptera sp. (Lepidoptera: Noctuidae) secara in vitro. Penelitian dilakukan di Laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara mulai bulan Januari hingga Agustus 2016. Penelitian menggunakan Rancangan Acak Lengkap (RAL) non faktorial dengan 5 perlakuan (Potato Dextrose Agar, Sabouraud Dextrose Agar, D0C2, Czapek Dox Agar, dan tepung yang berasal dari tubuh Spodoptera sp.) dan empat ulangan. Hasil penelitian menunjukkan mortalitas Spodoptera sp. tertinggi (100%) terdapat pada perlakuan media tepung yang berasal dari tubuh
Spodoptera sp. pada pengamatan 6 jam setelah aplikasi dan Lt50 terjadi 3,545 jam
setelah aplikasi.
ABSTRACT
This research was aimed to study the secunder metabolit toksicity of
Penicillium sp on various media of culture for controlling Spodoptera sp.
(Lepidoptera: Noctudae) by in vitro. This reseach was done in Plant Disease Laboratory of Agriculture Faculty, North Sumatera University from January till August, 2016. A Non Factorial Complexcitiy Randomized Design with 5 (five) treatment ( Potato Dextrose Agar, Sabouraud Dextrose Agar, DOC2, Czapex Dox Agar, and the flour which derived from the Spodoptera sp. body) and four replication was applied in this research. The result shown that the highest mortality of Spodoptera sp. (100%) was found on the treatment which used flour which derived from the body of Spodoptera sp.as media on the 6th hours observation after application and Lt50 was occured on the 3,545th hours after application.
RIWAYAT HIDUP
Eko Muri Sanjaya, lahir di Kisaran, Sumatera Utara pada tanggal 01 Juni 1991 dari pasangan Bapak Muliani dan Ibu Rida Sumarni. Penulis merupakan putra pertama dari tiga bersaudara.
Pendidikan formal yang pernah ditempuh :
- Lulus dari Sekolah Dasar Negeri 013858 Kisaran pada tahun 2003. - Lulus dari Sekolah Menengah Pertama (SMP) Negeri 2 tahun 2006.
- Lulus dari dari Sekolah Menengah Atas (SMA) Negeri 3 Kisaran ada tahun 2009.
- Tahun 2009 diterima di Fakultas Pertanian Universitas Sumatera Utara Medan, Program Studi Agroekoteknologi melalui jalur Pemandu Minat Prestasi (PMP).
Pendidikan informal yang pernah di tempuh di antaranya :
- Tahun 2012 menjadi asisten Laboratorium Dasar Perlindungan Tanaman, Fakultas Pertanian USU, Medan.
- Tahun 2012 menjadi asisten Laboratorium Mikrobiologi Pertanian, Fakultas Pertanian USU, Medan.
- Tahun 2012 melaksanakan Praktek Kerja Lapangan (PKL) di Kebun PTPN III Sei Karang Galang, Sumatera Utara.
- Tahun 2015 - 2016 melaksanakan penelitian di Laboratorium Penyakit Tumbuhan Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas KaruniaNya sehingga penulis dapat menyelesaikan skripsi ini.
Skripsi yang berjudul “Toksisitas Metabolit Sekunder Penicillium sp. pada Berbagai Media Kultur untuk Mengendalikan Spodoptera sp. (Lepidoptera: Noctuidae) Secara In Vitro” merupakan salah satu syarat untuk
mendapatkan gelar sarjana pada Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Komisi Pembimbing Prof. Dr. Dra. M. Cyccu Tobing, MS sebagai Ketua dan Dr. Lisnawita SP M.Si sebagai Anggota yang telah memberi saran dan kritik dalam penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini belum sempurna, oleh karena itu sangat diharapkan kritik dan saran yang membangun demi kesempurnaan penulisan yang akan datang.
Medan, November 2016
DAFTAR ISI
Cendawan Penicillium sp. ... 7
Medium Tumbuh Dan Substrat Penicillium sp ... 9
PDA (Potato Dextrose Agar) ... 11
SDA (Sabouroud Dextrose Agar). ... 11
CDA (Czapek Dox Agar). ... 12
D0C2. ... 13
Medium Substrat Tubuh Spodoptera sp………...13
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 15
Bahan dan Alat ... 15
Metode Penelitian ... 15
Pelaksanaan Penelitian Isolasi Penicillium sp ... 16
Perbanyakan Spodoptera sp...…...………...16
Introduksi Spodoptera sp ... 16
Inokulasi Penicillium sp . ... 17
HASIL DAN PEMBAHASAN
Perilaku dan Morfologi Spodoptera sp. ... 19
Mortalitas Larva Spodoptera sp.(%).. ... 20
Lethal Time 50 (LT50) ... 24
KESIMPULAN DAN SARAN Kesimpulan ... 27
Saran ... 27
DAFTAR PUSTAKA ... 28
DAFTAR TABEL
NO HAL
1. Komposisi medium PDA (Potato Dextrose Agar) ... 11
2. Komposisi medium SDA (Sabouroud`s Dextrose agar). ... 12
3. Komposisi medium CDA (Czapek Dox Agar). ... 12
4. Komposisi medium D0C2-4. ... 13
5. Komposisi kultikula serangga. ... 14
6. Mortalitas Spodoptera sp. 1 - 10 jsa (jam setelah aplikasi) di laboratorium... 20
DAFTAR GAMBAR
NO HAL 1. Siklus Hidup Spodoptera sp. ... 6 2. Bentuk Penicillium sp. ... 9 3.Struktur dan komposisi kultikula serangga dan penetrasi jamur
entomopatogen. ... 13 4.Gejala kematian Spodoptera sp. yang keracunan metabolik sekunder
DAFTAR LAMPIRAN
NO HAL
1. Mortalitas Spodoptera sp 1 JSA ... 36
2. Mortalitas Spodoptera sp 2 JSA ... 37
3. Mortalitas Spodoptera sp 3 JSA ... 38
4. Mortalitas Spodoptera sp 4 JSA ... 39
5. Mortalitas Spodoptera sp 5 JSA ... 40
6. Mortalitas Spodoptera sp 6 JSA ... 41
7. Mortalitas Spodoptera sp 7 JSA ... 42
8. Mortalitas Spodoptera sp 8 JSA ... 43
9. Mortalitas Spodoptera sp 9 JSA ... 44
10.Mortalitas Spodoptera sp 10 JSA ... 45
11. Rekapitulasi data mortalitas Spodoptera sp. 1-10 jsa di laboratorium ... 46
12. LT50 Spodoptera sp. terhadap metabolit sekunder Penicillium sp. pada medium PDB (Pottato Dextrose Broth) ... 47
13. LT50 Spodoptera sp. terhadap metabolit sekunder Penicillium sp. pada medium Czapek Dox Agar (CDA)... 48
14. LT50 Spodoptera sp. terhadap metabolit sekunder Penicillium sp. pada medium Sabouroud`s Dextrose Agar (SDA)………...50
15. LT50 Spodoptera sp. terhadap metabolit sekunder Penicillium sp. pada medium D0C2 ... 52
16. LT50 Spodoptera sp. terhadap metabolit sekunder Penicillium sp. pada medium tubuh Spodoptera ... 54
17. Metabolit sekunder Penicillium sp. pada berbagai media kultur ... 56
19. Perlakuan PDB (Potato Dextrose Broth) ... 57
20. Perlakuan SDA (Sabouroud Dextrose Agar) ... 58
21. Perlakuan DOC ... 58
22. Perlakuan Tepung Tubuh ... 58