TESIS
HUBUNGAN KADAR
FIBROBLAST GROWTH FACTOR 2
(FGF-2)
SERUM DENGAN DERAJAT MENINGIOMA PADA PENDERITA
MENINGIOMA INTRAKRANIAL DI RSUP. H. ADAM MALIK
MEDAN
OLEH :
MARSAL RISFANDI
NIM : 117041245
DEPARTEMEN ILMU BEDAH SARAF
FAKULTAS KEDOKTERAN
DAFTAR ISI
2.1.1. Sejarah Dan Definisi Meningioma ... 6
2.1.2. Epidemiologi Meningioma Intrakranial ... 7
2.1.3. Patologi Meningioma Intrakranial ... 8
2.1.4. Klasifikasi Meningioma Intrakranial ... 9
2.1.5. Karakteristik dan Diagnostik Meningioma ... 12
2.1.6. Prognosis ... 13
2.1.7. Faktor yang Mempengaruhi Pertumbuhan Meningioma 13 2.1.7.1. Sex Hormone ... 13
2.1.7.2. Growth Factor ... 14
2.2. FIBROBLAST GROWTH FACTOR 2 ... 16
2.2.1. Sejarah Dan Struktur Fibroblast Growth Factor 2 ... 16
2.2.2. Peranan Fibroblast Growth Factor 2 ... 18
2.2.3. FGF Signaling Pada Kanker ... 19
2.2.4.2. FGF Sebagai Faktor Angiogenesis ... 20
2.2.4.3. FGF Sebagai Faktor Anti Apoptosis ... 21
2.2.5. Peranan FGF Dalam Tumorigenesis Meningioma .. 22
2.2.5.1. Reseptor Tyrosine Kinase dan Tumor ... 22
2.2.5.2. Mekanisme Imbalanced FGF Signaling ... 23
2.2.5.3. Upregulasi Ekspresi FGF ... 23
2.2.5.4. Switching Antara Spliced Isoforms Alternatif . 24 2.2.5.5. Mutasi FGF ... 24
2.2.5.6. Fusi Protein FGF ... 25
2.2.5.7. Availibilitas Ligand ... 25
2.2.5.8. Gangguan Terminasi FGF Signaling ... 25
BAB 3 KERANGKA KONSEP DAN DEFINISI OPERASIONAL 3.1. KERANGKA TEORI ... 27
3.2. KERANGKA KONSEP PENELITIAN ... 28
3.3. VARIABEL DAN DEFINISI OPERASIONAL ... 28
3.4. HIPOTESIS... 34
BAB 4 METODE PENELITIAN ... 4.1. RANCANGAN PENELITIAN ... 35
4.2. LOKASI DAN WAKTU PENELITIAN ... 35
4.3. POPULASI DAN SAMPEL PENELITIAN ... 35
4.3.1. Populasi Penelitian ... 35
4.4.1. Persetujuan Setelah Penjelasan ... 37
4.4.2. Etika Penelitian ... 37
4.4.3. Pengumpulan Data ... 37
4.4.4. Pengumpulan dan Penyimpanan Sampel Darah ... 38
4.4.5. Pengolahan Sampel Darah ... 38
4.5. METODE ANALISIS DATA... 39
5.1.1. Jenis Kelamin ... 41
5.1.2. Umur ... 42
5.1.3. Suku ... 43
5.1.4. Frekuensi Lokasi Tumor ... 43
5.1.5. Distribusi Berdasarkan Histopatologi ... 44
5.1.6. Distribusi Fibroblast Growth Factor 2 ... 45
5.1.7. Distribusi Frekuensi Meningioma ... Menurut Klasifikasi WHO ... 47
5.1.8. Kadar FGF 2 Berdasarkan Jenis Kelamin ... 47
5.2. HUBUNGAN ANTARA FGF 2 DENGAN VARIABEL LAIN 48
BAB 6 PEMBAHASAN ... 51
BAB 7 SIMPULAN dan SARAN... 7.1. Simpulan ... 55
7.2. Saran .... ... 56
DAFTAR PUSTAKA ... 57
DAFTAR TABEL
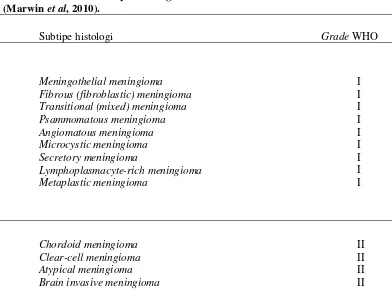
1. Tabel 2.1. Subtipe meningioma dan Grade menurut klasifikasi WHO .... 10
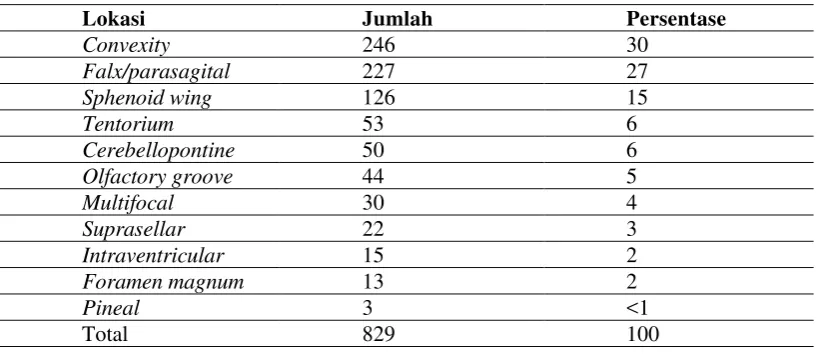
2. Tabel 2.2. Lokasi Tumor Meningioma ... 11
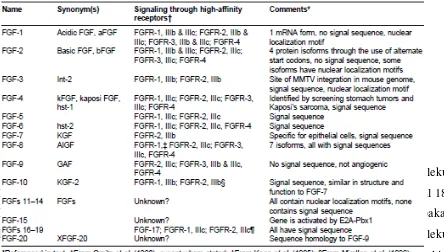
3. Tabel 2.3. Pembagian Fibroblast Growth Factor ... 17
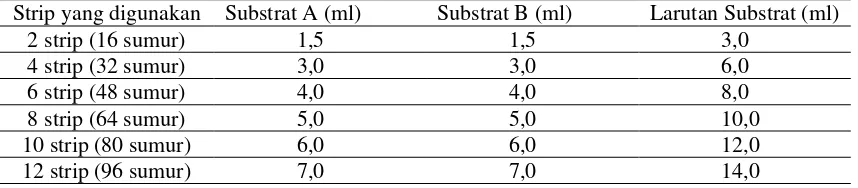
4. Tabel 3.1. Tabel rujukan pencampuran substrat ... 29
5. Tabel 3.2. Tabel Rujukan Pencampuran Standar Dengan Bufer Pencuci . 31 6. Tabel 3.3. Subtipe meningioma dan Grade menurut klasifikasi WHO .... 33
7. Tabel 5.1. Distribusi Frekuensi Jenis Kelamin ... 41
8. Tabel 5.2. Distribusi Frekuensi Umur ... 42
9. Tabel 5.3. Distribusi Frekuensi Suku ... 43
10.Tabel 5.4. Distribusi Frekuensi lokasi tumor ... 44
11.Tabel 5.5. Distribusi Frekuensi Berdasarkan Histopatologi ... 45
12.Tabel 5.6. Distribusi Frekuensi FGF-2 ... 46
13.Tabel 5.7. Distribusi Frekuensi Meningioma Intrakranial Berdasarkan Grade WHO ... 47
14.Tabel 5.8. Distribusi FGF-2 Berdasarkan Jenis Kelamin ... 48
15.Tabel 5.9. Distribusi FGF 2 Berdasarkan Histopatologi ... 49
16.Tabel 5.10. Tes Korelasi Kadar FGF 2-Histopatologi ... 49
17.Tabel 5.11. Distribusi FGF-2 Berdasarkan Histopatologi ... 49
DAFTAR GAMBAR
1. Gambar 5.1. Tampilan micro-wells sebelum pengukuran absorbansi dengan ELISA
DAFTAR SINGKATAN
1. FGF = Fibroblast Growth Factor
2. FGF-R = Fibroblast Growth Factor Reseptor
3. CPA = cerebelo Pontine Angle
4. PDGF = Platelet Derived Growth Factor
5. EGF = Epidermal Grotwh Factor
6. VEGF = Vascular Endothelial Growth Factor
7. GDFs = Growth and Differentiation Factors
8. PKC = Protein Kinase C
9. bFGF = basic Fibroblast Growth Factor
10.RTK = ReseptorTyrosineKinase
11.ELISA = Enzyme-Linked Immunosorbent Assay
BAB 1 PENDAHULUAN
1.1. LATAR BELAKANG
Meningioma intrakranial merupakan tumor otak jinak yang berasal dari jaringan pembungkus otak atau meningens. Tumor otak primer yang paling sering didiagnosa adalah meningioma yaitu sebesar 33,8% dari seluruh tumor otak primer (Wiemelsl, 2010 dan Cea-Soriano, 2012). Meningioma intrakranial juga memiliki sifat yang sangat bervariasi. Banyak diantaranya jinak, namun beberapa sangat agresif. Penyebab hal ini belum dapat dimengerti dengan jelas (Landriel, 2012).
Di Amerika Serikat, insiden meningioma intrakranial yang dikonfirmasi dengan pemeriksaan patologi diperkirakan sebesar 97,5 per 100.000 jiwa. Namun jumlah ini diperkirakan lebih rendah dari yang sebenarnya karena adanya sebagian meningioma intrakranial yang tidak dioperasi. Sedangkan di Inggris, insiden meningioma intrakranial diperkirakan sebesar 5,3 per 100.000 jiwa dan tetap stabil selama 12 tahun ini (Wiemels 2010 dan Cea-Soriano, 2012).
Faktor risiko terjadinya meningioma intrakranial adalah usia, radiasi, genetik dan hormonal. Insiden meningioma intrakranial meningkat seiring pertambahan usia dengan puncak pada usia 70 hingga 80 tahun. Tumor ini sangat jarang terjadi pada anak-anak. (Barnholtz-Sloan, 2007).
Berdasarkan jenis kelamin, insiden meningioma intrakranial pada wanita lebih tinggi dibandingkan pada laki-laki. Di Inggris, insiden meningioma intrakranial pada wanita adalah 7,19 per 100.000 jiwa sedangkan pada pria adalah 3,05 per 100.000 jiwa per tahun. Hal ini tidak berbeda jauh di Amerika, insiden meningioma intrakranial pada wanita dua kali lipat dibandingkan pada laki-laki, yaitu 8,36 dan 3,61 per 100.000 jiwa untuk wanita dan laki-laki. Hal ini menunjukkan adanya kemungkinan hubungan antara meningioma intrakranial dengan hormon seks. (Barnholtz-Sloan, 2007).
Fibroblast Growth Factor (FGF) memiliki aktifitas angiogenesis dan mitogenesis yang sangat diperlukan dalam pertumbuhan dan proses tumorigenesis meningioma intrakranial. Sebuah studi imunohistokimia telah menunjukkan adanya hubungan antara basic
FGF dengan FGF-reseptor pada sel meningioma intrakranial. Adanya ligand dan reseptor mendukung hipotesis mekanisme kerja autokrin pada meningioma intrakranial yang dapat dijadikan sebagai dasar terapi medikamentosa (Black, 2010).
Hingga saat ini dua puluh jenis FGFs telah ditemukan, dan dinamakan dengan FGF-1 hingga FGF-20. FGF-2 dikenal juga sebagai molekul pro-angiogenic, FGF-2 telah dibuktikan mampu merangsang angiogenesis secara in vivo. Penderita tumor agresif atau tumor ganas juga terbukti memiliki kadar FGF-2 yang lebih tinggi dibandingkan dengan penderita tumor jinak. (Li,1994).
Baru – baru ini, beberapa penelitian menyatakan overekspresi dari FGF-2 pada sel dapat menyebabkan aktivasi dari FGF-2 terus menerus. Menariknya, inhibisi dari FGF-2
signaling pada sel menginduksi apoptosis. Oleh karena itu FGF-2 signaling yang terus menerus diproduksi sebagai akibat dari overekspresi menyebabkan adanya proteksi terhadap apoptosis, dan dapat memicu terjadinya tumor (Chin, 2006).
Pemeriksaan kadar FGF-2 sangat mudah dilakukan. Kadar FGF-2 dapat diperoleh dengan dua metode, yaitu: pertama, dengan melakukan pemeriksaan ELISA dari serum darah, maka akan diperoleh kadar FGF-2. Kedua dengan melakukan pemeriksaan Imunohistokimia dari jaringan tumor meningioma intrakranial. Dari pemeriksaan ini akan diperoleh kadar dari 2 Reseptor. Peningkatan pada keduanya baik 2 maupun FGF-2 reseptor memiliki makna yang penting pada pertumbuhan tumor (Abnova, FGF-2014).
Hingga saat ini penelitan – penelitian mengenai kadar FGF-2 yang ada hanya sebatas menilai hubungan antara signifikansi kadar FGF-2 dengan pertumbuhan meningioma intrakranial. Belum ada penelitian yang menyatakan berapa besar kadar FGF-2 pada serum penderita meningioma khususnya meningioma intrakranial. Begitu juga belum ada penelitian yang menyatakan kadar FGF-2 darah pada setiap tingkatan derajat meningioma intrakranial.
Masih sangat sedikit penelitian yang membahas permasalahan tersebut diatas menyebabkan data yang ada juga terbatas. Di Indonesia, khususnya Sumatera Utara, penelitian yang menyatakan nilai kadar FGF-2 pada penderita meningioma intrakranial belum ada. Oleh karena itu peneliti tertarik untuk meneliti tentang kadar FGF-2 dan hubungannya dengan derajat klasifikasi meningioma intrakranial WHO.
Adakah hubungan antara kadar FGF-2 serum dengan derajat meningioma pada penderita meningioma intrakranial?
1.3. TUJUAN PENELITIAN 1.3.1. Tujuan Umum
Mengetahui hubungan antara FGF-2 dengan derajat histopatologi meningioma berdasarkan kriteria WHO pada penderita meningioma intrakranial.
1.3.2. Tujuan Khusus
a. Mengetahui kadar FGF-2 pada penderita meningioma intrakranial
b. Mengetahui derajat histopatologi meningioma intrakranial
c. Mengetahui kadar FGF-2 berdasarkan derajat histopatologi WHO pada meningioma
intrakranial.
d. Mengetahui kadar FGF-2 berdasarkan subtipe meningioma intrakranial
e. Mendapatkan data epidemiologi penderita meningioma intrakranial yang berobat ke
RSUP.H. Adam malik Medan
1.4. MANFAAT PENELTIAN
1.4.1. Bidang Pendidikan (Ilmu Pengetahuan)
Penelitian ini merupakan penelitian basicsicience, dimana hasil penelitian diharapkan memberi tambahan wawasan mengenai kadar FGF-2 pada penderita meningioma intrakranial.
1.4.2. Peneliti
Memberikan masukan bagi peneliti lain yang berminat mempelajari lebih dalam tentang peranan FGF-2 pada pertumbuhan meningioma intrakranial.
1.4.3. Pelayanan Kesehatan
BAB 2
TINJAUAN PUSTAKA
2.1. MENINGIOMA
2.1.1. Sejarah Dan Definisi Meningioma
Pada tahun 1922, Harvey Cushing memaparkan 85 kasus meningeal tumor pada kuliahnya dan Cushing memberikan istilah meningioma untuk menjelaskan lesi tersebut. Beberapa tahun kemudian Louise Eisenhardt menciptakan monograf tentang tumor ini (Igaki, 2009 dan Nakamura, 2003) Dia menyebutkan bahwa semua tumor yang berasal dari
arachnoidal cap cells tergabung dalam arachnoid granulations (Al-Rodhan, 1991).
Pada awalnya tumor ini dinamakan tumor fungoid, sarcoma, cylindroma,
endothelioma, fibroma, meningoethelioma, arachnothelioma, meningocytoma, mesothelioma, leptomeningioma, dural exothelioma, arachnoidal fibroblastoma, dan pada akhirnya dinamakan meningioma (Chou, 1991).
Jadi meningioma intrakranial merupakan tumor jinak ekstra-aksial atau tumor yang terjadi di luar jaringan parenkim otak yaitu berasal dari meningens otak dan tumbuh dari sel-sel arachnoid cap dengan pertumbuhan yang lambat (Al-Hadidy, 2007).
Meningioma tidak hanya dijumpai pada intrakranial tetapi dapat juga dijumpai pada medulla spinalis, disebut juga spinal meningioma. Spinal meningioma sering dijumpai pada wanita paruh baya. Rasio wanita berbanding pria tidak jauh yaitu 3:4. Spinal meningioma sering terjadi pada wanita disebabkan adanya kaitan dengan sex hormone. Meskipun pengaruh sex hormone pada meningioma masih kontroversi, hingga saat ini banyak ditemukan reseptor sex hormone pada meningioma (Haugsten, 2010).
2.1.2. Epidemiologi Meningioma Intrakranial
Meningioma intrakranial menduduki 15% hingga 20% dari keseluruhan tumor intrakranial primer, namun insiden pada skrining rutin sekitar 1 dalam 100 populasi. Insidensi meningkat dengan pertambahan usia. Lebih sering dijumpai pada wanita dengan perbandingan pria:wanita sama dengan 1:2,5. Perbedaan ini semakin meningkat pada meningioma intraspinal, dengan rasio 1:10. Jarang dijumpai pada anak, namun jika ada, cenderung agresif (Landriel, 2012).
intrakranial anak lebih cenderung terjadi pada anak laki-laki dibandingkan anak perempuan, dengan rasio 1,2-1,9:1 dan paling sering dijumpai pada ventrikuler (Landriel, 2012).
Beberapa penelitian melaporkan bahwa insiden meningioma intrakranial pada ras hitam Non-hispanics sedikit lebih tinggi dibandingkan dengan ras putih Non-Hispanics dan
Hispanics. Jenis kelamin juga memengaruhi prevalensi dari meningioma intrakranial, yaitu dua kali lebih tinggi pada wanita dibandingkan dengan pria (Wiemels, 2010 dan Rockhill, 2007).
2.1.3. Patologi Meningioma Intrakranial
Meningioma intrakranial merupakan neoplasma yang tumbuh lambat dan berasal dari sel meningotelial yang ditemukan dalam granulasi arachnoid. Terkonsentrasi mayoritas pada dinding sinus vena, struktur ini, mengandung arachnoid cap cell (Al-Mefty, 2011). Kelompok-kelompok arachnoid cap cell akan menjadi lebih jelas, membentuk whorls dan
psammoma bodies identik dengan yang ditemukan pada meningioma intrakranial (Marwin, 2010).
Secara makroskopis meningioma intrakranial merupakan tumor yang memiliki batas tegas, permukaan yang halus dan melekat pada duramater. Falx meningioma atau tentorial meningioma dapat berbentuk bilobus, dumbbell shape. Pada meningioma ganas, tumor terpisah dengan jaringan otak atau medula spinalis, dan dijumpai bagian-bagian yang nekrosis serta mudah berdarah. Meningioma intrakranial yang jarang dijumpai ialah en plaque meningioma, suatu meningioma yang melekat dan menutupi dura dalam bentuk yang datar dan menyerupai karpet. Varian ini sering disertai dengan hiperostosis pada tulang yang ditempel, sering berada pada sphenoid ridge atau dalam sinus cavernosus. Kebanyakan meningioma intrakranial menekan dan masuk ke dalam jaringan otak tanpa adanya invasi ke jaringan otak (Scheithauer, 2010).
Struktur jaringan bervariasi, mulai dari lembut bergelatin hingga keras dan berkalsifikasi. Jika dilakukan pemotongan, permukaan yang terpotong akan tampak
translucent dan pucat keabuan atau homogen merah kecoklatan pada tumor dengan vaskularisasi yang meningkat. Tumor dengan kandungan lemak yang tinggi (perubahan
2.1.4. Klasifikasi Meningioma Intrakranial
Meningioma intrakranial dapat diklasifikan berdasarkan histopatologi, lokasi tumor, serta pola pertumbuhan tumor.
2.1.4.1. Klasifikasi Meningioma Berdasarkan Histopatologi
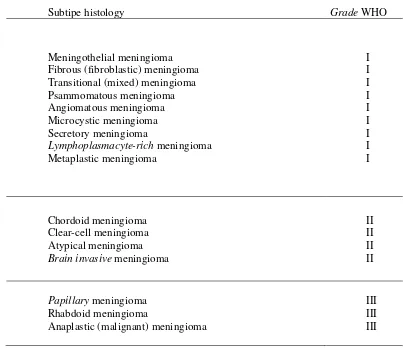
Pembagian meningioma secara histopatologi telah ditentukan oleh WHO pada tahun 2007 menjadi 3 grade, yaitu Jinak (Benign :Grade I), Atipikal (Atypical : Grade II), dan Ganas (Malignant : Grade III). Menurut histopatologinya, meningioma grade I diklasifikasikan sebagai meningioma meningothelial, meningioma fibrous (fibroblastik), meningioma transisional, meningioma psammomatous, meningioma angiomatosa,
meningioma mikrokistik, meningioma sekretorik, meningioma lymphoplasmacyte-rich; Meningioma grade II diklasifikasikan sebagai meningioma chordoid, meningioma clear-cell, meningioma atypical; Meningioma grade III diklasifikasikan sebagai meningioma papillary, meningioma rhabdoid, meningioma anaplastik (Marwin, 2010).
Tabel 2.1. Subtipe meningioma dan Grade menurut klasifikasi WHO
(Marwin et al, 2010).
Subtipe histologi Grade WHO
Papillary meningioma
2.1.4.2. Klasifikasi Meningioma Berdasarkan Lokasi
Berdasarkan lokasi tumor, meningioma dapat berada di konveksitas, parasagital, tuberkulum sella, falx, sphenoid ridge, CPA, frontal base, petroclival, fosa posterior,
tentorial, middle fossa, foramen magnum, dan lainnya (Otsuka, 2010).
Lokasi umum meningioma primer dalam urutan paling sering adalah parasagital, cavernous, tubercullum sellae, lamina cribrosa, foramen magnum, zona torcular, tentorium
cerebelli, sudut serebelopontin, dan sinus sigmoid. Meningioma dengan frekuensi lebih rendah dapat terjadi di medula spinalis, intraventrikular, orbita (optic nerve sheath dan
foramina opticum), intraoseus (tulang temporal petrosa), pineal, ekstracalvaria, dan ektopik (cavum nasi, sinus paranasal, glandula parotis, paru-paru, glandula adrenal, dan
mediastinum (Chou, 1991).
Tabel 2.2. Lokasi Tumor Meningioma (Otsuka, 2010).
Lokasi Jumlah Persentase
Convexity 246 30
Falx/parasagital 227 27
Sphenoid wing 126 15
Intraventricular 15 2
Foramen magnum 13 2
Pineal 3 <1
Total 829 100
2.1.4.3. Klasifikasi Meningioma Berdasarkan Pola Pertumbuhan
berbentuk seperti karpet dengan adanya abnormalitas tulang, sedangkan meningioma en masse didefinisikan sebagai bentuk antara dari en masse klasik dan meningioma invading en plaque dengan perlekatan dura yang luas tetapi tanpa tampilan seperti karpet (Talacchi, 2011).
2.1.5. Karakteristik dan Diagnostik Meningioma Intrakranial
Secara umum, penampilan karakteristik dan diagnostik dari meningioma intrakranial adalah batas yang tegas dan perlekatan fokal pada dura. Tumor ini biasanya berbentuk globular, berkapsul, dan memiliki proyeksi pertumbuhan ke arah dalam, menekan tetapi tidak menginvasi parenkim kecuali dalam bentuk maligna, terkadang menginvasi dura dan sinus. Jika meningioma intrakranial segar dipotong akan tampak pucat dan semi transparan atau homogen dan berwana coklat kemerahan tergantung dari derajat vaskularisasinya. Pola kumparan (whorl) biasanya akan tampak pada permukaan potongan setelah dilakukan fiksasi. Konsistensi berpasir adalah tampilan umum yang dihubungkan dengan adanya badan psammoma. Jaringan pembuluh darah yang kasar dapat tampak pada varian meningioma angiomatosa (Chou, 1991).
2.1.6. Prognosis
Prognosis dari meningioma intrakranial memiliki perbedaan pada setiap klasifikasi atau derajat meningioma. Invasi parenkim otak jelas akan mempengaruhi prognosis. Lokasi anatomis akan mempengaruhi laju rekurensi. Tumor-tumor yang berada pada posisi yang sulit akan menimbulkan kesulitan dalam total removal dari tumor, seperti pada ala sphenoidalis. Meningioma intrakranial yang menginvasi sinus, seperti pada meningioma parasagittal, memiliki rekurensi yang tinggi (Al-Mefty, 2011).
Walaupun meningioma intrakranial yang berbatas tegas dapat diangkat secara keseluruhan, meningioma intrakranial dengan ekstensi yang pipih pada ruang subdural (10% meningioma) akan sulit untuk direseksi seluruhnya, seperti pada meningioma en plaque. Rekurensi juga kerap terjadi pada meningioma intrakranial yang memiliki profil ganas, seperti pola hemangiopericytic atau papiler. Kriteria selular keganasan adalah adanya mitosis, meningkatnya selularitas, polimorfisme inti sel, dan nekrosis fokal. Indeks mitosis yang tinggi juga salah satu aspek yang mengarah pada keganasan (Al-Mefty, 2011).
Hubungan antara hormon dan meningioma telah dibuktikan oleh beberapa penelitian, termasuk data meningkatnya penderita tumor ini pada wanita dibandingkan pada pria (2:1). Dijumpai adanya estrogen, progesteron, dan reseptor androgen pada beberapa meningioma, adanya hubungan antara kanker payudara dengan risiko meningioma, perubahan ukuran meningioma yang semakin membesar pada fase luteal dari siklus menstruasi dan siklus kehamilan, dan adanya proliferasi in vitro pada sel meningioma yang di kultur setelah terpapar dengan estrogen, merupakan bukti bahwa meningioma dipengaruhi oleh hormon (Fisher, 2007 dan Wrensch, 2002). Sebuah penelitian pada 31 sampel meningioma melaporkan munculnya ekspresi gen lebih kuat berkaitan dengan adanya reseptor progesteron dibandingkan dengan reseptor estrogen (McCarthy, 1998). Penelitian-penelitian pada paparan hormon endogen memperlihatkan bahwa risiko meningioma berhubungan dengan status
menopause, paritas, dan usia pertama saat menstruasi. Namun, hal-hal ini masih menjadi kontroversi (Wiemels, 2010 dan Taghipour, 2007).
2.1.7.2. Growth Factor
Growth factor merupakan senyawa – senyawa protein yang memiliki peranan penting dalam pertumbuhan dan proliferasi sel. Sebuah penemuan terkini dalam bidang onkologi bahwa Platelet Derived Growth Factor (PDGF) merupakan sebuah produk onkogen yang menstimulasi pertumbuhan (Krisch,1997). Beberapa growth factor yang mempengaruhi pertumbuhan meningioma ialah Platelet Derived Growth Factor (PDGF), Epidermal Grotwh Factor (EGF), Vascular Endothelial Growth Factor (VEGF), dan Fibroblast Growth Factor
(FGF) (Krisch,1997).
Platelet Derived Growth Factor (PDGF) mampu menstimulasi proliferasi dan sintesis DNA pada kultur meningioma manusia melalui sebuah mekanisme yang melibatkan
oncogene c-fos (Weisman,1986). PDGF dihasilkan oleh meningioma dan paparan terhadap protein yang menstimulasi sintesis DNA (Wang, 1986). Penelitian lain menunjukkan bahwa PDGF merupakan komponen dari suatu media yang dihasilkan dari kultur meningioma dan dapat menstimulasi pertumbuhan meningioma (Todo,1996)
Vascular Endothelial Growth Factor (VEGF) disekresikan oleh meningioma, dan dua reseptor utama dari VEGF telah ditemukan pada vaskularisasi tumor meningioma (Ragel, 2003). VEGF sangat mempengaruhi edema pada peritumoral meningioma dan angiogenesis. Beberapa penelitian menemukan adanya korelasi peritumoral edema dengan ekspresi VEGF dengan transkripsi mRNA (Ragel, 2003). Hubungan antara ekspresi VEGF dan derajat histopatologi meningioma masih kontroversi, beberapa penelitian melaporkan ada nya hubungan, namun penelitian lainnya melaporkan tidak dijumpai hubungan yang positif (Ragel, 2003).
Fibroblast Growth Factor (FGF) dan Fibroblast Growth Factor Receptors
merupakan protein yang dijumpai pada semua meningioma. Dari beberapa penelitian FGF dilaporkan menstimulasi proliperasi sel dan sintesis DNA pada kultur meningioma manusia (Abe,1994). Selain itu FGF juga mempunyai efek angiogenesis dan mitogenesis dalam proses tumorigenesis meningioma. Penelitian – penelitian imunohistokimia telah menunjukkan adanya FGF dan FGF-R pada sel meningioma manusia (Ragel,2008). Hingga saat ini dua puluh jenis FGFs telah ditemukan, dan dinamakan dengan FGF-1 hingga FGF-20. Baru – baru ini, beberapa penelitian menyatakan overekspresi dari FGF-2 pada sel dapat menyebabkan aktivasi dari FGF-2 terus menerus. Menariknya, inhibisi dari FGF-2 signaling
pada sel menginduksi apoptosis. Oleh karena itu FGF-2 signaling yang terus menerus diproduksi sebagai akibat dari overekspresi menyebabkan adanya proteksi terhadap apoptosis, dan dapat memicu terjadinnya tumor (Chin, 2006).
2.2. FIBROBLAST GROWTH FACTOR 2
2.2.1. Sejarah dan Struktur FibroblastGrowthFactor 2
Ketika protein disintesis oleh suatu sel, protein tersebut dapat berdifusi ke daerah di sekitarnya dan menginduksi perubahan dari sel di sekitarnya, hal ini disebut sebagai interaksi parakrin, dan protein yang berdifusi tersebut dikenal sebagai faktor parakrin atau Growth and Differentiation Factors (GDFs). Faktor parakrin ini dapat dikelompokkan menjadi empat kelompok besar berdasarkan strukturnya. Kelompok tersebut ialah: Fibroblast Growth Factor (FGF) family, Hedgehog family, Wingless family, dan TGF-ß superfamily (Abnova 2014).
Kelompok FGF memiliki struktur yang sangat banyak. FGF-1 juga dikenal sebagai
acidic FGF; FGF-2 dikenal dengan basic FGF, dan FGF7 kadang disebut sebagai
keratinocyte growth factor (Abnova 2014).
ekspresi bFGF terdeteksi pada neoplasma intrakranial seperti glioma, dan berhubungan dengan derajat keganasan neoplasma intrakranial serta angiogenesis (Wei,2004)
Hingga saat ini dua puluh jenis FGFs telah ditemukan, dan dinamakan dengan FGF-1 hingga FGF-20, pembagian dapat dlihat pada tabel di bawah ini. Penamaan yang berbeda ini berdasarkan pada perbedaan aktivitas biologi dari masing – masing FGFs dan tidak semua FGF ini memiliki aktivitas stimulasi. Fibroblast Growth Factor yang tidak memiliki efek stimulasi ini tetap dikategorikan sebagai famili FGF dikarenakan bentuk struktur yang sama (Wei,2004).
Tabel.2.3. Pembagian Fibroblast Growth Factor (Wei,2004)
FGF-2 disebut juga basic FGF. FGF-2 berukuran 18kDa dan sekitar 55%
Saat ini dijumpai empat jenis FGF-2, pembagian ini didasarkan kepada berat molekul FGF-2 yang terdiri dari; 18kDa, 22.5-, 23.1-, dan 24.2-kDa. FGF dengan berat molekul 18-kDa merupakan hasil translasi inisiasi start codon 5’AUG. Sementara lainnya merupakan hasil translasi dari upstream codon, CUG. Oleh karena itu bentuk FGFs dengan berat molekul yang lebih besar merupakan co-linear amino-terminal extensions dari bentuk 18-kDa. Hal ini serupa dengan myc proto-oncogene, yang juga dapat menggunakan alternate non-AUG codon untuk inisiasi translasi (Bikfalvi, 1997).
FGF-2 memiliki empat residu sistein pada asam amino 26, 70, 88, dan 93. Mutasi dari empat sistein ini menjadi senyawa serine menghasilkan protein dengan struktur sekunder dan memiliki kemampuan mitogenik sama dengan sel 3T3 dan dikenal sebagai wild-type FGF-2. FGF-2 juga merupakan substrat untuk posforilasi oleh protein kinase C (PKC) dan protein kinase A (PKA). PKC memposforilasi FGF-2 pada Ser64; namun hal ini tidak memiliki aktivitas biologi, ataupun kapasitas mengikat reseptor. Namun, PKA memposforilasi FGF-2 pada Thr112 pada domain reseptor FGF, dan menghasilkan ikatan yang lebih kuat 3-8 kali lipat (Denizot, 2006).
Selama masa perkembangan embriologi, FGF-2 memiliki peranan dalam mengatur proliferasi sel. Pada organisme dewasa, FGF-2 merupakan faktor homeostatik dan berfungsi untuk memperbaiki jaringan dan respon cedera. Jika FGF-2 salah diekspresikan, beberapa senyawa FGF-2 menyebabkan pertumbuhan kanker.
2.2.3. FGF-2 Signaling Pada Kanker
Pada lingkungan ekstraseluler FGFs akan berikatan dengan reseptor sel di permukaan sel dan mengaktifkan kaskade transduksi sinyal. Sinyal tersebut kemudian mengaktifkan berbagai variasi program genetik melalui regulasi faktor-faktor transkripsi, menstimulasi pertumbuhan sel dengan memicu progersi siklus sel dan menginhibisi pathway kematian sel. Semua komponen dari pathway ini, mulai dari FGFs hingga faktor transkripsi merupakan onkoprotein yang potensial. Oleh karena itu, hilangnya regulasi pada tahap mana saja dapat memicu komponen downstream dan menyebabkan pertumbuhan sel tidak terkontrol dan menjadi neoplasma (Haughsten, 2010).
2.2.4. Program Genetika Pertumbuhan Tumor
FGF-2 mungkin mengaktivasi program genetika yang merangsang pertumbuhan sel dengan tiga mekanisme: pertama sebagai mitogen terhadap sel tumor itu sendiri, kedua dengan merangsang angiogenesis untuk suplai pertumbuhan tumor, dan ketiga dengan menginhibisi apoptosis dan membiarkan sel tumor untuk tumbuh diatas normal (Haughsten, 2010).
2.2.4.1. FGF-2 Sebagai Faktor Mitogenic
FGF-1 dan FGF-2 awalnya diidentifikasi berdasarkan kemampuan utnuk menstimulasi [3H]thymidine 3T3 fibroblast dan dianggap sebagai faktor mitogen yang kuat. Bagaimanapun juga sangat penting untuk membedakan konsep antara penambahan agen eksogen yang menghasilkan protein dengan konsep overexpresi dari gen itu sendiri. Sementara itu, FGF-1 dan FGF-2 merupakan patogen mitogen dengan sendirinya,
overekspresi FGF-1 dan FGF-2 cDNAs hanya dijumpai pada fibroblast yang sedang bermutasi. Hal ini memberikan asumsi bahwa mutasi yang disertai dengan sekresi FGF-1 atau FGF-2 mungkin bersifat onkogenik (Haughsten, 2010).
FGF-1 dan FGF-2 dikenal juga sebagai molekul pro-angiogenic, dan 1 dan FGF-2 telah dibuktikan mampu merangsang angiogenesis secara in vivo pada membran
korioalantois (Haughsten, 2010).
Angiogenesis diperantarai oleh sejumlah growth factor dan merupakan proses vital untuk pertumbuhan tumor (Denizot, 2006). Vascular endothelial growth factor (VEGF) dan
basic fibroblast growth factor (bFGF) merupakan dua angiogenic growth factor potensial yang merangsang stimulasi proliferasi sel endotelial pembuluh darah dan terlibat dalam angiogenesis neoplasma dari beberapa tumor termasuk meningioma (Sanmoto, 1995 dan Pietsch, 1997).
Angiogenesis terdiri dari beberapa tahap termasuk migrasi, proliferasi, dan tubulogenesis. Tahapan – tahapan ini terintegrasi secara bertahap dan sesuai dengan urutan proses pada tahap intraseluler dan ekstraseluler. FGF-2 berperan dalam kontrol migrasi, proliferasi, dan tubulogenesis. Peranan dan mekanisme aksi dari isoform FGF-2 dalam regulasi fenomena ini telah dipahami (Bikfalvi, 1997).
Angiogenesis tumor diregulasi tidak hanya pada level FGF-2 tetapi juga pada level reseptor. Arbeit telah menganalisa pola ekspresi dari sistem FGF-FGF reseptor dalam multi tahap karsinogenesis menggunakan tikus transgenik. Sementara FGF-1 berperan hanya dalam
up-regulasi displasia, FGF-2 berperan pada semua tahap secara simultan. Dari beberapa penelitian didapat sistem reseptor FGF-FGFR memiliki peran signifikan pada semua tahap karsinogenesis dan angiogenesis tumor pada epidermis. Oleh karena itu angiogenesis tumor mungkin dikendalikan juga pada level reseptor. (Arbeit, 1996)
Data klinis juga mendukung peranan FGF-2 dalam angiogensis tumor. Cairan CSF anak dan dewasa dengan tumor otak mengandung aktivitas angiogenik yang identik dengan FGF-2, dan berkorelasi dengan perluasan microvessel intra tumor. Kemudian, kadar FGF-2 juga meningkat pada sampel urin dari penderita tumor otak. Penderita tumor agresif atau tumor ganas memiliki kadar FGF-2 yang lebih tinggi dibandingkan dengan penderita tumor jinak. (Li,1994).
2.2.4.3. FGF-2 Sebagai Faktor Anti Apoptosis
BCL-2 merupakan protein antiapoptosis yang dijumpai overexpresi pada limfoma folikuler. Kemungkinan bahwa FGF-2 turut berpartisipasi .dalam regulasi apoptosis melalui BCL-2 oleh karena antibodi teradap FGF-2 ditemukan menginduksi apoptosis pada sel
Basic Fibroblast Growth Factor (bFGF) merupakan faktor pertumbuhan dengan fungsi angiogenesis dan proliferasi. Respon biologi dari bFGF timbul oleh adanya ikatan dengan reseptor spesifik pada permukaan sel. Penelitian menunjukkan Basic Fibroblast Growth Factor (bFGF) memiliki peranan penting dalam angiogenesis tumor, invasi, dan proliferasi (Arbeit, 1996).
Fibroblast Growth Factor 2 (FGF)-2 merupakan anggota tertua dari growth family
sejak ditemukan pada tahun 1982. Growth Factor ini mampu menstimulasi pertubuhan sel endotel dan angiogenesis baik secara in vitro atau in vivo, dan telah lama diperkirakan sebagai faktor angiogenesis tumor (Arbeit, 1996).
2.2.5. Peranan FGF-2 dalam Tumorigenesis Meningioma Intrakranial 2.2.5.1. Reseptor Tyrosine Kinase dan Tumor
FGF-2 merupakan keluarga dari reseptor tyrosine kinase (RTK), yang merupakan reseptor single-pass transmembrane dengan extracellular ligand-binding domains dan
intracellular tyrosine kinase domain (Haugsten, 2010). Aktivasi dari RTK oleh respective ligands menginduksi aktivasi kinase yang akan menginisiasi intracellular signaling network
sehingga proses – proses seluler akan dimulai, seperti proliferasi sel, pertumbuhan, diferensiasi, migrasi, dan survival (Haugsten, 2010). Dengan cara ini RTK memainkan peranan biologi penting selama pertumbuhan dan kehidupan organisme multiseluler. Oleh karena itu, tidak mengherankan jika terjadi deregulasi sejumlah besar RTK dihubungkan dengan berkembangnya berbagai penyakit pada manusia termasuk pembentukan tumor (Haugsten, 2010).
2.2.5.2. Mekanisme Imbalanced FGF-2 Signaling
Deregulasi aktivitas FGF-2 paling sering dikenal sebagai proses onkogen. Beberapa mekanisme dapat menyebabkan FGF-2 signaling yang berlebihan. Pertama, upregulated
FGF-2 expression menyebabkan meningkatnya FGF-2 signaling. Kedua, mutasi atau adanya penyusunan ulang pada kode gen FGF-2 dapat menyebabkan meningkatnya jumlah reseptor dan perubahan aktivitas signaling. Ketiga, availibilitas ligand yang mempengaruhi FGF-2
signaling. Selanjutnya, gangguan pada terminasi FGF-2 signaling seperti deregulasi protein inhibisi atau degradasi defective juga dapat meningkatkan FGF-2 signaling (Haugsten, 2010).
Overekspresi dari gen dapat disebabkan oleh adanya amplifikasi atau regulasi transkripsi yang terganggu. Peningkatan kadar FGF-2 telah ditemukan pada beberapa tumor manusia, seperti tumor otak, kepala dan leher, paru, payudara, lambung, dan prostat, serta sarkoma dan multiple myeloma (Chin, 2006)
Baru – baru ini, beberapa penelitian menyatakan overekspresi dari FGF-2 pada sel dapat menyebabkan aktivasi dari FGFR-2 terus menerus. Menariknya, inhibisi dari FGF-2
signaling pada sel menginduksi apoptosis. Oleh karena itu FGF-2 signaling yang terus menerus diproduksi sebagai akibat dari overekspresi menyebabkan adanya proteksi terhadap apoptosis, dan dapat memicu terjadinya tumor (Chin, 2006).
2.2.5.4. Switching Antara SplicedIsoforms Alternatif
Switching antara spliced isoforms alternatif juga dapat menyebakan gangguan keseimbangan FGF-2 signaling. Beberapa penelitian mengindikasikan potensial onkogen yang berbeda dari berbagai variasi isoform FGF-2. Pergeseran pada splicingisoform dengan kapasitas FGF-binding yang juga bergeser menyebabkan ketidakseimbangan FGF-2 signaling
dan memicu pertumbuhan tumor (Cha, 2008).
2.2.5.5. Mutasi FGF-2
Beberapa variasi displasia skeletal pada manusia talah diketahui disebabkan adanya mutasi fungsi germline dari FGF-1 ke FGF-3, dan mekanisme mutasi yang sama juga dijumpai pada berbagai tumor termasuk meningioma intrakranial. Banyak mutasi yang telah teridentifikasi memberikan bentuk reseptor yang lebih aktif. Titik mutasi dijumpai pada domain ekstraseluler dari reseptor dan dapat meningkatkan ligand binding atau ligand specifity. Beberapa mutasi juga telah menginduksi dimerisasi reseptor dan mengaktifkan terus menerus domain reseptor kinase. Mutasi yang teridentifikasi pada domain reseptor kinase menyebabkan peningkatan aktivitas FGF-2. Lebih lagi, gangguan terminasi FGF-2 signaling
dapat merupakan akibat dari mutasi domain tersebut (Cha, 2008 dan Ezzat,2002). 2.2.5.6. Fusi Protein FGF-2
2.2.5.7. AvailibilitasLigand
Peningkatan availibilitas ligand mungkin dapat meningkatkan FGF-2 signaling. Keduanya, ekspresi yang tidak tepat dari FGF-2, seperti up regulation dari ekspresi FGF-2 pada sel malignan atau lingkungan di sekitar sel malignan, dan pelepasan FGF-2 dari penyimpanan lokal di matriks ekstraseluler dapat meningkatkan availibiltas ligand (Itoh, 1994).
2.2.5.8. Gangguan Terminasi FGF-2 Signaling
Gangguan down regulation pada aktivitas FGF-2 dapat menyebabkan ketidakseimbangan FGF-2 signaling. Terminasi FGF-2 signaling terjadi melalui proses deposforilasi/posforilasi dan proses endositosis serta degradasi reseptor di lisosom (Cha, 2008 dan Ezzat,2002).
BAB 3
KERANGKA KONSEP DAN DEFINISI OPERASIONAL
3.1. KERANGKA TEORI
Berdasarkan derajat histopatologi meningioma intracranial dibagi menjadi 3, yaitu meningioma benign (derajat 1), meningioma atypical (derajat 2), dan meningioma maligna
(derajat 3). Dalam pertumbuhannya, tumor ini dipengaruhi oleh sexhormone yang terdiri dari estrogen dan progesteron, dan dipengaruhi oleh growth factor. (Arbeit, 1996). Dari keseluruhan growth factor yang ada, FGF-2 merupakan suatu growth factor yang memiliki sifat angiogenesis, mitogenesis serta mampu menghambat apoptosis sel normal. Sifat-sifat ini akan muncul apabila terjadi gangguan dalam regulasi FGF-2. Hal ini tentunya sangat berpengaruh dalam proses pertumbuhan meningioma intrakranial.
3.2. KERANGKA KONSEP PENELITIAN
Meningioma
Intrakranial
Derajat
Histopatologi
WHO
FGF-2 (Fibroblast Growth Factor 2)
Definisi : Suatu molekul dengan berat molekul 18-kDa merupakan hasil translasi inisiasi start codon 5’AUG dan memiliki peranan dalam mengatur proliferasi sel. Cara Ukur : Kadar FGF-2 akan diukur dengan cara Sandwich ELISA (Enzyme-Linked Immunosorbent Assay) dengan perangkat pemeriksaan (FGF-2 (Human) ELISA kit, Abnova, Taiwan). Pemeriksaan dilakukan dengan menggunakan ELISA analyser Chemwell 2910
(Awareness Technology, Inc.). Protokol Pengujian :
Persiapan Reagensia
Keluarkan reagensia dari lemari pendingin dan biarkan hingga suhu ruangan tercapai (20-250
Bufer pencuci (1x): tambahkan 60 cc bufer pencuci (20x) dan encerkan hingga volume akhir 1200 ml dengan air destilata atau air yang tidak mengandung ion. Campur sepenuhnya. Jika diinginkan volume bufer pencuci yang lebh kecil (1x), tambahkan 1 volum dari bufer pencuci (20x) dengan 19 volum air destilata. Bufer pencuci (1x) stabil selama 1 bulan pada suhu 2-8
C). Siapkan reagensia sesuai tahapan di bawah ini. Carmpur sepenuhnya dengan cara memutar pelan sebelum dilkukan pemipetan. Cegah terjadinya busa.
0
Larutan substrat: subsrat A dan substrat B harus dicampurkan bersamaan dalam jumlah yang sama, 15 menit sebelum digunakan. Tabel dibawah merupakan rujukan untuk jumlah yang tepat dalam pencampuran larutan.
C. Aduk rata sebelum digunakan.
Tabel 3.1. Tabel rujukan pencampuran substrat
Strip yang digunakan Substrat A (ml) Substrat B (ml) Larutan Substrat (ml)
2 strip (16 sumur) 1,5 1,5 3,0
Standar bFGF: campurkan standar bFGF dengan 2 ml calibrator diluent 1 (untuk serum/plasma). Campuran ini menghasilkan persediaan larutan sebesar 8000 pg/ml. Persediaan ini dapat disimpan beku (-200
Gunakan persediaan larutan diatas untuk menghasilkan sebuah serial cairan dilusi 2 kali lipat dalam rentang yang digunakan pada pengujian (250 pg/ml hingga 8000 pg/ml). Tambahkan 0,5 ml calibrator diluent yang tepat pada setiap tabung uji. Pastikan tercampur sepenuhnya pada setiap tabung uji. Standar bFGF yang yang tidak terdilusi akan berperan
sebagai standar tinggi (8000 pg/ml) dan calibrator diluent akan berperan sebagai standar 0 (0 pg/ml).
Persiapan Sampel
1. Cell culture supernatant: sentrifugasi untuk membuang material partikulasi yang tampak.
2. Serum: darah diambil sesuai tehnik punksi vena standar dan serum dipisahkan dari sel darah
sesegera mungkin. Sampel dibiarkan mengendap selama 1 jam pada suhu ruangan, sentrifus
selama 10 menit (40
3. Plasma: darah diambil sesuai tehnik punksi vena standar dan plasma dikumpulkan
menggunakan sodium citrate, EDTA, atau heparin sebagai anticoagulan. Untuk
meminimalkan kontaminasi platelet, setelah pengumpulan harus dipisahkan dengan cepat
dari plasma kurang dari 30 menit pada es. Sentrifus selama 10 menit (4 C) dan kemudian ekstrak serum.
0
Prosedur Pengujian
C) untuk membuang
partikulat.
1. Persiapkan bufer pencuci dan standar bFGF sebelum melakukan prosedur pengujian.
Disarankan untuk menggunakan tabel dan diagram yang disediakan sebagai referensi dalam
penambahan standar atau sampel ke plat microtiter.
Tabel 3.2. Tabel Rujukan Pencampuran Standar Dengan Bufer Pencuci
Sumur Isi Sumur Isi
2. Tambahkan 100 µl standar atau sampel ke sumur yang tepat yang berisi antibody pre-coated
3. Tanpa membuang standar dan sampel, tambahkan 50 µl bFGF biotin conjugate ke setiap
sumur. Aduk rata. Tutup dan inkubasi selama 1 jam pada suhu ruangan.
4. Cuci microtiter plate menggunakan salah satu metode di bawah ini:
Pencucian manual: pindahkan campuran yang diinkubasi dengan aspirasi isi dari plat ke tempat pembuangan. Gunakan squirt bottle, isi setiap sumur dengan bufer pencuci (1x) kemudian aspirasi isi dari plat ke tempat pembuangan. Ulangi prosedur ini hingga total 5 kali pencucian. Setelah pencucian terakhir, balikkan plat, dan keringkan dengan kertas hisap hingga kering.
Pencucian automatis: aspirasi semua sumur, kemudian cuci plat sebanyak lima kali
menggunakan bufer pencuci (1x). Selalu sesuaikan pencuci untuk aspirasi sebanyak mungkin hingga volum 350 µl (rentang: 350-400 µl). Setelah pencucian terakhir keringkan dengan kertas hisap hingga kering.
5. Buang 100 µl avidin conjugate ke setiap sumur, aduk rata. Tutup dan inkubasi selama 1 jam
pada suhu ruangan.
6. Siapkan larutan substrat tidak lebih dari 15 menit sebelum akhir dari inkubasi ke dua.
7. Ulangi prosedur pencucian seperti yang dijelaskan tahap 4.
8. Tambahkan 100 µl larutan substrat ke setiap sumur. Tutup dan inkubasi selama 15 menit
pada suhu ruangan.
9. Tambahkan 100 µl larutan penutup ke setiap sumur, aduk rata.
10. Baca Optical Density (O.D.) pada panjang gelombang 450nm menggunakan pembaca
microtiter plate yang di set selama 30 menit.
Hasil pengukuran: diperoleh nilai kadar FGF 2 dengan satuan pg/ml.
Derajat Histopatologi WHO
Menurut klasifikasi WHO, meningioma dibagi menjadi 3 grade, yaitu Jinak (Benign
:Grade I), Atipikal (Atypical : Grade II), dan Ganas (Malignant : Grade III). Menurut histopatologinya, meningioma grade I diklasifikasikan sebagai meningioma meningothelial, meningioma fibrous (fibroblastik), meningioma transisional, meningioma psammomatous, meningioma angiomatosa, meningioma mikrokistik, meningioma sekretorik, meningioma
sebagai meningioma chordoid, meningioma clear-cell, meningioma atypical; Meningioma grade III diklasifikasikan sebagai meningioma papillary, meningioma rhabdoid, meningioma anaplastik (Otsuka, Marwin et al, 2010).
Tabel 3.3. Subtipe meningioma dan Grade menurut klasifikasi WHO (Marwin et al, 2010).
Subtipe histology Grade WHO
Meningothelial meningioma
BAB 4
METODE PENELITIAN
4.1. RANCANGAN PENELITIAN
Penelitian ini dilakukan dengan menggunakan studi Cross Sectional analitik untuk mengukur kadar FGF-2 serum pada penderita meningioma intrakranial, dilanjutkan dengan analisa hubungan antara kadar FGF-2 serum dengan derajat histopatologi WHO.
4.2. LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Rumah Sakit H. Adam Malik / Fakultas Kedokteran Universitas Sumatera Utara, Medan. Pengambilan sampel dilakukan di ruang rawat pasien dan diolah oleh SMF Patologi Klinik RS. H. Adam Malik Medan. Penelitian dilakukan mulai bulan April 2013 hingga April 2014.
4.3. POPULASI DAN SAMPEL PENELITIAN 4.3.1. Populasi Penelitian
Semua pasien yang menderita meningioma intrakranial yang datang ke RS. H. Adam Malik Medan.
4.3.2. Sampel Penelitian 4.3.2.1. Kriteria Inklusi
Kriteria inklusi dari penelitian ini :
1. Pasien yang telah terdiagnosis secara klinis menderita meningioma intrakranial pada
berbagai lokasi intrakranial.
2. Pasien yang telah dilakukan pemeriksaan MRI kepala dengan kontras gadolinium
intravena.
3. Pasien yang telah dilakukan operasi sehingga terdapat jaringan tumor yang dapat
dikonfirmasi sebagai meningioma oleh bagian Patologi Anatomi.
4.3.2.2. Kriteria Eksklusi
Kriteria eksklusi dari penelitian ini :
1. Kejadian berulang (rekurensi) atau kekambuhan (residif), data tentang hal ini diambil
dari rekam medis pasien.
2. Pasien yang mengalami ruda paksa, diketahui dengan cara pemeriksaan fisik dan
rekam medis.
3. Pasien yang memiliki tumor lain pada bagian tubuhnya, data ini diambil dari rekam
medis.
4.3.3. Estimasi Besar Sampel
Pada penelitian ini digunakan total sampling, dimana seluruh penderita meningioma intrakranial yang memenuhi kriteria inklusi akan menjadi sampel.
4.4. METODE PENGUMPULAN DATA 4.4.1. Persetujuan Setelah Penjelasan
Semua subjek penelitian akan diminta persetujuan dari keluarga pasien setelah dilakukan penjelasan mengenai kondisi pasien dan tindakan yang akan dilakukan.
4.4.2. Etika Penelitian
Penelitian ini dilaksanakan dengan menggunakan sampel biologis tersimpan (untuk sampel yang diambil sebelum dilakukannya penelitian) dan sediaan darah yang diambil dari pasien yang masuk ke dalam kriteria inklusi, yang selama pelaksanaannya tidak bertentangan dengan nilai-nilai kemanusiaan dan kode etik penelitian biomedik. Izin didapat dari Komisi Etika Penelitian Fakultas Kedokteran USU.
4.4.3. Pengumpulan Data
4.4.4. Pengumpulan dan Penyimpanan Sampel Darah
Setelah pasien dan atau keluarganya menyetujui pengambilan data dan telah menandatangani formulir persetujuan setelah pemberitahuan, sampel darah akan diambil dari
vena mediana cubiti dengan menggunakan alat suntik steril ukuran 10 cc sesuai dengan prosedur phlebotomi yang telah baku. Darah diambil sebanyak sekitar 5 cc. Setelah sampel darah diambil, sampel tersebut segera dikode sesuai urutannya, dan diserahkan kepada instalasi Patologi Klinis untuk diproses menjadi serum. Setelah sampel mengalami penggumpalan, sampel kemudian akan disentrifuge dengan kekuatan 2.500 rpm selama 15 menit, dan supernatan dipindahkan ke dalam tabung aliquot dan kemudian disimpan dalam lemari es bersuhu -25oC.
4.4.5. Pengolahan Sampel Darah
Serum yang tersimpan akan dicairkan pada suhu ruangan selama sekitar 5 menit dan akan dilakukan pemeriksaan assay FGF. Pemeriksaan tersebut adalah suatu pemeriksaan kuantitatif dengan menggunakan teknik sandwich Enzyme Linked Immunosorbent Assay
(ELISA). Sebuah antibodi monoklonal spesifik terhadap FGF telah dilekatkan pada sumur-sumur dalam microplate. Standar atau sampel kemudian ditambahkan ke dalam sumur
microplate dan diinkubasi. Jika dijumpai bFGF pada sampel, akan berikatan dan diimmobilisasi oleh antibody pre-coated dalam sumur. Kemudian sumur microplate dicuci untuk menghilangkan bFGF yang tidak berikatan dan komponen – komponen lain dari sampel. Agar kadar bFGF dalam sampel dapat dihitung secara kuantitatif, sebuah sedian standar horseradish peroxidase (HRP)-conjugated polyclonal antibody specific untuk bFGF ditambahkan ke dalam sumur untuk menjadikan “sandwich” bFGF yang telah diimmobilisasi selama inkubasi pertama. Kemudian microtiter plate diinkubasikan kedua kalinya. Sumur – sumur tersebut kemudian dicuci kembali untuk membuang semua HRP-conjugated antibodies yang tidak berikatan, dan ditambahkan substrat TMB (3,3’5,5’ tetramethyl-benzidine) ke masing – masing sumut tadi. Enzim HRP dan substrat akan bereaksi dalam waktu inkubasi yang singkat. Hanya sumur – sumur yang mengandung bFGF dan enzyme-conjugated antibody akan mengalami perubahan warna. Reaksi ini diakhiri dengan penambahan larutan asam sulfur dan perubahan warna yang terjadi diukur menggunakan
spectrophotometer dengan panjang gelombang 450 nm ± 2 nm.
Data yang didapat akan diolah dengan menggunakan menggunakan perangkat lunak pengolah data. Variabel kategorik dianalisis dalam bentuk frekuensi dan persentase yang disajikan baik dalam bentuk tabel maupun grafik. Analisis deskriptif variabel numerik dilakukan pemusatan (mean, median) dan penyebaran (standar deviasi, minimum-maksimum). Jika sebaran data normal, digunakan pasangan mean dan standar deviasi. Jika sebaran data tidak normal, digunakan median dengan minimum-maksimum.
Untuk menguji adanya hubungan antara nilai FGF-2 serum dengan derajat histopatologi WHO, ditentukan terlebih dahulu nilai signifikansi secara statistik apakah memiliki kurva normal atau tidak normal dengan menggunakan Kolmogorof-Smirrnov atau
BAB 5
HASIL PENELITIAN
5.1. KARAKTERISTIK SAMPEL
Sampel pada penelitian ini diambil dari bulan April 2013 hingga April 2014. Didapatkan sampel sebanyak 52 spesimen yang berasal dari penderita meningioma intrakranial yang telah menjalani operasi pengangkatan tumor di RSUP. H. Adam Malik Medan. Setelah didapat jaringan tumor maka diagnosa dipastikan dengan pemeriksaan histopatologi. Terhadap penderita tersebut dilakukan pengambilan serum darah kemudian dilakukan pengukuran kadar FGF-2. Hasil lengkap data penderita dapat dilihat pada lampiran.
5.1.1. Jenis Kelamin
Setelah dilakukan pendataan dan analisis distribusi frekuensi, didapatkan sampel berjenis kelamin perempuan lebih banyak dibandingkan dengan sampel laki-laki, dimana sampel perempuan 38 orang (73,1%) dan laki-laki 14 orang (26,9%).
Tabel 5.1. Distribusi Frekuensi Jenis Kelamin
Jenis Kelamin n %
Laki-Laki 14 26,9
Perempuan 38 73,1
Total 52 100,0
5.1.2. Umur
Setelah dilakukan analisis deskriptif terhadap umur didapati bahwa mean adalah 44,5 ± 13,8 tahun dengan nilai minimal 24 tahun dan maksimal 89 tahun. Nilai median adalah 42,5 tahun.
Terhadap sampel dilakukan klasifikasi umur berdasarkan dekade kehidupan kejadian meningioma intrakranial, didapat data frekuensi kejadian terbanyak pada kelompok umur 30 – 39 tahun, 40 – 49 tahun dan 60-69 tahun, dengan masing-masing sebanyak 15 penderita (28,8%), 13 penderita (25%), 13 penderita (25%).
Tabel 5.2. Distribusi Frekuensi Umur
Usia Nilai
Median 42,5
Std. Deviation 13,8
Minimum 24
Maximum 89
Kelompok Umur n %
20 – 29 5 9,6
30 – 39 15 28,8
40 -49 13 25,0
50 -59 3 5,7
60 – 69 13 25
70 -79 2 3,8
80 – 89 1 1.9
Total 52 100
5.1.3. Suku
Berdasarkan suku, didapatkan frekuensi terbanyak adalah suku Batak (24 penderita, 46,2%) dan suku Jawa (20 penderita, 38,5%). Hal ini disebabkan RSUP.H. Adam Malik Medan merupakan rumah sakit pusat rujukan Sumatera Utara dan kedua suku ini merupakan suku terbanyak yang berobat ke RSUP H Adam Malik Medan.
Tabel 5.3. Distribusi Frekuensi Suku
Suku n %
Batak 24 46,2
Aceh 3 5,8
Jawa 20 38,5
Lain – lain 5 13,5
Total 52 100.0
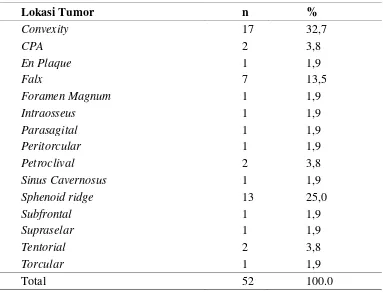
5.1.4. Frekuensi Lokasi Tumor
Berdasarkan lokasi terjadinya meningioma, didapatkan frekuensi terbanyak adalah
Tabel 5.4. Distribusi Frekuensi lokasi tumor
Lokasi Tumor n %
Convexity 17 32,7
CPA 2 3,8
En Plaque 1 1,9
Falx 7 13,5
Foramen Magnum 1 1,9
Intraosseus 1 1,9
Parasagital 1 1,9
Peritorcular 1 1,9
Petroclival 2 3,8
Sinus Cavernosus 1 1,9
Sphenoid ridge 13 25,0
Subfrontal 1 1,9
Supraselar 1 1,9
Tentorial 2 3,8
Torcular 1 1,9
Total 52 100.0
5.1.5. Distribusi Berdasarkan Histopatologi
Berdasarkan hasil histopatologi, didapati frekuensi terbanyak adalah tipe
Meningothelial meningioma sebesar 23 kasus (44,2%), diikuti oleh Fibroblastic meningioma 14 kasus (26,9%), Transitional meningioma 6 kasus (11,5%).
Tabel 5.5. Distribusi Frekuensi Berdasarkan Histopatologi
Histopatologi n %
Meningothelial 25 48,1
Transitional 6 11,5
Fibroblastic 14 26,9
Angiomatous 3 5,8
Psammomatous 1 1,9
Anaplastic 1 1,9
Total 52 100.0
5.1.6. Distribusi Fibroblast Growth Factor 2 (FGF-2)
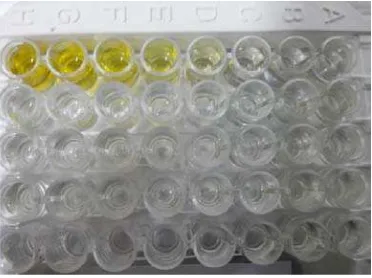
Setelah proses sampel serum dengan menggunakan alat ELISA analyzer sesuai protokol yang telah ditentukan akan didapatkan kumpulan micro-wells standar dan uji yang telah diberikan larutan STOP. Kumpulan micro-wells tersebut kemudian diukur absorbansi-nya pada gelombang cahaya 450nm ± 2 nm.
Gambar 5.1. Tampilan micro-wells sebelum pengukuran absorbansi dengan
ELISA analyzer.
Hasil absorbansi kemudian diplot secara otomatis oleh komputer serta perangkat lunaknya menjadi kurva standar. Dari kurva standar akan didapat nilai konversi konsentrasi FGF serum.
Nilai absrobansi FGF-2 dan konsentrasi FGF-2 yang didapatkan dari pemeriksaan tertera pada lampiran. Pola FGF-2 dideskripsikan dengan menguji pola distribusinya terlebih dahulu. Tes normalitas dilakukan dengan uji Shapiro-Wilk dengan nilai p<0,05 yang menyatakan bahwa data memiliki pola distribusi tidak normal; Sehingga FGF-2 dideskripsikan sebagai median 58,42 pg/Ml (max-min: 1366,23-0.0)
5.1.7. Distribusi Frekuensi Meningioma Intrakranial Menurut Klasifikasi WHO
Berdasarkan kalsifikasi WHO, distribusi meningioma didapat sebagai berikut, penderita dengan meningioma WHO grade 1 sebanyak 49 penderita (94,2%), WHO grade 2 sebanyak 2 penderita (3,8%), dan 1 orang penderita WHO grade 3 (1,9%).
Tabel 5.7. Distribusi Frekuensi Meningioma Intrakranial Berdasarkan Grade WHO
Histopatologi n %
WHO Grade 1 49 94,2
WHO Grade 2 2 3,8
WHO Grade 3 1 1,9
Total 52 100.0
5.1.8. Kadar FGF-2 Berdasarkan Jenis Kelamin
Berdasarkan jenis kelamin, dilakukan uji normalitas Shapiro-wilk didapatkan seluruh kelompok memiliki pola distribusi tidak normal (FGF-2 Perempuan, p<0,05; FGF-2 , p<0,05). Dengan demikian, dapat disebutkan bahwa nilai dari FGF-2 Laki-laki memiliki median 72,01pg/Ml min: 1366,3-3,2) FGF-2 Perempuan memiliki median 58,42 (max-min: 1143,8-0,0).
Tabel 5.8. Distribusi FGF-2 Berdasarkan Jenis Kelamin.
Jenis Kelamin Mean Median SD Min Max P
Tabel 5.6. Distribusi Frekuensi FGF-2
Kadar FGF-2 Nilai
Mean 148,2
Median 58,4
Std. Deviation 282,2
Minimum 0,0
Laki-Laki 156,5 72,0 350,1 3,3 1366,2
0,7*
Perempuan 145,1 58,4 258,2 0,0 1143,8
*
Kemaknaan dalam pengelompokan berdasarkan jenis kelamin ditentukan dengan menggunakan tes Student t jika distribusi data normal dan Mann-Whitney U jika distribusi data normal. Karena distribusi data tidak normal, maka dilakukan uji tes Mann-Whitney U
dengan hasil p: 0,76 (p>0,05). Berdasarkan hasil tersebut dapat disimpulkan bahwa tidak terdapat perbedaan bermakna antara nilai FGF-2 laki-laki dengan perempuan.
Mann-Whitney U
5.1.9. Hubungan Antara FGF-2 Dengan Histopatologi Meningioma Intrakranial
Setelah dilakukan telaah deskripsi terhadap data yang diperoleh, selanjutnya akan dicari hubungan antara kadar FGF-2 dengan variabel histopatolgi. Analisis akan dilakukan dengan menggunakan uji Kruskal – Wallis test.
Tabel 5.9. Distribusi FGF 2 Berdasarkan Histopatologi
HIstopatologi Mean Median SD Min Max P
Berdasarkan tabel diatas, nilai korelasi yang didapat pada hubungan antara kadar FGF-2 dengan histopatologi adalah p = 0,3 (p>0,05). Hal ini menunjukkan bahwa tidak dijumpai hubungan signifikan antara kadar FGF-2 dengan bentuk histopatologi penderita meningioma intrakranial. Pada tebel diatas anaplastic meningioma tidak memiliki nilai hitung oleh karena hanya memiliki 1 sampel saja.
Tabel 5.10. Distribusi FGF-2 Berdasarkan Derajat WHO
Histopatologi Mean Median SD Min Max p
WHO Grade 1 129,3 54,2 252,1 0,0 1366,2
0,07
WHO Grade 2 112,5 112,5 0,7 112,0 113,0
WHO Grade 3 - - - - -
*Kruskall-Wallis test
BAB 6 PEMBAHASAN
Meningioma intrakranial merupakan tumor otak jinak yang berasal dari jaringan pembungkus otak atau meningens. Tumor otak primer yang paling sering didiagnosa adalah meningioma yaitu sebesar 33,8% dari seluruh tumor otak primer (Wiemels et al, 2010; Cea-Soriano et al, 2012). Meningioma intrakranial merupakan tumor jinak ekstra-aksial yang tumbuh dari sel-sel arachnoid cap dengan pertumbuhan yang lambat (Al-Hadidy et al, 2007). Meningioma intrakranial menduduki 15% hingga 20% dari keseluruhan tumor intrakranial primer. Insidensi meningkat dengan pertambahan usia. Lebih sering dijumpai pada wanita dengan perbandingan pria:wanita sama dengan ratio 1 : 2 (Al-Mefty et al, 2011).
Pada penelitian ini diperoleh dari 52 sampel penderita meningioma intrakranial yang berobat ke RSUP H Adam Malik Medan. Dari 52 sampel tersebut, 38 sampel perempuan dan 14 sampel laki-laki. Jika dilakukan perbandingan pada kedua jenis kelamin ini didapatkan perbandingan sebesar; pria:wanita sama dengan 1:2,7.
Pada tahun 2012 Landriel melalui studinya memaparkan hal yang sama, insidensi wanita:pria = 2,5:1 (Landriel, 2012). Beberapa penelitian di negara lain seperti Amerika Serikat dan Inggris juga didapati hal yang sama (Barnholtz-Sloan, 2007). Hal ini berarti meningioma intrakranial dalam pertumbuhannya sangat dipengaruhi oleh hormon seks.
Tingginya insidensi pada perempuan dibandingkan pada laki - laki ternyata tidak memberikan dampak pada kadar FGF-2. Pada laki-laki nilai median kadar FGF-2 ialah 72,01pg/Ml min: 1366,23-3,32) dan pada perempuan memiliki median 58,42 (max-min: 1143,87-0,00). Kemudian dilakukan analisis pada data tersebut dan didapat nilai p = 0,76. Hal ini bermakna tidak dijumpai adanya perbedaan bermakna antara kadar FGF-2 pada perempuan maupun laki – laki. Kadar FGF-2 tidak dipengaruhi oleh jenis kelamin.
Berdasarkan suku, meningioma paling banyak dijumpai pada suku Batak (n=24, 46,2%), diikuti suku Jawa (n=20, 38,5%), Aceh, Melayu, Mandailing, Tamil, Cina, dan Karo. Suku-suku tersebut merupakan suku yang mayoritas dijumpai di Sumatera Utara. Suku Batak serta Jawa merupakan suku terbesar yang paling banyak melakukan kunjungan ke RSUP H Adam Malik Medan. Hasil frekuensi meningioma intrakranial berdasarkan kesukuan ini hampir sesuai dengan demografi penduduk propinsi Sumatera Utara.
Lokasi umum meningioma primer dalam urutan paling sering adalah convexity, parasagital, sphenoid wing, cavernous, tubercullum sellae, lamina cribrosa, foramen
magnum, zona torcular, tentorium cerebelli, sudut serebelopontin, dan sinus sigmoid (Chou, 1991 dan Otsuka,2010). Hal ini hampir menyerupai hasil peneltian, convexity meningioma
merupakan tumor dengan lokasi terbanyak dijumpai (n=17, 32,7%), diikuti Sphenoid ridge meningioma (n=13, 25%), dan Falxmeningioma (n=7, 13,5%).
Berdasarkan hasil histopatologi, didapati frekuensi terbanyak adalah tipe
Meningothelialmeningioma sebesar 23 kasus (44,2%), diikuti oleh Fibroblastic meningioma 14 kasus (26,9%), Transitional meningioma 6 kasus (11,5%). Kadar FGF 2 pada
meningothelial meningioma (median 63,83 pg/Ml; max:1366,23; min: 11,23), transitional meningioma (median 36,19 pg/Ml; max:422; min: 0), Fibroblastic meningioma (median 56,92 pg/Ml; max:259; min: 0), Epithelial meningioma (median 36,28 pg/Ml; max:59,92; min: 12,64), Atypical meningioma (median 112,5 pg/Ml; max:113; min: 112), Angiomatous meningioma (median 27,29 pg/Ml; max:108,52; min: 25,63).
Untuk melihat apakah kadar FGF-2 juga memiliki peranan pada perbedaan subtipe meningioma maka dilakukan uji Kruskal-wallis dengan hasil p=0,42. Hal ini menunjukkan bahwa tidak ada perbedaan bermakna secara statistika dan tidak ada hubungan antara perbedaan kadar FGF-2 dengan perbedaan jenis histopatologi meningioma intrakranial. Akan tetapi ada suatu hal menarik dari hasil diatas, yaitu kadar FGF-2 pada atypical meningioma
(WHO grade 2) dalam penelitian ini ialah 112 pg/ml dan 113 pg/ml, dan kadar meningioma anaplastic (WHO Grade 3) adalah 1143,7 pg/ml sedangkan median subtipe yang lain (WHO Grade 1) dibawah 110 pg/ml. Dari data ini terkesan bahwa kadar FGF-2 semakin meningkat dengan meningkatnya grade WHO, namun belum bisa dipastikan dengan tepat apakah hal tersebut benar oleh karena sampel dengan hasil patologi anatomi atypicalmeningioma hanya 2 sampel dan anaplastic hanya 1 sampel.
Menurut klasifikasi WHO, distribusi penderita dengan meningioma WHO grade 1 sebanyak 49 penderita (94,2%), WHO grade 2 sebanyak 2 penderita (3,8%), dan 1 orang penderita WHO grade 3 (1,9%).
Median FGF-2 pada penderita meningioma intrakranial WHO derajat 1 (median 54,26 pg/Ml; max:1366,23; min: 0), WHO derajat 2 (median 112,5 pg/Ml; max:113; min: 112), WHO derajat 3 (median 1143,87 pg/Ml).
Nilai korelasi yang didapat pada hubungan antara kadar FGF-2 dengan derajat meningioma berdasarkan klasifikasi WHO adalah p = 0,07 (p>0,05). Hal ini menunjukkan bahwa tidak ada hubungan antara kadar FGF-2 dengan derajat meningioma berdasarkan klasifikasi WHO.
Berdasarkan statistika tidak dijumpai adanya hubungan antara kadar FGF-2 dengan klasifikasi derajat WHO. Akan tetapi jika diperhatikan nilai median pada setiap derajat klasifikasi WHO, akan ditemukan nilai kadar FGF-2 yang berbeda dan cenderung meningkat. Pada WHO derajat 1 ditemukan kadar FGF-2 <100pg/ml, WHO derajat 2 kadar FGF-2 > 100pg/ml, dan derajat 3 kadar FGF-2 > 1000 pg/ml. Tidak adanya hubungan yang bermakna mungkin disebabkan karena data tidak terdistribusi secara normal.
BAB 7
SIMPULAN DAN SARAN
7.1. SIMPULAN
1. Pada penelitian ini diperoleh 52 sampel penderita meningioma intrakranial yang berobat ke
RSUP H Adam Malik Medan mulai dari Mei 2013 hingga Mei 2014 . Dari 52 sampel tersebut,
38 sampel perempuan dan 14 sampel laki-laki, dengan perbandingan sebesar; pria:wanita
sama dengan 1:2,7. Rerata usia adalah 44,54 ± 13,8 tahun.
2. Berdasarkan lokasi terjadinya meningioma, didapatkan frekuensi terbanyak adalah convexity meningioma (17 penderita, 32,7%), diikuti oleh sphenoid ridge meningioma (13 penderita, 25%) dan Falcinemeningioma (7 penderita, 13,5%).
3. Berdasarkan hasil histopatologi, didapati frekuensi terbanyak adalah tipe Meningothelial
meningioma sebesar 25 kasus (48,1%), diikuti oleh Fibroblastic meningioma 14 kasus (26,9%), Transitionalmeningioma 6 kasus (11,5%).
4. Berdasarkan kalsifikasi WHO, distribusi meningioma didapat sebagai berikut, penderita
dengan meningioma WHO grade 1 sebanyak 49 penderita (94,2%), WHO grade 2 sebanyak 2 penderita (3,8%), dan 1 orang penderita WHO grade 3 (1,9%)
5. Tidak dijumpai perbedaan bermakna antara nilai FGF-2 laki-laki dengan perempuan, dengan
hasil p: 0,7.
6. Tidak ada hubungan antara kadar FGF-2 dengan jenis histopatologi penderita meningioma
intrakranial, p = 0,3 (p>0,05).
7. Tidak ada hubungan antara kadar FGF-2 dengan derajat meningioma berdasarkan klasifikasi
WHO, p = 0,07 (p>0,05).
7.2. SARAN
1. Dari penelitian ini didapatkan hubungan tidak bermakna antara kadar FGF-2 serum dengan
setiap derajat WHO sehingga dapat terjadi bias. Disarankan penelitian selanjutnya untuk
menggunakan jumlah sampel yang sama pada setiap pembagian derajat klasifikasi WHO.
2. Dari beberapa penelitian juga didapat hubungan yang bermakna antara FGF-2 reseptor
dengan derajat klasifikasi WHO. Oleh karena itu disarankan untuk dilakukan penelitian
lanjutan tentang hubungan antara FGF-2 reseptor dengan derajat klasifikasi WHO serta
DAFTAR PUSTAKA
Al-Hadidy, A.M., Maani, W.S., Mahafza, W.S., Al-Najar, M.S., Al-Nadii, M.M. (2007). Intracranial Meningioma. J Med J 41(1):37-51.
Al-Mefty, O., Abdulrauf, S.I., Haddad, G.F. 2011. Meningioma. In Youmans Neurological Surgery, Winn HR (ed), 6th
Al-Rodhan, N.R.F., Laws, E.R. 1991. The History of Intracranial Meningiomas. In Meningiomas, Al-Mefty (ed). New York: Raven Press. pp. 1-7.
ed. New York: Elsevier. pp. 1426-1449.
Arbeit, J.M., Olson, D.C., Hanahan, D. Upregulation Of Fibroblast Growth Factors And Their Receptors During Multi-Stage Epidermal Carcinogenesis In K14-HPV16 Transgenic Mice. (1996). Oncogene (13):1847-1857.
Barnholtz-Sloan, J.S., Kruchko, C. 2007. Meningiomas: Causes and Risk Factors. Neurosurg Focus. 23 (4): E2.
Bikfalvi, A., Klein, S., Pintucci, G., Quarto, N., Mignatti, P., Rifkin, D.B. Differential Modulation Of Cell Phenotype By Different Molecular Weight Form Of Basic Fibroblast Growth Factor: Possible Intracellular Signaling By The High Molecular Weight Form. (1995). J Cell Biol (129):233-243.
Bikfalvi, A., Klein, S., Pintucci, G., Rifkin, D.B. Biological Roles of Fibroblast Growth Factor-2 (FGF-2). (1997). Endocr Rev (18):26-45.
Black, P.M., Tariq, F. 2010. Biology Of Meningiomas. In: Pamir, M.N., Black, P.M., Fahlbusch, Rudolf., Meningiomas, A Comprehensive Text. New York: Saunders Elsevier. pp. 121-125.
Black, P.M., Villavicencio, A.T., Rhouddou, C.C., Loeffler, J.S. Aggressive Surgery and Focal Radiation in The Management of Meningiomas of The Skull Base: Preservation of Function with Maintanance of Local Control. Acta Neurochir. 2001:143(6):555-62. Calvocoressi, L., Claus, E.B. 2010. Epidemiology and Natural History of Meningioma. In: Pamir, M.N., Black, P.M., Fahlbusch, R., (eds). Meningiomas: A comprehensive text. New York: Saunders Elsevier. pp. 61-77.
Cea-Soriano, L., Wallander, M.A., Garcia-Rodiquez, L.A., 2012. Epidemiology of meningioma in the United Kingdom. Neuroepidemiology 39 (1): 27-34.
Chin, K., Devries, S., Fridlyand, J. Genomic and Transcriptional Aberations Linked To Breast Cancer Pathopysiologies. Cancer Cell. 2006(10):529-541.
Chou, S.M., Miles, J.M. 1991. The Pathology of Meningiomas. In Meningiomas, Al-Mefty O(ed). New York: Raven Press. pp. 4:37-57.
Choy, W., Kim, W., Nagasawa, D., Stramotas, S., Yew, A., Gopen, Q. 2011. The molecular genetics and tumor pathogenesis of meningiomas and the future directions of
meningioma treatments. Neurosurg Focus(ed6).pp.30.
Christensen, H.C., Kosteljanetz, M.M., Johansen, C.C. Incidences of Gliomas and Meningiomas in Denmark, 1943 to 1997. Neurosurgery online. 2003;52(6):1327-33;discussion 1333.
Condra, K.S., Butti, J.M., Mendenhall, W.M., Friedman, W.A., Marcus, R.B., Rhoton, A.L. Benign Meningiomas: Primary Treatment Selection Affects Survival. Int J Radiat Oncol Biol Phys. 1997; 39(2):427-436.
Denizot, Y., et al. Short Communication, The Quantitative Analysis of bFGF and VEGF by ELISA in Human Meningiomas. In: Mediators of Inflamation. Hindawi Publishing Corporation. Volume 2006, article ID 36376, pages 1-3.
Evans, D.G.R., Watson, C., King, A., Wallace, A.J., Baser, M.E., 2005. Multiple meningiomas: differential involvement of the NF2 gene in children and adults. J Med Genet 42: 45-48.
Ezzat, S., Zheng, L., Zhu, X.F., Wu, G.E., Asa, S.L. Targeted Expression of A Human Pituitary Tumor-Derived Isoform of FGF Reseptor-4 Recapitulates Pituitary Tumorigenesis. J Clin Invest. 2002; (109):69-78.
Fisher, J.L., Schwartzbaum, J.A., Wrensch, M.W., Wiemels, J.L. Epidemiology of Brain Tumors. Neurol Clin. 2007; 25(4):867-890.
Haugsten, E.M., Wiedlocha, A., Olsnes, S. Roles Of Fibroblast Growth Factor Receptors in Carcinogenesis. Mol Cancer Res. 2010; (8):1439-1452.
Igaki H, Maruyama K, Koga T, et al. Stereotactic Radiosurgery for Skull Base Meningioma.
Neurol Med Chir (Tokyo). 2009; 49(10):456-461.
Itoh, H., Hattori, Y., Sakamato, H. Preferential Alternative Splicing In Cancer Generates a K-sam messenger RNA with higher transforming activity. Cancer Res.1994; (54):3237-3241.