PEMERIKSAAN RESIDU KLORAMFENIKOL PADA UDANG
WINDU (Penaeus monodon) DARI HASIL BUDIDAYA
TAMBAK SECARA KROMATOGRAFI
CAIR KINERJA TINGGI
SKRIPSI
OLEH:
ERNAL SALITA
NIM 071501031
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PEMERIKSAAN RESIDU KLORAMFENIKOL PADA UDANG WINDU (Penaeus monodon) DARI HASIL BUDIDAYA TAMBAK SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH ERNAL SALITA
NIM 071501031
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PEMERIKSAAN RESIDU KLORAMFENIKOL PADA UDANG WINDU (Penaeus monodon) DARI HASIL BUDIDAYA TAMBAK SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
OLEH: ERNAL SALITA
NIM 071501031
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Juni 2011
Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Nurmadjuzita, M.Si., Apt.
NIP. 195201041980031002 NIP. 1948090419741220
Pembimbing II,
Drs. Fathur Rahman Harun, M.Si., Apt.
NIP. 195201041980031002 Dra. Masfria, M.S., Apt.
NIP. 195707231986012001
Dra. Salbiah, M.Si., Apt. NIP. 194810031987012001
Drs. Syafruddin, M.S., Apt. NIP.194811111976031003
Dekan,
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala
berkat dan kasih karuniaNya, sehingga penulis dapat menyelesaikan penelitian
dan penyusunan skripsi ini.
Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar
Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul:
“Pemeriksaan Residu Kloramfenikol Pada Udang Windu (Penaeus monodon) dari Hasil Budidaya Tambak Secara Kromatografi Cair Kinerja Tinggi”.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan
terima kasih yang sebesar-besarnya kepada:
1. Ayahanda Adil Makmur Tarigan dan Ibunda Bantu Ginting yang telah
memberikan kasih sayang yang tidak ternilai dengan apapun, doa yang tulus,
dukungan yang besar dan pengorbanan baik materi maupun non-materi.
2. Bapak Drs. Fathur Rahman Harun, M.Si., Apt. dan Ibu Dra. Masfria, M.S.,
Apt. yang dengan sabar telah membimbing dan memberikan petunjuk serta
saran selama penelitian hingga selesainya skripsi ini.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. selaku Dekan, staf pengajar dan
staf administrasi Fakultas Farmasi yang telah mendidik penulis selama masa
perkuliahan dan membantu kemudahan administrasi.
4. Bapak Prof. Dr. rer. Nat Effendy De Lux Putra, SU, Apt. selaku Kepala
Laboratorium Penelitian dan Ibu Dra. Masfria, M.S., Apt. selaku Kepala
Laboratorium Kimia Farmasi Kualitatif Fakultas Farmasi USU yang telah
memberikan izin dan fasilitas bagi penulis sehingga dapat mengerjakan dan
5. Kak Mustika Puri dan Bang Abdi selaku penanggung jawab Laboratorium,
Kak Evi, Kak Tina selaku Operator Laboratorium Penelitian yang telah
membantu selama melaksanakan penelitian.
6. Bapak Drs. Nahitma Ginting, M.Si., Apt. selaku Kepala Laboratorium Sintesis
Obat dan Ibu Dra. Saleha Salbi, M.Si., Apt. selaku Kepala Laboratorium Kimia
Organik Fakultas Farmasi yang telah memberikan dukungan dan mendidik
penulis sebagai asisten pada laboratorium tersebut.
7. Sahabat-sahabat (Juwita Manik, Vintha, Santa, Martianus, Febri, Riwandi dan
Sandro), sahabat-sahabat setia di Laboratorium Penelitian (Kak Rikha, Kak
Anita, Melati, Kak Mida, Kak Harty, Bang Jaya dan Kak Mirna), abang dan
kakak asisten Laboratorium Sintesis Obat dan seluruh teman-teman STF
angkatan 2007 yang telah memberikan doa, semangat, perhatian kepada
penulis.
8. Serta seluruh pihak yang telah ikut membantu penulis namun tidak tercantum
namanya.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini.
Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat
bagi kita semua.
Medan, Juni 2011 Penulis,
PEMERIKSAAN RESIDU KLORAMFENIKOL PADA UDANG WINDU (Penaeus monodon) DARI HASIL BUDIDAYA TAMBAK SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
Abstrak
Kloramfenikol adalah antibiotik berspektrum luas pertama yang ditemukan dan digunakan untuk pengobatan penyakit yang diinfeksi oleh
Salmonella typhi. Dalam bidang veteriner, kloramfenikol digunakan untuk
pengobatan berbagai infeksi pada hewan yang disebabkan oleh bakteri. Udang windu yang dibudidayakan secara tambak mudah terserang oleh bakteri sehingga sering kali petambak menggunakan kloramfenikol sebagai solusi.
Tujuan penelitian ini adalah untuk memeriksa residu kloramfenikol pada udang windu dari hasil budidaya tambak secara kromatografi cair kinerja tinggi menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV pada panjang gelombang 278 nm dengan perbandingan fase gerak metanol-aquabidest (55:45) dan laju alir 1 ml/menit.
Dari hasil penelitian, disimpulkan bahwa udang windu hasil budidaya tambak yang diambil di Kota Medan yaitu Medan Labuhan Kelurahan Sei Mati, Medan Belawan Kelurahan Sicanang dan Medan Marelan Kelurahan Labuhan Deli mengandung residu kloramfenikol dengan kadar berturut-turut 0,0436 ± 0,0040 µg/g, 0,4623 ± 0,0046 µg/g dan 0,1038 ± 0,0021 µg/g. Dimana kadar yang diperoleh tidak sesuai dengan syarat zero tolerance yang dikeluarkan oleh WHO (World of Health Organization) pada tahun 2001.
Hasil pengujian validasi menunjukkan bahwa metode ini memiliki akurasi dan presisi yang baik dengan persen perolehan kembali 95,69%, simpangan baku relatif (RSD) 8,88%, batas deteksi 0,0165 µg/ml dan batas kuantitasi 0,0550 µg/ml.
EXAMINATION OF CHLORAMPHENICOL RESIDUE IN TIGER SHRIMP (Penaeus monodon) FROM AQUACULTURE POND BY HIGH
PERFORMANCE LIQUID CHROMATOGRAPHY Abstract
Chloramphenicol was first discovered broad-spectrum antibiotic and used for the treatment of disease which were infected by Salmonella typhi. In veterinary, chloramphenicol is used to treat a variety of animal infection caused by bacteria. Tiger shrimp that cultured in ponds easily attacked by bacteria so the owner often used chloramphenicol as a solution.
The aim of this research was to examine the residues of chloramphenicol in tiger shrimp from aquaculture ponds by high performance liquid chromatography using C18 column (250 mm x 4.60 mm), UV detector at wavelength 278 nm with a ratio of mobile phase methanol-aquabidest (55: 45) and flow rate of 1 ml / min.
Based on this research, it were summarized that tiger shrimp from aquaculture ponds taken from Medan that is Medan Labuhan Kelurahan Sei Mati, Medan Belawan and Medan Belawan Kelurahan Sicanang dan Medan Marelan Kelurahan Labuhan Deli containing chloramphenicol residues which levels of chloramphenicol residues are 0.0436 ± 0.0040 µg/g, 0.4623 ± 0.0046 µg/g and 0.1038 ± 0.0021 µg/g, respectively. In which, the levels is not proper to the terms
zero tolerance issued by the WHO (World of Health Organization) in 2001.
Validation test results indicate that this method have a good accuracy and precision with percent recovery 95.69%, relative standard deviation (RSD) 8.88%, limit of detection 0.0165 µg/ml and limit of quantization 0.0550 µg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... ... 5
2.1 Udang Windu ... ... 5
2.1.1 Budidaya Udang Windu .. ... 6
2.1.2 Penyakit Vibriosis Udang Windu ... 6
2.2 Kloramfenikol ... 7
2.2.1 Sifat Fisiko Kimia ... 7
2.2.3 Efek Samping Penggunaan Kloramfenikol pada
Budidaya Udang Windu ... 9
2.3 Kromatografi Cair Kinerja Tinggi ... 10
2.3.1 Kromatografi ... 10
2.3.2 Pembagian Kromatografi ... 10
2.3.3 Kromatografi Cair Kinerja Tinggi ... 10
2.3.3.1 Jenis-Jenis KCKT ... 11
2.3.3.2 Instrumen KCKT ... 12
2.3.3.2.1 Wadah Fase Gerak ... 13
2.3.3.2.2 Pompa ... 13
2.3.3.2.3 Injektor ... 13
2.3.3.2.4 Kolom ... 14
2.3.3.2.5 Detektor ... 14
2.3.3.2.6 Perekam ... 14
2.3.3.3 Parameter dalam KCKT ... 14
2.3.3.3.1 Tinggi dan Luas Puncak ... 15
2.3.3.3.2 Waktu Tambat ... 15
2.3.3.3.3 Faktor Kapasitas ... 15
2.3.3.3.4 Selektivitas ... 16
2.3.3.3.5 Efisiensi Kolom ... 16
2.3.3.3.6 Resolusi ... 17
2.4 Validasi Metode ... 17
2.4.1 Akurasi ... 19
2.4.2 Presisi ... 20
2.4.4 Batas Deteksi dan Batas Kuantitasi ... 20
2.4.5 Linearitas ... 21
2.3.6 Rentang ... 21
2.3.7 Kekuatan ... 22
BAB III METODE PENELITIAN ... 23
3.1 Alat-alat ... 23
3.2 Bahan-bahan ... 23
3.3 Sampel ... 23
3.4 Rancangan Penelitian... 24
3.4.1 Penyiapan Bahan ... 24
3.4.1.1 Pembuatan Pelarut ... 24
3.4.1.2 Pembuatan Fase Gerak ... 24
3.4.1.3 Pembuatan Larutan Induk Baku Kloramfenikol .... 24
3.4.2 Penentuan Panjang Gelombang Maksimum ... 24
3.4.3 Pembuatan Larutan Sampel ... 25
3.4.4 Prosedur Analisis ... 25
3.4.4.1 Penyiapan Alat KCKT ... 25
3.4.4.2 Penentuan Perbandingan Fase Gerak dan Laju Alir yang Optimum ... 26
3.4.4.3 Analisis Kualitatif ... 26
3.4.4.4 Analisis Kuantitatif ... 27
3.4.4.4.1 Pembuatan Kurva Kalibrasi Baku Pembanding Kloramfenikol ... 27
3.4.4.4.2 Penetapan Kadar Kloramfenikol dalam Sampel ... 27
Secara Statistik ... 28
3.4.5 Validasi Metode ... 29
3.4.5.1 Akurasi... 29
3.4.5.2 Presisi... 30
3.4.5.3 Batas Deteksi dan Batas Kuantitasi ... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum... ... 32
4.2 Penyiapan Larutan Sampel ... 35
4.3 Analisis Kualitatif ... 36
4.4 Analisis Kuantitatif ... 38
4.5 Validasi Metode ... 39
BAB V KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
DAFTAR TABEL
Halaman
Tabel 1. Data hasil analisis kloramfenikol baku 10 µg/ml pada
berbagai perbandingan komposisi fase gerak ... 15
Tabel 2. Hasil penetapan kadar kloramfenikol dalam sampel udang windu
secara statistik ... 20
DAFTAR GAMBAR
Halaman
Gambar 1. Kurva serapan kloramfenikol BPFI 15 µg/ml secara
spektrofotometri UV ... 13
Gambar 2. Kromatogram Hasil Penyuntikan kloramfenikol baku 10 µg/ml dengan perbandingan fase gerak metanol : aquabidest
(55:45) dengan laju alir 1 ml/menit ... 15
Gambar 3. Kromatogram hasil penyuntikan kloramfenikol baku 10 µg/ml (A), larutan sampel udang windu (B), dan larutan sampel yang telah di-spike dengan larutan baku pembanding
kloramfenikol (C) dengan kondisi KCKT yang sama ... 18
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kromatogram Penyuntikan Kloramfenikol Baku untuk Mencari Perbandingan Fase Gerak Metanol-Aquabidest
yang Optimal untuk Analisis ... 26
Lampiran 2. Kromatogram Hasil Penyuntikan LarutanKloramfenikol
BPFI Pada Pembuatan Kurva Kalibrasi ... 29
Lampiran 3. Perhitungan Persamaan Regresi dari Kurva Kalibrasi
Kloramfenikol ... 32
Lampiran 4. Kromatogram Hasil Penyuntikkan Udang
(Kelurahan Sicanang) ... 33
Lampiran 5. Analisis Data Statistik untuk Mencari Kadar Sebenarnya
dari Penyuntikkan Udang Kelurahan Sicanang ... 39
Lampiran 6. Kromatogram Hasil dari Penyuntikkan Udang
Kelurahan Labuhan Deli ... 42
Lampiran 7. Analisis Data Statistik untuk Mencari Kadar Sebenarnya
Dari Penyuntikkan Udang Kelurahan Labuhan Deli ... 48
Lampiran 8. Kromatogram Hasil Penyuntikkan dari Udang
Kelurahan Sei Mati ... 51
Lampiran 9. Analisis Data Statistik untuk Mencari Kadar Sebenarnya
Dari Penyuntikkan Udang Kelurahan Sei Mati ... 57
Lampiran 10. Hasil Pengolahan Data dari Penyuntikan Larutan Sampel
Udang dengan Menggunakan KCKT ... 59
Lampiran 11. Contoh Perhitungan untuk Mencari Kadar Kloramfenikol
dalam Sampel ... 60
Lampiran 12. Kromatogram Hasil Penyuntikan dari Udang Kelurahan Labuhan dan Udang dengan Penambahan Baku pada Persen Perolehan Kembali pada Rentang 50%, 100%,
dan 150 % ... 61
Lampiran 13. Data Perolehan Kembali Kloramfenikol Baku yang Ditambahkan pada Sampel Udang dari Kelurahan
Lampiran 14. Contoh Perhitungan % Recovery dengan Metode Penambahan Bahan Baku (Standard Addition Method)
Sampel Udang Dari Kelurahan Labuhan Deli ... 70
Lampiran 15. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) Kloramfenikol ... 71
Lampiran 16. Sertifikat Analisis Kloramfenikol BPFI ... 72
Lampiran 17. Sertifikat Analisis Baku Kloramfenikol PT. Varia Sekata .... 73
Lampiran 18. Tabel Nilai Distribusi t ... 74
Lampiran 19. Gambar alat KCKT dan vial Autosampler ... 75
Lampiran 20. Gambar Sonifikator (Branson 1510) dan Penyaring ... 76
Lampiran 21. Gambar perangkat pendukung penelitian lainnya ... 77
PEMERIKSAAN RESIDU KLORAMFENIKOL PADA UDANG WINDU (Penaeus monodon) DARI HASIL BUDIDAYA TAMBAK SECARA
KROMATOGRAFI CAIR KINERJA TINGGI
Abstrak
Kloramfenikol adalah antibiotik berspektrum luas pertama yang ditemukan dan digunakan untuk pengobatan penyakit yang diinfeksi oleh
Salmonella typhi. Dalam bidang veteriner, kloramfenikol digunakan untuk
pengobatan berbagai infeksi pada hewan yang disebabkan oleh bakteri. Udang windu yang dibudidayakan secara tambak mudah terserang oleh bakteri sehingga sering kali petambak menggunakan kloramfenikol sebagai solusi.
Tujuan penelitian ini adalah untuk memeriksa residu kloramfenikol pada udang windu dari hasil budidaya tambak secara kromatografi cair kinerja tinggi menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV pada panjang gelombang 278 nm dengan perbandingan fase gerak metanol-aquabidest (55:45) dan laju alir 1 ml/menit.
Dari hasil penelitian, disimpulkan bahwa udang windu hasil budidaya tambak yang diambil di Kota Medan yaitu Medan Labuhan Kelurahan Sei Mati, Medan Belawan Kelurahan Sicanang dan Medan Marelan Kelurahan Labuhan Deli mengandung residu kloramfenikol dengan kadar berturut-turut 0,0436 ± 0,0040 µg/g, 0,4623 ± 0,0046 µg/g dan 0,1038 ± 0,0021 µg/g. Dimana kadar yang diperoleh tidak sesuai dengan syarat zero tolerance yang dikeluarkan oleh WHO (World of Health Organization) pada tahun 2001.
Hasil pengujian validasi menunjukkan bahwa metode ini memiliki akurasi dan presisi yang baik dengan persen perolehan kembali 95,69%, simpangan baku relatif (RSD) 8,88%, batas deteksi 0,0165 µg/ml dan batas kuantitasi 0,0550 µg/ml.
EXAMINATION OF CHLORAMPHENICOL RESIDUE IN TIGER SHRIMP (Penaeus monodon) FROM AQUACULTURE POND BY HIGH
PERFORMANCE LIQUID CHROMATOGRAPHY Abstract
Chloramphenicol was first discovered broad-spectrum antibiotic and used for the treatment of disease which were infected by Salmonella typhi. In veterinary, chloramphenicol is used to treat a variety of animal infection caused by bacteria. Tiger shrimp that cultured in ponds easily attacked by bacteria so the owner often used chloramphenicol as a solution.
The aim of this research was to examine the residues of chloramphenicol in tiger shrimp from aquaculture ponds by high performance liquid chromatography using C18 column (250 mm x 4.60 mm), UV detector at wavelength 278 nm with a ratio of mobile phase methanol-aquabidest (55: 45) and flow rate of 1 ml / min.
Based on this research, it were summarized that tiger shrimp from aquaculture ponds taken from Medan that is Medan Labuhan Kelurahan Sei Mati, Medan Belawan and Medan Belawan Kelurahan Sicanang dan Medan Marelan Kelurahan Labuhan Deli containing chloramphenicol residues which levels of chloramphenicol residues are 0.0436 ± 0.0040 µg/g, 0.4623 ± 0.0046 µg/g and 0.1038 ± 0.0021 µg/g, respectively. In which, the levels is not proper to the terms
zero tolerance issued by the WHO (World of Health Organization) in 2001.
Validation test results indicate that this method have a good accuracy and precision with percent recovery 95.69%, relative standard deviation (RSD) 8.88%, limit of detection 0.0165 µg/ml and limit of quantization 0.0550 µg/ml.
BAB I PENDAHULUAN 1.1 Latar Belakang
Budidaya udang windu di Indonesia telah berkembang sejak tahun 1980
hingga saat ini. Udang windu merupakan komoditas bernilai ekonomis tinggi dan
banyak dibudidayakan serta merupakan komoditas ekspor yang berhasil
meningkatkan devisa Negara dari sektor nonmigas (Suyanto, 2001). Berdasarkan
data yang diperoleh, pada tahun 2000, Sumatera Utara mampu mengekspor udang
windu senilai US$ 621,2 juta ke Jepang, US$ 216,6 juta ke Amerika, US$ 35,5
juta ke Inggris dan US$ 157,8 juta ke Negara Eropa lainnya (Fatma, 2009).
Budidaya udang windu tidak mudah dilakukan karena banyak kendala
yang dihadapi para petambak udang, seperti serangan penyakit yang disebabkan
oleh bakteri, virus maupun jamur yang menimbulkan kematian pada larva udang
maupun udang sehingga tingkat produksi dapat menurun (Nugraheny, 2001). Oleh
karena itu, untuk mengendalikan penyakit udang yang disebabkan oleh bakteri,
maka petambak menggunakan antibiotik seperti tetrasiklin, oksitetrasiklin,
nitrofuran, golongan sulfonamida dan kloramfenikol (Nisha, 2008; WHO, 2007).
Ketidaksadaran para petambak dalam penggunaan antibiotik terutama
kloramfenikol ternyata sangat membahayakan. Penyalahgunaan antibiotika
tersebut mengakibatkan tertinggalnya bahan kimia sebagai residu dalam daging
udang yang dalam jumlah dan waktu lama akan menimbulkan gangguan
kesehatan yaitu terjadinya anemia aplastik pada konsumennya, penyebab grey
syndrome pada bayi dan dapat menyebabkan resistensi terhadap antibiotik
Residu antibiotik dapat dianalisa dengan menggunakan beberapa metode
seperti ELISA (Enzyme Linked Immuanoabsorbent Assay), HPLC (High
Performance Liquid Chromatography), LC (Liquid Chromatography)
kromatografi gas dan kromatografi kertas ( Nisha, 2008).
Kloramfenikol merupakan salah satu dari sembilan jenis bahan tambahan
makanan yang dilarang di Indonesia (Permenkes No. 1168/Menkes/PER/X/1999).
Bahkan WHO (World of Health Organization) memiliki aturan zero tolerance
terhadap kandungan kloramfenikol dalam udang (Islamulhayati, 2005). Beberapa
waktu yang lalu issue tentang residu kloramfenikol begitu meluas setelah
keluarnya Commission Decision Uni Eropa tanggal 27 September 2001 yang
menyatakan telah terdeteksi cemaran kloramfenikol sebesar 0,075 ppb pada
produk udang ekspor Indonesia yang masuk ke negara Uni Eropa (Setyaningsih,
2004; WHO, 2007). Begitu juga dengan ekspor udang ke Cina dan Jepang pada
tahun 2006 dan 2007 yang ditolak karena dicurigai mengandung residu
kloramfenikol (Putro, 2008).
Oleh karena itu peneliti melakukan identifikasi dan menetapkan kadar
kloramfenikol pada udang windu dari hasil budidaya tambak yang diperoleh dari
Kota Medan yaitu Medan Labuhan Kelurahan Sei Mati, Medan Belawan
Kelurahan Sicanang dan Medan Marelan Kelurahan Labuhan Deli secara KCKT
(Kromatografi Cair Kinerja Tinggi).
Metode identifikasi kloramfenikol pada udang windu dari hasil budidaya
tambak secara KCKT dilakukan dengan membandingkan parameter waktu tambat
dari sampel terhadap waktu tambat kloramfenikol BPFI sedangkan penetapan
diperoleh ke persamaan regresi. Untuk menguji keabsahan metode yang
digunakan dilakukan validasi. Parameter validasi yang diuji meliputi akurasi
(kecermatan), presisi (keseksamaan), batas deteksi dan batas kuantitasi.
1.2 Perumusan Masalah
a. Apakah terdapat residu kloramfenikol pada udang windu dari hasil
budidaya tambak yang diperoleh dari kota Medan?
b. Berapakah kadar residu kloramfenikol pada udang windu dari hasil
budidaya tambak yang diperoleh dari kota Medan?
1.3 Hipotesis
a. Terdapat residu kloramfenikol pada udang windu dari hasil budidaya
tambak yang diperoleh dari kota Medan.
b. Kadar residu kloramfenikol pada udang windu dari hasil budidaya tambak
yang diperoleh dari kota Medan tidak memenuhi persyaratan yang telah
ditentukan oleh WHO.
1.4Tujuan Penelitian
a. Untuk mengidentifikasi residu kloramfenikol pada udang windu yang
diperoleh dari tambak yang diperiksa.
b. Untuk mengetahui kesesuaian kadar residu kloramfenikol dalam udang
windu dengan persyaratan yang ditetapkan oleh WHO (World of Health
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi pada
masyarakat mengenai ada tidaknya kloramfenikol pada udang windu dari hasil
budidaya tambak di Kota Medan dan bahaya penggunaan kloramfenikol pada
udang serta agar masyarakat dapat lebih waspada dalam mengkonsumsi udang
BAB II
TINJAUAN PUSTAKA
2.1 Udang Windu
Udang windu (Penaeus monodon, Fabricius.) merupakan udang komoditas
asli daerah tropis yang telah berkembang sejak awal 1980-an, menjadi primadona
komoditas perikanan di Indonesia dan memiliki nilai tinggi dalam perdagangan
internasional (Rozi, 2008).
Klasifikasi udang windu menurut ilmu taksonomi adalah:
Kingdom : Animalia
Filum : Arthropoda
Kelas : Malacostraca
Ordo : Decapoda
Famili : Penaeidae
Genus : Penaeus
Species : Penaeus monodon (Anonim, 2000)
Dalam dunia perdagangan, udang windu dikenal dengan sebutan udang
pancet, jumbo tiger prawn, giant tiger prawn, black tiger prawn atau black tiger
shrimp (Anonim, 2000; Suyanto, 2001; Rozi, 2008).
Adapun ciri-ciri udang windu adalah udang berwarna cerah
kekuning-kuningan dengan sabuk-sabuk melintang di badan. Pada badannya terdapat
titik-titik hijau. Kulitnya keras, cucuk kepala (rostrum) tumbuh kuat sekali, ujungnya
lengkung ke atas berbentuk S. Gigi bagian atas 7 buah, sedangkan bagian bawah 3
mencapai 34 cm dan berat 270 gram (Suyanto, 2001). Oleh karena ukurannya
yang relatif besar dan memiliki nilai ekonomis yang tinggi maka udang windu
banyak dibudidayakan.
2.1.1 Budidaya Udang Windu
Budidaya udang di tambak (budidaya air payau) adalah kegiatan usaha
pemeliharaan atau pembesaran udang menggunakan campuran antara air laut dan
air kolam mulai dari ukuran benih (benur) sampai menjadi ukuran yang layak
dikonsumsi (Suyanto, 2001).
Kegiatan budidaya udang windu dapat dilakukan dengan pola tradisional,
semiintensif maupun intensif. Hambatan dalam pertumbuhan usaha budidaya
udang windu adalah adanya serangan bakteri, virus, jamur maupun protozoa.
Serangan bakteri merupakan salah satu serangan yang dapat menurunkan
produktivitas suatu tambak udang windu. Jenis bakteri yang paling banyak
ditemukan terkait dengan penyakit bakterial adalah Vibrio sp.
2.1.2 Penyakit Vibriosis Udang Windu
Genus Vibrio merupakan agen penyebab penyakit vibriosis yang
menyerang hewan laut seperti ikan, udang, dan kerang-kerangan.
Spesies Vibrio yang berpendar umumnya menyerang larva udang dan
penyakitnya disebut penyakit udang berpendar. Ciri-ciri udang yang terserang
vibriosis antara lain kondisi tubuh lemah, berenang lambat, nafsu makan hilang,
badan mempunyai bercak merah-merah (red discoloration) pada pleopod dan
abdominal serta pada malam hari terlihat menyala (Rozi, 2008).
Selain itu, penyakit bakterial yang sering terjadi adalah insang hitam dan
mampu mendegradasi kitin (chitinoclastic bacteria) yaitu Bacillus sp (Murdjani,
2007).
A. Udang tampak normal B. Udang berpendar pada cahaya gelap
Gambar 2. Bioluminescens Udang Windu Vibriosis (Breed et al., 1948)
Berbagai usaha telah dilakukan untuk mendapatkan suatu metode
pencegahan dan penanggulangan penyakit udang windu, antara lain penggunaan
obat-obatan dan antibiotik yang terdapat pada pakan, pembilasan kolam maupun
sebagai desinfektan sebelum udang di proses lebih lanjut (Islamulhayati, 2005,
Nugraheny, 2001). Salah satu antibiotika yang digunakan adalah kloramfenikol.
2.2 Kloramfenikol 2.2.1 Sifat Fisiko Kimia
Pemerian : Hablur halus berbentuk jarum atau lempeng memanjang; putih
hingga putih kelabu atau putih kekuningan; larutan praktis netral terhadap lakmus
P; stabil dalam larutan netral atau larutan agak asam.
Kelarutan : Sukar larut dalam air, mudah larut dalam etanol, dalam propilen
Struktur Kimia:
2.2.2 Mekanisme Kerja
Kloramfenikol dengan sinonim dichloroasetamide, amphicol, anacetin,
fenicol, cloramicol, cloromycetin atau kemicetine merupakan antibiotik
berspektrum luas yang berasal dari beberapa jenis Streptomyces, misalnya S.
venezuelae, S. phaeochromogenes, S. omiyamensis. Setelah para ahli berhasil
mengelusidasi strukturnya, maka sejak tahun 1950 kloramfenikol sudah dapat
disintesis secara total (Winholdz, 1983; Wattimena, dkk., 1991).
Kloramfenikol bekerja dengan menghambat sintesis protein bakteri dan juga
sel eukariosit. Obat ini mengikat secara reversibel unit ribosom 50 S. Ini akan
mencegah ikatan antar asam amino. Kloramfenikol akan bertindak sebagai analog
dipeptida dan sebagai antagonis substrat peptidil bagi enzim. Pembentukan ikatan
peptida akan dihambat selama obat tetap terikat pada ribosom. Kloramfenikol
juga dapat menghambat sintesis protein mitokondria sel mamalia, hal ini
dikarenakan ribosom mitokondria mirip dengan ribosom bakteri (Wattimena,
1991).
Kebanyakan bakteri gram positif dihambat oleh kloramfenikol pada konsentrasi
2.2.3 Efek Samping Penggunaan Kloramfenikol pada Budidaya Udang Windu
Penggunaan kloramfenikol sebagai antibiotik dalam budidaya udang windu
sangat merugikan konsumen karena begitu membahayakan bagi kesehatan.
Metabolit kloramfenikol yaitu nitrosokloramfenikol yang terbentuk dari hasil
reduksi kloramfenikol di hati merupakan metabolit yang dianggap sebagai
penginduksi terjadinya depresi sum-sum tulang (myelodepresi) yang tampak
dalam dua bentuk anemia, yaitu:
- penghambatan pembentukan sel-sel darah (eritrosit, trombosit, dan
granulosit) yang bersifat reversibel.
- anemia aplastik yang bersifat irreversibel (WHO, 1999; Tjay,
2002).
Selain itu, pada bayi prematur dan bayi baru lahir, pada dosis berlebih
timbul keadaan yang disebut “Gray sindrom” yang ditandai dengan muntah,
sianosis yang pucat, perut bengkak dan kolaps peredaran darah perifer dan
sebagian berakhir dengan kematian. Penyebab komplikasi yang parah ini adalah
kurangnya aktivitas glukuronil transferase bayi tersebut, artinya kloramfenikol
yang berikatan dengan asam glukoronat tidak cukup banyak. Ginjal bayi hanya
mampu mengekskresi kloramfenikol dalam bentuk tak diubah dalam jangka
waktu yang lambat. Atas dasar inilah dosis harian bayi yang baru lahir tidak boleh
melampaui 25 mg/kg (Mutschler, 1999; Tjay, 2002).
Penggunaan kloramfenikol sebagai bahan tambahan pangan sangat dilarang
oleh pemerintah Indonesia juga disebabkan oleh karena konsumen dapat menjadi
kloramfenikol dapat dilakukan dengan menggunakan metode kromatografi cair
kinerja tinggi (KCKT).
2.3 Kromatografi Cair Kinerja Tinggi 2.3.1 Kromatografi
Kromatografi adalah proses pemisahan campuran sampel yang terdistribusi
diantara dua fase di dalam kolom kromatografi. Salah satu fasenya adalah fase
diam (stationary phase) dalam bentuk padat, berpori, bahan yang aktif pada
permukaan (surface-active material), film tipis dari cairan yang dibungkus oleh
suatu padatan atau dinding kolom. Fase yang lain adalah fase gerak (mobile
phase) yang berupa gas atau cairan (Meyer, 2010).
2.3.2 Pembagian Kromatografi
Kromatografi dapat dibedakan atas berbagai macam, tergantung pada
pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi
dibedakan menjadi : (a) kromatografi adsorbsi, (b) kromatografi partisi, (c)
kromatografi pasangan ion, (d) kromatografi penukar ion, (e) kromatografi ekslusi
ukuran, (f) kromatografi afinitas. Berdasarkan alat yang digunakan, kromatografi
dapat dibagi atas : (a) kromatografi kertas, (b) kromatografi lapis tipis, (c)
kromatografi cair kinerja tinggi dan (d) kromatografi gas (Rohman, 2007).
2.3.3 Kromatografi Cair Kinerja Tinggi
Kromatografi Cair Kinerja Tinggi atau KCKT atau biasa juga disebut
dengan HPLC (High Performance Liquid Chromatography) dikembangkan pada
akhir tahun 1960-an dan awal tahun 1970-an.
Kegunaan umum KCKT adalah untuk pemisahan sejumlah senyawa
(impurities); analisis senyawa-senyawa tidak mudah menguap (non-volatil);
penentuan molekul-molekul netral, ionic, maupun zwitter ion; isolasi dan
pemurnian senyawa; pemisahan senyawa-senyawa yang strukturnya hampir sama;
pemisahan senyawa-senyawa dalam jumlah sekelumit, dalam jumlah banyak, dan
dalam skala proses industri. KCKT merupakan metode yang tidak destruktif dan
dapat digunakan baik untuk analisis kualitatif maupun kuantitatif.
KCKT paling sering digunakan untuk menetapkan kadar senyawa-senyawa
tertentu seperti asam-asam amino, asam-asam nukleat, dan protein-protein dalam
cairan fisiologis; menentukan kadar senyawa-senyawa aktif obat, produk hasil
samping proses sintetis, atau produk-produk degradasi dalam sediaan farmasi;
memonitor sampel-sampel yang berasal dari lingkungan, memurnikan senyawa
dalam suatu campuran; kontrol kualitas; dan mengikuti jalannya reaksi sintesis
(Rohman, 2007).
2.3.3.1 Jenis-Jenis KCKT
Pemisahan dapat dilakukan dengan fase normal atau fase terbalik
tergantung pada polaritas relatif fase diam dan fase gerak. Berdasarkan pada
kedua pemisahan ini, sering kali KCKT dikelompokkan menjadi KCKT fase
normal dan KCKT fase terbalik. Meskipun demikian, klasifikasi berdasarkan pada
sifat fase diam dan atau berdasarkan mekanisme sorpsi solute memberikan suatu
jenis KCKT yang lebih spesifik, yaitu:
a. Kromatografi adsorbsi
Pemisahan kromatografi adsorbsi biasanya menggunakan fase normal
dengan menggunakan fase diam silika gel dan alumina. Pada silika dan alumina
non polar, seperti dietil eter, benzen, hidrokarbon lurus seperti pentana, heksana,
heptana maupun iso-oktana. Halida alifatis seperti diklorometana, dikloroetana,
butilklorida dan kloroform juga digunakan.
Jenis KCKT ini kurang luas penggunaannya, meskipun demikian jenis
KCKT ini sesuai untuk pemisahan-pemisahan campuran isomer struktur dan
untuk pemisahan solut dengan gugus fungsional yang berbeda.
b. Kromatografi partisi
Kromatografi ini sering disebut juga dengan kromatografi fase terikat.
Kebanyakan fase diam kromatografi ini adalah silica yang dimodifikasi secara
kimiawi. Sejauh ini digunakan untuk memodifikasi silika adalah
hidrokarbon-hidrokarbon nonpolar seperti dengan oktadesilsilana, oktasilana atau dengan fenil.
Fase diam yang paling popular adalah oktadesilsilana (ODS atau C18
c. Kromatografi penukar ion
) dan
kebanyakan pemisahannya adalah fase terbalik.
KCKT penukar ion menggunakan fase diam yang dapat menukar kation
atau anion dengan suatu fase gerak. Penukar ion yang paling luas digunakan
adalah polistiren resin
d. Kromatografi eksklusi ukuran
Kromatografi ini disebut juga dengan kromatografi permiasi gel dan
dapat digunakan untuk memisahka atau menganalisis senyawa dengan berat
molekul > 2000 dalton. Fase diam yang digunakan dapat berupa silica atau
polimer yang bersifat porus sehingga solut dapat melewati porus (Rohman, 2007).
2.3.3.2 Instrumen KCKT
wadah fase gerak (reservoir), pompa (pump), tempat injeksi sampel (injector),
kolom (column), detector (detector) dan perekam (recorder).
2.3.3.2.1 Wadah Fase Gerak
Wadah fase gerak harus bersih, inert dan biasanya dapat menampung fase
gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus
dilakukan degassing (penghilangan gas) pada fase gerak, sebab adanya gas akan
berkumpul dengan komponen lain terutama pompa dan detektor sehingga akan
mengacaukan analisis (Rohman, 2007).
2.3.3.2.2 Pompa
Pompa yang dgunakan sebaiknya mampu memberikan tekanan sampai 5000
psi. Ada dua jenis pompa yang digunakan yaitu pompa dengan tekanan konstan
dan pompa dengan aliran fase gerak yang konstan. Sejauh ini tipe pompa dengan
aliran fase gerak yang konstan yang umum digunakan.
2.3.3.2.3 Injektor
Ada 3 jenis macam tempat injeksi sampel (injektor), yakni syringe injector,
sampling valve dan automatic injector. Syringe injector merupakan bentuk
injektor yang paling sederhana, terdapat dalam dua jenis antara lain stopflow
injection dan septumless-syringe injector .
Pada injector tipe sampling valve atau disebut juga manual injector,
sewaktu pengisian sampel (Load) sampel akan dipompa melewati sample loop
(keluk sampel) dan kelebihannya akan dikeluarkan ke pembuang. Pada saat
penyuntikan atau inject, katup diputar sehingga fase gerak mengalir melewati
Automatic injector atau disebut juga autosampler memiliki prinsip yang
mirip, hanya saja sistem penyuntikannya bekerja secara otomatis, terbagi menjadi
3 tipe prinsip penyuntikan, yakni pullloop injection, push-loop injection dan
integral-loop injection (Meyer, 2004). 2.3.3.2.4 Kolom
Kolom umumnya terbuat dari 316-grade stainless steel yang relatif tahan
karat. Ukuran kolom untuk tujuan analitik berkisar antara panjang 10 hingga 25
cm dan diameter dalam 3 hingga 9 mm. Sedangkan untuk tujuan preparatif
digunakan kolom dengan diameter 10 mm hingga 1 inchi (25,4 mm) (Meyer,
2004).
2.3.3.2.5 Detektor
Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu detektor
universal (yang mampu mendeteksi zat secara umum)seperti detektor indeks bias
dan detektor spektrometri massa selanjutnya adalah detektor yang spesifik yang
hanya mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis,
detektor fluoresensi dan elektrokimia (Rohman, 2007).
2.3.3.2.6 Perekam
Alat pengumpul data seperti komputer, integrator, rekorder dihubungkan
dengan detektor. Alat ini akan mengukur sinyal elektronik yang dihasilkan oleh
detektor lalu mem-plotkannya sebagai suatu kromatogram yang selanjutnya dapat
dievaluasi oleh seorang analis (Rohman, 2007).
2.3.3.3 Parameter dalam KCKT
Terdapat beberapa parameter yang penting untuk diketahui, parameter tersebut
2.3.3.3. 1 Tinggi dan Luas Puncak
Tinggi dan luas puncak berkaitan secara proporsional dengan kadar atau
jumlah analit yang terdapat dalam sampel. Namun, luas puncak lebih umum
digunakan dalam perhitungan kuantitatif karena lebih akurat atau cermat bila
dibandingkan dengan perhitungan menggunakan tinggi puncak karena luas
puncak relatif tidak banyak dipengaruhi oleh kondisi kromatografi, kecuali laju
alir (Ornaf dan Dong, 2005).. Sementara itu, tinggi puncak dipengaruhi oleh
banyak faktor seperti misalnya faktor tambat, suhu kolom serta cara injeksi
sampel (Miller, 2005).
2.3.1.2 Waktu Tambat
Waktu tambat atau retention time (tR) adalah periode waktu antara
penyuntikan sampel dan puncak maksimum yang terekam oleh detektor. Waktu
tambat merupakan fungsi dari laju alir fase gerak dan panjang kolom. Jika fase
gerak mengalir lebih lambat atau kolom semakin panjang, waktu tambat akan
semakin besar, demikian sebaliknya bila fase gerak mengalir lebih cepat atau
kolom semakin pendek, maka waktu tambat akan semakin kecil (Meyer, 2004).
2.3.1.3 Faktor Kapasitas
Faktor kapasitas (k’) atau faktor tambat merupakan suatu ukuran derajat tambahan
dari analit yang lebih independen. Faktor kapasitas dihitung dengan membagi
waktu tambat bersih (t’R) dengan waktu hampa (t0), seperti yang terlihat pada
rumus berikut:
Faktor tambat yang disukai berada di antara nilai 1 hingga 10. Jika nilai k terlalu
terjadi interaksi dengan fase diam dan oleh karena itu tidak akan muncul dalam
kromatogram. Sebaliknya, nilai k yang terlalu besar mengindikasikan waktu
analisis akan panjang. Nilai k’ dari analit yang lebih besar dari 20 kurang begitu
baik karena waktu analisis yang terlalu panjang dan sensitifitas yang buruk
sebagai akibat dari pelebaran puncak yang berlebihan (Ornaf dan Dong, 2005;
Meyer, 2004).
2.3.1.4 Selektivitas
Kemampuan sistem kromatografi dalam memisahkan/membedakan analit
yang berbeda dikenal sebagai selektivitas (α). Selektivitas umumnya tergantung
pada sifat analit itu sendiri, interaksinya dengan permukaan fase diam serta jenis
fase gerak yang digunakan (Kazakevich, 2007). Nilai selektifitas yang didapatkan
dalam sistem KCKT harus lebih besar dari 1 (Ornaf dan Dong, 2005). Selektivitas
ditentukan dengan rumus sebagai berikut:
2.3.1.5 Efisiensi Kolom
Ukuran kuantitatif dari efisiensi kolom disebut sebgai nilai lempeng/plate
number (N). Kolom yang efisien adalah kolom yang mampu menghasilkan
puncak sempit dan memisahkan analit dengan baik. Nilai lempeng akan semakin
tinggi jika ukuran kolom semakin panjang, hal ini berarti proses pemisahan yang
etrjadi semakin baik (Rohman, 2007).
Suatu ukuran alternatif (yang tergantung dari panjang kolom kromatografi)
adalah tinggi lempeng (H) atau juga biasa disebut dengan tinggi setara pelat teori
HETP merupakan panjang kolom kromatografi (dalam mm) yang
diperlukan sampai terjadinya satu kali kesetimbangan molekul solut dalam fase
gerak dan fase diam.
HETP berbanding terbalik dengan N. Maka kolom yang memberikan
jumlah lempeng (N) yang besar dan nilai HETP yang kecil akan mampu
memisahkan komponen-komponen dalam suatu campuran yang lebih baik yang
berarti efisiensi kolom adalah besar (Rohman, 2007).
2.3.1.7 Resolusi
Resolusi merupakan derajat pemisahan dari dua puncak analit yang
bersebelahan (Ornaf dan Dong, 2005). Resolusi dinyatakan sebagai rasio jarak
antara dua puncak analit, dengan rumus sebagai berikut:
Harga resolusi yang semakin besar memiliki arti proses pemisahan semakin bagus
dan sebaliknya resolusi yang kecil merupakan pertanda proses pemisahan buruk
(Snyder dan Kirkland, 1979). Dua puncak yang tidak terpisah dengan sempurna
namun sudah dapat terlihat, memiliki resolusi 1. Sedangkan bila kedua puncak
yang saling berdekatan terpisah sempurna tepat pada garis alas, resolusi bernilai
1,5. Oleh karena itu, pada analisis kuantitatif, resolusi yang ditunjukkan harus
lebih besar dari 1,5. Sementara bila kedua puncak yang berdekatan memiliki
perbedaan ukuran yang signifikan, maka diperlukan nilai resolusi yang lebih besar
(Meyer, 2004).
2.4 Validasi Metode
tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa
parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Berikut delapan karakterisitik utama yang digunakan dalam validasi
metode analitik menurut USP:
Karakteristik Pengertian
Akurasi Kedekatan antara nilai hasil uji yang diperoleh lewat metode
analitik dengan nilai sebenarnya.
Presisi Ukuran keterulangan metode analitik, termasuk di antaranya
kemampuan instrumen dalam memberikan hasil analitik yang reprodusibel.
Spesifisitas Kemampuan untuk mengukur analit yang dituju secara tepat
dan spesifik dengan adanya komponen lain dalam matriks sampel seperti ketidakmurnian, produk degradatif dan komponen matriks.
Batas deteksi Konsentrasi analit terendah dalam sampel yang masih dapat
dideteksi, meskipun tidak selalu dapat dikuantifikasi. Batas
kuantitasi
Konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
Linieritas
Rentang
Kemampuan suatu metode untuk memperoleh hasil uji yang secara langsung proposional dengan konsentrasi analit pada kisaran yang diberikan.
Konsentrasi terendah dan tertinggi yang mana suatu metode analitik menunjukkan akurasi, presisi dan linieritas yang cukup.
Kekasaran Tingkat reprodusibilitas hasil yang diperoleh dibawah berbagai
kondisi yang diekspresikan sebagai % RSD.
Ketahanan Kapasitas metode untuk tidak terpengaruh oleh adanya variasi
parameter yang kecil. (Rohman, 2007).
USP membagi metode-metode analisis ke dalam beberapa kategori, yakni:
1. Penentuan kuantitatif komponen-komponen utama atau bahan aktif
2. Penentuan pengotor (impurities) atau produk-produk hasil degradasi
3. Penentuan karakteristik-karakteristik kinerja
USP dan ICH memperkenalkan bahwa tidak selamanya seluruh parameter untuk
mengevaluasi metode diuji. Adapun elemen-elemen data yang dibutuhkan untuk
uji validasi berdasrkan kategori metode analisisnya adalah:
Parameter Kinerja Analisis
Pengujian Kategori 1
Pengujian Kategori 2 Uji kategori 3
Kuantitatif Uji
Batas
Akurasi Ya Ya * *
Presisi Ya Ya Tidak Ya
Spesifitas Ya Ya Ya *
LOD Tidak Tidak Ya *
LOQ Tidak Ya Tidak *
Linieritas Ya Ya Tidak *
Kisaran (range) Ya Ya * *
Ruggedness Ya Ya Ya Ya
* mungkin dibutuhkan, tergantung pada uji spesifiknya
2.4.1 Akurasi
Akurasi/kecermatan dapat ditentukan dengan dua metode, yakni spiked
placebo recovery dan standard addition method. Pada spiked placebo recovery
atau metode simulasi, analit murni ditambahkan (spiked) ke dalam campuran
bahan pembawa sediaan farmasi, lalu campuran tersebut dianalisis dan jumlah
analit hasil analisis dibandingkan dengan jumlah analit teoritis yang diharapkan.
Jika plasebo tidak memungkinkan untuk disiapkan, maka sejumlah analit
yang telah diketahui konsentrasinya dapat ditambahkan langsung ke dalam
sediaan farmasi otentik. Metode ini dinamakan metode standard addition method
atau metode penambahan baku.
Jumlah keseluruhan analit kemudian diukur dan dibandingkan dengan
jumlah teoritis, yaitu jumlah analit yang murni berasal dari sediaan farmasi otentik
tersebut, ditambah dengan jumlah analit yg di-spiked ke dalam sediaan. Akurasi
kemudian dinyatakan dalam persen perolehan kembali (%Recovery) (Harmita,
2.4.2 Presisi
Presisi diekspresikan dengan standar deviasi atau standar deviasi relatif
(RSD) dari serangkaian data. Data untuk menguji presisi seringkali dikumpulkan
sebagai bagian dari kajian-kajian lain yang berkaitan dengan presisi seperti
linearitas atau akurasi. Biasnya replikasi 6-15 dilakukan pada sampel tunggal
untuk tiap-tiap konsentrasi. Pada pengujian dengan KCKT, nilai RSD antara 1-2%
biasanya dipersyaratkan untuk senyawa-senyawa aktif dalam jumlah yang banyak
sedangkan untuk senyawa-senyawa dengan kadar sekelumit RSD berkisar antara
5-15% (Rohman, 2007).
2.4.3 Spesifitas
Penentuan spesifitas metode dapat diperoleh dengan dua jalan. Cara
pertama adalah dengan melakukan optimasi sehingga diperoleh senyawa yang
dituju terpisah secara sempurna dari senyawa-senyawa lain (resolusi senyawa
yang dituju ≥ 2). Cara kedua untuk memperoleh spesifitas adalah dengan
menggunakan detektor selektif terutama untuk senyawa-senyawa yang terelusi
secara bersama-sama sebagai contoh detektor elektrokimia hanya akan
mendeteksi senyawa tertentu, sementara senyawa yang lainnya tidak terdeteksi.
Penggunaan detektor UV pada panjang gelombang yang spesifik juga merupakan
cara yang efektif untuk melakukan pengukuran selektifitas (Rohman, 2007).
2.4.4 Batas Deteksi dan Batas Kuantitasi
Batas deteksi dan batas kuantitasi dapat ditentukan dengan 2 metode yakni
metode non instrumental visual dan metode perhitungan. Metode non instrumental
visual digunakan pada teknik kromatografi lapis tipis dan metode titrimetri.
kemiringan/slope (b) dengan rumus perhitungan batas deteksi dan batas kuantitasi
sbb:
Simpangan baku respon dapat ditentukan berdasarkan simpangan baku blanko,
simpangan baku residual dari garis regresi atau simpangan baku intersep y pada
garis regresi (Rohman, 2007).
2.4.5 Linearitas
Lineritas merupakan kemampuan suatu metode untuk memperoleh
hasil-hasil uji yang secara langsung proporsional dengan konsentrasi analit pada kisaran
yang diberikan. Linearitas suatu metode merupakan ukuran seberapa baik kurva
kalibrasi yang menghubungkan antara respon (y) dengan konsentrasi (x).
Linearitas dapat diukur dengan melakukan pengukuran tunggal pada konsentrasi
yang berbeda-beda. Data yang diperoleh selanjutnya diproses dengan metode
kuadrat terkecil, untuk selanjutnya dapat ditentukan nilai kemiringan (slope),
intersep, dan koefisien korelasinya (Rohman, 2007).
2.3.6 Rentang
Rentang atau kisaran suatu metode didefinisikan sebagai konsentrasi
terendah dan tertinggi yang mana suatu metode analisis menunjukkan akurasi,
presisi, dan linearitas yang mencukupi. Kisaran-kisaran konsentrasi yang diuji
tergantung pada jenis metode dan kegunaannya (Rohman, 2007).
Slope SB x LOQ=10
2.3.7 Kekuatan
Kekuatan/ketahanan dievaluasi dengan melakukan variasi
parameter-parameter metode seperti persentase pelarut organik, pH, kekuatan ionik, suhu,
dan sebagainya. Suatu praktek yang baik untuk mengevaluasi ketahanan suatu
metode adalah dengan memvariasi parameter-parameter penting dalam suatu
metode secara sistematis lalu mengukur pengaruhnya pada pemisahan (Rohman,
BAB III
METODE PENELITIAN
Penelitian ini merupakan penelitian deskriptif yang dilakukan di
Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan,
pada bulan Januari 2011 hingga Maret 2011.
3.1 Alat-alat
Alat yang digunakan dalam penelitian ini meliputi seperangkat instrumen
KCKT lengkap (Hitachi) dengan pompa (L-2130), injektor autosampler L-2200,
kolom Luna Phenomenex 5µm C18 (250 mm x 4,60 mm), detektor UV-Vis
L-2420, degasser (DGU 20 AS), wadah fase gerak, vial khusus autosampler,
sonifikator (Branson 1510), pompa vakum (Gast DOA - P604 – BN), neraca
analitik (Mettler Toledo), penyaring membran Whatman Cellulose Nitrate 0,45
µm dan PTFE (polytetrafluoroethylene) 0,5 µm, Cellulose Nitrate 0,2 µm,
Spektrofotometer UV-Vis (Shimadzu UV 1800), blender, vortex
(Boeco-Germany), sentrifus (Hitachi CF16RXII), alat-alat gelas, spatula dan bola karet.
3.2 Bahan-bahan
Bahan yang digunakan jika tidak dinyatakan lain merupakan kualitas p.a.
(pro analysis) keluaran E.Merck antara lain metanol HPLC Grade, asetonitril
HPLC Grade, n-heksana, natrium klorida, aquabidest (PT. Ikapharmindo
Putramas), kloramfenikol BPFI dan kloramfenikol baku pabrik (PT Varia Sekata).
3.3 Sampel
Sampel yang diperiksa dalam penelitian ini adalah udang windu dari hasil
Labuhan Kelurahan Sei Mati, Medan Belawan Kelurahan Sicanang dan Medan
Marelan Kelurahan Labuhan Deli.
3.4 Rancangan Penelitian 3.4.1 Penyiapan Bahan 3.4.1.1 Pembuatan Pelarut
Pelarut terdiri dari campuran metanol HPLC grade dan aquabidest dengan
perbandingan 55 : 45 (perbandingan fase gerak hasil optimasi).
3.4.1.2 Pembuatan Fase Gerak
Metanol sebanyak 500 ml dengan menggunakan membran penyaring
PTFE 0,5 µm dan diawaudarakan selama 30 menit.
Aquabidest disaring sebanyak 500 ml dengan menggunakan membran
penyaring Whatman Cellulose Nitrate 0,45 µm dan diawaudarakan selama 30
menit.
3.4.1.3 Pembuatan Larutan Induk Baku Kloramfenikol
Ditimbang seksama sebanyak 50 mg kloramfenikol BPFI, lalu dimasukkan
ke dalam labu tentukur 250 ml. Kemudian dilarutkan dengan 5 ml metanol.
Dicukupkan sampai garis tanda dengan menggunakan pelarut sehingga diperoleh
larutan dengan konsentrasi 200 µg/ml.
3.4.2 Penentuan Panjang Gelombang Maksimum
Dipipet sebanyak 7,5 ml Larutan Induk Baku, dimasukkan ke dalam labu
tentukur 100 ml, dicukupkan sampai garis tanda dengan aquabidest dan dikocok
sampai homogen, sehingga diperoleh larutan dengan konsentrasi 15 µg/ml.
3.4.3 Pembuatan Larutan Sampel (SNI 7541.1:2009)
Bagian kepala udang yang menjadi sampel dibuang kemudian dihaluskan
dan dihomogenkan. Selanjutnya ditimbang secara seksama sebanyak 5 g,
kemudian 10 ml asetonitril p.a. ditambahkan ke dalamnya dan dikocok dengan
vortex mixer selama 30 detik. Sampel disentrifugasi dengan kecepatan 3000 rpm
selama 10 menit. Supernatan dipisahkan dari endapan, ditambahkan kembali 10
ml asetonitril p.a. pada endapan dan diulangi perlakuan. Selanjutnya supernatan
dikumpulkan, ditambahkan 1,5 g natrium klorida dan dikocok dengan vortex
mixer selama 1 menit. Larutan tersebut disentrifugasi dengan kecepatan 3000 rpm
selama 5 menit dan dipisahkan supernatan dari endapan. Selanjutnya 5 ml
n-heksana ditambahkan kepada supernatant, dikocok dengan vortex mixer selama
30 detik dan didiamkan sampai terpisah sempurna hingga terbentuk 2 lapisan,
yaitu lapisan n-heksana dibagian atas dan lapisan asetonitril dibagian bawah.
Selanjutnya lapisan n-heksana dibuang dengan menggunakan pipet secara
hati-hati. Perlakuan penambahan n-heksana diulangi kembali. Kemudian lapisan
asetonitril dikeringkan dengan vacuum rotary evaporator hingga hampir kering.
Selanjutnya ekstrak dilarutkan kembali hingga 5ml dengan pelarut kemudian
disaring dengan Cellulose Nitrate 0,2 µm. Larutan sampel diawaudarakan selama
15 menit dan siap diinjeksikan.
3.4.4 Prosedur Analisis 3.4.4.1 Penyiapan Alat KCKT
Kolom yang digunakan adalah C 18 (4,6 x 250 mm) menggunakan detektor UV.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak
dibiarkan mengalir selama ±30 menit sampai diperoleh garis alas yang datar
pertanda sistem kromatografi telah stabil.
3.4.4.2 Penentuan Perbandingan Fase Gerak dan Laju Alir yang Optimum
Larutan Induk Baku kloramfenikol dipipet 5 ml dan dimasukkan ke dalam
labu tentukur 100 ml, dicukupkan dengan pelarut hingga garis tanda dan dikocok
sampai homogen sehingga diperoleh larutan kloramfenikol dengan konsentrasi 10
µg/ml, disaring dengan Cellulose Nitrate 0,2 µm, diawaudarakan selama 10
menit, kemudian diinjeksikan ke dalam sistem KCKT menggunakan vial
autosampler sebanyak 10 µl, menggunakan variasi fase gerak metanol -
aquabidest, dengan perbandingan (40 : 60), (50 : 50), (55 : 45), (60 : 40), (65 :
35), dan (70 : 30), dengan laju alir 1 ml/menit, dan dideteksi pada panjang
gelombang 278 nm. Kemudian dipilih perbandingan fase gerak dan laju alir yang
memberikan data yang terbaik (Data hasil optimasi dapat dilihat pada Lampiran
1).
3.4.4.3 Analisis Kualitatif
Analisis kualitatif kloramfenikol dalam sampel dapat dilakukan dengan
membandingkan waktu tambat yang sama (identik) dari kromatogram pada
penyuntikan larutan sampel dengan kromatogram pada penyuntikan larutan baku
pembanding kloramfenikol pada kondisi KCKT yang sama. Untuk mempertegas
identifikasi ini, sedikit larutan baku pembanding kloramfenikol ditambahkan
(spiking) ke dalam larutan sampel, lalu dianalisis kembali dengan KCKT. Puncak
dengan waktu tambat yang sama diamati kembali dan dibandingkan antara
Sampel dinyatakan mengandung kloramfenikol jika terjadi peningkatan tinggi dan
luas puncak pada kromatogram hasil spiking dengan waktu tambat yang sama
seperti pada kromatogram penyuntikan larutan baku pembanding (Rohman, 2007)
(Hasil analisis kualitatif dapat dilihat pada Gambar 3).
3.4.4.4 Analisis Kuantitatif
3.4.4.4.1 Pembuatan Kurva Kalibrasi Baku Pembanding Kloramfenikol
Larutan Induk Baku Kloramfenikol dipipet sebanyak 1 ml, dimasukkan ke
dalam labu tentukur 100 ml, dicukupkan dengan pelarut hingga garis tanda,
dikocok hingga homogen sehingga diperoleh larutan kloramfenikol dengan
konsentrasi 2 µ g/ml kemudian dipipet sebanyak 1,5 ml, 3,5 ml, 5 ml, 15 ml, 25
ml, masing-masing dimasukkan ke dalam labu tentukur 100 ml, dan diencerkan
dengan pelarut hingga garis tanda, dikocok sampai homogen sehingga diperoleh
konsentrasi 0,03 µg/ml, 0,07 µg/ml, 0,1 µg/ml, 0,3 µg/ml dan 0,5 µg/ml.
Kemudian masing-masing larutan disaring dengan Cellulose Nitrate 0,2 µm, dan
diinjeksikan ke sistem KCKT menggunakan vial autosampler sebanyak 10 µl dan
dideteksi pada panjang gelombang 278 nm. Selanjutnya dari luas area yang
diperoleh pada kromatogram dibuat kurva kalibrasi dihitung persamaan garis
regresi dan faktor korelasinya (Kromatogram dan data perhitungan dapat dilihat
pada Lampiran 2 dan Lampiran 3).
3.4.4.4.2 Penetapan Kadar Kloramfenikol dalam Sampel
Larutan sampel yang telah disiapkan seperti pada bagian 3.4.3 kemudian
disaring dengan Cellulose Nitrate 0,2 µm, dan diawaudarakan selama 15 menit,
kemudian diinjeksikan sebanyak 10 µl ke sistem KCKT menggunakan vial
fase gerak metanol : aquabidest (55 : 45) dan laju alir 1 ml/menit. Dilakukan
sebanyak 6 kali perlakuan. Kromatogram direkam dan dicatat luas puncak.
Kadar kloramfenikol yang terdapat dalam larutan sampel (X) dihitung
dengan mensubstitusikan luas puncak ke dalam persamaan regresi yang diperoleh
dari kurva kalibrasi pada bagian 3.4.4.4.1 sebagai Y. Hasilnya lalu dikali volume
larutan sampel, kemudian dibagi dengan berat penimbangan sampel udang
sehingga diperoleh kadar kloramfenikol dengan satuan µg/g sampel.
Rumus perhitungan kadar kloramfenikol dalam sampel dituliskan sebagai berikut:
Kadar Kloramfenikol (µ g/g sampel) =
) ( sampel(ml) larutan Volume x µg/ml) ( g sampel n penimbanga berat X
(Contoh Perhitungan untuk mencari kadar dapat dilihat pada Lampiran 11).
3.4.4.4.3 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar kloramfenikol pada bagian 3.4.4.4.2 dianalisis
secara statistik menggunakan uji t.
Rumus yang digunakan untuk menghitung simpangan baku adalah:
SD =
(
)
1 2 − −
∑
n X XSedangkan untuk mendapatkan thitung digunakan rumus:
thitung n SD X X / − =
Data diterima jika –ttabel < thitung < ttabel pada interval kepercayaan 95%
dengan derajat kebebasan dk = n-1 dan nilai α = 0,05.
Keterangan:
SD = standard deviation/simpangan baku
= kadar rerata kloramfenikol
n = jumlah perlakuan
Adapun alasan pemilihan interval kepercayaan 95% adalah dalam
preparasi sampel banyak tahapan yang dilakukan yang memungkinkan lebih
banyak terjadi kesalahan.
Untuk menghitung kadar kloramfenikol dalam sampel secara statistik
digunakan rumus:
Kadar Kloramfenikol (µ) = X ± t(1-1/2α)dk x n SD
Keterangan:
μ = kadar kloramfenikol
t = harga ttabel sesuai dengan derajat kepercayaan
α = tingkat kepercayaaan
dk = derajat kebebasan (Rohman, 2007).
(Data perhitungan penetapan kadar secara statistik dapat dilihat pada Lampiran 5,
7 dan 9).
3.4.5 Validasi Metode 3.4.5.1 Akurasi
Akurasi ditentukan dengan menggunakan metode penambahan baku (the
method of standard additives), yakni ke dalam sampel udang yang telah
dihaluskan ditambahkan kloramfenikol baku sebanyak 50, 100 dan 150% dari
kadar kloramfenikol yang diketahui terdapat dalam sampel, kemudian dianalisis
dengan prosedur yang sama seperti pada sampel. Hasil dinyatakan dalam persen
perolehan kembali (% recovery). Persen perolehan kembali dapat dihitung dengan
% Perolehan Kembali= A
A F
C C C
*
− x 100%
Keterangan :
CF = Konsentrasi sampel setelah penambahan baku yang diperoleh dari
pengukuran
CA = Konsentrasi sampel sebelum penambahan baku yang diperoleh dari
pengukuran
C*A = Konsentrasi analit yang ditambahkan
(Contoh perhitungan persen perolehan kembali dapat dilihat pada Lampiran 14).
(Kromatogram dan data uji perolehan kembali dapat dilihat pada Lampiran 12 dan
Lampiran 13).
3.4.5.2 Presisi
Presisi metode penelitian dinyatakan oleh simpangan baku relatif (Relative
Standard Deviation/RSD) dari serangkaian data. RSD dapat dirumuskan sebagai
berikut (Harmita, 2004):
RSD = X SD
x 100%
Keterangan:
SD = standard deviation/simpangan baku
= kadar rerata kloramfenikol dalam satu sampel
3.4.5.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi (Limit Of Detection/LOD) dan batas kuantitasi (Limit Of
Quantitation/LOQ) dihitung dari persamaan regresi kurva kalibrasi baku
pembanding. Batas deteksi dari batas kuantitasi dapat dihitung dengan
SB =
(
)
22
− −
∑
n Yi Y
LOD = Slope
SB x
3
LOQ = Slope
SB x
10
Keterangan :
SB = simpangan baku respon analitik dari blangko
S = slope atau derajat kemiringan
(Data perhitungan penetapan batas deteksi dan batas kuantitasi dapat dilihat pada
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum
Pemeriksaan residu kloramfenikol dalam udang windu dari hasil budidaya
tambak dilakukan dengan menggunakan KCKT fase terbalik . Oleh karena itu,
agar menghasilkan analisis yang baik maka terlebih dahulu ditentukan kondisi
optimum KCKT meliputi panjang gelombang yang digunakan untuk analisis dan
optimasi fase gerak yang digunakan.
Panjang gelombang analisis ditentukan dengan membuat kurva serapan dari
kloramfenikol BPFI menggunakan spektrofotometer UV. Spektrum hasil
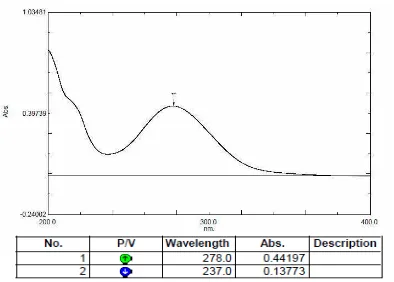
pengukuran kloramfenikol baku dapat dilihat pada Gambar 1.
[image:49.595.113.507.407.689.2]
Berdasarkan kurva serapan ini, dapat disimpulkan bahwa kloramfenikol
memberikan serapan maksimum pada panjang gelombang 278 nm. Hasil yang
diperoleh berbeda dengan panjang gelombang yang digunakan dalam prosedur
SNI 7541.1:2009 yang menjadi pedoman dalam penelitian ini. Dimana menurut
SNI 7541.1:2009, panjang gelombang kloramfenikol yang digunakan adalah 270
nm. Namun menurut Ditjen POM (1995) dan Moffat et al (2005) kloramfenikol
memberikan serapan maksimum pada panjang gelombang 278 nm. Berdasarkan
hal tersebut maka analisis kloramfenikol dalam penelitian ini dilakukan pada
panjang gelombang 278 nm.
Dalam penelitian ini, digunakan metanol dan aquabidest sebagai fase gerak.
Menurut prosedur SNI 7541.1:2009 fase gerak yang digunakan metanol :
aquabidest (50 : 50) dengan laju alir 1 ml/menit. Setelah dilakukan orientasi,
diperoleh hasil yang kurang begitu baik, dimana waktu tambat yang dihasilkan
terlalu lama dan jumlah lempeng yang kurang begitu besar. Oleh karena itu,
dilakukan optimasi fase gerak dengan memvariasikan komposisi metanol dan
aquabidest. Data analisis KCKT dengan berbagai perbandingan komposisi fase
gerak pada laju alir 1 ml/menit dapat dilihat pada Tabel 1.
Tabel 1 menunjukkan bahwa semakin besar konsentrasi metanol dalam
fase gerak, maka waktu tambat kloramfenikol semakin singkat. Hal ini disebabkan
oleh kekuatan pelarut dimana pada fase terbalik konsentrasi metanol yang lebih
besar akan mengakibatkan fase gerak semakin kuat sehingga proses elusi terjadi
lebih cepat (Snyder dan Kirkland, 1979). Jumlah lempeng merupakan salah satu
parameter yang digunakan untuk menilai kualitas pemisahan kromatografi yakni
Tabel 1. Data Hasil Analisis Kloramfenikol Baku 10 µ g/ml pada Berbagai
Perbandingan Komposisi Fase Gerak
Perbandingan Fase Gerak Waktu tambat
(menit)
Luas Puncak
Jumlah Lempeng Teoritis
Metanol Akuabidest
40 60 14,49 152806 3685
50 50 7,71 132466 2840
55 45 5,95 166900 4050
60 40 4,83 177214 3705
65 35 4,11 175588 3355
70 30 3,61 168701 2889
Oleh karena itu, semakin besar jumlah lempeng yang dihasilkan akan
menunjukkan bahwa kolom mampu memisahkan komponen dalam campuran
dengan baik berarti efisiensi kolom besar (Rohman, 2007).
Berdasarkan hal tersebut maka perbandingan komposisi fase gerak yang
digunakan dalam penelitian ini adalah metanol : aquabidest (55 : 45) dengan laju
alir 1ml/menit. Kromatogram hasil penyuntikan kloramfenikol baku dengan
perbandingan fase gerak metanol : aquabidest (55:45) dapat dilihat pada Gambar
2.
Gambar 2. Kromatogram Hasil Penyuntikan kloramfenikol baku 10 µg/ml
dengan perbandingan fase gerak metanol : aquabidest (55:45) dengan laju alir 1 ml/menit
[image:51.595.112.518.125.254.2] [image:51.595.107.465.462.704.2]4.2 Penyiapan Larutan Sampel
Setelah diperoleh kondisi KCKT yang optimal maka dilakukan penanganan
terhadap sampel yaitu udang windu yang diambil dari berbagai tambak. Adapun
udang windu yang dimaksud seperti yang terlihat pada lampiran 22.
Prosedur yang digunakan diambil dari SNI 7541.1:2009, yakni dimulai
dari sampel udang dikupas bagian kepala selanjutnya dicuci bersih. Kemudian
sampel dihaluskan dengan menggunakan blender dan dihomogenkan. Selanjutnya
sampel tersebut ditimbang secara seksama sebanyak 5 g, kemudian 10 ml
asetonitril p.a. ditambahkan ke dalamnya dan dikocok dengan vortex mixer selama
30 detik. Penambahan asetonitril sebagai pelarut polar untuk mengekstraksi
kloramfenikol dari udang. Selanjutnya larutan tersebut disentrifugasi dengan
kecepatan 3000 rpm selama 10 menit. Supernatan dipisahkan dari endapan dan
pada endapan ditambahkan kembali 10 ml asetonitril p.a. dan diulangi perlakuan.
Selanjutnya supernatan dikumpulkan dan ditambahkan 1,5 g natrium klorida,
dimana NaCl digunakan untuk mengendapkan protein karena kelarutannya lebih
besar dibandingkan protein. Peristiwa ini disebut dengan salting out (The
American Heritage, 2002). Kemudian larutan tersebut dikocok dengan vortex
mixer selama 1 menit, disentrifugasi dengan kecepatan 3000 rpm selama 5 menit
dan dipisahkan supernatan dari endapan. Kemudian 5 ml n-heksana ditambahkan
dan dikocok dengan vortex mixer selama 30 detik, didiamkan sampai terpisah
sempurna hingga terbentuk 2 lapisan, yaitu lapisan n-heksana dibagian atas dan
lapisan asetonitril dibagian bawah. Dimana berat jenis n-heksana adalah 0,660
g/cm3 sementara berat jenis asetonitril adalah 0,7874 g/cm3 (Windholz, 1983).
hati-hati. Perlakuan penambahan n-heksana diulangi kembali. Penambahan n-heksana
sebagai pelarut nonpolar ditujukan untuk mengekstraksi lemak yang terikut pada
proses ekstraksi sampel karena lemak larut dalam pelarut nonpolar. Kemudian
lapisan asetonitril dikeringkan dengan vacuum rotary evaporator hingga hampir
kering. Selanjutnya ekstrak dilarutkan kembali hingga 5 ml dengan pelarut.
4.3 Analisis Kualitatif
Larutan sampel yang telah diperoleh diatas kemudian diidentifikasi.
Identifikasi dilakukan dengan membandingkan waktu tambat dari sampel terhadap
waktu tambat kloramfenikol BPFI dan dari hasil uji kualitatif tersebut
menunjukkan bahwa terdapat kloramfenikol dalam sampel udang windu. Dari
hasil penyuntikan sampel udang windu diperoleh waktu tambat salah satu puncak
yaitu 5,91 menit. Waktu tambat ini berdekatan dengan waktu tambat
kloramfenikol BPFI yang dianalisis pada kondisi KCKT yang sama yaitu 5,95
menit. Meskipun waktu tambat yang dihasilkan tidak sama persis namun waktu
tambat 5,91 menit masih berada di dalam rentang waktu tambat yang dapat
diterima yaitu ± 5% dari waktu tambat 5,95 menit (Weston and Brown, 1997).
Kedua kromatogram ini dapat dilihat pada Gambar 3A dan 3B.
Untuk mempertegas identifikasi, maka ditambahkan sedikit larutan
kloramfenikol BPFI ke dalam larutan sampel (spiking method), kemudian
dianalisis kembali pada kondisi KCKT yang sama. Hasil analisis menunjukkan
terjadi peningkatan luas dan tinggi puncak kloramfenikol dari yang diamati
sebelumnya. Jadi dapat disimpulkan bahwa puncak yang diamati dalam larutan
sampel adalah benar merupakan puncak kloramfenikol. Kromatogram larutan
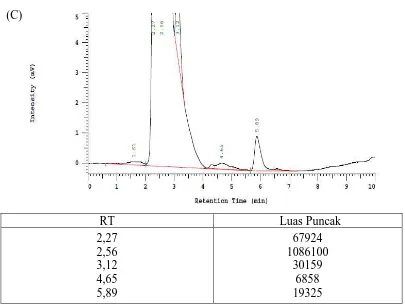
(A)
(B)
RT Luas Puncak
5,95 166900
RT Luas Puncak
1,40 2,27 2,55 3,11 5,91 6,65 7,17
28310 79903 1745200
(C)
Gambar 3. Kromatogram hasil penyuntikan kloramfenikol baku 10 µg/ml (A),
larutan sampel udang windu (B), dan larutan sampel yang telah
di-spike dengan larutan baku pembanding kloramfenikol (C) dengan
kondisi KCKT yang sama.
4.4 Analisis Kuantitatif
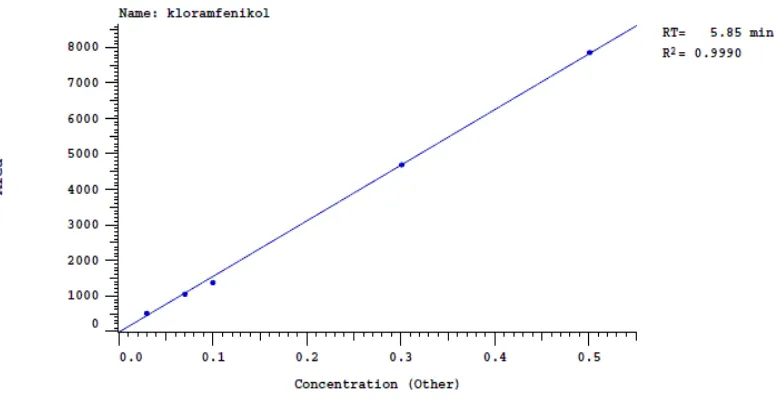
Analisis secara kuantitatif ditentukan dari kurva kalibrasi kloramfenikol
BPFI berdasarkan luas puncak. Kurva kalibrasi kloramfenikol baku dibuat dengan
konsentrasi yang meningkat dimulai dari konsentrasi 0 µg/ml, 0,03 µg/ml, 0,07
[image:55.595.107.512.77.384.2]µg/ml, 0,1 µg/ml, 0,3 µg/ml, dan 0,5 µ g/ml. Kurva kalibrasi dapat dilihat pada
Gambar 4.
Dari kurva kalibrasi diperoleh hubungan yang linier antara luas area dan
konsentrasi dengan koefisien korelasi r = 0,9997. Koefisien korelasi yang
diperoleh ini memenuhi persyaratan yaitu nilai koefisien korelasi lebih besar dari
RT Luas Puncak
2,27 2,56 3,12 4,65 5,89
67924 1086100
0,999 (Kromidas, S., 2005). Dari hasil perhitungan, diperoleh persamaan regresi
5765 , 44 4589
,
15754 −
= X
[image:56.595.119.508.148.349.2]Y .
Gambar 4. Kurva Kalibrasi Kloramfenikol BPFI
Hasil pengolahan data penetapan kadar kloramfenikol dalam udang windu
yang diperoleh dari berbagai tambak secara KCKT menggunakan kolom C18 (250
mm x 4,60 mm) pada kondisi yang optimal dapat dilihat pada lampiran 10. Hasil
penetapan kadar kloramfenikol dalam sampel udang windu secara statistik dapat
dilihat pada Tabel 2.