PEMERIKSAAN RESIDU KLORAMFENIKOL DALAM
TELUR AYAM SECARA KROMATOGRAFI CAIR
KINERJA TINGGI
SKRIPSI
OLEH : ANITA KARLINA
NIM 091524024
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PEMERIKSAAN RESIDU KLORAMFENIKOL DALAM
TELUR AYAM SECARA KROMATOGRAFI CAIR
KINERJA TINGGI
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH : ANITA KARLINA
NIM 091524024
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
PEMERIKSAAN RESIDU KLORAMFENIKOL DALAM TELUR AYAM SECARA KROMATOGRAFI CAIR
KINERJA TINGGI OLEH : ANITA KARLINA NIM 091524024
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal :
Pembimbing I, Panitia Penguji,
Prof. Dr. rer. nat. Effendy De Lux Putra, SU, Apt. Dr. Ginda Haro, M.Sc., Apt. NIP 195306191983031001 NIP 195108161980031002
Pembimbing II, Prof. Dr. rer. nat. Effendy De
Lux Putra, SU, Apt.
NIP 195306191983031001
Drs. Fathur Rahman Harun, M.Si.,Apt. Drs. Immanuel S. Meliala, M.Si., Apt.
NIP 195201041980031002 NIP 195001261983031002
Dra. Salbiah, M.Si., Apt NIP 194810031987012001
Disahkan Oleh: Dekan,
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
melimpahkan rahmat, taufik dan hidayah-Nya kepada penulis sehingga penulis
dapat menyelesaikan penelitian dan penulisan skripsi ini.
Skripsi yang berjudul “Pemeriksaan Residu Kloramfenikol dalam
Telur Ayam secara Kromatografi Cair Kinerja Tinggi” ini dimaksudkan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas
Farmasi Universitas Sumatera Utara.
Dalam menyelesaikan penelitian dan penulisan skripsi ini penulis banyak
mendapat bantuan dan dukungan dari berbagai pihak, baik secara moril maupun
materil. Oleh karena itu penulis ingin menyampaikan ucapan terima kasih dengan
ketulusan hati kepada :
1. Bapak Prof. Dr. rer. nat. Effendy De Lux Putra, SU, Apt. Dan Bapak Drs.
Fathur Rahman Harun, M.Si, Apt., selaku dosen pembimbing yang telah
memberikan waktu, bimbingan, dan nasehat kepada penulis dalam
menyelesaikan penelitian dan penulisan skripsi ini.
2. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi Universitas Sumatera Utara Medan.
3. Bapak Dr. Ginda Haro, M.Sc., Apt., Drs. Immanuel S. Meliala, M.Si.,
Apt., Dra. Salbiah, M.Si., Apt selaku dosen penguji yang telah memberi
banyak masukan kepada penulis untuk memperbaiki skripsi ini.
4. Bapak dan Ibu staf pengajar dan karyawan Fakultas Farmasi Universitas
Sumatera Utara.
5. Teman-teman penulis Rikha, kak Ira, Sri, Emil, Desmi, kak Winda, Ipit,
Izha, Pipi, Ernal dan rekan-rekan Ekstensi 2009 lainnya yang tidak dapat
disebut satu persatu, yang selalu menjadi teman dalam suka dan duka serta
memberi dorongan semangat kepada penulis.
6. Kepala dan Staf Laboratorium Penelitian kak Mustika Furi, kak Evi, bang
Terakhir dan teristimewa, penulis mengucapkan terima kasih yang
sebesar-besarnya kepada kedua orang tua tercinta, Ayahanda Aminul Karim, ST
dan Ibunda Mardelina serta kakak dan adik tersayang, Angriyani Karlina, SE.,
Anisa Karlina, SE., dan Amelia Karlina. yang selalu memberikan perhatian, kasih
sayang dan dukungan yang tak ternilai harganya.
Semoga Allah melimpahkan rahmat-Nya kepada kita semua. Penulis
berharap semoga skripsi ini dapat bermanfaat bagi kita semua.
Medan, Juni 2011
Penulis,
PEMERIKSAAN RESIDU KLORAMFENIKOL DALAM TELUR AYAM SECARA KROMATOGRAFI CAIR KINERJA TINGGI
Abstrak
Kloramfenikol adalah antibiotika pertama yang mempunyai efek terhadap
riketsia dan menjadi obat pilihan pada penyakit tifoid salmonellosis.
Kloramfenikol juga sering digunakan dalam peternakan ayam untuk pengobatan
dan pencegahan penyakit pada hewan ternak. Tujuan penelitian ini adalah untuk
memeriksa residu kloramfenikol dalam telur ayam secara kromatografi cair
kinerja tinggi.
Pemeriksaan dilakukan secara kromatografi cair kinerja tinggi
menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV pada panjang
gelombang 278 nm dengan perbandingan fase gerak metanol-air (55:45) dan laju
alir 1 ml/menit.
Dari hasil penelitian, disimpulkan bahwa telur ayam yang diambil dari
lima lokasi di daerah Sumatera Utara (Binjai, Tandem, Pantai Labu, Marelan, dan
Kabanjahe) ternyata mengandung residu kloramfenikol. Kadar residu
kloramfenikol dalam telur ayam tersebut berturut-turut 0,1937±0,0275 µg/g
(Binjai), 0,1709±0,0304 µg/g (Tandem), 0,1671±0,0200 µg/g (Pantai Labu),
0,0773±0,0002 µg/g (Marelan) dan 0,0752±0,0043 µg/g (Kabanjahe), dimana
kadar yang diperoleh melebihi persyaratan dari RSNI No. : 05 – TAN – 1996
tentang batas maksimum residu kloramfenikol dalam telur ayam yakni 0,01 µg/g.
Hasil pengujian validasi menunjukkan bahwa metode ini memiliki akurasi dan
presisi yang baik dengan persen perolehan kembali 101,5% (RSD = 5,7606%),
batas deteksi 0,0518 µg/ml dan batas kuantitasi 0,1570 µg/ml.
DETERMINATION OF CHLORAMPHENICOL RESIDUE IN CHICKEN EGG BY HIGH PERFORMANCE LIQUID CHROMATOGRAPHY
Abstract
Chloramphenicol is the first antibiotic that have effect for rickettsia and be
the drug of choice for salmonellosis typhoid disease. Chloramphenicol is also
often used on a large scale of chicken husbandry to cure and prevent diseases in
animals. The aim of this study was to determine the level of chloramphenicol
residue in chicken egg by high performance liquid chromatography.
Determination was done by high performance liquid chromatography
using C-18 (250 mm x 4.60 mm) column, UV detector at 278 nm with
methanol-water (55:45) were applied as mobile phase and the flow rate was 1 ml/minute.
Based on this research, it was summarized that the chicken eggs that were
collected from five locations in North Sumatera apparently contained
chloramphenicol residue. The level of chloramphenicol residue in chicken eggs
were 0.1937±0.0275 µg/g (Binjai), 0.1709±0.0304 µg/g (Tandem),
0.1671±0.0200 µg/g (Pantai Labu), 0.0773±0.0002 µg/g (Marelan) and
0.0752±0.0043 µg/g (Kabanjahe), respectively, which the level exceed the
regulation of RSNI No. : 05 – TAN – 1996 about the maximum level of
chloramphenicol residue in chicken egg that was 0.01 µg/g. The test result of
validation exhibited that this method have good accuracy and precision with
percent recovery 101.5 % (RSD = 5.7606%), limit of detection was 0,0518 µg/ml and limit of quantitation was 0.1570 µg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Telur ... 4
2.2 Antibiotik ... 5
2.2.1 Pengertian Antibiotika ... 5
2.2.2 Penggunaan Antibiotika dalam Peternakan ... 5
2.2.3 Residu Antibiotika ... 5
2.3 Kloramfenikol ... 6
2.3.1 Uraian Umum ... 6
2.3.2 Aktivitas Antimikroba ... 7
2.3.3 Reaksi-Reaksi yang Tidak Diinginkan ... 7
2.3.4 Penetapan Kadar Kloramfenikol ... 8
2.4 Kromatografi Cair Kinerja Tinggi ... 9
2.4.1 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi ... 10
2.4.2.1 Waktu Tambat ... 10
2.4.2.2 Faktor Kapasitas ... 10
2.4.2.3 Resolusi ... 11
2.4.2.4 Selektifitas atau Faktor Pemisahan ... 11
2.4.2.5 Faktor Tailing dan Faktor Asimetri ... 12
2.4.2.6 Efisiensi Kolom ... 13
2.5 Komponen KCKT ... 14
2.5.1 Wadah Fase Gerak ... 14
2.5.2 Pompa ... 14
2.5.3 Injektor ... 14
2.5.4 Kolom ... 15
2.5.5 Detektor ... 15
2.5.6 Pengolah Data ... 16
2.5.7 Fase Gerak ... 16
2.6 Validasi Metode ... 17
BAB III METODE PENELITIAN ... 19
3.1 Waktu dan Tempat Penelitian ... 19
3.2 Alat-alat ... 19
3.3 Bahan-bahan ... 19
3.4 Pengambilan Sampel ... 19
3.5 Prosedur Penelitian... 20
3.5.1 Penyiapan Bahan ... 20
3.5.1.1 Pembuatan Fase Gerak Metanol-Air ... 20
3.5.1.2 Pembuatan Pelarut ... 20
3.5.1.3 Pembuatan Larutan Induk Baku Kloramfenikol ... 20
3.5.1.4 Penyiapan Sampel ... 20
3.5.2 Penentuan Panjang Gelombang Maksimum Kloramfenikol.. 20
3.5.3 Prosedur Analisis... 21
3.5.3.1 Penyiapan Alat KCKT ... 21
3.5.3.2 Penentuan Perbandingan Fase Gerak Optimum ... 21
3.5.3.3 Pembuatan Kurva Kalibrasi Kloramfenikol Baku ... 22
3.5.3.5 Analisis Data Penetapan Kadar secara Statistik ... 25
3.5.4 Metode Validasi ... 25
3.5.4.1 Kecermatan (accuracy) ... 25
3.5.4.2 Keseksamaan (precision) ... 26
3.5.4.3 Penentuan Batas Deteksi dan Batas Kuantitasi ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Penentuan Panjang Gelombang Maksimum Kloramfenikol... 28
4.2 Penentuan Perbandingan Fase Gerak yang Optimum ... 29
4.2 Penentuan Linieritas Kurva Kalibrasi Kloramfenikol Baku ... 30
4.3 Penetapan Kadar Kloramfenikol dalam Sampel ... 32
4.4 Hasil Uji Validasi ... 34
BAB V KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Halaman
Tabel 1. Hasil optimasi fase gerak dengan parameter data waktu tambat
dan asimetris ... 29
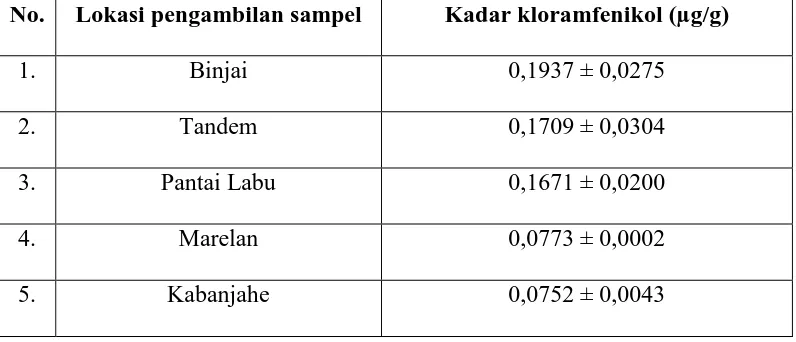
Tabel 2. Kadar rerata kloramfenikol dalam sampel ... 34
Tabel 3. Data hasil uji validasi metode pemeriksaan residu kloramfenikol
DAFTAR GAMBAR
Halaman
Gambar 1. Bentuk puncak kromatogram ... 12
Gambar 2. Pengukuran derajat asimetris puncak ... 13
Gambar 3. Bagan penetapan kadar kloramfenikol dalam sampel ... 24
Gambar 4. Kurva serapan kloramfenikol baku 15 µg/ml secara spektrofotometri UV ... 28
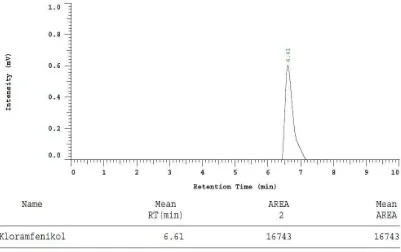
Gambar 5. Kromatogram hasil penyuntikan larutan kloramfenikol baku dengan perbandingan fase gerak metanol-air (55:45) ... 30
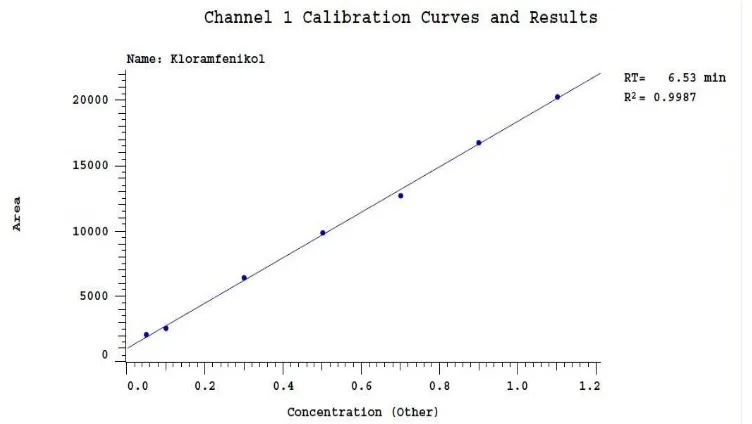
Gambar 6 Kurva kalibrasi kloramfenikol baku ... 30
Gambar 7. Kromatogram hasil penyuntikan larutan kloramfenikol baku 0,9 µg/ml pada pembuatan kurva kalibrasi ... 31
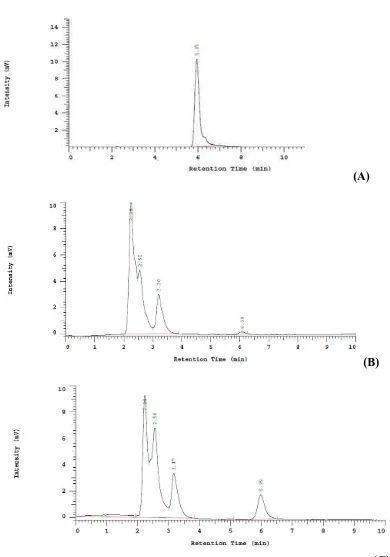
Gambar 8. Kromatogram hasil penyuntikan kloramfenikol baku 10 µg/ml (A), larutan sampel telur (B), dan larutan sampel yang telah di-spike dengan larutan kloramfenikol baku (C) dengan kondisi analisis KCKT yang sama ... 33
Gambar 9. Alat KCKT (Hitachi) ... 85
Gambar 10. Vial autosampler ... 85
Gambar 11. Telur ayam... 86
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Kromatogram penyuntikan kloramfenikol baku untuk menentukan
Fase gerak yang optimum ... 39
Lampiran 2. Kromatogram penyuntikan kloramfenikol baku pada
pembuatan kurva kalibrasi ... 43
Lampiran 3. Perhitungan persamaan regresi dari kurva kalibrasi kloramfenikol 47
Lampiran 4. Perhitungan batas deteksi (LOD) dan batas kuantitasi (LOQ)
kloramfenikol ... 49
Lampiran 5. Kromatogram hasil penyuntikan telur 1 (Binjai) ... 50
Lampiran 6. Perhitungan kadar kloramfenikol dalam telur 1 (Binjai) ... 51
Lampiran 7. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikan telur 1 (Binjai) ... 52
Lampiran 8. Kromatogram hasil penyuntikan telur 2 (Tandem) ... 55
Lampiran 9. Perhitungan kadar kloramfenikol dalam telur 2 (Tandem) ... 56
Lampiran 10. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikan telur 2 (Tandem) ... 57
Lampiran 11. Kromatogram hasil penyuntikan telur 3 (Pantai Labu) ... 59
Lampiran 12. Perhitungan kadar kloramfenikol dalam telur 3 (Pantai Labu) . 60
Lampiran 13. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikan telur 3 (Pantai Labu) ... 61
Lampiran 14. Kromatogram hasil penyuntikan telur 4 (Marelan) ... 63
Lampiran 15. Perhitungan kadar kloramfenikol dalam telur 4 (Marelan) ... 64
Lampiran 16. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikan telur 4 (Marelan) ... 65
Lampiran 17. Kromatogram hasil penyuntikan telur 5 (Kabanjahe) ... 68
Lampiran 18. Perhitungan kadar kloramfenikol dalam telur 5 (Kabanjahe) ... 69
Lampiran 19. Analisis data statistik untuk mencari kadar sebenarnya dari
penyuntikan telur 5 (Kabanjahe) ... 70
Lampiran 20. Hasil pengolahan data penetapan kadar residu kloramfenikol
dalam telur ayam ... 73
baku pada persen perolehan kembali pada rentang 50%, 100%,
dan 150% ... 74
Lampiran 22. Perhitungan persen perolehan kembali ... 80
Lampiran 23. Sertifikat analisis kloramfenikol BPFI ... 82
Lampiran 24. Sertifikat analisis kloramfenikol baku PT. Varia Sekata. ... 83
Lampiran 25. Tabel nilai distribusi t. ... 84
Lampiran 26. Gambar alat KCKT dan vial autosampler. ... 85
PEMERIKSAAN RESIDU KLORAMFENIKOL DALAM TELUR AYAM SECARA KROMATOGRAFI CAIR KINERJA TINGGI
Abstrak
Kloramfenikol adalah antibiotika pertama yang mempunyai efek terhadap
riketsia dan menjadi obat pilihan pada penyakit tifoid salmonellosis.
Kloramfenikol juga sering digunakan dalam peternakan ayam untuk pengobatan
dan pencegahan penyakit pada hewan ternak. Tujuan penelitian ini adalah untuk
memeriksa residu kloramfenikol dalam telur ayam secara kromatografi cair
kinerja tinggi.
Pemeriksaan dilakukan secara kromatografi cair kinerja tinggi
menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV pada panjang
gelombang 278 nm dengan perbandingan fase gerak metanol-air (55:45) dan laju
alir 1 ml/menit.
Dari hasil penelitian, disimpulkan bahwa telur ayam yang diambil dari
lima lokasi di daerah Sumatera Utara (Binjai, Tandem, Pantai Labu, Marelan, dan
Kabanjahe) ternyata mengandung residu kloramfenikol. Kadar residu
kloramfenikol dalam telur ayam tersebut berturut-turut 0,1937±0,0275 µg/g
(Binjai), 0,1709±0,0304 µg/g (Tandem), 0,1671±0,0200 µg/g (Pantai Labu),
0,0773±0,0002 µg/g (Marelan) dan 0,0752±0,0043 µg/g (Kabanjahe), dimana
kadar yang diperoleh melebihi persyaratan dari RSNI No. : 05 – TAN – 1996
tentang batas maksimum residu kloramfenikol dalam telur ayam yakni 0,01 µg/g.
Hasil pengujian validasi menunjukkan bahwa metode ini memiliki akurasi dan
presisi yang baik dengan persen perolehan kembali 101,5% (RSD = 5,7606%),
batas deteksi 0,0518 µg/ml dan batas kuantitasi 0,1570 µg/ml.
DETERMINATION OF CHLORAMPHENICOL RESIDUE IN CHICKEN EGG BY HIGH PERFORMANCE LIQUID CHROMATOGRAPHY
Abstract
Chloramphenicol is the first antibiotic that have effect for rickettsia and be
the drug of choice for salmonellosis typhoid disease. Chloramphenicol is also
often used on a large scale of chicken husbandry to cure and prevent diseases in
animals. The aim of this study was to determine the level of chloramphenicol
residue in chicken egg by high performance liquid chromatography.
Determination was done by high performance liquid chromatography
using C-18 (250 mm x 4.60 mm) column, UV detector at 278 nm with
methanol-water (55:45) were applied as mobile phase and the flow rate was 1 ml/minute.
Based on this research, it was summarized that the chicken eggs that were
collected from five locations in North Sumatera apparently contained
chloramphenicol residue. The level of chloramphenicol residue in chicken eggs
were 0.1937±0.0275 µg/g (Binjai), 0.1709±0.0304 µg/g (Tandem),
0.1671±0.0200 µg/g (Pantai Labu), 0.0773±0.0002 µg/g (Marelan) and
0.0752±0.0043 µg/g (Kabanjahe), respectively, which the level exceed the
regulation of RSNI No. : 05 – TAN – 1996 about the maximum level of
chloramphenicol residue in chicken egg that was 0.01 µg/g. The test result of
validation exhibited that this method have good accuracy and precision with
percent recovery 101.5 % (RSD = 5.7606%), limit of detection was 0,0518 µg/ml and limit of quantitation was 0.1570 µg/ml.
BAB I PENDAHULUAN
1.1. Latar Belakang
Telur merupakan produk peternakan yang memberikan sumbangan besar
bagi tercapainya kecukupan gizi masyarakat. Dari sebutir telur didapatkan gizi
yang cukup sempurna karena mengandung zat-zat gizi yang lengkap dan mudah
dicerna (Sudaryani, 2005). Namun, produk ternak akan menjadi tidak berguna dan
membahayakan kesehatan apabila tidak aman. Oleh karena itu, keamanan pangan
asal ternak bagi manusia merupakan persyaratan mutlak (Bahri, 2008).
Meningkatnya kebutuhan protein pada populasi penduduk dunia membuat
peternakan memaksimalkan produktivitas ternaknya seperti penggunaan
obat-obatan. Dalam praktiknya, obat-obatan digunakan dalam skala besar. Obat
digunakan di peternakan untuk beberapa alasan yang berbeda. Untuk mengobati
atau mencegah penyakit pada hewan, meningkatkan efisiensi pakan dan atau laju
pertumbuhan, dan untuk menenangkan hewan agar tidak stress. Residu
obat-obatan tersebut mungkin berada pada produk ternak seperti daging, susu, dan telur
(Botsoglov and Fletouris, 2000).
Di dalam tubuh sebagian senyawa kimia dimetabolisme menjadi senyawa
lain (metabolit). Senyawa induk maupun metabolitnya sebagian akan dikeluarkan
dari tubuh melalui air seni dan feses, tetapi sebagian lagi akan tetap tersimpan di
dalam jaringan (organ tubuh) yang selanjutnya disebut sebagai residu. Hampir
semua pabrik pakan menambahkan obat hewan berupa antibiotika ke dalam pakan
mengandung antibiotik. Hal ini dilakukan untuk membuat hewan tetap produktif
meskipun mereka hidup dalam kondisi berdesakan dan tidak higienis. Umumnya
pengobatan antibiotika yang diberikan pada ayam lebih banyak diberikan secara
massal dibandingkan pengobatan secara individual Apabila pakan yang
dikonsumsi ternak terlalu sering terkontaminasi maka residu senyawa kimia atau
obat hewan, maka residu tersebut akan terakumulasi di dalam jaringan organ
tubuh dengan konsentrasi yang bervariasi antara jaringan organ tubuh yang satu
dengan lainnya (Bahri, 2000).
Beberapa antibiotik yang sering dipakai untuk mengatasi penyakit pada
ayam adalah golongan salinomisin, sulfonamida, tetrasiklin dan derivatnya,
nitrofuran, quinolon, aminosilikosida, betalaktam, makrolida, dan kloramfenikol
(Fadilah dan Polana, 2005). Batas residu kloramfenikol dalam daging, telur, susu
dan olahannya adalah 0,01 µg/g (RSNI No. : 05 – TAN – 1996).
Menurut beberapa literatur, penetapan kadar kloramfenikol dapat
dilakukan dengan beberapa cara yakni nitrimetri, spektrofotometri ultraviolet
(Farmakope Indonesia III) dan kromatografi cair kinerja tinggi (Farmakope
Indonesia IV dan SNI 7541. 1:2009). Dalam penelitian ini digunakan metode
kromatografi cair kinerja tinggi karena metode ini sesuai untuk memeriksa analit
dalam matriks biologis karena terjadi pemisahan serta untuk analit yang
jumlahnya sangat sedikit dalam sampel.
Berdasarkan latar belakang tersebut maka peneliti ingin memeriksa residu
kloramfenikol dalam telur ayam dari lima lokasi yaitu Binjai, Tandem, Pantai
1.2 Perumusan Masalah
1. Apakah residu kloramfenikol terdapat dalam telur ayam dari kelima lokasi
yang diperiksa?
2. Apakah kadar residu kloramfenikol dalam telur ayam dari kelima lokasi
tersebut masih berada dibawah batas maksimum residu kloramfenikol
menurut RSNI No. : 05 – TAN – 1996?
1.3 Hipotesis
1. Residu kloramfenikol terdapat dalam telur ayam dari kelima lokasi yang
diperiksa.
2. Kadar residu kloramfenikol dalam telur ayam tersebut masih di bawah
batas maksimum residu kloramfenikol menurut RSNI No. : 05 – TAN –
1996.
1.4 Tujuan Penelitian
1. Untuk mengetahui ada tidaknya residu kloramfenikol pada telur ayam dari
kelima lokasi yang diperiksa.
2. Untuk mengetahui kesesuaian kadar residu kloramfenikol dalam telur
ayam dengan persyaratan yang ditetapkan oleh RSNI No. : 05 – TAN –
1996 tentang batas residu kloramfenikol dalam telur ayam.
1.5 Manfaat Penelitian
Hasil penelitian diharapkan menjadi informasi bagi instansi terkait, dalam
hal ini Dinas Peternakan mengenai keberadaan residu kloramfenikol yang dalam
BAB II
TINJAUAN PUSTAKA
2.1 Telur
Telur merupakan produk peternakan yang memberikan sumbangan besar
bagi tercapainya kecukupan gizi masyarakat. Dari sebutir telur didapatkan gizi
yang cukup sempurna karena mengandung zat-zat gizi yang lengkap dan mudah
dicerna. Oleh karenanya, telur merupakan bahan pangan yang sangat baik untuk
anak-anak yang sedang tumbuh, ibu hamil dan menyusui dan juga dianjurkan
diberikan kepada orang yang sedang sakit untuk mempercepat proses
kesembuhannya (Sudaryani, 2003).
Komposisi sebutir telur terdiri dari 11% kulit telur, 58% putih telur, dan
31% kuning telur. Kandungan gizi sebutir telur ayam dengan berat 50 g terdiri
dari protein 6,3 g, karbohidrat 0,6 g, lemak 5 g, vitamin (A, D, E, B1, B2, B6, dan
B12), dan mineral (kalsium, fosfor, besi, magnesium, kalium, natrium, dan zink).
Protein telur merupakan protein yang bermutu tinggi dan mudah dicerna karena
sebagian besar asam amino yang dibutuhkan oleh tubuh manusia terdapat di
dalam telur. Lemak pada telur terdiri dari trigliserida, fosfolipida, dan kolesterol.
Fungsi gliserida dan fosfolipida umumnya menyediakan energi untuk aktivitas
sehari-hari. Kolesterol digunakan untuk pembentukan garam empedu dan juga
hormon seperti testosteron dan adrenalin (Panda, 1998).
Ada beberapa faktor yang mempengaruhi kualitas telur, diantaranya
perbedaan kelas, strain, famili, dan individu; kandungan zat gizi pakan ayam,
2.2 Antibiotik
2.2.1 Pengertian Antibiotika
Antibiotika adalah bahan kimia yang dihasilkan oleh mikroba seperti bakteri
dan jamur, yang dalam konsentrasi tertentu mempunyai kemampuan menghambat
pertumbuhan mikroba lain. Berdasarkan definisi ini, bahan yang dapat dianggap
sebagai antibiotika adalah hasil alamiah saja. Akan tetapi yang termasuk kategori
ini juga adalah bahan-bahan antibiotika semi sintetis yang merupakan hasil
modifikasi bahan kimia antibiotika alam dan transformasi mikrobiologi dari
bahan-bahan sintetis (Hadisahputra dan Harahap, 1994). Antimikroba harus
memiliki sifat toksisitas selektif setinggi mungkin. Artinya, obat tersebut haruslah
bersifat sangat toksik untuk mikroba, tetapi relatif tidak toksik untuk hospes
(Setiabudy dan Gan, 2007).
2.2.2 Penggunaan Antibiotika dalam Peternakan
Pengunaan antibiotika pada hewan dilakukan peternak bertujuan untuk
mencegah dan mengobati ternak dari serangan penyakit dan juga sebagai hormon
pertumbuhan bagi ternak bila diberikan dalam dosis kecil. Pada usaha peternakan
modern, imbuhan pakan sudah umum digunakan. Suplemen ini dimaksudkan
untuk memacu pertumbuhan dan meningkatkan efisiensi pakan dengan
mengurangi mikroorganisme pengganggu (patogen) atau meningkatkan populasi
mikroba yang menguntungkan di dalam saluran pencernaan (Rahayu, 2009).
2.2.3 Residu Antibiotika
Tiap senyawa anorganik atau organik, baik yang berupa obat-obatan,
mineral atau hormon yang masuk atau dimasukkan ke dalam tubuh individu, akan
eliminasi. Kecepatan proses biologik tersebut di atas tergantung kepada jenis dan
bentuk senyawa, cara masuknya dan kondisi jaringan yang memprosesnya.
Apabila bahan tersebut dimasukkan melalui mulut, penyerapan terjadi di dalam
saluran pencernaan yang sebagian besar dilakukan oleh usus. Setelah terjadi
penyerapan, senyawa yang berbentuk asli akan di metabolisme menjadi
metabolitnya akan dibawa oleh darah dan akan didistribusikan ke seluruh bagian
tubuh. Eliminasi akan dilakukan terutama oleh ginjal, dalam bentuk kemih dan
lewat usus dalam bentuk tinja. Senyawa-senyawa dalam bentuk asli maupun
metabolitnya akan tertinggal atau tertahan di dalam jaringan untuk waktu tertentu
tergantung pada waktu paruh senyawa tersebut atau metabolitnya. Pada kondisi
ternak yang sehat kecepatan eliminasi akan jauh lebih cepat daripada ternak sakit.
Dalam keadaan tubuh lemah atau terdapat gangguan alat metabolisme, maka
eliminasi obat akan terganggu. Apabila senyawa-senyawa tersebut diberikan
dalam waktu yang lama, maka akan terjadi timbunan senyawa atau metabolitnya
di dalam tubuh, itulah yang disebut dengan residu. Jadi residu obat adalah
akumulasi dari obat atau metabolitnya dalam jaringan atau organ hewan/ternak
setelah pemakaian obat hewan (Rahayu, 2009).
2.3 Kloramfenikol 2.3.1 Uraian Umum
Rumus Molekul : C11H12Cl2N2O5
Rumus Bangun :
Pemerian : Hablur halus berbentuk jarum atau lempeng memanjang; putih
sampai putih kelabu atau putih kekuningan; tidak berbau; rasa
sangat pahit.
Kelarutan : Larut dalam lebih kurang 400 bagian air, dalam 2,5 bagian etanol
(95%) P dan dalam 7 bagian propilenglikol P; sukar larut dalam
kloroform P dan dalam eter P.
Serapan ultraviolet : Serapan-1 cm larutan 0,002% b/v dalam air pada 278 nm
adalah 0,58 sampai 0,61 (Ditjen POM, 1995).
Kloramfenikol termasuk antibiotika yang paling stabil. Larutan dalam air
pada pH 6 menunjukkan kecenderungan terurai yang paling rendah. Senyawa ini
cepat dan hampir sempurna diabsorpsi dari saluran cerna. Oleh karena itu
pemberian peroral menonjol (Wattimena, 1990).
2.3.2 Aktivitas Antimikroba
Kloramfenikol adalah antibiotika pertama yang mempunyai efek terhadap
riketsia dan juga menjadi obat pilihan pada penyakit tifoid salmonellosis,
hemofilus influenza, dan klebsiella pneumoniae. Penggunaannya perlu diawasi
dengan memonitor keadaan hematologi karena dapat menyebabkan efek
hipersensitivitas (Hadisahputra dan Harahap, 1994).
2.3.3 Reaksi - Reaksi yang Tidak Diinginkan
Semua obat mempunyai reaksi yang tidak dikehendaki, tetapi
kloramfenikol barangkali yang paling dikenal efek sampingnya dibandingkan
yang lainnya. Penggunaan klinis kloramfenikol pada saat sekarang terbatas pada
pengobatan demam tifoid, infeksi salmonela, dan infeksi yang disebabkan oleh
Menurut Katzung (2004), reaksi-reaksi yang tidak diinginkan pada terapi
kloramfenikol antara lain:
a. Gangguan Gastrointestinal
Kadang-kadang, orang dewasa dapat mengalami mual-mual, muntah-muntah,
dan diare. Hal ini jarang dijumpai pada anak-anak.
b. Gangguan Sumsum Tulang
Kloramfenikol biasanya menimbulkan suatu supresi reversibel terhadap
produksi sel darah merah yang terkait dosis, pada dosis diatas 50 mg/kg/hari
setelah 1-2 minggu. Anemia aplastik jarang menjadi konsekuensi pemberian
kloramfenikol melalui jalur apapun. Hal ini merupakan reaksi idiosinkrasi yang
tidak ada hubungannya dengan dosis
c. Toksisitas pada Bayi Baru Lahir
Bayi baru lahir kekurangan suatu mekanisme konjugasi asam glukoronat
(glucoronic acid) yang efektif untuk degradasi dan detoksifikasi kloramfenikol.
Lebih jauh lagi, apabila bayi-bayi ini diberi dosis diatas 50 mg/kg/hari, obat dapat
terakumulasi dan mengakibatkan sindrom bayi kelabu (gray baby sindrome).
2.3.4 Penetapan Kadar Kloramfenikol
Penetapan kadar kloramfenikol dapat dilakukan secara:
1. Nitrimetri dengan pelarut asam klorida P menggunakan pentiter natrium nitrit
0,1 M dan indikator kertas kanji iodida P. Titrasi dianggap selesai jika titik
akhir dapat ditunjukkan lagi setelah larutan dibiarkan selama 5 menit (Ditjen
2. Secara spektrofotometri ultraviolet, larutan sampel dalam air diukur
serapannya pada panjang gelombang maksimum ± 278 nm dengan harga A
(1%, 1 cm) pada 278 nm adalah 298 (Ditjen POM, 1979).
3. Secara kromatografi cair kinerja tinggi dengan menggunakan fase gerak
berupa campuran air : metanol P : asam asetat glasial (55:45:0,1), detektor
pada panjang gelombang 278 nm dan laju alir 1 ml/menit (Ditjen POM,
1995).
Uji kuantitatif keberadaan residu antibiotika dapat menggunakan metode
KCKT mempunyai beberapa keuntungan dibanding metode analisis lain,
diantaranya kolom dapat digunakan kembali, memiliki berbagai jenis detektor,
waktu analisis umumnya relatif singkat, ketepatan dan ketelitian relatif tinggi
serta dapat digunakan untuk menganalisis kebanyakan senyawa kimia yang tidak
tahan terhadap suhu tinggi (Meyer, 2004).
2.4 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi adalah suatu terminologi umum yang digunakan untuk
bermacam-macam teknik pemisahan yang didasarkan atas partisi cuplikan
diantara suatu fase gerak yang bisa berupa gas ataupun cairan, dan fase diam yang
juga bisa berupa cairan atau padatan.
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam
teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif
dan beragam sehingga mampu menganalisis berbagai cuplikan secara kualitatif
maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen
2.4.1 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi
Berdasarkan mekanisme interaksi antara analit dengan fase diam,
kromatografi cair dapat dibagi menjadi 4 metode, yaitu: kromatografi fase normal
(normal phase chromatography) atau disebut juga kromatografi adsorpsi,
kromatografi fase balik (reversed phase chromatography), kromatografi penukar
ion (ion exchange chromatography), dan kromatografi eksklusi ukuran (size
exclusion chromatography) (Riley,1995).
Kromatografi fase balik menggunakan fase diam yang relatif non polar
seperti oktadesisilan (ODS atau C18) sedangkan fase geraknya relatif lebih polar
dari fase diam. Kondisi kepolaran kedua fase ini merupakan kebalikan dari fase
normal sehingga disebut kromatografi fase balik (Meyer, 2004; Rohman, 2007).
2.4.2 Parameter Kromatografi
Ada beberapa parameter kromatografi yang digunakan secara umum yaitu:
2.4.2.1 Waktu Tambat (tR)
Periode waktu antara penyuntikan sampel dan puncak maksimum yang
terekam oleh detektor disebut sebagai waktu rambat/retention time (tR). Waktu
tambat merupakan fungsi dari laju alir fase gerak dan panjang kolom. Jika fase
gerak mengalir lebih lambat atau kolom semakin panajng, maka waktu tambat
akan semakin besar, dan sebaliknya jika fase gerak mengalir lebih cepat atau
kolom semakin pendek, maka waktu tambat akan semakin kecil (Meyer, 2004).
2.4.2.2 Faktor Kapasitas (k’)
Faktor kapasitas (k’) merupakan suatu ukuran seberapa jauh senyawa
tersebut berpartisi (mengadsorpsi) ke dalam fase diam dari fase gerak. Lamanya
pada faktor kapasitasnya (Watson, 2009). Faktor kapasitas suatu komponen dapat
dinyatakan sebagai berikut :
Keterangan :
t0 = waktu yang diperlukan bagi suatu molekul-takditahan untuk melewati volume
hampa
tr = waktu yang diperlukan analit untuk melewati kolom
2.4.2.3 Resolusi (Rs)
Resolusi didefinisikan sebagai perbedaan antara waktu retensi 2 puncak
yang saling berdekatan dibagi dengan rata-rata lebar puncak.
Nilai resolusi harus mendekati atau lebih dari 1,5 karena akan memberikan
pemisahan puncak yang baik (Rohman, 2007).
2.4.2.4 Selektifitas atau Faktor Pemisahan (α)
Menurut Kazakevich (2007), selektifitas (α) adalah kemampuan sistem
kromatografi untuk membedakan analit yang berbeda. Selektifitas ditentukan
sebagai rasio perbandingan faktor kapasitas (k’) dari analit yang berbeda:
Nilai selektifitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1
2.4.2.5 Faktor Tailing dan Faktor Asimetri
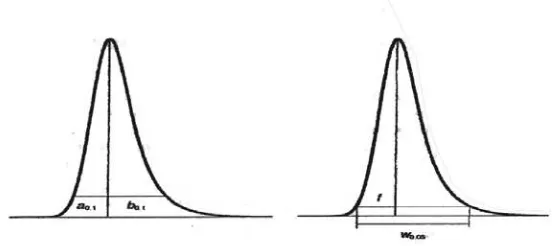
Faktor asimetri disebut juga “tailing factor (TF)” yaitu terjadinya
pengekoran pada kromatogram sehingga bentuk kromatogram menjadi tidak
simetris (Mulja dan Suharman, 1995). Idealnya, puncak kromatogram akan
memperlihatkan bentuk Gaussian dengan derajat simetris yang sempurna (Ornaf
and Dong, 2005). Namun kenyataannya, puncak yang simetris secara sempurna
jarang dijumpai. Jika diperhatikan secara cermat, maka hampir setiap puncak
dalam kromatografi memperlihatkan tailing. Pada Gambar 4 ditunjukkan tiga
jenis bentuk puncak.
Gambar 1. Bentuk puncak kromatogram. (sumber: Kazakevich, Y. 2007). Pengukuran derajat asimetris puncak dapat dihitung dengan 2 cara, yakni faktor
tailing dan faktor asimetris. Faktor tailing (Tf) dihitung dengan menggunakan
lebar puncak pada ketinggian 5% (W0,05), rumusnya dituliskan sebagai berikut.
f W T
2 05 , 0 =
Dengan nilai f merupakan setengah lebar puncak pada ketinggian 5%.
Sedangkan faktor asimetri dapat dihitung dengan rumus sebagai berikut.
1 , 0
1 , 0 a b
T =
Nilai a dan b dalam perhitungan faktor asimetri merupakan setengah lebar puncak
pada ketinggian 10%. Jika nilai T = 1, maka faktor tailing dan asimetri
tailing, maka kedua faktor ini akan bernilai lebih besar dari 1 dan sebaliknya bila
puncak berbentuk fronting, maka faktor tailing dan asimetri akan bernilai lebih
kecil dari 1.
Gambar 2. Pengukuran derajat asimetris puncak (sumber : Meyer, V.R. 2004). 2.4.2.6 Efisiensi Kolom (N)
Menurut Snyder and Kirkland (1979), efisiensi adalah ukuran tingkat
penyebaran puncak dalam kolom. Efisiensi kolom ditunjukkan dari jumlah
lempeng teoritikal atau theoretical plates (N), yang dapat dihitung dengan rumus:
Kolom yang efisien adalah kolom yang mampu menghasilkan pita sempit dan
memisahkan analit dengan baik. Nilai lempeng akan semakin tinggi jika ukuran
kolom semakin panjang, hal ini berarti proses pemisahan yang terjadi semakin
baik. Hubungan antara nilai lempeng dengan panjang kolom disebut sebagai nilai
HETP/High Equivalent of a Theoretical Plate (H). H dapat dihitung dengan
rumus:
N L
2.5 Komponen KCKT 2.5.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert) terhadap fase gerak.
Bahan yang umum digunakan adalah gelas dan baja anti karat. Daya tampung
tandon harus lebih besar dari 500 ml, yang dapat digunakan selama 4 jam untuk
kecepatan alir yang umumnya 1-2 ml/menit (Munson, 1991).
Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan
gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan
komponen lain terutama di pompa dan detektor sehingga akan mengacaukan
analisis. Oleh karena itu, fase gerak sebelum digunakan harus disaring terlebih
dahulu dengan penyaring mikrometer untuk menghindari partikel-partikel kecil
(Rohman, 2009).
2.5.2 Pompa
Pompa yang cocok digunakan untuk KCKT adalah pompa yang
mempunyai syarat sebagaimana syarat wadah pelarut yakni : pompa harus inert
terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja
tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu
memberikan tekanan sampai 6000 psi dan mampu mengalirkan fase gerak dengan
kecepatan alir 0,1-10 ml/menit. Aliran pelarut dari pompa harus tanpa denyut
untuk menghindari hasil yang menyimpang pada detektor (Putra, 2007).
2.5.3 Injektor
Ada 3 jenis macam injektor, yakni syringe injector, loop valve dan
automatic injector (autosampler). Syringe injector merupakan bentuk injektor
2.5.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis
tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom
dapat dibagi menjadi dua kelompok :
a. Kolom analitik : diameter khas adalah 2 – 6 nm. Panjang kolom
tergantung pada jenis kemasan. Untuk kemasan pellikular, panjang yang
umumnya adalah 50 – 100 cm. Untuk kemasan poros mikropartikulat,
umumnya 10 – 30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif : umumnya memiliki diameter 6 mm atau lebih besar
dan panjang kolom 25 – 100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada
temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama
untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom
tergantung pada mode KCKT yang digunakan.
2.5.5 Detektor
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan
dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki
sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang
luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan
yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi
tidak selalu dapat diperoleh.
Beberapa detektor yang paling sering digunakan dalam KCKT adalah
detektor spektrofotometri UV-Vis, photodiode-array (PDA), fluoresensi, indeks
2.5.6 Pengolah Data
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai
puncak-puncak yang secara keseluruhan disebut sebagai kromatogram. Alat pengumpul
data seperti komputer, integrator dan rekorder dihubungkan ke detektor. Alat ini
akan mengukur sinyal elektronik yang dihasilkan oleh detektor dan
memplotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi
oleh seorang analis (Rohman, 2007).
2.5.7 Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel (Rohman, 2007)
Elusi Gradien dan Isokratik
Elusi pada KCKT dapat dibagi menjadi dua sistem yaitu:
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam
atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap
selama elusi).
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase
gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi
fase gerak berubah-ubah selama elusi). Elusi bergradien digunakan untuk
meningkatkan resolusi campuran yang kompleks terutama jika sampel
2.6 Validasi Metode
Validasi metode adalah suatu proses yang menunjukkan bahwa prosedur
analitik telah sesuai dengan penggunaan yang dikehendaki (Bliesner, 2006).
Validasi metode merupakan persyaratan mendasar yang diperlukan untuk
menjamin kualitas dan reabilitas hasil dari semua aplikasi analitik. Hasil validasi
dapat digunakan untuk menentukan kualitas, reabilitas dan konsistensi dari hasil
analitik. Hal ini merupakan bagian tak terpisahkan dari suatu praktik analitik yang
baik (Ermer, 2005).
Menurut United States Pharmacopeia (USP) Edisi Ketigapuluh, ada 8
karakteristik utama yang digunakan dalam validasi metode, yakni akurasi, presisi,
spesifisitas, batas deteksi, batas kuantitasi, linieritas dan rentang, kekasaran dan
ketahanan.
Akurasi atau kecermatan adalah kedekatan antara nilai hasil uji yang
diperoleh lewat metode analitik dengan nilai sebenarnya. Akurasi dinyatakan
dalam persen perolehan kembali (%recovery). Akurasi dapat ditentukan dengan
dua metode, yakni spiked-placebo recovery dan standard addition method. Pada
spiked placebo recovery atau metode simulasi, analit murni ditambahkan (spiked)
ke dalam campuran bahan pembawa sediaan farmasi, lalu campuran tersebut
dianalisis dan jumlah analit hasil analisis dibandingkan dengan jumlah analit
teoritis yang diharapkan. Jika plasebo tidak memungkinkan untuk disiapkan,
maka sejumlah analit yang telah diketahui konsentrasinya dapat ditambahkan
langsung ke dalam sediaan farmasi. Metode ini dinamakan standard addition
Presisi atau keseksamaan merupakan ukuran kedekatan antar serangkaian
hasil analisis yang diperoleh dari beberapa kali pengukuran pada sampel homogen
yang sama. Biasanya diekspresikan sebagai relatif standar deviasi (RSD) dari
sejumlah sampel yang berbeda secara signifikan secara statistik (Rohmsn, 2007).
Berdasarkan rekomendasi ICH (International Conference on Harmonization),
karakteristik presisi dilakukan pada 3 tingkatan, yakni keterulangan
(repeatability), presisi antara (intermediate precision), dan reprodusibilitas
(reproducibility). Keterulangan dilakukan dengan menganalisis sampel yang sama
oleh analis yang sama menggunakan instrumen yang sama dalam periode waktu
singkat. Presisi antara dikerjakan oleh analis yang berbeda. Sedangkan
reprodusibilitas dikerjakan oleh analis yang berbeda dan di laboratorium yang
berbeda (Epshtein, 2004).
Batas deteksi (limit of detection, LOD) didefinisikan sebagai konsentrasi
analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu
dapat dikuantifikasi.
Batas kuantitasi (limit of quantitation, LOQ) didefinisikan sebagai
konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi
dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Penelitian Fakultas Farmasi
Universitas Sumatera Utara pada bulan Januari 2011 sampai Maret 2011.
3.2 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi seperangkat
instrumen KCKT lengkap (Hitachi) dengan pompa (L-2130), injektor
autosampler L-2200, kolom Luna 5u C18 (250 mm x 4,60 mm), detektor UV-Vis
L-2420, degasser (DGU 20 AS), wadah fase gerak, vial autosampler, sonifikator
(Branson 1510), pompa vakum (Gast DOA - P604 – BN), neraca analitik (Mettler
Toledo), membran penyaring PTFE 0,5 µm, membran penyaring nitrat selulosa
0,45 µm dan 0,2 µm, spektrofotometer UV-Vis (Shimadzu UV 1800), blender
(Miyako), vortex (Boeco-Germany), sentrifus (Hitachi), dan alat-alat gelas.
3.3 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian ini jika tidak dinyatakan
lain merupakan kualitas pro analysis keluaran E.Merck meliputi asetonitril,
n-heksan, metanol gradient grade for liquid chromatography, NaCl, aquabidestilata
(PT. Ikapharmindo Putramas), kloramfenikol BPFI dan kloramfenikol baku pabrik
(PT. Varia Sekata).
3.4 Pengambilan Sampel
Pengambilan sampel dilakukan secara purposif di lima lokasi di
3.5 Prosedur Penelitian 3.5.1 Penyiapan Bahan
3.5.1.1 Pembuatan Fase Gerak Metanol - Air
Metanol 500 ml disaring dengan menggunakan penyaring PTFE 0,5 µm
dan diawaudarakan selama 30 menit.
Air 500 ml disaring dengan menggunakan penyaring nitrat selulosa 0,45
µm dan diawaudarakan selama 30 menit.
3.5.1.2 Pembuatan Pelarut
Larutan metanol dan air dicampur dengan perbandingan 55:45. Pelarut
kemudian disaring dengan penyaring nitrat selulosa 0,2 µm dan diawaudarakan
selama 30 menit.
3.5.1.3 Pembuatan Larutan Induk Baku Kloramfenikol
Sebanyak 50 mg kloramfenikol baku ditimbang seksama, dimasukkan ke
dalam labu tentukur 250 ml, dilarutkan dengan 5 ml metanol kemudian
dicukupkan sampai garis tanda dengan pelarut dan dikocok sampai homogen,
sehingga diperoleh larutan dengan konsentrasi 200 µg/ml.
3.5.1.4 Penyiapan sampel
Dalam setiap percobaan digunakan satu buah telur. Telur yang akan
dipakai dipecahkan terlebih dahulu kulitnya, kemudian semua isinya (putih dan
kuning telur) dihomogenkan menggunakan blender.
3.5.2 Penentuan Panjang Gelombang Maksimum Kloramfenikol
Sebanyak 50 mg kloramfenikol baku ditimbang seksama, dimasukkan ke
dalam labu tentukur 50 ml, dilarutkan dengan 5 ml metanol lalu dicukupkan
larutan dengan konsentrasi 1000 µg/ml, larutan induk baku I (LIB I). LIB I
dipipet sebanyak 1,5 ml, dimasukkan ke dalam labu tentukur 100 ml,
dicukupkan sampai garis tanda dengan air dan dikocok sampai homogen,
sehingga diperoleh larutan dengan konsentrasi 15 µg/ml. Larutan diukur
serapannya pada panjang gelombang 200-400 nm.
3.5.3 Prosedur Analisis
3.5.3.1 Penyiapan Alat Kromatografi Cair Kinerja Tinggi
Masing-masing unit diatur, kolom yang digunakan C18 (250 mm x 4,60
mm), detektor UV-Vis pada panjang gelombang analisis yang diperoleh. Pompa
menggunakan mode aliran tetap dengan sistem elusi isokratik.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak
dibiarkan mengalir selama 30 menit sampai diperoleh garis alas yang datar,
menandakan sistem tersebut telah stabil.
3.5.3.2 Penentuan Perbandingan Fase Gerak yang Optimum
Larutan induk baku kloramfenikol dipipet 5 ml dan dimasukkan ke dalam
labu tentukur 100 ml, dicukupkan dengan pelarut hingga garis tanda dan dikocok
sampai homogen sehingga diperoleh larutan kloramfenikol dengan konsentrasi 10
µg/ml, disaring dengan membran penyaring PTFE 0,2 µm, diawaudarakan selama
10 menit, kemudian diinjeksikan ke dalam sistem KCKT menggunakan vial
autosampler sebanyak 10 µl, menggunakan fase gerak metanol - air, dengan
perbandingan (40 : 60), (50 : 50), (55 : 45), (60 : 40), (65 : 35), (70 : 30), dan (75 :
25), dengan laju alir 1 ml/menit, dan dideteksi pada panjang gelombang 278 nm.
Kemudian dipilih perbandingan fase gerak dan laju alir yang memberikan data
3.5.3.3 Pembuatan Kurva Kalibrasi Kloramfenikol Baku
Larutan induk baku kloramfenikol dipipet sebanyak 5 ml, dimasukkan ke
dalam labu tentukur 100 ml, dicukupkan dengan pelarut hingga garis tanda,
dikocok hingga homogen sehingga diperoleh larutan kloramfenikol dengan
konsentrasi 10 µg/ml (LIB II). LIB II dipipet 0,5; 1; 3; 5; 7; 9 dan 11 ml,
dimasukkan ke dalam labu tentukur 100 ml, diencerkan dengan pelarut hingga
garis tanda, dikocok sampai homogen sehingga diperoleh konsentrasi 0,05; 0,1;
0,3; 0,5; 0,7; 0,9dan 1,1 µg/ml. Kemudian masing-masing larutan disaring dengan
penyaring nitrat selulosa 0,2 µm, dan diinjeksikan ke sistem KCKT menggunakan
vial autosampler sebanyak 10 µl dideteksi pada panjang gelombang maksimum
yang diperoleh. Selanjutnya dari luas area yang diperoleh pada kromatogram
dibuat kurva kalibrasi dihitung persamaan garis regresi dan faktor korelasinya.
3.5.3.4 Penetapan Kadar Kloramfenikol dalam Sampel
Sampel ditimbang 5 g, kemudian dimasukkan ke dalam tabung sentrifus
bertutup, ditambahkan 10 ml asetonitril dikocok dengan vortex selama 30 detik,
dan disentrifus dengan kecepatan 3000 rpm selama 10 menit. Supernatan
dipisahkan dari endapan. Diulangi perlakuan dengan asetonitril terhadap endapan.
Supernatan dipisahkan dari endapan dan digabungkan supernatan pertama.
Gabungan supernatan ditambahkan 1,5 g NaCl, dikocok dengan vortex selama 1
menit, dan disentrifus dengan kecepatan 3000 rpm selama 5 menit. Supernatan
dipisahkan dari endapan. Supernatan ditambahkan 5 ml n-heksana, dikocok
dengan vortex selama 30 detik, dan didiamkan sampai terpisah sempurna hingga
terbentuk 2 lapisan, yaitu lapisan n-heksan di bagian atas dan lapisan asetonitril di
hati-hati. Diulangi perlakuan dengan n-heksan. Lapisan asetonitril dikeringkan dengan
alat penguap. Ekstrak dilarutkan kembali dengan pelarut sampai 5 ml kemudian
disaring dengan penyaring nitrat selulosa 0,2 µ m, dan diawaudarakan selama 10
menit, kemudian diinjeksikan ke sistem KCKT menggunakan vial autosampler
dan dideteksi pada panjang gelombang maksimum yang diperoleh dengan
perbandingan fase gerak metanol-air (55:45) dan laju alir 1 ml/menit. Dilakukan
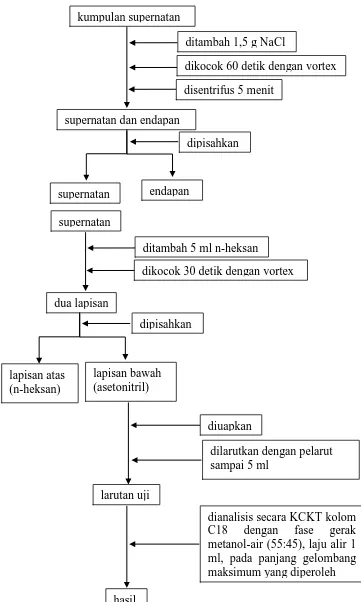
sebanyak 6 kali pengulangan untuk setiap sampel. Bagan penetapan kadar
kloramfenikol dalam sampel dapat dilihat pada Gambar 3.
5 gram telur yang telah disiapkan
ditambah 10 ml asetonitril
dikocok 30 detik dengan vortex
disentrifus 10 menit
supernatan dan endapan
supernatan endapan
ditambah 10 ml asetonitril
dikocok 30 detik dengan vortex
disentrifus 10 menit
supernatan dan endapan
supernatan endapan
Gambar 4. Bagan penetapan kadar kloramfenikol dalam sampel kumpulan supernatan
ditambah 1,5 g NaCl
dikocok 60 detik dengan vortex
disentrifus 5 menit
supernatan dan endapan
dipisahkan
supernatan endapan
ditambah 5 ml n-heksan
dikocok 30 detik dengan vortex
dua lapisan
lapisan atas (n-heksan)
lapisan bawah (asetonitril)
diuapkan
dilarutkan dengan pelarut sampai 5 ml
larutan uji
dianalisis secara KCKT kolom C18 dengan fase gerak metanol-air (55:45), laju alir 1 ml, pada panjang gelombang maksimum yang diperoleh
hasil supernatan
3.5.3.5 Analisis Data secara Statistik
Data dianalisis secara statistik menggunakan uji t pada tingkat
kepercayaan 95% dengan nilai α = 0,05. Data diterima jika – ttabel ≤ thitung ≤ ttabel.
Rumus yang digunakan untuk menghitung simpangan baku adalah:
1 )
( 2
− −
=
∑
n X X SD
Sedangkan untuk mendapatkan thitung digunakan rumus:
thitung
n SD
X X
/ − =
Keterangan :
SD = standard deviation (simpangan baku)
X = kadar kloramfenikol
X = kadar rerata kloramfenikol
n = jumlah perlakuan
Untuk menghitung kadar kloramfenikol dalam sampel secara statistik digunakan
rumus:
n SD x t X± = µ
Keterangan:
μ = kadar kloramfenikol
t = harga ttabel sesuai dengan derajat kepercayaan
3.5.4 Metode Validasi
3.5.4.1 Kecermatan (accuracy)
Menurut Harmita (2004), kecermatan adalah ukuran yang menunjukkan
derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan
Dalam hal ini persen perolehan kembali dilakukan dengan metode penambahan
baku (standard addition method). Dalam metode ini kadar kloramfenikol dalam
sampel ditentukan terlebih dahulu, selanjutnya dilakukan penentuan kadar
kloramfenikol dalam sampel setelah penambahan larutan standar 50%, 100%, dan
150%. Masing-masing dilakukan sebanyak 3 kali pengulangan kemudian
dianalisis dengan perlakuan yang sama seperti pada penetapan kadar sampel.
Persen perolehan kembali dapat dihitung dengan rumus:
% perolehan kembali = 100% *
) (
x C
C C
A A
F −
CF =kadar analit yang diperoleh setelah penambahan kloramfenikol baku
CA = kadar analit awal (sebelum ditambahkan kloramfenikol baku)
C*A = kadar kloramfenikol baku yang ditambahkan
(Data perolehan kembali dan perhitungan persen perolehan kembali dapat dilihat
pada Lampiran 21 dan 22).
3.5.4.2 Keseksamaan (precision)
Menurut Rohman (2007), presisi merupakan ukuran keterulangan metode
analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah
sampel yang berbeda signifikan secara statistik.
Untuk menghitung simpangan baku relatif digunakan rumus:
X SD x
RSD = 100
Sementara itu, nilai simpangan baku dihitung dengan menggunakan rumus:
(
)
( )
2
1 −
−
=
∑
n X X
SD
Keterangan:
RSD = relative standard deviation (simpangan baku relatif)
SD = standard deviation (simpangan baku)
X = kadar rerata kloramfenikol
X = kadar kloramfenikol
n = jumlah perlakuan
3.5.4.3 Penentuan Batas Deteksi dan Batas Kuantitasi
Menurut Epshtein (2004), batas deteksi (limit of detection /LOD) dan batas
kuantitasi (limit of quantitation/LOQ) dapat dihitung dengan menggunakan rumus sebagai berikut :
2 ) ( /
− −
=
∑
n Yi Y Sy x
S S x LOD=3,3 y /x
S S x LOQ=10 y /x
Keterangan:
x y
S / = simpangan baku residual
S = slope atau derajat kemiringan
BAB IV
HASIL DAN PEMBAHASAN
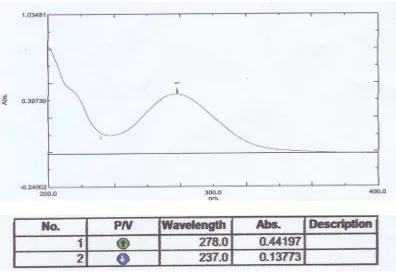
4.1 Penentuan Panjang Gelombang Maksimum Kloramfenikol
Panjang gelombang analisis ditentukan dengan membuat kurva serapan
kloramfenikol baku menggunakan spektrofotometer UV. Spektrum hasil
pengukuran kloramfenikol baku dapat dilihat pada Gambar 4.
Gambar 4. Kurva serapan kloramfenikol baku 15 µg/ml secara spektrofotometri UV Dari kurva serapan ini, diperoleh kesimpulan bahwa kloramfenikol
memberikan serapan maksimum pada panjang gelombang 278 nm. Panjang
gelombang yang diperoleh berbeda 8 nm dari prosedur menurut SNI 7541.1:2009
yang menyatakan bahwa kloramfenikol dalam sampel diidentifikasi pada panjang
gelombang 270 nm. Menurut Moffat et al (2005) dan Ditjen POM (1979),
kloramfenikol memberikan serapan maksimum pada panjang gelombang 278 nm.
[image:44.595.113.509.262.534.2]4.2 Penentuan Perbandingan Fase Gerak yang Optimum
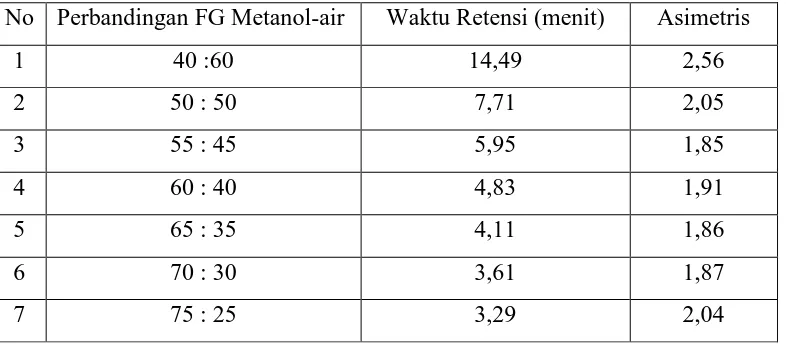
Pada orientasi dilakukan variasi perbandingan fase gerak metanol-air yaitu
(40 : 60), (50 : 50), (55 : 45), (60 : 40), (65 : 35), (70 : 30), dan (75 : 25) dengan
[image:45.595.117.510.227.399.2]laju alir 1 ml/menit. Kromatogram hasil optimasi dapat dilihat pada Lampiran 1.
Tabel 1. Hasil optimasi fase gerak dengan parameter data waktu tambat dan asimetris
Dari tabel di atas, dapat diamati bahwa semakin besar konsentrasi metanol
dalam fase gerak, maka waktu tambat akan semakin singkat. Namun, waktu
tambat yang singkat tidak selalu menjadi yang terbaik terutama untuk sampel
dalam matriks biologis. Hal ini dikarenakan sering muncul puncak-puncak lain
pada menit-menit awal yang akan mengganggu pengamatan.
Puncak kromatogram dalam kondisi ideal memperlihatkan bentuk
Gaussian dengan asimetris benilai 1. Bila asimetris lebih besar dari 1 maka
puncak akan berbentuk tailing, sehingga nilai asimetris yang terbaik adalah yang
mendekati 1. Berdasarkan kedua hal tersebut, maka dipilih perbandingan fase
gerak metanol-air (55:45) dengan waktu tambat 5,95 dan asimetris 1,85.
Kromatogram hasil penyuntikan kloramfenikol baku dengan perbandingan fase
gerak metanol-air (55:45) dapat dilihat pada Gambar 5.
No Perbandingan FG Metanol-air Waktu Retensi (menit) Asimetris
1 40 :60 14,49 2,56
2 50 : 50 7,71 2,05
3 55 : 45 5,95 1,85
4 60 : 40 4,83 1,91
5 65 : 35 4,11 1,86
6 70 : 30 3,61 1,87
Gambar 5. Kromatogram hasil penyuntikan larutan kloramfenikol baku dengan
perbandingan fase gerak metanol-air (55:45)
4.3 Penentuan Linieritas Kurva Kalibrasi Kloramfenikol Baku
Kurva kalibrasi kloramfenikol baku dibuat dengan konsentrasi yang
meningkat dimulai dari rentang konsentrasi 0,05; 0,1; 0,3; 0,5; 0,7; 0,9 dan 1,1
[image:46.595.123.507.84.336.2]µg/ml. Kurva kalibrasi dapat dilihat pada Gambar 6.
[image:46.595.114.490.506.718.2]Analisis secara kuantitatif ditentukan dari kurva kalibrasi kloramfenikol
baku berdasarkan luas puncak. Luas puncak digunakan karena kromatogram yang
diperoleh tidak simetris. Bila besaran puncak asimetri yang terjadi adalah : 0,8 >
SS > 1,2 maka penetapan kuantitatif berdasarkan tinggi puncak tidak boleh
dikerjakan, tetapi dilakukan penetapan kuantitatif berdasarkan luas puncak.
Dari kurva kalibrasi diperoleh hubungan yang linier antara luas area dan
konsentrasi dengan koefisien korelasi r = 0,9994. Koefisien korelasi yang
diperoleh ini masih dalam batas penerimaan nilai koefisien korelasi yaitu r =
0,995 (Moffat et al, 2005). Dari hasil perhitungan, diperoleh persamaan regresi
8297 , 1079 9059
,
17319 +
= X
Y . Salah satu kromatogram hasil penyuntikkan
[image:47.595.129.530.392.644.2]larutan kloramfenikol baku untuk kurva kalibrasi dapat dilihat pada Gambar 7.
Gambar 7. Kromatogram hasil penyuntikan larutan kloramfenikol baku 0,9µg/ml pada pembuatan kurva kalibrasi
(Perhitungan persamaan regresi dan koefisien korelasi dapat dilihat pada
3.3 Penetapan Kadar Kloramfenikol dalam Sampel
Dari hasil penyuntikan sampel diperoleh waktu tambat salah satu puncak
yaitu 6,09 menit. Waktu tambat ini berdekatan dengan waktu tambat
kloramfenikol baku yang dianalisis pada kondisi KCKT yang sama yaitu 5,95
menit. Meskipun waktu tambat yang ditunjukkan tidak sama persis, namun
puncak yang diamati dalam kromatogram sampel dapat diterima sebagai puncak
kloramfenikol karena waktu tambat 6,09 menit masih berada dalam rentang waktu
tambat yang dapat diterima yaitu ±5% dari waktu tambat puncak kloramfenikol
baku 5,95 menit (Weston and Brown, 1997). Kedua kromatogram hasil analisis
KCKT ini dapat dilihat pada gambar 8A dan 8B.
Untuk mempertegas identifikasi yang diperoleh, ditambahkan sedikit
larutan kloramfenikol baku ke dalam larutan sampel (spiking), lalu dianalisis pada
kondisi KCKT yang sama. Hasil analisis menunjukkan bahwa terjadi peningkatan
luas dan tinggi pada puncak kloramfenikol yang diamati sebelumnya. Jadi dapat
disimpulkan bahwa puncak yang diamati dalam larutan sampel adalah benar
merupakan puncak kloramfenikol. Kromatogram larutan sampel setelah spiking
(A)
(B)
(C)
[image:49.595.120.510.75.632.2]Hasil pengolahan data penetapan kadar kloramfenikol dalam sampel
secara KCKT menggunakan kolom C18 (250 mm x 4,60 mm) dengan
perbandingan fase gerak metanol-air (55:45), volume penyuntikan 10 µl, laju alir
1 ml/menit, detektor UV-Vis (L-2420) pada panjang gelombang 278 nm dapat
dilihat pada Lampiran 19. Kadar dapat dihitung dengan mensubtitusikan luas area
[image:50.595.114.512.281.452.2]pada Y dari persamaan regresi Y=17319,9059X +1079,8297
Tabel 2. Kadar rerata kloramfenikol dalam sampel
No. Lokasi pengambilan sampel Kadar kloramfenikol (µg/g)
1. Binjai 0,1937 ± 0,0275
2. Tandem 0,1709 ± 0,0304
3. Pantai Labu 0,1671 ± 0,0200
4. Marelan 0,0773 ± 0,0002
5. Kabanjahe 0,0752 ± 0,0043
3.4 Hasil Uji Validasi
Pada penelitian ini dilakukan uji validasi metode, dengan parameter
kecermatan (accuracy), keseksamaan (precision), batas deteksi (LOD) dan batas
kuantitasi (LOQ). Uji kecermatan dinyatakan dengan persen perolehan kembali
(% recovery) yang dilakukan dengan metode penambahan baku (standard
addition method). Uji keseksamaan dinyatakan dengan simpangan baku relatif
(RSD). Hasil perolehan kembali kloramfenikol dalam sampel dapat dilihat pada
Tabel 3.
Tabel 3. Data hasil uji validasi metode pemeriksaan residu kloramfenikol secara KCKT
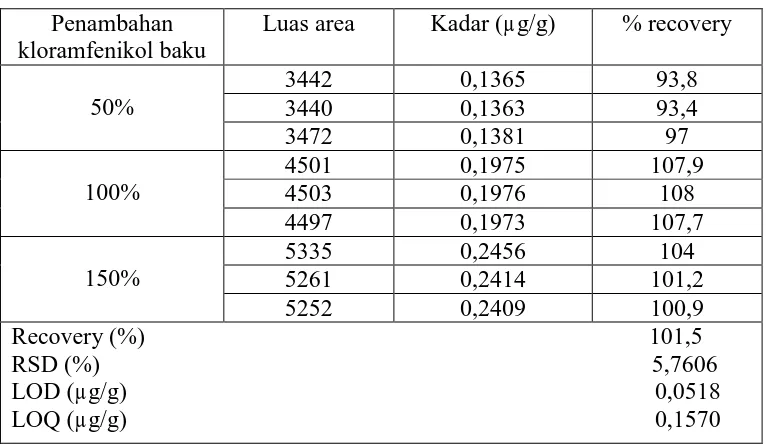
Dari data di atas diperoleh persen perolehan kembali (% recovery)
kloramfenikol sebesar 101,5%. Menurut Harmita (2004), rentang kesalahan yang
diijinkan dalam persen perolehan kembali untuk sampel dengan kadar analit
<1ppm adalah 80-110%.
Nilai simpangan baku relatif (RSD) yang diperoleh adalah 5,7606%.
Menurut Rohman (2007), nilai RSD yang dipersyaratkan untuk senyawa-senyawa
dengan kadar sekelumit berkisar antara 5-15%. Maka dapat disimpulkan bahwa
metode yang digunakan dalam penelitian ini mempunyai akurasi dan presisi yang
memenuhi syarat. Batas deteksi (LOD) dan batas kuantitasi (LOQ) yang diperoleh
dari penelitian ini sebesar 0,0518 µg/g dan 0,1570 µg/g. Kromatogram dan cara
perhitungan hasil perolehan kembali dapat dilihat pada Lampiran 21 dan 22. Penambahan
kloramfenikol baku
Luas area Kadar (µg/g) % recovery
50%
3442 0,1365 93,8
3440 0,1363 93,4
3472 0,1381 97
100%
4501 0,1975 107,9
4503 0,1976 108
4497 0,1973 107,7
150%
5335 0,2456 104
5261 0,2414 101,2
5252 0,2409 100,9
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Telur ayam dari lima lokasi yang diperiksa (Binjai, Tandem, Pantai Labu,
Marelan, dan Kabanjahe) ternyata mengandung residu kloramfenikol yang
melebihi persyaratan RSNI No. : 05 – TAN – 1996.
5.2 Saran
Disarankan agar dilakukan penelitian lebih lanjut terhadap penetapan
kadar antibiotik lain yang mungkin juga terdapat dalam telur ayam serta
Daftar Pustaka
Anonim. (2011). Antibiotik. [serial online] [12 April 2011].
Bahri, S. (2008). Beberapa Aspek Keamanan Pangan Asal Ternak di Indonesia. Balai Besar Penelitian Veteriner. Bogor.
Bahri, S., A. Kusumaningsih, T. B, Murdiati, A. Nurhadi, dan E. Masbulan. (2000). Analisis Kebijakan Keamanan Pangan Asal Ternak (terutama ayam ras petelur dan broiler). Laporan Penelitian. Pusat Penelitian dan Pengembangan Peternakan. Bogor.
Bliesner, D.M. (2006). Validating Chromatographic Methods A Practical Guide. John Wiley and Son, Inc. New Jersey. Halaman 1.
Botsoglov, N.A., Fletouris, D.J. (2000). Drug Residues In Food (Pharmacology, Food Safety, and Analysis). Aristotle University, Thessaloniki, Greece. Marcel Dekker, Inc, New York. Halaman 1.
Ditjen POM. (1979). Farmakope Indonesia. Edisi ketiga. Departemen Kesehatan RI. Jakarta. Halaman 144.
Ditjen POM. (1995). Farmakope Indonesia. Edisi keempat. Departemen Kesehatan RI. Jakarta. Halaman 189-190.
Epshtein, N.A. (2004). Validation of HPLC Techniques for Pharmaceutical Analysis. Pharmaceutical Chemistry Journal 38(4): 212-228.
Ermer, J. (2005). Analitical Validation within the Pharmaceutical Environment. Dalam: Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-VCH Verlag GmbH & Co. KgaA. Halaman 3-5.
Fadilah, R., Polana, A. (2005). Aneka Penyakit pada Ayam dan Cara Mengatasinya. Agromedia Pustaka. Jakarta. Halaman 33.
Foye, W.O. (1996). Prinsip - Prinsip Kimia Medisinal Jilid II Edisi Kedua. Penerjemah: Raslim Rasyid, dkk. Gajah Mada University Press. Yogyakarta. Halaman 1570.
Hadisahputra, S., U. Harahap. (1994). Biokimia Dan Farmakologi Antibiotik. USU Press. Medan. Halaman 38-39
Katzung, B.G. (2004). Farmakologi Dasar dan Klinik Buku 3 Edisi 8. Penerjemah dan editor: Bagian Farmakologi FK UNAIR. Penerbit Salemba Medika, Surabaya. Hlm 37-41.
Kazakevich, Y. and L. LoBrutto. (2007). Introduction. In: Kazakevich and L. LoBrutto (eds). HPLC for Pharmaceutical Scientists. New Jersey: John Wiley & Sons, Inc. Halaman 18-19.
Meyer, V.R. (2004). Practical High-Performance Liquid Chromatography. Chichester: John Wiley and Sons Inc. Halaman 4-8.
Moffat, A.C., M.D. Osselton, B. Widdop. (2005). Clarke’s Analysis of Drugs and Poisons. Pharmaceutical Press.
Panda, P.C. (1998). Text Book on Egg and Poultry Technology. Vikas Publishing House. Delhi (India). Halaman 18-20.
Rahayu, I. (2009). Prinsip Pengobatan. Universitas Muhammadyah Malang.
Riley, C.M. (1995). Modes of Chromatography. Dalam: High Performance Liquid Chromatography Fundamentals Principles and Practice. London. Halaman 36.
Ornaf, R.M. and M.W. Dong. (2005). Key Concepts of HPLC in Pharmaceutical Analysis. In: S. Ahuja and M.W. Dong (eds). Handbook of Pharmaceutical Analysis by HPLC. San Diego: Elsevier, Inc. Halaman 22-29.
Rohman, A. (2007). Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.
Setiabudy, R., Gan, V. H. 2007. Pengantar Antimikroba. Dalam: Farmakologi dan Terapi Edisi 5. Gaya Baru, Jakarta. Halaman 571-578.
RSNI No. : 05 – TAN. (1996). Batas Maksimum Cemaran Mikroba dan Batas Maksimum Residu dalam Bahan Makanan Asal Hewan.
Sudaryani, T. (2005). Kualitas Telur. Penebar Swadaya, Jakarta. Halaman 1,8.
SNI 7541.1. (2009). Metode Pengujian dengan Kromatografi Cair Kinerja Tinggi (KCKT) – Bagian 1 : Residu Kloramfenikol dalam Daging, Telur, Susu, dan Olahannya.
United States Pharmacopoeia. (2007). The National Formulary. 30th Edition .The United States Pharmacopoeial Convention. Halaman 1407.
Wattimena, J. R., (1991). Farmakodinami Dan Terapi Antibiotik. Gajah Mada University Press, Yogyakarta. Halaman 1, 187.
Lampiran 1. Kromatogram Penyuntikan Kloramfenikol Baku untuk Menentukan Perbandingan Fase Gerak yang Optimum
Perbandingan fase gerak metanol-air (40:60)
Perbandingan fase gerak metanol-air (55:45)
Perbandingan fase gerak metanol-air (65:35)
Lampiran 2. Kromatogram Penyuntikan Kloramfenikol Baku pada Pembuatan Kurva Kalibrasi
A
C
E
G
Lampiran 3. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Kloramfenikol
No X Y XY X2 Y2
1 0,05 2105 105,25 0,0025 4431025
2 0,1 2593 259,3 0,01 6723649
3 0,3 6455 1936,5 0,09 41667025
4 0,5 9872 4936 0,25 97456384
5 0,7 12733 8913,1 0,49 162129289
6 0,9 16743 15068,7 0,81 280328049
7 1,1 20272 22299,2 1,21 410953984
∑ 3,65 70773 53518,05 2,8625 1003689405
Rerata 0,5214 10110,4286
b aX
Y= +
( ) ( )( )
( )
X( )
X nn Y X XY a / / 2 2 − Σ Σ Σ Σ − Σ =
(
) ( )(
)
(
2,8625) ( )
3,65 /7 7 / 70773 65 , 3 05 , 53518 2 − − = 9593 , 0 9857 , 16614 = = 17319,9059 aX Yb= −
=10110,4286−
(
17319,9059)(
0,5214)
=1079,8297
Untuk mencari hubungan linier antara konsentrasi (X) dan luas area (Y), maka
dihitu