OPTIMASI FASE GERAK METANOL-AIR DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN TEOFILIN DAN EFEDRIN HCl DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
SKRIPSI
OLEH : PUTRI PRATIWI
NIM: 081524013
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
OPTIMASI FASE GERAK METANOL-AIR DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN TEOFILIN DAN EFEDRIN HCl DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
SKRIPSI
Diajukan untuk Melengkapi Salah Satu Syarat untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: PUTRI PRATIWI
NIM 081524013
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
Lembar Pengesahan Skripsi
OPTIMASI FASE GERAK METANOL-AIR DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN TEOFILIN DAN EFEDRIN HCl DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
OLEH:
PUTRI PRATIWI NIM 081524013
Dipertahankan dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal:
Disetujui oleh:
Pembimbing I, Panitia penguji,
Drs. Fathur Rahman Harun, M.Si., Apt. Dra. Nurmadjuzita, M.Si., Apt. NIP 195201041980031002 NIP 194809041974122001
Pembimbing II, Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195201041980031002
Prof. Dr. rer. nat. Effendy Delux Putra, SU, Apt. Drs. Salbiah, M.Si., Apt. NIP 195201041980031002 NIP 194810031987012001
Dra. Syafruddin, MS, Apt.
NIP 194811111976031003
Disahkan oleh: Dekan,
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah melimpahkan nikmat,
rahmat, karunia dan ridhoNya, sehingga penulis dapat menyelesaikan skripsi yang
berjudul “Optimasi Fase Gerak Metanol-Air dan Laju Alir pada Penetapan Kadar
Campuran Teofilin dan Efedrin HCl dalam Tablet dengan Metode Kromatografi
Cair Kinerja Tinggi (KCKT)”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara.
KCKT merupakan metode yang paling umum digunakan untuk penetapan
kadar campuran senyawa kimia. Tujuan penelitian ini adalah untuk mendapatkan
kondisi optimal metode KCKT dalam penetapan kadar campuran Teofilin dan Efedrin
HCl dalam tablet. Kombinasi obat ini sering digunakan untuk mengobati penyakit
asma bronkial. Hendaknya hasil penelitian ini menjadi metode alternatif bagi industri
farmasi pada penetapan kadar campuran Teofilin dan Efedrin HCl dalam tablet secara
KCKT.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Bapak Drs. Fathur Rahman Harun, M.Si., Apt., dan Prof. Dr. rer.
nat. Effendy Delux Putra, SU, Apt., yang telah membimbing dengan penuh
kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini
berlangsung. Ucapan terimakasih juga disampaikan kepada Dekan Fakultas
Farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio Hadisahputra, Apt., yang
telah memberikan bantuan dan fasilitas selama masa pendidikan.
Penulis juga mengucapkan terima kasih dan penghargaan yang tulus
kepada kedua orang tua, Ayahanda Punarto Wijaya (Alm) dan Ibunda Elita
Tanjung tercinta, serta abang dan adik atas doa, dorongan dan pengorbanan baik
moril maupun materil dalam penyelesaian skripsi ini.
Medan, Januari 2011
OPTIMASI FASE GERAK METANOL-AIR DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN TEOFILIN DAN EFEDRIN HCl
DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
ABSTRAK
Campuran teofilin dan efedrin HCl merupakan salah satu jenis kombinasi dalam sediaan tablet. Teofilin dan efedrin HCl adalah bronkodilator yang digunakan untuk meringankan gejala gangguan saluran pernapasan seperti asma bronkial. Penetapan kadar tablet campuran teofilin dan efedrin HCl tidak terdapat dalam monografi, baik pada Farmakope Indonesia edisi IV (1995) maupun USP (United States Pharmacopeia) edisi 30 (2007) sehingga diperlukan suatu metode analisis yang memenuhi uji validitas pada penetapan kadarnya. Metode yang dipilih yaitu Kromatografi Cair Kinerja Tinggi (KCKT) dan untuk mendapatkan hasil analisis yang baik, maka perlu dilakukan optimasi terhadap kondisi KCKT yang digunakan. Adapun optimasi yang dilakukan yaitu perbandingan fase gerak dan laju alir.
Analisis dilakukan dengan menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV-Vis pada panjang gelombang 257 nm. Kondisi kromatografi yang dioptimasi yaitu perbandingan fase gerak metanol-air dengan perbandingan 60:40, 70:30, dan 80:20. Dari hasil penelitian diperoleh perbandingan fase gerak yang terbaik adalah 60:40. Kemudian dengan perbandingan fase gerak yang terpilih dilakukan optimasi laju alir dari 0,5 ml/menit, 0,75 ml/menit, dan 1 ml/menit. Dari hasil optimasi diperoleh laju alir 0,75 ml/menit memberikan hasil yang terbaik dengan waktu retensi 3,55 menit untuk efedrin HCl dan 4,27 menit untuk teofilin; resolusi 2,53; theoretical plate 1944 untuk efedrin HCl dan 4762 untuk teofilin.
Dari hasil analisis penetapan kadar sampel campuran teofilin dan efedrin HCl dalam sediaan tablet menunjukkan semua sampel memenuhi persyaratan kadar umum untuk sediaan tablet. Hasil uji validasi yang dilakukan terhadap tablet Asthma Soho (PT. Soho Industri Pharmasi), untuk teofilin diperoleh persen recovery = 101,45%, simpangan baku relatif (RSD) = 1,25% dan untuk efedrin HCl diperoleh persen recovery = 101,30%, simpangan baku relatif (RSD) = 1,49%. Dapat disimpulkan bahwa metode KCKT yang digunakan memenuhi persyaratan akurasi dan presisi. Dengan batas deteksi (LOD) teofilin 12,6109 mcg/ml dan efedrin HCl 4,2622 mcg/ml. Batas kuantitasi (LOQ) teofilin 42,0366 mcg/ml dan efedrin HCl 14,2075 mcg/ml.
OPTIMIZATION OF METHANOL-WATER AS MOBILE PHASE AND FLOW RATE OF THE DETERMINATION OF THEOPHYLLINE AND EPHEDRINE HCl MIXTURE IN TABLETS HIGH PERFORMANCE
LIQUID CHROMATOGRAPHY METHOD ABSTRACT
The compound of theophylline and ephedrine HCl is one of combination in tablet supply. Theophylline and ephedrine HCl are bronchodilator used to minimize the symptoms of bronchial tube diseases such as bronchial asthma. Determination of content of theophylline and ephedrine HCl in tablet did not found in monography, either in the fourth edition Farmakope Indonesia (1995) or USP (United States Pharmacopeia) 30th edition (2007) that requires an analysis method that meets the test of validity in determining the content. Method of choice is High Performance Liquid Chromatography (HPLC) and in order to get best analysis, it apply the optimization to the HPLC condition. The optimization is conducted by different ratio of mobile phase and flow rate.
Analysis performed by used C18 colomn (250 mm x 4.60 mm), UV-Vis detector on wavelength 257 nm. Optimization is conducted to the ratio of mobile phase of methanol-water by ratio of 60:40, 70:30, and 80:20, respectively. Based on the results of research best mobile phase ratio is 60:40. And by ratio of choosen mobile phase, the optimization of flow rate is determine from 0.5 ml/minute, 0.75 ml/minute, and 1 ml/minute, respectively. Based on the optimization is indicated that the flow rate of 0.75 ml/minute provide the best results in the retention time is 3.55 minutes for ephedrine HCl and 4.27 minutes for theophylline; resolution 2.53; theoretical plate 1944 for ephedrine HCl and 4762 for theophylline.
Based on the results of analysis determine the sample content of theophylline and ephedrine HCl compound in tablet supply indicates that all of the sample fulfilled the general requirement of tablet. The results of validation test on the tablet of Asthma Soho (PT. Soho Industri Pharmacy), the percent recovery for theophylline is 101,45%, relative standard deviation (RSD) = 1,25% and for ephedrine HCl, the percent recovery = 101,30%, relative standard deviation (RSD) = 1,49%. It concluded that the applied HPLC method fulfill the requirement of accuracy and precision. By limit of detection (LOD) for theophylline is 12,6109 mcg/ml and ephedrine HCl 4,2622 mcg/ml. Limit of quantitation (LOQ) for theophylline is 42,0366 mcg/ml and for ephedrine HCl is 14,2075 mcg/ml.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Bahan ... 5
2.1.1 Teofilin ... 5
2.1.2 Efedrin HCl ... 6
2.2 Kromatografi Cair Kinerja Tinggi ... 7
2.3 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi ... 8
2.4 Parameter Kromatografi ... 8
2.4.1 Waktu Tambat (tR) ... 9
2.4.2 Faktor Kapasitas (k’) ... 9
2.4.3 Resolusi (Rs) ... 10
2.4.4 Selektifitas atau Faktor Pemisahan (α) ... 10
2.4.5 Faktor Tailing dan Faktor Asimetri ... 11
2.5 Komponen KCKT ... 13
2.5.1 Wadah Fase Gerak ... 13
2.5.2 Pompa ... 14
2.5.3 Injektor ... 14
2.5.4 Kolom ... 15
2.5.5 Detektor ... 16
2.5.6 Pengolah Data ... 16
2.5.7 Fase Gerak ... 16
2.6 Validasi... 17
BAB III METODOLOGI PENELITIAN... 19
3.1 Waktu dan Tempat Penelitian... 19
3.2 Alat-alat ... 19
3.3 Bahan-bahan ... 19
3.4 Pengambilan Sampel ... 19
3.5 Prosedur Penelitian ... 20
3.5.1 Uji Identifikasi Baku Teofilin dan Efedrin HCl Menggunakan Spektrofotometer FTIR ... 20
3.5.2 Penentuan Panjang Gelombang Maksimum ... 20
3.5.3 Penyiapan Bahan ... 21
3.5.3.1 Pembuatan Fase Gerak Metanol-Air ... 21
3.5.3.2 Pembuatan Pelarut ... 21
3.5.3.3 Pembuatan Larutan Induk Baku Teofilin ... 21
3.5.3.4 Pembuatan Larutan Induk Baku Efedrin HCl ... 22
3.5.4 Prosedur Analisis. ... 22
3.5.4.1 Penyiapan Alat KCKT ... 22
3.5.4.2 Penentuan Perbandingan Fase Gerak dan Laju Alir yang Optimum ... 22
3.5.4.3 Analisis Kualitatif ... 23
3.5.4.3.1 Uji Identifikasi Teofilin dan Efedrin HCl Menggunakan KCKT ... 23
3.5.4.4 Analisis Kuantitatif ... 23
3.5.4.4.2 Pembuatan Kurva Kalibrasi Efedrin HCl
BPFI ... 24
3.5.4.4.3 Penetapan Kadar Sampel ... 24
3.5.4.5 Analisa Data Penetapan Kadar Secara Statistik ... 25
3.5.5 Metode Validasi ... 26
3.5.5.1 Akurasi... 26
3.5.5.2 Presisi ... 27
3.5.5.3 Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) .... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Uji Identifikasi Menggunakan Spektrofotometer FTIR ... 28
4.2 Penentuan Kondisi Kromatografi Untuk Mendapatkan Hasil Analisis yang Optimum... 31
4.2.1 Penentuan Panjang Gelombang Maksimum ... 31
4.2.2 Penentuan Perbandingan Fase Gerak dan Laju Alir ... 34
4.3 Uji Identifikasi Teofilin dan Efedrin HCl Menggunakan KCKT ... 35
4.4 Penentuan Linieritas Kurva Kalibrasi ... 39
4.5 Penetapan Kadar Sampel ... 41
4.6 Hasil Uji Validasi ... 42
BAB V KESIMPULAN DAN SARAN... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Halaman
Tabel 1. Data Absorbansi dari Kurva Serapan Teofilin ... 32
Tabel 2. Data Absorbansi dari Kurva Serapan Efedrin HCl ... 33
Tabel 3. Hasil Optimasi Fase Gerak dan Laju Alir dengan Parameter Data Waktu Retensi, Theoretical Plate dan Resolusi ... 35
Tabel 4. Data Waktu Tambat dari Kromatogram Sampel... 39
Tabel 5. Data Hasil Penyuntikan Larutan Teofilin BPFI ... 39
Tabel 6. Data Hasil Penyuntikan Larutan Efedrin HCl BPFI ... 40
Tabel 7. Hasil Penetapan Kadar Teofilin dan Efedrin HCl dalam Sediaan Tablet ... 42
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Teofilin ... 5
Gambar 2. Struktur Efedrin Hidroklorida ... 6
Gambar 3. Kromatogram Hasil Analisis KCKT ... 9
Gambar 4. Bentuk Puncak Kromatogram ... 11
Gambar 5. Pengukuran Derajat Asimetris Puncak ... 11
Gambar 6. Diagram Skematik Alat KCKT ... 13
Gambar 7. Tipe Injektor Katup Putaran... 15
Gambar 8. Spektrum Inframerah Baku Teofilin PT. Indofarma ... 28
Gambar 9. Spektrum Inframerah Teofilin BPFI ... 29
Gambar 10. Spektrum Inframerah Baku Efedrin HCl PT. Kimia Farma ... 30
Gambar 11. Spektrum Inframerah Efedrin HCl BPFI ... 30
Gambar 12. Kurva Serapan Teofilin Baku 8 mcg/ml secara Spektrofotometri UV ... 32
Gambar 13. Kurva Serapan Efedrin HCl Baku 360 mcg/ml secara Spektrofotometri UV ... 33
Gambar 14. Kurva Serapan Teofilin Baku 8 mcg/ml dan Efedrin HCl 360 mcg/ml secara Spektrofotometri UV (Overlapping) ... 34
Gambar 15. Kromatogram Hasil Penyuntikan Larutan 500 mcg/ml Teofilin BPFI, dengan Perbandingan Metanol-Air (60:40), Laju Alir 0,75 ml/menit ... 36
Gambar 16. Kromatogram Hasil Penyuntikan Larutan 50 mcg/ml Efedrin HCl BPFI, dengan Perbandingan Metanol-Air (60:40), Laju Alir 0,75 ml/menit ... 36
Gambar 17. Kromatogram Hasil Penyuntikan Campuran Larutan Teofilin BPFI (500 mcg/ml) dan Larutan Efedrin HCl BPFI (50 mcg/ml), Fase Gerak Metanol-Air (60:40), Laju Alir 0,75 ml/menit dengan Rentang Intensitas Luas Area 0-1500 mV ... 37
0,75 ml/menit dengan Rentang Intensitas Luas Area 0-25
mV ... 38
Gambar 19. Kurva Kalibrasi Teofilin BPFI ... 40
Gambar 20. Kurva Kalibrasi Efedrin HCl BPFI... 41
Gambar 21. Alat KCKT (Hitachi) ... 47
Gambar 22. Vial Autosampler ... 47
Gambar 23. Sonifikator (Branson 1510) ... 48
Gambar 24. Pompa Vakum (Gast DO A-PG04-BN) dan alat penyaring fase gerak ... 48
Gambar 25. Spektrum Inframerah Teofilin (Literatur) ... 49
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Gambar alat KCKT dan vial Autosampler ... 47
Lampiran 2. Gambar Sonifikator (Branson 1510) dan Penyaring ... 48
Lampiran 3. Spektrum Inframerah Teofilin pada literatur Pharmaceutical
Sub stance (UV/IR) ... 49
Lampiran 4. Spektrum Inframerah Efedrin HCl pada literatur Pharmaceutical Sub stance (UV/IR) ... 50
Lampiran 5. Kromatogram Penyuntikan Teofilin dan Efedrin HCl Baku untuk Mencari Perbandingan Fase Gerak Metanol-Air dan Laju Alir yang Optimal untuk Analisis ... 51
Lampiran 6. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Teofilin .. 60
Lampiran 7. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi
(LOQ) Teofilin ... 61
Lampiran 8. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Efedrin HCl ... 62
Lampiran 9. Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi
(LOQ) Efedrin HCl ... 63
Lampiran 10. Kromatogram Hasil Penyuntikan dari Larutan Tablet Asmasolon (PT. Medifarma Laboratories, Inc)... 64
Lampiran 11. Analisis Data Statistik untuk Mencari Kadar Sebenarnya dari Penyuntikan Larutan Tablet Asmasolon (PT. Medifarma
Laboratories, Inc) ... 70
Lampiran 12. Kromatogram Hasil Penyuntikan dari Larutan Tablet Asthma Soho (PT. Soho Industri Pharmasi) ... 72
Lampiran 13. Analisis Data Statistik untuk Mencari Kadar Sebenarnya dari Penyuntikan Larutan Tablet Asthma Soho (PT. Soho Industri
Pharmasi) ... 78
Lampiran 14. Kromatogram Hasil Penyuntikan dari Larutan Tablet Neo
Napacin (PT. Konimex) ... 80
Lampiran 15. Analisis Data Statistik untuk Mencari Kadar Sebenarnya dari Penyuntikan Larutan Tablet Neo Napacin (PT. Konimex) ... 86
Lampiran 17. Kromatogram Hasil Penyuntikan dari Larutan Tablet Asthma Soho (PT. Soho Industri Pharmasi) dan Bahan Baku, pada Persen
Perolehan Kembali pada Rentang 80%, 100%, dan 120% ... 89
Lampiran 18. Contoh Perhitungan Persen Perolehan Kembali ... 98
Lampiran 19. Perhitungan Berat Sampel dari Lampiran 18 Setelah Penimbangan ... 100
Lampiran 20. Contoh Perhitungan Penimbangan Bahan Baku pada Persen Perolehan Kembali ... 102
Lampiran 21. Analisa Data Statistik Persen Perolehan Kembali pada Tablet Asthma Soho (PT. Soho Industri Pharmasi) ... . 103
Lampiran 22. Data Hasil Perolehan Kembali Teofilin dan Efedrin HCl pada Tablet Asthma Soho (PT. Soho Industri Pharmasi) ... 104
Lampiran 23. Contoh Perhitungan % Recovery dengan Metode Penambahan Bahan Baku (Standard Addition Method) dari Tablet Asthma Soho (PT. Soho Industri Pharmasi) ... . 105
Lampiran 24. Contoh Perhitungan Penimbangan Sampel ... . 106
Lampiran 25. Tabel Hasil Analisa Kadar Teofilin dan Efedrin HCl dalam Sampel ... . 107
Lampiran 26. Contoh Perhitungan untuk Mencari Kadar Teofilin dan Efedrin HCl ... . 109
Lampiran 27. Daftar Spesifikasi Sampel ... . 112
Lampiran 28. Sertifikat Pengujian Teofilin BPFI... . 113
Lampiran 29. Sertifikat Pengujian Efedrin HCl BPFI ... . 114
Lampiran 30. Sertifikat Bahan Baku Teofilin Pabrik dari PT. Indofarma ... 115
Lampiran 31. Sertifikat Bahan Baku Efedrin HCl Pabrik dari PT. Kimia Farma ... 116
OPTIMASI FASE GERAK METANOL-AIR DAN LAJU ALIR PADA PENETAPAN KADAR CAMPURAN TEOFILIN DAN EFEDRIN HCl
DALAM TABLET DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
ABSTRAK
Campuran teofilin dan efedrin HCl merupakan salah satu jenis kombinasi dalam sediaan tablet. Teofilin dan efedrin HCl adalah bronkodilator yang digunakan untuk meringankan gejala gangguan saluran pernapasan seperti asma bronkial. Penetapan kadar tablet campuran teofilin dan efedrin HCl tidak terdapat dalam monografi, baik pada Farmakope Indonesia edisi IV (1995) maupun USP (United States Pharmacopeia) edisi 30 (2007) sehingga diperlukan suatu metode analisis yang memenuhi uji validitas pada penetapan kadarnya. Metode yang dipilih yaitu Kromatografi Cair Kinerja Tinggi (KCKT) dan untuk mendapatkan hasil analisis yang baik, maka perlu dilakukan optimasi terhadap kondisi KCKT yang digunakan. Adapun optimasi yang dilakukan yaitu perbandingan fase gerak dan laju alir.
Analisis dilakukan dengan menggunakan kolom C18 (250 mm x 4,60 mm), detektor UV-Vis pada panjang gelombang 257 nm. Kondisi kromatografi yang dioptimasi yaitu perbandingan fase gerak metanol-air dengan perbandingan 60:40, 70:30, dan 80:20. Dari hasil penelitian diperoleh perbandingan fase gerak yang terbaik adalah 60:40. Kemudian dengan perbandingan fase gerak yang terpilih dilakukan optimasi laju alir dari 0,5 ml/menit, 0,75 ml/menit, dan 1 ml/menit. Dari hasil optimasi diperoleh laju alir 0,75 ml/menit memberikan hasil yang terbaik dengan waktu retensi 3,55 menit untuk efedrin HCl dan 4,27 menit untuk teofilin; resolusi 2,53; theoretical plate 1944 untuk efedrin HCl dan 4762 untuk teofilin.
Dari hasil analisis penetapan kadar sampel campuran teofilin dan efedrin HCl dalam sediaan tablet menunjukkan semua sampel memenuhi persyaratan kadar umum untuk sediaan tablet. Hasil uji validasi yang dilakukan terhadap tablet Asthma Soho (PT. Soho Industri Pharmasi), untuk teofilin diperoleh persen recovery = 101,45%, simpangan baku relatif (RSD) = 1,25% dan untuk efedrin HCl diperoleh persen recovery = 101,30%, simpangan baku relatif (RSD) = 1,49%. Dapat disimpulkan bahwa metode KCKT yang digunakan memenuhi persyaratan akurasi dan presisi. Dengan batas deteksi (LOD) teofilin 12,6109 mcg/ml dan efedrin HCl 4,2622 mcg/ml. Batas kuantitasi (LOQ) teofilin 42,0366 mcg/ml dan efedrin HCl 14,2075 mcg/ml.
OPTIMIZATION OF METHANOL-WATER AS MOBILE PHASE AND FLOW RATE OF THE DETERMINATION OF THEOPHYLLINE AND EPHEDRINE HCl MIXTURE IN TABLETS HIGH PERFORMANCE
LIQUID CHROMATOGRAPHY METHOD ABSTRACT
The compound of theophylline and ephedrine HCl is one of combination in tablet supply. Theophylline and ephedrine HCl are bronchodilator used to minimize the symptoms of bronchial tube diseases such as bronchial asthma. Determination of content of theophylline and ephedrine HCl in tablet did not found in monography, either in the fourth edition Farmakope Indonesia (1995) or USP (United States Pharmacopeia) 30th edition (2007) that requires an analysis method that meets the test of validity in determining the content. Method of choice is High Performance Liquid Chromatography (HPLC) and in order to get best analysis, it apply the optimization to the HPLC condition. The optimization is conducted by different ratio of mobile phase and flow rate.
Analysis performed by used C18 colomn (250 mm x 4.60 mm), UV-Vis detector on wavelength 257 nm. Optimization is conducted to the ratio of mobile phase of methanol-water by ratio of 60:40, 70:30, and 80:20, respectively. Based on the results of research best mobile phase ratio is 60:40. And by ratio of choosen mobile phase, the optimization of flow rate is determine from 0.5 ml/minute, 0.75 ml/minute, and 1 ml/minute, respectively. Based on the optimization is indicated that the flow rate of 0.75 ml/minute provide the best results in the retention time is 3.55 minutes for ephedrine HCl and 4.27 minutes for theophylline; resolution 2.53; theoretical plate 1944 for ephedrine HCl and 4762 for theophylline.
Based on the results of analysis determine the sample content of theophylline and ephedrine HCl compound in tablet supply indicates that all of the sample fulfilled the general requirement of tablet. The results of validation test on the tablet of Asthma Soho (PT. Soho Industri Pharmacy), the percent recovery for theophylline is 101,45%, relative standard deviation (RSD) = 1,25% and for ephedrine HCl, the percent recovery = 101,30%, relative standard deviation (RSD) = 1,49%. It concluded that the applied HPLC method fulfill the requirement of accuracy and precision. By limit of detection (LOD) for theophylline is 12,6109 mcg/ml and ephedrine HCl 4,2622 mcg/ml. Limit of quantitation (LOQ) for theophylline is 42,0366 mcg/ml and for ephedrine HCl is 14,2075 mcg/ml.
BAB I PENDAHULUAN 1.1Latar Belakang
Asma bronkial atau lebih populer dengan sebutan asma atau sesak napas,
telah dikenal luas di masyarakat. Salah satu obat yang digunakan dalam
pengobatan penyakit asma bronkial adalah kombinasi antara teofilin dan efedrin
HCl. Pada kombinasi obat tersebut, teofilin bekerja sebagai bronkodilator yang
berfungsi sebagai relaksasi langsung otot polos bronki. Sedangkan efedrin HCl
merupakan senyawa simpatomimetik dengan efek langsung dan tak langsung
terhadap α dan β-adrenoseptor. Karena sifat vasokonstriksinya, efedrin HCl
digunakan untuk bronkodilator, dekongestan hidung, dan dekongestan mata
(Siswandono dan Soekardjo, 1995).
Pada pembuatan obat, pemeriksaan kadar zat aktif merupakan persyaratan
yang harus dipenuhi untuk menjamin kualitas sediaan obat. Sediaan obat yang
berkualitas baik akan menunjang tercapainya efek terapeutik yang diharapkan.
Salah satu persyaratan mutu adalah kadar yang dikandung harus memenuhi
persyaratan kadar seperti yang tercantum dalam Farmakope Indonesia atau buku
standar lainnya (Depkes RI, 2009).
Tablet campuran teofilin dan efedrin HCl tidak terdapat pada monografi,
baik pada Farmakope Indonesia edisi IV (1995) maupun USP (United States
Pharmacopeia) edisi 30 (2007). Monografi dalam sediaan tablet dengan tiga
komponen yaitu teofilin, efedrin HCl, dan fenobarbital terdapat dalam USP edisi
30 (2007) yang penetapan kadarnya dapat ditentukan secara Kromatografi Cair
larutan dapar fosfat pH 3,0 ± 0,05 - metanol (75:25), laju alir (flow rate) 3,0
ml/menit, dan deteksi dilakukan pada panjang gelombang 215 nm.
Penggunaan dapar fosfat sebagai fase gerak dapat menyumbat kolom,
karena kelarutan dapar fosfat yang rendah dalam metanol dapat mengakibatkan
terbentuknya endapan fosfat di kolom, sehingga akan menyulitkan dalam
pembersihan kolom setelah analisis.
Analisis teofilin dan efedrin HCl dalam sediaan tablet secara KCKT sudah
pernah dilakukan oleh peneliti sebelumnya (Rizky, 2007), menggunakan sistem
kromatografi fase balik dengan kolom Zorbax C8, fase gerak metanol - air (40 :
60), laju alir 1 ml/menit, dan pada panjang gelombang 257 nm.
Berdasarkan hal tersebut diatas, maka peneliti mencoba memodifikasi
perbandingan fase gerak metanol-air untuk analisis kuantitatif campuran teofilin
dan efedrin HCl menggunakan kolom C18. Untuk mendapatkan hasil yang
optimal, perlu dilakukan optimasi terhadap perbandingan fase gerak dan laju
alirnya. Kemudian perbandingan fase gerak dan laju alir yang terpilih digunakan
untuk menetapkan kadar teofilin dan efedrin HCl dalam tablet.
Metode KCKT mempunyai beberapa keuntungan dibanding metode
analisis lain, diantaranya kolom dapat digunakan kembali, memiliki berbagai jenis
detektor, waktu analisis umumnya relatif singkat, ketepatan dan ketelitian relatif
tinggi serta dapat digunakan untuk menganalisis kebanyakan senyawa kimia
(Meyer, 2004).
Untuk menguji validitas dari metode ini dilakukan pengujian antara lain
variasi (RSD); uji sensitifitas dengan parameter limit deteksi (LOD) dan limit
kuantitasi (LOQ) (WHO, 1992).
1.2Perumusan Masalah
- Pada perbandingan dan laju alir berapakah fase gerak metanol-air dapat
memisahkan campuran teofilin dan efedrin HCl yang memenuhi kriteria
resolusi ≥ 1,5?
- Apakah kondisi optimal fase gerak yang diperoleh dapat digunakan untuk
menentukan kadar campuran teofilin dan efedrin HCl dalam tablet dengan
validasi metode yang memenuhi persyaratan?
1.3Hipotesis
- Perbandingan dan laju alir fase gerak metanol-air yang terpilih dapat
memisahkan campuran teofilin dan efedrin HCl yang memenuhi kriteria
resolusi ≥ 1,5.
- Kondisi optimal fase gerak yang diperoleh dapat digunakan untuk
menentukan kadar campuran teofilin dan efedrin HCl dalam tablet dengan
validasi metode yang memenuhi persyaratan.
1.4Tujuan Penelitian
- Melakukan optimasi fase gerak sehingga diperoleh perbandingan dan laju
alir metanol-air yang optimal untuk pemisahan campuran teofilin dan
efedrin HCl yang memenuhi kriteria resolusi ≥ 1,5.
- Menentukan kadar dan uji validasi campuran teofilin dan efedrin HCl
dalam tablet menggunakan metode KCKT pada kondisi optimal fase gerak
1.5Manfaat Penelitian
Sebagai metode alternatif bagi industri farmasi pada penetapan kadar
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Bahan
2.1.1 Teofilin
Rumus struktur :
NH
N N
CH3
O
N CH3
O
Gambar 1. Struktur Teofilin
Nama Kimia : 1,3-dimethyl-3,7-dihydro-1H-purine-2,6-dione
Rumus Molekul : C7H8N4O2.H2O
Berat Molekul : 180,17
Pemerian : Serbuk hablur, putih, tidak berbau, rasa pahit, stabil di
udara
Kelarutan : Sukar larut dalam air, tetapi lebih mudah larut dalam air
panas, mudah larut dalam larutan alkali hidroksida dan
dalam amonium hidroksida, agak sukar larut dalam etanol,
dalam kloroform dan dalam eter (Depkes RI, 1995).
Teofilin merupakan derivat xantin yang menyebabkan relaksasi otot polos,
terutama otot polos bronkus, serta merangsang otot jantung, dan meningkatkan
serangan asma yang berlangsung lama (status asmatikus). Selain itu, teofilin juga
digunakan sebagai profilaksis terhadap serangan asma (Ganiswara, 1995)
Teofilin mempunyai efek samping berupa mual dan muntah, baik pada
penggunaan oral maupun parenteral. Pada overdose terjadi efek sentral (gelisah,
sukar tidur, tremor dan konvulsi) serta gangguan pernafasan, juga efek
kardiovaskuler, seperti tachycardia, aritmia dan hipotensi (Tjay & Rahardja,
2007).
2.1.2 Efedrin Hidroklorida
Rumus Struktur :
Gambar 2. Struktur Efedrin Hidroklorida
Nama Kimia : (1R,2S)-2-(methylamino)-1-phenylpropan-1-ol
hydrochloride
Rumus Molekul : C10H15NO.HCl
Berat Molekul : 201,70
Pemerian : Serbuk atau hablur halus, putih, tidak berbau.
Kelarutan : Mudah larut dalam air, larut dalam etanol, tidak larut
dalam eter (Depkes RI, 1995).
Efedrin HCl merupakan simpatomimetik yang bekerja secara langsung dan
tidak langsung terhadap reseptor adrenergik. Obat ini juga meningkatkan tekanan
darah melalui peningkatan curah jantung dan juga menyebabkan vasokonstriksi
NH
CH3
.
HCl OHH
pembuluh darah tepi. Selain itu, efedrin juga bersifat bronkodilatasi, menurunkan
irama dan pergerakan usus, menurunkan aktivitas uterus serta merangsang pusat
napas (Sweetman, 2005)
Efek samping dari Efedrin HCl yaitu pada orang yang peka terhadap
Efedrin HCl, dalam dosis rendah sudah dapat menimbulkan gelisah, tremor, dan
gangguan berkemih. Sedangkan pada efek sentral yaitu insomnia yang sering
terjadi pengobatan kronik dan palpitasi (Tjay & Rahardja, 2007).
Saat ini, sangat banyak beredar produk obat yang mengandung kombinasi
dua atau lebih bahan aktif. Kombinasi tersebut dimaksudkan agar obat dapat lebih
efektif mencapai sasaran terapi. Salah satunya adalah kombinasi antara teofilin
dan efedrin HCl, yang digunakan untuk meringankan gejala gangguan saluran
pernapasan seperti asma bronkial, kejang bronkus dan alergi.
Asma bronkial atau lebih populer dengan sebutan asma atau sesak napas,
telah dikenal luas di masyarakat. Penyakit asma bronkial adalah penyakit saluran
pernapasan dengan ciri-ciri saluran pernapasan tersebut akan bersifat hipersensitif
(kepekaan yang luar biasa) atau hiperaktif (bereaksi yang berlebihan) terhadap
bermacam-macam rangsangan, yang ditandai dengan timbulnya penyempitan
saluran pernapasan bagian bawah secara luas, yang dapat berubah derajat
penyempitannnya menjadi normal kembali secara spontan dengan atau tanpa
pengobatan (Anonim, 2008).
2.2 Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi Cair Kinerja Tinggi (KCKT) merupakan sistem pemisahan
dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam
dan beragam sehingga mampu menganalisis berbagai cuplikan secara kualitatif
maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen
POM, 1995).
Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas
untuk analisis dan pemurnian senyawa tertentu dalam suatu sampel pada sejumlah
bidang, antara lain : farmasi, lingkungan, bioteknologi, polimer, dan
industri-industri makanan. KCKT biasanya dilakukan pada suhu kamar. Jadi, untuk zat –
zat yang labil pada pemanasan atau tidak menguap merupakan pilhan yang logis
(Rohman, 2007).
2.3 Jenis Pemisahan Kromatografi Cair Kinerja Tinggi
Berdasarkan jenis fase gerak dan fase diamnya, jenis pemisahan KCKT
dibedakan atas :
a. Kromatografi Fase Normal
Kromatografi dengan kolom yang fase diamnya bersifat polar, misalnya silika
gel, alumina, sedangkan fase geraknya bersifat non polar seperti heksan.
b. Kromatografi Fase Terbalik
Pada kromatografi fase terbalik, fase diamnya bersifat non polar, yang banyak
dipakai adalah oktadesilsilan (ODS atau C18) dan oktilsilan (C8). Sedangkan fase
geraknya bersifat polar, seperti air, metanol dan asetonitril (Mulja dan Suharman,
1995).
2.4 Parameter Kromatografi
Ada beberapa parameter kromatografi yang digunakan secara umum, yaitu :
Waktu tambat atau waktu retensi (tR) adalah selang waktu yang diperlukan
oleh linarut (solut) mulai saat injeksi sampai keluar dari kolom dan sinyalnya
ditangkap oleh detektor (Mulja dan Suharman, 1995). Waktu tambat suatu zat
selalu konstan pada kondisi kromatografi yang sama. Hal ini dijadikan suatu dasar
analisis kualitatif (Meyer, 2004).
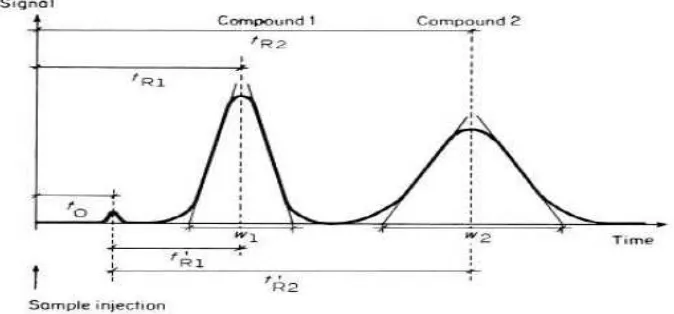
Gambar 3. Kromatogram hasil analisis KCKT. (sumber : Meyer, V.R. 2004).
Gambar 3 menunjukkan, w adalah lebar puncak dan t0 disebut waktu hampa (void
time/dead time) yaitu waktu tambat pelarut yang tidak tertahan atau waktu yang
dibutuhkan oleh fase gerak untuk melewati kolom (breakthrough time) (Meyer,
2004).
2.4.2 Faktor Kapasitas (k’)
Faktor kapasitas (k’) merupakan suatu ukuran seberapa jauh senyawa
tersebut berpartisi (mengadsorpsi) ke dalam fase diam dari fase gerak. Lamanya
waktu yang dibutuhkan suatu senyawa ditahan untuk melewati kolom bergantung
pada faktor kapasitasnya (Watson, 2009). Faktor kapasitas suatu komponen dapat
Keterangan :
t0 = waktu yang diperlukan bagi suatu molekul-takditahan untuk melewati volume
hampa
tr = waktu yang diperlukan analit untuk melewati kolom
2.4.3 Resolusi (Rs)
Resolusi didefinisikan sebagai perbedaan antara waktu retensi 2 puncak
yang saling berdekatan dibagi dengan rata-rata lebar puncak.
Nilai resolusi harus mendekati atau lebih dari 1,5 karena akan memberikan
pemisahan puncak yang baik (Rohman, 2007).
2.4.4 Selektifitas atau Faktor Pemisahan (α)
Selektifitas (α) adalah kemampuan sistem kromatografi untuk
membedakan analit yang berbeda. Selektifitas ditentukan sebagai rasio
perbandingan faktor kapasitas (k’) dari analit yang berbeda:
(Kazakevich, 2007).
Nilai selektifitas yang didapatkan dalam sistem KCKT harus lebih besar dari 1
(Ornaf dan Dong, 2005).
Faktor asimetri disebut juga “tailing factor (TF)” yaitu terjadinya
pengekoran pada kromatogram sehingga bentuk kromatogram menjadi tidak
simetris (Mulja dan Suharman, 1995). Idealnya, puncak kromatogram akan
memperlihatkan bentuk Gaussian dengan derajat simetris yang sempurna (Ornaf
and Dong, 2005). Namun kenyataannya, puncak yang simetris secara sempurna
jarang dijumpai. Jika diperhatikan secara cermat, maka hampir setiap puncak
dalam kromatografi memperlihatkan tailing. Pada Gambar 4 ditunjukkan tiga
jenis bentuk puncak.
Gambar 4. Bentuk puncak kromatogram. (sumber: Kazakevich, Y. 2007).
Pengukuran derajat asimetris puncak dapat dihitung dengan 2 cara, yakni faktor
tailing dan faktor asimetris. Faktor tailing (Tf) dihitung dengan menggunakan
lebar puncak pada ketinggian 5% (W0,05), rumusnya dituliskan sebagai berikut.
f W T
2 05 , 0 =
Dengan nilai f merupakan setengah lebar puncak pada ketinggian 5%.
Sedangkan faktor asimetri dapat dihitung dengan rumus sebagai berikut.
1 , 0
1 , 0 a b T =
Nilai a dan b dalam perhitungan faktor asimetri merupakan setengah lebar puncak
pada ketinggian 10%. Jika nilai T = 1, maka faktor tailing dan asimetri
menunjukkan bentuk puncak yang simetris sempurna. Bila puncak berbentuk
tailing, maka kedua faktor ini akan bernilai lebih besar dari 1 dan sebaliknya bila
puncak berbentuk fronting, maka faktor tailing dan asimetri akan bernilai lebih
kecil dari 1.
2.4.6 Efisiensi Kolom (N)
Efisiensi adalah ukuran tingkat penyebaran puncak dalam kolom. Efisiensi
kolom ditunjukk an dari jumlah lempeng teoritikal atau theoretical plates (N),
yang dapat dihitung dengan rumus:
Kolom yang efisien adalah kolom yang mampu menghasilkan pita sempit dan
memisahkan analit dengan baik. Nilai lempeng akan semakin tinggi jika ukuran
kolom semakin panjang, hal ini berarti proses pemisahan yang terjadi semakin
baik. Hubungan antara nilai lempeng dengan panjang kolom disebut sebagai nilai
HETP/High Equivalent of a Theoretical Plate (H). H dapat dihitung dengan
rumus:
N L H =
2.5 Komponen KCKT
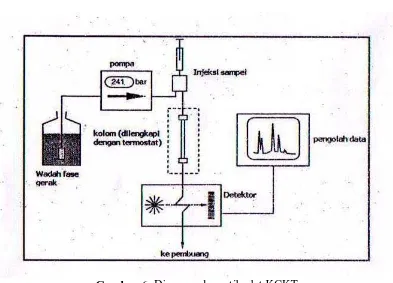
Gambar 6. Diagram skematik alat KCKT 2.5.1 Wadah Fase Gerak
Wadah fase gerak harus bersih dan lembam (inert) terhadap fase gerak.
Bahan yang umum digunakan adalah gelas dan baja anti karat. Daya tampung
tandon harus lebih besar dari 500 ml, yang dapat digunakan selama 4 jam untuk
kecepatan alir yang umumnya 1-2 ml/menit (Munson, 1991).
Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan
gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan
komponen lain terutama di pompa dan detektor sehingga akan mengacaukan
analisis. Oleh karena itu, fase gerak sebelum digunakan harus disaring terlebih
dahulu dengan penyaring mikrometer untuk menghindari partikel-partikel kecil
(Rohman, 2009).
Pompa yang cocok digunakan untuk KCKT adalah pompa yang
mempunyai syarat sebagaimana syarat wadah pelarut yakni : pompa harus inert
terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja
tahan karat, teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu
memberikan tekanan sampai 6000 psi dan mampu mengalirkan fase gerak dengan
kecepatan alir 0,1-10 ml/menit. Aliran pelarut dari pompa harus tanpa denyut
untuk menghindari hasil yang menyimpang pada detektor (Putra, 2007).
2.5.3 Injektor
Ada 3 jenis macam injektor, yakni syringe injector, loop valve dan automatic
injector (autosampler). Syringe injector merupakan bentuk injektor yang paling
sederhana (Meyer, 2004).
Pada waktu sampel diinjeksikan ke dalam kolom, diharapkan agar aliran
pelarut tidak mengganggu masuknya keseluruhan sampel ke dalam kolom.
Sampel dapat langsung diinjeksikan ke dalam kolom (on column injection) atau
digunakan katup injeksi (Adnan, 1997).
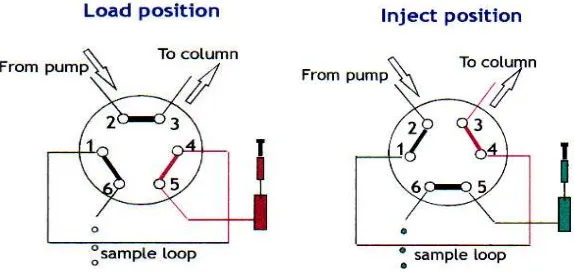
Katup putaran (loop valve) ditunjukkan secara skematik dalam Gambar 8,
tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar
daripada 10 µ l dan sekarang digunakan dengan cara otomatis (dengan adaptor
khusus, volume-volume lebih kecil dapat diinjeksikan secara manual). Pada posisi
LOAD, sampel loop (cuplikan dalam putaran) diisi pada tekanan atmosfir. Bila
katup difungsikan, maka cuplikan di dalam putaran akan bergerak ke dalam
Gambar 7. Tipe injektor katup putaran
Automatic injector atau disebut juga autosampler memiliki prinsip yang mirip,
hanya saja sistem penyuntikannya bekerja secara otomatis (Meyer, 2004).
2.5.4 Kolom
Kolom adalah jantung kromatografi. Berhasil atau gagalnya suatu analisis
tergantung pada pemilihan kolom dan kondisi percobaan yang sesuai. Kolom
dapat dibagi menjadi dua kelompok :
a. Kolom analitik : diameter khas adalah 2 – 6 nm. Panjang kolom
tergantung pada jenis kemasan. Untuk kemasan pellikular, panjang yang
umumnya adalah 50 – 100 cm. Untuk kemasan poros mikropartikulat,
umumnya 10 – 30 cm. Dewasa ini ada yang 5 cm.
b. Kolom preparatif : umumnya memiliki diameter 6 mm atau lebih besar
dan panjang kolom 25 – 100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada
temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama
untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom
tergantung pada mode KCKT yang digunakan. (Putra, 2007).
Suatu detektor dibutuhkan untuk mendeteksi adanya komponen cuplikan
dalam aliran yang keluar dari kolom. Detektor-detektor yang baik memiliki
sensitifitas yang tinggi, gangguan (noise) yang rendah, kisar respons linier yang
luas, dan memberi tanggapan/respon untuk semua tipe senyawa. Suatu kepekaan
yang rendah terhadap aliran dan fluktuasi temperatur sangat diinginkan, tetapi
tidak selalu dapat diperoleh (Putra, 2007).
Beberapa detektor yang paling sering digunakan dalam KCKT adalah
detektor spektrofotometri UV-Vis, photodiode-array (PDA), fluoresensi, indeks
bias dan detektor elektrokimia (Rohman, 2007).
2.5.6 Pengolah Data
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai
puncak-puncak yang secara keseluruhan disebut sebagai kromatogram. Alat pengumpul
data seperti komputer, integrator dan rekorder dihubungkan ke detektor. Alat ini
akan mengukur sinyal elektronik yang dihasilkan oleh detektor dan
memplotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi
oleh seorang analis (Rohman, 2007).
2.5.7 Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat
bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase
diam, dan sifat komponen-komponen sampel (Rohman, 2007)
Elusi Gradien dan Isokratik
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam
atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap
selama elusi).
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase
gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi
fase gerak berubah-ubah selama elusi). Elusi bergradien digunakan untuk
meningkatkan resolusi campuran yang kompleks terutama jika sampel
mempunyai kisaran polaritas yang luas (Rohman, 2009).
2.6 Validasi
Validasi adalah suatu tindakan terhadap parameter tertentu pada prosedur
penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi
persyaratan untuk penggunaannya (WHO, 1992).
Validasi metode menurut United States Pharmacopeia (USP) dilakukan
untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan
pada kisaran analit yang akan dianalisis. Suatu metode analis harus divalidasi
untuk verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk
mengatasi masalah dalam analisis. Parameter analisis yang ditentukan pada
validasi adalah akurasi, presisi, batas deteksi, batas kuantitasi, spesifikasi,
linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness).
Akurasi/kecermatan adalah kedekatan antara nilai hasil uji yang diperoleh
lewat metode analitik dengan nilai sebenarnya. Akurasi dinyatakan dalam persen
perolehan kembali (%recovery). Akurasi dapat ditentukan dengan dua metode, yakni
spiked-placebo recovery dan standard addition method. Pada spiked placebo recovery
atau metode simulasi, analit murni ditambahkan (spiked) ke dalam campuran bahan
analisis dibandingkan dengan jumlah analit teoritis yang diharapkan. Jika plasebo
tidak memungkinkan untuk disiapkan, maka sejumlah analit yang telah diketahui
konsentrasinya dapat ditambahkan langsung ke dalam sediaan farmasi. Metode ini
dinamakan standard addition method atau metode penambahan baku (Harmita, 2004)
Presisi merupakan ukuran kedekatan antar serangkaian hasil analisis yang
diperoleh dari beberapa kali pengukuran pada sampel homogen yang sama.
Biasanya diekspresikan sebagai relatif standar deviasi (RSD) dari sejumlah
sampel yang berbeda secara signifikan secara statistik.
Batas deteksi (limit of detection, LOD) didefinisikan sebagai konsentrasi
analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu
dapat dikuantifikasi.
Batas kuantitasi (limit of quantitation, LOQ) didefinisikan sebagai
konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi
dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan
BAB III
METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Penelitian Fakultas Farmasi
Universitas Sumatera Utara pada bulan Juli sampai September 2010.
3.2Alat-Alat
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat
instrumen KCKT lengkap (Hitachi) dengan pompa (L-2130), degasser (DGU 20
AS), injektor Autosampler L-2200, kolom Luna 5u C18 (250 mm x 4,60 mm),
detektor UV-Vis L-2420, wadah fase gerak, vial khusus Autosampler, Sonifikator
(Branson 1510), pompa vakum (Gast DOA - P604 – BN), neraca analitik (mettler
Toledo), membran filter PTFE 0,5 µm dan 0,2 µm, cellulose nitrat membran filter
0,45 µm, Spektrofotometer FTIR (Shimadzu IR Prestige-21), DRS 8000 ( Diffuse
Reflecttance measuring), Spektrofotometer UV-Vis (Shimadzu Mini 1240).
3.3Bahan-Bahan
Bahan-bahan yang digunakan dalam penelitian yaitu metanol HPLC
Solvent (Baker Analyzed®), aquabidestilata (PT. Ikapharmindo Putramas),
Teofilin dan Efedrin HCl BPFI (Badan POM RI), Teofilin baku pabrik (PT.
Indofarma), Efedrin HCl baku pabrik (PT. Kimia Farma), tablet Asmasolon (PT.
Medifarma Laboratories, Inc), tablet Asthma-Soho (PT. Soho Industri Pharmasi),
tablet Neo Napacin (PT. Konimex).
3.4 Pengambilan Sampel
Pengambilan sampel secara purposif yaitu tanpa membandingkan antara
dianggap homogen. Sampel yang digunakan adalah tablet Asmasolon (PT.
Medifarma Laboratories, Inc), tablet Asthma-Soho (PT. Soho Industri Pharmasi),
tablet Neo Napacin (PT. Konimex).
3.5 Prosedur Penelitian
3.5.1 Uji Identifikasi Baku Teofilin dan Efedrin HCl Menggunakan Spektrofotometer FTIR
Uji identifikasi baku Teofilin dan Efedrin HCl dapat dilakukan dengan
menggunakan spektrofotometer FTIR, yaitu dengan cara : masing-masing
ditimbang 10 mg, lalu dicampur dengan 100 mg serbuk KBr dalam lumpang,
digerus hingga halus dan homogen, masing-masing campuran tersebut diletakkan
pada sampel pan kemudian dipasangkan pada DRS 8000 dan dianalisa pada
bilangan gelombang 4000-500 cm-1.
3.5.2 Penentuan Panjang Gelombang Maksimum
Sejumlah lebih kurang 25 mg bahan baku Teofilin ditimbang seksama,
dimasukkan kedalam labu tentukur 50 ml, dilarutkan dengan metanol lalu
dicukupkan sampai garis tanda dengan metanol dan dikocok homogen, sehingga
diperoleh larutan dengan konsentrasi 500 mcg/ml, larutan induk baku I (LIB I).
Dipipet sebanyak 10 ml LIB I, dimasukkan ke dalam labu tentukur 50 ml,
dilarutkan dengan metanol lalu dicukupkan sampai garis tanda dengan metanol
dan dikocok homogen, sehingga diperoleh larutan dengan konsentrasi 100
mcg/ml, larutan induk baku II (LIB II).
Sejumlah lebih kurang 50 mg bahan baku Efedrin HCl ditimbang
seksama, dimasukkan kedalam labu tentukur 25 ml, dilarutkan dengan metanol
sehingga diperoleh larutan dengan konsentrasi 2000 mcg/ml, larutan induk baku
I (LIB I).
Kemudian dipipet sebanyak 4,0 ml LIB II Teofilin, dimasukkan ke dalam
labu tentukur 50 ml, dilarutkan dengan metanol lalu dicukupkan sampai garis
tanda dengan metanol dan dikocok homogen, sehingga diperoleh larutan dengan
konsentrasi 8,0 mcg/ml. Dan dipipet sebanyak 4,5 ml LIB I Efedrin HCl,
dimasukkan ke dalam labu tentukur 25 ml, dilarutkan dengan metanol lalu
dicukupkan sampai garis tanda dengan metanol dan dikocok homogen, sehingga
diperoleh larutan dengan konsentrasi 360 mcg/ml. Masing-masing larutan diukur
serapan pada panjang gelombang 200-400 nm.
3.5.3 Penyiapan Bahan
3.5.3.1 Pembuatan Fase Gerak Metanol - Air
Metanol 500 ml disaring dengan menggunakan membran filter PTFE 0,5
µ m dan diawaudarakan selama 20 menit.
Aquabidestilata 500 ml disaring dengan menggunakan cellulose nitrat
membran filter 0,45 µm dan diawaudarakan selama 20 menit.
3.5.3.2 Pembuatan Pelarut
Dicampur larutan metanol dan aquabidestilata dengan perbandingan yang
sama seperti perbandingan fase gerak hasil optimasi. Pelarut lalu disaring dengan
penyaring membran filter PTFE 0,2 µm dan diawaudarakan selama ± 20 menit.
3.5.3.3 Pembuatan Larutan Induk Baku Teofilin
Sejumlah lebih kurang 50 mg Baku Pembanding Teofilin ditimbang
larut, lalu dicukupkan sampai garis tanda dengan pelarut dan dikocok hingga
homogen, sehingga diperoleh larutan dengan konsentrasi 1000 mcg/ml (LIB).
3.5.3.4 Pembuatan Larutan Induk Baku Efedrin HCl
Sejumlah lebih kurang 25 mg Baku Pembanding Efedrin HCl ditimbang
seksama, dimasukkan kedalam labu tentukur 50 ml, ditambah pelarut aduk hingga
larut, lalu dicukupkan sampai garis tanda dengan pelarut dan dikocok hingga
homogen, sehingga diperoleh larutan dengan konsentrasi 500 mcg/ml (LIB).
3.5.4 Prosedur Analisis
3.5.4.1 Penyiapan Alat Kromatografi Cair Kinerja Tinggi
Masing-masing unit diatur, kolom yang digunakan C18 (250 mm x 4,60
mm), detektor UV-Vis pada panjang gelombang analisis yang diperoleh dengan
sensitifitas 1,000 AUFS. Pompa menggunakan mode aliran tetap dengan sistem
elusi gradien.
Setelah alat KCKT dihidupkan, maka pompa dijalankan dan fase gerak
dibiarkan mengalir selama 30 menit sampai diperoleh garis alas yang datar,
menandakan sistem tersebut telah stabil.
3.5.4.2 Penentuan Perbandingan Fase Gerak dan Laju Alir yang Optimum
Dipipet 5,0 ml Larutan Induk Baku Teofilin dan 1,0 ml Larutan Induk
Baku Efedrin HCl masukkan dalam labu tentukur 10 ml, dicukupkan dengan
pelarut hingga garis tanda, kocok sehingga diperoleh larutan Teofilin dengan
konsentrasi 500 mcg/ml dan Efedrin HCl dengan konsentrasi 50 mcg/ml, disaring
dengan membran filter PTFE 0,2 µm, kemudian diinjeksikan ke dalam sistem
KCKT menggunakan vial autosampler sebanyak 10 µl, menggunakan fase gerak
alir 0,5 ml/menit, 0,75 ml/menit, dan 1,0 ml/menit, dan dideteksi pada panjang
gelombang 257 nm. Kemudian dipilih perbandingan fase gerak dan laju alir yang
memberikan data yang terbaik.
3.5.4.3 Analisis Kualitatif
3.5.4.3.1 Uji Identifikasi Teofilin-Efedrin HCl Menggunakan KCKT
Larutan Induk Baku Teofilin dipipet 5,0 ml masukkan dalam labu tentukur
10 ml, dicukupkan dengan pelarut hingga garis tanda, dikocok sehingga diperoleh
larutan Teofilin dengan konsentrasi 500 mcg/ml.
Larutan Induk Baku Efedrin HCl dipipet 1,0 ml masukkan dalam labu
tentukur 10 ml, dicukupkan dengan pelarut hingga garis tanda, dikocok sehingga
diperoleh larutan Efedrin HCl dengan konsentrasi 50 mcg/ml.
Masing-masing larutan disaring dengan membran filter PTFE 0,2 µ m dan
diawaudarakan selama 5 menit, diinjeksikan ke dalam sistem KCKT
menggunakan vial autosampler sebanyak 10 µ l, menggunakan perbandingan fase
gerak dan laju alir yang memberikan pemisahan yang terbaik, kemudian dicatat
masing-masing waktu tambatnya. Kemudian waktu tambat Teofilin dan Efedrin
HCl BPFI dibandingkan dengan waktu tambat masing-masing sampel. Apabila
waktu tambat sampel hampir sama dengan waktu tambat BPFI, maka sampel
mengandung Teofilin dan Efedrin HCl.
3.5.4.4 Analisis Kuantitatif
3.5.4.4.1 Pembuatan Kurva Kalibrasi Teofilin BPFI
Larutan Induk Baku Teofilin dipipet sebanyak 3,5 ml, 4,0 ml, 4,5 ml, 5,0
ml, 5,5 ml, dan 6,0 ml, dimasukkan dalam labu tentukur 10 ml, diencerkan dengan
400 mcg/ml, 450 mcg/ml, 500 mcg/ml, 550 mcg/ml, dan 600 mcg/ml. Kemudian
masing-masing larutan disaring dengan membran filter PTFE 0,2 µm, dan
diinjeksikan kesistem KCKT menggunakan vial autosampler sebanyak 10 µ l
dideteksi pada panjang gelombang 257 nm. Selanjutnya dari luas area yang
diperoleh pada kromatogram dibuat kurva kalibrasi dihitung persamaan garis
regresi dan faktor korelasinya.
3.5.4.4.2 Pembuatan Kurva Kalibrasi Efedrin HCl BPFI
Larutan Induk Baku Efedrin HCl dipipet sebanyak 1,5 ml, 2,0 ml, 2,5 ml,
3,0 ml, 3,5 ml, dan 4,0 ml, dimasukkan dalam labu tentukur 25 ml, diencerkan
dengan pelarut hingga garis tanda. Kocok sehingga diperoleh konsentrasi 30
mcg/ml, 40 mcg/ml, 50 mcg/ml, 60 mcg/ml, 70 mcg/ml, dan 80 mcg/ml.
Kemudian masing-masing larutan disaring dengan membran filter PTFE 0,2 µm,
dan diinjeksikan kesistem KCKT menggunakan vial autosampler sebanyak 10 µ l
dideteksi pada panjang gelombang 257 nm. Selanjutnya dari luas area yang
diperoleh pada kromatogram dibuat kurva kalibrasi dihitung persamaan garis
regresi dan faktor korelasinya.
3.5.4.4.3 Penetapan Kadar Sampel
Ditimbang 20 tablet mengandung Teofilin dan Efedrin HCl kemudian
digerus, ditimbang sejumlah serbuk tablet setara dengan 130 mg Teofilin dan 12,5
mg Efedrin HCl (sebanyak 6 kali pengulangan). Masing-masing dimasukkan
kedalam labu tentukur 50 ml, dilarutkan dengan pelarut, diencerkan dengan
pelarut sampai garis tanda, hingga diperoleh larutan dengan konsentrasi 2600
mcg/ml Teofilin dan 250 mcg/ml Efedrin HCl, kemudian saring dengan kertas
2,0 ml dimasukkan kedalam labu tentukur 10 ml, diencerkan dengan pelarut
sampai garis tanda, sehingga diperoleh larutan dengan konsentrasi 520 mcg/ml
Teofilin dan 50 mcg/ml Efedrin HCl. Masing-masing larutan tersebut disaring
dengan membran filter PTFE 0,2 µ m dan diawaudarakan selama 5 menit,
kemudian diinjeksikan sebanyak 10 µ l kesistem KCKT menggunakan vial
autosampler dan dideteksi pada panjang gelombang 257 nm dengan laju alir
terpilih kemudian hitung kadarnya.
Kadar dapat dihitung dengan mensubtitusikan luas area sampel pada Y
dari persamaan regresi : Y = aX + b.
3.5.4.5 Analisis Data Penetapan Kadar Secara Statistik
Data perhitungan kadar dianalisis secara statistik menggunakan uji t.
Rumus yang digunakan untuk menghitung Standar Deviasi (SD) adalah :
1 )
( 2
− − =
∑
n X X SD
Kadar dapat dihitung dengan persamaan garis regresi dan untuk
menentukan data diterima atau ditolak digunakan rumus:
t hitung
n SD
X X
/ − =
Dengan dasar penolakan apabila t hitung ≥ t tabel, pada interval kepercayaan 99%
dengan nilai α = 0,01, dk = n-1.
Keterangan :
SD = Standard deviation/simpangan baku X = Kadar dalam satu perlakuan
Untuk mencari kadar sebenarnya dapat digunakan rumus:
n SD x t
X (1 1/2α)dk
µ= ± −
Keterangan:
μ = Kadar sebenarnya
X = Kadar sampel
n = Jumlah perlakuan
t = Harga ttabel sesuai dengan derajat kepercayaan
dk= Derajad kebebasan.
3.5.5 Metode Validasi 3.5.5.1 Akurasi
Akurasi dinyatakan sebagai persen perolehan kembali dalam kaitannya
dengan jumlah analit yang ditambahkan kedalam sampel, atau sebagai perbedaan
antara jumlah yang diketahui dan jumlah yang ditentukan oleh analis. Uji akurasi
dengan parameter persen perolehan kembali dilakukan dengan membuat 3
konsentrasi analit dengan rentang spesifik 80%, 100%, dan 120%, masing-masing
dengan 3 replikasi dan setiap rentang spesifik mengandung 70% analit dan 30%
bahan baku, kemudian dianalisa dengan perlakuan yang sama seperti pada
penetapan kadar sampel. Persen perolehan kembali dapat dihitung dengan rumus:
% Perolehan kembali x100%
C B A−
=
Keterangan :
A = Konsentrasi sampel yang diperoleh setelah penambahan bahan baku
B = Konsentrasi sampel sebelum penambahan bahan baku
3.5.5.2 Presisi
Menurut Rohman (2009), presisi merupakan ukuran kedekatan antar
serangkaian hasil analisis yang diperoleh dari beberapa kali pengukuran pada
sampel homogen yang sama.
Presisi seringkali dinyatakan dengan Standar Deviasi Relative (RSD) dari
serangkaian data. Nilai RSD dirumuskan dengan :
% 100
x X SD RSD=
Keterangan:
RSD = Standar Deviasi Relatif (%)
SD = Standar deviasi
X = Kadar rata-rata sampel
3.5.5.3 Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Menurut Miller (2005), Batas Deteksi (Limit Of Detection /LOD) dan Batas
Kuantitasi (Limit Of Quantitation/LOQ) dapat dihitung dengan menggunakan rumus
sebagai berikut :
2 )
( 2
− − =
∑
n Yi Y SY
S SY x LOD=3,3
S SY x LOQ=10
Keterangan:
SY = simpangan baku residual
BAB IV
HASIL DAN PEMBAHASAN
4.1 Uji Identifikasi Menggunakan Spektrofotometer FTIR
Baku Teofilin dan Efedrin HCl yang diperoleh dari PT. Indofarma dan PT.
Kimia Farma sebelum digunakan sebagai baku pembanding terlebih dahulu
diidentifikasi menggunakan Spektrofotometer FTIR pada rentang bilangan
gelombang 4000 – 500 cm-1.
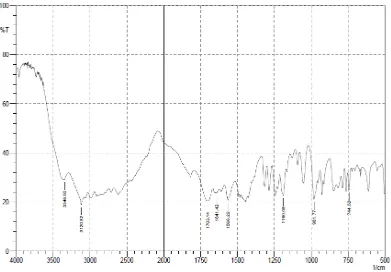
Spektrum Inframerah Baku Teofilin PT. Indofarma dan Teofilin BPFI dapat
[image:44.595.115.497.370.634.2]dilihat pada gambar bawah ini :
Gambar 2. Spektrum Inframerah Teofilin BPFI
Dari hasil pengukuran diperoleh bentuk spektrum Baku Teofilin hampir
sama dengan bentuk spektrum Teofilin BPFI. Pada daerah sidik jari diperoleh data
bilangan gelombang Baku Teofilin yang hampir sama dengan bilangan
gelombang yang terdapat di dalam literatur dan bilangan gelombang Teofilin
BPFI seperti pada tabel di bawah ini.
Nama Data Peak (cm-1)
Clarke’s 1670 1717 1567 745 980 1190
Teofilin BPFI 1641.42 1703.14 1566.2 744.52 981.77 1190.08 Teofilin Baku
PT. Indofarma 1651.07 1705.07 1568.13 742.59 979.84 1190.08
Pada daerah gugus fungsi terdapat bilangan gelombang 3344,57 cm-1,ini
menunjukkan adanya gugus amin sekunder, dan pada daerah sidik jari terdapat
bilangan gelombang 1705,07 cm-1 yang menunjukkan adanya gugus karbonil
(C=O). Dari data spektrum yang diperoleh dapat diambil kesimpulan bahwa baku
Spektrum Inframerah Baku Efedrin HCl PT. Kimia Farma dan Efedrin HCl BPFI
[image:46.595.122.506.151.415.2]dapat dilihat pada gambar bawah ini :
Gambar 3. Spektrum Inframerah Baku Efedrin HCl PT. Kimia Farma
[image:46.595.118.504.462.727.2]Dari hasil pengukuran diperoleh bentuk spektrum Baku Efedrin HCl
hampir sama dengan bentuk spektrum Efedrin HCl BPFI. Pada daerah sidik jari
diperoleh data bilangan gelombang Baku Efedrin HCl yang hampir sama dengan
bilangan gelombang yang terdapat di dalam literatur dan bilangan gelombang
Efedrin HCl BPFI seperti pada tabel di bawah ini.
Nama Data Peak (cm-1)
Clarke’s 994 699 754 1049 1242 670
Efedrin HCl BPFI 993.34 700.16 752.24 1049.28 1242.16 673.16 Efedrin HCl Baku
PT. Kimia Farma 993.34 700.16 752.24 1049.28 1242.16 673.16
Dari spektrum terlihat adanya gugus OH pada bilangan gelombang
3331,07 cm-1 dan adanya gugus amin primer padabilangan gelombang 3645,46
cm-1, 3624,25 cm-1. Ini menunjukkan bahwa baku yang diidentifikasi adalah
Efedrin HCl.
4.2 Penentuan Kondisi Kromatografi untuk Mendapatkan Hasil Analisis yang Optimum
4.2.1 Penentuan Panjang Gelombang Maksimum
Kadar Teofilin dan Efedrin HCl dalam sediaan tablet ditentukan dengan
KCKT fase balik. Untuk mendapatkan hasil yang optimal, terlebih dahulu
ditentukan kondisi kromatografi meliputi panjang gelombang analisis, komposisi
fase gerak dan laju alir.
Tahap pertama dilakukan penentuan panjang gelombang maksimum dari
Teofilin dan Efedrin HCl, kemudian kurva serapan yang diperoleh dibuat
overlapping.
Spektrum hasil pengukuran Teofilin dan Efedrin HCl baku dapat dilihat
Gambar 5. Kurva Serapan Teofilin Baku 8 mcg/ml secara spektrofotometri UV
Tabel 1. Data Absorbansi dari Kurva Serapan Teofilin
Dari kurva serapan ini, dapat disimpulkan bahwa Teofilin memberikan serapan
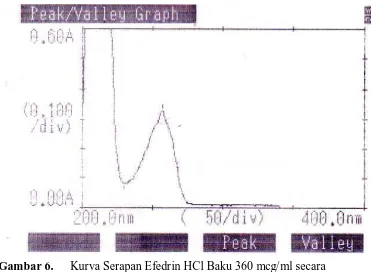
[image:48.595.179.453.425.568.2]Gambar 6. Kurva Serapan Efedrin HCl Baku 360 mcg/ml secara spektrofotometri UV
Tabel 2. Data Absorbansi dari Kurva Serapan Efedrin HCl
Dari kurva serapan ini, dapat disimpulkan bahwa Efedrin HCl memberikan
[image:49.595.181.441.423.568.2]Gambar 7. Kurva Serapan Teofilin Baku 8 mcg/ml dan Efedrin HCl Baku 360
mcg/ml secara spektrofotometri UV ( overlapping )
Dari hasil overlapping kurva serapan Teofilin dan Efedrin HCl
diperoleh panjang gelombang yang memberikan serapan optimal untuk keduanya
yaitu pada 257 nm.
4.2.2 Penentuan Perbandingan Fase Gerak dan Laju Alir
Menurut Munson (1991), kepolaran pelarut merupakan ukuran kekuatan
pelarut atau kemampuan untuk mengelusi suatu senyawa. Zat terlarut yang kuat
berinteraksi dengan fase gerak akan terelusi lebih cepat. Mekanisme pemisahan
Teofilin dan Efedrin HCl menggunakan sistem kromatografi fase terbalik, yakni
suatu sistem kromatografi dimana fase geraknya bersifat polar dan fase diamnya
bersifat non polar. Sistem kromatografi ini dipilih berdasarkan sifat kepolaran dari
kedua komponen ini. Dilihat dari strukturnya, Efedrin HCl lebih polar daripada
Teofilin sehingga Efedrin HCl akan terelusi lebih dahulu dari Teofilin.
(70 : 30), dan (80 : 20) pada panjang gelombang 257 nm dengan laju alir 0,5
ml/menit, 0,75 ml/menit dan 1 ml/menit. Adapun parameter yang perlu
diperhatikan yaitu waktu retensi, theoritical plate dan resolusi. Hasil optimasi
[image:51.595.72.557.241.422.2]dapat dilihat pada tabel 3 dan gambar pada lampiran 5.
Tabel 3. Hasil optimasi fase gerak dan laju alir dengan parameter data waktu retensi, theoretical plate dan resolusi
Keterangan :
- E = Efedrin HCl
- T = Teofilin
Dari tabel diatas dapat dilihat bahwa perbandingan fase gerak metanol-air
yang terpilih yaitu 60 : 40 dengan laju alir 0,75 ml/menit pada panjang
gelombang 257 nm karena resolusinya yang baik.
Setelah didapatkan perbandingan fase gerak yang terbaik selanjutnya
dilakukan uji identifikasi.
4.3Uji Identifikasi Teofilin dan Efedrin HCl Menggunakan KCKT
Hasil uji identifikasi Teofilin dan Efedrin HCl BPFI pada penyuntikan
terpisah masing-masing dengan konsentrasi 500 mcg/ml dan 50 mcg/ml
menggunakan fase gerak metanol-air (60:40) dengan laju alir 0,75 ml/menit Perbandingan Fase
Gerak
Waktu Retensi (menit)
Asym Theoretical
Plate Resolusi Laju Alir (ml/menit)
Metanol Air E T E T E T
60 40
5,40 6,39 1,30 1,63 1997 5554 2,39 0,5 3,55 4,27 1,13 1,55 1944 4762 2,53 0,75 2,63 3,21 1,13 1,31 1526 3885 2,41 1
70 30
5,16 5,97 - 1,79 1823 5916 2,03 0,5
3,44 3,99 1,22 1,76 1662 5092 1,95 0,75 2,59 2,99 1,15 1,46 1370 3836 1,72 1
80 20
- 5,73 - 1,62 - 6681 - 0,5
- 3,83 - 1,73 - 5572 - 0,75
diperoleh kromatogram dengan waktu tambat Teofilin 4,27 menit dan Efedrin
HCl 3,69 menit, kromatogram dapat dilihat pada Gambar 8 dan 9. Waktu tambat
yang diperoleh dari pengujian BPFI dibandingkan dengan waktu tambat yang
diperoleh dari sampel.
No Nama RT Area k’ Asym N (USP)
Res (USP)
Alpha
[image:52.595.111.508.200.416.2]1 Teofilin 4.27 11960808 426.33 1.32* 4567* --- ---
Gambar 8. Kromatogram hasil penyuntikan larutan 500 mcg/ml Teofilin
BPFI, dengan perbandingan metanol-air (60:40), laju alir 0,75 ml/menit
No Nama RT Area k’ Asym N (USP)
Res (USP)
Alpha
1 Efedrin 3.69 29891 367.67 0.87 1592* --- ---
Gambar 9. Kromatogram hasil penyuntikan larutan 50 mcg/ml Efedrin HCl
[image:52.595.107.510.202.702.2]Setelah dilakukan uji identifikasi masing-masing Teofilin dan Efedrin
HCl BPFI, selanjutnya dilakukan uji identifikasi terhadap campuran keduanya
pada kondisi yang sama.
No Nama RT Area k’ Asym N (USP)
Res (USP)
Alpha
1 Efedrin 3.59 38086 358.33 1.13 2055* --- --- 2 Teofilin 4.27 11840167 426.33 1.27* 4691* 2.40 1.19
Gambar 10. Kromatogram hasil penyuntikan campuran larutan Teofilin BPFI
(500 mcg/ml) dan larutan Efedrin HCl BPFI (50 mcg/ml), fase gerak metanol-air (60:40), laju alir 0,75 ml/menit dengan rentang intensitas luas area 0-1500 mV
Pada gambar 10, kromatogram Efedrin HCl tidak terlihat jelas pada
rentang intensitas luas area 0-1500 mV. Hal ini dikarenakan perbedaan
konsentrasi yang cukup besar antara Teofilin dan Efedrin HCl. Dimana
No Nama RT Area k’ Asym N (USP)
Res (USP)
Alpha
[image:54.595.108.512.79.376.2]1 Efedrin 3.59 38086 358.33 1.13 2055* --- --- 2 Teofilin 4.27 11840167 426.33 1.27* 4691* 2.40 1.19
Gambar 11. Kromatogram hasil penyuntikan campuran larutan Teofilin BPFI
(500 mcg/ml) dan larutan Efedrin HCl BPFI (50 mcg/ml), fase gerak metanol-air (60:40), laju alir 0,75 ml/menit dengan rentang intensitas luas area 0-25 mV
Pada gambar 11, dengan rentang intensitas luas area 0-25 mV ternyata
dapat terlihat kromatogram Teofilin dan Efedrin HCl, tetapi karena Teofilin
memiliki konsentrasi yang besar sehingga kromatogram terlihat terpotong.
Meskipun demikian, masing-masing komponen ini memiliki luas area yang sama
dan waktu retensinya sama dengan waktu retensi Teofilin dan Efedrin HCl BPFI
tunggal.
Hasil penyuntikan terhadap sampel menunjukkan waktu tambat semua
sampel hampir sama dengan waktu tambat Teofilin dan Efedrin HCl BPFI. Ini
menunjukkan sampel mengandung Teofilin dan Efedrin HCl. Kromatogram
sampel dapat dilihat pada lampiran 10, 12, 14 dan data waktu tambat dapat dilihat
Tabel 4. Data waktu tambat dari kromatogram sampel
Nama Sediaan
Waktu Tambat Sampel (menit)
Waktu Tambat BPFI (menit)
T E T E
Tablet Asmasolon 4,23 3,55
4,27 3,69
Tablet Asthma Soho 4,21 3,44
Tablet Neo Napacin 4,23 3,57
4.4Penentuan Linieritas Kurva Kalibrasi
Penentuan linieritas kurva kalibrasi Teofilin dan Efedrin HCl BPFI pada
rentang konsentrasi masing-masing yaitu 350 - 600 mcg/ml untuk Teofilin dan 30
– 80 mcg/ml untuk Efedrin HCl, memberikan hubungan yang linier antara luas
area dan konsentrasi dengan koefisien korelasi (r) = 0,9992 untuk Teofilin dan r =
0,9977 untuk Efedrin HCl. Dimana koefisien korelasi yang diperoleh ini masih
dalam batas penerimaan nilai koefisien korelasi yaitu r = 0,995 (Clarke’s, 2004).
Dari hasil perhitungan diperoleh persamaan regresi Y = 23069,8760 X +
349618,7333 untuk Teofilin dan Y = 861,2829 X – 11296,3905 untuk Efedrin
HCl.
Data hasil penyuntikan larutan Teofilin BPFI kesistem KCKT dapat dilihat
[image:55.595.185.439.584.702.2]pada tabel 5.
Tabel 5. Data hasil penyuntikan larutan Teofilin BPFI
No Konsentrasi Larutan Teofilin
(mcg/ml) Luas Area
1 350 844782
2 400 959157
3 450 10593493
4 500 11957804
5 550 13129484
6 600 14126676
Dari tabel 5 diatas, dengan memplot konsentrasi versus luas area akan diperoleh
Gambar 12. Kurva kalibrasi Teofilin BPFI
Data hasil penyuntikan larutan Efedrin HCl BPFI kesistem KCKT dapat
dilihat pada tabel 6.
Tabel 6. Data hasil penyuntikan larutan Efedrin HCl BPFI
No Konsentrasi Larutan Efedrin HCl
(mcg/ml) Luas Area
1 30 15585
2 40 23490
3 50 30272
4 60 39164
5 70 49359
6 80 58575
Dari tabel 6 diatas, dengan memplot konsentrasi versus luas area akan diperoleh
[image:56.595.173.451.451.566.2]Gambar 13. Kurva kalibrasi Efedrin HCl BPFI
4.5Penetapan Kadar Sampel
Analisis kuantitatif dapat ditentukan berdasarkan luas puncak dan tinggi
puncak. Pengukuran luas puncak tidak banyak dipengaruhi oleh kondisi
kromatografi dibandingkan dengan tinggi puncak, kecuali laju alir. Oleh karena
itu, pengukuran luas puncak merupakan pilihan yang terbaik dalam analisis
kuantitatif secara KCKT (Johnson dan Stevenson, 1991). Dimana kadar dapat
dihitung dengan mensubtitusikan luas puncak yang diperoleh pada Y dari
persamaan regresi.
Hasil perhitungan kadar setelah dilakukan uji statistik dapat dilihat pada