OPTIMASI FASE GERAK METANOL – AIR DALAM ANALISIS TABLET CAMPURAN PARASETAMOL DAN KOFEIN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
Oleh:
NOVALINA BR PURBA NIM 040824030
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
ii
PENGESAHAN SKRIPSI
OPTIMASI FASE GERAK METANOL – AIR DALAM ANALISIS TABLET CAMPURAN PARASETAMOL DAN KOFEIN SECARA KROMATOGRAFI
CAIR KINERJA TINGGI (KCKT) Oleh:
NOVALINA BR PURBA NIM 040824030
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: Januari 2010
Pembimbing I, Panitia Penguji,
Drs. Muchlisyam, M.Si., Apt. Drs. Chairul Azhar D., M.Sc., Apt. NIP 195006221980021001 NIP 194907061980021001
Pembimbing II,
Drs. Muchlisyam, M.Si., Apt.
NIP 195006221980021001
Prof. Dr. rer. nat. Effendy De Lux Putra SU., Apt. NIP 195306191983031001
Drs. Fathur Rahman H., MSi., Apt. NIP 195201041980031002
Dra. Sudarmi, M.Si., Apt. NIP 195409101983032001
Medan, Januari 2010 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
iii
KATA PENGANTAR
Alhamdulillah, puji dan syukur kehadirat Allah SWT yang telah melimpahkan rahmat, karunia, dan ridha-Nya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Optimasi Fase Gerak Metanol – Air Dalam Analisis Tablet Campuran Parasetamol dan Kofein secara Kromatografi Cair Kinerja Tinggi ( KCKT )”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar-besarnya kepada Bapak Drs. Muchlisyam, M.Si., Apt., Bapak Prof. Dr. rer. nat Effendy De Lux Putra, SU., Apt., yang telah memberi motivasi dan membimbing dengan penuh kesabaran, tulus dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih juga disampaikan kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Bapak Prof. Dr. Sumadio Hadisahputra, Apt., serta seluruh dosen dan staf Fakultas Farmasi Universitas Sumatera Utara yang telah memberikan bantuan dan fasilitas selama masa pendidikan.
iv
Penulis menyadari masih banyak kekurangan dalam penulisan ini, untuk itu penulis mengharapkan kritik dan saran yang dapat membangun dari seluruh pembaca. Semoga tulisan ini bermanfaat bagi seluruh pihak yang membutuhkan.
Medan, Januari 2010
Penulis,
vi
OPTIMASI FASE GERAK METANOL - AIR DALAM ANALISIS TABLET CAMPURAN PARASETAMOL DAN KOFEIN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Abstrak
Penelitian dilakukan untuk mendapatkan kondisi yang optimal pada analisis (optimasi) campuran tablet Parasetamol dan Kofein. Optimasi dikerjakan dengan memodifikasi metode Paszti dan Forgacs yang diambil dari salah satu literatur tentang analisis zat tersebut secara KCKT. Modifikasi dilakukan terhadap komposisi fase gerak dan laju alir.
Hasil optimasi fase gerak metanol - air menggunakan kolom ODS, detektor UV – Vis panjang gelombang 254 nm, diperoleh komposisi yang optimal pada perbandingan 35 : 65 dengan laju alir 1 ml/menit. Waktu tambat Parasetamol 4,18 menit dan Kofein 6,18 menit.
Setelah dilakukan pengujian terhadap sampel, hasil menunjukkan bahwa semua sampel yang diteliti mengandung Parasetamol diatas persyaratan kadar yang tertera dalam USP 30 tahun 2007 yaitu mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket Parasetamol dan Kofein. Sedangkan untuk Kofein semua sampel memenuhi persyaratan kadar. Hasil uji validasi metode memenuhi persyaratan dengan persen perolehan kembali Parasetamol 100,35 %, Kofein 98,69 %. Uji presisi parameter standar deviasi (SD) Parasetamol sebesar 0,1591, Kofein 0,0775 dan Relative Standar Deviasi (RSD) Parasetamol 0,1585 %, Kofein 0,0786 %. Batas deteksi (LOD) dan batas kuantitasi (LOQ) yang diperoleh dari penelitian ini ; Parasetamol sebesar 81,20 mcg/ml dan 270,66 mcg/ml ; Kofein sebesar 0,91 mcg/ml dan 3,06 mcg/ml.
vii
OPTIMIZATION MOBILE PHASE METHANOL - WATER IN ANALYSIS OF TABLET PARASETAMOL AND CAFFEIN BY HIGH
PERFORMANCE LIQUID CHROMATOGRAPHY ( HPLC )
ABSTRACT
Observation had done for getting optimal condition in determination of Paracetamol and Caffein in tablet. Optimization been doing by modificate Paszti and Forgacs methode, was taken from literature about analysis of it drug by HPLC. Modification was done to mobile phase composition and flow rate.
Optimization of mobile phase methanol - water use ODS column (C18), detector UV-Vis at wavelength 254 nm. Optimal condition with comparison methanol – water ( 35 : 65 ), flow rate 1, retention time of Paracetamol 4.18 minute and 6.18 minute for Caffein.
The result of determination Paracetamol and Caffeine, all samples were over than the requirement noted in USP 30 2007, that it contains Paracetamol is not less 90.0% and not more than 110.0 %, in this case Paracetamol in all samples were over than 110.0% from label declared. But, all samples contain Caffeine were in requirement. Validation test methode, concluded that this methode fulfilled clauses of validation test methode with percentage recovery 100.35% for Paracetamol ; Caffeine 98.69%. Standard Deviation (SD) Paracetamol 0.1591 ; Caffein 0,0775, Relative Standard Deviation (RSD) Paracetamol 0.1585 % ; Caffein 0,0786 %. Limit of Detection (LOD) Paracetamol 81.20 mcg/ml ; Caffein 0,91 mcg/ml. Limit of quantitation (LOQ) Paracetamol 270.66 mcg/ml ; Caffein 3,06 mcg/ml.
viii DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan ... 4
1.5 Manfaat ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Parasetamol ... 5
2.1.1 Sifat Fisikokimia ... 5
2.1.2 Farmakokinetik ... 5
2.1.3 Kegunaan ... 6
2.2 Kofein ... 6
ix
2.1.2 Farmakokinetik ... 7
2.1.4 Kegunaan ... 7
2.3 Kromatografi ... 7
2.4 Kromatografi Cair kinerja Tinggi ... 9
2.4.1 Komponen Kromatografi Cair kinerja Tinggi ... 10
2.4.2 Wadah Fase gerak ... 10
2.4.3 Pompa ... 10
2.4.4 Injektor ... 10
2.4.5 Kolom ... 11
2.4.6 Detektor ... 12
2.4.7 Fase Gerak ... 12
2.4.8 Pengolah Data ... 14
2.5 Parameter Kromatografi Cair kinerja Tinggi ... 14
2.6 Validasi ... 16
BAB III METODOLOGI PENELITIAN ... 17
3.1 Waktu dan Tempat Penelitian ... 17
3.2 Alat - alat ... 17
3.3 Bahan - bahan... 17
3.4 Prosedur Penelitian………... ... 17
3.4.1 Pengambilan Sampel ... 17
3.4.2 Pembuatan Fase Gerak Metanol : Air ... 18
3.4.3 Pembuatan Pelarut ... 18
3.4.4 Pembuatan Larutan Baku Induk Campuran Parasetamol Kofein BPFI ... 18
x
3.4.6 Penentuan garis alas ... 19
3.4.7 Penentuan kualitatif ... 19
3.4.8 Penentuan kuantitatif ... 19
2.3.8.1 Pembuatan Kurva Kalibrasi Campuran Parasetamol Kofein BPFI ... 19
2.3.8.2 Penetapan Kadar Sampel ... 20
2.3.8.3 Penentuan Uji Akurasi dengan Parameter Persen Perolehan kembali Mengunakan Metode Penambahan Bahan Baku (Standard Addition Method) ... 21
2.3.8.4 Penentuan Uji Presisi... 21
2.3.8.5 Pembuatan Limit of Detection (LOD) dan Limit of Quantitation (LOQ) ... 22
2.3.8.6 Analisis Statistik ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
BAB V KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
DAFTAR PUSTAKA ... 40
x
DAFTAR TABEL
Halaman Tabel 4.1. Data hasil penetapan kadar Parasetamol dan Kofein dalam sediaan
tablet.. ... 36 Tabel 4.2. Data hasil pengujian perolehan kembali Parasetamol dan Kofein
xii
DAFTAR GAMBAR
Halaman
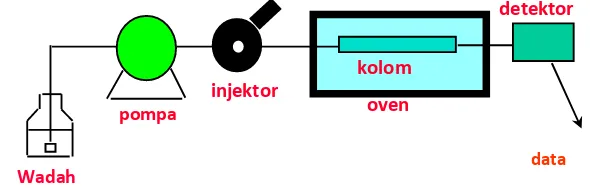
Gambar 2.1. Bagan alat KCKT. ... 10
Gambar 2.2. Tipe injektor katup putaran. ... 11
Gambar 2.3. Sistem elusi isokratik. ... 13
Gambar 2.4 Kromatogram. ... 14
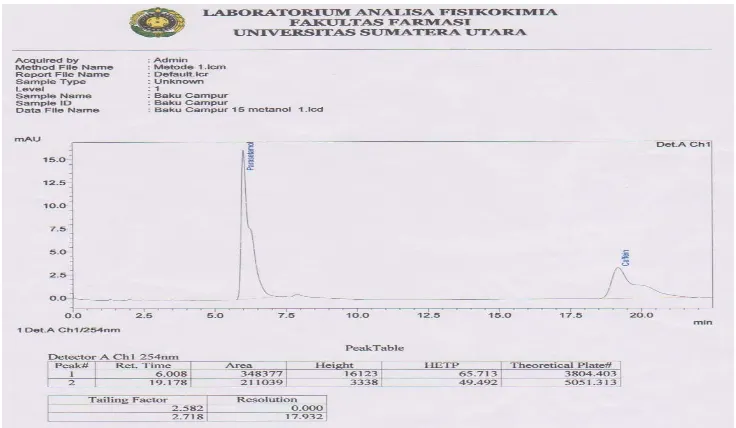
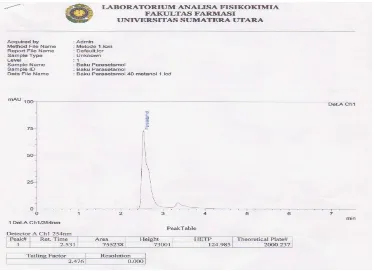
Gambar 4.1. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI dengan fase gerak metanol : air (15 : 85), tekanan 187 kgf/cm2. ... 24
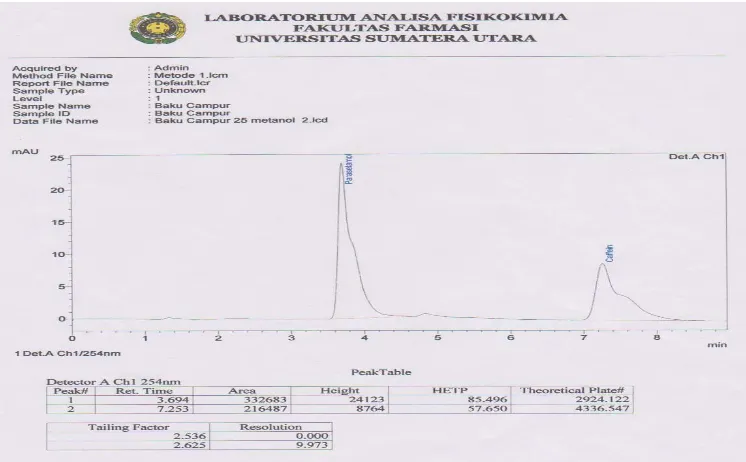
Gambar 4.2. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI dengan fase gerak metanol : air (25 : 75), tekanan 216 kgf/cm2. ... 25
Gambar 4.3. Kromatogram hasil penyuntikan larutan Baku Parasetamol BPFI, dengan fase gerak metanol : air (30 : 70) laju, tekanan 221 kgf/cm2. ... 25
Gambar 4.4. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI , dengan fase gerak metanol : air (30 : 70), tekanan 221 kgf/cm2. ... 26
Gambar 4.5. Kromatogram hasil penyuntikan larutan Baku Parasetamol, dengan fase gerak metanol : air (35 : 65), menggunakan pre kolom, tekanan 269 kgf/cm2. ... 26
Gambar 4.6. Kromatogram hasil penyuntikan larutan Baku Kofein BPFI,dengan fase gerak metanol : air (35 : 65), menggunakan pre kolom, tekanan 269 kgf/cm2. ... 27
Gambar 4.7. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI menggunakan pre kolom dengan fase gerak metanol : air (25 : 75), tekanan 269 kgf/cm2. ... 27
Gambar 4.8. Kromatogram hasil penyuntikan larutan Baku Parasetamol BPFI, dengan fase gerak metanol : air (40 : 60), tekanan 228 kgf/cm2. ... 28
xiii
Gambar 4.10. Kromatogram hasil penyuntikan larutan Baku Parasetamol BPFI menggunakan pre kolom, dengan fase gerak metanol : air (35 : 65), laju alir 1 ml/menit, tekanan 225 kgf/cm2. ... 29 Gambar 4.11. Kromatogram hasil penyuntikan larutan Baku Kofein BPFI
menggunakan pre kolom, dengan fase gerak metanol : air (35 : 65), laju alir 1 ml/menit, tekanan 225 kgf/cm2. ... 30 Gambar 4.12. Kromatogram hasil penyuntikan larutan Baku campur
Parasetamol dan Kofein BPFI dengan konsentrasi 300 dan 30 mcg/ml, menggunakan pre kolom dengan fase gerak metanol : air (35 : 65), laju alir 1 ml/menit, tekanan 225 kgf/cm2.. ... 30 Gambar 4.13. Kromatogram hasil penyuntikan larutan baku campur
Parasetamol dan Kofein BPFI dengan konsentrasi 300 dan 30 mcg/ml... ... 32 Gambar 4.14. Kromatogram hasil penyuntikan larutan tablet Panadol Extra
(PT. Sterling Products Indonesia) dengan konsentrasi 300 mcg/ml... ... 32 Gambar 4.15. Kromatogram hasil penyuntikan larutan tablet Oskadon (PT.
Supra Ferbindo Farma) dengan konsentrasi 300 mcg/ml. ... 33 Gambar 4.16. Kromatogram hasil penyuntikan larutan tablet Bodrex (PT.
xiv
DAFTAR LAMPIRAN
Halaman Lampiran 1. Alat KCKT (Shimadzu), kolom, pre kolom dan Syringe 100 µl.. .. 41 Lampiran 2. Gambar alat ultrasonic cleaner dan penyaring.. ... 43 Lampiran 3. Hubungan perbandingan fase gerak, waktu alir terhadap tekanan
dan waktu tambat pada penyuntikan larutan uji dengan
konsentrasi 300 mcg/ml.. ... 45 Lampiran 4. Kromatogram hasil penyuntikan larutan baku Campur Parasetamol
dan Kofein BPFI pada konsentrasi 100 dan 10 mcg/ml, fase
gerak metanol : air (35 : 56) laju alir 1 ml/menit.. ... 46 Lampiran 5. Perhitungan persamaan regresi dari kurva kalibrasi baku
campur Parasetamol dan Kofein BPFI... ... 51 Lampiran 6. Contoh perhitungan persen perolehan kembali.. ... 54 Lampiran 7. Kromatogram hasil persen perolehan kembali dari sampel
Panadol (PT. Sterling Products Indonesia).. ... 56 Lampiran 8. Data hasil perolahan kembali Parasetamol dan Kofein pada
Metode Penambahan Baku ( Standard Addition Methode).. ... 59 Lampiran 9. Analisa data statistik persen perolehan kembali pada tablet
Panadol ( PT. Sterling Products Indonesia).. ... 60 Lampiran 10. Contoh perhitungan batas deteksi (LOD) dan batas kuantitasi
(LOQ) ... 62 Lampiran 11. . Kromatogram dari larutan Tablet Bodrex
(PT. Tempo Scan Pacifik).. ... 64 Lampiran 12. Analisa data statistik untuk mencari kadar sebenarnya dari
penyuntikan larutan Tablet Bodrex (PT. Tempo Scan Pacifik
secara KCKT.. ... 67 Lampiran 13. Kromatogram dari larutan Tablet Panadol Extra
(PT. Sterling Product Indonesia)... 69 Lampiran 14. Analisa data statistik untuk mencari kadar sebenarnya dari
penyuntikan larutan Panadol Extra
xv
Lampiran 15. Kromatogram dari larutan Tablet Oskadon
(PT. Supra Ferbindo Farma).. ... 74
Lampiran 16. Analisa data statistik untuk mencari kadar sebenarnya dari penyuntikan larutan Oskadon (PT. Supra Ferbindo Farma) secara KCKT.. ... 77
Lampiran 17. Rekapitulasi hasil pengolahan data dari sediaan tablet Parasetamol-Kofein.. ... 79
Lampiran 18. Contoh perhitungan penimbangan sampel.. ... 81
Lampiran 19. Contoh perhitungan kadar perolehan.. ... 83
Lampiran 20. Daftar spesifikasi sampel.. ... 84
Lampiran 21. Sertifikat pengujian Kofein BPFI... 85
vi
OPTIMASI FASE GERAK METANOL - AIR DALAM ANALISIS TABLET CAMPURAN PARASETAMOL DAN KOFEIN SECARA
KROMATOGRAFI CAIR KINERJA TINGGI (KCKT)
Abstrak
Penelitian dilakukan untuk mendapatkan kondisi yang optimal pada analisis (optimasi) campuran tablet Parasetamol dan Kofein. Optimasi dikerjakan dengan memodifikasi metode Paszti dan Forgacs yang diambil dari salah satu literatur tentang analisis zat tersebut secara KCKT. Modifikasi dilakukan terhadap komposisi fase gerak dan laju alir.
Hasil optimasi fase gerak metanol - air menggunakan kolom ODS, detektor UV – Vis panjang gelombang 254 nm, diperoleh komposisi yang optimal pada perbandingan 35 : 65 dengan laju alir 1 ml/menit. Waktu tambat Parasetamol 4,18 menit dan Kofein 6,18 menit.
Setelah dilakukan pengujian terhadap sampel, hasil menunjukkan bahwa semua sampel yang diteliti mengandung Parasetamol diatas persyaratan kadar yang tertera dalam USP 30 tahun 2007 yaitu mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket Parasetamol dan Kofein. Sedangkan untuk Kofein semua sampel memenuhi persyaratan kadar. Hasil uji validasi metode memenuhi persyaratan dengan persen perolehan kembali Parasetamol 100,35 %, Kofein 98,69 %. Uji presisi parameter standar deviasi (SD) Parasetamol sebesar 0,1591, Kofein 0,0775 dan Relative Standar Deviasi (RSD) Parasetamol 0,1585 %, Kofein 0,0786 %. Batas deteksi (LOD) dan batas kuantitasi (LOQ) yang diperoleh dari penelitian ini ; Parasetamol sebesar 81,20 mcg/ml dan 270,66 mcg/ml ; Kofein sebesar 0,91 mcg/ml dan 3,06 mcg/ml.
vii
OPTIMIZATION MOBILE PHASE METHANOL - WATER IN ANALYSIS OF TABLET PARASETAMOL AND CAFFEIN BY HIGH
PERFORMANCE LIQUID CHROMATOGRAPHY ( HPLC )
ABSTRACT
Observation had done for getting optimal condition in determination of Paracetamol and Caffein in tablet. Optimization been doing by modificate Paszti and Forgacs methode, was taken from literature about analysis of it drug by HPLC. Modification was done to mobile phase composition and flow rate.
Optimization of mobile phase methanol - water use ODS column (C18), detector UV-Vis at wavelength 254 nm. Optimal condition with comparison methanol – water ( 35 : 65 ), flow rate 1, retention time of Paracetamol 4.18 minute and 6.18 minute for Caffein.
The result of determination Paracetamol and Caffeine, all samples were over than the requirement noted in USP 30 2007, that it contains Paracetamol is not less 90.0% and not more than 110.0 %, in this case Paracetamol in all samples were over than 110.0% from label declared. But, all samples contain Caffeine were in requirement. Validation test methode, concluded that this methode fulfilled clauses of validation test methode with percentage recovery 100.35% for Paracetamol ; Caffeine 98.69%. Standard Deviation (SD) Paracetamol 0.1591 ; Caffein 0,0775, Relative Standard Deviation (RSD) Paracetamol 0.1585 % ; Caffein 0,0786 %. Limit of Detection (LOD) Paracetamol 81.20 mcg/ml ; Caffein 0,91 mcg/ml. Limit of quantitation (LOQ) Paracetamol 270.66 mcg/ml ; Caffein 3,06 mcg/ml.
1 BAB I PENDAHULUAN
I.1. Latar Belakang
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam sehingga mampu menganalisis berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran. ( Depkes RI, 1995 ).
Keberhasilan pemisahan dan teknik analisis pada metode KCKT tergantung pada pemilihan cara kromatografi yang tepat, kombinasi fase diam dan
fase gerak yang sesuai, serta faktor-faktor lainnya seperti kolom, detektor, kemampuan sistem pompa dan sistem pengolahan data. Untuk keperluan analisis kimia maupun memperoleh kondisi yang diinginkan dalam kromatografi, perlu diperhatikan beberapa parameter antara lain : waktu retensi, faktor selektifitas, efisiensi kolom, resolusi, faktor ikutan yang banyak dipengaruhi oleh fase diam dan fase gerak dalam kolom. (Sudaryo, 2001).
Dalam beberapa literatur telah dicantumkan beberapa metode analisis penetapan kadar Campuran Parasetamol dan Kofein secara Kromatografi Cair Kinerja Tinggi (KCKT) dengan berbagai fase gerak antara lain : Metanol - air - asam asetat glasial (69 : 28 : 3), kolom L1, laju alir 2 ml/menit dan detektor UV
2
- air (40 : 60), laju alir 0,5 ml/menit, dengan UV detektor pada 249 dan 273 nm, kolom C 18. (Paszti and Forgacs, 2003). Campuran Parasetamol, kofein dan degradasinya dapat ditentukan dengan fase gerak methanol - buffer fosfat pH 6 (20 : 80), kolom C18, laju alir 1 ml/menit, UV detektor pada 230 nm. (Kuntic, V and Vujic, Z., 2008). Menurut Farmakope Indonesia edisi IV tahun 1995, tablet Parasetamol ditentukan kadarnya menggunakan Kromatografi Cair kinerja Tinggi dengan fase gerak air - metanol (3 : 1), kolom L1, laju alir 1,5 ml per menit, detektor 243 nm. Kofein dalam serbuk minuman dapat ditentukan secara Kromatografi Cair Kinerja Tinggi menggunakan kolom oktadesilsilan dengan fase gerak air - metanol - asam asetat glasial (69 : 28 : 3), laju alir 1,0 ml/menit, detektor UV 275 nm. (MA PPOM, 2007).
Berdasarkan sifat kepolaran dari Parasetamol dan Kofein, analisis
campuran ini dapat dilakukan dengan fase gerak metanol - air menggunakan kolom C18.
Campuran Parasetamol dan Kofein banyak ditemukan dalam kombinasi obat Flu yang beredar di pasaran. Parasetamol merupakan salah obat Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) yang secara luas digunakan dalam pengobatan demam dan mengurangi rasa sakit. Kofein merupakan stimulan sistem saraf pusat. Zat ini sering dikombinasikan dengan parasetamol untuk memperkuat efek analgetisnya. ( Tjay dan Rahardja, 2002).
Persyaratan kadar untuk campuran Parasetamol dan Kofein dalam sediaan tablet menurut USP 30 tahun 2007, mengandung tidak lebih dari 110% dan tidak
3
dengan memodifikasi kondisi metode Paszti and Forgacs yakni komposisi fase gerak, laju alir serta detektor. Modifikasi ini memiliki keuntungan antara lain fase gerak yang lebih sederhana, detektor hanya menggunakan satu panjang gelombang, tanpa penggunaan standar internal. Pada penelitian ini dilakukan juga uji validasi metode dengan parameter uji akurasi, presisi, batas deteksi dan batas kuantitasi.
1.2 Perumusan Masalah
1. Apakah analisis campuran Parasetamol dan Kofein dapat dilakukan secara kromatografi cair kinerja tinggi ( KCKT ), menggunakan fase gerak metanol - air, detektor UV dengan panjang gelombang 254 nm?
2. Berapa perbandingan fase gerak metanol - air yang optimal dalam analisis campuran Parasetamol dan Kofein?
3. Apakah komposisi fase gerak metanol - air yang dperoleh dari hasil optimasi dapat digunakan dalam penetapan kadar dan validasi campuran Parasetamol dan Kofein?
1.3 Hipotesis
1. Bahwa analisis campuran Parasetamol dan Kofein dapat dilakukan secara kromatografi cair kinerja tinggi ( KCKT ) dengan fase gerak metanol - air, detektor UV dengan panjang gelombang 254 nm.
2. Bahwa campuran Parasetamol dan Kofein dapat dianalisis secara optimal dengan fase gerak metanol - air pada perbandingan tertentu.
3. Bahwa komposisi fase gerak metanol - air yang diperoleh dari hasil
4 1.4 Tujuan Penelitian
1. Mengetahui hasil pemisahan campuran Parasetamol dan Kofein secara Kromatografi Cair Kinerja Tinggi (KCKT) menggunakan fase gerak metanol - air, detektor UV 254 nm.
2. Mendapatkan perbandingan fase gerak yang paling baik untuk analisis Campuran Parasetamol Kofein secara kromatografi cair kinerja tinggi (KCKT) menggunakan fase gerak metanol - air, detektor UV 254 nm. 3. Melakukan analisis campuran Parasetamol dan Kofein serta validasinya
lalu membandingkan hasil yang diperoleh dengan persyaratan kadar yang ditetapkan USP 30.
1.5 Manfaat Penelitian
1. Pengembangan ilmu bahwa penetapan kadar Campuran Parasetamol
Kofein dalam sediaan tablet dapat juga dilakukan dengan kromatografi cair kinerja tinggi (KCKT ) menggunakan kolom VP-ODS ( 4,6 mm x 25 cm ), fase gerak metanol - air, detektor UV 254 nm.
5 BAB II
TINJAUAN PUSTAKA
2.1 Parasetamol 2.1.1 Sifat Fisikokimia Rumus struktur :
Nama Kimia : 4- Hidroksiasetanilida Rumus Molekul : C8H9NO2
Berat Molekul : 151,16
Pemerian : serbuk, putih, tidak berbau, rasa sedikit pahit.
Kelarutan : larut dalam air mendidih dan dalam natrium hidroksida 1 N, mudah larut dalam etanol. (Depkes RI, 1995).
2.1.2 Farmakokinetik A. Absorpsi
Parasetamol diberikan secara oral, diserap dengan baik melalui saluran cerna. Penyerapan dihubungkan dengan tingkat pengosongan lambung. Konsentrasi darah puncak biasanya tercapai dalam 30 - 60 menit. Parasetamol sedikit terikat pada protein plasma dan sebagian dimetabolisme oleh enzim mikrosoma hati dan diubah menjadi sulfat dan glukoronida. (Katzung, 2002). B. Efek Samping
6
tetapi ini umumnya selintas. Nekrosis tubular ginjal dan koma hipoglikemia merupakan komplikasi yang jarang dari terapi dosis besar jangka lama. Asetaminofen dosis besar menyebabkan persediaan glutation di hati berkurang dan N-asetil-benzokuinoneimin bereaksi dengan grup sulfihidril protein hati, membentuk ikatan kovalen. Dapat terjadi nekrosis hati, suatu kondisi yang sangat serius dan berpotensi mengancam kehidupan.
2.1.3 Kegunaan
Asetaminofen merupakan pengganti yang baik untuk analgesik dan antipiretik aspirin pada penderita dengan keluhan saluran cerna dan pada mereka dengan perpanjangan waktu perdarahan yang tidak menguntungkan. Asetaminofen merupakan analgetik dan antipiretis. Asetaminofen tidak mengantagonis obat urikosurik probenesid dan karena itu dapat digunakan pada penderita gout yang
mendapatkan obat itu. 2.2 Kofein
2.2.1 Sifat Fisikokimia Rumus struktur :
Nama Kimia : 1,3,7-Trimetil xantin Rumus Molekul : C8H10N4O2
Berat Molekul : 194,19
Pemerian : serbuk putih atau bentuk jarum mengkilat putih,biasanya menggumpal, tidak berbau, rasa pahit.
7 2.2.2 Farmakokinetik
A. Absorpsi
Kafein per oral mudah diabsorbsi. Kafein tersebar ke seluruh tubuh termasuk otak. Obat dapat melewati plasenta janin dan disekresikan ke dalam ASI. Dimetabolisme di hati dan metabolitnya dikeluarkan di dalam urin.
B. Efek Samping
Kafein dosis sedang menyebabkan insomnia, ansietas dan agitasi. Dosis tinggi diperlukan untuk memperlihatkan toksisitas berupa muntah dan konvulsi. Dosis letal sekitar 10 g (kira-kira 100 cangkir kopi) yang menimbulkan aritmia jantung. Kematian karena kafein sangat tidak mungkin. Letargi, iritabel dan sakit kepala terjadi pada pengguna yang secara rutin minumg lebih dari 600 mg kopi per hari ( sekitar 6 cangkir kopi per hari) dan mendadak berhenti. (Mycek, 2001).
2.2.3 Kegunaan
Kofein berkhasiat menstimulasi SSP, dengan efek menghilangkan rasa letih, lapar dan mengantuk, juga daya konsentrasi dan kecepatan reaksi dipertinggi, prestasi otak dan suasana jiwa diperbaiki. Kofein juga memperkuat kontraksi jantung, vasodilatasi perifer dan diuretis. Kofein digunakan sebagai penyegar. Zat ini sering dikombinasikan dengan Parasetamol atau asetosal untuk memperkuat efek analgetisnya.
2.3 Kromatografi
Dalam analisis kimia pada umumnya, komponen (zat) yang dianalisa harus dipisahkan terlebih dahulu dari komponen lain atau zat pengganggu yang ada, lalu
8
campuran yang tidak mungkin dipisahkan dengan cara yang lain, menggunakan kromatografi dapat diselesaikan dalam waktu yang singkat dengan peralatan yang relatif sederhana. Lebih dari itu, karena sifat pemisahannya yang spesifik, maka selain digunakan sebagai metode pemisahan, kromatografi juga merupakan metode penentuan zat baik kualitatif maupun kuantitatif.
Kromatografi dapat didefinisikan sebagai suatu teknik pemisahan zat berdasarkan perbedaan kecepatan migrasi yang berlangsung dalam suatu sistem yang terdiri dari dua macam fasa, dimana salah satu fasa bergerak atas fasa lainnya.
Kromatografi apapun bentuknya mempunyai 2 macam fasa, yaitu fasa diam dan fasa gerak. Berdasarkan jenis fasa gerak yang digunakan, kromatografi dibedakan atas 2 golongan besar yaitu kromatografi gas bila fasa geraknya gas
dan kromatografi cair bila fasa geraknya cairan.
Pada kromatografi gas, fasa diam selalu ditempatkan di dalam kolom. Fasa diam itu dapat berupa padatan atau cairan yang diemban oleh butiran halus zat padat pendukung. Karena itu berdasarkan wujud fasa diamnya, kromatografi gas dapat dibedakan atas kromatografi gas padat dan kromatografi gas cair.
Pada kromatografi cair, selain ditempatkan dikolom, fasa diam dapat pula ditebarkan berupa lapis tipis diatas permukaan suatu pelat dari kaca yang disebut kromatografi lapis tipis. Selain itu dapat pula menggunakan secarik kertas sebagai fasa diamnya yang disebut kromatografi kertas. Kromatografi lapis tipis dan kromatografi kertas dilakukan untuk membedakannya dari kromatografi yang
9
gerak dan fasa diam yang digunakan, kromatografi dapat dibedakan berdasarkan mekanisme interaksi yang terjadi antara fasa diam dan komponen campuran yang dipisahkan. Maka dikenal kromatografi adsorbsi, kromatografi partisi, kromatografi penukar ion dan kromatografi eksklusi atau permiasi gel.
Mekanisme interaksi yang paling banyak dijumpai dilaboratorium adalah adsorbsi dan partisi. Pada proses adsorbsi, molekul pelarut dan molekul zat terlarut menempati permukaan zat padat pengadsorbsi (adsorbent). Dalam kromatografi partisi, fungsi zat padat pengadsorbsi sebagai fasa diam digantikan oleh zat cair. Distribusi komponen dalam fasa diam itu karena daya larutnya. Pada kromatografi cair, misalnya Kromatografi cair Kinerja Tinggi(KCKT), molekul senyawa yang digunakan sebagai fasa diam diikatkan secara kimia pada permukaan pertikel pendukung, menghasilkan kromatografi fasa terikat.
Berdasarkan perbandingan polaritas antara fasa diam dan fasa geraknya dikenal kromatografi fasa normal bila fasa diam lebih polar dari fasa geraknya, kromatografi fasa terbalik bila fasa gerak lebih polar daripada fasa diamnya. Karena fasa diam yang digunakan tidak sebanyak pada kromatografi gas, maka selektifitas pemisahan lebih mudah diperbaiki dengan merubah komposisi fasa gerak. (Sudaryo, 2001).
2.4 Kromatografi Cair Kinerja Tinggi
Kromatogarfi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif
10
2.4.1 Komponen Kromatografi cair kinerja tinggi
Gambar 2.1. Bagan alat KCKT 2.4.2 Wadah Fase gerak
Wadah fase gerak terbuat dari bahan yang inert terhadap fase gerak. Bahan yang umum digunakan adalah gelas dan baja anti karat. Daya tampung tandon harus lebih besar dari 500 ml, yang dapat digunakan selama 4 jam untuk kecepatan alir yang umumnya 1-2 ml/menit.
2.4.3 Pompa
Untuk menggerakkan fase gerak melalui kolom diperlukan pompa. Pompa harus mampu menghasilkan tekanan 6000 Psi pada kecepatan alir 0,1–10 ml/menit. Pompa ada 2 jenis yaitu pompa volume konstan dan pompa tekanan konstan. Pompa terbuat dari bahan yang inert terhadap semua pelarut. Bahan yang umum digunakan adalah gelas baja antikarat dan teflon. Aliran pelarut dari pompa harus tanpa denyut untuk menghindari hasil yang menyimpang pada detektor.
2.4.4 Injektor
Cuplikan harus dimasukkan ke dalam pangkal kolom (kepala kolom), diusahakan agar sesedikit mungkin terjadi gangguan pada kemasan kolom.
Ada tiga jenis dasar injektor, yaitu:
a. Hentikan aliran/stop flow: Aliran dihentikan, injeksi dilakukan pada kinerja atmosfir, sistem tertutup, dan aliran dilanjutkan lagi. Tehnik ini
pompa
injektor
kolom
oven
detektor
Wadah data
11
bisa digunakan karena difusi di dalam aliran kecil dan resolusi tidak dipengaruhi.
b. Septum: Injektor-injektor langsung ke aliran fase gerak umumnya sama dengan yang digunakan pada kromatografi gas. Injektor ini dapat digunakan pada kinerja sampai 60-70 atmosfir. Tetapi septum ini tidak tahan dengan semua pelarut-pelarut kromatografi cair. Disamping itu, partikel kecil dari septum yang terkoyak (akibat jarum injektor) dapat menyebabkan penyumbatan.
c. Katup putaran (loop valve): ditunjukkan secara skematik dalam Gambar 6, tipe injektor ini umumnya digunakan untuk menginjeksi volume lebih besar dari pada 10 µl dan sekarang digunakan dengan cara automatis (dengan adaptor khusus, volume-volume lebih kecil dapat diinjeksikan
secara manual). Pada posisi LOAD, sampel loop (cuplikan dalam putaran) diisi pada tekanan atmosfir. Bila katup difungsikan, maka cuplikan di dalam putaran akan bergerak ke dalam kolom.
Gambar 2.2 Tipe injektor katup putaran
2.4.5 Kolom
12
• Kolom analitik: diameter khas adalah 2-6 mm. Panjang kolom tergantung
pada jenis kemasan. Untuk kemasan pelikular, panjang yang lumrah adalah 50-100 cm. Untuk kemasan poros mikropartikilat, umumnya 10-30 cm. Dewasa ini ada yang 5 cm
• Kolom preparatif: umumnya memiliki diameter 6 mm atau lebih besar dan
panjang kolom 25 -100 cm.
Kolom umumnya dibuat dari stainless steel dan biasanya dioperasikan pada temperatur kamar, tetapi bisa juga digunakan temperatur lebih tinggi, terutama untuk kromatografi penukar ion dan kromatografi eksklusi. Kemasan kolom tergantung pada mode kromatografi cair kinerja tinggi yang digunakan. 2.4.6 Detektor
Detektor pada KCKT dikelompokkkan menjadi 2 golongan yaitu: \
• Detektor universal: Mampu mendeteksi zat secara umum, tidak bersifat
spesifik, dan tidak bersifat selektif, seperti detektor indeks bias dan detektor spektrometri massa.
• Detektor spesifik: Hanya mendeteksi analit secara spesifik dan selektif,
seperti detektor UV-Vis, detektor fluoresensi dan elektrokimia (Rohman,2007).
2.4.7 Fase Gerak
Fase gerak atau eluen biasanya terdiri atas campuran pelarut yang dapat bercampur yang secara keseluruhan berperan dalam daya elusi dan resolusi. Daya
13
Terdapat keragaman yang luas dari solvent yang digunakan dalam semua mode Kromatografi Cair Kinerja Tinggi, tetapi ada beberapa sifat yang diinginkan yang mana umumnya harus dipenuhi oleh semua solven.
Fase gerak harus:
• Murni; tidak ada pencemar/kontaminan
• Tidak bereaksi dengan pengemas
• Sesuai dengan detektor
• Melarutkan cuplikan
• Mempunyai viskositas rendah
• Mudah rekoveri cuplikan, bila diinginkan
• Tersedia diperdagangan dengan harga yang pantas
(Putra, 2003) Elusi gradien dan isokratik
Elusi pada kromatografi cair kinerja tinggi dapat dibagi menjadi dua sistem yaitu:
1. Sistem elusi isokratik. Pada sistem ini, elusi dilakukan dengan satu macam atau lebih fase gerak dengan perbandingan tetap (komposisi fase gerak tetap selama elusi)
[image:30.612.188.422.555.664.2]
Gambar 2.3 Sistem elusi isokratik pompa injektor
kolom oven
detektor
S
So
ol
lv
v
en
e
n
t
t
un
u
ng
gg
ga
al
l
data
14
2. Sistem elusi gradien. Pada sistem ini, elusi dilakukan dengan campuran fase gerak yang perbandingannya berubah-ubah dalam waktu tertentu (komposisi fase gerak berubah-ubah selama elusi).
2.4.8 Pengolahan Data
Komponen yang terelusi mengalir ke detektor dan dicatat sebagai puncak-puncak yang secara keseluruhan disebut sebagai kromatogram.
Gambar 2.4 Kromatogram Guna kromatogram:
1. Kualitatif
waktu retensi selalu konstan dalam setiap kondisi kromatografi yang sama. dapat digunakan untuk identifikasi.
2. Kuantitatif
luas puncak proporsional dengan jumlah sampel yang diinjesikan dan dapat digunakan untuk menghitung konsentrasi.
3. Kromatogram dapat digunakan untuk mengevaluasi efisiensi pemisahan dan kinerja kolom
2.5 Parameter Kromatografi Cair Kinerja Tinggi
Ada beberapa parameter yang perlu diperhatikan dalam memperoleh kondisi yang diinginkan dalam kromatografi antara lain :
W
W
1/2H
1/2H
Rt
15 a. Waktu Retensi
Waktu yang dibutuhkan suatu komponen untuk melewati suatu kolom disebut waktu retensi yang dapat didefinisikan sebagai waktu yang diperlukan untuk membawa keluar suatu komponen dari dalam kolom, dihitung mulai diinjeksikan hingga keluar kolom tepat pada saat konsentrasi maksimum.
2. Faktor Selektifitas
Suatu kolom dinyatakan baik apabila kolom tersebut cukup selektif, dan dikatakan selektif apabila kolom tadi mampu menahan berbagai komponen dengan kekuatan yang berbeda-beda.
3. Efisiensi Kolom
Jumlah plat teoritik dalam suatu kolom sebanding dengan panjang kolom. Karena itu jumlah plat teoritik suatu kolom dapat ditingkatkan dengan
memperpanjang kolom. Makin panjang kolom makin banyak jumlah plat teoritiknya maka makin sempurna pemisahan.
4. Resolusi
Derajat pemisahan atau resolusi dari dua pita yang berdekatan didefinisikan sebagai jarak antara puncak-puncak pita (atau pusat-pusat) dibagi dengan luas pita rata-rata. Semakin tinggi harga N selalu memberikan resolusi yang membaik. Oleh karena itu resolusi dapat diperbaiki dengan menambah panjang kolom. (Putra, 2003).
5. Faktor Ikutan
Keasimetrisan puncak dinyatakan dengan faktor ikutan atau faktor
16 2.6 Validasi
Validasi metode menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analis harus divalidasi untuk verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi masalah dalam analisis. Parameter analisis yang ditentukan pada validasi adalah akurasi, presisi, batas deteksi, batas kuantitasi, spesifikasi, linieritas dan rentang, kekasaran (Ruggedness) dan ketahanan (Robutness).
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima. Akurasi dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Akurasi dapat ditentukan dengan dua cara yaitu metode simulasi (spiked placebo recovery) dan metode
penambahan bahan baku (standard addition method).
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai relatif standar deviasi (RSD) dari sejumlah sampel yang berbeda secara signifikan secara statistik.
Batas deteksi (limit of detection, LOD) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat terdeteksi yang masih memberikan respon signifikan.
Batas kuantitasi (limit of quantitation, LOQ) didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan.
17 BAB III
METODOLOGI PENELITIAN
Penelitian ini dilakukan dengan metode Eksperimental yaitu penelitian yang bertujuan mencari pengaruh variabel tertentu terhadap variabel lain dalam kondisi terkontrol. Metode ini tidak membutuhkan teknik sampling, yang diperlukan adalah bahan yang homogen untuk penelitian.
3.1 Waktu dan tempat penelitian
Penelitian dilakukan dilaboratorium kimia farmasi kuantitatif Fakultas Farmasi Universitas Sumatera Utara Medan dan Laboratorium Terapetik Balai Besar POM di Medan pada bulan Juli sampai September tahun 2009.
3.2 Alat-alat
Alat-alat yang digunakan adalah satu unit alat KCKT ( Shimadzu ) yang
terdiri dari vacum degasser, pompa, Detektor UV/Vis (dilengkapi dengan komputer dan printer ) , kolom Shimpac VPODS ( 4,6 mm x 25 cm ), Pre kolom ODS, wadah fase gerak, penyuntik µl ( 100µl ), penyaring mikro , neraca listrik, neraca micro balance, dan alat gelas lainnya.
3.3 Bahan-bahan
Bahan-bahan yang digunakan adalah: metanol kualitas pro analisys produksi E.Merck, Parasetamol BPFI, Kofein BPFI (Badan POM RI), aquabidestilata (PT. Ikapharmindo Putramas), tablet Bodrex (PT. Tempo Scan
Pacifik), tablet Panadol Extra (PT. Sterling Products Indonesia), tablet Oskadon (PT. Supra Ferbindo Farma).
18
Pengambilan sampel dilakukan secara purposif yaitu tanpa membandingkan satu tempat dengan tempat yang lain karena tempat pengambilan sampel dianggap homogen. Hasil sampling diperoleh tablet Bodrex (PT. Tempo Scan Pacifik), tablet Panadol (PT. Sterling Products Indonesia), tablet Oskadon (PT. Supra Ferbindo Farma).
3.4.2 Pembuatan fase gerak Metanol - Air
Sebanyak 500 ml metanol, disaring menggunakan membran whatman filter PTFE 0,5 µm. Lalu diawaudarakan selama 20 menit. Sebanyak 500 ml aquabidestillata, disaring menggunakan membran cellulosa nitrat filter PTFE 0,5 µm. Lalu diawaudarakan selama 20 menit.
3.4.3 Pembuatan Pelarut
Sebanyak 350 ml metanol dicampur dengan 650 ml aquabidestillata. Aduk
dengan batang pengaduk. Lalu disonikasi selama 30 menit.
3.4.4 Pembuatan larutan induk baku campuran Parasetamol Kofein BPFI Ditimbang seksama sejumlah 50,0 mg Parasetamol BPFI, dimasukkan kedalam labu 50 ml, ditambahkan pelarut sebanyak 20 ml, disonikasi selama 15 menit, diencerkan dengan pelarut hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 1000 mcg/ml, disaring. Filtratnya digunakan sebagai larutan induk.
Ditimbang seksama sejumlah 50,0 mg Kofein BPFI, dimasukkan kedalam labu 50 ml, ditambahkan pelarut sebanyak 20 ml, disonikasi selama 15 menit, diencerkan dengan pelarut hingga garis tanda sehingga diperoleh larutan dengan
19
garis tanda. Filtratnya digunakan sebagai larutan induk baku (larutan induk baku II).
3.4.5 Penentuan Perbandingan Fase Gerak Metanol - Air
Masing - masing unit diatur, menggunakan kolom shimpac VP-ODS (4,6 mm x 25 cm). Sensitivitas 1.000 AUFS dan pengukuran menggunakan detektor UV/Vis pada panjang gelombang 254 nm. Pada pompa dipilih mode aliran tetap dengan laju aliran 1,5 ml/menit. Dibuat perbandingan fase gerak dengan perbandingan: (15:85), (20:80), (25:75), (30:70), (35:65), (40:60).
3.4.6 Penentuan garis alas
Setelah diperoleh kondisi seperti 3.4.5 maka pompa dijalankan, fase gerak dibiarkan mengalir selama 15 menit diperoleh garis alas yang cukup lurus yang menandakan sistem tersebut telah stabil. Setiap kali mengganti komposisi fase
gerak dan laju alir maka harus dilakukan hal yang ada pada 3.4.5 lalu dilakukan penentuan garis alas.
3.4.7 Penentuan Kualitatif
Baku Parasetamol tunggal dan Kofein tunggal disuntikkan ke sistem KCKT, lalu diamati puncak dan waktu tambat masing-masing. Campuran Parasetamol dan Kofein BPFI, larutan tablet dengan konsentrasi 300 mcg/ml masing-masing disuntikkan ke sistem KCKT dengan volume penyuntikan 20 µl. Puncak yang ditunjukkan diperhatikan dan dicatat waktu tambatnya kemudian waktu tambat masing-masing tablet dibandingkan dengan waktu tambat Baku Parasetamol dan Kofein tunggal serta campuran.
3.4.8 Penentuan kuantitatif
20
Dipipet larutan induk baku Parasetamol sebanyak 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 ml, masing-masing dimasukkan ke dalam labu tentukur 10 ml, lalu dipipet larutan baku induk II Kofein sebanyak 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 ml masing-masing dimasukkan ke dalam labu yang telah berisi Baku Parasetamol tersebut lalu ditambahkan pelarut hingga garis tanda, kocok. sehingga diperoleh konsentrasi 100, 200, 300, 400, 500 mcg/ml Parasetamol dan Kofein 10, 20, 30, 40, 50 mcg/ml lalu masing-masing konsentrasi diawaudarakan selama 20 menit dan disaring dengan cellulose nitrat membran filter PTFE 0,2 µm. Kemudian filtrat masing-masing konsentrasi diinjeksikan ke sistem KCKT dengan volume penyuntikan 20 µl diukur pada panjang gelombang 254 nm. Selanjutnya dari luas area yang diperoleh pada kromatogram dan dibuat kurva kalibrasi serta dihitung persamaan garis regresinya.
3.4.8.2 Penetapan kadar sampel
Ditimbang 20 tablet, kemudian digerus, sejumlah serbuk ditimbang seksama setara dengan lebih kurang 500 mg Parasetamol, masukkan kedalam labu tentukur 100 ml, ditambahkan 75 ml pelarut, disonikasi selama 30 menit, diencerkan dengan pelarut hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 5000 mcg/ml, kocok lalu disaring, 5 ml filtrat pertama dibuang dan filtrat selanjutnya ditampung. Filtrat yang jernih digunakan sebagai larutan uji. Kemudian dari larutan ini dipipet 3 ml ke dalam labu 50 ml dan ditambahkan pelarut hingga garis tanda sehingga diperoleh larutan dengan konsentrasi 300 mcg/ml. Dilakukan pengulangan sebanyak 6 kali. Lalu larutan disaring dengan
21
3.4.8.3 Penentuan Uji Akurasi dengan Parameter Persen Perolehan kembali Mengunakan Metode Penambahan Bahan Baku (Standard Addition
Method)
Ditimbang seksama setara 500 mg serbuk Panadol Extra yang sudah ditentukan kadarnya, dimasukkan ke dalam labu 100 ml. Ditimbang 125,08 mg Parasetamol BPFI, dimasukkan ke dalam labu yang telah berisi serbuk Panadol Extra, lalu ditambahkan 8,75 mg Kofein BPFI. Ditambahkan pelarut sebanyak 75 ml, disonikasi selama 30 menit, tambahkan pelarut hingga garis tanda lalu disaring. Dipipet sebanyak 3 ml ke dalam labu 50 ml, tambahkan pelarut hingga garis tanda. Lalu disaring dengan membran cellulosa 0,2 µl, lalu disonikasi selama 15 menit, diinjeksikan ke dalam sistem KCKT sebanyak 20 µl dan dideteksi pada panjang gelombang 254 nm, laju alir 1 ml/menit.
Persen perolehan kembali = C
B A−
X 100%
Dimana:
A = Konsentrasi sampel yang diperoleh setelah penambahan bahan baku B = Konsentrasi sampel sebelum penambahan bahan baku
C = Konsentrasi baku yang ditambahkan
3.4.8.4 Penentuan Uji Presisi
Uji presisi (keseksamaan) ditentukan dengan parameter Relatif Standar Deviasi (RSD) dengan rumus:
RSD = X SD
X 100%
Keterangan :
RSD = Relatif Standar deviasi SD = Standar deviasi
22
3.4.8.5 Penentuan Limit of Detection ( LOD ) dan Limit of Quantitation (LOQ) Batas deteksi atau Limit of Detection ( LOD ) adalah jumlah terkecil analit dalam sampel yang dapat dideteksi. Batas kuantitasi atau Limit of Quantitation (LOQ) merupakan kuantitas terkecil analit dalam sampel.
Untuk menentukan batas deteksi (LOD) dan batas kuantitasi (LOQ)
digunakan rumus: SD =
2 ) ( 2 − − n Yi Y LOD = Slope XSD 3 LOQ = Slope XSD 10 Keterangan :
SD = Standar Deviasi LOD = Batas Deteksi
LOQ = Batas Kuantitasi ( Harmita, 2004 ) 3.4.8.6 Analisis Statistik
Penolakan Hasil Pengamatan
Kadar Campuran Parasetamol dan Kofein sebenarnya dalam sampel dapat diketahui dengan menggunakan uji Q test. Cara untuk melakukan analisis terhadap data yang menyimpang adalah dengan Dixon’s Q-test yang dirumuskan sebagai berikut: terendah nilai tertinggi nilai terdekat yang nilai dicurigai yang nilai Qhitung − − =
Jika nilai Qhitung lebih kecil dari nilai Qkritis maka hipotesis nol diterima
23
[image:40.612.172.466.158.318.2]Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga Q pada Tabel 1, apabila Q > Q0,99 maka data tersebut ditolak.
Tabel 1. Nilai Qkritis pada Taraf Kepercayaan 99%
Banyak data Nilai Qkritis
4 0,926
5 0,821
6 0,740
7 0,680
8 0,634
24 BAB IV
HASIL DAN PEMBAHASAN
Penetapan kadar campuran Parasetamol dan Kofein ditentukan menggunakan kromatografi fase terbalik dimana fase diam (L1/C18) bersifat kurang polar dibandingkan fase gerak metanol - air.
Optimasi Fase gerak
Untuk mengetahui perbandingan fase gerak, laju alir, waktu tambat dan tekanan kolom yang optimal maka dilakukan percobaan pendahuluan dengan menyuntikkan larutan baku campuran Parasetamol dan Kofein pada konsentrasi 500 mcg/ml dan 50 mcg/ml ke dalam sistem KCKT dengan perbandingan fase gerak metanol - air (15 : 85), (20 : 70), (25 : 75), (30 : 70), (35 : 65), (40 : 60), laju alir 1,5 ml/menit. Hasil percobaan pendahuluan dapat dilihat pada gambar di bawah ini:
[image:41.612.135.503.434.648.2]25
Gambar 4.2. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI, dengan fase gerak metanol : air (25 : 75),
tekanan 216 kgf/cm2.
[image:42.612.133.506.386.664.2]26
Gambar 4.4. Kromatogram hasil penyuntikan larutan Baku campur Parasetamol dan Kofein BPFI, dengan fase gerak metanol : air (30 : 70), tekanan 221 kgf/cm2.
[image:43.612.132.507.79.353.2] [image:43.612.137.499.428.653.2]27
Gambar 4.6. Kromatogram hasil penyuntikan larutan Baku Kofein dengan fase gerak metanol : air (35 : 65), menggunakan pre kolom, tekanan 269 kgf/cm2.
[image:44.612.134.498.406.659.2]28
Gambar 4.8. Kromatogram hasil penyuntikan larutan Baku Parasetamol BPFI, dengan fase gerak metanol : air (40 : 60), tekanan 228 kgf/cm2.
[image:45.612.133.507.78.349.2] [image:45.612.133.508.413.650.2]29
Pada gambar 4.1 sampai 4.9 di atas dapat dilihat kromatogram dengan laju alir 1,5 ml/menit memberikan tekanan pompa >200 kgf/cm2, tailing faktor melebihi persyaratan yang tertera dalam USP 30 tahun 2007, yaitu tailing faktor tidak
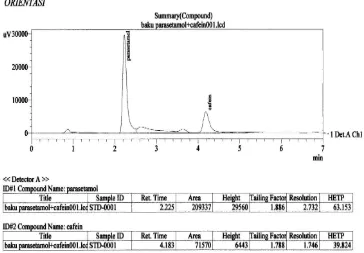
boleh lebih dari 2 dan resolusi harus lebih besar dari 1,5. Pada gambar 4.5 sampai 4.7 perbandingan metanol - air (35 : 65) adalah yang paling optimal dimana pada perbandingan itu waktu tambat lebih singkat, Parasetamol 2,225 menit dan Kofein 4,183 menit. Resolusi lebih besar dari 1,5. Karena tekanan yang terlalu tinggi akhirnya dilakukan percobaan pendahuluan pada perbandingan tersebut dengan menurunkan laju alir mrnjadi 1 ml/menit.
Hasil percobaan pendahuluan dapat dilihat pada gambar di bawah ini:
[image:46.612.138.502.360.620.2]30
[image:47.612.139.498.96.332.2]Gambar 4.11. Kromatogram hasil penyuntikan larutan Baku Kofeinl BPFI dengan konsentrasi 30 mcg/ml, menggunakan pre kolom, fase gerak metanol : air (35 : 65), laju alir 1 ml/menit, tekanan 225 kgf/cm2.
[image:47.612.134.501.422.663.2]31
Kromatogram menunjukkan bahwa waktu tambat Kofein lebih panjang dari Parasetamol. Hal ini menunjukkan bahwa Parasetamol lebih polar dibandingkan Kofein. Pada fase terbalik kolom yang digunakan lebih non polar dibandingkan dengan fase gerak, sehingga komponen yang terikat lebih lama dalam fase diam pastilah lebih non polar dari komponen yang memiliki waktu yang lebih sedikit dalam fase diam. Dari hasil penelitian juga diperoleh makin sedikit metanol yang dipakai dalam perbandingan maka makin panjang waktu tambat Kofein, sedangkan untuk Parasetamol tidak begitu jauh perubahannya, hal ini menunjukkan bahwa Kofein kurang polar dibandingkan Parasetamol.
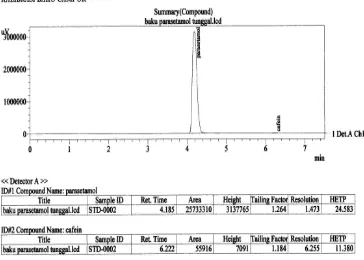
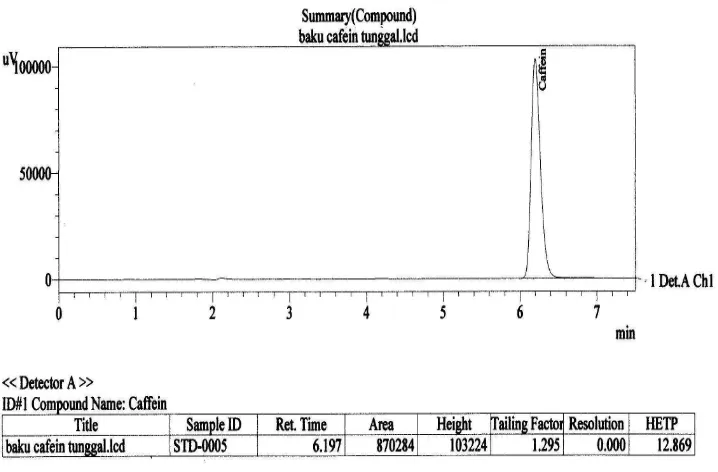
Kondisi yang optimal diperoleh dengan perbandingan fase gerak metanol - air (35 : 65), laju alir 1 ml/menit. Pada penyuntikan 20 µl waktu tambat Parasetamol 4,184 menit, waktu tambat Kofein 6,197 menit. Penyuntikan baku campur Parasetamol dan Kofein, waktu tambat Kofein 6,207 menit. Perbedaan waktu tambat kofein ini masih diperbolehkan. Menurut Weston dan Brown (1997) perbedaan waktu tambat yang diizinkan ± 5 %. Kondisi optimal juga ditunjukkan oleh tailing faktor dan resolusi yang memenuhi persyaratan USP 30 tahun 2007. Kromatogram dapat dilihat pada gambar 4.10 sampai 4.12. Perbandingan fase gerak dan laju alir ini yang dipakai pada pengukuran selanjutnya.
32
Panadol Extra (PT. Sterling Products Indonesia) Parasetamol 4,179 menit dan Kofein 6,201 menit, tablet Oskadon (PT. Supra Ferbindo Farma) Parasetamol 4,208 menit dan Kofein 6,245 menit. Hal ini berarti bahwa sampel yang digunakan dalam penelitian ini mengandung Parasetamol dan Kofein. Kromatogram penentuan waktu tambat dapat dilihat pada gambar di bawah ini.
[image:49.612.135.506.224.414.2]Gambar 4.13. Kromatogram hasil penyuntikan larutan baku campur Parasetamol dan Kofein BPFI dengan konsentrasi 300 dan 30 mcg/ml.
[image:49.612.138.498.470.645.2]33
Gambar 4.15. Kromatogram hasil penyuntikan larutan tablet Oskadon (PT. Supra Ferbindo Farma) dengan konsentrasi 300 mcg/ml.
Gambar 4.16. Kromatogram hasil penyuntikan larutan tablet Bodrex (PT. Tempo Scan Pacifik) dengan konsentrasi 300 mcg/ml.
[image:50.612.140.504.91.342.2] [image:50.612.134.505.395.644.2]34
[image:51.612.151.489.153.435.2]diperoleh hubungan linearitas dengan koefisien kolerasi (r) = 0,9818 dan persamaan garis regresi Y = 48988,0735 X + 4696428,75. Hasil linieritas kurva kalibrasi larutan Parasetamol BPFI dapat dilihat pada gambar 4.17.
Gambar 4.17. Kurva kalibrasi larutan Parasetamol BPFI
35 Gambar 4.18. Kurva kalibrasi larutan Kofein
Harga koefisien korelasi dari persamaan regresi di atas dapat diterima. Menurut Miller, J.N ( 2005 ), pada analisis koefisian korelasi dapat mengambil rentang 0,90 sampai 0,99 atau lebih. Kadar Parasetamol dan Kofein dalam sediaan tablet dapat dihitung berdasarkan luas puncak. Kadar Parasetamol dalam sampel dapat dihitung menggunakan persamaan regresi Y = 48988,0735 X + 4696428,75 yaitu mensubsitusikan Y dengan area sampel. Sedangkan untuk kadar Kofein dalam sampel dapat dihitung dengan mensubsitusikan Y dengan area sampel dengan menggunakan persamaan garis regresi Y = 29557,245 X 10364,85
Hasil perhitungan diketahui harga X (kadar sampel) dan pengolahan data dapat dilihat pada lampiran 12, 14, 16. Perhitungan data statistik diperoleh kadar Parasetamol dan Kofein dalam sampel dapat dilihat pada lampiran 17.
36
Tabel 4.1 Data hasil penetapan kadar Parasetamol dan Kofein dalam sediaan tablet.
No Nama Sampel
Kadar Parasetamol
(%)
Kadar Kofein (%) 1 Tablet Bodrex (PT. Tempo Scan Pacifik) 110,65 ± 0,4041 94,93 ± 1,1409
2 Tablet Panadol (PT. Sterling Products Indonesia) 112,50 ± 0,2727 91,72 ± 0,7086
3 Tablet Oskadon (PT. Supra Ferbindo Farma) 116,48 ± 0,4393 102,83 ± 0,5410
Dari tabel diatas terlihat bahwa semua sampel yang diteliti mengandung Parasetamol diatas persyaratan kadar yang tertera dalam USP 30 tahun 2007 yaitu mengandung tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket Parasetamol dan Kofein. Sedangkan untuk Kofein memenuhi persyaratan yang kadar.
Pada penelitian ini dilakukan uji validasi metode penambahan bahan baku (standard addition methode) terhadap sampel tablet Panadol (PT. Sterling
Products Indonesia) meliputi uji akurasi dengan parameter persen perolehan kembali (% recovery), uji presisi dengan parameter Standar Deviasi (SD), RSD (Relatif Standar Deviasi), batas deteksi (LOD) dan batas kuantitasi (LOQ). (Harmita, 2004).
37
Tabel 4.2 Data hasil pengujian perolehan kembali Parasetamol dan Kofein dengan metode penambahan bahan baku (standard addition methode)
Penambahan zat aktif Luas Puncak
Persen perolehan kembali
(%)
Parasetamol
24940270 100,59
24935124 100,45
24929978 100,32
24932865 100,39
24922627 100,13
24927846 100,26
Kadar rata-rata (%) 100,35
Standar Deviasi (SD) 0,1591
Relatif Standar Deviasi (RSD) (%) 0,1585
Kofein
1234410 98,66
1234395 98,66
1234381 98,66
1234612 98,85
1234362 98,66
1234355 98,66
Kadar rata-rata (%) 98,69
Standar Deviasi (SD) 0,0775
Relatif Standar Deviasi (RSD) (%) 0,0786
38
39 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Analisis Campuran Parasetamol dan Kofein dapat ditentukan secara Kromatografi Cair Kinerja Tinggi menggunakan kolom C18 (Oktadesil silana) dengan fase gerak Metanol - Air. Dari hasil optimasi diperoleh perbandingan yang paling optimal adalah (35 : 65) pada panjang gelombang 254 nm.
Hasil penelitian yang dilakukan menunjukkan bahwa metode ini dapat dipakai pada penetapan kadar campuran Parasetamol dan Kofein dalam sediaan
tablet. Kadar Parasetamol berdasarkan pengukuran luas puncak keseluruhannya berada diatas persyaratan kadar yang tertera dalam USP 30, yaitu mengandung Parasetamol tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Kadar Kofein dalam sediaan tablet yang diuji keseluruhnya berada dalam batas persyaratan kadar yang tertera dalam USP 30, yaitu mengandung Kofein tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket.
5.2 Saran
40
DAFTAR PUSTAKA
De Lux Putra, E. (2007). Dasar-dasar Kromatografi Gas & Kromatografi Cair Kinerja Tinggi. Fakultas Farmasi USU-Medan. Hal. 88-91.
Depkes RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan RI. Hal. 254-255, 650 – 651, 1009.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Departemen Farmasi FMIPA UI. Hal. 117-132.
Katzung, B.G. (2002). Farmakologi Dasar dan Klinik. Jakarta. Salemba Medika. Hal. 484 – 486.
Kuntic, V and Vujic, Z. (2008). Statistical Optimization Of Reverse Phase High Performance Liquid Chromatography for the Analysis of Caffein Paracetamol and its Degradation Product p-aminophenol. Belgrade. Faculty of Pharmacy Belgrade. Page. 1.
Lunn, G. and Schmuff, N. R. (1997). HPLC Methods for Pharmaceutical Analysis. John Wiley & Sons, Inc. Page. 17 -19.
Miller, J.N. dan Miller J.C. ( 2005 ). Statistic and Chemometrics for Analytical Chemistry. Pearson Education Limited. Page. 111 - 112
Mycek, M.J. (1997). Farmakologi Ulasan Bergambar. Jakarta. Widya Medika. Hal. 99 – 100.
Paszti, Gere E., Farkas, O. and Forgacs, E. (2008). Validation and Stimultaneous Determination of Paracetamola nd Caffein in Pharmaceutical Formulations by HPLC. Hungaria Academy of Science. Page. 1.
Pharmacopeia USP. (2007). The National Formulary. Edition 30 . The United States Pharmacopeial Convention. Page. 1275 – 1276.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta. Penerbit Pustaka Pelajar. Hal. 378- 379, 406.
Sudaryo. (2001). Pengantar Kromatografi. Surabaya. BBPOM Surabaya. Hal. 4-14.
Tjay & Rahardja. (2002). Obat-Obat Penting. Edisi kelima. Jakarta. Penerbit PT. Elex Media Komputindo. Hal. 140.
41
[image:58.612.133.507.117.369.2]Lampiran 1. Gambar alat KCKT dan syringe 100 µl
Gambar 1. Alat KCKT (Shimadzu) di laboratorium Farmasi Kuantitatif USU
42 Gambar 3. Kolom VP-ODS ( 4,6 mm x 25 cm )
[image:59.612.132.508.78.236.2]Gambar 4. Pre kolom ODS
[image:59.612.132.507.287.452.2] [image:59.612.136.510.501.654.2]43
[image:60.612.192.473.116.397.2]Lampiran 2. Gambar alat ultrasonic cleaner dan penyaring
Gambar 6. Alat Ultrasonic Cleaner di laboratorium Farmasi Kuantitatif USU
[image:60.612.133.506.438.675.2]44 Gambar Penyaring
45
Lampiran 3. Hubungan perbandingan fase gerak, waktu alir terhadap tekanan dan waktu tambat pada penyuntikan larutan uji dengan konsentrasi 300 mcg/ml.
Zat Aktif Perbandingan fase gerak (Metanol : Air)
Laju alir (ml/menit)
Tekanan (kgf/cm2)
Waktu tambat (menit)
Parasetamol
15 : 85 1,5 168 6,008
25 :75 1,5 173 3,694
30 : 70 1,5 198 3,132
35 : 65 1,5 269 2,225
40 : 60 1,5 273 2,533
35 : 65 1,0 225 4,184
Kofein
15 : 85 1,5 168 19,178
25 :75 1,5 173 7,253
30 : 70 1,5 198 5,163
35 : 65 1,5 269 4,183
40 : 60 1,5 273 3,356
46
Lampiran 4. Kromatogram hasil penyuntikan larutan baku Campur Parasetamol dan Kofein BPFI pada konsentrasi 100 dan 10 mcg/ml, fase gerak metanol : air (35 : 56) laju alir 1 ml/menit
47
48
49
50
51
Lampiran 5. Perhitungan persamaan regresi dari kurva kalibrasi baku campur Parasetamol dan Kofein BPFI.
A. Parasetamol No Konsentrasi (mcg/ml) X Luas Puncak Y
XY X2 Y2
1 100 7903074 790307400 10000 62458578649476
2 200 15476532 3095306400 40000 239523042747024 3 300 21023249 6306974700 90000 441976998516001 4 400 24852044,5 9940817800 160000 617624115829986 5 500 27709354,5 13854677250 250000 767808326806670
∑ 1500 96964254 33988083550 550000 2129391062549150
∑ 300 19392851 6979616710 110000 425878212509830
Y = a X + b
a =
(
) ( )( )
( )
x2( )
x 2 n y x xy n ∑ − ∑ ∑ ∑ − ∑a =
(
) (
)(
)
(
) (
)
21500 550000 5 96964254 1500 0 3398808355 5 − − a = 2250000 2750000 00 1454463810 00 1699404178 − − a = 500000 0 2449403675
a = 48988,0735
b = Y - a X
b = 19392851– 48988,0735(300) b = 19392851– 14696422,05
b = 4696428,75
Y = a X + b
52
Untuk mencari hubungan kadar (X) dengan luas puncak (Y) digunakan pengujian koefisien kolerasi (r)
r =
(
) ( )( )
( )
( )
[
2]
[
( )
2( )
2]
y y n x x n y x xy n ∑ − ∑ ∑ − ∑ ∑ ∑ − ∑ 2
r =
(
) (
)(
)
(
) (
)
(
)
[
2]
[
(
) (
)
2]
96964254 549150 2129391062 5 1500 550000 5 96964254 1500 0 3398808355 5 − − − r =
(
2750000 2250000)(
10646955312745800 9402066553776520)
00 1454463810 00 1699404178 − − − r =(
500000)(
1244888758969240)
0 2449403675 r = 0 2494883523 0 2449403675r = 0,9818
B. Kofein No Konsentrasi (mcg/ml) X Luas Puncak Y
XY X2 Y2
1 10 299896,5 2998965 100 89937910712,3
2 20 613415,5 12268310 400 376278575640,3
3 30 896885,0 26906550 900 804402703225,0
4 40 1181695,0 47267800 1600 1396403073025,0
5 50 1493619,0 74680950 2500 2230897717161,0
∑ 150 4485511,0 164122575 5500 4897919979763,5
∑ 30 897102,0 32824515 1100 979583995952,7
Y = a X + b
a =
(
) ( )( )
( )
2( )
2 x x n y x xy n ∑ − ∑ ∑ ∑ − ∑a =
(
) ( )(
)
(
) ( )
253 a = 22500 27500 672826650 820612875 − − a = 5000 147786225
a = 29557,245
b = Y - a X
b = 897102,0– 29557,245 (30) b = 897102,0 – 886717,35 b = 10384,85
Y = a X + b
Sehingga diperoleh persamaan regresi Y = 29557,245X + 10384,85
Untuk mencari hubungan kadar (X) dengan luas puncak (Y) digunakan pengujian koefisien kolerasi (r)
r =
(
) ( )( )
( )
( )
[
2]
[
( )
2( )
2]
y y n x x n y x xy n ∑ − ∑ ∑ − ∑ ∑ ∑ − ∑ 2
r =
(
) ( )(
)
(
) ( )
(
)
[
2]
[
(
) (
)
2]
4485511,0 763,5 4897919979 5 150 5500 5 4485511,0 150 164122575 5 − − − r =
(
27500 22500)(
24489599898818 20119808931121)
672826650 820612875 − − − r =(
5000)(
4369790967697)
147786225r =
147813920 147786225
54
Lampiran 6. Contoh perhitungan persen perolehan kembali Berat 20 tablet = 13,6967 g
Kandungan zat berkhasiat = Parasetamol 500 mg Kofein 65 mg
Penimbangan setara 500 mg = 500 mg x 13696,7 mg 20 x 500 mg
= 684,83 mg Penimbangan sampel : 684,9 mg
Ditambah baku Parasetamol : 125,08 mg : 100 ml x 3 ml : 50 ml X 1000 mcg/mg : 75,048 mcg/ml
Kofein : 8,75 mg : 100 ml x 3 ml : 50 ml X 1000 mcg/mg : 5,25 mcg/ml
Hasil Pengukuran :
No. Penambahan zat aktif Luas Puncak
1
Parasetamol
24940270
2 24935124
3 24929978
4 24932865
5 6 24922627 24927846 1 Kofein 1234410
2 1234395
3 1234381
4 1234612
5 1234362
6 1234355
Persen perolehan kembali = C
B A−
X 100%
Dimana:
55 C = Konsentrasi baku yang ditambahkan
A. Perhitungan Parasetamol
Konsentrasi Parasetamol hasil pengukuran : 337,74 mcg/ml (B) Y = 48988,0735X + 4696428,75
Y1 = 48988,0735X + 4696428,75
X1 = 24940270 - 4696428,75 = 413,24 mcg/ml
48988,0735
Persen perolehan kembali = C
B A−
X 100%
= 413,24 mcg/ml – 337,74 mcg/ml x 100% 75,048 mcg/ml
= 100,59%
Dengan cara yang sama dilakukan perhitungan untuk pengukuran 2 sampai 5. B. Kofein
Konsentrasi Rata-rata Kofein hasil pengukuran : 36,23 mcg/ml (B) Y1 = 29557,245X + 10384,85.
X1 = 1234410 - 10384,85 = 41,41 mcg/ml
29557,245
Persen perolehan kembali = C
B A−
X 100%
= 41,41 mcg/ml – 36,23 mcg/ml x 100% 5,25 mcg/ml
= 98,66 %
56
58
59
Lampiran 8. Data hasil perolehan kembali Parasetamol dan Kofein pada Metode Penambahan Baku ( Standard Addition Methode)
Data hasil pengujian perolehan kembali Parasetamol dan Kofein dengan metode penambahan bahan baku ( Standard Addition Methode)
No Penambahan zat aktif
Konsentrasi (mcg/ml) Persen perolehan (A-B) X 100% C Luas Puncak Setelah penambahan analit(A) Sebelum penambahan analit (B) Analit yang ditambahkan (C) 1 Parasetamol
24940270 413,23 337,74 75,048 100,59
2 24935124 413,13 337,74 75,048 100,45
3 24929978 413,03 337,74 75,048 100,32
4 24932865 413,08 337,74 75,048 100,39
5 24922627 412,89 337,74 75,048 100,13
6 24927846 412,99 337