i
KAJIAN DIAGNOSTIK PATOLOGI
PENYAKIT MAREK MENGGUNAKAN
METODE IMUNOHISTOKIMIA
MAWAR SUBANGKIT
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis “Kajian Diagnostik Patologi Penyakit Marek Menggunakan Metode Imunohistokimia” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir dari tesis ini.
Bogor, April 2013
iii
ABSTRACT
MAWAR SUBANGKIT. Diagnostic Study of Marek’s Disease Pathology by Immunohistochemistry Methods. Under direction of DEWI RATIH AGUNGPRIYONO and SRI ESTUNINGSIH
Marek’s Disease (MD) is viral disease which has a lot of differential diagnosis. Until now immunohistochemistry is a gold standard for diagnosing MD. This study aims to determine whether the cases of MD from Pathology Diagnostic Laboratory were could detect by polyclonal antibodies derived from live vaccine MD strain Herpesvirus of Turkey (HVT vaccine). Four male rabbits devide into two groups. Two rabbits serve as control group which receive 1 mL of 0.9% NaCl persubcutan and 2 rabbits serve as antibody producing animal which receive 1 mL of 250 µg/mL HVT vaccine per subcutan. They are boosted twice with same immunogen per subcutan within 6 weeks. The collected serum antibody was purified by Amonium Sulfate precipitate and Fast Protein Liquid Chromatography (FPLC). Antibody titer was screened using ELISA and Western Blot for compatibility assay. The result showed that average antibody titer after second boosting was 4.162. Thirty seven samples which diagnosed MD by Pathology Diagnostic Laboratory, Department of Clinic, Reproduction and Pathology, Faculty of Veterinary Medicine, Bogor Agricultural University were used for immunohistochemistry Assay (IHC). Thirty-four MD samples were immunoreactive with antibody while 3 samples were non-immunoreactive. We conclude that our antibody which produced by live HVT vaccine could detect field antigen of MD in the tissue with 91.89% of fidelity rate.
ABSTRAK
Mawar Subangkit. Kajian Diagnostik Patologi Penyakit Marek menggunakan Metode Imunohistokimia. Dibawah bimbingan DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
Marek’s Disease (MD) merupakan penyakit viral yang memiliki banyak diagnosa banding. Hingga saat ini imunohistokimia (IHK) masih menjadi metode unggulan alat diagnostik terhadap MD. Penelitian ini bertujuan untuk memastikan kejadian MD yang mampu dideteksi dengan antibodi poliklonal, dimana antibodi tersebut diproduksi dari vaksin live MD strain Herpesvirus of Turkey (HVT). Empat kelinci jantan strain New Zealand White umur 10 minggu dibagi menjadi 2 kelompok. Sebanyak 2 ekor kelinci sebagai kontrol yang diinduksi dengan 0.9% NaCl dan 2 ekor kelinci lain diinduksi dengan 250 µg vaksin live MD strain HVT yang diaplikasikan secara subkutan. Boosting dilakukan sebanyak 2 kali selama 6 minggu dan serum darah dikoleksi untuk dimurnikan dengan metode presipitasi dan FPLC. Titer antibodi diperiksa dengan metode ELISA dan pengujian kesesuaian antibodi yang diproduksi dengan metode Western Blot. Dari 37 sampel yang telah didiagnosa MD memberikan hasil 34 sampel imunoreaktif terhadap antibodi yang diproduksi dan 3 sampel non-imunoreaktif terhadap antibodi yang diproduksi. Sehingga diperoleh angka kepercayaan diagnosa dengan metode konvensional sebesar 91.89%.
v
RINGKASAN
MAWAR SUBANGKIT. Kajian Diagnostik Patologi Penyakit Marek Menggunakan Metode Imunohistokimia. Dibawah bimbingan DEWI RATIH AGUNGPRIYONO dan SRI ESTUNINGSIH.
Penggunaan metode imunohistokimia (IHK) merupakan salah satu pemecahan masalah untuk meneguhkan diagnosa terhadap Marek’s Disease (MD) dimana penyakit ini cukup sulit dikenali serta memiliki diagnosa banding yang cukup luas. Santos et al. (2009), menyebutkan bahwa IHK merupakan teknik yang efisien untuk mendeteksi virus golongan Retikuloendotelial dan virus Marek. Antibodi primer poliklonal atau monoklonal spesifik mengikat antigen pada jaringan sehingga antibodi sekunder yang dikonjugasi enzim akan bereaksi dengan kromogen mampu menghasilkan visualisasi berupa warna. Antibodi yang bersifat spesifik tersebut mampu digunakan untuk memastikan adanya suatu antigen atau protein dalam suatu jaringan, dengan karakteristik sel berisi antigen MD berupa akumulasi sel limfosit T (Kim et al. 2004).
Produksi antibodi poliklonal anti-Marek secara konvensional dapat digunakan untuk diagnosa penunjang dengan metode IHK. Sehingga penelitian ini bertujuan untuk mengkaji hasil diagnostik patologi MD yang dilakukan dengan metode imunohistokimia. Dalam penelitian ini, antibodi poliklonal diperoleh dari induksi asal vaksin. Antibodi ini diharapkan mampu mengikat antigen dari sampel lapang yang didiagnosa MD di laboratorium menggunakan metode imunohistokimia.
Sampel yang diambil berasal dari organ unggas yang terduga Marek atau telah didiagnosa terinfeksi MD secara Patologi Anatomi (PA) dan Histopatologi (HP) dengan pewarnaan umum (Haematoxyline-Eosin/HE). Metode diagnosa yang telah dilakukan Laboratorium Patologi FKH-IPB secara PA adalah dengan menemukan multifokus tumor di berbagai organ termasuk kebengkakan kelenjar proventrikulus, multifokus nodular di berbagai organ interna dan nekrosa sebagian otak. Secara HP untuk merumuskan MD harus ditemukan akumulasi sel limfoid yang bervariasi (limfotropik tumor) di berbagai organ interna dan syaraf.
Produksi antibodi poliklonal dilakukan pada hewan kelinci dengan strain New Zealand White yang berumur 2 bulan dengan jenis kelamin jantan. Kelinci tersebut diinduksi dengan imunogen virus Marek asal vaksin live strain Herpesvirus of Turkey (HVT). Imunisasi pertama dengan menambahkan adjuvant berupa Complete Freund’s Adjuvant yang berfungsi untuk melepaskan imunogen ke sistem sirkulasi secara perlahan. Boosting (reimunisasi) dilakukan setelah 3 minggu pasca imunisasi pertama. Setiap 10 hari pasca boosting dilakukan pengecekan titer antibodi dengan metode Enzym Linked Immunosorbant Assay (ELISA). Titer optimal yang diperoleh biasanya lebih dari 15 kali lipat dan setelah diperoleh titer optimal dilakukan pemanenan antibodi yang terdapat dalam serum.
Pewarna yang digunakan adalah Methylene Blue sehingga memberikan warna biru pada gel yang digunakan. Transfer warna tersebut ke dalam kertas dilakukan dengan metode elektroforesis.
Evaluasi dan aplikasi antibodi primer dilakukan pada preparat histopatologi dari sampel Diagnostik Patologi di Bagian Patologi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, IPB. Sampel histopatologi yang digunakan telah didiagnosa Marek oleh patologist dengan pewarnaan HE.
Hasil pengujian titer antibodi poliklonal dengan ELISA pada hari ke-10, data yang diperoleh belum menunjukkan hasil titer yang maksimal. Kelinci A dan B memiliki rataan titer 3.615, sedangkan kelinci kontrol menunjukkan titer sebesar 1.477, peningkatan yang terjadi adalah sebesar 2.45 kali. Nilai tersebut belum menunjukkan nilai yang optimal sehingga perlu dilakukan boosting kedua. Uji penapisan kedua terhadap titer yang dihasilkan, dilakukan pada 10 hari post boosting kedua. Data titer antibodi yang diperoleh setelah boosting kedua menunjukkan rataan titer dari kedua kelinci adalah 4.162. Nilai titer tersebut, jika dibandingkan dengan titer kontrol, sudah naik sekitar 33 kali lipat. Kondisi ini merupakan kondisi yang optimal untuk dilakukan pemanenan serum.
Serum yang diperoleh pada kelinci A sejumlah 35 mL dan kelinci B sejumlah 37 mL. Jumlah tersebut merupakan jumlah optimal pengambilan darah terakhir pada kelinci dengan rataan berat badan sebesar 3.7 kg. Darah yang telah diambil dilakukan pemisahan serum dan didapatkan total dari kedua kelinci diperoleh serum sejumlah 28.7 mL.
Pengujian kompatibilitas antibodi dilakukan menggunakan Western Blot. Garis berat molekul protein pada Western Blot menunjukkan bahwa serum mengandung antibodi yang mampu mengikat antigen yang diinfeksikan.
Tahap presipitasi dilakukan dengan menggunakan ammonium persulfat yang berfungsi sebagai pengkelat IgG. Hasil yang diperoleh dari 28.7 mL serum diperoleh konsentrat IgG dan ammonium persulfat sejumlah 13.8 mL. Serum sejumlah 2 mL dari hasil presipitasi dimurnikan dengan FPLC melalui kolom pemisah menggunakan sepharos G. Sepharos G berfungsi spesifik mengisolasi IgG. Dari 2 mL antibodi hasil presipitasi, diperoleh 159 uL antibodi poliklonal murni.
Berdasarkan derajat keparahan infeksinya, 34 sampel diagnostik MD digolongkan menjadi 3 kelompok infeksi, yaitu ringan, sedang dan berat. Sebagai kontrol positif antigen imunoreaktif digunakan hewan mencit yang diinjeksi secara intraperitoneal. Hasil pewarnaan IHK menunjukkan bahwa pada kontrol positif bersifat imunoreaktif terhadap antibodi poliklonal anti-Marek. Sampel dengan derajat infeksi berat menunjukkan hasil 100% imunoreaktif terhadap antibodi poliklonal anti-Marek, sedangkan pada derajat infeksi ringan 77.78% dan sedang 90.90%.
vii
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB
KAJIAN DIAGNOSTIK PATOLOGI
PENYAKIT MAREK MENGGUNAKAN
METODE IMUNOHISTOKIMIA
MAWAR SUBANGKIT
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Biomedis Hewan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Kajian Diagnostik Patologi Penyakit Marek Menggunakan Metode Imunohistokimia
Nama : Mawar Subangkit
NRP : B351100021
Disetujui, Komisi Pembimbing
Diketahui,
Ketua Program Studi Ilmu Biomedis Hewan
drh. Agus Setiyono, MS. Ph.D. APVet
a.n. Dekan Sekolah Pascasarjana Sekretaris Program Magister
Dr. Ir. Naresworo Nugroho, M.Si
Tanggal Ujian: Tanggal Lulus:
drh. Dewi Ratih Agungpriyono, PhD.APVet
Ketua
Dr.drh. Sri Estuningsih MSi. APVet
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak awal ialah diagnostika penyakit Marek dengan judul Kajian Diagnostik Patologi Penyakit Marek menggunakan metode imunohistokimia.
Terima kasih penulis ucapkan kepada drh. Dewi Ratih Agungpriyono, PhD. APVet dan Dr. drh. Sri Estuningsih, MSi. APVet selaku pembimbing serta Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Lembaga Riset Mochtar Riyadi Institute for Nanotechnology (MRIN) yang telah mendukung terselenggaranya penelitian ini. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, istri, adik-adik saya serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2013
Mawar Subangkit
xii
DAFTAR ISI
Halaman
DAFTAR GAMBAR xvi
DAFTAR TABEL xvii
PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 3
Tujuan 3
Manfaat 3
TINJAUAN PUSTAKA 4
Penyakit Marek 4
Definisi 4
Patogenesa MD 5
Model untuk Limfogenesis MD 6
Imunohistokima 7
Antigen-Antibodi Spesifik 8
MATERI DAN METODE 10
Waktu dan Tempat Penelitian 10
Prosedur Penelitian 10
HASIL DAN PEMBAHASAN 16
Berat Molekul Protein Imunogen 16
Boosting Imunogen 18
Uji PenapisanTiter Antibodi 18
Pemanenan Serum 19
Purifikasi Antibodi 21
Aplikasi Antibodi Poliklonal pada Imunohistokimia 22
KESIMPULAN DAN SARAN 26
DAFTAR GAMBAR
Halaman
1 Gambaran skematik tahap siklus patogenesa penyakit Marek hingga
menyebabkan tumor 6
2 Gambaran skematik mekanisme pembentukan tumor pada penyakit
Marek 7
3 Skematik gambaran molekul antibodi 9
4 Skema jadwal penelitian produksi antibodi poliklonal anti-penyakit
Marek pada kelinci New Zealand White 10
5 Emulsifikasi menggunakan dua spuit kacaaseptis 12 6 Hasil pegujian berat molekul protein sampel vaksin Marek dengan
metode SDS-PAGE 16
7 Alat dan bahan emulsifikasi imunogen 17
8 Gambar hasil koleksi darah dengan teknik pengambilan intracardial 20 9 Gambaran Western Blot row material kelinci yang digunakan dalam
produksi antibodi poliklonal MD 21
10 Hasil SDS-PAGE antibodi poliklonal anti-Marek pasca presipitasi dan
FPLC 22
11 Gambaran histopatologi sampel yang bersifat imunoreaktif 24 12 Foto mikrografi menggunakan pembesaran yang lebih besar dari
gambar 11 25
xiv
DAFTAR TABEL
Halaman
1 Komposisi Pakan Kelinci yang diberikan secara ad libitum selama 4
minggu 11
2 Gambaran derajat keparahan lesio dari infeksi penyakit Marek pada
ayam 15
3 Hasil titer antibodi pada hari ke-10 post induksi imunogen pada produksi antibodi poliklonal pada kelinci New Zealand White 19 4 Hasil titer antibodi pada hari ke-10 post boosting kedua pada produksi
antibodi poliklonal pada kelinci New Zealand White 19 5 Hasil produksi antibodi poliklonal anti-Marek pada kelinci New
Zealand White. 22
BAB I PENDAHULUAN
A.LATAR BELAKANG
Mareks Disease (MD) atau dalam bahasa Indonesia disebut penyakit Marek merupakan salah satu penyakit infeksius atau mudah menular pada unggas, yang disebabkan oleh virus golongan Alphaherpesvirus dari genus Mardivirus. Penyakit Marek ditularkan secara inhalasi atau infeksi terjadi melalui saluran pernafasan. Proses infeksi penyakit Marek dapat terjadi mulai dari umur 3-4 minggu hingga ayam dewasa, namun infeksi sering ditemukan pada umur 12-30 minggu. Kondisi imunosupresi pada kejadian penyakit Marek menyebabkan ayam rentan terhadap infeksi mikroorganisme non-patogen sekaligus. Infeksi sekunder yang terjadi akibat kondisi imunosupresi inilah yang dapat memperparah keadaan unggas yang terinfeksi penyakit Marek (Smith et al. 2011).
Kerugian secara ekonomi dari penyakit Marek diantaranya akibat adanya tumor di berbagai organ. Menurut Huminto et al. (2000), bungkul-bungkul tumor yang ada di berbagai organ akan dapat menyebabkan kerugian dengan diafkirnya beberapa bagian tubuh atau bahkan seluruh bagian tubuh unggas di rumah potong unggas. Tumor tersebut dapat ditemukan di organ interna seperti hati, limpa, jantung dan ginjal, dan bahkan di otot dada dan paha sehingga menurunkan kualitas daging. Penyakit Marek juga mampu ditularkan dengan cara terbawa pada tepung telur yang dimungkinkan melintas di berbagai negara akibat perdagangan internasional. Hal yang demikian ini menyebabkan penanganan kejadian penyakit Marek sulit terdeteksi dan teratasi (Abdu et al. 2006)
Bagian Patologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor merupakan institusi yang dalam keseharian salah satu aktivitasnya menerima sampel diagnosa penyakit unggas dari kalangan peternakan di daerah Jakarta, Banten dan Jawa Barat. Bagian Patologi memiliki 10 orang ahli patologi yang bergelar Ahli Patologi Veteriner (APVet.) yang sudah terbiasa dan berpengalaman mendiagnosa penyakit unggas khususnya penyakit Marek secara mikroskopis dengan pewarnaan Hematoksilin dan Eosin (HE). Selama tahun 2011 kasus unggas yang diterima bagian Patologi dan terdiagnosa sebagai penyakit Marek sebanyak 78 dari 257 kasus penyakit unggas dan tahun 2012 sebanyak 39 dari 311 kasus. Jumlah tersebut merupakan angka yang tinggi dari total kejadian kasus suatu penyakit di lapangan pada sebuah laboratorium pendiagnosa penyakit. Kendala yang dialami untuk mendiagnosa penyakit Marek adalah diagnosa banding yang cukup luas secara makroskopis maupun mikroskopis.
xvi Gambaran makroskopis organ atau patologi anatomi penyakit Marek memiliki gambaran berupa bungkul tumor berwarna putih atau hanya fokus pucat di berbagai organ. Diagnosa banding penyakit Marek yang memiliki gambaran patologi anatomi serupa diantaranya adalah Avian Tuberculosis (Avian TB), Lymphoid Leukosis (LL), Mikosis (mikotik granuloma), koligranuloma dan Avian Salmonellosis (Salmonelosis unggas). Bungkul tumor dan fokus warna pucat pada penyakit Marek merupakan kumpulan sel limfoid T yang teraktivasi. Gambaran yang sama dengan penyakit Marek pada Avian TB, mikotik granuloma dan koligranuloma adalah akibat terbentuknya radang granuloma dan akumulasi sel radang pada organ. Lymphoid Leukosis (LL) merupakan penyakit tumor yang menimbulkan akumulasi sel limfoid di berbagai organ sehingga menghasilkan gambaran makroskopis yang serupa dengan penyakit Marek. Demikian juga pada penyakit Salmonelosis unggas yang menyebabkan akumulasi sel radang di organ terutama hati (Clauer et al. 2009).
Gambaran mikroskopis dengan pewarnaan HE pada penyakit Marek menunjukkan adanya akumulasi sel limfoid yang ukurannya bervariasi atau pleomorfik (Clauer et al. 2009). Namun gambaran pleomorfik inilah yang sulit dibedakan dengan beberapa akumulasi sel limfoid lain seperti pada AE di organ otak dan gizzard serta akumulasi sel radang limfositik lain. Sehingga perlu pengalaman khusus bagi seorang ahli patologi untuk menentukan diagnosa penyakit Marek secara mikroskopis dengan pewarnaan HE.
Kendala diagnosa penyakit Marek seperti yang telah diungkapkan dapat menyulitkan proses diagnosa, penanganan dan pemberantasan penyakit Marek, sehingga perlu dilakukan metode pendiagnosaan terhadap penyakit Marek yang lebih terarah terhadap penyakit Marek, diantaranya adalah metode imunohistokimia (IHK). Santos et al. (2009) dan Kim et al. (2004), menyebutkan bahwa IHK merupakan teknik yang efisien untuk mendeteksi virus golongan Retikuloendotelial dan golongan Alphaherpesvirus, yaitu virus Marek. Antibodi primer poliklonal atau monoklonal terhadap virus Marek akan mengikat antigen secara spesifik pada jaringan sehingga antibodi sekunder yang dikonjugasikan dengan enzim. Enzim yang terkonjugasi dengan antibodi sekunder mampu mengikat warna (kromogen) sehingga menghasilkan visualisasi berupa warna.
B.KERANGKA PEMIKIRAN
Imunohistokimia merupakan metode unggulan dalam mendiagnosa penyakit Marek. Sifat spesifik ikatan antibodi dan antigen, mampu digunakan untuk mendeteksi suatu antigen tertentu. Hal ini dapat digunakan untuk menjawab keraguan terhadap adanya infeksi MD secara histopatologi yang tidak menunjukkan lesio spesifik secara mikroskopis dengan pewarnaan HE.
Produksi antibodi poliklonal anti-Marek merupakan langkah awal dalam melakukan pendeteksian penyakit Marek melalui metode IHK. Produksi antibodi secara ekonomis dapat dilakukan dalam skala laboratorium. Antigen vaksin live Marek yang disuntikkan bersama adjuvan(minyak pembawa) pada hewan kelinci mampu menggertak antibodi kelinci untuk menghasilkan imunoglobulin (IgG) akibat respon adanya protein asing berupa partikel virus Marek yang telah dilemahkan. Imunoglobulin G terhadap penyakit Marek ditemukan dalam serum darah sehingga untuk memperolehnya dilakukan koleksi serum kelinci yang telah diinduksi beberapa kali dengan virus Marek asal vaksin. Purifikasi (pemurnian) antibodi dilakukan untuk memurnikan IgG dari protein dan material lain yang terkandung dalam serum. Serum yang telah dipurifikasi inilah yang dapat digunakan secara akurat sebagai antibodi primer untuk pendeteksian penyakit Marek melalui metode IHK.
C.TUJUAN
Penelitian ini dilakukan untuk memecahkan masalah diagnostik penyakit Marek yang memiliki diagnosa banding yang cukup luas. Produksi antibodi poliklonal anti-Marek menggunakan virus vaksin bertujuan untuk menekan biaya produksi dalam menunjang aplikasi metode IHK di laboratorium diagnostik.
D.MANFAAT
Penyakit Marek merupakan salah satu penyakit unggas yang disebabkan oleh virus. Gejala klinis yang umum terjadi akibat infeksi virus Marek adalah gangguan syaraf yang terlihat sebagai inkoordinasi. Gejala klinis inkoordinasi sering terlihat pada ayam yang masih muda, terutama ayam yang masih memiliki tingkat kekebalan yang rendah. Gejala subklinis terjadi tanpa menunjukkan gejala yang nyata pada unggas. Gejala subklinis yang sering dilaporkan para peternak diantaranya penurunan produksi telur pada ayam petelur (layer) dan peternakan ayam indukan (breeder) serta gangguan pertumbuhan pada ayam pedaging (broiler). Selain gangguan produksi, penyakit Marek mampu menimbulkan gangguan kekebalan tubuh atau imunosupresi. Kejadian imunosupresi ini mendukung terjadinya infeksi sekunder, baik oleh bakteri maupun jamur serta mikroorganisme yang memiliki patogenisitas rendah (Abdu et al. 2006).
Virus Marek merupakan virus yang digolongkan ke dalam genus Mardivirus yang berasal dari golongan Alphaherpesvirus. Virus ini memiliki karakteristik berupa penyebaran yang cepat dan luas serta mengarah pada tumor limfosit T (Smith et al. 2011). Virus Marek memiliki tiga macam serotipe yaitu serotipe-1, serotipe-2 dan serotipe-3. Virus Marek serotipe-1 mampu menginduksi adanya pembentukan tumor (Kamaldeep et al. 2007), sedangkan serotipe lain tidak. Meskipun tidak menimbulkan tumor, serotipe-2 dan serotipe-3 mampu menyebabkan imunosupresi pada unggas yang terinfeksi. Di Inggris, virus Marek strain C12/130 diisolasi dari unggas pada peternakan yang telah divaksin HVT, memberikan gambaran kerusakan organ secara makroskopi (lesio) yang tidak umum, yaitu pembesaran organ limpa serta atrofi organ bursa dan timus akibat fase sitolitik pada organ tersebut. Beberapa fokus tumor di berbagai organ juga ditemukan pada kejadian ini (Barrow dan Venugopal 1999). Gambaran monositosis dari strain C12/130 tampak nyata dan disertai gejala syaraf yang berhubungan dengan infiltrasi sel mononuklear pada meningen otak mulai umur 6 sampai 10 hari pasca infeksi.
Meskipun vaksinasi telah dilaporkan berhasil menurunkan kejadian penyakit MD, namun vaksinasi tidak mampu mencegah evolusi virus yang berjalan terus menjadi virus dengan virulensi yang lebih tinggi. Virus MD dengan virulensi tinggi digolongkan menjadi patotipe yang berbeda yaitu vMDV (virulent MDV), vvMDV (very virulent MDV), vv+MDV (very very virulent MDV). Sejumlah vaksin live attenuated terhadap infeksi virus Marek telah ditemukan diantaranya HVT, MDV-2 strain SB-1, dan penggunaannya telah meluas di hampir seluruh wilayah dunia yaitu strain CV1998/Rispens (Witter 2001).
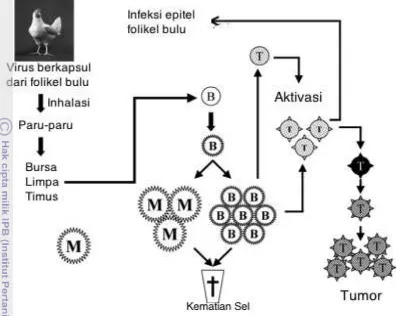
Patogenesa MD
Infeksi virus Marek terjadi secara langsung dari unggas terinfeksi kepada unggas lain. Penyebaran virus terutama terjadi secara aerosol (airborne disease) melalui feather-follicle epithelium (FFE) atau umum disebut sebagai debu bulu. Sel debris asal FFE dapat mengandung virus Marek yang dapat bertahan di lingkungan dan menyebar ke unggas lain. Virus Marek dapat ditemukan di folikel bulu hingga 14 hari post infeksi, namun kejadian tumor pada unggas baru terlihat pada unggas umur 16 minggu (Zhou et al. 2012).
xx Gambar 1 Gambaran skematik tahap siklus patogenesa penyakit Marek hingga menyebabkan tumor. (M) sel memori; (B) sel-B dan sel plasma; (T) sel limfosit T (Nair 2005).
Model untuk Limfogenesis MD
Semua golongan Herpesvirus terutama Alphaherpesvirus merupakan virus yang paling ahli bertahan lama dalam inangnya. Virus Marek melakukan kerusakan minimum pada jaringan yang diinfeksinya. Virus Marek melakukan infeksi berulang (multipel infeksi) pada satu inang yang menyebabkan peningkatan pembentukan tumor secara kronis hingga inang mati (Schat dan Xing 2000).
berada di lingkungan merupakan faktor terbesar dalam memicu perubahan metilasi DNA dan menyebabkan perubahan profil ekspresi gen (Tian et al. 2012).
Gambar 2 Gambaran skematik mekanisme pembentukan tumor pada penyakit Marek. (MDV) virus Marek; (IL) interleukin; (M∅) makrofag; (NK cell) Natural Killer cell (Schat dan Xing 2000).
B.IMUNOHISTOKIMIA
Imunohistokimia (IHK) merupakan metode deteksi protein atau imunogen dalam jaringan dengan prinsip reaksi imunologi melalui deteksi ikatan antigen dan antibodi. Imunohistokimia mempunyai nilai lebih dibandingkan metode imunologi lainnya, seperti Western Blot, ELISA dan PCR yaitu pendeteksian insitu, yaitu dapat menentukan lokasi protein yang diidentifikasi (Santos 2009). Imunohistokimia mulai dikenal pada tahun 1980an, dimana kegunaan imunohistokimia sering dikaitkan dengan deteksi dan menentukan prognosa dari suatu kejadian tumor (Coindre 2003).
Proses imunohistokimia memerlukan antibodi yang secara spesifik mengikat imunogen. Antibodi dengan spesivitas yang tinggi hanya berikatan dengan protein yang sesuai dalam jaringan. Interaksi tersebut kemudian akan divisualisasikan dengan warna yang berasal dari kromogen yang telah dikonjugasikan dengan enzim pada antibodi (Santos 2009).
xxii (Ig) serta berbagai spesies hewan. Protein A merupakan bagian dari dinding sel Staphylococcus aureus yang berguna untuk menentukan letak bakteri Staphylococcus aureus dalam jaringan pada mikroskop cahaya maupun mikroskop elektron. Protein lain yang diisolasi dari dinding sel bakteri Streptococcus kelompok G dikenal sebagai protein G. Seperti halnya protein A, protein G mempunyai afinitas yang kuat terhadap dalam berikatan dengan IgG dari berbagai spesies. Mulai dari penelitian ini berkembang berbagai metode imunohistokimia dengan berbagai imunogen dan antibodi yang dapat mendeteksi keberadaan imunogen dalam jaringan.
Menurut Kumagi dan Kouhei (2001), Interaksi yang terjadi antara antigen dan antibodi dalam proses imunohistokima tidak tampak secara kasat mata. Oleh karena itu diperlukan visualisasi untuk memastikan adanya ikatan antigen-antibodi dalam proses imunohistokimia. Visualisasi yang sering dilakukan adalah dengan warna dan fluoresen. Untuk dapat mengikat warna, antibodi dilabel dengan konjugat enzim atau fluorokom. Enzim tersebut akan direaksikan dengan kromogen sehingga menunjukkan warna, namun untuk fluorokom dapat langsung diamati dengan mikroskop fluoresen dan akan memendarkan warna.
Heidari et al. (2007) melakukan pewarnaan imunohistokimia pada kasus Marek dengan antibodi anti Meq. Meq merupakan salah satu asam amino penyusun Marek. Meq ini yang berperan dalam mengekspresikan gen ke arah pembentukan jaringan tumor. Meq mengubah karakteristik limfosit T dalam perkembangan dan proliferasinya untuk menjadi limfoma. Menurut Heidari et al. (2007), Meq membuat perubahan secara laten sel limfosit T untuk mengarahkan perkembangan sel menjadi bersifat onkogenik.
C.ANTIGEN-ANTIBODI SPESIFIK
Antibodi (immunoglobulin) adalah bahan utama yang dihasilkan oleh sistem kekebalan tubuh pada hampir semua hewan untuk menanggapi adanya infeksi agen asing. Hewan vertebrata memiliki tanggap kebal yang komplek sebagai pencegahan dan tindakan dalam mengatasi infeksi agen asing seperti virus. Menurut Kumagi dan Kohei (2001), antibodi merupakan kelompok glikoprotein yang berada dalam serum darah dan berikatan secara spesifik dengan molekul protein asing atau antigen. Pada mamalia terdapat lima kelompok antibodi, yaitu IgG, IgA, IgM, IgE, dan IgD. Kelompok imunoglobulin yang paling penting dalam proses imunohistokimia adalah IgG dan IgM.
Mekanisme dan fungsi dari berbagai imunoglobulin sangat komplek. IgM yang diproduksi pada awal reaksi peradangan berfungsi untuk mengeliminasi patogen. Kerja dari IgM diperantarai oleh Sel B mediated immunity. IgG diproduksi akibat kemokin yang dihasilkan oleh IgM dalam menanggapi reaksi peradangan. Keberadaan IgM dalam sirkulasi terus berlangsung hingga keberadaan IgG cukup. IgG mempunyai dua fungsi terpisah dalam menanggapi reaksi peradangan oleh suatu protein, pertama yaitu untuk mengikat patogen yang telah diekspresikan oleh sistem tanggap kebal dan kedua, merespon tanggap kebal tersebut dengan memanggil sel dan molekul lain untuk merusak antigen.
berat 50 kDa, sehingga total berat molekul protein sebesar 150 kDa, seperti ditunjukkan oleh gambar 3 (Koivunen dan Krogsrud 2006).
Gambar 3 Skematik gambaran molekul antibodi (Koivunen dan Krogsrud 2006).
Imunoglobulin G memiliki komponen terbanyak dari immunoglobulin lain dalam sirkulasi. Bagian dari imunoglobulin yang paling penting dalam imunohistokimia adalah fragmen Fc. Fragmen Fc ini yang berikatan secara langsung dengan imunogen untuk melakukan mekanisme netralisasi imunogen.
xxiv BAB III
MATERI DAN METODE
A.WAKTU DAN TEMPAT PENELITIAN
Penelitian dilaksanakan di Bagian Patologi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Bagian patologi ini membawahi Laboratorium Diagnostik Patologi, Laboratorium Histopatologi, Laboratorium Kultur Jaringan, dan Laboratorium Riset. Sampel yang digunakan dalam penelitian ini berasal dari laboratorium Diagnostik Patologi dan Laboratorium Histopatologi. Uji konfirmasi antibodi dilakukan di Laboratorium Imunologi Mochtar Riady Institute for Nanotechnology (MRIN), Lippo-Karawaci Tangerang. Uji konfirmasi ini meliputi uji titer antibodi (dengan menggunakan metode Enzym Linked Immunosorbent Assay/ELISA), Sodium Dedocyl Sulfate-Polyacrilamide Agar Gel Electrophoresis (SDS-PAGE), dan Western Blot.
Waktu penelitian dilakukan selama 6 bulan yang dibagi menjadi tiga tahap, yaitu produksi antibodi, pemurnian antibodi, dan aplikasi antibodi. Produksi antibodi dilakukan selama 8 minggu, pemurnian antibodi selama 4 minggu dan aplikasi antibodi dilakukan selama 12 minggu. Agenda penelitian dengan berbagai kegiatan terlihat pada gambar 4.
Gambar 4 Skema jadwal penelitian produksi antibodi poliklonal anti-Marek pada kelinci New Zealand White.
B.PROSEDUR PENELITIAN
Produksi Antibodi Poliklonal
Produksi antibodi poliklonal anti-Marek dilakukan pada 2 ekor kelinci jantan jenis New Zealand White yang berumur 8 minggu. Alat dan bahan yang digunakan adalah kandang kelinci tipe kelompok dengan ukuran kandang 1x1x1 meter, pakan kelinci komersial, air minum mineral komersial, Obat-obatan untuk aklimatisasi massa adaptasi (albendazole, metronidazole, ketoconazole, ivermectine®, dan multivitamin), Complete Freund’s Adjuvant (CFA), incomplete
Freund’s Adjuvant (IFA), spuit emulgator (Syringe double luer lock).
protein 14-16% (tabel 1). Pencahayaan kandang diatur dengan sistem 12 jam terang dan 12 jam gelap dengan suhu antara 25±1oC dan kelembaban 70-80%.
Kelinci diadaptasikan selama 8 hari dengan agenda perlakuan berupa; hari ke-1 dilakukan pemberian albendazole dengan dosis 25mg/KgBB secara per-oral yang bertujuan untuk mengeliminasi endoparasit cacing dalam saluran pencernaan. Hari ke-2 hingga ke-5 diberikan amoxyciline dengan dosis sebesar 25 mg/KgBB secara per-oral dengan tujuan mengeliminasi bakteri sistemik yang akan mengganggu jalannya penelitian. Hari ke-6 diberikan metronidazole dengan dosis 15 mg/KgBB secara per-oral yang bertujuan untuk mengeliminasi parasit protozoa dalam saluran pencernaan. Hari ke-7 diulang kembali pemberian albendazole dengan metode dan dosis yang sama. Hari ke 8 diberikan Ivermectine® untuk mengeliminasi ektoparasit dan beberapa endoparasit dengan
dosis 0.02 ml Ivermectin® 1% secara subkutan.
Tabel 1 Komposisi Pakan Kelinci yang diberikan secara ad libitum selama 4
xxvi Gambar 5 Emulsifikasi dengan menggunakan dua spuit kaca aseptis. (A) antigen dan adjuvan dimasukkan ke dalam spuit kaca dengan perbandingan 1:1, (B) antigen dan adjuvan dicampur dengan mengalirkan dari satu spuit kaca satu ke spuit kaca lain beberapa kali hingga emulsi stabil, (C) emulsi siap diinjeksi kepada host.
Keberhasilan hasil emulsifikasi diuji dengan cara meneteskan hasil emulsifikasi dalam aquades. Emulsi yang baik tidak pecah atau menyebar apabila diteteskan dalam aquades dan sebaliknya, emulsi yang kurang baik akan menyebar apabila diteteskan dalam aquades dan perlu dilanjutkan kembali proses emulsifikasi.
Rute Induksi dan Boosting
Induksi atau imunisasi imunogen dilakukan melalui rute subkutan dengan menyuntikkan emulsi antara antigen dan adjuvan sebanyak 1.0 ml dengan perbandingan 1:1. Emulsifikasi dilakukan menggunakan spuit dengan jarum pengemulsi ukuran 20 inci yang mampu mengalirkan emulsi dengan baik tanpa merusak emulsi. Alat-alat yang diperlukan dalam melakukan induksi atau imunisasi imunogen adalah alkohol 70%, spuit ukuran 1 ml dan jarum ukuran 20 inci.
Prosedur induksi imunogen diawali dengan menyucihamakan menggunakan alkohol 70% pada tempat dilakukannya penyuntikan. Bagian kulit yang diinjeksi ditarik dan jarum dimasukkan ke jaringan di bawah kulit, selanjutnya imunogen disuntikkan sejumlah 0.25 ml pada tiap daerah suntikan. Daerah suntikan imunogen sebanyak 4 daerah suntikan yaitu 2 tempat tepat diatas scapula kanan dan kiri dan 2 tempat tepat diatas persendian coxi-femoral. Setelah diinjeksikan kulit tetap ditekan dan ditunggu beberapa detik agar imunogen dapat dipastikan benar-benar masuk dalam daerah subkutan.
Boosting dilakukan dengan metode dan cara penyiapan yang sama dengan tindakan induksi, bedanya penggunaan adjuvan yang diperlukan adalah jenis IFA. Boosting dilakukan 3 minggu dari induksi dan boosting kedua juga dilakukan dengan jarak waktu selama 3 minggu dari boosting pertama.
dengan metode indirect ELISA. Hasil inkubasi dibaca dalam ELISA reader untuk menghitung titer antibodi yang telah diperoleh dari setiap induksi dan boosting.
Terminal Bleeding dan Pemanenan Serum
Terminal bleeding merupakan teknik pengambilan darah langsung ke jantung dengan tujuan mendapatkan jumlah darah dengan volume yang sebanyak-banyaknya, umumnya sampai hewan kehabisan darah dan pada akhirnya di-euthanasia. Pengambilan darah tersebut dilakukan untuk mendapatkan antibodi dalam jumlah banyak yang berada dalam serum kelinci. Waktu yang tepat untuk pemanenan serum ditentukan oleh hasil uji titer antibodi yang dilakukan dengan metode ELISA. Titer antibodi dikatakan meningkat optimal apabila titer antibodi mengalami peningkatan minimal 15 kali dibandingkan dengan kontrol.
Langkah awal pada proses pemanenan serum adalah dengan melakukan anesthesia terhadap kelinci menggunakan campuran ketamin (dosis 35 mg/kgBB) dan xylazin (dosis 5 mg/kgBB) yang diaplikasikan secara parenteral intramuskular pada otot semitendinosus. Langkah berikutnya adalah mencukur rambut daerah ventral torak dan dilanjutkan desinfeksi menggunakan alkohol 70%. Jarum yang digunakan ukuran 18G dan spuit yang digunakan dengan kapasitas 30 ml.
Jarum diinjeksikan ke organ jantung dengan sudut 30 derajat melalui kulit di daerah xyphoideus ke arah cranial menuju tengah rongga dada. Pengambilan darah untuk kelinci ukuran 2-3 kg, sejumlah 30-40 mL. Darah tersebut disimpan dalam flacon acrylic. Darah yang telah diperoleh disimpan pada suhu ruang (±25oC) selama 2 jam dan dilanjutkan penyimpanan pada suhu 4oC selama satu malam (overnight). Serum yang diperoleh dipisahkan secara manual dengan aspirasi dan disempurnakan dengan sentrifugasi pada 10.000 xg (g = [1.118 × 10-5] R RPM2) selama 15 menit. Serum yang diambil disentrifugasi kembali pada 10.000 xg selama 10 menit.
Pemurnian Antibodi
Pemurnian antibodi dilakukan dengan dua metode berkelanjutan, yaitu metode presipitasi dan dilanjutkan metode Fast Protein Liquid Chromatography (FPLC). Bahan utama yang diperlukan pada metode presipitasi adalah amonium sulfat sedangkan bahan utama yang diperlukan pada metode FPLC adalah matriks Sepharos G.
Presipitasi menggunakan amonium sulfat dilakukan dengan melarutkan 385g amonium sulfat murni dalam 500 ml aquades, dimana metode perhitungan dilakukan dengan bantuan software Biocalc Ammonium Sulfate Precipitation (©Encor Biotechnolgy Inc. 2012). Proses pelarutan amonium sulfat yaitu dengan dipanaskan hingga 100oC kemudian diaduk selama 30 menit tanpa pemanasan. Kemudian larutan didinginkan dan disaring dengan milipore 0.45 um dan disimpan pada suhu 4oC. Proses presipitasi dilakukan dari 20%, 45% dan 50% hingga 100% terpresipitasi. Alat yang dibutuhkan adalah tabung sentrifugasi, es, serum yang akan dipresipitasi, alat sentrifugasi, gelas beaker ukuran 100 mL, 500 mL dan 2 Liter, pengaduk magnetik (stirrer), pipet tetes, dan tabung dialisis.
xxviii amonium hidroksida dan selanjutnya disentrifugasi pada suhu 4oC pada 10.000 xg selama 30 menit. Filtrat atau pellet yang telah didapatkan dilarutkan kembali sehingga didapatkan ¼ volume awal antibodi dengan 5mM sodium phosphate (pH 6.5) untuk dipisahkan kembali dengan filtrasi dengan ukuran kapiler 0.22 µm dan selanjutnya dilakukan dialisis dengan kolom dialisis.
Garam amonium sulfat dihilangkan dengan kaset dialisis berkapasitas 18 mL. Tahapan dialisis dilakukan dengan memasukkan serum terpresipitasi dalam kolom dialisis dan menempatkannya dalam PBS pH 6.8-7.2 untuk dilakukan dialisis selama 24 jam dengan penggantian PBS sebanyak 3 sampai 4 kali. Sehingga diperoleh supernatan berupa antibodi IgG yang telah dipurifikasi dengan harapan tingkat kemurnian sebanyak 50-60%.
Proses pemurnian antibodi selanjutnya dilakukan dengan FPLC memakai alat AKTA™Purifier. Matriks sepharose G digunakan pada column c/c untuk pemurnian IgG terhadap antibodi yang sudah diperoleh, dengan sample loop yang dipakai 100 µl, sampel yang dimasukkan sebanyak 100 µL setiap kali mesin dijalankan, kemudian fraksi antibodi diamati melalui komputer yang tersambung ke mesin dengan software Unicorn 5.1, sehingga fraksi antibodi yang diinginkan ditampung pada tabung flacon. Hasil purifikasi dari FPLC dideteksi dengan menggunakan metode SDS-PAGE untuk menentukan berat molekul antibodi dan memastikan jenis protein yang diperoleh adalah antibodi IgG.
Kasus Diagnostik Patologi Penyakit Marek di Bagian Patologi FKH-IPB
Sampel yang diambil berasal dari organ unggas yang terduga Marek atau telah didiagnosa MD secara Patologi Anatomi (PA) dan Histopatologi (HP) dengan pewarnaan general Haematoxylin dan Eosin (HE). Metode diagnosa yang telah dilakukan Laboratorium Patologi FKH-IPB secara PA adalah dengan menemukan multifokus tumor di berbagai organ termasuk kebengkakan kelenjar proventrikulus, multifokus nodular di berbagai organ dan nekrosa sebagian otak. Secara HP untuk merumuskan MD harus menemukan akumulasi sel limfoid yang bervariasi (Limfotropik tumor) di berbagai organ. Sampel yang berasal dari Bagian Patologi digolongkan menjadi 3 berdasarkan gambaran tingkat keparahan infeksi menurut histopatologi, yaitu infeksi ringan, sedang dan berat. Gambaran tingkat keparahan infeksi dapat dilihat pada tabel 2.
Tingkat Infeksi
• Lesio saraf perifer dan saraf pusat tidak terlihat
• Terdapat akumulasi sel limfoid tepi buluh darah ringan dibeberapa organ
• Kerusakan jaringan sangat minim
Sedang
• Anamnesa: gejala klinis tidak nyata, terjadi penurunan produksi
• Lesio saraf perifer ringan namun tidak terdapat lesio saraf pusat
• Terdapat akumulasi cukup banyak hingga menyebabkan thrombus di
tepi buluh darah pada beberapa organ
• Kerusakan jaringan terjadi akibat kondisi infark
Berat
• Anamnesa: gejala klinis nyata, terjadi penurunan produksi
• Lesio saraf perifer dan saraf pusat sedang hingga berat
• Terdapat akumulasi cukup banyak hingga menyebabkan tumor trombus
di tepi buluh darah pada beberapa organ
• Kerusakan jaringan terjadi akibat kondisi infark
Penentuan tingkat infeksi dilakukan seorang Pathologist yang telah berpengalaman di bidang diagnostik secara mikroskopis (histopatologi). Metode histopatologi adalah embeeding paraffin dengan potongan setebal 5 µm dengan pewarnaan Haematoksilin dan Eosin (HE).
Pewarnaan Imunohistokimia Metode Stretavidine-Biotin Peroxidase
Pewarnaan imunohistokimia (IHK) dilakukan pada jaringan yang diberikan perekat berupa Poly-L Lysine. Jaringan dipotong dengan ketebalan 5 µm dengan metode embeeding paraffin. Pemotongan dilakukan dengan mikrotom rotari dengan merek American Optic Spencer.
Tahap pewarnaan IHK diawali dengan deparafinasi dengan meletakkan potongan jaringan dalam inkubator dengan 57-58oC selama 2 jam. Potongan diletakakan dalam xylene sebanyak 3 kali dengan waktu masing-masing selama 5 menit. Selanjutnya dilakukan rehidrasi menggunakan etanol beringkat mulai dari etanol absolut, etanol 96%, etanol 80%, dan etanol 70% masing-masing selama 5 menit. Potongan jaringan direndam dalam destilated water (DW) selama 2 menit.
xxx BAB IV
HASIL DAN PEMBAHASAN
A.BERAT MOLEKUL PROTEIN IMUNOGEN
Imunogen merupakan protein asing yang diinfeksikan pada inang sehingga inang memproduksi kekebalan spesifik khususnya IgG terhadap protein tersebut. Imunogen yang digunakan pada penelitian ini adalah vaksin live Marek strain Herpesvirus of Turkey (HVT). Pemilihan imunogen ini dilakukan dengan pertimbangan bahwa strain virus Marek yang banyak ditemukan pada kasus unggas di Indonesia adalah strain HVT. Vaksin live merupakan vaksin yang masih memiliki struktur virus yang lengkap, namun memiliki patogenisitas yang rendah. Struktur virus vaksin yang lengkap tersebut mampu memicu pembentukan antibodi yang masih sesuai dengan antigen yang terdapat di lapang.
Vaksin Marek yang digunakan merupakan jenis vaksin monovalen dimana hanya terkandung satu jenis virus dan material pembawa lainnya. Jumlah virus yang tunggal dalam vaksin Marek inilah yang digunakan sebagai imunogen dalam produksi antibodi. Satu imunogen yang diinduksikan mampu menggertak antibodi yang spesifik terhadap virus Marek. Namun demikian, profil protein imunogen perlu diketahui untuk menentukan berat molekul protein dan tingkat spesifitas atau kemurniannya.
Metode yang digunakan untuk mengetahui profil protein imunogen yang digunakan adalah dengan Sodium Dedocyl Sulfate-Polyacrilamide Agar Gel Electrophoresis (SDS-PAGE). Hasil pengukuran berat molekul protein dengan metode SDS-PAGE asal vaksin live MD terlihat pada gambar 6.
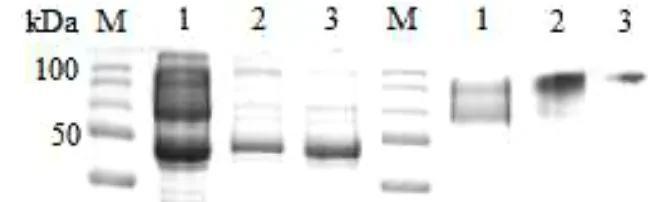
Gambar 6 Hasil pegujian berat molekul protein sampel vaksin Marek dengan metode SDS-PAGE. Hasil SDS-PAGE menunjukkan berat molekul dominan pada band 50 dan 100 kDa.
Marker yang digunakan dalam proses SDS-PAGE protein dari vaksin live Marek strain HVT adalah Precision Plus ProteinTM Standards. Sampel marker ini diproses dengan jenis substrat gel Tris-HCl 4-20% dimana gel tersebut yang mampu memfiltrasi protein secara bertahap berdasarkan bobot molekul protein. Pori-pori gel berfungsi untuk menahan protein dengan bobot molekul tertentu pada posisi tertentu sehingga diperoleh satu atau lebih posisi protein tergantung kemurniannya. Pewarna yang digunakan adalah Methylen Blue sehingga memberikan warna biru pada gel yang digunakan. Tansfer warna tersebut ke dalam kertas dilakukan dengan metode elektroforesis.
Induksi imunogen dilakukan dengan adjuvan yang dilengkapi dengan mikobakterium yang telah dilemahkan. Nama dari adjuvan ini adalah Complete Freund’s Adjuvant (CFA). Penyuntikan imunogen sebesar 250 µg dan dibagi menjadi 4 penyuntikan. Dua tempat suntikan berada subkutan di atas scapula dan dua tempat suntikan berada subkutan di atas femur. Pembagian menjadi 4 tempat penyuntikan diharapkan imunogen mampu menggertak imunoglobulin dari beberapa kelenjar pertahanan, baik pertahanan regio frontal maupun regio caudal.
Pembuatan adjuvan dengan spuit emulgator membutuhkan waktu sekitar 15 menit hingga terbentuk emulsi yang stabil. Pengujian kestabilan emulsi dengan meneteskan hasil emulsifikasi pada permukaan air. Apabila emulsi tersebut tidak menyebar artinya emulsi tersebut telah stabil. Apabila masih menyebar, emulsi tersebut masih perlu dilakukan emulsifikasi kembali.
Mikobakterium yang berada dalam adjuvan membuat radang granuloma di subkutan inang pada tempat penyuntikan. Radang granuloma tersebut membuat pelepasan imunogen dapat terjadi secara perlahan-lahan dan bertahap. Proses tersebut mampu menggertak imunoglobulin lebih optimal. Gambar 7 merupakan peralatan dan proses emulsifikasi.
xxxii
B. BOOSTING IMUNOGEN
Boosting imunogen merupakan tindakan yang dilakukan dengan tujuan untuk meningkatkan kembali titer antibodi yang mulai menurun setelah induksi imunogen yang sama sebelumnya. Boosting imunogen dalam produksi antibodi dilakukan terus menerus dengan periode waktu tertentu sampai diperoleh titer antibodi yang optimal. Titer antibodi dikatakan optimal apabila titer antibodi hasil boosting imunogen mencapai 15 kali lipat dari normal. Pembanding yang dipakai untuk mengetahui kenaikan titer antibodi adalah dengan menggunakan kelinci dan prosedur yang sama, namun imunogen digantikan dengan NaCl fisiologis.
Boosting imunogen dilakukan pada hari ke-14 post induksi imunogen sebelumnya dengan metode dan rute yang sama. Uji penapisan titer antibodi dilakukan untuk mengetahui peningkatan titer antibodi pasca induksi dan boosting. Tindakan uji penapisanini dilakukan pada hari ke 10 pasca induksi atau boosting karena antibodi akan meningkat secara optimal mulai hari ke-7 hingga ke-10 pasca induksi atau setiap boosting (Horvath et al. 2002). Hasil titer yang belum optimal memerlukan boosting kembali agar titer yang dihasilkan lebih optimal pada saat dipanen. Boosting dilakukan dengan jumlah imunogen yang sama namun adjuvan yang dipakai merupakan Incomplete Freund’s Adjuvant (IFA). Adjuvan jenis ini merupakan adjuvan murni tanpa penambahan mikobakterium. Adjuvan ini seringkali berupa minyak jagung atau aluminium, yang berfugsi untuk menjaga agar pelepasan imunogen dapat terjadi secara perlahan.
Prosedur yang dilakukan dalam boosting imunogen sama dengan prosedur induksi imunogen. Jumlah imunogen sebanyak 250 µg disuntik pada 4 tempat suntikan supaya menghasilkan reaksi yang optimal. Emulsifikasi yang dilakukan sama dengan proses pada induksi imunogen. Waktu yang tepat untuk dilakukan boosting adalah pada saat titer mulai menurun tetapi titer belum sampai habis. Waktu 14 hari post induksi atau boosting pertama merupakan waktu dimana titer mulai menurun tetapi belum sampai titer dalam angka nol. Jumlah boosting yang dilakukan berdasarkan pada hasil uji penapisan. Jumlah titer hasil imunisasi dijadikan pedoman waktu untuk dilakukan terminal bleeding. Parameter keberhasilan tindakan boosting terlihat dari hasil uji penapisan titer antibodi, dimana titer tersebut akan meningkat lebih tinggi dari titer induksi atau boosting sebelumnya.
C.UJI PENAPISAN TITER ANTIBODI
Uji penapisan menggunakan metode ELISA dilakukan pada 10 hari post induksi atau boosting. Pada 10 hari post induksi atau boosting merupakan tahap fase log dimana 4 hari kemudian berada pada lag fase (puncak). Pengujian 10 hari post induksi merupakan parameter untuk menentukan keputusan 4 hari kemudian, apakah sudah bisa dipanen atau belum. Hasil pengujian titer dengan ELISA pada hari ke-10 post induksi terlihat pada tabel 3.
Tabel 3 Hasil titer antibodi pada hari ke-10 post induksi imunogen pada produksi antibodi poliklonal pada kelinci New Zealand White.
Kelompok Ulangan I Ulangan II Rataan Titer
Kontrol 1.470 1.484 1.477
Kelinci A 3.569 3.572 3.571
Kelinci B 3.656 3.663 3.660
Blank 0.054 0.049 0.052
Data yang diperoleh belum menunjukkan hasil titer yang maksimal. Kelinci A dan B memiliki rataan titer 3.615, sedangkan kelinci kontrol menunjukkan titer sebesar 1.477. peningkatan yang terjadi sebesar 2.45 kali yang merupakan angka yang cukup kecil untuk dilakukan pemanenan serum. Uji penapisan kedua terhadap titer yang dihasilkan adalah 10 hari post boosting pertama. Hasil yang diperoleh terlihat pada tabel 4.
Tabel 4 Hasil titer antibodi pada hari ke-10 post boosting pertama pada produksi antibodi poliklonal pada kelinci New Zealand White.
Kelompok Ulangan I Ulangan II Rataan Titer
Kontrol 0.135 0.110 0.123
Kelinci A 4.204 4.126 4.165
Kelinci B 4.191 4.126 4.159
Blank 0.073 0.041 0.057
Data yang diperoleh menunjukkan rataan titer dari kedua kelinci adalah 4.162. Hasil titrasi titer kelompok kelinci perlakuan dibandingkan dengan titer kelinci kelompok kontrol tersebut sudah naik sekitar 33 kali lipat. Kondisi ini merupakan kondisi yang optimal untuk dilakukan pemanenan serum.
Hasil uji penapisan titer antibodi tersebut menunjukkan bahwa metode induksi dan boosting telah dilakukan dengan baik, ditunjukkan dengan adanya peningkatan titer antibodi yang signifikan. Hasil titer antibodi pasca induksi dan boosting pertama belum menunjukkan angka yang optimal sehingga perlu reboosting untuk mencapai angka yang optimal. Hasil boosting kedua menunjukkan angka yang optimal sehingga pemanenan serum dapat dilakukan untuk mendapatkan jumlah antibodi yang maksimal.
D.Pemanenan Serum
xxxiv banyak karena lumen ventrikel jantung yang luas dan tekanan aliran darah yang cukup tinggi. Pengambilan darah dilakukan pada dua ekor kelinci yaitu kelinci A dan kelinci B yang merupakan ulangan pada produksi antibodi anti-Marek dimana kelinci-kelinci ini telah diinduksi imunogen asal vaksin Marek. Hasil yang diperoleh pada kelinci A sejumlah 35 mL dan kelinci B sejumlah 37 mL. jumlah tersebut merupakan jumlah optimal pengambilan darah terakhir pada kelinci dengan rataan berat badan sebesar 3.7 Kg.
Gambar 8 Gambar hasil koleksi darah dengan teknik pengambilan intracardial yang ditempatkan pada tissue culture flash dengan tujuan agar permukaan darah luas sehingga didapatkan serum dengan jumlah yang maksimal.
Darah yang telah diambil dilakukan pemisahan serum dan didapatkan total dari kedua kelinci diperoleh serum sejumlah 28.7 mL serum. Serum tersebut disimpan pada suhu -20oC menunggu untuk dilakukan purifikasi antibodi. Serum merupakan komponen darah yang didalamnya mengandung imunoglobulin yang merupakan tanggap kebal dari semua perlakuan yang kita berikan.
Gambar 9 Gambaran Western Blot dari serum (row material) kelinci yang digunakan dalam produksi antibodi poliklonal anti-Marek. Warna cokelat yang dihasilkan menunjukkan bahwa ada kesesuaian antara antibodi yang dihasilkan dengan imunogen yang diberikan, sedangkan warna biru merupakan marker yang digunakan untuk menentukan berat molekul.
Western Blot merupakan model untuk penerapan ikatan antigen-antibodi yang dilakukan secara in vitro. Metode ini digunakan untuk memastikan adanya kecocokan antara antibodi yang telah diproduksi dengan imunogen yang diberikan. Tidak ada faktor lain yang menganggu aktivitas ikatan komplek antigen-antibodi yang terjadi. Warna cokelat yang dihasilkan akibat penggunaan kromogen dengan jenis diaminobenzidine (DAB) yang merupakan pewarna umum dalam metode Western Blot.
E.PURIFIKASI ANTIBODI
Pemurnian antibodi dilakukan dengan dua tahap utama, yaitu presipitasi dan Fast Protein Liquid Chromatography (FPLC). Tahap presipitasi dilakukan dengan menggunakan ammonium sulfat yang berfungsi sebagai pengikat IgG. Hasil yang diperoleh dari 28.7 mL serum diperoleh konsentrat IgG dan ammonium sulfat sejumlah 13.8 mL. Serum sejumlah 2 mL dari hasil presipitasi dilakukan pemurnian dengan FPLC dengan kolom pemisah menggunakan sepharos G, dimana bahan ini berfungsi spesifik untuk isolasi IgG. Hasil FPLC yang diperoleh dari 2 ml serum post presipitasi didapatkan 159 µL antibodi poliklonal murni.
xxxvi Gambar 10 Hasil SDS-PAGE antibodi poliklonal anti-MD pasca presipitasi (1, 2, 3) dan pasca FPLC (4, 5, 6). Hasil presipitasi belum menunjukkan berat molekul yang spesifik ditandai dengan banyaknya band yang terlihat sedangkan hasil purifikasi post FPLC telah menunjukkan 1 band dominan.
Antibodi poliklonal yang diperoleh diaplikasikan untuk imunohistokimia dengan pengenceran 1 : 500 hingga 1000. Setiap potongan jaringan yang diwarnai dibutuhkan antibodi yang telah diencerkan sebanyak 250 µL. Jadi dari 159 µL antibodi murni tersebut dapat digunakan untuk mewarnai lebih dari 200 potongan jaringan. Tabel proses produksi antibodi dapat dilihat dari tabel 5.
Tabel 5 Data hasil produksi antibodi poliklonal anti-Marek pada Kelinci New Zealand White.
Analogi hasil produksi antibodi yang dilakukan pada kelinci New Zealand White ini menunjukkan bahwa dari 2 mL serum hasil presipitasi menghasilkan 159µL serum murni post FPLC. Apabila 13.8 mL serum hasil presipitasi ini dilakukan pemurnian tahap FPLC maka akan dihasilkan (13.8/2) x 159 µL = 1097.1 µL. Pengenceran yang digunakan dalam aplikasi antibodi adalah 1:1000 dengan asumsi 1 potongan jaringan memerlukan 250 µL antibodi, sehingga apabila antibodi ini digunakan dalam metode imunohistokimia akan dapat digunakan sebanyak 1097.1 x 1000 / 250 = 4388.4 potongan jaringan. Angka ini cukup ekonomis dibandingkan dengan membeli produk komersial.
F. APLIKASI ANTIBODI POLIKLONAL PADA IMUNOHISTOKIMIA
digunakan adalah streptavidin-biotin peroksidase dan hasil yang diperoleh adalah terlihat pada tabel 6.
Tabel 6 Hasil uji IHK metode Streptavidin-Biotin Peroksidase, sampel terduga terinfeksi Marek dengan antibodi poliklonal anti-MD
Kategori Infeksi
(HE)
Jumlah Sampel
Imunohistokimia % Keberhasilan Positif Negatif
Kontrol Positif 3 3 0 100.00%
Ringan 9 7 2 77.78%
Sedang 11 10 1 90.90%
Berat 17 17 0 100.00%
Total Sampel 37 34 3 91.89%
xxxviii
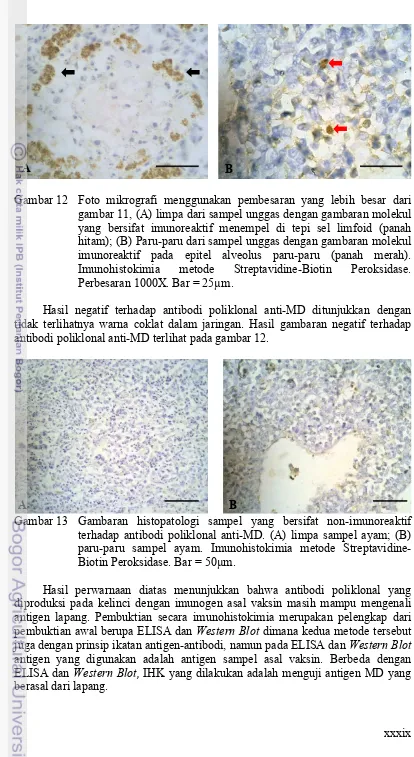
Gambar 11 Gambaran histopatologi sampel yang bersifat imunoreaktif (warna coklat) terhadap antibodi poliklonal anti-MD (A) limpa dari sampel unggas dengan derajat infeksi berat; (B) ginjal dari sampel unggas dengan derajat infeksi sedang; (C) Bursa Fabricius dari sampel unggas dengan derajat infeksi ringan; (D) Bursa Fabricius dari sampel unggas dengan derajat infeksi berat. Imunohistokimia metode Streptavidine-Biotin Peroksidase. Perbesaran 400X. Bar = 50µm.
Hasil pewarnaan IHK yang bersifat imunoreaktif menunjukkan warna coklat karena kromogen yang dipakai adalah diaminobenzidine (DAB). Materi yang terwarnai berada pada sitoplasma sehingga perlu pewarnaan latar yang mampu mewarnai inti sel. Pewarnaan latar yang digunakan adalah Mayer Hematoksilin. Pewarnaan latar ini juga memberi kesan kontras sehingga hasil gambar yang diperoleh mudah untuk diidentifikasi. Hasil pewarnaan IHK yang bersifat imunoreaktif terlihat pada gambar 11.
A B
Gambar 12 Foto mikrografi menggunakan pembesaran yang lebih besar dari gambar 11, (A) limpa dari sampel unggas dengan gambaran molekul yang bersifat imunoreaktif menempel di tepi sel limfoid (panah hitam); (B) Paru-paru dari sampel unggas dengan gambaran molekul imunoreaktif pada epitel alveolus paru-paru (panah merah). Imunohistokimia metode Streptavidine-Biotin Peroksidase. Perbesaran 1000X. Bar = 25µm.
Hasil negatif terhadap antibodi poliklonal anti-MD ditunjukkan dengan tidak terlihatnya warna coklat dalam jaringan. Hasil gambaran negatif terhadap antibodi poliklonal anti-MD terlihat pada gambar 12.
Gambar 13 Gambaran histopatologi sampel yang bersifat non-imunoreaktif terhadap antibodi poliklonal anti-MD. (A) limpa sampel ayam; (B) paru-paru sampel ayam. Imunohistokimia metode Streptavidine-Biotin Peroksidase. Bar = 50µm.
Hasil perwarnaan diatas menunjukkan bahwa antibodi poliklonal yang diproduksi pada kelinci dengan imunogen asal vaksin masih mampu mengenali antigen lapang. Pembuktian secara imunohistokimia merupakan pelengkap dari pembuktian awal berupa ELISA dan Western Blot dimana kedua metode tersebut juga dengan prinsip ikatan antigen-antibodi, namun pada ELISA dan Western Blot antigen yang digunakan adalah antigen sampel asal vaksin. Berbeda dengan ELISA dan Western Blot, IHK yang dilakukan adalah menguji antigen MD yang berasal dari lapang.
A B
xl BAB V
KESIMPULAN DAN SARAN
A. KESIMPULAN
Hasil penelitian produksi antibodi anti-Marek menggunakan imunogen asal vaksin live komersial dan dilakukan pada kelinci strain New Zealand White menunjukkan bahwa antibodi yang dihasilkan mampu mengenali antigen lapang yang berada dalam jaringan menggunakan metode imunohistokima. Antibodi yang dihasilkan cukup banyak dan dari sisi ekonomi, biaya produksi dan hasil memberikan efisiensi yang lebih. Bahkan dengan purifikasi sederhana (presipitasi) sudah mampu menunjukkan hasil yang cukup baik.
Kajian patologi terhadap kasus di Laboratorium Patologi, FKH-IPB menunjukkan bahwa peran dari IHK adalah sebagai uji konfirmatif untuk mendukung diagnosa yang telah ada. Diagnosa secara konvensional (Pewarnaan Hematoksilin dan Eosin) telah menunjukkan hasil yang baik dengan tingkat kebenaran hingga 91.87%. Namun perlunya metode IHK masih sangat diharapkan untuk mampu melengkapi diagnosa.
B. SARAN
DAFTAR PUSTAKA
Abdu PA, L Sa’idu, AM Wakawa. 2006. Marek’s Disease. Manual of Important Poultry Diseases in Nigeria, First edition. ABU Press Limited, Zaria, Nigeria, pp 24-25.
Baaten BJG, GJ Underwood, C Butter, TF Davison. 2007. Infection with Marek’s Disease Herpesvirus by the Natural Route. http://www.zootecnicainternational.com. [3 Mei 2012].
Barrow A and K Venugopal. 1999. Molecular Characteristics of very Virulent European MDV isolates. Acta Virologica, 43 (2-3): 90–93.
Biggs PM. 2004. Marek’s Disease Long and Difficult Beginnings. Elsevier: Cambridgeshire UK : 8-11.
Clauer JP. 2009. Avian Disease Fact Sheet. Virginia Tech, Virginia, pp 1-6.
Coindre JM. 2003. Immunohistochemistry in the Diagnosis of Soft Tissue Tumours. Journal of Pathology, 43 (1): 1.
Encor Biotechnolgy Inc. 2012. Biocalc Ammonium Sulfate Precipitation. http://www.encorbio.com/protocols/AM-SO4.htm. [6 April 2012]
Heidari M, SD Fitzgerald, HM Zhang, RF Silva, LF Lee, JR Dunn. 2007. Marek’s Disease Virus-Induced Skin Leukosis in Scaleless Chickens: Tumor Development in the Absence of Feather Follicles. Journal of Avian Diseases 51: 713–718.
Huminto H, BP Priyosoeryanto, IWT Wibawan, DR Agungpriyono, E Harlina, S Fatimah. 2000. Kasus Diagnostik Penyakit Marek pada Ayam. Seminar Nasional Peternakan dan Veteriner. Bogor
Jarosinski KW, BK Tischer, S Trapp, N Osterrieder. 2006. Marek's Disease Virus: Lytic Replication, Oncogenesis and Control. Expert Review of Vaccines, 5 (6) : 761-772.
Kaiser P, G Underwood, and F Davison. 2003. Differential Cytokine Responses Following Marek’s Disease Virus Infection of Chickens Differing in Resistance to Marek’s Disease. Journal of Virology, 77(1): 762–768.
Kamaldeep H, PC Sharma, N Jindal, G Narang. 2007. Occurrence of Marek’s Disease in Vaccinated Poultry Flocks of Haryana (India). International Journal of Poultry Science, 6 (5): 372-377.
Kim Y, TP Brown and MJP Jackwood. 2004. The Effects of Cyclophosphamide Treatment on the Pathogenesis of Subgroup J Avian Leukosis Virus (ALV-J) Infection in Broiler Chickens with Marek’s Disease Virus Exposure. Journal of Veterinary Science, 5(1): 49–58.
Kumagai I and T Kouhei. 2001. Antigen–Antibody Binding. Encyclopedia of Life Sciences. Nature Publishing Group. www.els.net. [19 September 2012].
xlii Nair V. 2005. Evolution of Marek’s disease – A Paradigm for Incessant Race between the Pathogen and the Host. The Veterinary Journal, 170(2): 175– 183.
Saif, YM, Fadly AM, Glisson JR, McDougald LR, Nolan LK, and Swayne DE. 2008. Disease of Poultry. 12th ed. Blackwell Publishing. Iowa State University, pp 449-618.
Santos VLSL, S Williams, G Zavala, J Zhang, S Cheng, RL Santos, CC Brown 2009. Detection of Reticuloendotheliosis Virus by Immunohistochemistry and In Situ Hybridization in Experimentally Infected Chicken Embryo Fibroblast. Brazilian Journal of Veterinary Pathology, 2 (1): 29-34.
Schat KA and Z Xing. 2000. Specific and Nonspecific Immune Responses to Marek’s Disease Virus. Journal of Developmental & Comparative Immunology, 24(2-3): 201-221.
Smith LP, LJ Petherbridge, SJ Baigent, J Simpson, V Nair. 2011. Pathogenicity of a Very Virulent Strain of Marek’s Disease Herpesvirus Cloned as Infectious Bacterial Artificial Chromosomes. Journal of Biomedicine and Biotechnology. 2011:1-7.
Tian F, J Luo, H Zhang, S Chang, J Song. 2012. Marek’s Disease Virus Challenge Induced Immune-Related Gene Expression and Chicken Repeat 1 (CR1) Methylation Alterations in Chickens. American Journal of Molecular Biology, 2 (3): 232-241.
Tulman ER, CL Afonso, Z Lu, L Zsak, DL Rock, and GF Kutish. 2000. The Genome of a Very Virulent Marek’s Disease Virus. Journal of Virology, 74(17): 7980–7988.
Wakawa AM, ZK Muhammad, HB Aliyu, B Mohammed. 2012. A Retrospective Analysis of Marek’s Disease Diagnosed at Poultry Clinic of Ahmadu Bello University, Zaria, Nigeria. Journal of Veterinary Advances, 2(8): 424-429.
Wakenell PS, P O’Connell, C Blackmore, SP Mondal, KA Schat. 2010. Role of Marek's Disease Herpes Virus in the Induction of Tumours in Japanese Quail (Coturnix coturnix japonica) By Methylcholanthrene. Journal of Avian Pathology 39:183–188.
Witter RL. 2001. “Marek’s Disease Vaccines—Past, Present and Future (Chicken vs Virus—A Battle of the Centuries),” In Current Progress on Marek’s Disease Research, KA Schat et al., Eds. American Association of Avian Pathologists, Kennett Square, USA, pp 1–9.
Witters RL and KA Schat (2003). Marek’s Disease. In: Saif YM, JP Barnes, AM Fadly, JR Glisson, LR McDougald and DE Swayne (eds.). Diseases of Poultry, 11th ed. Iowa State University Press: Ames, LA, pp 406-468.
RIWAYAT HIDUP
Penulis dilahirkan di Wonogiri pada tanggal 22 Mei 1985 dari ayah Suswanto, S.Sos dan Ibu Sutini S.Pd. penulis merupakan putera pertama dari tiga bersaudara.
Tahun 2003 penulis telah lulus dari SMA Negeri 1 Wonogiri dan pada tahun yang sama lulus seleksi masuk IPB melalui Undangan Seleksi Masuk IPB. Penulis memilih Mayor S1 Kedokteran Hewan dan dilanjutkan Program Profesi Dokter Hewan dan lulus sebagai dokter hewan pada tahun 2009. Pada tahun 2010 penulis lolos seleksi program pascasarjana IPB. Pada tahun 2011 penulis diterima sebagai tenaga pendidik di Bagian Patologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.