KLONING, KARAKTERISASI DAN REKAYASA EKSPRESI
GEN FSH
FOLLICLE STIMULATING HORMONE
SUBUNIT β
PADA IKAN PATIN SIAM
Pangasianodon hypopthalmus
UNTUK MEMPERCEPAT MATURASI GONAD
MUHAMMAD AHYA RAFIUDDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “kloning, karakterisasi dan rekayasa ekspresi gen Follicle stimulating hormone subunit β pada ikan patin siam Pangasianodon hypopthalmus untuk mempercepat maturasi gonad” adalah benar karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
RINGKASAN
M. AHYA RAFIUDDIN. Kloning, karakterisasi dan rekayasa ekspresi gen Follicle Stimulating Hormone subunit β pada ikan patin siam Pangasianodon hypopthalmus untuk mempercepat maturasi gonad. Dibimbing oleh AGUS OMAN SUDRAJAT, ALIMUDDIN, dan UTUT WIDYASTUTI.
Peningkatan produksi ikan budidaya dilakukan untuk memenuhi kebutuhan pangan yang masih berada kekurangan. Dalam rangka pemenuhan kebutuhan tersebut, maka dilakukan manipulasi secara hormonal dengan menginduksi PMSG dan antidopamin. Komposisi bahan induksi tersebut berisi hormon gonadotropin I atau FSH dan LH, namun aktivitas yang dominan diduga FSH. Saat ini, perolehan FSH murni sangat sulit karena harganya sangat mahal. Oleh karena itu, kemurnian FSH diperoleh dengan melakukan pembentukan protein rekombinan FSH yang berasal dari ikan. Pembentukan FSH rekombinan dilakukan dengan isolasi dan karakterisasi FSH subunit α dan β sebagai langkah awal dalam proses pembentukan FSH rekombinan.
Isolasi RNA total dilakukan dengan menggunakan TRIzol invitrogen kemudian dilakukan sintesis cDNA. Kemudian ligasi pada pGEM T easy (GEM-FSH) dan transformasi ke vektor kloning. Keberhasilan transformasi dievaluasi menggunakan metode seleksi koloni biru putih. Analisis kesamaan menggunakan penyejajaran pada situs NCBI dan program MEGA 5 untuk membuat hubungan kekerabatan. Penentuan sinyal peptida dan peptida mature menggunakan signal 4.1. Selanjutnya, analisis ekspresi dilakukan dengan menginduksi PMSG dan antidopamin untuk melihat aktivitas sekresi hormon yang berasal dari dalam tubuh (endogenous). Induksi PMSG dan antidopamin dilakukan setiap minggu selama 3 minggu kemudian dilakukan analisis molekuler dan respons fisiologis meliputi gonadal somatic index, histologi gonad, dan jumlah telur yang dihasilkan.
Sekuensing menghasilkan panjang basa 404 dengan asam amino residu 132 yang tersusun atas sinyal peptida pada asam amino ke 1-16 dan peptida mature pada asam amino ke 17-132. Penyejajaran asam amino dilakukan untuk membuat hubungan kekerabatan dengan ikan yang lain, berdasarkan pohon
filogenetik yang dibentuk susunan asam amino gen FSH subunit β terbagi menjadi
dua kluster besar yakni ikan bersisik dan ikan yang tidak bersisik. Pada ikan yang
bersisik memiliki kesamaan 0,08 dengan gen FSH subunit β, sedangkan pada ikan
yang tidak bersisik menunjukkan nilai pada interval 0,01-0,015. Tingkat kesamaan pada kisaran 79-99% menunjukkan kesamaan struktur asam amino pada ikan yang tidak bersisik seperti ikan lele dan belut laut. Ekspresi gen FSH
subunit β mendapat pengaruh yang berbeda antar perlakuan yang diinduksi
menggunakan PMSG, AD, PMSG+AD dan larutan fisiologis. Ekspresi gen FSH
aromatase. Dengan demikian, siklus reproduksi pada ikan patin dapat dikendalikan di luar musim sehingga produksi benih akan terjadi secara berkelanjutan.
SUMMARY
M. AHYA RAFIUDDIN. Cloning, characterization and manipulation expression of Follicle Stimulating Hormone gene β subunit from Striped Catfish Pangasianodon hypopthalmus for gonadal maturation. Under supervised by AGUS OMAN SUDRAJAT, ALIMUDDIN, and UTUT WIDYASTUTI.
Induced maturation of fish by hormonal plays important role to get mature broodstock at out of spawning season. In this study, striped catfish FSH β subunit was cloned, characterized, and analyzed its expression after PMSG and AD induction. Cloning of FSH is a step to construct recombinant protein expression vector. The aimed of this research were isolation and characterization of FSH β
subunit and evaluation of FSH β subunit expression after hormonal induction. Isolation of total RNA was done by TRIzol invitrogen method, then synthesis cDNA by reverse transciptase. Then, the PCR product were ligated to pGEM Teasy (GEM-FSH) and transformed into cloning vector. The successful of transformation would be evaluated by blue white colony screening. Similarity and alignment analysis used NCBI site and MEGA 5 for phylogenetic tree. Signal peptide and mature peptide were examined by signal 4.1 site. Then, manipulation
FSH β subunit expression by inducing PMSG and antidopamine was conducted. PMSG and AD was injected every week for three weeks to evaluate FSH endogenous activity and physiology respond. After inducing during three weeks, the analysis expression FSH was amplified as molecular analysis and physiological respond including gonadal somatic index, gonad histology, and fecundity.
The sequence of FSH β subunit fragment was 404 bp with 132 amino acid residue and consisted of signal peptide on 1-16 and mature peptide on 17-132. Alignment amino acid was done to make phylogenetic tree between other species. Based on phylogenetic tree, FSH gene β subunit divided for two clade; scales and no scales fishes. Genetic distance FSH gene β subunit has 0.08 with scales fish while 0.01-0.015 no scales fish. related to evolution, 0.08 with FSH gene β subunit for scale fish. The amino acid residue alignment showed 79-99% showed that similarity of structur amino acid on no scales fishes namely catfish and sea eel. Expression of FSH β subunit got influence after inducing with PMSG, AD, PMSG+AD and physiological solution. Inducing PMSG+AD showed expression FSH β subunit was higher than other one. Gonad histology showed that eeg developed to be late vitelogenic stage. Injected of combination PMSG and AD also increase aromatase expression. Therefore, reproduction cycle on striped catfish can be induced in out of season spawning.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KLONING, KARAKTERISASI DAN REKAYASA EKSPRESI
GEN FSH
FOLLICLE STIMULATING HORMONE
PADA IKAN
PATIN SIAM
Pangasianodon hypopthalmus
UNTUK
MEMPERCEPAT MATURASI GONAD
MUHAMMAD AHYA RAFIUDDIN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kloning, Karakterisasi dan Rekayasa Gen Follicle Stimulating Hormone pada Ikan Patin Siam Pangasianodon hypopthalmus untuk Mempercepat Maturasi Gonad
Nama : Muhammad Ahya Rafiuddin NIM : C151110241
Menyetujui Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Alimuddin, SPi, MSc Dr Ir Utut Widyastuti, MS
Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pasca Sarjana Ilmu Akuakultur
Dr Ir Widanarni, MSi Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan penyusunan tesis yang
berjudul ” Kloning, Karakterisasi dan Rekayasa Gen Follicle Stimulating Hormone pada Ikan Patin Siam Pangasionodon hypopthalmus untuk Mempercepat Maturasi Gonad”. Karya ilmiah ini disusun dalam rangka penelitian akhir sebagai syarat untuk memperoleh gelar Magister Sains di Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.
Penelitian dan penyusunan tesis ini dapat terselesaikan karena bantuan dari berbagai pihak. Penelitian ini dibiayai oleh LPDP (Lembaga Pengelola Dana Pendidikan) yang dilakukan selama 7 bulan di laboratorium BIORIN (Biotechnology Research Indonesian The Netherlands), Biologi Seluler dan Molekuler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB), Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, FPIK, dan Kolam Percobaan Babakan, FPIK, IPB. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan terima kasih dan penghargaan yang setinggi-tingginya kepada Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc yang telah banyak mengajari tentang ilmu endokrinologi molekuler, bersabar dalam membimbing mulai dari awal penelitian hingga penulisan karya ilmiah ini, dan membantu biaya selama mengikuti pendidikan di sekolah pascasarjana, Bapak Dr. Alimuddin, S.Pi., M.Sc, selaku komisi pembimbing yang telah membimbing penulis mulai dari penelitian hingga penyusunan tesis ini, dan Ibu Dr. Ir. Utut Widyastuti MS. yang telah memberikan izin menggunakan laboratorium Biologi Molokuler dan Seluler Tanaman, PPSHB, IPB, arahan serta bimbingan selama menjalani pendidikan dan penelitian di sekolah Pasca Sarjana IPB. Di samping itu, penulis mengucapkan terima kasih kepada Prof. Suharsono, DEA selaku kepala PPSHB, IPB yang telah memberikan izin penelitian dan menggunakan fasilitas selama penelitian di Laboratorium. Terima kasih juga saya ucapkan kepada Prof. Dr. Enang Harris selaku ketua program studi Ilmu Akuakultur atas ilmu pengetahuan dan bimbingan yang diberikan selama menempuh pendidikan. Rekan-rekan mahasiswa dan Teknisi di laboratorium BIORIN: Mba Pepi, Pak Mulya, Ibu Ifa, Pak Asri, Pak Ilyas, Mba Fajri, Mba Nurul, Mba Nuril, Mas Wawan, Mba Ista, dkk. Teman-teman PS Ilmu Akuakultur tahun 2011 semuanya yang tidak disebut satu persatu. Dan seluruh pihak yang telah memberikan peranan dalam berlangsungnya penyusunan tesis ini. Penulis juga mendedikasikan karya ilmiah ini untuk Mama yang dengan tulus mengiringi doa selama menempuh pendidikan, alm Papa yang semoga amal ibadahnya diterima oleh Allah SWT. Lisna Fauziah, S.Far., Apt. yang telah memberikan dukungan baik moril maupun materil, kesabaran dan kasih sayangnya.
Bogor, Februari 2014
DAFTAR ISI
Halaman
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PRAKATA xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
2 TINJAUAN PUSTAKA 2
Biologi ikan patin siam (Pangasianodon hypopthalmus) 2
Endokrin dalam kontrol reproduksi 3
Isolasi, kloning, dan karakterisasi FSH 4
Struktur umum dan ekspresi gonadotropin 6
Gametogenesis 7
3 METODE PENELITIAN 8
Isolasi mRNA 9
Sintesis cDNA 9
Kloning cDNA ke dalam pGEM®-T 10
Transformasi ke bakteri E. coli DH5α 10
Identifikasi hasil transformasi 11
Pengurutan cDNA 12
Analisis ekspresi mRNA 12
Analisis data 13
4 HASIL DAN PEMBAHASAN 13
Isolasi RNA dan Sintesis cDNA 13
Ligasi dan Transformasi 14
Identifikasi hasil transforman 14
Analisis urutan nukleotida gen FSH 14
Ekspresi gen FSH pada ikan yang dilakukan rekayasa maturasi 17
Histologi gonad ikan patin yang diberi perlakuan hormon 19
Nilai GSI yang diberikan perlakuan hormon 20
Jumlah telur yang dihasilkan dari perlakuan hormon 21
DAFTAR PUSTAKA 25
LAMPIRAN 31
RIWAYAT HIDUP 38
DAFTAR GAMBAR
Halaman
1. Struktur molekul gen FSH 7
2. Hasil isolasi RNA 13
3. Hasil amplifikasi PCR 13
4. Hasil PCR koloni dan pola pemotongan plasmid 14
5. Sekuen parsial 15
6. Hasil penyejajaran berdasarkan asam amino 16
7. Pohon filogenetik gen FSH subunit β 17
8. Ekspresi molekuler gen FSH subunit β 19
9. Histologi gonad 20
10.Nilai GSI pada induk ikan patin 21
11.Jumlah telur yang dihasilkan 22
DAFTAR LAMPIRAN
Halaman
1. Kuantitas RNA total ikan patin siam (Pangasianodon hypopthalmus) 31
2. Hasil transformasi 31
3. Hasil penyejajaran berdasarkan susunan nukleotida 31
4. Prediksi posisi sinyal peptida 33
5. Media kultur bakteri 34
6. Perbedaan asam amino antar spesies 34
1
PENDAHULUAN
Kegiatan budidaya ikan merupakan salah satu sektor yang berkembang menjadi industri dan memiliki peran dalam penyediaan kebutuhan pangan. Berkembangnya kegiatan budidaya ikan dalam skema produksi ditentukan oleh ketersediaan induk matang gonad yang kemudian menghasilkan benih. Berkembangnya kegiatan pembenihan memiliki kendala pada reproduksi yang diharapkan dapat dilakukan pada wadah yang terkontrol. Kendala yang terjadi seperti induk tidak dapat mencapai titik optimum pada vitelogenesis dan spermatogenesis, induk dapat mencapai titik optimum vitelogenesis dan sperma-togenesis tetapi tidak dapat menyelesaikan proses pematangan akhir gonad, dan induk tidak dapat mengeluarkan telur secara alami (harus distripping) (Zohar dan Mylonas, 2001). Kendala tersebut terjadi pada beberapa ikan seperti ikan sidat yang hanya dapat memijah di laut dalam dan hanya satu kali dalam siklus hidupnya; ikan lele yang sulit memijah dalam waktu tertentu (Hassin, 1997); abalon dan ikan kerapu yang hanya memijah pada bulan gelap (Hassin, 1997); dan udang yang hanya dapat memijah setelah dipotong tangkai matanya (Zohar dan Mylonas, 2001; Yusuf, 2012). Beberapa masalah tersebut telah teratasi dengan induksi hormonal secara intramuskular dan dicampur ke dalam pakan. Hormon yang diimplan ke induk matang kelamin menggunakan pregnant mare’s serum gonadotropin (PMSG), human chorionic gonadotropin (hCG), PMSG dicampur dengan hCG, PMSG dicampur dengan antidopamin, PMSG dicampur dengan hCG, dan antidopamin telah digunakan dan berhasil menghasilkan induk yang siap ovulasi (Lestari, 2010; Samara, 2010; Febriana, 2010; dan Putra, 2013).
Proses perkembangan awal gonad dikontrol oleh hormon follicle stimulating hormone (FSH) dan untuk pematangan gonad oleh hormon Luteinizing Hormone (LH). Perkembangan awal gonad yang dikontrol oleh FSH merupakan proses akumulasi pembentukan telur berupa lipoprotein yang berasal dari prekursor dan vitelogenin berasal dari hati. Proses pembentukan telur merupakan konversi estradiol dari testosteron yang dibawa melalui pembuluh darah dan masuk ke dalam oosit sehingga material tersebut menjadi penyusun kuning telur. Setelah itu, proses selanjutnya adalah pematangan akhir yang melibatkan LH, maturation inducing hormone (MIH), dan maturation-promoting factor (MPF). LH beraksi pada sel theca untuk memproduksi MIH (17α, 20β-dihydroxy-4-pregnen-3-one, 17α,20β-dihidroksi progesteron). Peningkatan kapasitas folikel setelah viteloge-nesis bertujuan untuk memproduksi MIH sebagai respons terhadap LH (Fukada et al. 1994; Nagahama, 1995; Planas et al. 2000; Nagahama dan Yamashita, 2008)
2
dapat mencapai kebuntingan pada ikan. Berbagai ikan yang telah diinduksi dengan premiks tersebut menunjukan adanya pengaruh induksi. Ikan patin dapat mencapai matang gonad 2-4 minggu (Lestari, 2010; Samara, 2010; Febriana, 2010), ikan lele 4 minggu (Manurung, 2011; dan Mayasari, 2012), ikan belut 3-4 minggu (Putra, 2013); ikan sidat 3-5 minggu (Lestari, 2013) dan dan udang vaname 2-4 minggu pascainduksi (Yusuf, 2011). PMSG merupakan hormon kompleks yang memberikan kombinasi aktivitas FSH dan LH, namun aktivitas secara biologi memiliki kecendrerungan FSH yang lebih besar (Pierce dan Parsons, 1981; Querrat et al. 1994). FSH merupakan hormon gonadotropin yang berperan dalam proses vitelogenesis yang menentukan proses maturasi dan rematurasi gonad pada induk betina. Namun demikian, bahan tersebut masih impor sehingga perlu bahan lain sebagai alternatif rekayasa secara hormonal.
FSH adalah salah satu hormon yang disekresikan oleh hipofisa yang termasuk dalam famili hormon glikoprotein dan tersusun atas subunit α dan β. Subunit bagian α merupakan bagian yang umum dari famili ini, sedangkan subunit
bagian β memiliki bersifat spesifik (Pierce dan Parsons, 1981). Isolasi gen penyandi FSH merupakan tahap awal untuk memproduksi FSH sintetik. Hormon ini disekresikan oleh kelenjar pituitari dan berperan dalam gonad. Sintesis dan sekresi FSH dipengaruhi langsung oleh hipotalamus dekapeptida gonadotropin releasing hormone (GnRH). Sintesis dan sekresi FSH memiliki proses yang sangat kompleks dan meliputi interaksi antara gonad, pituitari, dan hipotalamus. FSH berperan pada ovari dan testis untuk meregulasi proses vitelogenesis dan spermatogenesis (Burger et al. 2004).
Isolasi dan karakterisasi FSH subunit β akan menghasilkan domain protein struktural dan fungsional yang konservatif dan memiliki kesamaan yang tinggi dengan ikan yang bersisik dan ikan yang tidak bersisik. Ekspresi FSH berkaitan dengan stadia awal perkembangan gonad pada ikan uji, dan manipulasi secara hormonal dapat dilakukan dengan induksi pada ikan yang diharapkan mampu mempengaruhi ekspresi FSH dalam perkembangan gonad pada ikan patin.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengisolasi dan mengkarakterisasi gen FSH subunit β, dan evaluasi ekspresi mRNA FSH subunit β pada induk ikan patin diinduksi maturasi menggunakan hormon.
2
TINJAUAN PUSTAKA
Biologi ikan patin siam (Pangasianodon hypopthalmus)
3
menjadi patil yang bergerigi, dan tidak memiliki sisik (Khairuman dan Sudenda, 2008).
Secara alamiah, perkembangan ikan patin siam mulai dari telur hingga dewasa membutuhkan waktu selama 9-12 bulan, dan kematangan induk pertama kali biasanya setelah berumur 2 tahun dan membutuhkan waktu 2-6 bulan pasca dilakukan pemijahan secara stripping. Hal ini menyebabkan induk ikan patin dapat dipijahkan hanya dua kali dalam satu tahun. Kondisi ini merupakan kondisi sulit untuk berkembangnya budidaya ikan patin, padahal ikan ini merupakan salah satu komoditas budidaya yang dikembangkan. Oleh karena itu, kondisi ini tidak mendukung adanya industrialisasi perikanan budidaya ikan patin karena benih ikan patin belum dapat tersedia sepanjang tahun. Lamanya waktu kematangan gonad disebabkan oleh faktor internal dan eksternal. Faktor eksternal disebabkan oleh fotoperiode, suhu, dan lingkungan, sedangkan faktor internal salah satu di antaranya adalah kandungan FSH yang sedikit sehingga stimulasi tidak sampai ke gonad (Amano, 2010; Fard et al. 2012). Salah satu solusi dari permasalahan ini adalah induksi pematangan kembali dengan menggunakan PMSG dan antidopamin sehingga diharapkan periode kosong pada gonad lebih pendek. Penggunaan PMSG dapat meningkatkan aktivitas enzim aromatase (Nagahama et al. 1991; Yoshiura et al. 2003; Nagahama dan Yamashita, 2008).
Endokrin dalam kontrol reproduksi
Kemampuan reproduksi membutuhkan proses yang kompleks mulai dari larva (penentuan jenis kelamin) hingga matang kelamin (vitelogenesis hingga ovulasi) yang diatur dalam aksi poros otak-pituitari-gonad (OPG). Proses tersebut diatur oleh hormon steroid dan non steroid (Weltzein, 2004). Aksi OPG terdiri atas tiga jalur pada sel dan diatur dalam mekanisme yang kompleks (Dofour, 2010). Neuroendokrin pada bagian preoptik dari otak pada pertengahan antara sistem saraf pusat dan endokrin. Pada umumnya stimulasi dan penghambat disatukan dalam sistem neuroendokrin yang dihasilkan dari bentuk GnRH. Pada ikan teleost, GnRH langsung mengintervensi sel memproduksi gonadotropin di pituitari, produksi stimulasi dan sekresi dari dua bentuk gonadotropin yang berkaitan dengan struktur kimia gonadotropin masuk ke dalam sirkulasi dan stimulasi gonad. Penempelan FSH spesifik pada membran reseptor yang sangat spesifik, pada jantan kemungkinan membran spesifik tersebut terdapat pada sel sertoli dan sel Leydig.
4
dekapeptida GnRH yang seluruhnya berperan dalam menstimulasi kontrol reproduksi pituitari gonadotropin (Weltzein et al. 2004). Perbedaan yang paling terlihat antara vertebrata dengan teleost adalah sistem neuroanatomi hipopsiotropik. Hipopsiotropik pada mamalia dan vertebrata lainnya berada pada bagian tengah eminence, pada bagian dasar hipotalamus, dan sekresi neurohormon ke dalam sistem peredaran darah. Lain halnya dengan ikan teleost bahwa hipopsiotropik langsung menuju adenohipofisis menuju spesifik bagian sel pituitary (Weltzein et al. 2004).
Keberhasilan proses reproduksi pada ikan terjadi akibat faktor internal dan eksternal. Kedua faktor tersebut terjadi pada kondisi yang tidak tepat yang diatur oleh otak yang disebabkan oleh perbedaan respons reproduksi dengan menyekresikan neuropeptida hormon GnRH. Pada pituitari anterior, GnRH dan faktor yang lain menstimulasi dan menyekresikan gonadotropin, yakni FSH dan LH. Hormon ini ditransfer melalui pembuluh darah yang akan menempel pada reseptor yang spesifik (Yaron dan Levavi-Sivan, 2006; Amano, 2010). Bagian terpenting dari sekresi hormon ini dengan hormon yang memiliki ikatan peptida dapat memberikan umpan balik positif atau negatif pada sintesis dan sekresi gonadotropin, pada level tertentu otak-pituitari-gonad bergantung dari kondisi maturasi dan fungsi dari kondisi ikan tersebut (Levavi-Sivan, 2010).
Pada vertebrata aktivitas P450arom tipe ovari memiliki peranan yang sangat penting (Nagahama, 1994; Devlin dan Nagahama, 2002). Peningkatan aktivitas aromatase tertinggi terjadi pada proses konversi testosteron menjadi estradiol pada tahap akhir vitelogenesis. Pada beberapa spesies, aktivitas aromatase meningkat dengan induksi menggunakan PMSG setelah 18 jam proses perkembangan vitelo-genesis pada ovari. Mekanisme PMSG diindikasikan bekerja dengan forskolin dan dbcAMP yang diketahui dapat meningkatkan level cAMP. Pada proses aromatisasi, peningkatan PMSG, forskolin, dan dbcAMP berdampak pada penghambatan dengan actinomisin D dan sikloheksamid. Pola perubahan level mRNA pada P450arom tipe ovari memiliki kemiripan dari kemampuan produksi estradiol sebagai bentuk respons GtH (Fukada et al. 1994; Nagahama, 1997; Nagahama dan Yamashita, 2008)
Isolasi, kloning, dan karakterisasi FSH
Aktivitas gonadotropin dari ekstrak pitiutari dapat dibedakan menjadi 2 fungsi yang berbeda, di antaranya adalah luteinizing dan simulasi pembentukkan folikel (Querat et al. 1994; Querat et al. 2000; Yaron et al. 2003). Preparasi dari gonadotropin ini telah dilakukan sejak tahun 1988 pada ikan mas koki dan
menyebutkan bahwa hormon ini adalah heterodimer dengan dua subunit yakni α dan β. Hormon glikoprotein merupakan hormon heterodimer yang tersusun atas subunit α dan β. FSH, LH, chorionic gonadotropin (CG) dan tiroid stimulating hormone (TSH) termasuk dalam famili hormon glikoprotein. Subunit α
merupakan bagian yang sama dari semua hormon pada famili ini dan subunit β
merupakan bagian yang khas dari famili hormon glikoprotein (Pierce dan Parsons, 1981; Querat et al. 1994; Yaron, 2003).
5
subunit dari spesies yang pernah dilakukan, di antaranya adalah glikoprotein hormon-α (GPH-α) dari ikan mas (Cyprinus carpio; Huang et al. 1991), GtH
1-subunit β pada ikan sidat (Anguilla japonica) (Yoshiura et al. 1999), GtH
1-subunit α pada ikan sidat (Nagae et al. 1λλ6), GtH 1 dan 2 subunit α and β pada ikan kakap merah (Morone saxafilis) (Hassin et al. 1λλ8), GtH 1 dan 2 subunit β pada ikan chum salmon (Sekine et al. 1989), GtH 2 pada European eel (Anguilla anguilla) (Querat et al. 1λλ1), GtH 1 dan 2 subunit α and β pada Japanese flounder (Kajimura et al. 2001), GtH 1 dan 2 subunit β pada ikan gurame biru (Jackson et al. 1999), glikoprotein subunit α pada ikan channel catfish (Liu et al. 1997), gonadotrophin I-subunit β ikan koki (Carrasius auratus) (Sohn et al. 1998), FSH-subunit β dari ikan komet (Carassius auratus; Kobayashi et al. 2003; Kobayashi et al. 2006), GPH-subunit α Manchurian trout (Brachymystax lenok; Cui et al. 2007) dan GPH-subunit α, FSH-subunit β, dan LH-subunit β dari channel catfish (Ictalurus punctatus; Liu et al. 1λλ7). Setelah subunit α dan β diisolasi dan dikarakterisasi maka selanjutnya adalah pembentukan protein rekombinan. Produksi protein rekombinan telah dilakukan pada FSH dan LH menggunakan sel serangga amuba (Dictyostelium discoideum) (Vischer et al. 2003); FSH pada ikan sidat (Anguilla japonica) dengan methylotropic yeast (Pichia pastoris) (Kamei et al. 2003); FSH pada ikan sidat (Anguilla japonica) dengan baculovirus (Kobayashi et al. 2003); FSH dan LH pada ikan mujair (Oreochromis mossambicus) dengan methylotropic yeast (Pichia pastoris) (Kasuto dan Levavi, 2005; Aizen et al. 2007a,b); dan FSH dan LH pada ikan sidat (Anguilla japonica) dengan sel S2 Drosophila (Kazeto et al. 2008). Pengujian bioaktivitas rekombinan FSH ikan koki scFSH untuk memacu spermatogenesis ikan sidat juga telah dilakukan (Hayakawa et al. 2009).
6
memiliki kapasitas pascatranslasi yang menyerupai sel pada hewan vertebrata (Kamei et al. 2003; dan Yaron, 2009).
Struktur umum dan ekspresi gonadotropin
Pituitari mensekresikan FSH, LH, TSH, dan chorionic gonadotropin. Keempat jenis hormon tersebut termasuk dalam famili hormon glikoprotein (Pierce dan Parsons, 1981), yang bersifat heterodimer yang masing-masing
hormon tersebut terdiri atas bagian α dan β. Bagian α merupakan bagian yang umum pada keempat jenis hormon tersebut, dan bagian β merupakan bagian yang
spesifik dari keempat jenis hormone tersbut (Querat, 2004). Selain itu, bagian β memiliki karakterisasi yang unik yang terhubung gugus karboksil dengan terminal
peptida. Analisis dari perkembangan evolusi gonadotropin bagian β ini telah
disusun yang mengindikasikan kedekatan silsilah yang lebih tinggi dibandingkan dengan LH subunit β. Sekuen asam amino dari LH subunit β menunjukkan
daerah yang lebih konservatif (Anonim, 2008). Panjang asam amino subunit β berukuran 111 bp, lebih panjang 1λ asam amino dibandingkan dengan subunit α.
Beberapa ikan telah dieksplorasi terkait dengan ekspresi mRNA dari berbagai
macam stadia ikan. Pada ikan koki struktur cDNA FSH dan LH sub unit β dengan
tetrapoda yang berperan dalam proses perkembangan gonad pada ikan seperti vitelogenesis dan spermatogenesis (Yoshiura et al. 1997; Sohn et al. 1999). Penelitian lain seperti pada ikan salmonid, FSH hanya berperan dalam tahap perkembangan awal gonad (Swanson dan Dittman, 1997). Setelah sub unit dari hormon glikoprotein telah diisolasi ke dalam vektor kloning maka selanjutnya dipotong dengan enzim restriksi seperti Eco R1, SacI, Bam HI, dan lain-lain. Namun kelemahan produksi produksi heterolog eukaryot di sel prokaryot adalah tidak stabil, kekurangan aktivitas biologi, dapat terkontaminasi oleh toksin yang berasal dari bakteri, dan di dalam sel prokaryot tidak terjadi modifikasi pascatranslasi. Organisme yang digunakan sebagai vektor ekspresi yang sering digunakan untuk membuat protein rekombinan adalah khamir (Pischia pastoris) karena dapat memproduksi protein rekombinan protein yang berkisar antara 39-49 kDa (Kamei et al. 2003; dan Kamei et al. 2006), harganya murah (Yaron, 2009), dan memiliki kapasitas untuk pascatranslasi yang hampir sama dengan sel pada vertebrata seperti penambahan gugus glikolisasi melalui penambahan residu gula. Modifikasi yang terjadi pada saat proses pascatranslasi adalah pembentukan ikatan disulfida oleh disulfida isomerase yakni pelipatan protein yang menentukan stabilitas dan aktivitas biologis, pemotongan proteolitik dari protein prekursor dengan menentukan fungsi protein, dan glikolisasi dengan penambahan residu gulauntuk menentukan stabilitas protein (Yaron et al. 2003).
7
Gambar 1. Struktur molekul gen FSH. (A) Pola lipatan famili glikoprotein pada semua tetrapoda. (B) Pola lipatan FSH subunit β pada beberapa ikan teleost (Moyle, 2005).
Pada Gambar 1 (a), 12 rantai sistein pada LH sub unit β merupakan bagian
yang konservatif dari vertebrata. Struktur utama FSH subunit β lebih bervariasi,
seperti pada beberapa bagian dari struktur tersebut dalam penempelan yang spesifik. Secara umum, pada ikan teleostei memiliki kesamaan dari 12 rantai sistein yang ada, sedangkan pada perciform, salmonid, dan pleuronectiform hanya
memiliki 3 rantai sistein yang sama pada sub unit βL1. Ada penambahan rantai
sistein N-terminal. Bagian seat belt untuk interaksi reseptor dan formasi heterodimer, struktur heterodimer pada setiap spesies ikan berbeda dalam sistem reseptor. Struktur reseptor akan ditempeli ligand untuk mengenali gen yang sifat heterodimer (Moyle, 2005).
Gametogenesis
Gametogenesis merupakan fase awal dalam tahap perkembangan telur hingga pelepasan akhir dari folikel. Perkembangan telur mulai dari proses oogenesis terjadi mulai dari otak hingga pembentukkan kuning telur. Oosit dari semua ikan teleostei memiliki persamaan dalam proses perkembangan telur, yakni; oogenesis, perkembangan oosit utama, tahap kortikal alveolus, maturasi, dan ovulasi. Perkembangan telur pada ikan teleost pada umumnya telah diklasifikasikan menjadi sinkron dan tidak sinkron. Oogonia terbentuk dari proses mitosis yang terjadi pada luminal epitelium yang terhubung dengan
8
kelenjar ovari. Proses oogenesis dimulai ketika oogonia ditransformasi ke dalam oosit utama dan setiap oosit dikelilingi oleh lapisan yang dipisahkan oleh sel granulose dan sel theka dipisahkan oleh lapisan basement membrane (Nagahama dan Yamashita, 2008). Secara umum perkembangan gonad pada jantan dan betina memiliki kemiripan, namun yang membedakan adalah hasil akhir. Perkembangan gonad secara umum adalah immature, development, mature, spawning, dan penghabisan telur (Nagahama, 1997).
Oogenesis adalah proses yang terjadi pada primordial germ cell yang siap untuk dibuahi oleh sel sperma. Selain itu, oogonesis menghasilkan sel yang haploid dan telur yang siap dibuahi oleh sperma sehingga dapat berkembang pada fase embrio. Berdasarkan proses tersebut dapat dibagi menjadi beberapa tahapan penting diantaranya adalah: fase duplikasi, fase pertumbuhan oosit, perkembangan folikel, pengisian material kuning telur, vitelogenesis, dan migrasi inti telur, maturasi, ovulasi dan pembuahan, dan fase aktivasi telur (Fukada et al. 1994; Nagahama, 1997 dan Mylonas dan Zohar, 2005). Fase duplikasi merupakan perkembangan ovari dan oogonia dari sel bakal telur, perkembangan ini awal dari perkembangan oosit. Fase selanjutnya adalah fase pertumbuhan oosit; pada fase ini terjadi pada saat sel telur masih diploid dan diakhiri dengan pembelahan sel yang diikuti dengan terbentuknya oosit sekunder. Setelah itu, perkembangan oosit berkembang menjadi fase maturasi, oosit sekunder membelah menjadi ovum yang siap. Pada fase maturasi ini terjadi proses yang sangat panjang yakni perkembangan folikel, pengisian komposisi kuning telur, dan vitelogenesis. Perkembangan folikel terjadi dalam pembentukkan struktur oosit yang dibentuk atas dua lapisan yakni sel granulosa dan sel telur. Pengisian komposisi kuning telur dengan menggunakan kortikal alveoli. Tahap selanjutnya adalah vitelogenesis yang distimulasi oleh otak dalam mensekresikan GnRH agar pituitari mensekresikan FSH sehingga terjadi perkembangan diameter telur akibat dari pengisian kuning telur sehingga protein kortikal alveoli tergeser pada batas dinding folikel. Tahap selanjutnya adalah maturasi yang distimulasi oleh proses steroidogenesis oleh zat steroid yang diproduksi oleh folikel. Namun demikian, perkembangan dalam oosit primer ini masih belum jelas tentang peranan GTH dan antidopamin (Mylonas dan Zohar, 2007; Yaron dan Levavi-Sivan, 2011). Vitelogenesis merupakan proses sintesis vitelogenin pada oosit dan berperan dalam pertumbuhan oosit pada sebagian besar ikan teleostei. Indikator dari peranan proses ini dapat dilihat dari nilai GSI (gonadal somatic index) yang merupakan rasio dari bobot gonad dan bobot tubuh.
3
METODE
Penelitian ini dilakukan dengan dua tahap, yaitu kloning gen FSH subunit β dan rekayasa ekspresi yang diinduksi dengan PMSG dan antidopamin. Kloning
gen FSH bagian β dilakukan dengan tahapan sebagai berikutμ isolasi RNA total,
sintesis cDNA, kloning ke pGEM T-Easy, transformasi ke Escherichia coli
dengan strain DH5α, identifikasi transforman dan sekuensing. Analisis ekspresi
9
Isolasi mRNA
Ikan patin siam yang masih hidup dengan ukuran 700-1200 gram dipotong bagian kepalanya dengan jumlah 13 ekor. Hipofisa dimasukkan ke dalam tabung eppendorf yang telah berisi Trizol (Invitrogen) 800 µL. Setelah itu, diinkubasi pada suhu ruang selama 5 menit, kemudian dimasukkan klorofom 200 L ke dalam eppendorf tersebut dan suspensi sel dihomogenasi menggunakan vorteks. Campuran diinkubasikan pada suhu ruang selama 3 menit. Selanjutnya eppendorf tersebut disentrifugasi dengan kecepatan 10.000 rpm pada suhu 6 ˚C selama 15 menit. Cairan bagian atas diambil sebanyak minimal 60% dari volume trizol. Supernatan tersebut dipindahkan ke dalam eppendorf baru dan ditambah dengan isopropil alkohol, kemudian diinkubasikan dalam suhu ruang selama 10 menit. Setelah itu eppendorf tersebut disentrifugasi dengan kecepatan 10.000 rpm selama 10 menit dengan suhu 6oC. Supernatan dari hasil sentrifugasi dibuang, dan endapannya diambil, kemudian ditambah dengan etanol 75%, kemudian eppendorf disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit dengan suhu 6 oC. Etanol 75% dibuang dan dikeringkan dengan menggunakan vakum.
Setelah kering, endapan disuspensikan dalam 30 L H2O-DEPC 0,1%.
Kuantitas RNA total dianalisis dengan menggunakan spektrofotometer,
absorbansi diukur pada panjang gelombang 260 ( 260) dan 280 ( 280). Kemurnian
RNA diperoleh dari nilai rasio 260/ 280. Agarosa yang dibuat untuk proses separasi RNA adalah dengan gel agarosa 1% yang dibuat dengan melarutkan 0,2 g tepung agarosa, 20x MOPS 1 mL, formaldehida 1,08 mL, dan ddH2O DEPC 17,92 mL. Selanjutnya dilakukan elektroforesis pada gel agarosa 1% dengan 10x bufer MOPS, voltase 100 volt selama 35 menit. Visualisasi RNA dilakukan di atas transluminator GelDoc (Labquip) dan difoto menggunakan kamera digital f1.8 full bright (Olympus). Adanya pita unit-unit RNA ribosom menunjukkan keberhasilan isolasi RNA.
Sintesis cDNA
Sintesis cDNA melalui transkripsi balik (RT) dilakukan menggunakan metode Suharsono et al. (2002). Metode tersebut adalah dengan mengambil 2,5 l RNA total dicampur dengan 7,5 ddH2O DEPC, kemudian ditambah 1,1 L bufer DNase dan 0,2 L DNase dan setelah itu diendapkan dan PCR pada suhu 25 oC selama 10 menit dengan program DNase pada suhu 25 oC selama 10 menit. Kemudian langkah selanjutnya ditambahkan EDTA 1 L dan setelah itu diendapkan kemudian PCR kembali dengan program EDTA pada suhu 65 oC selama 10 menit. Setelah itu, sampel dimasukkan ke dalam es selama 5 menit dan ambil 5 l untuk dimasukkan ke dalam tabung yang berisi PCR mix. PCR mix tersebut berisi bufer 5x sebanyak 4 L, oligo dT sebanyak 2 L, dNTP 2mM sebanyak 0,4 L, dTT sebanyak 2 L, RTase sebanyak 0,2 L, dan ddH2O DEPC sebanyak 6,4 L. Mesin PCR dijalankan dengan 1 siklus dengan 30 oC selama 10 menit, 42 oC selama 50 menit, dan 95 oC selama 5 menit.
Primer untuk mengamplifikasi gen FSH didesain berdasarkan data dari genebank, yaitu Ictalurus punctatus dengan kode aksesi NM_001200079, Clarias gariepinus dengan kode aksesi AF324541, dan Silurus meridionalis dengan kode
10
54 oC selama 35 detik, dan elongasi 72 oC selama 30 detik. Proses denaturasi, annealing, dan elongasi dilakukan sebanyak 35 siklus dan elongasi akhir dilakukan pada suhu 72 oC selama 7 menit.
Kloning cDNA ke dalam pGEM®-T
cDNA yang berhasil disintesis kemudian disisipkan ke dalam pGEM®-T Easy mengikuti prosedur Promega (2003). Vektor pGEM®-pGEM®-T Easy dan produk RT-PCR disentrifugasi agar kandungannya terkumpul pada dasar tabung, selanjutnya reaksi ligasi dicampur pada tabung dengan komposisi, yaitu: 2x rapid ligase buffer 5 L, vektor pGEM®-T Easy, T4 DNA ligase (3 weiss
units/ L) dan produk RT-PCR sebanyak 3 L. Tahap berikutnya adalah campuran reaksi diinkubasi semalam pada suhu 4°C.
(275 rpm). Hasil kultur sebanyak 500 L dicampur dengan 5 ml LB, diinkubasi 2-3 jam hingga mencapai OD60 = 0,4-0,5. Setelah itu, sampel dimasukkan ke dalam tabung eppendorf 1,5 mL dan diinkubasi pada es selama 10 menit. Bakteri diendapkan dengan sentrifugasi pada 10.000 rpm selama 10 menit, pada suhu 4°C. Cairannya dibuang dan endapannya disuspensikan dalam 495 L (0,3 dari volume awal) buffer transformasi (TFB). Kemudian reaksi diinkubasikan dalam es selama 10 menit. Setelah itu, disentrifugasi pada 10.000 rpm selama 10 menit pada suhu 4°C untuk pengendapannya. Cairan dibuang, endapan disuspensikan dalam TFB 41,25 L (0,08 volume asal). Kemudian ditambahkan DMSO sebanyak 3,3 L (7-8 % volume dari 1/12 volume TFB), digoyang dan dibiarkan di dalam es selama 10 menit.
Transformasi. Sel kompeten yang akan ditransformasi dimasukkan dalam es, dibiarkan beberapa menit agar mencair. Selanjutnya, diambil 50 L
bakteri kompeten dan ditambahkan 10 L plasmid FSH-GEM, simpan pada es selama 20 menit, dan diberikan heatshock pada 42 °C selama 1 menit dan
11
Identifikasi Hasil Transformasi
Plating dan PCR. Koloni yang berwarna putih dilakukan pengujian kembali dengan pembuatan plating koloni dan PCR. Koloni putih diambil dengan tusuk gigi steril kemudian digoreskan pada media LA + ampisilin, lalu tusuk gigi dimasukkan ke tabung PCR dan digoreskan kembali. Koloni berwarna putih yang sudah digoreskan kemudian dicampurkan ke dalam 7 L ddH20 dan dilakukan hot start (denaturasi) PCR pada suhu 95 °C selama 10 menit dan
15°C selama 5 menit. Selanjutnya ditambahkan master mix sebanyak 5 L, primer maju (forward) maupun mundur (reverse) 0,25 L. Proses PCR dijalankan pada suhu 94°C selama 2 menit sebanyak 1 siklus; (94 °C selama 30 detik; 53°C selama 35 detik; 72°C, 1 menit 30 detik) sebanyak 35 siklus dan 72 °C selama 5 menit. dengan sentrifugasi pada 10.000 rpm pada suhu 4 °C selama 10 menit. Pelet atau
endapan yang terbentuk ditambahkan dengan 250 L buffer resuspensi, kemudian
ditambahkan 250 L bufer lisis dan 250 L bufer netralisir dan dibolak-balik. Selanjutnya, disentrifugasi pada kecepatan 10.000 rpm pada suhu 4 °C selama 15 menit. Supernatan yang terbentuk ditambahkan dengan 0,1 NaOAC 3 M pH dikeringkan dan ditambahkan TE sebanyak 15 L. Guna menghilangkan sisa-sisa RNA, tambahkan RNase 4 L dan diinkubasi pada suhu 37°C selama semalam. Selanjutnya TE ditambahkan hingga volume akhir 500 L, kemudian diekstraksi dengan fenol : kloroform : isoamilalkohol (25:24:1) sebanyak 1 kali volume. Larutan disentifugasi pada kecepatan 14.000 rpm pada suhu 20°C selama 10 menit. Cairan yang terbentuk pada bagian atas dipindahkan dan selanjutnya dipresipitasi dengan penambahan natrium asetat 3 M, pH 5,2 sebanyak 0,1 volume dan etanol absolut 2 volume dan diinkubasi pada suhu -20°C selama 2 jam. DNA plasmid diendapkan dengan sentrifugasi pada keeepatan 10.000 rpm, suhu 4 °C selama 20 menit. DNA plasmid dibilas dengan etanol 70% (v/v) dan dikeringkan dengan vakum. DNA disuspensikan di dalam ddH20.
Pengurutan cDNA
12
Analisis Ekspresi mRNA
Ikan yang digunakan untuk analisis ekspresi mRNA disuntik secara intramuskular dengan hormon berbeda. Ikan disuntik dengan antidopamin (AD) dengan dosis 10 mg/kg, PMSG 20 IU, OODEV (PMSG+AD) 0,5 ml/kg ikan, dan larutan fisiologis 0,5 mL/kg. Penyuntikan dilakukan selama 3 minggu dan dilakukan sekali seminggu. Setelah itu, dilakukan analisis mRNA dari otak dan hipofisa. Analisis mRNA dilakukan dengan isolasi total RNA, sintesis cDNA, dan amplifikasi cDNA dengan primer gen spesifik yang telah disusun dengan menggunakan BIOEDIT. Isolasi total RNA sesuai dengan prosedur pada subbab Isolasi mRNA. cDNA disintesis menggunakan metode seperti dijelaskan dalam subbab Sintesis cDNA.
Kuantitas RNA total dianalisis dengan menggunakan spektrofotometer, absorbansi diukur pada panjang gelombang 260 ( 260) dan 280 ( 280). Kemurnian
RNA diperoleh dari nilai rasio 260/ 280. Tingkat ekspresi FSH dan aromatase pada setiap perlakuan hormon dianalisis menggunakan metode PCR semikuantitatif. Primer gen FSH disusun berdasarkan data dari genebank, yaitu Ictalurus punctatus dengan kode aksesi NM_001200079, Clarias gariepinus dengan kode aksesi AF324541, dan Silurus meridionalis dengan kode aksesi AY973947 untuk
bagian β subunit. Primer gen aromatase disusun oleh Sudrajat (2000). Sebagai
kontrol internal dilakukan pengamatan ekspresi gen β-aktin. Deteksi ekspresi gen
β-aktin dilakukan melalui proses RT-PCR, dengan primer β-aktin sesuai dengan (Kobayashi et al. 2007). Program PCR yang digunakan adalah sebagai berikut: 50°C selama 30 menit, 95°C selama 15 menit, dilanjutkan dengan 35 siklus yang terdiri dari: 95°C selama 20 detik, 59°C selama 20 detik, 72°C selama 30 detik, dan ekstensi akhir pada suhu 72°C selama 10 menit. Pengecekkan hasil amplikfikasi PCR dilakukan dengan elektroforesis menggunakan agarose 1%.
13
penimbangan bobot gonad dibandingkan dengan bobot ikan uji pada akhir penelitian mengikuti rumus sebagai berikut :
Analisis Data
Urutan nukleotida sekuen cDNA FSH beta dianalisis pensejajaran dengan menggunakan software basic local alignment search tool nucleotide (BlastN) untuk nukleotida, dan BlastP untuk protein. Analisis data disajikan secara deskriptif untuk histologi, dan parameter GSI dan jumlah telur dilakukan uji lanjut duncan apabila terjadi perbedaan yang signifikan.
4
HASIL DAN PEMBAHASAN
Isolasi RNA dan Sintesis cDNA
Konsentrasi RNA total hasil isolasi dari kelenjar pituitari ikan patin siam adalah 6.197,33 ng/µL. Kualitas RNA tersebut relatif baik, ditunjukkan oleh elektroforegram dengan 2 pita RNA (28S rRNA dan 18S rRNA; Gambar 2).
Gambar 2. Hasil isolasi RNA total dari pituitari ikan patin siam (Pangasianodon hypopthalmus) yang dielektroforesis dengan 10x bufer MOPS pada gel agarosa 1% (b/v).
Fragmen cDNA diperoleh dengan RT-PCR menggunakan primer degenerate yang terkonservasi dari database NCBI. Berdasarkan hasil elektroforesis pada gel agarosa 1% (b/v) diperoleh fragment DNA ukuran sekitar 400 pb (Gambar 3). Ukuran DNA tersebut mendekati ukuran yang ditargetkan berdasarkan sekuen yang ada, yakni sebesar 420 pb.
Gambar 3. Hasil amplifikasi optimasi PCR menggunakan cetakan cDNA. M: Marker 1 kpb, lajur 1, 2, 3 merupakan hasil RT-PCR dari isolasi RNA total.
Keterangan : GSI : Gonadoosomatik Indeks Wg : Bobot gonad (g)
W : Bobot tubuh ikan (g)
1000 750
500
250
404 pb
14
Ligasi dan Transformasi
cDNA FSH ikan patin diligasikan ke vektor kloning, kemudian diintroduksi ke sel kompeten Seperti ditunjukkan pada Lampiran 2, transformasi berhasil dilakukan yang ditandai dengan adanya koloni berwarna putih. Koloni yang berwarna biru adalah koloni yang tidak tersisipi gen FSH (Lampiran 2). Bakteri E. coli DH5α yang mengandung pGEM®-T Easy rekombinan hidup dalam media
seleksi antibiotik (ampisilin). Bakteri yang tidak mampu menghasilkan β
galaktosidase karena adanya sisipan cDNA GH pada gen LacZ sehingga X-gal tidak dapat dikonversi menjadi senyawa berwarna biru sehingga koloni bakteri tetap berwarna putih.
Identifikasi hasil transforman
PCR koloni dilakukan untuk memastikan bahwa cDNA kloning yang telah dilakukan tersisip ke dalam plasmid. Amplifikasi PCR koloni menggunakan primer gen target yang telah dilakukan sehingga dapat dipastikan bahwa sisipan gen target telah masuk ke vektor sebelum transformasi dilakukan. Hasil isolasi plasmid ini dipotong agar dipastikan bahwa plasmid yang tersisipi gen FSH adalah benar. Enzim yang digunakan untuk memotong gen FSH dalam plasmid PGEM-T (pGEM-FSH) adalah Eco R1. Setelah terpotong berarti gen yang dimasukkan dalam vektor kloning adalah benar gen FSH yang terlihat dalam panjang pita yang dielektroforesis 404 pb dan vektor kloning sekitar 3 kpb.
Gambar 4. A. Hasil PCR koloni, Huruf M: marker DNA 1 kb ladder, Kolom 1, 2, 3, 4: hasil PCR koloni pGEM-FSH. B. Pola pemotongan plasmid pGEM-FSH menggunakan Eco R1. M: marker DNA 1 kb ladder, kolom 1 plasmid rekombinan pGEM-FSH, kolom 2 hasil pemotongan.
Analisis urutan nukleotida gen FSH
Analisis urutan nukleotida gen FSH dari koloni bakteri E. coli rekombinan pembawa plasmid pGEM-FSH telah dilakukan. Hasil sekuensing menunjukkan ukuran gen target sekitar 404 pb sudah terbaca yang dimulai dengan start codon
15 hypopthalmus; Huruf yang diberikan warna ungu pada bagian belakang merupakan primer Forward, sedangkan huruf yang diberikan warna coklat pada bagian belakang adalah primer Reverse;
Huruf merah menunjukkan kode awal sekuen FSH β subunit,
sedangkan huruf kuning menunjukkan kode akhir sekuen gen FSH β subunit, simbol kepala panah menunjukkan signal peptida.
16
rabaudi, Ctenopharyngodon idella, Mylopharyngodon piceus, Hypopthalmichthys nobilis, Gobiocypris rarus, Misqurnus anguilladatus, Clarias gariepinus, Ictalurus punctatus, dan Silurus meridionalis. Spesies yang dipilih untuk analisis pensejajaran berkisar antara 84-98% untuk mengetahui pola evolusi dari gen FSH yang telah dilakukan karakterisasi. Perbedaan urutan gen FSH dari setiap spesies yang disejajarkan berbeda antara satu dengan yang lain spesies.
Pangasionodon --MRGVAMVLLLPMLVWAGSECKTRCRLTSISITLESDECGSCITINTTACAGLCQTQER 58 Clarias MMMRGVAMVLLLPMLVWAGSECKTRCRLTNISITVESDECGSCITINTTACAGLCQTQER 60 Silurus -MMRGATMVLLLPMLVWAGSECKARCQLTNISITVESDECGSCITINTTACSGLCQTEER 59 Ictalurus -MMRGVTMVLLLPMLVWAGSECKARCCLTNISITVESDECGSCITVNTTACTGLCRTQER 59 Misqurnus --MRGVVMVMLLPVLMRAVSECRSSCRLTNISITVESEECGSCITIDTTACAGLCRTQER 58
Carrasius MRMRFVVMVILLPALMMSGSECRSSCRLTNISITVESEECGSCITIDTTACAGLCKTQES 60
Schizothorax MRMHFVVMVMLLPALMRAGSECRSSCRLTNISITMESEECGSCITIDTTACAGLCKTQES 60 Procypris MRMHFVVMVILLPALMRAGSECRSSCLLTNISITVESEECGSCITIDTTACAGLCRTQES 60 Gobiocypris MRMRFVVMVMLLPALMRAGSECRSSCRLTNISITVESEECGSCITIDTTACAGLCKTQER 60 Ctenopharyngodon MRMRFVVMVMLLPALMRAGSECRSSCRLTNISITMESEECGSCITIDTTACAGLCKTQER 60 Mylopharyngodon MRMRFVVMVMLLPALMRAGSEFRSSCRLTNISITMESEECGSCITIDTTACAGLCKTQER 60 Hypopthalmichthys MRMRFVVMVMLLPALMRAGSECRSSCRLTNISITMESEECGSCITIDTAACAGLCKTQER 60 *: ..**:*** *: : ** :: * **.****:**:*******::*:**:***:*:*
Pangasionodon AYRSPMAPYFQNTCNFRDWTYETVQLPGCAPGVDCSFTYPVALSCECSQCNTEITDCGAF 118 Clarias AYRSPMAPYFQNTCNFRDWTYETVQLPGCAPGVDSSFTYPVALSCECSQCNTEITDCGAF 120 Silurus AYRSPMAPYFQNTCNFRDWTYETVQLPGCAPGLESSFTYPVALSCECSQCNTEISDCGAF 119 Ictalurus AYRSPVAPYFQNTCNFRDWTYETIQLPGCPLGVDSSFTYPVALSCECSQCNTEITDCGAF 119 Misqurnus VYRSPMMQYYQNTCNFIEWTYETYEFKGCPVGVDSVFTYPVALSCDCSKCNTDITDCGVL 118 Carrasius VYRSPLMLSYQNTCNFREWTYETYEFKGCPARADSIFTYPVALSCECSKCNSDITDCGVL 120 Schizothorax VYRSPLMLSYQNTCNFREWTYETYEFKGCPARADSVFTYPVALSCECSKCNSDITDCGVL 120 Procypris VYRSPMMLYYQNTCNFKEWTYETYEFKGCPARADSVFTYPVALSCECSKCNSDITDCGVL 120 Gobiocypris VYRSPMMQYYQNTCNFREWAYETYEFKGCPAGADSVFTYPVALSCECSKCNSDITDCGAL 120 Ctenopharyngodon VYRSPMMQNYQNTCNFREWTYETYEFKGCPPGTDSVFTYPVALSCECSKCNSDIADCGVL 120 Mylopharyngodon VYRSPMMQNYQNTCNFREWTYETYEFKGCPPGTDSVFMYPVALSCECSKCNSDIADCGVL 120 Hypopthalmichthys VYRSFMMQNYQNTCNFREWTYETYEFKGCPPGIDSVFTYPVALSCECSKCNSDIADCGVL 120 .*** : :****** :*:*** :: **. :. * *******:**:**::*:***.: Hypopthalmichthys SQQQTSSCTVH--- 131 * *. * :
Gambar 6. Hasil pensejajaran berdasarkan susunan asam amino; kotak pada susunan sekuen parsial menunjukkan daerah yang konservatif pada ikan yang bersisik.
17
yang konservatif dengan ikan yang tidak bersisik sehingga ikan ini memiliki kelompok sendiri pada domain ikan yang bersisik.
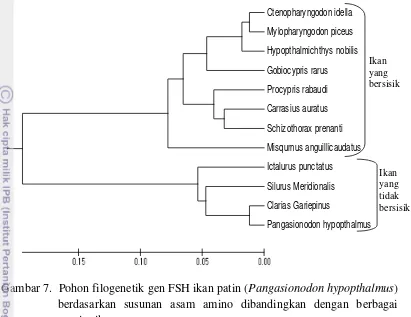
Gambar 7. Pohon filogenetik gen FSH ikan patin (Pangasionodon hypopthalmus) berdasarkan susunan asam amino dibandingkan dengan berbagai spesies ikan.
Hasil filogenetik menunjukkan bahwa sekuen FSH dari ikan patin memiliki perbedaan struktur protein antara ikan yang memiliki sisik dengan yang tidak memiliki sisik. Ikan yang memiliki sisik adalah ikan Ctenopharyngodon edilla, hingga Misqurnus anguillicaidatus memiliki kedekatan kekerabatan 0,08 pada kelompok besar ikan yang tidak bersisik seperti Ictalurus punctatus, Silurus meridionalis, Clarias gariepinus, dan Pangasionodon hypopthalmus ikan patin. Kedekatan kekerabatan tersebut berkisar antara 0,01-0,015 pada kelompok kecil hewan tidak bersisik. Kemudian spesies Misqurnus anguillicaidatus merupakan ikan yang memiliki sisik di satu sisi saja dan yang tidak bersisik pada sisi yang lain. Hal ini menyebabkan penempatan ikan ini berada dalam satu kelas tersendiri secara evolusi organisme. Perbedaan asam amino terjadi antara ikan bersisik dengan ikan tidak bersisik terlihat pada urutan asam amino ke 3, 36, 54, 65, 76, 82-85, 108, 110, 117, dan 118. Namun pada urutan ke 110 spesies Misqurnus anguillicaidatus memiliki kesamaan asam amino dengan ikan tidak bersisik. Oleh karena itu, ikan Misqurnus anguillicaidatus berada pada kelompok ikan yang bersisik pada cluster tersendiri (Lampiran 7).
Ekspresi gen FSH
Analisis ekspresi gen FSH dilakukan dengan menggunakan ikan patin sedang matang gonad, ikan yang telah ovulasi, dan ikan yang diberi perlakuan (immature) berbeda secara hormonal. Berdasarkan hasil RT-PCR semi-kuantitatif
18
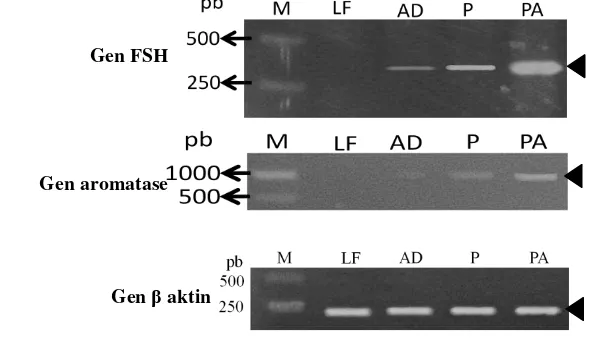
terlihat bahwa ikan yang disuntik dengan hormon PMSG+antidopamin menunjukkan adanya gen FSH yang memiliki ekspresi lebih tinggi dibandingkan dengan PMSG dan antidopamin secara terpisah (Gambar 8). Ikan matang gonad merupakan ikan yang matang kelamin pada saat di luar musim yang terjadi secara alami menunjukkan hasil yang hampir sama dengan ikan yang diberi perlakuan hormon PMSG+antidopamin. Berdasarkan hasil analisis ekspresi molekuler dapat dilihat bahwa penyuntikkan hormon PMSG dapat meningkatkan aktivitas aromatase yang berperan dalam konversi estradiol pada tahap perkembangan gonad. Peningkatan nilai estradiol pada belut dan ikan patin menunjukkan bahwa adanya konsistensi dari aktivitas aromatase dalam perkembangan gonad dan aktivitas molekuler pada FSH subunit β (Putra, 2013 dan Rachman, 2013). Pada kondisi alamiah (Gambar 8) dapat diamati bahwa ikan yang tidak diinduksi menggunakan hormon memiliki aktivitas yang berbeda pada konsentrasi FSH
subunit β. FSH bekerja dalam proses awal perkembangan gonad sehingga aktivitas sel dalam produksi telur dan hasil histologi pun menunjukkan hal yang
sama dengan adanya aktivitas FSH subunit β dari ikan yang diambil dari pituitari
19
Gambar 8. Ekspresi molekuler gen FSH sub unit β, gen aromatase, dan gen actin; M: marker 1 kpb, LF: Larutan fisiologis, AD: antidopamin, P: Hormon PMSG, PA: PMSG+antidopamin, tanda kepala panah menunjukkan posisi gen target.
Histologi gonad ikan patin yang diberi perlakuan hormon
Histologi gonad menunjukkan bahwa perlakuan hormon PMSG dan antidopamin mampu mempercepat pembentukan telur dari gonad ikan patin yang mencapai tahap vitelogenesis akhir dan sempurna pada tahap vitelogenesis. Ikan patin yang disuntik dengan PMSG saja dan antidopamin saja telah mampu menghasilkan telur pada tahap vitelogenesis awal dan beberapa telur masih dalam tahap pembentukkan oosit primer atau sekunder, sedangkan ikan yang disuntik dengan larutan fisiologis menunjukkan bahwa ikan patin masih dalam tahap pengembangan oosit dan masih membutuhkan waktu agar dapat mengisi material inti telur. Hasil histologi gonad pada beberapa ikan yang disuntik oleh hormon dan bahan kimia menunjukkan adanya perbedaan (Gambar 9).
Gen FSH
Gen aromatase
20
Gambar 9. Histologi gonad ikan patin siam yang diinduksi hormon berbeda; IM: pembentukkan folikel; Vte: Vitelogenesis awal; Vtl: Vitelogenisis akhir; Vt: Vitelogenesis sempurna; GV: Migrasi inti telur.
Nilai GSI
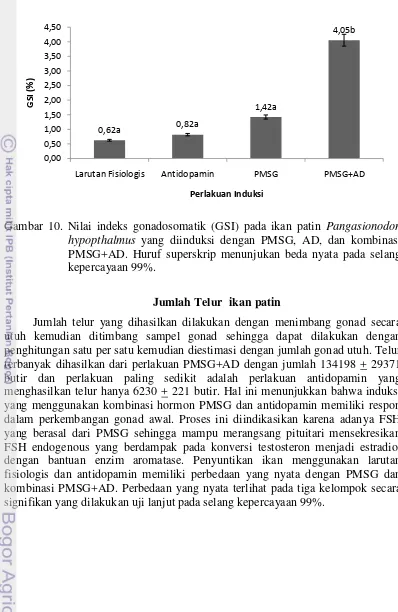
Kisaran nilai GSI pada penelitian ini berkisar antara 0,62% hingga 4,05%, rataan nilai GSI yang tertinggi ditunjukkan pada perlakuan PMSG+AD yakni 4,05 + 0,9 % (Gambar 12). Kemudian rataan GSI pada perlakuan PMSG adalah 1,42 + 0,08 %, sedangkan perlakuan antidopamin memiliki nilai GSI sebesar 0,82 + 0,06 % dan kontrol memiliki rataan nilai GSI sebesar 0,62 + 0,13 %. Hal ini menujukkan bahwa gonad yang diinduksi dengan kombinasi hormon PMSG dan antidopamin mengalami perkembangan pada tahap vitelogenesis sehingga dapat diharapkan mampu untuk dipijahkan. Nilai GSI antar perlakuan menunjukan perbedaan yang nyata. Perbedaan yang nyata terlihat pada perlakuan larutan fisiogis, AD, PMSG dengan kombinasi PMSG+AD pada selang kepercayaan 99%. Penyuntikan kombinasi PMSG dan AD mempunyai dampak terhadap nilai GSI dibandingkan dengan perlakuan yang lain.
AD PMSG
21
Gambar 10. Nilai indeks gonadosomatik (GSI) pada ikan patin Pangasionodon hypopthalmus yang diinduksi dengan PMSG, AD, dan kombinasi PMSG+AD. Huruf superskrip menunjukan beda nyata pada selang kepercayaan 99%.
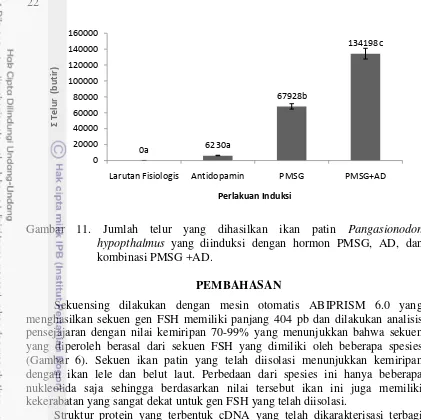
Jumlah Telur ikan patin
Jumlah telur yang dihasilkan dilakukan dengan menimbang gonad secara utuh kemudian ditimbang sampel gonad sehingga dapat dilakukan dengan penghitungan satu per satu kemudian diestimasi dengan jumlah gonad utuh. Telur terbanyak dihasilkan dari perlakuan PMSG+AD dengan jumlah 134198 + 29371 butir dan perlakuan paling sedikit adalah perlakuan antidopamin yang menghasilkan telur hanya 6230 + 221 butir. Hal ini menunjukkan bahwa induksi yang menggunakan kombinasi hormon PMSG dan antidopamin memiliki respon dalam perkembangan gonad awal. Proses ini diindikasikan karena adanya FSH yang berasal dari PMSG sehingga mampu merangsang pituitari mensekresikan FSH endogenous yang berdampak pada konversi testosteron menjadi estradiol dengan bantuan enzim aromatase. Penyuntikan ikan menggunakan larutan fisiologis dan antidopamin memiliki perbedaan yang nyata dengan PMSG dan kombinasi PMSG+AD. Perbedaan yang nyata terlihat pada tiga kelompok secara signifikan yang dilakukan uji lanjut pada selang kepercayaan 99%.
0,62a 0,82a
1,42a
4,05b
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50
Larutan Fisiologis Antidopamin PMSG PMSG+AD
GSI
(%
)
22
Gambar 11. Jumlah telur yang dihasilkan ikan patin Pangasionodon hypopthalmus yang diinduksi dengan hormon PMSG, AD, dan kombinasi PMSG +AD.
PEMBAHASAN
Sekuensing dilakukan dengan mesin otomatis ABIPRISM 6.0 yang menghasilkan sekuen gen FSH memiliki panjang 404 pb dan dilakukan analisis pensejajaran dengan nilai kemiripan 70-99% yang menunjukkan bahwa sekuen yang diperoleh berasal dari sekuen FSH yang dimiliki oleh beberapa spesies (Gambar 6). Sekuen ikan patin yang telah diisolasi menunjukkan kemiripan dengan ikan lele dan belut laut. Perbedaan dari spesies ini hanya beberapa nukleotida saja sehingga berdasarkan nilai tersebut ikan ini juga memiliki kekerabatan yang sangat dekat untuk gen FSH yang telah diisolasi.
Struktur protein yang terbentuk cDNA yang telah dikarakterisasi terbagi atas beberapa situs seperti rantai sistein dengan situs N-glikosilasi. Rantai utama sistein merupakan bagian yang sangat penting dalam menghubungkan diantara monomer GtH dari masing-masing bagian pada subunit α dan β. Bagian sistein yang dihubungkan dengan jembatan belerang disebut seat belt (Kajimura et al. 2000). Situs glikolisasi merupakan bagian yang sangat penting dari monomer GtH untuk menyatukan menjadi heterodimer yang aktif secara biologis. Pensejajaran yang telah dilakukan menunjukan bahwa susunan protein asam amino dari ikan patin, lele, dan belut menunjukkan kekerabatan yang dekat, tetapi berbeda dengan beberapa spesies yang memiliki sisik. Daerah yang memiliki kesamaan dengan hewan yang bersisik juga hampir sebagian menunjukkan daerah yang sama.
Struktur protein gen FSH subunit β terlihat unik antara ikan yang bersisik dan
ikan yang tidak bersisik, sedangkan ikan yang bagian sebelahnya bersisik dan sebelah bagian tubuhnya tidak bersisik (misqurnus) digolongkan dalam ikan yang bersisik. Hal itu, karena bagian situs aktif dari gen ini adalah sama sedangkan pada bagian inti struktur gen mengalami perbedaan dengan hewan ikan yang bersisik. Perbedaan antara yang bersisik dengan yang tidak bersisik terjadi perbedaan pada daerah setelah sinyal peptida. Namun asam amino pada urutan 110, terlihat bahwa spesies Misqurnus sama dengan hewan tidak bersisik sehingga ikan Misqurnus berada pada cluster tersendiri cluster besar pada cluster ikan
23
bersisik. Sedangkan perbedaan asam amino yang lain sama dengan kelompok ikan yang bersisik.
Sifat khas yang dimiliki oleh FSH subunit β menunjukkan perbedaan
ekspresi pada ikan yang disuntik dengan berbagi macam hormon dan bahan kimia selama tahap gametogenesis pada ikan uji. Selain itu, gen aromatase diukur tingkat ekspresinya untuk mengkonfirmasi adanya peran aromatase akibat induksi hormon PMSG dan antidopamin yang dihubungkan dengan konsentrasi estradiol pada tahap perkembangan gonad yang sama (Nagahama, 1991; Rahman, 2013). Konsentrasi estradiol meningkat seiring dengan aktivitas aromatase pada tahap perkembangan gonad, sedangkan untuk konsentrasi estradiol yang menurun terjadi pada tahap vitelogenesis akhir yang memberikan sinyal pada otak untuk mensekresikan LH karena inti telur sudah bermigrasi dan akan ovulasi. Penyuntikan yang dilakukan selama tiga minggu menunjukkan konsentrasi FSH yang semakin meningkat, namun perkembangan gonad yang telah sempurna untuk ovulasi menunjukkan konsentrasi yang menurun. Hal ini terjadi akibat sekresi FSH dari pituitari telah terhenti dan dilanjutkan dengan LH untuk ovulasi telur. Hal ini sesuai dengan Young et al. (2005) yang menyatakan bahwa FSH yang disekresikan menuju gonad akan berkurang setelah gonad menyampaikan sinyal positif pada otak untuk mensekresikan LH karena kondisi inti telur telah bermigrasi ke pinggir (GVBD; germinal vesicle break down). Ekspresi mRNA
24
dikombinasikan dengan AD dapat meningkat dibandingkan dengan induksi menggunakan AD dan PMSG. Hal ini berdampak pada jumlah telur yang dihasilkan dari proses steroidogenesis yang meningkatkan pertumbuhan oosit pada gonad. Penyuntikan menggunakan PMSG dan PMSG dikombinasi dengan AD mampu meningkatkan ekspresi enzim aromatase dan FSH (Nagahama, 1991; Nagahama dan Yamasita, 2008). Sintesis dan sekresi gonadotropin dapat meregulasi dengan GnRH dekapeptida yang disekresikan ke dalam portal hipofiseal. Kontrol sintesis dan sekresi FSH dan LH merupakan poros otak, hipofisa, dan gonad. FSH dan LH berperan di ovari dan testes dalam meregulasi folliculogenesis, ovulasi, spermatogenesis, dan steroidogenesis (Sherwood dan Adams, 2003; Burger et al. 2004; Dufour, 2005).
Kinerja reproduksi pada perlakuan hormon dan bahan kimia memberikan respons secara fisiologi melalui peningkatan nilai indeks somatik gonad. Hal ini membuktikan bahwa induksi menggunakan hormon dan bahan kimia memiliki peran dalam proses perkembangan awal gonad. Regulasi PMSG dalam perkembangan gonad dapat meningkatkan proses konversi testosteron menjadi estradiol melalui aktivitas aromatase. Proses selanjutnya estradiol digunakan sebagai bahan utama dalam mengisi oosit pada folikel telur. Mekanisme PMSG diindikasi bekerja dengan forskolin dan dbcAMP dalam proses aromatisasi sebagai respons dari disekresikannya GtH (Fukada et al. 1994; Nagahama, 1997; Nagahama dan Yamashita, 2008). Menurut Yaron dan Sivan (2011) regulasi antidopamin pada perkembangan gonad masih belum diketahui secara pasti mekanismenya. Hasil penelitian ini membuktikan bahwa antidopamin dapat berperan dalam perkembangan gonad dalam jumlah sedikit. Hal ini terjadi karena diduga adanya perbedaan sistem kerja antidopamin dalam perkembangan gonad sehingga peranan dalam otak belum diketahui.
Peningkatan ekspresi FSH subunit β dilakukan dengan menginduksi hormon dan bahan kimia. Penyuntikan dengan menggunakan larutan fisiologis tidak menunjukkan adanya peran dalam perkembangan gonad. Perlakuan lain yang menggunakan induksi hormon dan bahan kimia memiliki peran dalam perkembangan gonad. Konsentrasi DNA meningkat untuk setiap perlakuan hormon dan bahan kimia, kombinasi hormon dan bahan kimia mampu meningkatkan ekspresi kematangan gonad dan respon fisiologis melalui histologi gonad menunjukkan hasil yang konsisten (Gambar 9).
SIMPULAN DAN SARAN SIMPULAN
25
Saran
Rekayasa ekspresi menggunakan kombinasi PMSG dan antidopamin dapat dilakukan untuk meningkatkan FSH endogenous sehingga proses vitelogenesis dapat terjadi di luar musim pemijahan.
DAFTAR PUSTAKA
Aizen J, Kasuto H, Golan M, Zaky Z H, Levavi S B. 2007. Tilapia follicle-stimulating hormone (FSH): immunochemistry, stimulation by gonadotropin-releasing hormone, and effect of biologically active recombinant FSH on steroid secretion. Biology of Reproduction. 76:692– 700.
Alok D, Zohar Y. 2005. Genes For Fish GnRHs and Their Receptor: Relevance to Aquaculture Biotechnology. In: Pandian, T. J., Strusmann, Marian, M. P., (Eds.), Fish Genetics and Aquaculture Biotechnology. Science Publisher Inc.
Amano M. 2010. Reproductive biology of salmoniform and pleuronectiform fishes with special reference to gonadotropin-releasing hormone (GnRH). Aqua-BioScience Monographs. 3: 39–72.
[American Society Reproductive Medicine]. 2008. Gonadotropins preparations: past, present, and future perspective. 90: 13-20.
Bousfield G R, Perry W M, Ward D N. 1994. Gonadotropins, Chemistry and biosynthesis. In: Knobil, E., Neill, J. D. (Eds.). The Physiology of Reproduction. Raven Press, New York. 1749-1792.
Cui M, Li W, Liu W, Yang K, Pang Y, Haoran L. 2007. Production of recombinant orange-spotted grouper Epinephelus coioides luteinizing hormone in insect cells by the baculovirus expression system and its biological effect. Biology of Reproduction. 76: 74-84.
Dae-Jung K, Suzuki Y, Aida K. 2010. The Control Mechanism of Gonadotropin-Releasing Hormone and Dopamine on Gonadotropin Re-lease from Cultured Pituitary Cells of Rainbow Trout Oncorhynchus mykiss at Different Reproductive Stages. Fish Aquatic Science. 14: 379-388.
Dufour S, Sebert M E, Weltzien F A, Rousseau K, Pasqualini C. 2010. Neuroendocrine control by dopamine of teleost reproduction. Journal of Fish Biology. 76: 129-160.
Fard E R, Kamaruddin S, Sharr A, Harmin. 2012. Endocrine Control of Oogenesis in Teleost. Asian Journal of Animal and Veterinary Advances. 10: 1-11.
26
Fukada S, Sakai N, Adachi S. Nagahama Y. 1994. Steroidogenesis in the ovarian follicle of medaka (Oryzias latipes, a daily spanner) during oocyte maturation. Developmental Growth Differ. 36: 81–88.
Hassin S, Elizur A, Zohar Y. 1995. Molecular cloning and sequence analysis of striped bass Morone saxatilis gonadotropin I and II subunits. Journal of Molecular Endocrinology. 15: 23–35.
Hayakawa Y, Hidekazu N, Kaki H, Komei H, Kobayashi, M. 2009. Induction of spermatogenesis in Japanese eel by recombinant goldfish Carasius auratus gonadotropin. Fisheries Science. 75: 137-144.
Huang C J, Huang F L, Chang G D, Chang Y S, Lo C F, Fraser M J, Lo T B. 1991. Expression of two forms of carp gonadotropinasubunit in insect cells by recombinant baculovirus. Proc. Natl Acad. Sci. USA. 88: 7486–7490.
Jackson K, Goldberg D, Ofir M, Abraham M, Degani G. 1999. Blue gourami (Trichogaster trichopterus) gonadotropic β subunits (I and II) cDNA sequences and expression during oogenesis. Journal of Molecular Endocrinology. 23: 177-187.
Kajimura S, Yoshiura Y, Suzuki M, Aida K. 2001. cDNA cloning of two gonadotropin beta subunits (GTH-I beta and -II beta) and their expression proWles during gametogenesis in the Japanese Xounder (Paralichthys olivaceus). General Comparative and Endocrinology. 122: 117–129.
Kamei H., Ohira, T., Yoshiura, Y., Uchida, N., Nagasawa, H., Aida, K. 2003. Expression of a biologically acive recombinant follicle stimulating hormone of Japanese eel Anguilla japonica using methylotrophic yeast, Pichia pastoris. General Comparative and Endocrinology. 134: 244-254. Kasuto H, Levavi S B. 2005. Production of biologically active tethered tilapia
LHβα by the methylotrophic yeast Pichia pastoris. General Comparative and Endocrinology. 140: 222-232.
Kazeto Y, Kohara M, Miura T, Miura C, Yamaguchi S, Trant J M, Adachi S, Yamauchi K. 2008. Japanese eel follicle-stimulating hormone (FSH) and luteinizing hormone (LH): production of biologically active recombinant FSHand LH by Drosophila S2 cells and their differential actions on the reproductive biology. Biology of Reproduction. 79: 938-946.
Khairuman, Amri K. 2008. Buku Pintar Budidaya 15 ikan konsumsi. Jakarta: Agromedia Pustaka.
Khairuman, Sudenda D. 2010. Budidaya patin secara intensif. Jakarta: Agromedia Pustaka.
Kobayashi M, Morita T, Ikeguchi K, Yoshizaki G, Suzuki T, Watabe S. 2003. Production of recombinant goldfish gonadotropins by baculovirus in silkworm larvae. Fish Physiology and Biochemistry. 28: 469-471.