PENAMBAHAN MINYAK CENGKEH Syzygium
aromaticum DALAM PAKAN UNTUK MENINGKATKAN
PERTUMBUHAN DAN STATUS KESEHATAN IKAN BAWAL
Colossoma macropomum
ANDI TIARA EKA DIANA PUTERI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penambahan Minyak Cengkeh Syzygium aromaticum Dalam Pakan Untuk Meningkatkan Pertumbuhan Dan Status Kesehatan Ikan Bawal Colossoma macropomum adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
ANDI TIARA EKA DIANA PUTERI. Penambahan Minyak Cengkeh Syzygium aromaticum Dalam Pakan Untuk Meningkatkan Pertumbuhan Dan Status Kesehatan Ikan Bawal Colossoma macropomum. Dibimbing oleh DEDI JUSADI dan SRI NURYATI
Harga pakan ikan yang kian meningkat berbanding terbalik dengan harga jual ikan yang relatif stabil. Hal ini tidak diikuti dengan peningkatan nilai efisiensi pakan sehingga keuntungan yang diperoleh petani cenderung menurun. Diperlukan adanya suatu upaya untuk meningkatkan efisiensi pemanfaatan pakan sebagai langkah mengatasi kenaikan harga pakan. Hal tersebut dapat ditempuh melalui penggunaan zat aditif, dalam hal ini minyak cengkeh. Penelitian terdahulu mengenai penambahan minyak cengkeh dalam pakan ikan berhasil membuktikan terjadinya peningkatan pada kinerja pertumbuhan dan status kesehatan ikan. Penelitian ini dilakukan untuk mengevaluasi pengaruh minyak cengkeh yang ditambahkan ke dalam pakan terhadap kinerja pertumbuhan dan status kesehatan ikan bawal Colossoma macropromum.
Penelitian ini dilakukan dalam 2 tahap pemeliharaan yaitu pemeliharaan uji pertumbuhan selama 45 hari dan uji kecernaan selama 11 hari, terdiri dari 5 perlakuan dan 3 ulangan. Sebagai perlakuan adalah penambahan minyak cengkeh ke dalam pakan pada dosis 0 (kontrol), 5, 10, 15, dan 100 mg per 100 g pakan. Ikan bawal diberi pakan yang ditambah minyak cengkeh pada dosis sesuai perlakuan tersebut. Pada uji pertumbuhan, sebanyak dua puluh lima ekor ikan bawal dengan berat individu 7,6 ± 0,60 g ditebar ke dalam 15 akuarium. Selama masa pemeliharaan, ikan diberi pakan sesuai perlakuan sebanyak tiga kali sehari (pukul 08.00, 12.00 dan 16.00 WIB) secara at satiation. Parameter uji yang diamati antara lain bobot individu (awal dan akhir), tingkat kelangsungan hidup, jumlah konsumsi pakan, laju pertumbuhan harian, efisiensi pakan, dan retensi protein. Status kesehatan ikan diamati melalui pengambilan sampel darah untuk mengetahui profil gambaran darah ikan bawal, penghitungan kelimpahan dan karakterisasi jenis bakteri usus. Selanjutnya pada uji kecernaan, ikan bawal diberi pakan yang mengandung kromium (Cr2O3). Pengumpulan feses dari 15 ekor ikan
dilakukan untuk mengetahui besarnya kecernaan protein. Beberapa parameter penunjang lainnya yang turut diamati dalam penelitian ini antara lain hepatosomatik indeks, rasio panjang usus dengan tubuh, pengukuran panjang villi usus, kadar malondialdehyde (MDA) pada plasma serta histologi organ hati dan usus.
Hasil penelitian menunjukkan bahwa penambahan minyak cengkeh dalam pakan mampu meningkatkan kinerja pertumbuhan yang dilihat dari kenaikan bobot individu di akhir pemeliharaan, laju pertumbuhan harian, dan nilai retensi protein. Selain itu, juga berpengaruh pada menurunnya kadar MDA plasma serta meningkatnya kecernaan protein. Perlakuan penambahan minyak cengkeh sebesar 10 mg /100 g pakan merupakan dosis terbaik yang diperoleh dalam penelitian ini.
SUMMARY
ANDI TIARA EKA DIANA PUTERI. Supplementation of Clove Oil Syzygium aromaticum in the Diet to Enhance Growth Performance and Health Status of Tambaqui Colossoma macropomum. Supervised by DEDI JUSADI and SRI NURYATI
Fish feed price increasing inversely with fish selling price which relatively stable. It is not accompanied by the increasing of feed efficiency, this impact to decline of fish farmers benefit income. Therefore, it is needed an effort to improve feed efficiency to overcome fish feed price elevation. This can be done through utilization of clove oil as additive. Previous studies on clove oil addition in fish feed has proven an increase in growth performance and health status of fish. This study was conducted to evaluate the effect of diet supplemented with clove oil on growth performance and health status of Tambaqui Colossoma macropromum.
This research was conducted into 2 stages were growth performance test for 45 days and 11 days for digestibility test, consisting of 5 treatments and 3 replications. The treatment is addition of clove oil into feed at doses of 0 (control), 5, 10, 15, and 100 mg per 100 g of feed. Tambaqui fed with appropriate doses of the treatment. In growth performance test, 25 fishes with an individual weight of 7.6 ± 0,60 g were stocked into each 15 aquariums. During the maintenance period, fishes were fed according to the treatment three times a day (at 08:00 am, 12:00 am and 16:00 pm) at satiation level. The observed parameters were individual weights (at the beginning and the end test), survival rate, amount of feed intake, daily growth rate, feed efficiency and protein retention. The fish health status observed by taking a blood sample to determined Tambaqui blood profile, abundant and characterization of intestinal bacteria. Later in the digestibility test, Tambaqui were given feed containing chromium (Cr2O3). Feces collection of 15
fish was conducted to determine protein digestibility. Other supporting parameters that also observed in this study include hepatosomatic index, the ratio of the body length of the intestines, measurement of intestinal villi length, malondialdehyde (MDA) levels in plasma also liver and intestinal histology.
The results showed the addition of clove oil in feed was able to boosted growth performance seen from individual weights increasing at the end of maintenance, daily growth rate, and protein retention. Moreover, it was also affected to decrease levels of MDA plasma and increased protein digestibility. The addition of clove oil by 10 mg/100 g feed was the best dose obtained in this study.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PENAMBAHAN MINYAK CENGKEH Syzygium aromaticum
DALAM PAKAN UNTUK MENINGKATKAN PERTUMBUHAN DAN
STATUS KESEHATAN IKAN BAWAL Colossoma macropomum
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang telah dilaksanakan adalah Penambahan Minyak Cengkeh Syzygium aromaticum Dalam Pakan Untuk Meningkatkan Pertumbuhan Dan Status Kesehatan Ikan Bawal Colossoma macropomum.
Ucapan terima kasih penulis tujukan kepada Bapak Dr Dedi Jusadi dan Ibu Dr Sri Nuryati selaku komisi pembimbing yang selalu memberikan masukan demi perbaikan karya tulis ini. Penulis juga berterimakasih atas kesediaan Ibu Dr Mia Setiawati selaku dosen penguji serta Ibu Dr Dinamella Wahjuningrum selaku KPS yang tidak luput untuk memberikan saran yang membangun bagi kesempurnaan karya tulis ini.
Penulis juga menyampaikan terima kasih kepada staf dan laboran Departemen Budidaya Perairan IPB yang telah banyak membantu selama penulis melaksanakan penelitian. Tidak lupa, ungkapan terima kasih yang sebesar-besarnya penulis tujukan untuk orang tua, adik, dan keluarga atas segala doa, kasih sayang juga dukungan yang tiada henti. Kepada teman-teman seperjuangan Ilmu Akuakultur 2013, terutama rekanan Trio Cengkeh (Nurina Pratiwi dan Tira Silvianti) penulis ucapkan terimakasih atas kebersamaan dan semangatnya sehingga kita semua dapat melewati satu per satu tahapan menuju akhir studi. Kepada Bayuanggara Cahya Ramadhan, Didi Humaedi Yusuf (Babeh), Nur Hikma Mahasu (Kakak Gadis), Fahmi Akbar (Mimi), Aisyah Lukmini, Suhaiba Djai, Muhammad Rijalul Fikri, Azam Maulana, Chairun Nisa, Pipin Urip Kurniasih, Bambang Gunawan, Yusak, dan personel Laboratorium Nutrisi – AKU 2013 yang telah menyempatkan diri membantu penulis selama penelitian, terimakasih atas waktu, tenaga dan kehadirannya. Akhir kalam, semoga karya ilmiah ini dapat bermanfaat bagi yang membutuhkan.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Hipotesis 3
2 METODE 3
Rancangan Percobaan 3
Pakan Uji 4
Pemeliharaan Ikan untuk Uji Pertumbuhan dan Kecernaan 5
Rasio Panjang Usus dengan Tubuh dan Pengukuran Panjang Villi 6
Kelimpahan dan Karakterisasi Bakteri di Usus 6
Kadar Malondialdehyde (MDA) pada Plasma 6
Gambaran Darah 7
Hepatosomatik Indeks (HIS) dan Penghitungan Jumlah Sel Hepatosit 7
Analisis Proksimat Pakan 7
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 13
4 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1 Formulasi dan proksimat pakan uji (%) 5
2 Pengamatan parameter pertumbuhan ikan bawal selama 45 hari
pemeliharaan 8
3 Nilai kecernaan protein, rasio panjang usus dengan tubuh (RPU) dan
pengukuran panjang villi 8
4 Kelimpahan bakteri alami yang banyak ditemukan pada saluran
pencernaan ikan bawal 10
5 Karakterisasi dan identifikasi jenis bakteri yang banyak ditemukan
pada saluran pencernaan ikan bawal 10
6 Kadar Malondialdehyde (MDA) Plasma 10
7 Pengamatan gambaran darah pada ikan bawal 11
8 Hepatosomatik Indeks (HIS) dan jumlah sel hepatosit pada organ hati
ikan bawal 11
9 Analisis biaya ekonomi harga produksi pakan (HPP) 13
DAFTAR GAMBAR
1 Alur ruang lingkup penelitian 3
2 Skema Penelitian 4
3 Pengukuran panjang villi pada histologi membujur usus ikan bawal (perbesaran 4 kali). Skala bar: 10 µm. (a) perlakuan 0 mg/100 g (Kontrol), (b) 5 mg minyak cengkeh/100 g, (c) 10 mg/100 g, (d) 15 mg/100 g dan (e) 100 mg/100 g pakan. Pewarnaan
hematoksilin-eosin. Ser: Serosa 9
4 Tampilan sel hepatosit pada histologi hati ikan bawal (perbesaran 100 kali). Skala bar: 5 µm. (a) perlakuan 0 (Kontrol), (b) 5 mg minyak cengkeh/100 g, (c) 10 mg/100 g, (d) 15 mg/100 g dan (e) 100 mg/100 g pakan. Pewarnaan hematoksilin-eosin. Gambar yang dilingkari menunjukkan sel hepatosit, tanda panah menunjukkan inti sel hepatosit 12
DAFTAR LAMPIRAN
1 Kandungan nutrisi dari proksimat bahan baku pakan (% bobot basah) 23 2 Kondisi gas kromatografi untuk analisis kandungan bahan aktif minyak
cengkeh 23
3 Prosedur uji kecernaan (Takeuchi 1988) 23
4 Analisis kadar MDA pada plasma darah 23
5 Parameter uji pertumbuhan 24
6 Parameter uji kecernaan dan parameter penunjang 25 7 Prosedur pengamatan gambaran darah ikan dan parameter penunjang 26
8 Prosedur analisis proksimat 28
9 ANOVA dan Uji Lanjut DMRT 30
1 PENDAHULUAN
Latar Belakang
Peningkatan harga pakan ikan secara bertahap merupakan fakta yang dihadapi pembudidaya ikan di Indonesia, termasuk budidaya ikan bawal Colossoma macropomum. Seiring dengan peningkatan harga pakan ikan, harga jual ikan tetap stabil, serta nilai efisiensi pakan tidak meningkat. Oleh karena itu, untuk mengurangi dampak peningkatan harga pakan tersebut, maka perlu diimbangi dengan peningkatan mutu pakan. Upaya peningkatan mutu pakan dapat dilakukan di antaranya dengan menambah feed additive yang relatif murah. Salah satu bahan feed additive yang prospektif digunakan adalah minyak cengkeh Syzygium aromaticum. Harga eceran per 20 ml minyak cengkeh yaitu sebesar Rp 30.000, sehingga penambahan minyak cengkeh pada dosis yang relatif kecil, tidak banyak mempengaruhi harga pakan. Minyak cengkeh (dalam total 98,5%) mengandung eugenol sebesar 85%, β-caryophyllene sebesar 10,54%, α-humulene sebesar 3,12%, δ-candidene sebesar 0,29% dan Caryophyllene oxide sebesar 0,20% (Viuda-Martos et al. 2007).
2
Hasil penelitian lain menunjukkan bahwa ekstrak daun cengkeh mampu mencegah terjadinya hiperkolesterolemia pada kelinci. Hal ini ditandai dengan penurunan kadar kolesterol total, LDL (low density lipoprotein) dan trigliserida yang diikuti dengan peningkatan HDL (high density lipoprotein). Adapun kadar MDA (malondialdehyde) yang diukur pada organ hati serta ginjal juga mengalami penurunan. Rendahnya kadar MDA menunjukkan bahwa ekstrak daun cengkeh berperan aktif sebagai antioksidan (Mu’nisa 2009). Penggunaan minyak cengkeh yang mengandung salah satu bahan aktif berupa metil eugenol telah diatur kadar maksimum keberadaannya pada produk-produk perikanan sebesar 10 mg/kg (setara dengan 100 mg/100 g), sementara pada produk daging unggas batas maksimumnya sebesar 15 mg/kg atau setara dengan 150 mg/100 g (FSAI 2012). Oleh karena itu, melalui penelitian ini ingin melihat pengaruh penambahan minyak cengkeh di dalam pakan terhadap status kesehatan, perkembangan saluran pencernaan dan kinerja pertumbuhan ikan bawal.
Perumusan Masalah
Harga pakan ikan yang kian meningkat tidak diimbangi dengan peningkatan harga jual ikan dan efisiensi pakan, sehingga keuntungan yang diperoleh petani cenderung menurun. Untuk itu diperlukan adanya suatu upaya untuk meningkatkan efisiensi pemanfaatan pakan sebagai langkah mengatasi kenaikan harga pakan. Hal tersebut dapat ditempuh melalui penggunaan minyak cengkeh ke dalam pakan ikan. Minyak cengkeh diketahui memiliki banyak manfaat di antaranya bersifat antioksidan, antimikroba serta memperbaiki gambaran darah yang secara tidak langsung akan berdampak pada peningkatan kinerja pertumbuhan. Penelitian terdahulu menunjukkan bahwa penambahan minyak cengkeh dalam pakan, berperan sebagai antioksidan (Abdel-Magied & Ahmed 2011), berperan pada peningkatan kinerja pertumbuhan (Gaber 2000) dan status kesehatan ikan (Rattanachaikunsopon & Phumkhachorn 2009). Kandungan bahan aktif yang diduga mendukung peranan tersebut adalah eugenol. Melalui penelitian ini diharapkan bahwa penambahan minyak cengkeh (S. aromaticum) dalam pakan yang diberikan untuk ikan bawal pada dosis tertentu berdampak aman bagi bakteri usus, sehingga perkembangan saluran pencernaan ikan bawal tidak terganggu. Selain itu, juga perannya sebagai antioksidan diharapkan akan memperlihatkan efek yang positif pada status kesehatan dan pertumbuhan ikan.
Tujuan Penelitian
3
Manfaat Penelitian
Keberhasilan penelitian ini dapat memberi sumbangan informasi dan pengetahuan adanya feed additive berupa minyak cengkeh yang dapat meningkatkan efisiensi pemanfaatan pakan. Informasi tersebut dapat menjadi masukkan bagi industri pakan ikan dalam memformulasi pakan yang lebih tinggi mutunya serta harga yang tetap kompetitif.
Hipotesis
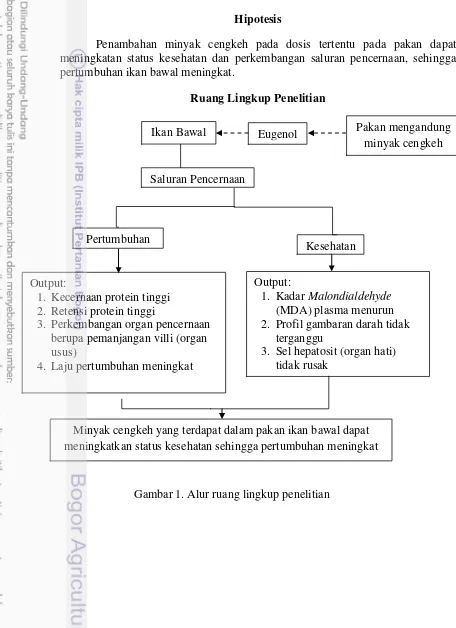
Penambahan minyak cengkeh pada dosis tertentu pada pakan dapat meningkatan status kesehatan dan perkembangan saluran pencernaan, sehingga pertumbuhan ikan bawal meningkat.
Ruang Lingkup Penelitian
Kesehatan Saluran Pencernaan
Pertumbuhan
Output:
1. Kadar Malondialdehyde (MDA) plasma menurun 2. Profil gambaran darah tidak
terganggu
3. Sel hepatosit (organ hati) tidak rusak
Output:
1. Kecernaan protein tinggi 2. Retensi protein tinggi
3. Perkembangan organ pencernaan berupa pemanjangan villi (organ usus)
4. Laju pertumbuhan meningkat
Minyak cengkeh yang terdapat dalam pakan ikan bawal dapat meningkatkan status kesehatan sehingga pertumbuhan meningkat
Gambar 1. Alur ruang lingkup penelitian
Ikan Bawal Pakan mengandung
4
2 METODE
Rancangan Percobaan
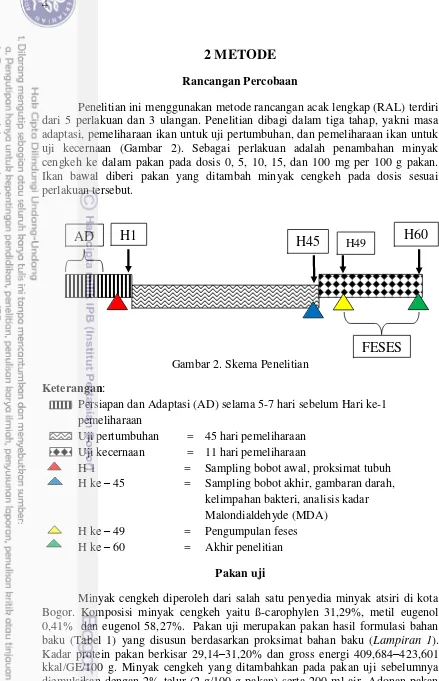
Penelitian ini menggunakan metode rancangan acak lengkap (RAL) terdiri dari 5 perlakuan dan 3 ulangan. Penelitian dibagi dalam tiga tahap, yakni masa adaptasi, pemeliharaan ikan untuk uji pertumbuhan, dan pemeliharaan ikan untuk uji kecernaan (Gambar 2). Sebagai perlakuan adalah penambahan minyak cengkeh ke dalam pakan pada dosis 0, 5, 10, 15, dan 100 mg per 100 g pakan. Ikan bawal diberi pakan yang ditambah minyak cengkeh pada dosis sesuai perlakuan tersebut.
Gambar 2. Skema Penelitian
Keterangan:
Persiapan dan Adaptasi (AD) selama 5-7 hari sebelum Hari ke-1 pemeliharaan
Uji pertumbuhan = 45 hari pemeliharaan Uji kecernaan = 11 hari pemeliharaan
H 1 = Sampling bobot awal, proksimat tubuh H ke – 45 = Sampling bobot akhir, gambaran darah,
kelimpahan bakteri, analisis kadar Malondialdehyde (MDA)
H ke – 49 = Pengumpulan feses H ke – 60 = Akhir penelitian
Pakan uji
Minyak cengkeh diperoleh dari salah satu penyedia minyak atsiri di kota Bogor. Komposisi minyak cengkeh yaitu ß-carophylen 31,29%, metil eugenol 0,41% dan eugenol 58,27%. Pakan uji merupakan pakan hasil formulasi bahan baku (Tabel 1) yang disusun berdasarkan proksimat bahan baku (Lampiran 1). Kadar protein pakan berkisar 29,14–31,20% dan gross energi 409,684–423,601 kkal/GE/100 g. Minyak cengkeh yang ditambahkan pada pakan uji sebelumnya diemulsikan dengan 2% telur (2 g/100 g pakan) serta 200 ml air. Adonan pakan uji dicetak pada mesin pencetak pelet berdiameter 1-2 mm kemudian dikeringkan pada oven bersuhu 40˚C selama 24 jam. Pakan yang sudah jadi dikemas dalam
H45
H60
H1
AD
5
plastik kemudian disimpan pada tempat yang tidak lembab. Pengukuran kadar bahan aktif minyak cengkeh (eugenol, ß-carophylen dan metil eugenol) menggunakan gas kromatografi (GC) yang mengacu pada (ISO 3141: 1997 (E)). Kondisi alat terdapat pada Lampiran 2. Sementara itu, pakan yang digunakan untuk uji kecernaan berdasar pada pakan perlakuan uji pertumbuhan, namun terdapat penambahan penanda kromium (Cr2O3) sebesar 0,5%.
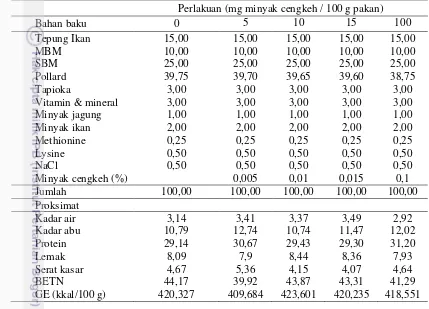
Tabel 1. Formulasi dan proksimat pakan uji (%)
Perlakuan (mg minyak cengkeh / 100 g pakan)
Bahan baku 0 5 10 15 100
Pemeliharaan ikan untuk uji pertumbuhan dan kecernaan
Pemeliharaan ikan dilakukan di dalam 15 akuarium ukuran 100 × 50 × 45 cm3. Setiap akuarium dilengkapi dengan aerasi untuk menjaga kelarutan oksigen, thermostat agar suhu stabil serta filter untuk sirkulasi air dan mengurangi kekeruhan akibat bahan organik di dalam akuarium.
6
7,2–7,3, total ammonia 0,08–0,12 mg/l, alkalinitas 82,8–117,5 mg/l, dan suhu 30–31 ºC.
Pada hari ke 45, ikan di seluruh akuarium dibius dengan menggunakan Ocean free special arowana stabilizer sebanyak 2 mL/3 L air, lalu ditimbang bobotnya. Dua ekor ikan dari setiap akuarium diambil darahnya dan dijadikan satu untuk dilakukan analisis sel darah merah, haemoglobin, sel darah putih, dan hematokrit. Dua ekor ikan lainnya diambil dan dimasukkan ke dalam freezer untuk keperluan analisis proksimat. Hasil analisis proksimat digunakan untuk menghitung retensi protein. Kelimpahan bakteri di saluran usus, panjang usus, panjang villi, masing-masing diukur dari 2-3 ekor ikan yang ada di setiap akuarium. Pengukuran kadar malondialdehyde (MDA) dilakukan pada plasma darah dari satu ekor ikan pada masing-masing perlakuan yang dikumpulkan jadi satu.
Mulai hari ke 46, setiap akuarium diisi 15 ekor ikan dan diberi pakan yang mengandung kromium. Pengambilan feses dilakukan mulai hari ke 49 sampai hari ke 60. Prosedur pengumpulan feces dilakukan satu jam setelah pemberian pakan pada waktu siang dan sore hari. Sampel feses yang telah dikumpulkan setiap kali dimasukkan ke freezer untuk menjaga agar tidak terjadi proses pembusukan sehingga kadar kromium dan nutrient dapat diukur. Prosedur uji kecernaan terdapat pada Lampiran 3.
Rasio Panjang Usus dengan Tubuh (RPU) dan Pengukuran Panjang Villi
Rasio panjang usus dengan tubuh (RPU) mengikuti prosedur Affandi (1993), kemudian pengukuran panjang villi untuk mengetahui perkembangan usus ikan mengacu pada Nasir (2002).
Kelimpahan dan Karakterisasi Bakteri di Usus
Pengamatan ini dilakukan melalui pengambilan contoh bakteri yang paling banyak ditemukan pada saluran pencernaan ikan bawal. Uji kelimpahan bakteri pada saluran pencernaan mengikuti metode Balaji et al. (2012). Karakterisasi bakteri disesuaikan dengan identifikasi genus bakteri pada Tabel Cowan (1993).
Kadar Malondialdehyde (MDA) pada Plasma
7
Gambaran Darah
Pengamatan parameter gambaran darah berupa sel darah merah dan sel darah putih dilakukan sesuai dengan prosedur Blaxhall & Daisley (1973), kadar hemoglobin sesuai dengan Collier (1944) dan kadar hematokrit sesuai dengan Anderson & Siwicki (1993).
Hepatosomatik Indeks (HIS) dan Penghitungan Jumlah Sel Hepatosit
Parameter hepatosomatik indeks (HIS) dianalisis menurut Garling & Wilson (1977) yang menjadi gambaran besarnya kenaikan bobot hati dibandingkan dengan bobot tubuh ikan. Sementara itu, jumlah sel hepatosit dari preparat histologi organ hati dihitung dengan software ImageJ kemudian dibagi dengan luasan area pengamatan (mm2). Bertambahnya jumlah sel hepatosit menjadi gambaran terjadinya penyesuaian struktur organ hati.
Analisis Proksimat Pakan
Analisis proksimat pakan dan tubuh ikan dilakukan sesuai dengan Watanabe (1988).
Analisis Data
Data yang diperoleh diolah menggunakan Microsoft Excell 2007 kemudian dilakukan Analisis sidik ragam (ANOVA) dengan taraf kepercayaan 95% menggunakan SPSS 16.0. Jika terdapat perlakuan yang berbeda nyata antar perlakuan dilakukan uji lanjut DMRT. Parameter uji pertumbuhan terdapat pada Lampiran 5. Parameter uji kecernaan serta parameter penunjang terdapat pada Lampiran 6. Prosedur pengamatan gambaran darah ikan serta parameter penunjang berupa histologi hati dan usus, perhitungan jumlah sel hepatosit per mm2 dan uji kelimpahan bakteri terdapat pada Lampiran 7. Prosedur analisis proksimat terdapat pada Lampiran 8. ANOVA dan uji lanjut DMRT terdapat pada Lampiran 9. Parameter histologi hati dan usus mengikuti prosedur Kiernan (1999) dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
8
Tabel 2. Pengamatan parameter pertumbuhan ikan bawal selama 45 hari pemeliharaan
Parameter Perlakuan (mg minyak cengkeh/ 100 g pakan)
0 (Kontrol) 5 10 15 100
JKP (g) 58,5+8,83a 53,4+9,13a 57,7+3,32a 61,5+4,56a 52,8+10,72a
RP (%) 32,5+5,51b 29,1+3,53b 40,4+1,71a 35,6+3,31ab 35,9+4,70ab
EP (%) 58,0+9,87a 62,3+7,54a 71,3+2,98a 70,9+6,46a 64,5+8,65a
LPH 3,8+0,07b 3,7+0,21b 4,2+0,18 ab 4,5+0,23a 3,8+0,39 b
W0 (g) 7,7+0,67a 7,8+0,49 a 7,8+3,22a 7,0+0,95a 7,6+0,11a
W45 (g) 41,1+4,84b 40,6+2,18b 48,9+3,22a 50,4+1,99a 41,4+6,12b
TK (%) 90,7+16,17a 94,7+4,62a 98,7+2,31a 85,3+11,55a 92,0+13,86a
Keterangan: Huruf superscript di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
JKP = jumlah konsumsi pakan; RP = retensi protein; EP = efisiensi pakan; LPH = laju pertumbuhan harian; W0 = bobot individu awal; W45 = bobot akhir individu hari 45; TK = tingkat kelangsungan hidup;
Berdasarkan hasil pada Tabel 2, nilai retensi protein perlakuan 10, 15 dan 100 mg/100 g pakan memiliki nilai yang tidak berbeda nyata dibandingkan perlakuan lainnya. Retensi protein tertinggi terdapat pada perlakuan 10 mg/100 g pakan. Pemberian pakan yang mengandung minyak cengkeh sebanyak 10 dan 15 mg/100 g pakan memberikan efek pada laju pertumbuhan yang berbeda dengan perlakuan tanpa penambahan minyak cengkeh. Penambahan minyak cengkeh ke dalam pakan pada kadar mulai dari 10 sampai 15 mg/100 g pakan mampu meningkatkan laju pertumbuhan harian ikan yang mengkonsumsi pakan-pakan tersebut. Sehingga pada akhir pemeliharaan uji pertumbuhan, kedua perlakuan tersebut mengalami peningkatan bobot akhir yang tinggi daripada perlakuan lainnya. Adapun hasil analisis proksimat tubuh ikan awal dan akhir pemeliharaan terdapat pada Lampiran 10.
Tabel 3. Nilai kecernaan protein, rasio panjang usus dengan tubuh (RPU) dan pengukuran panjang villi
Parameter Perlakuan (mg minyak cengkeh/ 100 g pakan)
0 (Kontrol) 5 10 15 100
Kecernaan protein 62,7+6,51b 65,7+3,14b 72,6+7,21ab 79,5+3,31a 71,5+7,52ab
RPU 1,3+0,08 a 0,8+0,01 b 1,5+0,19 a 1,5+0,13 a 1,5+0,19 a
Panjang villi (µm) 400+114,5b 500+50,0ab 675+86,6ab 767+200,5ab 950+458,9a
Keterangan: Huruf superscript di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
RPU= rasio panjang usus dengan panjang tubuh ikan
9
cengkeh. Perlakuan 100 mg/100 g pakan berbeda nyata dengan perlakuan 0 mg/100 g pakan (kontrol).
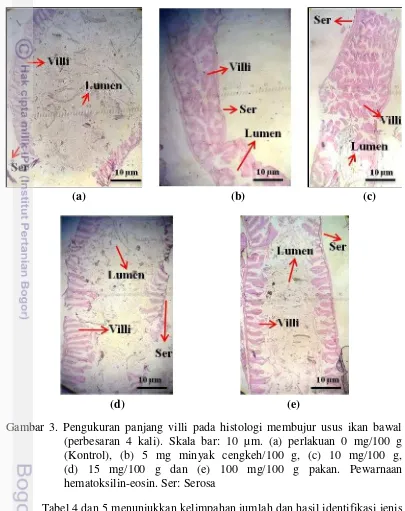
Hasil pengamatan kondisi villi usus terdapat pada Gambar 3. Histologi membujur usus ikan bawal memperlihatkan penampakan kondisi villi antara perlakuan kontrol dibandingkan dengan perlakuan penambahan minyak cengkeh. Terlihat bahwa kondisi villi usus ikan bawal mengalami perubahan dan pertambahan panjang sehingga tampak berbeda-beda pada semua perlakuan.
(a) (b) (c)
(d) (e)
Gambar 3. Pengukuran panjang villi pada histologi membujur usus ikan bawal (perbesaran 4 kali). Skala bar: 10 µm. (a) perlakuan 0 mg/100 g (Kontrol), (b) 5 mg minyak cengkeh/100 g, (c) 10 mg/100 g, (d) 15 mg/100 g dan (e) 100 mg/100 g pakan. Pewarnaan hematoksilin-eosin. Ser: Serosa
10
Tabel 4. Kelimpahan bakteri yang banyak ditemukan pada saluran pencernaan ikan bawal
Pengamatan Perlakuan (mg minyak cengkeh/ 100 g pakan)
0 (Kontrol) 5 10 15 100
Kelimpahan (CFU/g) 1,64 × 107 8,0 × 107 4,0 × 109 1,14 × 106 1,8 × 106
Tabel 4 memperlihatkan bahwa perlakuan 10 mg/100 g pakan memiliki kelimpahan bakteri dengan jumlah tertinggi sebesar 4,0×109 CFU/gr dibandingkan dengan perlakukan 0 mg/100 g pakan (kontrol). Sementara itu, perlakuan 15 mg/100 g pakan menunjukkan kelimpahan terendah yaitu 1,14×106 CFU/g.
Tabel 5 memperlihatkan hasil identifikasi bakteri berdasarkan panduan Tabel Cowan. Secara umum didominasi oleh Enterobactericeae dan Corynebacterium (perlakuan 0, 5, 10 dan 15 mg/100 g pakan). Sedangkan pada perlakuan 100 mg/100 g pakan menunjukkan bakteri yang lebih bervariasi yaitu Streptobacillus, Mycoplasma dan Corynebacterium.
Tabel 5. Karakterisasi dan identifikasi bakteri yang banyak ditemukan pada saluran pencernaan ikan bawal Keterangan: Berdasarkan tabel pengelompokan bakteri Gram positif dan negatif (Cowan 1993)
Tabel 6 menunjukkan hasil analisis kadar Malondialdehyde (MDA) yang berbeda nyata pada plasma darah ikan bawal. Pemberian pakan yang mengandung minyak cengkeh, pada kadar 5, 10 dan 15 mg/100 g pakan menurunkan nilai MDA hingga mencapai 3,61 ppm, 5,12 ppm, dan 4,42 ppm dibandingkan dengan kadar MDA perlakuan 0 mg/100 g pakan (kontrol) lebih tinggi yaitu 10,72 ppm. Tabel 6. Kadar Malondialdehyde (MDA) plasma
Parameter Perlakuan (mg minyak cengkeh/ 100 g pakan)
0 (Kontrol) 5 10 15 100
MDA plasma
(ppm) 10,72+1,37a 3,61+3,70b 5,12+2,08b 4,42+2,39b 6,69+1,28ab
11
Tabel 7 merupakan pengamatan gambaran darah pada ikan bawal. Parameter yang diamati berupa jumlah sel darah merah (SDM), jumlah sel darah putih (SDP), kadar hemoglobin (Hb) dan kadar hematokrit (Ht). Hasil pengamatan gambaran darah tidak menunjukkan adanya pengaruh dari penambahan minyak cengkeh pada pakan ikan bawal. Namun demikian, diperoleh kisaran nilai SDM dan nilai hematokrit yang lebih rendah dibandingkan dengan SDM dan hematokrit ikan mas. Sedangkan kisaran nilai SDP dan hemoglobin lebih tinggi dibandingkan dengan SDP dan hemoglobin ikan mas.
Tabel 7. Pengamatan gambaran darah pada ikan bawal
Parameter 0 (Kontrol) Perlakuan (mg minyak cengkeh/ 100 g pakan) 5 10 15 100 *Pustaka
Ikan Mas
SDM (106/mm3) 0,47 – 0,77 0,17 – 0,79 0,42 – 0,82 0,38 – 0,86 0,14 – 0,59 1,67
SDP (104/mm3) 4,50 – 7,00 4,50 – 7,50 4,00 – 8,00 4,00 – 8,00 3,00 – 6,00 3,78
Hb (gram % ) 9,00 – 10,60 9,00 – 10,60 9,20 – 10,60 9,00 – 9,20 8,40 – 9,60 8,2 Ht (%) 25,00 – 32,50 25,58 – 28,89 21,43 – 27,27 25,58 – 27,27 19,05 – 27,91 33,4
Keterangan: SDM = sel darah merah; SDP = sel darah putih; Hb = hemoglobin; Ht = hematokrit; *Groff & Zinkl (1999)
Tabel 8 menunjukkan nilai hepatosomatik indeks (HIS) yang merupakan rasio kenaikan bobot hati dibandingkan dengan bobot tubuh ikan. Adapun nilai hepatosomatik indeks (HIS) pada semua perlakuan tidak berbeda nyata. Sementara itu, banyaknya jumlah sel hepatosit yang dihitung pada luasan area (mm2) melaui histologi organ hati ikan bawal menunjukkan bahwa penambahan minyak cengkeh memberikan pengaruh terhadap perlakuan 0 (kontrol) dan 10 mg/100 g pakan. Sehingga kedua perlakuan tersebut tidak berbeda nyata, namun berbeda nyata dengan perlakuan lainnya.
Tabel 8. Hepatosomatik Indeks (HIS) dan jumlah sel hepatosit pada organ hati ikan bawal
Parameter Perlakuan (mg minyak cengkeh/ 100 g pakan)
0 (Kontrol) 5 10 15 100
HIS 1,97+0,27a 1,51+0,27a 1,28+0,11a 1,47+0,30a 1,34+0,29a
Jumlah sel
hepatosit/mm2 9503+474b 14099+1588a 11685+165b 16111+1735a 16506+1679a
Keterangan: Huruf superscript di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05). HIS = hepatosomatik indeks
12
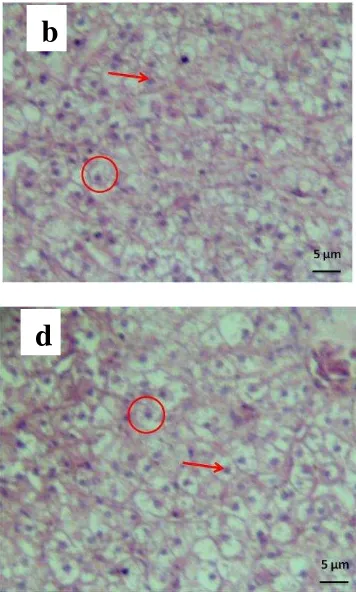
Gambar 4. Tampilan sel hepatosit pada histologi hati ikan bawal (perbesaran 100 kali). Skala bar: 5 µm. (a) perlakuan 0 (Kontrol), (b) 5 mg minyak cengkeh/100 g, (c) 10 mg/100 g, (d) 15 mg/100 g dan (e) 100 mg/100 g pakan. Pewarnaan hematoksilin-eosin. Gambar yang dilingkari menunjukkan sel hepatosit, tanda panah menunjukkan inti sel hepatosit.
Sel hepatosit dalam kondisi normal terlihat pada perlakuan 0 mg/100 g pakan (kontrol). Hal tersebut berbeda dengan kondisi sel hepatosit pada perlakuan penambahan minyak cengkeh (perlakuan 5, 15 dan 100 mg minyak cengkeh/100 g pakan) yang mengalami perubahan struktur sel berupa pengerutan. Sementara itu, sel hepatosit pada perlakuan 10 mg/100 g pakan terlihat mengalami pembesaran.
c
d
e
13
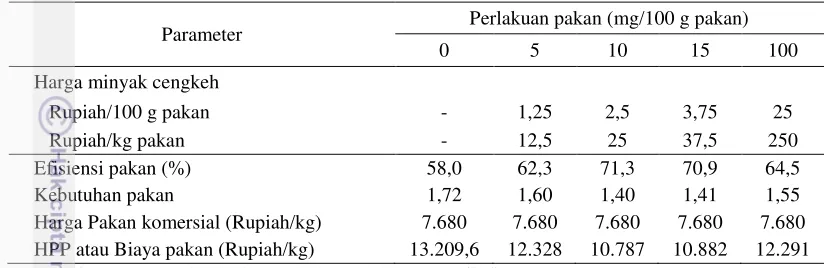
Tabel 9 merupakan pertimbangan biaya ekonomi yang dihitung berdasarkan perolehan nilai efisiensi pakan. Besarnya biaya yang dibutuhkan untuk menghasilkan 1 kg ikan bawal pada kelima dosis penambahan minyak cengkeh terlihat berbeda-beda, namun biaya terendah diperoleh pada penambahan 10 mg minyak cengkeh/100 g pakan.
Tabel 9. Analisis biaya ekonomi harga produksi pakan (HPP)
Parameter Perlakuan pakan (mg/100 g pakan)
0 5 10 15 100
Harga Pakan komersial (Rupiah/kg) 7.680 7.680 7.680 7.680 7.680
HPP atau Biaya pakan (Rupiah/kg) 13.209,6 12.328 10.787 10.882 12.291
Asumsi: Harga pakan komersial Rp. 384.000/50 kg = Rp. 7.680/kg Harga minyak cengkeh 1 liter = Rp. 250.000 (Per ml = Rp. 250)
Jika 1 mg = 0,001 ml, maka 5 mg = 0,005 ml. Harga minyak cengkeh per mg adalah 0,005 * Rp. 250 yaitu Rp. 1,25 per 100 g pakan.
Biaya pakan (Rp/kg) = (Harga pakan komersial + harga minyak cengkeh) * efisiensi pakan
4 PEMBAHASAN
Pakan perlakuan yang diberikan pada ikan bawal, menunjukkan nilai jumlah konsumsi pakan (JKP) yang tidak berbeda nyata pada kelima perlakuan. Hal tersebut diduga karena pakan yang mengandung minyak cengkeh dapat meningkatkan palatabilitas atau bertindak sebagai atraktan. Lain halnya dengan pemberian daun kayu manis dalam pakan yang diberikan pada ikan mas, memperlihatkan adanya peningkatan jumlah konsumsi pakan (Hutama 2012). Meskipun demikian, pakan yang mengandung minyak cengkeh menghasilkan nilai retensi protein dan laju pertumbuhan harian yang tinggi pada dosis 10 dan 15 mg/100 g pakan.
14
Tingginya nilai kecernaan protein seiring dengan peningkatan nilai retensi protein pada perlakuan 10, 15 dan 100 mg/100 g pakan. Retensi protein tertinggi diperoleh perlakuan 10 mg/100 g pakan yang tidak berbeda nyata dengan perlakuan 15 dan 100 mg/100 g pakan (Tabel 2). Penambahan minyak cengkeh diduga mampu mempengaruhi akumulasi nutrien yang dimakan oleh ikan bawal, dimana sebagian besar tersimpan dalam bentuk protein. Tingginya nilai retensi protein secara tidak langsung berdampak pada rendahnya buangan nitrogen (N) pada lingkungan perairan sehingga penambahan minyak cengkeh tidak memperburuk kondisi perairan.
Tingkat kecernaan ikan dapat dipengaruhi oleh kondisi organ pencernaannya. Pada penelitian ini, villi usus mengalami perkembangan berupa pertambahan panjang seiring dengan meningkatnya dosis penambahan minyak cengkeh. Panjang villi memiliki nilai tertinggi pada perlakuan 100 mg/100 g pakan dibandingkan dengan perlakuan lainnya (Tabel 3). Hal ini menunjukkan bahwa pakan mengandung minyak cengkeh merangsang terjadinya perkembangan usus yang lebih baik dibandingkan dengan pakan tanpa diberi minyak cengkeh (pakan kontrol). Selain itu, juga menyebabkan perluasan area penyerapan pada saluran pencernaan ikan bawal.
Histologi membujur organ usus memperlihatkan kondisi villi yang tampak berbeda-beda pada kelima perlakuan (Gambar 3). Kondisi tersebut merupakan bentuk penyesuaian terhadap pakan perlakuan yang diberikan. Hal itu dilakukan untuk mengimbangi kinerja proses pencernaan (Affandi et al. 2009). Struktur organ usus berubah atau berkembang sesuai dengan kebiasaan makan ikan. Semakin luas permukaan villi, maka penyerapan nutrien juga meningkat (Nasir 2002). Sehingga diduga area penempelan (kolonisasi) bakteri yang terdapat dalam saluran pencernaan semakin meluas sehingga berpengaruh terhadap kelimpahan bakteri. Selain itu, perluasan tersebut juga berdampak baik pada meningkatnya proses pencernaan.
Keberadaan bakteri yang ditemukan dalam saluran pencernaan diduga membantu proses pencernaan. Kelimpahan bakteri alami yang banyak ditemukan pada saluran pencernaan ikan bawal menunjukkan bahwa perlakuan 10 mg/100 g pakan memiliki jumlah bakteri terbanyak (Tabel 4). Diduga kolonisasi bakteri yang menempel sepanjang saluran pencernaan ikan bawal terkait dengan peningkatan panjang villi. Villi yang bertambah panjang menyebabkan terjadinya perluasan area penempelan (kolonisasi) bagi bakteri.
15
dalam pakan, menunjukkan pengaruh yang berbeda-beda terhadap kelimpahan jumlah maupun jenis bakteri saluran dalam pencernaan. Bakteri alami yang terdapat dalam saluran pencernaan ikan bawal diduga dapat membantu meningkatkan kecernaan nutrien sehingga berdampak pada peningkatan pertumbuhan.
Pada penelitian ini ditemukan bakteri yang berpotensi menjadi patogen yaitu Corynebacterium, Mycoplasma (Madigan et al. 2011) serta Streptobacillus. Namun, keberadaan bakteri tersebut tidak menyebabkan inang (host) menjadi sakit. Hal ini diduga dari strain bakteri tersebut tidak patogen serta jumlahnya dapat ditoleransi oleh inang. Enterobacteraceae merupakan bakteri patogen oportunistik, strain yang patogen dapat menginvasi lapisan mukus dalam usus ikan seerta mengakibatkan kerusakan jaringan (Hassan et al. 2012). Menurut Baya et al. (1992), strain Corynebacterium aquaticum merupakan bakteri patogen oportunistik yang menjadi penyebab penyakit ketika ikan berada dalam kondisi stress serta tersedianya nutrisi yang cukup pada media pemeliharaan (air). Salah satu strain motil Mycoplasma yang patogen yaitu strain 163K diisolasi dari ikan tench, carp dan trout (Kirchhoff dan Rosengarten 1984).
Bervariasinya bakteri yang terdapat dalam saluran pencernaan diduga dapat memproduksi enzim–enzim untuk membantu proses mencerna maupun mensintesis senyawa bermanfaat bagi inangnya (Hungate 1975 dalam Esakkiraj et al. 2009, Ray et al. 2012). Keberadaan bakteri menjadi suatu simbiosis yang menguntungkan bagi inang karena berperan dalam degradasi molekul kompleks yang telah dicerna menjadi bentuk yang lebih mudah diserap. Bakteri yang berhasil ditemukan dalam saluran pencernaan ikan bawal diduga berasal dari masuknya mikroorganisme melalui mulut bersamaan dengan masuknya air (media pemeliharaan) dan pakan yang melewati saluran pencernaan kemudian berkolonisasi dalam saluran pencernaan (Austin 2006). Adapun pendugaan jumlah populasi bakteri pada saluran pencernaan ikan dapat mencapai 108 bakteri heterotof CFU/g dan 105 bakteri anaerobik CFU/g (Austin 2006). Jumlah tersebut lebih tinggi daripada yang terdapat di perairan sekitarnya.
Penelitian lain yang meneliti tentang pengaruh pemberian minyak cengkeh pada ikan nila dengan dosis 3% (setara dengan 3 gram/100 g) tidak menyebabkan kematian (Rattanachaikunsopon & Phumkhachorn 2009). Dosis penggunaan minyak cengkeh dalam penelitian ini terbukti tidak membahayakan inang ataupun membunuh bakteri alami dalam saluran pencernaan. Daya antimikroba yang dimiliki minyak cengkeh tidak membunuh bakteri dalam saluran pencernaan. Sehingga peran bakteri dalam menghasilkan enzim-enzim pencernaan diduga berpengaruh pada peningkatan nilai kecernaan protein.
16
jenis bakteri pathogen dalam saluran pencernaan melalui kompetisi nutrisi (Hernandez et al. 2004, Dalkilic & Güler 2009).
Minyak cengkeh memiliki aktivitas antioksidan yang diduga menjadi pemicu meingkatnya performa pertumbuhan dan kesehatan ikan. Adanya pengaruh aktivitas antioksidan dari pakan yang mengandung minyak cengkeh ditunjukkan dengan menurunnya kadar MDA. Kadar MDA plasma darah ikan bawal yang menurun terlihat pada perlakuan 5, 10 dan 15 mg/100 g pakan, dibandingkan dengan perlakuan 0 mg/100 g pakan (kontrol) yang memiliki kadar MDA tertinggi (Tabel 4). Diduga kandungan eugenol pada minyak cengkeh berperan sebagai antioksidan. Pada penelitian ini, besarnya aktivitas antioksidan pada pakan yang mengandung minyak cengkeh tidak diukur sehingga tingginya kadar MDA plasma darah pada perlakuan kontrol diduga terjadi karena stres oksidatif yang diakibatkan oleh faktor lingkungan. Hal ini dapat mempengaruhi kondisi fisiologi ikan.
Santin et al. (2010) menemukan bahwa minyak cengkeh serta eugenol pada dosis 100 dan 250 mg/kg (setara dengan 10 mg dan 25 mg/100 g) berperan sebagai agen gastroprotective karena mampu menstimulasi pembentukan mukus pada lambung (gastric) tikus. Terbentuknya mukus menjadi pelindung bagi kerusakan lapisan mukosa karena adanya antioksidan yang terkandung dalam minyak cengkeh. Menurut Abdel-Magied dan Ahmed (2011), penggunaan minyak cengkeh pada dosis 150 mg/kg (setara dengan 15 mg/100 g) terhadap tikus yang terpapar radiasi gamma 6,5 Gy memperlihatkan perbaikan siginifikan terhadap status antioksidan darah. Sementara itu, Kuribayashi et al. (2010) menyatakan bahwa pemberian vitamin E sebanyak 600 mg/kg pakan (60 mg/100 g) sebagai sumber antioksidan dapat menurunkan kadar MDA darah serta kerusakan pembuluh darah pada kelinci yang mengalami stres oksidatif akibat induksi kortikosteroid. Namun hal ini berbeda dengan Esmaeilnejad et al. (2012) yang menyatakan bahwa domba yang berada dalam masa pemulihan pascainfeksi parasit Babesia ovis memiliki kadar MDA darah lebih tinggi pada perlakuan yang terpapar infeksi parasit tersebut dibandingkan dengan perlakuan non-infeksi.
Dalam penelitian ini, kadar MDA yang tinggi pada perlakuan pakan tanpa penambahan minyak cengkeh diduga karena terjadinya stres oksidatif yang berujung pada peroksidasi lemak. Peroksidasi lemak merupakan kondisi sel atau jaringan yang mengalami kerusakan oksidatif, baik pada hewan maupun manusia. Ketika peroksidasi lemak meningkat maka akan diimbangi dengan peningkatan aktivitas enzim antioksidan sebagai respon makhluk hidup untuk menteralisir radikal bebas serta induksi stres oksidatif. Namun jika jumlah radikal bebas terjadi secara berlebihan serta tidak diimbangi dengan jumlah antioksidan, maka mengakibatkan stres oksidatif.
17
atsiri (essential oil) dari tanaman cengkeh merupakan bahan alami yang menjadi agen potensial sebagai penekan stres oksidatif. Hal ini disebabkan oleh kandungan antioksidan dan aktivitas scavenging radical dari eugenol yang merupakan bahan aktif utama pada minyak cengkeh (Abdel-Magied & Ahmed 2011).
Berdasarkan pengamatan gambaran darah diketahui bahwa pemberian pakan yang mengandung minyak cengkeh tidak memberikan pengaruh serta tidak menganggu status kesehatan ikan bawal (Tabel 7). Menurut Gaber (2000), peningkatan kinerja pertumbuhan ikan nila diiringi dengan peningkatan status kesehatannya (parameter gambaran darah). Dosis terbaik penambahan minyak cengkeh dalam pakan yaitu 8 mg/100 g pakan menunjukkan nilai total eritrosit meningkat dari 0,93 juta sel/mm3 (kontrol) menjadi 1,62 juta sel/mm3, diikuti dengan peningkatan nilai hemoglobin dari 6,3 g% (kontrol) menjadi 7,7 g%. Selain itu, nilai hematokrit juga meningkat dari 37,03% (kontrol) menjadi 45,58%.
Nilai hematologi ikan mas menurut Groff dan Zinkl (1999) menjadi acuan yang dapat menggambarkan profil gambaran darah suatu jenis ikan tertentu. Kisaran nilai sel darah merah dan hematokrit ikan bawal lebih rendah jika dibandingkan dengan sel darah merah ikan mas (Cyprinus carpio). Sementara itu, kisaran nilai sel darah putih dan hemoglobin ikan bawal lebih tinggi dibandingkan dengan ikan mas (Tabel 7). Sel darah merah menjadi pembawa untuk menyalurkan oksigen dan nutrien ke seluruh bagian tubuh suatu organisme. Sedangkan sel darah putih berada pada kisaran yang menunjukkan bahwa penambahan minyak cengkeh dalam pakan tidak mengancam kesehatan ikan bawal. Dibandingkan dengan nilai gambaran darah pada ikan mas terlihat bahwa nilai SDP ikan bawal memiliki kisaran nilai yang lebih tinggi. Hal ini diduga karena adanya peningkatan aktivitas imunitas. Sel darah putih berperan aktif sebagai pertahanan utama terhadap zat asing yang masuk ke dalam tubuh organisme. Penambahan minyak cengkeh diduga menjadi pemicu diproduksinya lebih banyak sel darah putih pada tubuh ikan bawal sebagai reaksi alami menangani zat asing. Dalam kondisi sehat, ikan umumnya memiliki jumlah sel darah putih yang rendah (Daneshvar et al. 2012). Pemberian minyak cengkeh pada tikus albino juga menunjukkan adanya peningkatan jumlah sel darah putih (Shalaby et al. 2011) sebagai respon pertahanan. Pada penelitian ini, meningkatnya status kesehatan diduga berhubungan dengan adanya komponen minyak cengkeh yang berperan sebagai immunostimulan serta immunoregulation. Selain itu juga minyak cengkeh memiliki kandungan antioksidan yang melakukan scavenging radikal bebas (Kong et al. 2014).
18
Perubahan pada struktur organ hati terlihat dari histologi hati yang menampilkan kondisi sel hepatosit (Gambar 4). Kondisi organ hati pada perlakuan 5, 15 dan 100 mg/100 g pakan memperlihatkan sel hepatosit yang lebih rapat karena mengalami pengerutan dibandingkan dengan kondisi hati perlakuan 0 mg/100 g pakan (kontrol) yang terlihat normal. Sementara pada dosis 10 mg/100 g pakan, sel hepatosit cenderung membesar (ballooning). Banyaknya jumlah sel hepatosit yang dihitung per luasan mm2 mewakili kerapatan sel hepatosit pada organ hati ikan bawal yang diberi pakan mengandung minyak cengkeh. Perlakuan 5, 15 dan 100 mg/100 g pakan memiliki jumlah sel hepatosit yang lebih banyak dibandingkan perlakuan 0 (kontrol) dan 10 mg/100 g pakan. Pengerutan maupun pembesaran sel mempengaruhi kerapatan jumlah sel hepatosit. Namun demikian, secara umum sel hepatosit tidak mengalami kerusakan sehingga perlakuan pakan yang diberikan tidak berbahaya serta tidak toksik bagi ikan bawal. Pakan yang mengandung minyak cengkeh tidak menurunkan fungsi dan kerja organ hati.
Eugenol diketahui tidak membahayakan (non-toxic), berperan sebagai agen hepatoprotektif serta memfasilitasi lepasnya kandungan toksik dari usus melalui kemampuannya sebagai pencegah radikal bebas (Abdel-Magied & Ahmed 2011). Minyak cengkeh telah ditetapkan aman (Generally regarded as safe) oleh United States Food and Drug Administration (USFDA) pada penggunaan tidak lebih dari 1500 ppm (setara dengan 150 mg/100 g) untuk semua kategori makanan (USFDA 1978 dalam Gaber 2000). Sementara untuk konsumsi manusia, WHO Expert Comitte on Food Additives telah menetapkan batasnya sebesar 2,5 mg/kg (setara dengan 0,25 mg/100 g) per bobot tubuh manusia (Kildeaa et al. 2004 dalam Gülcin et al. 2012). Adapun nilai Lethal Dosis (LD) minyak cengkeh adalah 3,752 g/kg (setara dengan 375,2 mg/100 g) bobot tubuh (Kirsche 1990 dalam Abdel-Magied & Ahmed 2011).
19
5 SIMPULAN DAN SARAN
Simpulan
Pada penelitian ini, perlakuan penambahan 10 mg minyak cengkeh/100 g pakan merupakan dosis terbaik yang direkomendasikan penggunaannya pada ikan bawal. Hal ini ditinjau dari peningkatan kecernaan protein, retensi protein, perkembangan saluran pencernaan berupa pemanjangan villi serta turunnya kadar malondialdehyde (MDA) sebagai gambaran status kesehatan ikan sehingga menghasilkan kinerja pertumbuhan terbaik (laju pertumbuhan harian dan bobot setelah 45 hari pemeliharaan). Selain itu, rendahnya biaya produksi pakan (HPP) pada dosis 10 mg/100 g pakan juga menjadi salah satu pertimbangan ekonomi yang diperhitungkan.
Saran
20
DAFTAR PUSTAKA
Affandi R. 1993. Studi kebiasaan makan ikan gurame, Osphronemus gouramy (The study of food habit of giant gouramy, Osphronemus gouramy). Jurnal Ilmu-ilmu Perairan dan Perikanan Indonesia I (2): 56–67
Affandi R, Sjafei DS, Rahardjo MF, Sulistiono. 2009. Fisiologi Ikan: Pencernaan dan Penyerapan Makanan. Bogor (ID): IPB Press
Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health progs. Disease in Asian Aquaculture II: 185–202
Abdel-Magied N, Ahmed AG. 2011. Efficacy of clove oil as an antioxidant against radiation risk in male rats. J. Rad. Res. Appl. Sci. 4 (3): 939–955 Austin B. 2006. The bacterial microflora of fish, Revised. The Scientific World
Journal 6: 931–945
Balaji N, Rajasekaran KM, Kanipandian N, Vignesh V and Thirumurugan R. 2012. Isolation and screening of proteolytic bacteria from freshwater fish Cyprinus carpio. International Multidisciplinary Research Journal 2 (6): 56–59
Baya AM, Lupiani B, Bandin I, Hetrick FM, Figueras A, Carnahan A, May EM, Toranzo AE. 1992. Phenotypic and pathobiological properties of Corynebacterium aquaticum isolated from diseases stripped bass. Disease of Aquatic Organisms 14: 115–126
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. Journal Fish Biology 5: 771–781
Collier HB. 1944. The standardization of blood haemoglobin determination. Canadian Medical Association Journal 50: 550–552
Cowan ST. 1993. Cowan and Steel’s manual for identification of medical bacteria, 3rd ed. Barrow, GI and Feltham RKA, editor. Cambridge University Press
Dalkilic B, Güler T. 2009. The Effects of Clove Extract Supplementation on Performance and Digestibility of Nutriens in Broilers. Firat University Veterinary Journal of Health Sciences 23: 161–166
Daneshvar E, Ardestani MY, Dorafshan S, Martins ML. 2012. Hematological parameters of Iranian cichlid Iranocichla hormuzensis – Coad, 1982 (Perciformes) in Mehran River. Annals of the Brazilian Academy of Sciences 84 (4): 943–949
Esakkiraj P, Immanuel G, Sowmya SM, Iyapparaj P, Palavesam A. 2009. Evaluation of protease-producing ability of fish gut isolate Bacillus cereus for aqua feed. Food Bioprocess Technology 2: 383–390
Esmaeilnejad B, T Mosa, AR Siamak and DN Bahram. 2012. Evaluation of antioxidant status and oxidative stres in sheep naturally infected with babesia ovis. Vet. Parasitol. 185: 124–130
Food Safety Authority of Ireland (FSAI). 2012. Guidance on Flavourings. Dublin (Ireland): Abbey Court, Lower Abbey Street
21
Gaber MM. 2000. Growth response of nile tilapia fingerlings (Oreochromis niloticus) fed diets containing different levels of clove oil. Egypt J. Aquat. Biol. & Fish 4 (1): 1–18
Gülcin I, Elmastas M, Aboul-Enein HY. 2012. Antioxidant Activity of Clove Oil – A Powerful Antioxidant Source. Arabian Journal of Chemistry 5: 489–499
Goñi P, López P, Sánchez C, Gómez-Lus R, Becerril R, Nerín C. 2009. Antimicrobial activity in the vapour phase of a combination of cinnamon and clove essential oils. Food Chemistry 116: 982–989
Groff JM, Zinkl JG. 1999. Hematology and clinical chemistry of Cyprinid fish. Common carp and Goldfish. Vet. Clin. En. Am. Exot. Anim. Pract. 2 (3): 741–746
Hassan AHM, El Deen AEN, Galal HM, Sohad, Dorgham M, Bakry MA, Hakim AS. 2012. Further characterization of Enterobacteriaceae isolated from cultured freshwater fish in Kafr El Shiek governorate: clinical, biochemical and histopathological stuy with emphasis on treatment trials. Global Veterinaria 9 (5): 617–629
Hernandez F, Madrid J, Garcia V, Orengo J, Megias MD. 2004. Influence of two plant extracts on broilers performance, digestibility, and digestive organ size. Poultry Science 83: 169–174
Huisman EA. 1987. Principles of fish culture and fisheries. Netherlands: Wageningen Agricultural University.
Hutama AD. 2012. Pengaruh pemberian daun kayu manis terhadap pertumbuhan dan kualitas daging ikan mas [skripsi]. Bogor (ID): Institut Pertanian Bogor ISO 3141:1997 (E). Oil of clove leaves [Syzygium aromaticum (L.) Merr. et Perry,
syn. Eugenia caryophyllus (Sprengel) Bullock et S. Harrison], Genève, Switzerland.
Kuribayashi MM, Fujioka KA, Takahashi Y, Arai M, Ishida and T Goto. 2010. Vitamin E prevent steroid-induced osteonecrosis in rabbits. Acta Orthop. 81: 154–160
Kiernan JA. 1999. Histological and histochemical methods: theory and practice, 3rd edition. London: Hodder Arnold
Kirchhoff H, Rosengarten R. 1984. Isolation of a motile Mycoplasma from fish. Journal of General Microbiology 130: 2439–2445
Kong X, Liu X, Li J, Yang Y. 2014. Advances in Pharmacological Research of Eugenol. Curr. Opin. Complement Alternat. Med. 1 (1): 8–11
Lee S, Najiah M, Wendy W, Nadirah M. 2009. Chemical composition and antimicrobial activity of the essential oil of Syzygium aromaticum flower bud (Clove) against fish systemic bacteria isolated from aquaculture sites. Front. Agric. China Volume 3 (3): 332–336
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2011. Biology of Microorganisms Thirteenth Edition. San Fransisco (USA): Pearson Education Inc
22
Monaghan P, Mercalfe NB, Torres R. 2009. Oxidative stres as a mediator of life history trade-offs: mechanisms, measurements and interpretation (Review and Synthesis). Ecology Letters 12: 75–92
Nasir M. 2002. Pengaruh kadar selulosa yang berbeda dalam pakan terhadap panjang usus dan aktivitas enzim pencernaan benih ikan gurami (Osphronemus gouramy Lac.). [tesis]. Bogor (ID): Institut Pertanian Bogor. National Research Council (NRC). 2011. Nutrient Requirement of Warmwater
Fishes and Shellfishes. Washington DC. (USA): National Academy of Science Press.
Nelson SK, Bose SK, McCord JM. 1994. The toxicity of high-dose superoxide dismutase suggests that superoxide can both initiate and terminate lipid peroxidation in the reperfused heart. Free Radic. Biol. Med.16: 195–200 Pinto E, Vale-Silva L, Cavaleiro C, Salgueiro L. 2008. Antifungal activity of the
clove essential oil from Syzigium aromaticum on Candida, Aspergillus and dermatophyte species. Journal of Medical Microbiology 58: 1454–1462 Rattanachaikunsopon P, Phumkhachorn P. 2009. Protective effect of clove
oil-supplemented fish diets on experimental Lactococcus garvieae infection in tilapia. Bioscience Biotechnology Biochemical. 73 (9): 2085–2089
Ray AK, Ghosh K, Ringo E. 2012. Enzyme-producing bacteria isolated from fish gut: a review. Aquaculture Nutrition 18: 465–492
Rice-Evans C, Anthony TD. 1991. Techniques In Free Radical Research. Elsevier 146–202
Shalaby Se, El-Din MM, Abo-Donia SA, Mettwally M, Attia ZA. 2011. Toxicological affects of essential oils from Eucalyptus Eucalyptus globules and Clove Eugenia caryophyllus on albino rats. Polish J. of Environment. Stud. 20 (2): 429–434
Santin JR, Lemos M, Klein-Júnior LC, Machado ID, Costa P, de Oliveira AP, Tilia C, de Souza JP, de Sousa JPB, Bastos JK, de Andrade SF. 2010. Gastroprotective activity of essential oil of the Syzigium aromaticum and its major component eugenol in different animal models. Naunyn – Schmied Arch Pharmacol. DOI 10.1007/s00210-010-0582-x
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutriens. In: Fish Nutrition and Mariculture. Watanabe, T. Department of Aquatic Biosience. Tokyo University of Fisheries. JICA, pp.179–226.
Watanabe T. 1988. Fish Nutrition and Mariculture. Department Of Aquatic Bioscience. Tokyo University of Fisheries. JICA.
Viuda-Martos M, Ruíz-Navajas Y, Fernández-López J, Pérez-Álvarez JA. 2007. Chemical composition of the essential oils obtained from some spices widely used in mediterranean region. Acta Chim. Slov. 54: 921–926
23
LAMPIRAN
Lampiran 1. Kandungan nutrisi dari proksimat bahan baku pakan (% bobot basah)
Lampiran 2. Kondisi gas kromatografi untuk analisis kandungan bahan aktif minyak cengkeh
Agilent N890 dengan tipe kolom Carbowax 20 M, detektor FID, gas pembawa nitrogen, suhu injektor 220˚C, suhu detektor 250˚C, suhu kolom 60 – 80˚C, laju alir N2 1 ml/menit, laju alir H2 30 ml/menit, udara tekan 40 ml/menit
dan volume contoh 0,1 µl
Lampiran 3. Prosedur uji kecernaan (Takeuchi 1988)
1. Sampel ditimbang sebanyak 0,1–0,2 g sampel/bahan, kemudian dimasukkan ke dalam labu Kjehdal.
2. Larutan asam nitrat pekat ditambahkan sebanyak 5 ml ke dalam labu.
3. Setelah itu, sampel dipanaskan dengan hati-hati selama 30 menit sampai volume larutan menjadi sekitar 1 ml.
4. Setelah sampel dingin, ditambahkan 3 ml asam perklorat pekat ke dalam labu kemudian dipanaskan kembali.
5. Setelah asap putih terlihat dan larutan berubah dari hijau menjadi kuning atau orange, campuran dipanaskan selama sekitar 10 menit.
6. Larutan didinginkan, lalu diencerkan sampai volume 100 ml
7. Absorban larutan ditentukan oleh spektrofotometer dengan panjang gelombang 350 nm.
Lampiran 4. Analisis kadar MDA pada plasma darah
24
waktu yang sama. Sebanyak 1 ml supernatan jernih diambil kemudian ditambahkan 4 ml campuran larutan asam klorida dingin 0,25 N (2,23 ml asam klorida pekat/100ml) yang mengandung 15% asam trikloroasetat (w/v); 0,38 % asam tiobarbiurat dan 0,5% butilat hidroksitoluen. Campuran larutan asam klorida dan supernatan tersebut dipanaskan pada suhu 80˚C (inkubator) selama 1 jam. Selanjutnya didinginkan dengan air mengalir dan disentrifuse 3500 rpm selama 10 menit. Supernatan hasil sentrifuse tersebut kemudian diukur absorbansinya pada panjang gelombang 532 nm (Rice-Evans & Anthony 1991).
� (� � � ) = �� � � 50 � × 7,5
1,25 � ( )
A = kadar MDA yang diperoleh dari persamaan regresi kurva standar
Lampiran 5. Parameter uji pertumbuhan
Jumlah Konsumsi Pakan (JKP)
Pengukuran JKP ditentukan dengan menimbang jumlah pakan yang diberikan dikurangi jumlah pakan yang tidak dimakan (NRC 2011).
JKP = pakan yang diberikan (gram) – sisa pakan yang tidak termakan (gram)
Laju Pertumbuhan Harian (LPH)
Pengukuran LPH ikan uji dihitung menggunakan persamaan berikut (Huisman 1987):
Wt : Rata-rata bobot individu akhir pemeliharaan (g) Wo : Rata-rata bobot individu awal pemeliharaan (g) T : Lama waktu pemeliharaan (hari)
Efisiensi Pakan (EP)
Efisiensi pakan dihitung dengan menggunakan persamaan sebagai berikut (NRC 2011):
� % = � +� − � × 100
Keterangan :
EP : Efisiensi pakan (%)
F : Jumlah pakan yang diberikan selama pemeliharaan (g) Wt : Bobot ikan akhir pemeliharaan (g)
Wo : Bobot ikan awal pemeliharaan (g) Wd : Bobot ikan mati selama pemeliharaan (g)
Tingkat Kelangsungan Hidup atau Survival Rate (SR)
25
% = × 100 Keterangan :
SR : Survival Rate (%)
Nt : Jumlah ikan akhir pemeliharaan (ekor) No : Jumlah ikan awal pemeliharaan (ekor)
Retensi Protein
Nilai retensi protein dapat dihitung melalui persamaan berikut (Takeuchi 1988):
�= ( − )
� × 100
Keterangan :
RP : Retensi Protein (%)
Fp : Jumlah protein tubuh ikan pada akhir pemeliharaan (gram) Ip : Jumlah protein tubuh ikan pada awal pemeliharaan (gram)
P : Jumlah protein yang dikonsumsi ikan selama pemeliharaan (gram)
Lampiran 6. Parameter uji kecernaan dan parameter penunjang
Kecernaan Protein
Parameter kecernaan yang diukur yaitu kecernaan protein yang dihitung berdasarkan persamaan berikut (Watanabe 1988):
Populasi bakteri (bakteri) yang tumbuh pada saluran pencernaan akan dihitung jumlah dan jenis koloni yang dominan. Kelimpahan total bakteri dihitung menggunakan metode hitungan cawan sebar dengan perhitungan sebagai berikut:
Σ Bakteri= N
Σ Penebaran x
1 f
Keterangan:
Σ Bakteri : banyaknya sel bakteri (CFU/g) N : jumlah koloni bakteri
f : faktor pengenceran
Pengukuran Hepatosomatik Indeks (HIS) Garling & Wilson (1977)
26
Dimana (a) merupakan bobot hati ikan (gram) dan (b) merupakan bobot ikan (gram).
Rasio Panjang Usus dengan Panjang Tubuh (RPU) (Affandi 1993)
�� = × 100%
Dimana (a) merupakan panjang usus (cm) dan (b) merupakan panjang total tubuh ikan (cm).
Lampiran 7. Prosedur pengamatan gambaran darah ikan dan parameter penunjang
Pengambilan Darah Ikan Bawal
Pertama-tama alat suntik dan microtube dibilas dengan larutan antikoagulan Na-sitrat 3,8%. Ikan diletakkan dengan posisi kepada menghadap ke kiri diatas baki plastik yang dilapisi kain serbet lembab. Darah diambil dengan alat suntik, dari bagian antara anal dan ekor, yaitu pembuluh darah yang dekat tulang punggung. Jarum suntik ditusukkan secara horizontal searah dengan posisi kepala ikan lalu penghisap alat suntik perlahan-lahan ditarik hingga darah terhisap sampai batas tertentu. Selanjutnya darah ditaruh pada microtube.
Perhitungan sel darah merah (SDM) (Blaxhall & Daisley 1973)
Darah ikan yang diperoleh dalam microtube, masing-masing dihisap dengan pipet berisi bulir merah (kit SDM count) hingga skala 1, lalu larutan Hayems dihisap hingga skala 101. Setelah itu pipet digoyangkan pada posisi angka 8 secara horizontal selama 5 menit (kedua ujung pipet disumbat). Sebanyak 2 tetes pertama dibuang dari dalam pipet kemudian tetesan berikutnya diteteskan pada Haemocytometer tipe Neubeur yang berada di mikroskop untuk diamati jumlah sel darah merahnya. Pembesaran yang digunakan adalah 100×. Pembacaan sel darah merah pada Haemocytometer dilakukan dengan perhitungan 5 lapang pandang (5 kotak). Selanjutnya dihitung dengan rumus sebagai berikut :
5 =
5 × 25 × 10 × � / Keterangan :
N : jumlah sel darah yang teramati
FP : untuk darah yang dihisap hingga skala 1 = 100 untuk darah yang dihisap hingga skala 0,5 = 200
Perhitungan Sel Darah Putih (SDP) (Blaxhall & Daisley 1973)
27
sel darah merahnya. Pembesaran yang digunakan adalah 100×. Pembacaan sel darah putih pada Haemocytometer dilakukan dengan perhitungan 5 lapang pandang (5 kotak). Selanjutnya dihitung dengan rumus sebagai berikut :
� 5 =
5 × 25 × 10 × � /
Keterangan
N : jumlah sel darah yang teramati
FP : untuk darah yang dihisap hingga skala 1 = 10 untuk darah yang dihisap hingga skala 0,5 = 20
Perhitungan kadar Hemoglobin (Hb) (Collier 1944)
Darah ikan dihisap dengan pipet sahli hingga skala 0,2 mL kemudian dimasukkan ke dalam tabung Hb-meter. Larutan HCl 0,1 N ditambahkan hingga skala 10, lalu didiamkan hingga 5 menit sambil diaduk. Akuades ditambahkan secukupnya hingga warna yang terdapat dalam tabung hampir sama dengan warna larutan standar pada Hb-meter. Pembacaan nilai hemoglobin yaitu permukaan larutan dalam tabung dicocokkan dengan skala tabung jalur kuning (satuan gr %) hingga diperoleh banyaknya hemoglobin dalam gram per 100 ml darah.
Perhitungan kadar Hematokrit (Ht) (Anderson & Siwicki 1993)
Darah ikan dimasukkan ke dalam tabung mikrohematokrit melalui salah satu ujungnya hingga ¾ bagian lalu ujung lainnya disumbat dengan Crytoceal. Tabung mikrohematokrit disentrifugasi pada kecepatan 5000 rpm selama 5 menit. Pengukuran nilai hematokrit dilakukan dengan rumus :
� = × 100
Dimana (a) merupakan panjang darah yang mengendap dan (b) merupakan panjang total volume darah yang ada dalam tabung.
Histologi Hati dan Usus (Kiernan 1999)
Organ hati dan usus di-preservasi dalam larutan 4% formaldehid lalu direndam pada larutan etanol 60%. Sampel organ tersebut didehidrasi secara berkelanjutan, dibersihkan dengan xylol kemudian ditanam di dalam paraffin. Sampel tersebut dipotong dengan mikrotom berukuran 3-5 µm lalu diwarnai dengan pewarna hematoksilin dan eosin kuning.
Perhitungan jumlah sel hepatosit dengan software ImageJ
28
Prosedur uji kelimpahan bakteri (Balaji et al. 2012)
Kelimpahan bakteri pada saluran pencernaan diperoleh dari pembedahan ikan kemudian diambil isi saluran ususnya. Pengamatan isolasi bakteri dari saluran gastro-intestinal (lambung & usus) diperoleh dari pengenceran serial sampel usus pada larutan 0,1 mM PBS steril, kemudian dituang pada media agar TSA (Triptic Soy Agar) lalu disebar dengan batang penyebar. Selanjutnya diinkubasi pada suhu 28˚C selama 24 jam. Koloni bakteri yang tumbuh pada media selanjutnya diidentifikasi berdasarkan Tabel Cowan.
Lampiran 8. Prosedur analisis proksimat 1. Kadar Air
Menurut Watanabe (1988), analisis kadar air diawali dengan cawan dioven pada suhu 100°C selama 1 jam kemudian didinginkan dalam desikator selama 30 menit lalu ditimbang (X1). Sebanyak 2-3 g sampel ditimbang sebagai bobot A.
Cawan dan sampel dipanaskan kembali dalam oven pada suhu 110°C selama 4 jam lalu didinginkan dalam desikator selama 30 menit. Pada akhirnya bobot cawan dan sampel ditimbang (X2).
2. Kadar Abu
Menurut Watanabe (1988), cawan dipanaskan dalam oven bersuhu 100°C selama 1 jam dan didinginkan dalam desikator selama 30 menit. Bobot cawan ditimbang sebagai X1. Setelah itu, bahan dimasukkan ke dalam cawan dan
ditimbang 2-3 g sebagai bobot A. Cawan yang berisi bahan kemudian dipanaskan dalam tanur pada suhu 600°C dan didiamkan semalam hingga menjadi abu. Cawan lalu didinginkan dalam desikator selama 30-60 menit, ditimbang sebagai X2 dan dicatat bobot abunya.
3. Kadar Protein
Menurut Watanabe (1988), tahap oksidasi diawali dengan sampel ditimbang lalu dimasukkan ke dalam labu Kjeldahl yang ditambahkan katalis (K2SO4+CuSO4.5H2O) sebanyak 3 g dan 10 ml H2SO4 pekat. Labu disimpan
dalam rak digestion dan dipanaskan selama 3-4 jam hingga larutan berwarna hijau bening. Labu didinginkan kemudian diencerkan hingga volumenya 100 ml, dan didestilasi. Pada tahap destilasi, beberapa tetes H2SO4 dimasukkan ke dalam labu
yang telah diisi dengan akuades sampai setengahnya.
Erlenmeyer yang berisi 10 ml H2SO4 dan 2 tetes larutan indikator
29
4. Kadar Lemak
Dalam Watanabe (1988), terlebih dahulu labu dipanaskan di dalam oven pada suhu 110°C selama 1 jam, dan didinginkan dalam desikator selama 30 menit lalu bobot labu ditimbang (X1). Sampel ditimbang sebanyak 3-5 gdan dimasukkan
ke dalam selongsong lalu diekstraksi dalam soxhlet yang ditambahkan N-Hexan. Selama 3-4 jam dipanaskan dengan waterbath hingga larutan berwarna bening. Sisa N-Hexan dalam labu diuapkan kemudian labu dimasukkan ke dalam oven selama 15-30 menit, didinginkan dan ditimbang (X2).
5. Serat Kasar
Kertas saring dioven, didinginkan, dan ditimbang (X1). Setelah itu, corong
Buchner dipasang dan dihubungkan pada vacuum pump. Sampel ditimbang 0,5 g sebagai bobot A lalu dimasukkan ke dalam Erlenmeyer dan diberikan H2SO4 pada
sebanyak 50 ml, lalu sampel dipanaskan kembali selama 30 menit. Sampel ditambahkan 25 ml NaOH dan dipanaskan 30 menit. Larutan dan bahan tersebut kemudian disaringpada corong Buchner dan dibilas secara berturut-turut dengan air panas, H2SO4, air panas, dan aseton. Cawan porselen dan kertas saring
dipanaskan selama 1 jam kemudian didinginkan dan ditimbang (X2). Cawan
dipanaskan di dalam tanur hingga berwarna putih atau menjadi abu (4 jam), dioven kembali selama 15 menit, didinginkan dan ditimbang sebagai X3
(Watanabe, 1988).
6. Perhitungan kandungan BETN (Bahan Ekstrak Tanpa Nitrogen)