KATALIS ELEKTROHIDRODEKLORINASI
TETRAKLOROETILENA BERBASIS BARIUM HEKSAFERIT
TERDOPING NIKEL
MIRANTI MAYA SYLVANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi yang berjudul Katalis Elektrohidrodeklorinasi Tetrakloroetilena Berbasis Barium Heksaferit Terdoping Nikel adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
MIRANTI MAYA SYLVANI. Katalis Elektrohidrodeklorinasi Tetrakloroetilena Berbasis Barium Heksaferit Terdoping Nikel. Dibimbing oleh MOHAMMAD KHOTIB dan KOMAR SUTRIAH.
Tetrakloroetilena (PCE) adalah salah satu senyawa organoklorin yang dinyatakan sangat berbahaya oleh US EPA (United States Environmental Protection Agency). Penggunaan metode elektrohidrodeklorinasi dengan katode Ba1-xFe12NixO19 dapat menggurangi bahaya tersebut. Ba1-xFe12NixO19 dengan
komposisi x = 0.0, x = 0.3, dan x = 0.4 disintesis dengan metode ko-presipitasi menghasilkan serbuk berwarna merah-kecokelatan dan mempunyai sifat magnet. Pencirian dengan Spektroskopi Inframerah Transformasi Fourier (FTIR) menunjukkan spectrum Ba1-xFe12NixO19 dengan gugus Ba-O, Ni-O dan Fe-O pada
bilangan gelombang masing-masing 547.78 cm-1, 437.84 cm-1 dan 582.50 cm-1.
Informasi yang diperoleh dengan Difraksi Sinar-X (XRD) menunjukkan rumus molekul senyawa Ba1-xFe12NixO19 adalah BaFe12O19 yang didoping dengan NiO
pada permukaan. Elektrode dibuat dengan mencampurkan Ba1-xFe12NixO19 dan lem karbon. Nilai konduktivitas elektrode tertinggi didapat dengan nisbah Ba
1-xFe12NixO19 dan lem karbon yaitu 1:4. Berdasarkan hasil elektrohidrodeklorinasi
PCE dengan elektrode Ba1-xFe12NixO19 dan tegangan (10 V, 14 V) selama 30 menit diketahui bahwa kadar PCE yang terdegradasi, yaitu 51% sampai 100%. Kata kunci: magnet, barium heksaferit terdoping nikel, katode, tetrakloroetilena
ABSTRACT
MIRANTI MAYA SYLVANI. Nickel-Doped Barium Hexaferrite Based Electrohydrodechlorination Tetrachloroethylene Catalyst. Advised by MOHAMMAD KHOTIB and KOMAR SUTRIAH.
Tetrachloroethylene (PCE) is one of the most dangerous organochlorine compounds stated by US EPA (United States Environmental Protection Agency). The use of electrohydrodechlorination method with Ba1-xFe12NixO19 cathode can reduce the hazard. Ba1-xFe12NixO19 with compositions x = 0.0, x = 0.3, and x = 0.4
are synthesized by co-precipitation method to produce red-brownish powder and has magnetic properties. The characterization using Fourier Transform Infrared Spectroscopy (FTIR) shows spectra to be Ba1-xFe12NixO19 that is Ba-O, Ni-O and Fe-O groups at the wave numbers of 547.78 cm-1, 437.84 cm-1 and 582.50 cm-1. The information obtained by X-Ray Diffraction (XRD) shows that the molecular formula of Ba1-xFe12NixO19 compound is BaFe12O19 doped by NiO on the surface. The electrodes were made by mixing Ba1-xFe12NixO19 and carbon glue. The
highest electrode conductivity value was obtained by comparing Ba1-xFe12NixO19
and carbon glue, that is 1:4. Based on the results of electrohydrodechlorination of PCE using Ba1-xFe12NixO19 electrodes and the voltages (10 V, 14 V) for 30
minutes. The level of degraded PCE is 51% to 100%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains Kimia
pada
Departemen Kimia
KATALIS ELEKTROHIDRODEKLORINASI
TETRAKLOROETILENA BERBASIS BARIUM HEKSAFERIT
TERDOPING NIKEL
MIRANTI MAYA SYLVANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Katalis Elektrohidrodeklorinasi Tetrakloroetilena Berbasis Barium Heksaferit Terdoping Nikel
Nama : Miranti Maya Sylvani NIM : G44100092
Disetujui oleh
M Khotib, SSi, MSi Pembimbing I
Dr Komar Sutriah, MS Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Dengan menyebut Asma Allah yang Maha Pengasih dan Maha Penyayang. Alhamdulillah, segala puji syukur hanya bagi Allah SWT yang senantiasa melimpahkan rahmat-Nya yang tak pernah terputus sehingga penulis dapat menyelesaikan karya ilmiah yang diberi judul Katalis Elektrohidrodeklorinasi Tetrakloroetilena Berbasis Barium Heksaferit Terdoping Nikel. Shalawat serta salam semoga selalu tercurah kepada teladan umat manusia Nabi Muhammad SAW.
Penulis mengucapkan terima kasih kepada Bapak M Khotib SSi MSi selaku pembimbing I dan Bapak Dr Komar Sutriah MS selaku pembimbing II yang telah memberikan masukan dan arahan yang begitu berharga bagi penulis. Penulis juga ingin menyampaikan terima kasih kepada keluarga tercinta atas kasih sayang dan doa yang senantiasa diberikan selama penulis menjalani pendidikan hingga selesainya karya ilmiah ini. Ucapan terima kasih tak terhingga kepada kepala Laboratorium Kimia Terpadu IPB Dr Komar Sutriah MS, dan seluruh staf Laboratorium Kimia Terpadu IPB (Ibu Ani, Ibu Rita, Bapak Samsul, Bapak Yono, Kak Indah, Kak Tari, Kak Denar, Kak Agy) atas fasilitas yang diberikan selama penelitian. Selain itu penulis mengucapkan terima kasih kepada Pak Bambang (Laboratorium Fisika IPB) atas bantuannya, Alfi, Vicky, Asnan, Aski, Awalia, Ira, Eva Lilis, Nanda, Wawan, dan semua teman-teman Kimia angkatan 47 atas kebersamaan dan semangatnya, serta semua pihak yang telah membantu.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Ruang Lingkup 2
Sintesis Barium Heksaferit Terdoping Nikel 2
Analisis Fase dengan XRD 2
Analisis Gugus Fungsi dengan FTIR 3
Proses Elektrokatalisis Hidrodeklorinasi PCE 3
Analisis GC 4
HASIL DAN PEMBAHASAN 4
Sintesis Ba1-xFe12NixO19 dan Pencirian 4
Pembuatan Elektrode 6
Degradasi PCE 7
SIMPULAN DAN SARAN 9
Simpulan 10
Saran 10
DAFTAR PUSTAKA 10
LAMPIRAN 11
DAFTAR TABEL
1 Komposisi reaktan sintesis Ba1-xFe12NixO19 (Daulay 2012) 2
2 Konduktivitas elektroda Ba1-xFe12NixO19 6 3 Parameter elektrolisis PCE dan luas puncak PCE 14
DAFTAR GAMBAR
1 Proses elektrolisis 3
2 Ba1-xFe12NixO19 dengan 3 komposisi dan (b) sifat magnet 4
3 Difraktogram sinar-X Ba1-xFe12NixO19 5
4 Spektrum FTIR Ba1-xFe12NixO19 5
5 Mekanisme Tween 80 dalam elektrohidrodeklorinasi PCE
(Muthuraman dan Pillai 2001) 6
6 Proses elektrohidrodeklorinasi PCB (Bueres et al. 2009) 7
7 Kromatogram (a) blanko dan (b) standar 8
8 Degradasi PCE setelah elektrohidrodeklorinasi katode Ba
1-xFe12NixO19 8
9 Kromatogram (a) elektrode karbon dengan (v = 14 volt, t = 3 jam) dan (b) elektrode Ba1-xFe12NixO19 (x = 0.0) dengan (v = 14 volt, t = 30
menit) 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 12
2 Perhitungan Ba1-xFe12NixO19 dan konduktivitas elektrode Ba
1-xFe12NixO19 13
1
PENDAHULUAN
Latar Belakang
Organoklorin adalah senyawa hidrokarbon alifatik atau aromatik atau turunannya yang satu atau lebih atom hidrogennya disubstitusi oleh atom klorin. Tetrakloroetilena (PCE) digunakan sebagai pelarut dalam berbagai industri seperti elektronik, manufaktur, kedirgantaraan, dan tekstil. Namun, karena toksisitas dan karsinogenik, PCE diklasifikasikan sebagai polutan yang paling berbahaya oleh US-EPA (United States Environmental Protection Agency). Paparan PCE menyebabkan kerusakan sistem organ seperti: saraf, paru-paru, hati, dan ginjal; detak jantung abnormal; koma; dan bahkan kematian. Emisi PCE ke atmosfer juga berkontribusi pada penghancuran lapisan ozon, pembentukan asap, dan pemanasan global. Oleh karena itu, diperlukan metode untuk mengurangi bahaya tersebut seperti deklorinasi, adsorpsi secara fisik, dan bioremediasi (Meshesha 2011).
Deklorinasi dapat dilakukan dengan dua cara, yakni deklorinasi oksidatif dan deklorinasi reduktif (hidrodeklorinasi). Deklorinasi oksidatif mempunyai kelemahan seperti sampel tidak terurai seluruhnya menjadi CO2, H2O, HCl dan
terbentukan senyawa beracun seperti dioksin dan furan. Hidrodeklorinasi adalah salah satu solusi dalam mengatasi pencemaran organoklorin. Dalam proses ini atom klorin pada organoklorin disubtitusi dengan atom hidrogen (Ju 2005). Penggunaan katalis (hidrodeklorinasi terkatalisis) mempunyai keuntungan seperti tidak destruktif, dan menghasilkan hidrokarbon, misalnya hidrodeklorinasi TCE menghasilkan etana, yang dijadikan sebagai bahan bakar. Namun, kelemahan hidrodeklorinasi terkatalisis adalah adanya pendeaktivasi seperti senyawaan sulfur, dan karbon monoksida (CO). (Lien dan Zhang 2007)
Elektrokatalitik hidrodeklorinasi (Elektrohidrodeklorinasi) merupakan perpaduan elektrolisis dengan hidrodeklorinasi terkatalisis. Katalis sekaligus katode yang digunakan adalah logam seperti Pt, Pd, dan Ni. Akan tetapi, muncul kekhawatiran mengenai dampak toksikologis terhadap lingkungan. Bahan magnetik berbasis besi dikembangkan untuk memenuhi kebutuhan tersebut, salah satunya adalah barium heksaferit (BaFe12O19), yang dikenal tidak toksik dan
mempunyai stabilitas kimia yang tinggi serta tahan korosi. BaFe12O19 dapat
didoping oleh ion logam seperti nikel, atau tembaga. Substitusi pada BaFe12O19
dapat meningkatkan luas permukaan sehingga cocok untuk bahan elektrode (Kwak dan Lee. 2012).
Ahmed et al. (2013) menyintesis barium heksaferit terdoping kobalt jenis Mg–Y (Ba2Mg2-xCoxFe12O22) meningkatkan aktivitas katalitik dekomposisi N2O pada konsentrasi tinggi. Sintesis barium heksaferit dengan menggunakan metode kopresipitasi mempunyai keuntungan seperti peralatan yang sederhana, serta produk lebih banyak dan cepat (Kwak dan Lee. 2012). Chauhan (2010) menganalisis bahwa hasil sintesis BaFe12O19 menggunakan metode kopresipitasi
memiliki persentase kemurnian lebih tinggi daripada hasil sintesis BaFe12O19
menggunakan metode reaksi padatan persentase kemurnian. Penelitian ini bertujuan menyintesis Ba1-xFe12NixO19 dan mengaplikasikannya sebagai katode
2
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah neraca analitik, cawan porselen, tanur, oven, peralatan kaca, difraktometer sinar-X (XRD), kromatografi gas (GC) dan spektrofotometer inframerah transformasi fourier (FTIR), peralatan elektrolisis yang terdiri atas katode Ba1-xFe12NixO19, anode karbon, power supply DC (adaptor), dan wadah berisi PCE dalam medium air. Bahan yang digunakan adalah FeCl3.6H2O, Ni(NO3)2.6H2O, BaCl2.2H2O, HCl, NaOH, surfaktan Tween
80, lem karbon, dan es batu.
Ruang Lingkup
Katalis Ba1-xFe12NixO19 dibuat menggunakan metode kopresipitasi dengan berbagai komposisi bobot reaktan. Ba1-xFe12NixO19 dicirikan dengan FTIR dan XRD kemudian digunakan sebagai katode dalam proses elektrohidrodeklorinasi PCE dalam medium air dan kemudian diuji dengan GC. Lampiran 1 menyajikan alur penelitian ini.
Sintesis Barium Heksaferit Terdoping Nikel (Kwak dan Lee 2012)
Ba1-xFe12NixO19 disintesis menggunakan metode kopresipitasi dengan 3 komposisi reaktan yang diberikan pada Tabel 1, dan hitungan selengkapnya diberikan pada Lampiran 2.
Tabel 1 Komposisi reaktan sintesis Ba1-xFe12NixO19 (Daulay 2012) Ba1-xFe12NixO19 BaCl2.2H2O (g) FeCl3.6H2O (g) Ni(NO3)2.6H2O(g)
x = 0 1.0960 14.5822 0
x = 0.3 0.7873 14.8954 0.4006
x = 0.4 0.6767 15.0028 0.5379
FeCl3.6H2O, BaCl2.2H2O dan Ni(NO3)2.6H2O dilarutkan dalam 40 mL
3
Analisis Fase dengan XRD (Kwak dan Lee 2012)
Disiapkan serbuk sampel sebanyak 0.6-1 mg, kemudian dipasang pada tempat sampel dan dirotasikan. XRD yang digunakan adalah tipe Shimadzu XD-610 di Laboratorium Fisika, IPB, dengan tegangan 35 kV, arus 30 mA, dan target Cu (λ = 1,54056 Å). Hasil uji berupa difraktogram yang menghubungkan intensitas dengan sudut difraksi.
Analisis Gugus Fungsi dengan FTIR (Masyamir et al. 2012)
Sebanyak 0.2 mg serbuk Ba1-xFe12NixO19 dicampurkan dengan 100 mg KBr, dihomogenisasi. Spektrum FTIR dilakukan pada daerah IR tengah (4000 -400 cm-1) dengan melibatkan perangkat lunak OPUS versi 4.2. Spektrum dihasilkan dengan kecepatan 32 detik dan resolusi 4 cm-1.
Pembuatan Elektrode (Kwak dan Lee 2012)
Serbuk Ba1-xFe12NixO19 dicampur dengan lem karbon dengan nisbah 1:1, 1:2, 1:3 dan 1:4 dalam wadah berbeda kemudian masing-masing diaduk dengan menggunakan sudip sampai adonan tercampur merata. Adonan kemudian dimasukkan ke dalam cetakan aluminium berbentuk tabung dengan ukuran tinggi 5 cm, dan diameter 0.7 cm sedikit demi sedikit sambil ditekan menggunakan sumpit kayu agar adonan tercetak dengan baik. Setelah itu cetakan dikeringkan dalam oven dengan suhu 100 oC selama 2 jam. Setelah kering adonan berbentuk
elektrode tabung siap diuji konduktivitasnya untuk menentukan elektrode yang siap dipakai.
Proses Elektrohidrodeklorinasi PCE (Bo et al. 2006)
Sebagai katode digunakan Ba1-xFe12NixO19 dengan 3 komposisi yang
berbeda dan sebagai anoda digunakan grafit. Arus yang digunakan ialah 10 mA selama 3 jam dengan konsentrasi PCE 0.1% (v/v) dan ditambahkan 2 tetes surfaktan (Tween 80) dalam air, sambil terus diaduk menggunakan pengaduk bermagnet. Parameter selama elektrolisis meliputi tegangan, yakni 10, dan 14 volt selama 30 menit. Rangkaian alat untuk proses elektrohidrodeklorinasi ditunjukkan pada Gambar 1
4
Hasil elektrohidrodeklorinasi dimasukkan ke dalam corong pisah, ditambahkan n-heptana sebanyak 20 ml, kemudian diekstraksi. Setelah diekstraksi dibiarkan sebentar sampai fase organik dan fase air memisah. Fase air berada di bawah sedangkan fase organik berada di atas. Pada pemeriksaan GC, diperlukan fase organik. Setelah fase organik diambil, kemudian diencerkan ke dalam labu takar 50 ml menggunakan n-heptana. Kalau masih keruh ditambahkan Na2SO4
untuk menjerap air pada fase organik tersebut.
Analisis GC (Masyamir et al. 2012)
Analisis komponen PCE yang telah dielektrolisis dan dipreparasi dilakukan dengan Shimadzu 17-A Gas Chromatograph yang dilengkapi dengan detektor FID dan kolom BTEX. Kondisi suhu kolom mula-mula 80 oC, dinaikkan hingga mencapai suhu 200 oC dengan laju 10 oC/menit. Gas pembawa yang digunakan adalah nitrogen dengan laju alir 0.88 ml/min dan nisbah pemisahan 10:1. Injektor dijaga pada suhu 200 oC.
HASIL DAN PEMBAHASAN
Sintesis Ba1-xFe12NixO19 dan Pencirian
Pada pembuatan barium heksaferit terdoping nikel digunakan FeCl3.6H2O,
BaCl2.2H2O dan Ni(NO3)2.6H2O sebagai prekursor, HCl sebagai media pelarut
dan NaOH sebagai pengendapnya. Diperkirakan mekanisme reaksi yang terjadi adalah sebagai berikut,
12 Fe3++ Ba2++ Ni2+ + 38 OH- → Ba1-xFe12NixO19 + 19 H2O
Ba1-xFe12NixO19 yang disintesis dengan komposisi Ba, Fe dan Ni yang berbeda
menghasilkan serbuk berwarna merah-kecokelatan dan bersifat magnet. Bentuk fisik dan sifat magnet Ba1-xFe12NixO19 dapat dilihat pada Gambar 2.
Gambar 2 (a) Serbuk Ba1-xFe12NixO19 dengan 3 komposisi dan (b) sifat magnet
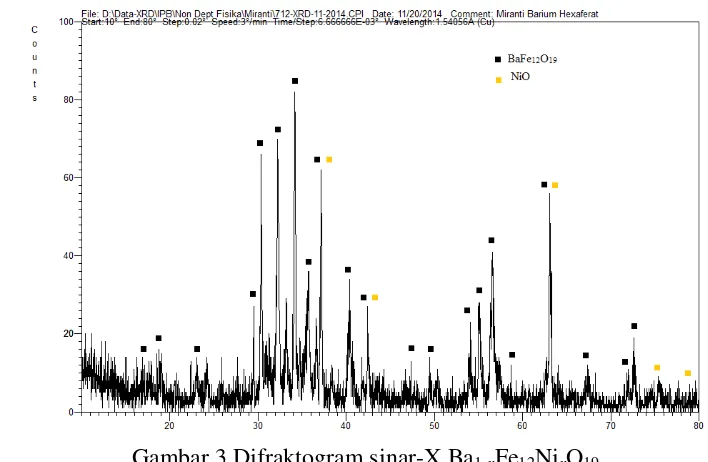
Selanjutnya salah satu sampel Ba1-xFe12NixO19 dengan x = 0.4 dikarakterisasi dengan XRD. Difraktogram hasil karakterisasi ditunjukkan pada Gambar 3 dan dianalisis menggunakan program JADE 6.5. Pola difraksi dari BaFe12O19 ditunjukkan oleh puncak-puncak difraksi pada 2θ 17.760o, 18.985o,
24.131o, 30.338o, 32.054o, 34.014o, 35.729o, 37.036o, 40.467o, 42.189o, 46.511o, 49.380o, 53.944o, 55.169o, 56.231o, 58.201o, 63.147o, 67.340o, 71.914o ,dan 72.20o.
5
Selain pola difraksi dari BaFe12O19, terdapat juga pola difraksi lainnya yang
merupakan ion doping dari barium heksaferit dalam bentuk logam oksida yakni NiO. Adapun puncak-puncak difraksi NiO pada 2θ 37.125o, 42.207o, 63.153o, 75.344 o dan 79.347o. NiO terbentuk selama proses kopresipitasi. Dengan adanya
pola difraksi NiO, diduga mekanisme doping yang terjadi pada barium heksaferit berlangsung di permukaan bukan di kisi kristal.
Gambar 3 Difraktogram sinar-X Ba1-xFe12NixO19
Analisis salah satu sampel Ba1-xFe12NixO19 dengan x = 0.3 menggunakan
FTIR sebagaimana tampak pada Gambar 4 menunjukkan ada puncak-puncak pada bilangan gelombang 3425.58 cm-1, 582.50 cm-1, 547.78 cm-1 dan 437.84 cm-1.
Puncak lebar pada 3425.58 cm-1 berhubungan dengan vibrasi gugus OH yang menunjukkan ada air yang tersisa pada Ba1-xFe12NixO19 sehingga Ba1-xFe12NixO19
yang dihasilkan bersifat higroskopis. Puncak-puncak pada 582.50 cm-1, 547.78
cm-1 dan 437.84 cm-1 menunjukkan vibrasi dari gugus Fe-O, Ba-O dan Ni-O (Mohsen 2010).
6
Pembuatan Elektrode
Ba1-xFe12NixO19 memiliki sifat magnet namun tidak bersifat konduktif (Haq dan Anis-ur-Rehman 2012). Oleh karena itu diperlukan bahan lainnya yang bersifat konduktif untuk pembuatan elektrode seperti lem karbon (Wu dan Sun 2011). Analisis konduktivitas elektrode dengan beberapa perbandingan antara salah satu sampel Ba1-xFe12NixO19 dengan x = 0.0 dan lem karbon dilakukan.
Semakin meningkat dengan jumlah lem karbon yang diberikan maka konduktivitas elektrode semakin meningkat yang ditunjukkan pada Tabel 2.
Tabel 2 Konduktivitas elektrode Ba1-xFe12NixO19 dengan x = 0.0
Semakin besar konduktivitas elektrode maka proses elektrohidrodeklorinasi berlangsung semakin baik karena dapat mengantarkan arus listrik (Wu dan Sun 2011). Oleh karena itu, dipilih perbandingan Ba1-xFe12NixO19 dengan lem karbon yang sesuai, yaitu 1:4. Susmita (2010) telah melakukan pembuatan dan analisis sifat listrik elektrode superkapasitor berbahan dasar polimer PANI dengan penambahan bottom ash dengan nilai konduktivitas 21.14 x 10-4 S/cm hingga 98.89 x 10-4 S/cm.
Degradasi PCE
Surfaktan nonionik seperti tween 80 memainkan peran penting karena sifat molekul amfibik yang kutub hidrofiliknya kompatibel dengan air dan kutub hidrofobiknya kompatibel dengan minyak. Mekanisme kerja tween 80 adalah surfaktan akan membentuk sebuah lapisan di sekeliling partikel seperti PCE dan sekitar elektrode. PCE dapat teradsorbsi pada elektrode dan dapat menempel pada permukaan elektrode sehingga dapat membantu proses elektrohidrodeklorinasi seperti yang ditunjukkan pada Gambar 5 (Muthuraman dan Pillai 2001).
7
Proses elektrohidrodeklorinasi yang berlangsung pada katode barium heksaferit terdoping nikel dapat melalui mekanisme yang dapat dilihat pada Gambar 6. Air dielektrolisis menghasilkan OH- dan H+. H+ akan berikatan dengan ion O2- yang terdapat pada katode barium heksaferit terdoping nikel. Ion besi pada
katode berfungsi sebagai situs adsorpsi awal untuk organoklorin misalnya PCB sehingga menyebabkan ikatan C-Cl terputus dan ion klor yang akan berikatan pada katode (Su et al. 2013).
Elektron dari proses elektrolisis ditampung pada oxygen vacancy yang terdapat pada katode. Oxygen vacancy adalah pelepasan atom O pada logam oksida yang bisa dipengaruhi oleh beberapa hal seperti doping ion pada logam oksida, maupun perlakuan listrik yang diberikan. Elektron tersebut ditransfer ke intermediet menyebabkan perpindahan H+ dari keterikatan dengan ion O 2-sehingga dapat menghasilkan produk seperti hidrokarbon. Ion klor yang terikat dapat bermigrasi di permukaan katode untuk melakukan pertukaran dengan ion O2- yang terikat pada ion logam. Perpindahan ion klor terus berulang sampai elektrohidrodeklorinasi selesai (Bueres et al. 2009).
Gambar 6 Proses elektrohidrodeklorinasi PCB (Bueres et al. 2009)
8
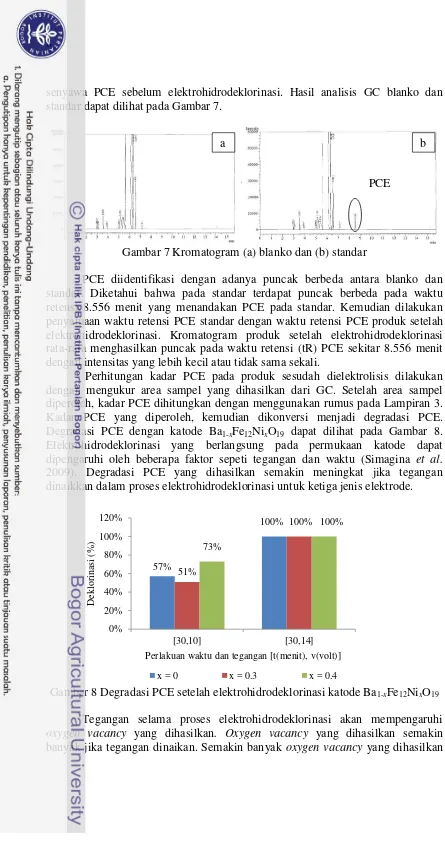
senyawa PCE sebelum elektrohidrodeklorinasi. Hasil analisis GC blanko dan standar dapat dilihat pada Gambar 7.
Gambar 7 Kromatogram (a) blanko dan (b) standar
PCE diidentifikasi dengan adanya puncak berbeda antara blanko dan standar. Diketahui bahwa pada standar terdapat puncak berbeda pada waktu retensi 8.556 menit yang menandakan PCE pada standar. Kemudian dilakukan penyamaan waktu retensi PCE standar dengan waktu retensi PCE produk setelah elektrohidrodeklorinasi. Kromatogram produk setelah elektrohidrodeklorinasi rata-rata menghasilkan puncak pada waktu retensi (tR) PCE sekitar 8.556 menit dengan intensitas yang lebih kecil atau tidak sama sekali.
Perhitungan kadar PCE pada produk sesudah dielektrolisis dilakukan dengan mengukur area sampel yang dihasilkan dari GC. Setelah area sampel diperoleh, kadar PCE dihitungkan dengan menggunakan rumus pada Lampiran 3. Kadar PCE yang diperoleh, kemudian dikonversi menjadi degradasi PCE. Degradasi PCE dengan katode Ba1-xFe12NixO19 dapat dilihat pada Gambar 8. Elektrohidrodeklorinasi yang berlangsung pada permukaan katode dapat dipengaruhi oleh beberapa faktor sepeti tegangan dan waktu (Simagina et al. 2009). Degradasi PCE yang dihasilkan semakin meningkat jika tegangan dinaikkan dalam proses elektrohidrodeklorinasi untuk ketiga jenis elektrode.
Gambar 8 Degradasi PCE setelah elektrohidrodeklorinasi katode Ba1-xFe12NixO19 Tegangan selama proses elektrohidrodeklorinasi akan mempengaruhi oxygen vacancy yang dihasilkan. Oxygen vacancy yang dihasilkan semakin banyak jika tegangan dinaikan. Semakin banyak oxygen vacancy yang dihasilkan
57%
Perlakuan waktu dan tegangan [t(menit), v(volt)]
x = 0 x = 0.3 x = 0.4
a b
9
mengakibatkan banyak elektron yang bisa tertampung dan dapat meningkatkan degradasi PCE pada proses elektrohidrodeklorinasi. Hal ini ditunjukan pada t = 30 menit dan v = 10 volt, elektrode Ba1-xFe12NixO19 dengan x = 0.0 hanya
mendegradasi PCE sebanyak 57% sedangkan pada elektrode yang sama dengan t = 30 menit dan v = 14 volt mampu mendegradasi PCE sebanyak 100%. Akan tetapi berbeda dengan doping ion pada barium heksaferit yang tidak menunjukkan efek serupa terhadap degradasi PCE (Bueres et al. 2009).
Bo et al. (2006) melakukan teknik elektrohidrodeklorinasi dengan katoda paladium terdoping nikel mengkonversi 4-monoklorobifenil dalam medium air dengan arus 15 mA, tegangan 1.56 V selama 3 jam sebesar 94.3%. Hasil degradasi pada penelitian ini tidak berbeda jauh dengan hasil degradasi pada penelitian Bo et al. (2006). Analisis lainnya juga dilakukan untuk meyakinkan bahwa degradasi PCE dengan katode Ba1-xFe12NixO19 ini tergolong baik,
dilakukan degradasi PCE dengan katode yang berbeda seperti karbon. Hasil kromatogram degradasi PCE dengan masing-masing katode yang ditunjukan oleh Gambar 9.
Gambar 9 Kromatogram (a) elektrode karbon dengan (v = 14 volt, t = 3 jam) dan (b) elektrode Ba1-xFe12NixO19 (x = 0.0) dengan (v = 14 volt, t = 30 menit)
Puncak PCE yang muncul pada tR 8.575 menit dengan intensitas sangat kuat pada kromatogram elektrode karbon dengan v = 14 volt, t = 3 jam mempunyai nilai degradasi PCE sekitar 0%, sedangkan puncak PCE yang muncul pada tR 8.532 menit dengan intensitas lemah pada kromatogram elektrode Ba 1-xFe12NixO19 (x = 0.0) dengan v = 14 volt, t = 30 menit mempunyai nilai degradasi
PCE sekitar 57%. Hal ini terjadi karena PCE pada elektrode karbon yang bersifat inert sehingga tidak terdegradasi akan tetapi melarut selama proses elektrohidrodeklorinasi berlangsung.
SIMPULAN DAN SARAN
Simpulan
Ba1-xFe12NixO19 disintesis dengan metode kopresipitasi menghasilkan serbuk berwarna merah-kecokelatan dan bersifat magnet. Pencirian dengan FTIR menunjukkan spektrum Ba1-xFe12NixO19 dengan gugus Ba-O, Ni-O dan Fe-O pada bilangan gelombang masing-masing 547.78 cm-1, 437.84 cm-1 dan 582.50 cm-1.
b a
10
Informasi yang diperoleh dengan XRD menunjukkan rumus molekul senyawa Ba1-xFe12NixO19 adalah BaFe12O19 yang didoping dengan NiO pada permukaan. Elektrode dibuat dengan mencampurkan Ba1-xFe12NixO19 dan lem karbon dan nilai
konduktivitas tertinggi didapat dengan nisbah Ba1-xFe12NixO19 dan lem karbon yaitu 1:4. Elektrohidrodeklorinasi PCE menggunakan elektrode Ba1-xFe12NixO19 dan tegangan (10 V, 14 V) selama 30 menit menghasilkan PCE yang terdegradasi, yaitu 51% sampai 100%.
Saran
Perlu dilakukan modifikasi atau penambahan metode dalam sintesis Ba
1-xFe12NixO19 agar mencapai rumus molekul yang diharapkan dan diperlukan metode pembuatan elektrode yang lebih baku seperti tekanan dari alat hidrolik agar elektrode yang terbentuk lebih sempurna sehingga elektrohidrodeklorinasi berjalan semakin baik
DAFTAR PUSTAKA
Ahmed S, Ulain B, Huang Y. 2013. Catalytic decomposition of N2O on cobalt
substituted barium hexaferrites. Chinese of Catal.34:1375-1362.
Bo Y, Yu G, Liu X. 2006. Electrochemical hydrodechlorination of 4-chlorobiphenyl in aqueous solution with the optimization of palladium loaded cathode material. Journal Electrochimica Acta 52: 1075-1081. Bueres R F, Diaz E, Diez F. 2009. Permofance of carbon nanofibres, high surface
area graphites, and activated carbons as supports of Pd-based hydrodechlorination catalysts. Journal Catalysis Today 150: 16-21.
Chauhan, Pooja. 2010. Preparation and characterization of barium hexaferrite by barium monoferrite [disertasi]. Patiala: University of Thapar.
Daulay S. 2012. Pengaruh substitusi Mn pada sifat magnetik barium heksaferit [skripsi]. Depok: Universitas Indonesia.
Haq A, Anis-ur-Rehman M. 2012. Effect of Pb on structural and magnetic properties of Ba-hexaferrite. Journal of Physica B 407: 822-826.
Ju X. 2005. Reductive dehalogenation of liquid-phase trichloroethylene using heterogenous catalytic and electrochemical methods. [disertasi]. USA: University of Arizona.
Kwak J, Lee C S. 2012. Characteristics of barium hexaferrite nanoparticles prepared by temperature-controlled chemical coprecipitation. Korean Chem 56 (5): 101.
Lien H I, Zhang W X. 2007. Nanoscale Pd/Fe bimetallic particles: catalytic effects of palladium on hydrodechlorination. Journal Applied Catalysis B: Environmental 77:110– 116.
11
Meshesha B T. 2011. Hydrodechlorination of chlorinated organic waste over Pd support mixed oxide catalyst. [tesis]. Spain: Universitat Rovirai Virgili. Mohsen Q. 2010. Barium hexaferrite synthesis by oxalate precursor route. Journal
of Alloys and Compounds 500: 125-128.
Muthuraman G, Pillai K C. 2001. Surfactant effects on mediated electrocatalyticdechlorination of allylchloride. Journal of Molecular Catalysis A: Chemical 169: 137–146.
Simagina V I, Netskina O V, Tayban E S. 2009. The effect of support properties on the activity of Pd/C catalysts in the liquid-phase hydrodechlorination of chlorobenzene. Journal Applied Catatlysis A: General 379: 87-94.
Su G, Liu Y, Huang L. 2013. Synergetic effect of alkaline earth metal oxides and iron oxides on the degradation of hexachlorobenzene and its degradation pathway. Journal Chemosphere 90: 103-111.
Susmita R. 2010. Analisis sifat listrik komposit polianilin (PANI) terhadap penambahan bottom ash sebagai elektroda superkonduktor [skripsi]. Padang: Universitas Andalas.
12
Lampiran 1 Diagram alir penelitian
BaCl2.2H2O FeCl3.6H2O
Larutan 1
Dilarutkan dalan 40 ml HCl 0,1 M
13
Lampiran 2 Perhitungan Ba1-xFe12NixO19 dan konduktivitas elektrode Ba1-xFe12NixO19
A. Perhitungan Penimbangan Bobot Reaktan
BaCl2.2H2O + FeCl3.6H2O + Ni(NO3)2.6H2O Ba1-xFe12NixO19
Komposisi-1
BaCl2.2H2O = x 5 gram
= x 5 gram = 1.096 gram
FeCl3.6H2O = x 5 gram
= x 5 gram = 14.5822 gram Ni(NO3)2.6H2O = 0 gram
B. Konduktivitas Elektrode Ba1-xFe12NixO19 σ =
Keterangan : R = Resistansi (Ω) A = Luas elektrode (cm2) l = Diameter elektrode (cm) Perbandingan 1 : 1
14
Lampiran 3 Perhitungan Degradasi PCE
Tabel 3 Parameter Elektrohidrodeklorinasi PCE dan Luas Puncak PCE Elektroda
Waktu (menit)
Tegangan
(volt) Luas Tinggi
Standar 14197 5763
x = 0.0 30 10 6105 2494
30 14 - -
x = 0.3 30 10 6939 2807
30 14 - -
x = 0.4 30 10 3797 1534
30 14 - -
PCE sampel =
Sisa PCE (x= 0.0, 30 s, 10 v) = = 0.043% (v/v) PCE yg terdegradasi = 0.1 – 0.043 = 0.057% (v/v)
15
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 29 Mei 1993 dari ayah Fahmi Rasyid dan ibu Dewi Siswati.Penulis adalah putri pertama dari tiga bersaudara. Pada tahun 2010 penulis lulus dari SMA Al-Ghazaly Bogor dan pada tahun yang sama, penulis diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Ujian Tes Masuk IPB (UTMI).
Selama kuliah penulis aktif di berbagai kegiatan pelatihan dan kepanitiaan mahasiswa antara lain Pelatihan LES (Leadership and Enterpreunership School) IPB tahun 2011, Panitia Acara MPF (Masa Perkenalan Fakultas) FMIPA IPB tahun 2012, dan Panitia Konsumsi Seminar Nasional Teknologi Kimia Aplikatif (Sensitif) IPB tahun 2012. Penulis melakukan praktik kerja lapangan di Pusat Sarana Pengendalian Dampak Lingkungan Hidup (Pusarpedal) Pusat Penelitian Ilmu Pengetahuan dan Teknologi (Puspitek) Serpong dengan judul laporan Penentuan Komponen Partikel Na+, K+, Ca2+, Mg2+, NH4+, Cl-, NO3- Dan SO42- Dan Gas-Gas SO2, HNO3, NH3, Dan