LAMA PEMBERIAN PAKAN MENGANDUNG
TEPUNG MENIRAN
Phyllanthus niruri
DAN BAWANG PUTIH
Allium sativum
UNTUK PENCEGAHAN INFEKSI BAKTERI
Aeromonas hydrophila
PADA IKAN LELE DUMBO
Clarias
sp.
IIS WIDIANI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
IIS WIDIANI. Lama pemberian pakan mengandung tepung meniran Phyllanthus niruri dan bawang putih Allium sativum untuk pencegahan infeksi bakteri
Aeromonas hydrophila pada ikan lele dumbo Clarias sp. Dibimbing oleh
DINAMELLA WAHJUNINGRUM dan SRI NURYATI.
Penyakit Motile Aeromonad Septicaemia (MAS) yang disebabkan oleh A. hydrophila menyebabkan wabah penyakit serius pada ikan air tawar salah satunya ikan lele dumbo Clarias sp. Penelitian ini bertujuan untuk mengetahui lama pemberian pakan mengandung tepung meniran dan bawang putih yang optimum untuk pencegahan penyakit MAS. Rancangan penelitian menggunakan Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 3 ulangan. Perlakuan yang diujikan adalah 3 waktu lama pemberian tepung meniran dan bawang putih yang berbeda, yaitu A (pakan dengan pemberian tepung meniran dan bawang putih selama 21 hari dan diinfeksi 0,1 ml A. hydrophila), B (pakan dengan pemberian tepung meniran dan bawang putih selama 14 hari dan diinfeksi 0,1 ml A. hydrophila), C (pakan dengan pemberian tepung meniran dan bawang putih selama 7 hari dan diinfeksi 0,1 ml A. hydrophila) dan perlakuan kontrol, yaitu K (tanpa pemberian tepung meniran dan bawang putih, dan disuntik 0,1 ml PBS) dan K (tanpa pemberian tepung meniran dan bawang putih, dan diinfeksi 0,1 ml A. hydrophila). Perlakuan dilakukan selama 21 hari, pada hari ke-22 dilakukan uji in vivo dengan menyuntikkan A. hydrophila (108 CFU/ml) pada ikan secara intramuskular dan diamati selama 10 hari. Nilai kelangsungan hidup tertinggi diperoleh perlakuan K 100±0,00%, perlakuan A 93,3±11,55%, dan perlakuan B 73,33±30,55%. Sedangkan perlakuan K+ dan C memiliki kelangsungan hidup yang sama yaitu, 26,67±11,55%. Pemberian tepung meniran dan bawang putih selama 21 hari optimum untuk pencegahan penyakit MAS pada ikan lele dumbo.
Kata kunci: A. hydrophila, lele dumbo, bawang putih, meniran
ABSTRACT
IIS WIDIANI. Duration of the application feed contains mixed powders of
Phyllanthus niruri and Allium sativum for the prevention of Aeromonas hydrophila infection in catfish Clarias sp. Supervised by DINAMELLA WAHJUNINGRUM and SRI NURYATI.
Motile Aeromonad Septicaemia (MAS) caused by Aeromonas hydrophila
application of P. niruri and A. sativum, namely A (feed with P. niruri and A. sativum powder application during 21 days and infected with A. hydrophila 0,1 ml), B (feed with P. niruri and A. sativum powder application during 14 days and infected with A. hydrophila 0,1 ml), C (feed with P. niruri and A. sativum powder application during 7 days and infected with A. hydrophila 0,1 ml), and control, namely K- (without P. niruri and A. sativum powder application and injected with PBS 0,1 ml) and K+ (without P. niruri and A. sativum powder application and infected with A. hydrophila 0,1 ml). The treatments was given for 21 days before challenging test, at 22thday test in vivo carried out by injecting A. hydrophila (108
CFU/ml) into the fish by intramuscular and observed for 10 days. The highest value of survival rate that consist in treatment K⁻ was 100 ± 0.00%, treatment A was 93.3 ± 11.55%, and treatment B was 73.33 ± 30.55%. While treatment K+ and C have the same survival rate that is, 26.67 ± 11.55%. The application P. niruri and A. sativum powder during 21 days was optimum for preventing MAS in catfish.
LAMA PEMBERIAN PAKAN MENGANDUNG
TEPUNG MENIRAN
Phyllanthus niruri
DAN BAWANG PUTIH
Allium sativum
UNTUK PENCEGAHAN INFEKSI BAKTERI
Aeromonas hydrophila
PADA IKAN LELE DUMBO
Clarias
sp.
IIS WIDIANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini menyatakan bahwa skripsi yang berjudul:
LAMA PEMBERIAN PAKAN MENGANDUNG TEPUNG MENIRAN
Phyllanthus niruri DAN BAWANG PUTIH Allium sativum UNTUK
PENCEGAHAN INFEKSI BAKTERI Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2011
PENGESAHAN
Judul Skripsi : Lama Pemberian Pakan Mengandung Tepung Meniran
Phyllanthus niruri dan Bawang Putih Allium sativum
untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila
pada Ikan Lele Dumbo Clarias sp. Nama Mahasiswa : Iis Widiani
Nomor Pokok : C14070092
Disetujui,
Pembimbing I Pembimbing II
Dr. Dinamella Wahjuningrum Dr. Sri Nuryati
NIP. 19700521 199903 2 001 NIP. 19710606 199512 2 001
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Odang Carman NIP. 19591222 198601 1 001
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yang Maha Esa yang senantiasa melimpahkan
rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini
dengan baik. Tema penelitian yang dilakukan dari tanggal 2 Maret 2011 sampai
dengan 7 Juni 2011 di Laboratorium Kesehatan Ikan, Departemen Budidaya
Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor adalah
peran fitofarmaka dalam mengatasi penyakit ikan dengan judul Lama Pemberian
Pakan Mengandung Tepung Meniran Phyllanthus niruri dan Bawang Putih Allium sativum untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp.
Banyak bantuan yang telah diberikan berbagai pihak sampai
diselesaikannya karya ilmiah ini. Oleh karena itu, pada kesempatan ini penulis
sampaikan ucapan terima kasih kepada: Dr. Dinamella Wahjuningrum dan Dr. Sri
Nuryati selaku dosen pembimbing yang telah bersedia meluangkan waktunya
untuk selalu memberikan bimbingan kepada penulis, Dr. Odang Carman selaku
penguji tamu yang telah memberikan masukan, seluruh keluarga besar penulis
terutama Ayah, Ibu dan Agus Bilman yang senantiasa memberikan dukungannya,
baik moril maupun materil. Terima kasih juga kepada rekan-rekan mahasiswa
Departemen Budidaya Perairan, Angkatan 44 khususnya, LKI’ers, Asep El
Qusairi, Pak Ranta, Kak Rahman, Kak Rahmat, Kak Karno, Bang Rusli, Kak
Fariq dan rekan-rekan semua yang telah membantu.
Semoga karya ilmiah ini bermanfaat bagi penulis dan semua pembaca.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 14 Maret 1989 sebagai anak
keenam dari enam bersaudara dari pasangan Bapak Iri Rohmandi dan Ibu
Rokayah. Pendidikan sekolah dasar (SDN Haruman III) sampai Sekolah
Menengah Atas (SMAN 2 Garut) dari tahun 1995 sampai tahun 2007 di Garut.
Penulis melanjutkan pendidikan ke Institut Pertanian Bogor (IPB) pada tahun
2007 melalui Seleksi Penerimaan Mahasiswa Baru (SPMB) dan mengambil
Program Studi Teknologi dan Manajemen Perikanan Budidaya (TMPB) di
Fakultas Peikanan dan Ilmu Kelautan (FPIK).
Selama perkuliahan penulis mengikuti beberapa organisasi yaitu, Badan
Eksekutif Mahasiswa (BEM) FPIK periode tahun 2009-2010 menjabat sebagai
Staff PPSDM, Himpunan Mahasiswa Akuakultur (HIMAKUA) menjabat sebagai
Sekretaris Divisi Kewirausahaaan, Badan Eksekutif Mahasiswa (BEM) FPIK
periode 2010-2011 menjabat sebagai Bendahara Umum 2. Penulis pernah
melaksanakan magang di Tambak Udang Bakauheni, Bakauheni, Lampung.
Penulis pernah menjadi Asisten Metode Statistika 2009 dan Asisten Manajemen
Kesehatan Akuakultur 2011. Selain itu penulis juga aktif di organisasi ekstra
kampus yaitu Beastudi Etos Bogor Community (BEBC) tahun 2008-2010 dan
Himpunan Mahasiswa Garut (HIMAGA). Penulis pernah mendapat beasiswa
Beastudi ETOS dan Karya Salemba Empat (KSE). Selain itu penulis juga banyak
mengikuti seminar dan pelatihan salah satu diantaranya Seminar Pertanian
Nasional 2008, Simposium Bioteknologi Akuakultur III 2010, National Seminar and Workshop of Environmental Health ”Save Our Environment For Indonesian Brigther Future” 2009, dan Pelatihan Mitigasi Bencana oleh Tim GEGANA 2009.
Penulis mempunyai pengalaman kerja sebagai Instructur Smart bidang
Matematika di Primagama Dramaga, Bogor.
Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis skripsi
yang berjudul “Lama Pemberian Pakan Mengandung Tepung Meniran
DAFTAR ISI
2.1.1 Karakterisasi sifat biokimia dan fisiologi Aeromonas hydrophila ... 3
2.1.2 Uji Postulat Koch ... 3
2.1.3 Regenerasi bakteri uji ... 3
2.1.4 Uji LD50 ... 4
2.1.5 Pembuatan tepung meniran Phyllanthus niruri ... 4
2.1.6 Pembuatan tepung bawang putih Allium sativum ... 5
2.1.7 Pembuatan pakan uji ... 5
2.2.4 Gejala klinis dan penyembuhan luka ... 8
2.2.5 Pengamatan organ dalam ... 9
2.2.6 Kualitas air ... 9
2.3 Analisis Data ... 9
III. HASIL DAN PEMBAHASAN ... 10
3.1. Hasil ... 10
3.1.1. Identifikasi bakteri uji ... 10
3.1.2. Uji LD50 ... 10
3.1.3. Uji in vivo ... 11
3.1.3.1 Kelangsungan hidup ... 11
3.1.3.2 Respons makan ... 12
3.1.3.3 Pertumbuhan relatif ... 12
3.1.3.4 Gejala klinis dan penyembuhan luka ... 13
3.1.3.5 Pengamatan organ dalam ... 20
3.1.3.6 Kualitas air ... 21
4.1. Kesimpulan ... 30
4.2. Saran ... 30
DAFTAR PUSTAKA ... 31
DAFTAR TABEL
Halaman
1. Parameter uji sebelum dan sesudah infeksi ... 12
2. Presentase penyembuhan luka ... 19
3. Parameter kualitas air pada akhir perlakuan ... 21
DAFTAR GAMBAR
Halaman
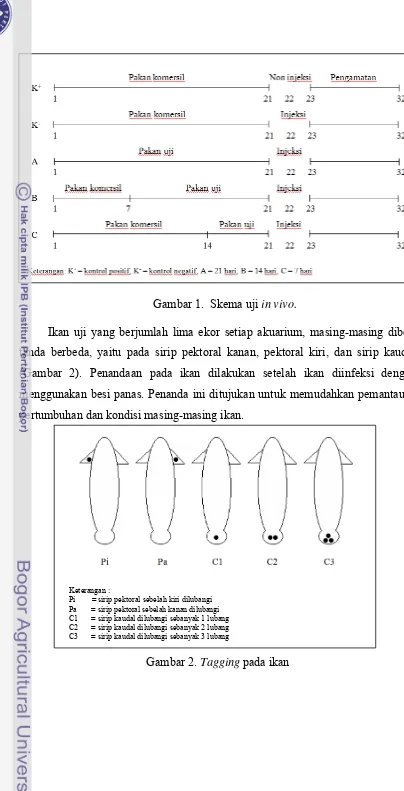
1. Skema uji in vivo ... 7
2. Tagging pada ikan ... 7
3. Ekspresi sel hasil pewarnaan Gram ... 10
4. Morfologi koloni A. hydrophila 1x24 jam pada media TSA ... 10
5. Kelangsungan hidup ikan lele pada akhir perlakuan ... 11
6. Jumlah kematian ikan per hari pasca infeksi ... 11
7. Pertumbuhan relatif ikan lele selama 21 hari sebelum infeksi ... 13
8. Kondisi ikan perlakuan K- tidak ada gejala klinis yang muncul ... 14
9. Radang muncul pada jam ke-7 pasca infeksi pada ikan perlakuan A ulangan 2 tag C3 ... 14
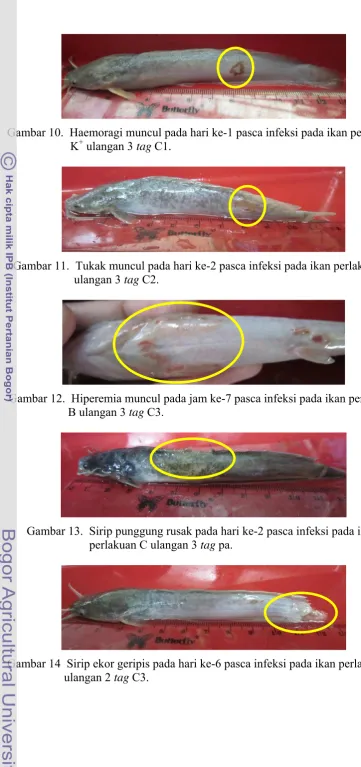
10.Haemoragi muncul pada hari ke-1 pasca infeksi pada ikan perlakuan K+ ulangan 2 tag C1 ... 15
11.Tukak muncul pada hari ke-2 pasca infeksi pada ikan perlakuan B ulangan 3 tag C2 ... 15
12.Hiperemia muncul pada jam ke-7 pasca infeksi pada ikan perlakuan B ulangan 3 tag C3 ... 15
13.Sirip punggung rusak pada hari ke-2 pasca infeksi pada ikan perlakuan C ulangan 3 tag pa ... 15
14.Sirip ekor geripis pada hari ke-6 pasca infeksi pada ikan perlakuan A ulangan 2 tag C3 ... 15
15.Perubahan diameter luka ikan perlakuan K+U1 pi ... 16
16.Perubahan diameter luka ikan perlakuan AU3 pi ... 17
17.Perubahan diameter luka ikan perlakuan BU1 pi ... 18
18.Perubahan diameter luka ikan perlakuan CU1 C2 ... 19
19.Organ dalam ikan lele setiap perlakuan ... 20
DAFTAR LAMPIRAN
Halaman
1. Perhitungan nilai LD50 ... 34
2. Analisis statistik respons makan ... 35
3. Analisis statistik pertumbuhan relatif ... 36
4. Respons makan ikan pasca infeksi A. hydrophila ... 37
I.
PENDAHULUAN
1.1 Latar Belakang
Ikan lele merupakan ikan air tawar yang banyak dibudidayakan karena
metode budidayanya mudah. Budidaya lele berkembang pesat dikarenakan ikan
lele mempunyai beberapa kelebihan, yaitu dapat dibudidayakan di lahan dan
sumber air yang terbatas dengan padat tebar tinggi, mempunyai pertumbuhan
yang cepat, teknologi budidaya relatif mudah dikuasai oleh masyarakat,
pemasarannya relatif mudah dan modal usaha yang dibutuhkan relatif rendah serta
mempunyai nilai ekonomis yang tinggi (Anonim, 2003). Konsumsi ikan lele
meningkat dari 0,67 kg/kepala pada tahun 2008 menjadi 2,3 kg/kepala pada tahun
2009 (KKP, 2010a).
Penyakit merupakan salah satu ancaman yang sangat membahayakan dalam
meningkatkan produksi ikan lele dengan budidaya intensif yang menyebabkan
kerugian secara ekonomis. Umumnya penyakit pada ikan lele adalah penyakit
MAS (Motile Aeromonad Septicaemia) yang disebabkan oleh infeksi bakteri
Aeromonas hydrophila yang sewaktu-waktu dapat menyerang pada kondisi tertentu (Swann dan White, 1989). Dengan demikian perlu dilakukan pencegahan
sebelum ikan positif terinfeksi. Sebelum adanya pelarangan penggunaan
antibiotik, pembudidaya umumnya menggunakan berbagai antibiotik untuk
menanggulangi penyakit ini, tetapi sekarang penggunaan antibiotik sudah sangat
dibatasi.
Alternatif lain yang digunakan untuk pencegahan penyakit pada ikan lele
yaitu dengan menggunakan bahan fitofarmaka. Salah satu bahan fitofarmaka yang
dapat digunakan yaitu campuran antara meniran Phyllanthus niruri dan bawang putih Allium sativum dalam bentuk tepung yang dicampurkan ke dalam pakan. Bawang putih berperan sebagai antimikroba (Lemar et al., 2005), sedangkan
meniran berperan dalam meningkatkan sistem imun (Suprapto, 2010 dalam
Kurniawan, 2010). Penggunaan campuran meniran dan bawang putih yang
dicampur ke dalam pakan dengan cara repelleting untuk mencegah pencegahan penyakit pada ikan lele sudah dilakukan oleh Kurniawan (2010). Namun, lama
keberhasilan kelangsungan hidup sebesar 60±20%. Oleh karena itu perlu
dilakukan penelitian mengenai pemberian campuran meniran dan bawang putih
dalam pakan dengan lama waktu pemberian yang berbeda.
1.2 Tujuan
Penelitian ini bertujuan untuk mengetahui lama pemberian pakan
mengandung tepung meniran dan bawang putih yang optimum untuk pencegahan
II.
BAHAN DAN METODE
2.1 Metode Penelitian
2.1.1 Karakterisasi sifat biokimia dan fisiologi Aeromonas hydrophila
Karakterisasi yang dilakukan meliputi pengamatan morfologi koloni secara
visual, meliputi warna, elevasi dan tepian sel. Uji yang dilakukan meliputi
pewarnaan Gram, uji motilitas, uji O/F, uji katalase, dan uji oksidase. Melalui
pewarnaan Gram akan diketahui sifat Gram dan morfologi dari bakteri yang
diidentifikasi. Berdasarkan uji biokimia akan diperoleh genus suatu bakteri
dengan mengacu pada identifikasi berdasarkan Bergey’s Mannual of
Determination Bacteriology (Holt et al., 1998 dalam Ayuningtyas, 2008). Karakterisasi dan uji tersebut dilakukan untuk memastikan bahwa sediaan bakteri
yang digunakan merupakan A. hydrophila.
2.1.2 Uji Postulat Koch
Postulat Koch dilakukan untuk menguji virulensi sediaan bakteri A. hydrophila yang ada di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, Institut Pertanian Bogor. Bakteri A. hydrophila disuntikkan pada 5 ekor ikan lele. Setelah muncul tanda-tanda penyakit Motil Aeromonad Septicaemia
pada ikan lele, kemudian dilakukan reisolasi bakteri A. hydrophila dari empat ekor ikan lele. Proses reisolasi dilakukan dengan menggoreskan jarum ose pada ginjal
dan borok yang terdapat pada ikan lele kemudian dibiakkan di media TSA
(Trypticase Soy Agar) dan diinkubasikan selama 24 jam di dalam inkubator. Bakteri yang tumbuh kemudian dimurnikan dengan menumbuhkannya pada
media TSA miring. Bakteri hasil reisolasi ini dikarakterisasi kembali dan di uji
sifat fisiologis dan biokimianya.
2.1.3 Regenerasi bakteri uji
Bakteri yang diuji diregenerasi terlebih dahulu sebelum digunakan. Bakteri
stok dari kultur primer dibiakkan dalam agar miring yaitu sebanyak satu ose
digoreskan ke agar miring dan diinkubasi selama 24 jam pada suhu 27 oC.
diinokulasikan ke dalam Erlenmeyer yang berisi 25 ml media media TSB
(Trypticase Soy Broth) kemudian diinkubasi selama 24 jam dalam water bath shaker. Setelah itu dilakukan pengenceran berseri dengan cara bakteri hasil kultur di media TSB diambil 1 ml suspense dan dimasukkan ke dalam Eppendorf dengan menggunakan pipet mikro, kemudian disentrifuse 3000 rpm sekitar 5 menit dan
dibuang supernatannya. Endapan yang diperoleh dicuci dengan PBS sebanyak 2x.
Kemudian ke dalam endapan ditambahkan 1 ml PBS dan divorteks sampai
tercampur rata, setelah itu diambil 0,1 ml dan dimasukkan ke dalam Eppendorf
yang berisi 0,9 ml PBS, dilakukan hal yang sama hingga pengenceran yang
diinginkan.
2.1.4 Uji LD50
Letal Dosis 50% (LD50) adalah suatu besaran yang diturunkan secara
statistik, guna menyatakan dosis tunggal sesuatu senyawa yang diperkirakan dapat
mematikan atau menimbulkan efek toksik yang berarti pada 50% hewan coba
setelah perlakuan (Sulastry, 2009). LD50 dilakukan untuk menentukan tingkat
virulensi bakteri A. hydrophila. Hal ini penting untuk mengetahui konsentrasi bakteri yang digunakan. Uji LD50 dilakukan dengan menggunakan akuarium
berukuran 35 x 30 x 35 cm sebanyak 5 buah masing-masing untuk perlakuan
kepadatan bakteri yang disuntikkan yaitu mulai dari 106 sampai 1010 cfu/ml.
Setiap akuarium diisi 5 ekor ikan. Penyuntikkan dilakukan secara intramuscular
sebanyak 0,1 ml/ekor. Pengamatan terhadap jumlah ikan yang mati dan yang
masih hidup dilakukan selama 7 hari. Setelah itu dilakukan perhitungan untuk
menentukan nilai LD50 (Lampiran 1).
2.1.5 Pembuatan tepung meniran Phyllanthus niruri
Herba meniran diperoleh dari Balai Penelitian Tanaman Rempah dan Obat
(BALITRO) Cimanggu, Bogor. Bagian tanaman yang diambil adalah bagian
daun. Sebelum digunakan daun meniran dicuci terlebih dahulu dengan air
mengalir, kemudian dikeringudarakan tanpa terkena sinar matahari selama tiga
tepung yang dihasilkan disaring dengan saringan halus. Setelah itu disimpan
dalam wadah kedap udara hingga saatnya dicampur dalam bahan pakan ikan.
2.1.6 Pembuatan tepung bawang putih Allium sativum
Bawang putih dibuang kulitnya dan diiris tipis-tipis. Kemudian
dikeringudarakan tanpa terkena sinar matahari selama enam hari. Setelah itu
dikeringkan dalam oven selama satu jam pada suhu 60 oC. Setelah kering, bawang
kemudian diblender sampai menjadi tepung. Kemudian tepung yang dihasilkan
disaring dengan saringan halus. Setelah itu disimpan dalam wadah kedap udara
hingga saatnya dicampur dalam bahan pakan ikan.
2.1.7 Pembuatan pakan uji
Pakan komersil berprotein 30% ditepungkan, kemudian dicampur dengan
tepung meniran 0,7% dan bawang putih 1,4% serta ditambahkan vitamin C 0,1%
dan diaduk rata. Setelah itu ditambahkan air sebanyak 25% lalu dicetak, kemudian
dikeringkan dalam oven sekitar 2 jam pada suhu 60 ⁰C. Pakan disimpan dalam
wadah kedap udara. Dosis meniran dan bawang putih yang digunakan diambil
dari dosis efektif hasil penelitian Kurniawan (2010).
2.1.8 Rancangan penelitian
Penelitian ini terdiri dari lima perlakuan dan tiga kali ulangan.
Masing-masing perlakuan tersebut adalah:
Perlakuan K- : pakan tanpa pemberian tepung meniran dan bawang putih
selama 21 hari, setelah itu disuntik PBS 0,1 ml/ekor
Perlakuan K+ : pakan tanpa pemberian tepung meniran 0,7% dan bawang putih
selama 21 hari 1,4%, setelah itu diinfeksi A. hydrophila 0,1 ml/ekor
Perlakuan A : pakan dengan pemberian tepung meniran 0,7% dan bawang
putih 1,4% selama 21 hari setelah itu diinfeksi A. hydrophila 0,1 ml/ekor
Perlakuan B : pakan dengan pemberian tepung meniran 0,7% dan bawang
ml/ekor
Perlakuan C : pakan dengan pemberian tepung meniran 0,7% dan bawang
putih 1,4% selama 7 hari setelah itu diinfeksi A. hydrophila 0,1 ml/ekor
2.1.9 Persiapan wadah dan ikan uji
Wadah yang digunakan dalam penelitian ini yaitu akuarium berukuran 60 x
30 x 35 cm sebanyak 15 unit. Akuarium dicuci bersih dan dikeringkan. Kemudian
didisinfeksi dengan CaOCl2 dengan konsentrasi100 ppm selama 24 jam. Setelah
itu diisi air setinggi 15 cm, kemudian didisinfeksi dengan CaOCl2 dengan
konsentrasi 30 ppm selama 24 jam, selanjutnya dinetralisir dengan Na2S2O3.5H2O
15 ppm dan diaerasi kuat. Seluruh sisi akuarium ditutup plastik berwarna hitam
untuk menghindari stress pada ikan sehingga ikan lele tidak loncat. Selain itu
untuk mencegah ikan loncat, bagian atas akuarium ditutup dengan kain kasa.
Ikan uji yang digunakan memiliki panjang 11,67±0,55 cm dengan bobot
12,44±1,31 gram. Ikan uji diadaptasikan terlebih dahulu selama satu minggu di
dalam kolam terpal kecil sebelum dimasukkan ke dalam akuarium. Sebelumnya
ikan direndam dalam larutan NaCl 30 ppm selama 5 menit untuk membebaskan
parasit yang menempel di insang atau permukaan tubuh ikan. Selama proses
adaptasi, ikan diberi pakan komersil dengan kadar protein 30% dua kali sehari
secara at satiation. Selanjutnya ikan diadaptasikan di dalam akuarium selama dua minggu. Setiap akuarium diisi ikan sebanyak 5 ekor. Selama diadaptasikan dalam
akuarium, ikan lele diberi pakan uji dengan FR (Feeding Rate) 3%, dan FF (Feeding Frequency) 2 kali sehari, yaitu pagi dan sore.
2.1.10 Uji in vivo
Uji in vivo dilakukan untuk mengetahui pengaruh lama pemberian pakan yang dicampur tepung meniran dan bawang putih terhadap kelangsungan hidup
ikan lele. Penyuntikkan A. hydrophila dilakukan setelah pemberian pakan uji selama 21 hari untuk perlakuan A, 14 hari untuk perlakuan B, dan 7 hari untuk
Gambar 1. Skema uji in vivo.
Ikan uji yang berjumlah lima ekor setiap akuarium, masing-masing diberi
tanda berbeda, yaitu pada sirip pektoral kanan, pektoral kiri, dan sirip kaudal
(Gambar 2). Penandaan pada ikan dilakukan setelah ikan diinfeksi dengan
menggunakan besi panas. Penanda ini ditujukan untuk memudahkan pemantauan
pertumbuhan dan kondisi masing-masing ikan.
Keterangan :
Pi = sirip pektoral sebelah kiri dilubangi Pa = sirip pektoral sebelah kanan dilubangi C1 = sirip kaudal dilubangi sebanyak 1 lubang C2 = sirip kaudal dilubangi sebanyak 2 lubang C3 = sirip kaudal dilubangi sebanyak 3 lubang
2.2 Parameter Pengamatan 2.2.1 Kelangsungan hidup
Kelangsungan hidup ikan diamati setiap hari hingga akhir perlakuan. Setiap
ikan yang mati dicatat dan diukur panjang serta bobotnya. Perhitungan
kelangsungan hidup dilakukan di akhir perlakuan dengan formula sebagai berikut
(Effendi, 2004).
Pengamatan respons makan dilakukan dari awal hingga akhir perlakuan.
Respons makan diamati saat pemberian pakan dilakukan pada setiap perlakuan.
Respons makan dapat diukur dari sisa pakandengan cara mengurangi pakan yang
seharusnya diberikan (FR 3%) dengan sisa pakan yang dikumpulkan selama satu
hari. Respons makan pasca infeksi juga diamati selama 10 hari.
2.2.3 Pertumbuhan relatif
Bobot ikan ditimbang saat awal, tengah, dan akhir perlakuan sebelum uji
tantang dengan menggunakan timbangan digital dengan ketelitian 0,01.
Pertumbuhan relatif ikan dihitung dengan rumus (Afrianto dan Liviawaty, 2005):
wt - wo
2.2.4 Gejala klinis dan penyembuhan luka
Gejala klinis diamati setiap hari setelah ikan diinfeksi dengan A. hydrophila
selama 10 hari. Gejala klinis yang diamati adalah hiperemia (kenaikkan jumlah
darah sebagai akibat adanya luka), tukak (rongga terbuka yang terbentuk pada
kulit akibat adanya jaringan yang rusak akibat infeksi), dan kondisi sirip.
Rumus yang digunakan untuk perhitungan persentase penyembuhan luka
adalah sebagai berikut (Sartika, 2010):
Diameter luka terbesar – Diameter luka terkecil 1
ΔX= x 100% x
Diameter luka terbesar t
Keterangan :
t = lama penyembuhan (hari)
ΔX = penyembuhan luka (%/hari)
2.2.5 Pengamatan organ dalam
Pengamatan organ dalam dilakukan pada akhir perlakuan yang bertujuan
untuk mengetahui kelainan yang terjadi antar perlakuan. Pengamatan meliputi
perubahan morfologi dan warna organ. Organ dalam yang diamati yaitu ginjal,
hati, empedu, dan limpa.
2.2.6 Kualitas air
Parameter kualitas air yang akan diamati meliputi pengukuran suhu, pH, DO
(oksigen terlarut) dan TAN (Total Ammonia Nitrogen). Pengukuran parameter kualitas air dilakukan pada awal dan akhir penelitian.
2.3 Analisis data
Percobaan ini dilakukan menggunakan RAL (Rancangan Acak Lengkap)
dengan lima perlakuan dan tiga kali ulangan. Data dianalisis menggunakan
ANOVA single factor, dan uji lanjut untuk beda nyata menggunakan Uji Duncan. Parameter yang dianalisis statistik secara kuantitatif adalah respons makan dan
pertumbuhan relatif, sedangkan parameter yang dianalisis secara deskriptif adalah
kelangsungan hidup, gejala klinis, kecepatan penyembuhan luka, morfologi dan
III.
HASIL DAN PEMBAHASAN
3.1 Hasil
3.1.1 Identifikasi bakteri uji
Hasil pewarnaan Gram menunjukkan bahwa bakteri uji yaitu A. hydrophila
berbentuk batang pendek, bersifat Gram negatif, dan morfologi selnya berwarna
merah muda (Gambar 3). Selain itu, bakteri uji juga memiliki morfologi koloni
berwarna krem, elevasi cembung, dan tepian halus (Gambar 4). Sifat biokimia dan
fisiologi bakteri uji adalah bersifat fermentatif, bersifat motil, dan positif terhadap
uji oksidase dan katalase.
Gambar 3. Ekspresi sel hasil Gambar 4. Morfologi koloni
pewarnaan Gram. A. hydrophila 1x24 jam pada media TSA.
3.1.2 Uji LD50
Uji LD50 dilakukan terhadap bakteri yang sudah diidentifikasi sebelumnya.
Pengujian dilakukan dengan menginfeksikan bakteri A. hydrophila dengan kepadatan berbeda pada ikan lele secara intramuscular. Kepadatan bakteri yang digunakan yaitu, dari 106 sampai 1010 cfu/ml. Hasil uji menunjukkan kepadatan
bakteri yang menyebabkan kematian 50% dari populasi dalam kurun waktu satu
minggu, adalah 108 cfu/ml. Hal ini menunjukkan bahwa LD50 bakteri uji adalah
3.1.3 Uji in vivo
3.1.3.1 Kelangsungan hidup
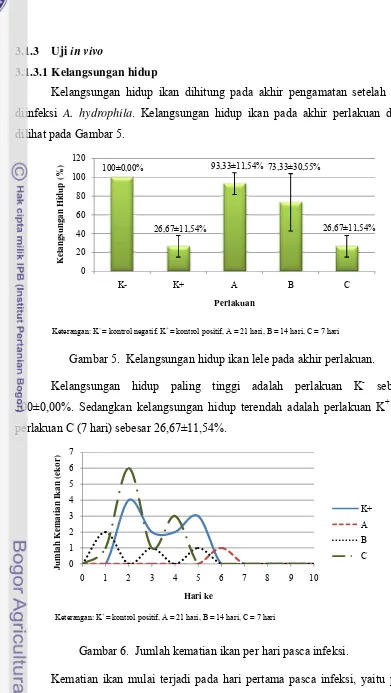
Kelangsungan hidup ikan dihitung pada akhir pengamatan setelah ikan
diinfeksi A. hydrophila. Kelangsungan hidup ikan pada akhir perlakuan dapat dilihat pada Gambar 5.
0
Gambar 5. Kelangsungan hidup ikan lele pada akhir perlakuan.
Kelangsungan hidup paling tinggi adalah perlakuan K- sebesar
100±0,00%. Sedangkan kelangsungan hidup terendah adalah perlakuan K+ dan
perlakuan C (7 hari) sebesar 26,67±11,54%.
0
Gambar 6. Jumlah kematian ikan per hari pasca infeksi.
Kematian ikan mulai terjadi pada hari pertama pasca infeksi, yaitu pada
tertinggi terjadi pada perlakuan C sebanyak 6 ekor pada hari ke-2. Setelah hari ke
7 hingga hari terakhir pengamatan tidak terjadi kematian ikan.
3.1.3.2 Respons makan
Respons makan ikan diamati sebelum dan sesudah infeksi. Respons makan
ikan sebelum infeksi diamati selama 21 hari. Nafsu makan ikan mengalami
penurunan ketika ikan diberi pakan uji. Rata-rata ikan perlakuan A, B dan C
memerlukan waktu 3-4 hari untuk dapat beradaptasi terhadap pergantian pakan
dari pakan komersil ke pakan uji. Setelah beradaptasi, ikan perlakuan A, B, dan C
dapat merespons dengan baik pakan yang diberikan. Setelah infeksi, pengamatan
respons makan ikan dilakukan selama 10 hari. Respons makan ikan meningkat
seiring bertambahnya hari pasca infeksi. Jumlah pakan yang dihabiskan sebelum
dan sesudah infeksi pada setiap perlakuan, dan parameter uji lainnya, yaitu
kelangsungan hidup dan pertumbuhan relatif dapat dilihat pada Tabel 1 di bawah
ini.
Tabel 1. Parameter uji sebelum dan sesudah infeksi
Parameter Uji
Lama pemberian pakan fitofarmaka (meniran + bawang putih)
Kontrol +
Pertumbuhan relatif (%) 27,43±2,06b 26,80±2,51b 24,69±3.02ab 21,93±0,74a 22,75±0,83a
Kelangsungan hidup (%) 100±0,00 100±0,00 100±0,00 100±0,00 100±0,00
Sesudah infeksi
Konsumsi pakan (g/hari/ekor)
0,22±0,02 0,45±0,01 0,31±0,01 0,20±0,05 0,18±0,01
Kelangsungan hidup (%) 26,67±11,54 100±0,00 93,33±11,54 73,33±30,55 26,67±11,54
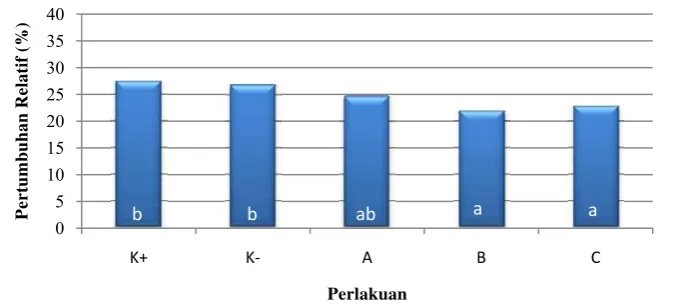
3.1.3.3 Pertumbuhan relatif
Berdasarkan hasil uji statistik, pertumbuhan relatif ikan pada perlakuan B
(14 hari) dan C (7 hari) berbeda nyata dengan perlakuan K+ dan K-.Pertumbuhan
relatif ikan pada setiap perlakuan dapat dilihat pada Tabel 1 dan Gambar 7. Hasil
0
Gambar 7. Pertumbuhan relatif ikan lele selama 21 hari sebelum infeksi.
3.1.3.4 Gejala klinis dan penyembuhan luka
Pengamatan gejala klinis pada ikan yang sudah diinfeksi A. hydrophila
dilakukan selama 10 hari pasca infeksi. Gejala klinis yang diamati meliputi
hiperemia, radang, haemoragi, tukak, kelengkapan dan kondisi sirip (Gambar
9-14). Secara umum gejala klinis berupa radang mulai muncul pada jam ke-7 pasca
infeksi. Radang pada ikan berubah menjadi haemoragi pada jam ke-24. Beberapa
ikan tidak mengalami haemoragi, peradangan langsung berubah menjadi tukak.
Ikan uji perlakuan K+ membentuk radang pada jam ke-7 pasca infeksi.
Tiga ekor ikan uji belum menunjukkan gejala klinis pada hari ke-1. Selain radang,
pada jam ke-7 juga terlihat ada ikan uji yang mengalami hiperemia. Pada hari ke-2
sudah terbentuk haemoragi dan tukak. Selain itu terdapat ikan uji yang mengalami
ekor geripis pada hari ke-2. Ikan yang mengalami hiperemia dan ekor geripis tidak
dapat sembuh dan akhirnya mati. Kematian ikan sudah terjadi pada hari ke-2
sebanyak empat ekor (Lampiran 5).
Ikan uji perlakuan A (21 hari) mulai menunjukkan gejala klinis berupa
radang jam ke-7 pasca infeksi. Radang yang terbentuk cukup besar. Haemoragi
muncul pada jam ke-24, sedangkan tukak sudah mulai muncul pada hari ke-2
pasca infeksi. Pada sebagian kecil ikan uji, radang yang terbentuk sembuh tidak
membentuk haemoragi maupun tukak (Lampiran 5).
Pada jam ke-7 pasca infeksi ikan uji perlakuan B (14 hari) sudah
gejala klinis pada jam ke-7. Pada hari ke-1 terbentuk haemoragi pada sebagian
ikan. Pada hari ke-1 sudah terjadi kematian ikan sebanyak dua ekor. Tukak mulai
terbentuk pada hari ke-2. Pada hari ke-3 satu ekor ikan baru membentuk radang.
Ikan uji perlakuan C (7 hari) menunjukkan gejala klinis berupa radang
pada jam ke-7 pasca infeksi. Radang yang terbentuk cukup besar. Pada hari ke-1
radang berubah menjadi haemoragi pada sebagian besar ikan. Sudah terjadi
kematian sebanyak satu ekor pada hari ke-1. Pada hari ke-2 kematian yang terjadi
meningkat sebanyak 6 ekor. Berbeda dengan perlakuan lainnya, pada perlakuan
K- tidak menunjukkan gejala klinis pasca infeksi hingga akhir perlakuan, karena
hanya diinjeksi PBS 0,1 ml/ekor (Gambar 8).
Gambar 8. Kondisi ikan perlakuan K-: tidak ada gejala klinis yang muncul.
Gambar 10. Haemoragi muncul pada hari ke-1 pasca infeksi pada ikan perlakuan K+ ulangan 3 tag C1.
Gambar 11. Tukak muncul pada hari ke-2 pasca infeksi pada ikan perlakuan B ulangan 3 tag C2.
Gambar 12. Hiperemia muncul pada jam ke-7 pasca infeksi pada ikan perlakuan B ulangan 3 tag C3.
Gambar 13. Sirip punggung rusak pada hari ke-2 pasca infeksi pada ikan perlakuan C ulangan 3 tag pa.
Luka yang terbentuk akibat infeksi A. hydrophila akan mengecil bahkan sembuh. Waktu penyembuhan luka pada setiap ikan berbeda-beda tergantung
pada diameter luka awal yang terbentuk dan kekebalan tubuh ikan itu sendiri.
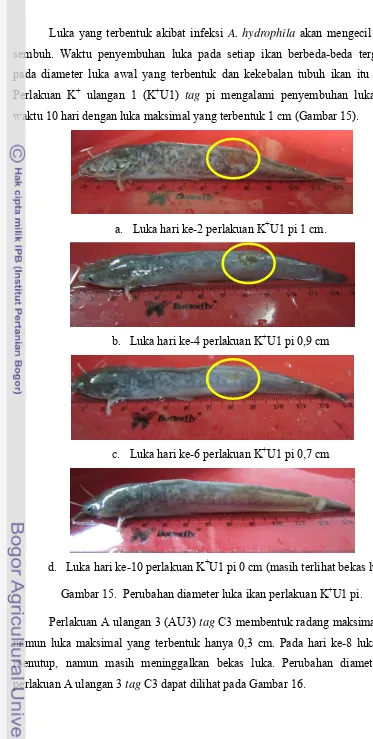
Perlakuan K+ ulangan 1 (K+U1) tag pi mengalami penyembuhan luka dalam waktu 10 hari dengan luka maksimal yang terbentuk 1 cm (Gambar 15).
a. Luka hari ke-2 perlakuan K+U1 pi 1 cm.
b. Luka hari ke-4 perlakuan K+U1 pi 0,9 cm
c. Luka hari ke-6 perlakuan K+U1 pi 0,7 cm
d. Luka hari ke-10 perlakuan K+U1 pi 0 cm (masih terlihat bekas luka)
Gambar 15. Perubahan diameter luka ikan perlakuan K+U1 pi.
Perlakuan A ulangan 3 (AU3) tag C3 membentuk radang maksimal 1 cm, namun luka maksimal yang terbentuk hanya 0,3 cm. Pada hari ke-8 luka sudah
menutup, namun masih meninggalkan bekas luka. Perubahan diameter luka
a. Radang pada jam ke-7 perlakuan AU3 C3 1 cm.
b. Luka hari ke-2 perlakuan AU3 C3 0,3 cm
c. Luka hari ke-4 perlakuan AU3 C3 0,2 cm
d. Luka hari ke-8 perlakuan AU3 C3 0 cm
Gambar 16. Perubahan diameter luka ikan perlakuan AU3 pi.
Luka maksimal yang terbentuk pada perlakuan B ulangan 1 (BU1) tag pi sebesar 0,8 cm. Luka tersebut sudah mencapai diameter 0,3 cm pada hari ke-8 dan
a. Luka hari ke-2 perlakuan BU1 pi 0,8 cm.
b. Luka hari ke-4 perlakuan BU1 pi 0,7 cm.
c. Luka hari ke-6 perlakuan BU1 pi 0,6 cm.
d. Luka hari ke-10 perlakuan BU1 pi 0,3 cm.
Gambar 17. Perubahan diameter luka perlakuan BU1 pi.
Perlakuan C ulangan 1 (CU1) tag C2 dengan diameter luka maksimal 0,9 cm menjadi 0 cm namun masih sedikit meninggalkan bekas pada hari ke-10 pasca
infeksi A. hydrophila. Perubahan diameter luka pada perlakuan C ulangan 1 tag
a. Luka hari ke-2 perlakuan CU1 C2 0,9 cm
b. Luka hari ke-4 perlakuan CU1 C2 0,8 cm
c. Luka hari ke-6 perlakuan CU1 C2 0,6 cm
d. Luka hari ke-10 perlakuan CU1 C2 0 cm
Gambar 19. Perubahan diameter luka perlakuan CU1 C2.
Perubahan diameter luka merupakan salah satu indikator dari proses
penyembuhan luka. Persentase penyembuhan luka dapat dilihat pada Tabel 2.
Tabel 2. Persentase penyembuhan luka
Lama pemberian (hari) Penyembuhan luka (%/hari)
A 15,63±2,08
B 16,67±0,00
C 9,93±2,05
K+ 12,43±6,25
3.1.3.5 Pengamatan organ dalam
Pengamatan organ dalam dilakukan pada akhir perlakuan setelah
dilakukan pengamatan selama 10 hari. Kondisi organ dalam perlakuan K- terlihat
normal dengan warna hati merah kecoklatan, empedu hijau kekuningan, limpa
merah kehitaman dan ginjal merah tua. Perlakuan K+ memiliki warna hati dan
ginjal yang berbeda dengan K- yaitu, warna hati dan ginjal merah pucat. Perlakuan
A (21 hari), B (14 hari), dan C (7 hari) memiliki organ dalam yang hampir sama
dengan perlakuan K-. Namun, terdapat sedikit perbedaan dengan perlakuan K-,
yaitu perlakuan B memiliki warna limpa merah tua, dan perlakuan C memiliki
warna ginjal merah pucat. Kondisi organ dalam semua perlakuan pada akhir
perlakuan dapat dilihat pada Gambar 19 di bawah ini.
Perlakuan K- Perlakuan K+
Perlakuan A Perlakuan B
Perlakuan C
Gambar 19 Organ dalam ikan lele setiap perlakuan
3.1.3.6 Kualitas air
Pengukuran kualitas air dilakukan pada awal dan akhir perlakuan.
Parameter utama yang diukur adalah oksigen terlarut (Disolve Oxygen, DO), suhu, pH, dan TAN (Total Ammonia Nitrogen). Oksigen terlarut pada awal perlakuan sebesar 4,64 ppm, suhu awal sebesar 28oC, pH awal sebesar 7,94 dan TAN awal
sebesar 0,159. Kualitas air pada akhir perlakuan dapat dilihat pada Tabel 3 di
bawah ini.
Tabel 3. Parameter kualitas air pada akhir perlakuan.
Parameter
(7 hari) Standar Pustaka
DO (ppm) 4,47 4,44 4,32 0,62 4,41 >3 Amri dan
Gambar 20. Suhu air selama perlakuan.
Kualitas air selama perlakuan masih sesuai untuk menunjang
kelangsungan hidup dan pertumbuhan ikan lele. Kisaran suhu pada pagi hari
25-26 oC, siang hari 27-30 oC, dan sore hari 28-30 oC.
3.2 Pembahasan
Identifikasi terhadap bakteri uji dilakukan untuk memastikan bakteri yang
digunakan adalah bakteri A. hydrophila. Hasil pewarnaan Gram dan pengamatan dalam media TSA 1x24 jam menunjukkan bakteri uji memiliki morfologi
cembung, dan tepian halus. Hasil uji biokimiawi dan fisiologi menunjukkan
bakteri bersifat fermentatif, positif terhadap uji motilitas, oksidase dan katalase.
Hasil tersebut sesuai dengan Joseph dan Carnahan (1994) dalam Angka (2005) bahwa karakter isolat yang diidentifikasi adalah A. hydrophila.
Sebelum digunakan untuk uji tantang, dilakukan terlebih dahulu Postulat
Koch dan Uji LD50. Postulat Koch bertujuan untuk menguji virulensi bakteri uji.
Selain itu Postulat Koch juga dilakukan untuk mengidentifikasi bakteri patogen
melalui gejala penyakit yang ditimbulkannya (Yulinda et. al, 2010). LD50 adalah
jumlah yang diharapkan dapat menyebabkan kematian pada setengah (50%) dari
populasi dari beberapa spesies hewan tertentu, ketika memasuki tubuh hewan
dengan rute tertentu (EHSC, 2001). Berdasarkan hasil Uji LD50 konsentrasi
bakteri A. hydrophila yang digunakan adalah 108 cfu/ml. Dalam kurun waktu 7 hari, konsentrasi 108 mampu mematikan ikan sebanyak 66,67% (Lampiran 1).
Perlakuan K- memiliki nilai kelangsungan hidup sebesar 100±0,00%
karena hanya diinjeksi PBS. Perlakuan A (21 hari) 93,3±11,55%, dan perlakuan B
(14 hari) 73,33±30,55%. Sedangkan perlakuan K+ dan C (7 hari) memiliki nilai
kelangsungan hidup yang sama yaitu, 26,67±11,55%. Hal ini menunjukkan
pemberian pakan uji selama 21 hari mampu meningkatkan kelangsungan hidup
ikan uji. Pemberian pakan uji selama 21 hari merupakan lama pemberian yang
optimum untuk mencegah infeksi A. hydrophila. Tingginya kelangsungan hidup ikan perlakuan A dapat disebabkan meniran dan bawang putih yang tepat dosisnya
dalam kombinasi ramuan, adanya efek dari kombinasi bahan yang bersifat saling
melengkapi, dan lama pemberian pakan uji yang tepat berefek positif terhadap
kelangsungan hidup ikan.
Tingginya kelangsungan hidup pada perlakuan A dapat disebabkan
antibakteri pada tubuh ikan bekerja dengan baik melawan bakteri sehingga bakteri
tidak mampu berkembang biak. Allicin yang terkandung dalam bawang putih
mampu menghambat pertumbuhan atau perkembangbiakkan bakteri A.
hydrophila. Sebagaimana disebutkan oleh Feldberg (1988) aktivitas allicin
berperan sebagai antimikroba dengan menghambat sintesis RNA, meskipun DNA
dan sintesis protein juga sebagian terhambat, RNA merupakan target utama
kurang maka sintesis protein akan sangat terpengaruh. Hal ini akan berpengaruh
kepada semua tahapan karena tidak adanya messenger RNA, ribosom RNA dan
transfer RNA. Jika asam amino dan protein tidak dapat dihasilkan maka
pertumbuhan dan perkembangan organisme tidak akan terjadi karena mereka
sangat penting untuk semua bagian struktur sel. Efek utama adalah bilayer
fosfolipid dari dinding sel tidak dapat terbentuk dengan benar pada kedua bakteri,
Gram positif dan Gram negatif. Semua hal yang berkontribusi terhadap bakteri
tidak dapat tumbuh dengan adanya allicin (Durairaj et. al, 2009). Bawang putih selain berfungsi sebagai antimikroba juga berfungsi sebagai perangsang kekebalan
tubuh, dapat merangsang sistem makrofag, sel darah putih yang menghancurkan
organisme asing dan meningkatkan sel helper (Derrida, 2003 dalam Mathew dan Titus, 2009). Mekanisme kerja dari antibakteri dapat dikelompokkan menjadi (1)
menghambat sintesis dinding sel bakteri, (2) menghambat keutuhan permeabilitas
dinding sel bakteri, (3) menghambat sintesis protein sel bakteri, dan (4)
menghambat sintesis asam nukleat (Sufriadi, 2006).
Analisis fitokimia ekstrak meniran menunjukkan adanya alkaloid, saponin,
tanin, flavonoid, karbohidrat dan glikosida (Okloi et al., 2009). Flavonoid merupakan senyawa antikanker dan antioksidan sebagaimana disebutkan oleh
Arima et al. (2002) flavonoid merupakan metabolit sekunder mengandung banyak quercetin berfungsi sebagai teraputik, khususnya antibakteria, antiradang,
antialergi, antiviral, antitumor, dapat menghambat pertumbuhan bakteri
pembunuh spora dan menghambat produksi enterotoksin.Meniran dikenal sebagai
imunostimulan yang baik. Imunostimulan merupakan senyawa kimia, obat, atau
bahan lain yang mampu meningkatkan respons imun spesifik dan non spesifik
ikan (Anderson, 1992 dalam Suryati, 2010). Ikan yang diberikan imunostimulan biasanya menunjukkan aktivitas sel fagositik. Imunostimulan meningkatkan daya
tahan terhadap penyakit infeksi, bukan karena meningkatnya respons imun
spesifik tetapi oleh meningkatnya mekanisme pertahanan non-spesifik (Sakai,
1999 dalam Suryati, 2010).
Kelangsungan hidup pada penelitian ini lebih tinggi dibandingkan dengan
dengan metode yang berbeda. Hasil penelitian yang sama dengan metode yang
berbeda dapat dilihat pada Tabel 3.
Tabel 3. Hasil penelitian yang telah dilakukan dengan metode berbeda
Bentuk bahan
Penyuntikkan 14 hari 73,33±11,55% Ayuningtyas
(2008)
14 hari 58,33±21,52% Sholikhah
(2009) Tepung meniran
dan bawang putih
2,1% (1:2) Formulasi dalam
pakan
14 hari 60±20% Kurniawan
(2010) Tepung meniran
dan bawang putih
2,1% (1:2) Formulasi dalam
pakan
14 hari 66,67±11,55% Sartika
(2011) Tepung meniran
dan bawang putih
2,1% (1:2) Formulasi dalam
pakan
21 hari 93,33±11,54% Penelitian ini
Kelangsungan hidup yang tinggi pada penelitian ini dapat disebabkan
pemberian pakan mengandung tepung meniran dan bawang putih dalam waktu
yang lebih lama yang mengakibatkan jumlah pakan uji yang dimakan oleh ikan
lebih banyak. Tingginya jumlah pakan uji berbanding lurus dengan jumlah
fitofarmaka (meniran dan bawang putih) yang masuk ke dalam tubuh ikan.
Semakin banyak meniran dan bawang putih maka zat antibakteri dan zat aktif lain
yang terkandung juga semakin tinggi. Hal ini sesuai dengan pernyataan Agustina
(2011) semakin banyak volume bahan yang digunakan maka antibakteri yang
terkandung juga semakin tinggi. Pemberian pakan uji yang cukup lama juga dapat
berpengaruh terhadap penyerapan zat aktif terutama antibakteri oleh tubuh lebih
banyak sehingga pembentukan kekebalan tubuh ikan lebih maksimal. Namun
pemberian pakan uji yang terlalu berlebihan diduga dapat memberikan pengaruh
yang negatif karena dapat bersifat toksik dan berbahaya bagi ikan uji. Metode
repelleting yang digunakan pada penelitian ini lebih praktis dan efektif dibandingkan dengan metode penyuntikkan langsung pada ikan dan metode spray
pada pakan. Metode repelleting lebih memudahkan dalam pemberian pakan pada ikan, selain itu pakan dapat disimpan dalam waktu yang relatif lama.
Penelitian yang sama dengan Marwa (2010) yaitu pemberian ekstrak
bawang putih dalam pakan untuk mencegah penyakit Koi Herves Virus pada ikan mas dengan lama pemberian yang sama yaitu 21 hari menghasilkan nilai
pemberian pakan uji selama 21 hari merupakan lama pemberian yang optimum
untuk mencegah infeksi A. hydrophila.
Berdasarkan jumlah pakan yang dihabiskan selama perlakuan, perlakuan
K- memiliki respons makan terbaik, dengan jumlah pakan yang dihabiskan
39,59±0,64 gram. Jumlah pakan yang dihabiskan pada perlakuan K+ tidak berbeda
nyata dengan perlakuan K- yaitu, 38,61±2,00 gram. Perlakuan B (14 hari)
memiliki respons makan terendah, dengan jumlah pakan yang dihabiskan
35,07±2,35 gram. Jumlah pakan yang dihabiskan perlakuan A (21 hari) dan C (7
hari), masing-masing 36,80±0,88 dan 35,89±1,86 gram. Berdasarkan hasil uji
statistik (Lampiran 2), perlakuan A tidak berbeda nyata dengan semua perlakuan,
perlakuan B berbeda nyata dengan perlakuan K- dan K+, dan perlakuan C berbeda
nyata dengan perlakuan K-. Jumlah pakan pada perlakuan A, B, dan C tidak
berbeda nyata. Hal ini menunjukkan perbedaan lama pemberian tepung meniran
dan bawang putih dalam pakan tidak memberikan pengaruh yang berbeda nyata
terhadap respons makan.
Tingginya jumlah pakan yang dihabiskan perlakuan K+ dan K- disebabkan
tidak adanya pemberian pakan mengandung tepung meniran dan bawang putih
yang membutuhkan proses pengadaptasian dari ikan yang menyebabkan
penurunan respons makan pada saat proses pengadaptasian tersebut. Secara umum
pada semua perlakuan mengalami peningkatan respons makan setiap harinya,
kecuali pada perlakuan A, B, dan C mengalami penurunan pada saat proses
pengadaptasian. Perlakuan A, B, dan C rata-rata membutuhkan waktu 3-4 hari
untuk dapat beradaptasi terhadap pergantian pakan dari pakan komersil ke pakan
uji. Waktu pengadaptasian yang cukup lama tersebut mengakibatkan penurunan
jumlah pakan total selama 21 hari perlakuan.
Respons makan pasca infeksi A. hydrophila juga diamati selama 10 hari. Ikan uji pada semua perlakuan mengalami penurunan nafsu makan pasca infeksi.
Penurunan nafsu makan tersebut disebabkan ikan stress akibat handling dan penyuntikkan. Penurunan nafsu makan pada perlakuan pasca infeksi A. hydrophila
rendah. Ikan lele perlakuan K- memiliki respons makan terbaik pasca infeksi
karena hanya diinjeksi PBS. Ikan perlakuan A memiliki respons makan yang lebih
baik pasca infeksi dibandingkan ikan lele perlakuan K+, B, dan C. Hal ini dapat
disebabkan penurunan nafsu makan akibat infeksi A. hydrophila tidak terjadi berlarut-larut. Hal tersebut terbukti ikan lele perlakuan A sudah mulai merespons
dengan cukup baik pakan yang diberikan pada hari ke-4 (Lampiran 4).
Respons makan yang cukup tinggi pada semua perlakuan berpengaruh
terhadap pertumbuhan relatif ikan. Pertumbuhan relatif paling tinggi terdapat pada
perlakuan K+ yaitu sebesar 27,43%±2,06%. Hal ini berbanding lurus dengan
jumlah pakan yang dihabiskan oleh perlakuan K+ yang tinggi. Pertumbuhan relatif
perlakuan K- tidak berbeda nyata dengan perlakuan K+, yaitu 26,80±2,51%.
Jumlah pakan uji A, B, dan C yang tidak berbeda nyata diikuti dengan
pertumbuhan relatif perlakuan A, B dan C yang tidak berbeda nyata pula. Hal ini
menunjukkan perbedaan lama pemberian pakan mengandung tepung meniran dan
bawang putih yang berbeda tidak memberikan pengaruh yang berbeda nyata
terhadap jumlah pakan dan pertumbuhan relatif. Hal ini juga menunjukkan
kombinasi pakan komersil dan pakan uji yang berbeda dalam waktu 21 hari pada
perlakuan A, B, dan C tidak mempengaruhi secara beda nyata terhadap jumlah
pakan dan pertumbuhan relatif. Dapat disimpulkan pakan mengandung tepung
meniran dan bawang putih dapat diterima sama baiknya dengan pakan komersil
oleh ikan uji perlakuan A, B, dan C.
Perlakuan A memiliki pertumbuhan relatif paling tinggi dibandingkan
dengan perlakuan B dan C yaitu sebesar 24,69±3,03%. Tingginya pertumbuhan
relatif pada perlakuan A dapat disebabkan jumlah pakan mengandung tepung
meniran dan bawang putih yang dikonsumsi lebih banyak karena pemberiannya
lebih lama yaitu 21 hari. Hal ini mengakibatkan jumlah meniran dan bawang putih
yang terserap oleh tubuh ikan juga lebih banyak. Pemberian pakan mengandung
tepung meniran dan bawang putih dapat meningkatkan pertumbuhan karena
kandungan zat anti bakteri (allicin) dalam bawang putih dapat melisiskan racun yang menempel pada dinding usus, sehingga penyerapan zat nutrisi menjadi lebih
baik (Agustina, 2011). Flavonoid yang terkandung dalam meniran juga diketahui
Mekanisme flavonoid sebagai kontrol hormon pada pertumbuhan diduga
berhubungan dengan kemampuannya merangsang kelenjar prosimal pars distalis
mensekresi hormon pertumbuhan (somatotropin) (Abdullah, 2008). Menurut
Zairin (2003) hormon somatotropin mampu merangsang pertumbuhan dan
metabolisme, meningkatkan nafsu makan, mencegah kerusakan hati dan terbukti
memiliki sifat imunostimulatori pada sel-sel imuno kompeten serta meningkatkan
aktivitas makrofag dan aktivitas hemolitik pada serum ikan.
Uji tantang dilakukan dengan menggunakan bakteri yang sudah dipastikan
A. hydrophila dengan kepadatan yang diperoleh pada uji LD50 yaitu 108 cfu/ml.
Uji tantang dilakukan untuk mengetahui pengaruh lama pemberian pakan
mengandung tepung meniran dan bawang putih terhadap kelangsungan hidup ikan
lele. Setelah dilakukan uji tantang, muncul gejala klinis pada semua ikan uji,
kecuali pada perlakuan K- tidak menunjukkan gejala klinis karena hanya diinjeksi
PBS 0,1 ml/ekor. Gejala klinis yang muncul yaitu hiperemia di bagian perut,
terbentuknya radang, haemoragi, dan tukak pada tempat bekas suntikan, sirip
punggung rusak, dan sirip ekor rusak. Selain itu, ikan terlihat lemah dan nafsu
makan menurun. Gejala klinis yang muncul tersebut sesuai dengan gejala klinis
yang seharusnya muncul pada ikan yang terinfeksi A. hydrophila. Ikan yang terinfeksi A. hydrophila menunjukkan gejala yaitu kematian mendadak pada ikan yang sehat, kurangnya nafsu makan, kelainan berenang, insang pucat, tukak pada
kulit (Swann dan White, 1989), ekor atau sirip membusuk, haemoragi (Cipriano,
2001), sirip ekor, dada, dan perut rusak, ikan lemah, dan pada permukaan tubuh
terdapat bagian-bagian yang berwarna merah (Maulina et al, 2006).
Hiperemia adalah kenaikkan jumlah darah dari sistem sirkulasi dan
timbulnya hiperemia merupakan mekanisme tubuh untuk manambah nutrisi dan
oksigen yang dibutuhkan jaringan tubuh bila laju metabolisme meningkat saat
tubuh mengadakan perlawanan terhadap antigen yang masuk setelah infeksi
(Runnels et al, 1965 dalam Abdullah, 2008). Hiperemia dibagian perut terjadi pada ikan lele perlakuan B ulangan 3 tag C4 pada jam ke-7 pasca infeksi. Gejala klinis berupa radang muncul pada jam ke-7 pasca infeksi A. hydrophila. Haemoragi pada sebagian besar ikan uji terbentuk pada hari ke-1 pasca infeksi.
ulangan 3, 2 ekor dan perlakuan C ulangan 2, 1 ekor. Kematian yang sangat cepat
tersebut dipastikan akibat infeksi A. hydrophila bukan karena handling ataupun penyuntikkan. Hal tersebut dibuktikan pada jam ke-7 pasca infeksi sudah
terbentuk radang. Selain itu, ikan yang terserang A. hydrophila dapat mati secara mendadak. Sebagaimana disebutkan oleh Swann dan White (1989) ikan yang
terinfeksi A. hydrophila dapat mengalami kematian mendadak. Kematian ikan tertinggi terjadi pada hari ke-2 pada perlakuan C sebanyak 6 ekor, dan perlakuan
K+ sebanyak 4 ekor. Kematian yang tinggi pada perlakuan C dan K+ menunjukkan
bakteri A. hydrophila dapat mencapai puncak infeksi cukup maksimal hal tersebut diduga pada perlakuan C bahan antibakteri tidak bekerja dengan maksimal
sehingga tidak dapat meningkatkan ketahanan ikan terhadap penyakit infeksi,
sedangkan pada perlakuan K+ tidak ada bahan yang dapat meningkatkan
ketahanan ikan terhadap penyakit infeksi seperti pada perlakuan A, B, dan C.
Kematian ikan tidak terjadi lagi dari hari ke-7 sampai hari ke-10 pasca infeksi.
Proses penyembuhan luka pada sebagian ikan uji mulai terjadi pada hari
ke-4, dan mengalami penyembuhan pada hari ke-5 sampai hari ke-10 meskipun
masih meninggalkan bekas luka. Diameter tukak yang berubah dari besar menjadi
kecil merupakan salah satu indikator penyembuhan luka. Persentase penyembuhan
luka terbesar dimiliki oleh perlakuan B yaitu sebesar 16,67±0,00%/hari.
Persentase penyembuhan luka untuk perlakuan A, C dan K+ berturut-turut
15,63±2,08%/hari, 9,93±2,05%/hari dan 14,43±6,25%/hari. Namun, persentase
penyembuhan luka tidak berkorelasi positif terhadap kelangsungan hidup ikan
lele, artinya persentase penyembuhan luka yang tinggi belum tentu menghasilkan
nilai kelangsungan hidup yang tinggi pula. Luka yang terbentuk mengalami
penyembuhan karena adanya kekebalan tubuh alami pada ikan dan kandungan
Vitamin C dalam pakan yang dapat berperan dalam penyembuhan luka. Selain itu
pada ikan uji perlakuan A, B dan C penyembuhan luka juga disebabkan
kandungan meniran dalam pakan uji dapat membantu dalam penyembuhan luka,
berfungsi sebagai anti ulcerogenik dan antiamnestic (Okloi et al., 2009)
Ikan uji perlakuan A sebagian besar mengalami peradangan pada jam ke-7
C1 dan pa, dan ulangan 3 tag C3 yang mengalami fase haemoragi. Perlakuan A mencapai luka maksimal sebesar 0,9 cm. Rata-rata luka yang terbentuk hanya 0,1
cm. Ikan uji perlakuan B sebagian kecil masih memiliki tukak dengan diameter
kecil pada hari ke-10. Hal ini disebabkan tukak yang terbentuk cukup besar.
Selain itu, terdapat tukak yang baru terbentuk pada hari ke-7 seperti pada ikan
perlakuan B ulangan 2 tag C3, sehingga pada hari ke-10 tukak tersebut belum sembuh.
Pengamatan organ dalam dilakukan pada akhir perlakuan. Kondisi organ
dalam ikan perlakuan K- yang hanya diinjeksi PBS sedikit berbeda dengan organ
dalam perlakuan yang diinfeksi A. hydrophila. Perlakuan K- memiliki kondisi organ dalam yang normal yaitu, warna hati merah kecoklatan, empedu hijau
kekuningan, limpa merah kehitaman dan ginjal merah tua. Perlakuan K+ memiliki
warna hati dan ginjal yang berbeda dengan K- yaitu, warna hati dan ginjal merah
pucat. Perlakuan A (21 hari), B (14 hari), dan C (7 hari) memiliki organ dalam
yang hampir sama dengan perlakuan K-. Namun, terdapat sedikit perbedaan
dengan perlakuan K-, yaitu perlakuan B memiliki warna limpa merah tua, dan
perlakuan C memiliki warna ginjal merah pucat. Menurut Bullock et al. (1971)
dalam Angka (2005) gejala klinis yang ditunjukkan oleh ikan sakit akibat infeksi
A. hydrophila yaitu tukak berwarna merah tua keabuan, radang diginjal, hati berwarna pucat dan kehijauan, dan hemoragi di usus. Menurut Swann dan White
(1989) organ dalam yang terpengaruh pada saat ikan terinfeksi A. hydrophila yaitu insang, ginjal, hati, limpa, pankreas, dan rangka otot.
Kualitas air harus diperhatikan karena kualitas air yang buruk dapat
berpengaruh terhadap kelangsungan hidup ikan uji. Sehingga dikhawatirkan ikan
yang mati disebabkan oleh kualitas air yang buruk bukan karena infeksi A. hydrophila. Kualitas air selama pemeliharaan (Tabel 3) tetap terkontrol dan masih sesuai dengan persyaratan hidup ikan lele. Kisaran suhu selama pemeliharaan
masih berada dalam kisaran normal untuk ikan lele dumbo yaitu 25-30 oC.
Menurut KKP (2010b) benih ikan lele dapat hidup dengan baik pada suhu media
pemeliharaan berkisar 26-30 oC. Kisaran toleransi kualitas air untuk ikan lele
yaitu, nilai pH 6,5-9 dan nilai DO > 3 ppm (Amri dan Khairuman, 2006), nilai
IV.
KESIMPULAN DAN SARAN
4.1 Kesimpulan
Kombinasi meniran dan bawang putih efektif untuk mencegah infeksi A. hydrophila. Lama pemberian pakan mengandung tepung meniran dan bawang putih yang optimum untuk mencegah infeksi A. hydrophila yaitu 21 hari dengan nilai kelangsungan hidup 93,33±11,54%
4.2 Saran
Perlu dilakukan penelitian lanjutan untuk menentukan waktu optimal
bahan aktif pada bawang putih dan meniran bertahan dalam pakan, agar dapat
ditentukan batas penyimpanan pakan yang sesuai.
DAFTAR PUSTAKA
Abdullah W. 2006. Efektivitas Ekstrak Daun Paci-Paci Leucas lavandulaefolia
untuk Pencegahan dan Pengobatan Infeksi Penyakit MAS Motile
Aeromonad Septicaemia Ditinjau dari Patologi Makro dan Hematologi Ikan Lele Dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Afrianto E., Liviawaty E. 2005. Pakan Ikan dan Perkembangannya. Kanisius. Yogyakarta.
Agustina L. 2011. Penggunaan Ramuan Herbal sebagai Feed Additif untuk Meningkatkan Performans Broiler. Lokakarya Nasional. Fakultas Peternakan. Universitas Hasanudin. Makassar.
Amri K., Khairuman S.P. 2006. Budidaya Lele Dumbo secara Intensif. Agromedai Pustaka. Jakarta.
Angka S.L. 2005. Kajian Penyakit Motile Aeromonad Septicaemia (MAS) pada Ikan Lele Dumbo Clarias sp. : Patologi, Pencegahan dan Pengobatannya dengan Fitofarmaka. [Disertasi]. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor.
Anonim. 2003. Budidaya Lele. http://www.dkp.go.id. [11 Maret 2009]
Arima H., Ashida H., Danno G. 2002. Rutin-enanched Antibacterial Activities of Flavonoids Against Bacillus cereus and Salmonella enteritidis. Biosci, Biotechnol, Biochem. 66 (5):1009-1014
Ayuningtyas A.K. 2008. Efektivitas Campuran Meniran Phyllanthus niruri dan Bawang Putih Allium sativum untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Cipriano R.C. 2001. Aeromonas hydrophila and Motile Aeromonad Septicaemia
of Fish. Fish Disease Leaflet 68, US. Fish and Wildlife Service Division of Fishery Research Washington, D. C. 20240.
Durairaj S., Srinivasan S., Lakshmanaperumalsamy P. 2009. In vitro Antibacterial Activity and Stability of Garlic Extract at Different pH and Temperature. Electronic Journal of Biology. 5(1): 5-10
Effendi, I., 2004. Pengantar Akuakultur. Penebar Swadaya, Depok.
EHSC [Environment, Health and Safety Committee]. 2001. LD50 (Lethal Dose
Feldberg R.S. Chang S.C., Kotik A.N., Nadler M., Neurwirth Z., Sundstrom D.C., Thompson N.H. 1988. In Vitro Mechanisme of Inhibition of Bacteria Cell Growth by Allicin. Antimicrob Agents and Chemotherapy. 32: 1763-1768. KKP [Kementrian Kelautan dan Perikanan]. 2010a. Ibu Ani Ajari Anak Cucu
Gemari Ikan Lele. http://www.perikanan-budidaya.kkp.go.id. [15 Juli 2011].
KKP [Kementrian Kelautan dan Perikanan]. 2010b. Budidaya Lele Dumbo.
http://www.perikanan-budidaya.kkp.go.id. [15 Juli 2011].
Kurniawan D. 2010. Efektivitas Campuran Meniran Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp.[Skripsi] Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Lemar K.M., Passa O., Aon M.A. Cortassa S., Muller C.T., Plummer S., O’Rourke B., Llyold D. 2005. Allyl Alcohol and Garlic (Allium sativum) Extract Produce Oxidatif Stress in Candida albicans. Microbiology, 151, 3257–3265.
Marwa K. 2010. Lama Pemberian Ekstrak Bawang Putih Allium sativum yang Optimum pada Pakan untuk Mencegah Penyakit Koi Herves Virus (KHV) pada Ikan Mas Cyprinus carpio. [Skripsi] Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Maulina I., Kiki H., Junianto. 2006. Pengaruh Meniran dalam Pakan untuk Mencegah Infeksi Bakteri Aeromonas sp. pada Benih Ikan Mas (Cyprinus carpio). Fakultas Perikanan dan Ilmu Kelautan. Universitas Padjajaran. Bandung.
Mathew, Titus. 2009. Efficacy of Allium sativum (Garlic) Bulbs Extracts on Some Enteric (Pathogenic) Bacteria. New York Science Journal. 2(6), ISSN 1554-0200.
Okoli C.O., Ezike A.C., Akah P.A. Udegbunam S.O., Okoye T.C., Mbanu T.P., Ugwu E. 2009. Studies on Wound Healing and Antiulcer Activities of Extract of Aerial Parts of Phyllanthus niruri L. (Euphorbiaceae). American Journal of Pharmacology and Toxicology. 4 (4): 118-126
Sholikhah E.H. 2009. Efektivitas Campuran Meniran Phyllanthus niruri dan Bawang Putih Allium sativum dalam Pakan untuk Pengendalian Infeksi Bakteri Aeromonas Hydrophila pada Ikan Lele Dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Sartika Y. 2011. Efektivitas Fitofarmaka dalam Pakan untuk Pencegahan Infeksi Bakteri Aeromonas Hydrophila pada Ikan Lele Dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Sufriadi A. 2006. Manfaat Daun Kayu Manis (Cinnamomum burmanni) terhadap Khasiat Antioksidan Mahkota Dewa (Phaleria macrocarpa (Scheff.) Boerl) selama Penyimpanan. [Skripsi]. Program Studi Biokimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Sulastry F. 2009. Uji Toksisitas Akut yang Diukur dengan Penentuan LD50
Ekstrak Daun Pegagan (Centella asiatica (L.) Urban) terhadap Mencit Balb/C. [Skripsi]. Fakultas Kedokteran. Universitas Diponogoro. Semarang.
Suryati. 2010. Pemberian Kappa-Karaginan untuk Meningkatkan Respons Imun Non-Spesifik dan Resistensi Penyakit pada Ikan Lele Dumbo Clarias sp. [Tesis]. Sekolah Pasca Sarjana. Institut Pertanian Bogor. Bogor.
Swann, L., White, R.M., 1989. Diagnosis and treatment of Aeromonas hydrophila
Infection of Fish. Aquaculture Extension. Purdue University.
Yulinda A.R., Ilyas S., Kadir T.S. 2008. Pengaruh Perlakuan Matriconditioning Plus Bakterisida Sintetis atau Nabati untuk Mengendalikan Hawar Daun Bakteri Terbawa Benih serta Meningkatkan Viabilitas dan Vigor Benih Padi. Makalah Seminar. Departemen Agronomi dan Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor
Zairin M.Jr. 2003. Endokrinologi dan Peranannya bagi Masa Depan Perikanan Indonesia. Orasi Ilmiah. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor 70 hlm.
Lampiran 1. Perhitungan nilai LD50
Kepadatan
bakteri Mati Hidup
Akumulasi
Mati Hidup Rasio kematian %
1010 5 0 14 0 14/14 100
109 5 0 9 0 9/9 100
108 3 2 4 2 4/6 66,67
107 1 4 1 6 1/7 14,29
106 0 5 0 11 0/11 0
Kematian di atas 50% - 50
Selang Proporsi =
Kematian di atas 50% - Kematian di bawah 50%
66,67 – 50 =
66,67 – 14,29
= 0,318
Log Negatif LD50 = - log negatif konsentrasi di atas 50% + selang proporsi
= - log 108 + 0,318
= - 8 + 0,318
= -7,682
Log LD50 = 7,682
LD50 = 107,682
Lampiran 2. Analisis statistik respons makan
Jumlah Rata-rata Standar Deviasi
K+ 3 38.6167 2.00909
P value < α maka terima H1 dan dilakukan Uji Lanjut dengan Uji Duncan
Uji Duncan
Perlakuan Jumlah Kelompok pada galat = 0.05
1 2 3
* perlakuan A tidak berbeda nyata dengan semua perlakuan. Perlakuan B berbeda
nyata dengan perlakuan K+ dan K-, dan perlakuan C berbeda nyata dengan
perlakuan K-.
Keterangan: K- = kontrol negatif
Lampiran 3. Analisis statistik pertumbuhan relatif
Jumlah Rata-rata Standar Deviasi
K+ 3 27.4300 2.05643
P value < α maka terima H1 dan dilakukan Uji Lanjut dengan Uji Duncan
Uji Duncan
Perlakuan Jumlah Kelompok pada galat = 0.05
1 2
* Perlakuan A tidak berbeda nyata dengan semua perlakuan. Perlakuan B dan C
berbeda nyata dengan perlakuan K+ dan K-.
Keterangan: K- = kontrol negatif
K+ = kontrol positif
A = 21 hari B = 14 hari
C = 7 hari
Lampiran 4. Respons makan pasca infeksi A. hydrophila
Perlakuan H1 H2 H3 H4 H5 H6 H7 H8 H9 H10
K+U1 0 0,04 0,12 0,14 0,19 0,22 0,31 0,23 0,31 0,34
K+U2 0 0,11 0,19 0,14 0,23 0,25 0,22 0,29 0,31 0,31
K+U3 0 0,10 0,14 0,27 0,21 0,25 0,23 0,28 0,22 0,22
K-U1 0 0,25 0,36 0,58 0,56 0,50 0,55 0,47 0,48 0,55
K- U2 0 0,19 0,29 0,39 0,44 0,56 0,55 0,50 0,51 0,52
K-U3 0 0,27 0,30 0,38 0,37 0,41 0,56 0,53 0,53 0,56
AU1 0 0,07 0,16 0,25 0,30 0,39 0,38 0,42 0,40 0,40
AU2 0 0,10 0,19 0,22 0,26 0,40 0,33 0,42 0,47 0,53
AU3 0 0,06 0,15 0,27 0,33 0,34 0,38 0,38 0,40 0,45
BU1 0 0,10 0,09 0,07 0,11 0,19 0,25 0,33 0,36 0,38
BU2 0 0,10 0,15 0,11 0,13 0,20 0,23 0,22 0,30 0,33
BU3 0 0,16 0,17 0,19 0,16 0,23 0,19 0,17 0,21 0,20
CU1 0 0,10 0,12 0,17 0,22 0,18 0,22 0,22 0,24 0,22
CU2 0 0,08 0,14 0,15 0,11 0,18 0,21 0,26 0,22 0,25
CU3 0 0,08 0,13 0,12 0,18 0,14 0,21 0,19 0,24 0,22
Keterangan: K- = kontrol negatif K+ = kontrol positif
A = 21 hari B = 14 hari
C = 7 hari
U1 = ulangan 1
U2 = ulangan 2
Lampiran 6 Gejala klinis setiap perlakuan
Perlakuan Tag H0 H1 H2 H3 H4 H5 H6 H7 H8 H9 H10
A1
Pa R 0,5 R 0,5 T 0,2 T 0,2 T 0,2 T 0,1 T 0,1 T 0,1 T 0,05 SBH
Pi R 0,3 R 0,3 T 0,1 T 0,1 T 0,1 T 0,1 SBH
C1 R 0,3 R 0,5 R 0,5 R 0,3 R 0,1 SBH
C2 NO R 0,2 R 0,3 T 0,1 T 0,1 T 0,1 SBH
C3 R 0,7 R 0,7 R 0,7 R 0,5 T 0,1 T 0,1 T 0,1 SBH
A2
Pa R 0,7 H 0,8 T 0,9 T 0,8 T 0,8 T 0,7 T 0,6 T 0,4 T 0,3 T 0,2 T 0,2
Pi R 0,6 H 0,3 T 0,2 T 0,2 T 0,2 T 0,1 T 0,1 T 0,1 T 0,05 SBH
C1 R 1 R 1 R 0,7 T 0,1 T 0,1 T 0,1 T 0,1 T 0,1 SBH
C2 NO NO R 0,2 R 0,2 T 0,1 T 0,1 T 0,05 SBH
C3 R 1,1 R 0,7 T 0,6 T 0,6 T 0,6 T 0,5 MATI
A3
Pa R 0,9 R 0,5 R 0,5 T 0,1 T 0,1 T 0,1 T 0,05 SBH
Pi R 1,5 R 1 R 0,9 R 0,6 T 0,1 T 0,1 T 0,1 T ,01 SBH
C1 R 1,5 R 1 T 0,1 T 0,1 T 0,1 T 0,1 T 0,1 SBH
C2 R 1,1 R 0,8 R 0,5 R 0,5 R 0,5 R 0,3 R 0,1 SBH
C3 R 1 H 0,5 T 0,3 T 0,3 T 0,2 T 0,2 T 0,1 T 0,1 T 0,1 SBH
Keterangan:
Lanjutan lampiran 6
Lanjutan lampiran 6
Perlakuan Tag H0 H1 H2 H3 H4 H5 H6 H7 H8 H9 H10