Oleh
TRI AGUSTINA
(Skripsi)
Sebagai Salah Satu Sarat Untuk Mencapai Gelar SARJANA PERIKANAN
Pada
Program Studi Budidaya Perairan Fakultas Pertanian Universitas Lampung
PROGRAM STUDI BUDIDAYA PERAIRAN FAKULTAS PERTANIAN
Oleh
Tri Agustina
Penelitian dilakukan untuk mengetahui kepadatan dan kandungan lemak total (crude lipid) Brachiounus plicatilis yang diberi Nannochloropsis sp dengan
perlakuan MES (Micro Environmental Stress). Penelitian telah dilakukan pada
bulan Oktober-November 2012 di Laboratorium Zooplankton Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung. Penelitian terdiri atas empat
perlakuan dan tiga ulangan.Nannochlororpsis sp dengan perlakuan MES tersebut
diberikan kepada B. plicatilis dengan rasio perbandingan 50 sel/ml : 1 ind/ml.
Pemberian pakan Nannochloropsis sp dilakukan sebanyak dua kali yaitu pada
pukul 09.00 WIB dan 15.00 WIB. Pengujian proksimat lemak total (crude lipid)
dilakukan dengan metode soxhlet di Laboratorium THP Politeknik Negeri Lampung. Data dianalisis dengan metode Chi Square. Hasil penelitian menunjukkan MES berpengaruh nyata terhadap kepadatan tetapi tidak
berpengaruh terhadap kandungan lemak total (crude lipid) B. plicatilis.Hubungan
regresi antar kepadatan dan kandungan lemak total cenderung linear negatif dan bersifat lemah.
KATA PENGANTAR ... i
DAFTAR ISI... ii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan... 3
1.3. Manfaat Penelitian... 4
1.4. Perumusan Masalah... 4
1.5. Hipotesis ... 7
II. TINJAUAN PUSTAKA 2.1. Bio-ekologi Rotifer (Brachionus plicatilis) ... 8
2.1.1. Klasifikasi dan Identifikasi... 8
2.1.2. Habitat dan Penyebaran... 10
2.1.3. Reproduksi... 10
2.1.4. Pemanfaatan Rotifer Bagi Larva Ikan... 12
2.1.5. Faktor Pembatas... ... 12
2.2. Bio-ekologi MikroalgaNannochloropsissp ... 14
2.2.1. Morfologi dan Klasifikasi ... ... 14
2.2.2. Habitat dan Penyebaran... 15
2.2.3. Faktor Pembatas... ... 16
2.2.4. Fase Pertumbuhan... ... 18
2.3. Lemak... 19
2.3.1. Lemak PadaNannochloropsissp ... ... 21
2.3.2. Lemak Pada Rotifer(Brachionus plicatilis)... 22
III. METODE PENELITIAN 3.1. Waktu dan Tempat ... 24
iii
3.3.1. Persiapan Penelitian ... 25
a. Sterilisasi Ruangan ... 25
b. Sterilisasi Alat ... 25
c. Sterilisasi Media (Air) ... 25
3.4. Penelitian Pendahuluan ... 26
3.5. Rancangan Penelitian ... 27
3.6. Pelaksanaan Penelitian ... 27
3.7. Parameter Pengamatan ... 28
3.7.1. Parameter Utama ... 28
a. Kepadatan Rotifer... 28
b. Uji Proksimat Lemak ... 29
3.7.2. Parameter Pendukung... 29
3.8. Analisis Data ... 29
IV. HASIL DAN PEMBAHASAN 4.1. KepadatanB. plicatilis... 32
4.2. Kandungan Lemak Total (Crude Lipid)B. plicatilis... 36
4.3. Hubungan Antara Kepadatan dan Lemak ... 38
4.4. Kualitas Air Pada Media PemeliharaanNannochloropsissp danB. plicatilis... 39
V. KESIMPULAN 5.1. Kesimpulan ... 44
5.2. Saran... 44
I. PENDAHULUAN 1.1 Latar Belakang
Pakan merupakan salah satu input penting dalam budidaya ikan. Pakan
menghabiskan lebih dari setengah biaya produksi dalam kegiatan budidaya ikan.
Dalam kegiatan budidaya ikan, pakan dibagi menjadi dua jenis, pakan buatan dan
pakan alami. Ketersediaan pakan alami sangat penting dalam budidaya ikan pada
fase larva terutama setelah absorbsi kuning telur (fase pendahuluan). Fase
pendahuluan tersebut memerlukan pakan alami yang baik (fitoplankton maupun
zooplankton) (Rukka, 2011).
Salah satu zooplankton yang sering digunakan sebagai pakan alami adalah
Brachionus plicatilis. Zooplankton ini merupakan pakan yang baik untuk larva
ikan karena mempunyai ukuran sangat kecil, kecepatan berenang lambat,
kebiasaan hidup di kolom air, dapat dikultur pada kepadatan tinggi hingga 2000
individu/ml, reproduksi tinggi dengan bereproduksi sepanjang hidup, mudah
diperkaya dengan asam lemak, dan digunakan untuk transfer substansi ke larva
(Rukka, 2011).
Di samping beberapa keunggulan di atas, masih dijumpai permasalahan
dalam kultur B. plicatilis. Permasalahan yang sering dihadapi adalah tingginya
angka kematian pada saat kultur. Hal tersebut diduga karena adanya faktor
lingkungan yang tidak sesuai (Rukka, 2011). Menurut Koesoebiono (1980)dalam
Rukka (2011), kondisi lingkungan dan pakan dalam pemeliharaan organisme
Nannochloropsis sp seringkali dipengaruhi oleh faktor lingkungan. Kondisi
lingkungan yang tidak sesuai menyebabkan pertumbuhan Nannochloropsis sp
sebagai pakan alami B. plicatilis mengalami penurunan kandungan nutrisi, yang
akan berdampak pada penurunan kandungan nutrisi pada B. plicatilis. Menurut
Tamaru et al, (1991) dalam Suminto, (2008), kualitas dan kuantitas B. plicatilis
ditentukan dari jenis dan kualitas pakan yang diberikan. Pakan tersebut
selanjutnya dapat digunakan sebagai sumber nutrisi yang disimpan di dalam tubuh
B. plicatilis.
Beberapa metode pengkayaan Nannochloropsis sp telah dilakukan.
Penambahan vitamin B12pada kultur fitoplankton dapat meningkatkan kepadatan
dan kualitas B. rotundiformis (Sumiarsa et al., 1996). Upaya optimalisasi
pertumbuhan dan komposisi asam lemak Nannochloropsis sp dilakukan dengan
menambahkan karbon ke dalam media kultur Nannochloropsis sp (Hu and Gao,
2003).
Selain dengan pengkayaan, peningkatan kandungan nutrisi
Nannochloropsis sp dapat ditingkatkan dengan Micro Environmental Stress (MES). Secara umum MES merupakan pengkondisian lingkungan kultur di bawah
atau di atas kondisi optimum. Hasil penelitian menunjukkan ternyata dengan
MES, kandungan dan komposisi nutrisi (lemak) Nannochloropsis sp dapat
ditingkatkan (Muhaemin, 2011).
Kandungan lemak total dalam Nannochloropsis oculata sangat
kandungan nutrisi Nannochloropsis oculata(Widianingsih et al., 2011). Salinitas yang tinggi dan kandungan nitrogen yang rendah selama budidaya dapat
meningkatkan kandungan lemak pada Nannchloropsis sebesar 31,45%
(Muhaemin, 2011).
Nutrisi penting yang terkandung dalam B. plicatilis adalah protein,
karbohidrat, dan lemak. Lemak menyediakan energi dua kali lebih besar
dibandingkan protein di dalam tubuh (Sargentet al., 2002dalam Pangkey 2011).
Bagi ikan laut, lemak merupakan sumber nutrisi utama (Froyland et al., 2000;
Sargent et al., 2002; Tocher, 2003 dalam Pangkey, 2011). Lemak digunakan
untuk kebutuhan energi jangka panjang, juga untuk pergerakan atau cadangan
energi selama periode kekurangan makanan (Pangkey, 2011).
Peran penting dan tingginya kebutuhan lemak bagi pertumbuhan larva ikan
memerlukan upaya peningkatan kandungan lemak pada B. plicatilis melalui
pakannya berupa Nannochloropsis sp. Kandungan alami lemak pada
Nannochloropsis sp diharapkan dapat ditingkatkan dengan memodifikasi faktor
lingkungan berupa perlakuan salinitas dan nitrogen. Peningkatan kepadatan dan
kandungan alami lemak pada Nannochloropsis sp selanjutnya diharapkan pula
dapat meningkatkan kepadatan dan kandungan alami lemak padaB. plicatilis.
1.2 Tujuan Penelitian
Tujuan penelitian untuk mengetahui fluktuasi kepadatan dan kandungan
lemak total (crude lipid) pada B. plicatilis setelah diberi pakan Nannochloropsis
Penelitian diharapkan mampu memberikan informasi kepada pengguna
mengenai upaya peningkatan kepadatan dan kandungan lemak total (crude lipid)
padaB. plicatilisdengan pemberian pakanNannochloropsissp.
1.4 Perumusan Masalah
Peningkatan kandungan lemak pada Nannochloropsis sp diharapkan akan
meningkatkan kandungan lemak pada B. plicatilis. Modifikasi faktor lingkungan
pada saat kultur Nannochloropsis sp diharapkan akan berpengaruh terhadap
kepadatan dan kandungan lemak total pada plankton tersebut. Dengan
memanfaatkan mekanisme rantai makanan, perubahan kepadatan dan kandungan
lemak total pada Nannochloropsis sp diharapkan dapat memberikan perubahan
pula pada kepadatan dan kandungan lemak total pada B. plicatilis. Salah satu
metode yang bisa digunakan adalah MES (Micro Environmental Stress).
Penelitian sebelumnya mengenai MES, membuktikan kondisi lingkungan
yang diubah dari kondisi optimal menjadi kondisi lingkungan MES ternyata dapat
meningkatkan salah satu atau beberapa kandungan nutrisi pada fitoplankton.
Penelitian Chiu et al. (2009) menjelaskan pertumbuhan dan kandungan lemak
pada Nannochloropsis oculata meningkat setiap fasenya pada media kultur
dengan konsentrasi CO2 yang berbeda. Krienitz dan Wirth (2006) menyatakan
bahwa kandungan polyunsaturated fatty acid (PUFA) pada Nannochloropsis
limneticameningkat pada kondisi lingkungan kultur tanpa aerasi dan penambahan
K2HPO4 sebanyak 40 mg/L. Penelitian Hu and Gao (2006) menyatakan bahwa
faktor yang diperlukan untuk meningkatkan kandungan EPA. Sedangkan
Muhaemin (2011) menyatakan bahwa salinitas 20% dan nitrogen pada konsentrasi
3 mM terbukti mampu meningkatkan kandungan lemak total sebesar 31,45%.
Pemberian tekanan terhadap lingkungan yang meliputi salinitas, suhu,
fotoperiode, intensitas cahaya dan nutrien dapat mempengaruhi kandungan lipid
total pada mikroalga (Qin, 2005dalamWidianingsihet al.,2011).
Diharapkan pemberian Nannochloropsis sp dengan kondisi kultur tertentu
Gambar 1. Kerangka pikir penelitian Mulai
Modifikasi faktor
lingkungan (MES) pada Nannochloropsissp
• Salinitas
• Nitrogen
Mencapai fase stasioner
Tidak
Ya
Pakan alami untuk B. plicatilis
Analisis kepadatan dan
kandungan lemak totalB.
plicatilis
Selesai
Persiapan Penelitian
1.5 Hipotesis
Hipotesis yang digunakan dalam penelitian ini adalah:
H0 : PemberianNannochloropsissp yang mendapatkan perlakuan
MES tidak memberi pengaruh nyata terhadap kepadatan dan
kandungan lemak total(crude lipid)padaB. plicatilis.
H1 : PemberianNannochloropsissp yang mendapatkan perlakuan
MES memberi pengaruh nyata terhadap kepadatan kandungan lemak
II. TINJAUAN PUSTAKA 2.1 Bio-ekologiBrachionus plicatilis
2.1.1 Klasifikasi dan Identifikasi
Brachionus plicatilis termasuk ke dalam filum Rotifera yang merupakan filum invertebrata. Ada tiga kelas rotifer, yaitu (1) Seisinoidea, (2) Bdelloidea:
kelompok yang menyerupai cacing dan bereproduksi secara aseksual, dan (3)
Monogononta: kelas yang di dalamnya terdapat B. plicatilis,B. calyciflorus, dan B. rubens.
Klasifikasi B. plicatilis menurut Fu et al. (1991) dalam Amali (2005)
adalah sebagai berikut:
Kingdom : Rotifera
Kelas : Monogononta
Ordo : Ploima
Famili : Brachionidae
Sub Famili : Brachioninae
Genus :Brachionus
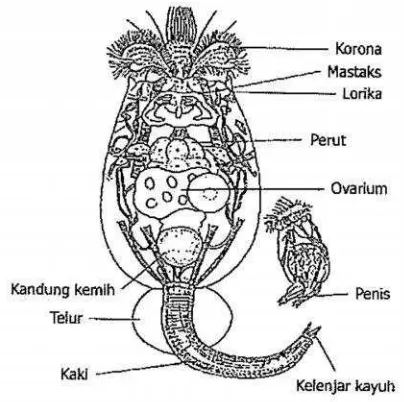
Gambar 2. MorfologiBrachionussp jantan dan betina (Koste, 1980dalamAmali,
2005)
B. plicatilis merupakan salah satu pakan alami yang sering diberikan dalam usaha pembenihan dan cocok bagi larva ikan, mengandung 40-60% protein
dan 13-16& lemak (Lubzens et al., 1989 dalam Aprilia, 2008). B. plicatilis memiliki ukuran tubuh yang kecil (80-120 μ m), bersifat nonselektif filter feeder,
gerakan yang lambat, mudah diklutur, mudah dicerna dan mudah ditingkatkan
kandungan gizinya terutama asam lemaknya (Watanabe, 1988 dalam Aprilia,
2008).
Tubuh B. plicatilis terdiri dari tiga bagian, yaitu kepala (head), badan (trunk), dan kaki atau ekor (foot). Bagian kepala dilengkapi dengan silia yang kelihatan seperti spiral dan disebut korona yang berfungsi untuk memasukkan
B. plicatilis ditemukan di seluruh dunia. Populasi yang berasal dari wilayah geografis berbeda memiliki karakteristik morfologi, fisiologi, dan
perilaku yang benar-benar berbeda. B. plicatilis tersebar di Amerika, Eurazia,
Australia, dan juga Indonesia. B. plicatilis termasuk hewan yang hidupnya
kosmopolitan, dapat ditemukan hampir di semua jenis perairan (Suminto, 2005).
2.1.3 Reproduksi
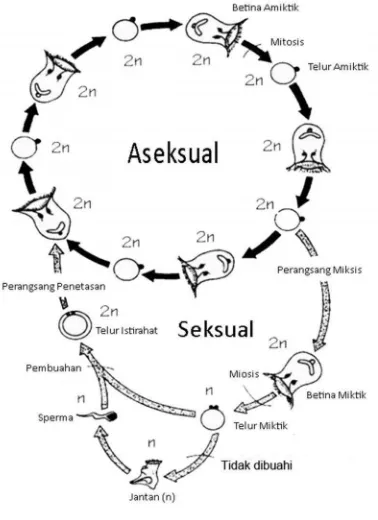
B. plicatilis mempunyai kelamin terpisah, dapat bereproduksi secara
aseksual dengan parthenogenesis yaitu menghasilkan telur tanpa terjadi
pembuahan dan individu baru yang dihasilkan bersifat diploid. Selain secara
aseksual, B. plicatilis juga bereproduksi secara seksual. Pada mulanya betina
miktik mengkasilkan 1-6 telur kecil (50-70 x 80-100 mikron). Betina miktik
adalah betina yang dapat dibuahi. Telur yang dihasilkan oleh betina miktik akan
menetas menjadi jantan. Jantan tersebut akan membuahi betina miktik dan
menghasilkan 1-2 telur istirahat. Telur tersebut mengalami masa istirahat sebelum
menetas menjadi betina amiktik. Betina amiktik adalah betina yang tidak dapat
dibuahi. Dari betina amiktik tersebut maka reproduksi secara aseksual akan terjadi
lagi (Isnansetyo dan Kurniastuty, 1995).
B. plicatilismemiliki masa hidup yang tidak terlalu lama. UsiaB. plicatilis
betina pada suhu 250C adalah antara 6-8 hari sedangkan yang jantan hanya sekitar
2 hari. Meskipun berumur pendek, namun B. plicatilis betina memiliki kapasitas
serta kualitas air yang bagus adalah 20-25 individu baru (Suminto, 2005).
Gambar 3. Partenogenesis dan reproduksi Brachionus plicatilis(Hoff and Snell,
Komposisi biokimia dan nutrisi B. plicatilis untuk larva ikan ditentukan
oleh makanannya. Komposisi nutrisi B. plicatilis didominasi oleh protein. Selain
itu terdapat juga lemak, abu, dan beberapa kandungan logam, dan 18 asam amino.
Zooplankton merupakan sumber pakan yang bagus bagi larva ikan kerena adanya
kandungan asam amino dan tingkat digestabilitas yang tinggi. Kandungan asam
lemak essensial B. plicatilis diketahui sebagai komponen penting yang
mempengaruhi daya tahan larva (Suminto, 2005). Redjeki (1999) menyatakan
pertumbuhan dan kelangsungan hidup larva ikan laut dan udang sangat tergantung
pada kualitasB. plicatilis.
Kualitas B. plicatilis yang diberikan harus mempunyai nutrisi yang sesuai
dengan kebutuhan larva ikan. Peningkatan kandungan nutrisi B. plicatilis dapat
ditingkatkan melalui Nannochloropsis sp karena dianggap sebagai pakan alami
yang dapat memindahkan kandungan nilai gizinya ke larva ikan (Redjeki, 1999).
2.1.5 Faktor Pembatas
Redjeki (1999) menyatakan pertumbuhan B. plicatilis sangat dipengaruhi
oleh kualitas air, pH, oksigen terlarut, karbondioksida dan salinitas. Kualitas air
merupakan salah satu faktor penting yang dapat menyebabkan perubahan tingkah
laku organisme perairan dan dapat memperlihatkan nafsu makan berkurang atau
tidak, pertumbuhan lambat atau cepat, adanya gangguan hama dan penyakit yang
B. plicatilis bersifat euryhalin. Betina dengan telurnya dapat bertahan hidup pada salinitas 98 ppt, sedangkan salinitas optimalnya adalah 10-35 ppt
(Isnansetyo dan Kurniastuty, 1995).
a. Suhu Air
Kisaran suhu antara 220-300C merupakan kisaran suhu optimum untuk
pertumbuhan dan reproduksi (Isnansetyo dan Kurniastuty, 1995).
b. pH
Keasaman air mempengaruhi kehidupan B. plicatilis. B. plicatilis masih
dapat bertahan hidup pada pH 5-10. Sedangkan pH optimum untuk pertumbuhan
dan reproduksi berkisar antara 7,5-8,0 (Isnansetyo dan Kurniastuty, 1995).
c. Oksigen Terlarut
Jumlah oksigen yang dikonsumsi oleh B. plicatilis pada suhu air 100C
adalah 7,07mg/L /hari, pada suhu air 250C 10,04 mg/L/hari (Fukusho, 1989dalam
Redjeki, 1999). BBL Lampung (2002) dalam Amali (2005) menyatakan oksigen
terlarut untuk pertumbuhanB. plicatilisadalah 4,5-6,5 mg/l.
d. Intensitas Cahaya
Suminto (2005) menyatakan cahaya sebesar 250-310 nm adalah yang
terbaik untuk menetaskan kistaB. plicatilis. Fulks dan Main (1991)dalamRedjeki (1999) menyatakan intensitas cahaya yang diperlukan untuk kultur B. plicatilis
Nannochloropsisadalah kelompok fitoplankton yang dikelompokkan dalam genus alga yang terdiri dari sekitar 6 spesies. Genus tersebut dalam
perkembangan ilmu taksonomi pertama kali disebut oleh Hibberd (1981). Spesies
yang sebagian besar telah dikenal dari lingkungan laut, tetapi juga terdapat di
perairan tawar dan payau.
Nannochloropsismampu mencapai konsentrasi tinggi dengan berbagai
pigmen seperti astaxanthin, zeaxanthindancanthaxanthin. Mikroalga tersebut
memiliki struktur yang sangat sederhana.Nannochloropsis memiliki diameter
sekitar 2 mikrometer. Nannochloropsis memiliki kemampuan dalam
mengakumulasi asam lemak tak jenuh ganda sehingga digunakan sebagai sumber
pangan yang kaya energi untuk larva ikan dan rotifer (Isnansetyo dan Kurniastuty,
1995).
2.2.1 Morfologi dan Klasifikasi
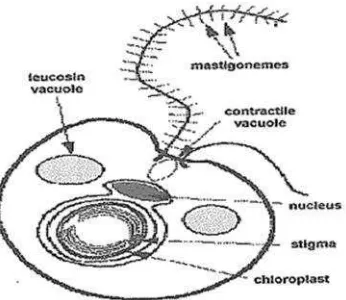
Nannochloropsis berukuran 2-4 μ m, berwarna hijau, tidak motil, dan
memiliki flagel (heterokontous) yang salah satu flagel berambut tipis (Allo, 2005).
Selnya berbentuk bola, berukuran kecil dengan diamater 4-6 mm. Organisme ini
merupakan divisi yang terpisah dari Nannochloriskarena tidak adanyachlorophyl
b. Nannochloropsis merupakan pakan yang populer untuk rotifer, artemia, dan
pada umumnya merupakan organisme filter feeder (penyaring). Nannochloropsis
Gambar 4. Ilustrasi morfologi selNannochloropsissp
(Waggoner dan Speer, 1999dalamAliabbas, 2002)
Klasifikasi Nannochloropsis sp menurut Hibberd (1981) adalah sebagai
berikut:
Kingdom : Protista
Superdevisi : Eukaryotes
Divisi : Chromophyta
Kelas : Eustigmatophyceae
Genus :Nannochloropsis
Species :Nannochloropsissp
2.2.2 Habitat dan Penyebaran
Penyebaran habitat mikroalga biasanya di air tawar (limpoplankton) dan
air laut (haloplankton), sedangkan sebaran berdasarkan distribusi vertikal di
perairan meliputi: plankton yang hidup di zona euphotik (ephiplankton), hidup di
zona disphotik (mesoplankton), hidup di zona aphotik (bathyplankton) dan yang
Secara umum pertumbuhan fitoplankton dipengaruhi oleh
parameter-parameter sebagai berikut:
a. Salinitas
Salinitas merupakan salah satu faktor yang sangat penting bagi kehidupan
di air, terutama dalam mempertahankan keseimbangan osmotik. Kisaran salinitas
yang dimiliki oleh Nannochloropsis sp. antara 20-25 ppt, tetapi dapat tumbuh dalam salinitas 0-35 ppt (Isnansetyo dan Kurniastuty, 1995).
b. pH
Nannochloropsis sp dapat tumbuh baik pada kisaran pH 8-9,5 (Hirata,
1980dalam Aryanto, 2008).
c. Suhu
Suhu merupakan salah satu faktor penting yang sangat berpengaruh bagi
kehidupan dan laju pertumbuhan organisme suatu perairan. Suhu berpengaruh
langsung terhadap aktivitas enzim dalam metabolisme sel suatu organisme,
sedangkan secara tidak langsung akan mempengaruhi kondisi lingkungan media
pertumbuhan (Rusyani, 2001). Suhu 25-300C merupakan kisaran suhu optimal
(Isnansetyo dan Kurniastuty, 1995). Menurut Ismi (1996), suhu 150C, 200C, dan
250C menghasilkan perkembangan populasi yang baik dibandingkan suhu 300.
d. DO (Oksigen Terlarut)
Arif & Adiwinata (2007) dalam Restiada et al., (2008) menyatakan
5,81 mg/L.
e. Cahaya
Kebutuhan akan cahaya untuk proses fotosintesis pada masing-masing
alga berbeda (Rusyani, 2001). Intensitas cahaya 1.000-10.000 lux merupakan
intensitas cahaya yang dibutuhkan Nannochloropsis sp (Hirata, 1980 dalam
Aryanto, 2008).
f. Karbondioksida
Tumbuhan akuatik seperti mikroalga membutuhkan CO2 untuk
fotosintesis, tetapi kehadiran CO2 dalam air menyebabkan turunnya pH.
Karbondioksida dengan kadar < 5 % biasanya sudah cukup digunakan dalam
kultur fitoplankton (Panggabeanet al.,2010).
g. Nutrien
Nutrien tersebut dibagi menjadi makronutrien dan mikronutrien,
makronutrien meliputi N (meliputi nitrat), P (posfat), K (Kalium), C (Karbon), Si
(Silikat), S (Sulfat) dan Ca (Kalsium). Sedangkan unsur Mikro nutrient terdiri atas
Fe (Besi), Zn (Seng), Cu (Tembaga), Mg (Magnesium), Mo (Molybdate), Co
(Kobalt), B (Boron), dan lainnya (Sylvester et al., 2002; Edhy et al., 2003;
Cahyaningsih, 2009dalamFachrullah, 2011).
Nitrogen merupakan salah satu makronutrien yang sangat mempengaruhi
pertumbuhan dan produktifitas biomassa alga karena dibutuhkan untuk
pembentuk protein, lemak dan klorofil (Richmond, 1998dalamMaula, 2009).
vitamin B1(thiamin), dan biotin (Rusyani, 2001).
2.2.4. Fase Pertumbuhan
Pertumbuhan adalah biosintesis yang menyebabkan bertambahnya
substansi atau protoplasma berupa perbanyakan sel, pembesaran sel, dan
penggabungan berbagai materi dari sekitar sel (Rusyani, 2001). Pertambahan sel
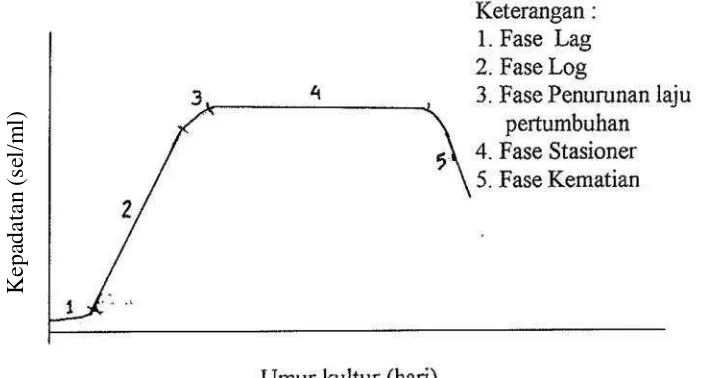
dalam kultur tersebut akan mengikuti pola tertentu. Fogg (1975) dalam Rusyani (2001) membagi pola pertumbuhan menjadi 5 fase, yaitu:
1. Fase lag, ditandai dengan peningkatan populasi yang tidak nyata. Fase ini
disebut juga fase adaptasi, karena sel alga sedang beradaptasi terhadap
media tumbuhnya. Pada fase lag, alga tetap hidup namun tidak
berkembang biak.
2. Fase eksponensial (logaritmik), ditandai dengan naiknya laju pertumbuhan
hingga kepadatan populasi meningkat. Pada fase eksponensial sel alga
sedang aktif berkembang biak. Ciri metabolisme selama fase eksponensial
adalah tingginya aktivitas yang berguna untuk pembentukan protein dan
komponen-komponen penyusun plasma sel yang dibutuhkan dalam
pertumbuhan.
3. Fase penurunan laju pertumbuhan, ditandai dengan penurunan laju
pertumbuhan. Disebut juga fase decline karena terjadi penurunan
pertambahan populasi persatuan waktu bila dibandingkan dengan fase
eksponensial.
4. Fase stationer, ditandai dengan seimbangnya laju pertumbuhan dengan laju
pertumbuhan populasi. Jumlah sel cenderung tetap diakibatkan sel telah
mencapai titik jenuh. Pertumbuhan sel yang baru dihambat oleh
keberadaan sel yang telah mati dan faktor pembatas lainnya.
5. Fase kematian, ditandai dengan kepadatan populasi yang terus berkurang,
hal ini dikarenakan laju kematian lebih tinggi dari laju pertumbuhan.
Kurva pertumbuhanNannochloropsissp dapat dilihat pada Gambar 5.
Gambar 5. Kurva pertumbuhanNannochloropsissp.
2.3 Lemak
Lemak adalah suatu ester asam lemak dengan gliserol. Gliserol merupakan
suatu trihidroksi alkohol yang terdiri atas tiga atom karbon. Tiap atom karbon
mempunyai gugus –OH. Satu molekul gliserol dapat mengikat satu, dua atau tiga
molekul asam lemak dalam bentuk ester, yang disebut monogliserida, digliserida
atau trigliserida. Lemak merupakan suatu trigliserida karena satu molekul gliserol
K
epa
da
ta
n (
se
l/
m
molekul asam lemak yang terikat pada gliserol (Poedjiadi, 1994).
Gambar 6. Struktur umum lemak (Poedjiadi, 1994)
Berdasarkan tingkat kejenuhannya, lemak terbagi menjadi dua yaitu lemak
jenuh dan tidak jenuh. berdasarkan sifat mengeringnya terbagi menjadi tiga yaitu
minyak tidak mengering, minyak setengah mengering dan minyak nabati
mengering. Penggolongan lemak berdasarkan sumbernya yaitu lemak hewani dan
lemak nabati (Herlina, 2002).
Fungsi lemak adalah sebagai sumber energi metabolik dan asam lemak
essensial yang berperan dalam struktur seluler, pemeliharaan dan integritas
biomembran (Widianingsih et al., 2011). Selain itu, lemak juga berfungsi sebagai
sumber energi metabolik (ATP), sumber dari asam lemak esensial (EFA) yang
penting untuk pertumbuhan dan kelangsungan hidup, dan sebagai sumber steroid
yang berperan dalam fungsi biologis penting, seperti mempertahankan sistem
membran, transport lemak, dan prekursor berbagai hormon steroid (Subandrio,
2009). Lemak juga memiliki peranan sebagai sumber energi yang lebih baik
dibandingkan karbohidrat dan protein (Widianingsih et al., 2011). 1 gram lemak
R1–COO–CH2
R2–COO–CH
kkal (Winarno, 1991dalamWidianingsihet al.,2011).
Lemak dalam jaringan ikan terdapat dalam jumlah yang besar
mengindikasikan bahwa lemak merupakan energi cadangan yang lebih disukai
daripada karbohidrat. Komponen penting lemak adalah: a) triglisirida; b)
fosfolemak; c) wax; d) steroid; serta e) spingomielin. Masing-masing komponen
tersebut memiliki fungsi penting dalam tubuh ikan (Subandrio, 2009).
2.3.1 Lemak PadaNannochloropsissp
Lemak mikroalga pada umumnya terdiri dari asam lemak tidak jenuh,
seperti linoleat, eicosapentaenoic acid (EPA) dan docosahexaenoic acid ( DHA)
(Skjak-Braek, 1992 dalamHarsanto, 2009). Mikroalga mengandung lemak dalam
jumlah yang besar terutama asam arachidonat (AA, 20:4ω6) (yang mencapai 36%
dari total asam lemak) dan sejumlah asam eikosapentaenoat (EPA, 20:5ω3)
(Fuentes, et al., 2000 dalam Harsanto, 2009). Selain itu, lemak mikroalga juga kaya akan asam lemak politidakjenuh (PUFA) dengan 4 atau lebih ikatan rangkap.
Sebagai contoh, yang sering dijumpai yaitu eicosapentaenoic acid (EPA, C20:5)
dandocosahexaenoic acid(DHA, C22:6) (Chisti, 2007dalamHarsanto, 2009).
Kandungan atau komposisi lemak pada mikroalga (Nannochloropsis
oculata dan Chlorella vulgaris) sangat dipengaruhi oleh suhu dan komposisi
nitrogen pada saat tumbuh (Converti, 2009 dalam He et al., 2011).
Bagaimanapun, tingginya kandungan lemak tidak bisa dijadikan kriteria untuk
keilmuan bioteknologi kelautan karena memiliki kandungan lemak yang tinggi
(Chiu et al., 2009). Banyak mikroalga dapat mengakumulasikan lemak yang
berasal dari hasil proses fotosintesis dan beberapa spesies dapat meningkatkan
kandungan lemaknya dalam kondisi lingkungan yang tidak sesuai (MES), seperti
penurunan kandungan nutrien (Takagiet al., 2000dalamChiuet al., 2009).
Yamazaki et al. (1989) dalam Haryanti et al (2010), memberikan contoh
beberapa spesies mikroalga yang dikultur pada kondisi yang berbeda akan
menghasilkan perbedaan kandungan nilai proximat dan komposisi lipid seperti;
Chlorella memiliki kandungan lipid 28-32 persen, Dunaliella primolecta (23
persen),Isochrysis galbana (2533%), danNannochloropsis oculata.(31-68 %)
Tabel 1. Komposisi asam lemak beberapa spesies fitoplankton
Asam lemak Chlorella (Malaysia)1 Chlorella vulgaris2) Chlorella minutissima2) Nannochloropsis oculata
16 : 0 9,3 20,2 20,6 16,54
18 : 1 8,8 8,6 2,5 2,04
18 : 2n-6 13,0 4,1 3,6 3,32
18 : 3n-3 9,2 - 0,1
-20 : 5n-3 0,10 26,6 27,3 30,51
22 : 6n-3 - - -
-Sumber: Suwiryaet al.,2002
2.3.2 Lemak Pada Rotifer(Brachionus plicatilis)
Lemak memiliki peran dalam pakan di samping sebagai sumber energi,
juga penting sebagai sumber lemak esensial untuk proses pertumbuhan dan
pertahanan tubuh (Kompiang dan llyas, 1988dalamNasution 2002).
Lemak digunakan untuk kebutuhan energi jangka panjang, juga untuk
(Sargentet al., 2002dalamPangkey, 2011).
Tabel 2. Kandungan asam lemak pada rotifer (Brachionus plicatilis) yang dikultur dengan pakan yang berbeda.
Asam Lemak
Chlorella regularis (air tawar)
Chlorella
minutissima(laut)
Yeast Nannochloropsis
16 : 0 9,3 16,8 6,7 11,1
18 : 1n-9 22,4 10,1 31,2 3,5
18 : 2n-6 18,5 3,2 5,9 2,5
18 : 3n-3 3,7 0,4 0,6 0,1
20 : 5n-3 1,9 24,1 - 37,8
22 : 6n-3 - - -
III. METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Oktober - November 2012 di Balai
Besar Pengembangan Budidaya Laut (BBPBL) Hanura-Lampung dan Uji
Proksimat dilaksanakan di Laboratorium THP Politeknik Negeri Lampung.
3.2 Alat dan Bahan 3.2.1. Alat
Alat-alat yang digunakan dalam penelitian antara lain, selang dan aerasi,
toples ukuran 2 L sebanyak 10 buah, toples ukuran 0,5 L sebanyak 48 buah,
mikroskop dan mikrometer, sedgewick rafter cell counts, pH meter, pipet tetes, gelas ukur, DO meter, refraktometer, thermometer, planktonnet, tisu dan kertas
saringwhatmann.
3.2.2. Bahan
a. Media Kultur
Media kultur yang digunakan adalah air laut steril yang berasal dari tandon
Laboratorium Zooplankton dan pupuk conwy untuk kulturNannochloropsissp.
b. Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah Brachionus
plicatilis yang berukuran < 100 µm diperoleh dari kultur di Laboratorium
Pakan alamiB. plicatilis yang diberikan adalah Nannochloropsis sp tanpa Micro Environmental Stress (MES) pada perlakuan A dan Nannochloropsis sp
dengan Micro Environmental Stress (MES) pada perlakuan B, C, dan D. MES
yang digunakan berupa salinitas yang dinaikkan dan nitrogen yang diturunkan.
3.3 Prosedur Penelitian 3.3.1 Persiapan Penelitian
a. Sterilisasi Ruangan
Sterilisasi ruangan dilakukan dengan membersihkan ruangan kultur
kemudian dipel dengan menggunakan karbol.
b. Sterilisasi Alat
Sterilisasi dilakukan dengan merebus semua alat yang akan digunakan
kemudian semua alat tersebut ditiriskan dan didinginkan. Setelah dingin, semua
alat disemprot dengan alkohol 70% di semua permukaan baik bagian luar maupun
bagian dalam.
c. Sterilisasi Media (Air)
Air laut yang akan digunakan merupakan air laut yang telah melewati
proses radiasi ultraviolet dan ozonisasi. Kemudian air laut tersebut disterilisasi
dengan cara direbus hingga air mendidih selama ± 10 menit. Setelah didinginkan,
air laut tersebut disaring dengan menggunakan planktonnet ukuran 0,25 μ m. Air laut selanjutnya diaerasi selama 24 jam.
Penelitian pendahuluan dilakukan untuk mengetahui cara kultur dan
pengukuran morfometriB. plicatilissehingga ketika penelitian berlangsung sudah
terbiasa untuk mengkultur dan mengukur morfometri B. plicatilis. Selama
penelitian pendahuluan B. plicatilis diberi pakan Nannochloropsis sp tanpa
perlakuan MES yang diberikan sebanyak 2 kali pada pagi hari pukul 08.00 WIB
dan siang hari pukul 14.00 WIB.Nannochloropsis sp diberikan sebagai pakan B.
plicatilisdengan perbandingan 50 sel/ml : 1 ind/ ml.
B. plicatilis dimasukkan ke dalam toples volume 2 liter dengan kepadatan
30 individu/ml dan diletakkan di atas rak kultur kemudian diberi aerasi. Selama
uji pendahuluan, pertumbuhan B. plicatilisdiukur dengan mengukur panjang total
serta diameter bagian kepala dan perut B. plicatilis(morfometri). Hasil penelitian pendahuluan disajikan oleh Tabel 3.
Tabel 3. Hasil pengukuran parameter morfometri rotifer(Brachionus plicatilis)
Hari Ke PT (μ m) DB (μ m) DK (μ m)
1 150.93 110.16 80.35
2 143.05 107.67 77.77
3 142.91 105.49 67.59
4 164.14 113.61 73.44
5 133.48 106.27 74.3
6 151.2 119.66 82.94
7 135.7 106.32 79.21
Keterangan: PT : Panjang Total
DB : Diameter Badan
Rancangan percobaan selama penelitian terdiri dari 4 perlakuan dan 3 kali
ulangan dengan analisis data menggunakan Chi-square. Perlakuan tersebut adalah:
Perlakuan A: kultur B. plicatilis dengan pemberian pakan Nannochloropsis sp.
yang dikultur dengan salinitas 28 ppt dan nitrogen 100%.
Perlakuan B : kultur B. plicatilis dengan pemberian pakan Nannochloropsis sp.
yang dikultur dengan salinitas 28 ppt dan nitrogen 50 %.
Perlakuan C : kultur B. plicatilis dengan pemberian pakan Nannochloropsis sp.
yang dikultur dengan salinitas 38 ppt dan nitrogen 100%.
Perlakuan D : kultur B. plicatilis dengan pemberian pakan Nannochloropsis sp.
yang dikultur dengan salinitas 38 ppt dan nitrogen 50%.
Keterangan:
Nitrogen 100% adalah kandungan komposisi NaNO3100 gr (pada pupuk conwy)
Nitrogen 50% adalah kandungan komposisi NaNO350 gr (pada pupuk conwy)
3.6 Pelaksanaan Penelitian
Selama penelitian B. plicatilis dikultur dengan diberi pakan
Nannochloropsissp dengan MES. B. plicatilisdikultur di dalam toples bervolume
2 liter dengan kepadatan 75-80 ind/ml. Toples yang digunakan dalam penelitian
dalam toples bervolume 0,5 liter.Nannochloropsissp dikultur sebanyak 12 toples perhari selama 4 hari sesuai jumlah perlakuan dan ulangan kultur B. plicatilis.
Nannochloropsis sp diberikan sebagai pakan B. plicatilis pada fase stasioner. Uji
penadahuluan yg dilakukan sebelum penelitian menunjukkan Nannochloropsissp
yang dikultur mencapai fase stasioner atau fase puncak pada hari ke 4. Oleh
karena itu, kultur Nannochloropsis sp yang dikultur pada hari pertama diberikan sebagai pakan B. plicatilis pada hari ke 4, begitu selanjutnya untuk kultur
Nannochloropsis sp diberikan pada hari berikutnya. Nannochloropsis sp sebagai pakan alami B. plicatilis diberikan dengan rasio perbandingan 1:50, yaitu 1
individu B. plicatilis diberikan 50 selNannochloropsis sp sebanyak 2 kali sehari
pada pukul 09.00 WIB dan pukul 15.00 WIB.
3.7 Pengukuran Parameter
Parameter yang diamati berupa parameter utama dan parameter pendukung.
3.7.1 Parameter Utama
Parameter utama yang diamati pada penelitian terdiri dari:
a. KepadatanB. plicatilis
Kepadatan populasiB. plicatilisdi dalam media kultur diukur dengan cara
sampling kulturB. plicatilis. Sampling dilakukan dengan cara mengaduk air pada
toples kultur dengan menggunakan pipet tetes kemudian diambil sampel sebanyak
1 ml pada bagian tengah air yang telah diaduk. Sampel yang telah diambil
kepadatanB. plicatilisper ml.
Jika B. plicatilis yang akan dihitung terlalu padat, maka dilakukan
pengenceran sebelum perhitungan. Pengenceran dilakukan dengan mengambil 1
ml sampel kemudian dimasukkan ke dalam gelas ukur dan ditambahkan air laut
hingga 100 ml. Kemudian dimasukkan ke dalam sedgwick rafter cell counts dan
dihitung di bawah mikroskop dengan bantuan hand counter. Hasil yang didapat dikali dengan 10.
b. Uji Proksimat Lemak
Pengujian kandungan lemak B. plicatilisdilakukan dengan uji proksimat.
Pengujian dilakukan dengan metode soxlet.
3.7.2 Parameter Pendukung
Parameter pendukung yang diamati adalah kualitas air berupa salinitas,
DO, pH, dan suhu. Pengamatan kualitas air ini dilaksanakan untuk
mengkondisikan media kultur rotifer dalam keadaan yang optimal.
3.8 Analisis Data
3.8.1Uji Chi Square (χ2)
Pengaruh MES padaNannochloropsis sp yang diberikan padaB. plicatilis
terhadap parameter pengamatan dianalisis dengan menggunakan uji Chi Square
(χ2). Pada dasarnya, untuk menguji hipotesis yang bersifat tetap. Uji Chi Square
(χ2) digunakan karena data merupakan data diskret (satu kali pengambilan
menggunakan formula berikut:
2 ( )
di mana:
Oi= frekuensi pengamatan (observasi) ke-i
Ei = frekuensi yang diharapkan mengikuti hipotesis yang dirumuskan (frekuensi
harapan ke-i)
P = notasi untuk banyaknya sifat yang diamati, banyaknya perlakuan yang
dicobakan, dan sebagainya.
Nilai Chi Square (χ2) yang diperoleh melalui rumus di atas akan menyebar
mengikuti sebaran Chi Square (χ2) dengan derajat bebas sama dengan p-1, di
mana p = banyaknya sifat atau perlakuan.
Metode pengambilan keputusan untuk Chi Square(χ2)adalah:
Jikaχ2hitung> daripadaχ2tabelmaka tolak H0
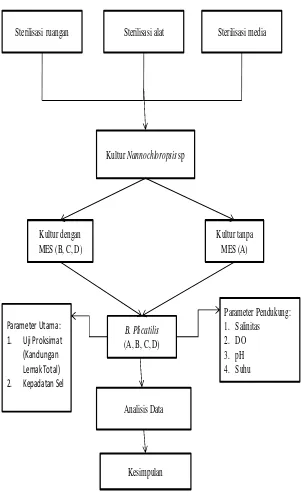
Sterilisasi ruangan Sterilisasi alat Sterilisasi media
KulturNannochloropsissp
Kultur dengan MES (B, C, D)
Kultur tanpa MES (A)
B. Plicatilis (A, B, C, D)
Analisis Data
Kesimpulan Parameter Utama:
1. Uji Proksimat (Kandungan Lemak Total) 2. Kepadatan Sel
[image:35.595.187.488.128.625.2]Parameter Pendukung: 1. Salinitas 2. DO 3. pH 4. Suhu
salinitas ataupun nitrogen selama budidaya Nannochloropsis sp (sebagai pakan
alami B. plicatilis) berpengaruh nyata terhadap kepadatan populasi, namun
cenderung tidak berpengaruh nyata terhadap kandungan lemak totalB. plicatilis.
5.2 SARAN
Perlu dilakukan penelitian sejenis untuk mengetahui pengaruh Micro
Environmental Stress (MES) lainnya selama budidaya Nannochloropsis sp yang
de Nanno. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Skripsi. Hal 4.
Allo, S. P. 2005.Pengamatan Terhadap Produksi Rotifera (Brachionus plicatilis)
yang Diberi Pakan Nannochloropsis sp Dengan Kepadatan Berbeda Pada Skala Laboratorium Di BBL Lampung. Program Studi Teknologi Akuakultur. Sekolah Tinggi Perikanan. Hal 13-17.
Amali, T. F. I. 2005. Pengaruh Pemberian Nannochloropsis sp. Natan dan
Coccolith sp. Pada Rotifera Terhadap Kelangsungan Hidup dan Pertumbuhan Larva Ikan Kerapu Macan (Epinephelus fuscoguttatus). Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Skripsi. Hal 4-6.
Aprilia, T. 2008.Aplikasi Pengkayaan Rotifera Dengan Asam Amino Bebas Untuk
Larva Kerapu Bebek Cromileptes altivelis. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Skripsi. Hal 8; 27.
Aryanto, A. 2008. Laju Pertumbuhan Diaphanosoma sp Dengan Pemberian
Pakan Nannochloropsis sp, Tetraselmis sp, dan Dunaliella sp Dalam Kondisi Laboratorium. Program Studi Ilmu Kelautan Universitas Sriwijaya. Skripsi. Hal 12.
Chiu, S. Y., Kao, C. Y., Tsai, M. T., Ong, S. C., Chen, C. H., dan Lin, C. S. 2009. Lipid Accumulation and CO2 Utilization of Nannochloropsis oculata In
Response to CO2 Aeration. Taiwan. National Chiao Tung University.
Jurnal. Bioresource Technology 100 (2009) 833-838.Introduction.
Eryanto et al., 2003. Keanekaragaman Hayati Laut: Aset Pembangunan
berkelanjutan Indonesia. Gramedia Pustaka. Jakarta
Fachrullah, M. R. 2011. Laju Pertumbuhan Mikroalga Penghasil Biofuel Jenis Chlorella sp. Dan Nannochloropsis sp. Yang Dikultivasi Menggunakan Air Limbah Hasil Penambangan Timah Di Pulau Bangka. Institut Pertanian Bogor. Fakultas Perikanan dan Ilmu Kelautan. Skripsi. Hal 9.
Harsanto, S. 2009. Analisis Asam Lemak Mikroalga Nannochloropsis oculata.
He, H., Rodgers, R. P., Marshall, A. G., and Hsu, C. S. 2011.Algae Polar Lipids Characterized by Online Liquid Chromatography Coupled with Hybrid Linear Quadrupole Ion Trap/Fourier Transform Ion Cyclotron Resonance Mass Spectrometry. Florida. Florida State University. Energy & Fuels Article. Hal. 4770.
Hibberd, D.J. (1981). Notes on the Taxonomy and Nomenclature of the Alga Classes Eustigmatophyceae and Tribophyceae (synonym Xanthophyceae). Journal of the Linnean Society of London, Botany.
Hu, H. and Gao, K. 2003. Optimization of Growth and Fatty Acid Composition of a Unicellular marine picoplankton, Nannochloropsis sp, with Enriched
Carbon Sources. Netherlands. Kluwer Academic Publisher.
Biotechnology Letters.Hal 421.
Hu, H and Gao, K. 2006. Response of Growth and Fatty Acid Compositions of
Nannochloropsis sp. to Environmental Factors Under Elevated CO2
Concetration.Biotechnol Lett (2006) 28:987–992
Ismi, S. 1996. Perkembangan Populasi Nannochloropsis oculata Pada Suhu dan Salinitas yang Berbeda. Jurnal Pendidikan Perikanan Indonesia. 2 (2): Hal: 71-75.
Isnansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton &
Zooplankton. Penerbit Kanisius. Hal 49-51.
Krienitz, L and Wirth, M. 2006. The high content of polyunsaturated fatty acid in Nannochloropsis limnetica (Eustigmotophyceae) and its implication for food web interactions, freshwater aquaculture and biotechnology. Limnologica 36 (2006) 204-210.
Lavens, P. and P. Sorgeloos. 1996. Manual on Production and Use of Live Food
For Aquaculture. FAO Fisheries Technical Paper. Hal 58.
Maula, N. M. 2009. Optimalisasi Kultivasi Mikroalga Laut Nannochloropsis
oculata Dengan Perlakuan Pupuk Urea Untuk Produksi Lemak Nabati. Malang. Universitas Brawijaya. Abstrak Skripsi.
Muhaemin, M. 2009. Cadmium- Peptides complexes in Dunaliella salina cells.
Cibinong. Pusat Penelitian Limnologi-LIPI. Jurnal Ikhtiologi Indonesia Vol. 2, No. 1, Tahun 2002.Hal 35.
Pangkey, H. 2011. Kebutuhan Asam Lemak Esensial Pada Ikan Laut. Sulawesi Utara. Fakultas Perikanan dan Ilmu Kelautan Universitas Sam Ratulangi. Jurnal Perikanan dan Kelautan Tropis Vol. VII-2, Agustus 2011. Hal 93-94.
Panggabean, L. M. G., Hartono, R., Saveya, V. S., dan Sitorus S. 2010. Pengaruh Injeksi Karbon Dioksida Terhadp Pertumbuhan Chlorella Sp. Dan
Nannochloropsis oculata. Prosiding Seminar Nasional Limnologi V
Tahun 2010.Hal 704.
Paridi, P. N. 2011. Laporan Praktikum Teknik Budidaya Pakan Alami Kultur
Nannochloropsis sp dan Artemia sp. Mataram. Universitas Mataram. Laporan Praktikum. Hal 1-2.
Poedjiadi, A. 1994.Dasar-dasar Biokimia. UI Press. Jakarta.
Redjeki, S. 1999. Budidaya Rotifera (Brachionus plicatilis). Oseana, Volume
XXIV, Nomor 2, 1999: 27-43. Jurnal.Hal 27-37.
Restiada, I. N., Muhdiat, dan Arif, A. G. 2008. Penyediaan Bibit Plankton
Nannochloropsis oculata Untuk Skala Massal. Buletin Teknik. Lit.
Akuakultur Vol. 7 No. 1 Tahun 2008. Hal 34.
Rukka, A. H. 2011. Pengaruh Salinitas yang Berbeda Terhadap Pertumbuhan
Rotifera Brachionus plicatilis O.F. Muller.Media Litbang Sulteng IV (1);
08-11 Juni 2011.Hal 8.
Rusyani, E. 2001. Pengaruh Dosis Zeolit Yang Berbeda Terhadap Pertumbuhan
Isochrysis galbana Klon Tahiti Skala Laboratorium Dalam Media Komersial. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Skripsi. Hal 6-12.
Sumiarsa G. S, Makatulu D, dan Rusdi I. Pengaruh Vitamin B12 dan Pengkayaan
Fitoplankton Kepadatan Tinggi Terhadap Kepadatan dan Kualitas Rotifer (Brachionus rotundiformis). Jurnal Penelitian Perikanan Indonesia Vol. 11 No. 2 Tahun 1996.
Suminto. 2005. Bididaya Pakan Alami Mikroalga dan Rotifer. Universitas
Pakan Mikroalga Yang Berbeda Terhadap Pertumbuhan Populasi Rotifer, Brachionus rotundiformis. Pusat Penelitian Oseanografi LIPI dan
Universitas Negeri Jakarta.Oseanologi dan Limnologi di Indonesia.
Suwirya, K., Marzuki, dan Giri, N. A. 2002. Informasi Nutrisi Ikan Untuk
Menunjang Pengembangan Budidaya Laut. Singaraja. Balai Besar Riset
Perikanan Budidaya Laut Gondol. Seminar Nasional Peningkatan
Pendapatan Petani Melalui Penerapan Teknologi Tepat Guna 2002. Hal 234-235.
Walpole, R. E. 1995.Pengantar Statistika. Jakarta. PT. Gramedia Pustaka Utama.