ELEKTROFORESIS SDS-PAGE,
IMMUNOBLOTTING,
DAN
PENENTUAN ASAM AMINO ANTIGEN DARI SARUNG
TANGAN LATEKS KARET ALAM
RANI ANGGRAENI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
3
ELEKTROFORESIS SDS-PAGE,
IMMUNOBLOTTING,
DAN
PENENTUAN ASAM AMINO ANTIGEN DARI SARUNG
TANGAN LATEKS KARET ALAM
RANI ANGGRAENI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
4
Judul skripsi : Elektroforesis SDS-PAGE, Immunoblotting, dan Penentuan Asam Amino Antigen dari Sarung Tangan Lateks Karet Alam
Nama : Rani Anggraeni NIM : G44203064
Menyetujui,
Pembimbing I Pembimbing II
Drs. Dudi Tohir, MS Dr. Siswanto, DEA
NIP 131851277 NIP 110600162
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP 131 578 806
PENDAHULUAN
Karet alam termasuk ke dalam keluarga Euphorbiaceae dan dapat menghasilkan lateks yang dapat diproses menjadi karet alam, pohon lainnya yang mengandung lateks antara lain euphorbia dan dandelion.
Namun, di antara tanaman-tanaman tersebut karet alam merupakan tanaman yang mempunyai nilai ekonomis paling tinggi, sehingga dibudidayakan secara meluas di beberapa negara, seperti Afrika, Eropa, Filipina, Thailand, dan juga Indonesia. Hal ini karena lateks alam yang dihasilkannya memiliki keunggulan dibandingkan dengan karet sintetik, di antaranya ialah kekuatan gel basah, kekuatan vulkanis, dan elastisitasnya (Siswantoro 1993) sehingga banyak digunakan sebagai bahan baku barang jadi lateks alam seperti sarung tangan (medis, bedah, industri), balon, dot bayi, dan kondom.
Penggunaan barang jadi asal lateks alam ternyata dapat menimbulkan alergi bagi penggunanya. Hal ini karena barang jadi asal lateks alam tersebut mengandung protein alergen. Laporan paling dini mengenai adanya alergi lateks dimuat dalam British Journal of Dermatology tahun 1979 (Stehlin 2001). Reaksi hipersensitivitas yang disebabkan oleh protein alergen dari barang jadi lateks karet alam adalah hipersensitivitas tipe I, yaitu respons terhadap sisa-sisa protein yang terdapat dalam lateks (O’Gilvie 1996). Terdapat lebih dari 250 jenis protein lateks yang berbeda-beda, dan kira-kira 20% di antaranya menyebabkan alergi (alergenik). Reaksinya berlangsung dengan cepat melalui kontak kulit atau mukosa dalam tempo beberapa menit sampai beberapa jam setelah penderita terpapar antigen yang dapat ditandai dengan terjadinya bengkak atau kulit memerah, hidung dan mata berair, kram perut, sulit bernafas, tekanan darah menurun, dan pasien mengalami goncangan (anafilaksis) yang dapat berpotensi menimbulkan kematian (Price & Lorraine 1994; Baratawidjaja 2006).
Data yang dihimpun oleh Food and Drug Administration (FDA) dari tahun 1989 sampai 1992 menyebutkan bahwa terdapat 1133 kasus hipersensitivitas oleh protein asal lateks alam dan 15 kasus di antaranya menyebabkan kematian, kondisi ini mendorong FDA melakukan pelabelan protein hipoalergenik dengan batas maksimum kandungan protein sebesar
150 µg/g (Jacobson 1999). Hal ini
dikhawatirkan dapat menurunkan konsumsi lateks alam dunia akibat penggunaan bahan baku pengganti juga dapat menghambat perkembangan industri lateks nasional dan produk jadinya sehingga menurunkan devisa negara.
Berbagai penelitian yang berhubungan dengan protein alergen lateks alam telah banyak dilakukan, dan juga telah banyak jenis protein alergen yang terdaftar dalam WHO-IUIS (International Union of Immunological Societies) (Lampiran 1). Dalam laporannya, Yeang et al. (2000) menyatakan bahwa pasien yang alergi terhadap lateks tidak hanya sensitif terhadap satu jenis protein alergen saja, tetapi dapat juga terhadap lebih dari satu jenis protein alergen. Hal ini mungkin, karena beberapa jenis protein dalam sarung tangan diketahui juga diproduksi oleh produk lain seperti makanan. Penelitian selanjutnya menyatakan bahwa sifat alergenik sarung tangan karet lateks alam dan bedak sarung tangan karet adalah berbeda (Tomazic & Sanchez 2005). Selain itu, Chalear
et al. (2006) menyatakan bahwa perawat di Rumah Sakit Thailand memiliki sensitivitas terhadap lateks karet alam yang jauh lebih rendah bila dibandingkan dengan pekerja kesehatan di Eropa.
Penelitian yang dilakukan kali ini bertujuan menentukan jenis protein antigenik dan asam amino penyusunnya dari sarung tangan lateks karet alam. Hasil penelitian ini dapat digunakan untuk mengisolasi protein antigenik atau protein alergenik sebagai tahapan awal dari produksi kit imunodiagnostik.
TINJAUAN PUSTAKA
Karet Alam (Hevea brasiliensis)Karet alam merupakan tanaman yang dapat menghasilkan lateks dan pertama kali ditemukan di Amazon, Brazil (Law 1999). Selain itu juga dikenal jenis lain seperti
Manihot alaziovii, Ficus elastica, Gutta percha, Castilloa elastica, dan Parthenium argentatum.
PENDAHULUAN
Karet alam termasuk ke dalam keluarga Euphorbiaceae dan dapat menghasilkan lateks yang dapat diproses menjadi karet alam, pohon lainnya yang mengandung lateks antara lain euphorbia dan dandelion.
Namun, di antara tanaman-tanaman tersebut karet alam merupakan tanaman yang mempunyai nilai ekonomis paling tinggi, sehingga dibudidayakan secara meluas di beberapa negara, seperti Afrika, Eropa, Filipina, Thailand, dan juga Indonesia. Hal ini karena lateks alam yang dihasilkannya memiliki keunggulan dibandingkan dengan karet sintetik, di antaranya ialah kekuatan gel basah, kekuatan vulkanis, dan elastisitasnya (Siswantoro 1993) sehingga banyak digunakan sebagai bahan baku barang jadi lateks alam seperti sarung tangan (medis, bedah, industri), balon, dot bayi, dan kondom.
Penggunaan barang jadi asal lateks alam ternyata dapat menimbulkan alergi bagi penggunanya. Hal ini karena barang jadi asal lateks alam tersebut mengandung protein alergen. Laporan paling dini mengenai adanya alergi lateks dimuat dalam British Journal of Dermatology tahun 1979 (Stehlin 2001). Reaksi hipersensitivitas yang disebabkan oleh protein alergen dari barang jadi lateks karet alam adalah hipersensitivitas tipe I, yaitu respons terhadap sisa-sisa protein yang terdapat dalam lateks (O’Gilvie 1996). Terdapat lebih dari 250 jenis protein lateks yang berbeda-beda, dan kira-kira 20% di antaranya menyebabkan alergi (alergenik). Reaksinya berlangsung dengan cepat melalui kontak kulit atau mukosa dalam tempo beberapa menit sampai beberapa jam setelah penderita terpapar antigen yang dapat ditandai dengan terjadinya bengkak atau kulit memerah, hidung dan mata berair, kram perut, sulit bernafas, tekanan darah menurun, dan pasien mengalami goncangan (anafilaksis) yang dapat berpotensi menimbulkan kematian (Price & Lorraine 1994; Baratawidjaja 2006).
Data yang dihimpun oleh Food and Drug Administration (FDA) dari tahun 1989 sampai 1992 menyebutkan bahwa terdapat 1133 kasus hipersensitivitas oleh protein asal lateks alam dan 15 kasus di antaranya menyebabkan kematian, kondisi ini mendorong FDA melakukan pelabelan protein hipoalergenik dengan batas maksimum kandungan protein sebesar
150 µg/g (Jacobson 1999). Hal ini
dikhawatirkan dapat menurunkan konsumsi lateks alam dunia akibat penggunaan bahan baku pengganti juga dapat menghambat perkembangan industri lateks nasional dan produk jadinya sehingga menurunkan devisa negara.
Berbagai penelitian yang berhubungan dengan protein alergen lateks alam telah banyak dilakukan, dan juga telah banyak jenis protein alergen yang terdaftar dalam WHO-IUIS (International Union of Immunological Societies) (Lampiran 1). Dalam laporannya, Yeang et al. (2000) menyatakan bahwa pasien yang alergi terhadap lateks tidak hanya sensitif terhadap satu jenis protein alergen saja, tetapi dapat juga terhadap lebih dari satu jenis protein alergen. Hal ini mungkin, karena beberapa jenis protein dalam sarung tangan diketahui juga diproduksi oleh produk lain seperti makanan. Penelitian selanjutnya menyatakan bahwa sifat alergenik sarung tangan karet lateks alam dan bedak sarung tangan karet adalah berbeda (Tomazic & Sanchez 2005). Selain itu, Chalear
et al. (2006) menyatakan bahwa perawat di Rumah Sakit Thailand memiliki sensitivitas terhadap lateks karet alam yang jauh lebih rendah bila dibandingkan dengan pekerja kesehatan di Eropa.
Penelitian yang dilakukan kali ini bertujuan menentukan jenis protein antigenik dan asam amino penyusunnya dari sarung tangan lateks karet alam. Hasil penelitian ini dapat digunakan untuk mengisolasi protein antigenik atau protein alergenik sebagai tahapan awal dari produksi kit imunodiagnostik.
TINJAUAN PUSTAKA
Karet Alam (Hevea brasiliensis)Karet alam merupakan tanaman yang dapat menghasilkan lateks dan pertama kali ditemukan di Amazon, Brazil (Law 1999). Selain itu juga dikenal jenis lain seperti
Manihot alaziovii, Ficus elastica, Gutta percha, Castilloa elastica, dan Parthenium argentatum.
2
n
Karet alam liar biasanya dapat tumbuh dengan tinggi mencapai 40 m dan hidup lebih dari 100 tahun. Namun, untuk tanaman karet alam yang dibudidayakan biasanya hanya berukuran sekitar 25 m karena pertumbuhannya terhambat dengan adanya penyadapan. Tanaman ini harus tumbuh selama tujuh tahun sebelum dapat dilakukan penyadapan. Umur karet alam budidaya relatif lebih singkat daripada yang liar, yaitu sekitar 25–35 tahun, karena pada usia tersebut karet alam tidak produktif lagi untuk menghasilkan lateks atau nilai ekonomisnya menurun, sehingga harus dilakukan penanaman kembali (Webster & Baulkwil 1989).Lateks
Lateks merupakan polimer alam yang diperoleh dari getah tanaman terutama dari tanaman karet alam. Lateks yang diperoleh dari pohon karet merupakan suatu larutan susu yang terdiri dari 30–40% hidrokarbon karet yang tersuspensi di dalam serum bersama dengan beberapa persen partikel non karet seperti karbohidrat, protein, lipid, gula, dan beberapa logam (Long 1998). Komponen-komponen dalam lateks tersebut dapat dipisahkan dengan cara ultrasentrifugasi dengan kecepatan 18,000 g selama 45 menit, sehingga lateks akan terpisah menjadi tiga fraksi utama, yaitu fraksi karet, fraksi serum-C, dan fraksi lutoid.
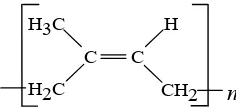
Fraksi karet berada di lapisan paling atas dan mengandung 93.7% hidrokarbon karet berupa molekul cis-1,4-poliisoprena (Gambar 1), sedangkan sisanya adalah bahan bukan karet, di antaranya diantaranya lemak 2.4%, glikolopid dan fosfolipid 1.0%, protein 2.2%, dan karbohidrat 0.4%. Selain itu juga terdapat enzim isopentenil pirofosfat yang berfungsi dalam pembentukan partikel karet (Dalimunthe 2004).
Gambar 1 Struktur cis-1,4-poliisoprena.
Fraksi tengah adalah serum-C (serum sitosol), berupa cairan bening dan akan berubah menjadi kecokelatan bila disimpan dalam wadah terbuka karena sifatnya yang mudah teroksidasi. Selain itu, fraksi
serum-C juga kaya akan protein. Fraksi dasar adalah partikel gelatin yang bersifat kental seperti gelatin dan diselubungi oleh membran semipermeabel.
Dewasa ini barang jadi lateks alam diketahui menyebabkan reaksi hipersensitivitas bagi pengguna. Berbagai macam metode telah dilakukan untuk menghilangkan protein alergen, salah satunya adalah dengan menciptakan suatu jenis lateks baru, yaitu lateks alam berprotein rendah (DPNR). Lateks karet alam DPNR adalah lateks alam yang kandungan proteinnya telah dikurangi. Lateks DPNR dapat diperoleh dengan berbagai cara, di antaranya dengan mereaksikan lateks alam dengan enzim papain (Alfa 2002) dan sentrifugasi berulang. Menurut Subramaniam (1992), sentrifugasi berulang dapat menurunkan kadar protein dalam serum lateks sampai 60%, tetapi masih tetap menyebabkan alergi. Selain itu, dapat dilakukan pencucian dan klorinasi, namun metode klorinasi ini tidak begitu baik, karena dapat mengurangi tegangan putus produk jadi lateks (Siswantoro 1993).
Protein Alergen dalam Lateks Alam dan Produk Jadinya
Lateks karet alam mengandung berbagai jenis protein, di antaranya adalah enzim-enzim yang berperan dalam proses polimerisasi isoprena menjadi senyawa hidrokarbon karet (enzim transferase karet), protein yang dapat menyebabkan alergi (protein alergen), dan beberapa protein lain yang berfungsi untuk memantapkan elastisitas karet (Webster & Baulkwill 1989).
Total protein yang terkandung dalam produk jadi lateks alam kurang lebih 1.7% dan hanya sebagian kecil yang dapat terekstraksi dengan air atau bufer fosfat salin (PBS). Walaupun jumlahnya sangat sedikit, protein tersebut dapat menyebabkan reaksi alergi bagi pengguna yang sensitif. Protein tersebut memiliki jenis dan bobot molekul yang beragam (Lampiran 1). Protein alergen lateks alam termasuk jenis protein yang tahan terhadap suhu tinggi, sehingga tidak hilang pada saat proses vulkanisasi (100–130 ºC) dan terbawa pada produk jadinya.
Bagi pengguna yang sensitif, protein dalam barang jadi lateks alam akan dianggap sebagai benda asing dalam tubuh yang disebut sebagai antigen. Antigen merupakan suatu molekul yang memacu respons imun, dan respons imun tubuh terhadap protein antigen yang bersifat alergi (reaksi alergi) termasuk reaksi hipersensitivitas tipe I atau reaksi cepat H3C
H2C C
H C
3
(Baratawidjaja 2006). Respons imun tipe I terjadi dengan segera, biasanya 5-30 menit sesudah kontak pertama melalui mediator antibodi imunoglobuin E (IgE) dengan gejala yang terjadi adalah tempat terdedah menjadi bengkak dan merah, gatal serta rasa panas (Ansell 2004).
Elektroforesis Gel Poliakrilamida-Natrium Dodesil Sulfat (SDS-PAGE)
Elektroforesis adalah suatu teknik pemisahan yang memisahkan analit berdasarkan kemampuannya bergerak dalam medium konduksi yang biasanya berupa larutan bufer dan akan memberikan respons setelah ditambahkan medan listrik (Harvey 2000). Jika suatu zat bermuatan diberi potensial, maka zat tersebut akan berpindah sepanjang medium yang kontinu ke arah katode atau anode sesuai dengan muatan yang dibawanya.
Elektroforesis SDS-PAGE termasuk ke dalam kelompok elektroforesis zona/wilayah, yaitu kelompok elektroforesis yang dibedakan berdasarkan medium penyangganya. Elektroforesis SDS-PAGE menggunakan gel buatan sebagai medium penyangga. Gel yang digunakan terbentuk dari polimerisasi akrilamida dengan N,
N’-metilena bis akrilamida sehingga terbentuk ikatan silang karena polimerisasi akrilamida sendiri hanya menghasilkan ikatan linear yang tidak membentuk gel kaku (Girindra 1993).
Polimerisasi dapat terjadi dengan cepat pada suhu kamar dengan adanya katalis dan inisiator. Katalis dan inisiator yang umum
digunakan ialah N,N’,N’,N’–
tetrametilenadiamina (TEMED) dan amonium persulfat (APS) sebagai sumber radikal bebas yang akan menginisiasi pembentukan polimer (Caprette 2005). Pada metode ini, digunakan natrium dodesil sulfat
(SDS) dan β-merkaptoetanol. SDS
merupakan detergen anionik yang bersama dengan β-merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein menjadi konfigurasi acak. Hal ini disebabkan oleh pecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus-gugus sulfidril.
Pergerakan partikel di dalam medium bergantung pada ukuran partikel dan ukuran medium penunjang. Ukuran pori dari gel akan ditentukan oleh konsentrasi gel poliakrilamida. Protein yang besar mempunyai mobilitas yang lebih lambat
dibandingkan dengan kompleks protein yang lebih kecil. Bobot molekul protein dapat ditentukan dengan kalibrasi menggunakan standar protein yang sudah diketahui bobot molekulnya (Rybicki et al. 1996). Teknik elektroforesis gel banyak digunakan baik di bidang kimia maupun biokimia, karena teknik ini memiliki banyak keuntungan, di antaranya ialah memiliki daya resolusi tinggi, sederhana, dan mudah dibawa (Girindra 1993).
Immunoblotting
Immunoblotting adalah suatu metode yang digunakan untuk mendeteksi keberadaan protein dalam suatu sampel. Metode ini menggunakan elektroforesis gel untuk memisahkan protein berdasarkan bobot molekulnya. Protein tersebut kemudian ditransfer dari gel hasil elektroforesis ke dalam suatu membran nitroselulosa, yang akan diuji menggunakan antibodi yang spesifik terhadap protein tersebut (Rybicki et al. 1996).
Immunoblotting digunakan secara luas untuk menentukan ukuran antigen dan antibodi yang diketahui, serta untuk identifikasi dan pencirian antigen dari campuran antigen yang tidak diketahui, serta uji alergi (Girindra 1993).
Belakangan ini, teknik transfer protein dari poliakrilamida atau fragmen-fragmen DNA/RNA dari agarosa-slab-gel ke membran nitroselulosa penggunaannya begitu meluas.
Southern blot merupakan metode pemindahan ruas DNA dari matriks gel ke penunjang padat, yaitu lembar nitroselulosa. Proses transfer yang identik tetapi dengan maksud mentransfer RNA dari gel ke nitroselulosa disebut northern blot, sedangkan proses transfer protein dari matriks gel ke membran nitroselulosa dan proses deteksinya secara imunologi sering disebut dengan western-blot.
Pita protein (misalnya, protein alergen) yang tercetak dalam membran nitroselulosa dapat diidentifikasi dengan menginkubasi membran dalam serum darah pasien yang positif alergi terhadap lateks, sehingga protein tersebut akan berikatan secara spesifik dengan IgE. Interaksi tersebut dapat terlihat setelah membran direaksikan dengan substrat yang dapat berpendar, sedangkan bobot molekulnya diketahui dari migrasinya pada gel SDS-PAGE (Rybicki et al. 1996).
Kromatografi Cair Kinerja Tinggi (HPLC)
4
dua fase, salah satunya merupakan lapisan stasioner dengan permukaan yang luas dan fase yang lain berupa zat cair yang mengalir lambat menembus atau sepanjang pipa tersebut (Day & Underwood 1992).
Kromatografi pada dasarnya adalah pemisahan komponen-komponen dalam sampel dengan cara mengalirkan sampel melewati suatu kolom. Sampel dibawa oleh fase gerak (mobile phase) yang dalam hal ini berupa cairan. Sementara kolom berisi suatu bahan yang disebut fase diam (stationary phase) yang berfungsi memisah-misahkan komponen sampel.
HPLC terdiri atas 4 jenis, yaitu kromatografi partisi, kromatografi adsorpsi, kromatografi penukar ion, dan kromatografi gel. Jenis kromatografi yang digunakan untuk pemisahan asam amino pada penelitian ini adalah kromatografi partisi, yaitu jenis kromatografi yang pemisahannya didasarkan pada perbedaan tingkat kepolaran. Fasa diam yang digunakan adalah kolom C18 yang bersifat non polar dan fasa geraknya bersifat polar. Jenis pemisahan ini disebut dengan kromatografi partisi fasa terbalik. Senyawa yang polar akan keluar terlebih dahulu sehingga memiliki waktu retensi yang relatif kecil sedangkan senyawa non polar akan ditahan lebih lama oleh fasa diamnya.
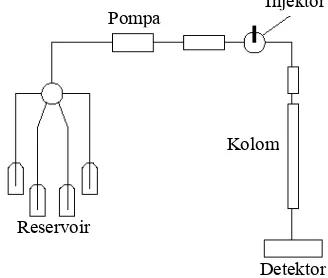
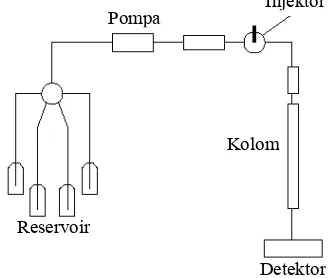
Gambar 2 Bagan alat HPLC.
Instrumen HPLC terdiri dari beberapa bagian, yaitu tandon (reservoir) cairan fase gerak, pompa, injektor, kolom, detektor, dan perekam (Gambar 2). Terdapat beberapa jenis detektor yang biasa digunakan dalam HPLC, diantaranya ialah detektor UV, infra merah, fluoresens, dan indeks refraksi. Detektor yang digunakan pada pemisahan asam amino sampel adalah detektor fluoresens.
HPLC dapat digunakan untuk analisis kualitatif dan kuantitatif. Kelebihan HPLC dibandingkan dengan jenis kromatografi lain adalah sensitivitasnya tinggi, dapat memisahkan senyawa yang tidak atsiri, analisisnya cepat, dapat memisahkan komponen dalam jumlah yang sedikit, memiliki daya pisah yang tinggi, kolom dapat digunakan kembali, dan dapat menganalisis molekul besar (Skoog et al. 1998).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan antara lain sarung tangan medis komersial (campuran dari berbagai sarung tangan di pasaran), sarung tangan DPNR, fraksi lateks (serum C dan lutoid), pereaksi Lowry, akrilamida, bis akrilamida, trisma base, HCl 0.1 N, SDS 10%, bufer elektrode pH 8.3, amonium persulfat (APS), TEMED, sampel bufer, isopropanol, pewarna biru Coomasie, metanol, asam asetat glasial, akuades, AgNO3, bufer transfer, bufer
western, larutan PBS 5×, Tween 20, membran nitroselulosa, serum darah manusia yang alergi terhadap sarung tangan berasal dari Rumah Sakit Cipto Mangunkusumo, Jakarta, serum darah manusia yang tidak alergi terhadap sarung tangan berasal dari teknisi di Balai Penelitian Bioteknologi Perkebunan Perkebunan Indonesia (BPBPI), serum darah kelinci anti serum-C dan anti lutoid (IgG), konjugat HR-peroksidase, substrat 3,3’-diaminobenzidin tetrahidroklorida (DAB), susu bubuk tanpa lemak (nonfat dry milk), H2O2
30%, dan bufer elusi. Pembuatan larutan dapat dilihat pada Lampiran 2.
Alat-alat yang digunakan adalah alat-alat kaca, neraca analitik, penangas air, mesin pendingin, tabung Eppendorf, sentrifus Eppendorf 5417 R, spektrofotometer Beckman Coulter DU®530, kuvet plastik, pH-meter, seperangkat peralatan elektroforesis SDS PAGE Bio Rad, lampu UV, alat selofan, seperangkat alat elektroeluter (Lampiran 3), dan HPLC.
Metode
Ekstraksi Serum C dan Lutoid
Lateks kebun disentrifugasi dengan kecepatan 18,000 g selama 45 menit dengan menggunakan sentrifus Beckman®. Setelah 45 menit, terdapat tiga lapisan dan lapisan pertama yang merupakan lapisan karet dibuang. Lapisan kedua adalah cairan serum-C yang kemudian Reservoir
Pompa
Detektor Kolom
4
dua fase, salah satunya merupakan lapisan stasioner dengan permukaan yang luas dan fase yang lain berupa zat cair yang mengalir lambat menembus atau sepanjang pipa tersebut (Day & Underwood 1992).
Kromatografi pada dasarnya adalah pemisahan komponen-komponen dalam sampel dengan cara mengalirkan sampel melewati suatu kolom. Sampel dibawa oleh fase gerak (mobile phase) yang dalam hal ini berupa cairan. Sementara kolom berisi suatu bahan yang disebut fase diam (stationary phase) yang berfungsi memisah-misahkan komponen sampel.
HPLC terdiri atas 4 jenis, yaitu kromatografi partisi, kromatografi adsorpsi, kromatografi penukar ion, dan kromatografi gel. Jenis kromatografi yang digunakan untuk pemisahan asam amino pada penelitian ini adalah kromatografi partisi, yaitu jenis kromatografi yang pemisahannya didasarkan pada perbedaan tingkat kepolaran. Fasa diam yang digunakan adalah kolom C18 yang bersifat non polar dan fasa geraknya bersifat polar. Jenis pemisahan ini disebut dengan kromatografi partisi fasa terbalik. Senyawa yang polar akan keluar terlebih dahulu sehingga memiliki waktu retensi yang relatif kecil sedangkan senyawa non polar akan ditahan lebih lama oleh fasa diamnya.
Gambar 2 Bagan alat HPLC.
Instrumen HPLC terdiri dari beberapa bagian, yaitu tandon (reservoir) cairan fase gerak, pompa, injektor, kolom, detektor, dan perekam (Gambar 2). Terdapat beberapa jenis detektor yang biasa digunakan dalam HPLC, diantaranya ialah detektor UV, infra merah, fluoresens, dan indeks refraksi. Detektor yang digunakan pada pemisahan asam amino sampel adalah detektor fluoresens.
HPLC dapat digunakan untuk analisis kualitatif dan kuantitatif. Kelebihan HPLC dibandingkan dengan jenis kromatografi lain adalah sensitivitasnya tinggi, dapat memisahkan senyawa yang tidak atsiri, analisisnya cepat, dapat memisahkan komponen dalam jumlah yang sedikit, memiliki daya pisah yang tinggi, kolom dapat digunakan kembali, dan dapat menganalisis molekul besar (Skoog et al. 1998).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan antara lain sarung tangan medis komersial (campuran dari berbagai sarung tangan di pasaran), sarung tangan DPNR, fraksi lateks (serum C dan lutoid), pereaksi Lowry, akrilamida, bis akrilamida, trisma base, HCl 0.1 N, SDS 10%, bufer elektrode pH 8.3, amonium persulfat (APS), TEMED, sampel bufer, isopropanol, pewarna biru Coomasie, metanol, asam asetat glasial, akuades, AgNO3, bufer transfer, bufer
western, larutan PBS 5×, Tween 20, membran nitroselulosa, serum darah manusia yang alergi terhadap sarung tangan berasal dari Rumah Sakit Cipto Mangunkusumo, Jakarta, serum darah manusia yang tidak alergi terhadap sarung tangan berasal dari teknisi di Balai Penelitian Bioteknologi Perkebunan Perkebunan Indonesia (BPBPI), serum darah kelinci anti serum-C dan anti lutoid (IgG), konjugat HR-peroksidase, substrat 3,3’-diaminobenzidin tetrahidroklorida (DAB), susu bubuk tanpa lemak (nonfat dry milk), H2O2
30%, dan bufer elusi. Pembuatan larutan dapat dilihat pada Lampiran 2.
Alat-alat yang digunakan adalah alat-alat kaca, neraca analitik, penangas air, mesin pendingin, tabung Eppendorf, sentrifus Eppendorf 5417 R, spektrofotometer Beckman Coulter DU®530, kuvet plastik, pH-meter, seperangkat peralatan elektroforesis SDS PAGE Bio Rad, lampu UV, alat selofan, seperangkat alat elektroeluter (Lampiran 3), dan HPLC.
Metode
Ekstraksi Serum C dan Lutoid
Lateks kebun disentrifugasi dengan kecepatan 18,000 g selama 45 menit dengan menggunakan sentrifus Beckman®. Setelah 45 menit, terdapat tiga lapisan dan lapisan pertama yang merupakan lapisan karet dibuang. Lapisan kedua adalah cairan serum-C yang kemudian Reservoir
Pompa
Detektor Kolom
5
disentrifugasi berulang kali sampai lapisan karetnya tidak ada lagi.
Lapisan ketiga adalah lapisan lutoid yang berwarna kekuningan. Bagian ini dipisahkan lalu digerus beberapa menit. Setelah homogen, larutan disentrifugasi kembali berulang kali sampai larutan menjadi seperti air kelapa (Siswanto & Suharyanto 1997).
Ekstraksi sampel
Sampel sarung tangan dipotong dengan ukuran 0.5 cm × 0.5 cm kemudian ditimbang. Sampel ditambah PBS dengan nisbah 1:4 (w/v) lalu diinkubasi pada suhu 37 ºC selama tiga jam dan setiap 1 jam sampel diaduk beberapa menit. Sebanyak 400 mL filtratnya lalu disentrifugasi dengan kecepatan 10,000 g selama 15 menit pada suhu 4 ºC. Sebanyak 200 mL supernatan kemudian ditambah 200 mL aseton lalu diinkubasi selama 30 menit pada suhu 4 ºC. Setelah itu, disentrifugasi dengan kecepatan 15,000 g selama 15 menit pada suhu 4 ºC dan peletnya dikeringudarakan sampai tidak ada lagi aseton. Setelah kering, pelet ditambah dengan PBS sampai larut kemudian disimpan dalam mesin pendingin (Siswanto 1997).
Penetapan Kadar Protein Metode Lowry
Penetapan kadar protein Lowry dilakukan dengan metode Lowry modifikasi Rubber Reaserch International Malaysia (RRIM) MS 1392:96P
(
Malaysian Rubber Board 2002). Sampel (filtrat ekstrak protein) diencerkan sampai volume akhirnya 1.6 mL, lalu ditambah 600 µL pereaksi C Lowry (Lampiran 2), divorteks dan didiamkan selama 10 menit. Selanjutnya ditambah 200 µL pereaksi D Lowry (Lampiran 2), divorteks, dan didiamkan selama 30 menit. Serapan warna diukur pada panjang gelombang 750 nm. Konsentrasi protein ditentukan berdasarkan kurva standar bovinserum albumin (BSA) konsentrasi 12.5–200 µg/mL (Lampiran 4).
Analisis Protein dengan Elektroforesis SDS-PAGE
Gel yang digunakan terdiri atas dua bagian, yaitu gel atas (stacking gel) dan gel bawah (running gel) (Laemmli 1970). Proses pembuatan running gel dilakukan dengan cara mencampurkan 3.35 mL akuades, 2.5 mL tris HCl pH 8.8. 0.1 mL
SDS 10%, dan 4 mL bis-akrilamida. Kemudian ditambah 0.05 mL APS 10%, dan 0.008 mL TEMED sambil digoyang perlahan. Running gel yang masih cair tersebut dimasukkan ke dalam kaca cetakan setinggi batas atas, kemudian ditambahkan isopropanol sampai batas ujung kaca untuk meratakan permukaan gel, lalu dibiarkan sampai membeku.
Setelah gel membeku, isopropanol dibuang dari cetakan dan dikeringkan dengan menggunakan kertas saring. Selanjutnya, bagian atas kaca cetakan yang kosong diisi dengan
stacking gel yang dibuat dengan cara mencampurkan 2.95 mL akuades, 1.25 mL tris HCl pH 6.8, 0.05 mL SDS 10%, dan 0.7 mL bis-akrilamida. Setelah tercampur rata, ditambahkan 0.05 mL APS 10% dan 0.008 mL TEMED. Kemudian sisiran pembuat sumur dimasukkan ke dalam cetakan. Gel dibiarkan sampai membeku. Setelah sisiran diangkat, tercetak sumur-sumur sesuai dengan jumlah gerigi pada sisiran sebagai tempat sampel, yang selanjutnya dipasang pada alat elektroforesis. Sebelum dimasukkan ke dalam sumur, sampel ditambahkan sampel bufer (Lampiran 2) dengan nisbah 1:1 kemudian divorteks. Selanjutnya, sampel dipanaskan selama 4 menit, lalu didinginkan dan dimasukkan ke dalam setiap sumur. Sebagai standar, digunakan
penanda yang telah diketahui bobot
molekulnya. Penanda ditambah sampel bufer dengan nisbah 1:20. Bufer elektrode (Lampiran 2) dimasukkan ke dalam alat elektroforesis lalu di running dengan tegangan 150 volt dan dihentikan setelah sampel sampai pada ujung gel kurang lebih selama satu jam. Setelah proses running selesai, gel dilepaskan dari cetakan dan dilakukan pewarnaan.
Pewarnaan gel dilakukan dengan menggunakan dua cara, yaitu dengan biru Coomasie dan AgNO3. Untuk pewarnaan
dengan biru Coomasie, gel yang telah dilepas dari cetakan direndam dalam larutan pewarna sambil digoyang selama 1.5 jam. Selanjutnya gel dicuci selama 15 menit berulang kali dengan larutan penghilang warna sampai larutan menjadi jernih. Gel diawetkan dengan menggunakan selofan.
Sementara untuk pewarnaan dengan AgNO3, gel direndam dalam larutan fiksasi
6
(Lampiran 2) sampai diperoleh intensitas warna yang diinginkan. Setelah pita protein muncul, gel dicuci kembali dengan akuades selama 2 menit sebanyak 5 kali. Gel diawetkan dengan menggunakan selofan.
Immunoblotting
Gel hasil elektroforesis yang tidak diwarnai, ditransfer ke membran nitroselulosa. Gel dan membran nitroselulosa disusun dalam alat
transblotting (metode sandwich), lalu diisi dengan bufer transfer. Blotting dilakukan selama satu jam pada arus konstan 0.25 A. Pewarnaan dilakukan dengan cara merendam membran dengan larutan bufer
western selama 1 jam pada suhu kamar sambil digoyang. Selanjutnya larutan dibuang dan membran diinkubasi dalam antibodi yang telah diencerkan dengan bufer
western dengan nisbah 1:6 untuk serum manusia dan 1:1000 untuk serum kelinci. Membran direndam sambil digoyang selama 1 jam pada suhu kamar. Setelah itu, membran dicuci selama 30 menit menggunakan campuran PBS dan Tween 20 (PBS Tween 0.05%) sambil digoyang. Kemudian membran direndam dalam HR-peroksidase konjugat yang telah diencerkan dengan bufer western dengan nisbah 1:1000 selama 1 jam sambil digoyang. Membran kemudian dicuci kembali menggunakan PBS tween 0.05% selama 30 menit sambil digoyang. Untuk pewarnaan, membran direndam dengan larutan substrat DAB (Lampiran 2) sampai muncul warna yang diinginkan.
Elektroeluter
Membran direndam dalam bufer elusi selama 1 jam pada suhu 60 ºC sebelum digunakan. Beberapa tabung gelas diletakkan pada tabung dengan diberi jarak dari dasar tabung. Tabung gelas tersebut dimasukkan ke dalam gromet dan ditetesi dengan bufer elusi sedikit demi sedikit. Lubang yang tidak digunakan ditutup dengan penutup. Setiap satu membran yang telah dibasahi diletakkan pada dasar adaptor silikon dan bagian dasarnya diisi dengan bufer elusi (± 400 µL) dan gelembung udara yang ada di sekitar membran dihilangkan dengan menggunakan pipet. Adaptor silikon lalu dipasang pada dasar tabung gelas dan semua gelembung dihilangkan. Setiap tabung diisi dengan bufer elusi dan potongan
gel diletakkan pada tabung kaca. Tinggi gel dengan gelas < 1 cm. Bagan alat elektroeluter terdapat dalam Lampiran 3.
Seluruh modul diletakkan dalam alat elektroforesis. Ruang bawah diisi dengan 600 mL bufer elusi dan tingginya harus lebih tinggi dari permukaan atas adaptor. Ruang atas diisi dengan ± 100 mL dan banana plugs harus kering. Pengaduk magnetik dimasukkan dalam tangki dan diaduk selama running. Elusi dilakukan pada arus konstan 8–10 mA untuk tiap gel dan dilakukan selama 5 jam. Hasil protein yang terelusi lalu dianalisis dengan menggunakan HPLC untuk mengetahui asam amino penyusunnya.
Analisis Asam Amino menggunakan HPLC
Protein hasil elusi kemudian dianalisis menggunakan HPLC untuk mengetahui asam amino penyusunnya. Sampel terlebih dahulu diberi perlakuan prakolom dengan menambahkan reagen o-ftalaldehida (OPA) dan 9-fluorenilmetil kloroformat (Fmoc-Cl). Sampel
lalu dianalisis dengan menggunakan HPLC fase terbalik (RP-HPLC). Kolom yang digunakan adalah Phenomenex Hypersil C18 pada suhu 40 ºC dengan detektor fluoresens (Soesilo 1995).
Dalam RP-HPLC, pemisahan dilakukan berdasarkan perbedaan kepolaran. Fase diam bersifat nonpolar dan fase gerak bersifat polar, sehingga senyawa yang bersifat nonpolar akan ditahan lebih kuat oleh fase diamnya sedangkan komponen yang bersifat polar akan ditahan lebih lemah. Hal ini menyebabkan senyawa yang lebih polar akan keluar terlebih dahulu dan memiliki waktu retensi yang lebih pendek dibandingkan dengan senyawa nonpolar.
Untuk memperoleh hasil yang baik, digunakan beberapa sistem pelarut untuk menyesuaikan kepolarannya (jenis elusi gradien). Eluen pertama ialah campuran bufer pH 10-trietilamina dan eluen kedua ialah campuran metanol-asetonitril.
HASIL DAN PEMBAHASAN
Penetapan Kandungan Protein Terekstraksidengan Metode Lowry
6
(Lampiran 2) sampai diperoleh intensitas warna yang diinginkan. Setelah pita protein muncul, gel dicuci kembali dengan akuades selama 2 menit sebanyak 5 kali. Gel diawetkan dengan menggunakan selofan.
Immunoblotting
Gel hasil elektroforesis yang tidak diwarnai, ditransfer ke membran nitroselulosa. Gel dan membran nitroselulosa disusun dalam alat
transblotting (metode sandwich), lalu diisi dengan bufer transfer. Blotting dilakukan selama satu jam pada arus konstan 0.25 A. Pewarnaan dilakukan dengan cara merendam membran dengan larutan bufer
western selama 1 jam pada suhu kamar sambil digoyang. Selanjutnya larutan dibuang dan membran diinkubasi dalam antibodi yang telah diencerkan dengan bufer
western dengan nisbah 1:6 untuk serum manusia dan 1:1000 untuk serum kelinci. Membran direndam sambil digoyang selama 1 jam pada suhu kamar. Setelah itu, membran dicuci selama 30 menit menggunakan campuran PBS dan Tween 20 (PBS Tween 0.05%) sambil digoyang. Kemudian membran direndam dalam HR-peroksidase konjugat yang telah diencerkan dengan bufer western dengan nisbah 1:1000 selama 1 jam sambil digoyang. Membran kemudian dicuci kembali menggunakan PBS tween 0.05% selama 30 menit sambil digoyang. Untuk pewarnaan, membran direndam dengan larutan substrat DAB (Lampiran 2) sampai muncul warna yang diinginkan.
Elektroeluter
Membran direndam dalam bufer elusi selama 1 jam pada suhu 60 ºC sebelum digunakan. Beberapa tabung gelas diletakkan pada tabung dengan diberi jarak dari dasar tabung. Tabung gelas tersebut dimasukkan ke dalam gromet dan ditetesi dengan bufer elusi sedikit demi sedikit. Lubang yang tidak digunakan ditutup dengan penutup. Setiap satu membran yang telah dibasahi diletakkan pada dasar adaptor silikon dan bagian dasarnya diisi dengan bufer elusi (± 400 µL) dan gelembung udara yang ada di sekitar membran dihilangkan dengan menggunakan pipet. Adaptor silikon lalu dipasang pada dasar tabung gelas dan semua gelembung dihilangkan. Setiap tabung diisi dengan bufer elusi dan potongan
gel diletakkan pada tabung kaca. Tinggi gel dengan gelas < 1 cm. Bagan alat elektroeluter terdapat dalam Lampiran 3.
Seluruh modul diletakkan dalam alat elektroforesis. Ruang bawah diisi dengan 600 mL bufer elusi dan tingginya harus lebih tinggi dari permukaan atas adaptor. Ruang atas diisi dengan ± 100 mL dan banana plugs harus kering. Pengaduk magnetik dimasukkan dalam tangki dan diaduk selama running. Elusi dilakukan pada arus konstan 8–10 mA untuk tiap gel dan dilakukan selama 5 jam. Hasil protein yang terelusi lalu dianalisis dengan menggunakan HPLC untuk mengetahui asam amino penyusunnya.
Analisis Asam Amino menggunakan HPLC
Protein hasil elusi kemudian dianalisis menggunakan HPLC untuk mengetahui asam amino penyusunnya. Sampel terlebih dahulu diberi perlakuan prakolom dengan menambahkan reagen o-ftalaldehida (OPA) dan 9-fluorenilmetil kloroformat (Fmoc-Cl). Sampel
lalu dianalisis dengan menggunakan HPLC fase terbalik (RP-HPLC). Kolom yang digunakan adalah Phenomenex Hypersil C18 pada suhu 40 ºC dengan detektor fluoresens (Soesilo 1995).
Dalam RP-HPLC, pemisahan dilakukan berdasarkan perbedaan kepolaran. Fase diam bersifat nonpolar dan fase gerak bersifat polar, sehingga senyawa yang bersifat nonpolar akan ditahan lebih kuat oleh fase diamnya sedangkan komponen yang bersifat polar akan ditahan lebih lemah. Hal ini menyebabkan senyawa yang lebih polar akan keluar terlebih dahulu dan memiliki waktu retensi yang lebih pendek dibandingkan dengan senyawa nonpolar.
Untuk memperoleh hasil yang baik, digunakan beberapa sistem pelarut untuk menyesuaikan kepolarannya (jenis elusi gradien). Eluen pertama ialah campuran bufer pH 10-trietilamina dan eluen kedua ialah campuran metanol-asetonitril.
HASIL DAN PEMBAHASAN
Penetapan Kandungan Protein Terekstraksidengan Metode Lowry
7
pabrik. Tahapan tersebut meliputi sentrifugasi untuk memperoleh lateks pekat, pencucian/leaching, serta penambahan dan pencampuran dengan bahan kimia tertentu (Siswanto 1997). Protein terekstraksi adalah protein permukaan yang terlarut jika bahan jadi lateks alam diekstraksi.
Hasil yang diperoleh pada Tabel 1 menunjukkan bahwa serum-C dan lutoid memiliki kandungan protein total yang jauh lebih besar bila dibandingkan dengan sarung tangan karet. Serum-C dan lutoid merupakan fraksi dasar lateks alam yang belum mengalami proses produksi seperti sarung tangan karet.
Tabel 1 Kandungan protein total sampel Konsentrasi Sampel
µg/ml µg/g Sarung tangan
komersial* 550.1 1650.3
Sarung tangan DPNR 116.7 350.0
Serum C 2004.7 -
Lutoid 2099.2 -
* Komersial: campuran berbagai macam merk produksi dalam negeri.
Penelitian baru-baru ini telah menciptakan suatu jenis lateks baru, yaitu lateks alam DPNR, jenis lateks alam yang kandungan proteinnya telah dikurangi. Sampai saat ini, telah diketahui beberapa cara untuk memperoleh lateks alam tersebut, di antaranya dengan cara sentrifugasi berulang (Subramaniam 1992), pencucian (Yusof & Yeang 1992), iradiasi (Geerstma
et al. 1996), dan penambahan enzim papain (Alfa 2002). Setiap cara memiliki kekurangan dan kelebihannya masing-masing. Yang paling banyak digunakan saat ini adalah penambahan enzim papain. Menurut Alfa (2002), penggunaan enzim papain dalam peluruhan protein menurunkan kandungan nitrogen lateks kebun dari 0.46% menjadi 0.07%.
Berdasarkan Tabel 1, dapat diketahui bahwa sarung tangan DPNR memiliki kandungan protein total yang lebih kecil sebesar 78.79% bila dibandingkan dengan sarung tangan komersial. Namun, kandungan protein sarung tangan DPNR sebesar 350.0 µg/g ini masih dua kali lebih besar dari standar yang telah diberlakukan oleh FDA, yang sebesar 150 µg/g. Karena itu, perlu dicari cara lain untuk dapat lebih menurunkan kandungan protein total tersebut agar berada di bawah standar FDA.
Penetapan Bobot Molekul Ekstrak Protein Sarung Tangan dengan Metode
Elektroforesis SDS-PAGE
Analisis semi kuantitatif terhadap keberadaan protein antigen pada berbagai produk barang jadi lateks alam dapat dilakukan secara imunologi menggunakan metode
immunoblotting. Metode ini diawali dengan pemisahan protein secara SDS-PAGE untuk mengetahui bobot molekul protein yang mungkin terdapat pada sampel.
Elektroforesis SDS-PAGE dilakukan pada konsentrasi gel 12% dengan pewarna biru Coomasie dan AgNO3. Berdasarkan Tabel 1
diketahui bahwa serum C dan lutoid memiliki kandungan protein total yang jauh lebih besar bila dibandingkan dengan sampel sarung tangan. Hal ini terbukti pada saat pewarnaan dengan pewarna biru Coomasie, sampel sarung tangan tidak menunjukkan adanya pita protein, karena kandungan protein keduanya yang relatif kecil. Limit deteksi biru Coomasie adalah 0.5–20 µg protein (William 2002). Karena itu digunakan pewarna AgNO3 yang memiliki
sensitivitas sebesar 10 ng/pita protein (Coachman et al. 2002). Dengan menggunakan pewarna AgNO3, kedua sampel tersebut
menunjukkan adanya pita protein seperti yang ditunjukkan pada Gambar 3.
Hasil pemisahan menunjukkan perbedaan baik komposisi maupun intensitas dari pita protein yang terbentuk pada sampel lateks (serum-C dan lutoid) dan protein terekstraksi dari barang jadi lateks alam (sarung tangan). Sampel sarung tangan karet, baik komersial maupun DPNR memiliki komposisi dan intensitas yang lebih rendah daripada pita protein sampel fraksi segar lateks (serum-C dan lutoid) (Gambar 3). Keadaan ini sesuai dengan kandungan protein total yang diperoleh pada Tabel 1. Perbedaan ini menunjukkan bahwa hanya sebagian kecil protein lateks yang terbawa pada produk jadinya. Hal ini sesuai dengan yang dilaporkan oleh Siswanto et al.
8
1 2 3 4 5
Gambar 3 Pita protein hasil SDS-PAGE dengan pewarna AgNO3:
(1) Standar; (2) Lutoid; (3) Serum C; (4) Sarung
tangan DPNR; (5) Sarung tangan komersial.
Berdasarkan Gambar 3, diketahui bahwa sampel lutoid dan serum-C memiliki pita protein yang cukup identik. Dari hasil perhitungan dengan kurva standar (Lampiran 5) sampel lutoid memiliki 22 pita protein dan serum C memiliki 25 pita protein dengan 11 pita protein yang identik, yaitu protein dengan bobot molekul 97, 76, 60, 43, 33, 27, 23, 19, 17, 12, dan 10 kDa (Lampiran 6).
Gambar 3 menunjukkan bahwa sampel sarung tangan komersial dan DPNR memiliki jumlah pita protein yang lebih sedikit bila dibandingkan dengan sampel fraksi segar lateks dan merupakan pita protein minor. Pita protein yang ditunjukkan oleh fraksi segar lateks dan sarung tangan (komersial dan DPNR) berdasarkan perhitungan dengan kurva standar (Lampiran 5) hanya menunjukkan 2 pita protein yang identik, yaitu pada bobot molekul 43 dan 10 kDa. Hal ini terjadi karena sebagian besar protein akan hilang, berkurang, atau muncul jenis protein baru ketika melewati beberapa tahapan proses dalam pembuatan produk barang jadi lateks alam.
Hal tersebut juga terjadi pada sampel sarung tangan komersial dan DPNR. Sarung tangan DPNR yang mengalami proses penurunan kandungan protein total memiliki jumlah pita protein yang lebih sedikit bila dibandingkan dengan sarung tangan komersial yang tidak mengalami proses
tersebut. Namun dari hasil perhitungan, diketahui masih terdapat pita protein yang identik satu sama lain yaitu protein dengan bobot molekul 128, 116, 73, 54, 49, 46, 43, 37, 31, 26, dan 10 kDa.
Telah banyak penelitian yang dilakukan untuk mengidentifikasi protein alergen dari lateks, baik dengan cara skin prick test (Santoso & Siswanto 1997), pola ikatan protein dengan IgE manusia, ataupun dengan serum IgG dari kelinci.
Identifikasi Protein Antigen dengan Metode
Immunoblotting
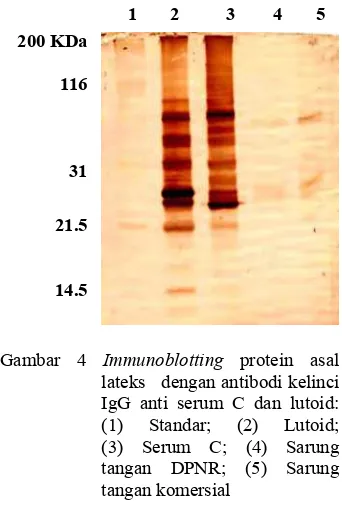
Hasil penelitian sebelumnya menunjukkan bahwa tidak semua protein lateks bersifat alergenik terhadap manusia. Deteksi protein antigen/alergen dapat dilakukan dengan western blotting (Siswanto 1998). Protein dari sampel lutoid, serum-C, sarung tangan komersial, dan DPNR setelah dipisahkan dengan SDS-PAGE kemudian ditransfer ke membran nitroselulosa. Membran kemudian direaksikan dengan (1) IgE manusia yang alergi terhadap sarung tangan karet, (2) antibodi IgE manusia yang tidak alergi terhadap sarung tangan karet, dan (3) antibodi IgG kelinci anti serum-C dan lutoid. Selanjutnya membran diinkubasi dalam konjugat peroksidase dan substrat yang dapat berpendar. Reaksi positif ditunjukkan dengan munculnya pita protein berwarna kecokelatan seperti Gambar 4.
Hasil yang diperoleh menunjukkan bahwa hanya membran yang diinkubasi dengan IgG antibodi kelinci anti serum-C dan lutoid yang menunjukkan adanya pita protein (Gambar 4). Membran yang diinkubasi dalam IgE manusia baik yang positif maupun yang negatif alergi terhadap sarung tangan karet sama sekali tidak menunjukkan adanya pita protein. Hasil ini tidak membuktikan bahwa dalam sampel tidak terdapat protein antigen. Banyak faktor yang dapat menyebabkan hal ini. Salah satunya adalah bahwa antibodi IgE dalam serum darah manusia jumlahnya paling sedikit bila dibandingkan dengan keempat imunoglobulin lain, yaitu hanya sebesar 1% dari total imunoglobulin manusia (Price & Lorraine 1994). Hal ini menyebabkan kecil kemungkinan terjadi ikatan spesifik antara antigen dan antibodi.
Selain antigen dan antibodi, komponen lain yang berperan adalah substrat dan konjugat. Substrat yang digunakan adalah substrat kromogenik, yaitu suatu bahan yang semula tidak berwarna dan kemudian menjadi berwarna karena dihidrolisis oleh suatu konjugat.
200 KDa
97.4
66
45 31
14.5
116
9
Konjugat yang digunakan memiliki dua syarat penting, yaitu tidak mengurangi sifat imunologik antigen dan antibodi, serta murni dan stabil jika disimpan dalam jangka waktu tertentu (Boedina 1984). Oleh karena itu, reaksi spesifik antigen-antibodi ini juga sangat dipengaruhi oleh keadaan substrat dan konjugat yang digunakan.
1 2 3 4 5
Gambar 4 Immunoblotting protein asal lateks dengan antibodi kelinci IgG anti serum C dan lutoid: (1) Standar; (2) Lutoid; (3) Serum C; (4) Sarung tangan DPNR; (5) Sarung tangan komersial
Intensitas warna yang tebal pada pita protein sampel lutoid dan serum-C menunjukkan konsentrasi yang cukup tinggi dalam sampel dan termasuk ke dalam jenis protein mayor, sedangkan pita protein pada sampel sarung tangan sangat tipis yang berarti jenis proteinnya minor (konsentrasinya dalam sampel cukup rendah). Walaupun protein tersebut berada dalam konsentrasi yang cukup rendah, tetap harus diwaspadai karena keberadaannya masih tetap memiliki peluang untuk terjadinya reaksi hipersensitivitas tipe cepat. Hasil inkubasi protein sampel dengan antibodi IgG kelinci anti serum-C dan lutoid (Gambar 4) menunjukkan terdapat satu pita protein antigen yang muncul pada keempat sampel yang diuji. Berdaskaran perhitungan kurva standar (Lampiran 7), protein tersebut memiliki bobot molekul 43 kDa. Protein dengan bobot molekul ini terdapat pada ketiga fraksi lateks, yaitu fraksi lutoid, fraksi serum-C, dan juga fraksi karet yang diwakili oleh kedua jenis sarung tangan karet. Berdasarkan data WHO-IUIS (Lampiran 1),
diketahui bahwa protein pada bobot molekul 43 kDa ini merupakan protein alergen Hev b7.02 yang berhubungan dengan pertahanan karet dan memiliki nama trivial patatin homologue.
Protein ini dalam lateks alam berada dalam fraksi serum-C dan termasuk ke dalam protein minor yang konsentrasinya cukup rendah.
Analisis Asam Amino Menggunakan HPLC
Protein merupakan poliamida, dan apabila dihidrolisis dapat menghasilkan asam-asam amino. Hidrolisis dilakukan untuk memecahkan ikatan peptida yang menghubungkan asam-asam amino sehingga dapat ditentukan asam-asam amino penyusun protein tersebut (Mayes et al. 1987). Pemutusan ikatan amida dari protein dapat dilakukan dengan empat cara, yaitu autolisis, hidrolisis, enzimolisis, dan fermentasi. Seperti yang telah dijelaskan sebelumnya, sebagian besar antigen adalah protein.
Analisis HPLC dilakukan untuk mengetahui asam amino penyusun dalam protein antigen yang diperkirakan sebagai protein alergen dalam sarung tangan karet dan dibandingkan dengan asam-asam amino penyusun protein non-antigen. Protein antigen yang diuji adalah protein dengan bobot molekul 43 kDa sedangkan protein nonantigennya berbobot molekul 30 kDa.
Sampel protein yang telah dielusi kemudian langsung dianalisis dengan HPLC. Sebelumnya dilakukan analisis prakolom dengan penambahan reagen OPA dan Fmoc-Cl. Metode prakolom ini telah banyak digunakan karena reaksinya cepat dan memiliki sensitivitas yang baik. Reaksi yang terjadi dalam analisis prakolom terdiri dari dua tahapan. Tahapan pertama ialah reaksi antara OPA yang mengandung asam 3-merkaptopropionat dengan amina primer membentuk suatu turunan isoindol, dan tahapan kedua adalah reaksi antara Fmoc-Cl dengan amina sekunder membentuk suatu amida sekunder. Kedua reagen ini dapat berfluoresensi sehingga dapat terdeteksi oleh detektor fluoresens yang digunakan dalam HPLC.
Hasil analisis dengan HPLC (Lampiran 9) menunjukkan protein antigen pada bobot molekul 43 kDa memiliki 7 puncak asam amino dan protein nonantigen pada 30 kDa memiliki 5 puncak asam amino (Lampiran 10). Ketujuh asam amino pada protein antigen adalah asam aspartat, arginin, histidin, valin, norvalin, isoleusin, dan leusin. Sementara asam amino pada protein nonantigen adalah histidin, arginin, valin, isoleusin, dan leusin. Terdapat 2 buah asam amino yang membedakan antara
200 KDa
116
31
21.5
10
protein antigen dan protein non-antigen, yaitu asam aspartat dan norvalin.
Hasil yang diperoleh menunjukkan bahwa protein antigen sarung tangan mengandung asam aspartat, Hal ini sesuai dengan yang dilaporkan oleh Daul et al.
(1994) yang menyatakan bahwa asam amino penyusun utama protein alergen udang pada 36 kDa adalah asam glutamat dan asam aspartat
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil penentuan kandungan protein total, disimpulkan bahwa sarung tangan komersial memiliki kandungan protein total sebesar 1650.3, µg/g sedangkan sarung tangan DPNR sebesar 350.0 µg/g yang berarti lebih kecil 78.79% daripada sarung tangan komersial. Hasil elektroforesis SDS-PAGE menunjukkan bahwa masing-masing sampel mengandung banyak protein, namun hasil immunoblotting hanya menunjukkan satu pita protein antigen yang identik, yaitu protein dengan bobot molekul 43 kDa yang diketahui bersifat alergen.
Hasil HPLC menunjukkan bahwa protein antigen pada 43 kDa mengandung 7 asam amino, yaitu asam aspartat, arginin, histidin, valin, norvalin, leusin, dan isoleusin. Sementara protein nonantigen pada 30 kDa mengandung 5 asam amino, yaitu histidin, arginin, valin, leusin, dan isoleusin. 2 asam amino yang membedakan antara protein antigen dan protein nonantigen adalah asam aspartat dan norvalin.
Saran
Perlu dilakukan analisis lebih lanjut untuk membuktikan bahwa protein dengan bobot molekul 43 kDa pada sarung tangan benar-benar bersifat alergen, dengan cara mereaksikannya dengan serum IgE manusia yang alergi terhadap sarung tangan. Selain itu, perlu dilakukan proses lain agar kandungan protein total sarung tangan DPNR dapat melewati pelabelan FDA.
DAFTAR PUSTAKA
Alfa AA. 2002. Produksi Karet Berprotein Rendah dari Lateks Karet Alam dengan Menggunakan Papain [tesis]. Bogor:
Program Pascasarjana, Institut Pertanian Bogor.
[Ansell] Ansell Cares. 2004. Pengelolaan Alergi Lateks. www.ansell health care.com. [13 Agu 2006].
Baratawidjaja KG. 2006. Imunologi Dasar. Ed ke-7. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Beezhold DH, Susman GL, Kostyal DA, Chang NS. 1994. Identification of a 46 kDa Latex Protein Allergen in Health Care Workers.
Clin. Exp. Immunol 98: 408-413.
Boedina KS. 1984. Imunologi: Diagnosis dan Prosedur laboratorium. Jakarta: FKUI.
Caprette DR. 2005. Preparing SDS-Gels.
Experimental Biosciences. Introductory Laboratory-Bios 211.Rice University
Chalear N, Bangornsri J, Witchara B, Tipaporn K, Pornpun S. 2006. Glove Allergy and Sensitization to Natural Rubber Latex Among Nurseing Staff at Srinagaruna Hospital, Khon Kaen, Thailand. J Med Assoc Thai 89 (3): 368-76.
Dalimunthe A. 2004. Biosintesis Lateks. Medan: Program Studi Kehutanan Fakultas Pertanian USU.
Daul CB, Slattery M, Reese G, Lehrer SB.
1994. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin. Department of Medicine, Tulane University School of Medicine, New Orleans, LA 70112. Int Arch Allergy Immunol. [24 Juli 2007]
Day RA, dan Underwood AL,. 1992. Analisis Kimia Kuantitatif. Ed ke-5. AH. Pudjaatmaka penerjemah. Jakarta: Erlangga.
Duke JA. 1983. Hevea brasiliensis (Willd.). Handbook of Energy Crops. (Tidak dipublikasikan).
Geertsma RE, Orzecinowski JTH, Jonker M, Dorpema JM, Van Aster JAAM. 1996. Biological Evaluation of PVNRL [abstrak]. Di dalam: Proc Ind. Symp. On RVNRL.
10
protein antigen dan protein non-antigen, yaitu asam aspartat dan norvalin.
Hasil yang diperoleh menunjukkan bahwa protein antigen sarung tangan mengandung asam aspartat, Hal ini sesuai dengan yang dilaporkan oleh Daul et al.
(1994) yang menyatakan bahwa asam amino penyusun utama protein alergen udang pada 36 kDa adalah asam glutamat dan asam aspartat
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil penentuan kandungan protein total, disimpulkan bahwa sarung tangan komersial memiliki kandungan protein total sebesar 1650.3, µg/g sedangkan sarung tangan DPNR sebesar 350.0 µg/g yang berarti lebih kecil 78.79% daripada sarung tangan komersial. Hasil elektroforesis SDS-PAGE menunjukkan bahwa masing-masing sampel mengandung banyak protein, namun hasil immunoblotting hanya menunjukkan satu pita protein antigen yang identik, yaitu protein dengan bobot molekul 43 kDa yang diketahui bersifat alergen.
Hasil HPLC menunjukkan bahwa protein antigen pada 43 kDa mengandung 7 asam amino, yaitu asam aspartat, arginin, histidin, valin, norvalin, leusin, dan isoleusin. Sementara protein nonantigen pada 30 kDa mengandung 5 asam amino, yaitu histidin, arginin, valin, leusin, dan isoleusin. 2 asam amino yang membedakan antara protein antigen dan protein nonantigen adalah asam aspartat dan norvalin.
Saran
Perlu dilakukan analisis lebih lanjut untuk membuktikan bahwa protein dengan bobot molekul 43 kDa pada sarung tangan benar-benar bersifat alergen, dengan cara mereaksikannya dengan serum IgE manusia yang alergi terhadap sarung tangan. Selain itu, perlu dilakukan proses lain agar kandungan protein total sarung tangan DPNR dapat melewati pelabelan FDA.
DAFTAR PUSTAKA
Alfa AA. 2002. Produksi Karet Berprotein Rendah dari Lateks Karet Alam dengan Menggunakan Papain [tesis]. Bogor:
Program Pascasarjana, Institut Pertanian Bogor.
[Ansell] Ansell Cares. 2004. Pengelolaan Alergi Lateks. www.ansell health care.com. [13 Agu 2006].
Baratawidjaja KG. 2006. Imunologi Dasar. Ed ke-7. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Beezhold DH, Susman GL, Kostyal DA, Chang NS. 1994. Identification of a 46 kDa Latex Protein Allergen in Health Care Workers.
Clin. Exp. Immunol 98: 408-413.
Boedina KS. 1984. Imunologi: Diagnosis dan Prosedur laboratorium. Jakarta: FKUI.
Caprette DR. 2005. Preparing SDS-Gels.
Experimental Biosciences. Introductory Laboratory-Bios 211.Rice University
Chalear N, Bangornsri J, Witchara B, Tipaporn K, Pornpun S. 2006. Glove Allergy and Sensitization to Natural Rubber Latex Among Nurseing Staff at Srinagaruna Hospital, Khon Kaen, Thailand. J Med Assoc Thai 89 (3): 368-76.
Dalimunthe A. 2004. Biosintesis Lateks. Medan: Program Studi Kehutanan Fakultas Pertanian USU.
Daul CB, Slattery M, Reese G, Lehrer SB.
1994. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin. Department of Medicine, Tulane University School of Medicine, New Orleans, LA 70112. Int Arch Allergy Immunol. [24 Juli 2007]
Day RA, dan Underwood AL,. 1992. Analisis Kimia Kuantitatif. Ed ke-5. AH. Pudjaatmaka penerjemah. Jakarta: Erlangga.
Duke JA. 1983. Hevea brasiliensis (Willd.). Handbook of Energy Crops. (Tidak dipublikasikan).
Geertsma RE, Orzecinowski JTH, Jonker M, Dorpema JM, Van Aster JAAM. 1996. Biological Evaluation of PVNRL [abstrak]. Di dalam: Proc Ind. Symp. On RVNRL.
10
protein antigen dan protein non-antigen, yaitu asam aspartat dan norvalin.
Hasil yang diperoleh menunjukkan bahwa protein antigen sarung tangan mengandung asam aspartat, Hal ini sesuai dengan yang dilaporkan oleh Daul et al.
(1994) yang menyatakan bahwa asam amino penyusun utama protein alergen udang pada 36 kDa adalah asam glutamat dan asam aspartat
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil penentuan kandungan protein total, disimpulkan bahwa sarung tangan komersial memiliki kandungan protein total sebesar 1650.3, µg/g sedangkan sarung tangan DPNR sebesar 350.0 µg/g yang berarti lebih kecil 78.79% daripada sarung tangan komersial. Hasil elektroforesis SDS-PAGE menunjukkan bahwa masing-masing sampel mengandung banyak protein, namun hasil immunoblotting hanya menunjukkan satu pita protein antigen yang identik, yaitu protein dengan bobot molekul 43 kDa yang diketahui bersifat alergen.
Hasil HPLC menunjukkan bahwa protein antigen pada 43 kDa mengandung 7 asam amino, yaitu asam aspartat, arginin, histidin, valin, norvalin, leusin, dan isoleusin. Sementara protein nonantigen pada 30 kDa mengandung 5 asam amino, yaitu histidin, arginin, valin, leusin, dan isoleusin. 2 asam amino yang membedakan antara protein antigen dan protein nonantigen adalah asam aspartat dan norvalin.
Saran
Perlu dilakukan analisis lebih lanjut untuk membuktikan bahwa protein dengan bobot molekul 43 kDa pada sarung tangan benar-benar bersifat alergen, dengan cara mereaksikannya dengan serum IgE manusia yang alergi terhadap sarung tangan. Selain itu, perlu dilakukan proses lain agar kandungan protein total sarung tangan DPNR dapat melewati pelabelan FDA.
DAFTAR PUSTAKA
Alfa AA. 2002. Produksi Karet Berprotein Rendah dari Lateks Karet Alam dengan Menggunakan Papain [tesis]. Bogor:
Program Pascasarjana, Institut Pertanian Bogor.
[Ansell] Ansell Cares. 2004. Pengelolaan Alergi Lateks. www.ansell health care.com. [13 Agu 2006].
Baratawidjaja KG. 2006. Imunologi Dasar. Ed ke-7. Jakarta: Balai Penerbit Fakultas Kedokteran Universitas Indonesia.
Beezhold DH, Susman GL, Kostyal DA, Chang NS. 1994. Identification of a 46 kDa Latex Protein Allergen in Health Care Workers.
Clin. Exp. Immunol 98: 408-413.
Boedina KS. 1984. Imunologi: Diagnosis dan Prosedur laboratorium. Jakarta: FKUI.
Caprette DR. 2005. Preparing SDS-Gels.
Experimental Biosciences. Introductory Laboratory-Bios 211.Rice University
Chalear N, Bangornsri J, Witchara B, Tipaporn K, Pornpun S. 2006. Glove Allergy and Sensitization to Natural Rubber Latex Among Nurseing Staff at Srinagaruna Hospital, Khon Kaen, Thailand. J Med Assoc Thai 89 (3): 368-76.
Dalimunthe A. 2004. Biosintesis Lateks. Medan: Program Studi Kehutanan Fakultas Pertanian USU.
Daul CB, Slattery M, Reese G, Lehrer SB.
1994. Identification of the major brown shrimp (Penaeus aztecus) allergen as the muscle protein tropomyosin. Department of Medicine, Tulane University School of Medicine, New Orleans, LA 70112. Int Arch Allergy Immunol. [24 Juli 2007]
Day RA, dan Underwood AL,. 1992. Analisis Kimia Kuantitatif. Ed ke-5. AH. Pudjaatmaka penerjemah. Jakarta: Erlangga.
Duke JA. 1983. Hevea brasiliensis (Willd.). Handbook of Energy Crops. (Tidak dipublikasikan).
Geertsma RE, Orzecinowski JTH, Jonker M, Dorpema JM, Van Aster JAAM. 1996. Biological Evaluation of PVNRL [abstrak]. Di dalam: Proc Ind. Symp. On RVNRL.
11
Girindra A. 1993. Immunokimia. Bogor: PAU-IPB.
Harvey D. 2000. Modern Analytical Chemistry. Ed ke-1. New York: McGraw Hill.
Jacobson ED. 1999. Statement on Latex Alergies. US Department of Health and Human Services: FDA.
Jones KP. 2000. Latex Protein Allergy: Some Questions. From Nature Rubber 17, 1st quarter 2000. International Rubber Research and Development.
Laemmli UK. 1970. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature 227; 680-685.
Law L. 1999. Hevea brasiliensis: The Rubber Tree. Southern Illinois University Carbondale / Ethnobotanical
Leaflets/. URL:
http://www.siu.edu/~ebl/. [4 Okt 2006]
Long OE et al. 1998. Latex Allergy on Your Glove. Malaysia
Malaysian Rubber Board, 2002. Latex protein allergy update: a decade after its emergence. Malaysian Rubber Board: 24 pp.
Mayes PA, Daryl KG, Victor WR, David WM. 1987. Biokimia Harper. Ed ke-20. Iyan Darmawan, alih bahasa. Jakarta: EGC
Nelson, David L, Michael M. Cox. 2005.
Lehninger Principles of Biochemistry
Ed Ke-4. W H. Freeman.
Noel R Rose, Pierluigi E Bigazzi. 1980.
Methods in Immunodiagosis 2nd Edition. New York: John Wiley & Sons.
O’Gilvie W. 1996. Latex sensitisation in the health care setting. Device Bulletin 9601
April 1996, The Medical Devices Agency of the Department of Health.
Palasuo T, Turjanmaa K, Reinkka-Railo H. 2002. Natural Rubber Latex Allergy.
Occupational and Environmental
Medicine 59: 419-424.
www.occenvmed.com. [4 Okt 2006].
Palasuo T, Turjanmaa K, Reinkka-Railo H. 2003. Allergen Content of Latex Gloves: A Market Surveillance Study of Medical Gloves Used in Finlad in 1997. http//www. Latexallergy links.org/NAM.html. [17 Sept 2006].
Price SA, Lorraine MC. 1994. Pathophysiology, Clinical Concepts of Disease Processes. Ed ke-4 Peter Anugrah, penerjemah. Jakarta: EGC
Putri FDRS. 2005. Optimasi Penetapan Kadar Protein Antigen Lateks Karet Alam (Havea brasiliensis) dan Produk Jadinya [skripsi]. Bogor: Program Studi Biokimia Institut Pertanian Bogor.
Rybicki EP, Vernon EC, MD James, Sharon JR,
editor. 1996. Molecular Biology
Techniques Manual. Ed ke-3. University of Capetown.
Schloman WW. 2002. Surfactant treatment reduces both allergen content and cure efficiency of Hevea latex. p. 245–249. In: J. Janick and A. Whipkey (eds.), Trends in new crops and new uses. ASHS Press, Alexandria, VA.
Siswanto. 1997. Extraction of protein from the inner and outher surface of gloves with successive washing technique. Menara Perkebunan 65: 75-84.
Siswanto & Suharyanto. 1997. Perakitan Perangkat Uji Protein Alergen dalam Proses Pembuatan Barang Jadi Asal Lateks
H. brasiliensis. Lap. Akhir Penelitian APBN 1997/1998, 22pp.
Siswanto, Suharyanto, Santoso D, Darussamin A. 1998. Identification of allergenic proteins from latex of Havea brasiliensis
by Immunoblotting technique. Menara Perkebunan 66: 87-95
Siswanto, Sandaru H, Haryono K, Suharyanto. 2002. Allergen on Natural Rubber Gloves. Kongres III KBI & Seminar Bioteknologi ITB, Bandung, 10-11 September 2002.
12
Latex. Bogor: Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI).
Siswanto H. Sundaru H, Haryono K, Suharyanto. 2002. Allergen on Natural rubber gloves. Kongres III KBI & Seminar Bioteknologi ITB, Bandung, 10-11 September 2002.
Siswantoro O. 1993. Tantangan industri lateks pekat dan barang jadi lateks di masa mendatang. Warta Perkaretan 12: 22-23.
Skoog DA, James Holler F, Timothy AN. 1971. Principles of Instrument Analysis. Ed Ke-5. Saunders College Publishing.
Slater JE, Vedvick T, Arthur-Smith A, Trybul DE, and Kekwick RGO. 1996. Identification, Cloning, and Sequence of a Major Allergen (Hev b5) from Natural Rubber Latex (H. brasiliensis). American Soc. Biochem. & Mol. Biol 41: 25394-25399.
Soesilo S (Panitia F.I). 1995. Farmakope Indonesia Edisi IV. Jakarta: Departemen Kesehatan RI
Stehlin D. 2001. Latex Allergies: When Rubber Rubs the Wrong Way. FDA Cunsomer Megazine: FDA
Suharyanto, Siswanto. 1996. Teknik Serologi untuk Deteksi Protein Alergen dalam Barang Jadi Lateks. Warta Puslit II: 10-16.
Suharyanto, Siswanto. 1998. Penetapan Kandungan Protein Alergen Pada Lateks Kebun Dari Berbagai Klon Kebun. Warta Penelitian Bioteknologi Perkebunan IV: 9-15.
Subramaniam A. 1992. Reduction of
Extractable Protein Content in Latex Product. Di dalam O. Siswantoro (penyunting) Sensitivity to Latex in Medical Device. Proc intl. Latex Conf Baltimor: November 1992.
Tanaka Y. 1997. Structure & Properties Deproteinized Natural Rubber. 16p (tidak dipublikasikan).
Tomazic Jezic, Sanchez VJ. 2005. Allergen Profiles of Natural Rubber Latex (NRL) Protein on Gloves and Gloves Powder. J long term Eff Med Implants 15: 115-24.
Watson L, Dallwitz MJ. 2006. The Families of Flowering Plants. http://delta-intkey.com. [5 Sept 2006]
Webster CC, Baulkwill WJ.. 1989. Rubber. New York: Loyman.
Weir DM et al. Leonore A.H, editor. 1986.
Handbook of Experimental Immunology in Four Volumes, Volume 1: Immunochemistry. Ed ke-4. Oxford: Alden Press.
William H. 2002. Coomasie Blue Staining of Protein Gels. Heidcamp, Biology Department, Gustavus Adolphus college.http://homepages.gac.edu/~cellab/c hpts/chpt4/ex4-3. [9 Okt 2006].
Yusof F, Yeang HY. 1992. Quantitation of Proteins from Natural Rubber Latex Gloves. J. Natural Rubber Res 7: 206-218.
1
14
Lampiran 1 Lateks alergen yang terdaftar dalam WHO-IUIS (International Union of Immunological Societies)
Nama Nama trivial Fungsi PIa&b
Bobot molekul (KDa) a&b
No. Protein
No. DNA
a Sifat
allergen Tempat
Hev b 1 Rubber elongation factor Rubber biosynthesis 4.9-5.3, 5.0, 8.5 14.6, 58 P15252 X56535 Major Rubber particle
Hev b 2 β-1,3-glucanases Defense related protein 9.5, 9.8, 10 34-36 P52407 U22147 Major B serum
Hev b 3 Small rubber particle
protein Rubber biosynthesis 4.3-5.7 22-23 O82803 -
Rubber particle
Hev b 4 Microhelix component Defense related protein 4.5 50-57 P82544 - B serum
Hev b 5 Acidic latex protein - 3.5-3.9 16 Q39967 U51361
U42460 Major C-serum
Hev b6.01
Hev b6.02 Hev b6.03
Prohavein hevein
Prohevein C Terminal fragment
Defense related protein (latex coagulation)
5.3,5.6
4.7, 4.9 6.0-7.4
19, 20
4.7 13.3, 14.0
P02877, P80359
M36986
M36986 M36986
Major
Major Major
B serum
B serum B serum Hev b7.01=Hev b13
(renamed) Hev b7.02
Patatin homologue from B serum & C serum
Defense related protein
Inhibitor of rubber synthesis
4.4, 4.8, 6.0 ?
43, 44
?
O04008, O81948, O65811, Q9SEM0
U80598 AJ223038
Minor C serum
Hev b 8 Latex profilin Structural protein 4.9 10.2,
14.2, 15.7
O65812, Q9STB6 Q9M7N0, Q9M7M9
C serum
Hev b 9 Latex enolase Glycolitic enzyme 5.6, 5.9, 6.0 48, 51 Q9LEJ0
Q9LEI9
C serum
Hev b 10 Mn’superoxide dismutase Destructions of radicals 4.3, 5.7, 6.1,
6.3 23, 25, 45
P35017 Q9STB5
B serum
Hev b 11 Class I endochitinase Defense related protein Basic 26.0, 27.5
Q949H3 AJ431363
(gene)
Hev b 12 Lipid transfer protein Defense related protein 9.3 Q8RYA8
Hev b13 = Hev b7.01 Latex esterase Defense related protein 42 P83269 major
15
Lampiran 2 Pembuatan larutan 1 Pereaksi Lowry
Pereaksi A
Sebanyak 15 gram Na2CO3 ditambahkan dengan 2 gram NaOH lalu dilarutkan dengan
akuades dan ditera dalam labu takar 250 mL. Pereaksi B
Sebanyak 0.2345 gram CuSO4 ditambah dengan 0.3 gram Natrium Sitrat lalu dilarutkan
dalam 10 mL akuades. Pereaksi C
Pereaksi A:Pereaksi B = 50:1 Pereaksi D
Folin Ceocalteus:akuades = 3:1 2. Pereaksi SDS-PAGE
Akrilamida/bis (30% r, 2.67% C) 50 mL
Larutan 1 : Sebanyak 14.6 gram akrilamida dilarutkan dalam 15 mL akuades Larutan 2 : Sebanyak 0.4 gram N, N’- metilena-bis- akrilamidaa dilarutkan dalam 15
mL akuades.
Larutan 2 perlahan-lahan ditambahkan ke dalam larutan 1 lalu ditera sampai 50 mL dengan menggunakan akuades. Setelah ditera, larutan tersebut disaring
Bufer tris HCl 0.5 M pH 6.8
Disiapkan HCl 1 N. Sebanyak 3 gram Tris dilarutkan dalam 20 mL akuades. pH larutan tersebut diukur lalu ditentukan sampai menjadi 6.8 dengan menambahkan larutan HCl 1 N sedikit demi sedikit. Setelah pH menjadi 6.8, larutan ditera sampai 50 mL.
Bufer tris HCl 1.5 M pH 8.8
Sebanyak 9.08 gram tris dilarutkan dalam 25 mL akuades kemudian pH diatur menjadi 8.8 dengan menambahkan larutan HCl 1 N. Lalu larutan ditera sampai 50 mL
SDS 10%
Sebanyak 10 gram SDS dilarutkan dalam akuades lalu ditera sampai 100 mL. Bufer elektroda pH 8.3
Sebanyak 6 gram tris, 28.8 gram glisin dan 2 gram SDS dilarutkan dan dihomogenkan dengan 400 mL akuades. Lalu pH larutan diukur tanpa harus menambahkan asam atau basa ke dalam larutan.
Sampel buffer
Sebanyak 1 mL 0.5 tris HCl pH 6.8, 0.8 mL gliserol 87%, 1.6 mL SDS 10%, 0.4 mL
β-Markaptoetanol, 1.5 mL 0.05% Bromphenol blue dan 2.7 mL akuades dihomogenkan dan disimpan dalam botol gelap.
Pewarna perak nitrat
16
Larutan 2 : Sebanyak 21 mL NaOH 0.36% ditambah dengan 1.54 mL NH4OH
25% lalu dihomogenkan.
Larutan 1 ditambahkan sedikit demi sedikit ke dalam larutan 2 sambil terus diaduk. Jika larutan menjadi keruh, pembuatan larutan harus diulangi dari awal. Setelah semua larutan 1 dimasukkan ke dalam larutan 2, lalu larutan ditera sampai 50 mL dengan akuades. Larutan penampak
Sebanyak 2.5 mL asam sitrat 1% ditambah dengan 0.27 mL formaldehida dan 500 mL akuades lalu dihomogenkan.
3. Pereaksi Immunoblotting Transfer buffer
Sebanyak 3.03 gram tris ditambah 14.4 gram glisin dan 200 mL metanol lalu ditera sampai 1 L dengan akuades.
PBS 5×
Sebanyak 10 gram NaCl ditambah 0.25 gram KH2PO4, 4.275 gram Na2HPO4.12H2O dan
0.25 gram KCl lalu dilarutkan dan ditera sampai 250 mL dengan akuades. Dari larutan tersebut diambil 100 mL lalu ditera sampai 500 mL dengan akuades.
PBS 0.05%
Sebanyak 100 mL larutan PBS 5× ditambah 0.25 mL Tween 20, lalu ditera hingga 500 mL. Larutan ini harus selalu baru.
bufer Western
Sebanyak 1.5125 gram Trisma base ditambah 0.073 gram EDTA, 2.1915 gram NaCl, 0.5 gram susu nonfat dry milk dan 125 µL Tween TC lalu ditera dengan akuades sampai 250 mL.
Pembuatan substrat DAB : 1 tablet DAB dilarutkan dalam 15 mL PBS 1× ditambah 12 µL H2O2 30%
4. Pereaksi elektroeluter Bufer elusi
17
Kurva standar protein Lowry
y = 0.0055x + 0.0244 R2 = 0.9973
0.0 0.2 0.4 0.6 0.8 1.0 1.2
0 50 100 150 200 250
Konsentrasi
Ab
so
rb
a
n
s
Lampiran 3 Bagan alat elektroeluter
Lampiran 4 Standar protein Lowry
No. Konsentrasi
(µg/mL) OD
1. 0.00 0.000 2. 12.50 0.100 3. 25.00 0.199 4. 50.00 0.282 5. 100.00 0.575 6. 200.00 1.127
Lampiran 5 Standar protein SDS-PAGE dengan pewarna AgNO3
No. BM log BM Panjang gel
(cm) Jarak pita (cm) Rf
1. 200 2.30 5.95 0.05 0.01
2. 116 2.06 5.95 0.60 0.10
3. 97.4 1.99 5.95 0.85 0.14
4. 66 1.82 5.95 1.70 0.29
5. 45 1.65 5.95 2.55 0.43
6. 31 1.49 5.95 2.80 0.47
7. 21.5 1.33 5.95 3.85 0.65
8. 14.5 1.16 5.95 5.30 0.89
Gromet
Tabung kaca
Adaptor silikon
Membran