SIFAT ANTIMIKROBA ZAT EKSTRAKTIF POHON
FALOAK (
Sterculia comosa
Wallich)
FABIANUS RANTA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI
TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Sifat Antimikroba Zat Ekstraktif Pohon Faloak (Sterculia comosa Wallich) belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2011
ABSTRACT
Fabianus Ranta. Antimicrobial Activity of Extractive of Faloak (Sterculia comosa Wallich). Guided by WASRIN SYAFII, EKO SUGENG PRIBADI, and DEDED SARIP NAWAWI.
Faloak (Sterculia comosa Wallich) is a specific species of dry land that has potential as antimicrobial. This study aims to determine the toxicity of barks, leaves, and seeds extracts as an antimicrobial, and to identify its bioactive compound. The extracts were prepared by multi stage maceration method. Antimicrobial activity was tested by agar well diffusion method, and minimum inhibition concentration (MIC) and minimum fungicide concentration (MFC) by two-fold serial dilution method . Bioactive compound of active fraction were identified by Liquid Chromatography Mass Spectroscopy (LCMS), Fourier Transform Infrared (FTIR), and Nuclear Magnetic Resonance (NMR). Results showed that the diethyl ether (DE) fraction of seeds is more effective in inhibiting of microbial growth, than the other fractions. Subfraction of DE2 has a higher potency in inhibiting the growth of bacteria. Whereas, DE6 and DE7 subfraction has a higher potency in inhibiting the growth of Candida albicans. Based on the analysis by LCMS, FTIR and proton NMR, the DE7 sub fractions contain 3-hydroxyoctadecanoic acid (C18H36O3), which is suggested as a mainly compound responsible for antimicrobial activity. These findings indicate that faloak have the potential to be antimicrobial.
RINGKASAN
FABIANUS RANTA. Sifat Antimikroba Zat Ekstraktif Pohon Faloak (Sterculia comosa Wallich). Dibimbing oleh WASRIN SYAFII, EKO SUGENG PRIBADI, dan DEDED SARIP NAWAWI.
Keanekaragaman spesies yang tinggi telah menjadikan Indonesia menjadi
salah satu negara di dunia yang menyandang “megabiodiversity”, yang di
dalamnya terkandung sekurang-kurangnya 9600 spesies tumbuhan berkhasiat obat yang tersebar di berbagai daerah di Indonesia(FWI/GFW 2001 dan Setyowati 2008). Salah satu tumbuhan dimaksud yang berpotensi sebagai tumbuhan obat adalah Faloak (Sterculia comosa Wallich). Secara tradisional kulit faloak telah dimanfaatkan untuk menyembuhkan berbagai penyakit, namun belum ada kajian ilmiah yang membuktikan faloak memiliki senyawa aktif yang dapat dimanfaatkan sebagai obat khususnya sebagai antimikroba.
Penelitian ini bertujuan untuk menguji sifat antimikroba zat ekstraktif yang terkandung dalam daun, biji, dan kulit pohon faloak, serta mengidentifikasi senyawa aktif zat ekstraktif faloak yang memiliki sifat antimikroba. Penelitian dilaksanakan di Laboratorium Kimia Hasil Hutan Fakultas Kehutanan, Laboratorium Terpadu Bagian Mikrobiologi Medik Fakultas Kedokteran Hewan, Laboratorium Kimia Organik Departemen Kimia Fakultas MIPA Institut Pertanian Bogor, dan Pusat Penelitian Kimia LIPI Serpong.
Tahapan dalam penelitian ini meliputi: persiapan bahan baku, ekstraksi dan fraksinasi bertingkat, pengujian aktifitas antimikroba, uji fitokimia, fraksinasi dan isolasi, uji MIC, dan identifikasi senyawa aktif. Bahan baku yang digunakan adalah kulit pohon, daun dan biji pohon faloak yang tumbuh di Kota Kupang dan sekitarnya. Kulit pohon, daun dan biji dibuat serbuk berukuran 40 – 60 mesh dan diekstraksi dengan aseton. Ekstrak aseton selanjutnya difraksinasi secara bertingkat, berturut-turut dengan n-heksan, dietil eter, dan etil asetat.
Uji aktivitas antimikroba terhadap bakteri Escherichia coli, Salmonella typhii, Staphylococcus aureus, Bacillus cereus, Streptococcus agalactiae, dan cendawan
Candida albicans menggunakan metode difusi sumur agar. Fraksi teraktif diisolasi dengan eluen terbaik hasil dari Kromatografi Lapis Tipis (KLT) menggunakan lempeng silika gel GF254, dengan beberapa jenis pelarut yang memiliki tingkat kepolaran berbeda. Kromatografi Kolom menggunakan silika gel 60 F254, dengan eluen Benzen dan Kloroform (4 : 1). Eluat dianalisis dengan KLT dan eluat yang serupa disatukan sebagai subfraksi, diuapkan dengan vakum rotavapor. Subfraksi yang diperoleh, selanjutnya digunakan untuk menguji nilai MIC dan MFC dengan menggunakan metode two-fold serial dilution. Identifikasi senyawa untuk fraksi terpilih hasil Kromatografi dilakukan dengan menggunakan spektrum inframerah (Fourier Transform Infrared,FTIR), Kromatografi cair spektroskopi masa (Liquid Chromatography Mass Spectroscopy, LCMS) dan resonansi magnetik inti (Nuclear Magnetic Resonance, NMR) untuk mengetahui gugus fungsi, bobot molekul, dan struktur senyawa.
paling aktif dan berspektrum umum yakni mampu menghambat semua mikroba uji dalam uji aktivitas antimikroba dari masing-masing fraksi adalah fraksi dietil eter biji, dengan zona hambat yang dibentuk terhadap bakteri S. typhi, E. coli, S. aureus, B. cereus, C. albicans, dan S. agalatiae berturut-turut 9,33 mm; 16,33 mm; 16,67 mm; 22,33 mm; 14,33 mm; 22;67 mm. Berdasarkan pengujian MIC, nilai MIC dari sub fraksi DE2 terhadap bakteri positif gram berkisar antara 0,0625 mg/mL terhadap S. agalatiae sampai dengan 0,5 mg/mL terhadap B. cereus, dan
≥ 1 mg/mL terhadap bakteri negatif gram. Nilai MIC terhadap cendawan terdapat
pada sub fraksi DE7 pada konsentrasi 0,5 mg/mL, dan nilai MFC pada konsentrasi 0,25 mg/mL .
Bakteri negatif gram maupun positif gram lebih peka terhadap sub fraksi DE2, sedangkan C. albicans lebih sensitif terhadap sub fraksi DE6 dan DE7. Meskipun sub fraksi DE6 memiliki nilai MIC (0,5) dan MFC (0,25) yang sama dengan subfraksi DE7, dan sub fraksi DE2 lebih aktif terhadap bakteri, namun pada penelitian ini hanya sub fraksi DE7 yang diuji lebih lanjut untuk identifikasi senyawa dengan FTIR, LCMS, dan NMR. Subfraksi DE7 memiliki sifat anti cendawan aktivitas antibakteri yang tinggi.
© Hak Cipta milik IPB, Tahun 2011
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
AKTIVITAS ANTIMIKROBA ZAT EKSTRAKTIF POHON
FALOAK (
Sterculia comosa
Wallich)
FABIANUS RANTA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu dan Teknologi Hasil Hutan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Sifat Antimikroba Zat Ekstraktif Pohon Faloak (Sterculia comosa Wallich)
Nama : Fabianus Ranta
NRM : E251 09 0011
Disetujui:
Komisi Pembimbing
Prof. Dr. Ir. Wasrin Syafii, M.Agr. Ketua
Dr. drh. Eko S. Pribadi, M.S. Ir. Deded Sarip Nawawi, M.Sc.F.
Anggota Anggota
Diketahui
Ketua Program Studi
Ilmu dan Teknologi Hasil Hutan
Dr. Ir. I Wayan Darmawan, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas kasih dan karunia-Nya sehingga penulisan tesis berjudul “Sifat Antimikroba Zat Ekstraktif Pohon Faloak (Sterculia comosa Wallich)” ini dapat diselesaikan. Tesis ini disusun berdasarkan hasil penelitian selama ± 9 bulan di Bagian Kimia Hasil Hutan Departemen Hasil Hutan Fakultas Kehutanan, Laboratorium Terpadu Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan, Laboratorium Kimia Organik Fakultas MIPA Institut Pertanian Bogor, Pusat Penelitian Kimia LIPI Serpong.
Terima kasih dan penghargaan penulis ucapkan kepada:
1. Bapak Prof. Dr. Ir. Wasrin Syafii, M.Agr. sebagai Ketua Komisi Pembimbing, Bapak Dr. drh. Eko Sugeng Pribadi, M.S., dan Bapak Ir. Deded Sarip Nawawi, M.Sc.F. selaku Anggota Komisi Pembimbing yang telah banyak membimbing dan memberikan masukan serta saran yang terkait dengan penelitian ini.
2. Staf Bagian Kimia Hasil Hutan Departemen Hasil Hutan Fakultas Kehutanan, Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan, Laboratorium Kimia Organik Fakultas MIPA Institut Pertanian Bogor, Pusat Penelitian Kimia LIPI Serpong yang telah banyak membantu selama melaksanakan penelitian ini. 3. Departemen Pendidikan Nasional Republik Indonesia yang memberikan
Beasiswa BPPS.
4. Direktur Politeknik Pertanian Negeri Kupang, Ketua Jurusan Manajemen Pertanian Lahan Kering atas kesempatan untuk melanjutkan pendidikan pada Program Studi Ilmu dan Teknologi Hasil Hutan Institut Pertanian Bogor. 5. Teman-teman angkatan 2009 atas kebersamaan selama proses belajar,
6. Istri dan anak-anak tercinta (Gabriel Honoratio Arifandy Ranta, Faustinus Sereno Ranta, dan Eleutaria Febrianggi Ranta) atas segala doa dan dan dukungan selama penulis menjalani studi.
Selain itu, penulis menyampaikan terimakasih dan penghargaan yang sebesar-besarnya kepada berbagai pihak atas dukungan dan dorongan yang diberikan sehingga tesis ini dapat terselesaikan.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Toak Kabupaten Manggarai Provinsi Nusa Tenggara Timur pada tanggal 01 Januari 1971 sebagai anak ke tujuh dari pasangan Bapak Ignatius Manggu dan Ibu Ester. Pendidikan Sarjana Kehutanan (S1) ditempuh di Universitas Satria Makassar sejak tahun 1991 pada Program Studi Konservasi
Sumberdaya Hutan dan lulus pada tahun 1997.
Pada tahun 1998 - 2001, Penulis bekerja sebagai staf honorer pada Dinas
Kehutanan Provinsi NTT. Pada tahun 2001 Penulis diterima sebagai staf pengajar di Politeknik Pertanian Negeri Kupang sejak tahun 2001 sampai sekarang. Pada tahun 2009 penulis berkesempatan melanjutkan pendidikan di Sekolah Pascasarjana IPB Bogor pada Program Studi Ilmu dan Teknologi Hasil Hutan melalui beasiswa BPPS.
DAFTAR ISI
Faloak (Sterculia comosa Wallich)……… 5Klasifikasi dan Morfologi……… 5
Zat Ekstraktif………. 7
Zat Ekstraktif Sebagai Obat………. 8
Etnobotani Faloak ………... 10
Persiapan Bahan Baku Sebagai Simplisia………..….…. 19
Penetapan Kadar Air………....…….. 19 Penentuan Nilai Kadar Hambat Minimum (Minimum Inhibition
Concentration, MIC) dan Kadar Membunuh Cendawan Minimum (Minimum Fungicide Concentration-MFC)………..…
Identifikasi Senyawa Aktif……….… 30
HASIL DAN PEMBAHASAN Kandungan Zat Ekstraktif………. 31
Hasil Uji Fitokimia ...……….. 32
Aktifitas Antimikroba………. 33
Penentuan MIC dan MFC ………. 36
Identifikasi Senyawa………. 39
KESIMPULAN DAN SARAN Kesimpulan……… 45
Saran……….. 45
DAFTAR PUSTAKA……….….. 46
DAFTAR TABEL
Halaman
1 Kandungan ekstraktif dari ekstrak aseton kulit, daun, dan biji faloak………..………. 31
2 Hasil analisis fitokimia ekstrak aseton kulit, biji, dan daun faloak………..…….. 33
3 Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat
ekstraktif kulit pohon faloak terhadap (ukuran dalam millimeter)…... 34
4 Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat
ekstraktif daun pohon faloak terhadap (ukuran dalam millimeter)... 34
5 Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat
ekstraktif biji pohon faloak terhadap (ukuran dalam millimeter)…... 35
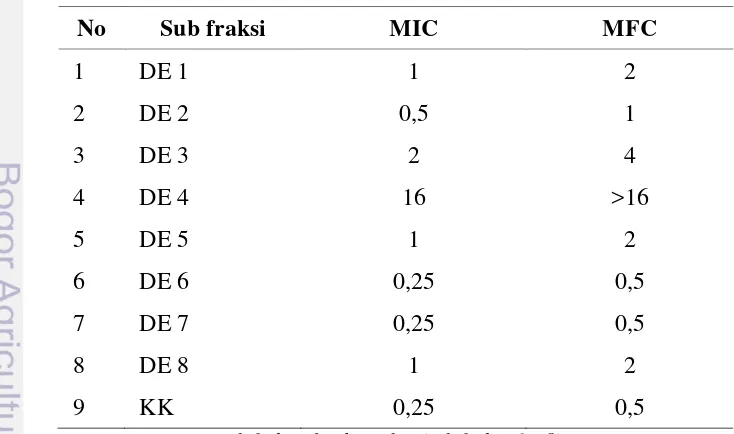
6 Nilai MIC (mg/mL) ekstrak dietil eter biji S. comosa Wallich...………. 36
7 MIC dan MFC sub fraksi dietil eter biji faloak terhadap cendawan C.
albicans………. 38
8 Nilai pengukuran H-NMR, C-NMR dan nilai pendugaan berdasarkan
DAFTAR GAMBAR
Halaman
1 Tumbuhan faloak (Sterculia comosa Wallich) di Kupang NTT……. 6
2 Diagram alir penelitian………... 18
3 Diagram alir uji fitokimia alkaloid………. 22
4 Diagram alir uji fitokimia flavonoid, fenolik, triterpenoid dan steroid, saponin……….. 22 5 Diagram ilustrasi dinding sel bakteri Positif Gram dan Negatif Gram ……….……. 37
6 Spektrum IR dari sub fraksi DE7………... 40
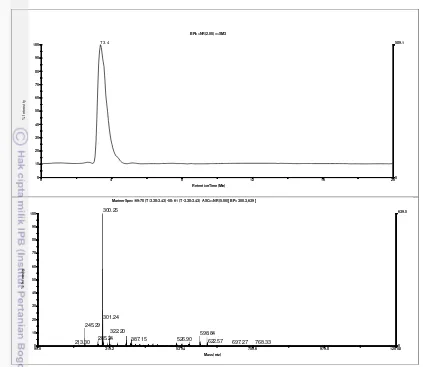
7 Kromatogram LCMS sub fraksi DE7……… 41
DAFTAR LAMPIRAN
Halaman 1 Surat keputusan hasil identifikasi tumbuhan faloak (Sterculia comosa
Wallich)………..……….. 51
2 Simplisia dan ekstrak kulit, daun , dan biji pohon faloak (Sterculia comosa Wallich)………...……….……
52
3 Kandungan ekstrak kulit, daun, dan biji faloak berdasarkan kadar air
dan berat sampel……….……….. 52
4 Diameter zona hambat (mm) zat ekstraktif faloak (kulit,, biji,
daun)………...………..
53
5 Uji MIC zat ekstraktif sub fraksi dietil biji faloak ………..……….…… 55
6 Uji MFC zat ekstraktif sub fraksi dietil biji faloak ………..……….… 56
7 Spektrum proton NMR senyawa DE7……….………. 57
PENDAHULUAN
Latar Belakang
Indonesia menjadi salah satu negara megabiodiversity karena 11% tumbuhan di dunia dijumpai di kawasan hutan di Indonesia (FWI/GFW 2001). Jumlah ini menempatkan Indonesia berada di peringkat lima dunia dengan jumlah 38.000 spesies dan 55% dari jumlah tersebut merupakan spesies endemik (Setyowati et al. 2008). Namun, ada yang patut dikhawatirkan, yakni laju kerusakan hutan saat ini mencapai ± 1,08 juta ha/tahun dalam kurun waktu tahun 2005 - 2009 (Lestari 2010). Kondisi ini akan berdampak pada penurunan
jumlah dan jenis flora maupun fauna yang dimiliki Indonesia saat ini.
Diantara ketersediaan sumber daya alam yang melimpah tersebut, terdapat sekurang-kurangnya 9.600 spesies tumbuhan berkhasiat sebagai obat yang tersebar di berbagai daerah di Indonesia. Dari jumlah tersebut, kurang lebih 300 spesies telah digunakan sebagai bahan obat tradisional oleh industri obat tradisional di Indonesia (Menkes RI 2007). Jumlah tersebut merupakan bagian dari kurang lebih empat juta spesies tumbuhan dunia yang telah diketahui sebagai tumbuhan obat dan saat ini yang telah diuji untuk mengetahui kandungan obatnya diperkirakan hanya sekitar satu persen (Smith 2004).
Berdasarkan catatan Organisasi Kesehatan Dunia (World Health Organization, WHO), peningkatan pemanfaatan obat-obatan dari bahan alam (obat tradisional) di berbagai negara saat ini telah mencapai 65% dari penduduk negara-negara maju (Menkes RI 2007). Keadaan ini memberikan peluang untuk mengkaji jenis tumbuhan obat di berbagai daerah yang secara turun-temurun telah dimanfaatkan masyarakat sebagai obat dan belum dikaji secara ilmiah. Di samping itu kecenderungan peningkatan pemanfaatan obat dari bahan alam
memberikan dampak positif bagi pertumbuhan industri, baik industri obat tradisional maupun sebagai bahan baku industri farmasi. Pertumbuhan industri
Faloak (Sterculia comosa Wallich) merupakan salah satu dari spesies yang belum mendapatkan perhatian, sehingga pohon ini dianggap tidak bermanfaat. Memang saat ini kayu faloak belum banyak dimanfaatkan, baik sebagai bahan baku ukiran, pertukangan maupun pemanfaatan lainnya. Oleh karena itu, pencarian sifat dan kandungan obat dari spesies ini menjadi penting karena dengan mengenal fungsi dan manfaatnya, faloak (Sterculia comosa Wallich) dapat menambah khasanah tumbuhan obat dunia saat ini.
Pemanfaatan faloak oleh masyarakat di Provinsi Nusa Tenggara Timur (NTT) sampai saat ini masih bersifat pemanfaatan secara tradisional yang didasarkan pengetahuan dan pengalaman secara turun-temurun. Pemanfaatan
faloak selama ini digunakan untuk menyembuhkan berbagai penyakit dalam, antara lain kulit pohon faloak dapat menyembuhkan penyakit tifus, maag, dan
lever. Faloak juga digunakan sebagai peluruh haid, peluruh sisa-sisa kotoran setelah melahirkan, dan pemulihan setelah melahirkan. Berdasarkan pengalaman masyarakat, mengkonsumsi faloak secara rutin dapat meningkatkan stamina (mengurangi rasa letih atau lelah bagi pekerja berat). Namun, semua pengetahuan tersebut belum didukung dengan kajian ilmiah atas pemanfaatan faloak sebagai bahan obat-obatan.
Pengkajian komponen zat ekstraktif yang terkandung dalam pohon faloak seperti kayu, biji, daun, kulit, dan pemanfaatannya sebagai tumbuhan obat sampai dengan saat ini belum dilaporkan secara ilmiah, baik di tingkat regional, nasional maupun internasional. Berdasarkan hal tersebut, maka perlu suatu kajian ilmiah untuk mengidentifikasi zat ekstraktif yang terdapat dalam faloak serta khasiatnya terhadap kesehatan manusia. Pengkajian komponen zat ekstraktif dari pohon faloak ini diarahkan untuk mengetahui komponen kimia dan pengujian antimikroba zat ekstraktif dari daun, biji, dan kulit pohon faloak tersebut, terutama senyawa-senyawa yang dapat digunakan sebagai obat antimikroba.
Perumusan Masalah
dengan tipe iklim D atau E menurut Smith dan Ferguson dengan jumlah bulan basah (BB) 3 – 4 bulan dan bulan kering (BK) 8 – 9 bulan (BPS NTT 2009). Karakteristik tumbuhan seperti ini sangat sesuai sebagai tanaman konservasi lahan kritis seperti NTT. Keunggulan yang dimiliki tumbuhan ini sampai saat ini belum menjadi perhatian semua pihak terutama para pengambil kebijakan untuk menjadikan tumbuhan ini sebagai salah satu jenis tumbuhan konservasi. Hal ini disebabkan sudut pandang para pihak masih terbatas pada tumbuhan yang memiliki nilai ekonomi pemanfaatan kayu (sebagai bahan baku konstruksi atau permebelan), sedangkan kualitas dari kayu faloak itu sendiri tidak termasuk dalam kelas konstruksi atau permebelan. Namun aspek ekonomi pemanfaatan sebagai
obat, serta keunggulan ekologis tersebut di atas seolah-olah terabaikan. Keterbatasan ini menyebabkan tindakan silvikultur belum menyentuh spesies ini.
Pohon faloak secara turun temurun telah dimanfaatkan masyarakat Nusa Tenggara Timur khususnya di Kota Kupang dan sekitarnya untuk menyembuhkan berbagai penyakit. Namun belum ada kajian ilmiah yang membuktikan faloak memiliki senyawa aktif yang bersifat antimikroba. Adanya kesenjangan seperti ini menyebabkan tindakan silvikultur belum menyentuh spesies ini, sehingga populasi faloak di daerah ini semakin berkurang dan terancam punah akibat tidak adanya keseimbangan antara pemanfaatan dengan tindakan silvikultur. Penyelamatan kayu faloak dapat segera dilakukan bila masyarakat diberitahu manfaat dari kayu faloak.
Berdasarkan permasalahan tersebut di atas, maka hipotesis yang dikemukakan melalui penelitian ini adalah bahwa zat ekstraktif yang terkandung di dalam daun, biji dan kulit pohon faloak kemungkinan memiliki senyawa aktif yang bersifat sebagai antimikroba. Untuk menjawab hipotesa tersebut, maka pertanyaan penelitian ini adalah 1) apakah zat ekstraktif daun, biji dan kulit pohon faloak memiliki senyawa aktif yang bersifat antimikroba?; dan 2) jenis senyawa aktif seperti apa yang terkandung dalam zat ekstraktif kulit, daun dan
Tujuan Penelitian
Berdasarkan permasalahan di atas, maka Penelitian ini bertujuan untuk 1. menguji sifat antimikroba zat ekstraktif yang terkandung dalam daun, biji dan
kulit pohon faloak;
2. mengidentifikasi senyawa aktif zat ekstraktif daun, biji dan kulit dari pohon faloak yang memiliki sifat antimikroba.
Manfaat Penelitian Manfaat yang diharapkan dari penelitian ini adalah
1. Memberikan informasi ilmiah mengenai senyawa antimikroba yang terdapat
dalam pohon faloak.
2. Informasi tersebut diharapkan dapat digunakan untuk pemanfaatan pohon
faloak sebagai bahan baku obat modern.
TINJAUAN PUSTAKA
Faloak (Sterculia comosa Wallich)
Klasifikasi dan Morfologi
Nama faloak merupakan nama lokal yang diberikan oleh masyarakat NTT, khususnya Timor untuk pohon S. comosa. Sterculia comosa Wallich teridentifikasi berdasarkan SK No. 1135/IPH.1.02/If.8/IX/2010 tentang Hasil Identifikasi/Determinasi Tumbuhan oleh Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi LIPI Bogor Tahun 2010 (Lampiran 1). Tantra (1976) melaporkan bahwa S. comosa memiliki beberapa nama lokal, seperti bangilan (Manado), bingiladu (Gorontalo), kalimana olimana (Tobelo), kaita (Pulau Sula di Maluku), lahea (Pulau Mangas), kayu pani (Pulau Buru), susulangit (Pulau Seram). Zipcodezoo (2010), menjelaskan bahwa S. comosa merupakan flora berbentuk pohon yang termasuk family Sterculiaceae dan secara taksonomi dapat diklasifikasikan sebagai berikut:
Kingdom : Plantae Phylum : Tracheophyta Class : Magnoliopsida
Order : Malvales Family : Sterculiaceae
Genus : Sterculia
Spesies : Sterculia comosa Wallich.
Faloak tersebar di Indonesia dan Filipina (Tantra 1976). Di Indonesia,
teridentifikasi sebagai spesies endemik dan salah satunya diketahui terdapat di Cina.
Faloak merupakan salah satu tumbuhan yang memiliki kemampuan untuk tumbuh dan berkembang dengan baik di kondisi alam seperti di NTT yang tergolong wilayah kering karena hanya memiliki empat bulan basah dengan curah hujan 1.470 mm pada tahun 2008, serta suhu rata-rata di atas 270C (BPS NTT, 2009). Faloak yang tumbuh di Kota Kupang dan sekitarnya pada umumnya tumbuh di atas tanah yang bersolum dangkal dan berbatu. Bahkan semua pohon yang diamati dalam penelitian ini tumbuh di atas batuan-batuan (Gambar 1). Tantra (1976) menunjukkan bahwa faloak tumbuh di hutan primer pada
lingkungan tanah bertekstur liat/lempung berpasir atau berbatu-batu (rocky soil) pada ketinggian 300 m di atas permukaan laut (dpl). Namun hal ini sangat berbeda
dengan faloak yang dilaporkan pada penelitian ini, yakni bertempat tumbuh tersebar dalam Kota Kupang pada tanah yang berbatu, sedangkan informasi persebaran faloak di NTT maupun di Timor, sampai dengan saat ini belum ada laporan tertulisnya.
a b
Zat Ekstraktif
Sjostrom (1993) menjelaskan bahwa zat ekstraktif merupakan salah satu unsur penyusun kayu. Zat ekstraktif dapat diekstraksi dengan menggunakan pelarut organik seperti etanol, aseton, atau diklorometan. Walker (2006) menyatakan bahwa zat ekstraktif merupakan komponen pengisi rongga sel kayu yang dapat diekstrak dari kayu dengan menggunakan pelarut polar maupun non polar. Kandungan dan komposisi zat ekstraktif dalam kayu berbeda-beda sesuai posisinya di dalam pohon. Secara umum, kandungan zat ekstraktif di dalam kayu berkisar antara 1% sampai dengan 20% (Stenius 2000). Perbedaan ini sangat dipengaruhi oleh kondisi tempat tumbuh (Sjostrom 1993).
Zat ekstraktif secara umum dapat digolongkan ke dalam tiga subgolongan, yaitu senyawa alifatik (lilin dan lemak), senyawa terpena dan terpenoid, dan
senyawa fenolik (Sjostrom 1993, Frederique 2009, Fengel dan Wegener 1995). 1. Alifatik (Aliphatic Compounds)
Kelompok senyawa alifatik merupakan kelompok senyawa yang mendominasi resin parenkhim (Sjostrom 1993). Selanjutnya disebutkan bahwa alkana dan alkohol tergolong bagian yang terkecil jumlahnya dibandingkan dengan arachinol (C20), behenol (C22), dan lignocerol (C24). Hasil berbeda disampaikan Frederique (2009), bahwa kelompok lilin, lemak dan turunannya terdiri dari asam lemak, trigliserida, gliserida, alkohol berlemak, sterol, dan steril ester.
2. Terpena dan Terpenoid (Terpenes and Terpenoids Compounds)
Terpena merupakan hidrokarbon murni sedangkan terpenoid mengandung gugus-gugus fungsional, seperti OH, C=O, COOH, dan lain-lain (Fengel dan Wegener 1995). Kelompok senyawa terpena dan terpenoid merupakan kelompok senyawa yang terdapat dalam oleoresin (Sjostrom 1993). Kelompok senyawa terpena dan terpenoid terdiri dari limonena, pinena, dan asam resin (Frederique 2009). Cole (2010) lebih rinci menjelaskan
3. Fenol (Phenolic Compounds)
Senyawa fenol merupakan kelompok senyawa yang menjelaskan bahwa akumulasi dari senyawa fenol dalam kayu teras adalah salah satu penciri dari kayu teras (Sjostrom 1993). Kelompok senyawa fenol terdiri dari senyawa fenol sederhana yang mencakup asam gallat dan vanilin; stilbena yang salah satunya adalah pinosylvin; flavonoid yang salah satunya adalah taxifolin; dan lignan yang salah satunya adalah pinoresinol(Sjostrom 1993, Frederique 2009).
Zat Ekstraktif Sebagai Obat
Sjostrom (1981) menjelaskan bahwa substansi fenol terkandung di dalam teras kayu (heartwood) dan kulit kayu, dan hanya sedikit terdapat dalam kayu
gubal (sapwood). Fenol memiliki sifat anticendawan (fungisida) sehingga sangat efektif melindungi kayu untuk melawan serangan cendawan.
Walker (2006) menyatakan bahwa zat ekstraktif memiliki berbagai fungsi, antara lain sebagai antiserangga (antifeedan, seperti anti nyamuk), antioksidan, antivirus, antibakteri, sitotoksin, dan anticendawan. Hal ini diduga disebabkan oleh berbagai senyawa yang terkandung dalam zat ekstraktif yang bersifat racun sehingga dapat mencegah serangan bakteri (bakterisidal), cendawan, serta rayap (Fengel dan Wegener 1995).
Beberapa kelompok senyawa zat ekstraktif yang berfungsi sebagai bahan obat-obatan diantaranya:
1. Alkaloid
Alkaloid umumnya mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen yang biasanya berada dalam gabungan sebagai bagian dari sistem siklik (Sastrohamidjojo 1996). Alkaloid seringkali bersifat racun bagi manusia dan mempunyai aktivitas fisiologik yang menonjol. Alkaloid biasanya tidak berwarna, seringkali bersifat optis aktif, kebanyakan
berbentuk kristal dan hanya sedikit yang berupa cairan (misalnya nikotina) pada suhu kamar. Uji sederhana yang sama sekali tidak sempurna untuk alkaloida dalam daun atau buah segar adalah rasa pahitnya di lidah (Harborne
2. Flavanoid
Flavonoid merupakan kelompok besar yang terdiri dari flavon, flavanon, dan isoflavon. Flavonoid yang telah teridentifikasi berupa krisin, taksifolin, pinosembrin, pinobanksin, pinostrobin, dan katekin (Fengel dan Wegener 1995). Tumbuhan yang mengandung flavonoid dipakai dalam pengobatan tradisional karena memiliki berbagai efek terhadap macam-macam organisme, antara lain mengobati gangguan fungsi hati karena memiliki aktivitas antioksidan, antihipertensi, antimutagen, menurunkan agregasi keping darah (lempengelet) sehingga dapat mengurangi pembekuan darah, dan dapat menghambat pendarahan (Robinson 1991).
3. Saponin
Saponin adalah senyawa aktif permukaan yang kuat dan menimbulkan
busa jika dikocok dalam air (Robinson 1991). Beberapa saponin bekerja sebagai antimikroba (Hasan et al. 2010). Beberapa tahun terakhir ini, saponin tertentu menjadi penting karena dapat diperoleh dari beberapa tumbuhan dengan hasil yang baik dan digunakan sebagai bahan baku untuk sintesis hormon steroid yang digunakan dalam bidang kesehatan (Robinson 1991). Saponin dibedakan atas dua jenis, yaitu glikosida triterpenoid alkohol dan glikosida struktur steroid tertentu yang mempunyai rantai samping spiroketal (Cheeke 2011, dan Robinson 1991). Kedua jenis saponin ini larut dalam air dan etanol, tetapi tidak larut dalam eter (Robinson 1991).
4. Steroid dan Triterpenoid
Triterpena merupakan senyawa yang mempunyai struktur sterana dan merupakan steroid. Senyawa utama dari triterpena siklik adalah skualena asiklik dan serrafenediol dalam jumlah yang sangat kecil. Komponen utama kelompok steroid dalam kayu pada umumnya mengandung β–sitosterol, sedangkan kampesterol, sitosterol, sitostanol, sikloartenol dan sitrostadienol merupakan senyawa yang jumlahnya tergolong kecil (Fengel dan Wegener 1995)
ini tidak berwarna, berbentuk kristal, bertitik leleh tinggi, terkenal karena rasanya yang pahit (misalnya limonen, suatu senyawa pahit yang larut dalam lemak dan terdapat dalam buah jeruk), umumnya sukar dicirikan karena tak ada kereaktifan kimianya. Uji yang banyak digunakan adalah reaksi Lieberman-Burchard (anhidrida asetat-H2SO4 pekat). Sampai saat ini yang diketahui tersebar luas adalah triterpena pentasiklik α-amirin dan β-amirin serta asam
turunannya, yaitu asam urosilat, asam oleanolat. Senyawa ini terdapat dalam lapisan malam daun dan dalam buah, seperti apel dan peer dan mungkin berfungsi sebagai pelindung untuk menolak serangga dan serangan mikroba (Harborne 1987).
Steroid tumbuhan mempunyai satu atau dua atom karbon tambahan selain
rantai samping delapan karbon yang terdapat dalam lanosterol yang juga terdapat dalam banyak steroid. Senyawa-senyawa seperti asam kolanat,
kolekalsiferol, 1,25-dihidroksivitamin D, hormon serangga ekdison dan ekdisteron ini berperan sebagai pelindung jika ditemukan di tanaman. Salah satu senyawa yang dimiliki tumbuhan adalah kukurbitasin yang merupakan glikosida triterpenoid dengan kerangka karbon lanosterol. Senyawa ini tidak hanya bekerja menolak beberapa serangga, tetapi juga menarik beberapa serangga lain (Robinson 1991).
Etnobotani Faloak
Pengetahuan masyarakat tentang pemanfaatan faloak sebagai obat secara tradisional merupakan pengetahuan berdasarkan pengalaman secara turun temurun dari nenek moyang mereka. Bagian yang dimanfaatkan adalah kulit pohon bagian dalam, dengan tahapan sebagai berikut:
1. Kulit pohon faloak diperoleh dengan cara dikupas dari batang pohon hidup. Kemudian kulit paling luar atau kulit mati atau biasa disebut ritidoma dipisahkan dari kulit bagian dalam yang akan dimanfaatkan.
2. Kulit pohon bagian dalam tersebut dicuci dengan air, kemudian direbus hingga air rebusan menunjukkan warna merah pekat.
(gangguan fungsi hati), meningkatkan stamina (menghilangkan rasa letih atau lelah setelah bekerja berat), peluruh haid, peluruh sisa-sisa kotoran setelah melahirkan, pemulihan setelah melahirkan.
Kulit pohon ini diperoleh dari pohon faloak yang tumbuh secara liar di kawasan hutan, kebun, maupun di sekitar pemukiman termasuk tumbuh menyebar di dalam Kota Kupang. Proses pembentukan kembali kulit faloak setelah pengambilan dapat terjadi setelah 1-3 bulan. Dengan demikian, dampak kerusakan yang terjadi akibat pemanfaatan kulit dari pohon faloak ini tidak menyebabkan kematian terhadap pohon faloak. Namun, tetap diperhitungkan bahwa pengambilan kulit pohon yang berlebihan tetap berdampak negatif terhadap
pertumbuhan faloak karena pengangkutan hara dari tanah melalui batang pohon faloak menjadi terhambat.
Ketersediaan pohon faloak yang masih cukup banyak menyebabkan tindakan silvikultur belum menyentuh spesies ini. Di samping itu bagian lain dari pohon ini yang dapat dimanfaatkan masih sangat rendah. Hal ini menyebabkan perhatian terhadap budidaya faloak ini menjadi berkurang bahkan belum pernah dilakukan. Bagian pohon faloak yang cukup tinggi dimanfaatkan selama ini adalah bagian kulit yang dimanfaatkan sebagai obat, sedangkan kayunya sendiri belum pernah dimanfaatkan sebagai bahan bangunan, meubel, maupun ukiran. Rendahnya pemanfaatan kayu faloak ini mengingat kelas kuat maupun kelas awet tergolong rendah, dan tinggi bebas cabangnya tergolong rendah. Sehubungan dengan pemanfaatan kayu faloak, Tantra (1976) menyatakan bahwa kayu faloak termasuk kelas interior yang tidak dapat bersentuhan langsung dengan tanah dan lingkungan eksterior. Bagian lain yang cukup bermanfaat selama ini yang dapat dimakan adalah biji kering dari buah faloak. Biji ini dapat langsung dimakan atau disangrai terlebih dahulu sebelum dimakan. Tantra (1976) menyatakan bahwa biji sterculiaceae secara umum dapat dimakan.
Belum diketemukan informasi resmi mengenai kemotaksonomi
polifenol yang diperoleh dari kulit pohon, dan komponen kimia utama polifenol dari Sterculia parviflora yang dihasilkan dari buah matang.
Kajian terbaru yang dilakukan terhadap beberapa spesies dari family Sterculiaceae ini diketahui mengandung alkaloid dari biji, seperti Sterculia javanica R.Br.,(sekarang menjadi Sterculia cordata Bl.), dan Sterculia blumei G. Don. (sekarang Sterculia coccinea Jack var. coccinea. Penelitian lain yang telah dilaporkan oleh Katade et al. (2006) bahwa zat ekstraktif biji Sterculia guttata bersifat larvicidal terhadap Aedes aegypti dan Culex quinquefascilatus karena mengandung alkaloid. Shamsundar dan Paramjyothi (2010) melaporkan bahwa berdasarkan uji fitokimia zat ekstraktif biji Sterculia foetida mengandung alkaloid, flavonoid, saponin sebagai komponen kimia utama yang bermanfaat dalam bidang farmasi. Vital et al. (2010) menemukan zat ekstraktif daun Sterculia
foetida bersifat antimikroba karena mengandung senyawa utama alkaloid dan tannin.
.
Bakteri
Pelczar dan Chan (2008) mendefenisikan bakteri sebagai mikroorganisme prokariotik uniselular, berkembangbiak dengan membelah diri dan tidak mengandung struktur yang terbatasi membran di dalam sitoplasmanya. Sel-selnya berbentuk bulat (kokus), batang (basilus), atau spiral (spirilium). Ukurannya beragam dengan diameter antara 0,5 sampai dengan 1,0 µm dan panjangnya antara 1,5 sampai dengan 2,5 µm.
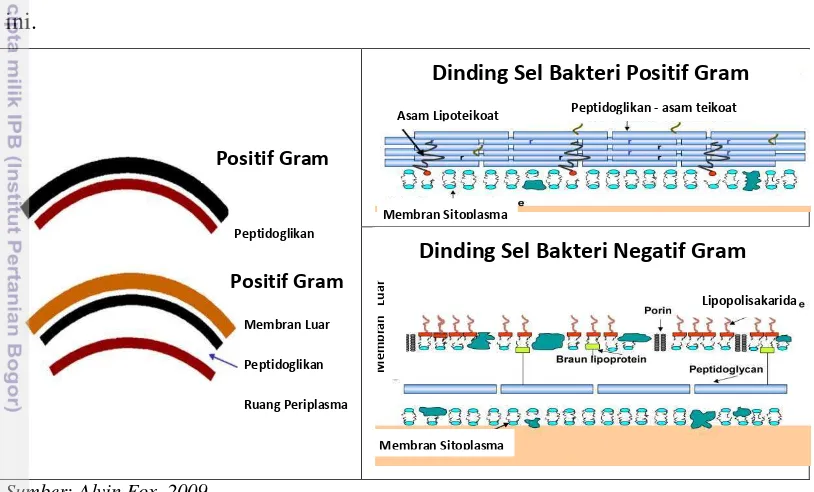
Klasifikasi bakteri negatif Gram dan positif Gram didasari oleh struktur dinding sel (Thiel 1999), yakni dinding sel bakteri negatif Gram memiliki beberapa lapis peptidoglikan dan membran luar, sedangkan dinding sel pada bakteri positif Gram tersusun atas berlapis-lapis peptidoglikan. Lapisan terluar dinding sel pun berbeda-beda (Hunt 2010). Lapisan terluar dinding sel bakteri negatif Gram adalah membran luar dengan lapisan terluar lebih tipis, sedangkan
kemampuan masing-masing mengeluarkan jenis toksin yang berbeda-beda (Purwoko 2009).
Endotoksin dan eksotoksin merupakan dua jenis toksin yang dikeluarkan oleh bakteri patogen. Endotoksin adalah lipida yang termasuk bagian dari lipopolisakarida dan lipida A yang dilepaskan oleh bakteri negatif Gram ketika bakteri mengalami lisis, sedangkan eksotoksin merupakan protein yang dihasilkan dan dikeluarkan oleh bakteri positif gram. Eksotoksin dilepaskan ke makanan, menyerang sel inang dan jaringan yang rentan, dan membentuk abses atau borok untuk merusak jaringan untuk memudahkan pertumbuhan bakteri patogen (Purwoko 2009).
Beberapa bakteri negatif Gram dan positif Gram penyebab penyakit pada manusia diuraikan sebagai berikut:
1) Escherichia coli
DAEC bersifat pathogen pada anak-anak khususnya pada anak-anak berusia prasekolah.
2) Salmonella typhii
Secara umum, Salmonella sebenarnya hanya satu spesies dari Salmonella (Salmonella enterica). Namun, lebih dari 2000 tipe akhirnya dapat digambarkan dengan menggunakan antibodi yang tepat. Beberapa jenis yang umumnya terkait dengan penyakit manusia diantaranya S. enteritidis, S. cholerae-suis dan S. typhi. Salmonellosis disebabkan oleh berbagai serotipe dan S. enteritidis merupakan jenis yang paling banyak menimbulkan salmonellosis pada manusia. Bakteri ini biasanya ditularkan melalui tempat air
minum atau dari sumber air atau makanan yang tercemar. Infeksi biasanya muncul sebagai gastroenteritis dengan gejala sakit berupa mual, muntah dan
buang air besar secara terus-menerus (Fox A 2009).
3) Staphylococcus aureus
Staphylococcus aureus merupakan bakteri anaerob fakultatif positif Gram dan merupakan salah satu penyebab infeksi oportunistik yang sering dijumpai pada pasien, baik di rumah sakit maupun di masyarakat. Makanan yang tercemar S.aureus akan menghasilkan enterotoksin (Fox A 2009). Enterotoksin yang dihasilkan oleh S. aureus adalah staphylococcal enterotoxins, yaitu enterotoksin yang diproduksi oleh S. aureus yang menyebabkan keracunan makanan ketika mengkonsumsi makanan yang tercemar S.aureus (Loir 2003). Gejala sakit yang biasanya terlihat berupa mual, muntah, diare (yang menyebabkan dehidrasi) dan sakit perut. Di samping itu toxic shock syndrome memiliki sifat-sifat superantigen dari S. aureus, mengakibatkan produksi sitokin, kebocoran pembuluh darah dan toksikitas sel (Fox A 2010).
4) Bacillus cereus
endophthalmitis, dan panophthalmitis. Dua jenis keracunan makanan yang berhubungan dengan B. Cereus adalah toksin emetik (umumnya ditemukan di beras) yang menyebabkan, mual, muntah, kram perut; dan diare (karena keracunan makanan) dengan gejala nyeri perut dan kram, demam dan muntah jarang terjadi (Fox K 2010). Schneider (2004) menguraikan bahwa B.cereus dapat menyebabkan foodborne illness, yaitu penyakit yang ditimbulkan akibat mengkonsumsi makanan yang tercemar B.cereus.
5) Streptococcus agalactiae
Fox A (2010) menjelaskan bahwa Streptococcus adalah bakteri gram-positif anaerob fakultatif, berbentuk seperti rantai (kadang-kadang
berpasangan) dan merupakan katalase-negatif. Streptococcus dapat diklasifikasikan berdasarkan sifat hemolitiknya, yaitu Streptococcus hemolitik
α, Streptococcus hemolitik β dan Streptococcus non-hemolitik (Kim 2011). Streptococcus agalactiae merupakan salah satu bakteri yang tergolong Streptococcus hemolitik β. Streptococcus agalactiae adalah bakteri yang menyebabkan meningitis neonatal, septicaemia dan pneumonia. Streptococcus
hemolitik β menyebabkan pecahnya sel darah merah. Struktur sel S. agalactiae mengandung gen yang menampilkan ragam ekstraseluler, seperti polisakarida dan protein yang berfungsi untuk menghindari sistem pertahanan inang (Glaser et al. 2002). Rubinstein et al. (2011) melaporkan bahwa 995 isolat S. agalactiae yang telah diisolasi selama kurun waktu 2002–2008, sebanyak 46,8% isolat diperoleh dari vagina, 30,7% diperoleh dari pembalut, 15,2% diperoleh dari air seni (urine), 1,6% diperoleh dari darah, dan 5,7% diperoleh dari bagian-bagian lain. Sebanyak 7,8% S. agalactiae tahan terhadap erythromycin.
Cendawan
Candida albicans
METODOLOGI PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan September 2010 sampai dengan bulan Juni 2011. Penelitian ini dilaksanakan di Laboratorium Kimia Hasil Hutan Fakultas Kehutanan, Laboratorium Terpadu Bagian Mikrobiologi Medik Fakultas
Kedokteran Hewan, Laboratorium Kimia Organik Departemen Kimia Fakultas MIPA Institut Pertanian Bogor, dan Pusat Penelitian Kimia LIPI Serpong.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah serbuk daun, biji, kulit Faloak (Sterculia comosa Wallich) yang diperoleh dari pohon Faloak yang tumbuh di Kota Kupang Provinsi Nusa Tenggara Timur. Bahan kimia untuk ekstraksi, fitokimia, fraksinasi, kromatografi kolom dan kromatografi lapis tipis antara lain: aseton, n-hexane, benzen, dietil eter, etil asetat, metanol, etanol, air suling, pereaksi Dragendorf, pereaksi Mayer, pereaksi Liebermann-Burchard, FeCl3 dan natrium hidroklorida, lempeng silika gel GF254, silika gel 60 F254 dan glass wool. Bahan untuk analisis antimikroba antara lain media agar (Muller Hinton Agar, Brain Heart Infusion, Tryptic Soy Agar), NaCl 1%, klorampenikol, dan ketokonazole. Mikroba yang digunakan terdiri dari bakteri S. aureus, S. agalactiae, B. cereus, E. coli, S. typhi, dan cendawan C. albicans yang diperoleh dari koleksi Laboratorium Terpadu Bagian Mikrobiologi Medik Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat yang digunakan untuk preparasi sampel antara lain oven, hammer mill, saringan ukuran 40 dan 60 mesh, eksikator, dan pinggan porselin. Alat yang
digunakan untuk ekstraksi dan fraksinasi antara lain bejana maserasi, kertas saring, alat-alat gelas, neraca analitik, lemari pendingin, rotary evaporator Buchi.
Infrared (FT-IR), Liquid Chromatography Mass Spectrophotometer (LC-MS) dan Nuclear Magnetic Resonance (NMR).
Metode Penelitian
Metode penelitian meliputi beberapa kegiatan, yakni; persiapan bahan baku, penetapan kadar air, ekstraksi dan fraksinasi secara bertingkat, pengujian awal aktifitas antimikroba, uji fitokimia, fraksinasi dan isolasi, penentuan kadar terkecil penghambatan (minimum inhibition concentration, MIC) dan kadar membunuh cendawan minimum (minimum fungicide concentration, MFC), dan identifikasi senyawa aktif (Gambar 2).
Gambar 2. Diagram alir penelitian.
Sampel Faloak (Serbuk 40-60 mesh)
Persiapan Bahan Baku Sebagai Simplisia
Bahan baku penelitian diperoleh dari kulit, biji, dan daun pohon faloak yang tumbuh di Kota Kupang dan sekitarnya. Pohon faloak (Sterculia comosa Wallich) yang digunakan dalam penelitian ini adalah pohon yang telah menghasilkan minimal tiga kali berbuah atau berdiameter minimal 30 cm. Dengan mengacu pada baku ini, diharapkan zat ekstraktif yang terkandung dalam kulit pohon, daun, serta biji telah terbentuk sempurna. Kulit pohon, daun, serta biji yang digunakan dalam penelitian ini dapat dilihat pada Lampiran 2.
Kulit pohon, daun, dan biji pohon faloak yang dikumpulkan selanjutnya dilakukan pemilahan dengan cara memisahkan bahan baku tersebut dari kotoran
lain yang melekat atau tercampur. Khusus untuk kulit, kulit bagian luar dipisahkan dari kulit bagian dalam untuk dibuang dengan cara dikikis, dan dibilas
dengan air bersih. Agar memudahkan proses pengeringan dan penggilingan, kulit pohon yang telah dibersihkan kemudian dirajang. Kulit yang telah dirajang, daun dan biji yang telah dipilah, selanjutnya dikeringudarakan dalam suhu ruangan hingga kering.
Serbuk kulit, serbuk daun, serta serbuk biji berukuran 40 – 60 mesh diperoleh dengan cara digiling dengan hammer mill. Ukuran partikel dari simplisia mempengaruhi kecepatan proses ekstraksi dan besarnya rendemen yang dihasilkan. Pengecilan ukuran partikel sampel dimaksudkan untuk memperkecil permukaan sampel sehingga semakin banyak yang terekstraksi. Serbuk sampel yang diperoleh kemudian dikeringkan dengan oven pada suhu 500C hingga kadar air kurang dari 10%.
Penetapan Kadar Air
Penetapan kadar air dilakukan dengan cara mengeringkan cawan porselin pada suhu 102±3oC selama 30 menit, kemudian ditimbang setelah didinginkan di dalam eksikator. Serbuk kulit, daun, dan biji masing-masing sebanyak kurang lebih dua gram dimasukkan ke dalam cawan porselin kemudian dikeringkan
Kadar air (%) = –
untuk
BKU = Bobot Serbuk Kering Udara (g) BKT = Bobot Serbuk Kering Oven (g)
Ekstraksi
Metode ekstraksi yang digunakan adalah metode maserasi menggunakan pelarut aseton, n-hexane, dietil eter, dan etil asetat. Maserasi ini dilakukan secara
bertingkat dengan pelarut awal aseton, dilanjutkan dengan fraksinasi secara berturut-turut mulai dari pelarut non polar n-hexane, dietil eter, dan etil asetat
sebagai pelarut semi polar.
Serbuk daun, serbuk biji, dan serbuk kulit masing-masing sebanyak ± 2000 gram direndam dalam aseton selama 48 jam dengan mengaduk sesering mungkin. Selanjutnya filtrat aseton dipisahkan dari residunya dengan cara penyaringan. Residu yang diperoleh kemudian direndam lagi dengan aseton selama 24 jam sambil diaduk sesering mungkin. Setelah 24 jam dilakukan penyaringan untuk memperoleh filtrat aseton. Hal ini dilakukan secara berulang-ulang hingga memperoleh filtrat bening.
Filtrat diuapkan dengan rotary evaporator pada suhu ± 40oC sehingga diperoleh ekstrak pekat sebanyak ± 100 ml. Ekstrak pekat ± 100 ml tersebut difraksinasi dengan n-hexan, dengan cara dimasukkan ke dalam funnel 500 ml yang di dalamnya sudah terdapat n-hexane 70 ml. Campuran dikocok dan didiamkan sampai ada pemisahan antara filtrat dengan residu. Jika belum menunjukkan pemisahan, maka n-heksan ditambahkan dengan kelipatan 70 ml sampai ada pemisahan antara ekstrak dengan residu. Jika isi funnel belum menunjukkan pemisahan setelah penambahan tiga sampai empat kali penambahan
n-heksan 70 ml, maka ditambahkan air suling 20 ml. Hasil yang diperoleh pada tahapan ini adalah ekstrak n-hexane dengan residu.
eter diuapkan dengan rotary evaporator pada suhu ± 40oC untuk memperoleh ekstrak dietil eter pekat, dan residunya difraksinasi dengan etil asetat untuk memperoleh extrak etil asetat. Hasil dari fraksinasi etil asetat menghasilkan extrak etil asetat dan residu. Ekstrak etil asetat diuapkan dengan rotary evaporator pada suhu ± 40oC untuk memperoleh ekstrak etil asetat pekat, dan residunya dipekatkan. Proses fraksinasi dietil eter dengan etil asetat dilakukan sama seperti prosedur fraksinasi n-hexan.
Semua fraksi ekstrak pekat n-hexane, dietil eter, etil asetat, dan residu pekat hasil fraksinasi etil asetat dikeringkan dalam oven pada suhu ± 500C. Ekstrak yang dihasilkan setelah pengovenan ini menghasilkan zat ekstraktif
kulit, daun dan biji faloak dalam bentuk padatan dari masing-masing fraksi. Zat ekstraktif yang diperoleh selanjutnya digunakan untuk dilakukan uji fitokimia dan
uji antibiogram.
Masing-masing ekstrak ditimbang untuk mengetahui rendemennya sebagai persentase zat ekstraktif (% zat ekstraktif), dan dilakukan uji fitokimia untuk mengetahui kandungan kimia utamanya (Harborne 1987). Selanjutnya dilakukan uji aktivitas antimikroba terhadap masing-masing zat ekstraktif. Rendemen masing-masing fraksi zat ekstraktif dihitung dengan persamaan sebagai berikut:
Ekstraktif (%) = x 100 % untuk
BKE = Berat kering tanur zat ekstraktif (g) BKS = Berat kering tanur serbuk sampel (g)
Uji Fitokimia
Analisis fitokimia dilakukan untuk mendeteksi adanya senyawa utama dengan mengikuti metode Harborne (1987). Senyawa-senyawa utama dimaksud adalah alkaloid, flavonoid, saponin, serta uji triterpenoid dan steroid.
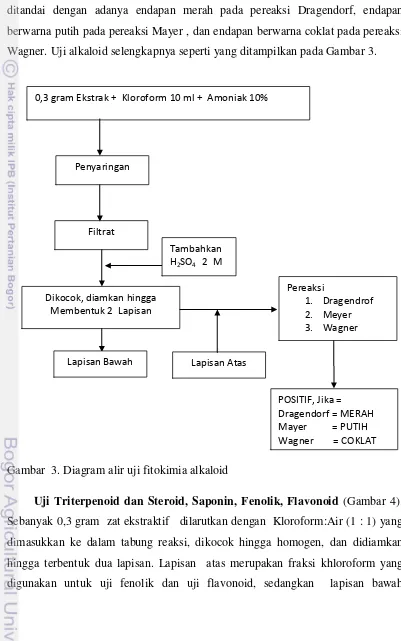
Uji Alkaloid. Sebanyak 0,3 gram zat ekstraktif dilarutkan dalam 10 mL khloroform dan tiga tetes amoniak 10 % yang dimasukkan ke dalam tabung
reaksi kemudian dikocok sampai homogen. Filtrat diperoleh dengan cara disaring, filtrat tersebut diasamkan dengan asam sulfat 2M (volumenya sebanyak
membentuk dua lapisan. Lapisan atas (lapisan asam sulfat) diambil dan dimasukkan ke dalam tiga tabung reaksi dan masing-masing tabung ditambahkan pereaksi Dragendorf, pereaksi Mayer, dan pereaksi Wagner). Adanya alkaloid ditandai dengan adanya endapan merah pada pereaksi Dragendorf, endapan berwarna putih pada pereaksi Mayer , dan endapan berwarna coklat pada pereaksi Wagner. Uji alkaloid selengkapnya seperti yang ditampilkan pada Gambar 3.
Gambar 3. Diagram alir uji fitokimia alkaloid
Uji Triterpenoid dan Steroid, Saponin, Fenolik, Flavonoid (Gambar 4). Sebanyak 0,3 gram zat ekstraktif dilarutkan dengan Kloroform:Air (1 : 1) yang dimasukkan ke dalam tabung reaksi, dikocok hingga homogen, dan didiamkan
hingga terbentuk dua lapisan. Lapisan atas merupakan fraksi khloroform yang digunakan untuk uji fenolik dan uji flavonoid, sedangkan lapisan bawah
0,3 gram Ekstrak + Kloroform 10 ml + Amoniak 10%
Penyaringan
Filtrat
Dikocok, diamkan hingga Membentuk 2 Lapisan
Tambahkan H2SO4 2 M
Lapisan Bawah
Pereaksi
1. Dragendrof 2. Meyer 3. Wagner
Lapisan Atas
merupakan fraksi air yang digunakan untuk uji triterpenoid dan steroid. Uji selengkapnya dilakukan sebagai berikut:
1. Lapisan Atas (Fraksi Kloroform)
Uji Fenolik dilakukan dengan mengambil fraksi kloroform dengan pipet dan diteteskan ke dalam lempeng tetes. Kemudian ditambahkan FeCl3 1%.
Gambar 4. Diagram alir uji fitokimia flavonoid, fenolik, triterpenoid dan steroid, saponin.
Adanya fenolik ditandai dengan adanya perubahan warna fraksi kloroform dalam lempeng tetes menjadi hijau, atau biru/ungu. Untuk uji adanya flavonoid, fraksi kloroform dimasukkan ke dalam tabung reaksi, ditambahkan magnesium sebanyak 0,1 gram, HCl pekat 1 mL, dan n-Amyl Kocok Vertikal sampai membentuk busa
Diamkan selama 10 menit,
alcohol 1 mililiter. Warna fraksi kloroform akan berubah menjadi kuning/jingga yang menunjukkan bahwa zat ekstraktif tersebut mengandung senyawa flavonoid.
2. Lapisan Bawah (Fraksi Air).
Fraksi air yang diperoleh disaring untuk memisahkan filtrat dengan residu. Filtrat selanjutnya digunakan untuk menguji adanya steroid dan triterpenoid, sedangkan residu digunakan untuk menguji adanya saponin.
Filtrat yang diperoleh digunakan untuk menguji adanya triterpenoid dan steroid, yakni dengan memasukkan filtrat beberapa tetes ke dalam lempeng
tetes, dan dibiarkan hingga filtrat dalam lempeng tetes menjadi kering. Setelah filtrat dalam lempeng tetes menjadi kering, ditambahkan beberapa tetes
pereaksi Lieberman Burchard. Adanya steroid jika filtrat yang telah ditambahkan pereaksi Lieberman Burchard berubah menjadi hijau atau biru, dan adanya triterpenoid ditunjukkan dengan perubahan warna menjadi merah. Pengujian adanya saponin dilakukan dengan melarutkan residu dari fraksi air dengan air suling sebanyak lima mililiter dan dimasukkan ke dalam baker glass, dipanaskan sampai mendidih, didinginkan, dan dimasukkan ke dalam tabung reaksi tertutup, kemudian dikocok vertikal sampai membentuk busa. Setelah terbentuk busa, didiamkan selama 10 menit, ditambahkan HCl 2 N, dan kemudian didiamkan selama 15 menit. Adanya saponin jika busa dalam tabung yang terbentuk tidak berubah.
Uji Aktivitas Antimikroba (Antibiogram)
Pengujian aktivitas antimikroba dilakukan dengan menggunakan metode difusi sumur agar dan metode ini merupakan modifikasi dari metode yang digunakan oleh Ramesh dan Patar (2010). Isolat bakteri uji dibiakkan pada media Brain Heart Infusion (BHI) Broth, dan isolat cendawan dibiakkan pada media Sabouraud Dextrose Broth (SDB). Biakkan diinkubasi pada suhu 370C selama 24
jam.
Setelah masa inkubasi dicapai, isolat dibuat suspensi di dalam tabung sentrifus, disentrifugasi selama 30 menit dengan kecepatan 5000 rpm untuk
mengendap di tabung sentrifus ditambahkan air suling sucihama (sampai setengah tabung) setelah supernatannya dibuang. Agar homogen, pellet yang telah
dicampur air suling dikocok dengan pengaduk “vortex” dan disentrifugasi selama
30 menit pada kecepatan 5000 rpm. Perlakuan yang sama dilakukan sampai tiga kali untuk memperoleh pellet yang benar-benar bersih (bebas dari media atau kotoran lain berupa supernatant) yang dibentuk selama proses pembiakkan. Pellet hasil sentrifugasi terakhir (ketiga) dilarutkan dalam NaCl fisiologis dengan cara memasukkannya sedikit demi sedikit sampai memperoleh kekeruhan suspensi isolat yang setara dengan Kekeruhan Standar Mc.Farland #1 (106 cfu/mL).
Pengukuran zona hambat dilakukan dengan mengunakan media Mueller
Hinton Agar untuk isolat bakteri dan media SDA untuk isolat cendawan. Sebanyak 100 µL (105 cfu/mL) suspensi isolat diteteskan ke atas media agar padat
datar di dalam cawan petri. Tetesan isolat diratakan dengan menggunakan spatula sehingga isolat dapat menyebar merata di atas permukaan media. Sumur kecil berdiameter 6 mm dibuat di media agar padat yang telah ditetesi isolat dengan menggunakan penggerek sucihama secara triplo. Ke dalam masing-masing sumur diisi 25 µL zat ekstraktif yang telah dilarutkan dalam dimetilsulfoksida (DMSO) pada konsentrasi 200 mg/mL.
Fraksinasi dan Isolasi Kromatografi Lapis Tipis (KLT)
Pemisahan senyawa yang memiliki sifat antimikroba dilakukan terlebih
dahulu mencari eluen terbaik dengan menggunakan KLT. Eluen yang digunakan adalah pelarut dengan tingkat kepolaran yang berbeda, yaitu hexan, benzene, kloroform, dietil eter, etil asetat, aseton, etanol, dan methanol sebagai fase gerak, dan silica gel dalam KLT sebagai fase diam. KLT yang telah dipotong berukuran 1 cm x 10 cm, diberi garis pembatas masing-masing 1 cm dari ujung bidang panjang lempeng KLT, kemudian dipanaskan menggunakan oven selama 30 menit pada suhu 800C, sambil menyiapkan sejumlah cember dan cawan petri sesuai banyaknya pelarut sebagai eluen. Masing-masing cember diisi eluen sebanyak empat milliliter, kemudian ditutup rapat dengan cawan petri sehingga kondisi dalam cember jenuh dengan eluen.
Lempeng KLT yang telah dipanasi, didiamkan sampai kondisi lempeng KLT menjadi dingin, Zat ekstraktif ditempatkan tepat pada garis batas bawah sampai ada warna yang timbul dengan menggunakan pipa kapiler. Lempeng KLT yang telah diberi tetesan zat ekstraktif didiamkan selama ± 15 menit agar zat ekstraktif yang ditotolkan terserap sempurna oleh silica gel dan menjadi kering dan selanjutnya dimasukkan ke dalam cember (lempeng KLT yang sudah berada
di dalam cember tidak boleh diganggu) dan ditutup kembali dengan cawan petri. Lempeng KLT yang siap dianalisis adalah lempeng KLT yang telah dialiri eluen
sampai pada garis batas atas KLT, didiamkan sampai eluen menguap kembali dan KLT menjadi kering. Analisis dilakukan dengan menggunakan sinar UV 254 nm untuk mengamati nilai Rf masing-masing lempeng KLT.
Kromatografi Kolom (KK)
sebanyak 90 gram direndam dengan kloroform selama 24 jam. Kolom yang telah disiapkan diisi dengan klorofom setinggi ± 10 cm dari dasar kolom. Kemudian dielusi dan kolom siap diisi dengan silica gel yang telah disiapkan.
Ketika pengisian kolom, perlu disiapkan ruang setinggi ± 10 cm di atas silica gel untuk memberikan ruang yang cukup untuk diisi eluen. Kolom yang telah diisi silika gel, dielusi dengan kloroform sambil diketuk perlahan dengan benda yang permukaannya tidak kaku (batang spidol whiteboard), sehingga gelembung udara keluar dan isi kolom tersebar merata yang ditandai dengan tinggi silica gel dalam kolom tidak berubah (Sudarmadji 1996).
Kolom yang siap untuk diisi dengan sampel, terlebih dahulu mengelusikan
semua eluen sampai permukaan silica gel kemudian keran ditutup. Sampel diteteskan dengan pipet sampai membasahi permukaan kolom. Perlahan-lahan
eluen ditambahkan pada kolom sampai setinggi 5 – 10 cm atau sampai penuh. Dengan demikian, kolom siap dielusi dengan membuka keran yang disambungkan dari kolom dengan pipa kapiler. Kecepatan aliran harus tetap, sehingga dalam penelitian ini eluat ditampung setiap lima menit dengan kecepatan satu tetes/detik. Eluen klorofom:benzene (10 : 0) akan berhenti dan diganti jika selama 3-5 tabung eluat yang tampung tidak berwarna/bening, maka gradient ditingkatkan menjadi kloroform : benzene (9 : 1). Perlakuan ini dilakukan hingga gradient akhir yaitu kloroform : benzene (0 : 10), dan dianggap selesai jika eluat yang keluar setelah menggunakan gradient akhir ini tidak berwarna lagi (bening seperti warna benzene).
Eluat yang keluar dari kolom yang telah ditampung, dianalisis dengan KLT. Hasil KLT diamati dengan menggunakan sinar UV 254 nm untuk mengamati nilai Rf masing-masing KLT. Eluen yang memiliki Rf yang sama disatukan, diuapkan, dan dilanjutkan dengan uji antimikroba untuk memilih sub fraksi yang paling aktif.
Eluen terbaik adalah kombinasi lempeng KLT yang memiliki spot terbanyak dengan pemisahannya mendekati sempurna, dan spot yang terbentuk pada lempeng KLT memiliki jarak antara spot tersebar hampir merata. Eluen terbaik yang digunakan dalam penelitian ini adalah benzen : khloroform (4:1). Eluen ini
memiliki tiga spot tunggal yang terpisah secara sempurna dan memiliki jarak yang jelas antara spot satu dengan yang lainnya. Khloroform memiliki tiga spot tunggal, tetapi salah satu spotnya berada di garis dasar atau tidak terelusi (eluen penahan). Kombinasi benzene yang semuanya terelusi dengan khloroform yang salah satu spotnya tidak terelusi menghasilkan kombinasi eluen yang menghasilkan sembilan spot dengan pemisahannya mendekati sempurna, dan spot yang terbentuk dalam KLT memiliki jarak antar spot tersebar hampir merata sehingga kombinasi ini dipilih sebagai eluen terbaik yang digunakan dalam kromatografi kolom (KK).
Penentuan Nilai Kadar Hambat Minimum (Minimum Inhibition Concentration, MIC) dan Kadar Membunuh Cendawan Minimum (Minimum Fungicide Concentration-MFC)
Nilai MIC dan MFC ditentukan dengan menggunakan metode two-fold serial dilution (Olaleye dan Tolulope 2007) dengan rangkaian konsentrasi zat ekstraktif sebesar 16, 8, 4, 2, 1, 0,5, dan 0,25 mg/mL dan suspensi mikroba sebanyak 100 µL (105 CFU/mL-1). Bakteri uji dibiakkan pada media Brain Heart Infusion (BHI) Broth, dan cendawan dibiakkan pada media Potato Dextrose Broth (PDB). Biakan bakteri diinkubasi pada suhu 370C selama 24 jam dan biakan cendawan diinkubasi selama 48 jam pada suhu 370C (Policegoudra et al. 2010).
Pembuatan suspensi bakteri dan cendawan dilakukan seperti tatacara untuk menguji aktivitas antimikroba di atas. Sebanyak tujuh tabung pengenceran diisi masing-masing dengan 0,5 mL BHI Broth untuk bakteri dan PDB untuk cendawan. Sebanyak 0,5 mL zat ekstraktif dietil eter biji dimasukkan ke dalam tabung pertama, kemudian dikocok atau diaduk dengan mixer agar media dengan zat ekstraktif tercampur merata. Sebanyak 0,5 mL suspensi dari tabung pertama diambil dan dimasukkan ke tabung kedua, dan diaduk kembali sampai merata. Perlakuan yang sama dilakukan sampai tabung ke tujuh, sehingga tersusun deret pengenceran 16, 8, 4, 2, 1, 0,5, dan 0,25 mg/mL. Pada tabung ke 7 (tujuh), sebanyak 0,5 mL larutan yang telah dikocok atau diaduk dibuang untuk
mL. Setiap tabung ditambahi 0,4 mL media BHI Broth untuk bakteri dan PDB untuk cendawan untuk memperoleh isi akhir mencapai satu mililiter. Sebagai kontrol negatif, satu tabung diisi dengan satu mililiter media BHI Broth untuk bakteri dan satu mililiter media PDB untuk cendawan. Untuk kontrol positif, satu tabung berisi 0,9 mL media BHI Broth ditambahi inokulum bakteri dan satu tabung lainnya yang berisi 0,9 mL media PDB ditambahi dengan 0,1 mL inokulum cendawan.
Pertumbuhan mikroba diamati dengan membandingkan tingkat kekeruhan media setelah diinkubasi pada suhu 370C selama 24 jam untuk bakteri, dan diinkubasi selama 48 jam pada suhu 370C untuk cendawan terhadap kekeruhan
tabung kontrol positif dan kontrol negatif. Tabung yang kekeruhannya setara dengan kontrol negatif akan dicatat sebagai terhambat yang berarti zat ekstraktif
dietil eter biji faloak bersifat mematikan mikroba (-). Sedangkan tabung yang tingkat kekeruhannya setara dengan kekeruhan pada tabung kontrol positif akan dicatat sebagai tidak terhambat (++) berarti zat ekstraktif dietil eter biji faloak bersifat tidak menghambat pertumbuhan mikroba, dan (+) untuk kategori tidak terlalu keruh berarti zat ekstraktif dietil eter biji faloak bersifat menghambat pertumbuhan mikroba namun tidak mematikan. Untuk membuktikan terhambat atau tidaknya mikroba pada metode pengenceran ini, maka setiap tabung diuji kembali dengan metode agar datar, yaitu menumbuhkan isi tabung pengenceran yang berisi campuran isolat, media, dan zat ekstraktif pada media MHA; dan SDA untuk cendawan. Media yang tidak ditumbuhi mikroba uji mengindikasikan bahwa fraksi tersebut bersifat mematikan, sedangkan media yang ditumbuhi mikroba uji berarti fraksi tersebut tidak berpengaruh terhadap mikroba.
Identifikasi Senyawa Aktif
HASIL DAN PEMBAHASAN
Kandungan Zat Ekstraktif
Kandungan zat ekstraktif dari pohon faloak pada penelitian ini diperoleh
melalui metode maserasi bertingkat menggunakan aseton sebagai pelarut awal, dan dilanjutkan dengan fraksinasi secara bertingkat mulai dari heksan, dietil eter, dan etil asetat. Maserasi dengan menggunakan aseton dapat mengekstraksi senyawa polar, semi polar maupun senyawa non polar. Hal ini disebabkan sifat dari aseton itu sendiri sebagai pelarut semi polar yang tidak hanya mengekstraksi komponen polar, tetapi juga komponen semi polar dan non polar. Berdasarkan sifat tersebut, maka aseton digolongkan ke dalam pelarut standar untuk mengekstraksi komponen zat ekstraktif kayu yang direkomendasikan oleh CPPA dan ISO untuk pengujian yang berhubungan dengan pengujian metode uji TAPPI (Stenius 2000).
Table 1. Kandungan zat ekstraktif dari ekstrak aseton kulit, daun, dan biji faloak
Jenis Fraksi
pada biji lebih tinggi dibandingkan dengan kandungan zat ekstraktif kulit dan daun.
Perbedaan jumlah zat ekstraktif yang diperoleh dari hasil ekstraksi sangat ditentukan oleh sifat pelarut dan komposisi senyawa yang terkandung dalam bahan baku. Hal ini terbukti bahwa kandungan zat ekstraktif dalam biji adalah yang tertinggi diantara zat ekstraktif daun dan kulit faloak. Oleh karena itu, perlu dilakukan kajian lanjutan terhadap penggunaan pelarut yang sesuai untuk memperoleh kemungkinan jumlah zat ekstraktif yang lebih tinggi.
Houghton dan Raman (1998), menguraikan bahwa pelarut non polar akan secara selektif mengekstraksi senyawa kelompok lipofilik, demikian pula pelarut
semi polar akan mengekstraksi sejumlah senyawa polar. Tabel 1 memperlihatkan bahwa zat ekstraktif biji dan daun faloak pada fraksi heksan lebih tinggi
dibandingkan zat ekstraktif fraksi semi polar. Hasil ini memperlihatkan bahwa biji dan daun faloak lebih dominan mengandung senyawa lipofilik daripada senyawa hidrofilik, sedangkan kulit lebih dominan mengandung senyawa hidrofilik.
Hasil Uji Fitokimia
Uji fitokimia merupakan metode umum yang dilakukan untuk mendeteksi adanya senyawa metabolit sekunder yang terdapat dalam suatu tumbuhan. Metode ini sangat bermanfaat dalam menentukan golongan utama dari senyawa aktif zat ekstraktif kulit, daun dan biji faloak yang memiliki senyawa yang bersifat antimikroba. Tabel 2 menunjukkan bahwa zat ekstraktif aseton biji faloak lebih banyak mengandung senyawa metabolit sekunder dibandingkan dengan zat ekstraktif aseton dari daun dan kulit pohon faloak.
Senyawa metabolit sekunder yang terkandung di dalam biji memiliki jenis senyawa utama alkaloid, steroid, dan triterpenoid. Senyawa utama yang terdapat di dalam ekstrak aseton kulit hanya mengandung saponin yang tinggi dan sedikit triterpenoid. Berbeda dengan zat ekstraktif aseton kulit dan biji, zat ekstraktif aseton daun meskipun hanya mengandung steroid, namun tergolong positif kuat
Tabel 2. Hasil analisis fitokimia zat ekstraktif aseton kulit, biji, dan daun faloak
Jenis zat ekstraktif
Senyawa Metabolit Sekunder
Alkaloid Flavonoid Steroid Triterpenoid Fenolik Saponin
Kulit - - - + - +++
Biji +++ - +++ +++ + -
Daun - - +++ - + -
Keterangan: (-) = Tidak Terdeteksi; (+) = Positif lemah; (++) = Positif; (+++) = Positif Kuat.
Secara umum zat ekstraktif yang mengandung steroid, alkaloid, tanin, polifenol pada level yang tinggi (positif kuat), memiliki aktivitas antimikroba yang cukup tinggi pula. Anjaneyulu et al. (2010), melaporkan bahwa zat ekstraktif dari kulit Acacia leucophloea L. pada kosentrasi MIC 25 mg/ml dapat menghambat pertumbuhan beberapa bakteri patogen pada diameter zona hambat 6
– 9 mm. Paiva (2010), dan Coolborn dan Bolatito (2010), melaporkan bahwa zat ekstraktif yang bersumber dari tumbuhan yang mengandung senyawa metabolit sekunder seperti steroid, alkaloid, tanin, polifenol dapat menghambat pertumbuhan sejumlah mikroba patogen. Berdasarkan hal tersebut, zat ekstraktif aseton kulit, daun, dan biji berpotensi sebagai antimikroba.
Aktivitas Antimikroba
Hasil uji tapis untuk mengetahui kemampuan antimikroba menunjukkan bahwa zat ekstraktif kulit , daun dan biji faloak serta fraksi-fraksinya menghasilkan berbagai tingkatan zona hambat (mm) yang dibentuk, bahkan beberapa fraksi tidak membentuk zona hambat. Zona hambat (mm) yang dibentuk oleh zat ekstraktif kulit , daun, dan biji faloak disajikan pada Tabel 3, 4 dan 5.
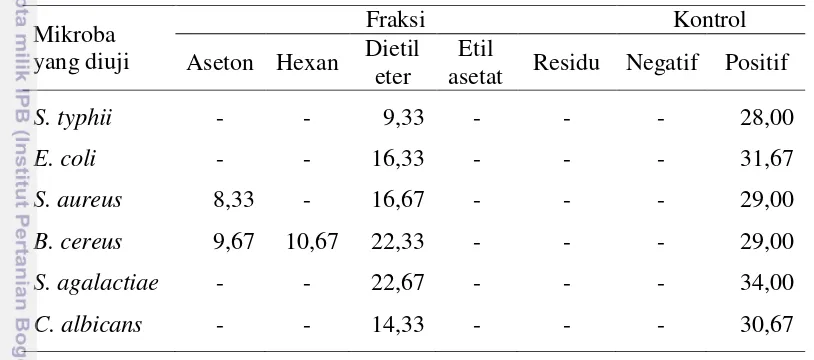
Fraksi aseton, dietil eter, etil asetat dan residu (fraksi polar) dari zat ekstraktif kulit pohon faloak memiliki sifat antimikroba terhadap bakteri S. aureus, S. agalactiae dan B. cereus, dan hanya fraksi heksan yang dapat menghambat pertumbuhan B. cereus (Tabel 3). Dari keempatnya, fraksi dietil eter menunjukkan hasil yang sangat baik karena mampu menghambat pertumbuhan
dan dietil eter saja yang menghambat pertumbuhan S. typhii dan E. coli. Fraksi dietil eter memberikan hasil penghambatan yang lebih baik dibandingkan fraksi aseton. C. albicans hanya mampu dihambat oleh fraksi aseton dengan diameter zona hambat yang relatif rendah.
Tabel 3.Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat ekstraktif dari kulit pohon faloak (ukuran dalam millimeter).
Mikroba daun faloak mampu menghambat pertumbuhan B. cereus dengan kisaran diameter zona hambat 7–13 mm, sedangkan S. aureus hanya mampu dihambat oleh fraksi etil asetat dan residu (fraksi polar). Hanya fraksi aseton dan fraksi etil asetat yang mampu menghambat S. typhii dan E. coli. Fraksi etil asetat memberikan hasil zona hambat yang lebih baik dibandingkan aseton. Seluruh fraksi dari zat ekstraktif daun faloak tidak mampu menghambat pertumbuhan C. albicans.
Tabel 4. Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat ekstraktif dari daun pohon faloak (ukuran dalam millimeter)
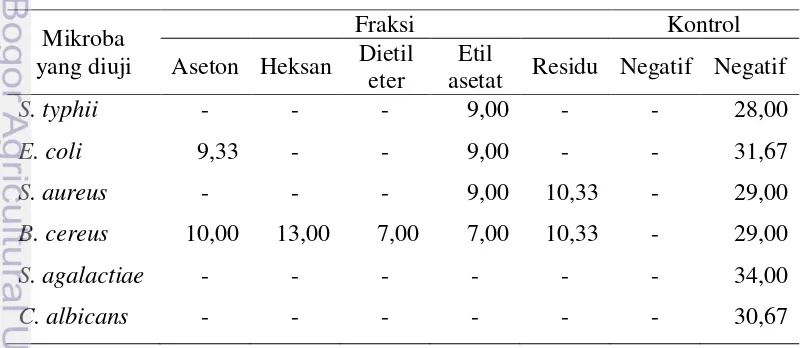
Dari data dalam Tabel 5 menunjukkan bahwa hanya fraksi dietil eter dari zat ekstraktif biji faloak yang memberikan hasil zona hambat yang baik. Fraksi ini mampu menghambat seluruh bakteri dan cendawan yang digunakan dalam penelitian ini. Fraksi aseton hanya mampu menghambat pertumbuhan bakteri B. cereus dan S. aureus. Fraksi heksan hanya mampu menghambat pertumbuhan bakteri B. cereus.
Tabel 5. Pembentukan zona hambat hasil uji tapis aktivitas antimikroba zat ekstraktif dari biji pohon faloak (ukuran dalam millimeter)
Mikroba yang diuji
Fraksi Kontrol
Aseton Hexan Dietil eter asetat Etil Residu Negatif Positif
S. typhii - - 9,33 - - - 28,00
E. coli - - 16,33 - - - 31,67
S. aureus 8,33 - 16,67 - - - 29,00
B. cereus 9,67 10,67 22,33 - - - 29,00
S. agalactiae - - 22,67 - - - 34,00
C. albicans - - 14,33 - - - 30,67