STRUKTUR KOMUNITAS LAMUN DAN
KETERKAITANNYA DENGAN KELIMPAHAN IKAN DI
PULAU PRAMUKA, KEPULAUAN SERIBU
SATRYO ARIF WIBOWO
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
STRUKTUR KOMUNITAS LAMUN DAN
KETERKAITANNYA DENGAN KELIMPAHAN IKAN DI
PULAU PRAMUKA, KEPULAUAN SERIBU
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan didalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, April 2013
RINGKASAN
Satryo Arif Wibowo. Struktur Komunitas Lamun dan Keterkaitannya dengan Kelimpahan Ikan di Pulau Pramuka, Kepulauan Seribu. Dibimbing oleh NEVIATY P. ZAMANI dan ADRIANI SUNUDDIN.
Ekosistem lamun di Pulau Pramuka, DKI Jakarta mempunyai peran yang penting bagi kehidupan ikan, baik yang hidup di dalamnya maupun yang berasal dari ekosistem lain seperti terumbu karang dan perairan pelagis. Lamun berperan sebagai daerah asuhan dan perlindungan, sebagai sumber makanan bagi ikan-ikan itu sendiri, dan tempat penggembalaan atau mencari makan (Adrim 2006). Pentingnya peran lamun bagi komunitas ikan, maka kajian tentang keterkaitan komunitas lamun dengan ikan perlu dilakukan. Tujuan penelitian ini adalah mengkaji struktur komunitas lamun, komunitas ikan, serta keterkaitan lamun dengan ikan yang ada di perairan Pulau Pramuka.
Penelitian dilakukan pada bulan Maret-Juni 2011. Pengambilan data komunitas lamun lamun dan ikan dilakukan di empat stasiun Pulau Pramuka (Utara, Timur, Selatan, dan Barat Pulau Pramuka). Analisis data yang digunakan pada penelitian ini meliputi analisis faktorial koresponden, indeks nilai penting, indeks ekologi, dan korelasi pearson.
Kondisi kualitas perairan Pulau Pramuka secara umum dalam keadaan baik untuk menunjang kehidupan sumberdaya lamun dan ikan. Berdasarkan hasil pengamatan, ditemukan 6 jenis lamun yang tersebar di perairan Pulau Pramuka. Jenis lamun tersebut adalah Cymodocea rotundata, Enhalus acoroides, Halodule uninervis, Halophila ovalis, Thalassia hemprichii, dan Syringodium isoetifolium. Thalassia hemprichii merupakan jenis yang umum ditemukan di perairan Pulau Pramuka. Thalassia hemprichii memiliki pengaruh yang besar dibandingkan jenis lainnya dengan rata-rata INP 122,32. Menurut Keputusan Menteri Lingkungan Hidup No. 200 Tahun 2004, berdasarkan penutupannya, kondisi ekosistem lamun di perairan Pulau Pramuka termasuk dalam criteria kurang baik (41,86%). Siganus sp. merupakan jenis ikan yang umum ditemukan di perairan Pulau Pramuka. Jenis ikan lainnya yang ditemukan di perairan Pulau Pramuka adalah Apogon,
Cheilodipterus, Cryptocentrus, Halichoeres, Gerres, Monachantus, Scolopsis, Dischistodus, Epinephelus, Siganus. Analisis indeks ekologi menunjukkan komunitas lamun dan ikan berada dalam kondisi yang stabil.
Analisis faktorial koresponden menunjukkan kelimpahan dan
keanekaragaman ikan lebih tinggi di daerah tutupan yang vegetasi lamunnya juga tinggi. Analisis korelasi pearson menunjukkan bahwa penutupan dan jumlah jenis lamun memberikan pengaruh yang nyata terhadap kelimpahan dan
keanekaragaman ikan.
© Hak cipta milik IPB, tahun 2012
Hak Cipta Dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a) Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b) Pengutipan tidak merugikan kepentingan yang wajar IPB
STRUKTUR KOMUNITAS LAMUN DAN
KETERKAITANNYA DENGAN KELIMPAHAN IKAN DI
PULAU PRAMUKA, KEPULAUAN SERIBU
SATRYO ARIF WIBOWO
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Penulis dilahirkan di Palembang, Sumatera Selatan, 16 Maret 1990 dari Ayah Ir. Edy Cahyono dan Ibu Sri Lestari. Penulis adalah anak ketiga dari empat bersaudara. Tahun 2007 Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri (SMAN) 60 DKI Jakarta. Penulis melanjutkan studi di Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dengan program studi Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama perkuliahan Penulis aktif diberbagai kegiatan kemahasiswaan diantaranya: kepengurusan Himpunan Mahasiswa Ilmu dan Teknologi Kelautan (HIMITEKA) 2009-20010, dan Ketua panitia Mariner’s Gathering Day 2010. Penulis juga aktif menjadi asisten praktikum mata kuliah Dasar-Dasar
Instrumentasi Kelautan dan Instrumentasi Kelautan 2010. Penulis juga pernah melakukan praktek kerja lapang (PKL) di COREMAP Bintan, Kepulauan Riau.
Sebagai tugas akhir untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dengan judul “Struktur Komunitas Lamun dan Keterkaitannya dengan Kelimpahan Ikan di Pulau Pramuka,
SKRIPSI
Judul Penelitian : Struktur Komunitas Lamun dan Keterkaitannya dengan Kelimpahan Ikan di Pulau Pramuka, Kepulauan Seribu
Nama Mahasiswa : Satryo Arif Wibowo Nomor Pokok : C54070073
Departemen : Ilmu dan Teknologi Kelautan
Menyetujui, Dosen Pembimbing
Dr. Ir. Neviaty P. Zamani M.Sc Adriani Sunuddin, S. Pi, M.Si NIP. 19641014 198803 2 001 NIP. 19790206 200604 2 013
Mengetahui,
24 April 2013
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga skripsi yang berjudul “Struktur Komunitas Lamun dan Keterkaitannya dengan Kelimpahan Ikan di Pulau Pramuka, Kepulauan Seribu” ini dapat diselesaikan dengan baik.
Terima kasih penulis ucapkan kepada Ibu Dr. Neviaty P. Zamani M.Sc sebagai pembimbing pertama, Ibu Adriani Sunuddin, S. Pi, M.Si sebagai pembimbing kedua, Bapak Dr. Syamsul Bahri Agus, S.Pi, M. Si, seluruh staf pengajar dan administrasi Mayor ITK, serta rekan-rekan mahasiswa ITK yang telah banyak membantu penulis selama masa penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga atas segala doa dan kasih sayangnya. Semoga hasil karya ini dapat bermanfaat bagi pengembangan pengetahuan di bidang perikanan dan ilmu kelautan.
Bogor, April 2013
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
1. PENDAHULUAN 1.1. Latar Belakang ... 1
1.2. Tujuan ... 3
2. TINJAUAN PUSTAKA 2.1. Keadaan Umum Daerah Penelitian ... 4
3. METODOLOGI PENELITIAN 3.1. Waktu dan Lokasi Penelitian ... 16
3.4.3. Analisis faktorial koresponden (Correspondence analysis) ... 22
3.4.4. Korelasi Pearson ... 23
ix
4.4.2. Indeks ekologi komunitas ikan ... 36
4.5. Hubungan Kelimpahan Ikan dengan Karakteristik Stasiun Pengamatan ... 37
4.6. Hubungan Karakteristik Lamun dengan Kelimpahan dan Keanekaragaman Ikan ... 39
5. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 41
5.2. Saran ... 41
DAFTAR PUSTAKA ... 42
x
DAFTAR TABEL
Halaman
1. Alat dan bahan yang digunakan dalam penelitian ... 17
2. Hasil analisis parameter fisik dan kimia perairan di Pulau Pramuka ... 26
3. Indeks Nilai Penting lamun ... 30
4. Kerapatan jenis lamun ... 31
5. Persentase penutupan jenis lamun ... 32
6. Frekuensi jenis lamun ... 33
xi
Halaman
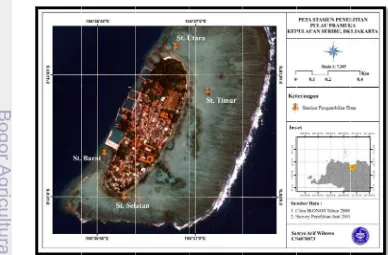
1. Peta lokasi penelitian ... 16
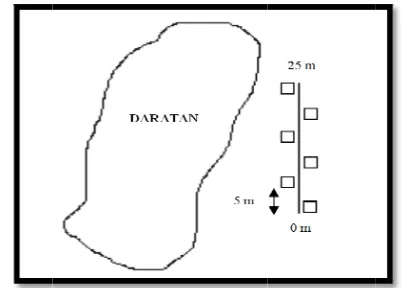
2. Ilustrasi peletakan garis transek terhadap garis daratan ... 18
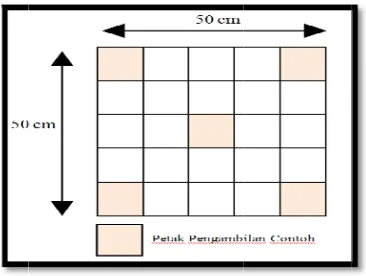
3. Transek kuadrat ... 19
4. Komposisi jenis lamun berdasarkan kerapatan jenis di empat stasiun pengamatan ... 28
5. Nilai Indeks ekologi komunitas lamun ... 30
6. Komposisi ikan berdasarkan kelimpahannya ... 35
7. Nilai indeks ekologi komunitas ikan ... 36
xii
DAFTAR LAMPIRAN
Halaman
1. Alat yang digunakan dalam penelitian ... 46
2. Data kelimpahan ikan (ind/m2) ... 47
3. Gambar berbagai jenis ikan di Pulau Pramuka ... 48
1
1.1. Latar belakang
Ekosistem laut tropis mencakup berbagai macam ekosistem yang berada pada daerah tropis, yaitu ekosistem mangrove, ekosistem lamun, dan ekosistem terumbu karang. Ketiga ekosistem ini saling membentuk interaksi yang terkait satu sama lain. Interaksi yang terbentuk dari ketiga ekosistem tersebut mencakup interaksi fisik, bahan organik terlarut, bahan organik partikel, dan migrasi fauna.
Ekosistem lamun merupakan suatu sistem ekologi padang lamun yang di dalamnya terjadi hubungan timbal balik antara komponen abiotik (sedimen dan air) dan komponen biotik (hewan dan tumbuhan) (Azkab 2006). Ekosistem lamun merupakan salah satu ekosistem laut terkaya dan produktif. Nilai produksi lamun dapat mencapai 460 m2/tahun bahkan dapat lebih dari dua kali lipatnya
(Hemminga dan Duarte 2000). Produktivitas primer yang tinggi dan system perakaran yang rumit menjadikan lamun sebagai sumber bahan organik dan stabilitas pantai serta ekosistem lain disekitarnya. Lamun bersama-sama dengan mangrove dan terumbu karang merupakan satu pusat kekayaan plasma nutfah dan keanekaragaman hayati, khususnya di Indonesia dan perairan tropis pada
umumnya.
Keberadaan ekosistem lamun telah memberikan kontribusi yang cukup besar baik secara ekologis maupun ekonomi. Secara ekologis lamun dapat berperan diantaranya sebagai stabilisator sedimen, filtrasi air, pendaur zat hara, dan pelindung erosi pantai, sedangkan secara ekonomis ekosistem lamun
2
Ekosistem lamun di Kepulauan Seribu terutama di Pulau Pramuka mempunyai peran yang sangat penting bagi kehidupan ikan yang hidup di dalamnya. Lamun berperan sebagai daerah asuhan dan perlindungan, sebagai makanan bagi ikan-ikan itu sendiri, dan tempat penggembalaan atau mencari makan (Adrim 2006). Keberadaan ekosistem ini secara tidak langsung juga berperan dalam produksi perikanan masyarakat di pulau tersebut.
Ekosistem lamun adalah ekosistem yang rentan terhadap perubahan kondisi lingkungan di sekitarnya. Pulau Pramuka merupakan salah satu pulau dengan kepadatan penduduk yang cukup tinggi. Jumlah penduduk di Pulau Pramuka mencapai 1004 jiwa (Pemprov DKI Jakarta 2009). Aktivitas dari penduduk setempat dapat memberikan pengaruh yang negatif terhadap kondisi ekosistem lamun. Ancaman terhadap ekosistem lamun ini berasal dari kegiatan penambangan karang untuk pembangunan, pencemaran, aktivitas keseharian di Pulau Pramuka, dan pengerukan pantai (Rachman 2007).
1.2. Tujuan
4
2. TINJAUAN PUSTAKA
2.1. Keadaan Umum Daerah Penelitian
Kepulauan Seribu terdiri atas 110 pulau yang terbentang di sebelah utara
Teluk Jakarta hingga Pulau Sebira yang terletak paling jauh dari Teluk Jakarta.
Kepulauan Seribu terletak antara 06○00’40” - 05○54’40” LS dan 106○40’45” -
109○01’19” BT. Pulau Pramuka secara administratif berada di Kelurahan Pulau
Panggang, Kecamatan Kepulauan Seribu Utara, Kabupaten Administratif
Kepulauan Seribu, Pemerintah Provinsi Khusus Ibukota Jakarta. Luas daratan
keseluruhan Kabupaten Administrafif Kepulauan Seribu mencapai 897,71 Ha.
Pulau Pramuka sendiri memiliki luas mencapai 16 Ha (Pemerintah Provinsi DKI
Jakarta 2009).
Kepulauan Seribu mempunyai iklim muson laut tropis, yakni adanya
pergantian arah angin setiap setengah tahun yang disebut angin muson. Musim
basah mencapai kondisi maksimum pada bulan Januari, sedangkan musim kering
mencapai puncak pada bulan Juni - Agustus. Rata-rata curah hujan bulanan
selama 10 tahun terakhir berkisar antara 43-510 mm. Musim hujan berlangsung
pada bulan November-April. Jumlah hari hujan antara 10-20 hari per bulan
dengan curah hujan tertinggi sebesar 510 mm terjadi pada bulan Januari. Musim
kemarau berlangsung antara bulan Mei-Oktober. Jumlah hari hujan antara 4-10
hari per bulan dengan curah hujan terendah sebesar 43 mm terjadi pada bulan
Agustus (BTNKpS 2008).
Kondisi angin di Kepulauan Seribu sangat dipengaruhi oleh Angin Muson
Barat dan Angin Musim Timur. Kecepatan angin pada musim Barat bervariasi
antara 7-15 knot/jam. Kedudukan air tertinggi dan terendah adalah 0,6 m dan 0,5
m di bawah duduk tengah. Kecepatan arus di Kepulauan Seribu berkisar antara
0,6-77,3 cm/detik, sedangkan di Pulau Pramuka sendiri berkisar antara 4 - 49
cm/detik. Tipe iklim di Kepulauan Seribu termasuk tropika panas dengan suhu
rata-rata sebesar 27 °C. Salinitas di Kepulauan Seribu tidak berbeda nyata
berkisar antara 30-34 ‰. Kadar DO dan BOD di Kepulauan Seribu masih masuk
dalam kisaran layak guna, namun untuk nilai COD sudah melebihi ambang batas.
Demikian halnya dengan logam berat Cd dan Pb, semakin dengan Teluk Jakarta
konsentrasinya semakin tinggi (Sachoemar 2008).
2.2. Padang Lamun
2.2.1. Sejarah penamaan lamun di Indonesia
Istilah lamun pertama kali diperkenalkan oleh Dr. Malikusworo Hutomo
(1984) berdasarkan istilah yang dipakai nelayan dan masyarakat pesisir Teluk
Banten untuk seluruh jenis “seagrass”. Istilah ini di daerah lain dipakai untuk satu jenis lamun saja seperti penduduk Pulau Pari. Penduduk Pulau Seribu
memberi nama samo-samo untuk jenis Enhalus acoroides dan tidak mengenal istilah lain untuk tumbuhan seagrass pada masa itu. Penduduk wilayah pesisir dan nelayan di beberapa wilayah Indonesia lainnnya seperti Lombok Selatan,
Pulau Selayar, Kepulauan Riau, Sumatera Utara, dan Teluk Lampung juga tidak
mengetahui istilah seagrass pada saat itu. Guna menyamakan persepsi
masyarakat Indonesia tentang seagrass, maka istilah lamun untuk seagrass dari Teluk Banten diangkat menjadi istilah dalam Bahasa Indonesia (Kiswara dan
6
Kata lamun untuk padanan kata dari tumbuhan laut, seagrass, di Indonesia digunakan dengan terpaksa karena seharusnya terjemahan seagrass dalam bahasa Indonesia adalah rumput laut. Kata rumput laut sudah digunakan secara umum
dan baku bagi tumbuhan algae (seaweed) baik dalam dunia perdagangan maupun dalam penggunaan bahasa Indonesia yang baku sehari-hari (Atmadja 1999 dalam
Azkab 2006). Kesepakatan tidak tertulis khususnya untuk para ilmuwan dan
akademisi untuk menghilangkan kerancuan dari tumbuhan seagrass dan seaweed, maka istilah lamun dipakai untuk tumbuhan seagrass dan rumput laut tetap untuk
seaweed.
2.2.2. Karakteristik dan habitat
Lamun atau seagrass merupakan tumbuhan berbunga yang sepenuhnya menyesuaikan diri untuk hidup terbenam dalam air laut. Tumbuhan ini terdiri dari
rhizome, daun, dan akar. Rhizome merupakan batang yang terbenam dan
merayap secara mendatar serta berbuku. Pada buku-buku tersebut tumbuh batang
pendek yang tegak keatas, berdaun, berbunga, serta tumbuh juga akar. Tumbuhan
ini menancapkan diri dengan menggunakan rhizome dan akarnya sehingga tahan
terhadap hempasan gelombang dan arus. Sistem pembiakannya khas karena
mampu melakukan penyerbukan di dalam air (hydrophilous pollination) dan buahnya juga terendam di dalam air (Nontji 2007). Tumbuhan ini memiliki
beberapa sifat yang memungkinkannya hidup di lingkungan laut, yaitu mampu
hidup di media air asin, mampu berfungsi normal dalam keadaan terbenam,
mempunyai sistem perakaran jangkar yang baik, serta mampu melaksanakan
Lamun tumbuh dan tersebar di sebagian besar perairan pantai dunia.
Tumbuhan ini dapat hidup dan berkembang baik di lingkungan perairan laut
dangkal, estuaria yang memiliki kadar garam tinggi, dan daerah yang selalu
mendapat genangan air pada saat air surut (Azkab, 2006). Lamun hidup di daerah
mid intertidal sampai kedalaman 0,5-10 m, dan sangat melimpah di daerah
sublitoral. Lamun bahkan dapat tumbuh hingga kedalaman 40-90 m di perairan
yang masih dapat ditembus cahaya matahari serta menerima nutrien dari darat dan
laut itu sendiri (Den Hartog 1970).
Jumlah jenis lamun di dunia dikelompokkan dalam 12 genus, empat
famili, dan dua ordo. Perairan Indonesia tercatat memiliki 12 jenis lamun, yaitu
Cymodocea rotundata, Cymodocea serrulata, Enhalus acoroides, Halodule pinifolia, Halophila decipiens, Halophila ovalis, Halophila spinulosa,
Syringodium isoetiflium, Thalassia hemprichii, dan Thalassodendron ciliatum. Namun, apabila Halophila beccarri dan Ruppia maritime yang herbariumnya dapat ditemui di Herbarium Bogoriense-Bogor, maka jumlah jenis lamun di
Indonesia adalah 14 jenis (Kiswara dan Winardi 1994).
2.2.3. Pola distribusi
Ekosistem lamun di Indonesia sering dijumpai di daerah pasang surut
bawah (inner intertidal) dan subtidal atas (upper subtidal). Pola distribusi lamun secara horizontal menunjukkan lamun terletak antara dua ekosistem penting yaitu
mangrove dan karang. Ekosistem lamun membentuk interaksi dengan kedua
ekosistem tersebut diantaranya sebagai mata rantai dan penyangga. Interaksi
ketiga ekosistem ini antaranya adalah interaksi fisik, nutrien dan zat organik, zat
8
Berdasarkan pasang surut dan kedalaman, sebaran lamun secara vertikal
dapat dikelompokkan menjadi 3 kategori, yaitu (Kiswara 1997) :
1. Jenis lamun yang tumbuh di daerah dangkal dan terbuka saat air surut yang
mencapai kedalaman kurang dari 1m saat surut terendah. Contoh : Halodule pinifola, Halodule uninervis, Halophila minor/ovate, Halophila ovalis, Thalassia hemprichii, Cymodocea rotundata, Cymodocea serrulata, Syringodium isotifolium dan Enhalus acoroides.
2. Jenis lamun yang tumbuh di kedalaman sedang atau daerah pasang surut
dengan kedalaman berkisar antara 1-5 m. Contoh : Halodule uninervis, Halophila ovalis, Thalassia hemprichii, Cymodocea rotundata, Cymodocea serrulata, Syringodium isotifolium dan Enhalus acoroides, Thalassodendron ciliatum.
3. Jenis lamun yang tumbuh di perairan dalam dengan kedalaman mulai 5-35 m.
Contoh : Halophila ovalis, Halophila decipiens, Halophila spinulosa, Thalassia hemprichii, Syringodium isotifolium, Thalassodendron ciliatum.
Ekosistem lamun dapat berupa vegetasi tunggal yang tersusun atas satu
jenis lamun dengan membentuk padang lebat, sedangkan vegetasi campuran
terdiri dari 2 sampai 12 jenis lamun yang tumbuh bersama-sama di satu substrat.
Spesies lamun yang biasanya tumbuh dengan vegetasi tunggal adalah Thalassia hemprichii, Enhalus acoroides, Halophila ovalis, Halodule uninervis, Cymodocea serrulata, Thalassodendron ciliatum. Padang lamun di perairan tropis seperti Indonesia lebih dominan dengan koloni beberapa jenis (mix species). Penyebaran lamun memang sangat bervariasi tergantung pada topografi pantai dan pola
2.2.4. Manfaat dan peran ekosistem lamun
Ekosistem padang lamun merupakan merupakan salah satu ekosistem
bahari yang produktif. Padang lamun secara ekologis memiliki beberapa fungsi
penting bagi wilayah pesisir dan laut, yaitu :
1. Lamun sebagai habitat biota
Lamun berperan sebagai tempat berlindung, mencari makan, tumbuh besar,
dan memijah bagi beberapa jenis biota laut. Beberapa organisme hanya
menghabiskan sebagian dari siklus hidupnya di padang lamun diantaranya
adalah ikan dan udang. Lamun juga dapat menjadi sumber makanan bagi
avertebrata seperti bulu babi, beberapa jenis ikan Famili Scaridae dan
Acanthuridae, serta oleh berbagai jenis biota lain seperti penyu dan duyung
(Azkab 2006).
2. Lamun sebagai perangkap sedimen
Lamun dapat mengikat sedimen dan menstabilkan subtrat lunak dengan
perakaran yang padat dan saling menyilang. Daun lamun yang lebat akan
memperlambat aliran air yang disebabkan oleh arus dan ombak sehingga
perairan menjadi tenang (Bengen 2001).
3. Lamun memegang peranan yang berarti dalam daur berbagai zat hara dan
elemen-elemen langka di lingkungan bahari (Azkab 2000).
4. Lamun berperan sebagai produsen primer
Lamun memfiksasi sejumlah karbon organik dan sebagian besar memasuki
rantai makanan, baik melalui pemangsaan langsung oleh herbivora maupun
melalui dekomposisi sebagai serasah. Lamun juga memberikan sumbangan
10
dapat meningkatkan kelimpahan fitoplankton yang berada di perairan
terumbu karang (Azkab 2006).
5. Lamun berfungsi sebagai pelindung bagi penghuni padang lamun dari
sengatan matahari (Azkab 2000).
6. Lamun berperan sebagai pemenuh kebutuhan manusia dan hewan. Lamun
berfungsi sebagai sumber makanan bagi hewan maupun manusia. Lamun
juga sudah digunakan dalam bahan baku pembuatan kertas dan atap rumah
(Azkab 2000).
7. Lamun dapat menjadi objek wisata bahari dan wisata pendidikan.
2.2.5. Degradasi
Ekosistem lamun merupakan sistem yang dinamis sehingga apabila
terdapat gangguan di ekosistem tersebut akan menurunkan keseimbangan
ekologisnya. Gangguan tersebut dapat berupa gangguan fisik seperti badai dan
pasang rendah yang membuka dan mengeringkan lamun. Gangguan biologi dapat
berasal dari biota pembuat lubang (udang, kepiting, dan beberapa jenis ikan) serta
hewan pemakan rumput (bulu babi, duyung, dan binatang lain). Kerusakan lamun
juga disebabkan oleh kegiatan manusia terutama di pulau-pulau yang menjadi
tempat wisata dan pemukiman. Faktor utama penyebab kerusakan ekosistem
lamun di kawasan TNKpS antara lain pencemaran, kegiatan pembangunan,
aktivitas keseharian di pulau-pulau pemukiman, kegiatan reklamasi dan
pengerukan pantai. Menurut keputusan Menteri Negara Lingkungan Hidup No.
200 tahun 2004, kondisi lamun dapat dilihat dari persentase penutupannya (baik ≥
2.3. Parameter Lingkungan 2.3.1. Kedalaman dan kecerahan
Kecerahan perairan menunjukkan kemampuan cahaya untuk menembus
lapisan air di kedalaman tertentu. Distribusi lamun berdasarkan kedalaman
cenderung dibatasi oleh kecerahan dan penurunan kejernihan air yang terkait
dengan disturbansi antropogenik (Kemp 2000). Penetrasi cahaya matahari penting
bagi tumbuhan lamun untuk melakukan fotosintesis. Lamun tidak membutuhkan
cahaya matahari yang besar untuk melakukan fotosintesis yaitu berkisar antara
10-37 % dari irradiansi permukaan (Zimmerman 2006)
2.3.2. Suhu
Suhu merupakan faktor yang sangat penting bagi kehidupan organisme di
laut karena suhu mempengaruhi aktifitas metabolisme dan pertumbuhan
organisme tersebut. Suhu tahunan memainkan peranan penting dalam mengontrol
pertumbuhan lamun. Adaptasi termal dan toleransi termal berkontribusi besar
terhadap distribusi lamun global. Suhu pertumbuhan optimum bagi seluruh
spesies di dunia berkisar antara 11,5 °C dan 26 °C, sedangkan suhu optimal untuk
pertumbuhan lamun di daerah tropis atau subtropis berkisar antara 23 °C hingga
32 °C (Lee et al. 2007).
2.3.3. Salinitas
Salinitas atau kadar garam yaitu jumlah berat semua garam (dalam gram)
yang terlarut dalam satu liter air, biasanya dinyatakan dalam satuan ‰ (per mil).
Sebaran salinitas di laut dipengaruhi oleh beberapa faktor seperti pola sirkulasi
air, penguapan, curah hujan, dan aliran sungai (Nontji, 2007). Salinitas
12
halnya cahaya dan suhu air. Salinitas yang optimum untuk pertumbuhan lamun
berkisar antara 24-35 ‰ (Hilman et al. 1989 dalam Zulkifli 2003).
2.3.4. Oksigen terlarut (Dissolved Oxygen)
Lamun, seperti semua tanaman vaskular lainnya, membutuhkan
kelangsungan penyediaan oksigen untuk mempertahankan metabolisme aerobik.
Ketersediaan oksigen untuk mendukung metabolisme aerobik berasal dari
fotosintesis lamun itu sendiri, difusi kolom perairan, dan aliran massa sedimen.
Kandungan oksigen yang tidak tercukupi di dalam perairan dapat mempengaruhi
pertumbuhan lamun dan kelangsungan hidupnya (Borum et al. 2006). Menurut Keputusan Menteri Lingkungan Hidup No. 51 Tahun 2004, kandungan oksigen
terlarut untuk kepentingan biota laut adalah lebih besar dari 5 ppm.
2.3.5. Derajat keasaman (pH)
Derajat keasaman menyatakan intensitas keasaman atau kebasaan dari
suatu cairan yang mewakili konsentrasi ion hidrogennya. Berdasarkan keputusan
Menteri Negara Lingkungan Hidup No. 51 Tahun 2004, nilai pH di lokasi
penelitian masih layak untuk kehidupan biota laut, dimana pH baku mutu untuk
biota laut sekitar 7,0-8,5. Perubahan pH perairan laut biasanya sangat kecil. Hal
ini dipengaruhi oleh turbulensi massa air yang selalu menstabilkan kondisi
perairan.
2.4. Asosiasi Ikan dengan Padang Lamun
Peranan padang lamun terhadap keberadaan ikan terutama yang bernilai
ekonomis penting sudah sering dilaporkan. Hal ini terkait dengan kompleksitas
predator bagi ikan-ikan tersebut. Sistem yang kompleks dengan ditandai oleh
berbagai macam biota yang menjadi penghuninya sebagai penghuni tetap maupun
penghuni sementara. Spesies yang hidup sementara di lamun biasanya adalah
biota juvenil yang mencari makan serta perlindungan semasa masa kritis dalam
siklus hidup mereka atau hanya sebagai pengunjung yang datang untuk mencari
makan (Tomascik et al. 1997).
Ekosistem lamun memiliki distribusi yang luas di daerah pesisir tropis dan
juga merupakan salah satu habitat yang disukai sebagai tempat berlindung, ruang
hidup dan tempat mencari makan bagi beraneka ragam jenis biota laut termasuk
ikan, yaitu (Adrim 2006) :
1. Ekosistem lamun sebagai daerah asuhan dan perlindungan ikan. Padang
lamun dapat berperan sebagai daerah asuhan bagi ikan-ikan muda (juvenile).
Selain itu, ada pula ikan sebagian ikan yang menghabiskan sebagian masa
dewasanya di padang lamun. Padang lamun juga dapat memberikan
perlindungan bagi ikan-ikan yang berada di dalamnya dari ancaman predator.
2. Lamun sebagai makanan ikan. Terumbu karang yang berbatasan dengan
padang lamun selalu dipisahkan oleh daerah yang tidak bervegetasi. Hal ini
disebabkan oleh ikan herbivora yang hidup di sekitar lamun dan terumbu
karang mencari makan di sekitar lamun.
3. Ekosistem lamun sebagai ladang penggembalaan atau tempat mencari makan
(feeding ground). Beberapa ikan karnivora memanfaatkan padang lamun yang jauh di terumbu karang pada malam hari. Kelompok ikan-ikan yang
14
makan setelah sampai di padang lamun. Pada dini hari ikan-ikan tersebut
kembali ke terumbu karang menggunakan jalur yang sama.
Keanekaragaman jenis ikan yang hidup di padang lamun bergantung pada
ekosistem lain, seperti terumbu karang, mangrove, estuari, dan muara sungai di
sekitar ekosistem lamun (Adrim 2006). Berdasarkan karakteristik sumberdaya
ikan yang berasosiasi dengan ekosistem lamun, Tomascik et al. (1997) mengelompokkan karakteristik tersebut menjadi 7 kategori, yaitu :
1. Keanekaragaman dan kelimpahan ikan di ekosistem lamun lebih tinggi
daripada daerah yang berdekatan dengan substrat kosong.
2. Lamanya asosiasi ikan dan dengan ekosistem lamun berbeda setiap
jenis spesies ikan.
3. Sebagian besar asosiasi ikan dengan ekosistem lamun didapatkan dari
plankton.
4. Zooplankton dan crustacea epifauna merupakan makanan utama ikan
yang berasosiasi dengan lamun.
5. Perbedaan yang jelas (pembagian sumberdaya) pada komposisi spesies
terjadi sebagian besar di ekosistem lamun.
6. Hubungan yang kuat terjadi antara ekosistem lamun dengan habitat yang
berbatasan, kelimpahan relatif dan komposisi spesies ikan di ekosistem
lamun menjadi bergantung pada tipe terumbu karang, estuaria, dan
mangrove.
7. Kumpulan ikan dari ekosistem lamun yang berbeda sering kali berbeda
Berdasarkan cara hidup di ekosistem lamun, asosiasi antara ikan dengan
lamun terdiri dari empat kategori utama, yaitu (Tomascik et al. 1997): 1. Penghuni tetap dengan memijah dan menghabiskan sebagian besar
hidupnya ekosistem lamun (Contoh: Apogon margariloporous).
2. Menetap dengan menghabiskan seluruh hidupnya di ekosistem lamun dari
juvenile hingga dewasa, tetapi memijah di luar padang lamun (Contoh :
Halichoeres leparensis, Pranaesus duodecimalis, Paramia quinquilineata, Gerres macrosoma, Monachantus tomentosus, Monachantus hajam, Hemiglyphidodon plagyometopon, Syngnathoides biaculeatus). 3. Menetap hanya pada tahap juvenile (Contoh : Siganus canaliculatus,
Siganus virgatus, Siganus chrysospilos, Lethrinus spp., Scarus spp., Abudefduf spp., Monachanthus mylii, Mulloides samoensis, Pelates quadrilineatus, Upeneus tragula).
4. Menetap sewaktu-waktu atau singgah hanya mengunjungi padang lamun
3.2. Alat dan Bahan
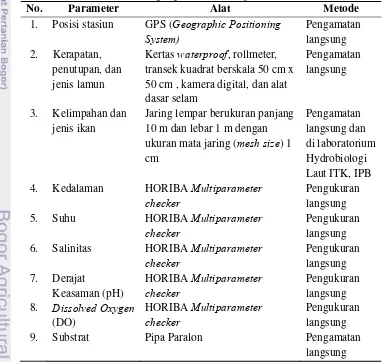
Alat yang digunakan dalam pengumpulan data primer pada penelitian ini antara lain (Lampiran 1); GPS (Geographic Positioning System), kertas
waterproof, rollmeter, transek berskala 50 cm x 50 cm , kamera digital, dan alat dasar selam. Alat yang digunakan untuk mengukur parameter fisika dan kimia perairan adalah HORIBA U-52 Multiparameter checker. Bahan yang digunakan dalam penelitian ini adalah buku identifikasi jenis lamun dan ikan, serta citra satelit IKONOS 2008 untuk kawasan Pulau Pramuka, Kepulauan Seribu. Alat dan bahan yang digunakan dapat dilihat secara lengkap pada Tabel 1.
Tabel 1. Alat dan bahan yang digunakan dalam penelitian
No. Parameter Alat Metode
1. Posisi stasiun GPS (Geographic Positioning System)
Kertas waterproof, rollmeter, transek kuadrat berskala 50 cm x 50 cm , kamera digital, dan alat dasar selam
Pengamatan langsung
3. Kelimpahan dan jenis ikan
Jaring lempar berukuran panjang 10 m dan lebar 1 m dengan 4. Kedalaman HORIBA Multiparameter
checker
Pengukuran langsung
5. Suhu HORIBA Multiparameter
checker
Pengukuran langsung 6. Salinitas HORIBA Multiparameter
checker
Pengukuran langsung 7. Derajat
Keasaman (pH)
HORIBA Multiparameter checker
Pengukuran langsung 8. Dissolved Oxygen
(DO)
HORIBA Multiparameter checker
Pengukuran langsung
9. Substrat Pipa Paralon Pengamatan
p dan software f
20
3.4. Analisis Data
3.4.1. Indeks Nilai Penting lamun
INP digunakan untuk mengukur peranan satu jenis di dalam suatu komunitas. INP berkisar antara 0-300 dimana INP memberikan gambaran mengenai suatu jenis tumbuhan terhadap suatu daerah. Semakin tinggi nilai INP, maka semakin tinggi peranan spesies tersebut. Rumus yang digunakan untuk menghitung Indeks Nilai Penting adalah sebagai berikut (Brower et al. 1977) :
INP = RFi + RDi + RCi... (1) Keterangan : INP = Indeks Nilai Penting
RFi = Frekuensi relatif
RDi = Kerapatan relatif
RCi = Penutupan relatif
Adapun rumus yang digunakan untuk membantu menghitung kerapatan, frekuesi dan penutupan relatif lamun adalah sebagai berikut :
a. Kerapatan jenis (Di) adalah jumlah individu (tegakan) per satuan luas. Kerapatan masing-masing pada setiap stasiun dihitung dengan menggunakan rumus (Brower et al. 1977) :
D
i=
A ... (2)Keterangan : Di = Jumlah individu (tegakan) ke-i per satuan luas Ni = Jumlah individu (tegakan) ke-i dalam transek kuadrat A = Luas transek kuadrat
RD
i=
∑ ... (3)Keterangan : RDi = Kerapatan relatif
Ni = Jumlah tegakan individu ke-i dalam transek kuadrat ∑ ij = Jumlah total individu seluruh jenis
c. Frekuensi jenis (F) adalah peluang suatu jenis ditemukan dalam titik contoh yang diamati. Frekuensi jenis dihitung dengan rumus :
F
i=
∑ ... (4)Keterangan : Fi = Frekuensi jenis ke-i
Pi = Jumlah petak contoh dimana ditemukan jenis i ∑ = Jumlah total petak contoh yang diamati
d. Frekuensi relatif (RFi) adalah perbandingan antara frekuensi jenis-i (Fi) dan jumlah frekuensi untuk seluruh jenis ∑ i :
RF
i=
∑ F ... (5)Keterangan : RFi = Frekuensi relatif Fi = Frekuensi jenis ke-i
∑ i = Jumlah frekuensi untuk seluruh jenis
e. Penutupan (Ci) adakah luas area yang tertutupi jenis-i
Ci ... (6)
Keterangan : Ci = Luas area yang tertutupi jenis ke-i ai = Luas total penutupan jenis ke-i
22
f. Penutupan relatif (RCi) adalah perbandingan antara individu jenis ke-i dengan
jumlah total penutupan seluruh jenis.
RC
i ∑ CC ... (7)Keterangan : RCi = Luas Penutupan relatif
Ci = Luas area yang tertutupi jenis ke-i ∑ ij = Penutupan seluruh jenis
3.4.2. Analisis Struktur komunitas lamun dan ikan 1. Indeks Keanekaragaman Shannon-Wiener
Indeks keragaman digunakan untuk mengukur kelimpahan komunitas berdasarkan jumlah jenis spesies dan jumlah individu dari setiap spesies di suatu lokasi. Rumus indeks keanekaragaman Shannon sebagai berikut (Odum 1971) :
′ ∑ i ln pi ... (8)
Keterangan : H’ = Indeks Keanekaragaman Shannon-Wiener
pi = Perbandingan antara jumlah individu ikan ke-i dengan jumlah seluruh jenis ikan
2. Indeks Keseragaman
Indeks ini digunakan untuk mengetahui seberapa besar kesamaan penyebaran jumlah individu setiap jenis, yaitu dengan membandingkan indeks
keanekaragaman dengan nilai maksimumnya. Indeks keseragaman ditentukan berdasarkan rumus berikut (Odum 1971):
Keterangan : E = Indeks keseragaman
H’ = Indeks keanekaragaman
H’ Max = Indeks keanekaragaman maksimum (ln s) S = Jumlah total spesies
3. Index Dominansi Simpson
Indeks ini digunakan untuk menggambakan jenis yang paling banyak ditemukan dapat diketahui dengan menghitung nilai dominansinya. Indeks dominansi dapat dirumuskan sebagai berikut (Odum 1971):
D ∑
... (10)Keterangan : D = Indeks dominansi
Ni = Jumlah individu jenis ke-i
N = Jumlah total individu seluruh jenis
3.4.3. Analisis faktorial koresponden (Correspondence analysis)
Analisis faktorial koresponden merupakan suatu analisis yang dapat mendeskripsikan berbagai tipe data yang berbeda. Tujuan utama penggunaan analisis faktorial koresponden umumnya adalah untuk mencari hubungan yang erat antara modalitas dari dua karakter, variabel, dan matriks data kontingensi. Selain itu, analisis ini dapat mencari kemiripan antara individu berdasarkan konfigurasi datanya. Perhitungan analisis faktorial koresponden pada penelitian ini dibantu dengan menggunakan software STATISTICA v.8.
3.4.4. Korelasi Pearson
24
penelitian ini peubah X merupakan peubah independen yang terdiri dari beberapa parameter komunitas lamun (kerapatan, penutupan, jumlah jenis, dan
keanekaragaman lamun). Peubah Y merupakan peubah dependen yang terdiri dari parameter komunitas ikan (kelimpahan dan keanekaragaman). Metode untuk mengukur korelasi linear antara dua peubah yang paling banyak digunakan adalah koefisien korelasi momen-hasil kali Pearson atau korelasi Pearson. Adapun rumus korelasi Pearson sebagai berikut :
∑ ∑ ∑
∑ ∑ ∑ ∑ ... (11)
Hubungan linear sempurna terjadi antara nilai-nilai X dan Y bila nilai r = +1 atau -1. Bila nilai r mendekati nilai tersebut maka terdapat korelasi yang tinggi antara kedua variabel, sedangkan bila nilai r mendekati nol maka hubungan linear antara nilai X dan Y sangat lemah atau tidak ada sama sekali. Nilai R memperlihatkan koefisien determinasi contoh yang menjelaskan bilangan yang menyatakan proporsi keragaman total nilai-nilai peubah Y yang dapat dijelaskan oleh nilai-nilai peubah X melalui hubungan linear (Walpole 1993).
Uji signifikansi koefisien korelasi digunakan untuk menunjukkan seberapa jauh pengaruh suatu variabel independen secara individual dalam menerangkan variasi variabel dependen. Pada penelitian ini digunakan nilai signifikansi sebesar 0,10 dan 0,05.
1. Hipotesis : H0 : Tidak ada hubungan signifikan antara X dan Y H1 : Ada hubungan signifikan antara X dan Y
2. Hipotesis : H0 : Tidak ada hubungan signifikan antara X dan Y
H1 : Ada hubungan signifikan antara X dan Y
26
4. HASIL DAN PEMBAHASAN
4.1. Karakteristik Fisik dan Kimia Perairan
Kondisi lingkungan perairan mempengaruhi segala bentuk kehidupan yang
ada di dalamnya, baik secara langsung maupun tidak langsung. Berdasarkan hasil
analisis parameter fisika kimia perairan yang dapat dilihat pada Tabel 2, kondisi
perairan Pulau Pramuka secara umum masih dalam keadaan baik untuk
menunjang kehidupan lamun dan ikan. Hal ini mengacu pada hasil pengukuran
beberapa parameter yang masih berada dalam kisaran optimum untuk
pertumbuhan lamun.
Tabel 2. Hasil analisis parameter fisik dan kimia perairan di Pulau Pramuka
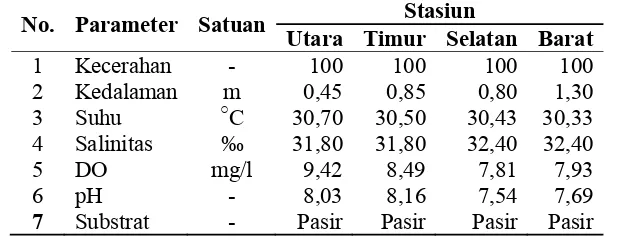
No. Parameter Satuan Stasiun
Utara Timur Selatan Barat
1 Kecerahan - 100 100 100 100
2 Kedalaman m 0,45 0,85 0,80 1,30
3 Suhu ○C 30,70 30,50 30,43 30,33
4 Salinitas ‰ 31,80 31,80 32,40 32,40
5 DO mg/l 9,42 8,49 7,81 7,93
6 pH - 8,03 8,16 7,54 7,69
7 Substrat - Pasir Pasir Pasir Pasir
Parameter kecerahan yang diamati di setiap stasiun di Pulau Pramuka
menunjukkan nilai 100%, yang berarti bahwa penyinaran cahaya matahari
mencapai dasar perairan. Kedalaman perairan di setiap stasiun pengamatan
berkisar antara 0,45-1,30 m. Kecerahan dan kedalaman merupakan parameter
yang saling terkait satu sama lain. Kedalaman merupakan salah satu faktor yang
memengaruhi penetrasi cahaya matahari ke dalam perairan. Kecerahan sangat
penting bagi lamun karena erat kaitannya dengan proses fotosintesis yang
Menurut Lee et al. (2007) kisaran suhu optimal untuk pertumbuhan lamun di daerah tropis berkisar antara 23-32 ○C . Hasil pengukuran suhu air di perairan
Pulau Pramuka berada pada kisaran 30 ○C yang berarti perairan Pulau Pramuka
dapat menunjang pertumbuhan lamun dengan baik. Nilai salinitas yang terukur di
lokasi pengamatan berkisar antara 31-32 ‰. Nilai salinitas yang terukur masih
berada dalam kisaran optimum pertumbuhan lamun, yaitu sebesar 24-35 ‰
(Hilman et al. 1989 dalam Zulkifli 2003).
Kandungan oksigen terlarut (DO) di suatu perairan sangat terkait dengan
proses fotosintesis dan metabolisme sumberdaya lamun serta biota yang hidup di
sekitar padang lamun. Hasil pengukuran DO di stasiun pengamatan berkisar
antara 7,81-9,42 mg/l. Parameter DO di lokasi penelitian dapat memenuhi kriteria
yang baik bagi biota laut, yaitu > 5 mg/l (KLH No. 51 / 2004).
Nilai pH di stasiun pengamatan berkisar antara 7,5-8,1. Nilai pH yang
diperoleh menunjukkan bahwa pH cenderung basa dan termasuk dalam kisaran
optimum untuk pertumbuhan lamun, yaitu 7,0-8,5 (KLH No.51 / 2004). Lamun
dapat ditemukan di beragam tipe substrat, mulai dari berlumpur, berpasir, hingga
substrat yang bercampur pecahan karang mati. Tipe substrat yang ditemukan di
keempat stasiun pengamatan adalah pasir.
4.2. Struktur Komunitas Lamun
4.2.1. Komposisi jenis lamun
Berdasarkan hasil pengamatan ditemukan enam (6) jenis lamun yang
tersebar di empat (4) stasiun pengamatan. Komunitas lamun tersebut membentuk
vegetasi campuran di setiap stasiun. Jenis lamun yang ditemukan di perairan
28
uninervis, Halophila ovalis, Thalassia hemprichii, dan Syringodium isoetifolium. Jenis lamun yang tumbuh di perairan Pulau Pramuka termasuk ke dalam 12 jenis
lamun yang ditemukan di seluruh perairan Indonesia (Kiswara dan Winardi 1994).
Jenis lamun Thalassia hemprichii selalu ditemui di empat stasiun pengamatan karena biasanya sebaran Thalassia hemprichii mendominasi padang lamun dan sering dijumpai di substrat berpasir (Takadengan dan Azkab 2010).
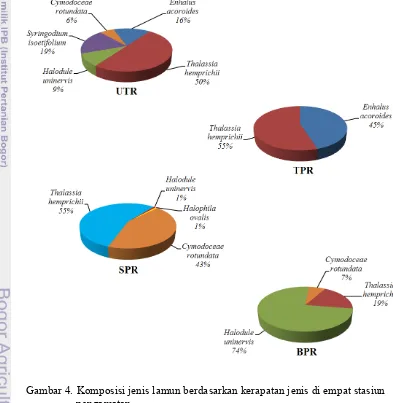
Gambar 4. Komposisi jenis lamun berdasarkan kerapatan jenis di empat stasiun pengamatan
Utara
Timur
Selatan
Hasil pengamatan yang dilakukan di empat stasiun menunjukkan bahwa
terdapat perbedaan komposisi jenis lamun dari setiap stasiun seperti yang terlihat
pada Gambar 4. Perbedaan komposisi jenis lamun ini dapat dipengaruhi aktifitas
manusia atau penduduk yang berada di sekitar lokasi penelitian (Kiswara dan
Winardi 1994). Di Stasiun Utara jenis lamun yang ditemukan lebih beragam
dibandingkan dengan ketiga stasiun lainnya. Hal ini mungkin dipengaruhi oleh
aktivitas masyarakat, seperti pembuangan limbah rumah tangga dan kegiatan
wisata yang lebih sedikit, sehingga tidak banyak gangguan terhadap lingkungan.
Kekayaan jenis lamun yang paling sedikit ditemukan di Stasiun Timur yang
kondisi perairannya tercemar limbah rumah tangga. Hal tersebut ditandai oleh
banyaknya pemukiman penduduk di sebelah timur Pulau Pramuka serta
keberadaan tempat pembuangan sampah akhir.
4.2.2. Indeks ekologi komunitas lamun
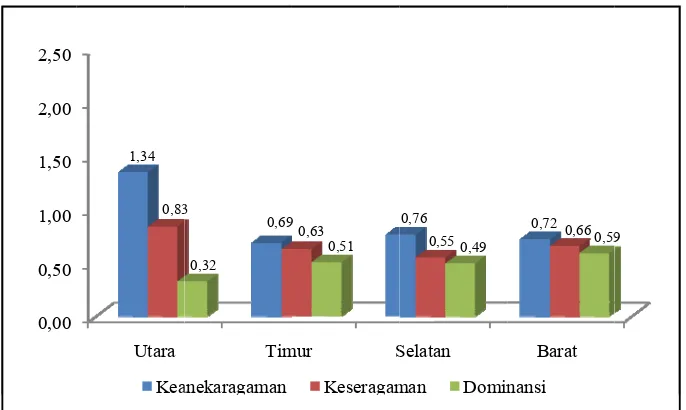
Hasil perhitungan indeks ekologi komunitas lamun di Pulau Pramuka
dapat dilihat pada Gambar 5. Indeks keanekaragaman menunjukkan bahwa di
Stasiun Utara Pulau Pramuka memiliki nilai tertinggi (1,34), sedangkan stasiun
timur memiliki nilai terendah (0,69). Indeks keseragaman tertinggi ditemukan di
Stasiun Utara dengan nilai 0,83, sedangkan indeks keseragaman terendah ada di
Stasiun Selatan dengan nilai 0,55. Nilai indeks keseragaman ≥ 0,5 termasuk
relatif tinggi yang menunjukkan bahwa tidak adanya jenis lamun tertentu yang
mendominasi di lokasi tersebut. Secara umum, nilai indeks keanekaragaman dan
keseragaman dari keempat stasiun pengamatan lebih tinggi dibandingkan nilai
indeks dominansinya yang menunjukkan bahwa komunitas lamun di Pulau
luas sebarannya. Jenis ini ditemukan hampir di seluruh perairan Indonesia ,
seringkali mendominasi vegetasi campuran dengan sebaran vertikal hampir
mencapai 25 m serta dapat tumbuh di berbagai macam tipe substrat (Takadengan
dan Azkab 2010).
4.3.1. Kerapatan jenis lamun
Kerapatan jenis lamun dipengaruhi oleh faktor-faktor tempatnya tumbuh,
yaitu kedalaman, kecerahan air, dan tipe substrat (Kiswara 1997). Berdasarkan
hasil pengamatan dapat diketahui bahwa kerapatan jenis lamun berbeda untuk
setiap stasiun pengamatan seperti yang terlihat pada Tabel 4.
Tabel 4. Kerapatan jenis lamun
No. Jenis Lamun Kerapatan Jenis (ind/m
2
) Utara Timur Selatan Barat 1 Cymodocea rotundata 7 0 57 7 2 Enhalus acoroides 18 18 0 0 3 Halodule uninervis 11 0 1 0
4 Halophila ovalis 0 0 1 0
5 Thalassia hemprichii 58 22 73 20 6 Syringodium isoetifolium 22 0 0 77
TOTAL 116 40 132 104
Kerapatan jenis lamun tertinggi terdapat di Stasiun Selatan yang mencapai
132 ind/ m2, sedangkan terendah terdapat di Stasiun Timur sebesar 40 ind/m2.
Kerapatan jenis lamun di Stasiun Utara dan Barat masing-masing sebesar 116
ind/m2 dan 104 ind/m2. Perbedaan kerapatan jenis lamun setiap stasiun ini
disebabkan oleh perbedaan kondisi kualitas di setiap stasiun pengamatan. Di
Stasiun Timur dan Barat, aktivitas masyarakat seperti penangkapan ikan, wisata
32
di Stasiun Utara dan Selatan cenderung lebih sedikit sehingga kerapatan jenis
lamunnya lebuh tinggi.
Selain ditentukan oleh faktor-faktor lingkungan, kerapatan jenis lamun per
satuan luas juga dipengaruhi oleh jenisnya (Kiswara 1997). Hal ini disebabkan
adanya perbedaan bentuk morfologi dan ukuran daun lamun tersebut.
Berdasarkan hasil pengamatan, Thalassia hemprichii memiliki daun pita
berukuran sedang memiliki kerapatan tertinggi di setiap stasiun pengamatan
(20-73 ind/ m2). Hal ini juga didukung dengan karakteristik lamun tersebut yang
mampu hidup di berbagai macam tipe substrat dan umumnya dominan di substrat
yang berdasar pasir ataupun puing karang mati (Kiswara 1992).
4.3.2. Penutupan jenis lamun
Penutupan lamun menggambarkan seberapa luas vegetasi lamun menutupi
dasar perairan dan umumnya dinyatakan dalam persen. Nilai penutupan tidak
hanya bergantung pada kerapatan jenis lamun, namun dipengaruhi juga oleh
morfologi jenis lamun tersebut. Nilai penutupan lamun dari tiap stasiun
pengamatan di Pulau Pramuka dapat dilihat pada Tabel 5.
Tabel 5. Persentase penutupan jenis lamun
No. Jenis Lamun Penutupan Jenis (%)
x
Utara Timur Selatan Barat
1 Cymodocea rotundata 3,75 0 30,04 1,63 8,86
2 Enhalus acoroides 10,15 20,34 0 0 7,62
3 Halodule uninervis 6,62 0 0,38 0 1,75
4 Halophila ovalis 0 0 0,19 0 0,05
5 Thalassia hemprichii 23,12 12,29 37,31 1,95 18,66
6 Syringodium isoetifolium 2,65 0 0 17,01 4,92
TOTAL 46,29 32,63 67,92 20,59 41,86
Penutupan lamun tertinggi terdapat di Stasiun Selatan, sedangkan terkecil
tinggi karena merupakan jenis yang umum ditemui dan tersebar luas di seluruh
perairan Indonesia, termasuk di Pulau Pramuka serta kemampuan tumbuhnya di
berbagai macam tipe substrat seperti pasir berlumpur, pasir berukuran sedang dan
kasar, hingga pecahan karang mati (Takadengan dan Azkab 2010). Lamun
Halophila ovalis memiliki penutupan terendah (0,19%) dan nilai kerapatannya juga sangat kecil (1 ind/m2) karena memiliki morfologi daun yang jauh lebih kecil
(panjang 5,6-21,0 mm; daun 4,1-10,1 mm) bila dibandingkan dengan Thalassia hemprichii (panjang 36-250 mm; lebar 1,7- 17mm) (Kiswara 1992).
Menurut Keputusan Menteri Lingkungan Hidup No. 200 Tahun 2004,
berdasarkan persentase penutupannya, kondisi lamun di perairan Pulau Pramuka
termasuk dalam kriteria kurang baik (41,86%). Hal ini dipengaruhi oleh tekanan
lingkungan yang tinggi akibat aktivitas manusia di lingkungan tersebut.
Pencemaran limbah rumah tangga, kegiatan wisata yang kurang ramah
lingkungan, dan penangkapan ikan menggunakan racun serta bom sempat menjadi
hal yang kerap terjadi di Pulau Pramuka (Rachman 2007).
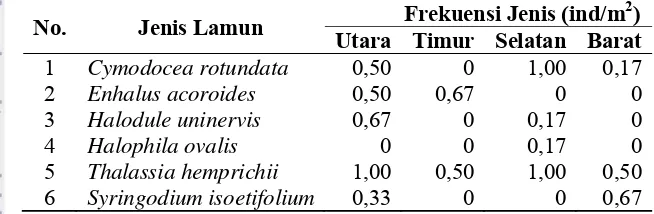
4.3.3. Frekuensi jenis lamun
Frekuensi jenis lamun menggambarkan peluang ditemukannya suatu jenis
lamun tertentu dalam petak contoh yang diamati. Hasil pengamatan frekuensi
jenis lamun di setiap stasiun pengamatan dapat dilihat pada Tabel 6.
Tabel 6. Frekuensi jenis lamun
No. Jenis Lamun Frekuensi Jenis (ind/m
2
34
Frekuensi kehadiran jenis tertinggi di Stasiun Utara dimiliki oleh
Thalassia hemprichii dengan nilai 1 ind/m2, sedangkan terendah dimiliki oleh
Syringodium isoetifolium dengan nilai 0,33 ind/m2. Frekuensi jenis tertinggi di Timur dimiliki oleh Enhalus acoroides dengan nilai 0,67 ind/m2, sedangkan terendah dimiliki oleh Thalassia hemprichii dengan nilai 0,50 ind/m2. Stasiun Selatan, frekuensi jenis tertinggi dimiliki oleh Thalassia hemprichii dengan nilai 1 ind/m2, sedangkan terendah dimiliki oleh Halodule uninervis dan Halophila ovalis dengan nilai yang sama, yaitu 0,17 ind/m2. Sementara itu, di Stasiun Barat, frekuensi jenis tertinggi dimiliki oleh Syringodium isoetifolium dengan nilai 0,67 ind/m2, sedangkan terendah dimiliki oleh Cymodocea rotundata dengan nilai 0,17 ind/m2.
Secara keseluruhan, Thalassia hemprichii merupakan jenis yang memiliki frekuensi kehadiran relatif tinggi di setiap stasiun pengamatan. Ini berarti bahwa
jenis tersebut sering ditemukan dalam setiap unit pengamatan. Sebaliknya,
frekuensi kehadiran terendah dimiliki oleh Halodule uninervis dan Halophila ovalis (0,17-0,67), yang berarti jenis ini jarang ditemukan dalam setiap unit pengamatan.
4.4. Struktur Komunitas Ikan
4.4.1. Komposisi jenis ikan
Kelimpahan ikan terbesar terdapat di Stasiun Selatan sebesar 116 ind/m2
dengan 8 jenis ikan, diikuti oleh Stasiun Utara sebesar 104 ind/m2 dengan 7 jenis
ikan. Kelimpahan ikan di Stasiun Barat adalah sebesar 30 ind/m2, sedangkan
Stasiun Timur memiliki kelimpahan ikan yang terkecil yaitu sebesar 14 ind/m2.
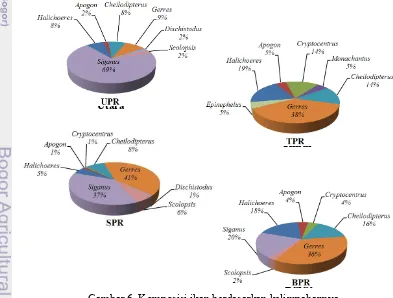
Jenis ikan yang paling umum ditemukan di Utara adalah, Siganus sp. dari Famili Siganidae sedangkan di ketiga stasiun lainnya Gerres sp. dari Famili Leiognathidae merupakan jenis yang umum ditemukan. Berdasarkan hasil
pengamatan, Siganus sp. merupakan jenis ikan yang paling banyak ditemukan di perairan Pulau Pramuka. Tingginya komposisi jenis Siganus sp. karena ikan tersebut memiliki kebiasaan hidup bergerombol di daerah padang lamun (Rappe
2010).
Jumlah spesies ikan yang ditemukan pada setiap stasiun pengamatan
berbeda-beda. Perbedaan ini disebabkan oleh kondisi lingkungan yang berbeda
pula. Keanekaragaman jenis ikan di ekosistem lamun juga bergantung pada
kehadiran ekosistem lain di sekitar ekosistem lamun seperti terumbu karang,
mangrove, muara sungai, dan estuaria (Adrim 2006).
Gambar 6. Komposisi ikan berdasarkan kelimpahannya Timur Utara
Selatan
38
sumbu yang berkoresponden memberikan sebagian informasi yang terkandung
dalam kumpulan data (Lebart et al. 1984).
Ordinasi merupakan peta dua atau tiga dimensi yang menggambarkan
kemiripan komunitas secara biologis. Ordinasi bukanlah menunjukkan lokasi
geografis dari sampel tersebut, melainkan mencerminkan pengelompokan karena
sampel tersebut memiliki kemiripan (Soedibjo 2008). Berdasarkan Gambar 7,
terlihat ada dua bentuk ordinasi yang menunjukkan sebaran stasiun pengamatan
dan genus ikan. Ordinasi stasiun pengamatan menggambarkan sebaran stasiun
berdasarkan kesamaan karakteristiknya. Ordinasi genera menggambarkan sebaran
genera terhadap stasiun pengamatan berdasarkan kelimpahannya. Penggabungan
kedua ordinasi ini dapat menggambarkan hubungan genera dengan karakteristik
stasiun pengamatan (Gotelli dan Ellison 2004).
Gambar 8 terlihat Stasiun Timur berada cukup jauh dengan stasiun dan
genera lainnya. Hal ini mungkin disebabkan oleh karakteristik stasiun tersebut
yang memiliki kerapatan (40 ind/m2) dan penutupan lamun (32,63%) terendah
dibandingkan stasiun lainnya sehingga mengakibatkan kelimpahan ikan yang
rendah pula. Menurut Heminga dan Duarte (2000), kelimpahan dan
keanekaragaman ikan akan lebih tinggi di daerah yang bervegetasi dibandingkan
dengan yang tidak, karena daerah tersebut dapat menyediakan makanan dan
perlindungan dari predator.
Genera Monachantus dan Epinephelus membentuk kelompok terpisah dari genera lainnya karena kelimpahan genera tersebut sangat kecil (1 ekor) dan
hanya ditemukan di Stasiun Timur. Stasiun Timur merupakan stasiun
Menurut Allen et al. (2004), genera Monachantus dan Epinephelus termasuk kedalam ikan terumbu. Keberadaan genera tersebut di ekosistem padang lamun
Stasiun Timur menunjukkan bahwa kelimpahan dan keanekaragaman ikan di
padang lamun bergantung pula pada keberadaan ekosistem lain yang berada di
dekatnya (Gillanders 2006). Mengingat besarnya peranan ekosistem padang
lamun terhadap kelimpahan dan keanekaragaman ikan, analisis hubungan
keduanya perlu dilakukan lebih mendalam.
4.6. Hubungan Karakteristik Lamun dengan Kelimpahan dan Keanekaragaman Ikan
Hubungan ekologis lamun dengan kelimpahan dan keanekaragaman ikan
dapat digambarkan dengan menggunakan analisis koefisien korelasi pearson.
Hasil analisis ini dapat menunjukkan keeratan hubungan antara sumberdaya
lamun dengan ikan. Parameter lamun yang digunakan adalah kerapatan jenis,
persen penutupan, jumlah jenis, keanekaragaman jenis lamun, sedangkan
parameter komunitas ikan yang digunakan adalah kelimpahan dan
keanekaragaman ikan.
Tabel 7. Hasil analisis koefisien korelasi parameter lamun dan ikan
No. Parameter r R p
Lamun (X) Ikan (Y)
1 Kerapatan
Kelimpahan
0,83 0,69 0,17
2 Persentase penutupan 0,90 0,81 *0,10
3 Keanekaragaman jenis 0,57 0,32 0,43
4 Jumlah jenis 0,87 0,76 0,13
5 Kerapatan
Keanekaragaman
-0,64 0,41 0,34
6 Persentase penutupan -0,68 0,46 0,32
7 Keanekaragaman jenis 0,85 0,72 0,15
8 Jumlah jenis -0,95 0,90 **0,05
Ket : Koefisien korelasi (r); * p < 0,10 ** p < 0,05 Koefisien Determinasi contoh (R);
40
Berdasarkan hasil analisis pada Tabel 7, beberapa parameter lamun tidak
menunjukkan korelasi yang signifikan dengan kelimpahan ikan, kerapatan (r = 0,83), keanekaragaman jenis (r = 0,57), dan jumlah jenis (r = 0,87). Persentase penutupan lamun dan kelimpahan ikan menunjukkan hasil korelasi yang
signifikan (r = 0,90, p < 0,10). Hasil analisis kedua variabel ini menunjukkan nilai R sebesar 0,81 yang bermakna 81% di antara keragaman dalam nilai-nilai kelimpahan ikan dapat dijelaskan oleh hubungan linearnya dengan penutupan
lamun. Padang lamun dengan kerapatan tinggi menyediakan perlindungan bagi
ikan dari serangan predator. Selain itu, kerapatan lamun yang tinggi tentunya
meningkatkan luas permukaan atau penutupan lamun bagi pelekatan hewan
maupun tumbuhan renik yang merupakan makanan utama bagi ikan di padang
lamun (Hemminga dan Duarte 2000).
Hasil analisis parameter lamun dengan variabel keanekaragaman ikan juga
menunjukkan beberapa korelasi yang tidak signifikan, kerapatan (r = - 0,64), persentase penutupan (r = - 0,68), dan keanekaragaman jenis (r = 0,85). Jumlah jenis lamun dan keanekaragaman ikan menunjukkan hasil korelasi yang signifikan
(r = 0,95 , p < 0,05). Hasil analisis korelasi kedua variabel ini menunjukkan nilai R sebesar 0,90 yang bermakna 90% di antara keragaman dalam nilai-nilai keanekaragaman ikan dapat dijelaskan oleh hubungan linearnya dengan jumlah
jenis lamun. Menurut Gillanders (2006), beberapa jenis ikan dapat membentuk
asosiasi dengan jenis lamun yang berbeda di padang lamun pada fase tertentu
dalam hidupnya. Banyaknya jumlah jenis lamun dapat memperkaya bentuk
asosiasi ikan di padang lamun dan tentunya dapat memenuhi kebutuhan
41
5.1. Kesimpulan
Kondisi kualitas perairan Pulau Pramuka secara umum masih dalam keadaan baik untuk menunjang kehidupan sumberdaya lamun dan ikan.
Berdasarkan hasil analisis, ditemukan 6 jenis lamun dan 10 jenis ikan di perairan ekosistem lamun Pulau Pramuka yang berada dalam kondisi stabil. Kelimpahan dan keanekaragaman ikan di ekosistem lamun Pulau Pramuka dipengaruhi oleh kondisi ekosistem lamun itu sendiri, terutama persentase penutupan dan jumlah jenis lamunnya. Tingginya penutupan lamun dapat meningkatkan lahan pelekatan hewan renik yang merupakan makanan utama bagi ikan dan tentunya
meningkatkan kelimpahan ikan di daerah tersebut. Jumlah jenis lamun dapat memperkaya bentuk asosiasi ikan di padang lamun dan tentunya meningkatkan keanekaragaman jenis ikan.
5.2. Saran
42
DAFTAR PUSTAKA
Adrim, M. 2006. Asosiasi ikan di padang lamun. Oseana. Volume 31(4) : 1-7. Allen, G., R. Steene, P. Humann, N. Deloach. 2003. Reef fish
identification-Tropical Pacific. New World Publication, Inc. Florida, USA.
Arbi, U. Y. 2011. Struktur komunitas moluska di padang lamun perairan Pulau Talise , Sulawesi Utara. Oseanologi dan Limnologi di Indonesia. Volume 37(1) : 71-89
Azkab, M. H. 2000. Produktifitas di lamun. Oseana.Volume 25(1) : 1-11. Azkab, M. H. 2006. Ada apa dengan lamun. Oseana. Volume 31(3) : 45-55. BTNKpS (Balai Taman Nasional Kepulauan Seribu). 2008. Taman Nasional Laut
Kepulauan Seribu. Jakarta.
Bengen, D. G. 2001. Ekosistem dan sumberdaya alam pesisir dan laut. Sinopsis. Pusat Kajian Sumberdaya Alam dan pesisir Lautan, Institut Pertanian Bogor. Bogor.
Borum, J., K. Sand-Jensen, T. Binzer, O. Pedersen, and T. M. Greve. 2006. Oxygen movement in seagrasses. Hal. 255-270. In Larkum, A. W. D., Robert J.O., C. M. Duarte (Ed.), Seagrasses : biology, ecology, and conservation. Springer. Dordrecht, Netherlands.
Brower, J. E., J. H. Zar. 1977. Fields and laboratory methods for general ecology. Wn. C. Brown Publs, Dubuque, USA.
Den Hartog, C. 1970. The seagrasses of the world. North-Holland. Amsterdam DKP (Departemen Kelautan dan Perikanan). 2008. Pedoman umum identifikasi
dan monitoring lamun. Jakarta.
Fahmi dan M. Adrim. 2009. Diversitas ikan pada komunitas padang lamun di perairan pesisir Kepulauan Riau. Oseanologi dan Limnologi di Indonesia. Volume 35(1) : 75-90.
Gillanders, B. M. 2006. Seagrasses, fish, and fisheries. Hal. 503-536. In Larkum, A. W. D., Robert J.O., C. M. Duarte (Ed.), Seagrasses : biology, ecology, and conservation. Springer. Dordrecht, Netherlands.
Gotelli, N. J., A. M. Ellison. 2004. A primer of ecological statistics. Sinauer Associates, Inc. Massachusetts, USA.
Kemp, W. M. 2000. Seagrass ecology and management : an introduction. Hal. 1-6. In Bortone S. A. (Ed.), Seagrass : Monitoring, ecology, physiology, and management. CRC Press. Washingtong, D. C. USA.
Kiswara, W. 1992. Vegetasi lamun (Seagrass) di rataan terumbu Pulau Pari, Pulau-Pulau Seribu, Jakarta. Hal. 31-49. Prosiding Seminar Ilmiah Nasional di Universitas Gadjah Mada, Yogyakarta. Lembaga Ilmu Pengetahuan Indonesia-Universitas Gadjah Mada. Yogyakarta, Indonesia. Oseanologi dan Limnologi di Indonesia. Volume 25(2) : 31-49
Kiswara, W. dan Winardi. 1994. Keanekaragaman dan sebaran lamun di Teluk Kuta dan Teluk Gerupuk, Lombok Selatan. Indonesian Institute of Science. Volume 31(7) : 15-33.
Kiswara, W. 1997. Struktur komunitas padang lamun perairan Indonesia, Hal. 53-61. Prosiding Kongres Biologi XV, 1997, Universitas Indonesia, Jakarta. Lembaga Ilmu Pengetahuan Indonesia-Universitas Indonesia. Jakarta, Indonesia.
Kiswara, W. dan M. H. Azkab. 2000. Spesimen Lamun (Seagrass) yang
Tersimpan di Dalam Koleksi Referensi Puslitbang Oseanologi-LIPI, Jakarta. h. 17-33. In H.M. Karim Moosa (Ed.), Katalog koleksi biota laut Puslitbang Oseanologi-LIPI, Jilid 3. Lembaga Ilmu Pengetahuan Indonesia, Jakarta. Lebart, L, A. Morineau, K. M. Warwick. 1984. Multivariate descriptive statistical
analysis. John Wiley & Sons. New York, USA.
Lee, K.-S., S.R. Park, dan Y. K. Kim. 2007. Effects of irradiance, temperature, and nutrients on growth dynamics of seagrasses: A review. Journal of Experimental Marine Biology and Ecology. Volume 350(3) : 144-175. Manik, N. 2011. Struktur komunitas ikan di padang lamun Kecamatan Wori,
Sulawesi Utara. Osenaologi dan Limnologi di Indonesia.Volume 37(1) : 29-41
Menteri Negara Lingkungan Hidup. 2004. Baku mutu air laut untuk biota laut. Keputusan Menteri Lingkungan Hidup No. 51 tahun 2004.
Menteri Negara Lingkungan Hidup. 2004. Kriteria baku kerusakan dan pedoman penentuan status padang lamun. Keputusan Menteri Lingkungan Hidup Nomor 200 tahun 2004.
Nontji, A. 2007. Laut nusantara. Djambatan. Jakarta.
44
Persulessy, A.E. dan Pramudji. 1997. Karakteristik nutrien sedimen di padang lamun tropis : suatu perbandingan antara sedimen berjenis karbonat dengan silikat di Perairan Pelita Jaya, Seram Barat. h.321-327. Prosiding Seminar Kelautan LIPI-UNHAS, 4-6 Juli 1997, Ambon, Indonesia. Lembaga Ilmu Pengetahuan Indonesia-Universitas Hasanuddin. Ambon, Indonesia. Pemerintah Provinsi DKI Jakarta. 2009. Kepulauan Seribu.
http://www.jakarta.go.id/jakv1/item/halaman/0/0/2458/1/6/2/139/3/6/4/43/5/ 139 [14 April 2012]
Rappe, R. A. 2010. Struktur komunitas ikan pada padang lamun yang berbeda di Pulau Barrang Lompo. Jurnal Ilmu dan Teknologi Kelautan Tropis. Volume 2(2) : 62-73.
Rachman, A. F. 2007. Pemanfaatan sumber daya alam dan lingkungan pesisir dan laut untuk pariwisata di Taman Nasional Laut Kepulauan Seribu. Jurnal Ilmiah Pariwisata. Volume 12(2) : 144-154
Sachoemar, S. I. 2008. Karakteristik lingkungan perairan Kepulauan Seribu. Balai Pengkajian dan Penerapan Teknologi (BPPT). Volume 4(2) : 109-114 Soedibjo, B. S. 2008. Analisis komponen utama dalam kajian ekologi. Oseana.
Volume 33(2) : 43-53.
Takadengan, K. dan M. H. Azkab. 2010. Struktur komunitas lamun di Pulau Talise, Sulawesi Utara. Oseanologi dan Limnologi Indonesia. Volume 36(1) : 85- 95.
Tomascik, T., A. J. Mah, A. Nontji, dan M. K. Moosa. 1997. The ecology of Indonesian seas. The Ecology of Indonesian Series. Vol VII. Periplus edition Ltd. Singapura.
Walpole, R. E. 1993. Pengantar statistik. Diterjemahkan oleh Bambang Sumantri. PT. Gramedia Pustaka Utama. Jakarta.
Zimmerman, R. C. 2006. Light and photosynthesis in seagrass meadows. Hal. 303-321. In Larkum, A. W. D., Robert J.O., C. M. Duarte (Ed.), Seagrasses : biology, ecology, and conservation. Springer. Dordrecht, Netherlands. Zulkifli, E. 2003. Kandungan zat hara air poros dan air permukaan padang lamun
L
Lampiran 1.
Al
Ke
Alat yang
lat dasar sela
GPS
ertas waterpr
digunakan d
am
roof
dalam penelit
H tian
R
HORIBA Mu
Jar
Rollmeter
ultiparameter
ring lempar
46
r checker
Lampiran 2. Data kelimpahan ikan (ind/m2)
No. Jenis Ikan Stasiun
Famili Genus Ukuran Maks Utara Timur Selatan Barat
1 Apogonidae Apogon 6,8 cm 3 1 2 2
2 Apogonidae Cheilodipterus 5,9 cm 12 3 14 7
3 Gobiidae Cryptocentrus 8,4 cm 0 3 1 2
4 Labridae Halichoeres 6,2 cm 6 1 3 4
5 Leiognathidae Gerres 9,3 cm 14 8 72 16
6 Monachantidae Monachantus 5,1 cm 0 1 0 0
7 Nemipteridae Scolopsis 5,3 cm 4 0 10 1
8 Pomacentridae Dischistodus 5,5 cm 3 0 1 0
9 Serranidae Epinephelus 8,7 cm 0 1 0 0
10 Siganidae Siganus 6,7 cm 107 0 65 9
Total 155 21 174 45
L
Lampiran 3.
Cry
Ch
Gambar be
Gerres sp.
yptocentrus
heilodipterus
Siganus sp.
erbagai jenis
sp.
s sp.
s ikan di Pula
au Pramuka
A
Mon
Hal
Disc
Apogon sp.
nachantus sp
lichoeres sp.
chistodus sp.
48
p.
.
Sc
colopsis sp.
Lampiran 4. Hasil analisis faktorial koresponden
a. Koordinat stasiun dan kontribusinya pada inersia Nama Kolom Nomor
Kolom
Koordinat Dim.1
Koordinat
Dim.2 Massa Kualitas
Inersia
Utara 1 0,4383 -0,2962 0,3924 1,0000 0,2787 0,2948 0,6864 0,3128 0,3136
Timur 2 -1,6939 -0,7063 0,0532 0,9831 0,4624 0,5967 0,8375 0,2410 0,1456
Selatan 3 -0,0623 0,3323 0,4405 0,9415 0,1357 0,0067 0,0320 0,4418 0,9095
Barat 4 -0,4780 0,0651 0,1139 0,5467 0,1231 0,1018 0,5368 0,0044 0,0100
b. Koordinat genera dan kotribusinya pada inersia Nama Kolom Nomor
Kolom
Koordinat Dim.1
Koordinat
Dim.2 Massa Kualitas