SKRIPSI
Disusun oleh :
Aji Septiyadi
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
Rahmat dan Hidayah-Nya yang dianugerahkan kepada penulis dalam menyelesaikan
SKRIPSI yang berjudul “
Pengaruh Material Lamun Buatan Terhadap
Keanekaragaman dan Kelimpahan jenis Crustacea Di Perairan Pulau Pari,
Kepulauan Seribu
”. Shalawat serta salam senantiasa penulis sampaikan kepada
Rasulullah SAW.
Selanjutnya dalam penulisan skripsi ini, penulis telah banyak mendapatkan
bantuan dan motivasi dari berbagai pihak baik langsung maupun tidak langsung
untuk itu perkenankanlah penulis menyampaikan terima kasih yang tak terhingga
kepada:
.
DR. Syopiansyah Jaya Putra, M.Sis selaku Dekan Fakultas Sains dan Teknologi.
.
DR. Lily Surayya Eka Putri, M.Env.Stud, selaku ketua Program Studi Biologi
dan Pembimbing II. Terima kasih telah memberikan bimbingan dan masukannya
dalam penulisan skripsi.
.
Dra. Rianta Pratiwi, M.Sc, selaku pembimbing I, terima kasih atas bimbingan
dan semua masukannya selama penelitian berlangsung, dengan bimbingan dari
Ibu penulis mendapatkan banyak ilmu dan pengalaman yang tak pernah
didapatkan dari Kampus.
.
Drs. Indra Aswandy, selaku Peneliti Utama yang telah membantu dan memberi
.
Para Dosen Biologi, yang telah memberikan dukungan baik moral maupun
spiritual dan membantu dalam teknis Akademis penyelesaian skripsi penulis.
.
Ayah dan Ibu Penulis, yang tidak henti – hentinya membantu baik doa, motivasi
maupun secara materi dalam proses mulai kuliah sampai selesai tugas akhir
penelitian dan memberikan masukan secara moral ketika dalam penelitian
berlangsung.
.
Adik – adik Penulis, yang telah membantu berupa dukungan baik moral maupun
spiritual.
.
Bpk. Mumuh, selaku Pengawas dan Teknisi Lapangan yang ada di Pulau Pari,
ketika memulai dan berlangsungnya penelitian.
.
Bpk. Hasan, selaku warga yang ada di Pulau Pari, yang telah memberikan
fasilitas baik pangan maupun papan (tempat tinggal) ketika saat penelitian di
lapangan.
.
Pengawas Perpustakaan LON-LIPI, yang telah memberikan bantuan berupa
referensi atau sumber literatur dalam proses penulisan skripsi penelitian.
.
Sdr. Achmad Syaifurrachman, S.Si, selaku teman yang selalu membantu dalam
penelitian berlangsung saat di lapangan (Pulau Pari) baik tenaga maupun fasilitas
alat dan bahan penelitian.
.
Sdr. Mr. Lukman Budianto, S.Si, selaku teman yang telah menyumbangkan
dukungan baik moral ataupun spiritual.
.
Keluarga Besar Biologi
(BIOMA), kita semua telah mengarungi lautan dan
menjelajah lembah yang curam serta mendaki gunung – gunung tertinggi selama
hampir tahun lebih bersama. Mudah – mudahan kita semua selalu diikatkan dan
jangan pernah terpisah. Semoga Allah SWT selalu memberkati ‘jalan’ yang kita
tempuh baik sekarang maupun kedepannya.
.
Teman-teman BIOLOGI angkatan
dan
kita semua satu rumpun,
satu ordo, satu famili dan satu marga hingga kita menjadi satu saudara penuh.
.
Kepada semua pihak yang tidak dapat dituliskan semua karena keterbatasan
halaman dan tempat.
Semoga Allah SWT senantiasa memberikan Rahmat dan Karunia-Nya kepada
semua pihak yang telah memberikan segala bantuan tersebut di atas. Skripsi ini tentu
saja masih jauh dari kesempurnaan, sehingga penulis dengan senang hati menerima
saran dan kritik yang bersifat membangun dan mengembangkan. Akhirnya semoga
Skripsi ini dapat digunakan sebaik-baiknya serta memiliki banyak manfaat bagi
semua pihak.
Jakarta, Maret
BAB I
PENDAHULUAN
. Latar Belakang
Keberadaan biota laut seperti crustacea berperan penting dalam berbagai
proses yang terjadi di daerah padang lamun. Peranan mereka tidak hanya sebagai
pengurai tapi juga sebagai komponen jaring makanan. Kelangsungan hidup
crustacea tidak dapat lepas dari keberadaan lamun sebagai tempat hidup, sumber
makanan, reproduksi dan lain – lain. Hewan yang datang sebagai pengunjung
biasanya untuk memijah dan tempat makanan seperti ikan dan beberapa jenis
crustacea di antaranya kepiting, udang, amphipoda dan isopoda (Putra, 2008).
Menurut Kasim (2005), bentuk crustacea infaunal maupun epifunal
berhubungan erat dengan produsen primer dan berada pada tingkatan trofik yang
lebih tinggi, karena selama masa juvenil dan dewasa mereka merupakan sumber
makanan utama bagi berbagai ikan dan invertebrata yang berasosiasi dengan
lamun. Adapun lamun memiliki produktifitas primer di perairan dangkal di
seluruh dunia dan merupakan sumber makanan penting bagi banyak organisme
(Fahruddin, 2002). Oleh sebab itu, padang lamun merupakan ekosistem yang
mempunyai produktivitas tinggi dan kaya akan keanekaragaman jenis biota laut
khususnya crustasea. Padang lamun biasanya terdapat di perairan tropis seperti
yang terdapat di Pulau Pari kawasan Kepulauan Seribu.
Kawasan tersebut banyak terdapat pemukiman penduduk yang dilengkapi
kurang upaya yang diberikan untuk menyelamatkan ekosistem lamun, meskipun
data mengenai kerusakan ekosistem lamun tidak tersedia, tapi faktanya sudah
banyak mengalami degradasi akibat aktivitas di darat (Rani, 2008).
Sektor wisata, budidaya, dermaga dan kegiatan manusia lainnya
(reklamasi, pertambakan, industri dan pengembangan kota) yang berada di Pulau
Pari tersebut tidak diimbangi dengan kesadaran untuk melestarikan lingkungannya
(Diatin et al, 2007). Hal ini banyak menimbulkan dampak negatif bagi pihak
setempat salah satunya mengalami pencemaran polusi dan sampah.
Menurut Rani (2008), degradasi padang lamun memberi dampak yang
nyata yaitu mengarah pada penurunan keragaman biota laut sebagai akibat hilang
atau menurunnya fungsi ekologi dari ekosistem lamun. Akibatnya dari berbagai
kegiatan manusia tersebut jelas ekosistem lamun akan mengalami kerusakan dan
kehilangan fungsinya serta membawa dampak terhadap penurunan produksi biota.
Khususnya bagi kehidupan biota crustacea ekonomis yang bergantung pada
habitat lamun akan mengalami penurunan dan berangsur – angsur akan hilang.
Sebagai tindak lanjut dalam menanggulangi penurunan produksi biota
lamun (crustacea) perlu dilakukan upaya antara lain pengembangan lamun buatan.
Lamun buatan dibentuk dari berbagai material seperti tali tambang, rumpon
plastik, batang bambu atau kayu, sabut kelapa dan lain – lain. Tujuannya untuk
memberikan habitat baru bagi berbagai biota laut dan dapat menciptakan suatu
proses ekologi terutama proses makan memakan (food chain & food web) (Rani,
2008).
Terbatasnya penelitian mengenai lamun buatan yang berperan penting bagi
dan mengingat perairan Pulau Pari sebagai penunjang, tempat perawatan hidup
(nursery ground) bagi biota crustacea, memiliki padang lamun dan telah banyak
mengalami kerusakan, maka untuk mengembalikan fungsi lamun alami di
perairan setempat perlu dikembangkan lamun buatan (artifisial).
. Rumusan Masalah
1. Apakah di lamun buatan terdapat jenis–jenis crustacea?
2. Apakah terdapat pengaruh baik pada lamun buatan terhadap
keanekaragaman dan kelimpahan crustacea padang lamun yang bernilai
ekonomis dan non ekonomis?
. Hipotesis
1. Di lamun buatan terdapat jenis–jenis crustacea antara lain dari kelompok
Decapoda (udang dan kepiting), Isopoda dan Amphipoda.
2. Terdapat pengaruh baik pada lamun buatan terhadap keanekaragaman
dan kelimpahan crustacea padang lamun yang bernilai ekonomis dan non
ekonomis.
. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui pengaruh dan peranan dari beberapa material lamun buatan
pada lokasi yang berbeda terhadap keanekaragaman dan kelimpahan
crustacea.
2. Mengetahui jenis–jenis crustacea yang hadir pada lamun buatan, di
. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat yaitu:
1. Memberikan informasi mengenai kelimpahan dan keanekaragaman
crustacea pada lamun buatan, di ekosistem lamun, Pulau Pari.
2. Memberikan informasi tentang kualitas perairan Pulau Pari, Kepulauan
Seribu.
3. Menjadi bahan informasi tambahan kepada pihak-pihak terkait
khususnya Lembaga Oseanografi, P2O-LIPI dan Balai Taman Nasional
Laut Kepulauan Seribu (BTNLKpS) dalam mengembangkan wilayah di
. Kerangka Berpikir
Gambar 1: Kerangka berpikir penelitian.
Padang lamun Pulau Pari sebagai habitat bagi biota crustacea
Berubahnya parameter fisik dan kimia perairan Pulau Pari, perputaran air akibat pergerakan aktivitas perahu nelayan di
perairan lamun dan metode penangkapannya.
Tercemar polusi dan rusaknya pada ekosistem lamun serta turunnya regenerasi biota crustacea
Dilakukan pengelolaan dan penelitian mengenai pengaruh material lamun buatan terhadap kelimpahan dan keanekaragaman crustacea di perairan padang lamun, Pulau
Pari
Pengambilan sampel crustacea dengan model artifisial (tali
tambang hijau)
Pengambilan sampel crustacea dengan model artifisial (sabut
kelapa)
Identifikasi crustacea yang diperoleh
Memberi informasi jenis crustacea khususnya bernilai ekonomis dan non ekonomis yang terdapat di lamun
buatan
Memberikan informasi tentang kegunaan dan manfaat dari artifisial lamun sebagai tempat kehidupan biota
BAB II
TINJAUAN PUSTAKA
. Keadaan Umum Gugus Pulau Pari, Kepulauan Seribu
. Letak Geografis Kawasan
Kepulauan Pari terletak antara 05° 50′ hingga 05° 52′ Lintang Selatan dan
106° 34′ sampai 106° 38’ Bujur Timur. Daerah ini terletak di Laut Jawa, tepatnya
di sebelah Utara DKI Jakarta dan Tangerang. Secara administrasi Kepulauan Pari
termasuk Kelurahan Pulau Tidung, Kecamatan Kepulauan Seribu Selatan,
Kabupaten Kepulauan Seribu, Propinsi DKI Jakarta. Jumlah penduduk tercatat
[image:11.612.134.534.54.670.2]567 jiwa pada tahun 1994 (Asriningrum, 2004) (Gambar 2).
Gugusan Pulau Pari terdiri atas 6 pulau kecil yaitu Pulau Pari, Burung,
Kongsi Timur, Kongsi Tengah, Kongsi Barat, dan Tikus. Gugusan pulau ini
menjadi satu kesatuan oleh adanya pertumbuhan terumbu karang. Dalam kesatuan
kepulauan ini, terumbu karang membentuk lagun di tengahnya sehingga
kepulauan ini dapat dikatakan sebagai Pulau Atol dalam bentuk mini
(Asriningrum, 2004).
. Topografi dan Luas Lahan
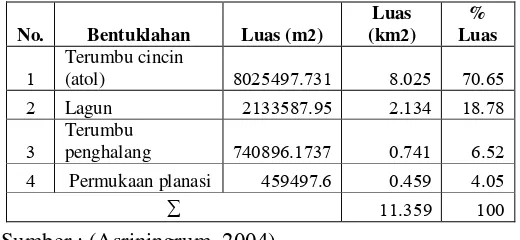
Menurut Asriningrum (2004) Gugusan Pari diketahui ada empat kelas
bentuk lahan dimana, dataran aluvial pantai merupakan bentuk lahan terluas.
Bentuk lahan terumbu cincin terbentuk oleh pertumbuhan terumbu karang atau
karena naiknya air laut pada terumbu samudera. Bentuknya seperti cincin dan
disebut juga atol. Luas bentuk lahan Gugus Pulau Pari dapat dilihat pada Tabel 1.
Tabel . Luas Bentuk Lahan Gugus Pulau Pari.
Sumber : (Asriningrum, 2004).
Bentuk atol tersebut berasosiasi dengan terbentuknya lagun, sedangkan
bentuk lahan lagun merupakan genangan air laut yang berada di tengah terumbu
karang karena terbentuk oleh pertumbuhan terumbu karang atau naiknya air laut.
Bentuk lahan terumbu penghalang berupa terumbu karang yang muncul ke
No. Bentuklahan Luas (m )
Luas (km ) % Luas 1 Terumbu cincin
(atol) 8025497.731 8.025 70.65 2 Lagun 2133587.95 2.134 18.78 3
Terumbu
penghalang 740896.1737 0.741 6.52 4 Permukaan planasi 459497.6 0.459 4.05
[image:12.612.189.449.473.593.2]permukaan laut oleh pertumbuhannya atau penurunan air laut. Bentuk lahan ini
muncul ke permukaan sebagai pulau-pulau karang timbul, sedangkan bentuk
lahan permukaan yang lebih dari satu bidang datar (planasi) terbentuk oleh proses
pengikisan lapisan atas permukaan (denudasi) sehingga membentuk suatu relief
hampir datar. Bentuk lahan ini terdapat di Pulau Pari yang material penyusunnya
merupakan sedimentasi pasir (Asriningrum, 2004).
Pulau Pari berbentuk memanjang arah diagonal Barat Daya – Timur Laut
mengikuti pola patahan secara regional. Sementara ke-lima pulau kecil lainnya
menunjukkan pola bentuk perkembangan terumbu karang yang telah lanjut dan
oleh adanya pertumbuhan karang dan atau penurunan air laut, terumbu karang ini
muncul ke permukaan (Asriningrum, 2004). Karang Timbul lainnya juga muncul
di tepi Gugusan Pulau Pari bagian Barat dan Utara dengan ukuran lebih kecil.
Menurut Kiswara (1992) bagian Selatan Pulau Pari merupakan rataan
terumbu dengan panjang terpendek 180 m dan terpanjang 900 m. Pantai utaranya
terdiri atas Goba (Goba Besar I dan II) di sebelah Barat dan rataan terumbu di
Timur. Panjang dari bagian tersempit rataan terumbu di pantai Utara Pulau Pari
sekitar 300 m dan yang terlebar 600 m. Rataan terumbu adalah bagian pulau
karang yang berada di daerah pasang surut. Pada waktu pasang rataan terumbu
tergenang air dan waktu surut terdapat tempat – tempat kering dan dasarnya terdiri
atas lumpur, pasir dan puing karang mati.
. Sejarah dan Dasar Hukum
Menurut Lestari (2008) Kelurahan Pulau Pari yang berkedudukan di Pulau
Adapun luas daratan Kepulauan Seribu kurang lebih 864,59 hektar dan luas
lautannya kurang lebih 6.997,50 km2 . Usaha pengaturan wilayah perairan laut di
Kepulauan Seribu sudah lama dilakukan, selain melalui peraturan daerah juga
melalui peraturan pusat (Diatin et al, 2007).
Pada tanggal 21 Juli 1982 dengan melihat potensi dan pemanfaatan
sumber daya alam khususnya daerah laut di Kepulauan Seribu yang cukup tinggi,
melalui Keputusan Menteri Pertanian Nomor 527/Kpts/Um/1982, ditetapkan
wilayah seluas 108.000 hektar di Kepulauan Seribu sebagai Cagar alam dan
dengan diberi nama Cagar Alam Laut Seribu (Diatin et al, 2007). Selanjutnya pada tahun yang sama dibulan Oktober, Menteri Pertanian memberikan
pernyataan pada Kongres Taman Nasional sedunia yang diadakan di Bali, dengan
Nomor 736/Mentan/X/1982, mengubah nama Cagar Alam Laut Pulau Seribu
menjadi Taman Nasional Kepulauan Seribu. Perubahan luas Taman Nasional
Kepulauan Seribu menjadi 108.475,45 hektar ditetapkan melalui Keputusan
Menteri Kehutanan Nomor 220/Kpts- II/2000. Namun, selanjutnya luas dari
Taman Nasional Kepulauan Seribu tersebut dirubah kembali menjadi 107.489
hektar dengan Keputusan Menteri Kehutanan Nomor. 6310/Kpts-II/2002 pada
tanggal 13 Juni 2002.
Menurut Diatin et al (2007) adapun pengelolaan Kawasan Pelestarian Alam Perairan Taman Nasional Laut Kepulauan Seribu diserahkan kepada
Direktur Jenderal Perlindungan Hutan dan Konservasi Alam. Luas Taman
Nasional Laut Kepulauan Seribu (TNLKpS) tersebut hanya 15% luas Kabupaten
Kepulauan Seribu, akan tetapi sangat berperan dalam pembangunan Kepulauan
potensi budidaya kelautan dan 73 % dari keseluruhan potensi wisata bahari yang
ada di Kepulauan Seribu.
. Zonasi Kawasan
Berdasarkan administrasi Gugusan Pulau Pari termasuk Kelurahan Pulau
Tidung, Kecamatan Kepulauan Seribu Selatan, Kabupaten Kepulauan Seribu,
Propinsi DKI Jakarta. Jumlah penduduk tercatat 567 jiwa (1994). Wilayah
Kepulauan Seribu seluas 108.000 Ha, sebagian telah ditetapkan sebagai Taman
Nasional melalui SK. Menteri Pertanian No. 736 /MENTAN/ X /1 982
(Asriningrum, 2004).
Zonasi Taman Nasional ini, ditetapkan sebagai berikut: Zona I, II, dan III
merupakan daerah yang mutlak dilindungi dan tidak diperbolehkan adanya
perubahan dalam bentuk apapun oleh aktivitas manusia, kecuali yang
berhubungan dengan Ilmu Pengetahuan, Pendidikan, dan Penelitian.
1. Zona inti I, merupakan perlindungan habitat Penyu Sisik yang berlokasi di
Pulau Gosong Rengat dan perairannya. Pulau Karang Rengat dan perairannya,
seluas 1.356,8 Ha.
2. Zona Inti II, merupakan perlindungan Hutan Bakau yang berlokasi di Perairan
Gosong Penjaliran dan perairannya, seluas 2.440,9 Ha.
3. Zona Inti III, merupakan ekosistem Terumbu Karang yang berlokasi di
Perairan Pulau Kayu Angin, Pulau Bira, dan perairan Pulau Belanda, seluas
Di samping Zona Inti tersebut, ada pula Zona Perlindungan yang
merupakan daerah perlindungan bagi zona inti dan dipergunakan sebagai kajian
konservasi serta pengembangan kegiatan cinta alam. Zona ini berlokasi di
perairan Pulau-pulau Jagung, Karang Buton, Karang Mayang, Rengit,
Nyamplung, Sebaru Besar dan Kecil, Lipan, Kapas, Bundar, Hantu Barat dan
Hantu Timur, Yu Barat dan Yu Timur, Satu, Kelor Barat, dan Kelor Timur. Zona
Perlindungan mempunyai luas total 12.271,94 Ha.
. Karakteristik Crustacea
. Klasifikasi
Menurut Romimohtarto dan Juwana (2007) crustacea merupakan
Arthropoda yang sebagian besar hidup di laut dan bernafas dengan insang.
Tubuhnya terbagi dalam kepala (chepalin), dada (thorax) dan abdomen. Kepala
dan dada bergabung membentuk kepala-dada (cephalotorax; Y: cephale = kepala;
thorax = bagian tengah tubuh atau dada). Kepalanya biasanya terdiri atas lima ruas yang tergabung menjadi satu. Mereka mempunyai dua pasang antena,
sepasang mandibel (mandible) atau rahang dan dua pasang maksila (maxilla).
Dada mempunyai embelan dada yang bentuknya berbeda – beda. Beberapa di
antaranya digunakan untuk berjalan. Ruas abdomen biasanya sempit dan lebih
mudah bergerak daripada kepala dan dada. Ruas – ruas tersebut mempunyai
embelan yang ukurannya sering mengecil.
Salah satu kelompok crustacea adalah Ordo Decapoda, yang masuk ke
dalam kelompok Infra Ordo Caridea. Ordo ini sangat penting, baik dari segi
karapas kecil yang tidak menutupi kepala dan dada (torax). Mereka memiliki
rangka luar (eksoskeleton), hanya satu atau dua sepasang kaki yang berfungsi
sebagai capit (chela) dan otot abdomen untuk berenang. Decapoda dari Klass
Crustacea biasa dibagi atas tiga kelompok menurut bentuk abdomennya, yakni
Macrura, Anomura dan Brachyura (Romimohtarto dan Juwana, 2007).
Gambar 3. Morfologi kelompok Macrura secara umum (Mackie, 1998).
Pengelompokkan Crustacea mengikuti Latreille yang pada tahun 1806
membagi Crustacea menjadi dua anak kelompok, yakni Entomostraca dan
Malacostraca. Berdasarkan ukuran tubuhnya Crustacea dikelompokkan menjadi
sebagai berikut (Putra, 2008):
1). Entomostraca (berukuran mikrokopis)
Hewan ini dikelompokkan menjadi empat ordo,yaitu:
a). Branchiopoda
c). Copepoda
d). Cirripedia
2). Malacostraca (berukuran makroskopis)
Hewan ini dikelompokkan dalam tiga ordo, yaitu:
a). Isopoda
b). Stomatopoda
c). Decapoda
d) Amphipoda
Malacostraca banyak hidup di laut dan air tawar. Tubuhnya terdiri dari
cephalotorax yaitu kepala dan dada bersatu dengan perut (abdomen).
Malacostraca dibagi tiga ordo, yaitu Isopoda, Amphipoda, Stomatopoda dan
Decapoda.
Decapoda (kaki sepuluh) terdiri dari udang dan kepiting. Decapoda
memiliki ciri – ciri kepala sampai dada menjadi satu (cephalotorax) yang ditutupi
oleh karapas, tubuh mempunyai lima pasang kaki atau sepuluh kaki (Jones (1984)
dalam Putra, 2008). Adapun Amphipoda yang terdiri atas Super Famili Gammaridean mendominasi kelompok Crustacea (Pera Carida) di zona Intertidal
laut dunia, yang sebagian di wilayah tropis (Thomas, 1993).
Gammaridean dari Ordo Amphipoda yang terkecil berukuran 1-8 mm dan
kehidupannya bebas seperti udang-udangan dan menghabiskan waktunya di dalam
sedimen pasir. Amphipoda (Pera Carida) memiliki rahang mulut yang
berkembang baik, tubuh lateral kompresi (subcylindrical) dan kutikula halus
Menurut Brusca & Wilson (1991), seperti halnya dari (Pera Carida)
Crustacea, Isopoda memiliki 10 Sub Ordo, 4 memiliki perwakilan di dalam laut.
Namun, salah satu dari 4 Sub Ordo, kelompok Asellota jauh dari dominasi
Isopoda laut dalam klasifikasi takson, sedangkan kelompok yang paling umum
dijumpai di daerah zona pantai laut (intertidal) ada 3 Famili yaitu Idoteidae
(Valvifera), Sphaeromatidae (Flabellifera) dan Cirolanidae (Flabellifera).
Isopoda memiliki tubuh yang terbagi menjadi 3 daerah berbeda, yaitu
kepala (cephalon), dada dan perut (pleon). Segmen pertama bagian dada (toraks)
menyatu ke kepala dan bagian yang tersisa dari segmen (pereonites) dari toraks
terdiri dari pereon, masing – masing segmen terdapat sepasang kaki (pereiopods)
(Brusca & Wilson,1991).
Dalam Isopoda, perut berbentuk primitif terdiri dari 5 segmen (pleonites)
ditambah 6 yang merupakan bagian segmen pleonite + telson (pleotelson) dan
memiliki mata majemuk, dua pasang antena, dan empat set rahang. Rahang
(anterior ke posterior) terdiri dari mandibula, maxillae 1, maxillae 2 dan
maxillipeds (Brusca & Wilson, 1991).
. Ekologi Crustacea lamun
Menurut Azkab (2000) padang lamun merupakan satu tipe biotip yang
sangat luas di lingkungan estuaria dan pesisir pantai. Di samping produktivitas
biologis yang tinggi dari lamun dan adanya asosiasi flora, kekayaan fauna
terkonsentrasi di padang lamun.
Crustacea termasuk salah satu fauna konsumen di padang lamun. Beberapa
samping itu, beberapa decapoda memakan daun lamun dan beberapa kepiting
dengan ukuran besar memakan moluska, polikhaeta dan algae yang menempel
pada serasah lamun (Aswandy, 2008).
Menurut Schmitt (1973) dalam Pratiwi (2003) Amphipoda umumnya hidup mendiami substrat dasar yang ditumbuhi oleh lamun (akar dan tangkai akar
lamun), tetapi apabila Amphipoda menempati substrat pasir mereka akan merubah
corak tubuhnya seperti warna pasir dan jenis ini juga membuat lubang pada
habitatnya dengan warna yang sesuai dengan akar lamun. Adapun pada Decapoda
ditemukan mendiami berbagai macam habitat dan substrat, terutama pada kepiting
(Sub ordo Brachyura) yang sebagian besar mendiami substrat keras seperti
batu-batuan (coral) yang terdapat di antara tumbuhan lamun (Aswandy, 2008).
Menurut Moosa dan Aswandy (1995) kepiting dan udang (Suku
Palaeomonidae) dari kelompok Decapoda beradaptasi dengan baik dan hidup
diantara daun lamun. Crustacea ini memangsa binatang–binatang kecil lainnya
yang hidup menempel (epizoa) pada daun atau bagian dari lamun. Kelompok ini
yang diwakili oleh berbagai jenis udang (Macrura), kepiting (Brachyura) dan
Kumang (Anomura) pada umumnya adalah pemakan segala (omnivore) dengan
kecenderungan ke arah pemakan daging (karnivore).
Decapoda sudah mengadaptasikan diri hidup pada tumbuhan seperti
beberapa jenis algae dan lamun, contohnya (Sub Ordo Brachyura) jenis Suku
Xantidae yang sebagian besar ditemukan pada substrat keras dan Suku Majidae
ditemukan merayap diantara tumbuhan, sedangkan Suku Portunidae dan
Calappidae bergerak di substrat dasar berpasir (Aswandy dan Moosa (1995)
Menurut Widyastuti (2002) Sub Ordo Brachyura berperan sebagai parasit
dan diperkirakan ada 130 jenis yang terbagi dalam 4 marga Argulus, ke empat
marga tersebut merupakan parasit di laut. Morfologi dari kelompok ini
mempunyai sepasang alat penghisap (sucker), sepasang mata faset yang besar dan
kepala tertutup oleh karapas yang transparan pada bagian dorsalnya.
Investasi dari parasit dapat menyebabkan kerusakan pada bagian tubuh
mangsa (hospes), termasuk Ordo Isopoda yang bersifat parasit bagi ikan dan jenis
crustacea lain seperti kepiting dan lainnya, sehingga biasanya ditemukan melekat
pada bilik insang dari hospes (Widyastuti, 2002). Adaptasi morfologi dari Isopoda
terutama untuk memakan dan melekat pada mangsanya, sehingga pada bagian
mulut dengan mandibula dan maksila pertama mampu menusuk dan masuk
jaringan hospes. Adapun Stomatopoda merupakan pemangsa (predator) yang
bergerak aktif mencari mangsa tapi merupakan jenis karnivora yang menunggu
mangsanya untuk diterkam (Barnard (1971) dalam Aswandy, 2008).
Ordo hoplocarida (Stomatopoda) hidup di substrat dasar dengan meliang,
seperti Lysiosquilla maculate dan ada pula yang membenamkan diri di substrat
dasar atau hidup di antara batu – batuan yang terdapat dalam ekosistem lamun.
Binatang ini merupakan pemangsa yang memangsa berbagai jenis moluska atau
binatang lain seperti ikan kecil atau crustacea, sedangkan stomatopoda sendiri
merupakan mangsa dari hewan lainnya seperti ikan, cumi dan gurita (Aswandy,
. Asosiasi dan Interaksi Lamun
. Pengertian
Menurut Azkab (2000) lamun merupakan tumbuhan berbunga
(Angiospermae) yang mempunyai adaptasi untuk hidup pada lingkungan laut dan
memerlukan kemampuan berkolonisasi untuk hidup pada media air asin yang
mampu berfungsi normal dalam keadaan terbenam, mempunyai sistem perakaran
yang berkembang dengan baik, mempunyai kemampuan untuk berkembang biak
secara generatif dalam keadaan terbenam dan dapat berkompetisi dengan
organisme lain dalam kondisi stabil. Untuk melihat karakter dan jenis lamun dapat
dilihat pada Gambar 4.
Gambar 4. Jenis–jenis Lamun di Perairan Indonesia. (http:// w ww.indo.seagrass.org.id.).
Menurut Azkab (2006) lamun juga sebagian besar memiliki struktur
berumah dua yang artinya dalam satu tumbuhan hanya ada bunga jantan saja atau
lamun adalah bersifat hidrophilus yaitu kemampuannya untuk melakukan polinasi
di bawah air.
Menurut Den Hartog (1970) dalam Azkab (2006) ekosistem padang lamun
memiliki kondisi ekologis yang sangat khusus dan berbeda dengan ekosistem
mangrove dan terumbu karang. Ciri-ciri ekologis padang lamun antara lain:
1. Terdapat di perairan pantai yang landai, di dataran lumpur/pasir
2. Pada batas terendah daerah pasang surut dekat hutan bakau atau di dataran
terumbu karang
3. Mampu hidup sampai kedalaman 30 meter, di perairan tenang dan
terlindung
4. Sangat tergantung pada cahaya matahari yang masuk ke perairan
5. Mampu melakukan proses metabolisme secara optimal jika keseluruhan
tubuhnya terbenam air termasuk daur generatif
6. Mampu hidup di media air asin
7. Mempunyai sistem perakaran yang berkembang baik.
. Klasifikasi
Menurut ITK-IPB (2007) di Indonesia hanya terdapat 7 genus dan sekitar
15 jenis yang termasuk ke dalam 2 famili yaitu : Hydrocharitacea ( 9 marga, 35
jenis ) dan Potamogetonaceae (3 marga, 15 jenis). Jenis Thalassia hemprichii tersebar luas di seluruh Indonesia dan tumbuh merambat secara vertikal dari zona
intertidal bawah ke zona subtidal, sedangkan Halophila ovalis juga tersebar dan tumbuh secara vertikal dari zona intertidal dengan kedalaman 20 meter dan
tumbuh dengan baik dalam sedimen dasar (Kuriandewa et al (2003) dalam Green
Secara rinci klasifikasi lamun menurut Den Hartog (1970) dan Menez,
Phillips, dan Calumpong (1983) adalah sebagai berikut :
Divisi : Anthophyta
Kelas : Angiospermae
Famili : Potamogetonacea
Subfamili : Zosteroideae
Genus : Zostera
Phyllospadix
Heterozostera
Subfamili : Posidonioideae
Genus : Posidonia
Subfamili : Cymodoceoideae
Genus : Halodule
Cymodoceae
Syringodium
Amphibolis
Thalassodendron
Famili : Hydrocharitaceae
Subfamili : Hydrocharitaceae
Menurut Den Hartog (1970) dalam Azkab (2006) berbagai bentuk pertumbuhan tersebut mempunyai kaitan dengan perbedaan ekologik lamun,
misalnya bentuk ‘Parvozosterid’ dan ‘Halophilid’ dapat dijumpai pada hampir
semua habitat, mulai dari pasir yang kasar sampai lumpur yang lunak, mulai dari
. . Asosiasi Crustacea Lamun
Asosiasi lamun yang paling beragam ditemukan pada habitat terumbu
karang di zona sublitoral atas, ditemukan pada daerah yang memiliki kestabilan
tinggi dan paling sedikit mengalami penurunan atau pasir yang hampir horisontal
(landai). Pecahan karang yang menutupi terumbu karang termasuk banyak
habitatnya, sehingga tiap spesies fauna dapat sangat melimpah dan mendominasi
komunitas (Azkab, 2006).
Komunitas lamun dihuni oleh banyak jenis fauna bentik, organisme
‘demersal’ serta ‘pelagis’ yang menetap maupun yang tinggal sementara disana.
Adapun spesies yang sementara hidup di lamun biasanya adalah juvenil dari
sejumlah organisme yang mencari makanan serta perlindungan selama masa kritis
dalam siklus hidup mereka, atau mereka mungkin hanya pengunjung yang datang
ke padang lamun setiap hari untuk mencari makan (Kasim, 2005).
Menurut Ngangi (2003) ekosistem padang lamun berperan sebagai
penyuplai energi, baik pada zona bentik maupun pelagis, salah satunya detritus
daun lamun yang tua didekomposisi oleh sekumpulan jasad bentik crustacea
(seperti udang, kepiting, termasuk bakteri), sehingga dihasilkan bahan organik,
baik yang tersuspensi maupun yang terlarut dalam bentuk nutrien. Nutrien
tersebut tidak hanya bermanfaat bagi tumbuhan lamun, tetapi juga bermanfaat
untuk pertumbuhan fitoplankton dan selanjutnya zooplankton, juvenil ikan dan
lainnya (Dahuri (2003) dalam Ngangi, 2003).
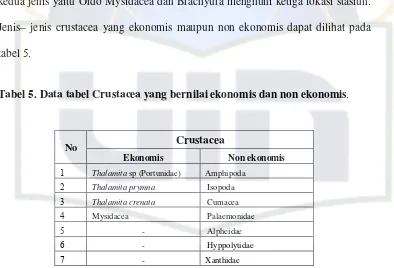
Fauna crustacea yang berasosiasi dengan lamun merupakan komponen
penting dari jaring makanan di lamun, meskipun bentuk crustacea infaunal
sebagai konsumen di lamun karena sebagian besar membutuhkan pakan nutrisi
atau epifit pada lamun dan lamun sebagai habitat yang ideal bagi crustacea untuk
berkembang biak. Kelompok crustacea di lamun berada pada tingkatan trofik
yang lebih tinggi, karena selama masa juvenil dan dewasa mereka merupakan
sumber makanan utama bagi berbagai ikan, udang dan invertebrata yang
[image:26.612.143.535.152.435.2]berasosiasi dengan lamun (Kasim, 2005)
Gambar 5. Jenis Udang yang menjadikan Lamun sebagai habitat utama nya (Kasim, 2005).
Banyak spesies epibentik udang baik yang tinggal menetap maupun
tinggal sementara di lamun dan bernilai ekonomis, seperti dari suku Penaeid
komersial penting, contohnya Penaeus esculentus dan P. semisulcatus (Bell & Pollard 1989; Coles et al. 1993; Mellors & Marsh 1993; Watson et al. 1993) dan lobster berduri (Panulirus ornatus) (Bell & Pollard 1989; Poiner et al. 1989), yang tergantung pada lamun sebagai tempat mencari makan serta berlindung
selama masa post larva dan juvenil dari siklus hidup mereka (Aswandy, 2008).
Menurut Moosa dan Aswandy (1995) padang lamun juga ditemukan
kelompok Stomatopoda yang merupakan kelompok predator dengan jenis
ciliata yang benar-benar berasosiasi dengan lamun. Stomatopoda umumnya hidup berbatasan dengan rataan terumbu intertidal. Diantara stomatopoda ada yang
berasosiasi dengan karang dan paling beragam warnanya adalah Odontodactylus scyllaus (Squillidae), merupakan predator aktif memakan moluska.
Crustacea predator yang berasosiasi dengan padang lamun umumnya
berada pada kondisi alami (tidak dieksploitasi oleh penduduk lokal). Kepiting dan
beberapa crustacea lain menghabiskan sebagian besar waktu hidupnya dengan
mengubur diri di bawah permukaan substrat. Diantara yang paling umum adalah
jenis kepiting kotak dari Famili Calappidae. Kepiting kotak biasanya meliang
dibawah permukaan pasir, dan aktif memakan gastropoda. Capit kanan mereka
digunakan khusus untuk menghancurkan cangkang gastropoda (Kasim, 2005).
. . Parameter Ekologi Lamun
a. Suhu
Menurut Azkab (1999) kisaran suhu bagi spesies lamun dapat tumbuh di
bawah atau di atas tingkat temperatur normal yaitu antara 28 – 30oC . Hal tersebut menyebabkan fotosintesis meningkat seiring dengan meningkatnya suhu. Jenis
Thalassia sp yang hidup pada temperatur tinggi (di atas 30oC) dapat berbunga
tetapi tidak dapat berbuah dan dapat mengakibatkan banyak daun yang gugur.
b. Salinitas
Menurut Dahuri (2003) dalam Ngangi (2003) kisaran salinitas bagi spesies
c. Kecerahan
Kecerahan perairan menunjukkan kemampuan cahaya untuk menembus
lapisan air pada kedalaman tertentu. Pada perairan alami, kecerahan sangat
penting karena erat kaitannya dengan proses fotosintesis. Kebutuhan cahaya yang
tinggi bagi lamun untuk kepentingan fotosintesis terlihat dari sebarannya yang
terbatas pada daerah yang masih menerima cahaya matahari (ITK-IPB, 2007).
Nilai kecerahan perairan sangat dipengaruhi oleh kandungan lumpur, kandungan
plankton, dan zat-zat terlarut lainnya.
d. Kedalaman
Menurut Gonzagawawa (2009) tumbuhan lamun ini hidup di habitat
perairan pantai yang dangkal hingga kedalaman 3 meter di lautan tropis hingga
sub tropis. Lamun tumbuh subur terutama di daerah terbuka pasang surut dan
perairan pantai yang dasarnya bisa berupa lumpur, pasir, kerikil, dan patahan
karang mati, dengan kedalaman hingga empat meter. Adapun di perairan yang
sangat jernih, beberapa jenis lamun ditemukan tumbuh di kedalaman 8 hingga 15
meter (Husein, 2005).
e. Nutrien
Menurut Husein (2005) detritus daun lamun yang tua diuraikan
(dekomposisi) oleh sekumpulan hewan dan jasad renik yang hidup di dasar
perairan, seperti teripang, kerang, kepiting, dan bakteri. Hasil penguraian ini
berupa nutrien yang tercampur atau terlarut di dalam air. Nutrien ini tidak hanya
bermanfaat bagi tumbuhan lamun, melainkan juga bermanfaat untuk pertumbuhan
f. Substrat
Menurut ITK-IPB (2007) kesesuaian substrat yang paling utama bagi
perkembangan lamun ditandai dengan kandungan sedimen yang cukup. Semakin
tipis substrat (sedimen) perairan akan menyebabkan kehidupan lamun yang tidak
stabil,sebaliknya semakin tebal substrat, lamun akan tumbuh subur yaitu berdaun
panjang dan rimbun serta pengikatan dan penangkapan sedimen semakin tinggi.
Sementara itu, di kepulauan Spermonde Makassar, Erftemeijer (1993) melaporkan
bahwa menemukan lamun tumbuh pada rataan terumbu dan paparan terumbu
yang didominasi oleh sedimen karbonat (pecahan karang dan pasir koral halus),
teluk dangkal yang didominasi oleh pasir hitam (terrigenous) dan pantai intertidal
datar yang didominasi oleh lumpur halus.
BAB III
METODOLOGI PENELITIAN
. Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan November 2009 bertempat di
Perairan Pesisir Pulau Pari, Taman Nasional Laut Kepulauan Seribu (TNLKpS),
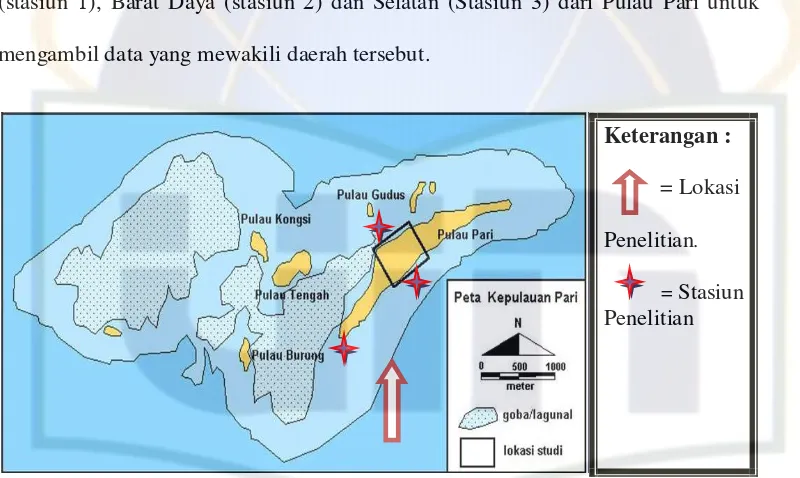
Teluk Jakarta – DKI Jakarta. Lokasi penelitian (Gambar 4), meliputi daerah Utara
(stasiun 1), Barat Daya (stasiun 2) dan Selatan (Stasiun 3) dari Pulau Pari untuk
mengambil data yang mewakili daerah tersebut.
Gambar 6. Lokasi dan Stasiun penelitian P. Pari, Kepulauan Seribu (PusLit Geoteknologi-LIPI, 2002).
. Alat dan Bahan
Alat–alat yang digunakan adalah termometer, kertas pH
universal/pHmeter, rollmeter, refraktosalinometer, kompas, water quality checker,
ember, GPS, mikroskop binokuler, snorkel, alat ukur kedalaman (Depth gauge), Keterangan :
= Lokasi
Penelitian.
alat ukur kecerahan (Secchi disk), sabut kelapa, tali plastik (tambang), plastik,
patok bambu ukuran 1,5 m, botol sampel, sedotan plastik 10 cm, jaring net, pinset,
tatakan dan alat tulis. Sedangkan bahan–bahan yang digunakan adalah alkohol
70% untuk mengawetkan sampel biota crustacea dan mengidentifikasinya.
. Cara Kerja
. Penentuan Titik Sampling
Untuk mengetahui penentuan titik sampling atau stasiun penelitian, maka
dilakukan pra survey terhadap kondisi lingkungan sebagai berikut:
a. Titik sampling ditentukan dari kondisi lingkungan atau parameter yang
mendukung baik (substrat, kondisi lamun dan geografis).
b. Penentuan stasiun tersebut berdasarkan pada zona padang lamun
sangat lebat (Selatan), sedang (Barat Daya) dan jarang (Utara).
c. Metode pengukuran yang digunakan untuk mengetahui kondisi lamun
adalah metode transek garis dan petak contoh (Line Transect)..
d. Tiap stasiun pengamatan, ditetapkan transek garis dari arah tepi pantai
ke arah laut hingga jarak 100 m (tegak lurus garis pantai sepanjang
zonasi padang lamun yang terjadi) di daerah intertidal.
e. Pada transek garis, letakkan petak contoh berbentuk segi empat dengan
ukuran 50x50 cm (interval 10 m).
f. Peletakkan tiap petak contoh perlu dilakukan, agar area tersebut
Gambar 7. Petakan plot di tiap stasiun.
. Metode Pengambilan sampel crustacea
Metode yang digunakan untuk mengumpulkan data sampel menggunakan
metode eksperimen rumpon buatan (Juwana, 2001), melalui beberapa tahap
sebagai berikut:
1. Tahap persiapan, yaitu menyiapkan seluruh keperluan alat atau bahan yang
digunakan untuk pembuatan artifisial lamun.
2. Tahap pembuatan konstruksi lamun buatan. Lamun buatan terdiri dari 2
model yaitu material tali plastik dan sabut kelapa yang sebelumnya dalam
bentuk produk pabrikan. Kemudian kedua material tersebut masing–
masing direntangkan dan dipotong dengan panjang 60 cm. Setelah itu,
material tersebut disisir dan dibuat bentuk rumbai atau rumpon. Sediakan
benang pancing dengan ketebalan ukuran 50–100 lbs dan dipotong dengan
ukuran 1-1,5 m. Setelah masing–masing material diukur, kemudian
satu rumpon (lamun buatan) dengan rumpon lain dalam satu buah artifisial
adalah 10 cm.
3. Tahap peletakkan lamun buatan. Tiap stasiun dibuat petak ukuran 10x10
m untuk penempatan artifisial dengan 2 model secara sejajar dan diagonal.
Tiap–tiap artifisial sudah ditentukan dengan ukuran 1m x 0,2m x 0,3m (P
x L x T). Untuk perolehan luasan plot, maka ukuran artifisial tersebut
diasumsikan menjadi 1x1m dengan 3 ulangan (plot), agar mewakili area
tersebut. Lalu artifisial tersebut ditempatkan dimasing–masing zona lamun
dengan ketentuan tingkat kerapatan rendah (6,25-12,5%), sedang (12,5
-50%) dan tinggi (50-100%) (Keputusan Meneg LH, 2004) pada tiap
stasiun. Jarak penempatan lamun buatan dengan alami disesuaikan dengan
kondisi lamun sekitar. Pengambilan data sampel dilakukan setelah
artifisial berumur 1, 2, 3 dan 4 minggu berada di perairan padang lamun.
4. Tahap pengambilan data. Pengambilan sampel crustacea yang berada di
artifisial menggunakan metode pengambilan secara langsung, yang
terlebih dahulu meletakkan jaring tepat di bawah lamun buatan secara
menyeluruh agar biota crustacea yang masuk perangkap artifisial tidak
mudah lolos, kemudian diangkat dan dimasukkan ke dalam ember dan
dibawa ke laboratorium. Pengambilan sampel tersebut dilakukan mulai
jam 13.30 – 17.00 WIB waktu setempat.
5. Identifikasi data. Identifikasi sampel dilakukan di laboratorium. Sampel
dalam botol atau kantong plastik telah diberi pengawet alkohol 70%. Lalu
disortir antara jenis sampel crustacea dan non crustacea. Kemudian
dari buku “Identification Manual for the Marine Amphipoda:
(Gammaridea)” (Thomas, 1993) dan buku “Guide To The Marine Isopods Of Southern Africa” (kensley, 1978) serta buku lainnya, sehingga dapat dikelompokkan secara sistematik.
Gambar 8. Gambaran dan Letak Plot Lamun Buatan.
Keterangan gambar;
(A) = Peta Pulau Pari yang terdiri dari beberapa lokasi : a. Utara (tingkat kerapatan lamun jarang). b. Selatan (sedang).
c. Barat Daya (padat).
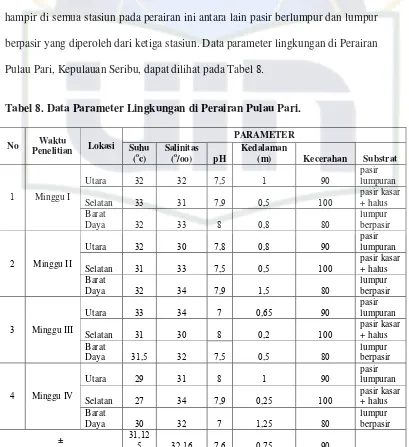
. . Pengukuran Parameter Kualitas Perairan Pada Tiap Stasiun Penelitian Dilakukan Sebanyak Tiga Kali Ulangan.
a. Temperatur
Suhu perairan diukur dengan menggunakan termometer alkohol, dengan
cara dicelupkan ke dalam perairan, kemudian suhu dilihat di dalam air. Untuk
menghindari berubahnya suhu dalam pengamatannya dengan cara pengambilan
sampel air. Posisi termometer harus sejajar dengan arah penglihatan agar tidak
terjadi kesalahan membaca suhu.
b. Kedalaman
Kedalaman perairan diukur dengan menggunakan batang bambu berskala,
dengan dimasukkan tongkat tersebut ke dalam perairan sampai menyentuh dasar.
Kemudian catat nilai yang diperoleh.
c. Kecerahan
Kecerahan perairan diukur dengan menggunakan Secchi disk, lalu dimasukkan ke dasar permukaan air dan dilihat apakah masih terlihat atau tidak
terlihat warna yang terdapat di Secchi disk tersebut. Jika tak terlihat, maka panjang tali dicatat dan pada saat Secchi disk diangkat lalu terlihat warna lempengannya, maka panjang tali tersebut dicatat kembali. Sehingga hasilnya
d. Salinitas
Salinitas perairan diukur dengan menggunakan refraktosalinometer, dengan cara
pengambilan sampel air pada setiap stasiun. Kemudian dibawa ke laboratorium
untuk dicatat nilai yang diperoleh.
e. pH
pH perairan diukur dengan menggunakan pH universal atau pHmeter,
dengan cara pengambilan sampel air pada tiap stasiun. Kemudian dibawa ke
laboratorium dan dicatat nilainya.
. Analisis Data
. Kelimpahan Crustacea
Analisis kelimpahan crustacea yang berada di lamun buatan, dihitung
dengan menggunakan rumus yang dikemukakan oleh Odum (1971), sebagai
berikut:
Keterangan :
X : Kelimpahan crustacea.
Xi : Jumlah individu (crustacea) pada stasiun pengamatan ke-i.
. Indeks Keanekaragaman (H’)
Untuk pengolahan data keanekaragaman digunakan rumus Shanon–
Wiener (Krebs (1989), yaitu;
S
H’ = ∑ (pi) (log2 pi)
i=1
dimana :
H’ : Nilai Indeks Keanekaragaman.
pi : Proporsi jumlah individu spesies ke –i (ni) terhadap
total individu (N) : (ni/N).
N : Jumlah total individu semua spesies.
S : Jumlah jenis.
Nilai indeks keanekaragaman (Shanon-Wiener) mempunyai beberapa
kategori menurut (Hardjosuwarno (1990) dalam Darojah, 2005), dibagi menjadi empat kriteria berdasarkan kondisi diversitas fauna bentik dengan kisaran:
H’ > 3,0 : Keanekaragaman sangat tinggi.
H’ 1,6–3,0 : Keanekaragaman tinggi.
H’ 1,0–1,5 : Keanekaragaman sedang.
H’ < 1 : Keanekaragaman rendah.
. Indeks Dominansi (D)
Metode indeks dominansi ‘Simpson’ digunakan untuk mengetahui adanya
spesies jenis tertentu yang mendominansi habitat tertentu (Krebs (1989) dalam Werdiningsih, 2005), dengan rumus:
Keterangan:
D : Indeks dominansi Simpson.
Pi : Proporsi spesies ke-i dalam komunitas
ni : Jumlah individu spesies ke-i.
N : Jumlah total individu.
Indeks Dominansi antara 0–1
D = 0, berarti tidak terdapat spesies yang mendominansi spesies lainnya atau struktur komunitas dalam keadaan stabil.
D = 1, berarti terdapat spesies yang mendominansi spesies lainnya atau struktur komunitas labil, karena terjadi tekanan ekologis.
. Indeks Keseragaman (E)
Indeks keseragaman dapat diketahui dengan cara membandingkan
keanekaragaman dengan nilai maksimum (Krebs (1989) dalam Werdiningsih,
2005), yang dinyatakan sebagai berikut:
Keterangan :
H’ max : Nilai maksimum H’ = Log2 S = 3,3219 log S.
H’ : Indeks keanekaragaman.
S : Jumlah jenis.
Nilai indeks berkisar antara 0–1
E ≈0: keseragaman antara spesies rendah, artinya kekayaan individu yang dimiliki masing-masing spesies sangat jauh berbeda.
BAB IV
HASIL DAN PEMBAHASAN
. Deskripsi Habitat
. Kondisi Habitat Lamun Alami, Pulau Pari
Berdasarkan hasil pengamatan dalam pengambilan sampel crustacea,
didapat bahwa lokasi penelitian berada di Perairan Pulau Pari. Pengambilan
sampel crustacea dilakukan pada tiga titik stasiun antara lain stasiun Barat Daya,
Utara dan Selatan. Pada perairan Barat Daya, Pulau Pari memiliki struktur
permukaan dengan rataan terumbu dan terdapat goba serta substrat yang
berlumpur pasir. Lokasi stasiun tersebut merupakan titik penelitian yang baik,
karena didukung oleh hamparan padang lamun dan berhubungan langsung dengan
laut lepas. Diduga stasiun Barat Daya memiliki beranekaragam jenis bentik
(demersal atau pelagis) yang hidup pada ekosistem padang lamun.
Adapun di stasiun Barat Daya terdapat sebagian kecil mangrove yang
tumbuh disekitar pesisir padang lamun. Tumbuhan mangrove dan padang lamun
yang terdapat di stasiun Barat Daya memiliki hubungan yang erat dilihat dari segi
ekologi. Kedua tumbuhan tersebut mampu memberikan habitat yang baik bagi
bentik crustacea atau biota lainnya. Padang lamun merupakan salah satu
ekosistem perairan pantai yang menjadi habitat dari berbagai jenis binatang
invertebrata termasuk beraneka jenis crustacea (Moosa dan Aswandy, 1995).
Lamun yang terdapat di perairan Barat Daya antara lain dari jenis Enhalus
Hampir sebagian besar di stasiun Barat Daya didominasi oleh jenis lamun
tersebut, walaupun ada sebagian kecil terdapat jenis Thalassia sp. Diduga jenis Enhalus sp lebih cocok dengan substrat dasar lumpur berpasir, sehingga dapat tumbuh subur dilingkungan tersebut.
Substrat berlumpur juga terdapat di stasiun Utara yang berbatasan
langsung dengan pulau kudus. Stasiun tersebut memiliki struktur dasar permukaan
yang curam dan tidak rata, ditambah juga kondisi dataran yang lunak, sehingga
cukup sulit apabila melintasinya. Perairan di stasiun Utara kondisinya cukup
tenang dan gelombang arus yang kecil, karena letaknya tidak berhubungan
langsung dengan perairan laut lepas. Perairan tersebut cukup ideal untuk dijadikan
tempat budidaya keramba khususnya jenis udang-udangan bagi masyarakat
sekitar. Hal ini diduga kondisi lingkungan perairan yang mendukung salah
satunya suhu mencapai (29-34oC) (tabel 8).
Padang lamun di stasiun Utara cenderung memiliki tingkat kerapatan yang
lebih rendah (12,1%) bila dibandingkan dengan stasiun lainnya (Barat Daya dan
Selatan) (lihat lampiran 9). Jenis lamun yang terdapat di stasiun Utara antara lain
Enhalus acroides dan Thalassia sp. Diduga kedua jenis lamun tersebut tidak mendominasi satu sama lain dan kondisi lamunnya yang tidak lebat (jarang),
sehingga kemungkinan bentik penghuni lamun khususnya crustacea jarang
ditemukan. Tidak hanya ekosistem lamun yang terdapat di stasiun Utara, tetapi
ada juga ekosistem mangrove walaupun hanya sebagian kecil wilayahnya.
Selain lokasi di Utara ada juga lokasi Selatan yang memiliki kondisi
padang lamun yang cukup baik, karena stasiun tersebut ditumbuhi oleh lamun
Thalassia mendominasi padang lamun di stasiun tersebut. Substrat dasar
lamunnya berpasir kasar dan halus serta permukaan dataran dengan rataan
terumbu. Disamping itu perairan bagian Selatan berdekatan dengan
perkampungan nelayan dan dermaga, sehingga bagi masyarakat tersebut dijadikan
tempat mencari ikan dan udang-udangan.
Lamun alami yang terdapat di 3 lokasi perairan dapat memberi keuntungan
tersendiri bagi crustacea dan terdapat suatu rantai makanan antar organisme
tersebut. Bentik crustacea sebagai konsumen bagi lamun, karena dapat
memanfaatkan daun lamun sebagai pakan nutrisi, sedangkan lamun sebagai
produsen dengan memanfaatkan detritus sisa pakan crustacea untuk dijadikan
nutrien bagi lamun.
. Lamun Buatan
Beberapa material lamun buatan yang dijadikan sebagai bahan alternatif
lamun alami, antara lain material tali plastik dan sabut kelapa. Kedua material
tersebut tidak memiliki ukuran yang luas dan cukup untuk mewakili dari tiap
stasiun, karena hanya untuk mengetahui keberadaan crustacea baik dari segi
diversitas (keanekaragaman) maupun kelimpahan jenis yang terdapat di area
padang lamun. Salah satunya material tali plastik yang memiliki kondisi fisik
yang kuat dan tahan lama walaupun lebih cenderung kurang ramah lingkungan. Di
duga material tali plastik mampu memberikan keuntungan bagi crustacea bentik di
lamun. Pada dasarnya material tali plastik memiliki kandungan bahan kimia
karet alam dan sejenisnya), mengandung zat pewarna yang berfungsi
meningkatkan penampilan fisik (Mujiarto, 2005).
Selain material tali plastik, sabut kelapa juga merupakan salah satu
material yang digunakan untuk pengambilan sampel dan mengetahui keberadaan
crustacea. Bahan tersebut diketahui dapat mempengaruhi keberadaan biota
crustacea antara lain dari jenis Amphipoda, Isopoda, Mysidacea dan sebagian dari
Decapoda, sehingga kemungkinan bahan tersebut mampu dijadikan sebagai
alternatif dan pengganti lamun alami. Sabut kelapa memiliki tekstur fisik yang
kasar pada tiap untaian helaiannya, karena dengan kondisi tekstur tersebut diduga
dapat menangkap zat–zat organik berupa kandungan mineral dan unsur hara lain
(fitoplankton) di perairan laut. Crustacea yang menempel pada material sabut
kelapa memiliki keuntungan antara lain sebagai tempat persembunyian dan
berlindung sementara agar terhindar dari predator di wilayah padang lamun.
Selain itu, dapat juga sebagai tempat mencari makan, karena diduga pada setiap
helai sabut kelapa terdapat zat organik (pakan) yang melekat, sehingga crustacea
dapat dengan mudah mencari makan.
Adapun bahan sabut kelapa memiliki daya tahan yang cukup terbatas
sebagai material lamun buatan. Diduga karena kondisi fisik yang cukup rentan
terhadap arus perairan laut dan teksturnya renggang, sehingga tiap beberapa
waktu perlu penggantian yang baru. Material Sabut kelapa cenderung ramah
terhadap lingkungan ataupun baik untuk dijadikan penunjang habitat sementara
bagi bentik crustacea. Hal ini juga karena bahan tersebut merupakan bahan
organik alternatif berasal dari buah kelapa tua yang memiliki serat kuat. Bagian
absorben terutama polutan logam berat yang berbahaya dan mempunyai
kemampuan untuk menyerap logam berat Pb, Fe dan Cu (Putra, 2008).
Pada material tali plastik memiliki kondisi rimbunan lebih lebat bila
dibandingkan dengan sabut kelapa yang agak renggang. Material tersebut dapat
dijadikan sebagai habitat alternatif yang bersifat sementara bagi crustacea yang
melekat. Diduga dengan kondisi rimbunan yang lebat dapat dijadikan tempat
berkembang biak dan berteduh ataupun asuhan “nursery ground”.
Kedua material tersebut memiliki fungsi yang hampir sama dilihat dari
segi fisik bahan (kerimbunan, kandungan zat, struktur dan bentuk) ataupun
perolehan jumlah komposisi bentik crustacea tersebut. Perolehan komposisi jenis
crustacea pada material tali plastik lebih banyak daripada sabut kelapa. Lain
halnya dengan material, lamun alami cenderung merupakan habitat yang secara
alami dapat menunjang bentik crustacea tersebut dapat hidup berkembang biak
ataupun reproduksi secara terus menerus dalam jangka waktu yang lama.
. . Kelimpahan jenis Crustacea
. . . Lokasi Barat Daya
Pengambilan sampel crustacea di 3 stasiun penelitian yang dilakukan di
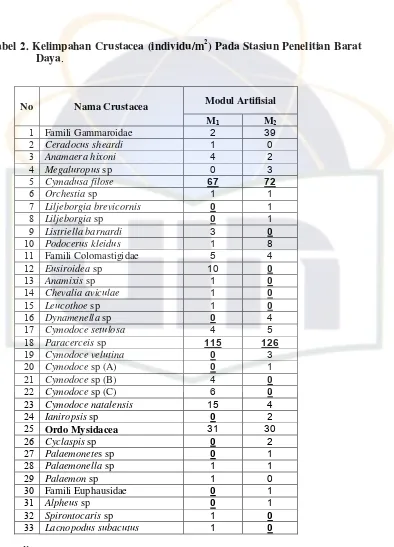
perairan Pulau Pari, Kepulauan Seribu diperoleh bahwa stasiun Barat Daya
terdapat jenis yang memiliki kelimpahan tertinggi yaitu Paracerceis sp (Ordo Isopoda) dan Cymadusa filosa (Ordo Amphipoda). Paracerceis sp memiliki kelimpahan sebesar 115 individu/m2, sedangkan Cymadusa filosa 67 individu/m2 (model artifisial sabut kelapa/M1). Pada jenis yang memiliki kelimpahan terendah
Ceradocus Sheardi (Ordo Amphipoda), Megaluropus sp (Famili Megaluropidae); Liljeborgia brevicornis, Liljeborgia sp (Ordo Amphipoda; Famili Liljeborgidae); Orchestia sp, Podocerus kleidus, Anamixis sp, Chevalia aviculae, Leucothoe sp, (Ordo Amphipoda), Dynamenella sp, Cymodoce velutina, Cymodoce sp, Ianiropsis sp (Ordo Isopoda); Cyclaspis sp (Ordo Cumacea); Famili Euphausid, Alpheus sp (Famili Alpheidae); Palaemonetes sp, Palaemon sp (Ordo Decapoda; Famili Palaemonidae), Spirontocaris sp (Caridean). Jenis–jenis tersebut masing – masing memiliki kelimpahan antara 0–2 individu/m2.
Model artifisial sabut kelapa (M1) mendukung kehidupan biota crustacea,
sehingga tercatat pada jenis Paracerceis sp (Ordo Isopoda) dan Cymadusa filosa (Ordo Amphipoda) memiliki kelimpahan jenis tertinggi. Hal ini diduga bahan
sabut kelapa memiliki struktur rimbunan agak renggang, kasar dan didukung oleh
faktor lingkungan (nutrien), dimana senyawa organik di perairan Barat Daya
menempel pada substrat sabut, sehingga memudahkan jenis–jenis tersebut dapat
mencari makan dengan mudah dan hadir di substrat sabut kelapa.
Model tali plastik (M2) memiliki kelimpahan jenis tertinggi adalah
Paracerceis sp (Ordo Isopoda) dan Cymadusa filosa (Ordo Amphipoda) yang masing – masing sebesar 126 dan 72 individu/m2. Kelimpahan jenis terendah pada model tali plastik (M2) adalah Ceradocus sheardi (Famili Gammaroidea),
Listriella barnardi (Famili Liljeborgidea), Eusiroidea sp, Anamixis sp, Chevalia
aviculae, Leucothoe sp, Cymodoce sp (Ordo Isopoda), Palaemon sp (Macrura;
Ordo Decapoda), Spirontocaris sp (Caridean) dan Lacnopodus subacutus
(Brachyura). Jenis–jenis tersebut tidak memiliki jumlah individu yang sama yaitu
Jenis yang memiliki kelimpahan tertinggi pada model tali plastik (M2)
hampir sama seperti model sabut kelapa (M1). Hal ini disebabkan tali plastik
memiliki kandungan polimer (protein, karet alam dan sejenisnya), mengandung
zat pewarna yang berfungsi meningkatkan penampilan fisik (Mujiarto, 2005).
Oleh sebab itu, tali plastik dapat memberikan habitat baru (sementara) untuk
berlindung bagi kehidupan crustacea.
Selain itu juga didukung oleh kondisi alaminya, pada jenis Paracerceis sp yang termasuk Famili Sphaeromatidae (isopoda) penyebarannya bersifat
kosmopolit dan menguasai zona intertidal (pesisir). Beberapa spesiesnya terdapat
menempel pada substrat tonggak kayu atau serabut dan sekitar karang (Kensley,
1978).
Kondisi substrat berupa lumpur pasiran yang didiami oleh kedua jenis ini
mendominasi di stasiun Barat Daya. Kelompok organisme yang mampu
beradaptasi pada kondisi substrat pasir adalah organisme infauna makro
(berukuran 1-10 cm) yang mampu menggali liang di dalam pasir dan organisme
meiofauna mikro (berukuran 0,1–1 mm) yang hidup di antara butiran pasir dalam
ruang interaksi (Ardi (2002) dalam Schmieg, 2007). Hal lain adanya komponen berupa lamun buatan dan alami pada stasiun Barat Daya yang saling memberi
Tabel . Kelimpahan Crustacea (individu/m ) Pada Stasiun Penelitian Barat Daya.
No Nama Crustacea Modul Artifisial
M M
1 Famili Gammaroidae 2 Ceradocus sheardi 3 Anamaera hixoni 4 Megaluropus sp 5 Cymadusa filose 6 Orchestia sp
7 Liljeborgia brevicornis 8 Liljeborgia sp
9 Listriella barnardi 10 Podocerus kleidus 11 Famili Colomastigidae 12 Eusiroidea sp
13 Anamixis sp 14 Chevalia aviculae 15 Leucothoe sp 16 Dynamenella sp 17 Cymodoce setulosa 18 Paracerceis sp 19 Cymodoce velutina 20 Cymodoce sp (A) 21 Cymodoce sp (B) 22 Cymodoce sp (C) 23 Cymodoce natalensis 24 Ianiropsis sp
25 Ordo Mysidacea
26 Cyclaspis sp 27 Palaemonetes sp 28 Palaemonella sp 29 Palaemon sp 30 Famili Euphausidae 31 Alpheus sp
32 Spirontocaris sp 33 Lacnopodus subacutus
Keterangan: M1 = Sabut Kelapa
[image:47.612.144.538.68.615.2]Sedikit atau tidak adanya kelimpahan jenis di stasiun Barat Daya bisa
disebabkan karena kurang cocoknya lamun buatan dalam memerankan fungsi
ekologinya bila dibanding dengan yang alami dan kondisi rimbunan lamun buatan
khususnya sabut kelapa yang kurang lebat, sedangkan pada lamun alaminya dapat
memproduksi detritus daun lamun untuk keperluan pakan crustacea. Kekurangan
lainnya bisa dipengaruhi oleh faktor lingkungan yaitu parameter (kecerahan).
Diduga apabila kecerahan yang cukup rendah kehadiran dari biota khususnya
crustacea akan relatif banyak dan begitu juga sebaliknya.
. . . Lokasi Utara
Pantauan dari hasil pengamatan yang didapat bahwa terdapat kelimpahan
jenis tertinggi yang berada di lokasi Utara antara lain pada Ordo Mysidacea dan
Paracerceis sp (Ordo Isopoda) yang masing–masing sebesar 24 dan 17
individu/m2. Jenis yang memiliki kelimpahan terendah antara lain Anamaera
hixoni (Ordo Amphipoda), Cymadusa filosa, Dynamenella sp (Ordo Isopoda),
Cymodoce setulosa, Cymodoce velutina, Famili Euphausidea, Alpheus sp (Ordo
Decapoda), Thalamita prymna (Brachyura), Thalamita sp dan Thalamita crenata.
Masing – masing jenis tersebut memiliki kelimpahan yang hampir sama dengan
rata – rata antara 0-3 individu/m2. Jenis–jenis tersebut berlaku pada kedua model
artifisial yaitu sabut kelapa (M1) dan tali plastik (tambang) (M2).
Jenis Paracerceis sp (Ordo Isopoda) merupakan paling dominan menempati posisinya pada lokasi penelitian Utara dengan jumlah yang signifikan
pada Ordo Isopoda diperoleh dari koleksi yang berada di sepanjang pantai
(pesisir) dan zona karang yang dangkal (Glynn, 1971). Kelimpahan jenis
crustacea pada lokasi Utara dapat dilihat di tabel 3.
Tabel . Kelimpahan Crustacea (individu/m ) Yang Terdapat Pada Stasiun Utara.
Keterangan:
M1 = sabut kelapa
M2 = tali plastik (tambang)
Walaupun demikian jenis tersebut mampu beradaptasi dengan lingkungan
sekitar baik yang berada di substrat alami maupun buatan dengan serabut atau
tonggak kayu untuk dijadikan habitat. Ordo Mysidacea memiliki kelimpahan lebih
tinggi daripada Ordo Isopoda yang berada di lokasi Utara yaitu dengan
kelimpahan 24 individu/m2. Hal ini dikarenakan Ordo Mysidacea memiliki sifatnya yang hidup bebas (epibentik) di perairan dan hidup berkoloni serta
sifatnya yang memiliki nilai ekonomis bagi masyarakat.
No Nama Crustacea Model Artifisial
M M
1 Anamaera hixoni 2
2 Cymadusa filose 2
3 Dynamenella sp 1
4 Cymodoce setulosa 3
5 Paracerceis sp 1
6 Cymodoce velutina 3
7 Ordo Mysidacea 5
8 Famili Euphausidae 2
9 Alpheus sp 1
10 Thalamita prymna 1
11 Thalamita sp 1
Kelompok Mysidacea pada tingkatan taksa genusnya secara spesifik tidak
diketahui, karena keterbatasan data literatur yang diperoleh tentang kelompok
tersebut. Diketahui bahwa morfologi dan adaptasi dari Ordo Mysidacea sebagian
besar menyerupai kelompok larva udang (Macrura). Mysidacea memiliki karapas
yang hampir menutup seluruh dadanya, mata bertangkai dan embelan dada semua
bercabang dua (Romimohtarto dan Juwana, 2007). Adapun ciri khas yang
diperoleh dari kelompok Mysidacea salah satunya terdapat sepasang bulatan
(statocyst proximal) pada bagian endopod (uropods) (Meland & Willassen, 2007).
Jenis tersebut merupakan spesies laut yang beradaptasi dan hidup sebagai hewan
bentik dan pelagis, terdistribusi dari zona litoral pantai sampai laut terbuka hingga
kedalaman tinggi dan tersebar diseluruh lautan benua. Sebagian dari kelompok
tersebut terdapat pada habitat laut dalam dan di tubir gua (Meland & Willassen,
2007).
Ordo Mysidacea merupakan kelompok crustacea tingkat rendah, diduga
dalam melakukan interaksi dengan lingkungannya saling memiliki sifat
ketergantungan dengan organisme lain atau sifat parasit. Substrat lamun buatan
yang dipakai dalam penggunaannya berpengaruh terhadap keberadaan Mysidacea,
karena terlihat dari data yang ada pada lokasi penelitian ini memiliki jumlah
individu lebih besar dari jenis yang lain. Hal ini disebabkan pengaruh dari lamun
buatan (substrat sabut kelapa) cukup terpenuhi sebagai tempat berkembang biak
atau aktivitas lainnya dan dapat dijadikan perantara sumber zat organik esensial
bagi kelompok tersebut. Pengaruh lain karena lokasi Utara berdekatan langsung
mangrove juga berperan dalam proses penyuplai energi yang dibutuhkan oleh
kelompok Mysidacea.
Tingginya kelimpahan jenis dari kedua jenis tersebut di stasiun penelitian
Utara disebabkan oleh sifatnya yang hidup bebas di perairan dan kondisi
lingkungan yang terpenuhi dalam mencari makan, karena terdapat zat organik
berupa lamun alami yang merupakan habitat asli dalam memenuhi kebutuhannya
atau mikroalga serta substrat berlumpur. Adapun pantai berlumpur cenderung
untuk mengakumulasi bahan organik, sehingga cukup banyak makanan yang
potensial bagi bentos pantai tersebut (Ardi (2002) dalam Schmieg, 2007).
Kondisi lamun buatan dari kedua model dengan bahan sabut kelapa (M1)
dan tali plastik (M2) menentukan keberadaan dari kedua jenis tersebut, sehingga
diduga stasiun ini merupakan habitat yang cukup cocok. Sumber makanan (zat
organik) yang menempel di lamun buatan khususnya pada bahan sabut kelapa
akan dikonsumsi oleh crustacea, sehingga dapat dijadikan tempat mencari makan
sementara dengan kondisi lingkungan parameter yang sesuai. Lokasi tersebut juga
berdekatan dengan ekosistem mangrove, sehingga dapat berinteraksi dengan baik.
Jenis yang memiliki kelimpahan sedikit bisa disebabkan karena kurang
cocoknya lamun buatan dalam memerankan fungsi ekologinya bila dibanding
dengan yang alami. Aktivitas masyarakat nelayan di perairan dan kondisi
parameter (suhu) yang mengalami perubahan signifikan dari minggu 3 ke 4 (Tabel
6). Oleh sebab itu, hasil yang didapat dari rimbunan kedua artifisial sabut kelapa
(M1) dan tali plastik (M2) relatif sedikit dengan jumlah kelimpahan antara 0–3
mencapai 30-33oC dan salinitas 30-33o/oo tinggi, sehingga memungkinkan perkembangan bakteri patogen (Aeromonas) (Juwana, 2001).
. . . Lokasi Selatan
Pada stasiun Selatan terdapat kelimpahan jenis tertinggi yaitu jenis
Cymadusa filosa (Ordo Amphipoda) dan Paracerceis sp (Ordo Isopoda) yang masing – masing berjumlah 51 dan 17 individu/m2, sedangkan jenis yang memiliki kelimpahan terendah yaitu Gammaropsis sp (Ordo Amphipoda), Dynamenella sp (Ordo Isopoda), Cymodoce velutina, Thalamita sp (Brachyura), Ordo Mysidacea yang masing–masing kelimpahannya antara 0–1 individu/m2. Kelimpahan tertinggi dan terendah tersebut berlaku pada kedua model (sabut
kelapa (M1) dan tali plastik (M2). Ordo Mysidacea memiliki kelimpahan terendah
pada model tali plastik (M2).
Jenis Cymadusa filosa (Ordo Amphipoda) dan Paracerceis sp (Ordo Isopoda), seperti halnya sama dengan lokasi sebelah Barat Daya yang
mendominasi sebagian dari seluruh crustacea yang didapat dari lamun buatan
tersebut. Jenis Paracerceis sp (Ordo Isopoda) yang mendominasi seluruh stasiun dan berperan penting sebagai rantai makanan bagi organisme lain. Kedua jenis
tersebut yang memiliki kelimpahan tertinggi merupakan predator bagi organisme
lain, salah satunya ikan dan juga crustacea lain seperti kepiting dan udang. Hal ini
karena hidupnya yang bebas dan menguasai daerah territorial serta tidak memiliki
nilai ekonomis penting bagi masyarakat sekitar. Secara ekologi, jenis dari
Amphipoda berperan sebagai kutu dan hidupnya parasit pada organisme lain.
didasarkan pada hospesnya, yaitu Isopoda pada ikan dan crustacea lain
(Widyastuti, 2002). Pengaruh dari lamun buatan terhadap kedua jenis antara lain
Amphipoda dan Isopoda cukup ideal, karena materialnya berperan sebagai untuk
dijadikan tempat perlindungan, asuhan dan bahkan untuk mencari makan.
Kelimpahan jenis crustacea pada stasiun selatan dapat dilihat pada Tabel 4.
Tabel . Kelimpahan Jenis Crustacea (individu/m ) Pada Stasiun Selatan.
Keterangan: M1 = sabut kelapa M2 = tali plastik (tambang)
Jenis dari Decapoda yang diperoleh dari stasiun Selatan jumlah
kelimpahannya antara 0–2 individu/m2. Sementara itu, jumlah yang dominannya berasal dari jenis Ordo Isopoda dan Ordo Amphipoda bila dibandingkan
kelompok Decapoda yang lebih sedikit. Hal ini diduga posisi peletakkan habitat
No Nama
Crustacea
Model Artifisial
M M
1
Famili
Gammaroidae 2 2
2 Gammaropsis sp 1
3 Cymadusa filose 6
4 Cymadusa sp 2 3
5
Cymadusa
compta 2 1
6
Podocerus
kleidus 3 1
7 Dynamenell